CINETICA QUIMICA Cinética Química
Anuncio

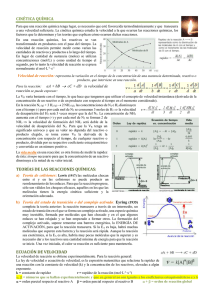
CINETICA QUIMICA El término Cinética Química se refiere al estudio de las Velocidades de Reacción y de los factores que influyen en ellas Velocidad: V = Espacio recorrido/Unidad de tiempo Velocidad de reacción: Vr = Cambio de concentración de reactivo o producto en función del tiempo que sucede el cambio (M/s) A B Para la reacción: Velocidad que se consumen los reactivos = Velocidad que se forman los productos VA = - A / t VB = B / t Velocidad de reacción y Estequiometría Cuando la relación estequiométrica es diferente a 1 aA + bB Velocidad = - cC + dD (1) 1 A 1 B 1 C 1 D a t b t c t d t Factores que afectan la velocidad de reacción Naturaleza de los reactivos Cambios de concentración Cambios de temperatura Presencia de un catalizador Efecto de la Naturaleza de los reactivos Cuando una o todas las sustancias que se combinan se hallan en estado sólido, la velocidad de reacción depende de la superficie expuesta en la reacción. Cuando los sólidos están molidos o en granos, aumenta la superficie de contacto y por consiguiente, aumenta la posibilidad de choque y la reacción es más veloz. Lo mismo ocurre cuando las sustancias reaccionantes no son miscibles entre sí, como por ejemplo, en la hidrólisis neutra de un aceite, se hace reaccionar éste con agua, para lograrlo, el agua de la parte inferior (recordemos que el aceite es más liviano que el agua) se recircula hacia la parte superior rociándola sobre la superficie del aceite. Otro ejemplo sería el de un kilo de viruta de madera, que se quema más rápido que un tronco de un kilo de masa. Efecto del Cambio de la Concentración Una forma de estudiar el efecto de la concentración en la velocidad de reacción consiste en establecer cómo depende la velocidad al comienzo de la reacción (velocidad inicial) de las concentraciones de partida La dependencia de la concentración se expresa: V = k A B m Para la reacción (1) n V = k R (2) Donde: - K es la constante de velocidad m y n determinan el orden de reacción (son números enteros pequeños 0, 1, 2….) Exponentes de la ecuación de Velocidad Los exponentes determinan el orden de reacción con respecto a los reactivos y la suma de ellos establece el orden general de reacción. - Si la concentración varía y no se ve afectada la velocidad, la reacción es de orden 0 - Si la concentración varía y la velocidad varía en la misma proporción, la reacción es de orden 1 - Si la concentración se duplica y la velocidad varía en una proporción de 22, la reacción es de orden 2 - Si la concentración se triplica y la velocidad varía en una proporción de 32 es de orden es de orden 3 Para V = k NH 4 NO 2 2 El orden general de reacción es 2 La constante de velocidad y sus unidades De lo expuesto anteriormente (2) se deduce que k depende del orden de reacción Si Velocidad se expresa en M/s y Concentración en M Para una reacción de primer orden: s-1 Para una reacción de segundo orden: M-1s-1 Para una reacción de tercer orden: M-2s-1 Reacciones de Primer Orden Es la que depende de la concentración de uno de sus reactivos elevado a la primera potencia A Para una reacción del tipo A Productos Velocidad = = k A t Si relacionamos la concentración de A al comienzo de la reacción A0 con su concentración en cualquier otro tiempo t, At lnAt lnA0 kt ó ln At A0 kt (3) La ecuación 2 también se puede ordenar Dónde lnAt kt lnA0 Y = mx + b Reacciones de Segundo Orden Es aquella cuya velocidad depende de la concentración de un reactivo elevada a la segunda potencia o de las concentraciones de dos reactivos diferentes, cada una elevada a la primera potencia. A 2 k A t Si relacionamos la concentración de A al comienzo de la reacción A0 con su concentración en cualquier otro tiempo t, At Velocidad = Dónde 1 1 kt At A0 Y = mx + b Vida media (t1/2) Es el tiempo necesario para que la concentración de un reactivo descienda a la mitad de su valor original At 1 1 2 A0 2 La vida media es una forma conveniente para describir la rapidez con la que una reacción ocurre 1 0,693 = 2 k k ln Para una reacción de Primer Orden t1/2 Para una reacción de Segundo Orden t1/2 = 1 k A0 Efecto de la Temperatura La velocidad de casi todas las reacciones cambia por efecto de la temperatura. Se puede ver este efecto en la descomposición de los alimentos, cuando los ponemos en refrigeración y cuando los dejamos al medio ambiente en una ciudad como Guayaquil. Cuando dos moléculas interaccionan, parte de la energía cinética se convierte en energía vibracional. Si la energía es muy grande, las moléculas comenzarán a vibrar fuertemente, con lo cual algunos enlaces se romperán. El rompimiento de los enlaces es el primer paso para que se produzca una reacción. ¿Pero que pasa si la energía es pequeña? ¿o muy grande? En realidad eso depende de las moléculas que deben reaccionar, pero siempre será necesaria una cantidad mínima de energía para que la reacción se produzca; a esa energía llamaremos Energía de activación Con este modelo es fácil entender el efecto de la temperatura en la velocidad de reacción, porque al aumentar la temperatura aumenta la energía cinética de las moléculas y con ello se aumenta la posibilidad de que se supere la energía de activación durante la colisión. El concepto de energía de activación fue concebido a finales del siglo XIX por el químico sueco Svante Arrhenius, quien demostró que la constante de velocidad para una reacción varía con la temperatura de acuerdo a la siguiente expresión conocida como la Ecuación de Arrhenius Ea k Ae RT Donde: Ea es la energía de activación R es la constante de los gases T es la temperatura absoluta e es la base de los logaritmos naturales A es el número de choques entre las partículas reaccionantes Si obtenemos el logaritmo para cada lado de la igualdad, nos queda: ln k Ea ln A RT Ecuación que puede identificarse con la ecuación de una recta Curvas de energía para (a) una reacción exotérmica; (b) una reacción endotérmica Efecto de los catalizadores Un catalizador es una sustancia que modifica la velocidad de una reacción, sin que sufra un cambio químico permanente y sin consumirse durante la misma Su presencia en muchos casos disminuye la necesidad de altas temperaturas y altas presiones en procesos industriales, razón por lo que actualmente se hacen grandes inversiones de dinero en estudios, buscando más y mejores catalizadores. Existen dos tipos de catálisis: homogénea y heterogénea. En la catálisis homogénea todas las sustancias (reactivos, productos y catalizadores) están en el mismo estado físico. En la heterogénea en cambio el catalizador es una sustancia sólida y las demás sustancias están en otros estados físicos.