Catalizadores en la industria
Anuncio

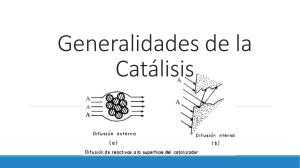
INTRODUCCIÓN. Un catalizador, es una sustancia que aceleran la velocidad de una reacción química sin sufrir en sí ningún cambio químico. Un catalizador en disolución con los reactivos, o en la misma fase que ellos, se llama catalizador homogéneo. El catalizador se combina con uno de los reactivos formando un compuesto intermedio que reacciona con el otro más fácilmente. Sin embargo, el catalizador no influye en el equilibrio de la reacción, porque la descomposición de los productos en los reactivos es acelerada en un grado similar. Un catalizador que está en una fase distinta de los reactivos se denomina catalizador heterogéneo o de contacto. Los catalizadores de contacto son materiales capaces de adsorber moléculas de gases o líquidos en sus superficies. Existen ciertas sustancias llamadas promotoras, que no tienen capacidad catalítica en sí, pero aumentan la eficacia de los catalizadores. Por ejemplo, al añadir alúmina a hierro finamente dividido, ésta aumenta la capacidad del hierro para catalizar la obtención de amoníaco a partir de una mezcla de nitrógeno e hidrógeno. Por otra parte, los materiales que reducen la eficacia de un catalizador se denominan venenos. Los compuestos de plomo reducen la capacidad del platino para actuar como catalizador; por tanto, un automóvil equipado con un catalizador para controlar la emisión de gases necesita gasolina sin plomo. CONTENIDO. Catalizadores: La piedra angular de la química industrial y de los seres vivos. El uso de catalizadores en la industria química está tan extendido que prácticamente participan en el 90% de los procesos químicos. El desarrollo de la química industrial se debe en gran medida a la catálisis, pero también encontramos catalizadores en la vida cotidiana: en estufas catalíticas, en los automóviles y, sobre todo, en nosotros mismos. Los seres vivos somos la más compleja industria química, en la que se producen millones de reacciones a la vez; la vida sería imposible sin la presencia de los catalizadores biológicos: las enzimas. La catálisis , como ya dijimos, es la aceleración de una reacción química con una pequeña cantidad de sustancia, que permanece esencialmente intacto. Nunca permite una reacción que sea termodinámicamente imposible, sino que crea un camino alternativo, una forma de interactuar los reactivos mucho más eficiente. Así, si nitrógeno e hidrógeno fluyen en un tubo a alta presión y temperatura no reaccionan para dar amoniaco, aunque el equilibrio químico sea favorable. Pero si se añaden partículas de hierro ambos compuestos reaccionan a gran velocidad. Por otro lado, si en un proceso existen reacciones paralelas o laterales, los catalizadores pueden favorecerlas para proporcionar el producto deseado. Todo esto hace que, gracias a su empleo, se consiga el abaratamiento de costes, simplificación de instalaciones, condiciones menos severas de presión y temperatura, reactores y aparatos más pequeños, además de la obtención de productos de mayor calidad. Los primeros logros importantes de la aplicación de la catálisis a la industria fueron la mejora sustancial de los procesos de conversión de amoniaco a ácido nítrico, la hidrogenación y la síntesis de amoniaco, que se desarrollaron durante última mitad del siglo XIX y principios del XX. Uno de los mayores éxitos del uso de los catalizadores fue el del craqueo (ruptura) catalítico de las fracciones 1 pesadas de petróleo a partir de 1936. Este hecho fue demostrado por Houdry en el laboratorio en 1928, permitiendo la obtención de gasolina de mayor octanaje y calidad. En este proceso, que sustituyó al craqueo térmico utilizado anteriormente, se emplean cada año millones de toneladas de catalizador. Poco después se desarrolló el reformado catalítico de hidrocarburos, y en la actualidad el catalizador más utilizado para ambos procesos, que nacieron o fueron mejorados durante la II Guerra Mundial, son las zeolitas. En la década de los 50−60 se consolidó la polimerización de etileno con catalizadores tipo Ziegler−Natta (en honor a sus descubridores) para la obtención de polietileno, un polímero ampliamente utilizado en botellas, recipientes, bolsas, moldes, etc., y también la oxidación de naftaleno y buteno a anhídrido ftálico y anhídrido maleico, sustancias precursoras en la obtención de cauchos, lonas y otros materiales plásticos. Los catalizadores para los coches, la transformación de glucosa a fructosa, la obtención de gasolina desde metanol, el metacrilato o la producción de la vitamina K 4, son algunos de los avances llevados a cabo en las dos décadas posteriores. En la actualidad, la mayoría de la producción de numerosos intermediarios orgánicos sintéticos usados para hacer plásticos, fibras, elastómeros, colorantes, pesticidas, resinas, pigmentos, medicamentos, etc. involucran etapas de catálisis. PRECURSORES En 1836 Berzelius introdujo el término de catálisis para describir las reacciones inducidas por ciertas sustancias, observadas ya por Kirchhoff, Davy y Faraday durante los primeros años de siglo. Aunque este fenómeno ya había sido utilizado inconscientemente en muchos procesos. Así, en 1831, P. Philips patentó el uso de platino para la oxidación del dióxido de azufre. Y fue a principios del siglo XX cuando se produjeron los primeros avances en la comprensión del fenómeno y se descubrieron nuevos procesos industriales, como la síntesis de amoniaco. CONCLUSIÓN. En la sociedad moderna sería impensable desarrollar nuevos procesos productivos y satisfacer la enorme demanda de consumo sin el uso de catalizadores, ya que ofrecen innumerables ventajas con respecto a los procesos en los que no intervienen. Además de seguir comprendiendo el mecanismo exacto con el que actúan y de mejorar su actividad, selectividad y resistencia a la desactivación, la catálisis se encuentra con grandes retos para los años venideros y puede reportar grandes beneficios para toda la humanidad: desarrollo de catalizadores para conseguir procesos sin desechos, nuevos catalizadores de membrana, catalizadores biológicos y mejora de los utilizados para la producción de fármacos, desarrollo de nuevas fuentes de energía y de combustibles, y para hacer los procesos productivos más seguros. 2