Lectura N°3- Capítulo 2-Capa de Ozono-abundancia natural y destruccion (1)
Anuncio

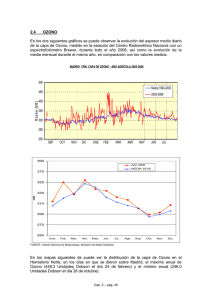
QUI-010 2S-2024 Lectura N°3 Capa de ozono: abundancia natural y destrucción. La atmósfera terrestre actúa como una barrera natural de protección frente a la radiación proveniente del sol a través de 2 tipos de transformaciones química: la fotoionización y la fotodisociación, los cuales nos protegen de la radiación de alta energía mediante la absorción de la mayor parte de ésta antes de que llegue a la tropósfera. En la fotoionización, la energía absorbida por un átomo o molécula provoca la pérdida de un electrón, mientras que, en la fotodisociación la energía absorbida por una molécula provoca la ruptura de un enlace químico. Ambos procesos se describen a continuación para las dos moléculas más abundantes de la atmósfera (recuerde E = h y c = ): Fotoionización: Fotodisociación: N2 + h → N2+ + e- < 80 nm O2 + h → O2+ + e- < 99 nm N2 + h → 2 N < 127 nm O2 + h → 2 O < 242 nm La radiación electromagnética con superior a 242 nm sigue siendo muy peligrosa para los organismos vivos (radiación UVB y parte de UVC), debido a que tiene energía suficiente para provocar rupturas de enlaces químicos en las moléculas, lo cual provoca daños a nivel celular que conducen a potenciales defectos genéticos y cáncer. La molécula de ozono (O3) pasa a tomar un rol fundamental para ampliar el efecto protector de la atmósfera, como se describe en el proceso de fotodisociación de éste: O3 + h → O2 + O < 320 nm La concentración del ozono (O3) en la atmósfera varía con la altura y los valores más altos se encuentran entre los 15 – 30 km, región a la que se le denomina capa de ozono (Figura 1). La acumulación de mayor concentración de O3 en esta región se puede explicar por la ocurrencia de 2 factores que varían en direcciones opuestas a medida que cambia la altitud. A mayor altura la radiación electromagnética que incide a la atmósfera tiene la energía suficiente para promover la fotodisociación del O2, permitiendo así la generación de átomos de O. En contraparte, a menores alturas la concentración de O2 es mayor, por lo tanto, las especies activas en la formación del O3 se encuentran en concentraciones adecuadas a alturas intermedias. Figura 1: Concentración comparativa de O3 en función de la altura. QUI-010 2S-2024 Así como existen procesos que describen la formación del O3, también existen procesos que describen la descomposición natural del ozono. Las siguientes ecuaciones resumen ambos procesos: Formación del O3: O2 + h → 2 O O2 + O → O3 Descomposición del O3: O3 + O → 2 O 2 O3 + H → OH + O2 (fotodisociación del H2O en H y OH) N2O + O → 2 NO (N2O generado en procesos biológicos) O3 + NO → NO2 + O2 G.M.B. Dobson, científico de la Universidad de Oxford, diseñó una escala para medir la concentración de O3 en la atmósfera. Esta escala considera la cantidad total de O3 contenida en una columna vertical de aire y su nombre se debe a su creador, unidades Dobson (en inglés DU). Se establece como definición que si todo el O3 contenido en una columna vertical se comprimiera a 0 °C y 1 atmósfera (atm) y se obtiene una capa de 3 mm de espesor, entonces se habla de 300 unidades Dobson (300 DU). De igual manera, si se obtiene una capa de 5 mm de espesor, entonces nos referimos a 500 DU (Figura 2). Figura 2: Definición de unidad Dobson (DU). La concentración de O3 se ha medido desde 1926 y las mediciones muestran que la concentración natural de O3 estratosférico no es uniforme a lo largo del planeta. La concentración de O3 depende de la intensidad de la radiación proveniente del sol (inclinación y distancia de la tierra) junto con el efecto que provocan los vientos estratosféricos. Valores entre 250 – 270 DU son característicos en el ecuador y en promedio, la concentración de O3 se incrementa a medida que nos alejamos de éste a valores de 300 a 350 DU, con variaciones estacionales. En las últimas décadas se ha observado un adelgazamiento de la capa de ozono, fenómeno que ocurre estacionalmente sobre el polo sur (primavera en la Antártica) y que se conoce como el agujero en la capa de ozono. Se definió que el área sobre el cual el nivel de ozono esté por debajo de los 220 DU es considerado como el agujero. La figura 3 muestra la evolución del nivel de ozono estratosférico mínimo entre los años 1979 y 2017. QUI-010 2S-2024 Figura 3: Nivel de O3 estratosférico mínimo sobre la Antártica (primavera) entre 1979 y 2017. En 1970 Paul Crutzen demostró que los óxidos de nitrógeno presentes en la naturaleza destruyen el O 3 de manera catalítica, posteriormente en 1974 F. Sherwood Rowland y Mario Molina reconocieron que el Cl de los clorofluorocarbonos (CFCs, compuestos conformados por átomos de Cl, F y C) podría adelgazar la capa de ozono, lo que finalmente se tradujo en el reconocimiento del premio Novel de Química en 1995. Los CFCs son compuestos muy inertes, no inflamables ni tóxicos y se comenzaron a usar como refrigerantes en la década de 1930, en reemplazo del amoníaco (NH 3) y dióxido de azufre (SO2), ambos compuestos muy tóxicos y corrosivos. Sin embargo, la falta de reactividad de los CFCs, que los vuelve comercialmente útiles, les permite mantenerse inalterados en la atmósfera (largos tiempos de vida) y difundir lentamente en la estratósfera. En la estratósfera los CFCs se exponen a la radiación de alta energía y experimentan procesos de fotodisociación (al igual que el O2 y O3), liberando así átomos de Cl por ser el enlace C-Cl más débil en comparación del enlace C-F. El átomo de Cl reacciona con el O 3 para formar monóxido de cloro (ClO) y O2. El ClO puede reaccionar con otro átomo de O para regenerar el Cl atómico o puede experimentar una fotodisociación. Las siguientes ecuaciones químicas resumen la descomposición del O3 por la acción de los CFCs: 1) CF2Cl2 + h → CF2Cl + Cl ( = 190 a 225 nm) 2) Cl + O3 → ClO + O2 3) ClO + O → Cl + O2 4) ClO + h → Cl + O Se observa que en la ecuación química 2 el átomo de Cl aparece como reactante, mientras que en 3 y 4 aparece como producto, por lo tanto, el resultado de este proceso es una secuencia de reacciones que descomponen el O3 en O2 de forma catalítica por la acción de átomos de Cl. Como una acción en respuesta al adelgazamiento de la capa de ozono, en 1987 cuarenta y seis países firmaron el protocolo de Montreal que tuvo como finalidad reducir la producción de CFCs a nivel mundial. A partir de esto fue necesario buscar compuestos que reemplacen a los CFCs, sin tener que volver al uso de amoniaco y dióxido de azufre. Cualquier sustituto de los CFCs debía mantener tres propiedades: baja toxicidad, baja inflamabilidad y un menor tiempo de vida en la atmósfera. QUI-010 2S-2024 Una estrategia para disminuir el tiempo de vida de los CFCs fue reemplazar un átomo de Cl por un átomo de H, lo que permite mayor reactividad de este compuesto con agentes de la naturaleza que favorecen su degradación. Así surgieron los hidroclorofluorocarbonos (HCFCs), uno de los ejemplos corresponde al CHF2Cl (HCFC-22, Figura 4), que presenta un tiempo de vida en la atmósfera de 12 años, bastante menor a los 110 años del homólogo CF2Cl2 (CFC-12). Si bien el desarrollo de los HCFC ha permitido disponer de compuestos que permanecen un menor tiempo en la atmósfera, estos siguen conteniendo átomos de Cl en su estructura y por ende, contribuyen de todas formas al adelgazamiento (en menor medida) de la capa de ozono. El desarrollo posterior ha conducido a la preparación de hidrofluorocarbonos (HCFs, constituidos por átomos de H, F y C) como respuesta a compuestos libres de átomos de Cl, un ejemplo corresponde a CH2F2 (HFC-32, Figura 4). Si bien el desarrollo de los HCFs permite disponer de refrigerantes que no afecten los niveles de O3 estratosférico, el uso masivo de estos compuestos (por ejemplo, en aires acondicionados) también impacta de una manera involuntaria en otro fenómeno climático, ya que estos compuestos además son gases invernadero. Figura 4: Ejemplo de CFCs, HCFCs y HFCs. Bibliografía: 1.- Radiation from the Sun, Chemistry in Context. BD Fahlman, KL Purvis-Roberts, JS Kirk, RS Kelly, PL Daubenmire, Mc. Graw-Hill, Tenth Edition (2020). 2.- Química del Medio Ambiente (Cap. 18), Química, la Ciencia Central. TL Brown, HE Lemay, BE Bursten, CJ Murphy, PM Woodward, Pearson, 12° Edición (2014).





![CFCl3 + hv → C˙FCl2 + Cl˙ [1]](http://s2.studylib.es/store/data/004556689_1-43a22359c51c0bc280f9bf9610a7da3d-300x300.png)