sop-revisao-qualidade-produto
Anuncio

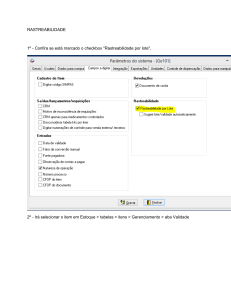
SISTEMA DE GESTÃO DA QUALIDADE FARMACÊUTICA POP – Procedimento Operacional Padrão Processo IDENTIFICAÇÃO POP. GQ. XXX Revisão de Qualidade do Produto (RQP) VERSÃO 01 FOLHA Nº 1/5 1. OBJETIVO Estabelecer as responsabilidades e normas para a compilação e análise de dados de produto, bem como a periodicidade, os requerimentos, a aprovação e o arquivamento do Relatório de Revisão de Qualidade do Produto (RRQP). O RQP, tem por finalidade, demonstrar e garantir que os produtos são fabricados com segurança e qualidade. 2. RESPONSABILIDADES 2.1. Responsável designado: Nomeado administrador de RQP é responsável pela coleta de dados e informações requeridas por este procedimento, transferi-las para o meio eletrônico, manter o cronograma atualizado, desenvolver o relatório, solicitar a aprovação dos envolvidos, monitorar as ações corretivas necessárias, manter este procedimento treinado e atualizado e arquivar os relatórios de RQP aprovados em pastas específicas. 2.2. Gerente da Garantia da Qualidade: Garantir que as medidas decorrentes das análises do relatório final sejam implementadas e as condições para o cumprimento das atividades estabelecidas neste procedimento. 2.3. Gerentes, Coordenadores, Analistas de Produção, Controle de Qualidade, Garantia da Qualidade e Assuntos Regulatórios: contribuir com os dados para o RRQP respeitando os prazos determinados e aprovar os processos. 2.4. Responsável Técnico: Revisar e aprovar o RRQP. 3. DEFINIÇÕES 3.1. Revisão da Qualidade de Produto (RQP): Conjunto de dados obtidos em um determinado período, para análise periódica de desempenho e padrões de qualidade de cada produto comercializado. 3.2. Cronograma RQP: Documento que estabelece um plano de trabalho no qual é listado quais relatórios de RQP devem ser concluídos. 3.3. Relatório de Revisão da Qualidade de Produto (RRQP): Documento confidencial utilizado para registrar dados críticos do processo de fabricação, através de levantamentos estatísticos dos processos e documentação das propostas de melhorias estabelecidas, quando necessárias. 3.5. Capabilidade: tem por objetivo diagnosticar se os processos são capazes de satisfazer os requerimentos estabelecidos. É calculado os índices de performance do processo (pp e ppk) para saber o desempenho real do processo e os índices (cp e cpk) para saber a capacidade real do processo – como se comportou no passado e o que se espera que continue a fazer no futuro. A proximidade dos índices pp e cp indicam a consistência do processo ao longo do tempo. 4. PROCEDIMENTO 4.1. Normas Gerais 4.1.1. O relatório de RQP recebe a seguinte codificação: RRQP-XX-XXXX Número Sequencial do Relatório Tipo do Documento Elaborado por: Garantia da Qualidade Revisado por: Responsável Técnico Aprovado para uso: Garantia da Qualidade ___________ _ Nome ___________ _ Nome ____________ _ Nome ___/___/ ___ Data ___/___/ ___ Data ___/___/ ___ Data Validade ___/___/ ___ Data SISTEMA DE GESTÃO DA QUALIDADE FARMACÊUTICA POP – Procedimento Operacional Padrão Processo Revisão de Qualidade do Produto (RQP) IDENTIFICAÇÃO POP. GQ. XXX VERSÃO 01 FOLHA Nº 2/5 Número Estabelecido do Produto Nota 01: O número estabelecido do produto é padronizado da seguinte forma: XXXXXXXXX Óleo 01 Pomada 02 Spray 03 4.2. Preparação do Cronograma da RQP 4.2.1. Os critérios para a disposição dos produtos no cronograma de RQP são: a. Os produtos são acompanhados conforme a linha de produção; b. Todas as apresentações de determinada forma farmacêutica devem ser avaliadas; c. O período de avaliação considerado para cada produto deve ser de até 12 meses, sendo que o relatório de RQP deve ser emitido no máximo em até 3 meses após a data final de disponibilização de todos os dados das áreas requeridas. 4.2.2. O anexo AX. GQ. 005 - Cronograma RQP deve estar atualizado e disponível para todos envolvidos. 4.3. Coleta de Dados 4.3.1. As áreas envolvidas devem disponibilizar os dados ao responsável designado, de acordo com a data definida no cronograma. Nota 02: Os dados disponíveis em ficha técnica de fabricação por lote produzido, e os resultados de análise de físico-químicas e microbiológicas devem ser disponibilizados até o 15º dia do mês seguinte em relação à produção do lote. 4.3.2. Caso o número de lotes fabricados durante o período avaliado seja inferior a 10 lotes produzidos, o relatório não contempla as análises estatísticas, sendo que as mesmas são integradas no próximo relatório do produto. 4.3.3. Todos os lotes de todos os produtos devem ser avaliados. 4.3.4. Os dados coletados são imputados em planilhas, por produto e concentração, e os mesmos são utilizados como base para as análises estatísticas pertinentes. 4.4. Análise de Dados e Informações 4.4.1. Uma vez que todos os dados requisitados tiverem sido coletados e agrupados, o responsável designado, deve analisá-los, e caso necessário, agendar a reunião com os envolvidos, para discussão dos dados. Nota 03: Os dados coletados são analisados mediante ferramentas estatísticas para observar o comportamento do produto ou processo. Sendo que os gráficos de Carta de Controle e Séries Temporais são preferencialmente utilizados para a análise estatística de Capabilidade. 4.4.2. Os resultados de gráficos, analisados em reunião pela equipe RQP, que apresentarem tendências e/ou desvios, planos de ações devem ser estabelecidos e detalhados, sendo que estes devem ser registrados no formulário de Ata de Reunião conforme FORM. GQ. 003 - Ata de Reunião. 4.5. Conteúdo do Relatório de Revisão da Qualidade de Produto (RRQP) SISTEMA DE GESTÃO DA QUALIDADE FARMACÊUTICA POP – Procedimento Operacional Padrão Processo Revisão de Qualidade do Produto (RQP) IDENTIFICAÇÃO POP. GQ. XXX VERSÃO 01 FOLHA Nº 3/5 4.5.1. Descrição do Produto: Deve conter uma descrição detalhada do produto em questão, seu nome, número do item, concentração, apresentação, tamanho do lote, embalagem primária e secundária, fórmula mestra do produto e o número do Registro. 4.5.2. Período de tempo avaliado: Informe o período específico da avaliação. 4.5.3. Resumo do Relatório: Descreva um resumo geral acerca das observações chaves e informações relevantes, como as tendências observadas nas documentações produtivas executadas, se aplicáveis. 4.5.4. Objetivo do Relatório: Descreva os objetivos do relatório. 4.5.5. Descrição do princípio ativo: Nome do(s) princípio(s) ativo, nome do(s) fabricante(s) e/ou fornecedor(es),a cópia da versão da especificação e a metodologia (método validado, farmacopeico ou não validado) do(s) princípio(s) ativo(s) utilizado(s), e quanto à situação de qualificação do fabricante. 4.5.6. Análise do princípio ativo: Deve conter gráfico e tabelas, quando aplicáveis, para avaliações do(s) princípio(s) ativo através de testes físico-químico e microbiológico que comprovem a liberação para utilização. 4.5.7. Descrição da Embalagem Primária: Descrição da(s) embalagem(s) utilizada(s), nome do(s) fabricante(s) e/ou fornecedor(es), a cópia da versão da especificação e a metodologia (método validado, farmacopeico ou não validado) utilizada(s), e quanto à situação de qualificação do fabricante. 4.5.8. Relação de todos os lotes produzidos, com os respectivos lotes de princípio ativo, lotes de embalagens primárias e descrição do volume de apresentação do referido lote. 4.5.9. Quantidade de lotes produzidos, lotes aprovados e lotes reprovados: a. Lotes produzidos: Liste todos os lotes produzidos durante o período de tempo avaliado; b. Lotes aprovados: Identifique os lotes aprovados; c. Lotes reprovados: Identifique os lotes reprovados e os motivos da rejeição. 4.5.10. Reprocesso: Descreva quais lotes foram reprocessados e o motivo deste. 4.5.11. O rendimento também será avaliado em gráfico por análises estatísticas. 4.5.12. Validação: Informe se o processo referente ao produto analisado está ou não validado. 4.5.13. Equipamentos e utilidades: Descreva o status de qualificação dos equipamentos e das utilidades críticas utilizadas para produzir ou analisar. 4.5.14. Análises do Produto em Processo: Deve conter gráfico e tabelas, quando aplicáveis, para avaliações dos controles em processo. Avalie as tendências, mudanças e desvios. 4.5.15. Descrição e análise de Produto Terminado: Descreva o código da metodologia e a cópia da versão da especificação utilizada para análise e informar se o método é validado, farmacopeico ou não validado. Descreva as especificações do produto em forma de gráficos e tabelas. A avaliação de resultados dos testes físico-químicos e microbiológicos. Avalie as tendências, mudanças e desvios. 4.5.16. Estudo de Estabilidade: A RQP também cobre os parâmetros de Estabilidade. Os lotes estudados devem ser referenciados em conjunto com o número do estudo realizado, deve ser descrita a data de fabricação e a validade, o início e o fim do estudo, o lote e o fabricante do princípio ativo do produto estudado. 4.5.17. Farmacovigilância: Informe as comunicações de eventos adversos registrados. 4.5.18. Não Conformidades: Informe quais lotes apresentaram não conformidades durante o período avaliado, o número do relatório de não conformidades, a descrição e as medidas adotadas como ações preventivas e/ou corretivas, bem como a eficácia das ações. SISTEMA DE GESTÃO DA QUALIDADE FARMACÊUTICA POP – Procedimento Operacional Padrão Processo Revisão de Qualidade do Produto (RQP) IDENTIFICAÇÃO POP. GQ. XXX VERSÃO 01 FOLHA Nº 4/5 4.5.19. Reclamações: Informe as reclamações recebidas durante o período analisado, registrando o lote, o número do registro de atendimento ao cliente, o motivo da reclamação, e as ações corretivas e preventivas realizadas. 4.5.20. Devoluções: Informe quais lotes foram devolvidos e causa destas devoluções. 4.5.21. Recolhimentos: Liste todos os lotes de produto recolhido, juntamente com os motivos e ações tomadas. 4.5.22. Controle de Mudanças: Liste os controles de mudanças relacionados ao produto e ao processo, implementados durante o período de revisão do produto, descrevendo o número, a alteração, a razão da mudança e a data de implementação. 4.5.23. Resultados da RQP: Os resultados devem ser apresentados em tabelas e gráficos em forma de anexos, podendo ser facilmente analisados, os quais podem mostrar tendências ou desvios. O resultado do relatório deve ser a partir da análise de gráficos obtidos, podendo resultar em: a. Processo capaz: Cpk ≥ 1,33 Cpk alto: é a distribuição centrada indicando que há uma baixa variação em relação à faixa dos limites de especificação. Cp alto: baixa variação em relação à faixa dos limites de especificação. b. Processo aceitável: 1≤ CpK < 1,33 Cpk bom: é a distribuição centrada indicando que há uma variação menor que a faixa dos limites de especificação. Cp bom: variação menor que a faixa dos limites de especificação. c. Processo incapaz: Cpk < 1 Cpk baixo: é a distribuição centrada, mas há uma variação maior que a faixa dos limites de especificação. Cp baixo: variação maior que a faixa dos limites de especificação. 4.5.24. Conclusões e recomendações: Todas as conclusões acerca do produto analisado devem ser listadas neste tópico, incluindo uma avaliação das tendências da qualidade e as ações corretivas e preventivas que devem ser tomadas para melhoria do processo, bem como as responsabilidades e os prazos para as mudanças e ações. 4.5.25. Referências bibliográficas: As referências utilizadas para a elaboração do relatório. 4.5.26. Revisões e Aprovações: Deve constar o nome, função, assinatura com data dos responsáveis por elaborar, revisar e aprovar os relatórios. Os mesmos têm um prazo de cinco dias úteis para avaliar, questionar, aprovar ou reprovar o relatório. 4.6. Aprovação do Relatório de RQP 4.6.1. A aprovação do Relatório de RQP é realizada por representantes de cada setor envolvido. 4.7. Arquivamento do Relatório de RQP 4.7.1. Os relatórios de RQP permanecem arquivados em pastas específicas, separadas por produto, a partir da data de fabricação, durante 5 anos. 5. DOCUMENTOS DE REFERÊNCIA 5.1. Resolução RDC 301 – Regulamento Técnico de Boas Práticas de Fabricação para Medicamentos (BPF), de 21 de agosto de 2019, da Agência de Vigilância Sanitária (ANVISA). 5.2. AX. GQ. 005 – Cronograma de RQP. SISTEMA DE GESTÃO DA QUALIDADE FARMACÊUTICA POP – Procedimento Operacional Padrão Processo Revisão de Qualidade do Produto (RQP) IDENTIFICAÇÃO POP. GQ. XXX VERSÃO 01 5.3. Guia sobre Revisão Periódica de Produtos –Guia Nª9/2018 – Versão 2. 6. CONTROLE DE REGISTROS Identificação FORM. GQ. 003 Descrição Ata de Reunião. 7. HISTÓRICO DE REVISÃO Pág/Item Todas Data de Revisão 12/2020 Versão 01 Natureza da Revisão Emissão inicial. FOLHA Nº 5/5