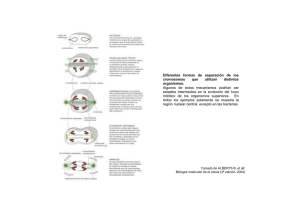
Traducido del inglés al español - www.onlinedoctranslator.com Indio J. Pharm. Biol. Res vol. 1 (3), septiembre de 2013 Artículo de revisión ISSN: 2320-9267 Allium CepaEnsayo de aberración cromosómica de la raíz: una revisión Namita Khanna* y Sonia Sharma Departamento de Ciencias Botánicas y Ambientales, Universidad Guru Nanak Dev, Amritsar, India. * Departamento de Fisiología, Facultad de Medicina Guru Gobind Singh, Universidad de Ciencias de la Salud Baba Farid, Faridkot, Punjab, India. Recibido el 08-05-2013; Revisado el 14-08-2013; Aceptado el 20-08-2013 ………………………………………………………………………………………………………… Abstracto Las plantas superiores, un material importante para las pruebas genéticas para controlar diversos contaminantes presentes en el medio ambiente. Entre las especies de plantas,Alium cepase ha utilizado para evaluar aberraciones cromosómicas y alteraciones en el ciclo mitótico. Actualmente se ha utilizado para evaluar un gran número de agentes genotóxicos/antigenotóxicos, lo que contribuye a su creciente aplicación en el seguimiento ambiental. ElA. cepaSe utiliza comúnmente como organismo de prueba porque es barato, fácilmente disponible y manejable y tiene ventajas sobre otras pruebas a corto plazo. Entre los puntos finales deA. cepaAberraciones cromosómicas de raíz, la detección de aberraciones cromosómicas ha sido la más utilizada para detectar genotoxicidad/antigenotoxicidad a lo largo de los años. El índice mitótico y las anomalías cromosómicas se utilizan para evaluar la genotoxicidad y el análisis de micronúcleos se utiliza para verificar la mutagenicidad de diferentes sustancias químicas. El Allium cepa El ensayo de aberración cromosómica de la raíz se usa ampliamente para determinar los efectos genotóxicos y antigenotóxicos de diferentes extractos de plantas. Palabras clave:Allium cepa, genotoxicidad, clastogénica, índice mitótico. ……………………………………………………………………………………………………………………………… Productos farmacéuticos, desechos domésticos 1. Introducción Hay una serie de productos químicos tóxicos en el medio ambiente; en su mayoría, las industrias los vierten al agua, el aire y el suelo. El uso continuo de productos químicos, llevó al mundo a establecer diversas industrias químicas. Los productos químicos ingresan a nuestro medio ambiente por vías tanto naturales como antropogénicas. Una vez que entran en nuestro proceso biológico, es realmente difícil eliminarlos del medio ambiente y alteran diversos procesos bioquímicos, lo que lleva a resultados fatales. Se han estudiado numerosas sustancias químicas potencialmente mutagénicas porque pueden causar cambios mutagénicos, dañinos y heredables en el material genético. Muchos miles de sustancias quimicos tóxicas incluido e industriales, pesticidas y productos derivados del petróleo están presentes en el medio ambiente y cada año se introducen nuevos productos químicos. Sin duda, el rápido progreso de la industria química ha proporcionado beneficios económicos y sociales pero al mismo tiempo ha acentuado los problemas ambientales y sociales. Los biólogos medioambientales se preocupan actualmente por proteger a los seres humanos de la exposición a sustancias químicas. La genotoxicidad consiste en determinar la magnitud del riesgo genético para el hombre por agentes/químicos ambientales bajo un nivel específico de exposición. Desafortunadamente, la evaluación directa en humanos no es factible debido a consideraciones étnicas, logísticas y prácticas. * Autor correspondiente: Dra. Namita Khanna,Departamento de Fisiología, Facultad de Medicina Guru Gobind Singh, BFUHS, Faridkot, Punjab, India.Identificación de correo:[email protected] ,[email protected] No móviles.+ 91-9417392924 105 Khannaet al., 1(3);2013 Incluso los enfoques epidemiológicos utilizados para detectar sustancias genotóxicas y cancerígenas quimicos tener limitaciones porque la detección es posible en los sistemas. Hay muchos que emplean una amplia variedad de organismos, desde virus, bacterias, plantas e insectos hasta cultivos de células humanas y mamíferos intactos para evaluar la mutagenicidad de las sustancias químicas ambientales. Para identificar los efectos nocivos de sustancias en diferentes concentraciones y tiempos de exposición, se han empleado diversas pruebas, como las pruebas citogenéticas. Estas pruebas se utilizan comúnmente para el biomonitoreo del alcance de la contaminación y para evaluar los efectos de sustancias tóxicas y mutagénicas en el entorno natural [1,2]. ambiente, debido a su sensibilidad y buena correlación con pruebas de mamíferos sistemas [5,6]. De este modoA. cepaes un eficiente prueba organismo para Monitoreo ambiental, especialmente en ambientes acuáticos contaminados [7-9]. 2.Modificación deAllium cepaensayo de aberración cromosómica de la raíz Las plantas superiores, un material importante para las pruebas genéticas para controlar diversos contaminantes presentes en el medio ambiente. El A. cepa La prueba fue introducida por primera vez por Levan [3] para examinar el efecto de las colchicinas en los husos mitóticos y se ha utilizado con frecuencia desde entonces. El procedimiento de la prueba original implicaba germinar bulbos de cebolla en agua destilada a temperatura ambiente después de retirar las escamas secas de Las plantas superiores constituyen un material los bulbos. Cuando las puntas de las raíces importante para las pruebas genéticas destinadas crecieron hasta una longitud de 1 a 2 cm en agua y a controlar los contaminantes ambientales. Sin luego se exponen a tratamientos específicos embargo, esta característica se debe a la seguidos de observaciones macroscópicas y posibilidad de evaluar varios criterios de microscópicas después de un cierto período de valoración genéticos, desde mutaciones puntuales tiempo. Sin embargo, las contaminaciones débiles hasta aberraciones cromosómicas en las células en agua natural, como en agua de ríos u otros (Tabla 1). suministros de agua para uso humano, a menudo Entre las especies de plantas superiores, las más utilizadas para evaluar la contaminación ambiental sonAllium cepa,vicia faba,zea mays, comercioscantia,Nicotiana tabacum,crepis capilaryHordeum vulgare. Pero, aún entre estas especies,Allium cepa (Cebolla) ha sido considerado un organismo de prueba eficiente para indicar la presencia de sustancias químicas mutagénicas [3,4] debido a su característica cinética de proliferación y cromosoma adecuado para este tipo de estudio [1,2].A. cepa El ensayo de aberración cromosómica de la raíz se describió como un sistema de prueba eficiente que se utiliza habitualmente para evaluar el potencial genotóxico de las sustancias químicas en el Disponible en línea enwww.ijpbr.in produjeron muy pocos efectos en la forma original de la prueba [10]. Desde entonces, las modificaciones técnicas en elA. cepaLas pruebas se han diseñado para permitir una evaluación más completa de contaminaciones débiles y desconocidas, como las mezclas complejas, que comprenden la mayoría de las muestras ambientales y puras [4-5,11]. Las primeras adaptaciones delA. cepaLa prueba fue realizada por Fiskesjo [4] al diseñarlo como un organismo de prueba para el monitoreo ambiental. Para ello propuso modificaciones que permitieron tanto la evaluación de compuestos solubles e insolubles en agua como la evaluación de los efectos de mezclas complejas. Serie 106 Khannaet al., 1(3);2013 Se permitía que varios bulbos de cebolla acciones aneugénicas. Dado que varios autores germinaran directamente en el producto químico han demostrado la eficiencia del análisis de CA que se iba a probar y las observaciones finales se enA. cepa comoParece más ventajoso investigar realizaban en unos pocos días. Dado que no se los mecanismos de acción de los agentes incluyó ningún tratamiento inicial con agua pura, probados en el ADN, lo que permite una mejor este método de "tratamiento" es más similar a las comprensión de los efectos promovidos por condiciones de la naturaleza. Incluso pequeñas dichos agentes [2, 14]. Puede ser una ventaja cantidades de contaminaciones tóxicas por utilizar la versión modificada.Alliumprueba ya productos químicos produjeron efectos en las que necesita concentraciones más bajas para diferencias en la longitud de las raíces entre las dar una respuesta específica en comparación diferentes series experimentales de bulbos. Los con los métodos más antiguos, lo que significa efectos tóxicos más graves de los productos que bajo ciertas condiciones es más sensible químicos también influyen en la forma y el color que la prueba original. La prueba modificada de las puntas de las raíces. Para ampliar aún más también es especialmente adecuada para la la importancia de los resultados, se puede realizar visualización fotográfica de las respuestas un análisis microscópico. Esta nueva modificación macroscópicas y microscópicas. delAllium cepaEl ensayo de aberración cromosómica de la raíz también ha sido 3.Materiales y métodos conveniente para estudiar la acción de diferentes Organismo de prueba concentraciones de sustancias químicas tóxicas Bulbos sanos y de igual tamaño de cebolla común (Allium cepaL.:2n=16), y se cultivan series de bulbos en sustancias problema. Para los experimentos, no se deben utilizar bulbos secos y enfermos. conocidas. Posteriormente, Rank y Nielsen [12] propusieron nuevas modificaciones alAllium prueba, lo que hace que sea aún más eficiente analizar varias mezclas complejas conocidas. Sin embargo, todas las modificaciones propuestas por los autores estuvieron relacionadas con la evaluación de aberraciones cromosómicas (CA), que detecta diversos agentes genotóxicos. La prueba fue modificada para evaluar los efectos mutagénicos observando la inducción de micronúcleos (MN) en las células de las raíces deA. cepaexpuestos a diferentes contaminantes ambientales. Se sabe que las AC, como roturas cromosómicas, fragmentos y pérdidas cromosómicas, dan como resultado la formación de células micronucleadas, ya que tanto los fragmentos como los cromosomas completos no pueden incorporarse al núcleo principal durante el ciclo celular [13]. Sin embargo, Rank [11] presentó una opinión diferente a la de los autores Procedimiento de prueba Las escamas exteriores sueltas de los bulbos y las raíces viejas se eliminaron con la ayuda de unas pinzas afiladas y puntiagudas para exponer los primodios de las raíces. Luego se colocaron una serie de bombillas en frascos de acoplamiento que contenían líquido de prueba a una temperatura de 25 ± 1 C̊. El experimento debe realizarse a una temperatura relativamente constante y protegido de la luz solar directa. La sustancia problema debe almacenarse en el refrigerador (Figura 1). Investigaciones citológicas. Fijación Después del tratamiento, los bulbos se lavaron minuciosamente con agua corriente. Se arrancaron las puntas de las raíces de cada bulbo y se fijaron en líquido de Farmer (ácido anteriores, porque según ellos, el análisis de acético glacial:etanol:: 1:3) durante 24 horas. CA, además de estimar los efectos genotóxicos Preparación de calabaza de los agentes probados, también permite Para el análisis cromosómico, las puntas de las evaluar sus efectos clastogénicos y raíces se hidrolizaron en HCl 1 N a 600C por 1 Disponible en línea enwww.ijpbr.in 107 Khannaet al., 1(3);2013 Allium/ViciaEl Programa Internacional de Bioensayos de Plantas (IPPB) también ha adoptado el ensayo de aberración cromosómica de la raíz para la evaluación de contaminantes ambientales [17]. Este ensayo también se ha utilizado para controlar la naturaleza antigenotóxica de diversas plantas y productos vegetales. minuto y se transfirió a un vidrio de reloj que contenía aceto-orcien y HCl 1 N (9:1). Luego se calentaron intermitentemente durante 5 a 10 minutos, se taparon y se dejaron reposar durante 20 a 30 minutos. Luego se cortó la punta de la raíz con una cuchilla afilada y se colocó sobre un portaobjetos de vidrio en una gota de ácido acético glacial al 45% y se cubrió con un cubreobjetos. La punta de la raíz se aplastó golpeando con una cerilla y se selló diferentes parámetros deAllium cepatales como la con DPX. Las células se calificaron bajo el forma de la raíz, el crecimiento, el índice mitótico y microscopio para detectar diferentes tipos de las aberraciones cromosómicas se pueden utilizar aberraciones cromosómicas. para estimar la citotoxicidad, genotoxicidad y 3.1 Ventajas deAllium cepaensayo de aberración cromosómica de la raíz mutagenicidad de los contaminantes ambientales [18]. ElAlliumLa prueba tiene muchas ventajas como ensayo de detección de genotoxicidad, una La principal conclusión de todas las de las cuales es que las células de la raíz deAllium investigaciones realizadas por muchos autores cepaPosee el sistema oxidasa de función mixta fue que los ensayos en plantas son sistemas de que es capaz de activar promutágenos o prueba eficientes y fiables para la detección sustancias químicas genotóxicas. En elAlliumEn la rápida de sustancias químicas en busca de prueba, la inhibición del crecimiento de las raíces y mutagenicidad y clastogenicidad. Entre estos la aparición de raíces atrofiadas indican ensayosAllium cepaSe ha demostrado que el citotoxicidad, mientras que el marchitamiento de ensayo de aberración cromosómica de L. es las raíces explica la toxicidad [5]. Sin embargo, eficaz, sensible, menos costoso y se utiliza para ambas observaciones se deben a la supresión de probar mutágenos potenciales en células la actividad mitótica. mitóticas y meióticas [15-16]. El Figura 1: Representación esquemática deAllium cepaaberración cromosómica de la raíz ensayo. Disponible en línea enwww.ijpbr.in 108 Khannaet al., 1(3);2013 Tabla 1. Resumen sobre el uso deAllium cepaEnsayo de aberración cromosómica de raíz para monitoreo ambiental. S. No 1. Agente/s estudiados Efluentes hospitalarios Naturaleza química mezcla de Tipo de aberraciones Referencia Alteraciones cromosómicas, puente/s [19] anafásico/s y micronúcleos. contaminantes 2. Cenizas volátiles de carbón Mezcla de quimicos inhibición del crecimiento radicular y de los [20] índices mitóticos; formación de células binucleadas. 3. Industrial Aguas residuales Dirigir [21] mitóticas aguas residuales 4. reducción de la división mitótica; anomalías Metal pesado disminuir el crecimiento de las raíces y el [22] índice mitótico; Inducir puente/s cromosómico/s, cromosoma/s rezagados y micronúcleos. 5. Nano-plata Antibacteriano Disminución del índice mitótico, c-metafase, [23] pegajosidad, puente/s, rezagado/s y micronúcleos. 6. Magnesio sulfato Fertilizantes propiedades citostáticas y clastogénicas [24] 7. Efluentes industriales mutagénico reducción del índice mitótico; puente/s, [25] contaminado con quimicos binucleadas; pérdida de cromosomas colorantes azoicos 8. Dirigir rezagado/s, c-metafase, células Metal pesado reducción del crecimiento de las raíces y [22] del índice mitótico; puente/s cromosómico/ s, cromosoma/s rezagados y micronúcleos 9. hidrazida maleica Herbicida aberraciones cromosómicas como [26] puente/s, rezagado/s, etc. 10. Petróleo hidrocarburo 11. Complejo químico mezcla yema nuclear, micronúcleos, minicélulas, cromosómico/s, metafase c y rotura/s extractos de Herbario aberraciones cromosómicas, la inhibición psicotria(PAG. medicamento de la división celular estaba más enP. miriantayPAG. [27] leiocarpaqueP. myriantha leiocarpa) 12. Quizalofop-P-etilo [14] células polinucleadas, puente/s Herbicida pegajosidad, puente/s, vagabundo/s, [28] canafase, multipolaridad, micronúcleos 13. Cadmio Disponible en línea enwww.ijpbr.in Metal inhibición del índice mitótico; CA, MA [29] 109 Khannaet al., 1(3);2013 y micronúcleo 14. hidrazida maleica Metal Los eventos mutagénicos reducen e [30] inducen la translocación de cromosomas. 15. Atrezina Herbicida inhibir el índice mitótico; micronúcleo, cromosomas y mitosis. [31] aberraciones dieciséis. Aluminio Metal estrés oxidativo, daño al ADN y muerte celular [32] 17. Extractos acuosos Medicinal Alteración del huso mitótico, inhibidor, [33] plantas mitodepresivo, turbagénico e deAzadiracta índica, morinda lúcida, cymbopogon inhibición del crecimiento radicular. citrato, Mangifera indica ycarica papaya 18. curcumina Antimutágeno rotura/s cromosómica/s, brecha/s y [34] fragmento/s 19. Potasio metabisulfito 20. Alimento reducción del índice mitótico; descanso/s, espacio/s [35] [36] preservativo Benzonato de sodio, Alimento Reducción de la división mitótica, ácido bórico, cítrico preservativo puente/s de anafase, c-mitosis, ácido, potasio citrato y sodio micronúcleos, rotura/s, retraso, pegajosidad y distribución desigual. citrato 21. Plantago [37] Medicinal disminuir el índice mitótico; inducir lanceolada planta roturas, puentes, pegajosidad 22. Vanadio Metal aberraciones cromosómicas [38]. 23. Herbicida aumento de células anormales, pegajosidad, [39] Avenoxano puente/s, rezagado/s 24. Paracetamol Analgésico las raíces no crecieron en altas [40] concentraciones, el índice mitótico disminuyó 25. Fumonisinas Tóxico se produce daño genético, [41] aberraciones cromosómicas, intercambio de cromátidas hermanas 26. Lechados de residuo sólido Disponible en línea enwww.ijpbr.in Metal pesado inhibición del índice mitótico, contaminación aberraciones cromosómicas y [42] 110 Khannaet al., 1(3);2013 micronúcleos 27. Metal pesado río contaminado Metal pesado agua 28. dinocap disminución de la reproducción celular; [43] puente/s, fragmento/s, rezagado/s, cmitosis, micronúcleos Fungicidas pegajosidad, c-mitosis, rezagado/s, [44] multipolaridad, micronúcleos, fragmento/s de poliploidía 29. La contaminación del aire 30. Diurón suelo contaminado citotóxico sustancia Disminución de la división celular mitótica, Urea rotura/s, células micronucleadas y herbicida binucleadas; el índice mitótico [45] se encontró sustancia genotóxica. [46] disminuyó 31. atrazina Pesticida descanso/s [47] 32. BDE-99 Fuego aberraciones cromosómicas [48] [49] retardante 33. Industrial Industrial inhibición de la división mitótica, aguas residuales de aguas residuales anillo/s cromosómico/s, fragmento/s, puente/s, metafase alterada Shawa, te presento a EI. Akrad, Telbana, Belgay 34. Aguas residuales metales tóxicos Se produce inhibición del crecimiento, aparece [27] marchitamiento en las puntas de las raíces, aumenta la división anormal de las células. micronúcleos, divisiones asincrónicas [49] Alimento índice mitótico disminuido, c- mitosis, [50] metabisulfito conservantes pegajosidad 37. Azadirachta indica Insecticida 35. extracto acuoso de Aristoloquia triangular, Antihipertensivos cinco agentes Cayaponia bonariensis, solana granulsolepros- mmm, 36. Sodio micronúcleo, células multinucleadas, [51] puente/s, pegajosidad, rezagado/s 38. Dirigir Metal inhibición de la actividad mitótica, disminución [52] del nivel de síntesis de ADN, c-mitosis 39. aguas residuales y Nacional y Alto número de micronúcleos y efluentes industriales industrial aberraciones anafásicas. de Amritsar Disponible en línea enwww.ijpbr.in [53] aguas residuales 111 Khannaet al., 1(3);2013 40. Cipermetrina y Insecticidas fenvalerato [6] inhibición del índice mitótico; aberraciones cromosómicas y mitóticas 41. Cs y Sr Radioisótopos la tasa de germinación de las cebollas disminuye; [54] aberraciones como pegajosidad, vagancia 42. 43. [55] Residuos, superficie y Tóxico inhibición del crecimiento de las raíces; agua subterránea sustancias aberraciones metafásicas y anafásicas Agua contaminada industriales y municipal fragmento/s, c-mitosis, pegajosidad [15] la longitud de la raíz disminuyó; el índice mitótico [56] muestra aguas residuales, agua de tratamiento planta 44. alquilbenceno, sulfonato y Surfactantes disminuyó; aberraciones cromosómicas citowett 45. [57] Aguas residuales Mezcla de inhibición de la actividad mitótica, muestras tóxico aberraciones cromosómicas y sustancias genómicas fumigativo Se reduce la longitud de la raíz y la viabilidad de las agente semillas, aumenta la frecuencia de células aberradas. Carbetamida Pesticida C-mitosis, rotura/s y puente/s [59] 48. clorofenoxi Herbicida tumores c, pegajosidad, vagabundos, [60] 46. gas fosfina 47. fragmentos; índice mitótico disminuido ácidos 49. carboxina, Pesticida micronúcleos [61] herbicidas agrandamiento celular y aberraciones [62] oxicarboxina 50. 2, 4, 5-T [58] cromosómicas; duración del ciclo mitótico aumentada 3.2 Diferentes criterios de valoración analizados I. Forma de raíz: Las raíces mostraron la mayor por elAllium cepaensayo de aberración sensibilidad, con efectos significativos incluso cromosómica de la raíz con la concentración más baja de la sustancia ElAlliumLa prueba se ha utilizado para controlar la naturaleza genotóxica, citotóxica y mutagénica de diferentes sustancias problema. A continuación se presentan las categorías genéticas de los diferentes parámetros analizados por este sistema de prueba. problema. Este parámetro es observable después de 3-5 días de tratamiento que muestran hinchazón, curvatura y decoloración de las puntas o raíces de las raíces. II. Raíz longitud y CE50 determinación: La disminución del crecimiento de las raíces superior al 45% indica la presencia de sustancias tóxicas. Disponible en línea enwww.ijpbr.in 112 Khannaet al., 1(3);2013 naturaleza de las sustancias [4] que tienen efectos subletales en las plantas [52]. Para la determinación de CE50Se cultivaron una serie de bulbos en frascos acoplados que contenían agua destilada a una temperatura de 25 ± 1 C̊. Después de 24 horas, se seleccionaron los bulbos con crecimiento uniforme de raíces y se colocaron en frascos de acoplamiento llenos con diferentes concentraciones tanto de la sustancia problema como de agua destilada (control negativo). Este conjunto de bulbos de cebolla se denominó día uno. Al cuarto día, se midieron las longitudes de las raíces para cada grupo (tanto de control como de tratamiento) y se calcularon los valores medios. Tomando la longitud media de la raíz del control como 100%, se graficaron las longitudes de los IV. Aberraciones cromosómicas (CA): Las CA se caracterizan por cambios en el número total de cromosomas o en la estructura cromosómica que se producen como resultado de la exposición a un tratamiento químico. Para evaluar las diferentes anomalías cromosómicas se consideran varios tipos de CA en diferentes etapas del ciclo celular (Profase, metafase, anafase y telofase). Las CA se agruparon en 2 tipos, aberraciones clastogénicas y fisiológicas. Las aberraciones clastogénicas incluyen puentes de cromatina, roturas cromosómicas y cromosomas en anillo, mientras que las aberraciones fisiológicas incluyen cmitosis, vagabundos, pegajosos, anafase retrasada y rezagados. diferentes grupos de tratamiento frente a las concentraciones de prueba y el punto en el gráfico que mostró un crecimiento del 50% se designó como EC.50concentración. III. Índice mitótico (IM): El nivel citotóxico de una sustancia problema/compuesto puede determinarse en función del aumento o disminución del índice mitótico (IM), que puede utilizarse como parámetro de citotoxicidad en estudios de biomonitoreo ambiental [15]. La reducción significativa del IM observada en el presente estudio puede deberse a la inhibición de la síntesis de ADN o al bloqueo en el sistema G.2 fase del ciclo celular [63]. Se ha informado que varias otras sustancias químicas inhiben la mitosis [36]. La inhibición de las actividades mitóticas se utiliza para rastrear sustancias citotóxicas. El nivel citotóxico puede determinarse por la disminución de la tasa del índice mitótico. Una disminución del índice mitótico por debajo del 22% del control negativo provoca efectos letales en el organismo de prueba, mientras que una disminución por debajo del 50% tiene efectos subletales [64] y se denomina valor límite citotóxico. Varios investigadores han utilizado la IM como criterio de valoración para la evaluación de la genotoxicidad o antigenotoxicidad de diferentes tratamientos químicos [65,66]. Disponible en línea enwww.ijpbr.in El término c-mitosis fue acuñado por Levan [3] y describió que las colchicinas impiden el ensamblaje de las fibras del huso y provocan la dispersión de los cromosomas sobre las células. Hay varios pesticidas que son agentes c-mitóticos como el mercurio, los carbamatos, el dieldrín, etc. el profam, el clorprofam, el carbarilo, el benomilo, etc. son productos químicos c-mitóticos extremadamente activos. En las aberraciones fisiológicas, se encontró que la frecuencia de las células con mitosis era máxima que otras aberraciones. Varios investigadores pudieron inducir cmitosis en células vegetales utilizando diferentes tipos de aditivos alimentarios [36, 50]. En la anafase retrasada, los dos grupos cromosómicos anafásicos se encuentran uno cerca del otro cerca de la placa ecuatorial. La frecuencia de células aberradas con cromosomas retrasados fue muy alta y aumentó al aumentar la concentración de las sustancias problema. Los cromosomas rezagados se deben a que los cromosomas no se unen a la fibra del huso y no se mueven. 113 Khannaet al., 1(3);2013 a cualquiera de los dos polos. Turkoglu [36] daños derivados de la exposición a sustancias también informó sobre la inducción de químicas mutagénicas. Según algunos aberraciones cromosómicas rezagadas, también autores, el MN puede formarse como llamadas rezagadas, después del tratamiento con resultado de fragmentos acéntricos o aditivos alimentarios. cromosomas completos no incorporados al La pegajosidad de los cromosomas ha resultado del aumento de la contracción y condensación cromosómica o de la despolimerización del ADN y la disolución parcial.de nucleoproteínas. La pegajosidad de los cromosomas refleja efectos tóxicos, generalmente de tipo irreversible y que probablemente conducen a la muerte celular. Los mismos resultados están en línea con los resultados de muchos grupos de investigación que examinaron los efectos de diferentes sustancias químicas en diferentes materiales [36, 50]. En los cromosomas vagabundos, un cromosoma se adelanta desde su grupo cromosómico hacia los polos y conduce a una separación desigual del número de cromosomas en las células hijas. Muchos investigadores han observado cromosomas vagabundos en diferentes estudios [30]. Los efectos clastogénicos se observaron en forma de puentes de cromatina, roturas de cromatina y cromosomas en anillo. Los cromosomas en anillo son el resultado de la pérdida de cromosomas del lado telomérico. Los puentes de cromatina podrían ocurrir durante la translocación del intercambio desigual de cromátidas y causar una mutación cromosómica estructural. Este tipo de anomalía también se observó en la mitosis devicia fabayAllium cepa después de tratamientos con aditivos alimentarios [67, 36]. V. Micronúcleos (MN): El MN puede originarse espontáneamente debido al desarrollo del cromosoma aislado que resulta de una distribución desigual del material genético. Sin embargo, su inducción se utiliza comúnmente para detectar genes. Disponible en línea enwww.ijpbr.in núcleo principal durante el ciclo celular. Por tanto, cualquier sustancia que sea capaz de promover la formación de micronúcleos se dice que es clastogénica o aneugénica [68]. La prueba MN se considera una de las pruebas más prometedoras para la evaluación de mutagenicidad/genotoxicidad ambiental, ya que es un ensayo eficiente, simple y rápido. Se observaron células portadoras de micronúcleos en diferentes etapas del ciclo celular, aunque la mayoría de ellas involucradas en interfase y etapas de profase. La mayoría de las veces, el MN observado era sincrónico con la división de los núcleos principales. Sin embargo, en algunos casos dicha sincronía no se produjo. A partir de análisis de linfocitos humanos, algunos autores han sugerido que el ADN sobrante de una célula puede originar una yema que da lugar a un micronúcleo y posteriormente es expulsado como una minicélula. Las minicélulas constituyen pequeñas porciones citoplasmáticas con un pequeño contenido nuclear. La formación de micronúcleos (MN) en las células de la punta de la raíz ha sido ampliamente estudiada en la evaluación de diversos agentes químicos [36]. VI. Otras anomalías Celik y Aslanturk [16] observaron células fantasma mientras evaluaban la citotoxicidad y genotoxicidad del extracto de hoja deInula viscosaconAllium cepa prueba. La célula fantasma es una célula muerta cuyo contorno es visible pero el núcleo y la estructura citoplasmática no se pueden teñir. La muerte celular o apoptosis es un proceso biológico de los organismos vivos. La muerte celular fue inducida por altas concentraciones. 114 Khannaet al., 1(3);2013 de productos químicos tóxicos y otros. Los cromosomas univalentes pueden resultar de una baja frecuencia de quiasma o de la presencia de genes asinápticos o desinápticos en la etapa de profase 1 del ciclo celular. Varios investigadores informaron sobre la presencia de células binucleadas en varios géneros después de tratamientos químicos [67]. La aparición de células binucleadas fue el resultado de la inhibición del proceso de citocinesis de la división celular. 4. Conclusión un ensayo fácil, rápido y muy sensible para detectar genotoxicidad/antigenotoxicidad ambiental de productos químicos o productos vegetales naturales. Este ensayo está relacionado con el estudio del efecto de sustancias químicas a nivel genético que incluye tanto microscópico y macroscópico parámetros. Por lo tanto, esta prueba proporciona un método importante para la detección de la toxicidad ambiental causada por sustancias tóxicas. Declaracion de conflicto de interes: Declaramos que no tenemos conflicto de interés. De la información proporcionada en la revisión, se concluye que entre los diferentes ensayos de plantas, elA. cepala prueba es Expresiones de gratitud Los autores agradecen a la Universidad Guru Nanak Dev, Amritsar, India, por proporcionar las instalaciones de laboratorio necesarias para el cepa. Genética y biología molecular, 2006; 29: 148-158. 3. Levan A. El efecto de la colchicina sobre la mitosis de la raíz enAllium. hereditas 1938; 24: 471-486. financiación del sector público, comercial o sin 4. Fiskesjo G. ElAlliumprueba como estándar en el monitoreo ambiental. hereditas, 1985; 102: 99-112. fines de lucro. 5. Grant WF., Ensayos de aberración cromosómica en trabajo. Esta investigación no recibió ninguna subvención específica de ninguna agencia de Allium. Un informe del Programa Gene-Tox de la Referencias 1. Matsumoto ST, Estudio sobre la influencia de los efluentes potencialmente genotóxicos de las curtidurías en la contaminación de los recursos hídricos en la región de Franca-SP, Ph.D. Tesis. Universidad Estatal de Sao Paulo/ Sao Jose do Rio Preto- SP. 216, 2004. 2. Matsumoto ST., Mantovani MS., Malagutti MI., Dias AL., Fonseca IC, Marin-Morales MA., Evaluación de los efectos genotóxicos y mutagénicos de los residuos de cromo presentes en los efluentes de la curtiduría utilizando el ensayo de micronúcleos y cometas enOreocromis niloticusy aberraciones cromosómicas en deAllium Disponible en línea enwww.ijpbr.in Agencia de Protección Ambiental de EE. UU. Investigación de mutaciones, mil novecientos ochenta y dos; 99: 273-91. 6. Chauhan LKS., Saxena PN., Gupta SK. Efectos citogenéticos de la cipermetrina y el fenvalerato en las células meristemáticas de la raíz de Allium cepa. Botánica ambiental y experimental, 1999; 42: 181-189. 7. Parry JM., Tweats DJ., Al-Massaur, Monitoreo del medio marino en busca de mutágenos.Naturaleza, 1976; 264: 538-540. 8. Rank J., Nielson MH Evaluación de laAllium Prueba de anafase-telofase en relación con la detección de genotoxicidad de aguas residuales industriales. Mutación Investigación, 1994;312; 17-24. 115 Khannaet al., 1(3);2013 9. Jiang WS, Liu DH Efectos del Pb2+ sobre el crecimiento de las raíces, las divisiones celulares y el nucléolo deBrassica junceaL. Israel. DiariodeCiencia de las plantas, 1999; 47: 153-156. 10. Fiskesjo G. Mercurio y selenio en forma modificada.Alliumprueba.hereditas, 1979; 91: 169-178. 11. Rango J. El método deAllium Ensayo de aberración cromosómica anafase-telofase. ecología, 2003; 1: 38-42. 12. Rango J., Nielson MH. Evaluación de la AlliumPrueba de anafase-telofase en relación con la detección de genotoxicidad de aguas residuales industriales.Mutación Investigación,1994; 312: 17-24. 13. Fenench M. Elin vitro Técnica de micronúcleos.investigación de mutaciones,2002; 455: 81-95. 14. Leme DM., Angelis DF, Marin-Morales MA, Mecanismos de acción de los cepaEnsayo de aberración cromosómica. Revista de Ciencias Biológicas de Pakistán, 2002; 5: 184-188. 19. Bagatin MD, Vasconcelos TG, Laughinghouse IV HD, Martins AF, Tedesco SB Biomonitoreo de efluentes hospitalarios por parte deAllium cepaL. prueba.Boletín de Contaminación Ambiental y Toxicología,2009; 82: 590-592. 20. Chakraborty R., Mukherjee AK, Mukherjee A. Evaluación de la genotoxicidad de las cenizas volantes de carbón enAllium cepa células de raíz combinando el ensayo del cometa con elAlliumprueba. Ambiental Monitoreando y Evaluación, 2009; 153: 351-357. 21. Sik L., Acar O., Aki, C. Efectos genotóxicos de las aguas residuales industriales en Allium cepal.Revista Africana de Biotecnología,2009; 8: 1919-1923. 22. Carruyo I., Fernández Y., Marcano hidrocarburos de petróleo presentes en L., Montiel X., Torrealba, Z. Correlación de la aguas impactadas por un derrame de toxicidad con el contenido de plomo en las petróleo sobre el material genético de células de la punta de la raíz (Allium cepa Allium cepacélulas de la raíz.Toxicología Acuática, 2008; 88: 214-219. L.).Investigación de oligoelementos biológicos, 2008; 125: 276-285. 15. Smaka-Kincl V., Stegner P., Lovka M., Toman, MJ La evaluación de la calidad de las aguas residuales, superficiales y subterráneas utilizando elAllium procedimiento de prueba.Investigación de mutaciones, 1996; 368: 171-179. 16. Celik TA, Aslanturk, OS, efectos antimitóticos y antigenotóxicos de Plantago lanceolataextracto acuoso en Allium cepaCélulas meristemáticas de la punta de la raíz.Celular y Molecular Biología,2006; 61: 693-697. 17. Ma TH El programa internacional sobre bioensayos de plantas y el informe del estudio de seguimiento después del taller práctico en China.Investigación de mutaciones, 1999; 426: 103-106. 18. Amin AW, Pruebas de citotoxicidad del tratamiento de aguas residuales utilizandoAllium Disponible en línea enwww.ijpbr.in 23. Babu K., Deepa MA, Shankar SG, Rai, S. Efecto de la nanoplata en la división celular y los cromosomas mitóticos: una sirena preliminar.La revista de Internet sobre nanotecnología, 2008; 2: 2. 24. Bhatta P., Sakya SR Estudio de la actividad mitótica y el comportamiento cromosómico en el meristemo de la raíz deAllium cepaL. tratado con sulfato de magnesio.Ecoimpresión, 2008; 15: 83-88. 25. Carita R., Marin-Morale MA Inducción de aberraciones cromosómicas en elAllium cepa sistema de prueba causado por la exposición de semillas a efluentes industriales contaminados azócontintes. quimiosfera, 2008; 72: 722-725. 26. Jabee F., Ansari MYK, Shahab, D. Estudios sobre el efecto de maleico 116 Khannaet al., 1(3);2013 hidrazida en las células de la punta de la raíz y la fertilidad del polen enTrigonella foenumgraecuml.Revista turca de botánica,2008; 32: 337-344. 27. Lubini G., Fachinetto JM., Laughinghouse IV HD., Paranhos JT., Silva ACF., Tedesco SB. Extractos que afectan la división mitótica en las células meristemáticas de la punta de la raíz.biología, 2008; 63: 647-651. 28. Mustafa Y., Arikan ES., Pruebas de genotoxicidad del herbicida quizalofop-petil utilizando elAllium cepa Ensayo de aberración cromosómica anafase-telofase.Cariología, 2008; 61: 45-52. 29. Seth CS, Misra V., Chauhan LKS, Singh, RR, Genotoxicidad del cadmio en las células del meristemo de la raíz de Allium cepa: enfoque citogenético y de ensayo de cometas.Ecotoxicología y Seguridad Ambiental, 2008; 71: 711-716. 30. Sondhi N., Bhardwaj R., Kaur S., Kumar N., Singh, B. Aislamiento de 24epibrassinolida de hojas deaegle marmelosy evaluación de su antigenotoxicidad empleandoAllium cepaEnsayo de aberración cromosómica. Regulación del crecimiento vegetal, 2008; 54: 217-224. 31. Srivastava K., Mishra, KK. Efectos citogenéticos de la atrazina formulada comercialmente en las células somáticas deAllium cepay vicia faba. Bioquímica y fisiología de plaguicidas, 2009; 93: 8-12. 32. Achary VMM., Jena S., Panda KK., Panda BB. El aluminio indujo estrés oxidativo y daño al ADN en las células de la raíz deAllium cepal. Ecotoxicología y Seguridad Ambiental, 2007; 70: 300-310. 33. Akinboro A., Bakare AA. Efectos citotóxicos y genotóxicos de extractos acuosos de cinco plantas medicinales sobre Disponible en línea enwww.ijpbr.in Allium cepaLinn.Revista de etnofarmacología, 2007; 112: 470-475. 34. Irulappan R., Natarajan P. Potencial antimutagénico de la curcumina sobre las aberraciones cromosómicas en Allium cepa. Revista de Ciencias B de la Universidad de Zhejiang,2007; 8: 470-475. 35. Kumar LP., Pannverselvan, N. Estudios citogenéticos de conservantes alimentarios enAllium ceparaíz meristemática células. hecho Universitatis, 2007; 14: 60-63. 36. Turkoglu S., Genotoxicidad de cinco conservantes alimentarios probados en las puntas de las raíces deAllium cepal. Investigación de mutaciones/ Toxicología genética y mutagénesis ambiental, 2007; 626: 4-14. 37. Celik TA, Aslanturk OS Efectos citotóxicos y genotóxicos de Lavandula stoechasextractos acuosos.biología, 2007; 62: 292-296. 38. Marcano L., Carruyo I., Fernández Y., Montiel X., Torrealba Z. Determinación de la acumulación de vanadio en células de raíz de cebolla (Allium cepaL.) y su correlación con la toxicidad.biocélula,2006; 30: 259-267. 39. Kaymark F., Muranli FDG. Los efectos citogenéticos del avenoxano sobre Allium cepay su relación con la esterilidad del polen.Acta Biológica Húngara,2005; 56: 3-4. 40. Rathore HS, Chowbey P. Prevención de paracetamolinducido mitodepresión con mirobálano enAllium cepamodelo. Revista iraní de farmacología y terapéutica,2005; 4: 100-104. 41. Lerda D., Bistoni MB, Peralta N., Ychari S., Vazquez M., Bosio G. Fumonisinas en alimentos cordobeses (Argentina), presencia y 117 Khannaet al., 1(3);2013 genotoxicidad.Toxicología alimentaria y química,2005; 43: 691-698. 42. Chandra S., Chauhan LKS, Murthy RC, Saxena PN, Pande PN, Gupta SK Comparativo biomonitoreo de lixiviados de residuos sólidos peligrosos de dos industrias utilizandoAlliumprueba.Ciencia del Medio Ambiente Total,2005; 347: 46-52. 43. Ivanova E., Staikova TA, Velcheva I. Pruebas citogenéticas de agua de río contaminada con metales pesados y cianuro en una región minera del suroeste de Bulgaria.Revista de biología celular y molecular, 2005; 4: 99-106. 44. Celik M., Yuzbasioglu D., Unal F., Arslan O., Kasap R. Efectos del dinocap en la mitosis deAllium cepal.citología,2005; 70: 13-22. 45. Glasencnik E., Ribaric-Lasnik C., Savinek K., Zalubersek M., Mueller M., Batic F., Impacto de la contaminación BDE-99, un retardante de llama de éter de difenilo pentabromado. Mutagénesis ambiental y molecular, 2003; 42: 85-90. 49. EI-Shahaby OA, Migid HMA, Soliman MI, Mashaly IA, Detección de genotoxicidad de aguas residuales industriales utilizando elAllium cepa Ensayo de aberración cromosómica. Revista de Ciencias Biológicas de Pakistán,2003; 6: 23-28. 50. Rencuzogullari E., Kayraldiz A., ILA HB, Cakmak T., Topaktas, M. Los efectos citogenéticos del metabisulfito de sodio, un conservante alimentario en las células de la punta de la raíz deAllium cepal. Revista turca de biología, 2001; 25: 361-370. 51. Soliman MI Pruebas de genotoxicidad de la planta de neem (Azadirachta indicaA. Juss.) usando elAllium cepa Ensayo de aberraciones cromosómicas. Revista de Ciencias Biológicas, 2001; 1021-1027. contaminados en Eslovenia. Revista de 52. Wierzbicka M. El efecto del plomo en el ciclo celular en el meristemo de la raíz de Allium cepa L. Protoplasma,1999; 207: 186-194. química atmosférica, 2004; 49: 363-376. 53. Grover IS, Kaur S. Genotoxicidad de muestras 46. Saxena PN, Chauhan LKS, Chandra S., Gupta SK Efectos genotóxicos del suelo contaminado con diurón en las células meristemáticas de la raíz de Allium sativum: Un posible mecanismo de daño cromosómico.Mecanismos y métodos de toxicología., 2004; 14: 281-286. de aguas residuales de aguas residuales y del aire en el material genético de la chalota (Allium cepaL. var.ascalónico) expuestos en diferentes lugares 47. Bolle P., Mastrangelo S., Tucci P., Evandri MG, Clastogenicidad de la atrazina evaluada con elAllium cepaprueba.Ambiental y mutagénesis molecular,2004; 43: 137-141. 48. Evandri MG, Mastrangelo S., Costa LG, Bolle P.,in vitroevaluación de la mutagenicidad y clastogenicidad de Disponible en línea enwww.ijpbr.in efluentes industriales detectadas por el AlliumEnsayos de aberración anafásica de raíz y micronúcleos.Investigación de mutaciones, 1999; 426: 183-188. 54. Kovalchuk O., Kovalchuk I., Arkhipov A., Teljuk P., Hotin B., Kovalchuk L. El Allium cepa La prueba de aberración cromosómica mide de forma fiable la genotoxicidad de los suelos de zonas habitadas de Ucrania contaminadas por el accidente de Chernobyl. Investigación de mutaciones, 1998; 415: 47-57. 55. Kincl VS, Stegnar P., Lovka M., Toman MJ La evaluación de la calidad de las aguas residuales, superficiales y subterráneas 118 Khannaet al., 1(3);2013 utilizando elAlliumprocedimiento de prueba. 63. Sudhakar R., Gowda N., Venu G., Anomalías investigación de mutaciones,1996; 368: mitóticas inducidas por efluentes de la 171-179. industria del teñido de seda en las células 56. Bellani LM, Rinallo C., Bennici, A. Alternancias citomorfológicas en Alliumraíces inducidas por surfactantes. Botánica ambiental y experimental, 1991; 31: 179-185. 64. Sharma S., Vig, AP, Efectos antigenotóxicos 57. Vidakovic Z., Papes D., Toxicidad de los la genotoxicidad inducida por mercurio fluidos de perforación residuales en Allium prueba.Contaminación del agua, el aire y el suelo,1993; 69: 413-423. 58. Younis SA, Al-Hakkar ZS, Al-Rawi FI, Hagop EG Efectos fisiológicos y citogenéticos del gas fosfina en Allium cepa. (L.).Revista de investigación de productos almacenados, 1989; 25: 25-30. 59. Badr A. Actividades mitodepresivas y cromotóxicas de 2 herbicidas enAllium cepa. citología, 1983; 48: 451-458. 60. Fiskesjo G., Lassen C., Renberg L. Ácidos fenoxiacéticos clorados y clorofenoles en forma modificada. Allium prueba. quimico - biológico Interacciones,1981; 34: 333-344. 61. Sakamoto HTE, Takahashi CS, Acción del fungicida benlate sobre los pelos del estambre de Tradescantia yAllium cepa células de la punta de la raíz.Revista Brasileira de Genética, 1981; 4. 367-382. 62. Grant WF, Los efectos genotóxicos de deAllium cepa. citología,2001; 66: 235-239. de la mostaza india (Brassica juncea(L.) Czern.) extracto acuoso de semillas contra (Hg).Investigación científica y ensayo., 2012; 7: 1385-1392. 65. Sharma S., Nagpal A., Vig AP Potencial genoprotector deBrassica junceaL. Czern. contra la genotoxicidad inducida por mercurio enAllium cepa. Revista turca de biología,2012; Doi: 10.3906/biy-1110-18. 66. Panda BB, Sahu UK Inducción de la función anormal del huso e inhibición de la citocinesis en células mitóticas deAllium cepapor el organofosforado insecticida fensulfotión.citobios,1985; 42: 147-155. 67. Gomurgen AN Efecto citológico del conservante alimentario metabisulfito de potasio y nitrato de potasio en las puntas de las raíces deAllium cepal. citología,2005; 70: 119-128. 68. Meng Z., Zhang L. Daño citogenético inducido por bisulfito de sodio. Investigación de mutaciones, 1992; 298: 63-69. 2,4,5-T.Investigación de mutaciones, 1979; 65: 83-119. Cite este artículo como: Namita Khanna y Sonia Sharma.Allium CepaEnsayo de aberración cromosómica de raíces: una revisión.Indio J. Pharm. Biol. Res. 2013; 1(3):105-119. Todos los © 2013 están reservados por Indian Journal of Pharmaceutical and Biological Research. Disponible en línea enwww.ijpbr.in 119