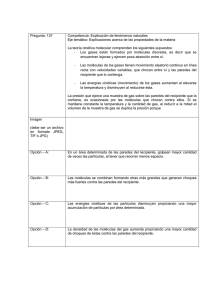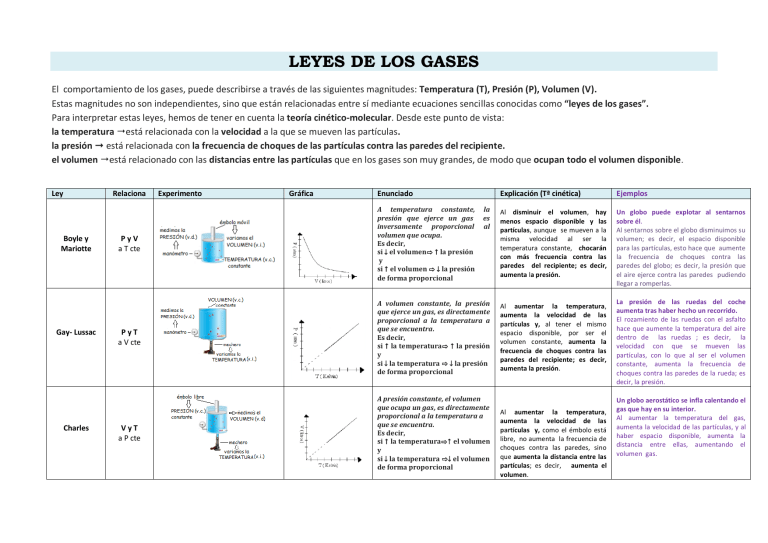
LEYES DE LOS GASES El comportamiento de los gases, puede describirse a través de las siguientes magnitudes: Temperatura (T), Presión (P), Volumen (V). Estas magnitudes no son independientes, sino que están relacionadas entre sí mediante ecuaciones sencillas conocidas como “leyes de los gases”. Para interpretar estas leyes, hemos de tener en cuenta la teoría cinético-molecular. Desde este punto de vista: la temperatura está relacionada con la velocidad a la que se mueven las partículas. la presión está relacionada con la frecuencia de choques de las partículas contra las paredes del recipiente. el volumen está relacionado con las distancias entre las partículas que en los gases son muy grandes, de modo que ocupan todo el volumen disponible. Ley Relaciona Boyle y Mariotte Gay- Lussac Charles Experimento Gráfica Enunciado PyV a T cte A temperatura constante, presión que ejerce un gas inversamente proporcional volumen que ocupa. Es decir, si ↓ el volumen⇨ la presión y si el volumen ⇨ ↓ la presión de forma proporcional la es al PyT a V cte A volumen constante, la presión que ejerce un gas, es directamente proporcional a la temperatura a que se encuentra. Es decir, si la temperatura⇨ la presión y si ↓ la temperatura ⇨ ↓ la presión de forma proporcional VyT a P cte A presión constante, el volumen que ocupa un gas, es directamente proporcional a la temperatura a que se encuentra. Es decir, si la temperatura⇨ el volumen y si ↓ la temperatura ⇨↓ el volumen de forma proporcional Explicación (Tª cinética) Ejemplos Al disminuir el volumen, hay menos espacio disponible y las partículas, aunque se mueven a la misma velocidad al ser la temperatura constante, chocarán con más frecuencia contra las paredes del recipiente; es decir, aumenta la presión. Un globo puede explotar al sentarnos sobre él. Al sentarnos sobre el globo disminuimos su volumen; es decir, el espacio disponible para las partículas, esto hace que aumente la frecuencia de choques contra las paredes del globo; es decir, la presión que el aire ejerce contra las paredes pudiendo llegar a romperlas. Al aumentar la temperatura, aumenta la velocidad de las partículas y, al tener el mismo espacio disponible, por ser el volumen constante, aumenta la frecuencia de choques contra las paredes del recipiente; es decir, aumenta la presión. Al aumentar la temperatura, aumenta la velocidad de las partículas y, como el émbolo está libre, no aumenta la frecuencia de choques contra las paredes, sino que aumenta la distancia entre las partículas; es decir, aumenta el volumen. La presión de las ruedas del coche aumenta tras haber hecho un recorrido. El rozamiento de las ruedas con el asfalto hace que aumente la temperatura del aire dentro de las ruedas ; es decir, la velocidad con que se mueven las partículas, con lo que al ser el volumen constante, aumenta la frecuencia de choques contra las paredes de la rueda; es decir, la presión. Un globo aerostático se infla calentando el gas que hay en su interior. Al aumentar la temperatura del gas, aumenta la velocidad de las partículas, y al haber espacio disponible, aumenta la distancia entre ellas, aumentando el volumen gas.