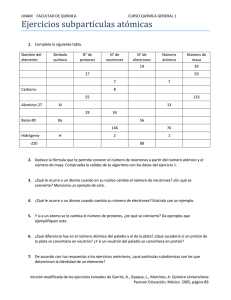
EL ATOMO Sistema energético en equilibrio y la mínima porción de materia que tiene existencia independiente. No es posible observarlo físicamente ESTRUCTURA ATOMICA NÚCLEO (zona interna).Sus principales características son: Constituye la parte central del átomo Su volumen es pequeño en comparación al volumen del átomo Concentra el 99,99 % de la masa del átomo Contiene aproximadamente 200 partículas subatómicas, llamadas nucleones Las partículas subatómicas más estables son los neutrones y protones llamadas nucleones fundamentales Que indica la posición del elemento en la tabla periódica OJO; Z = # p+ → p+ = e- = Z NÚMERO DE MASA (A) Es el número de: La suma de protones y neutrones que se encuentran el núcleo atómico Nucleones fundamentales (protones y neutrones) A = # p+ + # n0 El número de masa también se expresa como: A = Z + # n0 El número de neutrones se halla mediante: # n0 = A – Z CARGA DEL ÁTOMO (CARGA RELATIVA); Se determina de acuerdo al número de protones y al número de electrones que posee el átomo, como se indica en la siguiente relación: Teniendo en cuenta esta carga, el átomo puede ser: Neutro: Su carga es igual a CERO porque: p+ = e – = Z Iónico (anión y catión): Es todo átomo cargado eléctricamente debido a que: #p+ ≠ # e– Catión. (Ión positivo) Se forma cuando el átomo PIERDE electrones Se carga POSITIVAMENTE NÚMERO ATÓMICO = CARGA NUCLEAR (Z).- Es el número: De protones que presenta el núcleo atómico AÑO Y SECCIÓN: 3º - 4º - 5º Anión. (Ión negativo) Se forma cuando el átomo GANA electrones Se carga NEGATIVAMENTE QUIMICA SECUNDARIA PRACTICA Nivel 01 1. De las proposiciones: I. Un átomo es eléctricamente neutro debido a la existencia de los neutrones en el núcleo atómico. II. La nube electrónica es una región de elevada densidad. III. La masa del átomo se concentra casi totalmente en el núcleo atómico. Son incorrectas: A) Sólo III B) I – III D) Solo I E) I, II, III C) I y II 2. El átomo es una estructura neutra formada por un núcleo central y la envoltura electrónica. En esta última se encuentran, girando a una gran velocidad, los … determinando …. del átomo, los protones y …….que, determinan la masa, están en el….a los que llamamos….. A) protones – el volumen – neutrones – núcleo – electrones. B) electrones – el volumen – neutrones – núcleo – nucleones. C) electrones – la carga – neutrones – envoltura – nucleones. D) neutrones – la masa – electrones – núcleo – nucleones. E) electrones – el volumen – neutrones – núcleo – partículas neutras. 3. Los ........ poseen carga positiva, los .......... poseen carga negativa y los .......... son neutrones a) Neutrones - Protones - Electrones b) Electrones - Protones - Neutrones c) Protones - Electrones - Neutrones d) Electrones - Neutrones - Protones 4. ¿Cuál de las siguientes afirmaciones es incorrecta? a) El núcleo de un átomo contiene protones y neutrones. b) Los protones poseen carga positiva, los neutrones no tienen carga y los electrones tienen carga negativa. c) El neutrón es una partícula subatómica de masa similar al protón, pero sin carga eléctrica. d) De acuerdo a sus masas: electrón < protón < neutrón e) El electrón del átomo del hidrógeno es más pequeño que el electrón del átomo de oxígeno. 5. El núcleo de un átomo puede contener: a) neutrones y protones b) neutrones y electrones c) solamente electrones d) neutrones, protones y electrones 6. Relaciona según corresponda: I) e – A) Carga nuclear II) A B) Carga negativa III) nº C) Suma de p+ y nº IV) Z D) Su carga relativa es 0 a) I–A; II–B; III–C; IV–D b) I–B; II–A; III–D; IV–C c) I–B; II–C; III–D; IV–A d) I–C; II–B; III–D; IV–A NIVEL 02 1. Indica la afirmación incorrecta en: 49 +2 24𝑋 a) Tiene 24 p+ b) Tiene 22 e – o c) Tiene 25 n d) Z = 24 e) Tiene 25 nucleones 2. En un átomo neutro el número de masa es 80 y el número de neutrones es 10 unidades más que el número de electrones. Halle la carga nuclear del átomo. A) 35 B) 28 C) 37 D) 42 E) 40 5. El promedio aritmético entre el número atómico y número de masa de un átomo es 23. Si en el núcleo se tiene 16 neutrones, indique el número atómico del núclido. A) 30 B) 15 C) 20 D) 25 E) 10 6. Si E tiene 17 nO. Hallar # p+ ; Z; A: 3. Halla el número de p+ ; no ; e– en: 75 − 3 33𝑋 4. Señala la respuesta incorrecta Para 31 −3 15𝑋 AÑO Y SECCIÓN: 3º - 4º - 5º 𝐸 a) 16; 33; 16 b) 16; 16; 33 c) 33; 16; 33 d) 33; 16; 16 a) 33; 75; 36 b) 33; 42; 33 c) 33; 42; 30 d) 33; 42; 36 a) Es anión trivalente b) Tiene 16no y 15p+ c) Carga nuclear es 15 d) Contiene 18 e – e) Contiene 36 fundamentales 4𝑋+1 2𝑋 partículas 7. En un átomo se observa que el número de masa es el doble del número atómico, además posee 36 partículas fundamentales, determinar la cantidad de partículas neutras que posee. A) 24 B) 16 C) 12 D) 18 E) 14 8. Si un átomo presenta 180 nucleones y el número de neutrones es el doble que el de protones, halle el número atómico. a) 56 b) 58 c) 60 d) 62 e) 64 QUIMICA SECUNDARIA 9. En un átomo el número de neutrones es el triple que el número de protones. Si el número de nucleones es 80, halle el número atómico. a) 10 b) 20 c) 30 d) 40 10. El número de masa de un átomo es el doble de su número atómico, más 6 unidades y si el núcleo posee 40 neutrones, entonces su número de masa es: A) 74 B) 94 C) 64 D) 84 11. Un catión trivalente contiene 197 nucleones y 118 neutrones. Señale el número de electrones que posee dicho catión. A) 82 B) 76 C) 75 D) 78 12. Halla la masa atómica de un anión trivalente que tiene 36 electrones y 42 neutrones. a) 75 b) 76 c) 77 d) 78 13. Se tiene un átomo donde el número de neutrones excede en 4 al número de protones. Indique el número de partículas fundamentales sabiendo que el átomo posee 56 nucleones. A) 86 B) 58 C) 80 D) 82 14. Calcula el número de masa de un átomo que tiene 10 neutrones y la siguiente representación: a) 20 b) 30 c) 33 d) 11 e) 23 15. En cierto átomo neutro se cumple que el número de neutrones es proporcional al número de electrones como 7 es a 6. Si posee 52 nucleones fundamentales, calcula el número de electrones.