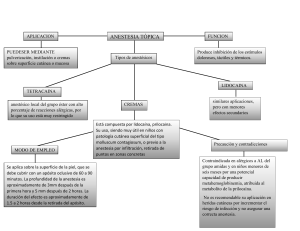
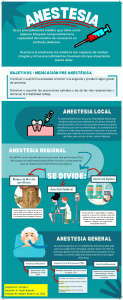
ANESTESIA S O T E R SEC C0400.indd i 2/15/11 11:12:12 AM C0400.indd ii 2/15/11 11:12:12 AM ANESTESIA S 0 T E R C SE Cuarta edición James Duke, MD, MBA Associate Professor of Anesthesiology, University of Colorado Health Sciences Center, Aurora, Colorado; Associate Director, Department of Anesthesiology, Denver Health Medical Center, Denver, Colorado KWWSERRNVPHGLFRVRUJ C0400.indd iii 2/15/11 11:12:12 AM Edición en español de la cuarta edición de la obra original en inglés Anesthesia Secrets Copyright © MMXI by Mosby Inc., an affiliate of Elsevier Inc. Traducción Dras. Bibiana Lienas Massot y M. Ángeles Martínez Òdena Revisión científica Dra. Carmen Gomar Sancho Catedrática de Anestesiología y Reanimación, Universidad de Barcelona; Consultor Senior, Hospital Clínic de Barcelona © 2011 Elsevier España, S.L. Travessera de Gràcia, 17-21 – 08021 Barcelona, España Fotocopiar es un delito (Art. 270 C.P.) Para que existan libros es necesario el trabajo de un importante colectivo (autores, traductores, dibujantes, correctores, impresores, editores...). El principal beneficiario de ese esfuerzo es el lector que aprovecha su contenido. Quien fotocopia un libro, en las circunstancias previstas por la ley, delinque y contribuye a la «no» existencia de nuevas ediciones. Además, a corto plazo, encarece el precio de las ya existentes. Este libro está legalmente protegido por los derechos de propiedad intelectual. Cualquier uso fuera de los límites establecidos por la legislación vigente, sin el consentimiento del editor, es ilegal. Esto se aplica en particular a la reproducción, fotocopia, traducción, grabación o cualquier otro sistema de recuperación de almacenaje de información. ISBN edición original: 978-0-323-06524-5 ISBN edición española: 978-84-8086-757-3 Producción editorial: Servicios editoriales A. Parras Advertencia La medicina es un área en constante evolución. Aunque deben seguirse unas precauciones de seguridad estándar, a medida que aumenten nuestros conocimientos gracias a la investigación básica y clínica habrá que introducir cambios en los tratamientos y en los fármacos. En consecuencia, se recomienda a los lectores que analicen los últimos datos aportados por los fabricantes sobre cada fármaco para comprobar la dosis recomendada, la vía y duración de la administración y las contraindicaciones. Es responsabilidad ineludible del médico determinar las dosis y el tratamiento más indicado para cada paciente, en función de su experiencia y del conocimiento de cada caso concreto. Ni los editores ni los directores asumen responsabilidad alguna por los daños que pudieran generarse a personas o propiedades como consecuencia del contenido de esta obra. El editor C0405.indd iv 2/15/11 11:17:11 AM DEDICATORIA Dedicado a Renee, mi esposa y fiel compañera, y a Desi, Audrey, Sailor y Famous. V C0415.indd V 2/15/11 11:25:09 AM C0415.indd VI 2/15/11 11:25:09 AM ÍNDICE DE CAPÍTULOS Los 100 secretos principales . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1 I. BASES DEL TRATAMIENTO DEL PACIENTE 1. Sistema nervioso autónomo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 9 James Duke, MD, MBA 2. Fisiología pulmonar y respiratoria . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 17 Matthew D. Coleman, MD 3. Gasometría y equilibrio ácido-base . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 24 Matthew D. Coleman, MD, y Steven T. Morozowich, DO, FASE 4. Líquidos, regulación de la volemia y alteraciones hidroelectrolíticas . . . . . . . 31 James Duke, MD, MBA 5. Electrolitos . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 38 James Duke, MD, MBA 6. Terapia transfusional . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 43 James Duke, MD, MBA 7. Coagulación . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 51 Jason P. Krutsch, MD 8. Manejo de las vías aéreas . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 58 James Duke, MD, MBA 9. Pruebas de función pulmonar . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 68 James Duke, MD, MBA II. FARMACOLOGÍA 10. Anestésicos inhalatorios . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 75 Michelle Dianne Herren, MD 11. Opioides . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 82 Christopher L. Ciarallo, MD 12. Anestésicos intravenosos y benzodiazepinas . . . . . . . . . . . . . . . . . . . . . . . . 90 Theresa C. Michel, MD 13. Relajantes musculares y monitorización de la actividad relajante . . . . . . . . . 95 James Duke, MD, MBA VII C0410.indd VII 2/15/11 11:21:16 AM VIII ÍNDICE DE CAPÍTULOS 14. Anestésicos locales . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 105 Sunil Kumar, MD, FFARCS 15. Fármacos inotrópicos y vasodilatadores . . . . . . . . . . . . . . . . . . . . . . . . . . . 112 Nathaen Weitzel, MD 16. Medicación preoperatoria . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 118 Sunil Kumar, MD, FFARCS III. PREPARACIÓN PARA LA ANESTESIA 17. Valoración preoperatoria . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 123 Mark H. Chandler, MD 18. El aparato de anestesia y los vaporizadores . . . . . . . . . . . . . . . . . . . . . . . . 130 James Duke, MD, MBA 19. Circuitos y ventiladores de anestesia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 137 James Duke, MD, MBA 20. Posición del paciente . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 142 James Duke, MD, MBA 21. Ventilación mecánica en el paciente crítico . . . . . . . . . . . . . . . . . . . . . . . . . 149 James B. Haenel, RRT, y Jeffrey L. Johnson, MD IV. MONITORIZACIÓN DEL PACIENTE Y PROCEDIMIENTOS 22. Electrocardiografía . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 157 William A. Baker, MD, y Christopher M. Lowery, MD 23. Pulsioximetría . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 168 Lyle E. Kirson, DDS, y Renee Koltes-Edwards, MD 24. Capnografía . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 175 James Duke, MD, MBA 25. Cateterismo y monitorización de la presión venosa central . . . . . . . . . . . . . 180 Lyle E. Kirson, DDS, y Jacob Friedman, MD 26. Cateterismo de la arteria pulmonar . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 188 James Duke, MD, MBA 27. Cateterismo y monitorización de la presión arterial . . . . . . . . . . . . . . . . . . . 194 James Duke, MD, MBA V. PROBLEMAS PERIOPERATORIOS 28. Trastornos de la presión arterial . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 201 James Duke, MD, MBA 29. Despertar intraoperatorio . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 207 Aaron Murray, MD 30. Arritmias cardíacas . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 210 William A. Baker, MD, y Christopher M. Lowery, MD C0410.indd VIII 2/15/11 11:21:16 AM ÍNDICE DE CAPÍTULOS IX 31. Alteraciones de la temperatura . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 217 James Duke, MD, MBA 32. Cuidados postanestésicos . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 222 Michael M. Sawyer, MD VI. ANESTESIA Y ENFERMEDAD SISTÉMICA 33. Cardiopatía isquémica . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 229 Tamas Seres, MD, PhD 34. Insuficiencia cardíaca . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 236 Tamas Seres, MD, PhD 35. Valvulopatías . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 244 Tamas Seres, MD, PhD 36. Patología aórtica oclusiva . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 254 Luke Osborne, MD 37. Patología vascular intracraneal y cerebral . . . . . . . . . . . . . . . . . . . . . . . . . . 259 Gurdev S. Rai, MD, y Luke Osborne, MD 38. Hiperreactividad bronquial . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 267 Malcolm Packer, MD 39. Broncoaspiración . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 274 Malcolm Packer, MD 40. Enfermedad pulmonar obstructiva crónica . . . . . . . . . . . . . . . . . . . . . . . . . 278 Howard J. Miller, MD 41. Síndrome de distrés respiratorio agudo . . . . . . . . . . . . . . . . . . . . . . . . . . . 285 James B. Haenel, RRT, y Jeffrey L. Johnson, MD 42. Hipertensión pulmonar . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 293 James Duke, MD, MBA 43. Disfunción hepática perioperatoria . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 300 Matthew J. Fiegel, MD 44. Función renal y anestesia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 308 James Duke, MD, MBA 45. Aumento de la presión intracraneal y traumatismo craneal . . . . . . . . . . . . . 317 Matthew Hall, MD 46. Hipertermia maligna y otras enfermedades motoras . . . . . . . . . . . . . . . . . . 324 James Duke, MD, MBA 47. Enfermedades neurológicas degenerativas y neuropatías . . . . . . . . . . . . . . 331 James Duke, MD, MBA 48. Abuso de alcohol y de sustancias . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 336 James Duke, MD, MBA C0410.indd IX 2/15/11 11:21:16 AM X ÍNDICE DE CAPÍTULOS 49. Diabetes mellitus . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 343 Robert H. Slover, MD, y Robin Slover, MD 50. Endocrinopatía no diabética . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 351 Joel E. Wilson, MD 51. Obesidad y apnea del sueño . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 358 Gillian E. Johnson, MBBChir, BSc 52. Reacciones alérgicas . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 364 James Duke, MD, MBA 53. Suplementos herbales . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 369 James Duke, MD, MBA VII. CONSIDERACIONES ANESTÉSICAS ESPECIALES 54. Traumatismos . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 373 James Duke, MD, MBA 55. El paciente quemado . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 380 Philip R. Levin, MD, y Alma N. Juels, MD 56. Anestesia neonatal . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 387 Rita Agarwal, MD, y Jennifer F. Brunworth, MD 57. Anestesia pediátrica . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 394 Rita Agarwal, MD, y Sola Olamikan, MD 58. Cardiopatía congénita . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 404 Robert H. Friesen, MD 59. Fundamentos de la anestesia obstétricas . . . . . . . . . . . . . . . . . . . . . . . . . . . 411 Ana M. Lobo, MD, MPH, Andrea J. Fuller, MD, y Marina Shindell, DO 60. Analgesia y anestesia obstétrica . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 419 Ana M. Lobo, MD, MPH, y Joy L. Hawkins, MD 61. Obstetricia de alto riesgo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 426 Brenda A. Bucklin, MD 62. Anestesia en geriatría . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 432 Gurdev S. Rai, MD 63. Sedación y anestesia fuera del quirófano . . . . . . . . . . . . . . . . . . . . . . . . . . 437 Mark H. Chandler, MD 64. Marcapasos y desfibriladores cardioversores implantables . . . . . . . . . . . . . 445 Christopher M. Lowery, MD VIII. ANESTESIA REGIONAL 65. Anestesia intradural o subaracnoidea . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 451 James Duke, MD, MBA 66. Analgesia y anestesia epidurales . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 458 Joy L. Hawkins, MD C0410.indd X 2/15/11 11:21:16 AM ÍNDICE DE CAPÍTULOS XI 67. Bloqueos nerviosos periféricos . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 466 Ronald Valdivieso, MD IX. CONSIDERACIONES ANESTÉSICAS EN PROCEDIMIENTOS QUIRÚRGICOS SELECCIONADOS 68. Trasplante de corazón . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 473 Tamas Seres, MD, PhD 69. Trasplante de hígado . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 480 Matthew J. Fiegel, MD 70. Circulación extracorpórea . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 487 Nathaen Weitzel, MD 71. Técnicas de aislamiento pulmonar . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 493 Mark D. Twite, MA, MB, BChir, FRCP 72. Potenciales evocados somatosensoriales y cirugía raquídea . . . . . . . . . . . . 500 Daniel J. Janik, MD [Colonel (Retired), USAF, MC] 73. Anestesia para la craneotomía . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 505 Daniel J. Janik, MD [Colonel (Retired), USAF, MC] 74. Cirugía mínimamente invasiva . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 511 Prairie Neeley Robinson, MD 75. Cirugía con láser y riesgo de ignición en el quirófano . . . . . . . . . . . . . . . . . 518 James Duke, MD, MBA 76. Terapia electroconvulsiva . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 522 Philip R. Levin, MD, y Alma N. Juels, MD X. TRATAMIENTO DEL DOLOR 77. Tratamiento del dolor agudo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 527 Robin Slover, MD, y Heather Rachel Davids, MD 78. Tratamiento del dolor crónico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 535 Ronald Valdivieso, MD Índice alfabético . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 541 C0410.indd XI 2/15/11 11:21:16 AM C0410.indd XII 2/15/11 11:21:16 AM COLABORADORES Rita Agarwal, MD Associate Professor of Anesthesiology, The Children’s Hospital, University of Colorado Health Sciences Center; Pediatric Anesthesia Program Director, The Children’s Hospital, Aurora, Colorado William A. Baker, MD Associate Professor of Medicine, University of Colorado School of Medicine; Director, Coronary Care Unit and Cardiology Clinic, Denver Health Medical Center, Denver, Colorado Jennifer F. Brunworth, MD Pediatric Anesthesiology Fellow, University of Colorado Denver, Denver; Pediatric Anesthesiology Fellow, The Children’s Hospital, Aurora, Colorado Brenda A. Bucklin, MD Professor of Anesthesiology, Department of Anesthesiology, University of Colorado Denver, Aurora, Colorado Mark H. Chandler, MD Assistant Professor of Anesthesiology, University of Colorado Health Sciences Center; Anesthesiologist, Department of Anesthesiology, Denver Health Medical Center, Denver, Colorado Christopher L. Ciarallo, MD Assistant Professor of Anesthesiology, University of Colorado Denver, Denver, Anesthesiologist, Denver Health Medical Center, Denver; Pediatric Anesthesiologist, The Children’s Hospital, Aurora, Colorado Matthew D. Coleman, MD Anesthesiology Critical Care Fellow, Department of Anesthesiology and Critical Care, Columbia University; Anesthesiology Critical Care Fellow, Department of Anesthesiology and Critical Care, New York-Presbyterian Hospital, New York Heather Rachel Davids, MD Pain Fellow, Interventional Pain Medicine, Department of Anesthesiology, University of Colorado, Aurora, Colorado James Duke, MD, MBA Associate Professor of Anesthesiology, University of Colorado Health Sciences Center, Aurora, Colorado; Associate Director, Department of Anesthesiology, Denver Health Medical Center, Denver, Colorado Matthew J. Fiegel, MD Assistant Professor, Department of Anesthesiology, University of Colorado Denver; Assistant Professor, Department of Anesthesiology, University of Colorado Denver Hospital, Aurora, Colorado Jacob Friedman, MD Assistant Professor, Department of Anesthesiology, University of Colorado Denver Health Sciences Center; Staff Anesthesiologist, Department of Anesthesiology, Denver Veteran’s Affairs Hospital, Denver, Colorado Robert H. Friesen, MD Professor of Anesthesiology, University of Colorado Denver; Vice-Chair, Anesthesiology, The Children’s Hospital, Aurora, Colorado XIII C0420.indd XIII 2/15/11 11:29:34 AM XIV COLABORADORES Andrea J. Fuller, MD Assistant Professor of Anesthesiology, University of Colorado Health Sciences Center, Aurora, Colorado James B. Haenel, RRT Surgical Critical Care Specialist, Department of Surgery, Denver Health Medical Center, Denver, Colorado Matthew Hall, MD Anesthesiologist, University of Colorado Health Sciences Center, Aurora, Colorado Joy L. Hawkins, MD Professor of Anesthesiology and Associate Chair for Academic Affairs, University of Colorado Denver School of Medicine; Director, Obstetric Anesthesia, University of Colorado Hospital, Aurora, Colorado Michelle Dianne Herren, MD Pediatric Anesthesiologist, Department of Anesthesiology, University of Colorado Hospital; Pediatric Anesthesiologist, Department of Anesthesiology, Denver Health Medical Center, Denver; Pediatric Anesthesiologist, Department of Anesthesiology, The Children’s Hospital Denver, Aurora, Colorado Daniel J. Janik, MD [Colonel (Retired), USAF, MC] Associate Professor and Co-Director, Intraoperative Neuromonitoring, Department of Anesthesiology, University of Colorado Denver School of Medicine; Attending Anesthesiologist, Department of Anesthesiology, University of Colorado Hospital, Aurora, Colorado Gillian E. Johnson, MBBChir, BSc Anesthesiology Resident, University of Colorado Health Sciences Center, Aurora, Colorado Jeffrey L. Johnson, MD Assistant Professor of Surgery, University of Colorado Health Sciences Center, Aurora; Director, Surgical Intensive Care, Denver Health Medical Center, Denver, Colorado Alma N. Juels, MD Assistant Professor of Anesthesiology, University of Colorado Denver, Aurora; Attending Physician, Department of Anesthesiology, Denver Health Medical Center, Denver, Colorado Lyle E. Kirson, DDS Associate Professor of Anesthesiology, University of Colorado Health Sciences Center, Aurora; Veterans Affairs Medical Center, Denver, Colorado Renee Koltes-Edwards, MD Clinical Instructor of Anesthesiology, University of North Dakota School of Medicine and Health Science; Staff Anesthesiologist, Altru Health System, Grand Forks, North Dakota Jason P. Krutsch, MD Director, Interventional Pain Management, and Assistant Professor of Anesthesiology, University of Colorado Health Sciences Center, Aurora, Colorado Sunil Kumar, MD, FFARCS Assistant Professor, Department of Anesthesiology, University of Colorado Health Sciences Center, Aurora; Anesthesiologist, Department of Anesthesiology, Denver Health Medical Center, Denver, Colorado Philip R. Levin, MD Associate Clinical Professor, Department of Anesthesiology, David Geffen School of Medicine at UCLA, Los Angeles; Medical Director of Perioperative Services, Chief of Anesthesiology, Department of Anesthesiology, Santa Monica/UCLA Medical Center and Orthopaedic Hospital, Santa Monica; Associate Clinical Professor, Department of Anesthesiology, Ronald Reagan/UCLA Medical Center, Los Angeles, California Ana M. Lobo, MD, MPH Assistant Professor of Anesthesiology, Obstetric Anesthesia, Yale University School of Medicine, Yale New Haven Hospital, New Haven, Connecticut C0420.indd XIV 2/15/11 11:29:34 AM COLABORADORES XV Christopher M. Lowery, MD Assistant Professor of Medicine, Department of Cardiology, University of Colorado Denver, Aurora; Director of Cardiac Electrophysiology, Department of Cardiology, Denver Health Medical Center, Denver; Staff Electrophysiologist, Department of Cardiology, University of Colorado Hospital, Aurora, Colorado Theresa C. Michel, MD Senior Lecturer, Department of Anesthesiology, University of Colorado; Attending Anesthesiologist, Denver Health and Hospital Authority, Denver, Colorado Howard J. Miller, MD Associate Professor of Anesthesiology, Denver Health Medical Center, Denver; Associate Professor of Anesthesiology, University of Colorado Denver School of Medicine, Aurora, Colorado Steven T. Morozowich, DO, FASE Instructor of Anesthesiology, Mayo Clinic College of Medicine, Mayo Clinic Arizona, Phoenix; Staff Anesthesiologist, Mercy Regional Medical Center, Durango, Colorado Aaron Murray, MD Anesthesiology Resident, University of Colorado Health Sciences Center, Aurora, Colorado Sola Olamikan, MD Pediatric Anesthesiology, University of Colorado, Denver; Anesthesiologist, The Children’s Hospital, Aurora, Colorado Luke Osborne, MD Assistant Professor of Anesthesiology, University of Colorado Health Sciences Center, Aurora; Assistant Professor of Anesthesiology, Veteran’s Affairs Medical Center, Denver, Colorado Malcolm Packer, MD Associate Professor of Anesthesiology, Department of Anesthesiology, University of Colorado Denver; Attending Anesthesiologist, Department of Anesthesiology, Denver Health and Hospitals Authority, Denver; Attending Anesthesiologist, Department of Anesthesiology, The Children’s Hospital, Denver, Colorado Gurdev S. Rai, MD Assistant Professor of Anesthesiology, University of Colorado Denver; Anesthesiologist, Anesthesiology Service, Eastern Colorado Health Care System, Veterans Affairs Medical Center, Denver, Colorado Prairie Neeley Robinson, MD Anesthesiology Resident, University of Colorado Health Sciences Center, Denver, Aurora, Colorado Michael M. Sawyer, MD Assistant Professor of Anesthesiology, Department of Anesthesiology, University of Colorado Denver Health Hospital Association, Denver, Colorado Tamas Seres, MD, PhD Associate Professor of Anesthesiology, University of Colorado Denver, Aurora, Colorado Marina Shindell, DO Assistant Professor of Anesthesiology, University of Colorado, Aurora, Colorado Robert H. Slover, MD Associate Professor of Pediatrics, University of Colorado Denver, Aurora; Director of Pediatric Services, The Barbara Davis Center for Childhood Diabetes, Aurora; Pediatric Endocrinologist, Department of Endocrinology, The Children’s Hospital, Aurora, Colorado Robin Slover, MD Associate Professor of Anesthesiology, University of Colorado; Interim Director of Chronic Pain Service, The Children’s Hospital; Chronic Pain Physician, Anschutz Outpatient Clinic, University of Colorado, Aurora, Colorado C0420.indd XV 2/15/11 11:29:34 AM XVI COLABORADORES Mark D. Twite, MA, MB, BChir, FRCP Director of Pediatric Cardiac Anesthesia, Department of Anesthesiology, The Children’s Hospital and University of Colorado, Denver, Colorado Ronald Valdivieso, MD Assistant Professor of Anesthesiology, University of Colorado, Aurora Assistant Professor of Anesthesiology, Denver Health Medical Center, Denver, Colorado Nathaen Weitzel, MD Assistant Professor of Anesthesiology, University of Colorado Health Sciences Center; Faculty Anesthesiologist, University of Colorado, Denver, Colorado Joel E. Wilson, MD Anesthesiology Resident, University of Colorado Health Sciences Center, Aurora, Colorado C0420.indd XVI 2/15/11 11:29:34 AM PREFACIO En esta cuarta edición de Anestesia Secretos, el objetivo sigue siendo la presentación concisa de una amplia variedad de temas importantes para todo aquel que esté interesado en anestesiología. Mi objetivo siempre ha sido ir más allá de proporcionar un texto resumido que familiarice en los temas y dar la profundidad adecuada con el fin de que el lector pueda integrar los aspectos concretos de este campo en el conocimiento más amplio de la medicina en general. Me siento honrado por la aceptación que ha recibido Anestesia Secretos, desde que se publicó la primera edición en 1996. Lo considero una reafirmación de que los colaboradores y yo tenemos una idea apropiada de los conceptos importantes en este campo con la extensión con que pueden describirse en un libro de este tamaño. Agradezco a los colaboradores su contribución en esta edición y en todas las anteriores. En el transcurso de los años han desarrollado una carrera brillante a lo largo y ancho del país, y han dejado una huella permanente. Aunque algunos de ellos ya no aparecen como autores, siguen teniendo todo mi agradecimiento. Y a usted, lector, le agradezco que Anestesia Secretos, forme parte de su formación educativa. James Duke MD, MBA XVII C0425.indd XVII 2/15/11 11:32:34 AM C0425.indd XVIII 2/15/11 11:32:34 AM Estos secretos son 100 de las máximas alertas. Resumen los conceptos, principios y detalles más importantes de la anestesiología. Los 100 Secretos Principales 1. Los pacientes deberían tomar los betabloqueantes recetados el día de la cirugía y continuarlos perioperatoriamente. Puesto que los receptores están sobrerregulados, la abstinencia puede precipitar hipertensión, taquicardia e isquemia miocárdica. La clonidina también debería continuarse perioperatoriamente debido a un posible efecto rebote. 2. En la mayoría de circunstancias, la hipotensión que se asocia con la inducción responde mejor a la administración intravenosa de líquidos y al empleo de simpaticomiméticos de acción directa, como la fenilefrina. 3. Para identificar la etiología de la hipoxemia, calcular el gradiente A-a para acotar el diagnóstico diferencial. 4. Calcular el anión gap (Na+ – [HCO−3 + Cl−]) cuando existe una acidosis metabólica ayuda a aco­ tar el diagnóstico diferencial. 5. Para valorar el estado de la volemia se debe obtener la máxima información clínica posible, porque cualquier variable o dato considerado de forma aislada puede confundir. Siempre se debe buscar información adicional. 6. La corrección rápida de los desequilibrios electrolíticos puede ser tan peligrosa como el propio desequilibrio electrolítico. 7. Cuando se han descartado otras causas, la hipotensión persistente y refractaria en pacientes traumatizados o críticamente enfermos puede deberse a hipocalcemia o hipomagnesemia. 8. No existe un nivel de hemoglobina/hematocrito definido para la transfusión. La decisión debería ser individualizada según la situación clínica, y teniendo en cuenta el estado de salud del paciente. 9. En la consulta, un paciente con diátesis hemorrágica puede ser identificado normalmente mediante la historia (incluyendo medicación) y la exploración física. Las pruebas de coagulación preoperatorias en pacientes asintomáticos tienen poco valor. 10. La exploración de la vía aérea y la identificación del paciente con vía aérea potencialmente difícil son de máxima importancia. La situación de «dificultad para ventilar, dificultad para intubar» debería evitarse en la medida de lo posible. Se necesita un abordaje organizado como se refleja en el Algoritmo de Vía Aérea Difícil de la American Society of Anesthesiologists, y facilita el cuidado de alta calidad de los pacientes con dificultades de manejo de la vía aérea. 11. Ningún resultado de las pruebas de función pulmonar contraindica totalmente la cirugía por sí solo. Factores como la exploración física, la gasometría arterial, y problemas médicos coexistentes deberían considerarse para determinar la indicación de cirugía. 12. La velocidad de comienzo de acción de los anestésicos halogenados se incrementa aumentando la concentración liberada de anestésico, aumentando el flujo de aire fresco, aumentando la ventilación alveolar y usando anestésicos no liposolubles. © 2011. Elsevier España, S.L. Reservados todos los derechos 1 2 Los 100 Secretos Principales 13. Los opioides deprimen el estímulo del CO2 para respirar, provocando hipoventilación. Debido a los metabolitos activos, los pacientes con insuficiencia renal pueden experimentar una respuesta exagerada a la morfina. 14. La dosis adecuada de anestésicos intravenosos requiere una valoración del estado del volumen intravascular, comorbilidades, edad y fármacos asociados. 15. La finalización del efecto de los anestésicos intravenosos es por redistribución, no por biotransformación y descomposición. 16. A pesar de que la succinilcolina es el relajante habitual utilizado para una inducción de secuencia rápida, los agentes quelantes de la molécula relajante no despolarizante pueden alterar este paradigma en el futuro. 17. Se debe dejar intubados y con respiración de apoyo (support) a los pacientes clínicamente débiles hasta que muestren recuperación de su fuerza muscular. 18. La solubilidad lipídica, pKa, y la unión a proteínas de los anestésicos locales determinan su potencia, comienzo y duración de la acción, respectivamente. 19. La toxicidad del sistema nervioso central inducida por anestésicos locales se manifiesta mediante excitación, seguida de convulsiones y posterior pérdida de conciencia. La hipotensión, el bloqueo de conducción cardíaca y la parada cardíaca son signos de toxicidad cardiovascular del anestésico local. 20. Actualmente existe evidencia científica de que la dopamina en dosis bajas es ineficaz para la prevención y tratamiento de la insuficiencia renal aguda y para la protección del intestino. 21. Una visita preoperatoria por un anestesiólogo tranquilizador y que informe proporciona una preparación psicológica útil, y calma los miedos y la ansiedad del paciente previos a la administración de la anestesia. 22. El riesgo de neumonitis por aspiración clínicamente significativa en pacientes sanos que se someten a una cirugía programada es muy bajo. El empleo rutinario de agentes farmacológicos para alterar el volumen o el pH del contenido gástrico es innecesario. 23. La información más importante obtenida en una valoración preanestésica proviene de una anamnesis orientada y precisa, y de la exploración física. 24. Cuando están comprimidos, algunos gases se condensan en líquido (N2O y CO2) y otros no (O2 y N2). Estas propiedades definen la relación entre el volumen y la presión de la bombona. 25. El circuito semicerrado que emplea un sistema circular es el más habitualmente utilizado en anestesia. Sus componentes incluyen rama inspiratoria, rama espiratoria, válvulas unidireccionales, absorbente de CO2, bolsa reservorio de gas y una válvula de salida o sobrepresión en la rama espiratoria. 26. Todo paciente ventilado con ventilador anestésico de concertinas ascendentes recibe, aproximadamente, 2,5-3 cmH2O de presión positiva al final de la espiración (PEEP) debido al peso de las concertinas. 27. La cantidad de vapor liberado por los vaporizadores tradicionales depende de la proporción de gas fresco que evita la cámara vaporizadora respecto a la proporción que pasa por la cámara vaporizadora. 28. Hay que prestar mucha atención a la posición para facilitar el procedimiento quirúrgico, prevenir compromisos fisiológicos, y prevenir neuropatías y lesiones en otras zonas de la anatomía del paciente. Los 100 Secretos Principales 3 29. El primer paso en el cuidado del paciente hipóxico que lucha con el ventilador es ventilar al paciente manualmente con oxígeno al 100%. 30. Los factores de riesgo para la autoPEEP incluyen ventilación minuto alta, tubo endotraqueal pequeño, enfermedad pulmonar obstructiva crónica y asma. 31. Para determinar si una señal anómala en el electrocardiograma (ECG) puede ser un artefacto, buscar si el ritmo cardíaco nativo está sobreimpuesto al trazado anómalo. 32. Un paciente con una depresión del segmento ST de nueva aparición o una inversión de la onda T puede estar sufriendo un infarto de miocardio sin elevación del ST. 33. La pulsioximetría mide la oxigenación arterial empleando diferentes longitudes de onda de luz a través de una red vascular pulsátil. La pulsioximetría puede detectar la hipoxemia más precozmente, proporcionando una señal de alarma temprana de posible lesión de órganos. 34. Por debajo de una saturación de hemoglobina del 90%, cualquier disminución pequeña de la saturación corresponde a una disminución importante de la PaO2. 35. A excepción de la visualización mediante broncoscopia, la detección de CO2 es el mejor método para verificar la localización de un tubo endotraqueal. 36. El análisis de la onda capnográfica proporciona datos para el diagnóstico de numerosas situaciones clínicas tales como la disminución del gasto cardíaco, la actividad metabólica alterada y la enfermedad pulmonar crónica y aguda, además del mal funcionamiento del ventilador, circuito y tubo endotraqueal. 37. Las tendencias de las presiones venosas centrales tienen más valor que los valores aislados, y siempre deberían ser evaluadas en el contexto del paciente. 38. La cateterización de la arteria pulmonar (AP) no ha demostrado mejorar los resultados en todos los subgrupos de pacientes en los que se ha empleado. 39. Los riesgos de la cateterización venosa central y de la AP son muchos y graves, y los beneficios deberían identificarse previamente al inicio de tales procedimientos para justificar su empleo. 40. Para mejorar la precisión en la interpretación de los datos del catéter de la AP, las ondas siempre se deben observar en relación al ciclo del ECG. © Elsevier. Fotocopiar sin autorización es un delito 41. La cateterización de la arteria cubital ipsolateral no debería intentarse tras múltiples intentos fallidos de cateterización arterial radial. 42. A excepción de los antagonistas del sistema renina-angiotensina, y posiblemente diuréticos, la terapia antihipertensiva debería continuarse hasta el día de la cirugía, en el que hay que administrar también el tratamiento. 43. Los síntomas de recuperación intraoperatoria de la conciencia pueden ser muy inespecíficos, particularmente cuando se emplean relajantes musculares. 44. Cuando un paciente con enfermedad cardíaca estructural desarrolla una taquicardia de complejo ancho, se debe asumir que el ritmo es taquicardia ventricular, hasta que se demuestre lo contrario. Cuando un paciente desarrolla taquicardia y se convierte en hemodinámicamente inestable, hay que prepararse para la cardioversión (a menos que el ritmo sea claramente sinusal). 45. Cuando un paciente desarrolla enlentecimiento transitorio del nodo sinoauricular además de bloqueo atrioventricular transitorio, se debe sospechar un tono vagal aumentado, un efecto farmacológico o ambos. 4 Los 100 Secretos Principales 46. La hipotermia, aunque sea leve, tiene una influencia negativa en la evolución del paciente: aumenta la incidencia de infección de la herida, retrasa la cicatrización, aumenta la pérdida de sangre y triplica la morbilidad cardíaca. 47. Si la capacidad de ejercicio de un paciente es excelente, incluso en una enfermedad isquémica cardíaca, las posibilidades de que el paciente sea capaz de tolerar el estrés de la cirugía son muy altas. La capacidad de subir dos o tres tramos de escaleras sin síntomas importantes (p. ej., angina, disnea, síncope) indica generalmente una reserva cardíaca adecuada. 48. Los pacientes con reserva miocárdica disminuida son más sensibles a los efectos de la depresión cardiovascular causada por los agentes anestésicos, pero con una administración cuidadosa y con monitorización estrecha de las respuestas hemodinámicas la mayoría de los agentes son seguros. 49. Para procedimientos electivos, las guías de ayuno más recientes son las siguientes: Líquidos claros (agua, zumos claros) 2 horas Líquidos no claros (gelatinosos, leche materna) 4 horas Comidas ligeras o tentempiés (galletas, tostadas, líquidos) 6 horas Comidas completas (con grasa, carne) 8 horas 50. «No todo lo que tiene sibilancias es asma». Tener en cuenta también la obstrucción mecánica de la vía aérea, insuficiencia cardíaca congestiva, reacción alérgica, embolia pulmonar, neumotórax, broncoaspiración e intubación endobronquial. 51. Los pacientes con importante enfermedad reactiva de la vía aérea requieren una preparación intensa preoperatoria, incluyendo tratamiento betaagonista inhalado y, posiblemente, corticosteroides, metilxantinas u otros agentes. 52. Los criterios necesarios para una lesión pulmonar aguda/síndrome de distrés respiratorio del adulto (LPA/SDRA) son: (1) Comienzo agudo. (2) Cociente PaO2/FiO2 de 300 para la LPA. (3) Cociente PaO2/FiO2 de 200 para el SDRA. (4) Radiografía torácica con infiltrados difusos. (5) Presión de enclavamiento en el capilar pulmonar de <18 mmHg. 53. El patrón de la ventilación mecánica para pacientes con SDRA o LPA es un volumen corriente de 6-8 ml/kg del peso corporal ideal, limitando las presiones meseta a <30 cmH2O. La PEEP debería ajustarse para prevenir el colapso al final de la espiración. La FiO2 debería ajustarse para mantener las saturaciones de oxígeno entre el 88 y el 92%. 54. Los aumentos agudos intraoperatorios de la presión AP pueden responder a la optimización de la oxigenación y la ventilación, corrigiendo el estado ácido-base, estableciendo la normotermia, disminuyendo la respuesta autonómica al estrés mediante profundización de la anestesia y administrando terapia vasodilatadora. 55. La mejor forma de mantener la función renal durante la cirugía es asegurar un volumen intravascular adecuado, mantener el gasto cardíaco y evitar fármacos que disminuyan la perfusión renal. 56. Las medidas para lograr una disminución aguda de la presión intracraneal (PIC) son la elevación de la cabeza en la cama, hiperventilación (PaCO2 25-30 mmHg), diuresis (manitol y/o furosemida), y minimizar la administración de líquido intravenoso. Ante una PIC elevada, evitar la ketamina y el óxido nitroso. Los 100 Secretos Principales 5 57. La vía aérea es la primera medida en todo algoritmo de actuación; así, la succinilcolina es el agente de elección para una inducción de secuencia rápida para el paciente con estómago lleno, traumatismo craneal, a pesar del aumento transitorio en la PIC que se observa con la succinilcolina. La succinilcolina debe evitarse en niños con distrofia muscular, y debería evitarse en hombres jóvenes, excepto en emergencias de la vía aérea. 58. La hipertermia maligna (HM) es un trastorno hereditario que se presenta en el período perioperatorio tras la exposición a anestésicos inhalatorios y/o succinilcolina. La enfermedad puede ser mortal si se retrasa el diagnóstico y no se administra dantroleno. El síntoma clave para el diagnóstico de la HM es un aumento inexplicado del CO2 teleespiratorio con un aumento simultáneo en la ventilación minuto, acompañado de una taquicardia inexplicada. 59. Los pacientes con enfermedad de Alzheimer pueden estar más confusos y desorientados con sedación preoperatoria. 60. En pacientes con esclerosis múltiple, la anestesia neuroaxial debería emplearse con precaución, y sólo en situaciones en las que los beneficios de la anestesia neuroaxial respecto a la anestesia general sean claros. 61. Los pacientes diabéticos tienen una alta incidencia de arteriopatía coronaria, con una presentación atípica o silente. Consideraciones claves son el mantenimiento de la presión de perfusión, el control de la frecuencia cardíaca, la monitorización mediante ECG continuo, y un alto grado de nivel de sospecha cuando aparezcan episodios de hipotensión refrac­ taria. 62. La incapacidad para hacer contactar la cara palmar de los dedos índices cuando las palmas se tocan (signo de la plegaria) puede indicar una intubación oral difícil en pacientes diabéticos. 63. La tormenta tiroidea puede simular una HM. Se confirma mediante una tetrayodotironina (T4) sérica aumentada, y se trata inicialmente con bloqueo beta seguido de terapia antitiroidea. 64. La administración de glucocorticoides perioperatorios debe considerarse en pacientes que reciben corticosteroides exógenos. 65. Los pacientes obesos pueden ser difíciles de ventilar y de intubar. Deben prepararse estrategias alternativas que estén disponibles antes de que comience el manejo de la vía aérea. © Elsevier. Fotocopiar sin autorización es un delito 66. Un paciente con una escala de coma de Glasgow (GCS) de 8 está lo suficientemente deprimido como para indicar la intubación endotraqueal. 67. El objetivo inicial de la reanimación de un quemado es corregir la hipovolemia. Las quemaduras provocan un aumento generalizado de la permeabilidad capilar, con pérdida importante de líquido y proteína en el tejido intersticial. 68. Desde las 24 horas, aproximadamente, después de la lesión hasta que la quemadura cicatriza, la succinilcolina puede causar hiperpotasemia debido a la proliferación de receptores neuromusculares fuera de la unión. Los pacientes quemados tienden a ser resistentes a los efectos de los relajantes musculares no despolarizantes, y pueden necesitar de dos a cinco veces la dosis normal. 69. La desaturación brusca de oxígeno mientras se transporta a un paciente pediátrico intubado se debe, probablemente, a la intubación de un bronquio principal. 70. Ya que los niños tienen ventrículos rígidos y dependen de la frecuencia cardíaca para el gasto cardíaco, se debe mantener la frecuencia cardíaca a toda costa, evitando la hipoxemia y administrando agentes anticolinérgicos cuando sea adecuado. 6 Los 100 Secretos Principales 71. Los niños pueden ser difíciles de intubar porque tienen la laringe más anterior, la lengua relativamente gorda y una epiglotis más móvil. La parte más estrecha de la laringe está debajo de las cuerdas vocales, en el cartílago cricoide. 72. La hiperventilación con oxígeno al 100% es el mejor primer paso para tratar un episodio de hipertensión pulmonar. 73. Si un niño con tetralogía de Fallot tiene una crisis hipercianótica durante la inducción de la anestesia, la compresión externa suave de la aorta abdominal puede revertir el cortocircuito derecha-izquierda mientras se preparan los tratamientos farmacológicos. 74. El paciente con lesión cardíaca obstructiva ventricular tiene un alto riesgo de insuficiencia cardíaca perioperatoria o parada cardíaca debido a hipertrofia ventricular, isquemia y pérdida del tejido contráctil. 75. Las pacientes embarazadas pueden suponer un problema en el manejo de la vía aérea, debido a edema de la vía aérea, mamas de mayor tamaño que pueden hacer la laringoscopia dificultosa, estómagos llenos que las hacen propensas a la broncoaspiración, y desaturación de oxígeno rápida debido a una disminución de la capacidad residual funcional. 76. En la preeclampsia, la hipertensión debería tratarse pero sin intentar «normalizar» la presión arterial. La anestesia subaracnoidea puede ser de elección frente a la anestesia general cuando la paciente preeclámptica no tiene un catéter epidural colocado previamente o no existe tiempo suficiente porque hay una frecuencia cardíaca fetal alarmante. 77. La reanimación fetal intrauterina y el manejo de la vía aérea materna son de extrema importancia en pacientes con convulsiones eclámpticas. 78. La función basal de la mayoría de sistemas y órganos permanece relativamente sin cambios causados por el proceso de envejecimiento en sí mismo, pero la reserva funcional y la capacidad de compensación ante el estrés fisiológico se ven reducidas. 79. En general, las necesidades de anestésicos están disminuidas en los pacientes geriátricos. Existe mayor riesgo de una gran variedad de complicaciones postoperatorias en el anciano, y la disfunción cognitiva postoperatoria no es necesariamente la más frecuente. 80. A los anestesiólogos se les pide cada vez más administrar anestesia en localizaciones no tradicionales. Independientemente de dónde se administra la anestesia, deben aplicarse los mismos estándares para la seguridad en lo que se refiere a monitores, equipamiento y personal. 81. El grupo sanguíneo O negativo es el donante universal para hematíes; en el caso del plasma es el AB positivo. 82. Si un paciente es dependiente de marcapasos, la interferencia del bisturí eléctrico puede interpretarse por el generador como una actividad cardíaca intrínseca, conduciendo a una inhibición profunda del ritmo y posible asistolia. Los marcapasos deberían ser programados al modo asincrónico previamente a la cirugía. 83. La taquicardia mediada por el marcapasos es una taquicardia de reentrada causada por activación auricular retrógrada por encima del sistema de conducción, que se propaga sólo por la aurícula y aparece un ritmo cardíaco ventricular. Puede terminarse mediante la aplicación de un imán que prevenga la descarga estimulada. 84. La pérdida de las aferencias sensitivas y de estimulación motora hace a un paciente sensible a la medicación sedante por esa desaferenciación. Por este mismo motivo, la anestesia neuraxial disminuye la concentración alveolar mínima de los anestésicos inhalatorios. Los 100 Secretos Principales 7 85. Cuando el paciente está bajo los efectos de la simpatectomía que produce una anestesia regional y presenta una parada cardíaca, precisa una reanimación más agresiva, probablemente con dosis muy altas de vasopresores para restablecer la perfusión miocárdica. 86. Aunque los pacientes con enfermedad hepática en últimos estadios tienen una circulación hiperdinámica caracterizada por un índice cardíaco aumentado y disminución de las resistencias vasculares sistémicas, es frecuente que también presenten una función miocárdica disminuida, arteriopatía coronaria e hipertensión pulmonar. 87. Los pacientes con enfermedad hepática habitualmente tienen un volumen de distribución aumentado, y necesitan dosis iniciales de fármacos más altas. Sin embargo, debido a que puede existir un metabolismo reducido de los fármacos, se administran dosis más pequeñas en intervalos más prolongados. 88. No existe una técnica anestésica «ideal» durante la circulación extracorpórea. Los pacientes con fracción de eyección disminuida no tolerarán las infusiones de propofol o la anestesia inhalatoria tan bien como los pacientes con volumen sistólico conservado, y requerirán probablemente una técnica basada en opioides. 89. Comprobar siempre de nuevo la localización óptima de cualquier dispositivo o tubo de aislamiento pulmonar tras recolocar al paciente. Se sospecha un tubo mal colocado ante aumentos bruscos de las presiones ventilatorias y disminuciones bruscas en la saturación de oxígeno. 90. Los métodos para mejorar la oxigenación durante la ventilación de un solo pulmón son el aumento de la FiO2, añadir PEEP al pulmón dependiente, añadir presión continua positiva de la vía aérea al pulmón no dependiente, ajustar los volúmenes corrientes y pinzar el flujo de sangre al pulmón no ventilado. 91. Para disminuir las presiones de la vía aérea, siempre se debe usar el tubo endotraqueal de doble luz más grande posible. 92. Si la PIC es alta, como se evidencia con profundos cambios en el estado mental o evidencia radiológica de edema cerebral, evitar los anestésicos inhalatorios y optar por una técnica anestésica intravenosa total. © Elsevier. Fotocopiar sin autorización es un delito 93. Si la PaCO2 aumenta significativamente a los 30 minutos de un neumoperitoneo buscar otra causa de hipercapnia que no sea aquél, como capnotórax, PaCO2 subcutánea, embolismo por CO2 o intubación endobronquial. 94. La presión de oclusión de la AP no es un indicador fiable de las presiones de llenado cardíaco durante el neumoperitoneo. 95. Las náuseas y los vómitos postoperatorios son habituales tras la cirugía laparoscópica; deberían preverse y tratarse profilácticamente. 96. El metohexital debería considerarse el fármaco de elección para la inducción de anestesia para la terapia electroconvulsiva (TEC). La TEC provoca una actividad simpática pronunciada, que puede ocasionar isquemia miocárdica, o incluso infarto, en pacientes con arteriopatía coronaria. 97. Para realizar una TEC de una manera segura, es necesario completar una anamnesis preoperatoria y una exploración física, emplear la monitorización estándar, disponer de equipamiento y medicación adecuada para una reanimación cardiopulmonar, utilizar un agente de inducción (p. ej., metohexital) y un relajante muscular (p. ej., succinilcolina), y tener un betabloqueador disponible (p. ej., esmolol). 8 Los 100 Secretos Principales 98. Las dosis de morfina difieren en un factor de 10 entre las vías intravenosa, epidural e intratecal. 99. El dolor crónico se trata mejor empleando modalidades terapéuticas múltiples, como la terapia física, el apoyo psicológico, el manejo farmacológico, y el uso racional de procedimientos más invasivos, como el bloqueo nervioso y tecnologías implantables. 100. El dolor neuropático responde generalmente menos a los opioides que el dolor nociceptivo. Sistema nervioso autónomo James Duke, MD, MBA Capítulo 1 I. BASES DEL TRATAMIENTO DEL PACIENTE 1. Describa el sistema nervioso autónomo. El sistema nervioso autónomo (SNA) es una red de nervios y ganglios que controla las acciones fisiológicas involuntarias y mantiene la homeostasis interna y las respuestas ante el estrés. El SNA inerva estructuras cardiovasculares, pulmonares, endocrinas, exocrinas, gastrointestinales, genitourinarias y del sistema nervioso central (SNC), e influye en el metabolismo y la regulación térmica. El SNA se divide en dos partes: el sistema nervioso simpático (SNS) y el sistema nervioso parasimpático (SNP). Cuando es estimulado, los efectos del SNS se extienden a todo el organismo. Por el contrario, la estimulación del SNP tiende a producir efectos discretos y localizados. El SNS y el SNP generalmente tienen efectos opuestos en órganos finales, presentando el SNS o el SNP un tono dominante en reposo y sin sucesos exógenos estimulantes (Tabla 1-1). En general, la función del SNP es homeostática, mientras que la estimulación del SNS prepara al organismo para algún acontecimiento estresante (esto con frecuencia se denomina respuesta de lucha o huida). TA B LA 1 - 1 . Pat r o n e s d e d o m i n a n c i a a u t ó n o m a e n l a s z o n a s e f e c t o r a s Sistema nervioso simpático Sistema nervioso parasimpático Arteriolas Venas Glándulas sudoríparas Nódulo sinoauricular Tracto gastrointestinal Útero Vejiga urinaria Glándulas salivales Iris Músculo ciliar P U N TOS CLAVE: Si stema ner vioso autónom o 1. Los pacientes deberían recibir los bloqueantes β que toman habitualmente el día de la cirugía y continuarlos perioperatoriamente. Puesto que los receptores están sobrerregulados, la absti­ nencia puede precipitar hipertensión, taquicardia e isquemia miocárdica. 2. La clonidina también debería continuarse perioperatoriamente debido a los riesgos de un posible efecto rebote. 3. Los simpaticomiméticos de acción indirecta (p. ej., efedrina) dependen de la liberación de no­ radrenalina para ser eficaces. Los estados de depleción de noradrenalina no responderán a la administración de efedrina. © 2011. Elsevier España, S.L. Reservados todos los derechos 9 10 Capítulo 1 Sistema nervioso autónomo 4. En la mayor parte de los casos, la hipotensión durante la inducción responde mejor a la administración de líquidos intravenosos y a la administración de simpaticomiméticos de acción directa como la fenilefrina. 5. La hipotensión ortostática es habitual tras la cirugía y puede estar causada por el uso de cualquier agente anestésico y el mantenimiento de la posición de decúbito supino durante períodos largos. Es necesario conocer este problema potencial cuando se eleva la cabeza de un paciente después de una cirugía o cuando se traslada al paciente de la mesa de operaciones a una silla (p. ej., intervenciones que solamente requieren sedación y monitorización). 2. Revise la anatomía del sistema nervioso simpático. Las neuronas simpáticas preganglionares se originan a partir de las columnas intermediolaterales de la médula espinal toracolumbar. Estas fibras mielinizadas salen a través de la raíz anterior del nervio espinal, y se unen con fibras posganglionares en los ganglios simpáticos paravertebrales, formando los ganglios prevertebrales desparejados, o con un ganglio terminal. Las neuronas preganglionares pueden ascender o descender en la cadena simpática antes de hacer sinapsis. Las neuronas preganglionares estimulan las neuronas colinérgicas nicotínicas posganglionares mediante la liberación de acetilcolina. Las neuronas posganglionares (adrenérgicas) se unen en los órganos diana finales y liberan noradrenalina (Figura 1-1). Figura 1-1. Anatomía neuronal del sistema nervioso autónomo con sus respectivos neurotransmisores. ACh, acetilcolina; NA, noradrenalina. (Moss J, Glick D: The autonomic nervous system. En Miller RD, editor: Miller’s Anesthesia, ed 6, Philadelphia, 2005, Churchill Livingstone, p 618.) 3. Explique la localización y los nombres de los ganglios simpáticos. Desde un punto de vista práctico, ¿para qué sirve conocer los nombres y la localización de dichos ganglios? Los ganglios paravertebrales fácilmente identificables se encuentran en la región cervical (incluido el ganglio estrellado), además de en los troncos simpáticos torácico, lumbar y pélvico. Los ganglios prevertebrales reciben el nombre según su relación con las ramas principales de la aorta, como los ganglios celíaco, mesentérico superior e inferior y renal. Los ganglios terminales se localizan próximos a los órganos a los que inervan. La importancia práctica de conocer la localización de algunos de estos ganglios es que pueden inyectarse anestésicos locales en la región de estas estructuras para tratar el dolor mediado simpáticamente. Capítulo 1 Sistema nervioso autónomo 11 4. Describa los receptores adrenérgicos posganglionares del sistema nervioso simpático y los efectos del estímulo de dichos receptores. Existen receptores adrenérgicos a1 (A1), a2 (A2), b1 (B1) y b2 (B2). Los receptores A1, A2 y B2 son postsinápticos, y se estimulan por el neurotransmisor noradrenalina. Los receptores A2 son presinápticos, y su estimulación inhibe la liberación del neurotransmisor (noradrenalina), conocido como retroalimentación negativa. Los farmacólogos moleculares han subdividido aún más estos receptores, pero ello está fuera del alcance de nuestro tema. La dopamina estimula los receptores dopaminérgicos posganglionares, clasificados como DA1 y DA2. La respuesta a la activación del receptor en los diferentes órganos se describe en la Tabla 1-2. TA B LA 1 - 2 . E f e c t o s d e l a e s t i m u l a c i ó n d e l r e c e p t o r a d r e n é r g i c o e n los órganos finales Receptor Órgano Respuesta b1 Corazón Aumenta la frecuencia cardíaca, contractilidad y velocidad de conducción Lipólisis Dilatación Dilatación Relajación Secreción de renina Gluconeogénesis, glucogenólisis Secreción de insulina Constricción Inhibe la liberación de insulina Relajación pero constricción de esfínteres Inhibe la liberación de noradrenalina b2 a1 a2 Dopamina-1 © Elsevier. Fotocopiar sin autorización es un delito Dopamina-2 Adipocitos Vasos sanguíneos Bronquiolos Útero Riñones Hígado Páncreas Vasos sanguíneos Páncreas Intestino, vejiga Terminaciones nerviosas presinápticas Vasos sanguíneos Terminaciones presinápticas Sistema nervioso central Dilata los vasos renales, coronarios y esplácnicos Inhibe la liberación de noradrenalina Alteraciones psíquicas 5. Revise la anatomía y la función del sistema nervioso parasimpático. Las neuronas parasimpáticas preganglionares se originan en los nervios craneales III, VII, IX y X, y en los segmentos sacrales 2-4. Las neuronas parasimpáticas preganglionares se unen con las neuronas posganglionares cerca de los órganos diana finales, creando un efecto fisiológico más discreto. Tanto las neuronas parasimpáticas preganglionares como las posganglionares liberan acetilcolina, y estos receptores colinérgicos se subclasifican en nicotínicos y muscarínicos. La respuesta a la estimulación colinérgica se resume en la Tabla 1-3. 6. ¿Qué son las catecolaminas? ¿Qué catecolaminas se producen de forma natural? ¿Cuáles son sintéticas? Las catecolaminas son feniletilaminas sustituidas por hidroxi y estimulan las terminaciones nerviosas adrenérgicas. La noradrenalina, la adrenalina y la dopamina son catecolaminas que se producen de forma natural, mientras que la dobutamina y el isoproterenol son catecolaminas sintéticas. 7. Revise la síntesis de la dopamina, la noradrenalina y la adrenalina. La tirosina es transportada activamente en el citoplasma terminal nervioso adrenérgico presináptico, donde se convierte en dopamina por dos reacciones enzimáticas: hidroxilación de la tirosina por la tirosina hidroxilasa a dopamina y descarboxilación de la dopamina por la descarboxilasa l-amino ácida aromática. La dopamina se transporta en vesículas de almacenamiento, 12 Capítulo 1 Sistema nervioso autónomo TA B LA 1 - 3 . E f e c t o s d e l a e s t i m u l a c i ó n d e l r e c e p t o r c o l i n é r g i c o e n los órganos finales Receptor Órgano Respuesta Muscarínico Corazón Disminución de la frecuencia cardíaca, contractilidad y velocidad de conducción Constricción Estimula la secreción Contracción y relajación de esfínteres, estimula las secreciones Contracción y relajación de esfínteres Contracción del músculo esquelético Estimulación del SNS Bronquiolos Glándulas salivales Intestino Nicotínico Vejiga Unión neuromuscular Ganglios autónomos SNS, sistema nervioso simpático. donde es hidroxilada por la dopamina b-hidroxilasa a noradrenalina. La adrenalina se sintetiza en la médula adrenal a partir de la noradrenalina a través de la metilación mediada por la feniletanolamina N-metiltransferasa (Figura 1-2). 8. ¿Cómo se metaboliza la noradrenalina? La noradrenalina desaparece de la unión sináptica mediante la recaptación dentro de la terminación ­nerviosa presináptica y la descomposición metabólica. La recaptación es el mecanismo más impor­ tante y permite la reutilización de los neurotransmisores. La enzima monoaminooxidasa (MAO) metaboliza la noradrenalina en el citoplasma neuronal; ambas, la MAO y la catecolamina O-metiltransferasa­ (COMT), metabolizan los neurotransmisores en localizaciones extraneuronales. Los metabolitos importantes son el 3-metoxi-4-ácido hidroximandélico, la metanefrina y la normetanefrina. 9. Describa la síntesis y degradación de la acetilcolina. El neurotransmisor colinérgico acetilcolina (ACh) se sintetiza en la mitocondria neuronal presináptica por esterificación de la acetil coenzima A y de colina por la enzima colina acetiltransferasa; se almacena en vesículas sinápticas hasta su liberación. Después de la liberación, la ACh se metaboliza principalmente por la acetilcolinesterasa, una enzima fijada a la membrana localizada en la unión sináptica. La acetilcolinesterasa se localiza también en otros tejidos no neuronales como los hematíes. 10. ¿Qué son los simpaticomiméticos? Los simpaticomiméticos son fármacos sintéticos con efectos vasopresor y cronotrópico, y son parecidos a las catecolaminas en estructura. Se emplean habitualmente en el quirófano para revertir los efectos circulatorios depresores de los agentes anestésicos, aumentando la presión arterial y la frecuencia cardíaca; también atenúan los efectos de la hipovolemia mientras se administran líquidos. Son eficaces tanto en la anestesia general como en la regional. 11. Revise los simpaticomiméticos empleados habitualmente en el período periope­­­ ratorio. Los simpaticomiméticos de acción directa son agonistas en el receptor diana, mientras que los simpaticomiméticos de acción indirecta estimulan la liberación de noradrenalina. Los simpaticomiméticos pueden ser mixtos en sus acciones, teniendo tanto efectos directos como indirectos. Prácticamente, la fenilefrina (acción directa) y la efedrina (de acción indirecta, principalmente) son los simpaticomiméticos empleados de forma habitual en el perioperatorio. La adrenalina, la dopamina y la noradrenalina también pueden utilizarse en el perioperatorio, en la mayor parte de © Elsevier. Fotocopiar sin autorización es un delito Figura 1-2. Vía de la síntesis de catecolaminas. (De http://www.answers. com/topic/epinephrine.) 14 Capítulo 1 Sistema nervioso autónomo los casos en infusión, ya que sus efectos en la presión arterial, frecuencia cardíaca y consumo de oxígeno por el miocardio son profundos. La dopamina se comenta en el Capítulo 15. 12. Comente los efectos de la fenilefrina y las dosis habituales de dicho fármaco. La fenilefrina estimula los receptores A1 principalmente, provocando un aumento en las resistencias vasculares sistémicas y en la presión arterial. Dosis superiores estimulan los receptores A2. Una bradicardia refleja puede ser la respuesta a un aumento de la precarga y de las resis­ tencias vasculares sistémicas. Las dosis intravenosas habituales de fenilefrina varían entre 50 y 200 mg. La fenilefrina puede administrarse también en infusión a 10-20 mg/min. 13. Comente los efectos de la efedrina y revise las dosis habituales de este ­fármaco. Dé algunos ejemplos de fármacos que contraindiquen el uso de efedrina y ­explique por qué. La efedrina produce la liberación de noradrenalina, estimulando principalmente los receptores A1 y B1, y los efectos son parecidos a los de la adrenalina, aunque menos intensos. Destacan el aumento de la presión arterial sistólica, presión arterial diastólica, frecuencia cardíaca y gasto cardíaco. Las dosis intravenosas habituales de efedrina están entre 5 y 25 mg. Dosis repetidas han demostrado una disminución progresiva de la respuesta, conocida como taquifilaxis, posiblemente debido al agotamiento de los depósitos de noradrenalina o al bloqueo del receptor. Del mismo modo, una respuesta inadecuada a la efedrina puede ser el resultado de las ya agotadas reservas de noradrenalina. La efedrina no debería usarse cuando el paciente toma fármacos que previenen la recaptación de noradrenalina debido al riesgo de hipertensión grave. Algunos ejemplos son los antidepresivos tricíclicos, los inhibidores de la monoaminooxidasa y la intoxicación aguda por cocaína. Los consumidores crónicos de cocaína pueden tener una depleción de catecolaminas y pueden no responder a la efedrina. 14. ¿Cuáles son las indicaciones para el uso de antagonistas adrenérgicos b? Los antagonistas adrenérgicos b, conocidos comúnmente como bloqueantes b, son antagonistas de los receptores b1 y b2. Los bloqueantes b son fundamentales en la terapia antihipertensiva, antianginosa y antiarrítmica. El bloqueo beta perioperatorio es esencial en pacientes con enfermedad arterial coronaria, y el atenolol ha demostrado reducir la muerte tras el infarto de miocardio. 15. Comente el mecanismo de acción de los antagonistas b1 además de sus efectos secundarios. El bloqueo b1 produce efectos inotrópico y cronotrópico negativos, disminuyendo el gasto cardíaco y las necesidades miocárdicas de oxígeno. Los bloqueantes b1 también inhiben la secreción de renina y la lipólisis. Como los anestésicos volátiles también deprimen la contractibilidad, la hipotensión intraoperatoria es un riesgo. Los bloqueantes b pueden producir bloqueo auriculoventricular. La supresión brusca de estos fármacos no es recomendable, debido a una sobrerregulación de los receptores; puede producirse isquemia miocárdica e hipertensión. El bloqueo beta reduce los signos de hipoglucemia, por lo que debe usarse con precaución en diabéticos insulinodependientes. Los bloqueantes b pueden ser cardioselectivos, con propiedades antagonistas b1 relativamente selectivas, o no cardioselectivos. Algunos bloqueantes b tienen efectos estabilizadores de la membrana (efectos antiarrítmicos); algunos tienen efectos simpaticomiméticos y son los fármacos de elección en pacientes con insuficiencia ventricular izquierda o bradicardia. Los bloqueantes b interfieren con el movimiento transmembrana del potasio; por tanto, el potasio debería administrarse con cuidado. Debido a sus efectos beneficiosos en la enfermedad isquémica cardíaca y al riesgo de rebote, los bloqueantes b deberían tomarse el día de la cirugía. 16. Revise los efectos del antagonismo b2. El bloqueo b2 produce broncoconstricción y vasoconstricción periférica e inhibe la liberación de insulina y la glucogenólisis. Los bloqueantes b1 selectivos deberían emplearse en pacientes con enfermedad de las vías aéreas crónica o reactiva, y con vasculopatía periférica por el riesgo de que se produzca, respectivamente, una constricción bronquial o vascular con el bloqueo beta no selectivo. Capítulo 1 Sistema nervioso autónomo 15 17. ¿Cómo pueden tratarse las complicaciones de un bloqueo beta intraoperatoria­ mente? La bradicardia y el bloqueo cardíaco pueden responder a la atropina; los casos refractarios pueden necesitar el efecto agonista b2 de la dobutamina o del isoproterenol. Curiosamente, el calcio también puede ser eficaz, aunque no se conoce su mecanismo. En todos los casos se tienen que emplear dosis más altas que las normales. 18. Describa la farmacología de los antagonistas adrenérgicos a. El bloqueo a1 produce vasodilatación y, por ello, los bloqueantes a se emplean en el tratamiento de la hipertensión. Sin embargo, los bloqueantes a no selectivos pueden asociarse con taquicardia refleja. Por ello, los bloqueantes a1 selectivos se usan principalmente como antihipertensivos. La prazosina es el prototipo de bloqueante a1 selectivo, mientras que la fentolamina y la fenoxibenzamina son ejemplos de bloqueantes a no selectivos. Curiosamente, el labetalol, un bloqueante b no selectivo, también tiene propiedades de bloqueo a1 selectivo y es un potente antihipertensivo. 19. Revise los agonistas a2 y su papel en la anestesia. Cuando se estimulan los receptores a2 en el SNC, disminuye el estímulo simpático. Con ello, se produce una disminución del gasto cardíaco, de las resistencias vasculares sistémicas y de la presión arterial. La clonidina es un agonista a2 empleado en el tratamiento de la hipertensión. También tiene importantes efectos sedantes. La clonidina disminuye los requerimientos de anestésicos intravenosos o inhalatorios. El uso intratecal de clonidina también se ha estudiado. Sin embargo, tras la administración intratecal se produce a menudo una hipotensión inaceptable, lo cual limita su utilidad. La clonidina debería continuarse perioperatoriamente debido a una posible hipertensión de rebote. © Elsevier. Fotocopiar sin autorización es un delito 20. Comente los antagonistas muscarínicos y sus propiedades. Los antagonistas muscarínicos, también conocidos como anticolinérgicos, bloquean los receptores colinérgicos muscarínicos, produciendo midriasis y broncodilatación, además de aumentar la frecuencia cardíaca e inhibir las secreciones. Los antagonistas muscarínicos de acción central (todos los no ionizados, aminas terciarias con la capacidad de cruzar la barrera sangre-cerebro) pueden producir delirio. Los antagonistas muscarínicos comúnmente empleados son atropina, escopolamina, glicopirrolato y bromuro de ipratropio. La administración de antagonistas muscarínicos es una indicación primordial cuando los efectos de los relajantes musculares son antagonizados por inhibidores de la acetilcolinesterasa, para evitar bradicardia profunda, bloqueo cardíaco y asistolia. El glicopirrolato es un compuesto de amonio cuaternario, que no puede cruzar la barrera sanguínea encefálica, y, por tanto, carece de actividad en el SNC. El bromuro de ipratropio inhalado puede producir broncodilatación. 21. ¿Cuál es el significado de la disfunción autónoma? ¿Cómo se puede saber si un paciente padece disfunción autónoma? Los pacientes con disfunción autónoma suelen padecer hipotensión grave intraoperatoriamente. La valoración de los cambios de la presión arterial ortostática y en la frecuencia cardíaca es un modo rápido y eficaz para la valoración de la disfunción autónoma. Si el SNA está intacto, cabe esperar un aumento de la frecuencia cardíaca de 15 latidos/min, además de un aumento de 10 mmHg en la presión arterial diastólica, al cambiar de posición supina a sentado. La disfunción autónoma debe sospecharse cuando existe una pérdida de la variabilidad del latido cardíaco, sea cual sea la situación. La disfunción autónoma incluye la disfunción vasomotora, de vejiga, intestinal y sexual. Otros signos incluyen visión borrosa, reducción o exceso de sudoración, ojos y boca secos o excesivamente húmedos, extremidades descoloridas o frías, incontinencia o vaciamiento incompleto de heces, diarrea o estreñimiento, e impotencia. Aunque existen numerosas causas, debería tenerse en cuenta que los diabéticos y los alcohólicos crónicos (dos problemas muy comunes) tienen disfunción autónoma. 22. ¿Qué es un feocromocitoma y cuáles son los síntomas asociados? ¿Cómo se diagnostica un feocromocitoma? Un feocromocitoma es un tumor del tejido cromafín secretor de catecolaminas que produce adrenalina o noradrenalina. La mayoría son intraadrenales, pero algunos son extraadrenales 16 Capítulo 1 Sistema nervioso autónomo (dentro de la pared vesical es frecuente), y sobre el 10% son malignos. Los signos y síntomas incluyen crisis paroxísticas de hipertensión, síncope, cefalea, palpitaciones, enrojecimiento facial y sudoración. El feocromocitoma se confirma mediante la detección de niveles elevados de catecolaminas plasmáticas y en orina, además de sus metabolitos, como ácido vanililmandélico, normetanefrina y metanefrina. 23. Revise el manejo preanestésico e intraoperatorio de los pacientes con feo­ cromocitoma. Estos pacientes tienen una reducción marcada de la volemia y un alto riesgo de crisis hipertensivas graves. Es esencial que, previamente a la cirugía, se instituya la rehidratación y el bloqueo alfa. El antagonista a1 fenoxibenzamina se administra habitualmente por vía oral. Los bloqueantes b se administran generalmente cuando se ha conseguido ya el bloqueo alfa, y nunca deberían administrarse en primer lugar, pues una vasoconstricción de origen a1 no contrarrestada podría provocar una hipertensión refractaria grave. El labetalol puede ser el bloqueante b de elección, y también tiene propiedades bloqueantes a. La monitorización intraarterial es necesaria intraoperatoriamente, ya que las fluctuaciones de la presión arterial pueden ser extremas. La manipulación del tumor puede provocar hipertensión. La hipertensión intraoperatoria puede manejarse mediante la infusión del bloqueante a fentolamina o el vasodilatador nitroprusiato. Una vez se ha extirpado el tumor, existe riesgo de hipotensión, y pueden ser necesaria la administración de líquidos y del agonista a fenilefrina. La monitorización de la presión venosa central ayuda al manejo del volumen. Bibliografía Recomendada 1. Neukirchen M, Kienbaum P: Sympathetic nervous system. Evaluation and importance for clinical general anesthesia, Anesthesiology 109:1113–1131, 2008. Matthew D. Coleman, MD Capítulo 2 Fisiología pulmonar y respiratoria 1. ¿Qué es la capacidad residual funcional? ¿Qué factores la afectan? La capacidad residual funcional (CRF) es el volumen pulmonar al final de la espiración pasiva. Está determinada por las fuerzas opuestas de expansión de la pared torácica y de retracción elástica del pulmón. CRF normal = 1,7 a 3,5 l. La CRF se ve aumentada por: Tamaño corporal (la CRF aumenta con la altura). Edad (la CRF aumenta ligeramente con la edad). Determinadas enfermedades pulmonares, como asma y enfermedad pulmonar obstructiva crónica (EPOC). La CRF disminuye por: Sexo (las mujeres tienen la CRF disminuida un 10% en comparación con los hombres). Tono del músculo del diafragma (los individuos con parálisis diafragmática tienen menos CRF que los individuos normales). Postura (la CRF es mayor de pie > sentado > decúbito prono > lateral > decúbito supino). Determinadas enfermedades pulmonares en las que la retracción elástica está disminuida (p. ej., enfermedad pulmonar intersticial, quemaduras torácicas y cifoescoliosis). Aumento de la presión abdominal (p. ej., obesidad, ascitis). 2. ¿Qué es la capacidad de cierre? ¿Qué factores afectan a la capacidad de cierre? ¿Cuál es la relación entre la capacidad de cierre y la capacidad residual funcional? La capacidad de cierre es el punto durante la espiración en el que las vías aéreas de menor tamaño empiezan a cerrarse. En los individuos jóvenes con un índice de masa corporal promedio, la capacidad de cierre es aproximadamente la mitad de la CRF en posición vertical y aproximadamente dos tercios de la CRF en posición supina. La capacidad de cierre aumenta con la edad y es igual a la CRF en el individuo en posición supina a los 44 años aproximadamente y en el individuo en posición vertical a los 66 años aproximadamente. La CRF depende de la postura; la capacidad de cierre es independiente de la postura. La capacidad de cierre aumenta al elevarse la presión intraabdominal, la edad, al disminuir el flujo de sangre al pulmón y en casos de enfermedad del parénquima pulmonar, y todos ellos reducen la distensibilidad. 3. ¿Qué músculos son responsables de la inspiración y la espiración? Los músculos respiratorios son el diafragma, los intercostales internos y externos, la musculatura abdominal, los músculos infrahioideos, el músculo esternocleidomastoideo, y los músculos dorsales largos e intervertebrales de la articulación de la cintura escapular. Durante la respiración normal, la inspiración requiere un trabajo, mientras que la espiración es pasiva. El diafragma, los músculos escalenos y los músculos intercostales externos realizan la mayor parte del trabajo durante la respiración normal. Sin embargo, a medida que el trabajo de respiración aumenta, la musculatura abdominal y los músculos intercostales internos se activan durante la espiración, y los músculos escaleno y esternocleidomastoideo adquieren cada vez más importancia para la inspiración. 4. ¿Qué es el trabajo fisiológico de la respiración? El trabajo fisiológico de la respiración comprende el trabajo para superar la retracción elástica del pulmón (distensibilidad y trabajo de resistencia tisular) y la resistencia al flujo del gas. La retracción elástica está alterada en determinados estados patológicos, como el edema pulmonar, © 2011. Elsevier España, S.L. Reservados todos los derechos 17 18 Capítulo 2 Fisiología pulmonar y respiratoria la fibrosis pulmonar, las quemaduras torácicas y la EPOC. La resistencia al flujo del gas aumenta de forma espectacular durante la respiración forzada. Además del trabajo fisiológico de la respiración, un paciente conectado a un respirador también debe vencer la resistencia del tubo endotraqueal. 5. Comente los factores que afectan a la resistencia al flujo del gas. ¿Qué es el flujo de gas laminar y turbulento? La resistencia al flujo del gas puede dividirse en las propiedades del tubo y en las propiedades del gas. Con un flujo bajo, o flujo laminar (respiración no obstruida), la viscosidad es la principal propiedad del gas que afecta al flujo. Claramente, el principal factor determinante es el radio del tubo. Esto puede demostrarse por la relación de Hagen-Poiseuille: R = (8 × L × m)/(π × r4) donde R es la resistencia, L es la longitud del tubo, m es la viscosidad y r es el radio del tubo. Con una velocidad de flujo mayor (en casos de obstrucción de las vías y respiración forzada), el flujo es turbulento. En estos flujos, los principales determinantes de la resistencia al flujo son la densidad del gas (ρ) y el radio del tubo, r. R a ρ/r5 6. Suponga que un paciente está intubado con un tubo endotraqueal de 7 mm y no puede desconectarse del ventilador debido al aumento del trabajo de la respiración, ¿qué sería más beneficioso: cortar el tubo endotraqueal 4 cm o sustituir el tubo por uno con un mayor diámetro interno? Según la relación de Hagen-Poiseuille comentada anteriormente, si el radio se reduce a la mitad, la resistencia en el interior del tubo aumenta seis veces; pero si se duplica la longitud del tubo, la resistencia solamente se duplica. Cortar mínimamente la longitud del tubo afecta a la resistencia, pero aumentar el diámetro del tubo reduce la resistencia de forma espectacular. Por tanto, para reducir el trabajo de respiración el tubo endotraqueal debe cambiarse por otro de mayor tamaño. 7. ¿Por qué el helio puede ser beneficioso en un paciente con estridor? Cuando el flujo es turbulento, como en el caso de un paciente con estridor, la presión está estrechamente relacionada con la densidad del gas. El empleo de mezclas de gases de baja densidad con helio y oxígeno disminuye la presión necesaria para desplazar el gas dentro y fuera del área, disminuyendo el trabajo de la respiración. 8. Comente la distensibilidad estática y dinámica. La distensibilidad describe las propiedades elásticas del pulmón. Es una medida de la variación en el volumen del pulmón al aplicar una presión. El pulmón es un cuerpo elástico que presenta histéresis elástica. Cuando el pulmón se infla rápidamente y se mantiene en un volumen determinado, la presión alcanza un pico y luego disminuye de forma exponencial hasta una presión meseta. La distensibilidad dinámica es la variación del volumen pulmonar por la variación de la presión máxima inicial. La variación del volumen por la presión meseta representa la distensibilidad estática del pulmón. 9. ¿Cómo afecta la tensión superficial a las fuerzas en las vías aéreas pequeñas y los alvéolos? La ley de Laplace describe la relación entre la presión (P), la tensión (T) y el radio (R) de una burbuja y puede aplicarse en los alvéolos. P = 2T/R A medida que el radio disminuye, aumenta la presión. En un pulmón sin surfactante, a medida que los alvéolos disminuyen de tamaño, la presión es mayor en los alvéolos más pequeños, provocando que el gas se desplace de las vías aéreas pequeñas a las mayores, colapsándose en el proceso. El surfactante, un fosfolípido producido en el pulmón por el epitelio alveolar de tipo II, reduce la tensión de superficie de las vías aéreas pequeñas, reduciendo así la presión a Capítulo 2 Fisiología pulmonar y respiratoria 19 medida que las vías aéreas disminuyen de tamaño. Esta importante sustancia ayuda a mantener abiertas las vías aéreas pequeñas durante la espiración. 10. Revise las diferentes zonas (de West) en el pulmón con respecto a la perfusión y la ventilación. West describió tres zonas de perfusión en un pulmón en posición vertical, y posteriormente se añadió una cuarta. Comenzando por los vértices, se trata de: Zona 1: la presión alveolar (P Alv) supera la presión arterial pulmonar (Ppa) y la presión venosa pulmonar (Ppv), provocando una ventilación sin perfusión (espacio muerto alveolar) (PAlv > Ppa > Ppv). Zona 2: la presión arterial pulmonar supera la presión alveolar, pero ésta aún es mayor que la presión venosa (Ppa > PAlv > Ppv). El flujo sanguíneo de la zona 2 está determinado por la diferencia de presión arterial-alveolar. Zona 3: la presión venosa pulmonar supera la presión alveolar, y el flujo está determinado por la diferencia de presión arterial-venosa (Ppa > Ppv > PAlv). Zona 4: la presión intersticial (P interstitium) es mayor que las presiones venosa y alveolar, así el flujo queda definido por la diferencia de presión arterial-intersticial (Ppa > Pinterstitium > Ppv > PAlv). La zona 4 debería ser mínima en pacientes sanos. Un cambio de posición vertical a supina aumenta el volumen de sangre pulmonar en un 25 a un 30%, incrementando así el tamaño de las zonas de West de mayor numeración. 11. ¿Cuáles son la ecuación del gas alveolar y la presión alveolar normal a nivel del mar y a temperatura ambiente? La ecuación del gas alveolar se usa para calcular la presión parcial de oxígeno alveolar: PAO2 = FiO2 (Pb − PH2O) − PaCO2/RQ donde PAO2 es la presión parcial de oxígeno alveolar, FiO2 es la fracción inspirada de oxígeno, Pb es la presión barométrica, PH2O es la presión parcial de agua (47 mmHg), PaCO2 es la presión parcial de CO2, y RQ es el cociente respiratorio, que en función de la actividad metabólica y la dieta se considera que está alrededor de 0,825. A nivel del mar la presión parcial alveolar (PAO2) es: PaO2 = 0,21(760 − 47) − 40/0,8 = 99,7 sabiendo que la PaO2 nos permite calcular el gradiente de O2 alveolar-arterial (gradiente A-a). Además, conociendo la ecuación del gas alveolar podemos ver cómo la hipoventilación (que provoca hipercapnia) reduce la PAO2 y, por tanto, la PaO2. © Elsevier. Fotocopiar sin autorización es un delito 12. ¿Qué es el gradiente A-a y cuál es su valor normal? El gradiente de O2 alveolar-arterial se conoce como gradiente A-a. Es la diferencia entre la presión parcial de O2 en el alvéolo (PAO2), calculada mediante la ecuación del gas alveolar, y la presión parcial de O2 determinada en la sangre (PaO2): Gradiente A-a = PAO2 − PaO2 El gradiente A-a normal se estima de la siguiente forma: Gradiente A-a = (edad/4) + 4 13. ¿Cuál es el significado práctico de la estimación del gradiente A-a? El gradiente A-a, junto con la PaO2 y la PaCO2, permite evaluar la hipoxemia de forma sistemática, lo que conduce a un diagnóstico diferencial preciso. Como se ha comentado, la gasometría arterial proporciona una evaluación inicial de la oxigenación mediante la medición de la PaO2. El gradiente A-a es una extensión de ello, ya que al calcular las diferencias entre la PAO2 y la PaO2 estamos evaluando la eficiencia del intercambio gaseoso en la membrana alveolar-capilar. 14. ¿Cuáles son las causas de la hipoxemia? Baja concentración de oxígeno inspirado (FiO ): el equipo de anestesia dispone de alarmas 2 de oxígeno para evitar el suministro de mezclas de gas hipóxico durante la anestesia. 20 Capítulo 2 Fisiología pulmonar y respiratoria Hipoventilación: los pacientes sometidos a anestesia general pueden no ser capaces de mantener una ventilación por minuto adecuada a causa de los relajantes musculares o los efectos depresores en la ventilación de los agentes anestésicos. La hipoventilación es un problema frecuente tras la cirugía. Shunt o cortocircuito: la sepsis, la insuficiencia hepática, las malformaciones arteriovenosas, las embolias pulmonares y los cortocircuitos cardíacos derecha-izquierda pueden provocar un cortocircuito suficientemente importante como para causar una hipoxemia. Dado que la sangre del cortocircuito no pasa por los alvéolos, la hipoxemia provocada por un cortocircuito no puede revertirse aumentando la FiO2. Desequilibrio ventilación-perfusión (V/Q): la ventilación y la perfusión de los alvéolos pulmonares están idealmente en una relación cercana al 1:1, favoreciendo el intercambio eficiente de oxígeno entre los alvéolos y la sangre. Cuando la ventilación y la perfusión alveolares en los pulmones no son iguales (desequilibrio V/Q) se produce una hipoxemia. Entre las causas de un desequilibrio V/Q destacan la atelectasia, la posición de decúbito lateral, la intubación bronquial, el broncoespasmo, la neumonía, un tapón mucoso, la contusión pulmonar y el síndrome de distrés respiratorio del adulto. La hipoxemia causada por un desequilibrio V/Q suele revertirse aumentando la FiO2. Defectos de difusión: el intercambio eficiente de O2 depende de una interfaz sana entre los alvéolos y el torrente sanguíneo. La enfermedad pulmonar avanzada y el edema pulmonar se asocian a trastornos en la difusión. P U N T OS CLAVE: C A USAS DE HIPOX EMIA 1. Baja concentración de oxígeno inspirado. 2. Hipoventilación alveolar. 3. Cortocircuito derecha-izquierda. 4. Desequilibrio V/Q. 5. Defectos de difusión. 15. ¿Cuáles son los gradientes A-a para las diferentes causas de hipoxemia?: Baja FiO : gradiente A-a normal. 2 Hipoventilación alveolar: gradiente A-a normal. Cortocircuito derecha-izquierda: gradiente A-a elevado. Desequilibrio ventilación/perfusión: gradiente A-a elevado. Defectos de difusión: gradiente A-a elevado. 16. Comente el desequilibrio V/Q. ¿Cómo puede la anestesia general empeorar el desequilibrio V/Q? El desequilibrio V/Q oscila entre el cortocircuito en un extremo del espectro hasta el espacio muerto en el otro extremo. En el individuo sano, la ventilación alveolar (V) y la perfusión (Q) varían en función de la anatomía pulmonar. En una situación ideal, V y Q son iguales, y V/Q = 1. En los cortocircuitos pulmonares la perfusión es mayor que la ventilación, creándose áreas pulmonares donde el flujo sanguíneo es elevado pero apenas se produce el intercambio gaseoso. En el espacio muerto pulmonar, la ventilación es mucho mayor que la perfusión, creándose zonas pulmonares a las que se suministra el gas pero en las que existe poco flujo sanguíneo y apenas se produce intercambio gaseoso. Ambas situaciones pueden causar hipoxemia. En el caso del espacio muerto, el aumento de la FiO2 elevará potencialmente la saturación de oxígeno de la hemoglobina, cosa que no sucederá en el caso de un cortocircuito. En muchas situaciones patológicas ambos extremos coexisten en el pulmón. Capítulo 2 Fisiología pulmonar y respiratoria 21 Bajo anestesia general la CRF se reduce aproximadamente en 400 ml en un adulto. La posición supina reduce la CRF otros 800 ml. Una disminución de la CRF lo suficientemente grande puede hacer que los volúmenes al final de la espiración o incluso todo el volumen corriente estén a niveles por debajo del volumen de cierre (volumen al que se cierran las vías aéreas pequeñas). Cuando las vías aéreas pequeñas empiezan a cerrarse se produce una atelectasia y aparecen zonas con bajo V/Q. 17. Defina el espacio muerto anatómico, alveolar y fisiológico. El espacio muerto fisiológico (VD) es la suma del espacio muerto anatómico y alveolar. El espacio muerto anatómico es el volumen pulmonar que no intercambia gas. Esto incluye la nariz, la faringe, la tráquea y los bronquios. Es de unos 2 ml/kg en un individuo con respiración espontánea y constituye en su mayor parte espacio muerto fisiológico. La intubación endotraqueal reducirá la cantidad total de espacio muerto anatómico. El espacio muerto alveolar es el volumen de gas que alcanza los alvéolos pero no interviene en el intercambio gaseoso porque los alvéolos no están perfundidos. En los individuos sanos, el espacio muerto alveolar es insignificante. 18. ¿Cómo se calcula el VD/VT? El VD/VT es el cociente entre el espacio muerto fisiológico y el volumen corriente (VT), suele ser de un 33% y está determinado por la siguiente fórmula: VD/VT = [(PCO2 alveolar − PCO2 espirado)]/PCO2 alveolar La PCO2 alveolar se calcula utilizando la ecuación del gas alveolar, y la PCO2 espirada es el promedio de la PCO2 en una muestra de gas espirado (no es lo mismo que la PCO2 al final de la espiración). 19. Defina el cortocircuito absoluto. ¿Cómo se calcula la fracción del cortocircuito? El cortocircuito absoluto se define como la sangre que alcanza el sistema arterial sin pasar a través de las regiones ventiladas del pulmón. La fracción de gasto cardíaco que pasa a través de un cortocircuito está determinada por la siguiente ecuación: Qs/Qt = (CiO2 − CaO2)/(CiO2 − CvO2) © Elsevier. Fotocopiar sin autorización es un delito donde Qs es el flujo fisiológico de sangre del cortocircuito por minuto, Qt es el gasto cardíaco por minuto, CiO2 es la concentración de oxígeno arterial ideal cuando V/Q = 1, CaO2 es el contenido de oxígeno arterial y CvO2 es el contenido de oxígeno en sangre venosa mixta. Se estima que entre un 2 y un 5% del gasto cardíaco pasa normalmente a través de los cortocircuitos pospulmonares, lo que constituye el gradiente normal de oxígeno alveolar-arterial (gradiente A-a). Entre los cortocircuitos pospulmonares destacan las venas tebesianas, bronquiales, mediastínicas y pleurales. 20. ¿Qué es la vasoconstricción pulmonar hipóxica? La vasoconstricción pulmonar hipóxica (VPH) es una respuesta local del músculo liso arterial pulmonar que disminuye el flujo sanguíneo en presencia de una tensión de oxígeno alveolar baja, permitiendo el mantenimiento de una relación V/Q normal al desviar sangre de las zonas hipoventiladas. La VPH está inhibida por los anestésicos inhalatorios y los vasodilatadores, pero no se ve afectada por la anestesia intravenosa. 21. Calcule el contenido de oxígeno arterial y venoso (CaO2 y CvO2). El contenido en oxígeno (mililitros de O2/dl) se calcula sumando el oxígeno ligado a la hemoglobina (Hgb) y el oxígeno disuelto en la sangre: Contenido de oxígeno = 1,34 × [Hgb] × SaO2 + (PaO2 × 0,003) donde 1,34 es el contenido de O2 por gramo de hemoglobina, SaO2 es la saturación de hemoglobina, [Hgb] es la concentración de hemoglobina, y PaO2 es la concentración de oxígeno arterial. Si [Hgb] = 15 g/dl, la saturación arterial = 96%, y la PaO2 = 90 mmHg, la saturación venosa mixta = 75%, y la PvO2 = 40 mmHg, luego: 22 Capítulo 2 Fisiología pulmonar y respiratoria CaO2 = (1,34 ml O2/g Hgb × 15 g Hgb/dl × 0,96) + (90 × 0,003) = 19,6 ml O2/dl y CvO2 = (1,34 ml O2/g Hgb × 15 g Hgb/dl × 0,75) + (40 × 0,003) = 15,2 ml O2/dl 22. ¿Cómo se transporta el CO2 en la sangre? El CO2 existe en tres formas en la sangre: CO2 disuelto (7%), como iones bicarbonato HCO3– (70%) y combinado con hemoglobina (23%). 23. ¿Qué relación tiene la PCO2 con la ventilación alveolar? La presión parcial de CO2 (PCO2) está inversamente relacionada con la ventilación alveolar y se describe mediante la ecuación: PCO2 = (VCO2/Valveolar) donde VCO2 es la producción total de CO2 y Valveolar es la ventilación alveolar (ventilación por minuto menos ventilación del espacio muerto). En general, la ventilación por minuto y la PCO2 están inversamente relacionadas. P U N T OS CLAVE: ECUA C IONES PULMONA R E S Ú T I L E S 1. Presión parcial de gas alveolar: PAO2 = FiO2 (Pb – PH2O) – PaCO2/QR. 2. Contenido de oxígeno en la sangre: CaO2 = 1,34 × [Hgb] × SaO2 + (PaO2 × 0,003). 3. Resistencia del flujo laminar a través de un tubo: R = (8 × L × m)/(π × r4). 4. Resistencia del flujo turbulento a través de un tubo: R a ρ/r5. 5. Cálculo de la fracción del cortocircuito: Qs/Qt = (CiO2 – CaO2)/(CiO2 – CvO2). 24. ¿Qué factores alteran el consumo de oxígeno? Los factores que aumentan el consumo de oxígeno son la hipertermia (incluida la hipertermia maligna), la hipotermia con escalofríos, el hipertiroidismo, el embarazo, la sepsis, las quemaduras, el dolor y el feocromocitoma. Los factores que reducen el consumo de oxígeno son la hipotermia sin escalofríos, el hipotiroidismo, el bloqueo neuromuscular y la anestesia general. 25. ¿Dónde se localiza el centro respiratorio en el cerebro? El centro respiratorio está localizado bilateralmente en el bulbo raquídeo y la protuberancia. Existen tres centros principales que colaboran en la regulación respiratoria. El centro respiratorio dorsal es responsable principalmente de la inspiración, el centro respiratorio ventral es responsable de la espiración y la inspiración, y el centro neumotáxico ayuda a controlar la frecuencia y el patrón respiratorios. El centro respiratorio dorsal es el más importante; está situado en el núcleo solitario donde finalizan las terminaciones nerviosas del nervio vago y del glosofaríngeo, y transporta señales desde los quimiorreceptores y barorreceptores periféricos (incluidos los cuerpos carotídeos y aórticos) y varios receptores pulmonares. También existe un área quimiosensible en el tronco encefálico justo debajo del centro respiratorio ventral. Esta área responde a las variaciones en el pH del líquido cefalorraquídeo (LCR), enviando las correspondientes señales a los centros respiratorios. Los anestésicos provocan la depresión de los centros respiratorios del tronco encefálico. 26. ¿Cómo actúan el CO2 y el oxígeno para estimular e inhibir la respiración? El CO2 (indirectamente) o los iones hidrógeno (directamente) actúan en la zona quimiosensible del tronco encefálico. El oxígeno interactúa con los quimiorreceptores periféricos situados en los cuerpos aórticos y carotídeos. Durante los estados de hipercapnia e hipoxia, el tronco encefálico Capítulo 2 Fisiología pulmonar y respiratoria 23 es estimulado para aumentar la ventilación por minuto, mientras que en el caso de hipocapnia y normoxia sucede lo contrario. El CO2 influye mucho más en la regulación de la respiración que el oxígeno. 27. ¿Cuáles son las causas de hipercarbia? Hipoventilación: la disminución de la ventilación por minuto en última instancia reduce la ventilación alveolar, aumentando la PCO2. Algunas causas habituales de hipoventilación son la parálisis muscular, una ventilación mecánica insuficiente, los anestésicos inhalatorios y los opioides. Aumento de la producción de CO : si bien se asume que la producción de CO es cons2 2 tante, existen ciertas situaciones en las que el metabolismo y la producción de CO2 están aumentados. La hipertermia maligna, la fiebre, la tirotoxicosis y otros estados hipercatabólicos son algunos ejemplos. Iatrogénicas: el anestesiólogo administra determinados fármacos para incrementar el CO . 2 El más habitual es el bicarbonato de sodio, que es metabolizado por la enzima anhidrasa carbónica para formar CO2. El CO2 pasa al torrente circulatorio durante las intervenciones laparoscópicas. En raras ocasiones pueden administrarse gases enriquecidos con CO2. La insuflación de CO2 para la laparoscopia es una causa. El agotamiento del absorbente de CO2 del circuito anestésico puede provocar que se vuelvan a respirar los gases exhalados pudiendo dar lugar también a una hipercarbia. 28. ¿Cuáles son los signos y síntomas de una hIpercarbia? La hipercarbia actúa como vasodilatador directo en la circulación sistémica y como vasoconstrictor directo en la circulación pulmonar. También es un depresor cardíaco directo. El flujo sanguíneo cerebral aumenta en proporción al CO2 arterial. El aumento de las catecolaminas es responsable de la mayor parte de los signos clínicos y síntomas de la hipercarbia. La hipercarbia provoca un aumento de la frecuencia cardíaca, de la contractilidad miocárdica y de la frecuencia respiratoria, junto con una disminución de la resistencia vascular sistémica. Otros hallazgos clínicos frecuentes son: presión arterial sistólica elevada, presión del pulso más amplia, taquicardia, mayor gasto cardíaco, presiones pulmonares elevadas y taquipnea. En los pacientes despiertos los síntomas son cefalea, ansiedad/inquietud e incluso alucinaciones. Una hipercapnia extrema provoca hipoxemia ya que el CO2 desplaza al O2 en los alvéolos. Bibliografía Recomendada 1. Barash PG, Cullen BF, Stoelting RK: Clinical anesthesia, ed 5, Philadelphia, 2006, Lippincott Williams & Wilkins, 790–812. © Elsevier. Fotocopiar sin autorización es un delito 2. Wilson WC, Benumof JL: Respiratory physiology and respiratory function during anesthesia. In Miller RD, editor: Miller’s anesthesia, ed 6, Philadelphia, 2005, Churchill Livingstone, pp 679–722. Capítulo 3 Gasometría y equilibrio ácido-base Matthew D. Coleman, MD, y Steven T. Morozowich, DO, FASE 1. ¿Cuáles son los valores normales de la gasometría arterial en un paciente sano que respira aire ambiente a nivel del mar? Véase la Tabla 3-1. TABLA 3 - 1 . Va l o r e s d e g a s o m e t r í a a r t e r i a l a n i v e l d e l m a r pH PaCO2 PaO2 HCO3 Déficit de base SaO2 7,36-7,44 33-44 mmHg 75-105 mmHg 20-26 mmol/l +3 a –3 mmol/l 95-97% 2. ¿Qué información proporciona la gasometría arterial sobre un paciente? La gasometría arterial (GSA) proporciona una valoración de lo siguiente: Oxigenación (PaO ). La PaO es la cantidad de oxígeno disuelto en sangre y, por tanto, 2 2 proporciona información inicial sobre la eficiencia de la oxigenación. Ventilación (PaCO ). La eficacia de la ventilación es inversamente proporcional a la PaCO , 2 2 por lo que cuando la ventilación aumenta, la PaCO2 disminuye, y cuando la ventilación disminuye, la PaCO2 aumenta. Estado ácido-base (pH, HCO – y déficit de base [DB]). Un pH plasmático superior a 3 7,4 indica alcalemia, y un pH inferior a 7,35 indica acidemia. A pesar de un pH normal, una acidosis o alcalosis subyacentes todavía pueden estar presentes. La oxigenación y la ventilación se comentan en el Capítulo 2 y el estado ácido-base será el centro de este capítulo. 3. ¿Cómo se suele describir la regulación del equilibrio ácido-base? El equilibrio ácido-base se suele explicar utilizando la ecuación de Henderson-Hasselbalch, que establece que las variaciones en el HCO3– y la PaCO2 determinan el pH de la siguiente forma: pH = pK + log[HCO3/(0,03 × PaCO2)] Para evitar una variación en el pH, cualquier aumento o disminución de la PaCO2 debe estar acompañado por un aumento o disminución compensatorios en el HCO3–. Posteriormente se reconoció la importancia de otros tampones fisiológicos no bicarbonato y se integraron parcialmente en el DB y el anión gap corregido, siendo ambos útiles para interpretar trastornos ácido-base complejos. 24 © 2011. Elsevier España, S.L. Reservados todos los derechos Capítulo 3 Gasometría y equilibrio ácido-base 25 P U N TOS CLAVE: PRINCIPALES CAUSAS D E A C I D O S I S M E T ABÓLICA CON ANIÓN GAP A UMENTAD O Una acidosis metabólica con anión gap elevado está causada por la acumulación de aniones no medidos habitualmente: Ácido láctico. Cuerpos cetónicos. Toxinas (etanol, metanol, salicilatos, etilenglicol, propilenglicol). Uremia. 4. ¿Qué es el método fisicoquímico (modelo de Stewart) para el análisis del equilibrio ácido-base? En 1981, Stewart propuso un modelo conceptualmente diferente para analizar los trastornos ácido-base. Su método empleó dos principios importantes de química de soluciones: la conservación de la masa y la electroneutralidad. Describió tres variables independientes que determinan el pH en el líquido extracelular. Estas variables son la diferencia de iones fuertes (DIF), la PaCO2 y la concentración de ácidos débiles (AToT). La DIF se calcula de la siguiente forma para un valor normal dado: DIF = ([Na+] + [K+] + [Ca2+] + [Mg2+]) − ([Cl−] + [otros aniones]) = 40 − 42 mEq/l La concentración de otros aniones hace referencia a proteínas y ácidos débiles. Los principales ácidos débiles del plasma son proteínas (principalmente albúmina), fosfato y sulfato. En estados patológicos otros ácidos débiles serían el lactato, los cuerpos cetónicos, o las toxinas. A medida que se acumulan los aniones, la DIF disminuye y se produce una acidosis. Si el equilibrio se desplaza hacia un predominio de los cationes, se desarrolla una alcalosis. Stewart desarrolló varias ecuaciones que demuestran que estos parámetros son variables independientes y demostró que el HCO3– y el pH dependían de tres variables independientes, en oposición a los modelos de Henderson-Hasselbalch y del exceso de base estándar. Este modelo ha sido de gran utilidad para interpretar trastornos ácido-base complejos en pacientes con trastornos ácido-base mixtos y otros trastornos no detectables mediante los análisis ácido-base convencionales como son la hipoalbuminemia y la acidosis metabólica hiperclorémica. © Elsevier. Fotocopiar sin autorización es un delito 5. ¿Cuáles son los trastornos ácido-base más habituales y sus compensaciones? Véase la Tabla 3-2. TABLA 3 - 2 . P r i n c i pa l e s t r a s to r n o s á c i d o - ba s e y m e c a n i s m o s de compensación* Trastorno primario Alteración primaria Compensación primaria Acidosis respiratoria ↑ PaCO2 ↑ HCO3 Alcalosis respiratoria ↓ PaCO2 ↓ HCO3 Acidosis metabólica ↓ HCO3 ↓ PaCO2 Alcalosis metabólica ↑ HCO3 ↑ PaCO2 *La compensación primaria de los trastornos metabólicos se consigue rápidamente mediante el control respiratorio de CO2, mientras que la compensación primaria de trastornos respiratorios se consigue más lentamente, pues los riñones excretan o absorben ácido y bicarbonato. Los trastornos ácido-base mixtos son frecuentes. 26 Capítulo 3 Gasometría y equilibrio ácido-base 6. ¿Cómo se calcula el grado de compensación? Véase la Tabla 3-3. TABLA 3 - 3 . C á l c u l o d e l g r a d o d e c o m p e n s a c i ó n * Trastorno primario Regla Acidosis respiratoria (aguda) El HCO3– aumenta 0,1 × (PaCO2 – 40) Acidosis respiratoria (crónica) Alcalosis respiratoria (aguda) El pH disminuye 0,008 × (PaCO2 – 40) El HCO3– aumenta 0,4 × (PaCO2 – 40) El HCO3– disminuye 0,2 × (40 – PaCO2) Alcalosis respiratoria (crónica) Acidosis metabólica Alcalosis metabólica El pH aumenta 0,008 × (40 – PaCO2) El HCO3– disminuye 0,4 × (40 – PaCO2) La PaCO2 disminuye de 1 a 1,5 × (24 – HCO3–) La PaCO2 aumenta de 0,25 a 1 × (HCO3– – 24) *Los mecanismos compensatorios nunca corrigen en exceso un desequilibrio ácido-base; cuando la gasometría arterial revela un aparente exceso de corrección, debe sospecharse la presencia de un trastorno mixto. Datos de Schrier RW: Renal and electrolyte disorders, ed 3, Boston, 1986, Little, Brown. 7. ¿Cuáles son las causas más frecuentes de trastornos ácido-base respiratorios? Alcalosis respiratoria: sepsis, hipoxemia, ansiedad, dolor y lesiones del sistema nervioso central. Acidosis respiratoria: fármacos (anestésicos residuales, paralizantes, benzodiazepinas, opiáceos), asma, enfisema, obesidad-hipoventilación, lesiones del sistema nervioso central (infección, infarto) y trastornos neuromusculares. 8. ¿Cuáles son los principales sistemas tampón del organismo? El bicarbonato, la albúmina, las proteínas intracelulares y el fosfato son los principales sistemas tampón. El sistema de bicarbonato extracelular es el que responde más rápidamente ante una variación del pH pero tiene menos capacidad total que los sistemas intracelulares, que representan entre un 60 y un 70% de los tampones químicos del organismo. Los iones hidrógeno están en equilibrio dinámico con todos los sistemas tampón del organismo. Las moléculas de CO2 también atraviesan fácilmente las membranas celulares y mantienen los sistemas tampón tanto intra como extracelulares en equilibrio dinámico. Además, el CO2 tiene la ventaja de que se elimina mediante la ventilación. 9. ¿Qué órganos desempeñan un papel importante en el equilibrio ácido-base? Los pulmones son el principal órgano implicado en la rápida regulación ácido-base. El CO 2 producido en la periferia es transportado al pulmón, donde la baja tensión de CO2 favorece la conversión de bicarbonato en CO2, que entonces es eliminado. El sistema regulador respiratorio puede aumentar y disminuir la ventilación por minuto para compensar los trastornos metabólicos ácido-base. Capítulo 3 Gasometría y equilibrio ácido-base 27 Intervienen en el control del equilibrio ácido-base eliminando los ácidos fijos y en la eliminación de los electrolitos, el bicarbonato, el amoníaco y el agua. El hígado interviene en múltiples reacciones que tienen como resultado la producción o el metabolismo de los ácidos. El tracto gastrointestinal secreta soluciones ácidas en el estómago y absorbe agua y otros electrolitos en el intestino delgado y grueso. Esto afecta notablemente al equilibrio ácidobase. 10. ¿Qué se entiende por pH? El pH es el logaritmo negativo de la concentración de iones hidrógeno ([H+]). El pH describe convenientemente el poder del hidrógeno. Normalmente la [H+] en el líquido extracelular es de 40 nmol/l, una cifra muy baja. Al calcular el logaritmo negativo de esta cifra se obtiene un pH de 7,4, una forma mucho más sencilla de describir la [H+]. El pH de una solución se determina por un electrodo de pH que mide la [H+]. 11. ¿Por qué es importante el pH? El pH es importante porque los iones hidrógeno reaccionan fuertemente con las proteínas celulares, alterando su función. Evitar la acidemia y la alcalemia mediante un control estricto de los iones hidrógeno es esencial para la función celular normal. Las desviaciones del pH normal indican que los procesos fisiológicos normales están alterados y deben determinarse y tratarse sus causas. © Elsevier. Fotocopiar sin autorización es un delito 12. Enumere las consecuencias más importantes de la acidemia. La acidemia grave se define como un pH sanguíneo <7,20 y se asocia con las siguientes consecuencias: Deterioro de la contractilidad cardíaca, gasto cardíaco y respuesta a las catecolaminas. Susceptibilidad para las arritmias recurrentes y disminución del umbral para la fibrilación ventricular. Vasodilatación arteriolar, con la consecuente hipotensión. Vasoconstricción de la vasculatura pulmonar, que conduce a un aumento de las resistencias vasculares pulmonares. Hiperventilación (como respuesta compensadora). Confusión, estupor y coma. Resistencia a la insulina. Inhibición de la glucólisis y de la síntesis de trifosfato de adenosina (ATP). Tanto la hiperpotasemia como los iones de potasio se desplazan extracelularmente. 13. Enumere las principales consecuencias de la alcalemia. La alcalemia grave se define como un pH sanguíneo >7,60 y se asocia con los siguientes efectos importantes: Aumento de la contractilidad cardíaca hasta que se llega a un pH >7,7, en que ya se observa una disminución. Arritmias ventriculares refractarias. Espasmo/vasoconstricción arterial coronaria. Vasodilatación de la vasculatura pulmonar, que conduce a una disminución de la resistencia vascular pulmonar. Hipoventilación, que puede frustrar los esfuerzos para destetar a los pacientes de la ventilación mecánica. 28 Capítulo 3 Gasometría y equilibrio ácido-base Vasoconstricción cerebral. Síntomas neurológicos, como cefalea, letargia, delirio, estupor, tetania, y convulsiones. Hipopotasemia, hipocalcemia, hipomagnesemia e hipofosfatemia. Estimulación de la glucólisis anaeróbica y de la producción de lactato. 14. ¿Tiene el mismo valor en la gasometría arterial el HCO3– que el valor de CO2? No. El HCO3– es un valor calculado, mientras que el CO2 es medido. Ya que el CO2 es medido, se cree que es una determinación del HCO3– más exacta. En la GSA el HCO3– se calcula empleando la fórmula de Henderson-Hasselbalch y los valores medidos de pH y PaCO2. Por el contrario, un panel químico informa del contenido de CO2 sérico medido (CO2), que es la suma del bicarbonato medido (HCO3–) y del ácido carbónico (H2CO3). El CO2 se considera una determinación precisa de HCO3– porque la concentración de HCO3– en sangre es alrededor de unas 20 veces mayor que la concentración de H2CO3, así que el H2CO3 es tan sólo un contribuyente menor al CO2 total medido. 15. ¿Qué es el déficit de base? ¿Cómo se determina? El DB o exceso de base (EB), que son sinónimos de un mismo concepto, es el número de mEq/l de base (o ácido) para recuperar un pH normal a 37 °C cuando la PaCO2 se mantiene constante a 40 mmHg, eliminando así el componente respiratorio. Por tanto, el EB representa solamente el componente metabólico de un trastorno ácido-base. El analizador de GSA calcula el EB desde un nomograma basado en las medidas de pH, HCO3– y el tampón no bicarbonato hemoglobina. Aunque el EB se determina en parte por el tampón no bicarbonato hemoglobina, esto es criticable, porque se calcula a partir del nomograma, y asume valores normales de otros tampones no bicarbonato, como la albúmina. Así, en el paciente hipoalbuminémico, el EB debería emplearse con precaución pues puede enmascarar una acidosis metabólica. 16. ¿Qué es el anión gap? El anión gap (AG) calcula la presencia de aniones no medidos. Los aniones orgánicos e inorgánicos sobrantes que no se miden fácilmente con pruebas normales se denominan aniones no medidos. El AG es una herramienta empleada para clasificar una acidosis metabólica como acidosis metabólica anión gap (AG elevado) o acidosis metabólica no anión gap (AG normal). Esta distinción delimita el diagnóstico diferencial. El AG es la diferencia entre los cationes y aniones séricos más importantes que se miden rutinariamente: AG = Na+ − (HCO3− + Cl−) Un valor normal es 12 mEq/l ± 4 mEq/l. Cuando existen aniones no medidos, se tampo­ nan mediante HCO3– , y, por tanto, disminuye la concentración de HCO3–. De acuerdo con la ecuación anterior, esta disminución del HCO3– aumentará el AG. Debe recordarse que la hipoalbuminemia tiene un efecto alcalinizante que disminuye el AG, lo que puede enmascarar una acidosis metabólica existente debido a los aniones no medidos. Este riesgo puede evitarse corrigiendo el AG cuando se evalúe la acidosis metabólica en un paciente hipoalbuminémico: AG corregido = AG observado + 2,5 × (albúmina normal − albúmina observada) Capítulo 3 Gasometría y equilibrio ácido-base 29 P U N TOS CLAVE: PRINCIPALES CAUSAS D E U N A A C I DOSIS M ETAB ÓLICA S IN ANIÓN GAP A U M E N T A D O La acidosis metabólica sin AG aumentado se produce por la pérdida de Na+ y K+ o la acumulación de Cl–. El resultado de estos procesos es una disminución de HCO3– : La administración iatrogénica de soluciones hiperclorémicas (acidosis metabólica hiperclorémica). Pérdidas alcalinas gastrointestinales. Acidosis tubular renal. Derivación del uréter a través del conducto ileal. Trastornos endocrinos. 17. Enumere las causas frecuentes de alcalosis metabólica. La alcalosis metabólica se produce habitualmente por vómitos, disminución de la volemia (diuréticos, deshidratación), administración de soluciones alcalinas y trastornos endocrinos. © Elsevier. Fotocopiar sin autorización es un delito 18. Enumere las causas frecuentes de acidosis metabólica con anión gap elevado y no elevado. Una acidosis metabólica sin AG elevado está causada por la administración iatrogénica de soluciones hiperclorémicas (acidosis metabólica hiperclorémica), pérdidas alcalinas gastrointestinales, acidosis tubular renal (ATR) o derivación del uréter a través del conducto ileal. Una administración excesiva de suero fisiológico es causa de acidosis metabólica hiperclorémica. Una acidosis metabólica con AG elevado está causada por la acumulación de ácido láctico o cuerpos cetónicos, intoxicación por toxinas (p. ej., etanol, metanol, salicilatos, etilenglicol, propilenglicol) o uremia. 19. Describa un protocolo gradual para interpretar el equilibrio ácido-base. Compruebe el pH para determinar si existe acidemia o alcalemia. Si el paciente respira de forma espontánea, utilice las siguientes reglas: Si la PCO está aumentada y el pH es <7,35, es muy probable que el trastorno primario sea 2 una acidosis respiratoria. Si la PCO está disminuida y el pH >7,40, es muy probable que el trastorno primario sea 2 una alcalosis respiratoria. Si el trastorno primario es respiratorio, determine si es agudo o crónico. Si la PCO está aumentada y el pH es >7,40, es muy probable que el trastorno primario sea 2 una alcalosis metabólica con compensación respiratoria. Si la PCO está disminuida y el pH es <7,35, es muy probable que el trastorno primario sea 2 una acidosis metabólica con compensación respiratoria. También pueden observarse trastornos metabólicos analizando el EB o DB. Si existe una acidosis metabólica, calcule el AG y determine si la acidosis tiene aumentado o no el AG, recordándose de realizar la corrección para la hipoalbuminemia. Si el paciente recibe ventilación mecánica o el trastorno ácido-base no se explica bien, compruebe los electrolitos y la albúmina y considere calcular la DIF. También tenga en cuenta el contexto clínico del trastorno ácido-base (p. ej., administración iatrogénica de líquidos, transfusión masiva, insuficiencia renal, insuficiencia hepática, diarrea, vómitos, aspiración por sonda gástrica, ingestión de toxinas). Esto puede requerir pruebas adicionales, como la determinación de los electrolitos en orina y suero y la osmolalidad urinaria, e identificar las toxinas ingeridas. 30 Capítulo 3 Gasometría y equilibrio ácido-base Bibliografía Recomendada 1. Casaletto JJ: Differential diagnosis of metabolic acidosis. Emerg Med Clin North Am 23:771–787, 2005. 2. Corey HE: Stewart and beyond: new models of acid-base balance. Kidney Int 64:777–787, 2003. 3. Kraut JA, Madias NE: Serum anion gap: its uses and limitations in clinical medicine. Clin J Am Soc Nephrol 2:162–174, 2007. 4. Morris CG, Low J: Metabolic acidosis in the critically ill. Part 1. Classification and pathophysiology. Anaesthesia 63:294–301, 2008. 5. Morris CG, Low J: Metabolic acidosis in the critically ill. Part 2. Cause and treatment. Anaesthesia 63:396–411, 2008. James Duke, MD, MBA Capítulo 4 Líquidos, regulación de la volemia y alteraciones hidroelectrolíticas 1. Describa los diferentes compartimentos funcionales del agua corporal, tomando como modelo un paciente de 70 kg. Las estimaciones exactas son difíciles porque el peso corporal ideal (PCI) se emplea habitualmente como base de cálculo. La obesidad es habitual en nuestra sociedad, lo cual dificulta la exactitud de las estimaciones. Los compartimentos de agua corporal en un paciente con un PCI de 70 kg quedan reflejados en la Figura 4-1. Figura 4-1. Compartimentos de agua corporal en un paciente con un peso ideal de 70 kg. LEC, líquido extracelular; LI, líquido intersticial; LIC, líquido intracelular; VS, volumen sanguíneo. 2. Describa los movimientos de la distribución de líquido entre los compartimentos intravascular e intersticial. Los espacios de líquido intravascular e intersticial forman el líquido extracelular, y están en equilibrio dinámico, gobernado por las presiones hidrostática y oncótica. Bajo circunstancias normales, la presión hidrostática capilar produce un movimiento de salida de líquido, mientras que la presión oncótica capilar provoca reabsorción. La suma de las fuerzas conduce a una salida de líquido desde las arteriolas; sobre el 90% del líquido vuelve por las vénulas. El líquido sobrante es devuelto a la circulación a través del sistema linfático. 3. ¿Cómo se regulan el agua corporal y la tonicidad? La hormona antidiurética (ADH) es un mecanismo fundamental; circula libre en el plasma, tiene una vida media de unos 20 minutos, aproximadamente, y aumenta la producción de monofosfato de adenosina cíclica en los túbulos colectores distales del riñón. La permeabilidad tubular al agua aumenta, favoreciendo la conservación de agua y sodio y la producción de orina concentrada. Los estímulos para la liberación de ADH son: Los osmorreceptores hipotalámicos tienen un umbral osmótico de unos 289 mOsm/kg. Por encima de este nivel se estimula la liberación de ADH. © 2011. Elsevier España, S.L. Reservados todos los derechos 31 32 Capítulo 4 Líquidos, regulación de la volemia y alteraciones hidroelectrolíticas Las neuronas hipotalámicas del centro de la sed regulan el deseo consciente de agua, y se activan por incremento del sodio plasmático de 2 mEq/l, un aumento de la osmolalidad plasmática de 4 mOsm/l, y pérdida de potasio desde las neuronas del centro de la sed y angiotensina II. Los barorreceptores aórticos y receptores de estiramiento de la aurícula izquierda responden a la reducción de volumen y estimulan las neuronas hipotalámicas. 4. Comente la síntesis de hormona antiduirética. La ADH, o vasopresina, se sintetiza en los núcleos supraóptico y paraventricular del hipotálamo. Se transporta unida a proteínas en gránulos secretores por el tallo hipofisario hasta la glándula hipofisaria posterior (neurohipófisis). Aquí es almacenada y liberada en los capilares de la neurohipófisis en respuesta a los estímulos desde el hipotálamo. Las neuronas productoras de ADH reciben inervación eferente de osmorreceptores y barorreceptores. 5. Enumere las condiciones que estimulan y las que inhiben la liberación de hormona antidiurética. Véase la Tabla 4-1. TA B LA 4 - 1 . S i t u a c i o n e s q u e e s t i m u l a n o i n h i b e n l a l i b e r a c i ó n d e h o r m o n a a n t i d i u r é t i c a ( ADH ) Estados fisiológicos normales Estados fisiológicos anormales Fármacos Resultados Estimula la liberación de ADH Inhibe la liberación de ADH Hiperosmolalidad Hipovolemia Posición erecta Hipoosmolalidad Hipervolemia Posición supina Estimulación b-adrenérgica Dolor y estrés emocional Estimulación colinérgica Shock hemorrágico Hipertermia Presión intracraneal elevada Presión positiva de las vías aéreas Morfina Nicotina Barbitúricos Antidepresivos tricíclicos Clorpropamida Estimulación a-adrenérgica Oliguria, orina concentrada Poliuria, orina diluida Ingesta excesiva de agua Hipotermia Etanol Atropina Fenitoína Glucocorticoides Clorpromazina 6. ¿Qué es la diabetes insípida? La diabetes insípida (DI) es causada por el déficit de síntesis de ADH, alteración de la liberación de la ADH desde la neurohipófisis (DI central), o resistencia renal a la ADH (DI nefrogénica). El resultado es la excreción de importantes volúmenes de orina diluida, lo cual, si no se trata, conduce a deshidratación, hipernatremia e hiperosmolalidad sérica. La prueba habitual para la DI es la restricción cuidadosa de líquidos. La incapacidad para disminuir y concentrar la orina sugiere el diagnóstico, que puede confirmarse mediante la medición de la ADH plasmática. La Capítulo 4 Líquidos, regulación de la volemia y alteraciones hidroelectrolíticas 33 administración de vasopresina acuosa mide la respuesta del túbulo renal. Si la osmolalidad del plasma excede a la de la orina después de una restricción ligera de líquido, se debe sospechar el diagnóstico de DI. 7. Enumere las causas de diabetes insípida. Véase la Tabla 4-2. TA B LA 4 - 2 . C a u s a s d e d i a b e t e s i n s í p i d a ( DI ) Déficit de vasopresina (DI central) Familiar (autosómica dominante) Adquirida Idiopática Fracturas craneales basilares o craneofaciales Craneofaringioma, linfoma, metástasis Granuloma (sarcoidosis, histiocitosis) Infecciones del sistema nervioso central Síndrome de Sheehan, aneurisma cerebral, circulación extracorpórea Lesión cerebral hipóxica, muerte cerebral Falta de respuesta a la vasopresina (DI nefrogénica) Familiar (recesiva ligada a X) Adquirida Pielonefritis Obstrucción posrenal Enfermedad y rasgo de células falciformes Amiloidosis Hipopotasemia, hipercalcemia Sarcoidosis Litio © Elsevier. Fotocopiar sin autorización es un delito 8. Comente los tratamientos alternativos para la diabetes insípida. Las preparaciones disponibles de ADH son el tanato de pitresina en aceite, administrado cada 24-48 horas; la pitresina acuosa, 5-10 U por vía intravenosa o intramuscular, cada 4-6 horas; la desmopresina (DDAVP), 10-20 U intranasal cada 12-24 horas, o la vasopresina acuosa, 100-200 mU/h. La DI incompleta puede responder a diuréticos tiacidas o a clorpropamida (que potencia la ADH endógena). Dado que el paciente está perdiendo agua, la administración de soluciones isotónicas puede causar hipernatremia; además, el exceso de vasopresina puede provocar intoxicación por agua. Hay que medir la osmolalidad plasmática, además del gasto urinario y de su osmolalidad, cuando se infunde vasopresina. PUNTOS CLAVE: LÍQUIDOS Y REGULACIÓN DE LA VOLEMIA 1. La estimación del estado de la volemia requiere recopilar la máxima información clínica posible porque si se valora cualquier variable de forma aislada puede llevar a error. Siempre hay que buscar información de apoyo al diagnóstico. 2. Reponga las pérdidas de líquidos intraoperatorias con líquidos isotónicos. 3. El suero fisiológico normal, cuando se administra en grandes cantidades, produce una acidosis metabólica hiperclorémica; el déficit de base asociado puede llevar a concluir erróneamente que el paciente sigue estando hipovolémico. 4. La hipotensión es un síntoma tardío en casos de hipovolemia aguda porque el tono simpático aumentará el tono vascular para mantener el gasto cardíaco. 34 Capítulo 4 Líquidos, regulación de la volemia y alteraciones hidroelectrolíticas 9. Defina el síndrome de secreción inadecuada de vasopresina. ¿Cuál es su principal tratamiento? La hipotonicidad debida a una liberación no osmótica de ADH, lo que inhibe la excreción renal de agua, define clásicamente el síndrome de secreción inadecuada de vasopresina (SIADH). Se deben cumplir tres criterios para establecer el diagnóstico de SIADH: El paciente debe ser euvolémico o hipervolémico. La orina debe estar insuficientemente concentrada (osmolalidad plasmática <280 mOsm/kg, osmolalidad en orina >100 mOsm/kg). El funcionamiento renal, cardíaco, hepático, suprarrenal y tiroideo deben ser normales. La principal terapia para SIADH es la restricción de agua. El SIADH postoperatorio es, normalmente, un fenómeno pasajero, y se resuelve espontáneamente. El SIADH crónico requiere la administración de demeclociclina, que bloquea la resorción de agua mediada por ADH en los túbulos colectores del riñón. 10. ¿Qué trastornos producen síndrome de secreción inadecuada de vasopresina? Los trastornos del sistema nervioso central (SNC) son causas frecuentes, como la hipertensión intracraneal aguda, traumatismo, tumores, meningitis y hemorragia subaracnoidea. Las causas pulmonares también son habituales, como tuberculosis, neumonía, asma, bronquiectasias, hipoxemia, hipercapnia y ventilación con presión positiva. Los tumores malignos pueden liberar componentes ADH-like. La insuficiencia suprarrenal y el hipotiroidismo también se han asociado con SIADH. 11. ¿Qué es la aldosterona? ¿Qué estimula su liberación? ¿Qué función tiene? La aldosterona, un mineralocorticoide, es responsable del control exacto de la excreción de sodio. Una disminución en la presión arterial sistémica o renal, además de la hipovolemia o la hiponatremia, producen una liberación de la renina desde las células yuxtaglomerulares del riñón. La angiotensina, originada en el hígado, se convierte en angiotensina I por la renina. En el torrente sanguíneo, la angiotensina I se convierte en angiotensina II, y la zona glomerular de la corteza suprarrenal se estimula entonces por la liberación de aldosterona. Un efecto adicional de la angiotensina II es la vasoconstricción. La aldosterona actúa en los túbulos renales distales y en los ductos colectores corticales, promoviendo la retención de sodio. Además de la hiponatremia y la hipovolemia, los estímulos para la liberación de aldosterona son la hiperpotasemia, los niveles altos de hormona adrenocorticotropa (ACTH) y el estímulo quirúrgico. 12. Comente detalles asociados con la estimación del estado de la volemia en pacientes ambulatorios. Para la mayoría de los pacientes ambulatorios, el período de ayuno debería proporcionar una estimación aproximada del déficit de volumen. Los requerimientos metabólicos por hora de un paciente son, aproximadamente, de unos 4 ml/kg para los primeros 10 kg, 2 ml/kg para los siguientes 10 kg, y 1 ml/kg para el peso restante. El déficit verdadero puede ser menor que el calculado debido a una conservación renal de líquidos. Los factores que pueden provocar reducción del volumen intravascular son hipertensión crónica, empleo de diuréticos, diabetes mellitus, ingestión de alcohol y preparaciones de limpieza intestinal (se pueden perder 2-4 l). 13. Comente el estado de la volemia en pacientes agudos en estado crítico. Los pacientes en estado crítico agudo están, generalmente, hipovolémicos debido a sangrado, peritonitis, pancreatitis, sepsis, pérdidas gastrointestinales, traumatismos o reposición insuficiente de líquidos. Los signos físicos que sugieren que el líquido intravascular es bajo son sequedad de membranas mucosas, pérdida de la turgencia cutánea, tiempo de relleno capilar mayor a 2 segundos, hipotensión ortostática, taquicardia y oliguria (menos de 0,5 ml/h en adultos, menos de 1 ml/h en niños). Si se dispone de ellos, el catéter venoso central o (raramente) de arteria pulmonar pueden ayudar en el diagnóstico de hipovolemia. Las pruebas de laboratorio útiles para la valoración del estado del volumen son hemoglobina, hematocrito, electrolitos, nitrógeno ureico en sangre (BUN), creatinina, proteínas, y en orina, la osmolalidad, gravedad específica y concentración de sodio. Capítulo 4 Líquidos, regulación de la volemia y alteraciones hidroelectrolíticas 35 14. ¿Existen ventajas diferenciadas con el empleo de coloides para reanimar a un paciente? Los partidarios de los coloides afirman que, puesto que estas soluciones tienen una semivida en el espacio intravascular de 3 a 6 horas (mucho mayor que la de los cristaloides), son líquidos mejores para la reanimación. Sin embargo, cuando se comparan con los cristaloides de forma controlada, no han demostrado mejorar los resultados. Es más, en los casos en que aumenta la permeabilidad capilar (p. ej., quemaduras, sepsis, traumatismos), los coloides se acumulan extracelularmente, atrayendo consigo otros líquidos a causa del gradiente osmótico, lo que provoca un edema extracelular. Por último, las soluciones coloides son más caras. Si bien solamente entre un tercio y un cuarto de cada litro de cristaloide permanece en el espacio intravascular, si se administran en cantidades suficientes (para reponer las pérdidas en una relación de 3-4 a 1), los cristaloides son líquidos excelentes para la reanimación. Debe destacarse que los pacientes deshidratados sufren pérdidas de líquidos tanto en el compartimento intracelular como en el extracelular y los cristaloides repondrán ambos compartimentos. 15. Revise la composición de las soluciones cristaloides. La reanimación con líquidos en el quirófano se consigue con líquidos isotónicos, pues las pérdidas intraoperatorias incluyen tanto agua como sales. Así, sólo enumeraremos líquidos relativamente isotónicos. Los pacientes que requieren líquidos de reposición para el mantenimiento se tratan, generalmente, con líquidos hipotónicos, pues sus pérdidas son predominantemente agua libre, pero es poco común intraoperatoriamente. Aunque el suero fisiológico normal es el cristaloide preferido para diluir los concentrados de hematíes, en grandes cantidades provocarán una acidosis metabólica hiperclorémica, debido a la dilución de bicarbonato (Tabla 4-3). TA B LA 4 - 3 . S o l u c i o n e s c r i s ta l o i d e s e q u i l i b r a d a s m á s h a b i t u a l e s e n e l i n t r a o p e r at o r i o SF RL Plasmalyte Osmolalidad* Na Cl– K Ca2 308 273 294 154 120 140 154 109 98 4 5 3 Mg2 Lactato Acetato Gluconato 27 23 28 3 © Elsevier. Fotocopiar sin autorización es un delito RL, solución Ringer lactato; SF, suero fisiológico normal. *La osmolalidad se mide en mOsm/l; otras sustancias se miden en mEq/l. 16. Revise las soluciones coloidales disponibles. Existen dos preparaciones de albúmina, al 5 y al 25%. Los métodos de preparación eliminan la posibilidad de infección. La solución al 5% tiene una presión osmótica coloidal de unos 20 mmHg, que es la presión osmótica coloidal aproximada en circunstancias normales. La solución al 25% (también denominada albúmina pobre en sal) obviamente tiene una presión osmótica coloide el quíntuple que en la solución normal. Si se pierde el volumen intravascular y el volumen extracelular está muy expandido, este exceso de presión osmótica coloide atraerá líquido desde el intersticio hacia el espacio vascular. El almidón hidroxietilo en una solución al 6% (disuelto en suero fisiológico normal o en solución de Ringer lactato) es otra preparación coloidal. La preparación heterogénea contiene moléculas polimerizadas con pesos moleculares de entre 20.000 y 100.000 daltons. Es metabolizada por la amilasa, se acumula en el sistema reticuloendotelial y se excreta por vía renal. Aumenta el tiempo de tromboplastina parcial. Tiene efectos diluyentes en los factores de coagulación, y las moléculas de almidón pueden introducirse en el coágulo organizado de fibrina impidiendo así la coagulación. Se recomienda que no se administren más de 20 ml/kg. Se cree que la preparación disuelta en una solución de Ringer lactato tiene menos efectos sobre la coagulación, quizá debido a que es menos heterogénea en cuanto a la dispersión del peso molecular. No interfiere con las pruebas cruzadas. 36 Capítulo 4 Líquidos, regulación de la volemia y alteraciones hidroelectrolíticas Los dextranos son moléculas hidrosolubles de glucosa polimerizada. Se comercializan dos preparaciones (dextrano 40 y 70), y el peso molecular de las respectivas soluciones es 40 y 70 kilodaltons. Se han observado reacciones anafilácticas y anafilactoides e inhibición de la adhesión plaquetaria. Pueden interferir con las pruebas cruzadas (Tabla 4-4). TA B LA 4 - 4 . C o l o i d e s a d m i n i s t r a d o s h a b i t u a l m e n t e Coloide Riesgos y beneficios Albúmina (al 5 o 25%) Caro; reacciones alérgicas; cuestionar su uso ante la pérdida de integridad alveolar Constituido normalmente en SF o RL; administrar menos de 20 ml/kg para evitar efectos antiplaquetarios; excretado renalmente; aumenta la amilasa sérica Reacciones anafilácticas; interfiere con la función plaquetaria y con las pruebas cruzadas; eleva las transaminasas hepáticas Almidón Dextrano (40 o 70) RL, solución Ringer lactato; SF, suero fisiológico normal. 17. ¿Cuál es el rango normal para la osmolalidad sérica? Fuentes diferentes proporcionan distintos rangos, pero, en general, la osmolalidad sérica normal varía entre 285 y 305 mOsm/l. Una estimación rápida aproximada se obtiene al multiplicar por dos la concentración de sodio. Una estimación de la osmolalidad más exacta se puede obtener empleando la fórmula siguiente: 2 × [Na] + [glucosa]/18 + BUN/2,8 donde los valores en corchetes son las concentraciones de las sustancias (sodio en mEq/l, glucosa y BUN en g/l). 18. ¿Qué situaciones pueden ser apropiadas para administrar suero fisiológico hipertónico? El suero fisiológico hipertónico (normalmente, al 3%) se ha empleado con éxito en reconstrucciones de aorta y resecciones extensas de cáncer, para shock hipovolémico, corrección lenta de la hiponatremia crónica sintomática, resección transuretral del síndrome prostático (RTSP), presión intracraneal aumentada, y para reducir el edema periférico después de reanimaciones de líquido mayores. Se ha empleado en situaciones de combate y en pacientes traumáticos con tiempos de transporte prolongados (áreas rurales). Dicho esto, su uso aún no está muy extendido. 19. ¿Cómo se calcula la pérdida de líquido durante una intervención quirúrgica? Éste es un proceso poco preciso y es necesario recopilar la máxima información posible. Calcular el volumen en las botellas de los aspiradores y restar el volumen empleado para irrigar el campo quirúrgico permite evaluar la pérdida de sangre. Las gasas quirúrgicas pueden pesarse; una gasa grande de laparotomía puede contener más de 100 ml de sangre. La pérdida de sangre también puede estar oculta, empapando los paños quirúrgicos o derramándose al suelo. Medir el aspirado por la sonda gástrica. Las colecciones importantes de líquido peritoneal pueden necesitar reposición. Las pérdidas insensibles están asociadas con intervenciones intraabdominales en las que se exponen las vísceras abdominales, pero estas estimaciones pueden ser problemáticas, y las «recetas de cocina» no están basadas en la evidencia. Por ejemplo, sea sensato a la hora de reponer la diuresis; si al paciente se le han administrado 5 l de líquido de más, espere una diuresis abundante y no la reponga. 20. ¿Qué se entiende por pérdidas en el tercer espacio? ¿Cuáles son los efectos de dichas pérdidas? En determinadas condiciones médicas, como operaciones intraabdominales mayores, shock hemorrágico, quemaduras y sepsis, el paciente desarrolla necesidades de líquido que no se Capítulo 4 Líquidos, regulación de la volemia y alteraciones hidroelectrolíticas 37 explican por las pérdidas externas medibles. Las pérdidas son internas, un secuestro temporal del líquido intravascular en un tercer espacio poco útil, que puede no participar fácilmente en los intercambios dinámicos de líquido a nivel microcirculatorio. El volumen de esta pérdida interna es proporcional al grado de lesión, y su composición es similar a la del plasma o líquido intersticial. La creación del tercer espacio requiere infundir más líquidos para mantener el volumen intravascular, el gasto cardíaco adecuado y la perfusión, y los líquidos en el tercer espacio permanecerán allí hasta que el problema principal del paciente se haya resuelto. 21. ¿Qué cantidad de líquido es apropiado administrar durante una intervención quirúrgica? Como se ha mencionado anteriormente, existen muchas recetas de cocina para administrar líquidos intravenosos durante las intervenciones quirúrgicas. Muchas de estas recomendaciones tradicionales tienen pocas evidencias que las apoyen. Claramente es mejor administrar algún líquido que no hacerlo. Por ejemplo, las náuseas, los vómitos y la hipotensión ortostática son menos frecuentes en los pacientes sometidos a cirugía ambulatoria que reciben 1 o 2 l de líquidos intravenosos perioperatoriamente. Pero aún debe investigarse qué cantidad y en qué intervención. Cada paciente es diferente porque cada uno tiene distintos períodos de ayuno, gravedad de la enfermedad, contracción de la volemia y enfermedades concomitantes. Existe una evidencia sólida de que la restricción de líquidos es beneficiosa en los pacientes sometidos a toracotomía y resección pulmonar a causa de un posible edema pulmonar postoperatorio. De forma similar, los procedimientos neuroquirúrgicos y resecciones hepáticas programados requieren una administración prudente de líquidos. La viabilidad de los colgajos miocutáneos se ve alterada en casos de un edema excesivo. Investigaciones recientes han comparado protocolos liberales de administración de líquidos (considérense de 12 a 15 ml/kg/h o más) con protocolos restrictivos (considérense de 4 a 8 ml/ kg/h) en pacientes sometidos a resección intestinal. En el grupo con restricción de líquidos, las reducciones de un 20% en los valores iniciales de la presión arterial o una diuresis menor de 0,5 ml/kg/h se trataron mediante la administración de bolos repetidos de 250 ml de Ringer lactato. En el grupo con restricciones la hospitalización fue más corta, la función intestinal se restableció de forma más rápida y se produjeron menos complicaciones quirúrgicas. © Elsevier. Fotocopiar sin autorización es un delito 22. ¿Es la presión arterial un buen signo de hIpovolemia? La presión arterial no se ve afectada de forma significativa hasta que se ha perdido aproximadamente un 30% del volumen sanguíneo. Los mecanismos compensatorios precoces, como la vasoconstricción periférica y la taquicardia, pueden enmascarar pérdidas de volumen significativas. 23. ¿Qué signos clínicos apoyan el diagnóstico de hipervolemia? El paciente puede tener crepitantes en la auscultación pulmonar, secreciones espumosas en el tubo endotraqueal, membranas mucosas y conjuntiva edematosas (aunque la conjuntiva edematosa por sí sola no constituye el diagnóstico, especialmente cuando el paciente ha estado en prono), poliuria y edema periférico. Al igual que la hipovolemia, la hipervolemia se diagnostica mejor cuando se asocian varios signos, y no cuando está presente uno solo. P á gina w eb http://www.fluidtherapy.net Bibliografía Recomendada 1. Ellision DH, Berl T: The syndrome of inappropriate antidiuresis. N Engl J Med 356:2064–2072, 2007. 2. Growcott MPW, Mythen MG, Gan TJ: Perioperative fluid management and clinical outcomes in adults. Anesth Analg 100:1093–1106, 2005. 3. Nisanevich V, Felsenstein I, Almogy G, et al: Effect of intraoperative fluid management on outcome after intraabdominal surgery. Anesthesiology 103:25–32, 2005. Capítulo 5 Electrolitos James Duke, MD, MBA 1. ¿Cuál es la concentración normal de sodio? ¿Qué grado de hiponatremia es aceptable para proceder a una intervención electiva planeada? El nivel de sodio normal es de 135 a 145 mEq/l. Generalmente, un nivel de sodio de 130 mEq/l no debe hacer cancelar una intervención planeada siempre y cuando el paciente esté asintomático y la intervención no cause hiponatremia. Es importante investigar la causa de la hiponatremia tan pronto como ésta sea identificada. Si la investigación debe tener prioridad sobre la cirugía depende de la urgencia de la intervención y de la evaluación global del estado del paciente. 2. ¿Cómo se clasifica la hiponatremia? La hiponatremia puede producirse en presencia de hipotonicidad, tonicidad normal o hipertonicidad; así es importante medir la osmolalidad del suero para determinar la causa de la hipona- TA B LA 5 - 1 . C a u s a s d e h i p o n at r e m i a Contenido de sodio total Disminuido Normal Aumentado Tratamiento (tratar siempre el trastorno subyacente) Causas Diuréticos (incluyendo los diuréticos osmóticos); acidosis tubular renal; hipoaldosteronismo; nefropatías perdedoras de sal, vómitos; diarrea SIADH; hipotiroidismo; déficit de cortisol Insuficiencia cardíaca congestiva; cirrosis; síndrome nefrótico Reponer los déficits de líquido y sodio con suero fisiológico isotónico Restricción de agua Restricción de agua, diuréticos de asa SIADH, síndrome de secreción inadecuada de vasopresina. tremia. La evaluación del estado de la volemia también es importante para determinar la causa. Un exceso de agua corporal total es más habitual que una pérdida de sodio en un exceso de agua. La Tabla 5-1 resume las causas y el tratamiento de la hiponatremia. 3. ¿Cómo debe tratarse la hiponatremia aguda? La rapidez a la que la hiponatremia se desarrolla y la presencia de síntomas determinan la agresividad del tratamiento. Si la hiponatremia se ha desarrollado rápidamente, el paciente puede desarrollar náuseas, vómitos, alteraciones visuales, calambres musculares, debilidad, hipertensión, bradicardia, confusión, ansiedad, agitación, obnubilación o convulsiones; habitualmente el contenido de sodio sería menor de 125 mEq/l. La agresividad del tratamiento depende de la magnitud de los síntomas. 38 © 2011. Elsevier España, S.L. Reservados todos los derechos 39 Capítulo 5 Electrolitos En los casos más sencillos, la restricción de líquidos puede ser suficiente. La administración de diuréticos de asa también puede estar indicada. Los síntomas neurológicos graves requieren la administración cuidadosa de suero fisiológico hipertónico (3%). La dosis de suero fisiológico al 3% (513 mEq Na/l) se determina de la siguiente manera: Dosis (mEq) = (Peso en kg) × (140 − concentración de sodio medida en mEq/l) × 0,6 La corrección debe realizarse lentamente, midiendo repetidamente las concentraciones de sodio seriadas. Por debajo de 125 mEq/l, corregir a una velocidad de aproximadamente 1 mEq/l/h. Una vez se ha alcanzado la concentración de 125 mEq/l, disminuye la probabilidad de síntomas neurológicos graves continuos. Debe destacarse que una corrección agresiva puede dar lugar a una mielinólisis pontina central. Las convulsiones requieren la protección de la vía aérea, oxigenación, ventilación y quizá la administración de anticonvulsivos, aunque las convulsiones suelen ser autolimitadas. 4. ¿Existe un subgrupo de pacientes que tienden a presentar secuelas neurológicas residuales tras un episodio hiponatrémico? Las mujeres en edad reproductiva, y especialmente durante la menstruación, han demostrado tener un riesgo máximo de secuelas residuales. Puede existir una alteración de la capacidad adaptativa del cerebro asociada a los estrógenos cuando existe hiponatremia. 5. ¿Qué puede causar hiponatremia aguda en el quirófano? La administración de líquidos hipotónicos o la absorción de soluciones de irrigación bajas en sodio pueden provocar hiponatremia. Estas soluciones se emplean para facilitar la resección transuretral de próstata o para distender el útero durante las histeroscopias. Sin embargo, los líquidos isotónicos se emplean cada vez más en este contexto cuando se utiliza el bisturí eléctrico bipolar para la intervención. Así pues, la hiponatremia como consecuencia de estas intervenciones se observa cada vez con menos frecuencia. Sin embargo, algunos cirujanos pueden seguir prefiriendo el bisturí monopolar porque la resección es más rápida. En este caso se emplea un líquido de irrigación hipotónico para prevenir la dispersión de la corriente eléctrica, y en este contexto la hiponatremia es un riesgo. La causa más habitual de hiponatremia postoperatoria es el síndrome de secreción inadecuada de vasopresina y la posterior retención de agua. 6. Comente la hipernatremia y sus causas. La hipernatremia es menos frecuente que la hiponatremia y siempre se asocia con hipertonicidad. La hipernatremia puede asociarse a niveles bajos, normales o altos de contenido corporal total de sodio. Con frecuencia, la hipernatremia es el resultado de una disminución de la ingesta de agua libre, como sucede en el anciano o en el paciente debilitado con alteración de la sed o disminución de la ingesta oral. Otras causas son la falta de hormona antidiurética (diabetes insípida) y un exceso de ingesta de sodio (bien por vía parenteral o intravenosa como sucede con la administración de bicarbonato sódico o cloruro sódico al 3%). La Tabla 5-2 enumera las causas y tratamiento para cada categoría. 7. ¿Qué problemas causa la hipernatremia a los anestesiólogos? La hipernatremia se relaciona más habitualmente con déficit de líquidos, y la hipovolemia es un reto parea los anestesiólogos. Para mayor complicación, los déficits de líquidos deben corregirse lentamente, para evitar el edema celular. Generalmente, la cirugía programada debería retrasarse si los niveles de sodio sérico exceden los 150 mEq/l. La hipernatremia aumenta la concentración alveolar mínima. 8. Revise la hipopotasemia y sus causas. Un nivel sérico de potasio menor de 3,5 mEq/l define la hipopotasemia. La hipopotasemia puede ser el resultado de una pérdida corporal total de potasio (gastrointestinal y renal), desplazamientos Capítulo 5 Electrolitos 40 TA B LA 5 - 2 . C a u s a s d e h i p e r n at r e m i a Contenido de sodio total Causas Disminuido Diuresis osmótica; pérdidas insensibles aumentadas Normal Diabetes insípida (neurogénica, nefrogénica); diuréticos; insuficiencia renal Administración de Na en exceso (NaHCO3; ClNa al 3%); hiperaldosteronismo Aumentado Tratamiento (tratar siempre el trastorno subyacente) Primero, reponer el volumen intravascular con líquidos isotónicos; luego, corregir el Na con líquidos hipotónicos Corregir las pérdidas de agua con líquidos hipotónicos Corregir lentamente los déficits de líquido glucosado al 5%, diuréticos de asa transcelulares de potasio o una ingesta insuficiente. Los diuréticos con frecuencia causan hipopotasemia, al igual que las pérdidas gastrointestinales y la acidosis tubular renal. Los agonistas adrenérgicos b, la insulina y la alcalosis (respiratoria y metabólica) desplazan el potasio hacia el espacio intracelular. La hipopotasemia es frecuente en mujeres embarazadas que reciben tratamiento tocolítico o en pacientes que requieren soporte inotrópico ya que los agonistas b se emplean en ambos casos. © Elsevier. Fotocopiar sin autorización es un delito 9. ¿Cuáles son los riesgos de la hipopotasemia? La hipopotasemia produce alteraciones electrocardiográficas (depresión del segmento ST y de la onda T e inicio de ondas U) y arritmias cardíacas (a menudo extrasístoles ventriculares prematuros y fibrilación auricular). También altera la contractilidad cardíaca. Estas alteraciones cardíacas no suelen verse hasta que las concentraciones séricas de K disminuyen hasta 3 mEq/l. La hipopotasemia es especialmente preocupante en pacientes que toman digital o que presentan cardiopatía isquémica o arritmias preexistentes. La hipopotasemia debilita los músculos y los sensibiliza a los relajantes musculares. Pero no existen datos definitivos que sugieran que los pacientes sometidos a cirugía con concentraciones de potasio tan bajas como 2,6 mEq/l tienen resultados adversos. 10. Un paciente toma diuréticos y presenta un nivel de potasio de 3 mEq/l. ¿Por qué no se administra al paciente suficiente potasio para restaurar el nivel sérico normal? El déficit corporal total de potasio, un catión principalmente intracelular, no se refleja en las concentraciones séricas. Un paciente con una concentración sérica de potasio de 3 mEq/l puede tener un déficit corporal total de potasio de 100 a 200 mEq. Los intentos rápidos por corregir la hipopotasemia no resuelven el problema y pueden ocasionar una parada cardíaca. Los pacientes con hipopotasemia que no presentan los factores de riesgo descritos anteriormente, que no van a ser sometidos a intervenciones torácicas mayores, vasculares o cardíacas pueden tolerar una hipopotasemia moderada (con seguridad de 3 y posiblemente tan baja como 2,8 mEq/l). 11. Si se administra potasio, ¿qué cantidad debe administrarse y a qué velocidad? El potasio debe administrarse a una velocidad no superior a 0,5 a 1 mEq/l. Como medida de seguridad, no deben inyectarse más de 20 mEq de potasio, diluido en suero y administrado con una bomba de infusión controlada, conectado en el equipo intravenoso del paciente. 41 Capítulo 5 Electrolitos 12. Defina la hiperpotasemia y revise sus síntomas. La hiperpotasemia se define como una concentración sérica de potasio superior a 5,5 mEq/l. Puede producir una debilidad profunda. Entre las manifestaciones de la conducción cardíaca destacan el aumento de la automaticidad y la repolarización. Las ondas T presentan un pico y existe una prolongación del intervalo PR y QRS y un aumento del riesgo de arritmias ventriculares graves. 13. ¿Cuáles son algunas de las causas de la hiperpotasemia? La hiperpotasemia puede ser de etiología aguda o crónica y secundaria a un aumento de la ingesta, una reducción de la excreción o a desplazamientos intracelulares relacionados con el equilibrio ácido-base. La hiperpotasemia puede ser iatrogénica (p. ej., suplementos de potasio, fármacos que contienen potasio) y asociarse con transfusión masiva, acidosis metabólica e insuficiencia renal (aguda y crónica); también puede producirse después de un traumatismo masivo de tejidos o una rabdomiólisis. Los fármacos que pueden provocar hiperpotasemia son antagonistas y bloqueantes de los receptores de la angiotensina, diuréticos ahorradores de potasio (espironolactona y triamtereno) y succinilcolina. 14. Describa los patrones de la hiperpotasemia observada tras la administración de succinilcolina. Se produce una leve hiperpotasemia (un aumento aproximado de 0,5 mEq/l) tras la administración rutinaria de succinilcolina, pero los pacientes más sensibles pueden sufrir una hiperpotasemia potencialmente mortal. Ejemplos de dichos pacientes son aquellos con lesiones crónicas de la médula espinal o denervación, traumatismos craneoencefálicos y quemaduras importantes no curadas, y los pacientes que están inmovilizados (p. ej., pacientes en cuidados intensivos). Conozco el caso de un paciente, por lo demás sano, que sufrió una parada cardíaca hiperpotasémica tras la administración de succinilcolina. El único factor de riesgo que presentaba es que era un prisionero hospitalizado encadenado a la cama varios días. 15. Un paciente con insuficiencia renal crónica necesita una fístula arteriovenosa para hemodiálisis. El potasio medido es de 7 mEq/l. ¿Cuáles son los riesgos de una anestesia general? La hiperpotasemia >6 mEq/l debería corregirse antes de cualquier intervención electiva. Habitualmente el tratamiento es la diálisis. Siempre hay que sospechar una hiperpotasemia ante un paciente con insuficiencia renal que sufre una parada cardíaca. 16. ¿Cómo se trata la hiperpotasemia? El tratamiento urgente de la hiperpotasemia es triple. Tratar la cardiotoxicidad con cloruro de calcio intravenoso. El potasio puede desplazarse rápidamente al espacio intracelular mediante la hiperventilación, estimulación b-adrenérgica (p. ej., agonistas b en nebulización), bicarbonato de sodio e insulina (si se administra insulina, debería considerarse la suplementación con glucosa). La excreción de potasio requiere más tiempo pero se consigue con diuréticos, Kayexalato y diálisis. 17. ¿Cuáles son las principales causas y manifestaciones de la hipocalcemia? Las principales causas de la hipocalcemia son hipoparatiroidismo, hiperfosfatemia, deficiencia de vitamina D, malabsorción, transfusión sanguínea rápida (calcio quelado por citrato), pancreatitis, rabdomiólisis y embolismo graso. La hipocalcemia constituye un problema tras la tiroidectomía si no se deja tejido paratiroideo, y el paciente puede desarrollar espasmos laríngeos y estridor. Esto debe distinguirse de otras causas de estridor postoperatorio, como el hematoma de la herida y la lesión de los nervios laríngeos recurrentes. La hipocalcemia también afecta a la contractilidad cardíaca, provocando hipotensión, una complicación rara durante una transfusión masiva. Los pacientes también pueden padecer confusión. Capítulo 5 Electrolitos 42 P U N T OS CLAVE: ELECTROLITOS 1. La corrección rápida de las alteraciones electrolíticas puede ser tan peligrosa como la alteración electrolítica existente. 2. Las alteraciones electrolíticas no pueden corregirse sin tratar la causa subyacente. 3. La hiperpotasemia aguda es potencialmente mortal y se asociada con taquicardia y fibrilación ventriculares. Siempre debería sospecharse cuando se produce un colapso cardíaco tras la administración de succinilcolina o en pacientes con enfermedad renal crónica. 4. Cuando se han descartado otras causas, la hipotensión refractaria y persistente en pacientes traumatizados o gravemente enfermos puede deberse a hipocalcemia o hipomagnesemia. 18. ¿Cómo se trata la hipocalcemia? El tratamiento de la hipocalcemia aguda es directo: administrar cloruro cálcico. Para un mismo volumen de solución, proporciona más calcio que una preparación de gluconato. Recordar que siempre se ha de tratar la alteración primaria. 19. ¿Supone la hipomagnesemia un problema para el anestesiólogo? Se está identificando un aumento de la hipomagnesemia en pacientes graves, a menudo asociada a hipopotasemia e hipofosfatemia. Es habitual en pacientes alcohólicos. La hipopotasemia no puede corregirse a menos que la hipomagnesemia también se trate. Los pacientes hipomagnesémicos tienen un aumento de la susceptibilidad a los relajantes musculares y pueden presentar debilidad tras la cirugía e incluso insuficiencia respiratoria. También pueden presentar hipocontractilidad cardíaca y arritmias. Los pacientes traumatizados que reciben transfusiones sanguíneas masivas también pueden volverse hipomagnesémicos, y a estos pacientes deberían administrárseles cloruro de magnesio, de 1 a 2 g, si aparecen las arritmias o hipotensión refractaria. © Elsevier. Fotocopiar sin autorización es un delito 20. ¿Qué solución utilizada para la reanimación estándar se está identificando cada vez más como causa de hipercloremia? La hipercloremia se asocia con la administración masiva de suero fisiológico normal y con la acidosis metabólica debida a la dilución de bicarbonato sódico, y debería ser parte del diagnóstico diferencial de acidosis metabólica en este contexto. Además de en los traumatismos, se ha identificado durante cirugía aórtica o ginecológica, circulación extracorpórea y durante el tratamiento de la sepsis. Bibliografía Recomendada 1. Palmer BF: Approach to fluid and electrolyte disorders and acid-base problems, Prim Care Clin Pract 35:195–213, 2008. James Duke, MD, MBA Capítulo 6 Terapia transfusional 1. ¿De qué forma conocer el suministro de oxígeno afecta a la decisión de trans­ fundir? Una transfusión estaría indicada cuando el suministro de oxígeno cae por debajo de un nivel crítico (DO2crit) y no se satisfacen las necesidades del consumo de oxígeno (VO2). Recuerde que el DO2 es una función del gasto cardíaco (GC) y el contenido de oxígeno arterial (CaO2). El CaO2 es una función de la saturación del oxígeno arterial, la capacidad transportadora de oxígeno de la hemoglobina, la concentración de hemoglobina, y, para la cantidad de oxígeno disuelto en la sangre (no ligado a la hemoglobina), la presión parcial de oxígeno. Habitualmente el DO2 cuadruplica al VO2 (de 800 a 1.200 ml/min frente a 200 a 300 ml/min). Así pues, el cociente de extracción (O2ER = VO2/DO2) es del 20 al 30%. Siempre que el DO2 supere al VO2, el VO2 es «independiente del suministro». Sin embargo, por debajo del DO2crit el VO2 se convierte en «dependiente del suministro», y disminuye a medida que disminuye el DO2, creando una situación en la que los órganos finales presentan riesgo de isquemia. Llegados a este punto la transfusión está claramente indicada. 2. ¿En qué momento se alcanza el DO2crit? ¿Cuáles son los criterios indirectos de valoración del DO2crit? En un paciente euvolémico, el DO2crit no se alcanza hasta que la hemoglobina no disminuye hasta unos 3,5 g/dl. Esto también requiere que la función pulmonar esté intacta ya que la saturación de oxígeno de la hemoglobina debe ser completa y el oxígeno debe estar disuelto en sangre (no ligado a la hemoglobina). Debe destacarse que con este nivel de hemoglobina el oxígeno disuelto en sangre resulta el principal contribuyente (casi el 75%) del oxígeno suministrado. También debe mencionarse que el DO2crit se ve modificado por los requerimientos de oxígeno del paciente que sobrepasen el nivel basal (p. ej., estados catabólicos como sepsis, quemaduras) y la presencia de enfermedad en los órganos finales como arteriopatía coronaria. Dado que en las condiciones normales de un quirófano no se dispone de la medida de DO2crit, deben utilizarse otras variables para determinar si el paciente debe transfundirse. Entre éstas destacan la hipotensión, taquicardia, diuresis, presencia de acidosis láctica, signos de isquemia miocárdica (nueva depresión del segmento ST >0,1 mV, nueva elevación del segmento ST >0,2 mV, alteraciones ecocardiográficas en la motilidad regional de la pared), y baja saturación de oxígeno en sangre venosa mixta (<50%, requiere cateterismo de la arteria pulmonar para su determinación). 3. ¿Cuáles son las adaptaciones fisiológicas frente a una anemia normovolémica aguda? Durante la cirugía, las pérdidas de sangre agudas suelen reponerse con soluciones cristaloides y, si su volumen es alto, se produce una hemodilución normovolémica aguda. Los cambios compensatorios se traducen en una estimulación simpática, que conduce a taquicardia y aumento del GC. La disminución de la viscosidad reduce la poscarga, aumenta la precarga y mejora el flujo a nivel capilar. Puesto que el flujo capilar no es máximo en condiciones de reposo, el reclutamiento capilar también es un mecanismo adaptativo. Además se produce una redistribución de sangre a los tejidos que dependen del aporte de oxígeno (p. ej., corazón y cerebro) y aumenta la extracción de oxígeno. Es importante destacar que la extracción de oxígeno miocárdico es elevada en circunstancias normales, de forma que la reserva es menor. El cerebro tiene una mayor reserva de extracción © 2011. Elsevier España, S.L. Reservados todos los derechos 43 44 Capítulo 6 Terapia transfusional que el corazón. Así pues, el corazón depende más del aumento del flujo sanguíneo para aumentar el suministro de oxígeno; la importancia de todo ello es evidente en casos de arteriopatía coronaria. El fracaso de la anemia normovolémica aguda para suministrar oxígeno ante un exceso de consumo es otro argumento a favor de la transfusión de sangre. 4. Históricamente se utilizaba un nivel de hemoglobina de 10 g/dl (hematocrito de 30) como umbral para iniciar una transfusión. ¿Por qué ya no se acepta esta práctica? En pacientes con arteriopatía coronaria y signos de isquemia miocárdica, este nivel de hemoglobina podría ser adecuado. En el resto de situaciones se considera como un umbral liberal para la transfusión. Recuerde que en una situación normal, el DO2crit no se alcanza hasta que la hemoglobina no disminuye hasta 3,5 g/dl. A pesar de que ningún médico probablemente lleva a un paciente hasta este extremo (a menos que el paciente rechace la transfusión por motivos religiosos o similares), cuantas menos probabilidades existan de que una transfusión esté realmente indicada, más riesgo hay de que impacte de forma negativa en la relación riesgo/beneficio. También es interesante destacar que los hombres y las mujeres tienden a tratarse de forma igualitaria a la hora de decidir realizar una transfusión, a pesar de que las mujeres sanas son anémicas en relación a los hombres. Utilizar el mismo umbral de transfusión no parece racional. Por último, preocupa que una transfusión no aumente de forma sustancial el suministro de oxígeno (véase el comentario sobre las lesiones por almacenamiento de la sangre en la pregunta 8). Éstos son argumentos sólidos para revisar cuidadosamente las consideraciones a la hora de transfundir. 5. ¿Cuáles son los riesgos de la transfusión? Los riesgos son contagio de una enfermedad infecciosa a través de la transfusión, reacciones transfusionales y efectos inmunomoduladores de la transfusión. 6. ¿Qué enfermedades infecciosas pueden contraerse con una transfusión y cuán importante es ese riesgo? En la actualidad, el suministro de sangre es tan seguro como lo ha sido siempre, estimándose que el riesgo de contraer hepatitis o el virus de la inmunodeficiencia humana (VIH) en un país desarrollado es de 1 por cada 2,4 millones de unidades transfundidas. Las donaciones de sangre son sometidas a pruebas para detectar la hepatitis B (antígeno nuclear de la hepatitis B), la hepatitis C (anticuerpos frente a la hepatitis C), sífilis, VIH, virus linfotrópico humano de células T, virus del Nilo occidental y citomegalovirus. Dadas las mejoras en las pruebas de detección, la ventana entre donación y seroconversión es cada vez más estrecha. No obstante, existen nuevos riesgos infecciosos, como el contagio de enfermedades mediadas por priones (variante de la enfermedad de Creutzfeldt-Jakob [ECJv]), enfermedades parasitarias (enfermedad de Chagas, paludismo) y gripe aviar. Preocupa que el síndrome respiratorio agudo grave pueda diseminarse en última instancia a través de la transfusión. Los riesgos de transmisión de estas enfermedades varían en función de la localidad geográfica. Por ejemplo, el paludismo tiene un mayor riesgo en los países subdesarrollados (al igual que el VIH); el único caso conocido de contagio de la ECJv a través de una transfusión se ha dado en Reino Unido. Dado que las plaquetas se almacenan a una temperatura más elevada (de 20 a 22 °C) que los hematíes (4 °C) u otros derivados hemáticos, son los componentes sanguíneos que presentan un mayor riesgo de infección bacteriana. Sin embargo, las pruebas para detectar sepsis en unidades plaquetarias están mejorando y el riesgo, con toda probabilidad, disminuirá con el tiempo. 7. Revise las principales reacciones relacionadas con la transfusión. Las reacciones transfusionales hemolíticas causadas por incompatibilidad ABO son las producidas con más frecuencia por errores administrativos y la transfusión de una unidad errónea. Se considera que los errores de transfusión se producen con una frecuencia entre 1:14.000 y 1:18.000. La mayoría de las reacciones se producen durante o poco tiempo después de una transfusión. Entre las manifestaciones clínicas destacan: fiebre; escalofríos; dolor torácico, en hipocondrio y lumbar; hipotensión; náuseas; rubor; hemorragias difusas; oliguria o anuria, y hemoglobinuria. La anestesia general puede enmascarar algunas de las manifestaciones clínicas, y la hipotensión, la hemoglobinuria y la hemorragia difusa pueden ser los únicos signos. Debe destacarse que los signos de una reacción hemolítica grave Capítulo 6 Terapia transfusional 45 pueden pasar desapercibidos mientras el paciente está sometido a una anestesia general o pueden atribuirse a otra causa. Las reacciones anafilácticas están causadas por la unión de las IgE; se presentan con broncoespasmo, edema, enrojecimiento e hipotensión, y requieren tratamiento urgente con adrenalina, fluidoterapia, corticosteroides y antihistamínicos, y otros tratamientos indicados en función de la gravedad y progresión de los síntomas. Las reacciones febriles pueden ser un signo precoz de reacción transfusional hemolítica (pero pueden estar presentes otros síntomas) o de contaminación bacteriana de un derivado hemático. Las reacciones transfusionales no hemolíticas febriles suelen producirse en pacientes que han recibido transfusiones con anterioridad; cefaleas, náuseas y malestar son síntomas asociados. La reacción está causada por anticuerpos leucocitarios, y en estos pacientes están indicados los hematíes lavados de leucocitos. Los antipiréticos pueden reducir los síntomas si se administran antes de la transfusión; la meperidina puede reducir la gravedad de los escalofríos. La lesión pulmonar aguda asociada a la transfusión (LPAAT) es una de las tres primeras causas de muerte por transfusión, con una mortalidad del 50%. Una forma de edema pulmonar no cardiogénico, la LPAAT también es inmunomediada y suele detectarse entre 6 y 12 horas después de la transfusión. Entre los síntomas destacan hipoxia, disnea, fiebre y edema pulmonar; el tratamiento es sintomático. Las reacciones urticarias secundarias a la desgranulación de los mastocitos no requiere suspender la transfusión; pueden administrarse antihistamínicos. Estas reacciones transfusionales se comparan en la Tabla 6-1. TA B LA 6 - 1 . D i a g n ó s t i c o d i f e r e n c i a l d e l a l e s i ó n p u l m o n a r a g u d a asociada a transfusión* © Elsevier. Fotocopiar sin autorización es un delito Entidad diagnóstica Inicio Lesión pulmonar aguda asociada a transfusión Minutos a horas Reacción anafiláctica o anafilactoide Minutos a horas Contaminación bacteriana de derivados hemáticos Minutos Reacción transfusional hemolítica Minutos Signos y síntomas principales Características diferenciales Disnea, distrés respiratorio, hipoxemia, cianosis, edema pulmonar, fiebre, taquicardia Broncoespasmo, distrés respiratorio, hipotensión, cianosis, eritema y urticaria generalizados, edema de membranas mucosas Fiebre, rigidez, hipotensión y colapso vascular Edema pulmonar no cardiogénico, fiebre frecuente Fiebre, rigidez, hipotensión, hemoglobinuria, coagulación intravascular diseminada Eritema, urticaria y edema; hipotensión y broncoespasmo destacado Fiebre, rigidez y colapso vascular predominante; más frecuente con plaquetas Habitualmente con la transfusión de hematíes, hemólisis *Los síntomas pueden pasar desapercibidos durante una anestesia general; el diagnóstico diferencial debe incluir los problemas intraoperatorios habituales. (Con permiso de Boskkov LK: Transfusion-related acute lung injury and the ICU, Crit Care Clin 21:479-495, 2005.) 46 Capítulo 6 Terapia transfusional 8. ¿Cuál es el estándar actual para el período de almacenamiento de la sangre? ¿Qué es una lesión por almacenamiento de la sangre? Las leyes de la mayoría de países requieren que como mínimo el 70% de los hematíes transfundidos sobrevivan 24 horas cuando se conservan con CPDA-1 y 42 días si se añade AS-1 (Adsol) o AS-3 (Nutrice). Los cambios en la sangre almacenada que reducen la viabilidad postransfusional se conocen como lesiones por almacenamiento. Destacan la reducción en la deformabilidad de los hematíes; alteraciones en la adherencia de los hematíes; agotamiento de las reservas de trifosfato de adenosina; y la reducción del 2,3-difosfoglicerato (2,3-DPG) que disminuye la capacidad de la curva de disociación de la hemoglobina para desplazarse a la derecha, lo que aumenta la liberación de oxígeno periférico. Las citocinas proinflamatorias se acumulan e, incluso después de 2 semanas, tienen capacidad para sensibilizar de forma significativa a los neutrófilos provocando una respuesta inflamatoria exacerbada. 9. ¿Existen evidencias convincentes sobre el efecto perjudicial de una transfusión en la función inmunitaria? La mayoría de la evidencia sobre modulación inmunitaria e infección relacionada con la transfusión es de naturaleza retrospectiva y, por tanto, adolece la ausencia de control de las variables de confusión. No existe un número suficiente de estudios aleatorios y controlados que tengan una potencia suficiente, y los estudios que existen se han realizado en pacientes con enfermedades críticas, no en el ámbito perioperatorio (quizá con la excepción de los pacientes con derivación coronaria). Así pues, se está a la espera de las recomendaciones definitivas. No obstante, vale la pena comentar algunos puntos. El ensayo Transfusion Requirements in Critical Care tuvo una potencia suficiente para evaluar el impacto de la transfusión en el resultado de la evolución de los pacientes. Los grupos estudiados se dividieron en un grupo de transfusión restrictiva (umbral de hemoglobina de 7 g/dl, teniendo como objetivo una concentración de hemoglobina entre 7 y 9 g/dl) y un grupo de transfusión liberal (umbral de hemoglobina de 10 g/dl, teniendo como objetivo una concentración de hemoglobina de 10 a 12 g/dl). La mortalidad a los 30 días fue menor en el grupo de transfusión restrictiva, aunque no se alcanzó la significación estadística de p <0,05. Sin embargo, cuando se subdividieron los pacientes en grupos de grados de enfermedad aguda, los pacientes con enfermedad aguda del grupo restrictivo tenían una mortalidad mayor a los 30 días. Otros estudios prospectivos son menos convincentes en sus resultados, pues existen umbrales de transfusión solapados, y la población de pacientes difiere. Algunos estudios observacionales, aunque no todos, han hallado que el número de unidades transfundidas es un factor de riesgo independiente frente a la mortalidad y aumenta la duración de la hospitalización. En general debe decirse que aún no se ha dicho la última palabra sobre el impacto de la transfusión en la mortalidad. Hay que destacar que muchos países realizan actualmente de forma rutinaria la leucorreducción de la sangre del donante en vistas del impacto de la transfusión en la función inmunitaria del receptor. 10. Revise las características de la lesión pulmonar aguda asociada a la transfusión. Recientemente se ha identificado la LPAAT como la principal causa de muerte por transfusión en Estados Unidos. Se estima que 1 de cada 5.000 transfusiones provocará LPAAT. Todos los componentes de la sangre han causado LPAAT, incluso los concentrados de hematíes, las plaquetas de donantes aleatorios, las plaquetas de donantes únicos (aféresis), el plasma fresco congelado y el crioprecipitado. No obstante, la LPAAT se asocia más con los componentes celulares. Incluso la sangre autóloga ha provocado LPAAT, lo que indica que puede existir alguna lesión de almacenamiento que contribuya a su etiología. Si bien se ha demostrado que los anticuerpos del donante están presentes en muchas series de LPAAT, su presencia no es necesaria ni suficiente para provocar LPAAT. En la actualidad se cree que la LPAAT es multifactorial y un subtipo de lesión pulmonar aguda en dos fases. Debido a algunos procesos asociados, el receptor presenta una elevada concentración de mediadores inflamatorios (p. ej., citocinas), leucocitos sensibilizados y endotelio pulmonar. El derivado hemático administrado constituye la segunda fase, a través de la unión clásica antígeno-anticuerpo o los productos lipídicos u otras citocinas generadas durante el almacenamiento de los Capítulo 6 Terapia transfusional 47 derivados hemáticos. Los leucocitos sensibilizados son activados y liberan sustancias como superóxidos que lesionan el endotelio pulmonar. 11. ¿Qué procesos pueden predisponer a un paciente a la lesión pulmonar aguda asociada a la transfusión? Algunos de los procesos que se han asociado con la LPAAT son: sepsis, isquemia orgánica, transfusión masiva, circulación extracorpórea, tumores malignos, intervenciones quirúrgicas recientes, broncoaspiración de contenido gástrico, ahogamiento, neumonía, fracturas de huesos largos, quemaduras, contusión pulmonar y coagulación intravascular diseminada. Obviamente el paciente debe estar lo suficientemente grave como para requerir una transfusión. 12. Comente los criterios para diagnosticar la lesión pulmonar aguda asociada a la transfusión. Comienzo agudo: a menudo se produce transcurridas menos de 2 horas tras la transfusión, y habitualmente durante las primeras 6 horas. Presión de oclusión arterial pulmonar ≤18 mmHg o ausencia de evidencia clínica de sobrecarga auricular izquierda (es decir, el problema es un edema pulmonar no cardiogénico). Observación de infiltrados bilaterales en la radiografía torácica. Hipoxemia con un cociente PaO /FiO ≤300 mmHg independientemente del nivel de presión 2 2 positiva al final de la espiración, o saturación de oxígeno ≤90% en aire ambiente. Ausencia de lesión pulmonar aguda antes de la transfusión. © Elsevier. Fotocopiar sin autorización es un delito 13. ¿Qué tratamientos existen para la lesión pulmonar aguda asociada a la transfusión? Si el paciente sufre un deterioro de la oxigenación durante la transfusión, ésta debe suspenderse y el resto de la sangre a transfundir debe enviarse al laboratorio para su análisis. Obviamente también puede estar produciéndose otro tipo de lesión por transfusión además de la LPAAT. El tratamiento es sintomático, deben seguir tratándose otros problemas médicos del paciente (que pueden haber sido la causa desencadenante de la LPAAT) y continuarse con el tratamiento de soporte respiratorio enérgico. Si son necesarias transfusiones adicionales, es aconsejable utilizar derivados hemáticos que tengan una baja probabilidad de contener mediadores inflamatorios, como concentrados de hematíes leucorreducidos, unidades de menos de 14 días, hematíes lavados, o, en el caso de las plaquetas, unidades de aféresis de menos de 3 días. 14. Revise los genotipos ABO y Rh sanguíneo y los patrones de anticuerpos aso­ ciados. El grupo sanguíneo está determinado por dos alelos de tres tipos: O, A y B. A y B hacen referencia a antígenos en la superficie de los hematíes. Un individuo puede tener A o B, ambos A y B, o ninguno de ellos (sangre del grupo O). Si un individuo no tiene el antígeno del grupo A, con el tiempo formará anticuerpos anti-A (también conocidos como aglutininas). Un paciente con sangre del grupo AB tiene ambos antígenos y no formará aglutininas. Los individuos con sangre del grupo O no tienen antígeno y desarrollarán anticuerpos A y B (Tabla 6-2). Los anticuerpos son básicamente inmunoglobulinas IgM o IgG. Las reacciones hemolíticas agudas están causadas por la activación del complemento y la liberación de enzimas proteolíticas que digieren la membrana de los hematíes. Las personas con sangre del grupo O no tienen antígenos A ni B (aglutinógenos) en la superficie celular. Estas células no pueden ser aglutinadas por los anticuerpos (aglutininas) que puedan existir en la sangre del receptor de la transfusión. Así la sangre del grupo O se conoce como el donante universal de hematíes. Los pacientes con sangre del grupo AB tienen ambos tipos de antígenos (aglutinógenos) y, por tanto, no forman anticuerpos A o B (aglutininas). Puesto que no existen anticuerpos en el plasma, los pacientes del grupo AB son donantes universales de plasma. Existen seis antígenos habituales en el sistema Rh; la presencia del antígeno D se conoce habitualmente como Rh positivo. El sistema Rh del grupo sanguíneo es ligeramente diferente porque las aglutininas Rh no suelen formarse espontáneamente. Normalmente es necesaria una exposición masiva, como en el caso de una transfusión anterior, para estimular su formación. Un paciente Rh negativo puede recibir sangre Rh positivo en una situación de emergencia, aunque 48 Capítulo 6 Terapia transfusional TA B LA 6 - 2 . G r u p o s s a n g u í n e o s y s u s a n t í g e n o s y a n t i c u e r p o s constituyentes Genotipos sanguíneos Grupo sanguíneo Antígenos (aglutinógenos) Anticuerpos (aglutininas) OO OA o AA OB o BB AB O A B AB Ningunoa A B AyB Anti-A y anti-B Anti-B Anti-A Ningunob aLa ausencia de aglutinógenos hace del concentrado de hematíes del grupo O el donante universal de hematíes. bLa ausencia de aglutininas hace del plasma AB el donante universal de plasma. en algunos pacientes se formarán anticuerpos, y es posible que se produzca una reacción transfusional hemolítica, normalmente leve y retardada. Pero ahora el paciente está sensibilizado al Rh y puede presentar una reacción mucho más grave si se expone a sangre Rh positivo en una fecha posterior. 15. ¿Cuáles son las diferencias entre grupo sanguíneo, cribado de anticuerpos y prueba cruzada? La sangre del paciente se clasifica según el grupo ABO y el grupo Rh colocando los hematíes con reactivos comercializados anti-A y anti-B, y revierten el suero del paciente frente a las células reactivas A y B. Un cribado para anticuerpos supone colocar el suero del paciente con hematíes especialmente seleccionados que contienen todos los antígenos relevantes de los grupos sanguíneos. En una prueba cruzada, el suero del paciente también se incuba con una pequeña cantidad de hematíes de la unidad del posible donante para verificar la compatibilidad in vitro. Una prueba cruzada también detecta anticuerpos más selectivos (Tabla 6-3). TA B LA 6 - 3 . P r u e b a s c r u z a d a s y c o m pat i b i l i d a d Grado de cruzamiento Probabilidad de transfusión compatible ABO-Rh solamente ABO-Rh + cribado de anticuerpos ABO-Rh + pruebas cruzadas con cribado de anticuerpos 99,8% 99,94% 99,95% 16. ¿Qué grupo sanguíneo debería usarse en una situación de emergencia? Las transfusiones en situaciones de emergencia no disponen del tiempo suficiente para realizar pruebas cruzadas completas. Bajo estas circunstancias, la elección más rápida es utilizar sangre no cruzada del grupo O, Rh negativo (o Rh positivo en hombres). Si es necesario administrar más de dos unidades de sangre del grupo O a pacientes del grupo A o B, debido a los anticuerpos anti-A y anti-B en la sangre del grupo O, debería seguir administrándose sangre del grupo O hasta que el estudio completo de la sangre del paciente garantice que no se producirá la hemólisis de las células nativas del paciente. La siguiente elección sería sangre no cruzada de grupo específico, seguida de sangre parcialmente cruzada de grupo específico y finalmente, sangre totalmente cruzada. Capítulo 6 Terapia transfusional 49 17. ¿Cuáles son algunas de las complicaciones de una transfusión masiva de san­­ gre? La transfusión masiva se define por la administración de más de una volemia en varias horas. Las complicaciones son: Coagulopatía secundaria a trombocitopenia dilucional, falta de factores de coagulación lábiles V y VIII, y coagulación intravascular diseminada. Alteraciones metabólicas asociadas con la sangre almacenada en el banco, como hiperpotasemia, hipocalcemia (toxicidad por citrato), acidosis y alteraciones en la cesión de oxígeno debida a la reducción del 2,3-DPG. Hipotermia. Es interesante destacar que un metaanálisis (Rajagopalan et al, 2008) halló que una hipotermia leve (de 34 a 36 °C) aumenta la pérdida de sangre en un 16% y eleva el riesgo relativo de transfusión en un 22%. La hipotermia altera la función plaquetaria y las proteínas de la cascada de la coagulación. © Elsevier. Fotocopiar sin autorización es un delito 18. ¿Cómo debería tratarse una reacción transfusional grave en caso de sospecharse? Interrumpir inmediatamente la transfusión y retirar el equipo de transfusión de sangre. Avisar al banco de sangre, y enviar una muestra de sangre del receptor y del donante para realizar pruebas de compatibilidad. Tratar la hipotensión de forma enérgica con líquidos intravenosos y agentes presores. Mantener la diuresis con hidratación intravenosa. Se pueden emplear manitol y diuréticos de asa. La hemólisis masiva puede provocar hiperpotasemia. Monitorizar los niveles de potasio sérico y observar de forma continuada el electrocardiograma por posibles signos de hiperpotasemia. Puede producirse una coagulación intravascular diseminada. El mejor tratamiento es identificar y tratar la causa subyacente. Monitorizar los niveles de protrombina, tromboplastina parcial, fibrinógeno y dímero-d. Comprobar los niveles de hemoglobina en plasma y orina y verificar la hemólisis mediante pruebas de antiglobulina directa (Coombs), niveles de bilirrubina y haptoglobina en plasma. La disponibilidad de la tromboelastografía va en aumento y resulta muy útil para evaluar alteraciones de la coagulación. 19. ¿Qué alternativas existen a la transfusión de sangre de donante? Transfusión autóloga (recoger y reinfundir la propia sangre del paciente). Hay que destacar que solamente cerca de un 55% de las unidades predonadas son devueltas al paciente. El paciente programado para una transfusión autóloga sigue teniendo riesgo de errores administrativos e infección bacteriana. Asimismo se ha descrito el caso de un paciente que recibió una transfusión autóloga y desarrolló LPAAT. Empleo preoperatorio de eritropoyetina para estimular la producción de hematíes. La eritropoyetina estimula la producción de hematíes en 5 a 7 días y ha demostrado reducir el uso de sangre alogénica en pacientes con insuficiencia renal y anemia por enfermedad crónica y en casos de rechazo a la transfusión. Recuperar intraoperatoriamente y reinfundir la sangre perdida durante la cirugía. Hemodilución isovolémica intraoperatoria (la reducción del hematocrito o de la hemoglobina mediante extracción de sangre y reposición intravascular simultánea con cristaloides). Empleo de soluciones de hemoglobina. 20. ¿Cuáles son las limitaciones, ventajas e inconvenientes de las soluciones alter­ nativas de hemoglobina? Los beneficios de las alternativas a la transfusión de hematíes son la ausencia de antigenicidad, posible disponibilidad ilimitada, sin riesgo de transmisión de enfermedades, larga vida de conservación, y mejores propiedades reológicas. Se han desarrollado dos tipos de soluciones transportadoras de oxígeno: 50 Capítulo 6 Terapia transfusional Emulsiones de perfluorocarbono que tienen una elevada capacidad para disolver gases como el oxígeno. Transportadores de oxígeno basados en hemoglobina. Comentaremos estos últimos. Estos componentes se fabrican a partir de hemoglobina recombinante humana, sangre humana caducada o sangre bovina. Los componentes de la estroma de los hematíes se eliminan, y la molécula de hemoglobina se polimeriza o se encapsula en liposomas para evitar una rápida eliminación renal y nefrotoxicidad. Las soluciones de hemoglobina sin células tienen dos problemas importantes. En primer lugar, presenta una baja concentración de 2,3-DPG. La ausencia de 2,3-DPG desplaza a la izquierda la curva de disociación de la oxihemoglobina, la afinidad de la hemoglobina por el oxígeno aumenta y el oxígeno no puede ser liberado a nivel de los tejidos. En segundo lugar existen secuestradores de óxido nítrico que producen una vasoconstricción excesiva. La hipertensión pulmonar y la isquemia miocárdica son riesgos; de hecho, los casos publicados de muertes por infarto de miocardio han retrasado la aparición de estas soluciones para su empleo generalizado. Estas soluciones también provocan la activación plaquetaria, la liberación de mediadores proinflamatorios, metahemoglobinemia y, debido a su color, interfieren en las pruebas de laboratorio. P U N TOS CLAVE: TERAPIA TRANSFUSIONA L 1. No está establecido el nivel de hemoglobina/hematocrito al que está indicada la transfusión. La decisión debería ser individualizada según la situación clínica, teniendo en cuenta el estado de salud del paciente. 2. Si se requiere sangre en una emergencia, pueden emplearse concentrados de hematíes del grupo O y/o sangre de grupo específico. 3. Existen numerosas reacciones relacionadas con la transfusión, y es esencial la vigilancia mientras se administran bajo anestesia porque muchos de los signos y síntomas clásicos pueden pasar desapercibidos en un paciente bajo paños quirúrgicos y sometido a anestesia general. P á gina w e b American Society of Anesthesiologists http://www.asahq.org Bibliografía Recomendada 1. American Society of Anesthesiologists Task Force on Perioperative Blood Transfusións. Practice guidelines for perioperative blood transfusión and adjuvant therapies. Anesthesiology 105:198–208, 2006. 2. Hebert PC, Tinmouth A, Corwin H: Anemia and red cell transfusión in critically ill pacientes. Crit Care Med 31(Suppl):S672–S677, 2003. 3. Madjdpour C, Spahn DR: Allogenic red blood cell transfusións: efficiency, risks, alternatives and indications. Br J Anaesth 98:33–42, 2005. 4. Rajagopalan S, Mascha E, Na J, et al: The effects of mild perioperative hypothermia on blood loss and transfusión requirement. Anesthesiology 108:71–77, 2008. 5. Spahn DR, Kocian R: Artificial oxygen carriers: status in 2005. Curr Pharm Des 11:4099–4114, 2005. Jason P. Krutsch, MD Capítulo 7 Coagulación 1. ¿Cómo se puede identificar a un paciente con riesgo de sangrado? La valoración preoperatoria incluye historia clínica, exploración física y las pruebas de laboratorio adecuadas. Las preguntas sobre alteraciones y problemas de sangrado (p. ej., tendencia a tener hematomas grandes tras golpes mínimos, sangrado grave durante el cepillado de dientes) y sangrado tras operaciones quirúrgicas previas (p. ej., extracciones dentales, amigdalectomía) son importantes. Una cirugía previa sin transfusión sugiere la ausencia de trastornos hereditarios de la coagulación. Es necesario comentar la medicación para identificar fármacos con potencial anticoagulante (p. ej., los antiinflamatorios no esteroideos [AINE], fármacos antiplaquetarios y anticoagulantes). Los estudios de coagulación pueden confirmar una sospecha clínica de que el paciente tiene un trastorno de sangrado. No existe ninguna evidencia sobre el valor de los estudios de coagulación preoperatorios en pacientes asintomáticos. 2. ¿Qué procesos forman el mecanismo hemostático normal? Tres procesos interconectados garantizan que la sangre permanezca en estado líquido hasta que sucede la lesión vascular: hemostasia primaria, hemostasia secundaria y fibrinólisis. 3. Comente la hemostasia primaria. Segundos después de la lesión vascular, las plaquetas se activan y se adhieren a la capa de colágeno subendotelial del vaso denudado, a través de los receptores de glucoproteína; esta interacción se estabiliza con el factor von Willebrand (vWF). El colágeno y la adrenalina activan las fosfolipasas A y C en la membrana plasmática plaquetaria, provocando la producción de tromboxano A2 (TXA2) y desgranulación, respectivamente. El TXA2 es un vasoconstrictor potente que promueve la agregación plaquetaria. Los gránulos de la plaqueta contienen difosfato de adenosina (ADP), TXA2, vWF, factor V, fibrinógeno y fibronectina. El ADP altera la membrana de la glucoproteína IIb/IIIa, facilitando la unión de fibrinógeno a las plaquetas activadas. Así, se construye y refuerza un tapón de plaquetas. 4. Describa la hemostasia secundaria. La hemostasia secundaria supone la formación de un trombo de fibrina. La red de fibrina se une y fortalece el tapón de plaquetas. La fibrina puede formarse mediante dos vías (intrínseca y extrínseca), y supone la activación de precursores de la coagulación circulantes. Sea cual sea la vía que se active, la cascada de la coagulación acaba en la conversión de fibrinógeno a fibrina. 5. ¿Cuáles son las vías de coagulación intrínseca y extrínseca? Tradicionalmente, estas dos vías se consideraban mecanismos separados que surgen tras la formación de factor X activado (Figura 7-1). Esta rígida división ha perdido su validez absoluta porque interfieren muchos factores. Por ejemplo, el factor VIIa puede activar al factor IX, pero los factores IXa, Xa, trombina y XIIa pueden, a su vez, activar al factor VII. Este modelo clásico de dos vías, sin embargo, aún es útil para interpretar los estudios de coagulación in vitro. La vía intrínseca ocurre dentro del vaso sanguíneo, y se activa por la interacción entre el colágeno subendotelial y el factor XII circulante, quininógeno de alto peso molecular y precalicreína. El fosfolípido plaquetario (PF3) sirve como catalizador en esta vía. La vía extrínseca comienza con la liberación de tromboplastina tisular (factor III) desde las membranas de las células lesionadas. © 2011. Elsevier España, S.L. Reservados todos los derechos 51 52 Capítulo 7 Coagulación Figura 7-1. Cascada de la coagulación con las vías intrínseca y extrínseca. Los números romanos indican los diferentes factores de la coagulación. La letra «a» indica la forma activada. FT, factor tisular; HPME, heparina de peso molecular elevado; vWF, factor de von Willebrand. (De Griffin J, Arif S, Mufti A: Crash course: immunology and hematology, ed 2, St. Louis, 2004, Mosby.) 6. Explique la fibrinólisis. El sistema fibrinolítico se activa simultáneamente con la cascada de coagulación, y funciona para mantener la fluidez de la sangre durante la coagulación. También es útil para la lisis del trombo, una vez que comienza la reparación del tejido. Cuando se forma un trombo, el plasminógeno se incorpora y se convierte en plasmina mediante el activador de plasminógeno tisular (APT) y fragmentos del factor XII. Las células endoteliales liberan APT en respuesta a la trombina. La plasmina degrada la fibrina y el fibrinógeno en fragmentos pequeños. Estos productos de la degradación de fibrina poseen propiedades anticoagulantes, ya que compiten con el fibrinógeno por la trombina; se eliminan normalmente por el sistema monocitosmacrófagos. 7. ¿Por qué no se coagula la sangre en los tejidos sanos? La coagulación se limita al tejido lesionado mediante la localización de las plaquetas en el lugar de la lesión y el mantenimiento del flujo sanguíneo normal en las zonas no lesionadas. El sistema monocitos-macrófagos elimina factores de la coagulación activados en zonas de flujo sanguíneo normal. El endotelio vascular normal produce prostaciclina (prostaglandina I2), un vasodilatador potente que inhibe la activación plaquetaria y ayuda a limitar la hemostasia primaria a la zona Capítulo 7 Coagulación 53 lesionada. Además, la antitrombina III, las proteínas C y S y el inhibidor del factor tisular son inhibidores de la coagulación que están generalmente presentes en el plasma. La antitrombina III desactiva factores de coagulación circulantes (excepto el factor VIIa). La proteína C inactiva los factores Va y VIIIa; la proteína S aumenta la actividad de la proteína C. Finalmente, el inhibidor del factor tisular antagoniza al factor VIIa. 8. ¿Qué recuento plaquetario es aceptable en un preoperatorio? Un recuento plaquetario normal es de 150.000-440.000/mm3. La trombocitopenia se define por un recuento inferior a 150.000/mm3. El sangrado intraoperatorio puede ser grave con recuentos de 40.000-70.000/mm3, y el sangrado espontáneo se produce normalmente con recuentos inferiores a 20.000/mm3. El recuento plaquetario mínimo recomendado previo a una cirugía es de 75.000/mm3. Sin embargo, diferencias cualitativas en la función de las plaquetas hacen poco prudente confiar sólo en el recuento plaquetario. Los pacientes trombocitopénicos con destrucción acelerada pero producción activa de plaquetas tienen relativamente menos sangrado que los pacientes con trastornos hipoplásicos con un determinado número de plaquetas. La valoración de la función plaquetaria preoperatoria es más complicada por la falta de correlación entre el tiempo de sangrado, y cualquier otra prueba de la función plaquetaria, y un aumento en la tendencia a un sangrado intraoperatorio. Sin embargo, los tiempos de sangrado normal varían de 4 a 9 minutos, y un tiempo de sangrado superior a 1,5 veces el normal (>15 minutos) se considera significativamente anormal. © Elsevier. Fotocopiar sin autorización es un delito 9. Enumere las causas de anomalías plaquetarias. Trombocitopenia Dilución tras transfusión sanguínea masiva. Producción plaquetaria disminuida debido a infiltración maligna (p. ej., anemia aplásica, mieloma múltiple), fármacos (p. ej., quimioterapia, fármacos citotóxicos, etanol, hidroclorotiazida), exposición a radiaciones o depresión de la médula ósea tras infección viral. Destrucción periférica aumentada debida a hiperesplenismo, coagulación intravascular diseminada (CID), lesión extensa vascular y tisular tras quemaduras importantes, o mecanismos inmunitarios (p. ej., púrpura trombocitopénica idiopática, fármacos como la heparina, enfermedades autoinmunes). Trastornos cualitativos de las plaquetas Hereditarios (p. ej., enfermedad de von Willebrand). Adquiridos (uremia, cirrosis, fármacos [p. ej., ácido acetilsalicílico, AINE]). 10. ¿Cómo actúa el ácido acetilsalicílico como un anticoagulante? La hemostasia primaria se controla mediante un equilibrio entre las acciones opuestas de dos prostaglandinas, el TXA2 y la prostaciclina. Dependiendo de la dosis, los salicilatos producen un efecto diferente en la síntesis de prostaglandina en las plaquetas y en las células endoteliales vasculares. Las dosis bajas inhiben la ciclooxigenasa plaquetaria principalmente, impidiendo la producción de TXA2 e inhibiendo la agregación plaquetaria. El efecto comienza a las 2 horas tras la ingesta. Puesto que las plaquetas carecen de un núcleo celular y no pueden producir proteínas, el efecto dura la vida entera de la plaqueta (7-10 días). Los AINE tienen un efecto similar, pero más transitorio que el ácido acetilsalicílico, durando sólo 1-3 días tras el cese de su uso. 11. Comente las propiedades del factor VIII. El factor VIII es un complejo proteico de gran tamaño que fija dos factores no covalentes: el vWF (factor VIII:vWF) y el antígeno plasmático del factor VIIII. El factor VIII:vWF es necesario para la adhesión plaquetaria y la formación de un tapón hemostático a través de la regulación y la liberación del antígeno plasmático del factor VIII. En la enfermedad de von Willebrand existe una disminución de ambos, el antígeno plasmástico del factor VIII y el VIII:vWF. 54 Capítulo 7 Coagulación P U N T OS CLAVE: C OAGULA C IÓN 1. Un paciente ambulatorio con una diátesis hemorrágica suele identificarse a través de la historia médica (medicaciones incluidas) y la exploración física. Las pruebas de coagulación preoperatorias en pacientes asintomáticos son poco útiles. 2. In vivo, la coagulación se inicia principalmente por el contacto del factor VII con un tejido extravascular. 3. La diátesis hemorrágica intraoperatoria más habitual es la trombocitopenia dilucional. 4. El principal tratamiento de la CID consiste en tratar el proceso médico subyacente. 5. La tromboelastografía es una prueba dinámica de la coagulación y puede ser tan útil como todo el resto de pruebas combinadas. 12. ¿Cómo afecta el déficit de vitamina K a la coagulación? Cuatro factores de la coagulación (II, VII, IX y X) se sintetizan en el hígado. Cada factor sufre una carboxilación dependiente de la vitamina K para fijarse a la superficie del fosfolípido. Sin la vitamina K los factores se producen, pero no son funcionales. La vía extrínseca se afecta primero por el déficit de vitamina K, ya que el factor con la vida media más corta es el factor VII, que se encuentra sólo en la vía extrínseca. Con un déficit mayor, ambas vías, intrínseca y extrínseca, se verán afectadas. Los fármacos de tipo warfarina compiten con la vitamina K por los lugares de unión en el hepatocito. La administración de vitamina K subcutánea revierte el déficit funcional en 6-24 horas. Si existe un sangrado activo en cirugía de emergencia, el plasma fresco congelado (PFC) puede administrarse para una hemostasia inmediata. 13. ¿Cómo actúa la heparina como anticoagulante? La heparina es un mucopolisacárido polianiónico que acelera la interacción entre antitrombina III y las formas activadas de los factores II, X, XI, XII y XIII, neutralizando efectivamente cada uno de ellos. La vida media del efecto anticoagulante de la heparina es de unos 90 minutos en un paciente normotérmico. Los pacientes con niveles reducidos de antitrombina III son resistentes al efecto de la heparina. La heparina también puede afectar a la función y al número de plaquetas a través de un mecanismo mediado inmunológicamente. 14. Dé una descripción general de las diferentes pruebas de coagulación. La diferencia básica entre las vías intrínseca y extrínseca es la superficie fosfolípida en la que los factores de la coagulación interaccionan antes de entrar en la vía común. Tanto el fosfolípido plaquetario (vía intrínseca) como la tromboplastina tisular (vía extrínseca) pueden añadirse al plasma del paciente, y el tiempo necesario para la formación del coágulo puede medirse. Se requiere que haya menos del 30% de la actividad del factor normal para que las pruebas se vean afectadas. Las pruebas también se prolongan ante una concentración de fibrinógeno disminuida (<100 mg/dl) y disfibrinogenemias. El tiempo de tromboplastina parcial (TTP), el tiempo de tromboplastina parcial activado (TTPA) y el tiempo de coagulación activado (TCA) miden las vías intrínseca y común. 15. ¿Qué mide el tiempo de tromboplastina parcial? El TTP mide la capacidad de coagulación de todos los factores de la vía intrínseca y común, excepto el factor XIII. La tromboplastina parcial se sustituye por fosfolípido plaquetario y elimina la variabilidad plaquetaria. El TTP normal es de unos 40-100 segundos; más de 120 segundos es anormal. 16. Describa el tiempo de tromboplastina parcial activado. La activación máxima de los factores de contacto (XII y XI) elimina la extensa fase de activación por contacto natural y tiene unos resultados más constantes y reproducibles. Se añade un activador al tubo de ensayo antes de añadir la tromboplastina parcial. El TTPA normal es de 25-35 segundos. Capítulo 7 Coagulación 55 17. ¿Cómo se mide el tiempo de coagulación activado? Se añade sangre completa fresca (con fosfolípido plaquetario) al tubo de ensayo que ya contiene el activador. El TCA automatizado se emplea para monitorizar la terapia con heparina en el quirófano. El rango normal es de 90-120 segundos. 18. ¿Cuál es el tiempo de protrombina? El tiempo de protrombina (TP) mide las vías común y extrínseca. La tromboplastina plaquetaria se añade al plasma del paciente. La prueba varía en sensibilidad y respuesta a la terapia anticoagulante oral según se mida el TP en segundos o la razón (TPpaciente/TPnormal), donde «normal» es el valor de TP normal medio del sistema de prueba de laboratorio. El TP normal es de 10-12 segundos. 19. Explique la ratio internacional normalizada. La ratio internacional normalizada (INR) se introdujo para mejorar la estabilidad de la terapia anticoagulante oral. La INR se calcula como (TPpaciente/TPnormal-ISI), donde ISI es el índice de sensibilidad internacional asignado a la prueba. Los rangos terapéuticos recomendados para la terapia anticoagulante oral estándar y la terapia a altas dosis tienen valores de INR de 2-3 y 2,5-3,5, respectivamente. 20. ¿Cuáles son las indicaciones para administrar plasma fresco congelado? Cuando se detecta sangrado microvascular y el TP o el TTP superan en 1,5 el valor control, debe considerarse administrar PFC. La dosis habitual es de 10 a 15 ml/kg. El PFC también revierte los efectos anticoagulantes de la warfarina (5 a 8 ml/kg). (La administración de vitamina K tendrá el mismo resultado pero tardará entre 6 y 12 horas en hacer efecto.) La reposición de la volemia no es una indicación para PFC. © Elsevier. Fotocopiar sin autorización es un delito 21. ¿Qué es un crioprecipitado? ¿Cuándo debería administrarse? El crioprecipitado es un precipitado blanco insoluble en frío que se forma cuando se descongela el PFC. Se obtiene mediante centrifugación, recongelado y descongelado inmediatamente antes de su uso. El crioprecipitado contiene factor VIII, vWF, fibrinógeno y factor XIII. Se emplea para sustituir al fibrinógeno, las deficiencias de factor VIII y las deficiencias de factor XIII. Se ha utilizado para tratar la enfermedad de von Willebrand (que no responde a la desmopresina) y la hemofilia. En la actualidad existe un concentrado de factor VIII purificado más apropiado para usar en estos problemas mencionados. Una unidad de crioprecipitado por 10 kg de peso corporal aumenta los niveles de fibrinógeno en 50 mg/dl. Dado que el crioprecipitado carece de factor V, también se necesita PFC para tratar la CID. 22. ¿Qué es la coagulación intravascular diseminada? La CID suele observarse en situaciones clínicas en las que las vías de la coagulación son activadas por los fosfolípidos circulantes, conduciendo a la síntesis de trombina, pero los mecanismos habituales para prevenir la formación de un trombo desequilibrado están afectados. El sistema fibrinolítico se activa y la plasmina empieza a participar en la conversión de fibrinógeno y fibrina en productos de degradación de la fibrina (PDF). La CID no es una enfermedad sino una complicación clínica de otros problemas: Complicaciones obstétricas (p. ej., embolismo del líquido amniótico, desprendimiento de placenta, síndrome de retención fetal, eclampsia, aborto inducido con suero fisiológico). Sepsis y viremia (p. ej., infecciones bacterianas, citomegalovirus, hepatitis, varicela, virus de la inmunodeficiencia humana [VIH]). Enfermedad neoplásica diseminada y leucemia. Reacciones transfusionales, lesiones por aplastamiento, necrosis tisular y quemaduras. Hepatopatía (p. ej., ictericia obstructiva, insuficiencia hepática aguda). 23. ¿Qué pruebas se utilizan para el diagnóstico de coagulación intravascular diseminada? No existe una prueba diagnóstica. A menudo, tanto el TP como el TTP están elevados y el recuento plaquetario disminuido. La hipofibrinogenemia es habitual. En el 85-100% de pacientes, los PDF están elevados. Una forma medida de PDF es el dímero-D. El dímero-D es un neoantígeno formado por la acción de la trombina en convertir fibrinógeno en fibrina. Es específico de los PDF formados a través de la digestión de fibrina por la plasmina. 56 Capítulo 7 Coagulación 24. Describa el tratamiento de la coagulación intravascular diseminada. La medida más importante es tratar la enfermedad subyacente. A menudo, los componentes sanguíneos específicos están reducidos y requieren su recuperación basada en las pruebas de coagulación. En ocasiones, si el sangrado persiste a pesar del tratamiento convencional, debería considerarse la terapia antifibrinolítica con ácido ε-aminocaproico, aunque sólo si el proceso de la coagulación intravascular está bajo control y la fibrinólisis residual continúa. 25. ¿Qué es el factor VIIa recombinante (NovoSeven)? El factor VIIa forma un complejo con el factor tisular para activar los factores IX y X. Consecuentemente, el factor Xa ayuda a la conversión de protrombina a trombina, lo que conduce a la activación del fibrinógeno en fibrina. Los efectos beneficiosos del factor recombinante VIIa se han demostrado en la hemofilia, trasplante de hígado, traumatismo mayor, hemorragia intracerebral, sangrado gastrointestinal, cirugía cardíaca y sangrado inducido por warfarina, cuando los tratamientos tradicionales para el paciente sangrante habían demostrado escasa o ninguna eficacia. 26. Comente los principios básicos de la tromboelastografía. La tromboelastografía (TEG) mide las propiedades de viscoelasticidad de la sangre, pues se induce el coágulo en un ambiente sin rozamiento parecido al flujo venoso, midiendo la fuerza y estabilidad del coágulo, incluyendo el tiempo de formación del coágulo inicial, la fase de aceleración, fuerza, retracción y lisis del coágulo. Se coloca una muestra de sangre completa activada por celite en una cubeta precalentada. Se hace descender un pistón suspendido en la cubeta y éste rota hacia atrás y hacia delante. El coágulo que se forma va transmitiendo su movimiento al pistón suspendido. El coágulo débil se reafirma y retrasa el arco de movimiento del pistón y esto se expresa gráficamente como una TEG estrecha. A la inversa, un coágulo fuerte moverá el pistón simultáneamente en proporción a los movimientos de la cubeta, produciendo una TEG gruesa. Figura 7-2. Patrón típico de tromboelastografía, valores normales de las variables y ejemplos de algunos trazados aberrantes. (De DeCastro M: Evaluation of the coagulation system. En Faust RJ, editor: Anesthesiology reviews, ed 3, New York, 2002, Churchill Livingstone, p 352.) Capítulo 7 Coagulación 57 27. Comente los parámetros medidos por tromboelastografía. Existen cinco parámetros en el gráfico de la TEG: R, K, ángulo alfa, MA y MA60 (Figura 7-2). R: período de tiempo desde el inicio de la prueba hasta la formación de fibrina inicial. k: tiempo desde el comienzo de la formación del coágulo hasta que la amplitud de la TEG alcanza 20 mm, que representa la dinámica de la formación del coágulo. Ángulo alfa: ángulo entre la línea del medio del trazado TEG y la línea tangencial al cuerpo de desarrollo del trazado, que representa la cinética de la fibrina. MA (amplitud máxima): refleja la fuerza del coágulo, que depende del número y función de las plaquetas y de su interacción con fibrina. MA60: mide el ritmo de reducción de la amplitud 60 minutos después de MA, y representa la estabilidad del coágulo. P á gina w eb http://www.ispub.com Bibliografía Recomendada 1. Drummond JC, Petrovitch CT: Hemostasis and hemotherapy. In Barash PG, Cullen BF, Stoelting RK, editors: Clinical anesthesia. ed 5, Philadelphia, Lippincott, Williams & Wilkins, 2006, pp 221–240. © Elsevier. Fotocopiar sin autorización es un delito 2. Wenker O, et al: Thrombelastography. The Internet Journal of Anesthesiology http://www.ispub.com. Capítulo 8 Manejo de LAS VÍAS AÉREAS James Duke, MD, MBA 1. Enumere las indicaciones para la intubación endotraqueal. Anestesia general, aunque existen alternativas a la intubación endotraqueal. Ventilación con presión positiva. Protección del tracto respiratorio ante la aspiración de contenido gástrico. Intervenciones quirúrgicas en las que el anestesiólogo no puede controlar fácilmente la vía aérea (p. ej., intervenciones en decúbito lateral, prono o sentado). La mayoría de las situaciones en las que se han administrado relajantes neuromusculares. Intervenciones quirúrgicas en tórax, abdomen o cráneo. Cuando debe tratarse la hipertensión intracraneal. Protección de un pulmón sano ante un pulmón enfermo para garantizar su función continuada (p. ej., hemoptisis, empiema, absceso pulmonar). Lesión pulmonar y multisistémica graves asociadas con insuficiencia respiratoria (p. ej., sepsis grave, obstrucción de la vía aérea, hipoxemia e hipercapnia de diferentes etiologías). 2. Comente las medidas objetivas que sugieren la necesidad de realizar una intuba­­ ción endotraqueal. Estas medidas objetivas suelen utilizarse en pacientes en unidades de cuidados intensivos, no necesariamente en el período perioperatorio. También son útiles para determinar qué pacientes no deben extubarse tras la cirugía. Frecuencia respiratoria >35 respiraciones/min. Capacidad vital <5 ml/kg en adultos y 10 ml/kg en niños. Incapacidad para generar una fuerza inspiratoria negativa de 20 mmHg. Presión parcial arterial de oxígeno (PaO ) <70 mmHg respirando 40% de oxígeno. 2 Gradiente alveolar-arterial (A-a) >350 mmHg respirando 100% de oxígeno. Presión parcial arterial de CO (PaCO ) >55 mmHg (excepto en retenedores crónicos). 2 2 Espacio muerto (Vd/Vt) >0,6. 3. ¿Qué información de la historia clínica puede ser útil para valorar la vía aérea del paciente? Se les debería preguntar a los pacientes sobre episodios adversos relacionados con previas ocasiones de manejo de la vía aérea. Por ejemplo, si han sido informados alguna vez por un anestesiólogo de que tienen un problema de manejo de la vía aérea (p. ej., «difícil de ventilar, difícil de intubar»). También, si han tenido alguna traqueostomía en otra cirugía o radiación de cuello y cara, si han sufrido quemaduras importantes en tales zonas o si tienen apnea obstructiva del sueño o disfunción de la articulación temporomandibular (ATM). Sería aconsejable revisar las gráficas de anestesias previas. 4. Describa la exploración física de la cavidad oral. Se exploran la boca y la cavidad oral marcando la extensión y la simetría de la abertura (tres traveses de dedos es óptimo), el estado de los dientes (que se muevan, que falten o rotos deberían documentarse), y la presencia de prótesis dentales. Unos dientes anteriores prominentes pueden interferir en el uso del laringoscopio. Se debe observar el tamaño de la lengua (una lengua grande rara vez hace el manejo de la vía aérea imposible, sólo más difícil), al igual que el arco del paladar (los paladares de arco alto se asocian con dificultad para visualizar la laringe). 58 © 2011. Elsevier España, S.L. Reservados todos los derechos Capítulo 8 Manejo de LAS VÍAS AÉREAS 59 5. Revise la clasificación de Mallampati. El aspecto de la faringe posterior puede predecir la dificultad de la laringoscopia y la visualización de la laringe. Se ha observado en varios metaanálisis que, cuando se usa sola, la prueba de Mallampati tiene una exactitud limitada para predecir la presencia de una vía aérea difícil y, por tanto, está claro que es necesaria una exploración exhaustiva de las vías aéreas, no simplemente la clasificación de Mallampati, para identificar a los pacientes que pueden presentar dificultades durante la intubación. Esta clasificación tampoco define la facilidad de la ventilación mediante mascarilla. Mallampati organizó a los pacientes en diferentes clases del I al IV basándose en las estructuras visualizadas (Figura 8-1). La visualización de menos estructuras anatómicas (especialmente clases III y IV) se relaciona con una exposición laríngea difícil. Con el paciente sentado erecto, la boca abierta totalmente y sacando la lengua, la clasificación se basa en la visualización de las siguientes estructuras: Clase I: son visibles los pilares faríngeos, todo el paladar y la úvula. Clase II: son visibles los pilares faríngeos y el paladar blando, con visualización de la úvula obstruida por la lengua. Clase III: el paladar blando es visible, pero no se ven ni los pilares faríngeos ni la úvula. Clase IV: sólo se ve el paladar duro, sin ver el paladar blando, los pilares ni la úvula. © Elsevier. Fotocopiar sin autorización es un delito Figura 8-1. Clasificación de la orofaringe según Mallampati. 6. ¿Cuál es el siguiente paso tras la exploración de la cavidad oral? Tras haber completado la exploración de la cavidad oral, dirigir la atención hacia el tamaño de la mandíbula y la calidad de la función de la ATM. Un cuerpo mandibular corto (tres traveses de dedo) medido desde el proceso mentoniano hasta la prominencia del cartílago tiroide (distancia tiromentoniana) sugiere dificultad para visualizar la laringe. Los pacientes con disfunción de la ATM pueden tener asimetría o limitaciones al abrir la boca, además de padecer subluxación al protruir la mandíbula. La manipulación de la mandíbula durante la preparación para la laringoscopia puede empeorar los síntomas postoperatorios. Curiosamente, algunos pacientes con disfunción de la ATM tienen más dificultad al abrir la boca tras la inducción anestésica y la parálisis neuromuscular que cuando están despiertos y cooperan. 7. Describa la exploración del cuello. Se debe anotar cualquier evidencia de cirugías previas (especialmente traqueotomía) o quemaduras significativas. ¿Tiene el paciente masas anómalas (p. ej., hematoma, abscesos, celulitis o edema, linfadenopatía, bocio, tumor, inflamación de los tejidos blandos) o desviación de la trá­­ quea? Un cuello corto o grueso puede ser problemático. Se ha descrito que una circunferencia del cuello mayor de 45,5 cm se asocia con una vía difícil. Los senos voluminosos (p. ej., en una parturienta) pueden dificultar el uso del laringoscopio, y se han desarrollado laringoscopios con mangos cortos teniendo esto en cuenta. 60 Capítulo 8 Manejo de LAS VÍAS AÉREAS También es importante hacer que el paciente muestre el grado de movilidad de la cabeza y el cuello. La preparación para la laringoscopia requiere la extensión del cuello para facilitar la visualización. Los pacientes mayores y los que tienen fusiones cervicales pueden tener una movilidad limitada. Además, los pacientes con enfermedad de la columna cervical (discopatía o inestabilidad cervical, como en la artritis reumatoide) pueden desarrollar síntomas neurológicos con la movilización del cuello. Las proyecciones radiológicas del cuello en flexión y extensión pueden revelar inestabilidad cervical en estos pacientes. Según mi experiencia, la evaluación preoperatoria del grado de movilidad en pacientes con cirugía previa de la columna cervical no se correlaciona bien con su movilidad después de ser anestesiados y paralizados, lo que indica que en este grupo de pacientes la cautela es la mejor política y deben considerarse, como se describirá más adelante, técnicas de vías aéreas avanzadas. Sobre todo en pacientes con patología de cabeza y cuello, como cáncer laríngeo, es importante conocer los resultados de nasolaringoscopias efectuadas por el otorrinolaringólogo. (Esto siempre es así en cirugía de oído, nariz y garganta: nunca hay que dar nada por sentado. Siempre hay que trabajar codo con codo con el cirujano y de forma anticipada para determinar cómo debe manejarse la vía aérea.) Por último, si los antecedentes sugieren obstrucción de la vía aérea dinámica (como en el caso de masas intra o extratorácicas), las pruebas de función pulmonar, incluyendo curvas de flujo-volumen, pueden alertar al clínico de la posible obstrucción de vía aérea una vez se han administrado los relajantes musculares. 8. Comente la anatomía de la laringe. La laringe, situada en los adultos en los niveles cervicales C4-C6, protege la entrada al tracto respiratorio y permite la fonación. Se compone de tres cartílagos únicos (tiroide, cricoide y epiglotis) y tres cartílagos emparejados (aritenoide, corniculado y cuneiforme). El cartílago tiroide es el mayor y el más prominente, y forma las paredes anterior y lateral. El cartílago cricoide tiene forma de anillo, se sitúa posteriormente, y es el único anillo cartilaginoso completo del árbol laringotraqueal. La membrana cricotiroidea conecta estas estructuras anteriormente. La epiglotis se extiende superiormente en la hipofaringe, y cubre la entrada de la laringe al tragar. Los pares de cartílagos corniculados y cuneiformes son relativamente pequeños y no aparecen prominentemente en el aspecto laringoscópico de la laringe o en su función. Los cartílagos aritenoides articulan la zona posterior de la laringe y son las uniones posteriores de los ligamentos vocales (o cuerdas). La identificación de los cartílagos aritenoides puede ser importante durante la laringoscopia. En un paciente con una vía aérea anterior, los aritenoides pueden ser las únicas estructuras visibles. Finalmente, las cuerdas vocales se unen anteriormente al cartílago tiroide. 9. Describa la inervación y el aporte sanguíneo a la laringe. Los nervios laríngeo superior y recurrente laríngeo, ambos ramas del nervio vago, inervan la laringe. Los nervios laríngeos superiores se dividen en ramas interna y externa. Las ramas internas proporcionan la inervación sensitiva de la laringe por encima de las cuerdas vocales, mientras que las ramas externas proporcionan la inervación motora al músculo cricotiroideo, un tensor de las cuerdas vocales. Los nervios laríngeos recurrentes proporcionan la inervación sensitiva por debajo del nivel de las cuerdas y la inervación motora de los músculos cricoaritenoideos posteriores, los únicos abductores de las cuerdas vocales. El glosofaríngeo o noveno nervio craneal proporciona la inervación sensitiva de la vallécula (espacio anterior a la epiglotis) y la base de la lengua. Las arterias que aportan sangre a la laringe incluyen la laríngea superior (rama de la arteria tiroidea superior) y la laríngea inferior (rama de la arteria tiroidea inferior). El drenaje venoso sigue el mismo patrón que las arterias; también existe un amplio drenaje linfático. 10. Resuma los diferentes instrumentos disponibles para facilitar la oxigenación. El aporte de oxígeno siempre es una prioridad cuando los pacientes están sedados o anestesiados. Los instrumentos varían de cánulas nasales a tiendas faciales, y mascarillas simples o mascarillas con reservorio y mascarillas que pueden emplearse para la ventilación con presión positiva. Su limitación es la concentración de oxígeno que pueden liberar eficazmente. Capítulo 8 Manejo de LAS VÍAS AÉREAS 61 11. Comente las ventajas de los tubos o cánulas oral y nasal que ayudan a mantener la vía aérea existente. Las cánulas orales están hechas normalmente de plástico duro; están disponibles en varios tamaños y tienen una forma para curvarse detrás de la lengua, levantándola de la faringe posterior. La utilidad de estos dispositivos sencillos no debe despreciarse, pues la lengua es la causa más frecuente de obstrucción de vía aérea, generalmente en pacientes sedados. Los tubos o cánulas nasales (trompetas) pueden introducirse por las fosas nasales hacia la nasofaringe, y se toleran mejor que las cánulas orofaríngeas en pacientes despiertos o ligeramente anestesiados. Sin embargo, la epistasis es un riesgo. 12. ¿Cómo se emplean los laringoscopios? Los laringoscopios son, generalmente, herramientas para manejar con la mano izquierda, diseñadas para facilitar la visualización de la laringe. Las palas cortas funcionan mejor para pacientes obesos, con tórax grandes o pechos grandes. Las palas del laringoscopio tienen diferentes diseños y tamaños. Las palas más usadas son la de Macintosh curvada y la de Miller recta. Las palas curvas se introducen en la vallécula, inmediatamente anteriores a la epiglotis, la cual es desplazada del eje visual para exponer la entrada laríngea. La pala de Miller se introduce hasta pasada la epiglotis, que simplemente se eleva permitiendo la visualización laríngea. 13. ¿Qué estructuras deben alinearse para lograr visualizar la laringe? Para visualizar directamente la laringe es necesario alinear los ejes oral, faríngeo y laríngeo. Con el objeto de facilitar este proceso, es necesario elevar la cabeza con una pequeña almohada y extender la cabeza en el eje atlanto-occipital (Figura 8-2). 14. ¿Qué es un GlideScope? Se han comentado diferentes palas de laringoscopio y no debe sorprender que se hayan desarrollado variaciones de mangos y palas para laringoscopios. El laringoscopio GlideScope Video Laryngoscope (Verathon, Inc., Bothell, WA) dispone de un mango de plástico rígido de una sola pieza con una pala curvada; en el extremo de la pala existe además de la luz una cámara. La imagen es transmitida a una pantalla portátil. Al utilizar el GlideScope no es necesario alinear los ejes comentados en la pregunta anterior. Así el paciente puede ser intubado fácilmente con el cuello en una posición neutra. Además, en los pacientes en quienes, con un laringoscopio convencional, la abertura laríngea queda anterior al eje visual, el GlideScope facilita la visualización de la laringe y la intubación endotraqueal. El GlideScope ha demostrado ser una incorporación excepcional en el arsenal para el manejo de las vías aéreas. P U N T OS CLAVE: MANEJ O DE LA S VÍA S AÉ R E A S © Elsevier. Fotocopiar sin autorización es un delito 1. Es de suma importancia realizar una exploración e identificación exhaustivas de los pacientes con posible situación de vía aérea difícil. 2. Siempre que sea posible debe evitarse el escenario ventilación difícil, intubación difícil. 3. Es necesario establecer un protocolo organizado, como refleja el American Society of Anesthesiologists’ Difficult Airway Algorithm, que facilite la atención de calidad en los pacientes con dificultades en el manejo de las vías aéreas. 15. ¿De qué tubos endotraqueales disponemos? Los tubos endotraqueales vienen en infinidad de tamaños y formas. Habitualmente se fabrican en cloruro de polivinilo, con una línea radiopaca de arriba a abajo; conexiones de tamaño estándar para los circuitos de anestesia o las bolsas de ventilación; manguito de alto volumen y baja presión y un balón piloto; y un orificio en la parte distal (ojo de Murphy). El diámetro interno varía de 2 a 10 mm en incrementos de medio milímetro. Los tubos endotraqueales pueden estar 62 Capítulo 8 Manejo de LAS VÍAS AÉREAS Figura 8-2. Representación esquemática de la posición de la cabeza para la intubación endotraqueal. A, una laringoscopia directa satisfactoria para la exposición de la abertura de la glotis requiere la alineación de los ejes oral, faríngeo y laríngeo. B, la elevación de la cabeza unos 10 cm colocando almohadas debajo del occipucio y con los hombros apoyados en la mesa permite alinear los ejes laríngeo y faríngeo. C, la subsiguiente extensión de la cabeza en la articulación atlanto-occipital crea la distancia más corta y la línea más recta desde el incisivo hasta la abertura de la glotis. (De Gal TJ: Airway management. En Miller RD: Miller’s anesthesia, ed 6, Philadelphia, 2005, Churchill Livingstone, p 1622.) Capítulo 8 Manejo de LAS VÍAS AÉREAS 63 reforzados con espiral de metal, diseñada para intervenciones con láser, o tener formas especiales para determinadas operaciones (tubos RAE orales o nasales). 16. ¿Qué son las mascarillas laríngeas? Las mascarillas laríngeas (ML) mantienen la vía aérea permeable durante la anestesia cuando no se necesita o no se desea una intubación endotraqueal (p. ej., pacientes asmáticos, cantantes). Las ML van sustituyendo poco a poco a los tubos endotraqueales. Son una parte importante del manejo de las vías aéreas difíciles y los pacientes pueden ser intubados a través de una ML bien colocada. 17. ¿De qué otros dispositivos disponemos? Las guías de transiluminación pueden ser útiles para la intubación a ciegas de la tráquea. La técnica se denomina a ciegas porque la abertura laríngea no visualiza directamente. Cuando se transilumina bien el cuello (el efecto «linterna»), el extremo del tubo endotraqueal está a la entrada de la laringe, y la guía puede retirarse del tubo, entrando en la tráquea de manera ciega. Las guías elásticas son flexibles, como estiletes maleables dirigidos anteriormente, con una punta doblada que puede ser útil para intubar una tráquea anterior al eje visual. La fibrobroncoscopia se usa habitualmente para facilitar las intubaciones difíciles y permitir la inserción del tubo endotraqueal bajo visualización directa. Finalmente la tráquea puede intubarse empleando una técnica retrógrada. En términos simples se introduce una guía larga tipo Seldinger a través de un catéter con el que se ha puncionado la membrana cricotiroideas. La guía se dirige hacia arriba y se saca a través de la nariz o la boca y el tubo endotraqueal se enhebra en la guía y se hace descender hasta la tráquea. 18. Comente las indicaciones de la intubación con el paciente despierto. Si la exploración física cuestiona la capacidad para ventilar e intubar una vez el paciente esté anestesiado y paralizado, debería plantearse una intubación con el paciente despierto. Los pacientes con antecedentes de intubación difícil, procesos agudos que comprometen la vía aérea (p. ej., infecciones de las tejidos blandos de cabeza y cuello, hematomas, fracturas mandibulares u otras deformidades faciales importantes), obesidad mórbida o cáncer que involucra a la laringe, son los candidatos apropiados para la intubación con el paciente despierto. © Elsevier. Fotocopiar sin autorización es un delito 19. ¿Cómo se prepara al paciente para una intubación despierto? Se requiere una franca conversación con el paciente, pues su seguridad es la prioridad. Se deben explicar claramente con antelación la dificultad del manejo de la vía aérea y los riesgos de proceder a la anestesia sin asegurar previamente una vía aérea permeable. A pesar de nuestros mejores esfuerzos para proporcionar anestesia tópica y sedación, el procedimiento es a veces molesto para el paciente, y esto se debe tener en cuenta. 20. ¿Cómo se realiza la intubación en un paciente despierto? La administración por vía intramuscular de glicopirrolato, 0,2-0,4 mg 30 minutos antes de la intervención, es útil para reducir las secreciones (como preparación para la intubación). Muchos clínicos administran también lidocaína nebulizada para proporcionar anestesia tópica de toda la vía aérea, aunque existen muchas técnicas para proporcionar anestesia de la vía aérea. Una vez que el paciente llega al quirófano, se aplica la monitorización anestésica estándar y se administra oxígeno complementario. Se seda al paciente con los agentes adecuados (p. ej., opiáceos, benzodiazepinas, propofol). El nivel de sedación se modula de forma que el paciente no quede confuso, apneico o incapaz de proteger la vía aérea (Tabla 8-1). La vía de la intubación puede ser oral o nasal, dependiendo de las necesidades quirúrgicas y de los factores del paciente. Si se planea una intubación nasal, la mucosa nasal y nasofaríngea debe ser anestesiada; deben emplearse sustancias vasoconstrictoras para prevenir la epistaxis. A menudo, se introducen suavemente cánulas nasales con ungüento de lidocaína para dilatar las fosas nasales. Se administra una inyección transtraqueal de lidocaína mediante la punción de la membrana cricotiroidea. También son útiles los bloqueos nerviosos para proporcionar anestesia tópica (véase la siguiente pregunta). 64 Capítulo 8 Manejo de LAS VÍAS AÉREAS TA B LA 8 - 1 . F á rm a c o s ú t i l e s pa r a l a i n t u b a c i ó n c o n e l pa c i e n t e d e s p i e r t o Fármaco Propósito Dosis Vía Glicopirrolato Midazolam Fentanilo Antisialagogo Sedación/amnesia Analgésico 0,2-0,4 mg 1-4 mg i.v. o i.m. i.v. i.v. Cocaína Anestesia tópica y vasoconstricción Vasoconstricción Anestesia tópica Fenilefrina al 1% Lidocaína viscosa al 2% Cetacaína en pulverizador Lidocaína al 1-4% 50-250 mg 40-160 mg Intranasal Pulverizador 5-20 ml Intranasal Oral Anestesia tópica 2-4 pulverizaciones Oral Anestesia de la vía aérea 2-3 ml Transtraqueal o bloqueo nervioso i.m., intramuscular; i.v., intravenosa. Una vez se ha alcanzado un nivel de sedación y anestesia tópica adecuado, se introduce el fibrobroncoscopio en el tubo endotraqueal. El fibrobroncoscopio se introduce suavemente por la vía elegida, se dirige hacia la epiglotis, a través de la laringe hasta la tráquea, visualizando los anillos traqueales y la carina. El tubo endotraqueal se introduce en la tráquea y se retira el fibrobroncoscopio. Se confirman los sonidos respiratorios y la capnografía, y comienza la anestesia general. 21. ¿Qué bloqueos nerviosos son útiles cuando se planea una intubación con el paciente despierto? El nervio glosofaríngeo, que proporciona la inervación sensitiva de la base de la lengua y la vallécula, puede bloquearse con la inyección transmucosa de anestésico local en la base de los pilares amigdalinos. El nervio laríngeo superior proporciona la inervación sensitiva de la laringe por encima de las cuerdas vocales y puede bloquearse mediante la inyección justo por debajo del cuerno mayor del hioides. Se debe aspirar cuidadosamente antes de la inyección, pues éste es territorio de la arteria carótida. Muchos clínicos son reacios a bloquear los nervios laríngeos superiores y a realizar un bloqueo transtraqueal en pacientes con el estómago lleno, pues se pierden todos los reflejos protectores de la vía aérea. Estos pacientes son incapaces de autoprotegerse de la aspiración si regurgitan contenido gástrico. 22. ¿Cuáles son los factores predictivos de la ventilación difícil con mascarilla? ¿Qué importancia tienen? Existe gran interés en la intubación y los factores predictivos de intubación difícil pero es necesario tener en cuenta que la capacidad para ventilar con mascarilla a un paciente tiene tanta o más importancia. Por ejemplo, si en el momento de la intubación se determina que quizá no sea posible intubar al paciente mediante un laringoscopio convencional, pero la saturación de oxígeno del paciente puede mantenerse mediante ventilación con mascarilla, la situación está bajo cierto control mientras se reúnen ayuda y herramientas adicionales para manejar la vía aérea. Sin embargo, si tenemos un paciente difícil de intubar y ventilar, la situación no está bajo control, y el paciente está en riesgo de lesión hipóxica. Entre un 1 y un 2% de los pacientes serán difíciles de ventilar. Los factores predictivos de una ventilación difícil con mascarilla son las limitaciones en la protrusión mandibular; distancia tiromentoniana menor de 6 cm; edad avanzada (mayor de 57 años en un estudio); anatomía alterada del cuello; apnea del sueño, ronquidos; índice de masa corporal ≥30 kg/m2; llevar barba. Una Capítulo 8 Manejo de LAS VÍAS AÉREAS 65 barba puede por sí misma dificultar la ventilación con mascarilla, pero también puede ocultar una distancia tiromentoniana corta. Algunos hombres pueden elegir dejarse barba porque ensancha la barbilla, que es otra forma de decir que tienen una distancia tiromentoniana corta. 23. Se ha anestesiado y relajado al paciente, pero la vía aérea es difíci de intubar. ¿Existe un algoritmo para manejar este problema? El paciente difícil de ventilar y de intubar es, posiblemente, el problema más importante con el que puede encontrarse un anestesiólogo porque la lesión cerebral hipóxica y la parada cardíaca son posibles en este contexto. Está establecido que los intentos fallidos por intubar se asocian con mortalidad. Aunque una historia y una exploración física completas pueden identificar a la mayoría de los pacientes con vías aéreas difíciles, ocasionalmente pueden presentarse problemas no previstos. Estas situaciones sólo se manejan óptimamente mediante algoritmos planeados y ensayados. La American Society of Anesthesiologists ha preparado un algoritmo de vía aérea difícil (Figura 8-3) para ayudar al clínico. Se consideran los beneficios relativos de las diferentes opciones de manejo (vía aérea quirúrgica frente a no quirúrgica, intubación despierta frente a intubación postinducción, ventilación espontánea frente a asistida). Una vez se han tomado estas decisiones se diseñan estrategias principales y alternativas para ayudar en un manejo escalonado. Este algoritmo merece un estudio repetido e intensivo antes de que el anestesiólogo intente enfrentarse a dichos problemas. No es hora de heroísmos; si la intubación o la ventilación son difíciles, pida ayuda. Siempre es juicioso considerar los beneficios de la anestesia regional para evitar una vía aérea que se sospecha o es difícil. Sin embargo, en los pacientes con vías aéreas difíciles, el uso de anestesia regional no releva al anestesiólogo de cierta planificación ante posibles dificultades. La muerte y las lesiones del sistema nervioso central siguen siendo la principal causa de resultados adversos en un contexto perioperatorio. Sin embargo, un análisis pormenorizado de las reclamaciones medicolegales ha puesto en evidencia que la incidencia de estas lesiones ha disminuido desde que se han introducido estos algoritmos y técnicas avanzadas de vías aéreas. © Elsevier. Fotocopiar sin autorización es un delito 24. Comente la técnica de la ventilación transtraqueal y sus limitaciones. La ventilación transtraqueal es una medida temporal si la ventilación con mascarilla es inapropiada. Se introduce un catéter (12 o 14G) a través de la membrana cricotiroidea y se conecta a un ventilador tipo jet (Sanders), capaz de liberar oxígeno bajo presión. El gas se libera de forma intermitente por un mecanismo manejado manualmente. La duración de la ventilación se estima mejor observando la subida y bajada del tórax: se recomienda una relación inspiratoria-espiratoria de 1:4 segundos. Normalmente, la oxigenación mejora rápidamente; sin embargo, los pacientes no pueden espirar totalmente con frecuencia, quizá por una obstrucción de la vía aérea, y pueden desarrollar presiones intratorácicas altas, poniendo al paciente en riesgo de barotrauma o gasto cardíaco disminuido. La retención de CO2 limita la duración de la utilidad de la técnica. 25. Defina los criterios para la extubación. El paciente debería estar despierto y responder, con constantes vitales estables. Se debe revertir el bloqueo neuromuscular cuando se haya demostrado la capacidad para mantener la cabeza levantada. En situaciones confusas, la fuerza inspiratoria negativa debe superar los 20 mmHg (véase la pregunta 2). 26. ¿Qué es la inducción de secuencia rápida? ¿Qué pacientes se manejan mejor con esta modalidad? Se aprecian mejor las características de una inducción de secuencia rápida (ISR) si la inducción de no secuencia rápida se entiende en primer lugar. Habitualmente el paciente ayuna durante 6 a 8 horas para evitar el riesgo de aspiración pulmonar del contenido gástrico. Se preoxigena al paciente y se le administra un agente anestésico de inducción. Una vez se ha establecido que el paciente puede ser ventilado de forma satisfactoria, se administra un relajante muscular. El paciente se ventila con mascarilla hasta que se comprueba la relajación completa mediante neuroestimulación. Entonces se llevan a cabo la laringoscopia y la intubación endotraqueal y se continúa con la anestesia. 66 Capítulo 8 Manejo de LAS VÍAS AÉREAS Figura 8-3. Manejo de la vía aérea difícil. ML, mascarilla laríngea. (De la American Society of Anesthesiologists.) Por el contrario, la ISR se realiza en pacientes que se cree pueden presentar riesgo de aspiración pulmonar del contenido gástrico. Los pacientes con el estómago lleno presentan este riesgo; otros factores de riesgo son: embarazo, diabetes, dolor, analgésicos opiáceos, traumatismo reciente, intoxicación y patología del tracto gastrointestinal como obstrucción del intestino delgado. Los pacientes con el estómago lleno deberían premedicarse con agentes que reducen la acidez y el volumen del contenido gástrico como los bloqueadores de los receptores histamina-2 (ranitidina, cimetidina), antiácidos no particulados (citrato sódico o Alka-Seltzer) y gastrocinéticos (metoclopramida). Capítulo 8 Manejo de LAS VÍAS AÉREAS 67 27. ¿Cómo se realiza una inducción de secuencia rápida? El objetivo de la ISR es asegurar y controlar la vía aérea rápidamente. Se preoxigena al paciente. Se administra un agente de inducción seguido rápidamente de un relajante de acción rápida, como succinilcolina o dosis altas de rocuronio. Simultáneamente un ayudante aplica presión en el cartílago cricoide (el único anillo cartilaginoso completo del tracto respiratorio), que cierra el esófago y previene la entrada de contenido gástrico regurgitado en la tráquea y los pulmones. Conocida como maniobra de Sellick, esta presión se mantiene hasta que la vía aérea se protege mediante intubación traqueal. 28. ¿Cuál es el objetivo de la preoxigenación antes de la inducción anestésica? La preoxigenación es una parte importante de toda anestesia general. El aire ambiente inspirado contiene aproximadamente un 21% de O2, siendo el resto nitrógeno (N2) en su mayor parte. Muy pocas personas pueden aguantar más de unos pocos minutos sin ventilar antes de que se produzca la desaturación. Si los pacientes respiran oxígeno al 100% durante varios minutos, pueden estar sin desaturar hasta 3 a 5 minutos, ya que la capacidad residual funcional (CRF) del pulmón ha sido lavada completamente de N2 y se ha llenado de O2. 29. Los anestesiólogos administran de forma rutinaria oxígeno al 100% durante unos minutos antes de la extubación. ¿Qué sentido tiene esta acción y por qué sería mejor una FiO2 del 80%? Los pacientes que salen de una anestesia general pueden presentar obstrucción de las vías aéreas o patrones respiratorios desorganizados. Un período de 5 minutos inspirando oxígeno al 100% es suficiente para llenar la CRF del paciente con oxígeno al 100%, estableciendo una reserva de oxígeno por si se produjese una obstrucción de las vías aéreas u otras dificultades respiratorias durante la extubación. Desgraciadamente, el oxígeno al 100% favorece la atelectasia, reduciendo la superficie disponible para el intercambio gaseoso y provocando cortocircuitos intrapulmonares. Si bien parece que una FiO2 de 0,8 previene la atelectasia, no está claro si el leve aumento en la atelectasia asociado con la respiración de oxígeno al 100% tiene importancia clínica. Hasta que esto se demuestre, lo más aconsejable es administrar oxígeno al 100% antes de la extubación. P á gi na w eb © Elsevier. Fotocopiar sin autorización es un delito http://www.asahq.org Bibliografía Recomendada 1. American Society of Anesthesiologists. Practice guidelines for management of the difficult airway: an updated report by the ASA Task Force on management of the difficult airway. Anesthesiology 98:1269–1277, 2003. 2. Kheterpal S, Han R, Tremper KK, et al: Incidence and predictors of difficult and impossible mask ventilation. Anesthesiology 105:885–891, 2006. 3. Peterson GM, et al: Management of the difficult airway: a closed claims analysis. Anesthesiology 103:33–39, 2005. Capítulo 9 Pruebas de función pulmonar James Duke, MD, MBA 1. ¿Qué son las pruebas de función pulmonar y cuál es su utilidad? El término de prueba de función pulmonar (PFP) se refiere a la medición estandarizada del flujo aéreo de un paciente (espirometría), volúmenes pulmonares y capacidad de difusión del monóxido de carbono (DLCO). Estos valores se expresan siempre en porcentajes de un valor normal esperado, que se calcula basándose en la edad y la altura del paciente. En combinación con la historia, la exploración física, la gasometría y la radiografía de tórax, las PFP facilitan la clasificación de una enfermedad respiratoria en obstructiva, restrictiva o trastorno mixto. 2. ¿Qué beneficio se obtiene de las pruebas de función pulmonar? El principal objetivo de una PFP preoperatoria, también llamada espirometría, es identificar a los pacientes con riesgo alto o prohibitivo de complicaciones pulmonares postoperatorias. Unas PFP anormales identifican a pacientes que no se beneficiarán de terapia pulmonar perioperatoria enérgica y aquellos en quienes la cirugía debería evitarse totalmente. Sin embargo, no existe una prueba única o combinación de pruebas que predigan definitivamente qué pacientes desarrollarán complicaciones pulmonares postoperatorias. 3. Además de las pruebas de función pulmonar anómalas, ¿cuáles son los factores de riesgo reconocidos para las complicaciones pulmonares postoperatorias? Los factores de riesgo para complicaciones pulmonares son: Edad >70 años. Obesidad. Cirugía torácica o abdominal alta. Historia de enfermedad pulmonar. Historia de fumador de más de 20 paquetes/año. Resección de masa mediastínica anterior. 4. ¿Qué factores deberían tenerse en cuenta para la interpretación de las pruebas de función pulmonar? Los valores de PFP esperados se basan en resultados de las pruebas de individuos sanos, y varían según la edad, la altura, el sexo y la raza. Por ejemplo, la capacidad vital y la capacidad pulmonar total son un 13-15% más bajas en los individuos de raza negra que en los caucásicos. Unas pruebas fiables requieren la cooperación del paciente y un técnico experto. 5. Describa los volúmenes pulmonares estándares. El volumen corriente (Vt) es el volumen de aire inhalado y exhalado con cada respiración normal. El volumen de reserva inspiratorio (VRI) es el máximo de volumen de aire que se puede inhalar tras un Vt normal. El volumen de reserva espiratorio (VRE) es el máximo volumen de aire que puede exhalarse tras un Vt normal. El volumen residual (VR) es el volumen de aire que permanece en el pulmón tras una espiración máxima (Figura 9-1). 6. ¿Cuáles son las capacidades pulmonares? Las capacidades pulmonares se componen de dos o más volúmenes pulmonares. La capacidad pulmonar total (CPT) es la suma de VRI, Vt, VRE y VR. La capacidad vital (CV) es la suma de VRI, Vt, y VRE. La capacidad inspiratoria (CI) es la suma de VRI y Vt. La capacidad residual funcional (CRF) es el volumen de aire en el pulmón al final de una espiración normal, y es la suma de VR y VRE (véase la Figura 9-1). 68 © 2011. Elsevier España, S.L. Reservados todos los derechos Capítulo 9 Pruebas de función pulmonar 69 Figura 9-1. Subdivisiones de los volúmenes y capacidades pulmonares. CI, capacidad inspiratoria; CPT, capacidad pulmonar total; CRF, capacidad residual funcional; CV, capacidad vital; VR, volumen residual; VRE, volumen de reserva espiratorio; VRI, volumen de reserva inspiratorio; Vt, volumen corriente. © Elsevier. Fotocopiar sin autorización es un delito 7. ¿Qué técnicas se emplean para determinar la capacidad residual funcional? La medición de la CRF es la piedra angular para determinar lo que queda de los volúmenes pulmonares. La CRF se puede medir con tres técnicas diferentes: Equilibrio/dilución de helio. Lavado de nitrógeno. Pletismografía corporal. La pletismografía es la más exacta para determinar la CRF en pacientes con enfermedad obstructiva de las vías respiratorias, y aplica la ley de Boyle, que establece que el nivel de gas en un espacio cerrado varía inversamente a la presión a la que está sometido. Todas las mediciones de la CRF, si se realizan de forma correcta, son independientes del esfuerzo del paciente. 8. ¿Qué información se obtiene de la espirometría? La espirometría es la base de las pruebas de función pulmonar, y proporciona medidas en el tiempo de los volúmenes pulmonares espirados (Figura 9-2). Con un equipo automático se pueden interpretar más de 15 medidas diferentes de una sola espirometría. La capacidad vital forzada (CVF), el volumen espiratorio forzado en 1 segundo (FEV1), el cociente FEV1/CVF y el flujo entre el 25 y el 75% de la CVF (MMF25-75) son los índices clínicos más útiles obtenidos de una espirometría. Aunque la espirometría demuestra las limitaciones del flujo de aire, no determina sus causas (p. ej., obstrucción de la vía aérea, retracción elástica alveolar disminuida, fuerza muscular disminuida). También depende del esfuerzo, y requiere que el paciente colabore. 9. ¿Qué es la capacidad de difusión en la prueba de respiración única para la capacidad de difusión del monóxido de carbono? La DLCO mide la velocidad de recaptación del gas no fisiológico, el monóxido de carbono (CO). El CO se emplea por su afinidad por la hemoglobina y porque refleja la capacidad de difusión de los gases fisiológicos oxígeno y CO2. La DLCO depende de la capacidad de difusión de la membrana y de la vascularización pulmonar, y por ello es una medida de las unidades funcionales alveolocapilares. Esta prueba se ha empleado como indicador de la idoneidad de la resección pulmonar, y es un factor predictivo de la morbilidad pulmonar postoperatoria. 10. ¿Qué estados patológicos causan una disminución de la capacidad de difusión del monóxido de carbono? Cualquier enfermedad que afecte a la unidad alveolocapilar puede provocar una disminución en la DLCO. Los tres tipos más importantes de trastornos pulmonares que causan una disminución de la DLCO son: 70 Capítulo 9 Pruebas de función pulmonar Figura 9-2. Espirograma. CPT, capacidad pulmonar total; CRF, capacidad residual funcional; CVF, capacidad vital forzada; FEV1, volumen espiratorio forzado en 1 segundo; FM, flujo máximo; MMF, flujo máximo medio; VR, volumen residual. Enfermedad obstructiva de la vía aérea. Enfermedad pulmonar intersticial. Vasculopatía pulmonar. 11. ¿Qué estados patológicos causan un aumento de la capacidad de difusión del monóxido de carbono? En general, las situaciones que causan un aumento relativo de la concentración de hemoglobina provocan un aumento de la DLCO. La insuficiencia cardíaca congestiva, el asma y la hemorragia pulmonar difusa son las causas más frecuentes de aumento de DLCO. Una membrana timpánica perforada puede causar una DLCO alta por artefacto, permitiendo una fuga de CO por una vía no pulmonar. 12. Comente las enfermedades respiratorias obstructivas y las alteraciones que causan en las pruebas de función pulmonar. Las enfermedades respiratorias obstructivas, como asma, bronquitis crónica, enfisema, fibrosis quística y bronquiolitis tienen un flujo aéreo espiratorio disminuido, e implican a las vías aéreas distales a la carina. El FEV1, el cociente FEV1/CVF y el flujo espiratorio forzado al 25-75% de la CVF (FEF25-75) están por debajo de los valores esperados. Una disminución de FEF25-75 refleja el colapso de las vías aéreas pequeñas, y es un indicador sensible de la obstrucción de la vía aérea en fases iniciales. La CVF puede estar normal o disminuida debido a la debilidad de los músculos respiratorios o a un colapso de las vías aéreas dinámicas con el consecuente atrapamiento de aire. En la Tabla 9-1 se comparan las alteraciones en las medidas de la función pulmonar en varias enfermedades pulmonares obstructivas. La Tabla 9-2 clasifica la gravedad de la obstrucción según el cociente FEV1/CVF. 13. Comente los trastornos pulmonares restrictivos y sus anomalías en las pruebas de función pulmonar asociadas. Los trastornos que provocan volúmenes pulmonares disminuidos son configuración anómala de la caja torácica, debilidad de los músculos respiratorios, pérdida del espacio aéreo alveolar (p. ej., fibrosis pulmonar, neumonía), e invasión del espacio pulmonar por trastornos Capítulo 9 Pruebas de función pulmonar 71 TABLA 9 - 1 . A lt e r a c i o n e s e n l a s p r u e b a s d e f u n c i ó n p u l m o n a r e n l a e n f e r m e d a d p u l m o n a r o b s t r u c t i va Medida Asma Bronquitis Enfisema CPT CV VR CRF DLCO FEV1 Aumentada Normal o disminuida Aumentado Aumentada Sin cambio o aumentada Disminuido Normal o aumentada Normal o disminuida Aumentado Aumentada Sin cambio o disminuida Disminuido Aumentada Normal o disminuida Aumentado Aumentada Disminuida Disminuido Adaptado de Taylor AE et al: Clinical respiratory physiology, Philadelphia, 1989, Saunders. CPT, capacidad pulmonar total; CRF, capacidad residual funcional; CV, capacidad vital; DLCO, capacidad de difusión del monóxido de carbono inspirado; FEV1, volumen espiratorio forzado en 1 segundo; VR, volumen residual. TABLA 9 - 2 . G r av e d a d d e l a s e n f e r m e d a d e s d e l a s v í a s a é r e a s o b s t r u c t i va s y r e s t r i c t i va s d e t e r m i n a d a p o r FEV 1 / C VF y C PT * FEV1/CVF CPT Normal Leve Moderada Grave >73% >81% 61–73% 66–80% 51–60% 51–65% <50% <50% CPT, capacidad pulmonar total; CVF, capacidad vital forzada; FEV1, volumen espiratorio forzado en 1 segundo. *Porcentajes de valores esperados. © Elsevier. Fotocopiar sin autorización es un delito de la cavidad pleurítica (p. ej., inflamación, tumor). El patrón restrictivo característico es una reducción en los volúmenes pulmonares, especialmente en CPT y capacidad vital (CV). Las velocidades de flujo aéreo pueden ser normales o estar aumentadas. 14. ¿Qué es la curva flujo-volumen y qué información proporciona? Empleando los valores espirométricos rutinarios, las curvas de flujo-volumen ayudan a identificar la localización anatómica de la obstrucción de la vía aérea. Los flujos espiratorios e inspiratorios forzados al 50% de la CVF (FEF50 y FIF50) se muestran en la Figura 9-3. Obsérvese que el flujo espiratorio se representa por encima del eje-x, mientras que el flujo inspiratorio se representa por debajo del eje. En una curva de flujo-volumen normal el cociente FEF50/FIF50 es 1. 15. ¿Cuáles son los patrones característicos de una curva flujo-volumen en una obstrucción de vía aérea fija, obstrucción extratorácica variable y una obstrucción intratorácica? Las lesiones de la vía aérea superior (p. ej., estenosis traqueal) se caracterizan por una fase meseta tanto en inspiración como en espiración. El cociente FEF50/FIF50 permanece igual. Una obstrucción extratorácica se produce cuando la lesión (p. ej., un tumor) se localiza por encima de la depresión del esternón, y se caracteriza por un aplanamiento de la curva de flujo-volumen durante la inspiración. El aplanamiento de la curva representa la falta de aumento de flujo aéreo, porque la masa provoca el colapso de la vía aérea. El cociente FEF50/FIF50 es >1. Una obstrucción intratorácica se caracteriza por un aplanamiento de la curva espiratoria de la curva flujovolumen, y el cociente FEF50/FIF50 es <1. La lesión provoca el colapso de la vía aérea durante la espiración (Figura 9-4). 72 Capítulo 9 Pruebas de función pulmonar Figura 9-3. Curva flujo-volumen idealizada. CVF, capacidad vital forzada; FEF50, flujo espiratorio al 50% de la capacidad vital forzada; FIF50, flujo inspiratorio al 50% de la capacidad vital forzada. (De Harrison RA: Respiratory function and anesthesia. En Barash PG, Cullen BF, Stoelting RK, editors: Clinical anesthesia, Philadelphia, 1989, Lippincott, pp 877-994, con permiso.) 16. ¿Qué importancia tiene medir las curvas de flujo-volumen en un paciente con una masa en el mediastino anterior? La inducción anestésica y relajación bruscas en pacientes con una masa en el mediastino anterior (p. ej., linfoma, timoma, masa tiroidea) puede imposibilitar ventilar al paciente y producir un colapso cardiovascular, debido a la compresión del árbol traqueobronquial, vena cava, vasos pulmonares o corazón. El cambio de respiración espontánea con presión negativa a ventilación asistida con presión positiva es un factor importante en este colapso. La valoración preoperatoria de las curvas de flujo-volumen en las posiciones sentado y supino ayuda a valorar las Capítulo 9 Pruebas de función pulmonar 73 Figura 9-4. Curvas flujo-volumen en una obstrucción de vías aéreas fija, extratorácica e intratorácica. Las líneas discontinuas representan el flujo al 50% de la capacidad vital. CPT, capacidad pulmonar total; esp., espiratorio; insp., inspiratorio; VR, volumen residual. (De Kryger M et al: Diagnosis of obstruction of the upper and central airways, Am J Med 61:85-93, 1976.) lesiones potencialmente obstructivas de la vía aérea, y a identificar a los pacientes en quienes puede estar indicado un manejo alternativo. 17. ¿Cuáles son los efectos de la cirugía y la anestesia en la función pulmonar? Todos los pacientes que se someten a anestesia general e intervenciones quirúrgicas (especialmente, de tórax y abdomen superior) muestran cambios en la función pulmonar que favorecen las complicaciones pulmonares postoperatorias. Por ejemplo, la CV disminuye aproximadamente al 40% de los valores preoperatorios, y permanece disminuida durante al menos 10-14 días después de una colecistectomía abierta. Las intervenciones abdominales altas provocan una disminución de la CRF en 10-16 horas; la CRF vuelve gradualmente a su valor normal en 7-10 días. El patrón normal de ventilación también resulta alterado, con disminución de los suspiros y del aclaramiento de secreciones. 18. ¿Qué valores de la prueba de función pulmonar predicen un aumento de las complicaciones pulmonares perioperatorias tras la cirugía abdominal o torácica? Véase la Tabla 9-3. © Elsevier. Fotocopiar sin autorización es un delito TABLA 9 - 3 . C r i t e r i o s d e f u n c i ó n p u l m o n a r q u e s u g i e r e n a u m e n t o d e l riesgo de la cirugía abdominal y torácica CVF FEV1 FEV1/CVF VVM VR DLCO VO2 Abdominal Torácica <70% del esperado <70% del esperado <65% <50% del esperado <70% del esperado o <1,7 l <2 la, <1 lb, <0,6 lc <35% <50% del esperado o <28 l/min <47% del esperado <50% <15 ml/kg/min Datos de Gass GD, Olsen GN: Preoperative pulmonary function testing to predict postoperative morbidity and mortality, Chest 89:127-135, 1986. CVF, capacidad vital forzada; DLCO, capacidad de difusión del monóxido de carbono inspirado; FEV1, volumen espiratorio forzado en 1 segundo; VO2, consumo de oxígeno; VR, volumen residual; VVM, ventilación voluntaria máxima. a Neumonectomía. b Lobectomía. c Segmentectomía. 74 Capítulo 9 Pruebas de función pulmonar 19. ¿Existen valores absolutos de pruebas específicas de la función pulmonar por debajo de los cuales el riesgo de cirugía es prohibitivo? Ningún resultado de una PFP aislada contraindica totalmente la cirugía. Factores como la exploración física, la gasometría arterial y los problemas médicos coexistentes también deben tenerse en cuenta para determinar la idoneidad de la cirugía. Al final, la decisión de operar se hace valorando todos los riesgos y beneficios y es una decisión consensuada entre cirujano, anestesiólogo y paciente. P U N T OS CLAVE: P RUEBAS DE FUNC IÓN P U L M O N A R 1. Las PFP alteradas identifican a los pacientes que se beneficiarán de un tratamiento pulmonar perioperatorio intensivo y en quienes la cirugía debe evitarse por completo. Éste es el caso, especialmente, cuando se planean resecciones pulmonares. 2. La CVF, el FEV1, el cociente FEV1/CVF y el flujo entre el 25 y el 75% de la CVF (MMF25-75) son los índices clínicos más útiles obtenidos en la espirometría. 3. No existe ningún resultado aislado de una PFP que contraindique la cirugía totalmente. Factores como la exploración física, la gasometría arterial y los problemas médicos coexistentes también deberían considerarse al determinar la idoneidad de la cirugía. Bibliografía Recomendada 1. Gal TJ: Pulmonary function testing. In Miller RD, editor: Miller’s anesthesia, ed 6, Philadelphia: Churchill Livingstone; 2005:999–1016. Anestésicos inhalatorios Michelle Dianne Herren, MD Capítulo 10 II. FARMACOLOGÍA 1. ¿Cuáles son las propiedades de un gas anestésico ideal? Un gas anestésico ideal debería ser predecible en el comienzo de acción y en el despertar; proporcionar relajación muscular, estabilidad cardiovascular y broncodilatación; no provocar hipertermia maligna u otros efectos secundarios importantes (como náuseas y vómitos); no ser inflamable; no sufrir transformación en el organismo, y permitir una estimación fácil de la concentración en el lugar de acción. 2. ¿Cuál es la estructura química de los gases anestésicos más habituales? ¿Por qué ya no usamos los antiguos? Isoflurano, desflurano y sevoflurano son los anestésicos halogenados empleados con mayor frecuencia. Como demuestran sus estructuras moleculares, son éteres halogenados, excepto el halotano, que es un alcano halogenado. Muchos agentes anestésicos antiguos tenían propiedades y efectos secundarios desfavorables, como la inflamabilidad (ciclopropano y fluroxeno), la inducción lenta (metoxiflurano) y el riesgo teórico de convulsiones (enflurano) (Figura 10-1). Figura 10-1. Estructura molecular de los anestésicos inhalatorios actuales. 3. ¿Cómo se compara la potencia de los diferentes gases anestésicos? La potencia de los gases anestésicos se compara usando la concentración alveolar mínima (CAM), que es la concentración a una atmósfera que consigue la abolición de la respuesta motora a una estimulación dolorosa (esencialmente, la incisión quirúrgica) en el 50% de los pacientes. Concretamente, se necesitan 1,3 CAM para abolir esta respuesta en el 99% de pacientes. Otras definiciones de CAM incluyen la CAM-RAB, que es la concentración que se necesita para bloquear los reflejos autónomos a los estímulos nociceptivos (1,7-2 CAM), y la CAM-despierto (CAM-awake), la concentración necesaria para bloquear los reflejos voluntarios intencionados y mide la conciencia perceptiva (0,3-0,5 CAM). La CAM parece ser constante en las diferentes especies. La medida de CAM asume que la concentración alveolar refleja directamente la presión parcial del anestésico en el lugar de la acción, además del equilibrio entre las distintas localizaciones. © 2011. Elsevier España, S.L. Reservados todos los derechos 75 76 Capítulo 10 Anestésicos inhalatorios 4. ¿Qué factores influyen en la concentración alveolar mínima? Las CAM más altas se dan en niños de 6-12 meses, y disminuyen tanto con la edad como en prematuros. Por grado centígrado de disminución de la temperatura corporal, la CAM disminuye aproximadamente un 2-5%. La hiponatremia, los opiáceos, los barbitúricos, los bloqueantes a2, los antagonistas del calcio, la intoxicación alcohólica aguda y el embarazo disminuyen la CAM. La hipertermia, el alcoholismo crónico y los estimulantes (cocaína) del sistema nervioso central (SNC) aumentan la CAM. Los factores que no afectan la CAM son la hipocapnia, la hipercapnia, el sexo, la función tiroidea y la hiperpotasemia. La CAM es aditiva. Por ejemplo, el óxido nitroso potencia los efectos de los anestésicos halogenados. 5. Defina el cociente de partición. ¿Qué cocientes de partición son importantes? Un cociente de partición describe la distribución de un determinado agente en equilibrio entre dos sustancias a la misma temperatura, presión y volumen. Así, el cociente sangre/gas describe la distribución del anestésico entre la sangre y el gas a la misma presión parcial. Un cociente sangre/gas mayor se correlaciona con una concentración del anestésico mayor en sangre (es decir, mayor solubilidad). Por tanto, una mayor cantidad de anestésico va a la sangre, que actúa como reservorio del agente, reduciendo la concentración alveolar y, así, ralentizando el ritmo de inducción. El equilibrio es relativamente rápido entre las presiones parciales del anestésico en los alvéolos y en el cerebro. Así, la concentración alveolar es, finalmente, el principal factor para determinar el comienzo de una acción. Otros coeficientes de partición importantes incluyen cerebro/sangre, grasa/sangre, hígado/ sangre y músculo/sangre. A excepción del grasa/sangre, estos coeficientes están próximos a 1 (equitativamente distribuidos). La grasa tiene coeficientes de partición para diferentes agentes halogenados de 30-60; esto significa que los anestésicos siguen siendo captados por la grasa por algún tiempo, tras el equilibrio con otros tejidos (Tabla 10-1). TA B LA 1 0 - 1 . P r o p i e d a d e s f í s i c a s d e l o s g a s e s a n e s t é s i c o s a c t u a l e s Isoflurano Peso molecular 184,5 Punto de ebullición (°C) 48,5 Presión de vapor (mmHg) 238,0 Coeficientes de partición a 37 °C Sangre/gas 1,4 Cerebro/sangre 2,6 Grasa/sangre 45 Aceite/gas 90,8 CAM (% a 1 atm) 1,15 Desflurano Halotano Óxido nitroso Sevoflurano 168 23,5 664 197,5 50,2 241 44 –88 39.000 200 58,5 160 0,42 1,2 27 18,7 6 2,3 2,9 60 224 0,77 0,47 1,7 2,3 1,4 104 0,69 1,7 48 47,2 1,7 CAM, concentración alveolar mínima. 6. Comente la evolución en las hipótesis de cómo trabajan los anestésicos inha­­ ­latorios. A principios del siglo pasado, Meyer y Overton observaron independientemente que el coeficiente de partición aceite/gas se correlacionaba con la potencia del anestésico. La teoría de la solubilidad lipídica de Meyer-Overton fue la más aceptada durante casi medio siglo hasta que se modificó. Capítulo 10 Anestésicos inhalatorios 77 © Elsevier. Fotocopiar sin autorización es un delito Franks y Lieb encontraron que un solvente anfofílico (octanol) se correlacionaba mejor con la potencia que la lipofilicidad, y dedujeron que el lugar de acción del anestésico debe tener tanto una zona polar como no polar. Las modificaciones de las teorías de expansión de membrana de Meyer y Overton incluyen la teoría de volumen excesivo, en la que se crea anestesia cuando los componentes de la membrana celular polar y los anestésicos anfofílicos crean sinérgicamente un volumen celular mayor que la suma de los dos volúmenes juntos. En la hipótesis del volumen crítico, la anestesia aparece cuando el volumen celular en el lugar de la anestesia alcanza un tamaño crítico. Estas teorías se basan en los efectos de la expansión de membrana sobre los canales de iones. Las teorías antes mencionadas simplifican el mecanismo de acción del anestésico, y se han abandonado por los siguientes motivos: los anestésicos inhalatorios conducen sólo a mínimos cambios en los lípidos, y los mismos cambios son reproducibles por cambios en la temperatura sin provocar cambios de comportamiento; además, las variaciones en tamaño, rigidez y localización del anestésico en la bicapa lipídica son similares a compuestos que no tienen actividad anestésica, lo que implica que existen lugares de acción específicos. Nuevas teorías aceptadas proponen distintos objetivos moleculares y localizaciones anatómicas de acción, más que acciones inespecíficas en el volumen o en la pared celular. Se cree que los anestésicos inhalatorios potencian los receptores inhibidores, como los receptores tipo A del ácido g-aminobutírico (GABA) o los receptores de la glicina. También existe evidencia que apoya el efecto inhibitorio sobre canales excitatorios, como los receptores neuronales nicotínicos o de glutamato. Es más probable que las acciones de inmovilidad y la amnesia se deban a mecanismos distintos situados en diferentes localizaciones anatómicas. A nivel de la médula espinal, los anestésicos suprimen las respuestas motoras nociceptivas, y son responsables de la inmovilidad del músculo esquelético. Los efectos supraespinales en el cerebro son responsables de la amnesia y la hipnosis. El tálamo y la formación reticular del cerebro están más deprimidos que otras zonas del cerebro. 7. ¿Qué factores influyen en la velocidad de inducción? Los factores que aumentan la velocidad de comienzo de la concentración alveolar del anestésico son: Aumento de las concentraciones liberadas de anestésico. Flujo alto en el circuito respiratorio. Aumento de la ventilación minuto. Los factores que disminuyen la concentración alveolar y producen un comienzo lento de la inducción inhalatoria son: Aumento del gasto cardíaco. Disminución de la ventilación minuto. Alta liposolubilidad del anestésico. Flujo bajo en el circuito respiratorio. 8. ¿Qué es el efecto del segundo gas? Explique la hipoxia por difusión. En teoría, este fenómeno debería acelerar el comienzo de la inducción anestésica. Ya que el óxido nitroso es insoluble en sangre, su rápida absorción desde los alvéolos provoca un aumento brusco en la concentración alveolar del anestésico halogenado acompañante. Sin embargo, incluso a concentraciones altas de óxido nitroso (70%), este efecto sólo se traduce en un ligero aumento de la concentración del anestésico halogenado. Cuando se cierra bruscamente el óxido nitroso, su rápida difusión desde la sangre al alvéolo disminuye la tensión de oxígeno en el pulmón, conduciendo a un período breve de disminución de la concentración de oxígeno, conocido como hipoxia por difusión. La administración de oxígeno al 100% al final de la anestesia puede eliminar este efecto. 78 Capítulo 10 Anestésicos inhalatorios P U N T OS CLAVE: A NES TÉS ICOS INHA LATO R I O S 1. La velocidad de comienzo de los anestésicos inhalatorios se incrementa aumentando la concentración administrada del anestésico, aumentando el flujo de gas fresco, aumentando la ventilación alveolar y usando anestésicos no liposolubles. 2. Los anestésicos inhalatorios disminuyen el volumen corriente y aumentan la frecuencia respiratoria, provocando un patrón rápido y superficial de respiración. 3. La CAM disminuye con la edad o prematuridad, hiponatremia, hipotermia, opiáceos, barbitúricos, bloqueantes a2, antagonistas del calcio, intoxicación alcohólica aguda y embarazo. 4. La CAM aumenta con hipertermia, alcoholismo crónico y estimulantes del SNC (cocaína). 5. Los anestésicos inhalatorios disminuyen la respuesta fisiológica a la hipoxia y la hipercapnia de forma dependiente de la dosis. 6. Debido a su insolubilidad en sangre y a la entrada rápida en espacios llenos de aire, el óxido nitroso no puede usarse en el contexto de neumotórax, obstrucción intestinal, neumocéfalo, o durante la cirugía del oído medio. 7. La degradación del desflurano y sevoflurano por absorbentes desecados puede conllevar la producción de monóxido de carbono, intoxicando gravemente al paciente. 8. La toxicidad por óxido nitroso es rara pero un peligro real en personas que abusan de él, en pacientes con deficiencia de vitamina B12 y posiblemente en fetos no nacidos debido a alteraciones en la síntesis de metionina que provoca secuelas neurológicas. 9. ¿Debería administrarse óxido nitroso a pacientes con neumotórax? ¿Existen otras situaciones en las que el óxido nitroso debería evitarse? Aunque el óxido nitroso tiene un coeficiente de partición sangre/gas bajo, es 20 veces más soluble que el nitrógeno (que supone el 79% de los gases atmosféricos). Así, el óxido nitroso puede difundirse dentro de los espacios cerrados 20 veces más rápidamente que la velocidad a la que sale, provocando la expansión de neumotórax, gas intestinal, embolismo gaseoso o aumento de la presión de las cavidades no expansibles, como el cráneo o el oído medio (Figura 10-2). 10. Describa los efectos ventilatorios de los anestésicos inhalatorios. La administración de gases anestésicos provoca una depresión dependiente de la dosis de la ventilación mediada directamente a través de los centros medulares, e indirectamente a través de efectos sobre la función de los músculos intercostales. El volumen minuto disminuye secundariamente a las disminuciones del volumen corriente, aunque la frecuencia suele aumentar de forma dependiente de la dosis. El estímulo ventilatorio en respuesta a la hipoxia queda eliminado fácilmente con CAM de 1 y atenuado con CAM menores. La respuesta ventilatoria a la hipercapnia también se atenúa a medida que se aumenta la concentración administrada de anestésico. 11. ¿Qué efectos tienen los anestésicos halogenados sobre la vasoconstricción pulmonar hipóxica, el calibre de la vía aérea y la función mucociliar? La vasoconstricción pulmonar hipóxica (VPH) es una respuesta de la vascularización pulmonar, mediada localmente, a la disminución de la tensión de oxígeno alveolar, y sirve para equilibrar la ventilación y la perfusión. Los agentes inhalatorios disminuyen esta respuesta. Todos los anestésicos halogenados parecen disminuir las resistencias de las vías aéreas por un efecto relajante directo sobre el músculo liso bronquial, y disminuyendo el efecto broncoconstrictor de la hipocapnia. Los efectos broncoconstrictores de la liberación de histamina también parecen disminuir cuando se administra un anestésico inhalatorio. Capítulo 10 Anestésicos inhalatorios 79 Figura 10-2. Aumento de volumen del gas intrapleural durante la administración de óxido nitroso (cuadrados, círculos y triángulos vacíos) frente al cambio de volumen en la administración de oxígeno, además de haloteno. (Redibujado de Eger EI II, Saidman LJ: Hazards of nitrous oxide anesthesia in bowel obstruction and pneumothorax. Anesthesiology 26:61-68, 1965.) El aclaramiento mucociliar parece disminuir con anestésicos inhalatorios, principalmente por interferir con el movimiento ciliar. Los efectos de los gases secos inhalados, la ventilación con presión positiva y el alto contenido de oxígeno inspirado también contribuyen a la afectación ciliar. © Elsevier. Fotocopiar sin autorización es un delito 12. ¿Qué efectos tienen los anestésicos halogenados sobre la circulación? Véase la Tabla 10-2. 13. ¿Qué agentes anestésicos producen más arritmias cardíacas? El halotano ha demostrado un aumento en la sensibilidad del miocardio a la adrenalina, provocando extrasístoles ventriculares y taquiarritmias. El mecanismo puede estar relacionado con la prolongación de la conducción a través del sistema His-Purkinje, lo que facilita el fenómeno de reentrada y la estimulación de receptores b1-adrenérgicos en el corazón. En comparación con los adultos, los niños que se someten a anestesia con halotano parecen ser relativamente resistentes a este efecto sensibilizador, aunque el halotano ha demostrado tener un efecto colinérgico bradicárdico inducido vagalmente en los niños. 14. Comente la biotransformación de los anestésicos inhalatorios y la toxicidad de los metabolitos. En la mayoría de ocasiones, el metabolismo oxidativo se produce en el hígado a través del sistema del citocromo P-450, y en menor medida, en los riñones, pulmones y tracto gastrointestinal. El desflurano y el isoflurano se metabolizan menos del 1%, mientras que el halotano se metaboliza más del 20% en el hígado. En condiciones hipóxicas, el halotano puede sufrir un metabolismo reductivo, produciendo metabolitos que pueden provocar necrosis hepática. La hepatitis por halotano es secundaria a una reacción autoinmune de hipersensibilidad. 80 Capítulo 10 Anestésicos inhalatorios TA B LA 1 0 - 2 . E f e c t o s c i r c u l at o r i o s d e l o s g a s e s a n e s t é s i c o s a c t u a l e s Gasto cardíaco Frecuencia cardíaca Presión arterial Volumen sistólico Contractilidad Resistencia vascular sistémica Resistencia vascular pulmonar Flujo sanguíneo coronario Flujo sanguíneo cerebral Flujo sanguíneo muscular Niveles de catecolaminas Isoflurano/ desflurano Sevoflurano Halotano Óxido nitroso 0 ++/0 – –* –* – –* –– 0 + + + 0 0 0 – –* –* – –* –– 0 + + + 0 –* 0 –* –* – –* 0 0 0 ++ – 0 + + 0 – –* 0 + 0 0 0 0 *, dependiente de la dosis; +, aumento; ++, aumento importante; 0, sin cambio; –, disminución; – –, disminución importante. El flúor es otro producto potencialmente tóxico del metabolismo anestésico. El uso de metoxiflurano se asocia a disfunción renal por el flúor, y ha contribuido enormemente a la desaparición del metoxiflurano del mercado. El flúor producido por el sevoflurano no se ha implicado en la disfunción renal, tal vez porque el sevoflurano no es tan liposoluble como el metoxiflurano y el tiempo de exposición (carga de flúor) es mucho menor. La cal sodada también puede degradar el sevoflurano. Uno de los metabolitos intermedios es un éter vinílico conocido también como Compuesto A. El Compuesto A ha demostrado ser nefrotóxico en ratas, pero no se ha experimentado ninguna disfunción orgánica asociada a su empleo clínico en los humanos. El Compuesto A puede acumularse en anestesias más largas, anestesia con bajos flujos, absorbentes secos, y con concentraciones de sevoflurano altas. 15. Comente los efectos de los absorbentes de CO2 sobre los productos metabóli­ cos de los anestésicos inhalatorios. El desflurano, mucho más que cualquier otro anestésico halogenado, se ha asociado con la producción de monóxido de carbono (CO). Existen una serie de condiciones clave. El compuesto halogenado debe contener un grupo difluorometoxi (desflurano, enflurano e isoflurano). Este grupo interacciona con un absorbente de CO2 fuertemente básico y desecado. Una abstracción de protones catalizada por una base forma un carbanión que puede reprotonarse por el agua para regenerar el anestésico original o formar CO cuando el absorbente está seco. Debido a la gran oportunidad para secarse del absorbente, la incidencia de la exposición de CO es mayor los lunes por la mañana, en la primera anestesia del día, o cuando las máquinas no se han empleado en algún tiempo, o cuando el flujo de gas fresco se ha dejado abierto durante un período prolongado. Las condiciones anteriores se encuentran a menudo, y son significativas en la mañana del lunes si el aparato no se ha utilizado durante el fin de semana. Los absorbentes deben ser sustituidos regularmente a pesar de la falta de cambio del color claro, y de supervisar los niveles de humedad. Los absorbentes que contienen hidróxido de potasio (KOH) son las bases más fuertes, y ocasionan una mayor producción de CO. De mayor a menor, los absorbentes que contienen KOH son Baralyme (4,6%) > cal sodada clásica (2,6%) > cal sodada moderna (0%) > cal sodada de hidróxido de calcio (Amsorb) (0%). La elección del anestésico halogenado también determina la cantidad de CO producida y a igualdad de CAM, desflurano > enflurano > isoflurano. El sevo- Capítulo 10 Anestésicos inhalatorios 81 flurano, que se creía inocuo, recientemente también ha resultado implicado cuando se expone a un absorbente seco (especialmente si contiene KOH). Esto conduce a la producción de CO y a un rápido aumento de la temperatura del absorbente, a la generación de ácido fórmico que provoca una irritación intensa de las vías respiratorias, y a una menor concentración eficaz en el circuito de sevoflurano suministrado en comparación con la concentración en el vaporizador. 16. ¿Qué agente anestésico ha demostrado ser teratogénico en animales? El óxido nitroso, administrado a ratas gestantes en concentraciones mayores del 50% durante más de 24 horas, ha demostrado aumentar las deformidades esqueléticas. El mecanismo está probablemente relacionado con la inhibición de la síntesis de metionina, que es necesaria para la síntesis; el mecanismo también puede ser secundario a los efectos fisiológicos de una disminución del flujo sanguíneo uterino por el óxido nitroso. Aunque no se han detectado efectos directos en los humanos, sería prudente limitar el empleo de óxido nitroso en mujeres embarazadas. Varias encuestas han intentado cuantificar el riesgo relativo de la exposición del personal de quirófano a los gases anestésicos no evacuados. Se encontró que las mujeres embarazadas tenían un aumento del 30% de riesgo de aborto espontáneo y un 20% de aumento de riesgo de anomalías congénitas. Sin embargo, en estos estudios, los sesgos debidos a la población que participó y la falta de control de otros factores de exposición peligrosos pudieron influir en los resultados. El óxido nitroso es tóxico para los humanos debido a su capacidad para impedir que la cobalamina (vitamina B12) actúe como coenzima de la metionina sintasa. En general, los efectos tóxicos se ven en personas que abusan del óxido nitroso durante períodos largos de tiempo (p. ej., mielinopatías, degeneración de la médula espinal, alteración del estado mental, parestesias, ataxia, debilidad, espasticidad). Otros pacientes pueden estar expuestos a la toxicidad durante el uso rutinario de anestésicos nitrosos, presentando anemia perniciosa o deficiencia de vitamina B12. Los pacientes sometidos a cirugías en las que se utiliza un 70% de óxido nitroso durante más de 2 horas han demostrado tener más complicaciones postoperatorias, como atelectasia, fiebre, neumonía e infecciones de la herida. Parece prudente, pues, limitar el uso del óxido nitroso en intervenciones largas. Bibliografía Recomendada 1. Campagna JA, Miller KE, Forman SA: Mechanisms of actions of inhaled anesthetics. N Engl J Med 348:2110–2124, 2003. 2. Coppens MJ, Versichelen LFM, Rolly G, et al: The mechanism of carbon monoxide production by inhalational agents. Anaesthesia 61:462–468, 2006. 3. Eger EI II, Saidman LJ: Hazards of nitrous oxide anesthesia in bowel obstruction and pneumothorax. Anesthesiology 26:61–68, 1965. 4. Myles PS, Leslie K, Chan MTV, et al: Avoidance of nitrous oxide for patients undergoing major surgery. Anesthesiology 107:221–231, 2007. © Elsevier. Fotocopiar sin autorización es un delito 5. Sanders RD, Weimann J, Maze M: Biologic effects of nitrous oxide. Anesthesiology 109:707–722, 2008. Capítulo 11 Opioides Christopher L. Ciarallo, MD 1. ¿Qué es un opiáceo, un opioide y un narcótico? Los opiáceos son fármacos analgésicos y sedantes que contienen opio o un derivado del opio procedente de la amapola (Papaver somniferum). Entre los opiáceos destacan el opio, la morfina y la codeína. Un opioide es cualquier sustancia con actividad de tipo morfina que actúa como agonista o antagonista en un receptor opioide. Los opioides pueden ser exógenos o endógenos (como las endorfinas) y pueden ser naturales, derivados o completamente sintéticos. El término narcótico no es específico de los opioides y hace referencia a cualquier sustancia con potencial adictivo que induce analgesia, euforia o alteraciones del sensorio. 2. ¿Qué son los opioides endógenos? Las endorfinas, las encefalinas y las dinorfinas son las tres clases de péptidos endógenos derivados de prohormonas y funcionalmente activos en los receptores opioides. A pesar de que sus acciones fisiológicas no se conocen por completo, parecen modular la nocicepción. Las endorfinas no se limitan al sistema nervioso central y pueden expresarse a través de los leucocitos activados. En la actualidad se está investigando una cuarta clase, las nociceptinas. 3. Diferencie tolerancia, dependencia y abuso de opioides. La tolerancia es la disminución de los efectos fisiológicos de una sustancia a causa de su administración repetida. La dependencia puede ser física o psicológica y hace referencia al uso repetido de una sustancia para evitar síntomas de abstinencia. La tolerancia puede ser necesaria para establecer el diagnóstico de dependencia. El abuso hace referencia al uso habitual de una sustancia a pesar de sus consecuencias adversas, como problemas sociales e interpersonales. 4. Cite los opioides empleados habitualmente en el contexto perioperatorio, sus nombres comerciales, dosis equivalentes de morfina, vida media y clase química. Véase la Tabla 11-1. 5. Describa los diferentes receptores opioides y sus efectos. Véase la Tabla 11-2. 6. ¿Qué es un opioide agonista-antagonista? Inicialmente se creyó que fármacos como la pentazocina, el butorfanol, la buprenorfina y la nalbufina eran agonistas de los receptores m y k. Sin embargo, en la actualidad se clasifican como agonistas parciales de los receptores m y k. Estos fármacos proporcionan analgesia pero menos euforia y riesgo de dependencia que los agonistas puros. Los agonistas-antagonistas en general causan menos depresión respiratoria que los agonistas y pueden revertir la depresión respiratoria y el prurito provocados por los agonistas puros. 7. Explique el mecanismo de acción, la duración y los efectos secundarios del antagonista opioide naloxona. La naloxona es un antagonista de los receptores m, k y d que revierte los efectos de los fármacos agonistas. El efecto máximo se produce al cabo de 1 a 2 minutos de la administración intravenosa. Su efecto dura entre 30 y 60 minutos y puede ser más corto que la duración del agonista 82 © 2011. Elsevier España, S.L. Reservados todos los derechos Capítulo 11 Opioides 83 TA B LA 1 1 - 1 . C o m pa r a c i ó n d e l o s o p i o i d e s d e e m p l e o h a b i t u a l Equipotencia i.v./i.m. (mg) Equipotencia v.o. (mg) Vida media plasmática (h) Clase química Sulfato de morfina Ms Contin Heroína Limifen Fentanilo Sufenta Ultiva Dilaudid Opana Dolantina Metasedín 10 30 2 Fenantreno — 5 1 0,1 0,01-0,02 0,04 1,3-2 1 75 10 2-4 30 45-60 — — — — 7,5 10 300 20 2-4 15 0,5 1,5 3-4 2,5-4 9 min 2-3 7-9 3-4 15-40 13 Fenantreno Fenantreno Fenilpiperidina Fenilpiperidina Fenilpiperidina Fenilpiperidina Fenantreno Fenantreno Fenilpiperidina Difenilheptano Tylenol No. 3* Vicodin, Lortab* Percocet* OxyContin Adolonta 130 i.m. 200 2-4 Fenantreno — 30 4 Fenantreno — — 100 20 20 120-150 4-5 5-6,5 5-7 Fenantreno Fenantreno Ciclohexanol Nombre genérico Nombre comercial Morfina Morfina LC Diacetilmorfina Alfentanilo Fentanilo Sufentanilo Remifentanilo Hidromorfona Oximorfona Meperidina Metadona (aguda) (crónica) Codeína Hidrocodona Oxicodona Oxicodona SR Tramadol © Elsevier. Fotocopiar sin autorización es un delito i.m., intramuscular; i.v, intravenosa; LC, liberación controlada; SR, liberación continuada. *Opioide combinado con paracetamol. opioide implicado. Inicialmente deben utilizarse dosis incrementales de 0,5 a 1 mg/kg a fin de revertir la depresión respiratoria y reducir al mínimo los efectos secundarios como abstinencia aguda de opioides, hipertensión grave, arritmias ventriculares o edema pulmonar. 8. Describa las diferentes vías de administración de los opioides. Las vías típicas de administración son la oral, intravenosa, intramuscular, epidural, subaracnoidea y rectal. También pueden utilizarse por vía intranasal, en nebulización o por vía subcutánea. Los opioides lipofílicos como el fentanilo también se comercializan en forma de parche transdér­ mico, y en formulaciones transmucosa y sublingual. 9. ¿Cuáles son los efectos secundarios típicos de los opioides? Entre los efectos secundarios de los opioides destacan la depresión respiratoria, náuseas y vómitos, prurito, inhibición de la tos, retención urinaria y espasmo de vías biliares. Algunos opioides pueden inducir la liberación de histamina y provocar habones, broncoespasmo e hipotensión. Los opioides intravenosos pueden provocar rigidez de la pared abdominal y torácica. La mayoría de los opioides, con la destacada excepción de la meperidina, produce bradicardia dependiente de la dosis. 84 Capítulo 11 Opioides TA B LA 1 1 - 2 . S u b t i p o s d e r e c e p t o r e s o p i o i d e s Subtipo de receptor opioide Agonistas Respuesta agonista Mu-1 (m-1) Encefalina b-endorfina Fenantrenos Fenilpiperidinas Metadona Encefalina b-endorfina Fenantrenos Fenilpiperidinas Metadona Dinorfina Butorfanol Levorfanol Nalbufina Oxicodona Encefalina Deltorfina Sufentanilo Analgesia supraespinal Euforia Miosis Retención urinaria Mu-2 (m-2) Kappa (k) Delta (d) Sigma (σ) (ya no se clasifica como receptor opioide) Pentazocina Analgesia espinal Depresión respiratoria Bradicardia Estreñimiento Dependencia Analgesia espinal (k-1) Analgesia supraespinal (k-2) Disforia Sedación Analgesia espinal (d-1) Analgesia supraespinal (d-2) Depresión respiratoria Retención urinaria Dependencia Disforia Taquipnea Alucinaciones Modificado de Stoelting RK, Miller RD: Basics of Anesthesia, ed 4, New York, 2000, Churchill Livingstone, p 71. 10. ¿Qué opioides están asociados con la liberación de histamina? La administración parenteral de meperidina, morfina y codeína se ha asociado a la liberación de histamina con las consiguientes reacciones cutáneas e hipotensión. La incidencia y gravedad, al menos en el caso de la morfina, parece depender de la dosis. 11. Describa los mecanismos de las náuseas inducidas por opioides. Los opioides se unen directamente a los receptores opioides en la zona gatillo quimiorreceptora en el área postrema del bulbo raquídeo y estimulan el centro del vómito. Ejercen un efecto se­ cundario al sensibilizar el sistema vestibular. La incidencia de náuseas y vómitos es similar en todos los opioides y parece ser independiente de la vía de administración. 12. ¿Qué es la metilnaltrexona y qué papel potencial desempeña en el tratamiento con opioides? La metilnaltrexona es un antagonista de los receptores opioides periféricos derivado de la naltrexona. Es una molécula polar, cargada, que no atraviesa la barrera hematoencefálica. El uso de la metilnaltrexona está autorizado en Estados Unidos para cuidados paliativos en el tratamiento del estreñimiento inducido por opioides. Un fármaco relacionado, el alvimopan, se ha autorizado en forma oral para el tratamiento del íleo postoperatorio tras una resección intestinal. Capítulo 11 Opioides 85 13. Describa los efectos cardiovasculares de los opioides. Como grupo, los opioides tienen efectos mínimos sobre el sistema cardiovascular. Exceptuando la meperidina, provocan una bradicardia dependiente de la dosis por estimulación del núcleo vagal. Dejando de lado la actividad depresora del miocardio de la meperidina, los opioides tienen un ligero efecto inotrópico sobre el miocardio. Algunos opioides pueden inducir la liberación de histamina y reducir de forma significativa la resistencia vascular sistémica (RVS), pero la mayoría solamente reduce la RVS de forma moderada, incluso a dosis anestésicas. P U N T OS CLAVE: O PIOIDES 1. Entre los efectos habituales de los opioides destacan náuseas, prurito, bradicardia, retención urinaria y depresión respiratoria. 2. La morfina y la meperidina deberían emplearse con precaución en pacientes con insuficiencia renal debido al riesgo de depresión ventilatoria prolongada y convulsiones, respectivamente. 3. Los opioides y los anestésicos locales por vía neuroaxial actúan de forma sinérgica para proporcionar analgesia con menos efectos secundarios. 4. La naloxona debe ajustarse en dosis incrementales para la depresión respiratoria inducida por opioides, y es posible que la administración deba repetirse para revertir los agonistas opioides de larga acción. 5. Las conversiones equianalgésicas de los opioides son aproximaciones, y no explican la tolerancia cruzada incompleta de los opioides. 14. Describa el patrón respiratorio y la respuesta ventilatoria típicos al CO2 en presen­­ cia de opioides. Los opioides reducen la ventilación alveolar de forma dependiente de la dosis. Ralentizan la frecuencia respiratoria y pueden provocar una respiración periódica o apnea. Gráficamente los opioides desplazan la curva de respuesta ventilatoria alveolar al CO2 hacia abajo y hacia la derecha. Por consiguiente, ante un nivel arterial dado de CO2, la ventilación alveolar se reducirá en presencia de opioides. Además, un aumento del CO2 arterial no estimulará el correspondiente aumento de la ventilación. Los opioides también afectan al impulso ventilatorio hipóxico (Figura 11-1). © Elsevier. Fotocopiar sin autorización es un delito 15. Describa el inicio, efecto máximo y duración de la analgesia tras la administra­ ción intravenosa de fentanilo, morfina e hidromorfona. Véase la Tabla 11-3. 16. Explique por qué el fentanilo puede tener una duración de acción más corta pero una mayor vida media de eliminación que la morfina. La vida media de eliminación se corresponde con la duración de la acción en un modelo farmacocinético de compartimento único. Los opioides lipofílicos, como el fentanilo, están mejor representados por un modelo multicompartimental ya que la redistribución desempeña un papel mucho mayor que la eliminación a la hora de determinar la duración de su acción. 17. Explique el concepto de vida media sensible al contexto y su importancia en los opioides. La vida media sensible al contexto es el tiempo requerido para obtener una reducción del 50% en la concentración plasmática de un fármaco al finalizar la administración de una infusión constante. Este tiempo viene determinado por la eliminación y la redistribución, y varía considerablemente en función de la duración de la infusión de los opioides utilizados habitualmente (Figura 11-2). 86 Capítulo 11 Opioides Figura 11-1. Respuesta ventilatoria a la PaCO2 en presencia de opioides. TA B LA 1 1 - 3 . C o m pa r a c i ó n d e l o s o p i o i d e s i n t r av e n o s o s d e u s o h a b i t ua l Opioide Inicio (min) Efecto máx. (min) Duración (h) Fentanilo Morfina Hidromorfona 1-3 5-15 5 3-5 30-90 15-30 0,5-1 4-5 4-5 18. Explique por qué la morfina puede provocar una depresión ventilatoria prolongada en pacientes con insuficiencia renal. Entre el 5 y el 10% de una dosis de morfina se excreta por la orina sin modificar. El resto básicamente se conjuga en el hígado como morfina-3-glucurónido (del 50 al 75%) y morfina-6-­ glucurónido (10%), del cual un 90% se excreta por vía renal. La morfina-3-glucurónido es inactiva, pero la morfina-6-glucurónido es aproximadamente 100 veces más potente que la morfina como agonista del receptor m. 19. ¿Qué opioides pueden estar asociados con actividad convulsiva en pacientes con insuficiencia renal? La hidromorfona y la meperidina están asociadas con actividad convulsiva en pacientes con insuficiencia renal. En raras ocasiones los metabolitos hidromorfona-3-glucurónido y normeperidina pueden acumularse en casos de insuficiencia renal y favorecer la aparición de mioclonos y convulsiones. 20. ¿Qué es el remifentanilo y en qué se diferencia de otros opioides? El remifentanilo es un opioide de acción ultracorta, con una duración de 5 a 10 minutos y una vida media sensible al contexto de 3 minutos. Contiene una fracción éster y es metabolizado por esterasas inespecíficas del plasma. Si bien el remifentanilo se administra con mayor frecuencia en infusión continua, se ha administrado en forma de bolo intravenoso para facilitar la intubación pero con una incidencia significativa de bradicardia y rigidez de Capítulo 11 Opioides 87 Figura 11-2. Vida media sensible al contexto de los opioides utilizados más habitualmente en función de la duración de la infusión. (Adaptado de Egan TD et al: The pharmacokinetics of the new short-acting opioid remifentanil [GI87084B] in healthy adult male volunteers, Anesthesiology 79:881, 1993.) la pared torácica. Se ha demostrado que el remifentanilo induce hiperalgesia y tolerancia aguda a los opioides, y su uso debe cuestionarse en pacientes con síndromes de dolor crónico. © Elsevier. Fotocopiar sin autorización es un delito 21. Describa el metabolismo de la codeína. La codeína se metaboliza por el citocromo P-450 2D6 (CYP2D6) y se transforma en morfina por desmetilación. El polimorfismo genético del gen CYP2D6 permite clasificar a los pacientes en metabolizadores lentos, rápidos y ultrarrápidos. Los metabolizadores lentos pueden obte­ ner analgesia marginal gracias a la codeína, mientras que los metabolizadores ultrarrápidos pueden presentar una concentración plasmática de morfina y morfina-6-glucurónido hasta un 50% mayor que los metabolizadores rápidos. Los metabolizadores ultrarrápidos pueden tener un riesgo significativo de intoxicación por opioides y apnea con las dosis perioperatorias típicas de codeína. 22. ¿Qué recomendaciones especiales hay que tener en cuenta con la administra­ ción de metadona? Dado que la metadona tiene una vida media particularmente larga y variable, la administración repetida puede dar lugar a niveles plasmáticos excesivos, en especial los días 2 a 4 tras iniciar el tratamiento. La metadona actúa como agonista en los receptores opioides m y como antagonista en el receptor del N-metil-d-aspartato (NMDA). El antagonismo del receptor NMDA puede potenciar los efectos en el receptor m y evitar la tolerancia al opioide. Por ultimo, la metadona puede prolongar el intervalo QT del electrocardiograma (ECG) y aumentar el riesgo de torsades de pointes. Las recomendaciones del panel de expertos incluyen un ECG inicial y uno de seguimiento a los 30 días y anualmente mientras se esté administrando la metadona. 23. ¿Qué es el tramadol? El tramadol es un análogo de la codeína que actúa como agonista en los receptores m, d y k e inhibe la recaptación de noradrenalina y serotonina. Es un analgésico de eficacia moderada 88 Capítulo 11 Opioides con una menor incidencia de depresión respiratoria, estreñimiento y dependencia que otros agonistas del receptor m. En raras ocasiones el tramadol puede inducir convulsiones, y está contraindicado en pacientes con trastornos convulsivos preexistentes. 24. ¿Cuáles son algunas de las características únicas de la meperidina? A diferencia de otros opioides, la meperidina tiene cierta propiedad anestésica local débil, en particular cuando se administra por vía neuroaxial. La meperidina no provoca bradicardia y puede inducir taquicardia, quizá debido a que su estructura es similar a la de la atropina. Como agonista de los receptores k, la meperidina puede emplearse para inhibir los temblores postoperatorios. La meperidina está contraindicada en pacientes que toman inhibidores de la monoaminooxidasa ya que la combinación puede provocar toxicidad serotoninérgica, hipertermia y muerte. 25. Describa el lugar y el mecanismo de acción de los opioides neuroaxiales. Los opioides neuroaxiales se unen a los receptores en la lámina II de Rexed (sustancia gelatinosa) del asta dorsal de la médula espinal. La activación de los receptores m parece reducir el dolor visceral y somático a través de las vías del dolor descendentes mediadas por el ácido g-aminobutírico. La activación de los receptores k parece reducir el dolor visceral a través de la inhibición de la sustancia P. El efecto de los receptores d no se ha establecido por completo, pero parece mínimo en algunos modelos animales. 26. Comente el efecto de la liposolubilidad en la acción de los opioides neuroaxiales. Los opioides lipofílicos se difunden a través de las membranas espinales más rápidamente que los opioides hidrofílicos. Por consiguiente, tienen un inicio más rápido de la analgesia. Sin em­ bargo, también difunden a través de las membranas vasculares más fácilmente, provocando un aumento de las concentraciones séricas y una menor duración de acción. Los opioides hidrofílicos tienen una mayor difusión cefalocaudal cuando se administran en el espacio epidural o subaracnoideo. Ambos logran una cobertura analgésica mayor que los opioides lipofílicos, pero pueden provocar una depresión respiratoria retardada tras la diseminación cefálica hacia el tronco encefálico. 27. ¿Los receptores opioides son exclusivos del sistema nervioso central? No. Existen receptores opioides periféricos en las neuronas aferentes primarias, pero son funcionalmente inactivos en condiciones normales. La inflamación de los tejidos puede inducir la sobrerregulación de los receptores opioides y la eficacia de la transducción nerviosa. 28. Describa las ventajas de combinar anestésicos locales y opioides en la analgesia neuroaxial. A pesar de sus efectos analgésicos beneficiosos, los anestésicos locales epidurales tienen efectos secundarios problemáticos como bloqueo motor e hipotensión sistémica. Los opioides epidurales causan prurito y náuseas. Combinados, los opioides y los anestésicos locales funcionan de forma sinérgica para proporcionar analgesia con atenuación de los efectos secundarios. 29. ¿Qué es el DepoDur y en qué se diferencia de otros opioides neuroaxiales? El DepoDur es un agonista opioide que consiste en partículas de base lipídica con vesículas in­ ternas de morfina (DepoFoam). Está autorizado solamente para una única administración epidural y puede proporcionar hasta 48 horas de analgesia. Exceptuando la dosis de prueba epidural, DepoDur no debe administrarse junto con anestésicos locales debido al riesgo de liberación acelerada de morfina. No debe administrarse ninguna otra medicación en el espacio epidural durante 48 horas tras la administración de DepoDur. Bibliografía Recomendada 1. Coda BA: Opioids. In Barash PG, Cullen BF, Stoelting RK, editors: Clinical anesthesia, ed 5, Philadelphia, Lippincott Williams & Wilkins, 2006. 2. Crawford MW, Hickey C, Zaarour C, et al: Development of acute opioid tolerance during infusion of remifentanil for pediatric scoliosis surgery. Anesth Analg 102:1662–1667, 2006. Capítulo 11 Opioides 89 3. Fukuda K: Intravenous opioid anesthetics. In Miller RD, editor: Anesthesia, ed 6, Philadelphia, Elsevier, 2005. 4. Gillman PK: Monoamine oxidase inhibitors, opioid analgesics and serotonin toxicity. Br J Anaesth 95:434–441, 2005. 5. Kirchheiner J, Schmidt H, Tzvetkov M, et al: Pharmacokinetics of codeine and its metabolite morphine in ultrarapid metabolizers due to CYP2D6 duplication. Pharmacogenomics J 7:257–265, 2007. 6. Krantz MJ, Martin J, Stimmel B, et al: QTc interval screening in methadone treatment: the CSAT consensus guideline. Ann Intern Med 150:387–395, 2009. 7. Moss J, Rosow CE: Development of peripheral opioid antagonists: new insights into opioid effects. Mayo Clin Proc 83:1116–1130, 2008. 8. Smith HS: Peripherally-acting opioids. Pain Physician 11:S121–S132, 2008. © Elsevier. Fotocopiar sin autorización es un delito 9. Viscusi ER, Martin G, Hartrick CT, et al: Forty-eight hours of postoperative pain relief after total hip arthroplasty with a novel, extended-release epidural morphine formulation. Anesthesiology 102:1014–1022, 2005. CAPÍTULO 12 Anestésicos intravenosos y benzodiazepinas Theresa C. Michel, MD 1. ¿Qué cualidades debería tener un anestésico intravenoso ideal para inducción? El agente ideal debería tener un inicio de acción rápido, producir amnesia, analgesia e hipnosis y estabilidad hemodinámica. Debería tener pocos efectos secundarios intrínsecos, pocas interacciones con otros fármacos y permitir una rápida recuperación tras la cirugía. 2. Enumere los inductores anestésicos más utilizados y sus propiedades. Compare sus efectos cardiovasculares. Tiopental sódico (TPS): es un depresor miocárdico directo, produce vasodilatación periférica, que comporta una reducción de la presión arterial media (PAM), y provoca taquicardia refleja. Etomidato: es un derivado imidazólico cuyas propiedades inductoras de la anestesia derivan de la modulación del receptor gammaaminobutírico (GABA). Destaca por su estabilidad hemodinámica. El gasto cardíaco (GC) y la contractilidad están preservados, y solamente se aprecia una leve reducción de la PAM. Entre los efectos secundarios destacan dolor a la inyección, náuseas y vómitos, hipo, mioclonías, convulsiones, tromboflebitis y, lo más importante, inhibición suprarrenal. Propofol: la depresión del miocardio y la vasodilatación periférica son más profundas que con el TPS y puede provocar una reducción más significativa de la PAM. Los efectos sobre la frecuencia cardíaca (FC) son mínimos. Ketamina: los efectos simpaticomiméticos provocan un aumento del GC, la PAM y la FC. Es un depresor del miocardio, pero habitualmente predominan sus propiedades simpaticomiméticas. Midazolam: es la principal benzodiazepina que se emplea perioperatoriamente. Las benzodiazepinas proporcionan ansiólisis, sedación, amnesia e inconsciencia a dosis elevadas. El midazolam tiene efectos depresores sobre el miocardio mínimos. No tiene efectos sobre la PAM o el GC; la FC puede aumentar ligeramente. Opioides: dosis elevadas de la mayoría de los opioides tienen efecto vagolítico, provocando bradicardia. La meperidina es la excepción, ya que tiene efectos simpaticomiméticos que provocan taquicardia. Puede observarse una reducción de la PAM secundaria a bradicardia, vasodilatación, bloqueo de la respuesta simpática y liberación de histamina (especialmente evidente con morfina y meperidina). Estos efectos se observan al administrar de forma individualizada estos fármacos. Cuando se administran combinados (p. ej., midazolam seguido de un opioide y posteriormente TPS), los efectos son sinérgicos y no está garantizada la estabilidad hemodinámica (Tablas 12-1 y 12-2). 3. En lugar de inyectar pentotal intravenoso, lo ha administrado inadvertidamente en la línea intraarterial del paciente. ¿Cuál es el impacto en el paciente y cómo deberían tratarse los posibles problemas derivados? Es probable que el TPS intraarterial provoque molestias significativas, vasoespasmo y formación de trombos. Deje el catéter colocado e inyecte papaverina, procaína o lidocaína diluidas a través del catéter para inhibir el espasmo del músculo liso. Si esto no restablece la perfusión, considere realizar un bloqueo del plexo braquial o un bloqueo alfalítico. Administre también heparina para prevenir la formación de trombos. 90 © 2011. Elsevier España, S.L. Reservados todos los derechos CAPÍTULO 12 Anestésicos intravenosos y benzodiazepinas 91 Ta b la 1 2 - 1 . G uía s d e d o s i f i cac i ó n pa r a la i n d ucc i ó n a n e s t é s i ca y la s e d ac i ó n * Agente Clase Dosis para la inducción anestésica Dosis para la sedación Tiopental sódico Ketamina Barbitúrico 3-6 mg/kg i.v. 0,5-1,5 mg/kg i.v. Midazolam Benzodiazepina 1-2 mg/kg i.v. 2-4 mg/kg i.m. 0,2-0,5 mg/kg i.v. 1-2,5 mg/kg bolo i.v. 50-200 mg/kg/min infusión 0,1-0,4 mg/kg i.v. 0,2-0,5 mg/kg i.v. Etomidato Propofol Derivado de la fenciclidina Derivado del imidazol Fenol sustituido Uso inadecuado 25-100 mg/kg/min i.v. 0,01-0,1 mg/kg i.v. i.m., intramuscular; i.v., intravenoso. *Las dosis de los fármacos deben ajustarse al estado del volumen intravascular, comorbilidad y otros fármacos. Ta b la 1 2 - 2 . E f e cto s ca r d i o va s cula r e s d e lo s i n d ucto r e s a n e s t é s i co s Agente PAM FC RVS GC Contractilidad Venodilatación Tiopental Ketamina Midazolam Propofol Etomidato – ++ 0a– – 0 + ++ 0a+ + 0 0a+ + 0a– – 0 – + 0a– 0 0 – + o –* 0a– – 0 + 0 + + 0 © Elsevier. Fotocopiar sin autorización es un delito FC, frecuencia cardíaca; GC, gasto cardíaco; PAM, presión arterial media; RVS, resistencia vascular sistémica; +, aumento; 0, sin efecto; –, disminución. *El efecto de la ketamina depende de los niveles de catecolaminas del paciente. 4. ¿Cuáles son las contraindicaciones del tiopental sódico? Alergia al TPS: el TPS contiene una molécula de azufre que provoca un mayor riesgo de liberación de histamina. No debería administrarse TPS a pacientes alérgicos a los sulfatos. Porfiria: los barbitúricos aumentan la síntesis de porfirina y pueden desencadenar una crisis de porfiria aguda con síntomas como dolor abdominal, debilidad, disfunción autónoma y alteraciones gastrointestinales y del sueño. Debe administrarse con precaución en pacientes con hipovolemia y mala función sistólica debido a sus efectos depresores cardiovasculares. El TPS es una mala elección en este contexto. La edad avanzada, la disfunción hepática y la obesidad pueden provocar una redistribución más lenta y prolongar sus efectos. 5. ¿Cómo afectan los inductores anestésicos al impulso respiratorio? Todos los agentes inductores intravenosos con la excepción de la ketamina producen depresión respiratoria dependiente de la dosis, manifestada por una disminución del volumen corriente, 92 CAPÍTULO 12 Anestésicos intravenosos y benzodiazepinas disminución de la ventilación por minuto, disminución de la respuesta a la hipoxia y desplazamiento a la derecha de la curva de respuesta al CO2, que culmina en hipoventilación o apnea. 6. ¿En qué se diferencia la ketamina de otros agentes inductores? La ketamina es un antagonista de los receptores del N-metil-d-aspartato con propiedades analgésicas importantes. Químicamente relacionada con la fenciclidina, provoca un estado disociativo e inconsciencia dependientes de la dosis y puede causar alucinaciones o sueños desagradables en los individuos emocionalmente sensibles. Tiene una débil capacidad amnésica. La administración concomitante de una benzodiazepina puede reducir la incidencia de los efectos adversos sensoriales. Los efectos simpaticomiméticos de la ketamina provocan taquicardia, aumento del GC y de la PAM. Es un agente inductor ideal en pacientes en estados de shock, hipovolemia significativa y taponamiento cardíaco. Como se ha mencionado anteriormente, la ketamina tiene efectos depresores directos sobre el miocardio que no tienden a manifestarse debido al predominio de la estimulación simpática. Sin embargo, los efectos depresores del miocardio pueden ponerse de manifiesto en los estados de depleción de catecolaminas. Otros efectos secundarios favorables son la broncodilatación y la preservación del impulso respiratorio. Los efectos secundarios indeseables incluyen aumento del flujo sanguíneo cerebral, que puede ser problemático en casos de elevación de la presión intracraneal. La ketamina también aumenta las secreciones orales de forma destacada, es emetógena y puede provocar nistagmos. 7. Comente los problemas del empleo de etomidato en pacientes críticos. El etomidato reduce los niveles séricos de cortisol al bloquear dos enzimas de la vía del cortisol: la 11-b-hidroxilasa y la 17-a-hidroxilasa. En pacientes críticos y en quienes presentan shock séptico se ha documentado supresión suprarrenal clínicamente significativa y aumento de la morbilidad y la mortalidad tras recibir una única dosis de etomidato. Annane et al publicaron que 68 pacientes de un total de 72 (94%) que recibieron etomidato para la inducción de la anestesia no respondieron a la prueba de estimulación con una dosis alta de cosintropina. Esto concuerda con otras descripciones de insuficiencia suprarrenal 12 a 24 horas después de la administración de etomidato. Los resultados parecen indicar una mortalidad significativa tras la inducción con etomidato en pacientes sépticos. Sin embargo, las propiedades de estabilidad hemodinámica hacen del etomidato un agente de inducción favorable en pacientes con shock. Mientras sigue la controversia y se obtienen datos adicionales, algunos autores defienden el empleo de etomidato junto con una terapia de sustitución con corticosteroides exógenos (p. ej., 100 mg de hidrocortisona cada 8 horas) midiendo los niveles de cortisol del estrés. P U N T OS CLAVE: A nest ésicos intravenosos y benz od ia zepinas 1. Para dosificar bien los anestésicos intravenosos hay que tener en cuenta el estado del volumen intravascular, comorbilidad, edad y medicación crónica. 2. Las benzodiazepinas y los opioides tienen efectos sinérgicos con agentes inductores intravenosos, necesitando ajustar las dosis. 3. La ketamina es el mejor agente de inducción para pacientes traumatizados hipovolémicos, siempre y cuando no exista riesgo de aumento de la presión intracraneal. También es un buen agente para pacientes con enfermedad broncoespástica activa. 4. El propofol es el agente de inducción con menos probabilidad de provocar náuseas y vómitos. 5. El fin del efecto de los anestésicos intravenosos es por redistribución, no por biotransformación y metabolismo. CAPÍTULO 12 Anestésicos intravenosos y benzodiazepinas 93 8. Describa el síndrome de infusión del propofol. Descrito por primera vez en la población pediátrica en 1992, este síndrome se ha observado también en adultos. Se desconoce su incidencia real pero se estima que es aproximadamente de 1 por cada 270 pacientes. La población en riesgo son pacientes críticos que reciben dosis altas de propofol en infusión durante largos períodos de tiempo (más de 4 mg/kg/h durante más de 48 horas). Los niños en situación crítica tienen más riesgo. Este riesgo aumenta con la administración de esteroides exógenos y catecolaminas y una ingesta insuficiente de hidratos de carbono. Entre sus manifestaciones destacan la insuficiencia cardíaca, rabdomiólisis, acidosis metabólica grave, hiperlipidemia, insuficiencia renal e incluso muerte. En la actualidad el propofol no está autorizado como sedante en unidades pediátricas de cuidados intensivos. A pesar de que la morbilidad y la mortalidad son actualmente muy elevadas en aquellos pacientes con síndrome de infusión del propofol y las opciones terapéuticas son limitadas, los mejores resultados se han logrado con tratamiento sintomático como hemodiálisis y soporte cardiorrespiratorio. 9. ¿Cuáles son algunas de las contraindicaciones para el empleo de propofol? El propofol contiene aceite de soja y lecitina de huevo, de forma que los pacientes alérgicos a los huevos y a los derivados de la soja no deberían recibir este fármaco. El propofol atraviesa la barrera placentaria y puede estar asociado con depresión neonatal. Tiene efectos cardiodepresores; así pues, los pacientes con miocardiopatías e hipovolemia no son candidatos ideales. Por último, hay que tener en cuenta la conveniencia de su empleo en pacientes con trastornos del metabolismo lipídico como hiperlipoproteinemia primaria, hiperlipidemia diabética y pancreatitis. © Elsevier. Fotocopiar sin autorización es un delito 10. ¿Cuál sería el agente de inducción adecuado para un hombre sano de 47 años con un tumor del lóbulo parietal programado para craneotomía y exéresis tumoral? El ATPS tiene el mejor perfil protector cerebral ya que disminuye el consumo de oxígeno cerebral (CRMO2) y conserva la presión de perfusión cerebral. La ketamina debería evitarse ya que aumenta el flujo sanguíneo cerebral y la presión intracraneal. 11. Describa el mecanismo de acción de las benzodiazepinas. Los receptores benzodiazepínicos, que se encuentran en las terminaciones nerviosas postsinápticas del sistema nervioso central (SNC), forman parte del complejo receptor GABA. El GABA es el principal neurotransmisor inhibitorio del SNC. El complejo receptor GABA está formado por dos subunidades a y dos subunidades . Las subunidades a son los lugares de unión de las benzodiazepinas. Las subunidades son los lugares de unión del GABA. En el centro del complejo receptor GABA se localiza un canal de iones cloruro. Las benzodiazepinas producen sus efectos reforzando la unión del GABA a su receptor. El GABA activa el canal del ion cloruro, permitiendo que los iones de cloruro entren en la neurona. El flujo de iones de cloruro hacia el interior de la neurona provoca su hiperpolarización e inhibición. Las benzodiazepinas son metabolizadas en el hígado mediante oxidación y glucuronidación microsómica. Deben emplearse con precaución en pacientes con hepatopatías y en ancianos. La potencia, el inicio y la duración de acción de las benzodiazepinas dependen de su liposolubilidad. El inicio de acción se logra gracias a la rápida distribución al cerebro muy vascularizado. La finalización de su efecto se produce a medida que el fármaco se redistribuye a otras partes del organismo. 12. ¿Cuáles son las benzodiazepinas que se administran habitualmente por vía intravenosa? Midazolam: es liposoluble y, por tanto, es el que posee un inicio de acción más rápido y el que tiene una duración más corta. A diferencia de otras benzodiazepinas, el midazolam es liposoluble e hidrosoluble y, por tanto, puede fabricarse sin necesidad de incluir propilenglicol, el disolvente que provoca dolor. Tiene un único metabolito con actividad mínima. Es, con diferencia, la benzodiazepina empleada con más frecuencia perioperatoriamente. 94 CAPÍTULO 12 Anestésicos intravenosos y benzodiazepinas Diazepam: su inicio de acción es ligeramente más lento. Tiene una vida media de eliminación larga y dos metabolitos activos que pueden prolongar la sedación. Lorazepam: es el menos liposoluble y, por tanto, el que tiene un inicio de acción más lento y una duración más larga. Su vida media de eliminación también es larga. 13. ¿Cómo debería tratarse la sedación excesiva inducida por benzodiazepinas? Como primera regla, siempre hay que proporcionar tratamiento sintomático. Mantener la vía aérea y ventilar mediante mascarilla si es necesario. Evaluar la idoneidad de la circulación. En segundo lugar, administrar el antagonista benzodiazepínico flumazenil. El flumazenil actúa mediante inhibición competitiva, revirtiendo la sedación y la depresión respiratoria de forma dependiente de la dosis. El inicio de acción es rápido y su efecto es máximo en 1 a 3 minutos. Debería ajustarse hasta efecto administrando dosis de 0,2 mg por vía intravenosa hasta una do­sis máxima de 3 mg. Debería administrarse con precaución, si es que se administra, en pacientes con antecedentes de trastornos convulsivos. 14. ¿Qué diría a las enfermeras que monitorizaran a este paciente sobre los posibles efectos secundarios del flumazenil? La vida media de eliminación del midazolam es de 2 a 3 horas, mientras que la vida media de eliminación del flumazenil es de 1 hora. La sedación recurrente es un riesgo. El flumazenil puede administrarse de forma repetida en infusión a una velocidad de 0,5 a 1 mg/kg/min. Bibliografía Recomendada 1. Annane, et al: Etomidate and fatal outcome—even a single bolus dose may be detrimental for some patients. Br J Anaes 97:116–117, 2006. 2. Djillali A: ICU physicians should abandon the use of etomidate! Intensive Care Med 31:325–326, 2005. 3. Wysowski DK: Reports of death with use of propofol for nonprocedural (long-term) sedation and literature review. Anesthesiology 105:1047–1051, 2006. James Duke, MD, MBA Capítulo 13 Relajantes musculares y monitorización de la actividad relajante 1. Describa la anatomía de la unión neuromuscular. Un nervio motor se ramifica cerca de su terminación para contactar con muchas células mus­ culares, perdiendo mielina para ramificarse más y tener un contacto más cercano con la zona de unión de la superficie muscular. En la porción más distal de la neurona motora, se hallan las vesículas, que contienen el neurotransmisor acetilcolina (ACh). La neurona terminal y la superficie muscular se aproximan mediante filamentos de proteína, y el espacio entre ellas se conoce como «hendidura sináptica». Dentro de la hendidura también existe líquido extracelular con acetilcolinesterasa, la enzima responsable de metabolizar la ACh. La membrana motora post­ sináptica está altamente especializada e invaginada, y los codos de estos pliegues son ricos en receptores de la ACh (Figura 13-1). Figura 13-1. La unión neuromuscular. (De Kandel ER, Schwartz JH, Jessel TM, editors: Principles of neural science, ed 3, New York, 1991, Elsevier, p 136.) © 2011. Elsevier España, S.L. Reservados todos los derechos 95 96 Capítulo 13 Relajantes musculares y monitorización de la actividad relajante 2. ¿Cuál es la estructura del receptor de la acetilcolina? El receptor de la ACh se encuentra en la membrana de la célula motora, y consiste en cinco subunidades de glucoproteína: dos a y una b, d y ε. Éstas se distribuyen de forma cilíndrica; el centro del cilindro es un canal iónico. La ACh se une a las subunidades a. 3. En cuanto a la transmisión neuromuscular, enumere todas las localizaciones de los receptores de acetilcolina. Los receptores de la ACh se encuentran en diferentes zonas: Unos 5 millones de receptores de la ACh por cada unión neuromuscular (UNM) se encuen­ tran en la membrana motora postsináptica. Existen receptores presinápticos e influyen en la liberación de la ACh. Los receptores pre­ sinápticos y postsinápticos tienen diferentes afinidades por la ACh. Los receptores extrasinápticos se localizan a lo largo del músculo esquelético en canti­ dades relativamente bajas, debido a la supresión de su síntesis por la actividad neuronal normal. En los casos de músculo esquelético traumatizado o lesiones con denervación, estos receptores proliferan. 4. Comente los pasos de la transmisión neuromuscular normal. Se transmite el potencial de acción nervioso y la terminal nerviosa se despolariza. Se libera ACh de las vesículas de almacenamiento de la terminal nerviosa. Se libera suficiente ACh para unirse a 500.000 receptores. Las moléculas de ACh se unen a las subunidades alfa del receptor de la ACh en la mem­­ brana postsináptica, generando un cambio conformacional y abriendo canales del receptor. Los receptores no se abren hasta que ambos receptores alfa han sido ocupados por ACh (es el fundamento del antagonismo competitivo de los relajantes no despolarizantes). El sodio y el calcio circulan a través del canal abierto del receptor, generando la elevación del potencial en la placa motora. Cuando el 5-20% de los canales del receptor se ha abierto y el potencial umbral se ha alcanzado, se origina el potencial de acción muscular (PAM). La propagación del PAM a lo largo de la membrana muscular conduce a la contracción muscular. La rápida hidrólisis de la ACh por la acetilcolinesterasa (verdadera colinesterasa) en la hendi­ dura sináptica y la recuperación de los gradientes iónicos normales hacen que la unión neu­ romuscular vuelva a un estado de no despolarización, de reposo, y se cierren los receptores de ACh. 5. ¿Cuáles son los riesgos y los beneficios del empleo de relajantes musculares? Al interferir con la trasmisión neuromuscular normal, estos fármacos paralizan el músculo esquelético, y pueden emplearse para facilitar la intubación endotraqueal, ayudar con la ven­ tilación mecánica y optimizar las condiciones quirúrgicas. Ocasionalmente, pueden emplearse para reducir las demandas metabólicas de la respiración y facilitar el tratamiento de la presión intracraneal (PIC) elevada. Ya que todos los músculos respiratorios quedan paralizados, son fármacos peligrosos en pacientes no intubados, a menos que quien los administre esté en­ trenado para el manejo de la vía aérea. 6. ¿Cómo se clasifican los relajantes musculares? Relajantes despolarizantes: la succinilcolina (SC) está formada por dos moléculas de ACh unidas, es un agonista en la UNM, y es el único relajante despolarizante disponible en clínica. Como tal, la SC se une a las subunidades alfa del receptor de ACh. Tras unirse, la SC puede abrir el canal iónico y despolarizar la placa motora. Aunque la SC, como la ACh, se une brevemente con el receptor, no se hidroliza en la hendidura sináptica por la acción de la acetilcolinesterasa. De hecho, las moléculas de SC se pueden separar y volver a unirse a los receptores repetidamente. La SC debe difundirse y descomponerse en el plasma por enzimas llamadas seudocolinesterasas plasmáticas, y el tiempo de eliminación del organismo es una medida precisa de la duración de su efecto. Capítulo 13 Relajantes musculares y monitorización de la actividad relajante 97 Relajantes no despolarizantes: estos fármacos son antagonistas competitivos de la ACh en la membrana postsináptica. Sólo necesitan unirse a una de las dos subunidades alfa para evitar la abertura del poro iónico. © Elsevier. Fotocopiar sin autorización es un delito 7. ¿Cuáles son las indicaciones para el empleo de la succinilcolina? La SC proporciona el comienzo y el fin del efecto más rápido de todos los relajantes muscula­ res (RM) disponibles actualmente. Comienza a los 60-90 segundos, y la duración de su efecto es de sólo 5-10 minutos. Cuando el paciente tiene el estómago lleno y hay riesgo de aspiración pulmonar del contenido gástrico, la parálisis rápida y el control de la vía aérea son una priori­ dad, y la SC es, a menudo, el fármaco indicado. (El rocuronio, si se administra a dosis altas, también tiene un comienzo de acción como el de la SC, aunque su duración del efecto pro­ longada podría contraindicar su uso en pacientes con posible dificultad de ventilar o intubar.) Los pacientes con riesgo por estómago lleno son, entre otros, aquellos con diabetes mellitus, hernia de hiato, obesidad, embarazo, dolor grave, obstrucción intestinal o traumatismo. 8. Si la succinilcolina funciona tan rápidamente y de forma predecible, ¿por qué no se usa siempre? La SC tiene numerosos efectos secundarios: La SC estimula tanto a los receptores colinérgicos nicotínicos como a los muscarínicos. La estimulación de los receptores muscarínicos en el nódulo sinusal provoca numerosas bradiarritmias, incluyendo bradicardia sinusal, ritmos de la unión, de escape ventricular y asistolia. La SC es un desencadenante de la hipertermia maligna. La exposición prolongada de los receptores a la SC deja abierto permanentemente el canal del receptor, y con ello se producen flujos iónicos continuos a través del poro iónico, lo que se conoce como bloqueo de fase II o desensibilización. La despolarización/repolarización normal no puede producirse hasta que la SC se ha metabolizado. En pacientes de cirugía ambulatoria, las contracciones musculares generalizadas (fascicu­ laciones) se han asociado con mialgias dolorosas. Se sigue discutiendo si el tratamiento con una dosis subparalizante de un relajante no despolarizante antes de la SC, es efectivo para reducir las mialgias. La SC aumenta la PIC. La etiología no se conoce totalmente, pero se sabe que una dosis subparalizante de un relajante no despolarizante antes de la administración de SC reduce el aumento en la PIC, por lo que tal vez las fasciculaciones son la causa del aumento de la PIC. En presencia de receptores extrasinápticos inmaduros, la administración de SC puede provocar hiperpotasemia grave y arritmias ventriculares malignas. Los receptores fuera de la unión se suprimen por la actividad en situaciones normales. Cualquier situación que disminuya la actividad nerviosa motora provoca una proliferación de estos receptores. Algunos ejemplos son las lesiones de la médula espinal u otras denervaciones, enferme­ dad de la motoneurona alta y baja, traumatismos craneales, quemaduras, enfermedades neuromusculares, e incluso la inmovilización prolongada. La SC aumenta la presión intraocular (PIO). Existe el riesgo teórico de que el uso de SC en pacientes con traumatismos oculares abiertos provoque la expulsión de contenidos fuera del ojo. Sin embargo, el aumento de la PIO es moderado, y desde el punto de vista clínico no se ha observado la expulsión de contenidos oculares. Si se administra un agente no despolarizante en vez de SC, y el paciente es intubado antes de tener las condiciones ópti­ mas para la intubación, la reacción al tubo endotraqueal aumenta la PIO significativamente, y pone al paciente en riesgo de expulsión de contenidos oculares. 9. ¿Cómo se diferencian los receptores maduros e inmaduros de la acetilcolina? Los receptores maduros de la ACh también se conocen como receptores inervados o recepto­ res ε (por la subunidad ε del receptor de ACh). Están estrechamente agrupados en la UNM y son responsables de la activación neuromuscular normal. Los receptores inmaduros, también 98 Capítulo 13 Relajantes musculares y monitorización de la actividad relajante conocidos como fetales, extrajuncionales o receptores g, difieren de los receptores maduros en que están presentes durante el desarrollo fetal y se inhiben por la actividad normal, están dispersos por toda la membrana muscular en lugar de estar localizados en la UNM, y tienen una subunidad g, pero no una subunidad ε como parte del receptor. La vida media de los receptores maduros es de unas 2 semanas, mientras que la vida media de los receptores inmaduros es menor de 24 horas. Los receptores inmaduros se despolarizan más fácilmente en presencia de ACh o SC y, por lo tanto, tienen una mayor tendencia a liberar potasio. Asi­ mismo, una vez despolarizados, los receptores inmaduros tienden a estar abiertos durante más tiempo. Los receptores inmaduros están sobrerregulados en presencia de lesiones por denervación, quemaduras y similares. Esto también exacerba el potencial de hiperpotasemia al administrar SC. 10. Distinga entre las deficiencias cualitativas y cuantitativas de seudocolinesterasas. Las seudocolinesterasas se producen en el hígado y circulan en el plasma. Las deficiencias cuantitativas de seudocolinesterasas se observan en la enfermedad hepática, embarazo, cáncer, malnutrición, vasculopatía del colágeno e hipotiroidismo; éstas prolongan la duración del blo­ queo con SC. Sin embargo, desde un punto de vista práctico el aumento en la duración del SC no es, probablemente, de importancia clínica. También pueden existir deficiencias cualitativas de las seudocolinesterasas; es decir, la acti­ vidad de la enzima está alterada. Son enfermedades congénitas, y pueden presentarse tanto en forma homocigota como heterocigota. La forma más habitual es la llamada déficit de colineste­ rasa resistente a la dibucaína, y hace referencia a la prueba de laboratorio que la define. Cuando se añade al suero en el laboratorio, la dibucaína inhibe la colinesterasa plasmática normal en un 80%, mientras que la colinesterasa plasmática atípica es inhibida sólo en un 20%. Así, un paciente con seudocolinesterasa normal es asignado con un número de dibucaína 80. Si el paciente tiene un número de dibucaína de 40-60, entonces el paciente es heterocigoto para esta seudocolinesterasa atípica, y tendrá un bloqueo con SC moderadamente prolongado y general­ mente insignificante clínicamente. Si un paciente tiene un número de dibucaína 20, el paciente es homocigoto para la colinesterasa plasmática atípica y tendrá un bloqueo extremadamente prolongado con SC. 11. Comente las propiedades de los relajantes musculares no despolarizantes. Los relajantes no despolarizantes son antagonistas competitivos en la UNM, y se clasifican según la duración de su acción (corta, intermedia o larga). Las dosis, el inicio y la duración de su efecto se detallan en la Tabla 13-1. 12. Comente el metabolismo de los relajantes musculares no despolarizantes. Relajantes aminoesteroides (p. ej., pancuronio, vecuronio, pipecuronio y rocuronio) se diacetilan en el hígado, y su acción puede prolongarse por la disfunción hepática. El vecu­ ronio y el rocuronio también pueden tener una excreción biliar significativa, y sus acciones pueden verse prolongadas por la obstrucción biliar extrahepática. Los relajantes con excreción renal significativa son tubocurarina, metocurina, doxacurio, pancuronio y pipecuronio. El atracurio es único en su metabolismo ya que sufre una descomposición espontánea a temperatura y pH fisiológicos (eliminación Hoffmann), además de hidrólisis éster, por lo que es ideal para el empleo en pacientes con función hepática o renal afectadas. El mivacurio como la SC, se metaboliza por la seudocolinesterasa. 13. Describa los efectos secundarios habituales de los relajantes musculares no despolarizantes. La liberación de histamina es mayor con d-tubocurarina, pero también aparece con mivacu­ rio, atracurio y doxacurio. La cantidad de histamina liberada es, generalmente, dependiente de la dosis. El cisatracurio no parece causar una liberación de histamina importante. Un efecto secundario del pancuronio, es la taquicardia, debido a la estimulación ganglionar y a la vagólisis. Capítulo 13 Relajantes musculares y monitorización de la actividad relajante 99 TA B LA 1 3 - 1 . Pr o p i e d a d e s d e l o s r e l a j a n t e s m u s c u l a r e s n o despolarizantes Relajante De acción corta Mivacurio Rocuronio De acción intermedia Rocuronioc Vecuronio Atracurio Cisatracurio De acción larga Pancuronio Pipecuronio Doxacurio ED95a (mg/kg) Dosis de intubación (mg/kg) Inicio tras la dosis de intubación (minutos) Duraciónb (minutos) 0,08 0,3 0,2 0,6 1-1,5 2-3 15-20 30 0,3 0,05 0,23 0,05 1,2 0,15-0,2 0,75 0,2 1 1,5 1-1,5 2 60 60 45-60 60-90 0,07 0,05 0,025 0,08-0,12 0,07-0,85 0,05-0,08 4-5 3-5 3-5 90 80-90 90-120 aED , dosis a la que se espera reducir la altura del impulso único en un 95%. 95 bDuración medida como la recuperación de la contracción del impulso único al 25% del control. rocuronio administrado a una dosis de 1,2 mg/kg tiene un comienzo similar al de la succinilcolina, aunque la duración es bastante más prolongada. © Elsevier. Fotocopiar sin autorización es un delito cEl 14. Comente los fármacos que potencian las acciones de los relajantes musculares. Los anestésicos halogenados potencian a los relajantes por varias razones, entre ellas la depresión del sistema nervioso central (SNC), aumento del flujo sanguíneo (y, por tanto, de llegada de moléculas relajantes) al músculo, y desensibilización de la membrana post­ sináptica. Los anestésicos locales afectan a las membranas motoras presinápticas y postsinápticas, deprimiendo las funciones normales en estas localizaciones. Los bloqueantes de los canales del calcio y b-adrenérgicos afectan al transporte iónico, pero su importancia clínica en la UNM es probablemente ínfima. Los antibióticos, y más particularmente los aminoglucósidos, parecen tener efectos presináp­ ticos y postsinápticos negativos. La penicilina y las cefalosporinas no afectan a la actividad relajante. El magnesio inhibe la liberación y el efecto de despolarización de la ACh y disminuye la exci­ tabilidad de fibras musculares. El litio también potencia el bloqueo neuromuscular. El uso de esteroides a largo plazo conduce a una miopatía y también tiene algún efecto en la UNM, particularmente cuando los relajantes musculares se han utilizado durante un período prolongado. El dantroleno deprime directamente el músculo esquelético y perjudica la excitacióncontracción. 15. ¿Qué situaciones clínicas potencian las acciones de los relajantes musculares? La acidosis respiratoria, alcalosis metabólica, hipotermia, hipopotasemia, hipercalcemia e hiper­ magnesemia potencian el bloqueo. La disfunción hepática o renal también aumenta la duración de la acción de los relajantes. 100 Capítulo 13 Relajantes musculares y monitorización de la actividad relajante 16. Comente las características importantes del neuroestimulador. Un neuroestimulador debe liberar una estimulación de impulso único de 0,1 Hz (un estímulo cada 10 segundos), tren de cuatro (TOF) a 2 Hz (dos por segundo), y estimulación tetánica a 50 Hz (50 por segundo). El electrodo negro del estimulador está cargado negativamente, y el electrodo rojo está cargado positivamente. El electrodo negro despolariza la membrana, mien­ tras que el rojo la hiperpolariza. Aunque la estimulación es posible cualquiera que sea la posición de los electrodos, la máxima altura de la contracción sucede cuando el electrodo negativo se coloca lo más cerca posible del nervio. 17. Enumere los diferentes patrones de estimulación. Estímulo único (twitch). Estimulación TOF. Estimulación tetánica. Facilitación postetánica y cuenta postetánica. Estimulación doble-ráfaga. 18. ¿Cuál es el modo más sencillo de neuroestimulación? La contracción del estímulo único es el modo más sencillo de neuroestimulación. Consiste en la liberación de impulsos únicos separados por, al menos, 10 segundos, pero es de utilidad clínica limitada. 19. ¿Cuál es el modo de neuroestimulación más usado para valorar el grado de blo­ queo? ¿Cómo se lleva a cabo? La estimulación TOF es la modalidad más habitual para valorar el grado de bloqueo. Se liberan cua­ tro estímulos a frecuencia de 2 Hz (dos por segundo), y la proporción entre la amplitud de la cuarta y la primera respuesta en una sucesión de cuatro estímulos (tren) (cociente T4:T1) valora el grado de bloqueo. Los cuatro impulsos del TOF desaparecen en orden inverso al grado de profundidad del bloqueo. La cuarta respuesta del TOF desaparece cuando el 75-80% de los receptores está ocu­ pado, la tercera respuesta desaparece al 85% de ocupación, la segunda respuesta desaparece al 85-90% de ocupación, y la primera respuesta al 90-95% de ocupación. Sin embargo, existe eviden­ cia acumulativa de que la valoración visual o táctil de la respuesta TOF es insuficiente para valorar la función neuromuscular, porque se ha demostrado repetidamente que incluso si el anestesiólogo es experto, las estimaciones de TOF subjetivas se correlacionan mal con la desaparición del verdadero TOF. Recientemente, se han recomendado medidas más objetivas de la recuperación de la función motora, como la aceleromiografía, la monitorización de la fuerza de tensión y la electromiografía. P U N TOS CLAVE: R elaj antes m usculares 1. El metabolismo de los relajantes es más importante que su reversión farmacológica para la finalización del efecto relajante. 2. La valoración visual del tren de cuatro es muy subjetiva y se ha demostrado en varias ocasiones que subestima el bloqueo neuromuscular residual. 3. La mejor práctica sería administrar agentes para la reversión a todos los pacientes que reciben relajantes no despolarizantes. 4. Dejar intubados y con respiración asistida a los pacientes clínicamente débiles hasta que pue­ dan mostrar la recuperación de su fuerza. 20. ¿Qué es la estimulación tetánica? La estimulación tetánica consiste en una estimulación repetitiva de alta frecuencia, a frecuencias de 50 Hz o más. La pérdida de contracción durante la estimulación tetánica, conocida como desvanecimiento tetánico, es un indicador sensible del bloqueo neuromuscular residual. La estimulación Capítulo 13 Relajantes musculares y monitorización de la actividad relajante 101 tetánica causa la liberación de ACh desde la membrana presináptica, disminuyendo la validez de estimulaciones nerviosas posteriores que se den en los siguientes 30 minutos, llevando a la so­ brestimación de la recuperación de la función neuromuscular. El estímulo tetánico es doloroso. 21. Explique la facilitación postetánica y la cuenta postetánica. Esta forma de estimulación es útil en períodos de bloqueo neuromuscular intenso (cuando no existe respuesta a la estimulación TOF), y amplía la información que proporciona la monitoriza­ ción. Es un indicador de cuándo se prevé la recuperación de un impulso único, y con ello, cuán­ do se puede revertir el bloqueo neuromuscular. La aplicación de un estímulo de 50 Hz durante 5 segundos se sigue de impulsos únicos repetitivos a 1 Hz durante 3 segundos. El número de impulsos que se observa es inversamente proporcional al grado de bloqueo. 22. ¿Qué es la estimulación de doble ráfaga? La estimulación de doble ráfaga (DB) parece ser más sensible que la estimulación TOF para detectar pequeños grados de bloqueo neuromuscular residual. La DB supone la aplicación de una ráfaga inicial de tres impulsos a 50 Hz en 0,2 milisegundos, seguidos de una estimulación idéntica durante 750 milisegundos. La magnitud de las respuestas a la DB es, aproximadamente, tres veces mayor que la de la estimulación TOF, facilitando así la valoración del grado de desva­ necimiento existente. 23. ¿Qué es la aceleromiografía? Preocupa que las cualidades visuales y táctiles de la estimulación TOF convencional y la evalua­ ción de la fuerza levantando la cabeza durante 5 segundos no proporcionen suficiente informa­ ción cuantitativa para detectar todos los casos de bloqueo neuromuscular residual. El concepto de la aceleromiografía es que, dado que la fuerza es proporcional a la aceleración, ésta se mide durante la estimulación TOF. Se cree que la aceleromiografía proporciona comparativamente más información cuantitativa sobre la estimulación TOF, y cada vez existen más evidencias de que la aceleromiografía debería utilizarse de forma rutinaria para reducir la incidencia de debi­ lidad residual. © Elsevier. Fotocopiar sin autorización es un delito 24. ¿Qué nervios pueden elegirse para la neuroestimulación? Se puede emplear cualquier nervio fácilmente accesible, pero el nervio más habitualmente esti­ mulado es el cubital. Se observa la contracción de los músculos aductores del pulgar. La rama oftálmica del nervio facial también puede estimularse, controlando la contracción del músculo orbicular. La estimulación del nervio peroneal cerca de la cabeza del peroné provoca la dorsifle­ xión del tobillo. La estimulación del nervio tibial posterior y del tobillo provoca la flexión plantar del primer dedo del pie. 25. ¿Cuáles son las respuestas características a los diversos patrones de estimu­ lación producidos por los relajantes no despolarizantes? La estimulación repetitiva (TOF o tétanos) se asocia con desvanecimiento en la respuesta muscular. Tras el estímulo tetánico, la respuesta a estímulos posteriores aumenta (facilitación postetá­ nica). Esto puede deberse al aumento de la liberación de ACh o al aumento de la sensibilidad en la placa terminal (Figura 13-2). Figura 13-2. Respuesta al bloqueo por relajante muscular no despolarizante. (De Bevan DR, Bevan JC, Donati F: Muscle relaxants in clinical anesthesia, Chicago, 1988, Year Book, pp 49-70.) 102 Capítulo 13 Relajantes musculares y monitorización de la actividad relajante 26. Resuma las respuestas características de los diversos patrones de neuroesti­ mulación producidos por los relajantes despolarizantes (succinilcolina). Las amplitudes de la respuesta al impulso único y del tétanos disminuyen uniformemente a cual­ quier nivel de bloqueo. Existen una falta de desvanecimiento en respuesta al TOF y al tétanos, y una falta de facilitación postetánica. Puede producirse una desensibilización o bloqueo en fase II con la exposición prolongada a SC. El bloqueo en fase II tiene las mismas características de respuesta al impulso único que el bloqueo no despolarizante (Figura 13-3). Figura 13-3. Respuesta al bloqueo por relajante muscular despolarizante. (De Bevan DR, Bevan JC, Donati F: Muscle relaxants in clinical anesthesia, Chicago, 1988, Year Book, pp 49-70.) 27. Basándonos en la neuroestimulación, ¿qué es una relajación muscular adecua­ da para la cirugía? La relajación adecuada se consigue cuando se produce una o dos contracciones de la respuesta TOF, correlacionándose con el 80% de la depresión de la altura de un impulso único. Sin em­ bargo, los anestésicos halogenados, otros fármacos y el estado de salud del paciente también pueden afectar a la fuerza muscular, y bajo estas circunstancias los niveles más superficiales de bloqueo pueden ser suficientes. 28. ¿Cómo puede terminarse la actividad relajante? Se puede terminar por agonismo competitivo en la UNM, administrando inhibidores de la ace­ tilcolinesterasa que impiden el metabolismo de la ACh, aumentando la concentración de ACh en la UNM. Alternativamente, el relajante podría migrar de su lugar de acción, cuando existe un gradiente de concentración que lo favorece. Habitualmente dicho gradiente de concentración se crea por el metabolismo del relajante. Sin embargo, la fijación selectiva de las moléculas relajantes es una alternativa farmacológica en auge en la práctica clínica. El primer fármaco de este tipo que probablemente esté disponible es el sugammadex. 29. Revise las propiedades del sugammadex. El sugammadex es una ciclodextrina modificada que forma complejos extremadamente hidro­ solubles con los relajantes con núcleo esteroideo (rocuronio > vecuronio >> pancuronio). De forma gráfica puede decirse que la molécula de ciclodextrina tiene forma de donut; el relajante se une en el interior del agujero, y la velocidad de disociación es muy baja. La unión de la molécula relajante al sugammadex crea un gradiente de concentración fuera de la UNM. Su eficacia no depende de la excreción renal del complejo ciclodextrina-relajante. Parece que el sugammadex está relativamente desprovisto de efectos secundarios. El sugammadex no afecta a la acetilcoli­ nesterasa ni a otros receptores colinérgicos. 30. ¿Cómo podría el sugammadex modificar la práctica anestésica? Ya se han comentado aquí el papel de la SC para asegurar rápidamente la vía aérea, al igual que los numerosos efectos secundarios de la SC. La innovación farmacológica en el desarro­ llo de relajantes musculares per se no ha dado como resultado un relajante no despolarizante con un inicio de acción rápido y de corta duración, y desprovisto de los efectos secundarios preocupantes. Sin embargo, el sugammadex puede resultar una alternativa útil si permite que el clínico administre rocuronio en dosis relajantes rápidas (≈1,2 mg/kg) y disponga de una vía de antagonismo farmacológico poco tiempo después de la administración del relajante gracias a una fijación firme de las moléculas relajantes circulantes. De hecho, el empleo de sugammadex Capítulo 13 Relajantes musculares y monitorización de la actividad relajante 103 después de la administración de rocuronio puede proporcionar un perfil más rápido de inicio-fi­ nal que la SC administrada a una dosis de 1 mg/kg y evitar la necesidad de administrar fármacos anticolinesterásicos. Por último, debe mencionarse que la eliminación del bloqueo neuromuscu­ lar residual en el período postoperatorio constituiría un beneficio clínico indiscutible. 31. Comente el momento adecuado para revertir un bloqueo neuromuscular basán­ dose en la neuroestimulación. El mejor método para finalizar el efecto relajante es no dar dosis mayores de las necesarias y permitir que se metabolice el relajante. Recuerde que sólo una de las dos subunidades alfa del receptor postsináptico debe ser ocupada por la molécula del relajante para inhibir la función, mientras que se necesitan las dos moléculas de ACh para estimular al receptor; por ello, aunque los relajantes no despolarizantes son antagonistas competitivos, el receptor funciona a favor de los relajantes. Con esto, el bloqueo neuromuscular puede revertirse cuando existe por lo menos una respuesta con la estimulación TOF. Sin embargo, esto todavía refleja un nivel muy profundo de bloqueo, y el clínico debe monitorizar al paciente en busca de signos clínicos de in­ suficiente recuperación de la fuerza. Cuantas más respuestas al TOF existan cuando se revierte, mejor. También es importante recordar que los estímulos tetánicos recientes pueden provocar una sobrestimación del TOF. 32. Comente los inhibidores de la acetilcolinesterasa que se emplean habitualmen­ te para antagonizar el bloqueo no despolarizante. Los inhibidores de la acetilcolinesterasa impiden el metabolismo de la acetilcolinesterasa, au­ mentando la cantidad de ACh disponible en la UNM. La neostigmina en 25-70 mg/kg y el edro­ fonio en 0,5-1 mg/kg se emplean habitualmente con este fin perioperatoriamente. El edrofonio también estimula la membrana presináptica, aumentando la liberación de ACh. Estos fármacos contienen grupos de amonio cuaternario cargados positivamente, son hidrosolubles y se ex­ cretan por el riñón. © Elsevier. Fotocopiar sin autorización es un delito 33. Comente los efectos secundarios importantes tras la administración de los inhi­­ bidores de la acetilcolinesterasa. Al aumentar la ACh disponible en la UNM (que tiene receptores nicotínicos), también se esti­ mulan los receptores colinérgicos muscarínicos. Es especialmente preocupante el efecto en la conducción cardíaca. Los efectos muscarínicos, sin antagonizar, afectarán a la conducción del nodo sinusal provocando bradicardia sinusal, ritmos de la unión y, en casos extremos, asistolia. Para evitar esto, se administran anticolinérgicos junto con los inhibidores de acetilcolinestera­ sa. Se administra glicopirrolato 7-15 mg/kg junto con neostigmina y atropina 7-10 mg/kg con edrofonio; así, el comienzo de la actividad anticolinérgica se coordina adecuadamente con el comienzo de la inhibición de la acetilcolinesterasa. 34. ¿Debería revertirse a todos los pacientes a quienes se les administran relajan­ tes no despolarizantes? Existe abundante evidencia sobre la gran frecuencia con que se observa bloqueo neuromuscular residual y debilidad clínica, incluso cuando el paciente sólo ha recibido una dosis de relajante no despolarizante de duración intermedia. Estos efectos residuales se observan incluso 2 horas después de una dosis única. Parte de este problema parecen ser malinterpretaciones subjetivas de la recuperación completa de TOF, como se comentó anteriormente. Al parecer, es una práctica prudente la reversión rutinaria de todos los pacientes. 35. Comente los signos clínicos asociados con la insuficiente recuperación de la fuerza. Véase la Tabla 13-2. 36. Un paciente está débil tras la reversión farmacológica de un bloqueo neuromus­ cular. ¿Qué factores deben tenerse en cuenta? ¿Ha transcurrido el tiempo suficiente para observar el máximo efecto de reversión? ¿Era el bloqueo tan intenso que no permitía la reversión? 104 Capítulo 13 Relajantes musculares y monitorización de la actividad relajante TA B LA 1 3 - 2 . Pr u e b a s d e r e c u p e r a c i ó n d e l a f u n c i ó n n e u r o m u s c u l a r Prueba Resultado Porcentaje de receptores ocupados Volumen corriente Contracción única (twitch) Tren de cuatro Tétanos mantenido (50 Hz, 5 segundos) Capacidad vital Estimulación doble ráfaga Tétanos mantenido (100 Hz, 5 segundos) Fuerza inspiratoria Elevación de la cabeza Aprieta la mano Mordida mantenida >5 ml/kg Vuelta al nivel basal Sin desvanecimiento Sin desvanecimiento 80 75-80 70-75 70 >20 ml/kg Sin desvanecimiento Sin desvanecimiento 70 60-70 50 >–40 cmH2O Mantenido 5 segundos Vuelta al nivel basal Mantiene la sujeción con los dientes de un depresor lingual 50 50 50 50 ¿Está el monitor de neuroestimulación funcionando y los electrodos se hallan bien colocados? ¿Son normales la temperatura corporal, el estado ácido-base y el equilibrio electrolítico? La hipotermia potencia el bloqueo neuromuscular, al igual que la acidosis, la hipopotasemia, la hipocalcemia y la hipermagnesemia. ¿Recibe el paciente otros fármacos que potencien el bloqueo neuromuscular? ¿Cómo es la función renal y hepática del paciente? Es muy importante no extubar al paciente mientras esté débil. Generalmente el tiempo lo cura todo. Bibliografía Recomendada 1. Herrerling TM, Le N: Brief review: Neuromuscular monitoring: an update for clinician. Can J Anesth 54:58–72, 2007. 2. Hirsch NP: Neuromuscular junction in health and disease. Br J Anaesth 99:132–138, 2007. 3. Martyn JAJ, Richtsfeld M: Succinylcholine-induced hyperkalemia in acquired pathologic states. Anesthesiology 104:158–169, 2006. 4. Naguib M: Sugammadex: Another milestone in clinical neuromuscular pharmacology. Anesth Analg 104:575–581, 2007. Sunil Kumar, MD, FFARCS CAPÍTULO 14 AnesTÉsicos locales 1. ¿Qué papel desempeñan los anestésicos locales en la anestesiología? Dado que los anestésicos locales bloquean reversiblemente la conducción nerviosa, se emplean para la anestesia regional en cirugía, y para proporcionar analgesia postoperatoria en las intervenciones quirúrgicas dolorosas. Los anestésicos locales atenúan la respuesta presora a la intubación traqueal, disminuyendo la tos durante la intubación y la extubación, y, además, son antiarrítmicos. 2. ¿Cómo se clasifican los anestésicos locales? Aminoésteres: los ésteres son anestésicos locales en los que la cadena intermedia forma una unión éster entre los grupos aromático y amino. Los anestésicos locales de tipo éster empleados habitualmente son: procaína, cloroprocaína, cocaína y tetracaína (Figura 14-1). Aminoamidas: las amidas son anestésicos locales con una unión amida entre los grupos aromático y amino. Los anestésicos locales de tipo amida empleados habitualmente son: lidocaína, prilocaína, mepivacaína, bupivacaína, levobupivacaína, ropivacaína y etidocaína. Figura 14-1. Estructura de los ésteres y de las amidas. 3. ¿Cómo se metabolizan los anestésicos locales? Los ésteres sufren una hidrólisis por las seudocolinesterasas que se encuentran principalmente en el plasma. Las amidas sufren una biotransformación enzimática principalmente en el hígado. Los pulmones también pueden extraer lidocaína, bupivacaína y prilocaína de la circulación. La cloroprocaína es la que tiene menos probabilidades de producir un aumento sostenido de los niveles sanguíneos debido a su rápida hidrólisis en la sangre. El riesgo de toxicidad con los ésteres aumenta en pacientes con seudocolinesterasa atípica, hepatopatías graves y en neonatos. La hepatopatía o las reducciones del flujo sanguíneo hepático, que pueden producirse en pacientes con insuficiencia cardíaca congestiva o durante la anestesia general, reducen el metabolismo de las aminoamidas. 4. ¿Cómo se conducen los impulsos en las células nerviosas? La transmisión de impulsos depende del gradiente eléctrico a través de la membrana nerviosa, que, a su vez, depende de los movimientos de los iones de sodio (Na+) y potasio (K+). La aplicación de un estímulo de suficiente intensidad conduce a un cambio en el potencial de membrana (de –90 mV a –60 mV), y con ello, a la despolarización del nervio y la propagación del impulso. © 2011. Elsevier España, S.L. Reservados todos los derechos 105 106 CAPÍTULO 14 AnesTÉsicos locales La despolarización se debe a la entrada de iones Na+ desde el espacio extracelular al intracelular. La repolarización se debe a la salida de los iones K+ desde el espacio intracelular al extracelular. La bomba Na+-K+ restablece el equilibrio en la membrana nerviosa tras completarse el potencial de acción. 5. ¿Cuál es el mecanismo de acción de los anestésicos locales? La cascada de eventos (Figura 14-2) es la siguiente: Difusión de las formas no ionizadas (base) a través de la vaina nerviosa y la membrana. Reequilibrio entre las formas base y catiónica en el axoplasma. Unión del catión al receptor dentro del canal del Na+, provocando su bloqueo y, con ello, la inhibición de la conducción de Na+. Figura 14-2. Mecanismo de acción de los anestésicos locales. 6. Su paciente afirma ser alérgico a la novocaína, que recibió para una extracción dental. ¿Debería evitar el empleo de anestésicos locales en este paciente? Probablemente no. La alergia a los anestésicos locales es rara a pesar del empleo frecuente de anestésicos locales. Menos de un 1% de las reacciones adversas a los anestésicos locales son alergias verdaderas. La mayoría de las reacciones etiquetadas como alérgicas probablemente son una respuesta vasovagal, toxicidad sistémica o efectos sistémicos de la adrenalina. La alergia verdadera debe considerarse cuando hay antecedentes de exantema, broncoespasmo, edema laríngeo, hipotensión, aumento de la triptasa sérica y pruebas intradérmicas positivas. Los ésteres producen metabolitos relacionados con el ácido p-aminobenzoico y es más probable que provoquen reacciones alérgicas que los anestésicos locales de tipo amida. Las reacciones alérgicas tras la administración de anestésicos locales también pueden deberse al metilparabeno o a otros conservantes existentes en las preparaciones comerciales de los anestésicos locales. No existe sensibilidad cruzada entre las diferentes clases de anestésicos locales. Por tanto, los pacientes con alergias conocidas a los anestésicos locales de tipo éster pueden recibir anestésicos locales de tipo amida. Se aconseja precaución en caso de que el paciente sea alérgico al conservante, que puede ser común en ambas clases de fármacos. CAPÍTULO 14 AnesTÉsicos locales 107 TA B L A 1 4 - 1 . P ot e n c i a d e lo s a n e s té s i co s local e s Unión a proteínas (%) Duración pKa Agente Liposolubilidad Potencia relativa Procaína 2-Cloroprocaína <1 >1 1 3 5 – Corta Corta 8,9 8,7 Mepivacaína Lidocaína Bupivacaína Tetracaína Etidocaína Ropivacaína 1 3 28 80 140 14 1,5 2 8 8 8 8 75 65 95 85 95 94 Media Media Larga Larga Larga Larga 7,7 7,9 8,1 8,5 7,9 8,1 Tiempo de comienzo Lento Muy rápido Rápido Rápido Moderado Lento Rápido Moderado 7. ¿Qué determina la potencia de un anestésico local? A mayor solubilidad, mayor potencia (Tabla 14-1). Esta relación es más clara experimentalmente en nervios aislados que en situaciones clínicas, cuando factores como la vasodilatación y la redistribución tisular en respuesta a los distintos anestésicos locales influyen en la duración del efecto del anestésico local. Por ejemplo, la alta liposolubilidad de la etidocaína provoca un bloqueo nervioso profundo en el nervio aislado. En el uso clínico epidural, la etidocaína queda secuestrada en cantidades importantes por la grasa epidural, dejando sólo una pequeña cantidad de etidocaína disponible para el bloqueo nervioso. © Elsevier. Fotocopiar sin autorización es un delito 8. ¿Qué factores influyen en la duración de la acción de los anestésicos locales? A mayor unión con las proteínas, más larga es la duración de la acción. La duración de la acción también está influida por los efectos vasculares periféricos de los anestésicos locales. Por ejemplo, la lidocaína, la prilocaína y la mepivacaína proporcionan una anestesia de duración similar en un nervio aislado. Sin embargo, la lidocaína es un vasodilatador más potente, aumentando la absorción y el metabolismo del fármaco, y provocando así un bloqueo clínico más corto que el producido por la prilocaína o la mepivacaína. 9. ¿Qué determina el inicio de acción de un anestésico local? El grado de ionización: mientras más cercano esté la pKa del anestésico local al pH del tejido, más rápido será el comienzo de la acción. La pKa se define como el pH al que las formas ionizada y no ionizada están a igual concentración. Puesto que todos los anestésicos locales son bases débiles, aquellos con una pKa cercana al pH fisiológico (7,4) tendrán más moléculas en forma no ionizada liposolubles. A un pH fisiológico menos del 50% del fármaco está en forma no ionizada. Como se ha mencionado, la forma no ionizada debe atravesar la membrana axonal para iniciar el bloqueo neuronal. La latencia del anestésico local también puede acortarse empleando concentraciones más altas y con soluciones de anestésicos locales carbonatados para ajustar el pH local. 10. ¿Cómo se produce el inicio de la anestesia en un bloqueo nervioso periférico? El bloqueo de la conducción se produce desde la parte más externa (manto) hacia la más interna (core) de los haces nerviosos. En general, las fibras del manto inervan las estructuras proximales y las fibras del core inervan las estructuras distales. Esto explica el bloqueo precoz de las zonas más proximales, pudiendo aparecer debilidad muscular antes del bloqueo sensorial si las fibras motoras son más periféricas. 11. ¿Cuáles son las dosis máximas seguras de los diferentes anestésicos locales? Véase la Tabla 14-2. 108 CAPÍTULO 14 AnesTÉsicos locales TA B L A 1 4 - 2 . Do s i s m á x i m a s d e s e g u r i d a d d e lo s a n e s té s i co s local e s * Fármaco Dosis máxima (mg/kg) Fármaco Dosis máxima (mg/kg) Procaína Cloroprocaína Tetracaína Lidocaína 7 8-9 1,5 (tópica) 5 o 7 (con adrenalina) Mepivacaína Bupivacaína Etidocaína 5 2,5 5 *Estas dosis se basan en la administración subcutánea y son aplicables sólo para inyecciones de una única dosis. Las infusiones continuas de anestésicos locales, como puede ocurrir durante horas en la anestesia epidural del parto, permiten una mayor dosis total del anestésico antes de alcanzar niveles plasmáticos tóxicos. La dosis máxima segura también se ve influida por la vascularización de la rama de tejido y si se añade adrenalina al anestésico local. 12. Al realizar una anestesia regional, ¿qué abordaje anatómico se asocia con el mayor grado de absorción vascular sistémica del anestésico local? Bloqueo nervioso intercostal > caudal > epidural > plexo braquial > ciático-femoral > subcu­ táneo. Dado que los nervios intercostales están rodeados de una vascularización rica, los anestésicos locales inyectados en esta zona serán absorbidos más rápidamente, aumentando así la posibilidad de alcanzar niveles tóxicos. 13. ¿Por qué se añaden adrenalina y fenilefrina a los anestésicos locales? ¿Qué precauciones son aconsejables con respecto al empleo de estos fármacos? Estos fármacos provocan vasoconstricción del tejido local, limitando la recaptación del anestésico local por los vasos, prolongando así sus efectos y reduciendo su potencial tóxico (véase la pregunta 14). La adrenalina, habitualmente a una concentración 1:200.000, también es un marcador útil de inyección intravascular inadvertida. La adrenalina está contraindicada en los bloqueos de los dedos u otras zonas con escasa circulación colateral. La absorción sistémica de adrenalina también puede provocar hipertensión y arritmias cardíacas, y se aconseja precaución en pacientes con cardiopatía isquémica, hipertensión, preeclampsia y otros procesos en los que esta respuesta no sería deseable. 14. ¿Cómo se produce la intoxicación por anestésicos locales en un paciente? ¿Qué manifestaciones clínicas tiene la toxicidad por anestésicos locales? La toxicidad sistémica se debe a unos niveles plasmáticos elevados de anestésico local, generalmente por una inyección intravascular inadvertida y, con menor frecuencia, como resultado de la absorción sistémica del anestésico local desde el lugar de la inyección. La toxicidad afecta a los sistemas cardiovascular y nervioso central (SNC). Dado que el SNC generalmente es más sensible a los efectos tóxicos de los anestésicos locales, suele verse afectado en primer lugar. Las manifestaciones se presentan seguidamente en orden cronológico: Toxicidad sobre el SNC. Mareo, acúfenos, entumecimiento perioral, confusión. Fasciculaciones musculares, alucinaciones visuales y auditivas. Convulsión tónico-clónica, pérdida de conciencia, parada respiratoria. Cardiotoxicidad. Menos frecuente pero puede resultar mortal. Hipertensión, taquicardia. Disminución de la contractilidad y del gasto cardíaco, hipotensión. Bradicardia sinusal, arritmias ventriculares, parada circulatoria. CAPÍTULO 14 AnesTÉsicos locales 109 15. ¿Es el riesgo de cardiotoxicidad el mismo con los diferentes anestésicos locales? Existen varios casos descritos de parada cardíaca y asistolia tras la administración de bupivacaína, muchos de ellos asociados con reanimación difícil. La cardiotoxicidad de fármacos más potentes, como la bupivacaína y la etidocaína, difiere de la producida por la lidocaína de la siguiente forma: La relación entre la dosis necesaria para el colapso cardiovascular irreversible y la dosis que provoca toxicidad en el SNC es mucho menor para la bupivacaína y la etidocaína que para la lidocaína. El embarazo, la acidosis y la hipoxia aumentan el riesgo de cardiotoxicidad con la bupivacaína. La reanimación cardíaca es más difícil tras un colapso cardiovascular inducido por la bupivacaína. Puede deberse a la liposolubilidad de la bupivacaína, que provoca una disociación lenta de este fármaco en los canales de sodio cardíacos (entrada rápida, salida lenta). Por el contrario, la recuperación tras la administración de lidocaína, menos soluble, es rápida (entrada rápida, salida rápida). En un intento por reducir al mínimo el riesgo de toxicidad cardíaca en caso de inyección intravascular accidental, debe evitarse administrar bupivacaína en una concentración mayor del 0,5%, especialmente en anestesia obstétrica epidural. Para la analgesia postoperatoria, una concentración de bupivacaína al 0,25% generalmente proporciona un efecto excelente. P U N TOS CLAVE: A nest é sicos locales 1. Los anestésicos locales son aminoésteres o aminoamidas. Las dos clases de fármacos difieren en cuanto a su potencial alérgico y método de biotransformación. 2. La liposolubilidad, la pKa y la unión a proteínas de los anestésicos locales determinan su ­potencia, inicio de la acción y duración de la acción, respectivamente. 3. La toxicidad del SNC inducida por los anestésicos locales se manifiesta por excitación, seguida de convulsiones y posteriormente pérdida de conciencia, mientras que la hipotensión, el bloqueo de la conducción y la parada cardíaca son signos de la toxicidad cardiovascular de los anestésicos locales. © Elsevier. Fotocopiar sin autorización es un delito 4. La bupivacaína presenta el riesgo más elevado de producir arritmias cardíacas graves y colapso cardiovascular irreversible. Se debe evitar administrar una concentración mayor del 0,5%, especialmente en epidurales obstétricas. 16. ¿De qué forma se puede prevenir y tratar la toxicidad sistémica? La mayoría de las reacciones se pueden prevenir seleccionando cuidadosamente la dosis y la concentración, utilizando la dosis de prueba con adrenalina, la inyección incremental con aspiración frecuente, monitorizando al paciente por posibles signos de inyección intravascular, y empleando de forma juiciosa las benzodiazepinas para elevar el umbral convulsivo. Las convulsiones pueden dar lugar rápidamente a hipoxia y acidosis, y la acidosis empeora los efectos tóxicos. Debe asegurarse una vía aérea permeable y la ventilación adecuada con oxígeno al 100%. Si aparecen convulsiones, pequeñas dosis intravenosas de diazepam (0,1 mg/kg) o tiopental (1 a 2 mg/kg) pueden finalizar la convulsión. Los relajantes musculares de acción corta pueden estar indicados en el momento de actividad muscular o para facilitar la intubación si es necesario. El colapso cardiovascular con fibrilación ventricular resistente al tratamiento tras la administración de anestésicos locales, especialmente de bupivacaína, puede ser extremadamente difícil de reanimar. El tratamiento consiste en la reanimación cardiopulmonar sostenida, la 110 CAPÍTULO 14 AnesTÉsicos locales cardioversión repetida, dosis altas de adrenalina, y la administración de bretilio para tratar las arritmias ventriculares. La administración intravenoso de Intralipid se ha utilizado con buenos resultados en los casos en los que las medidas convencionales de reanimación han fracasado. La dosis sugerida es un bolo inicial de 1,5 ml/kg de una solución de Intralipid al 20%, que puede repetirse cada 3 a 5 minutos hasta una dosis total máxima de 8 ml/kg. 17. ¿Cuál es el riesgo de neurotoxicidad con los anestésicos locales? El riesgo global de lesiones neurológicas permanentes con la anestesia regional es extremadamente bajo. Sin embargo, en los últimos años se han descrito las dos complicaciones siguientes tras la anestesia subaracnoidea y epidural: Los síntomas neurológicos transitorios se manifiestan en forma de dolor moderado a grave en la zona lumbar, glúteos y muslos posteriores. Estos síntomas aparecen a las 24 horas de la anestesia subaracnoidea y generalmente se resuelven en 7 días. La aparición más tardía puede reflejar una etiología inflamatoria para estos síntomas. Se observan con más frecuencia tras la administración de lidocaína para anestesia subaracnoidea y son raros tras la administración de bupivacaína. Los pacientes sometidos a cirugía en la posición de litotomía parecen tener el riesgo más elevado de síntomas neurológicos tras una anestesia subaracnoidea o epidural. Síndrome de cola de caballo: inicialmente se describieron algunos casos de lesiones difusas en el plexo lumbosacro en pacientes que recibían anestesia subaracnoidea continua con lidocaína al 5% a través de microcatéteres. Se cree que el mecanismo de la lesión nerviosa es que la distribución no homogénea de la inyección subaracnoidea del anestésico local puede exponer las raíces del nervio sacro a una elevada concentración del anestésico local con la consiguiente toxicidad. También se han descrito casos raros que no llevaban microcatéteres. Se debe evitar inyectar grandes volúmenes de anestésico local en el espacio subaracnoideo, especialmente si se obtiene una respuesta menor de la esperada con la dosis inicial. 18. ¿Qué anestésico local está asociado con riesgo de metahemoglobinemia? La prilocaína y la benzocaína son los dos anestésicos locales responsables de la mayoría de casos de metahemoglobinemia relacionada con los anestésicos locales, aunque en casos excepcionales otros agentes han estado implicados. La prilocaína se metaboliza en el hígado a O-toluidina, que puede oxidar la hemoglobina a metahemoglobina. La prilocaína en dosis superiores a 600 mg produce metahemoglobinemia clínica, provocando un color cianótico en el paciente. La benzocaína pulverizada para anestesia tópica de boca y garganta puede provocar metahemoglobinemia si se emplea una cantidad excesiva en forma de múltiples pulverizaciones o pulverizando la zona durante más tiempo del recomendado. La metahemoglobina se reduce por la metahemoglobina reductasa, y este proceso se ve acelerado por la administración intravenosa de azul de metileno (1 a 2 mg/kg). 19. Describa el papel de la infusión de lípidos en el tratamiento de la toxicidad por anestésicos locales. La toxicidad sistémica por anestésicos locales es poco frecuente pero puede ser mortal debido a la resistencia relativa de la parada cardíaca inducida por anestésicos locales a las medidas estándar de reanimación. La cardiotoxicidad de la bupivacaína casi siempre ha resultado mortal, a menudo ha requerido la colocación del paciente en circulación extracorpórea hasta que el fármaco se elimina lentamente del músculo cardíaco. Los estudios realizados en animales han demostrado que la infusión de lípidos aumenta la resistencia a la toxicidad de los anestésicos locales y mejora el éxito de la reanimación por una sobredosis de anestésico local. Durante los últimos años se han publicado casos de empleo satisfactorio de emulsión lipídica en el tratamiento de la toxicidad por anestésicos locales en seres humanos. El mecanismo del efecto beneficioso se cree que es una reducción en la unión del anestésico local a los tejidos y un efecto beneficioso metabólico-energético. El protocolo para la administración de Intralipid es el siguiente: Inicialmente administrar el Intralipid al 20% a una dosis de 1,5 ml/kg durante 1 minuto. Seguidamente proceder con una infusión a una velocidad de 0,25 ml/kg/min. CAPÍTULO 14 AnesTÉsicos locales 111 Continuar con el masaje cardíaco (el lípido debe circular). Repetir el bolo cada 3 a 5 minutos hasta una dosis total de 3 ml/kg mientras no se restaura la circulación. Continuar la infusión hasta que se restablezca la estabilidad hemodinámica. Aumentar la velocidad a 0,5 ml/kg/min si la presión arterial baja. Se recomienda una dosis máxima total de 8 ml/kg. 20. ¿Cuáles son algunos de los nuevos anestésicos locales y sus posibles aplicaciones? La ropivacaína es un nuevo anestésico local de tipo amida similar a la bupivacaína en cuanto a estructura y comportamiento. Al igual que ella, se une fuertemente a las proteínas y la duración de acción es larga. Cuando se compara con la bupivacaína, es menos cardiotóxica y produce menos bloqueo motor, lo que permite lograr analgesia con menos compromiso motor (bloqueo diferencial). Sin embargo, algunas de estas ventajas pueden estar asociadas a cierta reducción de la potencia de la ropivacaína y pueden no existir cuando se comparan dosis equipotentes. La levobupivacaína es un isómero S(–) de la bupivacaína racémica y su perfil de toxicidad cardíaca y sobre el SNC es más seguro en comparación con el de la bupivacaína. Los efectos anestésicos locales son similares a los de la bupivacaína. Dado su mejor perfil de toxicidad, tanto la ropivacaína como la levobupivacaína son adecuadas en situaciones que requieren dosis relativamente altas de anestésicos locales. P á gi na w eb Rescate de lípidos, reanimación de la toxicidad cardíaca www.lipidrescue.org Bibliografía Recomendada 1. Mulroy ME: Systemic toxicity and cardiotoxicity from local anesthetics: incidence and preventive measures. Reg Anesth Pain Med 27:556–561, 2002. 2. Rosenblatt MA, Abel M: Successful use of a 20% lipid emulsion to resuscitate a patient after a presumed bupivacaine-related cardiac arrest. Anesthesiology 105:217–218, 2006. © Elsevier. Fotocopiar sin autorización es un delito 3. Strichartz GR, Berde CB: Local anesthetics. In Miller RD, editor. Anesthesia ed 6, Churchill Livingstone, Philadelphia, 2005, pp 573–603. CAPÍTULO 15 Fármacos inotrópicos y vasodilatadores Nathaen Weitzel, MD Nota del director: el capítulo 1 complementa esta discusión. 1. ¿Cuáles son los efectos beneficiosos de los fármacos cardiovasculares? Todos los componentes de la perfusión orgánica, como la precarga (volumen telediastólico), la poscarga, el inotropismo, la frecuencia cardíaca y el aporte y la demanda de oxígeno miocárdicos pueden modificarse farmacológicamente. El concepto subyacente es el principio de Frank-Starling, que establece que el aumento de longitud de las fibras miocárdicas (es decir, el volumen telediastólico) mejora la contractilidad hasta llegar a un punto de estado contráctil óptimo, a partir del cual una elongación mayor provocaría una disminución de la función. 2. Comente las limitaciones de los fármacos que modifican el tono vascular. La precarga puede modificarse por cambios en el volumen intravascular y por fármacos que varían el tono vascular, en especial los vasos de capacitancia venosa. Además, los vasodilatadores arteriales pueden mejorar el estado contráctil de un miocardio mal funcionante al reducir la poscarga y disminuir la impedancia de la eyección ventricular. Sin embargo, el estado contráctil intrínseco no mejora por los vasodilatadores, a diferencia del efecto de los fármacos inotrópicos positivos. 3. ¿Cuáles son los objetivos generales del tratamiento inotrópico y las caracterís­ ticas del inotropo ideal? El objetivo consiste en incrementar el gasto cardíaco mediante la mejora de la contractilidad miocárdica para optimizar la perfusión de los órganos finales. Además, en casos de cardiomegalia también es deseable una reducción del diámetro ventricular, de la tensión de la pared y de la demanda de oxígeno miocárdico con lo que deberían mejorar el estado contráctil y la perfusión miocárdica. Algunos fármacos inotrópicos también reducen la resistencia vascular pulmonar, mejorando el gasto cardíaco y el flujo anterógrado del lado derecho. 4. Comente el perfil hemodinámico de los inhibidores de la fosfodiesterasa III amrinona y milrinona. La amrinona y la milrinona son aproximadamente equipotentes a la dopamina y la dobutamina con respecto al aumento del gasto cardíaco a través del incremento del inotropismo y una mejo­ ría del lusitropismo (relajación miocárdica). Además de los efectos directos sobre el miocardio, se produce típicamente una vasodilatación, lo que hace difícil separar las contribuciones relativas de estos efectos al aumento del gasto cardíaco. La función del ventrículo derecho puede mejorar ya que estos fármacos disminuyen la resistencia vascular pulmonar (comparable a 20 ppm de óxido nítrico en pacientes sometidos a cirugía cardíaca), mejorando así el flujo anterógrado del corazón derecho. Los vasos coronarios y los injertos arteriales para revascularización miocárdica (arterias mamaria interna y gastroepiploica e injertos de arteria radial) se dilatan; además, en presencia de estos fármacos están menos sometidos a los efectos vasoconstrictores de los agonistas adrenérgicos a administrados de forma concomitante. 5. ¿Qué efectos indeseables pueden derivarse del uso de inhibidores de la fosfo­ diesterasa? ¿Cómo se reducen al mínimo? Dado que los efectos del vasodilatador pueden ser profundos, a menudo es necesario admi­ nistrar de forma concurrente vasoconstrictores (p. ej., adrenalina, noradrenalina y fenilefrina), en particular tras un bypass cardiopulmonar. La infusión prolongada de amrinona, pero no de 112 © 2011. Elsevier España, S.L. Reservados todos los derechos CAPÍTULO 15 Fármacos inotrópicos y vasodilatadores 113 milrinona, puede provocar una trombocitopenia significativa debido a la destrucción periférica inmunomediada de plaquetas. 6. ¿Qué otras ventajas tienen los inhibidores de la fosfodiesterasa? Además de los efectos inotrópicos y lusitrópicos positivos, la vasodilatación y la ausencia relativa de taquiarritmias significativas, estos inhibidores pueden restaurar de forma transitoria la función adrenérgica b al disminuir el catabolismo del monofosfato cíclico de adenosina (AMPc) y potenciar la acción de los agonistas adrenérgicos b administrados. Estos fármacos dilatan las arterias y los injertos coronarios, mejorando la circulación coronaria colateral, además de atenuar la actividad del tromboxano; en determinadas situaciones clínicas pueden ayudar a reducir el consumo de oxígeno miocárdico. 7. ¿Qué intermediario intracelular interviene en las acciones de los inhibidores de la fosfodiesterasa III y de las aminas simpaticomiméticas? Ambas clases de fármacos aumentan las concentraciones de AMPc intracelular. La estimulación adrenérgica b simpaticomimética activa la adenil ciclasa del sarcolema, generando un aumento de AMPc a partir del trifosfato de adenosina (ATP). Los inhibidores de la fosfodiesterasa (PDE) III reducen el catabolismo del AMPc. Se observa un efecto sinérgico cuando se infunden agonistas adrenérgicos b junto con inhibidores de la PDE III. © Elsevier. Fotocopiar sin autorización es un delito 8. ¿Cómo afecta el aumento del AMPc intracelular al miocito cardíaco? ¿Cuáles son los efectos correspondientes en la función miocárdica? El aumento del AMPc intracelular activa las proteincinasas, que fosforilan las proteínas del sarcolema, el retículo sarcoplásmico (RS) y el complejo tropomiosina. Esto provoca un aumento de la entrada de calcio (Ca2+) a través de los canales de Ca2+, amplificando los efectos del Ca2+ en los elementos contráctiles. Además, el aumento de la fosforilación proteica en el RS y el complejo tropomiosina mejora el lusitropismo al estimular la recaptación de Ca2+ hacia el RS. El resultado final es la restauración de los miofilamentos a su estado de reposo. 9. Describa los perfiles hemodinámicos de la adrenalina, noradrenalina y dopamina. Los efectos de una infusión de dosis bajas de adrenalina (<0,04 mg/kg/min) se ven limitados principalmente a la estimulación de los receptores adrenérgicos b y a en el corazón y los vasos periféricos, lo que provoca efectos cronotrópicos, dromotrópicos (velocidad de conducción), e inotrópicos positivos, aumento de la automaticidad y vasodilatación. La infusión de dosis mode­ radas (0,04 a 0,12 mg/kg/min) genera mayores efectos a-adrenérgicos y vasoconstricción, y la infusión de dosis altas provoca una vasoconstricción tan destacada que muchos de los efectos b-adrenérgicos se bloquean. Relación hemodinámica dosis-respuesta de la adrenalina: <0,04 mg/kg/min Principalmente estimulación b. 0,04 a 0,12 mg/kg/min Estimulación a y b combinada. >0,12 mg/kg/min Principalmente estimulación a. La potencia de la noradrenalina para estimular los receptores b-adrenérgicos es parecida a la de la adrenalina, pero provoca una estimulación a-adrenérgica importante en dosis mucho menores. Los límites de las dosis habituales se hallan entre 0,02 y 0,25 mg/kg/min. La dopamina estimula receptores dopaminérgicos postsinápticos específicos en los lechos arteriales renal, mesentérico y coronario para producir vasodilatación. Estos efectos dopaminérgicos se producen en dosis menores (0,5-1,0 mg/kg/min), siendo máximos con 2-3 mg/kg/min. En dosis intermedias (2-6 mg/kg/min), la estimulación b1-adrenérgica es evidente. Comenzando con dosis de unos 10 mg/kg/min (pero también tan bajas como 5 mg/kg/min), se observa estimulación a, que, con dosis mayores, supera los efectos dopaminérgicos y provoca vasoconstricción. 10. Describa los perfiles hemodinámicos del isoproterenol y la dobutamina. El isoproterenol es el agonista b1 y b2 más potente, y no posee propiedades a-estimuladoras. Por tanto, el isoproterenol aumenta la frecuencia cardíaca, el automatismo y la contractilidad, y dilata tanto los vasos de capacitancia venosa como los arteriales. Puede ser una buena opción para mantener la frecuencia cardíaca en un corazón trasplantado denervado sin marca- 114 CAPÍTULO 15 Fármacos inotrópicos y vasodilatadores pasos. La dobutamina actúa principalmente en los receptores b-adrenérgicos, siendo relativamente selectiva en los receptores b1. Además, tiene un ligero efecto estimulante b1 indirecto, que es secundario al impedimento de la recaptación de noradrenalina, pero se compensa con una estimulación b2 más potente. Generalmente, en dosis clínicas, provoca un mínimo aumento de la frecuencia cardíaca, efecto inotrópico positivo, aumento del gasto cardíaco y una disminución leve o moderada en la resistencia vascular sistémica y pulmonar. Debido al efecto estimulador indirecto b1, los pacientes que reciben conjuntamente bloqueantes b pueden mostrar un importante aumento de la resistencia vascular sistémica sin mejoría en el gasto cardíaco. Además, en casos aislados existe aumento de la frecuencia cardíaca dependiente de la dosis. 11. ¿Qué características de los agonistas adrenérgicos b limitan su eficacia? Los efectos cronotrópicos positivos y arritmogénicos (efecto dependiente de la dosis con adrenalina, isoproterenol y dobutamina) provocan un aumento del consumo de oxígeno mio­ cárdico. La vasoconstricción secundaria a la activación a (con noradrenalina, dosis altas de adrenali1 na y dosis altas de dopamina) provoca un aumento de la poscarga y el consiguiente aumento de la tensión en la pared miocárdica. El isoproterenol y la dobutamina, en menor grado, producen vasodilatación causada por la estimulación de los receptores b2 vasculares. Una vasodilatación excesiva puede disminuir la perfusión coronaria. 12. ¿De qué forma pueden reducirse al mínimo los efectos secundarios y las limita­ ciones de los agonistas adrenérgicos b? Los efectos secundarios pueden reducirse administrando la dosis adecuada y empleando combinaciones de fármacos. En la actualidad los inhibidores de la PDE III tienen una función destacada a este respecto. No obstante, tanto la vasopresina como el nicardipino a dosis bajas pueden resultar beneficiosos en estas circunstancias. 13. ¿Son los digitálicos útiles como inotropos intraoperatorios? Debido al estrecho margen terapéutico y a las interacciones adversas con los cambios de volemia y electrolitos, los digitálicos se emplean en raras ocasiones intraoperatoriamente como inotropos. 14. ¿Cuáles son los mecanismos y los lugares de acción de los nitrovasodilatadores? Los nitratos como la nitroglicerina y el nitroprusiato de sodio son profármacos que penetran en el endotelio vascular y se transforman en óxido nítrico (NO). La nitroglicerina necesita que la actividad enzimática del endotelio esté intacta, lo que no sucede en los vasos de pequeño tamaño o lesionados, mientras que el nitroprusiato se degrada de forma no enzimática en NO y cianuro (un compuesto muy tóxico para la cadena respiratoria mitocondrial). El NO estimula la producción de monofosfato cíclico de guanosina (GMPc), provocando una disminución de los niveles de calcio celular y, por tanto, la relajación de la musculatura lisa vascular. El nitroprusiato de sodio actúa principalmente en los vasos arteriales mientras que la nitroglicerina tiene su efecto más destacado en los vasos de capacitancia venosa (aunque esto no es así con dosis elevadas). El NO también puede suministrarse directamente a la circulación pulmonar mediante inhalación, llegando así a la musculatura lisa vascular del pulmón mediante difusión a través de la membrana alveolocapilar. El suministro directo a la circulación pulmonar reduce el riesgo de hipotensión sistémica indeseable y provoca vasodilatación pulmonar específica. 15. Describa los efectos antianginosos de los nitratos. Los efectos beneficiosos de la nitroglicerina y otros nitratos en el tratamiento de la angina derivan de la mejoría de la perfusión coronaria, la reducción del consumo de oxígeno miocárdico (MVO2) y los efectos antiagregantes plaquetarios. Mejora el espasmo de las arterias coronarias y se produce la dilatación de las arterias coronarias epicárdicas, de las colaterales coronarias y de los segmentos coronarios estenosados por aterosclerosis. La venodilatación reduce el retorno venoso, la presión de llenado ventricular, la tensión de la pared y el MVO2, y mejora el flujo de sangre subendocárdico y colateral. Se inhibe la agregación plaquetaria por liberación de NO y por aumento de la formación de GMPc. CAPÍTULO 15 Fármacos inotrópicos y vasodilatadores 115 P UNTOS CLAVE: Fármacos inotrópicos y vaso dilatador es 1. La insuficiencia cardíaca congestiva con preservación de la función sistólica ventricular izquierda (fracción de eyección [FE] >35%) en ausencia de isquemia y patología valvular sugiere una insuficiencia cardíaca diastólica. 2. La vasopresina interviene en el mantenimiento de la presión sanguínea en casos de shock séptico, shock cardiogénico y otros estados de shock. 3. Los efectos beneficiosos de la nitroglicerina y otros nitratos en el tratamiento de la angina derivan de la reducción del MVO2, la mejoría de la perfusión coronaria y los efectos plaquetarios. 4. El nicardipino y el clevidipino son fármacos bloqueantes del calcio de rápida acción con un perfil hemodinámico prácticamente ideal para muchos pacientes cardíacos con hipertensión. Actúan reduciendo la poscarga, aumentando el flujo de sangre coronario y mejorando el equilibrio de oxígeno miocárdico. 5. Dosis bajas de dopamina no son eficaces en la prevención ni en el tratamiento de la insuficien­­ cia renal aguda ni para la protección intestinal, y la dopamina generalmente no es un tratamiento eficaz para el shock séptico. 6. El levosimendán es un nuevo fármaco que se muestra prometedor en el tratamiento de la insu­ ficiencia cardíaca y el shock cardiogénico tras cirugía cardíaca. © Elsevier. Fotocopiar sin autorización es un delito 16. Comente la etiología de la taquifilaxia con los nitrovasodilatadores. Durante el tratamiento con nitroglicerina se presenta a menudo taquifilaxia, especialmente con el empleo prolongado, debido a los cambios en el sistema enzimático responsable de su transfor­ mación en NO. La taquifilaxia también puede deberse a cambios adaptativos del mismo sistema vascular. Los nitratos también pueden tener un efecto clínico limitado ante un sistema de precarga no sensible o hipertensión pulmonar fija. La presencia de taquifilaxia con la administración de nitroprusiato sódico sugiere que se ha alcanzado el techo terapéutico o hay toxicidad por cianuro, que, además se asocia habitualmente con infusiones prolongadas de más de 2 mg/kg/min o cuando los depósitos de metahemoglobi­ na y donantes de sulfuro están agotados. 17. Comente los tipos y mecanismos de acción de los fármacos vasodilatadores selectivos disponibles para uso clínico. La hidralazina relaja directamente la musculatura lisa, dilatando las arteriolas en mayor grado que las venas y reduciendo la presión arterial diastólica más que la sistólica. La respuesta es lenta, con un inicio entre 15 y 20 minutos, y en cierto modo impredecible, causando a menudo una hipotensión prolongada. La taquicardia refleja también puede ser un efecto secundario no deseado. El nicardipino es un bloqueante de los canales del calcio selectivo y de acción corta que actúa en los lechos arteriolares, con un ajuste de la dosis fácil que produce una reducción controlada de la presión arterial sistémica. El nicardipino se está convirtiendo en el vasodilatador arterial de elección en pacientes sometidos a cirugía cardíaca con hipertensión ya que presenta una vasodilatación coronaria más selectiva que la vasodilatación sistémica. El resultado final es una reducción de la poscarga, aumento del volumen sistólico y aumento del flujo de sangre coronario, que resulta en un efecto favorable en el equilibrio de oxígeno miocárdico. El inicio se produce entre los 5 y 15 minutos, y su acción dura de 4 a 6 horas. El clevidipino es un nuevo bloqueante del calcio de tercera generación que se considera un vasodilatador arteriolar de acción ultracorta. Metabolizado por las esterasas plasmáticas, la vida media del clevidipino es de aproximadamente 2 minutos, con una vida media sensible al contexto de 2 a 5 minutos independientemente de la duración de la infusión. Actúa de forma similar al nicardipino en que dilata de forma selectiva el lecho arteriolar, reduciendo la poscarga sin modificar la presión de llenado cardíaco. Se presenta en forma de emulsión similar al propofol. 116 CAPÍTULO 15 Fármacos inotrópicos y vasodilatadores El fenoldopam es un vasodilatador parenteral único que actúa a través de los receptores periféricos D1 de la dopamina. Tiene un efecto vasodilatador selectivo para los vasos renales y esplácnicos y provoca una leve diuresis renal. La acción comienza en 5 minutos, y su vida media es aproximadamente de 5 minutos con una duración de acción de 30 a 60 minutos en infusión. Se cree que el fenoldopam proporciona cierto grado de protección renal frente a lesiones renales agudas (al menos en pacientes sometidos a cirugía aórtica abdominal), pero los ensayos en pacientes de unidades de cuidados intensivos y en el contexto perioperatorio no han mostrado un efecto beneficioso claro. El fenoldopam puede provocar una hipotensión significativa, de modo que, si se emplea como protector renal, es necesario monitorizar estrechamente la presión arterial para asegurar una perfusión renal adecuada. 18. Describa el mecanismo de acción de la vasopresina. La arginina vasopresina (AVP) actúa en tres subtipos de receptores (V1, V2 y V3). El receptor V1 es­­ timula la contracción de la musculatura lisa vascular, provocando la respuesta vasopresora de la AVP. Los receptores V2 actúan principalmente en el riñón para provocar retención de agua (hormona anti­ diurética), y los receptores V3 actúan en el sistema nervioso central, modulando la secreción de corticotropina. El sistema vasopresina constituye unos de los tres sistemas vasopresores del organismo junto con el sistema simpático y el sistema renina-angiotensina. La vida media plasmática de la AVP es de 4 a 20 minutos; por tanto, debe administrarse en infusión para obtener efectos prolongados. 19. ¿Cómo puede ayudar la vasopresina en el tratamiento del shock cardiogénico o séptico? La vasopresina se está convirtiendo en la piedra angular del tratamiento de los estados de shock en combinación con fármacos inotrópicos adrenérgicos. Ante una respuesta inflamatoria sistémica se ha observado que los pacientes en shock séptico tienden a presentar niveles plasmáticos de vasopresina bajos. El empleo de vasopresina ha demostrado mejorar la hemodinámica y reducir los requerimientos de los fármacos adrenérgicos. El rango de dosificación sigue debatiéndose; muchos estudios muestran que dosis de 0,01 a 0,04 U/min son eficaces. Existen datos publicados que apoyan el uso de la vasopresina tras un bypass cardiopulmonar, con dosis tan altas como 0,1 U/min. Las dosis en bolo administradas en casos de parada cardíaca son de 20 a 40 unidades según las pautas de las guías actuales. Dosis de vasopresina mayores comportarían un mayor riesgo de vasoconstricción intensa, pudiendo derivar en una hipoperfusión esplácnica; sin embargo, los estudios aún no han definido de forma clara el grado de este riesgo. 20. ¿Cómo puede ayudar el péptido natriurético tipo b en el manejo de la insuficien­ cia cardíaca congestiva? Aunque no se han realizado grandes ensayos aleatorios prospectivos con nesiritida (péptido natriurético tipo b), algunos datos iniciales parecen indicar que la nesiritida puede ser beneficiosa para el tratamiento de pacientes previamente al trasplante cardíaco que presentan aumento de la resistencia vascular pulmonar e insuficiencia renal. De hecho, el péptido natriurético tipo b mejora el perfil hemodinámico, aumenta la excreción renal de sodio, e inhibe el sistema reninaangiotensina-aldosterona, mejorando la sintomatología clínica. 21. ¿Qué es la insuficiencia cardíaca diastólica y qué opciones terapéuticas existen? Una insuficiencia cardíaca congestiva en presencia de función sistólica ventricular izquierda conservada (FE >35%) y en ausencia de isquemia y de patología valvular sugiere insuficiencia cardíaca diastólica. El tratamiento crónico con inhibidores de la enzima conversora de la angiotensina (IECA) se está evaluando en varios ensayos clínicos a gran escala, con la premisa de que los niveles reducidos de aldosterona y angiotensina mejoran la remodelación de la estructura cardíaca debido al colágeno alterado. El tratamiento agudo se dirige a mejorar la disfunción diastólica de la siguiente manera: La reducción de la frecuencia cardíaca mediante bloqueo b puede beneficiar a la disfunción diastólica sensible a la precarga. Dosis bajas de inhibidores de la PDE y bloqueantes del calcio de tipo L (dihidropiridinas) pueden mejorar la relajación de las células del miocardio. Los nitratos pueden mejorar la sintomatología en determinados casos de disfunción diastólica con sobrecarga de volumen. CAPÍTULO 15 Fármacos inotrópicos y vasodilatadores 117 22. ¿Cuáles son las indicaciones clínicas y la evidencia actual para el empleo de do­­ pamina? La evidencia científica actual indica que las dosis bajas de dopamina no son eficaces para la prevención y el tratamiento de la insuficiencia renal aguda y la protección intestinal. Es evidente que dosis bajas de dopamina, además de no lograr el objetivo establecido de proteger al órgano, pueden ser perjudiciales porque pueden inducir insuficiencia renal en pacientes normovolémi­ cos e hipovolémicos. La dopamina también inhibe la secreción y la función de las hormonas del eje hipofisario anterior, agravando así el catabolismo y la disfunción inmunitaria celular e induciendo hipotiroidismo central. Además, mitiga el impulso respiratorio, aumentando el riesgo de insuficiencia respiratoria en pacientes que están siendo desconectados de la ventilación mecánica. Asimismo existen estudios observacionales recientes que parecen indicar un aumento de la mortalidad en pacientes sépticos tratados con dopamina, mientras que pacientes similares tratados con noradrenalina no presentan este riesgo de mortalidad. Sobre la base de metaanálisis actuales (que carecen de buenos datos aleatorizados y prospectivos), la dopamina se considera actualmente un fármaco de cuarta línea para el shock cardiogénico, séptico o vasoplégico. © Elsevier. Fotocopiar sin autorización es un delito 23. Describa el nuevo fármaco inotrópico levosimendán, con su mecanismo de acción y su lugar en el tratamiento clínico. El levosimendán es una piridazinona-dinitrito que pertenece a una nueva clase de agentes farmacológicos, los «sensibilizadores del calcio». Este fármaco actúa aumentando la contractilidad sin elevar los niveles de calcio intramiocárdico. Esto se logra estabilizando la troponina C de forma activa, proporcionando así apoyo inotrópico de forma similar a otros fármacos pero con unos requerimientos mucho menores de calcio intracelular. Aumenta la fuerza sistólica mientras mantiene la perfusión coronaria mediante la vasodilatación de la arteria coronaria, junto con una leve vasodilatación sistémica y pulmonar. Puede administrarse de forma sinérgica con fármacos b-adrenérgicos y parece que tiene un potencial arritmogénico bajo. El levosimendán es tan eficaz o más que la dobutamina en casos de insuficiencia cardíaca congestiva. En pacientes sometidos a cirugía cardíaca la combinación de dobutamina y levosimendán produjo un mejor mantenimiento del volumen sistólico tras bypass cardiopulmonar que la combinación de dobutamina y milrinona. Sobre la base de la evidencia actual, la pauta recomendada consiste en empezar con un bolo <36 mg/kg seguido de una infusión a razón de 0,4 mg/kg/min. Existen numerosos ensayos que demuestran buenos resultados con este fármaco, pero son necesarios más ensayos aleatorizados. La duración de las infusiones en los estudios actuales solamente es de 24 horas, lo que limita recomendar el uso prolongado. 24. ¿Qué mecanismo de acción es el responsable del efecto inotrópico de la hormo­­ na tiroidea? La hormona tiroidea afecta a cambios crónicos en la síntesis proteica como la alteración de la cadena de síntesis nuclear, cambios estructurales de la isoenzima miosina y la expresión incrementada de los receptores b-adrenérgicos. Además se produce un aumento más inmediato de la contractilidad como respuesta a un aumento de la respiración mitocondrial y la producción de ATP, a un aumento de la función de la Ca-ATPasa del sarcolema, y a un aumento de la entrada de sodio a los miocitos. Los niveles aumentados de sodio intracelular aumentan la concentración y la actividad del calcio intracelular. Bibliografía Recomendada 1. Leone M, Martin C: Vasopressor use in septic shock: an update. Curr Opin Anesthesiology 21:141-147, 2008. 2. Ouzounian M, Lee DS, Liu PP: Diastolic heart failure: mechanisms and controversies. Nat Clin Pract Cardiovasc Med 5:375-386, 2008. 3. Raja SG, Rayen BS: Levosimendan in cardiac surgery: best available evidence. Ann Thorac Surg 81:1536-1546, 2006. 4. Treschan TA, Peters J: The vasopressin system. Anesthesiology 105:599-612, 2006. 5. Venkataraman R: Can we prevent acute kidney injury? Crit Care Med 36:S166-S171, 2008. CAPÍTULO 16 Medicación preoperatoria Sunil Kumar, MD, FFARCS 1. Enumere los principales objetivos de la premedicación. La premedicación debe adaptarse a las necesidades de cada paciente. Los objetivos importantes incluyen: Sedación y ansiólisis. Analgesia y amnesia. Efecto antisialogogo. Mantener la estabilidad hemodinámica, incluyendo la reducción de la respuesta del sistema nervioso autonómico. Evitar y/o minimizar el impacto de la broncoaspiración. Disminuir las náuseas y los vómitos postoperatorios. Profilaxis de reacciones alérgicas. 2. Enumere los fármacos empleados más habitualmente en el preoperatorio, con las dosis adecuadas. Véase la Tabla 16-1. 3. ¿Qué factores deben tenerse en cuenta al seleccionar la premedicación para un paciente? Edad y peso del paciente. Estado físico. Niveles de ansiedad y dolor. Historia previa de uso o abuso de fármacos. Historia de náuseas o vómitos postoperatorios o mareos en los viajes. Alergias a fármacos. Cirugía de urgencia o programada. Cirugía con o sin ingreso. 4. ¿Qué factores limitan la capacidad de dar fármacos con efectos depresores centrales preoperatoriamente? Edades extremas. Lesiones cerebrales o estado mental alterado. Reserva cardíaca o pulmonar limitada. Hipovolemia. Estómago lleno. 5. ¿Qué quiere decir premedicación psicológica? La mayoría de los pacientes están muy ansiosos antes de la cirugía. Una visita informativa y tranquilizadora por parte del anestesiólogo puede sustituir muchos miligramos de medicación depresora y funciona como premedicación psicológica. Durante esta visita, debe proporcionarse al paciente y a su familia una descripción detallada de los acontecimientos anestésicos previstos durante el período perioperatorio, y se debe responder a todas las preguntas del paciente o de la familia. Sin embargo, la preparación psicológica no puede cubrirlo todo ni aliviará totalmente la ansiedad. 118 © 2011. Elsevier España, S.L. Reservados todos los derechos CAPÍTULO 16 Medicación preoperatoria 119 TA B L A 1 6 - 1 . F á r maco s p r e op e r ato r i o s h ab i tual e s . Do s i s y v ía a Fármaco Vía de administración Diazepam Midazolam Morfina Meperidina Ranitidina Oral, i.v. i.v. i.v. i.m. Oral, i.v. Metoclopramida Omeprazol Dosis (mg) Objetivos Oral, i.v. Oral 5-10 1-2 2-10 25-100 150 mg y 50 mg, respectivamente 5-20 20 Pantoprazol i.v. 40 Glicopirrolato i.v. 0,1-0,3 Escopolamina Prometazinab Ketamina i.m., i.v. i.m. i.m., oral 0,3-0,6 25-50 1-2 mg/kg y 6 mg/kg, respectivamente Sedación Sedación Analgesia Analgesia Disminución del pH gástrico Gastrocinético Inhibidor de la bomba de protones Inhibidor de la bomba de protones Sedante débil, antisialogogo Sedante, antisialogogo Antiemético Sedación © Elsevier. Fotocopiar sin autorización es un delito i.m., intramuscular; i.v., intravenosa. aLos fármacos potentes siempre deben administrarse en dosis fraccionadas hasta conseguir el efecto. bLa FDA advierte del riesgo del uso en niños menores de 2 años. 6. Comente el papel de las benzodiazepinas en la premedicación. Las benzodiazepinas son los fármacos más empleados para la premedicación. Actúan sobre los receptores del neurotransmisor inhibitorio, el ácido γ-aminobutírico, produciendo ansiólisis, amnesia y sedación en dosis que no producen depresión cardiovascular ni respiratoria importantes. Estos fármacos no son analgésicos ni se asocian con náuseas y vómitos. Entre los efectos secundarios de las benzodiazepinas destacan la sedación excesiva y prolongada en algunos pacientes, especialmente con lorazepam. En ocasiones puede producirse una excitación paradójica en lugar de ansiólisis con estos fármacos. La benzodiazepina utilizada más habitualmente en la práctica actual es el midazolam, administrado por vía intravenosa en dosis pequeñas incrementales durante el período preoperatorio inmediato. El diazepam se asocia con dolor en la inyección intramuscular o intravenosa y con un aumento del riesgo de flebitis. 7. Enumere los efectos secundarios más frecuentes cuando se emplean opioides como premedicación. Prurito Liberación de histamina Náuseas y vómitos Retraso del vaciamiento gástrico Depresión respiratoria Rigidez torácica Hipotensión ortostática Espasmo del esfínter de Oddi 8. Describa los motivos para incluir un agente anticolinérgico en la premedicación. Las principales indicaciones de estos fármacos son las siguientes: Desecación de las secreciones de la vía aérea. Especialmente útiles en la cirugía de la vía aérea o intraoral, antes de aplicar anestesia tópica a la vía aérea y en la anestesia general con intubación endotraqueal. 120 CAPÍTULO 16 Medicación preoperatoria Prevenir la bradicardia refleja cuando se prevé sobreactividad vagal, especialmente durante la inducción anestésica pediátrica y la manipulación de la vía aérea. La atropina o el glicopirrolato es mejor administrarlos por vía intravenosa justo antes de la estimulación vagal prevista. Efecto sedante y amnésico: al ser aminas terciarias, la escopolamina y la atropina pueden cruzar la barrera hematoencefálica y producir sedación y amnesia. A este respecto, la escopolamina es unas ocho a diez veces más potente que la atropina. El glicopirrolato es una amina cuaternaria, no cruza la barrera hematoencefálica y, por tanto, no posee ningún efecto sedante significativo. 9. Resuma los efectos de los agentes anticolinérgicos habitualmente empleados. Véase la Tabla 16-2. TA B L A 1 6 - 2 . Ef e cto s d e lo s f á r maco s a n t i col i n é r g i co s e mpl e a d o s h ab i tualm e n t e Taquicardia Efecto antisialogogo Sedación, amnesia Toxicidad del sistema nervioso central Relajación del esfínter esofágico inferior Midriasis y cicloplejía Atropina Escopolamina Glicopirrolato ++ + + + ++ + + +++ +++ ++ ++ +++ ++ ++ 0 0 ++ 0 0, Ninguno; +, leve; ++, moderado; +++, pronunciado. 10. Enumere los efectos secundarios más frecuentes de los fármacos anticolinérgicos. Sequedad y espesamiento de las secreciones de las vías aéreas. Disminución del tono del esfínter esofágico inferior. Midriasis y cicloplejía. Toxicidad del sistema nervioso central. Prevención de la sudoración. Hipertermia. 11. En la sala de preanestesia, un paciente sufre un delirio tras administrársele sólo 0,4 mg de escopolamina como premedicación. ¿Cuál es la causa del delirio? ¿Cómo se trata? La causa más probable del delirio es el síndrome anticolinérgico central producido por la escopolamina. La toxicidad central puede ser secundaria a la administración de la amina terciaria escopolamina (y con menor frecuencia tras atropina), que atraviesa la barrera hematoencefálica. Los síntomas tóxicos son infrecuentes tras una dosis normal de premedicación. Sin embargo, los pacientes ancianos tienen una mayor tendencia a este efecto secundario. La fisostigmina es el único inhibidor de la acetilcolinesterasa que atraviesa la barrera hematoencefálica, y puede emplearse para tratar el síndrome anticolinérgico central en dosis de 15-60 mg/kg por vía in­ travenosa, administrándose lentamente para prevenir convulsiones. 12. ¿Cómo influye la preocupación por una neumonitis por aspiración en la elección de la premedicación? La aspiración se comenta con más detalle en el Capítulo 39. La incidencia real de neumonitis por aspiración clínicamente significativa es extremadamente rara en pacientes sanos sometidos CAPÍTULO 16 Medicación preoperatoria 121 a cirugía programada. En el pasado, muchos anestesiólogos administraban de forma rutinaria fármacos como los antagonistas H2, antiácidos y gastrocinéticos con el fin de reducir el volumen y aumentar el pH del contenido gástrico de los pacientes durante el período preoperatorio. En vista de la extremadamente baja incidencia de neumonitis por aspiración clínicamente significativa en pacientes sanos sometidos a cirugía programada, el empleo rutinario e indiscriminado de antiácidos, bloqueantes de la secreción gástrica, antieméticos, anticolinérgicos y gastrocinéticos no está justificado. P U N TOS CLAVE: M edicación Preoper ator ia 1. Una visita preoperatoria por parte de un anestesiólogo que informe y tranquilice proporciona una preparación psicológica útil y calma los miedos y la ansiedad del paciente antes de la anestesia. 2. La elección de la premedicación depende del estado físico y mental del paciente, si se trata de cirugía ambulatoria o no, si la cirugía es programada o de urgencia, y si el paciente tiene antecedentes de náuseas y vómitos postoperatorios. 3. El riesgo de neumonitis por aspiración clínicamente significativa en pacientes sanos sometidos a cirugía programada es muy bajo. El empleo rutinario de fármacos que modifican el volumen o el pH del contenido gástrico es innecesario. 4. Si se considera que el paciente tiene un riesgo elevado de aspiración pulmonar, una dosis oral de 15 a 30 ml de antiácido no particulado, administrada entre 15 y 30 minutos antes de la inducción anestésica, es la forma más eficaz de aumentar el pH gástrico por encima de 2,5. 5. Muchos pacientes requieren poca o ninguna premedicación. 6. Los pacientes pediátricos tienen una tendencia especial a la bradicardia durante la anestesia y se benefician de la premedicación anticolinérgica. © Elsevier. Fotocopiar sin autorización es un delito 13. ¿Es seguro permitir a los pacientes beber algo de agua para tragar los fármacos preoperatorios? Sí. Se acepta permitir a los pacientes tomar fármacos preoperatorios, incluyendo sus fármacos habituales, con menos de 150 ml de agua en la hora previa a la inducción de la anestesia. 14. ¿Cuáles son las diferencias entre la premedicación de los pacientes pediátricos y los adultos? Los pacientes pediátricos tienen las siguientes necesidades: Son más difíciles de preparar psicológicamente para la cirugía y la anestesia. Existe un mayor énfasis por la vía de administración oral porque la mayoría de los niños temen las agujas. Existe un empleo más frecuente de vagolíticos porque es mayor la incidencia de bradicardia durante la inducción. 15. ¿Cómo afecta la edad de los pacientes pediátricos a la premedicación? Los niños menores de 6 meses de edad no parecen sufrir ansiedad cuando se separan de los padres. Sin embargo, los niños de 6 meses a 5 años tienen un mayor riesgo de ansiedad de separación, y pueden sufrir un trauma psicológico a largo plazo por una experiencia hospitalaria negativa. Es difícil tranquilizar y explicar lo que se les va a hacer a este grupo. Es más fácil comunicarse con niños mayores de 5 años, a quienes se les puede tranquilizar. El comportamiento de los padres también es importante en la preparación psicológica de los pacientes pediátricos. Las necesidades de cada paciente deben valorarse individualmente. La mayoría de los niños mayores de 1 año se benefician de alguna premedicación sedante. El midazolam oral (0,5 mg/kg 122 CAPÍTULO 16 Medicación preoperatoria disueltos en un jarabe con sabor, en una dosis máxima de 20 mg) se emplea con frecuencia. La atropina puede administrarse por vía intravenosa una vez que se ha canalizado una vena, justo antes de la manipulación de la vía aérea, lo que puede provocar reflejos vagales. 16. Comente el tratamiento preoperatorio de un paciente obeso mórbido con una vía aérea difícil. Asuma que el paciente no tiene otra patología asociada. Un paciente obeso mórbido se considera con mayor riesgo de broncoaspiración pulmonar durante la inducción de la anestesia debido al retraso del vaciamiento gástrico y a la posibilidad de dificultad en el manejo de la vía aérea. Por tanto, los bloqueantes H2 administrados la noche anterior (si es posible) y la mañana de la cirugía, la metoclopramida preoperatoria y los antiácidos no particulados orales están indicados. El glicopirrolato es útil si se planea broncoscopia con fibra óptica. Mejora la visualización mediante el secado de las secreciones, aumenta la eficacia de la anestesia tópica y disminuye la respuesta de la vía aérea. Los opiáceos y las benzodiazepinas deben reducirse prudentemente, administrando oxígeno suplementario y mediante una observación continua para asegurar un paciente despierto, con respuesta adecuada, que puede proteger su propia vía aérea. Bibliografía Recomendada 1. Dotson R, Wiener-Kronish JP, Ajayi T: Preoperative evaluation and medication. In Stoelting RK, Miller RD, editors. Basics of anesthesia ed 5, New York, Churchill Livingstone, 2007, pp 157–177. 2. Kararmaz A, Kaya S, Turhanoglu S, et al: Oral ketamine premedication can prevent emergence agitation in children after desflurane anaesthesia. Paediatr Anaesth 14:477–482, 2004. Valoración preoperatoria Mark H. Chandler, MD Capítulo 17 III. PREPARACIÓN PARA LA ANESTESIA 1. ¿Cuáles son los objetivos de la valoración preoperatoria? La valoración preoperatoria consiste en la recogida de información sobre el paciente y la formulación de un plan anestésico. El objetivo final es la reducción de la morbilidad y la mortalidad perioperatorias. Sería ideal que la valoración preoperatoria la realizara el mismo anestesiólogo que va a administrar la anestesia. 2. Comente los elementos más importantes de la valoración preoperatoria. El anestesiólogo debe revisar el diagnóstico quirúrgico, los órganos que afectará y la intervención planeada. Los elementos importantes son la entrevista personal, la exploración física y la revisión de la historia médica. Preguntas importantes que se deben realizar son: alergias medicamentosas, abuso de sustancias (p. ej., tabaco, alcohol, drogas ilegales), revisión de sistemas y experiencia anestésica previa (p. ej., antecedentes de intubación difícil, retraso del despertar, hipertermia maligna, bloqueo neuromuscular prolongado o náuseas y vómitos postoperatorios). A partir de esta valoración el anestesiólogo decide si son necesarias o no pruebas o consultas preoperatorias y entonces formula un plan anestésico. 3. ¿Con cuánta frecuencia altera los planes la valoración preoperatoria? Se ha estudiado que los planes se alteraban en el 20% de todos los pacientes (incluyendo el 15% de los pacientes clases 1 y 2 de la American Society of Anesthesiologists [ASA]) debido a la patología identificada en la valoración preoperatoria. Las alteraciones que con más frecuencia que provocaban cambios eran: reflujo gástrico, diabetes mellitus dependiente de insulina, asma y sospecha de vía aérea difícil. Estos hallazgos indican que es preferible en todos los pacientes, cuando sea posible, realizar la valoración preoperatoria antes del día de la cirugía. 4. ¿Qué características debe tener el consentimiento informado? El consentimiento informado supone que el plan anestésico se le ha explicado al paciente en términos que puede comprender y engloba todos los aspectos, desde la premedicación y los procedimientos preoperatorios al tratamiento intraoperatorio y los cuidados postoperatorios (p. ej., la analgesia, las náuseas y los vómitos). Se deben comentar con el paciente las alternativas, posibles complicaciones y los riesgos frente a los beneficios, y se debe responder a las preguntas del paciente. La valoración preoperatoria y el consentimiento informado establecen una relación de confianza médico-paciente que disminuye mucho la ansiedad del paciente e influye de modo cuantificable en la recuperación postoperatoria y la evolución. 5. ¿Cuál es la clasificación del estado físico de la American Society of Anesthesio­ logists? La clasificación ASA se creó en 1940 con el objetivo de realizar estudios estadísticos e informes hospitalarios. Sirve tanto para la comparación de resultados como para la comunicación del estado físico del paciente. Por desgracia, es poco exacta, y a menudo el paciente se clasifica de forma diferente según el anestesiólogo. Además, una clase ASA alta sólo predice burdamente el riesgo anestésico. Las seis clases son las siguientes: Clase 1: paciente sano, sin problemas médicos. Clase 2: enfermedad sistémica ligera. Clase 3: enfermedad sistémica grave. © 2011. Elsevier España, S.L. Reservados todos los derechos 123 124 Capítulo 17 Valoración preoperatoria Clase 4: enfermedad sistémica grave que supone una continua amenaza de muerte. Clase 5: moribundo, de quien no se espera que sobreviva sin operación. Clase 6: paciente declarado en muerte cerebral cuyos órganos son extraídos para donación. Se añade una «E» al número del estado para designar una operación urgente. 6. ¿Cuánto tiempo de ayuno debe mantener un paciente antes de la cirugía? En 1999 la ASA, a través de su grupo de trabajo sobre ayuno preoperatorio, revisó una serie de estudios y diseñó unas guías para los clínicos (Tabla 17-1). Estas guías deben adaptarse al estado de salud del paciente y a la posible dificultad de la vía aérea. Las guías de ayuno actuales para pacientes pediátricos son las siguientes: líquidos claros hasta las 2 horas preoperatoriamente; leche materna hasta 4 horas preoperatoriamente, y alimentos sólidos, como leche no humana y de fórmula hasta 6 horas preoperatoriamente. TA B LA 1 7 - 1 . R e c o m e n d a c i o n e s d e ay u n o p r e o p e r at o r i o Material ingerido Líquidos claros (como agua, zumo de frutas sin pulpa, bebidas carbonatadas, té y café; el alcohol no se considera líquido claro) Leche materna Leche maternizada Leche no humana Comida ligera (consiste típicamente en una tostada y líquidos claros) Comida grasa, pesada y completa Período de ayuno mínimo (horas) 2 horas 4 horas 6 horas 6 horas 6 horas 8 horas 7. ¿Cuáles son las pruebas de laboratorio preoperatorias adecuadas? ¿A qué pacientes se les debería realizar un electrocardiograma? ¿Y una radiografía de tórax? Ninguna evidencia apoya el uso de pruebas de laboratorio rutinarias. Sin embargo, existe evidencia sobre el empleo de análisis de laboratorio selectivos basados en la historia preoperatoria del paciente, la exploración física y la intervención quirúrgica planeada (Tabla 17-2). A menos que haya algún cambio en el estado del paciente, un electrocardiograma y una radiografía de tórax obtenidas 6 meses antes de la intervención no tienen por qué repetirse. De forma parecida, valores bioquímicos y de hemoglobina/hematocrito obtenidos en el último mes se aceptan en situaciones estables. Los estudios de coagulación no deberían ser anteriores a una semana. 8. ¿Cuál es el hematocrito mínimo aceptado generalmente para la cirugía progra­ mada? No existe un valor mínimo específico; depende del contexto clínico. La determinación preoperatoria de la hemoglobina para cirugía sin pérdidas sanguíneas importantes no añade ningún valor a las estimaciones sobre riesgo perioperatorio y resultados adversos. La posible pérdida de sangre y las demandas de oxígeno asociadas con intervenciones quirúrgicas propuestas deben tenerse en cuenta, además de la patología asociada del paciente que aumente el riesgo de isquemia, como aterosclerosis coronaria, insuficiencia cerebral o enfermedad vasculorrenal. Los pacientes con enfermedad pulmonar avanzada también toleran mal la anemia. Los ancianos con anemia también tienen, a menudo, un estado funcional peor, hospitalizaciones más prolongadas y más mortalidad al año. Capítulo 17 Valoración preoperatoria 125 TA B LA 1 7 - 2 . P r u e b a s d e l a b o r at o r i o p r e o p e r at o r i a s a d e c u a d a s b a s a d a s e n l a h i s t o r i a y l a e x p l o r a c i ó n f í s i c a d e l pa c i e n t e * Prueba Indicaciones Electrocardiograma Enfermedad cardíaca y circulatoria, enfermedad respiratoria, edad avanzada Enfermedad pulmonar crónica, antecedentes de cardiopatía congestiva Enfermedad reactiva de la vía aérea, enfermedad pulmonar crónica, enfermedad pulmonar restrictiva Edad avanzada, anemia, trastornos de sangrado, otros trastornos hematológicos Trastornos hemorrágicos, disfunción hepática, anticoagulantes Radiografía de tórax Pruebas de función pulmonar Hemoglobina/ hematocrito Pruebas de coagulación Bioquímica sérica Prueba de embarazo Trastornos endocrinos, fármacos, disfunción renal Anamnesis compatible con embarazo, historia que sugiera embarazo actual *Al menos el 50% de los expertos acordó que las pruebas mencionadas eran beneficiosas cuando se empleaban selectivamente. Debido a la falta de evidencia sólida en la literatura, estas indicaciones son en cierto modo amplias y vagas, y limitan la utilidad clínica de las guías. La definición de edad avanzada es vaga, y debería considerarse en el contexto de la salud general del paciente. 9. ¿Existe alguna forma de predecir qué pacientes presentarán complicaciones pul­ monares? Entre los factores de riesgo más habituales de complicaciones pulmonares postoperatorias (CPP) destacan la enfermedad pulmonar obstructiva crónica y la edad avanzada; la Tabla 17-3 presenta una lista más exhaustiva de los factores de riesgo. Por fortuna, las CPP que se observan con más frecuencia raramente provocan mortalidad postoperatoria; así pues, la mayoría de las cirugías pueden realizarse incluso si estos factores de riesgo están presentes. Las indicaciones de las pruebas de función pulmonar se abordan en el Capítulo 9. © Elsevier. Fotocopiar sin autorización es un delito TA B LA 1 7 - 3 . Fa c t o r e s d e r i e s g o d e c o m p l i c a c i o n e s p u l m o n a r e s p o s t o p e r at o r i a s Factores de riesgo preoperatorio Factores de riesgo intraoperatorio EPOC Edad Consumo de tabaco inhalado Hipertensión pulmonar NYHA clase II AOS Estado nutricional Zona de la cirugía Anestesia general Empleo de pancuronio Duración de la cirugía Cirugía de urgencia De la New York Heart Association (NYHA). AOS, apnea obstructiva del sueño; EPOC, enfermedad pulmonar obstructiva crónica. 126 Capítulo 17 Valoración preoperatoria 10. ¿Cuándo están indicadas las consultas preoperatorias con otros especialistas? Las interconsultas preoperatorias se clasifican en dos categorías generales: Aquellos casos en los que se necesita más información o experiencia para establecer o cuantificar un diagnóstico que tiene implicaciones en el tratamiento anestésico. Un ejemplo de ello es pedir a un cardiólogo que evalúe a un hombre de 50 años que ha comenzado recientemente con dolor precordial con el ejercicio. Los pacientes en quienes se conoce el diagnóstico, pero se necesitan una mayor valoración y tratamiento para optimizar su situación médica previa a la cirugía. La derivación a internistas de pacientes con diabetes mal controlada, hipertensión o asma serían otros ejemplos. P U N T OS CLAVE: Valoración preoperatoria 1. Las pruebas de laboratorio preoperatorias deben ser selectivas e individualizadas. 2. Las guías para pruebas cardiológicas del American College of Cardiology/American Heart Association para intervenciones no cardíacas son el «patrón de oro» actual para la valoración cardíaca preoperatoria. 3. La información más importante obtenida de la valoración preanestésica deriva de una anamnesis precisa, detallada y dirigida, y de una exploración física. 4. La hemoglobina previa de un paciente tiende a predecir la necesidad de transfusión cuando se produce una gran pérdida de sangre. 5. Los cuatro procesos cardíacos activos que probablemente provoquen la cancelación de la cirugía para poder realizar una valoración cardíaca y un tratamiento adicionales son: síndrome coronario inestable, insuficiencia cardíaca descompensada, arritmias cardíacas significativas y valvulopatía grave. 6. Antes de suspender la anticoagulación de un paciente se deben considerar el tipo y la urgencia de la cirugía, la posibilidad y las consecuencias de una hemorragia intraoperatoria y, quizá lo más importante, el motivo por el cual el paciente recibe anticoagulación. 11. ¿Qué efectos beneficiosos y riesgos se asocian con el cese del consumo de tabaco preoperatorio? Todos los profesionales de la salud deberían aprovechar cualquier oportunidad para alentar a los pacientes a que dejen de fumar. En los últimos años se argumentó que dejar el consumo de tabaco inmediatamente antes de la cirugía aumentaba determinados riesgos perioperatorios como un aumento de la irritabilidad de las vías aéreas, disminución de la cicatrización de la herida con el tratamiento sustitutivo de nicotina, y aumento de la ansiedad del paciente asociada con la abstinencia de la nicotina. La mayoría de estos argumentos han sido desautorizados y son insignificantes en comparación con los efectos beneficiosos globales para la salud derivados del cese del consumo de tabaco. 12. ¿Cuánto tiempo antes de una cirugía debe un paciente dejar de fumar para lograr algún beneficio para la salud? Todos los pacientes fumadores deben entender que dejar de fumar, incluso inmediatamente antes de la cirugía, tiene unos efectos beneficiosos pronunciados y mensurables para la salud. La nicotina es un estimulante y tiene una vida media de solamente 1 a 2 horas; sus efectos adversos en la presión arterial sistólica y la frecuencia cardíaca pueden observarse ya a las 12 horas del cese del consumo de tabaco. El monóxido de carbono (CO), que disminuye la capacidad transportadora de oxígeno, tiene una vida media de solamente 4 horas. Es probable que la reducción de los niveles de nicotina y CO estén detrás de los resultados de un estudio para detectar episodios de depresión del segmento ST en pacientes fumadores sometidos a cirugía vascular. Este estudio demostró que los pacientes que fumaban inmediatamente antes de la cirugía presentaron más episodios de depresión del segmento ST que los no fumadores, los fumadores previos y los fumadores crónicos que no fumaron antes de la cirugía. Capítulo 17 Valoración preoperatoria 127 Cuanto más tiempo un paciente se abstenga de fumar antes de la cirugía, mayores son los efectos beneficiosos perioperatorios sobre su salud: la función broncociliar mejora a los 2 o 3 días de dejar de fumar, y el volumen del esputo disminuye hasta niveles normales en unas 2 semanas. Un estudio realizado en 120 pacientes sometidos a cirugía ortopédica aleatorizados para ser sometidos a una intervención que les ayudaría a dejar de fumar 6 a 8 semanas antes de la cirugía, presentó una espectacular reducción de la tasa de complicaciones globales en el grupo que dejó de fumar, principalmente gracias a la reducción de las infecciones de la herida. 13. ¿Cuáles son las guías actuales para la valoración cardíaca perioperatoria de los pacientes programados para cirugía no cardíaca? El American College of Cardiologists y la American Heart Association (ACC/AHA) han establecido un algoritmo para considerar los riesgos cardíacos de un paciente antes de la cirugía, teniendo en cuenta la urgencia de la intervención, la presencia de procesos cardíacos activos (véase la Pregunta 14), la invasión de la cirugía planeada, el estado funcional del paciente y la presencia de factores de riesgo clínicos de cardiopatía isquémica (véase la Pregunta 15). En conjunto, este algoritmo subraya la importancia de una historia centrada en los aspectos cardíacos en todos los pacientes quirúrgicos. 14. ¿Qué son los procesos cardíacos activos? Los procesos cardíacos activos son trastornos cardíacos graves que justifican una valoración y un tratamiento inmediatos antes de la cirugía. Existen cuatro procesos cardíacos activos: 1. Síndromes coronarios inestables, entre los que destacan la angina inestable o la angina grave y el infarto de miocardio reciente. 2. Insuficiencia cardíaca descompensada. 3. Arritmias significativas como las arritmias ventriculares sintomáticas, el bloqueo auriculoventricular de grado alto y la bradicardia sintomática. 4. Valvulopatías graves como la estenosis mitral sintomática o la estenosis aórtica grave. © Elsevier. Fotocopiar sin autorización es un delito 15. ¿Cuáles son los factores de riesgo clínico ante un suceso cardíaco periopera­ torio importante? El Índice de Riesgo Cardíaco Revisado (Tabla 17-4) tiene seis componentes: antecedentes de cardiopatía isquémica, antecedentes de insuficiencia cardíaca congestiva, antecedentes de vasculopatía cerebral, tratamiento preoperatorio con insulina, riesgo quirúrgico y creatinina sérica preoperatoria elevada. El paciente recibe un punto por cada uno de estos factores de riesgo, que posteriormente se traducen en porcentajes de riesgo de sucesos cardíacos mayores perioperatorios como infarto de miocardio, edema pulmonar, fibrilación ventricular, parada cardíaca primaria y bloqueo cardíaco completo. 16. ¿Qué constituye la valoración de laboratorio básica del estado de coagulación? El Capítulo 7 revisa la información de la exploración física y de la historia clínica que podría indicar una alteración en la coagulación. La valoración de laboratorio básica incluye recuento plaquetario, tiempo de hemorragia, tiempo de protrombina (TP), tiempo de tromboplastina parcial activado (TTPA) y tiempo de trombina. El número mínimo de plaquetas con función normal para evitar hemorragia quirúrgica es de 50.000/mm3. Es importante destacar que tanto el TP como el TTPA requieren una pérdida de la actividad de la coagulación del 60-80% antes de producir valores anormales, pero los pacientes con disminuciones más leves en la función pueden también presentar sangrado quirúrgico importante. Por ello, la historia sigue siendo muy importante. La tromboelastografía mide la función combinada de plaquetas y factores de coagulación. 17. ¿Existen consideraciones anestésicas especiales para los pacientes quirúrgi­ cos que toman warfarina? La warfarina es un antagonista de la vitamina K y se utiliza para prevenir la trombosis y los émbolos. Un paciente en tratamiento con warfarina tiene un riesgo elevado de hemorragia intraoperatoria. Antes de suspender la warfarina en un paciente es importante conocer la indicación de la anticoagulación, el tipo y urgencia de la cirugía y las consecuencias de la hemorragia intraoperatoria. Se considera que algunos pacientes tienen un riesgo bajo de tromboembolismo, como los que presentan fibrilación auricular aislada, y otros tienen un riesgo muy alto, como quienes llevan prótesis valvulares. Los pacientes que tienen un riesgo muy alto de tromboembolismo pero, no obstante, deben suspender la administración del anticoagulante durante el período perioperatorio, a menudo suelen recibir un tratamiento puente con heparina, otro anticoagulante de acción mucho 128 Capítulo 17 Valoración preoperatoria TA B LA 1 7 - 4 . Í n d i c e d e r i e s g o c a r d í a c o r e v i s a d o Cada uno de los seis factores de riesgo siguientes recibe un punto 1. Intervenciones quirúrgicas de riesgo quirúrgico alto Intraperitoneal Intratorácica Vascular suprainguinal 2. Antecedentes de cardiopatía isquémica Antecedentes de infarto de miocardio Antecedentes de prueba de esfuerzo positivo Presencia de dolor torácico secundario a isquemia miocárdica Empleo de tratamiento con nitratos Electrocardiograma con ondas Q patológicas 3. Antecedentes de insuficiencia cardíaca congestiva Edema pulmonar Disnea paroxística nocturna Estertores bilaterales o galope S3 Radiografía de tórax con redistribución vascular pulmonar 4. Antecedentes de vasculopatía cerebral Antecedentes de crisis isquémica transitoria o ictus 5. Tratamiento preoperatorio con insulina 6. Creatinina sérica preoperatoria >2 mg/dl Riesgo de episodio cardíaco mayor Puntos 0 1 2 3 o más Clase I II III IV Riesgo 0,4% 0,9% 6,6% 11% Entre los sucesos cardíacos mayores se incluyen infarto de miocardio, edema pulmonar, fibrilación ventricular, parada cardíaca primaria y bloqueo cardíaco completo más corta. Dado que la warfarina tiene una vida media tan larga (unos 2,5 días) y la heparina tiene una vida media tan corta (cerca de 1,5 horas), es posible que se recomiende al paciente suspender la warfarina 4 días antes de la cirugía y luego, generalmente ya hospitalizado, reciba inyecciones periódicas de heparina hasta unas horas antes de la cirugía. Una vez ha finalizado la intervención (y dependiendo del riesgo de hemorragia postoperatoria) puede reinstaurarse la warfarina. 18. ¿Cuáles son las consideraciones para pacientes con stents coronarios? Los stents coronarios, que son pequeñas mallas tubulares metálicas que mantienen abiertas las arterias coronarias estenosadas, pueden dividirse en dos categorías principales: stents metálicos sin recubrimiento y stents liberadores de fármacos. Estos últimos liberan lentamente una sustancia química que previene la endotelización. Entre los cardiólogos sigue debatiéndose durante cuánto tiempo debe permanecer anticoagulado un paciente tras la colocación del stent. Este aspecto se comenta con más detalle en el Capítulo 33. Este tema de la anticoagulación se suma a la considerable complejidad de recomendar protocolos cardíacos en pacientes sometidos a cirugía. Capítulo 17 Valoración preoperatoria 129 19. Un niño de 3 años se programa para amigdalectomía. Su madre refiere que en los últimos 3 días ha presentado rinorrea y moqueo posterior. ¿Debería pospo­ nerse la intervención? Una infección del tracto respiratorio alto (ITRA) viral altera la calidad y la cantidad de las secreciones de la vía aérea y aumenta los reflejos de ésta a la estimulación mecánica, química o irritante. Algunos estudios clínicos han demostrado broncoespasmo, laringoespasmo e hipoxia intraoperatorios y postoperatorios asociados. Existe evidencia de que el riesgo de complicaciones pulmonares puede permanecer alto durante por lo menos 2 semanas, y posiblemente 6-7 semanas, después de una ITRA. Los niños en edad preescolar presentan un riesgo más alto que otros niños, y la intubación confiere un riesgo adicional. Los niños pequeños pueden tener una media de cinco a ocho ITRA por año, la mayoría desde el otoño a la primavera. Si se respeta rigurosamente un intervalo asintomático de 4-7 semanas, la cirugía programada debería posponerse indefinidamente. Sin embargo, la mayoría de los anestesiólogos distinguen entre ITRA con rinorrea crónica no complicada de rinorrea asociada con ITRA más graves con o sin infección del tracto respiratorio bajo. La rinorrea crónica es, habitualmente, de origen no infeccioso, y está causada por rinitis alérgica o vasomotora. Una ITRA no complicada se caracteriza por dolor o picor de garganta, laringitis, estornudos, rinorrea, congestión, malestar, tos no productiva y temperatura inferior a 38 °C. Las infecciones del tracto respiratorio alto o bajo más graves presentan nasofaringitis grave, esputo purulento, fiebre alta, tos profunda y hallazgos auscultatorios asociados, como sibilancias o crepitantes. Se cree, en general, que la rinorrea crónica no supone un riesgo anestésico importante. En cambio, en los niños con infecciones respiratorias altas o bajas graves siempre se debe posponer la cirugía programada. Probablemente, la mayoría de los anestesiólogos procederán a la cirugía con un niño con ITRA no complicada en vías de resolución, a menos que el niño presente una historia de asma u otra enfermedad pulmonar importante. P á gina w eb ACC/AHA Guideline for perioperative cardiovascular evaluation and care for noncardiac surgery http://circ.ahajournals.org/cgi/reprint/116/17/e418 Bibliografía Recomendada 1. Ansell J, Hirsh J, Poller L, et al: The pharmacology and management of the vitamin K antagonists: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest 126 (3 suppl):204S–233S, 2004. © Elsevier. Fotocopiar sin autorización es un delito 2. American Society of Anesthesiologists Task Force on Preoperative Evaluation: Practice advisory on preanesthesia evaluation. Anesthesiology 96:485–496, 2002. 3. American Society of Anesthesiologists Task Force on Preoperative Fasting: Practice guidelines for preoperative fasting and the use of pharmacologic agents to reduce the risk of pulmonary aspiration: application to healthy patients undergoing elective procedures. Anesthesiology 90:896–905, 1999. 4. Bapoje SR, Whitaker JF, Schulz T, et al: Preoperative evaluation of the patient with pulmonary disease. Chest 132:1637–1645, 2007. 5. Barnett SR: Is a preoperative screening clinic cost-effective. In Fleisher LA, editor: Evidenced-based practice of anesthesiology. Philadelphia, Saunders, 2004, pp 23–26. 6. Mller AM, Villebro N, Pedersen T, et al: Effect of preoperative smoking intervention on postoperative complications: a randomised clinical trial. Lancet 359:114–117, 2002. 7. Narr BJ, Brown DR: Should preoperative hemoglobin always be obtained? In Fleisher LA, editor: Evidencebased practice of anesthesiology. Philadelphia, Saunders, 2004, pp 15–17. CAPÍTULO 18 El aparato de ANESTESIA Y LOS VAPORIZADORES James Duke, MD, MBA 1. ¿Qué es el aparato de anestesia? Un nombre más correcto y actual para el aparato de anestesia es sistema para la administración de anestesia. El papel de los primeros aparatos de anestesia era proporcionar una mezcla de gases anestésicos y medicinales para el mantenimiento de la vida del paciente. El sistema de administración de anestesia actual tiene estas funciones, además de ventilar al paciente y proporcionar una serie de monitorización de funciones. El objetivo más importante es ayudar al anestesiólogo a mantener al paciente vivo, seguro y adecuadamente anestesiado. Los aparatos de anestesia se han estandarizado bastante. Actualmente existen dos destacados fabricantes en Estados Unidos: Drager y Datex-Ohmeda. 2. Describa las conducciones de una máquina de anestesia para dar una visión general de sus interconexiones esenciales. Dejando aparte las características de seguridad y los monitores, el aparato de anestesia se divide en tres secciones: Un mezclador de gas, o sistema liberador de gas, que proporciona a su salida una mezcla definida de gas elegida por el anestesiólogo. El circuito respiratorio del paciente, que incluye el circuito respiratorio del paciente, el absorbedor de CO2, el ventilador y, a menudo, monitores de presión flujo y de gas. Un sistema de eliminación que recoge el exceso que sale del paciente y que sobra del aporte de gas, y expele el gas fuera del hospital para reducir la exposición del personal de quirófano a los gases anestésicos. 3. ¿De qué gases disponen todos los aparatos de anestesia y de dónde proceden? Casi todos los aparatos de anestesia disponen de oxígeno (O2) y óxido nitroso (N2O). La mayoría de las veces el tercer gas es aire, pero también puede ser helio (He), heliox (una mezcla de He y O2), dióxido de carbono (CO2) o nitrógeno (N2). Si el tercer gas no contiene O2 (como el aire y el heliox), y se administra solo, posiblemente se suministre al paciente una mezcla hipóxica (peligrosa). Habitualmente, la fuente de gas de los aparatos de anestesia de los hospitales es una toma en la pared o una canalización centralizadas. Un suministro de gases de reserva para emergencias se almacena en bombonas llamadas cilindros E fijados a la parte trasera del aparato de anestesia. Estas bombonas deben comprobarse diariamente para garantizar que contienen una reserva suficiente en caso de que falle la salida centralizada. 4. Dado que las velocidades de flujo de N2O y O2 se controlan de forma indepen­ diente, ¿hay riesgo de que el aparato se programe para liberar una mezcla hipóxica al paciente? Los diferentes fabricantes de aparatos tienen distintas formas de proteger al paciente frente a mezclas hipóxicas. El sistema Drager’s ORMC (Oxygen Ratio Monitor and Controller) percibe el flujo de O2 y controla el flujo de N2O de forma neumática. El sistema DatexOhmeda’s Link-25 conecta mecánicamente los interruptores de flujo de O2 y N2O para garantizar que la proporción de N2O y O2 permanece en el rango seguro a medida que aumenta el flujo de N2O. 130 © 2011. Elsevier España, S.L. Reservados todos los derechos CAPÍTULO 18 El aparato de ANESTESIA Y LOS VAPORIZADORES 131 5. ¿Qué es un regulador de presión? ¿Cómo controla el flujo del gas? El oxígeno y el aire de los cilindros E están presurizados hasta aproximadamente 2.200 psig, pero el aparato de anestesia necesita trabajar con gas a una presión inicial de unos 50 psig, ligeramente menos que la presión del gas que sale de la pared. El regulador realiza esta función. Cada gas se regula por separado. El gas de la bombona y el de la pared pasan por una válvula de comprobación que selecciona la fuente de gas con la presión más alta para que sea utilizada por el aparato. En circunstancias normales se usa preferiblemente la toma de la pared, y el de la bombona se reserva por si falla el suministro de la pared. 6. ¿En qué se diferencian el gas suministrado por el hospital y el gas de la bom­­ bona? Por cuestiones prácticas, el volumen disponible de los gases de la pared es continuo, siempre que se reponga el suministro de oxígeno central. La presión del gas de la pared es típicamente de unos 55 psig. La presión de la bombona generalmente está regulada por el manorreductor de primer paso a 45 psig. El aparato de anestesia escoge preferiblemente la fuente con la presión más alta. Mientras todo funcione correctamente, se usa la toma de la pared en lugar de la toma de la bombona. Es preferible utilizar el oxígeno de la pared porque se dispone en un mayor volumen, es más barato y reserva el suministro de la bombona para casos de emergencia. © Elsevier. Fotocopiar sin autorización es un delito 7. El suministro de oxígeno del hospital falla. El manómetro de la bombona de O2 marca 1.000 psi. ¿Cuánto tiempo podremos suministrar oxígeno antes de que se vacíe la bombona? Los aparatos de anestesia actuales disponen de dos fuentes de gases: el suministro de la pared y los cilindros E o bombonas del propio aparato. Las bombonas están codificadas por colores y suelen dejarse cerradas, reservándose para casos de emergencia, pero un aparato de anestesia que funcione normalmente con presiones de oxígeno normales en la pared utilizará preferiblemente la toma de la pared. Una bombona E verde de O2 llena por completo tiene una presión de 2.000 psi y contiene unos 625 l de O2. Dado que el O2 es un gas comprimido, el volumen de la bombona se corresponde linealmente con la presión del manómetro. Por tanto, una presión de 1.000 psi significa que a la bombona de O2 le quedan aproximadamente unos 312 l de gas. Además de suministrar flujo de oxígeno directamente al paciente, el oxígeno también propulsa los fuelles del ventilador, y la ventilación minuto del paciente se aproxima al flujo propulsor («driving») de los fuelles o concertinas. Así pues, si un paciente está recibiendo un flujo de oxígeno de 2 l/min y una ventilación minuto de 8 l/min, cada minuto se extraen 10 l de oxígeno del cilindro. Una bombona a la que le queden 312 l durará 31 minutos a esta velocidad. Para reducir el consumo de la bombona de oxígeno, disminuya la velocidad de flujo del oxígeno y ventile de forma manual; también pida que lleven bombonas adicionales al quirófano. 8. Se ha instalado un cilindro nuevo de N2O y el manómetro marca solamente unos 750 psig. ¿Por qué la presión del cilindro de N2O difiere de las presiones de otros gases? El aire y el O2 son gases comprimidos y no pueden comprimirse a estado líquido a temperatura ambiente porque se sobrepasa la temperatura crítica (temperatura a la que un gas puede comprimirse en líquido). Sin embargo, a temperatura ambiente el N2O se comprime a líquido a 747 psi. Las bombonas E de N2O contienen el equivalente a unos 1.600 l de gas cuando están llenas, mientras que las bombonas E de O2 y aire contienen solamente unos 600 l. La presión en la bombona de N2O permanece constante hasta que el N2O se ha vaporizado. Solamente cerca de un cuarto del volumen inicial de N2O permanece cuando la presión de la bombona cae, aunque para una estimación más precisa sería necesario pesar la bombona, conociendo su peso vacío (tara), y determinar los moles de N2O restante. Por el contrario, al ser un gas comprimido, el volumen del gas restante en una bombona de O2 o aire es directamente proporcional a la presión. La presión de una bombona llena es de 2.200 psig. Una lectura de presión de 1.100 indicaría que la bombona está medio llena o le quedan unos 300 l. 132 CAPÍTULO 18 El aparato de ANESTESIA Y LOS VAPORIZADORES 9. Enumere los usos del O2 en el aparato de anestesia. Contribuye al flujo de gas fresco. Proporciona gas para el O de emergencia. 2 Dispara la alarma de flujo de O bajo. 2 Controla el flujo de óxido nitroso. Activa las válvulas de fallo-seguridad. Es el gas activador («driving») del ventilador. 10. Describa los sistemas de seguridad empleados para evitar las conexiones de gas incorrectas en la pared y bombonas. Todas las tomas de salida de gas de la pared son específicas para cada gas, de manera que sólo puede conectarse el tubo de suministro de O2 en la toma de O2 de la pared, el tubo de suministro de N2O en la salida de N2O, y así sucesivamente. Esto se conoce como sistema DISS (Diameter-Index-Safety-System). Las bombonas de gas están marcadas mediante un sistema PISS (Pin-Index-Safety-System) de manera que solamente la bombona correcta puede unirse a su conexión correspondiente en el aparato de anestesia, ¡asumiendo que no se hayan intercambiado las clavijas! Estos sistemas de seguridad deben estar controlados por un monitor que mida la concentración de oxígeno suministrada en la mezcla de gas. Este monitor es el punto más crítico a la hora de prevenir el suministro de una mezcla de gas hipóxico. 11. Además de las diferencias descritas anteriormente, ¿qué otras maneras hay de diferenciar los gases para prevenir un error humano? En primer lugar, la rosca de flujo de O tiene una forma aflautada. Las roscas de otros gases 2 tienen un diseño con ranuras. En segundo lugar, existe un código de colores, de manera que cada rosca de gas, flujómetro, bombona y toma de la pared tiene el color correspondiente a su gas asociado. En Estados Unidos el O2 es verde, el aire es amarillo y el N2O azul. Los estándares internacionales difieren en muchos países. En España, el O2 es blanco, el aire gris y el N2O azul. 12. Existen dos flujómetros para cada gas en un aparato de anestesia. ¿No podría apañárselas de forma segura solamente con uno? Se usan dos flujómetros para aumentar el rango de flujos sobre los que puede obtenerse una medida precisa. Los tubos de flujo en los aparatos de anestesia siempre se colocan en serie de modo que todo el gas fluye secuencialmente por ambos tubos. Para medir los flujos de manera precisa en los rangos usados para bajos flujos o incluso en anestesia con circuito cerrado (de 200 a 1.000 ml/min), es esencial disponer de dos tubos. Los medidores de flujo, también llamados flujómetros y tubos de Thorpe, también son específicos para el gas para el que han sido diseñados y no son intercambiables con otros gases. 13. ¿Por qué los flujómetros para aire, O2 y N2O se colocan en un orden determinado? Las razones incluyen estándares del gobierno de Estados Unidos (normas NIOSH), y de Europa convenciones del fabricante y de seguridad. El hecho de tener la rosca de O2 en la misma posición en todos los aparatos de anestesia reduce el riesgo de que el anestesiólogo gire el mando erróneo. En Estados Unidos, el flujómetro debe estar siempre a la derecha, lo más cerca posible del punto de salida en el colector de gases común, justo proximal al vaporizador de la anestesia. Con el flujómetro de O2 en esta posición, la mayoría de las fugas tienden a perder selectivamente los otros gases diferentes al O2. Esta configuración es la que tiene menos probabilidades de suministrar una mezcla de gas hipóxico. De nuevo, la mejor forma de detectar una mezcla de gas hipóxico es utilizar un analizador de oxígeno. 14. ¿Qué son las válvulas fallo-seguridad? Las válvulas fallo-seguridad están diseñadas para interrumpir el flujo de todos los gases a excepción del O2 cuando la presión de O2 cae por debajo de un valor establecido, habitualmente unos 25 psig (Figura 18-1). CAPÍTULO 18 El aparato de ANESTESIA Y LOS VAPORIZADORES 133 © Elsevier. Fotocopiar sin autorización es un delito Figura 18-1. Efecto del dispositivo fallo-seguridad y del dispositivo de fallo de presión del oxígeno. 15. ¿Sería más seguro dejar abierta la bombona de reserva de O2 del aparato, así, si la toma central de O2 falla, el aparato cambiaría automática e inmediatamente al suministro de la bombona de reserva? No. Primero, cuando todo el equipo funciona adecuadamente, la desventaja de dejar la bombona abierta es que si existe un fallo en el O2 de la pared, el aparato empleará el gas de la bombona. Puede que no se entere hasta que el aparato (y la bombona) estén totalmente vacíos de O2 y la alarma de baja presión de O2 comience a sonar. En este momento, tendrá que espabilarse rápidamente para conseguir O2, de otra procedencia. El segundo motivo se relaciona con el fallo del equipo, y existen dos partes para esta explicación: 1. Cuando deja de haber flujo de gas, puede que la presión se mantenga en el manómetro a pesar de una fuga en la conexión con la bombona. Así, es posible que se lea una presión completa y en cambio la bombona esté vacía. La presión de la bombona debería comprobarse después de que la presión del sistema cae, y entonces debería cerrarse la bombona. 2. Si la presión del O2 de la toma de pared es demasiado baja, la bombona podría vaciarse, suministrando al aparato de anestesia, en vez de reservar el O2 de la bombona para emergencias. Una segunda válvula de comprobación impide que el O2 de la bombona entre en las tuberías de alimentación de la pared en caso de que falle el suministro de la pared. Si esta válvula falla, la bombona podría, durante el breve período que tardaría en vaciarse, rellenar retrógradamente el sistema del hospital, ayudando al suministro de O2 a pacientes de otras salas. 16. ¿Durante cuánto tiempo puede liberarse O2 cuando falla el suministro de la pared? Las bombonas E que suministran O2 a la mayoría de los aparatos de anestesia contienen 600 l cuando están llenas. Si el ventilador no se está usando (recuerde que el O2 activa el ventilador), el flujómetro de O2 indica cuánto O2 se está usando. Con un flujo de O2 de 2 l/min, existen unos 300 minutos (o 5 horas) de O2 disponible. Si el ventilador se está usando, el gas adicional que se requiere para este propósito es aproximadamente igual al volumen minuto del ventilador, y el tiempo que durará el suministro de la bombona se reducirá significativamente por debajo de las 5 horas estimadas anteriormente con una bombona llena. Debe destacarse que ventilando manualmente al paciente en este caso se preservaría el suministro de oxígeno. Reducir el flujo de O2 también alargaría la duración de la bombona. 134 CAPÍTULO 18 El aparato de ANESTESIA Y LOS VAPORIZADORES 17. ¿Qué principios físicos intervienen en el proceso de vaporización? La presión de vapor saturado del anestésico inhalatorio, que varía en función de la temperatura, determina la concentración de las moléculas de vapor por encima del líquido anestésico. El calor de vaporización es la energía necesaria para liberar moléculas de un líquido a la fase gaseosa. La fase líquida libera calor durante la vaporización, o se enfría a medida que las moléculas salen y se incorporan a la fase gaseosa. Para abordar este problema, los vaporizadores se fabrican con metales de alta conductividad térmica. Esta elevada conductividad asegura que existe un reservorio de calor de forma que el calor necesario para la vaporización se recupera constantemente a partir del ambiente, y la velocidad de vaporización del anestésico inhalatorio es independiente de las variaciones de la temperatura del vaporizador. 18. ¿Qué significa que un vaporizador tenga un bypass variable? ¿Qué sucede si se inclina lateralmente éste? Los vaporizadores están situados por detrás de los flujómetros. El gas fresco de los flujómetros entra en el vaporizador y se divide en dos corrientes. La mayor parte del gas entra en la cámara de bypass o cortocircuito y no se expone al agente halogenado. El gas restante entra en la cámara de vaporización y se satura con el anestésico. El dial de concentración determina la proporción de flujo de gas que entra en cada una de las corrientes. Posteriormente éstas se reúnen antes de la salida del vaporizador. El gas fresco que sale del vaporizador contiene una concentración de vapor especificada por el dial de concentración. En caso de que un vaporizador con bypass variable se incline lateralmente, el líquido anestésico puede derramarse desde la cámara de vaporización a la cámara de bypass, creando dos cámaras de vaporización eficaces y aumentando la vaporización del vaporizador. Esto podría provocar niveles tóxicos del anestésico inhalatorio que se está suministrando al paciente. Sin embargo, la mayoría de los vaporizadores modernos, aunque no todos, disponen de mecanismos para reducir al mínimo este efecto. 19. ¿Qué significa la compensación de temperatura? Durante la vaporización el anestésico líquido se enfría, extrayendo calor del metal del vaporizador, que a su vez extrae calor del quirófano. A medida que el anestésico líquido se enfría, la presión de vapor saturado disminuye, al igual que el anestésico liberado del vaporizador. La compensación de temperatura significa que el vaporizador dispone de mecanismos para ajustar la vaporización al compensar la temperatura. 20. ¿Qué es el efecto bombeo? La presión positiva se transmite de forma retrógrada hacia el vaporizador durante la ventilación del paciente. La presión positiva puede provocar brevemente una inversión en la circulación del gas dentro del vaporizador, permitiendo la reentrada periódica del gas en la cámara de vaporización. El resultado del efecto bombeo es un aumento de la vaporización por encima de lo indicado en el dial de concentración. Los vaporizadores modernos disponen de mecanismos para reducir el efecto bombeo, pero no lo eliminan totalmente. 21. ¿Cómo afecta la altitud a los vaporizadores modernos? El efecto del cambio en la presión barométrica sobre la concentración en porcentaje de volumen que sale del vaporizador puede calcularse de la siguiente forma: x’ = x (p/p’), donde x’ es el vapor que sale en porcentaje de volumen en la nueva altitud (p’), y x es la concentración del vapor que sale en porcentaje de volumen para la altitud (p), una vez calibrado el vaporizador. Considere el siguiente ejemplo: supongamos que un vaporizador está calibrado a nivel del mar (p = 760 mmHg), se lleva a Denver (p’ = 630 mmHg) y se programa para liberar isoflurano al 1% (x). La salida de vapor real (x’) es 1% (760/630) = 1,2%. Recuerde que la presión parcial de vapor, y no la concentración en porcentaje de volumen, es el factor determinante para la profundidad de la anestesia. Observe que el 1% a nivel del mar (760 mmHg) es 7,6 mmHg y que el 1,2% en Denver (630 mmHg) es 7,6 mmHg; así que, a pesar de la altitud, el efecto clínico no variará. CAPÍTULO 18 El aparato de ANESTESIA Y LOS VAPORIZADORES 135 22. ¿Qué sucede si se llena con un anestésico equivocado un vaporizador calibra­­ do para otro anestésico? Un anestésico incorrecto en un vaporizador específico para otro anestésico liberará una sobredosis o una dosis inferior. El factor más importante para determinar la dirección de los errores es la presión de vapor del anestésico. Si se coloca un anestésico con una presión de vapor alta en un vaporizador destinado a un anestésico menos halogenado, la vaporización será excesiva. Si se emplea accidentalmente un anestésico con una presión de vapor menor que la del anestésico destinado a ese vaporizador, la vaporización del anestésico será menor de lo esperado. Cada vez más, los vaporizadores y los frascos de anestésicos inhalatorios están chaveteados para evitar el vertido incorrecto de los anestésicos inhalatorios en los vaporizadores. 23. ¿Qué es diferente en el vaporizador de desflurano? La presión de vapor del desflurano es de 664 mmHg a 20 °C. En otras palabras, el punto de evaporación de este anestésico aproximadamente está a temperatura ambiente. El desflurano también es menos potente que otros anestésicos habituales (concentración alveolar mínima [CAM] = 6%), y puede administrarse en concentraciones de hasta un 18%. La vaporización pasiva de este volumen de anestésico provocará importantes variaciones en la temperatura que deben compensarse. El vaporizador del desflurano calienta de forma activa el anestésico líquido a 39 °C. A esta temperatura la presión de vapor del anestésico es aproximadamente de dos atmósferas. Esto ha demostrado ser un método práctico para suministrar de forma precisa un anestésico con una presión de vapor elevada. © Elsevier. Fotocopiar sin autorización es un delito 24. ¿Qué impide abrir dos vaporizadores simultáneamente? Los aparatos de anestesia modernos disponen de un sistema de interconexión o una llave interconectada que permite que solamente se abra un vaporizador a la vez. Sin embargo, en los aparatos de anestesia donde pueden instalarse tres vaporizadores, el espacio central debe estar ocupado o el sistema de interconexión no será operativo. 25. A una altitud de 2.100 metros, tiene que programar el vaporizador para que libe­ re más desflurano que el que esperaría basándose en la concentración alveolar mínima del agente. Explique por qué esto no ocurre con otros agentes. Los vaporizadores convencionales (para halotano, isoflurano y sevoflurano) están «compensados para la altitud». La compensación para la altitud se produce porque la válvula de diversión está colocada funcionalmente a la salida del vaporizador, una variación en el diseño que minimiza los efectos de bombeo y presurización. Estos vaporizadores liberan una presión parcial constante del agente, no un porcentaje de volumen constante. El vaporizador de desflurano no deriva una parte del flujo de gas fresco a través de la cámara vaporizadora, sino que añade vapor al flujo de gas para liberar un verdadero porcentaje de volumen. Puesto que es el número de moléculas del agente (la presión parcial) lo que anestesia al paciente, los vaporizadores convencionales tienen la misma potencia anestesiadora a cualquier altura. El vaporizador de desglurano libera un porcentaje de volumen programado, independientemente de la altitud, lo que representa una presión parcial (potencia anestesiadora) que es un 24% menor que la misma concentración a nivel del mar. Así, se debe liberar un porcentaje mayor de desflurano para alcanzar la CAM a 2.100 metros de altitud. 26. Un paciente con hipertermia maligna requiere ser anestesiado. ¿Deberían qui­ tarse los vaporizadores del aparato de anestesia? Los vaporizadores Datex-Ohmeda se quitan fácilmente soltando un pestillo y levantando el vaporizador del aparato. En los aparatos de anestesia Drager, hay que quitar dos tornillos Allen para soltar los vaporizadores. Luego, a menos que el vaporizador se haya sustituido por otro, hay que instalar un bypass de bloqueo en el hueco del vaporizador vacío. Estas tareas las puede realizar fácilmente cualquiera que sea capaz de manipular una llave Allen, pero Drager recomienda que sus vaporizadores se cambien sólo por personal de servicio autorizado. Sin embargo, al lavar con O2 durante varios minutos deberían desaparecer todos los agentes (excepto las partes de goma en el absorbedor y en el circuito). El fabricante debería garantizar que la persona que haga uso del aparato no pueda abrir accidentalmente un vaporizador. 136 CAPÍTULO 18 El aparato de ANESTESIA Y LOS VAPORIZADORES P UNTOS CLAVE: El aparato de anestes i a y los vapo rizadores 1. Los aparatos de anestesia son sistemas integrados que no sólo liberan gases anestésicos, sino que también monitorizan tanto al paciente como al propio aparato. 2. Algunos gases, al comprimirse, se condensan en líquido (N2O y CO2), y otros no (O2 y N2). Estas propiedades definen la relación entre el volumen de la bombona y la presión. 3. Los aparatos de anestesia deben tener oxígeno de reserva en caso de que falle el oxígeno de la pared. 4. Los flujómetros miden con precisión solamente el gas para el que se han calibrado explícitamente. 5. La vaporización de los vaporizadores tradicionales depende de la proporción de gas fresco que pasa por fuera de la cámara de vaporización (bypass) en relación con la proporción que entra en la cámara de vaporización. 6. El vaporizador de desflurano inyecta vapor de forma activa en la corriente de gas fresco, mientras que los vaporizadores tradicionales emplean un sistema pasivo de bypass variable. 27. ¿Qué es un sistema de extracción de gases? Excepto en el circuito cerrado, el gas está continuamente entrando y saliendo del circuito respiratorio anestésico. El gas que sale es una mezcla del gas espirado por el paciente y del exceso de gas fresco que supera las necesidades del paciente pero que contiene agente anestésico. Para reducir la exposición del personal de quirófano a las cantidades ambientales de agentes anestésicos, se cree adecuado capturar y expeler este gas «contaminado» del ambiente del quirófano. El dispositivo que se emplea para transferir este gas de manera segura desde el circuito respiratorio al sistema de aspiración central del hospital se llama sistema de extracción de gases. Debido a la periodicidad de la respiración, el gas sale del circuito respiratorio intermitentemente. El sistema de extracción tiene un reservorio para el gas expelido hasta que el extractor o el sistema aspirador, que funciona a un ritmo de flujo constante, pueda eliminar el gas. El sistema de extracción debe evitar el exceso de aspiración o una oclusión que afecte al circuito respiratorio del paciente. Esto lo realiza mediante válvulas de presión positiva y negativa. Así, si falla el sistema aspirador o se ajusta a una velocidad demasiado baja, saldrá a través de una válvula de descarga de presión positiva. (Por supuesto, esto contamina el quirófano, pero este problema es mínimo comparado con inflar los pulmones del paciente como un globo.) Si el sistema se ajusta demasiado alto, una válvula de presión negativa permite que el aire ambiente se mezcle con el gas expelido, impidiendo que exista una aspiración de más de 2,5 mmHg en el circuito respiratorio. Bibliografía Recomendada 1. Brockwell RC, Andrews JJ: Inhaled anesthetic delivery systems. In Miller RD, editor: Miller’s anesthesia, ed 6, Philadelphia, Elsevier Churchill Livingstone, 2005, pp 273-316. 2. Dorsch JA, Dorsch SE: Understanding anesthesia equipment. ed 5, Philadelphia, Lippincott Williams & Wilkins, 2008. James Duke, MD, MBA Capítulo 19 Circuitos Y VENTILADORES DE ANESTESIA 1. ¿Cuáles son las diferencias entre los distintos tipos de circuitos respiratorios de anestesia? Los circuitos respiratorios se clasifican, habitualmente, en abiertos, semiabiertos, semicerrados y cerrados. Incluyen varios componentes configurados de tal manera que permiten al paciente respirar (o ser ventilado) con una mezcla de gases diferente al aire ambiente. 2. Cite un ejemplo de circuito abierto. Un circuito abierto es el método por el que se administraron las primeras anestesias hace 160 años. El «circuito» consistía simplemente en un paño saturado con éter o cloroformo y puesto en la cara del paciente. El paciente respiraba los vapores y quedaba anestesiado. La profundidad de la anestesia se controlaba por la cantidad de anestésico líquido en el paño; así, supuso muchos procesos de prueba y error el conseguir una buena técnica. 3. Nombre un ejemplo de circuito semiabierto. Los diferentes circuitos semiabiertos fueron descritos con detalle por Mapleson, y se conocen habitualmente como circuitos Mapleson A, B, C, D, E y F (Figura 19-1). Todos tienen en común una fuente de gas fresco, tubos corrugados (más resistentes por acodarse) y una válvula de Figura 19-1. Circuitos Mapleson A, B, C, D, E y F. FGF, flujo de gas fresco. (De Willis BA, Pender JW, Mapleson WW: Rebreathing in a T-piece: Volunteer and theoretical studies of the Jackson-Rees modification of Ayrés T-piece during spontaneous respiration. Br J Anaesth 47:1239-1246, 1975, con permiso.) © 2011. Elsevier España, S.L. Reservados todos los derechos 137 138 Capítulo 19 Circuitos Y VENTILADORES DE ANESTESIA escape de sobrepresión o de presión ajustable. Las diferencias entre los circuitos están en la localización de la válvula de sobrepresión, la entrada de gas fresco, y si existe bolsa reservorio o no. Las ventajas de los circuitos Mapleson son la simplicidad de su diseño, la capacidad de cambiar la profundidad de la anestesia rápidamente, el poderse transportar, y la falta de inhalación de gases ya exhalados (siempre que se utilice el flujo de gas fresco suficiente). Las desventajas son la falta de conservación del calor y la humedad, la capacidad limitada para eliminar los gases no utilizados y las necesidades altas de flujo de gas fresco. Estos circuitos se usan en raras ocasiones hoy día, excepto en el transporte del paciente. 4. Cite un ejemplo de circuito semicerrado. El prototipo de circuito semicerrado es el circuito circular, que es el que está en la mayoría de quirófanos de Estados Unidos (Figura 19-2). Todos los circuitos semicerrados contienen una rama inspiratoria, una rama espiratoria, válvulas unidireccionales, canister para el absorbedor de CO2, bolsa reservorio y una válvula de sobrepresión en la rama espiratoria. Las ventajas del circuito circular son la conservación del calor y la humedad, la capacidad de emplear flujos reducidos de gas (por tanto, ahorrando anestésico halogenado y conservando la capa de ozono), y la capacidad de extraer los gases no utilizados. Las desventajas son la complejidad de su diseño, con unas 10 conexiones, cada una de las cuales tiene la posibilidad de fallar. Figura 19-2. Circuito circular. LPA, limitadora de presión ajustable. (De Andrews JJ: Inhaled anesthetic delivery system. En Eiller RD, editor: Anesthesia, ed 4, New York, 1994, Churchill Livingstone, pp 185-228.) 5. Cite un ejemplo de circuito cerrado. Como el circuito semicerrado, el circuito cerrado es un circuito circular ajustado de forma que la entrada de gas fresco es igual al consumo de O2 por el paciente y la captación del agente anestésico. El CO2 se elimina en el absorbedor. 6. Ordene los circuitos Mapleson basándose en su eficacia para una ventilación espontánea y controlada. Controlada: D > B > C > A. Espontánea: A > D > C > B. 7. ¿Qué circuito es el que se emplea para la administración de anestesia con más frecuencia hoy día? Casi todos los fabricantes de aparatos de anestesia aportan un circuito circular de anestesia con su equipo. Cuando se comparan con otros circuitos disponibles, el circuito circular es el que presenta más ventajas. Capítulo 19 Circuitos Y VENTILADORES DE ANESTESIA 139 8. ¿Cómo se detecta la desconexión del circuito respiratorio durante el suministro de un anestésico? Los ruidos respiratorios dejarían de detectarse con un fonendoscopio precordial o esofágico, y, si los parámetros se han programado adecuadamente, el monitor de presión de la vía aérea hará sonar la alarma del monitor volumen corriente-volumen minuto. El capnógrafo no detectará el CO2, y minutos más tarde la saturación de O2 comienza a declinar. El CO2 exhalado es, probablemente, el mejor monitor para detectar las desconexiones; una reducción o la ausencia del capnograma es sensible aunque no específica de desconexión. 9. ¿Cómo se elimina el CO2 del circuito circular? Los gases exhalados pasan a través de un canister que contiene un absorbedor de CO2, como la cal sodada o Baralyme. La cal sodada consiste en hidróxido cálcico (Ca[OH]2) con menores cantidades de hidróxido sódico (NaOH) e hidróxido potásico (KOH). El Baralyme sustituye el calcio por bario. Tanto la cal sodada como el Baralyme reaccionan con el CO2 para formar calor, agua y el carbonato correspondiente. La cal sodada reacciona de este modo: CO2 + Ca (OH)2 ⇌ CaCO3 + H2O + calor 10. ¿Cuánto CO2 puede neutralizar el absorbedor? ¿Qué factores afectan a su efi­ cacia? La cal sodada es el absorbedor más frecuente y lo máximo que puede absorber es 23 l de CO2 por cada 100 g de absorbedor. Sin embargo, el absorbedor medio elimina 10-15 l de CO2 por cada 100 g de absorbedor en un sistema de cámara única, y 18-20 l de CO2 en un sistema de doble cámara. Los factores que afectan la eficacia son el tamaño del recipiente del absorbedor (el volumen corriente del paciente debería caber totalmente en el espacio vacío del recipiente o canister), el tamaño del gránulo del absorbedor (el tamaño óptimo es 2,5 mm o entre 4 y 8 mesh), y la presencia o ausencia de canales (si el relleno no es compacto se permite que los gases eliminados eviten los gránulos del absorbedor en el recipiente). © Elsevier. Fotocopiar sin autorización es un delito 11. ¿Cómo saber si el absorbedor ya se ha agotado? ¿Qué reacciones adversas pueden producirse entre los anestésicos inhalatorios y el absorbedor de CO2? Se añade un colorante sensible al pH a los gránulos que cambia de color en presencia de ácido carbónico, un intermediario en la reacción química de la absorción de CO2. El colorante más habitual en Estados Unidos es el violeta de etilo, que es de color blanco mientras está fresco y se vuelve violeta cuando el absorbedor se ha agotado. Las reacciones adversas entre los anestésicos inhalatorios y los absorbedores se comentan en el Capítulo 10. 12. ¿Cómo se puede comprobar el buen funcionamiento de un sistema circular? Se debe cerrar la válvula de sobrepresión, tapar la pieza Y y presionar el botón de O2 de emergencia hasta que la presión sea de 30 cmH2O. La presión no disminuirá si no existen fugas. Posteriormente se abre la válvula de sobrepresión para asegurar que funciona correctamente. Además, se debe comprobar la función de las válvulas unidireccionales respirando por cada rama individualmente, asegurándose de que no se puede inhalar por la rama espiratoria o exhalar por la rama inspiratoria. 13. ¿En qué se diferencian los ventiladores de anestesia de los ventiladores de las unidades de cuidados intensivos? Los ventiladores de las unidades de cuidados intensivos suelen ser más potentes (permitiendo presiones inspiratorias y volúmenes corrientes mayores, lo que es importante en pacientes con distensibilidad pulmonar reducida) y disponen de más modos de ventilación. No obstante, los aparatos de anestesia de nueva generación ofrecen cada vez más modos de ventilación. Véase el Capítulo 21. 14. ¿Qué gas se emplea para impulsar la concertina en un ventilador de anestesia? En general suele emplearse el O2 para este propósito porque es barato y siempre está disponible. En los ventiladores modernos de concertina ascendente la presión en el interior de la concertina siempre es ligeramente mayor que en la cámara fuera de la concertina ya que el peso de la propia 140 Capítulo 19 Circuitos Y VENTILADORES DE ANESTESIA concertina equivale a 1-2 cmH2O. En el caso de que se produzca una fuga en la concertina, cualquier flujo de gas neto saldría (no entraría) en la concertina y no variaría la composición de la mezcla respiratoria. Cuando la concertina alcanza el máximo de su trayecto, una presión adicional de 1 a 2 cmH2O provoca que se abra la válvula de sobrepresión. 15. ¿Cuál es el estado del sistema de extracción de gases cuando la concertina está por debajo del máximo de su recorrido? Cuando el ventilador está en marcha y la concertina está por debajo del máximo de su trayecto, el circuito respiratorio está totalmente cerrado. El exceso de gas puede salir del circuito respiratorio solamente cuando se activa un valor determinado de presión al alcanzar la concertina su recorrido máximo. 16. ¿Qué efecto tiene sobre el paciente la presión extra que se necesita para abrir la válvula de sobrepresión? Un paciente ventilado con un ventilador de concertina ascendente suele estar sometido a 2,5-3 cmH2O de presión positiva teleespiratoria (PEEP). La mayoría de los expertos coinciden en que esta PEEP que se añade es en realidad más fisiológica que ventilar al paciente sin PEEP. 17. ¿Qué parámetros pueden ajustarse en un ventilador de anestesia? La mayoría de los ventiladores de anestesia permiten el ajuste de: Volumen corriente (o volumen minuto). Frecuencia respiratoria. Relación tiempo inspiratorio-espiratorio (I:E). Pausa inspiratoria (en ocasiones). PEEP. Algunos ventiladores de anestesia más modernos permiten realizar otros ajustes, por ejemplo la selección de los diferentes modos de ventilación como ventilación con presión de soporte y ventilación mandatoria intermitente sincronizada. P u n tos Clave: Cir cuitos y ventilado r e s d e a nestesia 1. Excepto en los aparatos de anestesia en los que existen compensadores de flujo, el flujo de gas fresco contribuye al volumen corriente. 2. Aunque las características de los ventiladores de anestesia han mejorado mucho en los últimos años, aún no son tan potentes como los ventiladores clásicos de las unidades de cuidados intensivos. 3. Todo paciente que se ventila con un ventilador de anestesia con concertina ascendente recibe unos 2,5-3 cmH2O de PEEP debido al peso de la concertina. 4. El circuito semicerrado que emplea un sistema circular es el circuito de anestesia utilizado con más frecuencia. 5. Las ventajas de un circuito circular son la conservación del calor y de la humedad, la capacidad de usar flujos reducidos de gas fresco, y la capacidad de eliminar los gases usados. Los inconvenientes son la multiplicidad de conexiones, con la posibilidad de fallos, y su alta compliance. 18. ¿Por qué se han abandonado las concertinas descendentes en favor de las ascendentes? Las concertinas se clasifican basándose en su movimiento durante la espiración (es decir, su posición cuando el ventilador no está ventilando al paciente). Las concertinas colgantes o des- Capítulo 19 Circuitos Y VENTILADORES DE ANESTESIA 141 cendentes se consideran poco seguras por dos razones. En primer lugar, si se produce la desconexión del circuito, la concertina se llenará de aire ambiente y, aunque su movimiento pueda parecer normal, el ventilador ventilará la habitación más que al paciente. En segundo lugar, dado que el peso de la concertina crea una presión ligeramente negativa en el circuito, esto puede provocar una presión teleespiratoria negativa, pudiéndose aspirar aire ambiente a través del sistema de extracción de gases, interfiriendo con el control ejercido por el anestesiólogo sobre las concentraciones de gas respirado por el paciente. 19. ¿Cuál es la causa de que la concertina no llegue a subir completamente entre cada respiración? El motivo más obvio es que exista una fuga en el circuito respiratorio, o que haya una desconexión, o que el paciente se haya extubado. Si el flujo de gas fresco es demasiado bajo, es posible que el paciente esté usando oxígeno del circuito a una velocidad mayor que su llenado. 20. ¿Cómo contribuye la velocidad del flujo de gas fresco al volumen corriente? Durante la fase inspiratoria del ciclo ventilatorio el flujo se añade al volumen corriente. Supongamos que la frecuencia respiratoria se ha programado a 10 respiraciones/minuto con una relación I:E de 1:2 y un volumen corriente de 1.000 ml. Cada ciclo respiratorio dura entonces 6 segundos, 2 segundos para la inspiración y 4 segundos para la espiración. Si el flujo de gas fresco es de 6 l/min, 2/60 × 6.000 = 200 ml de gas fresco se añaden a cada inspiración. La mayoría de los ventiladores de anestesia modernos compensan de forma automática esta suma al volumen corriente. © Elsevier. Fotocopiar sin autorización es un delito 21. ¿Cómo y dónde se mide el volumen corriente? ¿Por qué distintas mediciones son a menudo diferentes? El volumen corriente se mide empleando varias técnicas y en diferentes localizaciones del circuito respiratorio. Las mediciones habituales son el ajuste del panel de control del ventilador, el recorrido de la concertina y el flujo a través de las ramas inspiratoria y espiratoria del circuito. Estas mediciones difieren con frecuencia porque pueden incluir o no la contribución del flujo inspiratorio, se realizan a diferentes presiones y compensan de forma diferente las velocidades de flujo. Dado que cada medición puede, teóricamente, ser una medida exacta de un parámetro diferente, es más importante registrar siempre una misma medición del volumen corriente en vez de discutir qué medición es la correcta. 22. Cuando se emplean flujos muy bajos de gas fresco, ¿por qué existe a veces discrepancia entre la concentración de oxígeno inspirado y la concentración de gas fresco? Con flujos de gas fresco bajos las concentraciones en el circuito cambian lentamente. Sin em­ bargo, esta pregunta hace referencia al hecho de que el paciente captará diferentes gases (obteniéndolos del circuito) a velocidades distintas de la velocidad a la que los gases entran en el circuito. En el caso del O2, un paciente adulto medio consumirá (obteniéndolo permanentemente del circuito) aproximadamente 200-300 ml/min de O2. Si se aporta nitrógeno u óxido nitroso junto con O2, el paciente sigue consumiendo O2 mientras aumenta la concentración de nitrógeno u óxido nitroso en el circuito. Es posible que se cree una mezcla hipóxica en el circuito aunque el gas fresco contenga el 50% o más de O2. Bibliografía Recomendada 1. Brockwell RC, Andrews JJ: Inhaled anesthetic delivery systems. In Miller RD, editor: Miller’s anesthesia, ed 6, Philadelphia, Elsevier Churchill Livingstone, 2005, pp 273–316.. 2. Dorsch JA, Dorsch SE: Understanding anesthesia equipment, ed 5 Philadelphia, Lippincott Williams & Wilkins, 2008. Capítulo 20 Posición del paciente James Duke, MD, MBA 1. ¿Cuál es el objetivo de colocar al paciente para la cirugía? El objetivo de la posición quirúrgica es facilitar el abordaje técnico al cirujano a la vez que se disminuye el riesgo para el paciente. El paciente anestesiado no puede avisar al clínico de posiciones comprometidas; por tanto, la colocación del paciente para la cirugía es un aspecto crítico para un resultado seguro. Una posición adecuada requiere colocar al paciente de manera segura en la mesa de operaciones; proteger todas las zonas con posible presión; protección de ojos; evitar la tracción de músculos, tendones o estructuras neurovasculares; dejar los catéteres y vías intravenosas accesibles y que se mantengan permeables; tubo endotraqueal en posición adecuada; ventilación y circulación no interrumpidas, y comodidad y seguridad del paciente mantenidas durante toda la duración de la intervención. Se aconseja preguntar al paciente si tiene conocimiento de algún problema de movilidad de alguna articulación; no intentar nunca colocar al paciente en una posición más allá de sus limitaciones. Durante todo el proceso quirúrgico también es importante revaluar la posición, reajustándola según sea necesario, y anotar en la gráfica todo lo referente a la posición y sus revaluaciones. 2. Comente las posiciones más habituales empleadas en el quirófano. Véase la Figura 20-1. 3. ¿Qué efectos fisiológicos se relacionan con el cambio de posición corporal? Una consideración importante son los efectos gravitatorios sobre los sistemas cardiovascular y respiratorio. Un cambio desde la posición erecta a la supina aumenta el gasto cardíaco secundariamente a la mejoría en el retorno venoso al corazón, pero los cambios en la presión arterial secundarios a las disminuciones reflejas de la frecuencia cardíaca y de la contractilidad son mínimos. Las situaciones que aumentan la presión intraabdominal en la posición supina, como tumores abdominales, ascitis, obesidad, embarazo o la insuflación de CO2 para laparoscopia disminuyen el retorno venoso y el gasto cardíaco. La posición supina provoca una disminución de la capacidad residual funcional y de la capacidad pulmonar total secundaria a un desplazamiento del diafragma por la presión del contenido abdominal. La relajación muscular y la anestesia disminuirán aún más estos volúmenes pulmonares. Las posiciones de litotomía y Trendelenburg provocan una compresión de las bases pulmonares, con la consecuente disminución de la distensibilidad pulmonar. Aunque se mejora algo con la ventilación con presión positiva, el diafragma no recupera su posición en el paciente despierto. En la posición supina, con respiración espontánea, la ventilación de las zonas pulmonares dependientes aumenta, lo que mejora la relación ventilación-perfusión porque el flujo sanguíneo también aumenta en estas zonas dependientes. 4. Describa la posición de litotomía y sus complicaciones frecuentes. Las caderas y rodillas del paciente se flexionan y los pies del paciente se colocan en unos estribos para facilitar el acceso a los genitales y al periné. El rango de flexión puede ser moderado (litotomía baja) o extremo (litotomía alta). Los pies pueden suspenderse en unas barras verticales, o en unas botas, o se sostienen las rodillas con unas perneras. Al elevar las piernas, se libera presión de la zona lumbar baja, y la sangre se transporta desde los miembros inferiores a los compartimentos centrales. La compresión de los nervios periféricos de la extremidad inferior es la lesión más habitual, y sucede en el 1-2% de pacientes que se colocan en la posición de litotomía. Las neuropatías 142 © 2011. Elsevier España, S.L. Reservados todos los derechos © Elsevier. Fotocopiar sin autorización es un delito Capítulo 20 Posición del paciente 143 Figura 20-1. Posición del paciente. (De Martin JT: Positioning in anesthesia and surgery, ed 2, Philadelphia, 1987, WB Saunders.) pueden ser unilaterales o bilaterales, y dependen del tiempo de colocación en esta posición (especialmente, si es superior a 2 horas). Aparecen pronto tras la cirugía, y pueden presentarse con parestesias y/o debilidad motora y, habitualmente, se resuelven por completo, aunque puede ser tras varios meses. Antes de atribuir estas lesiones a la posición de litotomía, hay que plantearse si el uso de agujas neuroaxiales, torniquetes de extremidad inferior o traumatismo quirúrgico (p. ej., el uso de separadores) pueden haber contribuido. Para evitar la subluxación de cadera, al finalizar la cirugía deberían quitarse ambas piernas de los estribos y bajarlas simultáneamente. Cuando se eleva la sección de la mesa de quirófano 144 Capítulo 20 Posición del paciente correspondiente a las piernas, hay que asegurarse de que los dedos de las manos no quedan atrapados para evitar aplastamiento o lesiones por amputación. 5. ¿Qué nervios pueden afectarse en la posición de litotomía? Nervio femoral: una práctica recomendable es evitar una flexión de cadera superior a 90°, aunque sigue sin haber acuerdo sobre si la flexión forzada predispone al paciente a neuropatía femoral. El nervio femoral también se ve comprometido por los separadores pélvicos. Nervio peroneal común: puede lesionarse cuando la cabeza del peroné no se ha protegido con almohadillado suficiente y se comprime con los estribos. Nervio ciático: evitar el estiramiento de los músculos posteriores del muslo, evitando una flexión de caderas superior a 90°. Nervio safeno: puede lesionarse si el cóndilo tibial interno se comprime. Nevio obturador: puede elongarse en su salida a través del agujero del obturador durante la flexión del muslo. Nervio femorocutáneo lateral: se presenta siempre con afectación de la sensibilidad únicamente. 6. ¿Cuáles son las lesiones posibles en un paciente colocado en decúbito lateral? Todos los pacientes en decúbito lateral deberían tener colocado un rollo axilar para distribuir el peso en la caja torácica del paciente y evitar la compresión de ramas neurovasculares del brazo dependiente. La pérdida de pulso del brazo dependiente sugiere una compresión excesiva, pero la presencia de pulso no asegura que el plexo braquial esté protegido. Los brazos se protegen y almohadillan en una posición perpendicular a los hombros. La pierna dependiente se flexiona normalmente a nivel de la cadera y de la rodilla, con un almohadillado entre las piernas y bajo la cabeza tibial inferior, para reducir la presión en el nervio peroneal. La cabeza debería colocarse en línea con la columna vertebral para evitar el estiramiento del plexo braquial del brazo proclive. Se ha producido síndrome de Horner cuando la cabeza no se ha mantenido en una posición neutra. Las estructuras faciales, mamas y genitales también deberían protegerse. En la posición lateral puede producirse un desequilibrio de la ventilación-perfusión. El pulmón dependiente se hipoventila, y tiene mayor perfusión. En cambio, el pulmón proclive se hiperventila debido al aumento de la distensibilidad. Normalmente, existe alguna compensación fisiológica, y los cambios en la ventilación y la perfusión suelen ser bien tolerados, aunque en un paciente comprometido puede ser problemático. 7. ¿Cuáles son los efectos fisiológicos y los riesgos asociados con la posición de Trendelenburg? La cabeza hacia abajo, o posición de Trendelenburg, aumenta la translocación de sangre en el compartimento central. La presión intracraneal e intraocular aumentan en la posición de Trendelenburg de forma secundaria a la disminución del drenaje venoso cerebral. No se han encontrado complicaciones en pacientes sanos, aunque la posición de Trendelenburg es una contraindicación clara en pacientes con aumento de la presión intracraneal. Las intervenciones largas pueden provocar edema facial y de la vía aérea superior importantes. La posibilidad de una obstrucción de la vía aérea postextubación debería plantearse, y la capacidad del paciente para respirar alrededor del tubo endotraqueal con el balón desinflado es tranquilizadora, aunque no garantiza por completo que no se producirá la obstrucción de la vía aérea postextubación. Tras una cirugía prolongada en posición de Trendelenburg, especialmente cuando se han administrado cantidades importantes de líquido intravenoso, puede ser prudente dejar al paciente intubado, con el tórax elevado, dejando tiempo para la redistribución de líquido. Las disminuciones en la distensibilidad pulmonar, además de en la capacidad residual funcional y la capacidad vital, pueden producirse en la posición de Trendelenburg. También se han observado picos de presiones de la vía aérea durante la ventilación mecánica. Las hombreras empleadas para evitar que el paciente se deslice en la mesa de operaciones se han asociado con lesiones del plexo braquial. 8. ¿Qué riesgos específicos se asocian con la posición prono? La posición prono provoca un desplazamiento cefálico del diafragma. Se emplean rollos debajo del tórax para disminuir la compresión abdominal, mejorando el movimiento diafragmático y limitando la compresión sobre la aorta y la vena cava inferior. En esta posición es necesaria una Capítulo 20 Posición del paciente 145 protección adecuada de todos los puntos de presión, como cara, ojos, orejas, brazos, rodillas, caderas, tobillos, mamas y genitales. Los brazos deben colocarse en una posición neutra para evitar la tracción del plexo braquial, aunque es aceptable una abducción superior a 90°. Los electrodos del electrocardiograma no deben colocarse de modo que el paciente quede tumbado sobre ellos. 9. ¿Qué es la posición de tumbona? Esta posición se usa para mejorar el acceso y la movilidad del hombro durante la cirugía. Cuando se ha terminado de colocar al paciente, el anestesiólogo no tiene un acceso fácil a la cabeza o al tubo endotraqueal, por lo que estas estructuras deben asegurarse bien en una posición neutra antes del inicio de la cirugía. La presión de perfusión debe monitorizarse cuidadosamente, ya que la cabeza está muy por encima del nivel del corazón. También debe prestarse especial atención en proteger los ojos porque el cirujano está trabajando muy cerca de la cara y los instrumentos y otros útiles podrían ejercer presión sobre ellos. Protectores de ojos, de plástico, son de uso frecuente en estas situaciones. 10. ¿Cuándo se emplea la posición de sentado? La posición de sentado se emplea para facilitar el acceso a la fosa craneal posterior y realizar una laminectomía cervical. Sin embargo, estas intervenciones se realizan hoy día con el paciente en posición supina, y el empleo de la posición sentada está disminuyendo. 11. ¿Cuáles son las ventajas de la posición de sentado? Posición óptima para la exposición quirúrgica con menor pérdida sanguínea, mejoría del campo quirúrgico y, tal vez, mejor resección de la lesión. Disminución del edema facial. Acceso fácil al tubo endotraqueal. Menor lesión nerviosa cerebral. © Elsevier. Fotocopiar sin autorización es un delito 12. Enumere las desventajas de la posición de sentado. Hipotensión: debido a la disminución del retorno venoso, el gasto cardíaco puede reducirse hasta el 20%, pero mejora con la administración de líquidos y vasopresores. Hay que plantearse la compresión con medias de las extremidades inferiores para mejorar el retorno venoso. La monitorización intraarterial es esencial. Nivelar el transductor a nivel del meato auditivo externo para monitorizar la presión de perfusión cerebral. La manipulación del tronco encefálico provoca cambios hemodinámicos. Los riesgos de una flexión cervical marcada son la isquemia de la médula espinal y la obstrucción de la vía aérea (debido a edema grave de la lengua o acodamiento del tubo endotraqueal). Deben dejarse dos traveses de espacio entre la barbilla y el esternón. Embolismo gaseoso venoso (EGV). 13. ¿Cómo se produce el embolismo gaseoso venoso? ¿Cuáles son las secuelas? Cuando la zona quirúrgica está por encima del nivel del corazón, la entrada de aire en la circulación venosa es un riesgo. El EGV puede provocar embolismo gaseoso pulmonar, hipotensión y embolia gaseosa paradójica, si existe una comunicación intracardíaca. A menos que sea masivo, el EGV responde habitualmente a la infusión de líquidos y a terapia vasopresora. La zona quirúrgica debe irrigarse con abundante líquido para evitar que siga entrando gas. 14. Revise la sensibilidad y las limitaciones de los monitores para detectar un em­ bolismo gaseoso venoso. Existen muchos monitores para la detección del EGV. No hay ninguna técnica totalmente fiable por sí sola, de modo que cuantos más monitores se utilicen, mayor es la probabilidad de detectar un EGV. En orden decreciente de sensibilidad, los monitores son: ecocardiografía transesofágica y ecografía Doppler > aumento de la fracción teleespiratoria de nitrógeno > disminución del CO2 teleespiratorio > aumento de la presión de la aurícula derecha > fonendoscopio esofágico. 146 Capítulo 20 Posición del paciente Un catéter en la aurícula derecha tiene la ventaja de poder aspirar el aire intracardíaco. Por tanto, de todas las modalidades mencionadas es la única que permite realizar un diagnóstico y tratamiento. Los catéteres multiperforados son claramente la elección, y deberían dejarse colocados en la parte superior de la aurícula derecha. 15. ¿Cuáles son los riesgos al colocar a una paciente embarazada? La paciente embarazada es susceptible a la compresión aorta-cava secundaria al útero grávido, que ejerce presión sobre estas estructuras vasculares, disminuyendo potencialmente el flujo sanguíneo uteroplacentario y el retorno venoso al corazón. El desplazamiento uterino izquierdo disminuye la presión intraabdominal, y se consigue colocando una almohada o una cuña bajo la cadera derecha. 16. ¿Qué neuropatías periféricas se asocian con la cirugía cardíaca? El plexo braquial puede lesionarse. Las características anatómicas del plexo, como es su localización superficial, su paso entre el foramen intervertebral y la fascia, y el pequeño espacio que tiene durante su recorrido entre la primera costilla y la clavícula, lo vuelven vulnerable a la lesión. Son factores de riesgo la retracción esternal y las fracturas de la primera costilla. No parece que exista una diferencia significativa entre la neuropatía braquial cuando los brazos se mantienen pegados al cuerpo, en comparación con la abducción de brazos de 90° con los codos elevados y las palmas hacia arriba. Las mejores recomendaciones son: mantener la cabeza en una posición neutra, colocar el separador esternal lo más caudalmente posible y emplear los separadores asimétricos con precaución. 17. ¿Cuál es la neuropatía perianestésica más habitual? El nervio cubital es el nervio periférico que se lesiona con mayor frecuencia, aunque su incidencia es relativamente poco frecuente. Existe más riesgo en los hombres mayores de 50 años, y es habitual que se manifiesta tras varios días. Ocasionalmente es una neuropatía bilateral. Como detalle, el Closed Claims Analysis de la American Society of Anesthesiologists (ASA) halló que el 15% de las neuropatías cubitales se producían en pacientes sometidos a sedación y anestesia subaracnoidea o epidural o a vigilancia monitorizada. Cabría esperar que, dado que está despierto, el paciente recolocara sus brazos si apareciese embotamiento o parestesia durante la intervención. Las neuropatías cubitales tienden a ser leves, la mayoría de naturaleza sensitiva y autolimitadas. Es razonable decirles a los pacientes que la recuperación de la función se produce en unas 6 semanas, aunque algunos déficits han durado hasta 2 años. Existen numerosos casos de neuropatías cubitales en los que se utilizaron almohadillas para proteger el nervio cubital; así pues, las neuropatías cubitales son de naturaleza claramente multifactorial. Algunos pacientes pueden tener una neuropatía cubital subclínica previa a su identificación postoperatoria. 18. Revise la incidencia de lesiones del plexo braquial. El Closed Claims Analysis halló que las lesiones del plexo braquial representaban el 20% de todas las lesiones nerviosas asociadas con la anestesia. Entre los factores de riesgo destacan el empleo de hombreras en posiciones de Trendelenburg, mala posición de los brazos y extensión cervical mantenida. Aunque sin relación con la posición, las técnicas anestésicas regionales de la extremidad superior también pueden provocar lesiones del plexo braquial. Como detalle, las parestesias durante la colocación de agujas o inyección de anestésicos locales no se asocian con lesiones posteriores. 19. ¿Cómo se pueden evitar las neuropatías de la extremidad superior mediante la colocación cuidadosa del paciente? La abducción del brazo debe limitarse a 90° en pacientes en decúbito supino. El almohadillado protector es esencial para evitar las neuropatías de la extremidad superior, pero no es garantía de que no se producirán. Debe protegerse con almohadillas el surco cubital, y se debe evitar la pronación ya que ésta coloca al nervio cubital en su posición más vulnerable. Cuando se colocan los brazos pegados al cuerpo es preferible una posición neutra. La flexión del codo puede aumentar el riesgo de neuropatía cubital. La presión en el surco espiral del húmero puede provocar una neuropatía radial. La limitación de la extensión del codo es frecuente y su hiperextensión Capítulo 20 Posición del paciente 147 puede suponer un riesgo para el nervio mediano. Los manguitos de presión arterial automática que funcionen correctamente no aumentan el riesgo de neuropatía de la extremidad superior. P U N TOS CLAVE: P osi ción del paci ente 1. Colocar cuidadosamente al paciente en la posición adecuada es necesario para facilitar la intervención quirúrgica, evitar trastornos fisiológicos y prevenir lesiones. 2. La ceguera postoperatoria está aumentando su frecuencia, pero no se sabe de forma precisa qué pacientes están en riesgo. Aunque no sea una garantía para prevenir esta complicación, durante intervenciones de columna prolongadas en posición prona se deben mantener el volumen intravascular, el hematocrito y la presión de perfusión. 3. La lesión nerviosa postoperatoria más frecuente es la neuropatía cubital. Es la más habitual en hombres mayores de 50 años, tiene una presentación retardada, no se evita invariablemente mediante la protección con almohadillas y su origen es multifactorial. 4. En orden de sensibilidad decreciente, los monitores para la detección de EGV son: ecocardiografía transesofágica y ecografía Doppler > aumento de la fracción teleespiratoria de nitrógeno > disminución del CO2 teleespiratorio > aumento de la presión en la aurícula derecha > fonendoscopio transesofágico. Debe destacarse que de todos estos monitores, solamente el catéter en la aurícula derecha permite tratar un EGV identificado. © Elsevier. Fotocopiar sin autorización es un delito 20. ¿Qué lesiones pueden producirse en el ojo? La lesión más común es la abrasión corneal, pero los pacientes también pueden desarrollar conjuntivitis, lesiones químicas, traumatismos directos, visión borrosa y neuropatía óptica isquémica. Los síntomas varían desde malestar a dolor o ceguera. Las lesiones relativamente menores están causadas por la presión directa sobre el ojo por parte de las mascarillas faciales, paños quirúrgicos, productos químicos que entran en contacto con el ojo y falta de protección ocular. Las posiciones distintas a la supina se asocian con más frecuencia a lesiones oculares. Aunque en el pasado se recomendaba tratar una abrasión corneal mediante parche ocular, parece que esto retrasa la cicatrización; en la actualidad algunos autores recomiendan el empleo de pomada oftálmica con antiinflamatorios no esteroideos. No se recomienda el uso repetido de anestésicos locales o gotas con corticosteroides. 21. Revise las intervenciones asociadas con pérdida de visión postoperatoria. Se ha estimado que la incidencia de ceguera tras una cirugía cardíaca es aproximadamente del 4%. Se cree que los mecanismos son embólicos, trombóticos, oncóticos e isquémicos, y que están relacionados con la propia intervención quirúrgica. Estos pacientes pueden desarrollar una oclusión de la arteria retiniana central o una neuropatía óptica isquémica (NOI). Otras intervenciones quirúrgicas que se han asociado con pérdida de visión postoperatoria (PVPO) son las disecciones cervicales (incluso cuando se produce la ligadura de la vena yugular interna), tiroidectomía, cirugía vascular mayor y craneotomía. Preocupa el aparente aumento de la incidencia de PVPO asociada a la cirugía de columna vertebral en posición prona. 22. ¿Qué factores pueden predisponer a un paciente sometido a cirugía de la co­­ lumna a una pérdida de visión postoperatoria? Los factores causales asociados a la PVPO tras una cirugía de columna no se conocen del todo. Al parecer, la incidencia es de un 0,2%. La ASA ha desarrollado un registro de pérdida visual en un intento por identificar los factores predisponentes y emitir recomendaciones para reducir la incidencia de esta trágica complicación. Se cree que existe un subgrupo de pacientes con un riesgo elevado de sufrir esta complicación, aunque no siempre es posible identificar antes de la cirugía qué pacientes presentan ese riesgo. Estos pacientes pueden 148 Capítulo 20 Posición del paciente tener antecedentes de hipertensión, diabetes mellitus, tabaquismo, otras vasculopatías y obe­­ sidad mórbida. Las cirugías de columna de larga duración (más de 6 horas) con una pérdida de sangre significativa (1 a 2 l o más) son características frecuentes en los pacientes que presentan una PVPO continuada. No parece que se deba a un efecto de la presión sobre el globo ocular ya que muchos de estos pacientes se colocaron con cabezal de Mayfield. Las técnicas anestésicas deliberadamente hipotensoras no parecen ser un factor predisponente, aunque puede argumentarse que una hipotensión continuada en casos de anemia requiere tratamiento. Es interesante destacar que, hoy en día, que se está reduciendo el umbral para la transfusión (a un hematocrito menor), es posible que los casos de cirugía de columna de larga duración no constituyan un grupo en el que sea aceptable una anemia pronunciada. Podría ser que, en los casos de cirugía de columna que requieran estabilización anterior y posterior, fuera aconsejable hacer la intervención en dos tiempos. Si bien la complicación es devastadora, su incidencia sigue siendo baja, y los pacientes en riesgo, los factores que contribuyen a la PVPO y las recomendaciones para su prevención son meramente especulativos. 23. ¿Qué patrones de ceguera se observan? En un 90% de los casos se presenta una NOI, y en los restantes una oclusión de la arteria retiniana central. La NOI posterior es más frecuente que la anterior, y es más probable que la NOI sea bilateral (aproximadamente dos terceras partes de los casos), lo que sugiere diferentes etiologías. No suele producirse una recuperación sustancial de la visión. 24. ¿Cómo afecta la posición de la cabeza a la posición del tubo endotraqueal res­ pecto a la carina? La flexión de la cabeza puede desplazar el tubo endotraqueal hacia la carina; la extensión lo desplaza alejándolo de la carina. Una regla general es que el extremo del tubo endotraqueal sigue la dirección de la punta de la nariz del paciente. El cambio de la posición del tubo probablemente sea más problemático en niños que en adultos. Los aumentos repentinos de la presión de la vía aérea o la desaturación de oxígeno pueden deberse a una intubación bronquial. P á g ina w e b http://www.asahq.org Bibliografía Recomendada 1. ASA Task Force Perioperative Blindness 2006 Practice advisory for perioperative visual loss associated with spine surgery. Anesthesiology 104 1319–1328, 2006. 2. Lee LA, Roth S, Posner KL, et al: The American Society of Anesthesiologists postoperative visual loss registry: analysis of 93 spine surgery cases with postoperative visual loss. Anesthesiology 105:652–659, 2006. James B. Haenel, RRT, y Jeffrey L. Johnson, MD Capítulo 21 Ventilación mecánica en el paciente crítico 1. ¿Por qué puede necesitar un paciente ventilación mecánica? Existen tres situaciones en las que se puede necesitar ventilación mecánica (VM): 1. Estímulo respiratorio inadecuado. 2. Incapacidad para mantener una ventilación alveolar adecuada. 3. Hipoxia. La decisión de instaurar VM debe basarse en la exploración clínica y en la valoración del intercambio gaseoso mediante gasometría arterial. Esta decisión debe ser individualizada, porque los valores de corte arbitrarios para la PO2, PCO2 o pH como indicadores de la insuficiencia respiratoria pueden no ser útiles para todos los pacientes. Los trastornos fisiológicos que requieren VM incluyen principalmente los trastornos parenquimatosos primarios, como neumonía, edema pulmonar o contusión pulmonar, o la enfermedad sistémica que afecta indirectamente a la función pulmonar, como la sepsis o la disfunción del sistema nervioso central (SNC). El principal objetivo de la VM en el contexto de la insuficiencia respiratoria es facilitar el intercambio gaseoso mientras se revierte la enfermedad de base. 2. ¿Cuál es el modo de ventilación más empleado, controlada por volumen o por presión? Desde el punto de vista de la clasificación, no existe un modo de ventilación mejor que otro. Para ser precisos, los modos convencionales de VM controlan el volumen o la presión. El modo de ventilación es una función del tipo de respiración liberada (p. ej., respiración mandatoria y/o espontánea) y de la forma en cómo se determina cada respiración. La VM controlada por volumen proporciona respiraciones cuyo volumen es constante y la presión variable. La VM controlada por presión proporciona respiraciones cuya presión es constante y el volumen variable. Es la respuesta del ventilador a los esfuerzos del paciente la que determina el modo. 3. ¿Cuáles son los modos de ventilación a presión positiva más utilizados? En la actualidad existen nueve modos basados en el uso del volumen o la presión como variable de control: CV-VMC, controlada por volumen-ventilación mandatoria continua. CV-VAC, controlada por volumen-ventilación asistida controlada. CV-IMV o CV-SIMV, controlada por volumen-ventilación mandatoria intermitente o intermitente sincronizada. CP-VMC, controlada por presión-ventilación mandatoria continua. CP-VAC, controlada por presión-ventilación asistida controlada. CP-IMV o CP-SIMV, controlada por presión-ventilación mandatoria intermitente o intermitente sincronizada. PSV, ventilación con soporte de presión. 4. ¿La CP-VMC permite al paciente interactuar con el ventilador? El uso de un término como CP-VMC con frecuencia lleva a confusión a los no iniciados. El término VM controlada implica que el paciente está recibiendo un bloqueante neuromuscular y no puede activar el ventilador. Por tanto, cuando hablamos de VM controlada por volumen o controlada por presión, términos más descriptivos como ventilación determinada por el volumen o ventilación determinada por la presión pueden reducir al mínimo cualquier malentendido. © 2011. Elsevier España, S.L. Reservados todos los derechos 149 150 Capítulo 21 Ventilación mecánica en el paciente crítico 5. ¿Cómo funciona el modo CV-VAC? El modo CV-VAC libera un número mínimo programado de respiraciones mandatorias y también permite que el paciente active (o colabore con) respiraciones adicionales. Cada respiración (mandatoria o asistida) se asocia con una velocidad de flujo programada para liberar un volumen corriente (VT) preestablecido. La CV-VAC puede provocar una alcalosis respiratoria a menudo y puede promover una presión teleespiratoria autopositiva (PEEP) porque el paciente recibe un VT completo en cada respiración, incluso si está taquipneico. 6. ¿En qué se diferencian la CV-VAC y la CV-SIMV? Ambos modos liberan respiraciones mandatorias a una frecuencia programada, y un VT y una velocidad de flujo de gas programados. Entre las respiraciones iniciadas por el respirador en el modo CV-VAC, el paciente puede activar el ventilador y recibir una respiración asistida al VT programado. En el modo CV-SIMV el ventilador crea una ventana temporal sobre la base de la frecuencia programada de las respiraciones mandatorias, y trata de sincronizar la liberación de la respiración con los esfuerzos espontáneos del paciente. En modo SIMV, el paciente tiene libertad para iniciar un esfuerzo totalmente espontáneo entre respiraciones mandatorias y generar un VT compatible con el esfuerzo muscular inspiratorio del paciente. La velocidad del flujo de gas varía durante estas respiraciones espontáneas y se basa en los esfuerzos y demandas del paciente. 7. Cuando se inicia la ventilación mecánica, ¿cómo se decide entre una CV-VAC o una CV-SIMV? Si el propósito de la VM es proporcionar apoyo ventilatorio total, es obligado suministrar un nivel suficiente de ventilación alveolar. La preferencia por una CV-VAC sobre una CV-SIMV, asumiendo que se satisfacen las demandas de ventilación minuto (frecuencia y VT programados), es realmente una cuestión de costumbre o preferencia. Sin embargo, una vez el paciente ha logrado la estabilidad cardiopulmonar y el objetivo ahora es iniciar el apoyo ventilatorio parcial, las opciones entre CV-VAC y CV-SIMV son muy diferentes. Un paciente con una frecuencia respiratoria programada de 4 respiraciones/min en modo CV-VAC con una frecuencia respiratoria total de 18 respiraciones/min sigue recibiendo apoyo ventilatorio total. Por el contrario, en modo CV-SIMV se considera que un paciente con la misma frecuencia programada tiene un apoyo ventilatorio parcial y debe ser capaz de soportar el grueso de sus propias demandas de intercambio gaseoso. 8. ¿Qué otras variables se asocian con los modos convencionales de ventilación mecánica? De forma simplista, los ventiladores se clasifican como controlados por presión, volumen o flujo. Los ventiladores actuales de las unidades de cuidados intensivos pueden combinar el control de presión con el control del flujo, todo en una única respiración. Luego están las variables de fase, sucesos que tiene lugar durante el ciclo ventilatorio. Estas variables de fase controlan la forma de la respiración: Activada (por el paciente o la máquina). Limitada (en presión o volumen). Ciclada desde la inspiración hasta la espiración (por presión, volumen, flujo o tiempo). 9. ¿Qué es la ventilación con soporte de presión? La PSV aumenta el esfuerzo inspiratorio espontáneo de un paciente con un nivel de presión positiva en la vía aérea seleccionado por el clínico. La inspiración se completa cuando el flujo máximo generado de forma espontánea por el paciente disminuye hasta un nivel mínimo o un porcentaje del flujo inspiratorio inicial, típicamente menos del 25%. Por tanto, la PSV es meramente un modo de ventilación activado por el paciente, limitado por presión y ciclado por flujo. La PSV permite que el paciente establezca su propia frecuencia respiratoria (FR), varíe la velocidad máxima del flujo sobre la base de las demandas de respiración a respiración, y aumente el VT liberado. Tomados en conjunto, la FR, el flujo máximo y el VT determinan la relación inspiratoria-espiratoria (I:E). Es mucho más fisiológico y cómodo para el paciente controlar la relación I:E que imponerle una relación I:E fija que no responderá favorablemente al aumento de sus demandas. Capítulo 21 Ventilación mecánica en el paciente crítico 151 10. ¿En qué se diferencia la ventilación controlada por presión de la ventilación con soporte de presión? La ventilación controlada por presión (PCV), a diferencia de la PSV, es un modo de ventilación limitado por presión y ciclado por tiempo. El VT generado es consecuencia del tiempo inspiratorio determinado por el clínico y la presión sobre la vía aérea aplicada que están influidos predominantemente por la resistencia al flujo y la distensibilidad del sistema respiratorio. En términos prácticos, la PCV se utiliza como modo de ventilación cuando es necesario un soporte ventilatorio total, mientras que la PSV es óptima para proporcionar soporte ventilatorio parcial. 11. ¿Cuáles son las variables de activación o trigger? Todos los ventiladores modernos de las unidades de cuidados intensivos miden de forma constante una o más variables de fase (es decir, presión, volumen, flujo o tiempo) (Tabla 21-1). La inspiración se produce cuando una de estas variables alcanza un valor preestablecido. En la clínica esto se denomina activación o trigger del ventilador. Son necesarias las siguientes condiciones para iniciar una respiración bajo cada variable individual: Activación por presión: requiere un esfuerzo iniciado por el paciente para disminuir la presión del circuito por debajo de un valor preestablecido (p. ej., es habitual –2 cmH2O por debajo del valor inicial de la presión teleespiratoria). Activación por flujo o volumen: de nuevo requiere el esfuerzo del paciente para conseguir una caída de la velocidad del flujo o el volumen del gas que está continuamente presente en el circuito. Activación por tiempo: no requiere el esfuerzo del paciente pero se produce cuando se alcanza la FR programada en el ventilador. También se han identificado dos formas de activación potencialmente peligrosas: Autoactivación: se produce cuando el ventilador tiene un ciclado rápido sin aparente esfuerzo por parte del paciente. Si el sistema de activación es muy sensible (p. ej., la presión se programa a –1 cmH2O) y existe un exceso de condensación en el circuito, el movimiento del agua puede causar una disminución en la presión del circuito, provocando un autociclado. Activación ineficaz: se produce cuando el ventilador no reconoce el esfuerzo inspiratorio del paciente. Esto se observa con frecuencia durante la activación por presión en presencia de autoPEEP que puede impedir que el paciente logre la disminución de la presión del circuito necesaria. Ta b l a 2 1 - 1 . T i p o s d e r e s p i r a c i ó n d e l o s m o d o s d e c o n t r o l del ventilador por volumen y presión © Elsevier. Fotocopiar sin autorización es un delito Mandatoria Asistida Modo (nombre habitual) Trigger Límite Ciclo Trigger Límite Ciclo CV-VMC Tiempo Flujo Volumen o tiempo — — — CV-VAC Tiempo Flujo Paciente Flujo CV-SIMV Tiempo Flujo — — Volumen o tiempo — CP-VMC CP-VAC CP-SIMV Tiempo Tiempo Tiempo Presión Presión Presión Volumen o tiempo Volumen o tiempo Tiempo Tiempo Tiempo — Paciente — — Presión — — Tiempo — 152 Capítulo 21 Ventilación mecánica en el paciente crítico 12. ¿Cuáles son los objetivos de la ventilación mecánica en pacientes con insuficiencia respiratoria aguda? La mayoría de pacientes con insuficiencia respiratoria aguda (IRA) necesita apoyo ventilatorio completo. Los objetivos son conservar o mejorar la oxigenación arterial y la ventilación, optimizar los mecanismos pulmonares y promover la comodidad del paciente mientras se evita la lesión pulmonar inducida por el ventilador. Las complicaciones pueden surgir de las presiones alveolares elevadas o de las altas concentraciones de oxígeno inspirado (FiO2). 13. ¿Cuáles son las programaciones iniciales del ventilador en la insuficiencia res­ piratoria aguda? Habitualmente, comienza con el modo VAC, que garantiza la liberación de un volumen programado. Pueden utilizarse los modos ciclados por presión, pero probablemente sólo ofrecen ventajas teóricas. La FiO2 comienza a 1 y se va reduciendo al ritmo que se va tolerando. La FiO2 alta en el contexto de una lesión pulmonar aguda provoca un empeoramiento del cortocircuito intrapulmonar, probablemente como resultado de atelectasias de absorción. El VT se basa en el peso corporal ideal (PCI) y la fisiopatología de la lesión pulmonar. Los VT de 6-10 ml/kg/PCI son aceptables si la presión meseta es <30 cmH2O. Sin embargo, el síndrome de distrés respiratorio agudo (SDRA) disminuye el volumen del pulmón disponible para la ventilación. Puesto que las presiones o volúmenes grandes pueden empeorar la lesión pulmonar subyacente, se eligen volúmenes más bajos, en el rango de 6-8 ml/kg/PCI. La FR se elige, habitualmente, en el rango de 10-20 respiraciones por minuto (rpm). Los pacientes que precisan un volumen minuto alto o con VT bajo (estrategia protectora pulmonar) pueden necesitar una frecuencia de alrededor de 32 rpm. La eliminación de CO2 no mejora significativamente con FR >25/min, y la FR >30 predispone al atrapamiento de gas secundario a tiempos espiratorios abreviados. 14. ¿Qué papel desempeña la presión teleespiratoria positiva? La PEEP ha sido la piedra angular en el tratamiento de la insuficiencia respiratoria durante más de 40 años. Se aplica de forma específica al circuito espiratorio del ventilador mecánico. Los principales objetivos de la PEEP son: Aumentar la capacidad residual funcional al evitar el colapso alveolar y reclutar alvéolos atelectásicos. Disminuir el cortocircuito intrapulmonar. Reducir el trabajo respiratorio. Deben considerarse ajustes en la PEEP en respuesta a períodos de desaturación (después de descartar las causas habituales de hipoxemia, como tapones mucosos y barotrauma) para valorar el potencial de reclutamiento. 15. ¿Cómo se identifica la presión teleespiratoria positiva óptima? Aunque se han sugerido varios métodos para el reclutamiento pulmonar, nosotros utilizamos el siguiente algoritmo para identificar la PEEP óptima: Los pacientes que experimentan una desaturación aguda se colocan en el modo controlado por presión, con la FR programada a 10 respiraciones/min, una relación I:E de 1:1, y una presión máxima de 20 cmH2O. La PEEP se incrementa a 25-40 cmH2O durante 2 minutos. El paciente está monitorizado continuamente para detectar efectos adversos. Luego la PEEP se sitúa en el valor inicial. Si el paciente vuelve a desaturar, se repite el ensayo, pero la PEEP basal se aumenta en 5 cmH2O. Este proceso se continúa hasta que el paciente ya no desatura. Para aumentar la seguridad, antes de aplicar niveles elevados de PEEP se debe realizar la identificación de déficits de líquido intravascular y optimizar el estado hemodinámico. 16. ¿Qué es la presión teleespiratoria intrínseca o autoPEEP? La PEEP intrínseca (PEEPi) es el desarrollo de presión alveolar positiva no detectada al final de la espiración durante la VM. Los pacientes que precisan un volumen minuto elevado o los pacientes con enfermedad pulmonar obstructiva crónica (EPOC) o asma tienen riesgo de PEEPi. En pulmones sanos durante la VM, si la FR es demasiado alta o el tiempo espiratorio demasiado corto, no existe tiempo suficiente para la espiración completa, provocando una sumación de las respiraciones y la generación de una presión positiva en la vía aérea al final de la espiración. Los tubos endotraqueales de diámetro pequeño también pueden limitar la espiración y producir la Capítulo 21 Ventilación mecánica en el paciente crítico 153 PEEPi. Los pacientes con aumento de la resistencia de la vía aérea y disminución de la distensibilidad pulmonar tienen mayor riesgo de PEEPi. Estos pacientes presentan dificultad para espirar el gas debido a la obstrucción o el colapso de las vías aéreas pequeñas, y tienen mayor tendencia a desarrollar PEEPi durante la ventilación espontánea y la VM. La PEEPi tiene los mismos efectos secundarios que la PEEP extrínseca, pero detectarla requiere mayor vigilancia. La incapacidad para reconocer la presencia de una PEEPi puede conducir a cambios inadecuados de ventilador (Figura 21-1). La única manera de detectar y medir la PEEPi es ocluyendo la salida espiratoria al final de la espiración mientras se monitoriza la presión de la vía aérea. Disminuyendo la FR o aumentando el flujo inspiratorio (para aumentar la relación I:E) se puede permitir más tiempo para la espiración completa. La administración de broncodilatadores en caso de broncoespasmo suele ser beneficiosa. © Elsevier. Fotocopiar sin autorización es un delito Figura 21-1. Fallo al apreciar que la autoPEEP puede conducir a un círculo vicioso donde la ventilación minuto (VE), aumentada en respuesta a un aumento de la PaCO2, disminuye el tiempo espiratorio, aumentando el atrapamiento de gas, aumentando la ventilación del espacio muerto (VD/VT) y, paradójicamente, disminuyendo la eliminación de CO2. Un aumento adicional de VE repite otra vez el ciclo, haciendo que la presión pleural aumente y con ello que puedan surgir los efectos adversos de la PEEP (p. ej., disminución del gasto cardíaco). 17. ¿Cuáles son los efectos secundarios de la presión teleespiratoria extrínseca e intrínseca? Puede aparecer barotrauma por la sobredistensión de los alvéolos. El gasto cardíaco puede disminuir debido al aumento de la presión intratorácica, produciendo un aumento en la presión transmural en la aurícula derecha y una disminución en el retorno venoso. La PEEP también aumenta la presión de la arteria pulmonar, disminuyendo potencialmente el gasto del ventrículo derecho. La dilatación del ventrículo derecho puede desplazar el tabique interventricular hacia el ventrículo izquierdo, afectando así al llenado del ventrículo izquierdo y disminuyendo el gasto cardíaco, especialmente si el paciente está hipovolémico. Interpretación incorrecta de las presiones de llenado cardíacas. La presión transmitida desde el alvéolo a los vasos pulmonares puede dar lecturas falsamente elevadas. La sobredistensión de los alvéolos por una PEEP excesiva disminuye el flujo sanguíneo a estas zonas, aumentando el espacio muerto (Vd/VT). El trabajo respiratorio puede aumentar con PEEP porque el paciente necesita generar una presión negativa mayor para activar el flujo desde el ventilador. Aumento de la presión intracraneal (PIC) y retención de líquidos. 154 Capítulo 21 Ventilación mecánica en el paciente crítico 18. ¿Qué es un programa integral de ventilación mecánica? Un programa integral de VM es una serie de intervenciones relacionadas con los cuidados ventilatorios que han mostrado reducir de forma significativa la incidencia de neumonía asociada al ventilador. Los componentes clave de un programa integral de VM son: Elevación de la cabecera de la cama. Descansos en la sedación diarios y revaluación de la posibilidad de extubación. Profilaxis de las úlceras por estrés. Profilaxis de trombosis venosa profunda. Intervenciones adicionales probablemente complementarias a este programa son la implementación de una campaña de higiene de manos y un protocolo de cuidados orales. 19. ¿Qué es la hipoventilación controlada con hipercapnia permisiva? La hipoventilación controlada (o hipercapnia permisiva) es una estrategia que limita la presión o el volumen, protectora del pulmón, en la que se permite que la PCO2 aumente, dando más importancia a proteger el pulmón que a mantener la eucapnia. El VT programado se baja a un valor de 4-6 ml/kg/PCI, aproximadamente, en un intento de mantener la presión máxima por debajo de 35-40 cmH2O y la presión máxima estática inferior a 30 cmH2O. Varios estudios del SDRA y estado asmático han demostrado una disminución del barotrauma, días de ingreso en cuidados intensivos y de la mortalidad con esta técnica. La PCO2 se permite aumentar lentamente hasta valores de 80 a 100 mmHg. El pH disminuye y puede tratarse con tampones cuando es inferior a 7,20. Alternativamente, cabe esperar que el riñón normal retenga bicarbonato en respuesta a la hipercapnia. La hipercapnia permisiva suele tolerarse bien. Los efectos adversos posibles son vasodilatación cerebral, que conduce a aumento de la PIC, y la hipertensión intracraneal es la única contraindicación absoluta a la hipercapnia permisiva. La actividad simpática aumentada, la vasoconstricción pulmonar y las arritmias cardíacas pueden producirse, pero raramente tienen consecuencias. La depresión de la contractilidad cardíaca puede ser un problema en pacientes con disfunción ventricular preexistente. 20. ¿Qué es la distensibilidad? ¿Cómo se determina? La distensibilidad o compliance se expresa como el cambio en el volumen para un cambio dado en la presión. La determinación de la distensibilidad involucra una relación entre la presión, el volumen y la resistencia al flujo de aire. Las dos presiones relevantes que deben monitorizarse durante la VM son la presión máxima y la estática o presión meseta. 21. ¿Cómo se mide la presión máxima? La presión máxima se mide durante la liberación de flujo de aire al final de la inspiración. Está influida por el volumen de insuflación, la resistencia de la vía aérea, y la retracción elástica de los pulmones y de la pared torácica, y refleja la distensibilidad dinámica del sistema respiratorio total. 22. ¿Cómo se mide la presión estática? La presión estática, también llamada meseta, se mide durante la pausa al final de la inspiración, durante una condición de no flujo, y refleja la distensibilidad estática del sistema respiratorio, incluyendo el parénquima pulmonar, la pared torácica y el abdomen. 23. ¿Cómo se calcula la distensibilidad? La distensibilidad dinámica y la estática deberían calcularse. La distensibilidad dinámica se calcula como VT/(presión máxima – PEEP total), y la distensibilidad estática o meseta es VT/(presión meseta – PEEP total). Los valores normales para ambas distensibilidades dinámica y estática son 60-100 ml/cmH2O. Una disminución en la distensibilidad dinámica sin un cambio en la distensibilidad estática sugiere un aumento agudo en la resistencia de la vía aérea, y puede valorarse comparando la presión máxima y la presión meseta. El gradiente normal es, aproximadamente, 10 cmH2O. Un gradiente superior a 10 cmH2O puede ser secundario a una obstrucción del tubo endotraqueal, taponamiento con moco o broncoespasmo. Si el volumen es constante, los cambios agudos tanto en la distensibilidad dinámica como en la estática sugieren una disminución de la distensibilidad del sistema respiratorio, que puede haber sido causada por un empeoramiento de una neumonía, SDRA, atelectasias o aumento en las presiones abdominales. Capítulo 21 Ventilación mecánica en el paciente crítico 155 La distensibilidad es un valor global, y no describe lo que está ocurriendo regionalmente en los pulmones con SDRA, en los que las regiones afectadas están intercaladas con zonas relativamente sanas. Los valores de distensibilidad de 20-40 cmH2O son habituales en el SDRA avanzado. Una distensibilidad pulmonar disminuida refleja la distensibilidad del pulmón que está participando en el intercambio gaseoso, no los alvéolos colapsados o llenos de líquido. 24. ¿Es la ventilación en posición prona una alternativa para pacientes que son difíciles de oxigenar? ¡Por supuesto! Los estudios han demostrado que la PaO2 mejora significativamente en dos terceras partes de los pacientes con SDRA cuando se colocan en prono. Los mecanismos son: Reclutamiento de los campos pulmonares dorsales colapsados por la redistribución del edema pulmonar a las zonas anteriores. Aumento de la movilidad del diafragma potenciando la ventilación. Eliminación de los efectos compresivos del corazón en las zonas pulmonares bajas inferiores, mejorando así la ventilación regional. Mantenimiento de la perfusión pulmonar dorsal en el contexto de una mejor ventilación posterior, lo que conduce a la mejoría del equilibrio V/Q. 25. ¿Cuáles son las indicaciones de la ventilación en prono? Las indicaciones para la ventilación en prono no están claramente establecidas. Se debe iniciar un ensayo en prono en cualquier paciente que esté hipoxémico o que necesite concentraciones de FiO2 altas después de realizar maniobras de reclutamiento/PEEP. El mejor predictor de un resultado favorable durante la ventilación en prono puede ser una disminución en la PaCO2, aunque la oxigenación no mejore. 26. ¿Cómo debe abordarse al paciente que lucha con el ventilador? Inicialmente, las posibles causas se dividen en problemas del ventilador (aparato, circuito y tubo de la vía aérea) y problemas relacionados con el paciente. Las causas asociadas con el paciente son hipoxemia, secreciones o tapones mucosos, neumotórax, broncoespasmo, infección (neumonía o sepsis), embolia pulmonar, isquemia miocárdica, sangrado gastrointestinal, empeoramiento de PEEPi o ansiedad. Las causas relacionadas con el ventilador son la fuga del circuito o la desconexión; el soporte ventilatorio o FiO2 liberada insuficientes; los problemas relacionados con la vía aérea, como extubación, tubo endotraqueal obstruido, herniación del manguito o rotura del mismo, y flujos o sensibilidad de disparo inadecuados. Hasta que el problema se solucione, el paciente debería ventilarse manualmente con oxígeno al 100%. La auscultación respiratoria y las constantes vitales deben comprobarse inmediatamente. La gasometría arterial y la radiografía de tórax portátil tienen valor, pero si se sospecha un neumotórax a tensión la descompresión inmediata debe preceder a la radiografía de tórax. © Elsevier. Fotocopiar sin autorización es un delito P U N T OS CLAVE: Ventilación mecá nica en el pac iente crítico 1. Hay tres indicaciones para la VM: estímulo inspiratorio inadecuado, incapacidad para mantener la ventilación alveolar e hipoxia. 2. Hay dos indicaciones para la ventilación con presión positiva no invasiva: insuficiencia respiratoria hipercápnica y comodidad en pacientes terminales. 3. Factores de riesgo para autoPEEP: ventilación minuto alta, tubo endotraqueal pequeño, EPOC y asma. 4. El gradiente de la vía aérea normal entre la presión máxima y la presión estática es aproximadamente de 10 cmH2O. 5. El primer paso en el cuidado del paciente hipóxico que lucha contra el ventilador es ventilarlo manualmente con oxígeno al 100%. 156 Capítulo 21 Ventilación mecánica en el paciente crítico 27. ¿Deberían utilizarse relajantes musculares para facilitar la ventilación mecánica? Los relajantes musculares (RM) se emplean habitualmente para facilitar la VM durante el SDRA, pero a pesar de su aceptación general existen pocos datos, y no hay un consenso establecido sobre cuándo estos agentes deberían emplearse. Gainnier et al, en el año 2004, fueron los primeros en comunicar los efectos de una infusión de RM durante 48 horas sobre el intercambio gaseoso en pacientes con SDRA en fases iniciales. Todos los pacientes se ventilaron según el protocolo de ARDSNet. Se consiguieron mejorías significativas en la oxigenación y en la posibilidad de reducir la PEEP en el grupo que recibió RM, y se mantuvieron durante un período de infusión de 48 horas. Aunque sigue sin aclararse por qué la relajación muscular mejora la oxigenación, se piensa que los RM disminuyen el consumo de oxígeno, promueven el acoplamiento pacienteventilador y aumentan la distensibilidad de la pared torácica. La relajación muscular también puede ser beneficiosa en situaciones específicas, como la hipertensión intracraneal o los modos no convencionales de ventilación (p. ej., relación I:E invertida o técnicas extracorpóreas). Son desventajas del uso de estos fármacos la imposibilidad de exploración neurológica, la abolición de la tos, paciente despierto pero paralizado, numerosas interacciones farmacológicas y electrolíticas, posible parálisis prolongada y muerte asociada con desconexiones inadvertidas del ventilador. El empleo de RM no debe tomarse a la ligera. Se debería intentar primero una sedación adecuada; si es absolutamente necesario, el uso de RM debería limitarse a 24-48 horas, para evitar posibles complicaciones. 28. ¿Es útil alguna vez la ventilación a pulmones separados? La ventilación de los pulmones separadamente se refiere a la ventilación de cada pulmón independientemente, por lo general a través de un tubo endotraqueal de doble luz y dos ventiladores. Los pacientes con enfermedad pulmonar unilateral grave pueden ser candidatos a la ventilación a pulmones separados. Ésta ha demostrado mejorar la oxigenación en pacientes con neumonía unilateral, edema pulmonar y contusión. El aislamiento de los pulmones puede salvar la vida de pacientes con hemoptisis grave o absceso pulmonar mediante la protección del pulmón sano ante un posible paso de líquido al otro pulmón. Los pacientes con fístula broncopleural también pueden beneficiarse de la ventilación de los pulmones separadamente. Los diferentes modos de ventilación pueden aplicarse a cada pulmón individualmente. Los dos ventiladores no tienen que estar sincronizados y, de hecho, la estabilidad hemodinámica se mantiene mejor empleando los dos ventiladores de forma asincrónica. P á g ina w e b Institute for Healthcare Improvement: Implement the ventilator bundle www.IHI.org Bibliografía Recomendada 1. Alsaghir AH, Martin CM: Effects of prone positioning in patients with acute respiratory distress syndrome: a meta-analysis. Crit Care Med 36:603–609, 2008. 2. Fessler HE, Hess DR: Does high-frequency ventilation offer benefits over conventional ventilation in adult patients with acute respiratory distress syndrome? Respir Care 52:595–608, 2007. 3. Kallet RH, Branson RD: Do the NIH ARDS Clinical Trials Network PEEP/FIO2 tables provide the best evidencebased guide to balancing PEEP and FIO2 settings in adults? Respir Care 52:461–477, 2007. 4. MacIntyre NR: Is there a best way to set tidal volume for mechanical ventilatory support? Clin Chest Med 29:225–231, 2008. 5. Nichols D, Haranath S: Pressure control ventilation. Crit Care Clin 23:183–199, 2007. 6. Steinburg KP, Kacmarek RM: Should tidal volume be 6 mL/kg predicted body weight in virtually all patients with acute respiratory failure? Respir Care 52:556–567, 2007. Electrocardiografía William A. Baker, MD, y Christopher M. Lowery, MD Capítulo 22 IV. MONITORIZACIÓN DEL PACIENTE Y PROCEDIMIENTOS 1. ¿Todos los electrocardiogramas anormales indican enfermedad cardíaca? No. Así como unos individuos son muy altos, algunos otros sin patología cardíaca real presentan hallazgos en el electrocardiograma (ECG) que se desvían lo suficiente de la media de la población como para preguntarse si hay enfermedad cardíaca. Como siempre, una anamnesis y exploración física completas pueden ser útiles. Las técnicas no invasivas, como la ecocardiografía y la resonancia magnética (RM) cardíaca, pueden ayudar a diferenciar a pacientes con verdaderas enfermedades estructurales cardíacas de aquellos con variaciones inusuales que son anormales sólo en sentido estadístico. Otros hallazgos, como el bloqueo de rama derecha, se encuentran presentes en pacientes con enfermedad cardíaca, pero también pueden observarse con frecuencia en aquellos que no tienen evidencia de enfermedad cardíaca por la historia clínica, la exploración física o el ecocardiograma. 2. ¿Cuál es el diagnóstico diferencial del bajo voltaje? Se incluyen en el diagnóstico diferencial la enfermedad pulmonar obstructiva crónica, el hipotiroidismo, el derrame pericárdico, la anasarca, la amiloidosis, la miocardiopatía isquémica y la obesidad. 3. ¿Es sensible o no el electrocardiograma para la detección de crecimiento e hiper­ trofia de cavidades cardíacas? No es sensible. Cuando se usa la ecocardiografía o la autopsia como patrón de diagnóstico, el ECG no llega a detectar a muchos pacientes con hipertrofia o crecimiento real de las cavidades cardíacas. Esto es particularmente cierto en pacientes que tienen grados menos importantes de estos hallazgos (aunque sean, sin embargo, potencialmente significativos). Aunque es útil por su bajo coste y fácil aplicación, la electrocardiografía tiene claras limitaciones. 4. ¿Qué claves sugieren que un paciente tiene hipertrofia ventricular izquierda? Un alto voltaje en el QRS es la característica clásica de la hipertrofia ventricular izquierda (HVI), aunque muchos pacientes jóvenes tienen alto voltaje en el QRS sin una HVI real. Otras pistas asociadas (aunque no son específicas) son la desviación izquierda del eje cardíaco, crecimiento auricular izquierdo, ensanchamiento del QRS y signos de «sobrecarga» (anomalías asociadas del ST-T). Los pacientes con bloqueo completo la rama izquierda (BCRI) no se pueden diagnosticar de HVI con un ECG, pero es importante recordar que muchos pacientes con BCRI en realidad tienen HVI por ecocardiografía. Existen varios sistemas de puntuación para decidir si un paciente reúne los criterios del ECG para HVI, y todos ellos son insensibles. 5. Un adulto tienen una onda R grande en V1. ¿Cuál es el diagnóstico diferencial? Hipertrofia ventricular derecha (buscar una desviación del eje a la derecha asociada, crecimiento auricular derecho y «sobrecarga» del ventrículo derecho con anomalías del ST-T). Infarto miocárdico posterior. Síndrome de Wolff-Parkinson-White (WPW). Distrofia muscular. Transición normal precoz. © 2011. Elsevier España, S.L. Reservados todos los derechos 157 158 Capítulo 22 Electrocardiografía 6. ¿Qué derivaciones son las más útiles para buscar un bloqueo de rama? V1, V6, I y, hasta cierto punto, II. La duración del QRS debe ser de más de 120 milisegundos para identificar un bloqueo de rama. No todos los QRS anchos son bloqueos de rama; el diagnóstico diferencial también incluye el latido ventricular, el retraso de la conducción intraventricular, la hiperpotasemia, efectos de los fármacos y el WPW con conducción a través de una vía accesoria. 7. ¿Cuáles son las características de un bloqueo completo de rama derecha? Los pacientes con bloqueo completo de rama derecha (BCRD) tienen, clásicamente, un patrón de rSR’ en V1 y una onda S terminal amplia en I y V6 (Figura 22-1). Figura 22-1. Apariencia típica de un bloqueo completo de rama derecha en V1, con rSR’. 8. ¿Qué es un retraso de la conducción intraventricular? ¿Cuándo se observa? Un retraso de la conducción intraventricular (RCIV) es un QRS ancho que viene de una conducción supraventricular que no es ni un BCRD ni un BCRI clásicos. Se encuentra a menudo en pacientes con miocardiopatía. 9. ¿Cuáles son las características de un bloqueo completo de rama izquierda? En V1, hay una onda S (o una onda QS) profunda y amplia, con una elevación del segmento ST, que puede estar precedida por una onda R muy estrecha (Figura 22-2). En la derivación I hay una onda R ancha (a veces, mellada) sin onda Q ni onda S. 10. ¿Qué es un hemibloqueo? La rama izquierda se bifurca en dos fascículos (anterior y posterior), y cualquiera de los dos puede bloquearse. En un hemibloqueo, la duración del QRS es, generalmente, menor de 120 milisegundos, a menos que haya un BCRD asociado (comúnmente llamado bloqueo bifascicular). Figura 22-2. Apariencia típica de un bloqueo completo de rama izquierda en V1. En algunos casos, una onda R estrecha precede a una gran onda S monomórfica. Capítulo 22 Electrocardiografía 159 11. Usted está intentando pasar un catéter de Swan-Ganz por la arteria pulmonar en un paciente con bloqueo completo de rama izquierda. Cuando el trazado hemodinámi­ co sugiere que la punta del catéter se encuentra en el ventrículo derecho, el paciente se vuelve bradicárdico, con una frecuencia cardíaca de 25. ¿Qué ha pasado? El paciente se encuentra en bloqueo cardíaco completo como resultado de un BCRD inducido por el catéter (conjuntamente con un BCRI preexistente). Afortunadamente, la lesión a la rama derecha es a menudo breve, pero puede requerir un marcapasos temporal. Para los pacientes con BCRI, considere cuidadosamente la indicación de un catéter en la arteria pulmonar antes de proceder a implantarlo. Adicionalmente, debe disponer de un equipo de marcapasos de emergencia, para responder de manera adecuada si se produce esta complicación. La afectación transitoria de la rama derecha puede aparecer hasta en el 5-10% de casos. © Elsevier. Fotocopiar sin autorización es un delito 12. ¿Excluye un electrocardiograma normal la posibilidad de arteriopatía coronaria grave? No, aunque un ECG realizado durante el dolor torácico isquémico es usualmente anormal. Es frecuente que los pacientes con arteriopatía coronaria grave tengan un ECG con sólo alteraciones inespecíficas. Como ejemplo de hallazgos en el ECG de un paciente con angina de esfuerzo, véase la Figura 22-3. Figura 22-3. Este ECG de 12 derivaciones muestra inversiones de onda T profundas relativamente simétricas, que cumplen los criterios de isquemia. La insuficiencia coronaria suele ser la causa más frecuente y potencialmente mortal de este patrón. No es infrecuente que pacientes con dolor torácico en reposo debido a una insuficiencia coronaria (un síndrome coronario agudo) presenten un ECG como éste. También podrían mostrar una depresión del segmento ST, alteraciones inespecíficas ST-T o incluso un ECG normal. Si bien las inversiones simétricas y profundas de la onda T generalmente deberían conducir a una evaluación clínica de una arteriopatía coronaria, deben considerarse otras causas como embolia pulmonar, patología aguda del sistema nervioso central (clásicamente una hemorragia subaracnoidea), miocardiopatía, repolarización alterada por una hipertrofia ventricular o desequilibrios electrolíticos importantes. Este paciente era una mujer de 42 años con antecedentes de tabaquismo que presentó una angina progresiva producida al mínimo esfuerzo. El cateterismo mostró una patología coronaria de varios vasos y fue sometida a una cirugía de revascularización coronaria. 13. ¿Cómo se subdividen los pacientes con infarto de miocardio basándose en los cambios del electrocardiograma durante el infarto. Los infartos de miocardio (IM) a menudo se dividen en dos tipos: IM con elevación del segmento ST e IM sin elevación del segmento ST. Los pacientes con elevación del segmento ST deben considerarse para angioplastia primaria inmediata, o terapia trombolítica si la angioplastia no se encuentra disponible. Las ondas Q a menudo aparecen con el paso del tiempo en las derivaciones donde se encuentra la elevación. Las ondas Q pueden disminuir de tamaño o desaparecer a medida que pasa el tiempo. Los pacientes con IM agudo sin elevación del segmento ST a menudo presentan depresión del ST (que puede ser dinámica) y/o inversión de la onda T. Los pacientes con IM sin elevación 160 Capítulo 22 Electrocardiografía del segmento ST se pueden manejar usualmente con tratamiento médico, y el cateterismo cardíaco se realiza varios días después. Sin embargo, la persistencia de los síntomas y los cambios del ECG que no responden al tratamiento médico pueden indicar una evaluación invasiva urgente. Para un ejemplo de los cambios del ECG asociados a un IM sin elevación del segmento ST, véanse las Figuras 22-4 y 22-5. Figuras 22-4 y 22-5. Estos ECG son del mismo paciente, un hombre vigoroso de 78 años con dolor torácico de aparición reciente que se inició tras un ejercicio moderado. La Figura 22-4 se obtuvo mientras el paciente estaba en el servicio de urgencias con dolor torácico persistente. El principal hallazgo es la depresión significativa del segmento ST de las derivaciones precordiales anterolaterales. El dolor torácico y los cambios en el segmento ST se resolvieron en los 30 minutos siguientes (véase la Figura 22-5). Los niveles séricos de troponina I estaban ligeramente elevados. Dado que el dolor estuvo provocado por el mínimo ejercicio, con alteraciones ECG significativas y niveles alterados de troponina I, se realizó una angiografía coronaria en lugar de una prueba de esfuerzo. Se detectó una enfermedad coronaria de la arteria coronaria izquierda afectando a varios vasos, y el paciente fue sometido con éxito a una cirugía de revascularización coronaria. En este ejemplo, la sospecha de coronariopatía fue muy sólida, sobre la base de los cambios ECG y los síntomas clínicos. Sin embargo, grados más moderados de depresión del segmento ST son menos específicos de insuficiencia coronaria, en particular cuando las diferencias son sutiles y existe otra posible (desequilibrio electrolítico, efecto de la digoxina o alteraciones de la repolarización en una hipertrofia de ventrículo izquierdo). Capítulo 22 Electrocardiografía 161 14. La elevación del segmento ST, ¿siempre indica infarto de miocardio? No. Otras causas de elevación del segmento ST se encuentran en la Tabla 22-1. Ta b l a 2 2 - 1 . C a u s a s d e e l e va c i ó n d e l s e g m e n t o ST Lesión subepicárdica aguda (p. ej., infarto agudo de miocardio con elevación del segmento ST) Patrón de repolarización precoz Pericarditis Hiperpotasemia Hipercalcemia Hipertrofia ventricular izquierda Bloqueo de rama izquierda Síndrome de Brugada Variante normal © Elsevier. Fotocopiar sin autorización es un delito 15. En los pacientes con infarto de miocardio con elevación del segmento ST, ¿cómo se localiza el infarto? Los pacientes con IM inferior generalmente tienen elevación del ST en II, III y aVF. Los pacientes con IM lateral tienen elevación del ST en I, aVL, V5 y V6. Los pacientes con IM anterolateral tienen elevación de ST en I, aVL y V3-V6. Los pacientes con IM septal tienen elevación del ST en V1-V2. Los pacientes con IM anteroseptal tienen una elevación del segmento ST en V1-V4. Los pacientes con IM anterior tienen elevación del segmento ST en V3-V4. Para un ejemplo de IM con elevación del segmento ST, véase la Figura 22-6. Figura 22-6. Este ECG de 12 derivaciones se obtuvo de una mujer de 60 años con dolor torácico. Se observa una elevación masiva del segmento ST (lesión subepicárdica) acompañada de ondas Q en V1-3 y depresión del segmento ST inferior recíproca en este florido ejemplo de IM con elevación del segmento ST anterior, o STEMI. La elevación destacada en forma rectangular del segmento ST se denomina en ocasiones lápida. El vaso infartado fue la arteria coronaria descendente anterior izquierda. Los pacientes con STEMI deberían recibir alguna forma de tratamiento de reperfusión urgente (intervención coronaria percutánea, si se dispone fácilmente, o tratamiento trombolítico cuando no está contraindicado). 162 Capítulo 22 Electrocardiografía 16. Un paciente tiene signos de un infarto de miocardio agudo inferior en el elec­ trocardiograma. ¿Qué hallazgos asociados debe buscar? Signos de compromiso del ventrículo derecho. Como V1 es realmente una derivación del lado derecho, una elevación del ST en V1 acompañada de un IM inferior sugiere compromiso ventricular derecho. De manera alternativa, puede revisar las derivaciones precordiales derechas. La elevación del ST de 1 mm o más en V4 o V5 derechas indican un infarto del ventrículo derecho. Signos de compromiso de la pared lateral, usualmente sugeridos por la elevación del ST en V5-V6. Signos de compromiso de la pared posterior, sugeridos por la presencia de una onda R en V1 amplia y alta, particularmente en comparación con ECG previos. Los pacientes con IM posterior a menudo tienen depresión del ST en V1-V2. Signos de bradicardia debidos a bloqueo nodal sinoauricular (SA) o auriculoventricular (AV). Los pacientes con IM inferior pueden requerir atropina y/o marcapasos temporal (Figura 22-7). Figura 22-7. Derivaciones de las extremidades de un paciente con IM inferior y bloqueo cardíaco completo (véase el Capítulo 30). El paciente tiene una elevación del ST en II, III y aVF junto a una depresión en I y aVL (cambio recíproco). Se identifica el bloqueo cardíaco completo por una disociación AV con una frecuencia auricular (aproximadamente, 110/min) mayor que la frecuencia ventricular (aproximadamente, 40/min) con un intervalo regular RR. 17. ¿Qué es el cambio recíproco? ¿Por qué es importante? El cambio recíproco es la depresión del segmento ST que se observa en pacientes con un IM con elevación del ST. Por ejemplo, un paciente con IM inferior puede tener una elevación en II, III y aVF, con depresión del ST (cambio recíproco) en I y aVL. No todos los pacientes con IM con elevación del segmento ST tienen un cambio recíproco, pero cuando éste se observa generalmente confirma el diagnóstico de IM agudo (véase la Figura 22-7). 18. ¿Qué cambios del electrocardiograma sugieren hipotiroidismo? El voltaje es bajo, la frecuencia cardíaca es baja y el intervalo QT puede estar prolongado. Puede haber anomalías asociadas de la onda T y bloqueo AV. Capítulo 22 Electrocardiografía 163 19. Un paciente anciano se presenta con fatiga, confusión y fibrilación auricular con respuesta ventricular lenta (frecuencia cardíaca = 40). El electrocardiograma mues­ tra depresión del ST con concavidad hacia arriba. La familia cuenta que el paciente toma una medicación desconocida que se encuentra bajo llave en su apartamento. ¿Qué prueba de laboratorio debe pedir para confirmar sus sospechas? Niveles séricos de digoxina. 20. Un electrocardiograma tomado en el momento en que la enfermera del qui­ rófano se encuentra lavando el tórax del paciente, demuestra actividad de complejos anchos. El paciente está asintomático. ¿Qué debe sospechar? ¿Cómo puede probar que tiene razón analizando el trazado del electrocar­ diograma? Los artefactos son comunes en este contexto, y en otras situaciones en las que hay actividades de frotamiento, como cepillarse los dientes. Con los artefactos, la frecuencia cardíaca es generalmente la misma antes e inmediatamente después de la señal de complejos anchos. Con filtros se pueden ver complejos QRS que atraviesan el artefacto en la línea de frecuencia cardíaca basal. Si se encuentra disponible de manera simultánea la pulsioximetría de onda, es posible confirmar que la frecuencia cardíaca es relativamente constante durante la «arritmia». © Elsevier. Fotocopiar sin autorización es un delito 21. ¿Qué hallazgos del electrocardiograma sugieren hiperpotasemia? El ensanchamiento del QRS y/u ondas T picudas (Figura 22-8). En los peores casos, el ECG parece una onda sinusoide. Figura 22-8. Este ECG se obtuvo de un paciente con hiperpotasemia (9,2 mmol/l). Obsérvense la forma de pico de las ondas T, el ensanchamiento del complejo QRS y la disminución de la amplitud de la onda P. 22. ¿Qué hallazgos del electrocardiograma sugieren hipopotasemia? Las ondas U (que aparecen después de la onda T) son prominentes y pueden aparecer con la onda T, creando una onda T amplia y un intervalo QT prolongado. Adicionalmente, la onda P puede estar amplificada y puede haber depresión del ST (Figura 22-9 y 22-10). 23. ¿Qué hallazgos del electrocardiograma sugieren hipocalcemia? El intervalo QT se encuentra prolongado sin ensanchamiento de la onda T (a diferencia de la situación de la hipopotasemia). La onda T parece ser alejada del complejo QRS. Véase la Figura 22-11. 164 Capítulo 22 Electrocardiografía Figura 22-9. Este ECG se obtuvo de un paciente con hipopotasemia (2,1 mmol/l). Las alteraciones de la onda ST-T en las derivaciones anteriores podían hacer sospechar una isquemia miocárdica, pero mejoraron de forma sustancial con la reposición de potasio. Figura 22-10. Este ECG se obtuvo de un paciente con hipopotasemia (3,2 mmol/l). Obsérvese la destacada onda U tras la onda T en las derivaciones precordiales V2-6. Con la hipopotasemia a menudo se produce la fusión TU, lo que crea una onda T ancha y un aumento en la medición del intervalo QT. La hipopotasemia puede provocar una taquicardia ventricular polimórfica. Capítulo 22 Electrocardiografía 165 Figura 22-11. Este ECG se obtuvo de un hombre de 34 años con seudohipoparatiroidismo y miocardiopatía dilatada. El calcio sérico era de 5,9 mg/dl, con un calcio ionizado de 0,74 mmol/l. El intervalo QT se midió a 484 ms, con QTc 586. El intervalo QT se aleja del complejo QRS, fusionándose con la onda P en algunas derivaciones. Esta miocardiopatía dilatada del paciente se resolvió gradualmente tras el tratamiento con calcio. © Elsevier. Fotocopiar sin autorización es un delito 24. ¿Qué cambios del electrocardiograma sugieren hipercalcemia? El acortamiento del intervalo QT, con o sin elevación del segmento ST (Figura 22-12). Figura 22-12. Este ECG se obtuvo de un paciente con hipercalcemia (calcio sérico: 12,5 mg/dl). El complejo SfT-T está elevado y el QT acortado. La hipercalcemia puede ser consecuencia de neoplasias malignas (especialmente con metástasis ósea), hiperparatiroidismo, sarcoidosis u otros procesos. 166 Capítulo 22 Electrocardiografía P UNTOS CLAVE: E lectrocardiograf ía Diagnóstico diferencial de una onda R grande en V1: 1. Hipertrofia ventricular derecha. 2. Infarto de miocardio de la pared posterior. 3. Variante normal (transición precoz). 4. Síndrome de WPW. 5. Distrofia muscular. 25. ¿Cuáles son algunas de las causas habituales de un intervalo QT prolongado? Alteraciones electrolíticas, especialmente hipopotasemia, hipocalcemia e hipomagnesemia pueden contribuir a la prolongación del intervalo QT. Muchos fármacos pueden contribuir a la prolongación del intervalo QT, y algunas categorías son más destacadas que otras. Los fármacos psicoactivos, en particular las fenotiazinas, los antidepresivos tricíclicos, la metadona y las butirofenonas pueden prolongar el intervalo QT. Muchos fármacos antiarrítmicos (especialmente el sotalol, la amiodarona, y los antiarrítmicos de clase Ia como la procainamida) prolongan el intervalo QT. En otros casos la administración de fármacos (cimetidina, verapamilo, ketoconazol, eritromicina) o la cirrosis pueden interferir en el metabolismo hepático de los fármacos que prolongan el intervalo QT. Cardiopatías estructurales consecuencia de una miocardiopatía o una isquemia miocárdica pueden prolongar el intervalo QT. Los pacientes con bradicardia o prolongación del intervalo QRS (p. ej., a causa de un bloqueo de rama) pueden presentar una prolongación del intervalo QT. Enfermedades sistémicas como el hipotiroidismo pueden provocar una prolongación del intervalo QT. Algunos pacientes tienen una predisposición hereditaria a la prolongación del intervalo QT (un síndrome congénito de QT prolongado debido a la presencia de canales iónicos alterados), que puede ser más evidente durante el embarazo. Muchos pacientes tienen una prolongación del intervalo QT debido a una combinación de los factores mencionados. Por ejemplo, un paciente con un síndrome congénito de QT prolongado puede tener una prolongación más acentuada al añadir un nuevo fármaco o por una alteración electrolítica. En algunos casos, estos procesos multifactoriales pueden provocar arritmias ventriculares potencialmente mortales como las torsades de pointes (véase el Capítulo 30). 26. Un paciente tiene un bloqueo completo de rama derecha que no existía en el electrocardiograma de hace 2 años. ¿Cómo debo proceder? Aunque un BCRD puede estar causado por una arteriopatía coronaria (p. ej., con un infarto anterior importante que haya destruido algunos de los sistemas de conducción en el septo interventricular), esto solamente es cierto en una minoría de pacientes con BCRD. Estos pacientes presentan típicamente una qR en V1 en lugar de una rSR’ debido a que se ha perdido la onda r inicial como consecuencia del IM. Ocasionalmente un BCRD puede estar causado por cardiopatías congénitas (como tetralogía de Fallot), cirugía cardíaca previa, miocardiopatía o hipertensión pulmonar. La anamnesis y la exploración física pueden suplementar el ECG en estos casos, y, si se observan signos clínicos de cardiopatía estructural, la ecocardiografía puede ser útil. En una minoría de los casos, el BCRD puede producirse en pacientes con enfermedades importantes del sistema de conducción. Por ejemplo, algunos pacientes con hemibloqueo concomitante, bloqueo AV de primer grado y BCRD pueden tener riesgo de bloqueo cardíaco completo. Sin embargo, en ausencia de síntomas de bloqueo cardíaco completo (p. ej., síncope o casi síncope) o algunos signos en el ECG de bloqueo AV de grado alto, no está indicado un marcapasos profiláctico. Capítulo 22 Electrocardiografía 167 Los pacientes que han tenido (en momentos diferentes) tanto un BCRD como un BCRI tienen un riesgo importante de bloqueo cardíaco completo; generalmente está indicada la colocación de un marcapasos permanente. En la mayoría de los pacientes con BCRD el pronóstico es excelente, y la probabilidad de cardiopatía subyacente grave es baja. Si la anamnesis y la exploración física no revelan ningún indicio de enfermedad cardíaca, no es necesario realizar posteriores estudios o visitas. 27. Un paciente tiene un bloqueo completo de rama izquierda que no existía en el electrocardiograma de hace 2 años. ¿Cómo debo proceder? En un paciente con signos y síntomas de isquemia miocárdica aguda (p. ej., dolor torácico, insuficiencia cardíaca congestiva [ICC] nueva, inestabilidad hemodinámica), un BCRI nuevo puede ser signo de un IM agudo anterior importante. Sin embargo, en la amplia mayoría de los casos, un nuevo BCRI no está causado por un IM agudo. En ocasiones un ECG de 12 derivaciones puede indicar la superposición de una lesión subepicárdica en casos de IM agudo, pero el diagnóstico es más difícil que el diagnóstico de un IM con elevación del segmento ST sin bloqueo de rama. Incluso en ausencia de un IM agudo, un BCRI puede indicar una cardiopatía estructural subyacente como miocardiopatía dilatada o hipertrofia ventricular izquierda. Es importante realizar una buena anamnesis y una exploración física en busca de signos y síntomas de angina, insuficiencia cardíaca, síncope, hipertensión y valvulopatía. En situaciones electivas, la ecocardiografía es una herramienta razonable para detectar cardiopatías estructurales. Algunos clínicos obtienen imágenes de esfuerzo (como una gammagrafía de perfusión nuclear con adenosina o persantín) para descartar una cardiopatía isquémica crónica como causa del BCRI. En general un BCRI tiene un pronóstico menos favorable que un BCRD, incluso en ausencia de alteraciones en la anamnesis, la exploración física y las pruebas no invasivas. Sin embargo, el momento y la necesidad de una prueba no invasiva dependen de la situación clínica del paciente y de la urgencia de la cirugía. En casos de una indicación quirúrgica urgente en un paciente sin otros signos y síntomas de ICC o isquemia miocárdica aguda, es razonable proceder con la cirugía. P á gina w eb ECG Library http://www.ecglibrary.com/ecghome.html BIBLIOGRAFÍA RECOMENDADA 1. Bowbrick S, Borg AN: ECG complete, New York: Churchill Livingstone 2006. © Elsevier. Fotocopiar sin autorización es un delito 2. Ellis KM: EKG Plain and simple, ed 2, Prentice Hall, Upper Saddle River, New Jersey, USA 2007. 3. Kilgfield P, Lauer MS: Exercise electrocardiogram resting: beyond the ST segment. Circulation 114:2070–2082, 2006. 4. Lanza GA: The clectrocardiogram as a prognostic tool for predicting major cardiac events. Prog Cardiovasc Dis 50:87–111, 2007. 5. Nelson WP, Marriott HJL, Schocken DD: Concepts and cautions in electrocardiography, ed 1, MedInfo, Northglenn, Colorado, USA, 2007. 6. Roden DM: Drug-induced prolongation of the QT interva. N Engl J Med 350:1013–1022, 2004. 7. Sgarbossa EB, Pinski SL, Barbagelata A, et al: Electrocardiographic diagnosis of evolving acute myocardial infarction in the presence of left bundle-branch block. N Engl J Med 334:481–487, 1996. 8. Surawicz B, Kailans TK: Chou’s electrocardiography in clinical practice: adult and pediatric, ed 6, Philadelphia, Saunders, 2008. 9. Wagner GS: Marriott’s practical electrocardiography, ed 11, Philadelphia, Lippincott, Williams & Wilkins, 2007. 10. Wang K, Asinger RW, Marriott HJL: ST-segment elevation in conditions other than acute myocardial infarction. N Engl J Med 349:2128–2135, 2003. Capítulo 23 Pulsioximetría Lyle E. Kirson, DDS, y Renee Koltes-Edwards, MD 1. ¿Qué es la pulsioximetría? La pulsioximetría es un método no invasivo mediante el cual se puede evaluar la oxigenación arterial. Está basada en la ley de Beer-Lambert y el análisis espectrofotométrico. Cuando se aplica a la pulsioximetría, la ley de Beer-Lambert afirma que la intensidad de la luz transmitida que atraviesa un lecho vascular disminuye de forma exponencial en función de la concentración de la sustancia absorbente en ese lecho vascular y de la distancia desde la fuente de luz hasta el detector. 2. ¿Qué importancia tiene la pulsioximetría? Los monitores fisiológicos proporcionan al anestesiólogo información que debe integrar en el cuadro clínico global. Todo anestesiólogo debería conocer los límites de los diferentes monitores fisiológicos, y todos los monitores que se utilizan en el quirófano, en las condiciones adecuadas, pueden dar lecturas falsas. Los pulsioxímetros no son una excepción, y el clínico debe tener claro cuándo las lecturas son erróneas. 3. ¿Qué es la pulsioximetría de transmisión y la pulsioximetría de reflexión? Como su nombre indica, en la pulsioximetría de transmisión los diodos emisores de luz (LED) transmiten luz a través de un lecho vascular a un fotodetector. En la pulsioximetría de reflexión los LED transmiten la luz reflejada a un fotodetector en el mismo lado del lecho vascular que los LED. La pulsioximetría de transmisión es la forma más habitual de pulsioximetría utilizada en el quirófano, aunque la pulsioximetría de reflexión se está popularizando debido a su mayor exactitud y facilidad de colocación sobre varios lechos vasculares. Este capítulo se centra en la pulsioximetría de transmisión, a no ser que se indique lo contrario. 4. ¿Cómo funciona un pulsioxímetro? Se coloca un sensor a cada lado de un lecho vascular pulsátil, como la yema del dedo o el lóbulo de la oreja. Los LED de un lado del sensor envían dos longitudes de onda de luz: una roja (600 a 750 nm) y una infrarroja (850 a 1.000 nm). La mayoría de los pulsioxímetros utilizan longitudes de onda de 660 nm (roja) y 940 nm (infrarroja). Las dos longitudes de onda de luz atraviesan el lecho vascular hasta el otro lado del sensor, donde un fotodetector mide la cantidad de luz roja e infrarroja recibida. 5. ¿Cómo se determina la saturación de oxígeno a partir de la cantidad de luz roja e infrarroja recibida y absorbida? Una determinada cantidad de luz roja e infrarroja es absorbida por los tejidos (como la sangre) que están situados entre los emisores y el detector. Por lo tanto, no toda la luz emitida por los LED llega al detector. La hemoglobina reducida absorbe mucha más luz roja (660 nm) que la oxihemoglobina. La oxihemoglobina absorbe más luz infrarroja (940 nm) que la hemoglobina reducida. El detector mide la cantidad de luz no absorbida en cada longitud de onda, lo que a su vez permite que el microprocesador determine un número muy específico para la cantidad de hemoglobina y oxihemoglobina presente. 168 © 2011. Elsevier España, S.L. Reservados todos los derechos Capítulo 23 Pulsioximetría 169 6. ¿Cómo determina el pulsioxímetro el grado de saturación de la hemoglobina arterial? En el lecho vascular monitorizado, la cantidad de sangre está variando constantemente debido a la pulsación provocada por cada latido cardíaco. De este modo, los haces de luz atraviesan no sólo un volumen relativamente estable de hueso, tejido blando y sangre venosa, sino también atraviesan sangre arterial, formada por una porción no pulsátil y una porción pulsátil variable. Al medir la luz transmitida varios centenares de veces por segundo, el pulsioxímetro puede diferenciar entre el componente pulsátil variable (AC) del flujo arterial y el componente estático fijo de la señal (DC) emitida por el tejido blando, la sangre venosa y la sangre arterial no pulsátil. El componente pulsátil (AC) generalmente comprende entre el 1 y el 5% de la señal total, y puede aislarse anulando los componentes estáticos (DC) en cada longitud de onda (Figura 23-1). El fotodetector transmite esta información al microprocesador. Éste conoce la cantidad de luz roja e infrarroja emitida, la cantidad de luz roja e infrarroja detectada, la cantidad de señal estática y la cantidad de señal que varía con la pulsación. Entonces establece lo que se conoce como cociente roja/infrarroja (R/IR) de la porción pulsátil (AC) de la sangre. La R y la IR de este cociente es el total de luz absorbida en cada longitud de onda, respectivamente, sólo para la porción AC. © Elsevier. Fotocopiar sin autorización es un delito Figura 23-1. La luz transmitida atraviesa la sangre arterial pulsátil (AC) y otros tejidos (DC). El pulsioxímetro diferencia entre la porción AC y DC midiendo la luz transmitida varios centenares de veces por segundo. 7. ¿Qué es el procedimiento de normalización? Dado que la intensidad de la luz transmitida depende de la sensibilidad del detector y de las intensidades individuales de las fuentes de luz, y como la absorción de los tejidos puede variar en gran medida entre individuos, habitualmente se utiliza un proceso de normalización. La normalización supone dividir el componente pulsátil (AC) del fotopletismograma rojo e infrarrojo entre el componente no pulsátil (DC) correspondiente del fotopletismograma. Este proceso de escalado da lugar a un cociente R/IR normalizado, que es prácticamente independiente de la intensidad lumínica incidente. Cociente R/IR = (ACred/DCred)/(ACir/DCir) 8. ¿Cómo se relaciona el cociente R/IR con la saturación de oxígeno? El cociente R/IR normalizado se compara con un algoritmo preestablecido que proporciona al microprocesador el porcentaje de hemoglobina oxigenada en sangre arterial (el porcentaje de 170 Capítulo 23 Pulsioximetría saturación de oxígeno), y se muestra este porcentaje. Este algoritmo se deriva de la exposición de voluntarios, normalmente sanos, a una desaturación del 75-80%; se realiza una gasometría arterial y se mide la saturación en un laboratorio estándar. Los fabricantes mantienen sus algoritmos en secreto, pero en general un cociente R/IR de 0,4 se corresponde con una saturación del 100%, un cociente R/IR de 1,0 se corresponde aproximadamente con una saturación del 87%, y un cociente R/IR de 3,4 se corresponde con una saturación del 0% (Figura 23-2). Figura 23-2. La relación entre luz roja y luz infrarroja absorbidas se corresponde con el porcentaje adecuado de hemoglobina oxigenada. 9. ¿Qué es la curva de disociación de la oxihemoglobina? Es la curva que describe la relación entre la tensión de oxígeno y su fijación (porcentaje de saturación de oxígeno de la hemoglobina) (Figura 23-3). El transporte de oxígeno eficiente se basa en la capacidad de la hemoglobina para cargar y descargar oxígeno de forma reversible. La forma sigmoidea de la curva facilita la descarga del oxígeno en los tejidos periféricos, donde la PaO2 Figura 23-3. La curva de disociación de la hemoglobina describe la relación no lineal entre la PaO2 y el porcentaje de saturación de la hemoglobina con oxígeno (SaO2). En la parte más elevada de la curva (50% de la región), pequeños cambios en la PaO2 provocan grandes cambios en la SaO2. Capítulo 23 Pulsioximetría 171 es baja. A nivel capilar se libera una gran cantidad de oxígeno de la hemoglobina, dando lugar a una disminución relativamente leve de la tensión. Esto permite un gradiente adecuado para la difusión de oxígeno al interior de las células y limita el grado de desaturación de la hemoglobina. La curva puede desviarse a la izquierda o a la derecha debido a muchas variables (Tabla 23-1). TA B LA 2 3 - 1 . D e s v i a c i o n e s a l a d e r e c h a y l a i z q u i e r d a d e l a c u r va de disociación de la oxihemoglobina Desviación a la derecha Desviación a la izquierda Efectos: Disminución de la afinidad de la Hb por el O2 (facilita la descarga de O2 a los tejidos) Causas: Aumento de la PCO2 Hipertermia Acidosis Aumento de la altitud Aumento de 2,3-DPG Anemia falciforme Efectos: Aumento de la afinidad de la Hb por el O2 (disminuye la descarga de O2 de la Hb) Causas: Disminución de la PCO2 Hipotermia Alcalosis Hemoglobina fetal Disminución de 2,3-DPG Carboxihemoglobina Metahemoglobina © Elsevier. Fotocopiar sin autorización es un delito 2,3-DPG, 2,3-difosfoglicerato; Hb, hemoglobina. 10. ¿Por qué es posible que el pulsioxímetro dé una lectura falsa? Parte 1: no relacionada con el cociente R/IR. El algoritmo que utiliza el pulsioxímetro para determinar la saturación pierde exactitud de forma significativa a medida que la saturación disminuye por debajo del 80% debido a que, como se ha mencionado, históricamente se han utilizado voluntarios sanos para establecer estos algoritmos, y no sería ético someter a alguien a una desaturación por debajo del 80%. Por tanto, el porcentaje de saturación por debajo del 75-80% se extrapola de estos datos. A medida que disminuye la saturación, su exactitud disminuye. Se realiza el promedio de la saturación a lo largo de un período de tiempo entre 5 y 20 segundos. Durante una desaturación, la lectura de la pantalla del monitor será más alta que la saturación real. Esto resulta crítico cuando el paciente entra en la parte más elevada de la curva de desaturación de la oxihemoglobina porque el grado de desaturación aumenta de forma espectacular y puede sobrepasar la capacidad del monitor para mostrar lo suficientemente rápido el nivel real de saturación de oxígeno. Del mismo modo, a medida que aumenta la saturación de una persona, la lectura mostrada por la pantalla será menor que la saturación real. La pigmentación oscura de la piel puede sobrestimar la saturación de oxígeno. El tiempo de respuesta a los cambios en la saturación depende de la localización del sensor. El tiempo de respuesta es menor con los sensores de la oreja y mayor con los dactilares y puede aumentar con la hipoxia y la vasoconstricción. Si el monitor no permite detectar un buen pulso durante un período de desaturación, es posible que muestre una lectura de saturación artificialmente elevada. Esto se debe a que cuando el pulsioxímetro no puede encontrar una buena pulsación, la lectura anterior se congela en la pantalla mientras el monitor continúa buscando el pulso. Una vez el paciente entra en la parte elevada de la curva de disociación de la oxihemoglobina, la diferencia en la lectura mostrada y la saturación real puede ser significativa. 172 Capítulo 23 Pulsioximetría La congestión venosa, en particular cuando está causada por la insuficiencia tricúspide, puede producir una pulsación venosa que es interpretada como una señal. Esto dará lugar a una lectura artificialmente baja mientras la sangre venosa sea interpretada como sangre arterial. La anemia, la hipotensión, una mala perfusión en la zona de la medición y el esmalte de uñas, especialmente de color azul o negro, también pueden provocar lecturas falsas. 11. ¿Por qué es posible que el pulsioxímetro dé una lectura falsa? Parte 2: relacionada con el cociente R/IR. Como se ha mencionado anteriormente, el cociente R/IR determina la saturación mostrada. Cualquier circunstancia que conduzca erróneamente al cociente R/IR hacia 1,0 resultará en una lectura de la saturación cercana al 87%. La gran mayoría de las veces, estas circunstancias aparecen en pacientes bien oxigenados y dan lugar a lecturas falsamente bajas de la saturación. Sin embargo, las consecuencias son mayores cuando estas circunstancias se producen en situaciones en las que la oxigenación del paciente es críticamente baja y los resultados de la lectura de saturación están falsamente elevados. ¿Qué puede afectar al valor R/IR? Se produce un cortocircuito óptico cuando parte de la luz del LED no atraviesa el lecho vascular antes de alcanzar el detector y es resultado de una mala o incompleta colocación del sensor. El valor R/IR tiende hacia 1,0 (87%) y provoca una medición falsamente baja en un paciente que en realidad está mejor saturado. Sin embargo, si se produce en un paciente que es difícil de ventilar y está desaturando, se mostrará un valor falsamente alto, independientemente de lo hipóxico que esté el paciente. El efecto penumbra, similar al cortocircuito óptico, se produce cuando el sensor no está colocado de forma adecuada y la longitud del trayecto entre cada uno de los LED y el fotodetector no es igual, lo que provoca una distorsión relativa de la lectura de absorción. El cociente R/IR se dirige hacia 1,0. Artefactos de movimiento provocan un cociente señal/ruido bajo, alteran la detección de la absorción de la luz roja e infrarroja por parte del fotodetector, llevan el cociente R/IR hacia 1,0 y provocan lecturas de saturación falsas. Si el sensor no está bien ajustado en el dedo o la oreja, la iluminación fluorescente y las luces del quirófano, a causa de la producción de luz de fase (que es demasiado rápida para que la detecte el ojo humano) pueden provocar lecturas falsas del cociente R/IR. Cuando no se elimina la luz ambiente de alguna de las fuentes anteriores, se detecta tanto en el rango rojo como infrarrojo y el microprocesador se vuelve loco. Cuando ocurre esto, el valor R/ IR se dirige hacia 1,0 (saturación del 87%). Para reducir al mínimo las lecturas falsas a causa de la luz exterior, los pulsioxímetros funcionan en tres fases, centenares de veces por segundo. Durante la primera fase se emite una longitud de onda de 660 nm, durante la segunda fase una longitud de onda de 940 nm y durante la tercera fase no se emite ninguna longitud de onda. Esta tercera fase permite que el fotodetector mida la contaminación por la luz ambiente. Entonces el microprocesador desecha la contaminación por luz ambiente de sus mediciones. Sin embargo, esta solución al problema de la luz ambiente no es totalmente eficaz; por ello los fabricantes recomiendan colocar un material opaco sobre el sensor del oxímetro. Las dishemoglobinemias carboxihemoglobina (COHb) y metahemoglobina (MetHb) suponen un problema para la medición precisa de la saturación de oxígeno. A 660 nm, la COHb absorbe la luz de forma similar a la hemoglobina oxigenada, causando una sobrestimación de la saturación real. La influencia de la metahemoglobinemia en las lecturas de la SpO2 es más complicada. La MetHb se asemeja mucho a la Hb reducida a 660 nm. Sin embargo, lo que es más importante, a 940 nm la absorbancia de la MetHb es notablemente mayor que la de la Hb reducida u oxigenada. Por tanto, el monitor la lee como absorción de ambas especies, llevando el valor R/IR hacia 1,0 y la saturación hacia el 87%. Así pues, a un nivel elevado de SaO2 el sensor subestima el valor real; a un valor de SaO2 bajo, el valor está falsamente elevado. Capítulo 23 Pulsioximetría 173 12. La SaO2 cae en picado tras la inyección de azul de metileno. ¿El paciente se está desaturando? Debido a los cambios en la absorción de la luz (y a las alteraciones en el cociente R/IR), el azul de metileno engaña al pulsioxímetro haciéndole creer que hay más hemoglobina reducida. La aparente, pero falsa, lectura de la saturación periférica de O2 (SpO2) vuelve a la normalidad en unos minutos. 13. Explique las diferencias entre la saturación de hemoglobina funcional y frac­ cional. La saturación funcional de hemoglobina es el cociente entre la oxihemoglobina y toda la hemoglobina capaz de transportar oxígeno. La saturación fraccional de la hemoglobina es el cociente entre la oxihemoglobina y toda la hemoglobina, incluidas las dishemoglobinas (Hb + MetHb + COHb). SaO2 funcional = (O2Hb/[O2Hb + Hb]) × 100% SaO2 fraccional = (O2Hb/[O2Hb + Hb + COHB + MetHb]) × 100% 14. ¿Los pulsioxímetros miden la saturación de hemoglobina funcional o fraccional? En el pasado, los pulsioxímetros medían la hemoglobina funcional porque no existía ningún método para detectar las dishemoglobinemias con los oxímetros del quirófano. Esto ya no es así. En la actualidad existen pulsioxímetros que proporcionan lecturas de las especies de COHb, MetHb y hemoglobina normal. Para lograr esto se requiere el uso de cuatro LED y sus correspondientes fotodetectores. © Elsevier. Fotocopiar sin autorización es un delito 15. Puesto que el paciente se oxigena antes de la inducción anestésica, si el pulsioxímetro llega al 100%, ¿indica una desnitrogenación completa? La sustitución de todo el nitrógeno alveolar por oxígeno proporciona una reserva de oxígeno que podría ser necesaria si la ventilación mediante mascarilla o la intubación resultase difícil. Es posible que la hemoglobina esté saturada por completo con oxígeno antes de que se elimine todo el pulmón de nitrógeno. De este modo, una lectura del 100% por sí misma no es un indicador preciso de la desnitrogenación. 16. ¿El pulsioxímetro es un buen indicador de la ventilación? Un pulsioxímetro no indica la ventilación, solamente la oxigenación. Por ejemplo, en la unidad de cuidados postanestésicos un paciente puede llevar una mascarilla de oxígeno que libera un 50% o más de oxígeno y tener una lectura de SpO2 alrededor de 90, y aun así hipoventilar y estar hipercápnico. En esta situación el pulsioxímetro da un falso sentido de seguridad. Un mejor enfoque sería administrar menos oxígeno y, puesto que los valores del pulsioxímetro descenderían por debajo de 90, eso alertaría a la enfermera para atender al paciente. Despertar al paciente del sueño, animarle a que respire profundamente y elevar el cabezal de la cama son mejores estrategias que simplemente aumentar la concentración de oxígeno suministrado. Por supuesto que estas intervenciones no mejoran la situación de forma considerable, pero entonces la persona a cargo puede buscar otros motivos por los que el paciente no está oxigenando. Siempre hay que tratar la causa, no el síntoma; tratar al paciente, no los números. 17. ¿Existen complicaciones asociadas al uso de los sensores de pulsioximetría? Se ha descrito necrosis por presión de la piel en recién nacidos y adultos cuando el sensor se ha dejado colocado en el mismo dedo durante períodos de tiempo prolongados. También se han descrito quemaduras dactilares por los LED en pacientes sometidos a tratamiento fotodinámico. 174 Capítulo 23 Pulsioximetría P U N TOS CLAVE: P ulsi oximetría 1. El uso de la pulsioximetría ha permitido al anestesiólogo detectar y tratar rápidamente disminuciones agudas de la SaO2. 2. Al igual que sucede con todos los monitores, conocer su funcionamiento y sus limitaciones es crítico para aplicar una atención segura. Los pulsioxímetros pueden dar cifras falsamente altas y bajas; es necesario entender los motivos por los que sucede esto. 3. ¡Tratar al paciente, no el síntoma! La oxigenación y la ventilación son procesos separados, y la pulsioximetría no evalúa la idoneidad de la ventilación. P á g ina w eb http://www.asa-abstracts.com Bibliografía Recomendada 1. Barker S: Motion-resistant pulse oximetry: a comparison of new and old models. Anesth Analg 95:967–972, 2002. 2. Moyle J: Pulse oximetry. ed 2, London, BMJ Publishing Group, 2002. 3. Pedersen T, Moller A, Pedersen B: Pulse oximetry for perioperative monitoring: systematic review of randomized, controlled trials. Anesth Analg 96:426–431, 2003. Capítulo 24 Capnografía James Duke, MD, MBA 1. ¿Cuál es la diferencia entre capnometría y capnografía? ¿Cuál es mejor? La capnometría se define como la medida numérica en un monitor del nivel de CO2. Ni de cerca es tan valiosa como la capnografía, donde el nivel de CO2 espirado se expresa de manera gráfica como una función del tiempo y la concentración. 2. Describa el método más habitual de muestra de gases y sus problemas asociados. Usualmente, los dispositivos de toma lateral aspiran el gas (clásicamente, 50-250 ml/min), desde la pieza en Y del circuito, y transportan el gas a través de tubos de pequeño calibre hasta el analizador. El muestreo también se puede hacer con cánulas nasales, pero, debido a la mezcla y dilución de la concentración del CO2 con el aire ambiente, la conexión en Y proporciona una mejor muestra, tanto cualitativa como cuantitativamente, que las cánulas nasales. Los problemas con la medición por toma lateral son un retraso finito en la lectura de los resultados de la muestra de gas y una posible oclusión del tubo con vapor de agua condensado o con secreciones. La absorción de infrarrojos es el método más habitual de análisis de CO2. 3. ¿Por qué es importante medir el CO2? La monitorización de la concentración teleespiratoria de CO2 (ETCO2) ha sido un factor importante en la reducción de la mortalidad y la morbilidad relacionadas con la anestesia. La monitorización del CO2 se considera el mejor método de verificación de la colocación del tubo endotraqueal (TET). Además de su valor como monitor de seguridad, la evaluación del CO2 espirado proporciona información valiosa acerca de algunos factores fisiológicos importantes, como la ventilación, el gasto cardíaco, la actividad metabólica, así como sobre de un adecuado funcionamiento del ventilador. Los niveles de ETCO2 también se han usado para predecir el resultado de la reanimación cardiopulmonar. Un estudio prospectivo observacional de 150 paradas cardíacas extrahospitalarias encontró que los niveles de ETCO2 inferiores a 10 mmHg después de 20 minutos de soporte vital cardíaco avanzado estándar predecían en un 100% el fracaso de la reanimación. 4. Describa la curva capno­ gráfica. Las características importantes son el nivel basal, la magnitud y la rapidez de elevación del CO2 y el contorno de la curva. Los capnogramas pueden evaluar respiración por respiración, o la tendencia, que es muy útil para valorar el estado fisiológico del paciente. Hay cuatro fases distintas en un capnograma (Figura 24-1). La primera fase (A-B) es el estado inicial de exhalación, donde la muestra de gas tomada es el gas presente en el espacio muerto, libre de CO2. En el punto B, hay una mezcla Figura 24-1. Curva capnográfica. A-B: exhalación del gas, carente de CO2 del espacio muerto; B-C: combinación de gas del espacio muerto y gas alveolar; C-D: exhalación de gas alveolar, principalmente; D: punto teleespiratorio (meseta alveolar); D-E: inhalación de gas sin CO2. © 2011. Elsevier España, S.L. Reservados todos los derechos 175 176 Capítulo 24 Capnografía de gas alveolar con el gas del espacio muerto, y el CO2 se eleva bruscamente. La meseta espiratoria o alveolar se encuentra representada por la fase C-D, y la muestra de gas es esencialmente alveolar. El punto D es el nivel de CO2 máximo, el mejor reflejo de CO2 alveolar, y se conoce como ETCO2. El gas fresco se mezcla a medida que el paciente inspira (fase D-E), y el trazado vuelve al nivel basal de CO2, aproximadamente cero. 5. ¿Qué puede causar la elevación de la línea basal del capnograma? La línea basal del capnograma puede no volver al cero en las frecuencias respiratorias elevadas. Sin embargo, si la línea basal se encuentra elevada más de 2 mmHg de CO2, el paciente está recibiendo CO2 durante la inspiración, y esto se describe frecuentemente como reinhalación (Figura 24-2). Las posibles causas de reinhalación son las siguientes: Un absorbedor de CO agotado. 2 La canalización del gas dentro del absorbedor de CO2. Una válvula inspiratoria o espiratoria unidireccional ineficaz. La administración accidental de CO2 (p. ej., de una bombona de CO2 Figura 24-2. Reinhalación de CO2 demostrada porque la curva usada en laparoscopia). no regresa a su línea basal en cero. Un flujo insuficiente de gas fresco. 6. ¿Se correlaciona el ETCO2 con la PaCO2? El CO2 difunde fácilmente a través de la membrana alveolocapilar; de este modo, el ETCO2 debería proporcionar una estimación de la presión parcial del CO2 alveolar y de la presión parcial de CO2 arterial (PaCO2). La presión parcial de CO2 alveolar y la PaCO2 suelen diferir en unos 5 mmHg, estando causada esta pequeña diferencia, en su mayor parte, por el espacio muerto alveolar (zonas pulmonares ventiladas no perfundidas). A medida que aumenta la mala distribución entre la ventilación y la perfusión, disminuye la correlación entre el ETCO2 y la PaCO2, siendo el ETCO2 menor. El aumento del espacio muerto provoca un incremento del gradiente, y puede asociarse con estado de shock, embolismo aéreo o tromboembolismo, parada cardíaca, enfermedad pulmonar crónica, enfermedad reactiva de la vía aérea o posición en decúbito lateral. Por el contrario, el aumento del gasto cardíaco y del flujo de sangre pulmonar reducirá el gradiente. Cuando se sospecha un aumento de la ventilación del espacio muerto, el gradiente entre el ETCO2 y la PaCO2 se puede determinar mediante gasometría arterial. Valorando el gradiente, sigue siendo útil la medición del ETCO2 como medida indirecta del contenido arterial de CO2. Se debe destacar que el cortocircuito pulmonar tiene un efecto mínimo en los gradientes arterioalveolares de CO2. 7. ¿Es posible observar CO2 espirado después de una intubación accidental del esófago? Las bebidas o los fármacos carbonatados (p. ej., Alka-Seltzer) hacen salir CO2 después de la intubación esofágica. Sin embargo, no se esperarían las curvas y valores de CO2 usuales, y el CO2 disminuirá rápidamente. También algo de CO2 puede alcanzar el estómago si la ventilación con mascarilla es subóptima. 8. ¿Qué puede provocar una pérdida súbita de la onda capnográfica? Una pérdida súbita del registro capnográfico (Figura 24-3) puede deberse a lo siguiente: Intubación esofágica. Desconexión o mal funcionamiento del ventilador. Desconexión o mal funcionamiento del capnógrafo. Capítulo 24 Capnografía 177 Figura 24-3. Una disminución brusca del ETCO2 hasta cerca de cero puede indicar una pérdida catastrófica de la ventilación o del gasto cardíaco. P U N T OS CLAVE: Capnografía 1. Exceptuando la visualización mediante broncoscopia, la detección de CO2 exhalado es el mejor método para verificar la colocación del tubo endotraqueal (TET). 2. En ausencia de alteraciones en la ventilación-perfusión, el ETCO2 se aproxima burdamente a la PaCO2. 3. El análisis de la capnografía proporciona evidencia para diagnosticar muchos estados clínicos, como la disminución del gasto cardíaco; alteraciones en la actividad metabólica; enfermedad pulmonar aguda y crónica; y mal funcionamiento del ventilador, el circuito y el tubo endotraqueal. © Elsevier. Fotocopiar sin autorización es un delito Obstrucción del TET. Trastornos fisiológicos catastróficos, como la parada cardíaca o el embolismo pulmonar masivo. 9. ¿Qué procesos pueden llevar a disminuciones en el ETCO2? Los descensos rápidos en el registro del CO2 pueden asociarse con lo siguiente: Hipotensión. Hipovolemia. Estados de bajo gasto cardíaco. Grados menores de embolismo pulmonar. Desplazamiento de un TET correctamente colocado. Otros, y usualmente menos marcados, descensos en el ETCO2 pueden estar causados por lo siguiente: Muestreo incompleto del gas exhalado. Fugas respiratorias (incluyendo fugas alrededor del balón endotraqueal). Desconexión parcial del cir­ cuito. Obstrucción parcial de la vía aérea. Hiperventilación. Hipotermia. Aumento del espacio muerto. Actividad metabólica disFigura 24-4. Una disminución gradual del ETCO2 indica una minuida (p. ej., después del producción decreciente de CO2 o un descenso de la perfusión bloqueo neuromuscular) pulmonar. (Figura 24-4). 178 Capítulo 24 Capnografía 10. ¿Qué procesos pueden aumentar el ETCO2? Los valores de ETCO2 pueden aumentar gradualmente de manera secundaria a lo siguiente (Figura 24-5): Hipoventilación. Aumento de la temperatura corporal. Aumento de la actividad metabólica (p. ej., fiebre, sepsis, hipertermia maligna). Obstrucción parcial de la vía aérea. Figura 24-5. Un ETCO2 que va aumentando se debe Intubación bronquial. a hipoventilación, aumento de la producción de CO2 o Reinhalación. absorción del CO2 desde una fuente exógena, como la Absorción de CO exógeno 2 laparoscopia con CO2. (como durante una laparos­ copia) y embolismo venoso de CO2. Agotamiento del absorbedor de CO . 2 Flujo de gas fresco insuficiente. Fallos en el ventilador o en las válvulas del circuito anestésico. Aumentos transitorios del ETCO (pueden observarse tras la administración intravenosa de 2 bicarbonato, tras la liberación de un torniquete de una extremidad o la retirada de pinzas vasculares). 11. ¿Qué procesos pueden cambiar la configuración de la curva de capnografía? El asma y las enfermedades pulmonares obstructivas crónicas pueden ocasionar un retraso del ascenso de la curva y una meseta alveolar elevada (Figura 24-6). Un capnograma anormal que se observa con frecuencia aparece cuando el paciente hace esfuerzos respiratorios espontáneos e inhala antes de la siguiente inspiración mecánica. Esta melladura característica en la meseta alveolar es un signo clínico útil que indica que el paciente ha comenzado a respirar (Figura 24-7). Finalmente, una fuga alrededor del balón del TET puede resultar en un descenso inicial variable en la configuración normal de la curva (Figura 24-8). Las Figura 24-6. Una meseta con pendiente sugiere enfermedad pulmonar obstructiva. Figura 24-7. Una melladura en la meseta alveolar indica usualmente una recuperación parcial del bloqueo neuromuscular. La manipulación quirúrgica contra la superficie inferior del diafragma o si se apoyan en el tórax puede producir curvas similares, aunque usualmente irregulares, igual que en la figura 24-8. Figura 24-8. La disminución brusca del CO2 a un valor bajo, pero no hasta cero, se observa en el muestreo incompleto de la exhalación del paciente, en las fugas del circuito del sistema o en la obstrucción parcial de la vía aérea. Capítulo 24 Capnografía 179 curvas irregulares y las curvas variables próximas entre sí pueden deberse a la manipulación del diafragma por parte del cirujano, a la presión del cirujano contra la pared torácica, a la percusión de un abdomen distendido por CO2 o a la respiración espontánea desfasada del ventilador. Capnography P á gi na w eb www.capnography.com (Excelente e interactiva) Bibliografía Recomendada © Elsevier. Fotocopiar sin autorización es un delito 1. Moon RE, Camporesi EM: Respiratory monitoring. In Miller RD, editor: Miller’s anesthesia, ed 6, Philadelphia, Elsevier Churchill Livingstone, 2005, pp 1437–1482. Capítulo 25 CATETERISMO y monitorización de la presión venosa central Lyle E. Kirson, DDS, y Jacob Friedman, MD 1. Defina el cateterismo ve­ noso central. El cateterismo venoso central consiste en la inserción de un catéter en la circulación venosa y el avance del mismo de manera que su orificio distal se posiciona inmediatamente adyacente a o dentro de la aurícula derecha del corazón (Figura 25-1). 2. ¿Cuáles son las indicacio­ nes perioperatorias para la inserción de un catéter venoso central? Guiar la reposición hídrica. Evaluar la función cardíaca. Proporcionar acceso a lo siguiente: La aspiración de los émFigura 25-1. Colocación de un catéter venoso central. bolos aéreos que puede producirse durante los procedimientos neuroquirúrgicos. La infusión de medicación. La infusión de líquidos y sangre. La introducción de un catéter de arteria pulmonar o un marcapasos transvenoso. La toma de muestras sanguíneas. 3. ¿Cuáles son las indicaciones para la colocación de un catéter venoso central fuera de la cirugía? Hiperalimentación. Hemodiálisis temporal. Quimioterapia a largo plazo. Plasmaféresis terapéutica frecuente. 4. ¿Cuál es la mejor vía para la canulación venosa central? Existen diferentes accesos para la introducción de un catéter en la circulación venosa. Todos los abordajes conllevan riesgos, y ninguno garantiza el cateterismo en todos los pacientes. Por tanto, es importante familiarizarse con varios abordajes: la vena subclavia, la vena yugular interna, la vena yugular externa, la antecubital y la vena femoral. También es de interés que la presión venosa periférica medida en la vena antecubital refleja de forma aproximada la presión venosa central (PVC). 180 © 2011. Elsevier España, S.L. Reservados todos los derechos Capítulo 25 CATETERISMO y monitorización de la presión venosa central 5. Describa la técnica de canulación de la vena subclavia. La canulación de la vena subclavia se usa por la facilidad de acceso al vaso. La vena subclavia se canaliza más fácilmente con una punción subclavicular con el paciente en posición de Trendelenburg. La punción en la piel se hace justo externamente y a un través de dedo por debajo del ligamento costoclavicular, el cual se puede identificar por ser una escotadura a nivel de los dos tercios externos de la longitud de la clavícula. La aguja se dirige a lo largo del borde posterior de la clavícula en la dirección de la escotadura esternal hasta que se aspira la sangre venosa. 6. Describa la técnica de canulación de la vena yugular interna. Existen varios abordajes de la vena yugular interna, tres de los cuales se describen brevemente a continuación. El paciente se coloca en posición de Trendelenburg. Anterior baja: se localiza el punto en el cual las cabezas esternal y clavicular del músculo esternocleidomastoideo se unen. Se introduce la aguja en este punto y se dirige con un ángulo de 30° con la piel. Se avanza la aguja hacia el pezón ipsolateral hasta aspirar sangre venosa. Anterior alta: se palpa la arteria carótida a nivel de la membrana cricotiroidea. Se introduce la aguja justo por fuera del pulso carotídeo y se avanza hacia el pezón ipsolateral con un ángulo de 30° hasta aspirar sangre venosa. Este abordaje con frecuencia requiere atravesar el músculo esternocleidomastoideo con la aguja. Posterior: se localiza la unión del borde posterior del músculo esternocleidomastoideo y la vena yugular externa. Se introduce la aguja justo posterior a este punto y se avanza a lo largo de la superficie profunda del músculo hacia el borde ipsolateral del manubrio esternal, hasta aspirar sangre venosa. 7. Describa la técnica de canulación de la vena yugular externa. Cuando el paciente se encuentra en posición de Trendelenburg, la vena yugular externa suele observarse cuando se cruza con el músculo esternocleidomastoideo. La aguja se avanza en dirección paralela al vaso, y se introduce en la vena aproximadamente a dos traveses de dedo por debajo del borde inferior de la mandíbula. Puede encontrarse dificultad a la hora de avanzar el catéter o la guía dentro de la circulación central en la técnica de la vena yugular externa, ya que la anatomía del paciente con frecuencia dificulta el paso de la guía o del catéter más allá de la clavícula. © Elsevier. Fotocopiar sin autorización es un delito 8. ¿Cuándo se usa el abordaje por la vena femoral? La vena femoral no es el mejor abordaje dado el alto riesgo de infección. La canulación de la vena femoral puede hacerse cuando la canulación de la subclavia y de la yugular interna es imposible. Los catéteres femorales deben retirarse tan pronto como sea posible. 9. Revise los diferentes tipos de catéteres venosos centrales. Los catéteres de una sola luz pueden tener una salida distal única o múltiple. Los catéteres de tres luces tienen tres canales y luces a diferentes niveles, con poca distancia entre ellas en el extremo distal, proporcionando salidas para la infusión simultánea de fármacos, la toma de muestras sanguíneas y la monitorización de la presión venosa central (PVC). Se encuentran disponibles en tamaños de 7,5 y 9 Fr. Se ha diseñado un introductor percutáneo para la inserción de un catéter en la arteria pulmonar en la circulación central. Es un catéter de gran calibre (9 Fr) y tiene salidas laterales que se pueden usar para monitorizar la PVC o para la infusión de líquidos. Algunos catéteres tienen recubrimiento con heparina. 10. ¿Cómo se introduce el catéter en la circulación venosa central? Antes de intentar la canulación, la posición de Trendelenburg incrementará la presión venosa del vaso. A medida que se avanza la aguja hacia el vaso, se realiza una aspiración suave y constante. Ocasionalmente, durante el avance de la aguja las paredes del vaso se pueden colapsar entre ellas, de manera que la aguja atravesará la totalidad del vaso y se podrá aspirar sangre durante la retirada lenta de la aguja, siempre aspirando con delicadeza. Finalmente, mediante el conocimiento de las estructuras vitales adyacentes se evitarán complicaciones inadvertidas. Aunque un catéter se puede insertar a través de una aguja de gran calibre, la técnica más habitual consiste en pasar el catéter sobre una guía metálica, comúnmente referida como la 181 182 Capítulo 25 CATETERISMO y monitorización de la presión venosa central técnica de Seldinger. Se introduce en el vaso una aguja de 18 o 20 G, y la guía se mete por la aguja hasta la vena. Se retira la aguja, dejando la guía en su lugar. Entonces, se pasa el catéter por encima de la guía y dentro del vaso. Finalmente, se retira la guía. El beneficio obvio de la técnica de Seldinger reside en el uso de una aguja introductora de menor calibre. 11. Al intentar una punción venosa central, se obtiene retorno de sangre oscura. ¿Es esto suficiente para pensar que se está dentro de una vena? La sangre arterial puede ser oscura en un paciente que esté cianótico, que presente un gasto cardíaco insuficiente o que tenga metahemoglobinemia, por ejemplo. El flujo de sangre también puede ser no pulsátil en la insuficiencia cardíaca. La mejor manera de determinar si de verdad se está dentro de una vena es pasar un catéter de pequeño calibre (p. ej., 18 o 20 G) sobre la guía, retirar la guía y conectar el pequeño catéter a un transductor de presión. 12. ¿Cómo se mide la presión venosa central? El catéter venoso central se conecta a un manómetro lleno de líquido o a un transductor electrónico. La presión en el orificio distal se transmite a través del trayecto líquido dentro del catéter, y, si se usa el manómetro, soporta la columna de líquido dentro del manómetro. Si la base de la columna de fluido se coloca a nivel de la aurícula derecha, la altura de la columna de fluido representa la presión (en cmH2O) en el orificio distal del catéter, la PVC. Más comúnmente, el catéter se conecta a un transductor de presión que convierte la presión transmitida por el catéter en una señal eléctrica, que se representa (mmHg) en una pantalla en tiempo real (1 mmHg = 1,3 cmH2O). Cuando se mide la PVC, es crucial poner el transductor de presión o la base del manómetro al mismo nivel (auricular) cada vez, ya que una variación de sólo unos centímetros desde ese nivel resultará en un error de medición significativo, teniendo en cuenta que el rango de la PVC es sólo de 0-13 cmH2O. En contraste, la variación de la posición del transductor durante la toma de presión arterial resultará en un error mucho menor, ya que el rango de presión arterial es de 0-200 mmHg, y un error en la posición del transductor que mide la presión en la arteria pulmonar resultaría en un error intermedio entre las situaciones anteriores. 13. ¿A qué nivel del cuerpo se debe medir la presión venosa central? El punto ideal donde se debe medir la PVC es a nivel de la válvula tricúspide. Es en este punto donde, en el corazón sano, las presiones hidrostáticas causadas por cambios en la posición del cuerpo son casi de cero. Este fenómeno existe porque a medida que la presión en la válvula tricúspide cambia (p. ej., si aumenta por los cambios posicionales), el ventrículo derecho se llenará en un mayor grado, el gasto ventricular derecho aumentará transitoriamente, y el cambio de la presión en la válvula tricúspide será llevado nuevamente a cero. Lo opuesto ocurrirá si disminuye la presión en la válvula tricúspide. Una referencia externa de la tricúspide es un punto a 7 cm por detrás del esternón, más o menos en la línea axilar anterior a nivel del cuarto espacio intercostal. Es necesario realizar ajustes cada vez que haya un cambio en la posición o en la altura de la cama del paciente, para asegurarse de que el transductor o el manómetro se encuentra siempre a este nivel (Figura 25-2). Figura 25-2. Posición del paciente para la medición de la presión venosa central (PVC). Capítulo 25 CATETERISMO y monitorización de la presión venosa central 14. ¿Dónde se debe colocar el orificio distal del catéter? Cuando la medición de las presiones se utiliza para guiar la fluidoterapia, la punta del catéter se puede posicionar en la aurícula o en la vena cava cerca de la unión aurículo-cava. Para monitorizar la curva del trazado de la PVC, se posiciona el catéter dentro de la aurícula. Con esta posición, la curva no se verá modificada y reflejará adecuadamente los cambios de presión dentro de la aurícula derecha. La colocación del catéter para aspiración de émbolos aéreos durante casos neuroquirúrgicos requiere poner la punta del catéter (preferiblemente, un multiperforado) en la aurícula derecha, cerca de la unión de la vena cava superior con la aurícula. El aire embolizado pasa más allá de este punto y se acumula en la cara superior de la aurícula. Dejando la punta del catéter en la unión de la vena cava superior con la aurícula se consigue su óptima aspiración. © Elsevier. Fotocopiar sin autorización es un delito 15. ¿Cómo se puede juzgar la posición adecuada del orificio distal del catéter? Antes de la inserción, medir la distancia desde el punto de inserción a la aurícula derecha (referencia externa: inmediatamente a la derecha del tercer cartílago costal); esto dará una estimación de la longitud del catéter que se debe insertar. El método más preciso para colocar la punta de un catéter es avanzarlo bajo fluoroscopia, pero esto consume mucho tiempo y es engorroso. Con un catéter venoso central especializado, la punta puede usarse como un electrodo de un electrocardiograma (ECG). Después de la inserción, el catéter se llena con solución electrolítica (suero fisiológico o NaHCO3 al 8,4%) y la derivación V del ECG se conecta al extremo proximal del catéter. El catéter se avanza hacia la aurícula derecha. El eje de la onda P y su voltaje en el trazado de la derivación V indican la posición de la punta del catéter. A medida que la punta del catéter pasa el área del nódulo sinoauricular, la onda P adquiere la misma altura que la onda R del ECG. Cuando la punta del catéter pasa por la posición medio-auricular, se observa una onda P descendente o bifásica. La posición baja en la aurícula se indica por una onda P invertida o ausente. 16. Describa la curva normal de la presión venosa central y relacione su patrón con el ciclo cardíaco. La curva normal de la PVC muestra un patrón de tres ascensos y dos descensos, que corresponden a algunos episodios en el ciclo cardíaco (Figura 25-3). La onda a representa un aumento de la presión auricular que se produce durante la contracción auricular. La onda x’ descendente es el descenso en la presión auricular a medida que la aurícula empieza a relajarse. Antes de que se complete la relajación total, aparece la onda c, que es causada por el abombamiento de la válvula tricúspide en la auríFigura 25-3. Onda normal de presión venosa central. cula durante las fases iniciales de la contrac­ ción ventricular dere­ cha. La onda x descentente es la siguiente después de la onda c, y es una continuación de la onda x’ descendente. La onda x descendente está causada por una disminución de la 183 184 Capítulo 25 CATETERISMO y monitorización de la presión venosa central presión, consecuencia del movimiento hacia abajo del ventrículo y de la válvula tricúspide durante los estadios finales de la contracción ventricular. La onda v representa el aumento de la presión auricular que se produce mientras se llena la aurícula contra una válvula tricúspide cerrada. La y descendente representa una disminución en la presión a medida que se relaja el ventrículo, la válvula tricúspide se abre (porque la presión auricular es mayor que la presión ventricular en ese momento), y la sangre entra pasivamente al ventrículo. 17. ¿Qué factores influencian la presión venosa central? La PVC se relaciona directamente con el retorno venoso, el tono venomotor y la presión intratorácica, e inversamente con la función cardíaca. Los siguientes episodios perioperatorios pueden modificar estas variables: La vasodilatación y la depresión cardíaca inducida por la anestesia. La hipovolemia, la hemorragia y la reposición rápida de fluidos. La ventilación con presión positiva y la presión positiva teleespiratoria. El aumento de la presión abdominal (neumoperitoneo). La activación simpática causada por fármacos agonistas y por el estrés quirúrgico. La isquemia intraoperatoria puede causar disfunción diastólica o insuficiencia cardíaca. 18. ¿Es la presión venosa central un indicador del gasto cardíaco? El gasto cardíaco es, primordialmente, una función del retorno venoso (en ausencia de insuficiencia cardíaca franca), así como de la frecuencia cardíaca, contractilidad cardíaca y de la resistencia vascular periférica. Dado que la PVC no refleja únicamente el volumen intravascular, debe considerarse en el contexto clínico para poder ser útil. Por ejemplo, aunque una PVC que va aumentando sugiere un incremento del volumen intravascular y una mejoría del retorno venoso al tórax, la PVC también puede aumentar en el contexto de una insuficiencia cardíaca derecha, un taponamiento cardíaco, un neumotórax a tensión, un embolismo pulmonar o un aumento de la presión intraabdominal, etc. Estos episodios se asocian a un gasto cardíaco decreciente. 19. ¿Cómo se relaciona la presión venosa central con la precarga del ventrículo derecho? Desde hace tiempo se cree que la PVC refleja la precarga del ventrículo derecho o, más específicamente, el volumen telediastólico del ventrículo derecho (VTDVD). El volumen telediastólico es un parámetro clave en la ley del corazón de Frank-Starling. Hace poco se ha demostrado que la PVC no se correlaciona necesariamente con el volumen ventricular, la función cardíaca ni con la respuesta del corazón a la infusión de líquidos en el paciente normal y anestesiado en estado crítico. La posible razón es la gran variedad y la no linealidad de la distensibilidad de la diástole ventricular en los individuos y el conocimiento incompleto de las presiones transmurales. A pesar de este hallazgo, se cree ampliamente que la medición de la PVC es útil para el clínico como una guía para la reposición de líquidos intravenosos, especialmente en el rango más alto y en el más bajo de la PVC. Por tanto, una PVC baja (0-2 mmHg) o decreciente puede indicar la necesidad de administrar líquidos, mientras que una PVC en aumento o elevada (más de 12 mmHg) puede indicar exceso de reposición volémica o una función cardíaca afectada. La respuesta de la PVC a una carga de líquidos también se ha visto que es útil para evaluar el estado de hidratación. En la Figura 25-4 se puede ver que una carga de 200 ml de líquidos en el paciente hipovolémico resultará en un aumento pequeño y transitorio de la PVC, mientras que la misma carga en el paciente normovolémico resultará en un aumento mayor, aunque también transitorio. Sin embargo, en el paciente hipervolémico con insuficiencia ventricular derecha, la misma carga resulta en un aumento mantenido de la PVC. La PVC se usa para monitorizar una tendencia: una determinación aislada tiene un valor limitado. Capítulo 25 CATETERISMO y monitorización de la presión venosa central Figura 25-4. Presión venosa central (PVC) y estado volémico. A, hipovolemia; B, normovolemia; C, hipervolemia/insuficiencia del ventrículo derecho. P U N T OS CLAVE: C A TETERIS MO y monitorización de la presión venosa central 1. Las tendencias en las PVC son más valiosas que los valores aislados y siempre deberían valorarse en el contexto de la situación clínica del paciente. 2. Como mucho, la PVC proporciona una estimación de la precarga cardíaca, y existen muchas variables que influyen en su valor numérico y su interpretación. 3. Dado que las complicaciones del cateterismo venoso central son importantes e incluyen neumotórax, lesión arterial, hemotórax, laceración del conducto torácico, embolismo del catéter y aéreo, tromboembolismo e infección, y dado que la información obtenida es de apoyo y no definitivo, este procedimiento no debe realizarse sin una indicación clara. © Elsevier. Fotocopiar sin autorización es un delito 4. La PVC proporciona una información limitada sobre la función del ventrículo izquierdo. 20. ¿Se relaciona la presión venosa central con la precarga ventricular izquierda? La PVC refleja solamente la precarga ventricular derecha. En los pacientes cuyos ventrículos izquierdo y derecho funcionan normalmente, la PVC con frecuencia es paralela a la presión de la aurícula izquierda, que es la precarga del ventrículo izquierdo que se mide clínicamente. Sin embargo, en pacientes con hipertensión pulmonar, enfermedad pulmonar o alteraciones de la función ventricular izquierda o derecha, un catéter de arteria pulmonar proporciona mejor información con relación al lado izquierdo del corazón que un catéter venoso central. 21. ¿Existe un valor único normal de la presión venosa central? No hay un valor normal único de la PVC para todos los pacientes. La PVC en reposo puede fluctuar entre 0 y 10 mmHg en diferentes individuos, y varía poco a lo largo del tiempo. La razón para este intervalo no está clara, aunque no se relaciona necesariamente con el volumen sanguíneo. En el quirófano hay perturbaciones frecuentes que pueden afectar a la PVC, y la correcta interpretación de una PVC que va cambiando no siempre es fácil. Por eso, es importante utilizar todos los signos clínicos disponibles, incluyendo la respuesta en la administración de líquidos, la diuresis, la presión arterial y el efecto de los agentes anestésicos para determinar un rango adecuado de la PVC en un paciente. 185 186 Capítulo 25 CATETERISMO y monitorización de la presión venosa central 22. ¿Existen alternativas no invasivas a la presión venosa central que sean mejores indicadores de la volemia? En los últimos años, a medida que ha quedado claro que la PVC no se correlaciona de forma fiable con la precarga y que puede ser un indicador útil del estado hemodinámico solamente en los extremos, ha aparecido el concepto más dinámico de respuesta a líquidos para optimizar la fluidoterapia. Se han utilizado diferentes técnicas para medir la respuesta a los líquidos. Por ejemplo, la variación respiratoria en la presión arterial sistólica durante la ventilación con presión positiva disminuirá a medida que se infunda volumen en un paciente hipovolémico, o puede usarse un Doppler esofágico para medir el aumento de la velocidad de flujo de la aorta descendente (que refleja el gasto cardíaco) a medida que se infunde el líquido. 23. ¿Cómo puede utilizarse una onda de presión venosa central anormal para diag­ nosticar episodios cardíacos anormales? Puede utilizarse en el diagnóstico de episodios fisiopatológicos que afectan a la función cardíaca derecha. Por ejemplo, la fibrilación auricular se caracteriza por la ausencia del componente normal de la onda a. La regurgitación tricuspídea resulta en una onda v gigante que reemplaza a las ondas c, x y v normales. Otros episodios que pueden cambiar la forma normal de la onda de PVC incluyen el ritmo de la unión con ondas a en cañón, la disociación auriculoventricular, la contracción auricular asincrónica durante el marcapasos ventricular, la estenosis tricuspídea, el taponamiento cardíaco, el aumento de la poscarga ventricular (de la hipertensión pulmonar o del embolismo pulmonar), y la isquemia a la insuficiencia del ventrículo derecho. 24. ¿Se puede utilizar el catéter venoso central para transfusiones sanguíneas? Depende del calibre del catéter. Por ejemplo, los catéteres de tres luces de 7 Fr tienen luces estrechas, grandes longitudes y alta resistencia al flujo, restringiendo la velocidad de administración de sangre y creando un aumento de la fuerza de razonamiento en las células sanguíneas, que puede lesionarlas. Los catéteres de tres luces de 9 Fr tienen luces más grandes y resultan más cortos y resultan adecuados para la administración de sangre. Los introductores percutáneos usados para el cateterismo de la arteria pulmonar son cortos, tienen luces de 9 Fr y resultan excelentes para la administración de sangre. Siempre debe calentarse la sangre que se administra a través de un acceso central para prevenir la hipotermia y las arritmias. 25. Describa las complicaciones asociadas con la colocación de un catéter venoso central. Considerando la proximidad de la arteria carótida a la vena yugular interna, no es sorprendente que la punción de la arteria carótida sea una de las complicaciones más habituales de las vías centrales yugulares internas. El neumotórax puede producirse, y se asocia con mayor frecuencia con los abordajes subclavio, al anterior bajo de la yugular interna o de la unión (unión de la vena yugular interna y la vena subclavia). El hemotórax se produce principalmente con el abordaje de la vena subclavia, y aparece de manera secundaria a una punción o una laceración de la arteria subclavia. El conducto torácico, como rodea la vena yugular interna izquierda, puede llegar hasta 3 o 4 cm por encima de la porción esternal de la clavícula. Esto sitúa al conducto en una posición vulnerable para la punción o laceración del mismo cuando se intenta una venopunción de la yugular interna izquierda. La rotura y la embolización de la punta del catéter pueden producirse cuando el catéter se retira a través de una aguja. Asimismo, una guía de Seldinger se puede desgarrar y embolizar si se intenta retirar a través de una aguja introductora. Por tanto, si un catéter o guía no se pueden hacer avanzar a través de la aguja introductora, se debe retirar todo a la vez. El embolismo aéreo es un riesgo, y para evitar este problema el paciente se debe colocar en posición con la cabeza hacia abajo (si el acceso venoso se encuentra en una posición superior al corazón) hasta que el catéter sea insertado y las salidas proximales del catéter sean ocluidas. Las complicaciones tardías son la infección, la lesión vascular, la formación de hematoma, la formación de coágulos, la arritmia y la migración extravascular del catéter. Capítulo 25 CATETERISMO y monitorización de la presión venosa central 26. ¿Qué precauciones especiales se deben tener al retirar un catéter venoso cen­ tral? Antes de retirar el catéter subclavio o yugular interno, el paciente debe colocarse en posición con la cabeza hacia abajo, para aumentar la presión venosa en el punto de retirada y así prevenir la aspiración de aire en la vena. Después de retirar el catéter, se debe mantener la compresión externa en el área donde se ha retirado hasta que la formación del coágulo selle el vaso. Bibliografía Recomendada 1. Deflandre E, Bonhomme V, Hans P: Delta down compared with delta pulse pressure as an indicator of volaemia during intracranial surgery. Br J Anaesth 100:245–250, 2008. 2. Domino KB, Bowdle TA, Posner KL, et al: Injuries and liability related to central vascular catheters: a closed claims analysis. Anesthesiology 100:1411–1418, 2004. 3. Gelman S: Venous function and central venous pressure. Anesthesiology 108:735–748, 2008. © Elsevier. Fotocopiar sin autorización es un delito 4. Taylor RW, Palagiri AV: Central venous catheterization. Crit Care Med 35:1390–1396, 2007. 187 Capítulo 26 CATETERISMO de la arteria pulmonar James Duke, MD, MBA 1. ¿Qué presiones se miden mediante los catéteres de arteria pulmonar? Los catéteres de arteria pulmonar (AP) son catéteres con un balón en la punta y múltiples orificios. Cuando el catéter se conecta a un sistema transductor y se hincha el balón, la punta del catéter dirigida por el flujo pasa a través de las cámaras cardíacas derechas hasta la AP. El catéter de AP mide continuamente las presiones de la aurícula derecha (o presión venosa central [PVC]) y de la AP. Cuando está en la AP, este balón puede hincharse de manera intermitente y enclavarse en un segmento de la AP, y puede medirse la presión de oclusión de la arteria pulmonar (POAP), habitualmente referida como la presión en cuña o capilar pulmonar. 2. ¿Cuáles son los valores normales para la presión venosa central, la presión de la arteria pulmonar y la presión de oclusión de la arteria pulmonar? Los valores normales se relacionan a continuación. Existen pequeñas discrepancias entre las diferentes referencias. PVC 2 a 6 mmHg PAP sistólica 20 a 30 mmHg PAP diastólica 5 a 15 mmHg POAP 8 a 12 mmHg 3. ¿Qué otras variables hemodinámicas pueden medirse o calcularse con el catéter de arteria pulmonar? ¿Cuáles son sus valores normales? La mayoría de los catéteres de AP también pueden medir el gasto cardíaco y la saturación venosa mixta de oxígeno (SvO2). Se requieren otras variables, como la frecuencia cardíaca, la presión arterial sistémica y el índice de masa corporal, para calcular otros índices hemodinámicos, como los que se citan a continuación: SvO2 Gasto cardíaco Índice cardíaco Volumen sistólico Índice sistólico Resistencia vascular sistémica Resistencia vascular pulmonar 60 a 75% 4 a 8 l/min 2,5 a 4 l/min/m2 50 a 100 ml 25 a 45 ml/m2 900 a 1.300 din/s cm–5 100 a 300 din/s cm–5 4. ¿En qué procedimientos quirúrgicos se colocan con mayor frecuencia los catéteres de arteria pulmonar? ¿Qué problemas médicos pueden influenciar la decisión del clínico de insertar un catéter de arteria pulmonar antes de la intervención quirúrgica? Los catéteres de la AP son útiles en los pacientes que se someten a cirugía cardíaca (válvulas, arterias coronarias, trasplante cardíaco o pulmonar), a trasplante hepático y a cirugía vascular, y en pacientes de alto riesgo que requieren procedimientos quirúrgicos agresivos con una alta probabilidad de pérdidas sanguíneas importantes y fluctuaciones en los fluidos corporales. Los pacientes de alto riesgo son aquellos con enfermedad cardíaca isquémica o valvular, función ventricular afectada o hipertensión pulmonar, o deterioro significativo en la función de otros órganos (p. ej., hígado y riñón). También los pacientes que se encuentran hemodinámicamente 188 © 2011. Elsevier España, S.L. Reservados todos los derechos Capítulo 26 CATETERISMO de la arteria pulmonar 189 inestables (p. ej., shock o sepsis) o que tienen requerimientos ventilatorios extremos (p. ej., lesión aguda de pulmón) se cateterizan a menudo para guiar la terapia. 5. ¿Los catéteres de arteria pulmonar mejoran la supervivencia de los ­pacientes? Los catéteres de AP empezaron a utilizarse clínicamente de forma regular en la década de 1970 y siguen empleándose ampliamente (se estima que se colocan más de 1,2 millones al año). Sin embargo, solamente desde la pasada década los clínicos han investigado de forma rigurosa su eficacia clínica. Las evidencias demostrando un efecto beneficioso no son sólidas en general, y algunos indicios demostraron que los catéteres de AP eran, en realidad, perjudiciales. En este momento, estudios bien diseñados no demuestran un efecto beneficioso en todos los grupos. Naturalmente, el tema sigue siendo motivo de estudio y de debate. Se están llevando a cabo ensayos en muchos subgrupos de pacientes como pacientes con sepsis, lesión pulmonar aguda e insuficiencia cardíaca congestiva; estos estudios bien diseñados seguirán afinando nuestros conocimientos sobre los riesgos y beneficios de los catéteres de AP. Por ultimo, es importante destacar que los datos obtenidos del cateterismo de la AP deben guiar los tratamientos con efectos beneficiosos demostrados. © Elsevier. Fotocopiar sin autorización es un delito 6. ¿Qué complicaciones se asocian con el cateterismo de la arteria pulmonar? Existen los riesgos propios de la colocación de un catéter venoso central, que incluyen infección, neumotórax, hemotórax, lesión de la arteria carótida o subclavia o nerviosa, etc. En lo que concierne al catéter de AP en sí, los pacientes con bloqueo cardíaco completo de rama izquierda pueden desarrollar un bloqueo de rama derecha a medida que el catéter atraviesa el ventrículo derecho, con el consiguiente bloqueo cardíaco completo. Esto puede ser un episodio transitorio o requerir un marcapasos. Otras arritmias que pueden producirse son tanto las taquiarritmias supraventriculares como las ventriculares, y la fibrilación auricular. Otras complicaciones son la formación de nudos, la hemorragia y el infarto pulmonar, el tromboembolismo y el embolismo aéreo, la bacteriemia, la endocarditis y la sepsis. El embolismo aéreo es especialmente problemático si el paciente tiene un cortocircuito intracardíaco derecho-izquierdo. Para evitar la rotura del balón, debe hincharse lentamente, usando la mínima presión necesaria para adquirir la onda de POAP y, posteriormente, permitir que el balón se deshinche pasivamente. Finalmente, una complicación frecuente e importante del cateterismo de la AP es la mala interpretación de los datos. 7. Resuma la presentación usual, los factores de riesgo principales y el manejo de la rotura de la arteria pulmonar. La rotura de la AP se manifiesta usualmente con una hipotensión brusca con hemoptisis. Los principales factores de riesgo para la rotura de la AP son la hipertensión pulmonar, la circulación extracorpórea, la hipotermia, el hinchar de manera agresiva y prolongada el balón, la migración de la punta y la manipulación del catéter. El tratamiento consiste en la administración de líquidos, dejando el catéter de AP en su lugar, colocando un tubo endotraqueal de doble luz para aislar el pulmón afectado, revirtiendo la anticoagulación, si existe, y la preparación del paciente para toracotomía y posible lobectomía o neumonectomía. La presión positiva teleespiratoria (PEEP) también ha sido útil en algún caso para controlar la hemorragia. Las estrategias para disminuir el riesgo de hemorragia pulmonar son evitar avanzar el catéter de AP más de 55 cm y revisar la radiografía de tórax tras la colocación (el catéter no debe sobrepasar el borde mediastínico lateral). Desde luego, el balón sólo debe hincharse durante las mediciones de la POAP y deshincharlo después. Algunos centros retiran el catéter un poco entre las medidas de POAP. 8. ¿Cómo se puede evitar el acodamiento del catéter de arteria pulmonar? Se debe prestar atención a la profundidad de inserción del catéter. La distancia desde el sitio de acceso venoso al ventrículo derecho (VD) es de 35 cm cuando se coloca por la vena yugular interna derecha o subclavia derecha, y de 45 cm si se usa la vena yugular interna o subclavia izquierdas. La onda de la AP debe encontrarse a 15 cm de la onda del VD. Los catéteres de AP pueden ser difíciles de colocar cuando existe hipertensión pulmonar, distensión ventricular derecha o insuficiencia tricuspídea. 190 Capítulo 26 CATETERISMO de la arteria pulmonar P U N T OS CLAVE: C A TETERIS MO de la arteria pulmonar 1. No se ha demostrado que el cateterismo de la AP mejore la supervivencia en todos los subgrupos de pacientes. Aún se encuentra en fase de investigación científica rigurosa el tipo de pacientes que pueden beneficiarse de dicho tratamiento. 2. Deben evaluarse los siguientes aspectos al considerar el cateterismo de la AP: Los riesgos del cateterismo venosa central y de la colocación del catéter en AP son muchos e importantes, y deben identificarse los efectos beneficiosos antes de realizar estos procedimientos para justificar su uso. ¿Cuáles son las indicaciones para la colocación de un catéter de AP? Hay que considerar su uso en las fases iniciales del tratamiento, más que de manera tardía, y hay que retirarlo cuando disminuya su utilidad para guiar la terapia. Debe asegurarse que los datos obtenidos del catéter de AP son precisos e interpretados correctamente. Basándose en los datos obtenidos, ¿cuáles son los objetivos terapéuticos y cómo se conseguirán? 3. Para mejorar la precisión de la interpretación se debe tener en cuenta siempre la coincidencia del trazado de la onda con el ciclo cardíaco del electrocardiograma (ECG). 9. ¿Cuál es el eje flebostático? Las mediciones confiables y reproducibles de las presiones intravasculares requieren un punto de referencia fijo. El nivel del corazón derecho, localizado en la línea axilar media, es el punto de referencia habitualmente aceptado, y se llama eje flebostático. 10. Describa las características de la onda venosa central. Véase el Capítulo 25, Pregunta 16 (PVC). 11. Describa las características de la onda del ventrículo derecho. La onda del VD presenta un ascenso rápido hasta el pico de la sístole, una disminución rápida y un pequeño ascenso terminal al final de la diástole. La presión sistólica máxima se encuentra después del complejo QRS pero antes del pico de la onda T. El fin de diástole se halla cerca del final del complejo QRS (Figura 26-1). Figura 26-1. Onda del ventrículo derecho (VD). 12. Describa la onda de la arteria pulmonar. Quizá el cambio más notorio a medida que el catéter entra en la AP es el aumento de la presión diastólica (Figura 26-2). Otras características son un ascenso rápido, una disminución diastólica progresiva y una onda dicrótica debida al cierre de la válvula pulmonar (Figura 26-3). El pico sistólico se encuentra después del complejo QRS pero antes del pico de la onda T. El fin de la diástole se halla cerca del final del complejo QRS. Capítulo 26 CATETERISMO de la arteria pulmonar 191 Figura 26-2. La presión diastólica aumenta a medida que la punta del catéter de la arteria pulmonar cruza el ventrículo derecho hasta llegar a la arteria pulmonar. Figura 26-3. Onda de la arteria pulmonar. El pico sistólico se encuentra después del complejo QRS pero antes del pico de la onda T. El fin de diástole se halla cerca del final del complejo QRS. © Elsevier. Fotocopiar sin autorización es un delito 13. Revise la onda de la presión de oclusión de la arteria pulmonar. Al igual que la onda de PVC, la POAP tiene tres ondas positivas (a, c y v). La onda a es clásicamente más prominente y la onda c no es visible. La onda a corresponde a la contracción auricular izquierda, la onda c al cierre de la válvula mitral y la onda v al llenado auricular izquierdo. Nótese que la onda v aparece después de la onda T del ECG. La onda a se promedia para determinar la POAP (Figura 26-4). 14. Compare la respiración espontánea y la ventilación mecánica con presión positiva y su efecto sobre las ondas de presión de oclusión de la arteria pulmonar. La medición deseada es una presión transmural (es decir, la diferencia entre la presión de la cámara sometida a la medición y la presión pleural). Dado que las presiones pleurales no se miden en la práctica clínica, lo mejor que se puede hacer es medir la POAP cuando la presión intratorácica es mínima. Las presiones Figura 26-4. Una onda de presión característica de oclusión de la arteria pulmonar, con una onda c no visible. 192 Capítulo 26 CATETERISMO de la arteria pulmonar intratorácicas son mínimas al final de la espiración durante la respiración espontánea (Figura 26-5). La PEEP y la espiración activa confunden la interpretación de la POAP. 15. Las presiones del catéter de la arteria pulmonar son medidas de ciertas variables fisiológicas de importancia: ¿A cuáles nos referimos? ¿Qué se asume acerca de las variables que se obtieFigura 26-5. Comparación de las ondas de presión de nen a través del cateterismo oclusión de la arteria pulmonar durante la ventilación de la arteria pulmonar? mecánica y espontánea. Se asumen varias cosas para intentar estimar la información más importante: el volumen telediastólico del ventrículo izquierdo (VTDVI). Primero, estamos usando presiones para estimar volúmenes. Segundo, aunque podemos medir las presiones sistólica, diastólica y la POAP, estamos usando estas presiones para estimar la presión de la aurícula izquierda (PAI) y la presión telediastólica del ventrículo izquierdo (PTDVI). La presión diastólica de la AP en el corazón sano es una estimación fiable de la POAP, la PAI y la PTDVI. Sin embargo, claramente estas relaciones no se mantienen si existe enfermedad cardíaca y pulmonar. La PTDVI no sólo depende del volumen sino también de la distensibilidad del ventrículo, que puede estar disminuida por isquemia, hipertrofia ventricular y dilatación, por desviaciones septales, estenosis aórticas, derrames pericárdicos, por el uso de agentes inotrópicos y por la hipertensión; en estas situaciones la PAI estima vagamente la PTDVI. En su lugar, es mejor la estimación de la PTDVI mediante la medición de la onda a de la POAP. La PAI puede ser mayor que la PTDVI si existe regurgitación mitral, como se evidencia por una onda v grande en la onda POAP (Figura 26-6). La resistencia vascular pulmonar aumentada, presente en la enfermedad pulmonar obstructiva crónica, en la enfermedad pulmonar embólica, en la insuficiencia respiratoria aguda, en la hipoxia y en la hipercapnia, también disminuye la correlación entre la PA diastólica y las POAP. Figura 26-6. Una onda v grande en un trazado de presión de oclusión de la arteria pulmonar (AP) sugiere regurgitación mitral. Obsérvese que las ondas v grandes pueden diferenciarse de una onda de AP si se valora de acuerdo con el electrocardiograma. La sístole de la AP aparece antes de la onda T, mientras que la onda v de la aurícula izquierda aparece después de la onda T. 16. Si se observa una gran onda v en la presión de oclusión de la arteria pulmonar, ¿cómo se debe estimar la presión de oclusión de la arteria pulmonar? La mejor manera de estimar la POAP es promediando la onda a (Figura 26-7). Capítulo 26 CATETERISMO de la arteria pulmonar 193 Figura 26-7. Promedio de la altura de la onda a para estimar la presión de oclusión de la arteria pulmonar en presencia de una onda v grande. 17. ¿Cómo puede la posición del catéter de arteria pulmonar en el pulmón dar lugar a errores en la interpretación de los datos de la presión de la aurícula izquierda? Las zonas de West, como se ha comentado en el Capítulo 2, describen la relación de presión entre la arteria pulmonar, las venas pulmonares y el alvéolo en diferentes zonas anatómicas del pulmón. Las zonas pueden cambiar según la posición del paciente y los cambios en el volumen intravascular. La ventilación mecánica y la PEEP también cambian en las zonas. Habitualmente, un catéter de AP flotará a la zona 3 y, de hecho, debe hacerlo para reflejar adecuadamente la PAI porque solamente en la zona 3 existe una columna de líquido constante entre la AP y la aurícula izquierda. Sin embargo, debe destacarse que, una vez se ha colocado el catéter, la volemia del paciente y el estado ventilatorio pueden cambiar notablemente, y la punta del catéter puede no estar ya en una posición adecuada para su interpretación correcta (el catéter no migró, sí cambió la fisiología del paciente). Agradecimientos El autor agradece la contribución del Dr. Robert Taylor con las figuras utilizadas en este capítulo. P á gina w eb © Elsevier. Fotocopiar sin autorización es un delito Pulmonary Artery Catheter Education Project: una excelente página web interactiva http://www.pacep.org Bibliografía Recomendada 1. Magder S: Invasive intravascular hemodynamic monitoring: technical issues. Crit Care Clin 23:401–414, 2007. 2. Polanco PM, Pinsky MR: Practical issues of hemodynamic monitoring at the bedside. Surg Clin North Am 86:1431–1456, 2006. 3. Sandham JD, Hull RD, Brant RF, et al: A randomized, controlled trial of the use of pulmonary artery catheters in high-risk surgical patients. N Engl J Med 348:5–14, 2003. Capítulo 27 Cateterismo y monitorización de la presión arterial James Duke, MD, MBA 1. ¿Por qué se monitoriza la presión arterial? La monitorización de la presión arterial es fundamental para valorar los efectos de la anestesia sobre el sistema cardiovascular. Como hay decisiones sobre el cuidado del paciente que se tomarán según los datos de la presión arterial, es importante entender cómo se obtienen dichos datos. La presión arterial se monitoriza, ya sea de manera no invasiva con un manguito de presión arterial o de manera invasiva con canulación arterial y un transductor de presión. 2. ¿Cómo funcionan los aparatos de medición de la presión arterial no invasivos? La presión arterial suele medirse de forma manual (método auscultatorio) o con un aparato automático (método oscilométrico). Con el método auscultatorio, se infla un manguito neumático para ocluir el flujo sanguíneo arterial. A medida que el manguito se desinfla se crean frecuencias audibles, llamadas sonidos de Korotkoff, a causa de las turbulencias en el flujo sanguíneo arterial. La presión a la cual los sonidos son audibles por primera vez se toma como la presión sistólica, y la presión a la que los sonidos desaparecen se toma como la presión diastólica. Los errores en la medición pueden estar causados por: Gomas del estetoscopio excesivamente largas. Mala audición del observador. Errores en la calibración del esfigmomanómetro. Disminución del flujo sanguíneo en las extremidades causada por una hipovolemia o por el uso de vasopresores. Arteriosclerosis grave que impide la oclusión de la arteria a presiones suprasistólicas. Tamaño inadecuado del manguito. Velocidad de desinflado demasiado rápida. Con el método oscilométrico, también se hincha un manguito neumático para ocluir el flujo sanguíneo arterial. A medida que se deshincha el manguito, las pulsaciones arteriales causan cambios en la presión del manguito, que son analizados por un ordenador. Se toma la presión sistólica como el punto de oscilaciones rápidamente crecientes, la presión arterial media como el punto de máxima oscilación, y la presión diastólica como el punto de oscilaciones rápidamente decrecientes. Los errores en la medición pueden producirse por un tamaño inapropiado del manguito o por factores que impiden la detección de las variaciones de la presión del manguito, como el temblor del paciente. El uso prolongado del modo «continuo», en el cual el manguito se vuelve a inflar inmediatamente después de cada toma de presión, puede crear complicaciones, como parestesias del nervio cubital, tromboflebitis o síndrome compartimental. 3. ¿Cuáles son las indicaciones para monitorizar la presión sanguínea intraarterial? La monitorización intraarterial de la presión arterial está indicada cuando: Los cambios de la presión arterial son muy rápidos. Los cambios moderados de la presión arterial pueden ocasionar lesiones en órganos diana. Se requieren gasometrías frecuentes. La monitorización no invasiva de la presión arterial es imprecisa. Son ejemplos de situaciones clínicas en las que está indicada: inestabilidad cardiovascular prevista (p. ej., cambios masivos en los fluidos corporales, cirugía intracraneal, enfermedad cardiovascular significativa, enfermedad cardíaca valvular, diabetes), manipulación directa del 194 © 2011. Elsevier España, S.L. Reservados todos los derechos Capítulo 27 Cateterismo y monitorización de la presión arterial 195 sistema cardiovascular (p. ej., cirugía cardíaca, cirugía vascular mayor, hipotensión deliberada), muestras frecuentes para gasometría para valorar el estado ácido-base de la enfermedad pulmonar o la ventilación unipulmonar, o la obesidad mórbida que impide la medición no invasiva adecuada. 4. ¿Cuáles son las complicaciones de la monitorización arterial invasiva? Las complicaciones incluyen la isquemia distal, la trombosis arterial, la formación de hematomas, la infección del lugar del catéter, la infección sistémica, la necrosis de la piel circundante y la pérdida potencial de sangre causada por la desconexión. La incidencia de infección aumenta con la duración del cateterismo. La incidencia de la trombosis arterial aumenta con: La duración del cateterismo. El mayor calibre del catéter. El tipo de catéter (los catéteres de Teflón causan más trombosis que los catéteres de polipropileno). El embolismo proximal. El estado de shock prolongado. Las vasculopatías periféricas preexistentes. © Elsevier. Fotocopiar sin autorización es un delito 5. ¿Cómo se realiza el cateterismo de la arteria radial? La muñeca se coloca en extensión dorsal y se fija, se limpia la piel con solución antiséptica, el trayecto de la arteria radial se determina por palpación, y se infiltra un anestésico local en la piel sobre de la arteria. Se inserta un catéter sobre aguja de 20 G en un ángulo de 30-45° con la piel en el trayecto de la arteria radial. Cuando se obtiene retorno de sangre arterial, se reduce el ángulo, y se avanza levemente el catéter para asegurarse que tanto la punta del catéter como la aguja han avanzado dentro de la luz arterial. Entonces el catéter se desliza dentro de la arteria. De manera alternativa, la arteria radial puede transfixiarse. Después de obtener retorno sanguíneo arterial, se avanza el catéter hasta que tanto éste como la aguja atraviesan completamente la pared anterior y posterior de la arteria. La aguja se retira de dentro del catéter, y éste se va retirando lentamente. Cuando se encuentra flujo sanguíneo pulsátil en el catéter, éste hace avanzar hacia la luz. Si el catéter no avanza dentro de la luz arterial y el retorno sanguíneo es bueno, se puede colocar una guía estéril dentro de la luz arterial, a través del catéter, y avanzar éste sobre la guía. Algunos equipos de canulación arterial llevan un sistema combinado de aguja, guía y cánula, donde la guía se avanza a la luz después de obtener un adecuado flujo sanguíneo, y entonces se avanza el catéter sobre la guía. Después de la canulación, se conecta al catéter una alargadera de presión de baja distensibilidad, se aplica un apósito estéril y se fija el catéter en su lugar. Se debe tener cuidado de que la alargadera no tenga burbujas antes de la conexión. Posteriormente, es aconsejable retirar cualquier dispositivo que mantenga la dorsiflexión de la muñeca para evitar la parálisis del nervio mediano. 6. Describa el flujo sanguíneo normal de la mano. La mano se encuentra irrigada por las arterias radial y cubital. Estas arterias se anastomosan mediante cuatro arcos en la mano y en la muñeca (los arcos palmares superficiales y profundos, los arcos anterior y posterior del carpo) y mediante sus ramas digitales y del metacarpo. Debido a su doble suplencia arterial, la mano generalmente tiene flujo colateral, y los dedos pueden irrigarse por una arteria si la otra se ocluye. Tanto la arteria radial como la cubital han sido extraídas y usadas con buenos resultados como injertos arteriales coronarios, sin dejar secuelas isquémicas en la mano. 7. Describa la prueba de Allen. Explique su propósito. La prueba de Allen se realiza antes de la canulación de la arteria radial para determinar si la circulación colateral cubital de la mano es adecuada en caso de trombosis de la arteria radial. Se exsanguina la mano haciendo que el paciente la cierre apretando el puño. Se ocluyen las arterias radial y cubital mediante compresión manual, el paciente relaja la mano y la presión sobre la arteria cubital se libera. El flujo colateral se evalúa midiendo el tiempo que tarda en retornar 196 Capítulo 27 Cateterismo y monitorización de la presión arterial la coloración normal de la mano. El retorno del color en menos de 5 segundos indica un flujo colateral adecuado, el retorno en 5-10 segundos sugiere una prueba dudosa, y el retorno en más de 10 segundos indica una circulación colateral inadecuada. En el 25% de la población la circulación colateral de la mano es inadecuada. 8. ¿Es la prueba de Allen un predictor adecuado de las secuelas isquémicas? Aunque algunos clínicos indican el uso de la prueba de Allen, otros han demostrado que la prueba de Allen de la permeabilidad cubital no se correlaciona con el flujo sanguíneo distal evaluado por la inyección de tintura de fluoresceína. Existen muchos casos publicados de secuelas isquémicas en pacientes con una prueba de Allen normal; asimismo, algunos pacientes con una prueba de Allen anormal pueden no tener secuelas isquémicas. Aparentemente, la prueba de Allen aislada no predice de manera fiable la aparición de consecuencias adversas. Además, parece que la trombosis arterial no es infrecuente tras la retirada del catéter. Se han observado tasas de trombosis del 25% y mayores sin evidencia de isquemia. Al parecer, la trombosis es un suceso autolimitado. 9. ¿Qué lugares de canulación alternativos existen? Las arterias cubital, radial, humeral, axilar, femoral, pedia dorsal y tibial posterior son localizaciones aceptables para la canulación arterial. La arteria cubital puede canularse si la arteria radial proporciona un flujo colateral adecuado. La arteria humeral tiene la desventaja de carecer de flujo colateral, pero muchos estudios han demostrado que su canulación es relativamente segura. La canulación de la arteria axilar también es relativamente segura, pero se prefiere el lado izquierdo por su menor incidencia de embolización a la arteria carotídea. La arteria femoral es un lugar excelente de canulación debido a su gran tamaño, su facilidad técnica de canulación y el bajo riesgo de secuelas isquémicas. Mientras que algunos estudios han indicado una incidencia mayor de infección con un catéter femoral, otros no han demostrado este aumento. El pequeño calibre de la arteria pedia dorsal y de la arteria tibial posterior hace que su canulación sea difícil y que aumente el riesgo de complicaciones isquémicas; la canulación de estas arterias está relativamente contraindicada en pacientes con vasculopatía periférica y diabetes mellitus. La canulación de la arteria cubital no se debe intentar después de haber puncionado la arteria radial del mismo lado. 10. ¿En qué difiere una onda arterial central de una onda periférica? A medida que la presión arterial se transmite desde la aorta central a las arterias periféricas, la onda se va distorsionando (Figura 27-1). La transmisión se encuentra retardada, se pierden los componentes de alta frecuencia como la escotadura dicrótica, el pico sistólico aumenta y la curva diastólica disminuye. Los cambios en la presión sistólica y diastólica son el resultado de una disminución en la distensibilidad de la pared arterial y de la resonancia (la suma de las ondas reflejadas hacia la onda arterial a medida que viaja distalmente en el árbol arterial). La presión arterial sistólica en la arteria radial puede ser de hasta 20-50 mmHg más alta que la presión central de la aorta. Figura 27-1. Configuración de la onda arterial a varios niveles del árbol arterial. (De Blitt CD, Hines RL: Monitoring in anesthesia and critical care medicine, ed 3, New York, 1995, Churchill Livingstone, con permiso.) Capítulo 27 Cateterismo y monitorización de la presión arterial 197 11. ¿Qué información se puede obtener de una onda arterial? La onda arterial proporciona información valiosa acerca del estado hemodinámico del paciente: La onda determina la frecuencia cardíaca durante la interferencia del bisturí eléctrico con el electrocardiógrafo, y determina si los picos eléctricos de un marcapasos se traducen en contracciones ventriculares. La pendiente ascendente de la curva puede utilizarse para evaluar la contractilidad miocárdica. Las variaciones amplias con la respiración sugieren hipovolemia. La onda proporciona una estimación visual de las consecuencias hemodinámicas de las arritmias. P U N TOS CLAVE: CATETERISMO y monitoriz aci ón de la presión arterial 1. El uso prolongado de los manguitos de presión automatizados en modo «continuo», en el cual el manguito se vuelve a inflar inmediatamente después de obtener cada medición, puede producir complicaciones como parestesias del nervio cubital, tromboflebitis o síndrome compartimental. 2. En el 25% de la población, la circulación colateral de la mano es inadecuada. 3. El cateterismo ipsolateral de la arteria cubital no debe intentarse después de múltiples intentos fallidos en el cateterismo radial del mismo lado. 4. Las ondas arteriales medidas en la periferia parecen amplificadas y demuestran presiones de pulso más amplias y presiones diastólicas algo menores. La presión arterial media se reduce sólo levemente. © Elsevier. Fotocopiar sin autorización es un delito 5. La presión arterial sistólica en la arteria radial puede ser de hasta 20-50 mmHg más alta que la presión de la aorta central. 12. ¿Cómo se registra la onda arterial? El registro de la onda arterial requiere el siguiente equipo: Catéter intravascular. Alargadera llena de líquido y llave de tres vías. Transductor electromecánico. Analizador electrónico y sistema de pantalla. La energía mecánica en la punta del catéter se transmite a un transductor a través de la alargadera llena de líquido y se convierte en una señal eléctrica. La señal eléctrica se convierte luego en una onda mediante el analizador y se proyecta en la pantalla. 13. Defina el coeficiente de amortiguación y la frecuencia natural. La frecuencia natural, una propiedad del sistema catéter-llave de tres pasos-aparato transductor, es la frecuencia a la cual el sistema de monitorización resuena y amplifica las señales que recibe. La frecuencia natural es directamente proporcional al diámetro de la luz del catéter e inversamente proporcional a la longitud de las alargaderas de conexión, la distensibilidad del sistema y la densidad del líquido contenido en el sistema. Ya que la frecuencia natural de la mayoría de los sistemas de monitorización se encuentran en el mismo rango que las frecuencias usadas para recrear la onda arterial, puede producirse una distorsión y amplificación significativas de la onda. El coeficiente de amortiguación refleja la velocidad a la cual se disipa la energía de una onda de presión. Esta propiedad puede ajustarse para contrarrestar la amplificación errónea que resulta cuando la frecuencia natural del sistema de monitorización se solapa con las frecuencias usadas para recrear la onda. 198 Capítulo 27 Cateterismo y monitorización de la presión arterial 14. ¿Cuáles son las características de un sistema de monitorización sobreamortiguado y de uno subamortiguado? El coeficiente de amortiguación se estima evaluando el tiempo necesario para que el sistema se nivele a cero después de un flujo de alta presión (Figura 27-2). Un sistema subamortiguado continúa oscilando durante tres o cuatro ciclos; sobrestima la presión sistólica y subestima la presión diastólica. Un sistema sobreamortiguado llega a la línea de base lentamente, sin oscilación; subestima la presión sistólica y sobrestima la presión diastólica. En ambos casos, sin embargo, la presión arterial media es relativamente precisa. Figura 27-2. Ondas de presión arterial subamortiguada, adecuadamente amortiguada y sobreamortiguada después del lavado del sistema con alta presión. 15. ¿Cómo puede reducirse la incidencia de artefactos en los sistemas de monitorización arterial? La incidencia de artefactos puede reducirse mediante el cuidado meticuloso del sistema de monitorización: La alargadera debe ser rígida, con un diámetro interno de 1,5-3 mm y una longitud máxima de 120 cm. Las líneas deben mantenerse libres de acodamientos, tapones y burbujas que causan sobreamortiguación del sistema. Se debe usar sólo una llave de tres pasos por línea para minimizar la posibilidad de entrada de aire. El sistema de acoplamiento mecánico debe purgarse con suero fisiológico heparinizado para mantener la permeabilidad de la línea arterial y minimizar el riesgo de embolización distal e infección nosocomial. El transductor debe colocarse a nivel de la aurícula derecha, en la línea axilar media en la posición supina. El transductor debe estar equilibrado eléctricamente, y se debe reiniciar el cero periódicamente ya que el punto cero puede desplazarse si cambia la temperatura de la habitación. Capítulo 27 Cateterismo y monitorización de la presión arterial 199 16. ¿Qué es la amplificación distal del pulso? La forma de la onda de presión arterial cambia a medida que viaja desde la baja resistencia de la aorta ascendente a la alta resistencia del lecho arteriolar. Este cambio importante de las resistencias hace que la onda de presión se refleje retrógradamente hacia la aorta ascendente, influenciando la forma de la onda de presión. Mientras que los cambios de forma varían con la edad, el tono simpático y la impedancia vascular, generalmente las mediciones periféricas de la onda arterial parecen estar amplificadas y muestran presiones sistólicas más elevadas, presiones de pulso más anchas y presiones diastólicas algo inferiores. La presión arterial media sólo se encuentra ligeramente reducida. 17. ¿Cuáles son los riesgos y beneficios de disponer de heparina en el líquido de un sistema de transducción? Las infusiones heparinizadas se han utilizado durante más de 25 años para reducir la incidencia de trombosis del catéter arterial. Sin embargo, una comparación reciente sobre el uso de soluciones heparinizadas frente a no heparinizadas para sistemas de transducción arterial no halló ningún aumento en la incidencia de trombosis del catéter cuando se utilizó una solución no heparinizada. El efecto beneficioso de no utilizar soluciones heparinizadas sería la reducción de la exposición a la heparina y, por ende, la posibilidad de causar una trombocitopenia inducida por la heparina. 18. ¿Existe algún riesgo asociado a la irrigación del sistema del catéter? A veces los sistemas de catéteres arteriales se irrigan para mejorar la calidad de la onda arterial. La embolización retrógrada del aire o el trombo en los vasos cerebrales es un riesgo. Se ha observado que velocidades de irrigación mayores de 1 ml/min provocan un flujo retrógrado. Debe destacarse que los sucesos neurológicos asociados con la canulación arterial son extremadamente raros y esporádicos en este momento. Bibliografía Recomendada 1. Barbeito A, Mark JB: Arterial and central venous pressure monitoring. Anesthesiol Clin 24:717–735, 2006. 2. Murphy GS, Szokol JW, Marymont JH, et al: Retrograde blood flow in the brachial and axillary arteries during routine radial arterial catheter flushing. Anesthesiology 105:492–497, 2006. © Elsevier. Fotocopiar sin autorización es un delito 3. Tuncali BE, Kuvaki B, Tuncali B, et al: A comparison of the efficacy of heparinized and nonheparinized solutions for maintenance of perioperative radial arterial catheter patency and subsequent occlusion. Anesth Analg 100:1117–1121, 2005. Trastornos de la presión arterial James Duke, MD, MBA Capítulo 28 V. PROBLEMAS PERIOPERATORIOS 1. ¿Cuál es la importancia de la hipertensión para la población general? La prevalencia de la hipertensión arterial (HTA) es de alrededor del 20-25% en la población general, lo que la convierte en la comorbilidad preoperatoria más frecuente. Es una causa importante de muerte y discapacidad en la mayoría de las sociedades occidentales. La HTA prolongada conlleva aterosclerosis y fallo orgánico crónico. Es el principal factor de riesgo para la patología cardíaca, vascular, cerebral y renal. 2. ¿Qué valores de presión arterial se consideran hipertensivos? Las cifras son siempre arbitrarias. La presión arterial (PA) cambia durante el día, y puede encontrarse afectada por la postura, el ejercicio, la medicación, el tabaquismo y la ingesta de cafeína, así como por el estado de ánimo. La HTA no puede diagnosticarse basándose en una toma de PA anormal, sino que requiere elevaciones mantenidas en múltiples mediciones en días diferentes. La hipertensión sistémica suele considerarse cuando hay elevaciones mantenidas de la PA diastólica superiores a 90-95 mmHg, o una PA sistólica superior a 140-160 mmHg. La HTA límite se define como una PA diastólica de 85 a 89 mmHg o una PA sistólica de 140 a 159 mmHg. Las PA diastólicas de 110 a 115 mmHg definen la HTA grave, y la HTA maligna se define por PA superiores a 200/140 mmHg. La HTA maligna es una emergencia médica. 3. ¿Qué causa hipertensión? HTA esencial (o idiopática): causa desconocida; >90% de todos los casos se incluyen en esta categoría. Endocrina: síndrome de Cushing, hiperaldosteronismo, feocromocitoma, tirotoxicosis, acromegalia, tratamiento con estrógenos. Renal: pielonefritis crónica, estenosis vasculorrenal, glomerulonefritis, enfermedad poliquística del riñón. Neurogénica: presión intracraneal aumentada, hiperreflexia autonómica. Miscelánea: obesidad, hipercalcemia, preeclampsia, porfiria aguda intermitente. 4. ¿Cuáles son los procesos fisiológicos que se producen cuando un paciente se vuelve hipertenso? Con frecuencia, el gasto cardíaco aumenta de manera transitoria, seguido por un aumento mantenido de la resistencia vascular sistémica. Se observa hipertrofia del músculo liso vascular y hay un tono arteriolar aumentado. El volumen de líquido extracelular y la actividad de renina no tienen un patrón constante, pero usualmente aumentan las concentraciones intracelulares de sodio y calcio. La HTA mantenida conduce a hipertrofia concéntrica del ventrículo izquierdo y a una relajación ventricular deteriorada, conocida como disfunción diastólica. La disfunción diastólica produce presiones telediastólicas aumentadas. 5. Identifique los tratamientos farmacológicos actuales para los pacientes hiper­ tensos. Se inicia el tratamiento con un único agente, pero si esto no es efectivo se pueden prescribir múltiples fármacos. Hay numerosos factores que determinan qué fármaco se debe escoger, incluyendo la raza, el sexo, la edad y la comorbilidad. Por ejemplo, los pacientes de raza negra responden mejor a los bloqueantes de los canales del calcio, a los inhibidores de la enzima convertidora de angiotensina (IECA) y a los bloqueantes b . Los bloqueantes b están relativamente © 2011. Elsevier España, S.L. Reservados todos los derechos 201 202 Capítulo 28 Trastornos de la presión arterial contraindicados en pacientes con enfermedad reactiva de la vía aérea, y los pacientes con estenosis de la arteria renal no deberían recibir IECA. Los diuréticos producen hipopotasemia e hiperglicemia. Los bloqueantes b no son particularmente efectivos en los ancianos. La Tabla 28-1 revisa la medicación antihipertensiva más habitualmente recetada. Ta b l a 2 8 - 1 . F á r m a c o s a n t i h i p e r t e n s i v o s p r e s c r i t o s h a b i t u a l m e n t e Tipo Ejemplos Efectos adversos Diuréticos tiazídicos Hidroclorotiazida Diuréticos del ASA Furosemida Bloqueantes Propranolol, metoprolol, atenolol Bloqueantes Terazosina, prazosina Agonistas 2 Clonidina Bloqueantes de los canales del calcio IECA Verapamilo, diltiazem, nifedipino Captopril, enalapril, lisinopril, ramipril Antagonistas de la angiotensina Relajantes del músculo liso vascular Losartán, irbesartán, candesartán Hidralazina, minoxidil Hipopotasemia, hiponatremia, hiperglicemia, hipomagnesemia, hipocalcemia Hipopotasemia, hipocalcemia, hiperglicemia, hipomagnesemia, alcalosis metabólica Bradicardia, broncoespasmo, bloqueo de la conducción, depresión miocárdica, fatiga Hipotensión ortostática, taquicardia, retención hídrica Hipotensión ortostática, sedación, hipertensión de rebote, disminución de la CAM Depresión cardíaca, bloqueo de la conducción, bradicardia Tos, angioedema, retención hídrica, taquicardia refleja, disfunción renal, hiperpotasemia Hipotensión, insuficiencia renal, hiperpotasemia Taquicardia refleja, retención hídrica Adaptado de Morgan GE, Mikhail MS, Murray MJ: Clinical anesthesiology, ed 4, New York, 2005, McGraw-Hill, Capítulo 20. CAM, concentración alveolar mínima; IECA, inhibidores de la enzima conversora de angiotensina. 6. ¿Cuáles son las consecuencias de la hipertensión arterial mantenida? Los pacientes hipertensos no tratados desarrollan enfermedad de órganos diana, como hipertrofia del ventrículo izquierdo, enfermedad coronaria, insuficiencia cardíaca congestiva, miocardiopatía, insuficiencia renal y accidente vascular cerebral. Los pacientes hipertensos también presentan PA lábiles intraoperatorias. 7. ¿Por qué se deben tomar los antihipertensivos hasta el momento de la ciru­ gía? Un paciente hipertenso bien controlado tiene menos labilidad intraoperatoria de su PA. La supresión brusca de los antihipertensivos puede precipitar una HTA de rebote o una isquemia miocárdica. En particular, los bloqueantes b y los agonistas a2 se asocian con HTA de rebote. En general, la medicación antihipertensiva debe mantenerse hasta el momento de la cirugía, y debe reanudarse lo antes posible después de la intervención. Capítulo 28 Trastornos de la presión arterial 203 8. ¿Qué antihipertensivos deben suspenderse el día de la cirugía? Aunque no hay un acuerdo universal, muchos opinan que los IECA y los antagonistas de los receptores de angiotensina deben suspenderse el día de la cirugía (véase la Pregunta 15). Los diuréticos pueden suspenderse cuando la depleción del espacio intravascular sea un motivo de preocupación. 9. ¿Es la anestesia regional una opción viable para los pacientes hipertensos? Sí, pero un nivel de bloqueo simpático alto en pacientes hipertensos puede producir reducciones excesivas en la PA, ya que el volumen intravascular disminuido exacerba los efectos de la vasodilatación. Estos pacientes deben recibir líquidos intravenosos antes de la anestesia regional. 10. Relacione los diagnósticos diferenciales de la hipertensión arterial intraopera­ toria. Véase la Tabla 28-2. Ta b l a 2 8 - 2 . D i a g n ó s t i c o d i f e r e n c i a l d e h i p e r t e n s i ó n i n t r a o p e r at o r i a Relacionado con la enfermedad preexistente Relacionado con la cirugía Relacionado con la anestesia Relacionado con la medicación © Elsevier. Fotocopiar sin autorización es un delito Otros Hipertensión crónica, presión intracraneal aumentada, hiperreflexia autónoma, disección aórtica, infarto de miocardio agudo precoz Tiempo de torniquete prolongado, circulación extracorpórea poscardiopulmonar, pinzamiento aórtico, endarterectomía poscarotídea Dolor, insuficiente profundidad anestésica, liberación de catecolaminas, hipertermia maligna, temblores, hipoxia, hipercapnia, hipotermia, hipervolemia, tamaño demasiado pequeño del manguito del tensiómetro, transductor intraarterial posicionado muy abajo Hipertensión de rebote (por supresión de la clonidina, bloqueantes b o metildopa), absorción sistémica de vasoconstrictores, colorantes intravenosos (p. ej., índigo carmín) Distensión vesical, hipoglicemia 11. ¿Cómo debe manejarse la hipertensión arterial intraoperatoria y postoperato­ ria? El dolor es la causa más habitual de la HTA postoperatoria, pero siempre se deben considerar otras causas. Intraoperatoriamente, considere aumentar la concentración del anestésico inhalatorio empleado o administrar opiáceos adicionales. Considere la dosis horaria usual de los opiáceos comunes y determine si se ha llegado a la dosis límite máxima. Las recomendaciones usuales para la administración de opiáceos pueden no aplicarse a los pacientes que reciben opiáceos de manera crónica. Si la administración de agentes inhalatorios y opiáceos no controla la HTA suficientemente, considere agentes antihipertensivos primarios. Postoperatoriamente, la terapia con opiáceos debe dosificarse según la frecuencia respiratoria y la valoración del paciente de la intensidad del dolor. Deben considerarse útiles los bloqueos nerviosos y los analgésicos adyuvantes como el ketorolaco. Los antihipertensivos usados con mayor frecuencia en el período perioperatorio se describen en la Tabla 28-3. 204 Capítulo 28 Trastornos de la presión arterial Ta b l a 2 8 - 3 . A g e n t e s a n t i h i p e rt e n s i v o s u t i l i z a d o s p e r IO p e r ato r i a m e n t e Fármaco Dosis Tiempo de acción Labetalol 5-20 mg 1-2 minutos Bolo de esmolol Infusión de esmolol 0,5 mg/kg en 1 minuto 1-2 minutos 1-2 minutos Propranolol Hidralazina Infusión de nitroprusiato sódico Nitroglicerina 50-300 mg/kg/min 1-3 mg 5-20 mg 0,5-10 mg/kg/min 1-2 minutos 5-10 minutos 1 minuto 0,5-10 mg/kg/min 1 minuto 12. ¿Tienen los pacientes hipertensos que van a ser sometidos a una anestesia ge­ neral un mayor riesgo de morbilidad cardíaca perioperatoria? Aunque numerosos estudios han demostrado que la PA sistólica preoperatoria aumentada es un factor predictivo significativo de la morbilidad postoperatoria, no hay datos que establezcan definitivamente si el tratamiento preoperatorio de la HTA reduce el riesgo perioperatorio. Sin embargo, los pacientes hipertensos deficientemente tratados presentan una labilidad aumentada de la PA, y las fluctuaciones hemodinámicas tienen cierta relación con las complicaciones postoperatorias. Además, algunos pacientes con HTA tendrán lesión de órganos diana. Parece razonable que para los procedimientos quirúrgicos no urgentes la hipertensión se trate preoperatoriamente. 13. Describa de forma general las causas de hipotensión perioperatoria. Hipovolemia: deshidratación, ingesta oral o administración intravenosa insuficiente de líquidos, enemas intestinales, fiebre, despeños diarreicos, vómitos. Hipovolemia funcional (shock): Sepsis: resistencias vasculares sistémicas disminuidas, capacitancia venosa aumentada. Insuficiencia cardíaca: cardiopatía isquémica, miocardiopatía, embolismo pulmonar, valvulopatía, arritmias. Hemorragia: traumatismo, hemorragia quirúrgica, «tercer espacio». Neurogénica: disminución de la resistencia vascular sistémica por lesión de la médula ­espinal. Anafilaxia: disminución de la resistencia vascular sistémica. Fármacos: incluyendo agentes inductores anestésicos, anestésicos halogenados, fármacos liberadores de histamina, butirofenonas, fármacos usados para inducir hipotensión (p. ej., bloqueantes ganglionares, vasodilatadores, bloqueantes adrenérgicos a y b), anestesia regional. Ventilación con presión positiva. Taponamiento cardíaco, neumotórax a tensión. Neuropatía autonómica: diabetes mellitus, lesiones de la médula espinal, síndrome de Guillain-Barré, disautonomía familiar, síndrome de Shy-Drager, virus de inmunodeficiencia humana (VIH) o síndrome de inmunodeficiencia adquirida (sida). La hipotensión ortostática se comenta en el Capítulo 1. Enfermedad médica y quirúrgica: hematemesis, melenas, cetoacidosis diabética, diabetes insípida, insuficiencia renal poliúrica, enfermedad intestinal, quemaduras. 14. ¿Qué es el cemento articular y cómo causa hipotensión? El metilmetacrilato, un cemento utilizado en la prótesis articular, experimenta una reacción exotérmica que permite que se adhiera a las irregularidades de la superficie ósea. La hipotensión se produce usualmente a los 30-60 segundos de la colocación del cemento, pero puede aparecer hasta 10 minutos después. Los mecanismos postulados incluyen la lesión tisular por la reacción, la liberación de sustancias vasoactivas cuando se hidroliza a ácido metacrilato, la embolización y la vasodilatación producida por la absorción del monómero volátil. Capítulo 28 Trastornos de la presión arterial 205 P U N TOS CLAVE: T rastornos de la presión arterial 1. Aunque numerosos estudios han demostrado que la PA sistólica preoperatoria aumentada es un factor predictivo significativo de morbilidad postoperatoria, no hay datos que establezcan definitivamente si el tratamiento preoperatorio de la hipertensión reduce el riesgo perioperatorio. 2. Parece lógico que, para las intervenciones quirúrgicas que no son urgentes, la hipertensión deba tratarse preoperatoriamente. 3. Con la excepción de los antagonistas del sistema renina-angiotensina y posiblemente de los diuréticos, el tratamiento antihipertensivo debe tomarse incluso hasta el mismo día de la cirugía. 15. ¿Por qué la administración de antagonistas del sistema renina-angiotensina produce hipotensión durante la inducción? ¿Cómo puede tratarse la hipoten­ sión? Se supone que el mecanismo es la pérdida del tono simpático superpuesto al bloqueo del sistema renina-angiotensina (SRA). El sistema de la vasopresina es el único sistema que queda intacto para mantener la PA, y la liberación de vasopresina no es un sistema de respuesta rápida en comparación con el sistema nervioso simpático. La administración intravenosa de líquidos es el tratamiento inicial adecuado. Los agentes vasopresores que se utilizan usualmente en quirófano (fenilefrina y efedrina) pueden ser insuficientes si se administran cuando existe bloqueo del sistema SRA, asociado a pérdida del tono simpático que produce la inducción anestésica. Los preparados de vasopresina se han usado para corregir la hipotensión refractaria. © Elsevier. Fotocopiar sin autorización es un delito 16. ¿Cómo produce hipotensión la anestesia regional? Tanto la anestesia subaracnoidea como la epidural producen hipotensión a través del bloqueo simpático y la vasodilatación, aunque el efecto de la anestesia subaracnoidea puede ser más brusco. Los bloqueos por debajo del quinto dermatoma torácico producen menos hipotensión por vasoconstricción compensatoria de las extremidades superiores. Los bloqueos por encima del cuarto dermatoma torácico pueden afectar a los nervios cardioaceleradores, resultando en bradicardia y disminución del gasto cardíaco (veánse los Capítulos 65 y 66). 17. ¿Cómo se evalúa y trata la hipotensión intraoperatoria? La hipotensión brusca requiere un tratamiento rápido antes de que se pueda disponer de toda la información sobre su causa. Se recomienda la administración de agonistas adrenérgicos y líquidos, y disminuir los niveles de anestésicos volátiles o intravenosos. Si la hipotensión es gradual y progresiva, se puede tener tiempo para averiguar su causa, aunque la hipovolemia es la causa más probable. Los efectos de la cirugía, la anestesia y la enfermedad coexistente son dinámicos, y cualquier dato considerado aisladamente puede resultar erróneo. Por tanto, siempre se debe considerar la mayor cantidad de variables que se puedan obtener. Adicionalmente, la frecuencia cardíaca, la PA, la diuresis, el hematocrito, el déficit de base, la concentración de lactato sérico y la respuesta a la administración de líquidos son estimadores valiosos de la causa de la hipotensión. La hipotensión refractaria requiere una monitorización invasiva para obtener información adicional sobre la función y las presiones de llenado cardíaco. 18. Revise los agonistas adrenérgicos estándar empleados para tratar la hipoten­ sión durante la anestesia. Los fármacos más habituales son la fenilefrina y la efedrina. Su empleo se describe en el Capítu­ ­lo 1. Otros inotropos y cronotropos se comentan en el Capítulo 15. 206 Capítulo 28 Trastornos de la presión arterial 19. ¿Cómo se debe tratar la hipotensión debida a isquemia cardíaca? Las consideraciones que se deben tener en cuenta son: Reducir la isquemia aumentando el aporte de oxígeno, disminuyendo la frecuencia cardíaca, y produciendo vasodilatación coronaria con nitroglicerina. Reducir la poscarga cardíaca (el nitroprusiato sódico es un dilatador arterial). Aumentar la contractilidad, utilizando inotropos como dopamina, dobutamina y amrinona. Si todo esto falla, se puede considerar la terapia trombolítica junto con una interconsulta a cardiología. Bibliografía Recomendada 1. Morgan GE, Mikhail MS, Murray MJ, editors: Clinical anesthesiology, ed 4, New York, McGraw-Hill, 2005, ­Chapter 20. 2. Roizen MF, Fleishser LA: Anesthetic implications of concurrent diseases. In Miller RD, editor: Miller’s anesthesia, ed 6, Philadelphia, Elsevier Churchill Livingstone, 2005, pp 1017–1150. Aaron Murray, MD CAPÍTULO 29 Despertar intraoperatorio 1. Revise las clasificaciones de memoria y recuperación de la conciencia intra­ operatorias. Las clasificaciones actuales de memoria intraoperatoria incluyen tanto memoria implícita o inconsciente como memoria explícita o consciente. La memoria explícita se refiere a los recuerdos conscientes de los episodios intraoperatorios que tuvieron lugar durante la anestesia general, también llamada despertar anestésico. Los recuerdos solamente pueden valorarse tras la cirugía. Estos recuerdos pueden producirse con o sin dolor y varían desde experiencias vívidas hasta recuerdos vagos. En 2008 se informó que las percepciones auditivas subjetivas representaron el 50% de las experiencias de recuperación de la conciencia intraoperatoria. Por el contrario, la memoria implícita refleja cambios en el comportamiento o en las actuaciones secundarias a una experiencia intraanestésica sin la capacidad de recordar específicamente el suceso. El asesoramiento práctico de la American Society of Anesthesiologists (ASA) en 2006 con respecto al despertar intraoperatorio excluyó los sueños como experiencias de conciencia anestésica. 2. ¿Cuál es la incidencia de los recuerdos intraoperatorios? La estimación de los recuerdos intraoperatorios en cirugías no obstétricas y no cardíacas es de aproximadamente el 0,1-0,2%. Si se utiliza anestesia superficial, la incidencia aumenta. Durante la cirugía cardíaca la incidencia oscila entre el 1,1 y el 1,5%. También se observa una incidencia más elevada en casos obstétricos (0,4%) y traumáticos (11-43%). Es interesante que, si bien ha disminuido el empleo de técnicas anestésicas asociadas con un aumento de los recuerdos intraoperatorios (p. ej., óxido nitroso-opiáceo), las denuncias contra los anestesiólogos por esta causa van en aumento, llegando a representar recientemente el 2% de todas las reclamaciones. Esta tasa de reclamaciones rivaliza con otras complicaciones frecuentes, como la neumonía por aspiración y el infarto de miocardio. 3. ¿Existen algunas técnicas y situaciones clínicas que tengan más probabilidad de provocar recuerdos intraoperatorios? Los factores de riesgo reconocidos para los recuerdos intraoperatorios son: Planos superficiales de anestesia, que son frecuentes en pacientes hipovolémicos, traumáticos y obstétricos. Antecedentes de recuerdos intraoperatorios. Los pacientes sometidos a cirugía cardíaca con circulación extracorpórea tienen una mayor incidencia de recuerdos postoperatorios (cerca del 1%) por la utilización de anestesia basada en opiáceos, que reduce la depresión miocárdica pero no garantiza la amnesia. Empleo de relajantes musculares. Mal funcionamiento del equipo como vaporizadores vacíos, mal funcionamiento o desconexión de la bomba de infusión de anestesia intravenosa y reposición de jeringuillas cuando se han acabado. Otros riesgos que dependen del paciente son: individuos muy jóvenes, pacientes drogadictos, pacientes con dolor crónico y pacientes con hipernatremia. 4. Describa los signos y síntomas clínicos de la anestesia superficial. La activación de los signos motores y simpáticos puede indicar planos superficiales de anestesia. Los signos motores en respuesta a la anestesia superficial preceden frecuentemente a los cambios hemodinámicos o a la activación simpática. Los signos motores específicos incluyen movimientos del párpado o de los ojos, deglución, tos, muecas faciales y movimientos de las © 2011. Elsevier España, S.L. Reservados todos los derechos 207 208 CAPÍTULO 29 Despertar intraoperatorio e­ xtremidades o de la cabeza. Los esfuerzos respiratorios aumentados se deben a la actividad de los músculos intercostales y abdominales, que se encuentran inhibidos en niveles anestésicos más profundos. Si se utilizan relajantes musculares, los signos motores no proporcionan información sobre la profundidad anestésica. En consecuencia, la activación simpática representa un método adicional para evaluar la anestesia superficial. Los efectos simpáticos asociados con la anestesia superficial son: hipertensión, taquicardia, midriasis, lagrimeo, sudoración y salivación. Estos hallazgos son inespecíficos y se encuentran modificados por los agentes anestésicos; por tanto, su presencia o ausencia no es un indicador fiable del nivel de conciencia. Otras medicaciones perioperatorias, como los bloqueantes b y el bloqueo simpático, hacen que estos signos no sean fiables. De hecho, los signos de anestesia superficial (p. ej., taquicardia, hipertensión) sólo se dan en una minoría de pacientes que se quejan de recuerdos intraoperatorios. P U N T OS CLAVE: Despertar int raoper ato r i o 1. El despertar es más probable en los casos en los que se administran dosis mínimas de anestésicos, como en la circulación extracorpórea, traumatismos y en pacientes obstétricas. 2. Los síntomas de despertar pueden ser muy inespecíficos, especialmente cuando se utilizan relajantes musculares. 3. El pequeño riesgo de recuperación de la conciencia debe comentarse durante el consentimiento informado, especialmente si los pacientes tienen un riesgo más alto de despertar. 5. ¿Cuáles son las consecuencias del despertar intraoperatorio? Los recuerdos intraoperatorios se relacionan de forma importante con la insatisfacción de los pacientes. El dolor no tratado es la forma más perturbadora. Otras son la posibilidad de oír al personal del quirófano, la sensación de debilidad o parálisis, ansiedad, desamparo y miedo a la muerte. Los efectos subsecuentes pueden variar desde trastornos del sueño, ansiedad y depresión hasta trastorno de estrés postraumático (TEPT). Un estudio indicó que los síntomas psicológicos tardíos ocurren en el 33% de los pacientes en el despertar intraoperatorio. Los síntomas del TEPT pueden incluir pesadillas, recuerdos vívidos, comportamiento de evitamiento, bloqueo emocional, hiperactividad durante el sueño y preocupación por la muerte. 6. ¿Cómo se debe abordar a un paciente que ha estado consciente durante la anestesia? Primero, no es necesario preguntarles a todos los pacientes si han recordado algo de la intervención, ya que el recuerdo no es un problema habitual. Darán la información espontáneamente o parecerán enfadados o tristes sin causa aparente, como si algo no fuera bien. En los casos en los que, por alguna razón, tenga dudas, al menos inicialmente, haga preguntas generales y abiertas. Un ejemplo puede ser: «¿Qué es lo último que recuerda?». Una vez se identifica un caso, una nota detallada en la historia clínica es lo apropiado. Escuche la historia del paciente y explique las circunstancias que rodearon su situación (inestabilidad cardiovascular, trauma, etc.). Lo que los pacientes traumáticos pueden recordar es su estancia en la sala de despertar o en cuidados intensivos, pero no necesariamente sucesos intraoperatorios. Reafirme al paciente, excúsese, ofrezca apoyo psicológico, y continúe controlando al paciente, aun después del alta. Notifique el hecho a los cirujanos, a las enfermeras y a los asesores legales del hospital. El ASA Task Force on Intraoperative Awareness no está de acuerdo en que todos los pacientes deban ser advertidos del despertar intraoperatorio durante el consentimiento informado, pero aprueba que las personas en mayor riesgo deban ser informadas antes de la cirugía. 7. ¿Cuáles son los métodos para evitar el despertar intraoperatorio? La premedicación con fármacos amnésicos, como benzodiazepinas o escopolamina, es un método estándar para reducir la probabilidad del despertar intraoperatorio, especialmente en pacientes, cirugías o técnicas anestésicas con riesgo elevado. CAPÍTULO 29 Despertar intraoperatorio 209 Se deben administrar las dosis adecuadas de fármacos inductores y suplementarlas si el manejo de la vía aérea es difícil y no existe la posibilidad de administrar anestésicos inhalatorios. Evite los relajantes musculares a menos que sean necesarios. Suplemente las técnicas a base de opiáceos-óxido nitroso con anestésicos inhalatorios. Intente utilizar una concentración alveolar mínima de anestésico de 0,8 a 1 o mayor, si es posible. Mantenga adecuadamente los equipos de anestesia, asegure una función correcta de la bomba de infusión intravenosa con alarmas de presión/volumen, y administre fármacos anestésicos a través de una vía intravenosa específica y funcional. Considere el uso de monitorización neurofisiológica para evaluar la profundidad de la anestesia. © Elsevier. Fotocopiar sin autorización es un delito 8. ¿Se dispone de monitores para evaluar la profundidad de la anestesia? Se puede utilizar la monitorización de actividad eléctrica cerebral para evaluar la profundidad de la anestesia, e incluye dos categorías: procesado del electroencefalograma (EEGp) y potenciales evocados (p. ej., auditivos). No hay un único monitor que proporcione una respuesta segura e inequívoca a la pregunta de la profundidad anestésica. Puede emplearse la tecnología de las ondas del EEGp de diferentes formatos, que ha entrado en el mercado en mayor grado que los potenciales evocados. La tecnología más conocida se denomina índice biespectral (BIS). El objetivo de cualquiera de estas formas de análisis del EEG es estimar el grado de hipnosis que experimenta el paciente. Los datos recogidos por los electrodos colocados en la zona frontal y temporal son procesados por el módulo en el ordenador para crear una representación numérica adimensional del grado de sedación. Las cifras más bajas se corresponden con una mayor profundidad, mientras que los valores más altos se observan en pacientes despiertos o ligeramente sedados. La incidencia del despertar intraoperatorio en casos de alto riesgo se redujo aproximadamente un 82% (del 0,91 al 0,17%) al administrar anestesia monitorizada por BIS con un BIS objetivo de 40 a 60 durante la anestesia. El uso de BIS durante la anestesia general con relajación muscular concomitante provocó una reducción similar del 77% (del 0,18 al 0,04%) en la incidencia de despertar intraoperatorio. Además de estar aprobado el uso del monitor de BIS por la Food and Drug Administration para evaluar la profundidad de la anestesia, ayuda al anestesiólogo a ajustar mejor la anestesia en cada paciente. La anestesia demasiado profunda se ha asociado con una mayor mortalidad a 1 año en los adultos de edad avanzada, lo cual lleva a los investigadores a la conclusión de que controlar los valores del BIS puede mejorar otros resultados además del despertar intraoperatorio. Si bien una puntuación del BIS menor de 60 puede reducir la probabilidad de recuperar la conciencia, el riesgo no se elimina. Se ha publicado el caso de un paciente con dolor crónico e inestabilidad hemodinámica intraoperatoria que presentó recuerdos vívidos y dolorosos de la cirugía a pesar de tener una puntuación promedio BIS de 44. La ASA Task Force sugiere que la monitorización de la actividad eléctrica cerebral no está indicada de forma rutinaria, pero debe considerarse el uso de monitorización cerebral individualmente en pacientes seleccionados (pacientes con alto riesgo, anestesia general superficial). Bibliografía Recomendada 1. ASA Task Force on Intraoperative Awareness: Practice advisory for intraoperative awareness and brain function monitoring. Anesthesiology 104:847–864, 2006. 2. Bowdle TA: Depth of anesthesia monitoring. Anesthesiol Clin 24:793–822, 2006. 3. Domino KB, Posner KL, Cheney FW: Awareness during anesthesia: a closed claims analysis. Anesthesiology 90:1053–1061, 1999. 4. Errando CL, Sigl JC, Robles M, et al: Awareness with recall during general anaesthesia: a prospective observational study evaluation of 4001 patients. Br J Anaesth 101:178–185, 2008. 5. Mashour GA: Integrating the science of consciousness and anesthesia. Anesth Analg 103:975–982, 2006. 6. Samuelsson P, Brudin L, Sandin RH: Late psychological symptoms after awareness among consecutively included surgical patients. Anesthesiology 106:26–32, 2007. Capítulo 30 Arritmias cardíacas William A. Baker, MD, y Christopher M. Lowery, MD 1. Mencione algunas de las causas de bradicardia sinusal. Las causas incluyen tono vagal elevado, fármacos, hipoxia, hipotiroidismo, disfunción intrínseca del nodo sinusal, trastornos electrolíticos e hipotermia. 2. Un paciente, durante el postoperatorio, desarrolla mareo con bradicardia sinu­ sal y una frecuencia cardíaca de 36. Su presión arterial sistólica es de 83 mmHg. ¿Qué tratamiento se debe realizar? La atropina, 0,5 mg por vía intravenosa, puede ser efectiva y aumentar la frecuencia cardíaca. Adicionalmente, busque datos sobre la causa de la bradicardia, como las mencionadas en la Pregunta 1. 3. ¿Cómo se identifica un bloqueo auriculoventricular de primer grado? El intervalo PR se encuentra anormalmente prolongado (>0,20 s), pero todas las ondas P con­ ducen (o sea, éstas se siguen de un complejo QRS). 4. Describa los tipos de bloqueos auriculoventriculares de segundo grado. Mobitz tipo I (Wenckebach): conformado por un alargamiento progresivo del intervalo PR, seguido por una onda P no conductora, seguido por una onda P conductora con un intervalo PR más corto. Cuando el alargamiento del PR es difícil de identificar, comparar la duración del PR antes y después de la onda P bloqueada puede confirmar el Wenckebach. El nivel del bloqueo se encuentra generalmente en el nodo auriculoventricular (AV) con Mobitz I. Mobitz tipo II: mucho menos habitual que el Wenckebach. En el bloqueo Mobitz II no hay una prolongación progresiva del intervalo PR, que para el primer latido conducido es igual que el intervalo PR antes del latido no conducido. El nivel del bloqueo AV se encuentra, generalmente, por debajo del nodo AV en el Mobitz II, lo cual se refleja por un complejo QRS amplio. Está indicado un marcapasos permanente en los pacientes con bloqueo Mo­ bitz II. Bloqueo AV 2:1: un ritmo en el cual una onda P de cada dos conduce. Ya que no existe la oportunidad de evaluar latidos sucesivos conducidos, el bloqueo AV 2:1 no es ni Mobitz I ni Mobitz II. 5. ¿Qué es un bloqueo auriculoventricular de tercer grado? Este bloqueo también se conoce como bloqueo cardíaco completo, sin ondas P que conduz­ can a los ventrículos. El intervalo RR es regular, a menos que haya complejos ventriculares prematuros. El bloqueo puede ser a nivel del nodo AV (usualmente, con un QRS estrecho) o por debajo del nodo (con un QRS ancho y una frecuencia cardíaca particularmente lenta). El bloqueo cardíaco completo es una forma, pero no la única, de disociación AV. No es infrecuente que un paciente tenga un ritmo en el cual sólo conduzcan ondas P ocasionales, indicado esto por un acortamiento transitorio del intervalo RR. Oficialmente, esto no cons­ tituye un bloqueo cardíaco completo, ya que una onda P sí atraviesa el nodo AV hacia los ventrículos. Esta disociación AV incompleta es habitualmente referida como bloqueo AV de alto grado. 210 © 2011. Elsevier España, S.L. Reservados todos los derechos Capítulo 30 Arritmias cardíacas 211 PUNTOS CLAVE: Causas frecuentes de bradicardia 1. Fármacos. 2. Tono vagal elevado. 3. Trastornos tiroideos y electrolíticos. 4. Degeneración asociada a la edad del nodo sinusal, del nodo AV o del sistema de conducción. 5. Enfermedad estructural del sistema de conducción relacionada con arteriopatía coronaria o hipertrofia ventricular. 6. Además del bloqueo cardíaco completo, ¿qué otras causas de disociación auri­ culoventricular existen? Otras causas incluyen el ritmo de la unión acelerado y la taquicardia ventricular (TV). 7. ¿Cuáles son algunas de las causas de bloqueo auriculoventricular? Al igual que en la disfunción del nodo sinusal, las causas del bloqueo AV pueden ser intrínse­ cas (asociadas con enfermedad cardíaca estructural) o extrínsecas (relacionadas con factores externos). Causas extrínsecas: incluyen fármacos, alteraciones electrolíticas, hipotiroidismo, hipoxia y aumento del tono vagal. Trastornos de la conducción intrínseca: pueden producirse en pacientes con coronariopatía (a veces como una complicación del infarto agudo de miocardio), hipertrofia ventricular, miocarditis, sarcoidosis, cirugía cardíaca reciente (especialmente, cirugía valvular) o dege­ neración calcificada del sistema de conducción. © Elsevier. Fotocopiar sin autorización es un delito 8. Su paciente muestra evidencia transitoria de disfunción tanto sinoauricular como auriculoventricular, con enlentecimiento simultáneo de la frecuencia si­ nusal y un bloqueo auriculoventricular de segundo grado, tipo I. ¿Qué está pa­ sando? El bloqueo sinoauricular (SA) y AV simultáneos aparecen habitualmente con un tono vagal aumentado. Esto se observa con frecuencia en un paciente durante el sueño o en un paciente con síncope de origen vagal. Otra causa es un efecto farmacológico, como el visto con los bloqueantes b o con la adenosina. 9. ¿Qué agentes antihipertensivos deben evitarse en pacientes con una bradicar­ dia significativa o con bloqueo cardíaco? Los bloqueantes b, como el metoprolol y el esmolol, los bloqueantes de los canales del calcio no dihidropiridínicos (verapamilo y diltiazem) y los simpaticolíticos centrales, como la clonidina, deben evitarse. Adicionalmente, el litio y algunos anticonvulsivos pueden producir bradicardia. 10. Mencione algunas de las arritmias que se observan con la toxicidad a la digoxina. La bradicardia sinusal, el bloqueo AV, la taquicardia auricular con bloqueo 2:1, el ritmo de la unión acelerado y la TV se observan con la toxicidad a la digoxina. 11. ¿Siempre es apropiado tratar la taquicardia sinusal con bloqueantes b? No siempre. La taquicardia sinusal puede ser una respuesta a varios estímulos nocivos, y la mejor aproximación es identificar por qué el paciente se encuentra taquicárdico y tratar la cau­ sa subyacente. En algunos casos, como en la isquemia miocárdica debida a hipertensión, los bloqueantes b pueden ser útiles. En otros casos (p. ej., broncoespasmo agudo, edema pulmo­ nar, taponamiento e hipovolemia) los bloqueantes b pueden ser perjudiciales. El dolor, la fiebre, los cambios de volumen intravascular y la anemia son todas causas importantes de taquicardia que se deben considerar en el postoperatorio de un paciente. 212 Capítulo 30 Arritmias cardíacas 12. ¿Qué significa el término taquicardia supraventricular paroxística? La taquicardia supraventricular paroxística (TSVP) es una taquicardia regular, con un inicio y terminación súbitos, que generalmente tiene complejos estrechos. Se puede abortar con manio­ bras vagales, como el masaje del seno carotídeo o la maniobra de Valsalva. Generalmente, la TSVP responde a agentes como la adenosina, los bloqueantes b o el verapamilo, si el ritmo es dependiente del nodo AV. La TSVP es, en realidad, una familia de ritmos específicos que cum­ plen estas características, y que incluyen la taquicardia del nodo AV con reentrada (TNAVR), la taquicardia AV con reentrada (TAVR) y algunos tipos de taquicardia auricular. Otras causas de taquicardias de complejos estrechos se enumeran en la Tabla 30-1. Ta b l a 3 0 - 1 . D i a g n ó s t i c o d i f e r e n c i a l d e u n a ta q u i c a r d i a d e c o m p l e j o estrecho Taquicardia sinusal Flúter auricular Fibrilación auricular Taquicardia auricular multifocal Taquicardia auricular Taquicardia del nodo auriculoventricular con reentrada (TNAVR) Taquicardia auriculoventricular con reentrada (TAVR) Taquicardia de la unión 13. ¿Qué es la taquicardia auricular multifocal? ¿Cuándo se observa? La taquicardia auricular multifocal (TAM) es un ritmo supraventricular, con una frecuencia cardíaca superior a 100, en el que se encuentran por lo menos tres morfologías de onda P diferentes. La TAM suele observarse en pacientes con enfermedad pulmonar significativa o con estados con niveles altos de catecolaminas. 14. ¿Cuál es la principal contraindicación de la adenosina? El broncoespasmo. A pesar de su corta vida media, la adenosina puede provocar exacerbaciones importantes de broncoespasmo, y debe utilizarse con cuidado en los pacientes que tienen histo­ ria de asma o de enfermedad pulmonar obstructiva crónica reactiva. 15. Un paciente desarrolla de repente un ritmo irregular, con una frecuencia car­ díaca de 170. Un electrocardiograma de 12 derivaciones no evidencia ondas P. ¿Cuál es el ritmo más probable? ¿Cómo se debe manejar? El paciente probablemente ha desarrollado una fibrilación auricular con una respuesta ven­ tricular rápida. Si el paciente se encuentra inestable, la cardioversión eléctrica es lo más ade­ cuado. Si los síntomas son leves, la hemodinámica puede mejorar con la reducción de la fre­ cuencia cardíaca (control de frecuencia) con fármacos como el diltiazem o los bloqueantes b. Obsérvese que el control de la frecuencia mediante la administración de dosis moderadas de bloqueantes b está contraindicado en pacientes con disfunción significativa del ventrículo izquierdo que no están recibiendo tratamiento con bloqueantes b. Algunos pacientes son can­ didatos para la cardioversión química con fármacos como la amiodarona, la procainamida o la ibutilida. Esto puede seguirse de cardioversión eléctrica si el antiarrítmico no revierte el ritmo por sí mismo. Los pacientes con fibrilación auricular rápida incoercible que requieren un fármaco vasopresor deberían recibir un fármaco que no incremente aún más la taquicardia. En la mayoría de estos casos la fenilefrina suele preferirse a la dopamina si se debe utilizar un fármaco vasopresor. 16. ¿Es útil la adenosina para el tratamiento de la fibrilación auricular? No. La adenosina no revierte la fibrilación auricular, y su vida media es tan corta (segundos) que la reducción de la frecuencia cardíaca es bastante breve. Para el flúter (aleteo) auricular, la adenosina puede ayudar, ocasionalmente, a hacer más claro el diagnóstico si no es ya evidente en el trazado de base. La adenosina causa un enlentecimiento transitorio del intervalo RR, lo que hace que las ondas de flúter sean más fáciles de identificar. Capítulo 30 Arritmias cardíacas 213 17. ¿Qué se debe hacer para reducir el riesgo de accidente vascular cerebral en un paciente con fibrilación auricular crónica o paroxística? La anticoagulación debe realizarse, generalmente, en casos de fibrilación auricular si no está contraindicada. Para un paciente que recientemente ha sido sometido a un procedimiento inva­ sivo, el cirujano debe involucrarse en la decisión, debido a los riesgos de sangrado que existen durante la anticoagulación. Los pacientes que se encuentran estables, que han estado en fibrilación auricular durante más de 48 horas, no deben someterse a cardioversión, a menos que se hayan anticoagulado durante 3 se­ manas o hayan tenido un ecocardiograma transesofágico (ETE) que excluya un coágulo auricular. 18. ¿Qué es una taquicardia de complejos anchos? ¿Cuál es su diagnóstico dife­ rencial? Una taquicardia de complejo ancho es un ritmo rápido (>100 latidos/min) en el que la duración del QRS es superior a 120 milisegundos. En el diagnóstico diferencial debe hacerse con la TV la taquicardia supraventricular con conducción aberrante y la conducción de la aurícula a los ven­ trículos a través de una vía accesoria (síndrome de Wolff-Parkinson-White [WPW]). P U N TOS CLAVE: Diagn óstico di fe r encial de una ta q uica rdia con comple j os anchos 1. Taquicardia ventricular. 2. Taquicardia supraventricular con conducción aberrante como con un bloqueo de rama. © Elsevier. Fotocopiar sin autorización es un delito 3. Taquicardia con activación de los ventrículos a través de una vía accesoria (síndrome de WPW). 19. Un hombre de 60 años con historia previa de infarto de miocardio de cara ante­ rior desarrolla una taquicardia monomórfica de complejos anchos después de una cirugía no cardíaca. ¿Cuál es el diagnóstico más probable, y qué tratamien­ tos serían o no serían apropiados? En el contexto de una enfermedad cardíaca estructural, debe asumirse que una taquicardia de complejos anchos es una TV hasta que no se demuestre lo contrario. En los pacientes que se encuentran inestables, la cardioversión eléctrica es apropiada. Para los pacientes estables, debe obtenerse un electrocardiograma (ECG) de 12 derivacio­ nes para ayudar en el diagnóstico definitivo. La amiodarona, la procainamida y la lidocaína son opciones terapéuticas razonables en casos de TV monomórfica. Pueden producirse resultados trágicos cuando no se reconoce una TV y se trata como una taquicardia supraventricular de manera errónea. El diltiazem y el verapamilo (que deprimen la contractilidad y disminuyen la presión arterial) pueden poner en peligro la vida de estos pacientes. 20. ¿Qué características de una taquicardia de complejo ancho sugieren una taqui­ cardia ventricular en vez de una taquicardia supraventricular con aberrancia? La disociación AV, si se encuentra presente, confirma el diagnóstico de TV. La capacidad de una onda P para conducir hasta el ventrículo y capturar el ritmo a través de un complejo QRS estrecho es diagnóstica de TV. La concordancia (el QRS enteramente por encima de la línea basal en todas las derivaciones precordiales) se observa en una minoría de casos. Cuando se encuentra presente, la concor­ dancia sugiere de manera importante una TV. Sin embargo, la falta de concordancia es común con TV y no implica que una taquicardia de complejos anchos sea una taquicardia supraven­ tricular con aberrancia. Cuando el intervalo desde el inicio del QRS hasta el final de la onda S es mayor de 100 milisegundos en cualquier derivación precordial, es sugestivo de una TV. 214 Capítulo 30 Arritmias cardíacas El QRS en pacientes con taquicardia supraventricular con aberrancia se muestra usualmente como un bloqueo de rama derecha o izquierda (BRD o BRI). Si no se parece a ninguno de los dos, el ritmo es usualmente una TV. Una onda P antes de cada QRS ancho sugiere una taquicardia supraventricular con abe­ rrancia. En algunos casos, un ECG previo de 12 derivaciones del paciente demuestra la misma morfo­ logía ancha del QRS sin taquicardia, lo que sugiere una taquicardia supraventricular más que una TV. 21. ¿Por qué es importante distinguir entre taquicardia supraventricular monomór­ fica y polimórfica? El diagnóstico diferencial y el tratamiento de cada una son bastante diferentes. La TV monomór­ fica es habitual en pacientes con enfermedad cardíaca estructural (tal como infarto de miocardio previo con onda Q), pero generalmente no se debe a isquemia aguda. La TV polimórfica puede verse en varias situaciones. Los pacientes pueden tener un intervalo QT prolongado asociado con una TV polimórfica, habitualmente denominado torsades de pointes. Esto puede deberse a fármacos, desequilibrios electrolíticos, una predisposición congénita (síndrome de QT largo), bradicardia importante o isquemia de miocardio (Figura 30-1). Figura 30-1. Torsades de pointes. (De Olgin JE, Zipes DP: Specific arrhythmias: diagnosis and treatment. En Libby P et al: Braunwald’s heart disease: a textbook of cardiovascular medicine, ed 8, Philadelphia, 2008, Saunders.) 22. ¿Cómo se trata la torsades de pointes? Si el paciente se encuentra inestable con una TV persistente, se debe realizar cardioversión eléctrica. Si un fármaco (como la procainamida) es sospechoso de ser la causa, su administración debe interrumpirse inmediatamente. Generalmente, debe administrarse magnesio, incluso si los niveles séricos del paciente son normales. Busque y corrija otras alteraciones electrolíticas, como la hipopotasemia. Se debe considerar la isquemia aguda de miocardio y tratarse si se encuentra presente. En algunos casos, el isoproterenol o el marcapasos temporal (para evitar la bradicardia) pue­ den salvar la vida del paciente. El marcapasos es el tratamiento de elección cuando la torsades de pointes es la consecuencia de una bradiarritmia importante, como por ejemplo un bloqueo cardíaco completo. 23. ¿Cómo se tratan los pacientes con síndrome de QT largo congénito y síncope? El síncope en estos individuos puede ser una consecuencia de una torsades de pointes, un tipo de TV. Si no se reconoce y se trata, puede aparecer una recurrencia fatal de la torsades. El tratamiento se realiza generalmente con bloqueantes b y un marcapasos/desfibrilador. Los familiares de los individuos afectados deberán estudiarse para descartar un síndrome de QT largo congénito. Capítulo 30 Arritmias cardíacas 215 24. ¿Son curativos los desfibriladores cardioversores implantables en las arritmias ventriculares? No. Únicamente tratan los episodios con un choque eléctrico o una hiperestimulación con mar­ capasos. Un paciente con TV intratable debe estabilizarse antes de considerar colocarle este dis­ positivo. Muchos pacientes con este dispositivo necesitan terapia farmacológica concomitante para minimizar la TV (y el disparo del aparato). 25. ¿Todos los pacientes con una vía accesoria tienen una onda delta (patrón WPW) en su electrocardiograma de base? No. Muchas vías accesorias conducen solamente de manera retrógrada (del ventrículo a la aurí­ cula) o tienen una conducción anterógrada muy lenta (auricular a ventricular). Estos pacientes pueden o no tener una taquicardia supraventricular de complejo estrecho (TSVCE). En cambio, algunos pacientes tienen una onda delta en el ECG basal, sin síntomas clínicos. En la mayoría de casos, estos pacientes asintomáticos no necesitan tratamiento farma­ cológico ni estudios electrofisiológicos invasivos © Elsevier. Fotocopiar sin autorización es un delito 26. En un paciente de 25 años que presenta palpitaciones, se le encuentra una taqui­ cardia irregular de complejo ancho a una frecuencia de 260. El ascenso del com­ plejo QRS no se detecta nítidamente. La presión arterial es normal, y el paciente se encuentra aparentemente bien. ¿Cuál es el diagnóstico más probable? ¿Qué trata­ mientos están indicados? ¿Qué tratamientos son potencialmente perjudiciales? Probablemente se trata de un caso de fibrilación auricular con síndrome de WPW (Figura 30-2). El QRS ancho es el resultado de la conducción a través de la vía accesoria de la aurícula al miocardio ventricular. En un paciente inestable, la cardioversión eléctrica está indicada. En un paciente estable, la amiodarona o la procainamida son una alternativa razonable. En estos pacientes, evite el uso de la digoxina, los bloqueantes de los canales del calcio, la adenosina y Figura 30-2. Taquicardia irregularmente irregular de complejo ancho en un paciente joven con síndrome de Wolff-Parkinson-White y fibrilación auricular. El complejo QRS es ancho porque los ventrículos se encuentran activados a través de una vía accesoria en vez de a través del nodo auriculoventricular (AV). Los fármacos que bloquean de manera primaria el nodo AV, como la digoxina, el diltiazem, el verapamilo, los bloqueantes b y la adenosina, están contraindicados en esta situación ya que pueden precipitar una fibrilación ventricular. 216 Capítulo 30 Arritmias cardíacas los bloqueantes b. La frecuencia cardíaca puede aumentar, y se ha encontrado fibrilación ven­ tricular causada por los agentes bloqueantes del nodo AV. Está indicada la ablación electiva por radiofrecuencia de la vía. Esto se realiza mediante cateterismo percutáneo por un electrofisiólogo cardíaco. 27. ¿Por qué es importante guardar los trazados electrocardiográficos que docu­ mentan una arritmia? Un cardiólogo o un electrofisiólogo cardíaco podrá proporcionar mucha más información si la arritmia puede diagnosticarse adecuadamente. El inicio y el final del episodio pueden ayudar a determinar el tipo específico de arritmia. Las descripciones generales de la arritmia, como la bradicardia o la taquicardia de complejo ancho, pueden no ser suficientes para facilitar el tratamiento específico. Los artefactos no pueden diagnosticarse a menos que el trazado actual se encuentre disponi­ ble para su análisis. Finalmente, los terceros pagadores (como las compañías aseguradoras) pueden no querer reembolsar los pagos de ciertos aparatos, como los marcapasos y desfi­ briladores, a menos que haya una prueba de la arritmia. P á gina w eb ECG Library http://www.ecglibrary.com/ecghome.html Bibliografía Recomendada 1. ACLS Committee: Management of symptomatic tachycardia and bradycardia. Circulation 112(Suppl):67–77, 2005. 2. Atwood S, Stanton C, Storey-Davenport J: Introduction to basic cardiac dysrhythmias, ed 4, St. Louis, MosbyElsevier, 2008. 3. Goldenberg I, Moss AJ: Long QT syndrome. J Am Coll Cardiol 51:2291–2300, 2008. 4. Lip GY, Tse HF: Management of atrial fibrillation. Lancet 370:604–618, 2007. 5. Surawicz B, Kailans TK: Chou’s electrocardiography in clinical practice: adult and pediatric, ed 6, Philadelphia, Saunders, 2008. 6. Wagner GS: Marriott’s practical electrocardiography, ed 11, Philadelphia, Lippincott, Williams & Wilkins, 2007. 7. Reising S, Kusumoto F, Goldschlager N: Life-threatening arrhythmias in the intensive care uni. J Intensive Care Med 22:3–13, 2007. 8. Olgin JE, Zipes DP: Specific arrhythmias: diagnosis and treatment. In Libby P, et al: Braunwald’s heart disease: a textbook of cardiovascular medicine, ed 8, Philadelphia, 2008, Saunders. James Duke, MD, MBA Capítulo 31 Alteraciones de la temperatura 1. Describa los procesos que contribuyen a la termorregulación. Hay tres fases en la termorregulación: la aferencia sensorial, la integración termorreguladora central y la respuesta eferente. Los distintos receptores se encuentran distribuidos por el cuerpo para detectar el calor y el frío. Los impulsos fríos viajan a centros superiores a través de fibras mielinizadas tipo A-delta, el calor se transmite mediante fibras C no mielinizadas, y la mayoría de la información térmica ascendente viaja cefálicamente a través del tracto espinotalámico anterior. La información térmica se integra en la médula espinal y, centralmente, en el hipotálamo. Dentro de un rango estrecho de temperaturas (el rango umbral), no se emite respuesta eferente alguna por parte del hipotálamo. Por encima y por debajo de ciertos umbrales, se activan los mecanismos eferentes en un intento de disminuir o aumentar la temperatura corporal, respectivamente. Las respuestas al calor son la vasodilatación y la sudoración; las respuestas al frío son la vasoconstricción, temblores y termogénesis no producida por temblor. 2. ¿Qué pacientes tienen riesgo de hipotermia? Todos los pacientes sometidos a anestesia general o neuroaxial, o sencillamente a sedación, presentan riesgo. Los pacientes con un riesgo especial son los ancianos, que tienen disminuido el control vascular autónomo, y los lactantes, que tienen una relación área de superficie/masa elevada. Los pacientes con quemaduras, lesiones de la médula espinal con disfunción autónoma, y alteraciones endocrinas también presentan riesgo. 3. ¿La hipotermia afecta a la supervivencia del paciente? La hipotermia leve (1 a 3 °C) tiene los siguientes efectos: Aumenta la incidencia de infecciones del sitio quirúrgico (ISQ). Aunque éste es un problema multifactorial, se ha observado que la vasoconstricción secundaria a la hipotermia reduce el flujo de sangre a la herida y la muerte bacteriana por parte de los neutrófilos. Aumenta el período de hospitalización al incrementar la probabilidad de ISQ y retrasar la cicatrización. Reduce la función plaquetaria y limita la activación de la cascada de la coagulación, aumentando la pérdida de sangre y los requerimientos transfusionales (algunos autores han demostrado que esto también es una causa de aumento de ISQ). Triplica la incidencia de taquicardia ventricular y episodios cardíacos deletéreos. Prolonga la actividad de los relajantes musculares y los fármacos anestésicos, aumentando la probabilidad de debilidad postoperatoria y prolongando la recuperación postoperatoria. Los efectos fisiopatológicos de la hipotermia se revisan en la Tabla 31-1. 4. Caracterice los diferentes estadios de la hipotermia. La hipotermia es un estado clínico de temperatura corporal subnormal en el cual el cuerpo es incapaz de generar el calor suficiente para mantener una temperatura normal. La hipotermia leve (32-35 °C) va acompañada de depresión leve del sistema nervioso central (disartria, amnesia, ataxia y apatía), disminución de la tasa metabólica basal, taquicardia, vasoconstricción periférica y temblor. © 2011. Elsevier España, S.L. Reservados todos los derechos 217 218 Capítulo 31 Alteraciones de la temperatura La hipotermia moderada (27-32 °C) produce depresión progresiva de la conciencia, disminución de la actividad motora, depresión leve de los signos vitales, arritmias y diuresis por frío. En la hipotermia grave (<27 °C) el paciente puede encontrarse comatoso, arrefléxico y tener los signos vitales significativamente deprimidos. Si no se trata, dicha hipotermia profunda conlleva a la muerte. Ta b l a 3 1 - 1 . E f e c t o s d e l a h i p o t e r m i a e n l o s ó r g a n o s y s i s t e m a s Sistema Efectos Vascular Aumenta la resistencia vascular sistémica y la hipoperfusión periférica; el volumen plasmático disminuye debido a la diuresis del frío Disminuye la frecuencia cardíaca, la contractilidad y el gasto cardíaco, y produce arritmias Aumenta la resistencia vascular pulmonar; disminuye la vasoconstricción pulmonar hipóxica; aumenta los trastornos de la ventilación-perfusión; deprime la ventilación; disminuye el tono del músculo bronquial aumentando el espacio muerto anatómico; la curva de disociación de la oxihemoglobina se desvía a la izquierda Disminuye el flujo sanguíneo renal y la tasa de filtración glomerular; altera la reabsorción de sodio y la diuresis, llevando a hipovolemia Disminuye el flujo sanguíneo hepático, y la función metabólica y excretora Disminuye el flujo sanguíneo cerebral; aumenta la resistencia cerebral vascular; el consumo de oxígeno disminuye en un 7%/°C; las latencias de los potenciales evocados aumentan; la CAM disminuye Disminuye la agregación plaquetaria y la actividad de los factores de coagulación; aumenta la viscosidad sanguínea; lesiona la respuesta inmunitaria La tasa metabólica basal disminuye; hiperglicemia e insulinopenia; disminución del consumo de oxígeno y de la producción de CO2 Aumento de la infección de las heridas Cardíaco Pulmonar Renal Hepático SNC Hematológico Metabólico Cicatrización CAM, concentración alveolar mínima; SNC, sistema nervioso central. 5. ¿Qué episodios perioperatorios predisponen al paciente a la hipotermia? La pérdida de calor es habitual en todos los pacientes durante la anestesia general debido a la vasodilatación periférica, la alteración de la termorregulación y la incapacidad para generar calor mediante el temblor. La anestesia general amplía el rango umbral, y, como la respuesta termorreguladora es mucho menos eficaz, la temperatura corporal cambia pasivamente con los gradientes de temperatura existentes. La hipotermia también aparece durante la anestesia neuroaxial, y es un resultado del bloqueo simpático, de la relajación muscular y de una falta de información sensorial aferente a los centros de termorregulación central. Capítulo 31 Alteraciones de la temperatura 219 6. ¿Qué procesos físicos contribuyen a la pérdida de calor del paciente en el qui­ rófano? Radiación: la disipación del calor por el ambiente más frío, que causa cerca del 60% de la pérdida de calor de un paciente, dependiendo del flujo sanguíneo cutáneo y del área de superficie corporal expuesta. Evaporación: la energía requerida para vaporizar el líquido de cualquier superficie, ya sea la piel, la serosa o las membranas mucosas. Corresponde al 20% de pérdida de calor, y es una función del área de superficie expuesta y de la humedad relativa. Convección: es responsable de cerca del 15% de pérdida de calor y depende del flujo aéreo sobre la superficie expuesta. Conducción: describe la transferencia de calor entre superficies adyacentes; corresponde a cerca del 5% de la pérdida total de calor, y es una función del gradiente de temperatura y de la conductividad térmica. 7. De manera práctica, ¿qué acciones sobre un paciente en el quirófano hacen que aumente la pérdida de calor? Los quirófanos fríos, las soluciones intravenosas y las soluciones para desinfección frías, y la exposición del paciente al ambiente contribuyen de manera significativa a la hipotermia. La pérdida de calor cutánea es proporcional al área de la superficie expuesta y corresponde al 90% de la pérdida de calor. Una unidad de sangre refrigerada o 1 litro de cristaloides a temperatura ambiente disminuyen la temperatura corporal en cerca de 0,25 °C. Los efectos de la anestesia general, la anestesia regional y el bloqueo neuromuscular ya se han indicado. Menos del 10% de pérdida de calor se produce a través del tracto respiratorio. © Elsevier. Fotocopiar sin autorización es un delito 8. ¿Deberían recibir todos los pacientes monitorización de la temperatura dentro del quirófano? ¿Cuáles son las zonas adecuadas para monitorizar la temperatura? Las guías de monitorización anestésica mínima de la American Society of Anesthesiologists afirman: «todo paciente anestesiado debe tener una monitorización de la temperatura siempre que se esperen, anticipen o sospechen cambios clínicos significativos en la temperatura corporal». Las zonas para monitorizar la temperatura son la piel, el recto, el esófago, el conducto auditivo externo, la nasofaringe, la vejiga o el catéter de la arteria pulmonar. 9. Revise la termogénesis producida y no producida por temblores. El temblor es la contracción espontánea, asincrónica y desordenada de los músculos esqueléticos en un intento de aumentar la tasa metabólica basal. Los temblores o escalofríos están modulados a través del hipotálamo, y pueden aumentar la producción corporal de calor hasta en un 300% en individuos jóvenes y musculosos. El temblor aumenta el consumo de oxígeno y la producción de CO2. Este efecto puede ser indeseable en un paciente con enfermedad coronaria o insuficiencia pulmonar. Los niños menores de 3 meses de edad no pueden temblar, y tienen una respuesta calórica mediante termogénesis sin temblor, lo cual aumenta la producción de calor metabólico sin producir trabajo mecánico. El músculo esquelético y el tejido graso pardo son las principales fuentes de energía para este proceso. 10. Describa las manifestaciones electrocardiográficas de la hipotermia. La hipotermia leve puede estar asociada con bradicardia sinusal únicamente. La hipotermia moderada puede resultar en intervalos QT prolongados, complejos QRS ensanchados y un intervalo QT prolongado. Por debajo de 32 °C, puede observarse una elevación de la unión de los segmentos QRS y ST, conocida como la joroba hipotérmica, o la onda Osborn u onda J. Su tamaño aumenta a medida que desciende la temperatura corporal; se ve usualmente en las derivaciones II y V6, y puede extenderse a las derivaciones V3 y V4. La onda J no es específica de hipotermia; también puede encontrarse en las lesiones hipotalámicas y en la isquemia cardíaca. Los ritmos nodales son frecuentes por debajo de 30 °C. Por debajo de 28 °C también pueden aparecer extrasístoles ventriculares, bloqueos auriculoventriculares y fibrilación auricular o ventricular espontáneas. La fibrilación ventricular o la asistolia por debajo de 28 °C normalmente no responde a la atropina, a la desfibrilación o al marcapasos. Las maniobras de reanimación deben mantenerse hasta que el paciente se caliente. 220 Capítulo 31 Alteraciones de la temperatura PUNTOS CLAVE: ALTERACIONES de la temperatura 1. La hipotermia es un episodio extremadamente frecuente en el quirófano ya que el ambiente y los efectos de los anestésicos aumentan la pérdida de calor. Los anestésicos también reducen la capacidad para generar una respuesta frente a la hipotermia (temblores y vasoconstricción). 2. Incluso una hipotermia leve tiene un efecto negativo en la evolución del paciente, aumentando las tasas de infección, retrasando la cicatrización, aumentando las pérdidas de sangre y aumentando la morbilidad cardíaca. 3. El mejor método para tratar la hipotermia es el uso de mantas calentadoras de aire forzado. Calentar todos los líquidos y los hemoderivados. Cubrir todas las superficies corporales posibles, incluida la cabeza, para reducir aún más la pérdida de calor. 11. ¿Cómo afecta la hipotermia a los efectos y al metabolismo de los fármacos usa­ dos en el ámbito perioperatorio? Los efectos de los fármacos se encuentran prolongados debido al descenso del flujo sanguíneo hepático y del metabolismo, así como al descenso del flujo sanguíneo y del aclaramiento renal. La unión a las proteínas aumenta a medida que la temperatura corporal disminuye. La concentración alveolar mínima de los agentes inhalatorios se ve disminuida en cerca del 5-7% por cada grado que desciende la temperatura corporal central. Los efectos de los agentes sedantes también disminuyen la temperatura. La hipotermia puede prolongar la duración de los relajantes musculares debido a la disminución de su metabolismo. La hipotermia retrasa el alta de la sala de cuidados postanestésicos y puede prolongar la necesidad de ventilación mecánica. 12. Explique los métodos de recalentamiento. Recalentamiento pasivo: utiliza la habilidad del cuerpo para producir calor si se reduce la pérdida continua de calor cubriendo las áreas expuestas. Como el recalentamiento pasivo se apoya en la termogénesis relacionada con el temblor, los mecanismos hipotalámicos deben estar intactos, y deben existir depósitos suficientes de glucógeno. Recalentamiento activo: se realiza dentro del quirófano, e incluye la elevación de la temperatura ambiente, la administración de líquidos intravenosos calentados y el calentamiento con calor radiante. Los aparatos de calentamiento con aire forzado son especialmente útiles y superiores a las mantas de agua circulante. El calentamiento de la vía aérea es menos efectivo, ya que el contenido de calor de los gases es bajo. La sangre se puede extraer de la arteria femoral, hacer circular por un circuito de calentamiento y ser devuelta a la vena femoral, e incluso puede usarse el recalentamiento extracorpóreo con cortocircuito cardiopulmonar. Puede producirse una nueva disminución de la temperatura central (una disminución secundaria en la temperatura central aumentada con recalentamiento) por el regreso de la sangre fría desde la periferia. 13. Defina la hipertermia. La hipertermia es una elevación de la temperatura corporal de 2 °C por hora. Ya que es infrecuente en el quirófano, su causa debe investigarse. La causa usual es la sepsis o el sobrecalentamiento. Las lesiones hipotalámicas y el hipertiroidismo son menos frecuentes. La hipertermia maligna es un motivo de preocupación, ya que está causada por anestésicos halogenados o por succinilcolina, y puede ser mortal si no se trata. 14. Describa las manifestaciones de la hipertermia. La hipertermia es un estado hipermetabólico asociado con un aumento del consumo de oxígeno, aumento de la ventilación minuto, sudoración, taquicardia y vasodilatación. Un paciente despierto puede sentir malestar general, náuseas y mareos. Con la hipertermia prolongada el paciente puede quedar exhausto o presentar «golpe de calor». En el paciente anestesiado, los signos y Capítulo 31 Alteraciones de la temperatura 221 síntomas incluyen taquicardia, hipertensión, aumento del CO2 espirado, aumento del metabolismo de los fármacos, rabdomiólisis, oliguria e hipovolemia. La frecuencia cardíaca aumenta en 10 latidos por minuto por cada aumento de un grado centígrado en la temperatura. 15. ¿Qué estados se encuentran asociados con la hipertermia? La hipertermia maligna, como ya se ha comentado en el Capítulo 46. Estados hipermetabólicos, incluyendo sepsis, tirotoxicosis y feocromocitoma. Lesiones hipotalámicas secundarias a traumatismo, anoxia o tumor. Síndrome neuroléptico maligno. Reacción transfusional. Medicaciones. 16. ¿Qué fármacos aumentan el riesgo de hipertermia? Los fármacos simpaticomiméticos, los inhibidores de la monoaminooxidasa, la cocaína, las anfetaminas y los antidepresivos tricíclicos aumentan la tasa metabólica basal y la producción de calor. Los anticolinérgicos y los antihistamínicos pueden elevar la temperatura mediante la supresión de la sudoración. 17. ¿Cuáles son los efectos farmacológicos de la hipertermia? Los aumentos en la tasa metabólica basal y el metabolismo hepático disminuyen la vida media de los fármacos anestésicos. Los requerimientos anestésicos pueden verse aumentados. 18. ¿Cuál es el tratamiento para el paciente hipertérmico en el quirófano? Dejar al descubierto las superficies cutáneas y utilizar sábanas enfriadoras y sueros intravenosos fríos. Se deben descartar las causas corregibles de hiperpirexia. Considere la administración de antipiréticos, aunque siempre es mejor tratar la causa, en vez de los síntomas. P á gina w eb http://www.asahq.org/publicationsAndServices/standards/ Bibliografía Recomendada 1. Mauermann WJ, Nenergut EC: The anesthesiologist’s role in the prevention of surgical site infections. Anesthesiology 105:413–421, 2006. © Elsevier. Fotocopiar sin autorización es un delito 2. Rajagopalan S, Mascha E, Na J, et al: The effects of mild perioperative hypothermia on blood loss and the transfusion requirement. Anesthesiology 108:71–77, 2008. 3. Sessler DI: Temperature monitoring and perioperatiave thermoregulation. Anesthesiology 109:318–338, 2008. Capítulo 32 Cuidados postanestésicos Michael M. Sawyer, MD 1. ¿Qué pacientes deben ser atendidos en una unidad de recuperación post­ anestésica? La atención en una unidad de recuperación postanestésica (URPA) se divide tradicionalmente en la fase 1, durante la cual la intensidad de monitorización y de personal son equivalentes a una unidad de cuidados intensivos, y la fase 2, durante la cual se hace una transición de la observación intensiva a la estabilización para la atención en una sala de hospitalización quirúrgica o en el domicilio. El concepto de recuperación rápida (fast-track) está en aumento debido a los fármacos anestésicos de recuperación rápida y a los fármacos asociados. La mayoría de los pacientes que han sido sometidos a monitorización más sedación o anestesia regional de las extremidades serán pacientes apropiados para la recuperación rápida, saltándose la fase 1. Sin embargo, es típico que tras la administración de anestesia general inhalatoria o anestesia regional neuroaxial se requiera un período de atención de fase 1. La presencia de enfermedad preexistente, el procedimiento quirúrgico y las implicaciones farmacológicas de la anestesia utilizada determinan en última instancia la secuencia más adecuada de cuidados postoperatorios para cada paciente. 2. Revise las consideraciones importantes durante el traslado del paciente desde el quirófano hasta la unidad de recuperación postanestésica. El traslado desde el quirófano hasta la URPA puede ser un momento peligroso para los pacientes. Los diseños recientes de las URPA se hacen teniendo en cuenta el hacer este traslado lo más corto posible. Sin embargo, muchos centros siguen disponiendo de URPA situadas lejos de los quirófanos. Esto también ha sido tema de debate con el desarrollo de nuevas localizaciones satélite donde se realizan anestesias (p. ej., resonancia magnética). Antes de trasladar a un paciente, éste debe mantener una vía aérea permeable con respiración espontánea. Se recomienda el uso de oxígeno suplementario durante el traslado. Los pacientes más complicados necesitan monitorización durante el traslado para facilitar una valoración más estrecha. 3. Describa el proceso del ingreso en la unidad de recuperación postanestésica. El anestesiólogo informa a la enfermera de la URPA, revisando el estado de salud anterior del paciente, la intervención quirúrgica, los episodios intraoperatorios, los fármacos empleados y el curso anestésico. El empleo de relajantes musculares y la reversión del bloqueo neuromuscular, las intervenciones intraoperatorias destinadas a la analgesia, y los líquidos y hemoderivados intraoperatorios administrados permiten planificar los cuidados en la URPA. La evaluación inicial del paciente por parte de la enfermera de la URPA incluye las constantes vitales, la respuesta basal y la idoneidad de la ventilación y de la analgesia. Se han utilizados diferentes sistemas de puntuación para obtener una puntuación numérica de las observaciones subjetivas como indicadores del progreso hacia el traslado. La escala de evaluación Aldrete (Tabla 32-1) registra cinco observaciones: actividad, esfuerzo respiratorio, circulación, conciencia y oxigenación. Las puntuaciones de cada uno van de 0 a 2, y una puntuación total de 8 a 10 indica disposición para el traslado a la siguiente fase de cuidados. La regresión del bloqueo motor en el caso de la anestesia regional también es un determinante importante de la evaluación del traslado. 4. ¿Qué monitores deberían utilizarse de forma rutinaria en la unidad de recupera­ ción postanestésica? El nivel de los cuidados dependerá del estado clínico del paciente. La pulsioximetría y la monitorización intermitente de la presión arterial deben utilizarse de forma rutinaria en todos los pacientes. Es interesante destacar que no se ha observado que la monitorización rutinaria del electrocardio- 222 © 2011. Elsevier España, S.L. Reservados todos los derechos Capítulo 32 Cuidados postanestésicos 223 Ta b l a 3 2 - 1 . P u n t u a c i ó n d e A l d r e t e Actividad Respiración Circulación Consciencia Saturación de O2 Capaz de mover las cuatro extremidades Capaz de mover dos extremidades Incapaz de mover las extremidades de forma voluntaria o cuando se le ordena Capaz de respirar y toser Disnea o limitaciones en la respiración Apneico PA ± 20% del nivel preanestésico PA ± 21-49% del nivel preanestésico PA ± 50% del nivel preanestésico Totalmente despierto Se despierta cuando le llaman No responde La saturación de O2 se mantiene >92% en aire ambiente Necesita O2 para mantener la saturación de O2 >90% Saturación de O2 < 90% con O2 suplementario 2 1 0 2 1 0 2 1 0 2 1 0 2 1 0 PA, presión arterial. Adaptado de Aldrete AJ, Krovlik D: The postanesthetic recovery score, Anesth Analg 49:924-933, 1970. © Elsevier. Fotocopiar sin autorización es un delito grama (ECG) sea útil en pacientes sin factores de riesgo de enfermedad coronaria. Por último, la temperatura, la diuresis y el drenaje quirúrgico requieren la monitorización adecuada. 5. ¿Qué problemas deben resolverse durante la recuperación postanestésica? Hipoventilación: el paciente debe estar respirando fácilmente, ser capaz de toser cuando se le pide y debe estar oxigenando a los niveles preanestésicos. Estabilidad hemodinámica: la presión arterial debe estar dentro del 20% de los valores preanestésicos, con una frecuencia y ritmo cardíacos estables. Sensorio disminuido: el paciente debe estar completamente despierto y moviendo de forma voluntaria todas las extremidades. Dolor postoperatorio: el control del dolor no debe requerir una intervención continua por parte de enfermería. Náuseas y vómitos postoperatorios (NVPO): las NVPO deben tratarse de forma enérgica dado que se asocian con una estancia prolongada en la URPA y con una reducción de la satisfacción del paciente con la experiencia perioperatoria. 6. ¿Cómo afecta de manera adversa la anestesia a la ventilación? El bloqueo neuromuscular residual, los efectos de los opioides y los efectos residuales de la anestesia inhalatoria pueden provocar una hipoventilación postoperatoria (Tabla 32-2). 7. Describa los signos de bloqueo neuromuscular residual. El paciente parece hipotónico, con una actividad de los músculos respiratorios poco coordinada e ineficaz. El paciente puede referir que le cuesta respirar y que los intentos por administrarle oxígeno suplementario le resultan sofocantes. El paciente es incapaz de sostener la cabeza levantada o de apretar la mano. En el peor de los casos, la debilidad de los músculos faríngeos provoca el colapso de la vía aérea superior y una obstrucción respiratoria postextubación. Ni la existencia de una buena respuesta a la estimulación «tren de cuatro» en el quirófano o una ventilación rítmica espontánea antes de la extubación descartan un bloqueo neuromuscular residual. 224 Capítulo 32 Cuidados postanestésicos Ta b l a 3 2 - 2 . P r o b l e m a s c o n l a v e n t i l a c i ó n e n l a u n i d a d d e r e c u p e r a c i ó n p o s ta n e s t é s i c a Problema Síntomas Tratamiento Bloqueo neuromuscular residual Sedación por opioides Esfuerzo respiratorio ineficaz y descoordinado Ventilación lenta, sedado y difícil de despertar Neostigmina, 0,05 mg/kg i.v. Anestesia inhalatoria residual Somnoliento, respiración superficial Favorecer la respiración profunda Soporte respiratorio, naloxona 0,04-0,4 mg i.v. 8. ¿Cómo afectan los opioides y los anestésicos halogenados residuales a la res­ piración? La respiración lenta y rítmica o las pausas apneicas en un paciente que es difícil de despertar sugieren un efecto opioide residual. A diferencia del paciente con relajación muscular residual, el paciente con opioides está indiferente a su ventilación a pesar de la hipoxia evidente. La hipoventilación también retrasa la eliminación de los anestésicos inhalatorios, potenciando la hipoventilación. Pueden observarse grados sorprendentes de hipercapnia, incluso con valores de pulsioximetría relativamente normales cuando se administra oxígeno suplementario. 9. ¿Cómo se deben tratar estas causas de hipoventilación? La hipoventilación por bloqueo neuromuscular residual debe tratarse de manera urgente y enérgica. Los fármacos reversores deben administrarse en dosis fraccionadas hasta alcanzar las dosis máximas usuales. Las decisiones terapéuticas para los efectos residuales de los opioides pueden resultar más problemáticas. Los antagonistas de los opioides utilizados para apoyar la ventilación revierten la analgesia adecuada. Los analgésicos opioides agonistas/antagonistas pocas veces producen una mejoría neta en la ventilación cuando se usan para la reversión de la hipoventilación inducida. Habitualmente las mejores alternativas son el soporte ventilatorio con cánulas orales o nasales y la estimulación continua hasta que se hayan resuelto los efectos clínicos del opioide sobre la ventilación y la respuesta a la estimulación. Otras medidas de soporte son aumentar la fracción inspirada de oxígeno (FiO2) cambiando de cánula nasal a mascarilla (Tabla 32-3). Sin embargo, una advertencia importante: el aumento de la FiO2 no revierte la hipoventilación, solamente la enmascara. Ta b l a 3 2 - 3 . P r e d i cc i ó n d e l a F i O 2 c o n a d m i n i s t r a c i ó n d e o x í g e n o s u p l e m e n ta r i o Sistema Flujo suministrado (l/min) Predicción de FiO2 Cánula nasal Cánula nasal Mascarilla Mascarilla con reinhalación parcial Mascarilla con reinhalación total 2 4 6 6 0,28 0,36 0,50 0,6 8 0,8 FiO2, fracción de oxígeno inspirado. Capítulo 32 Cuidados postanestésicos 225 10. El paciente ha sido trasladado a la unidad de recuperación postanestésica. La saturación de oxígeno está en el rango superior de los 80, y el movimiento de la pared torácica no es adecuado. ¿Cómo debería tratarse al paciente? Es necesario establecer una vía aérea permeable (elevación del mentón, subluxación de la mandíbula) y administrar oxígeno. Aspirar la vía aérea del paciente si es necesario. ¿La tráquea está en la línea media? Una vez la vía aérea es permeable, observe y ausculte el tórax. ¿El paciente está hipoventilando? Quizá sea necesario revertir el efecto de los opioides. ¿El abdomen se distiende y el tórax se retrae durante la inspiración (respiración paradójica), lo que sugeriría una obstrucción de la vía aérea o una reversión insuficiente del bloqueo neuromuscular? Evalúe la fuerza del paciente mediante el apretón de manos o manteniendo la cabeza levantada. ¿Existen sibilancias o estertores que requieran la administración de agonistas β inhalados o forzar la diuresis? Palpe los pulsos y ausculte el corazón porque la desaturación de oxígeno puede causar depresión circulatoria. Es posible que el paciente requiera ventilación asistida o reintubación. La mayor parte de las hipoxias producidas en la URPA están causadas por atelectasias, que se tratan sentando al paciente en posición erguida, pidiéndole que respire profundamente y tosa, y mediante espirometría incentivada y presión continua positiva (BIPAP) nasal. © Elsevier. Fotocopiar sin autorización es un delito 11. El paciente presenta estridor respiratorio. Describa la causa más probable y el tratamiento más adecuado. Una causa probable de estridor respiratorio durante la postextubación temprana es el laringoespasmo, aunque deben descartarse otras causas de obstrucción de vías aéreas superiores (p. ej., crup postextubación, hematomas expansivos, inflamación de los tejidos blandos). El laringoespasmo puede desencadenarse por la extubación durante planos ligeros de anestesia o caída de secreciones en las cuerdas vocales. Si el laringoespasmo es incompleto, el paciente tendrá estridor respiratorio. Si el laringoespasmo es completo, el movimiento aéreo es casi inexistente, y los sonidos respiratorios estarán ausentes. La evaluación de la obstrucción de las vías aéreas se ve facilitada por la observación del tórax y la pared abdominal. Los movimientos paradójicos en los que el tórax se contrae mientras el abdomen se expande sugieren que se está intentando inspirar a través de una glotis cerrada o alguna otra forma de obstrucción de la vía aérea. 12. ¿Cómo se trata el laringoespasmo? El tratamiento del laringoespasmo consiste en apoyar la ventilación. Llame a un ayudante, levante el mentón, y ayude a los esfuerzos inspiratorios del paciente con ventilación de presión positiva, utilizando oxígeno al 100%. Si todo esto no da resultado, administre succinilcolina, 0,15 a 0,30 mg/kg (unos 10 a 20 mg en adultos), para relajar las cuerdas vocales. (Yo he tenido éxito con incluso 5 mg de succinilcolina administrados por vía intravenosa a un adulto: en este caso, poco hace mucho y además tiene la ventaja de que el diafragma y los músculos accesorios de la respiración siguen siendo funcionales.) Si el paciente sigue teniendo dificultades con la ventilación, puede ser necesario reintubar tras la administración de aproximadamente 100 mg de succinilcolina. Una vez se ha logrado la intubación y se ha verificado el CO2 teleespiratorio, el paciente debe recibir ventilación asistida. Se debe administrar la sedación adecuada. Cuando se intenta la reextubación, hay que estar preparados para una posible recurrencia del laringoespasmo. Si el estridor respiratorio está causado por un edema laríngeo, puede estar indicada la administración de adrenalina racémica en nebulización y corticoesteroides intravenosos. 13. El laringoespasmo se resuelve. La auscultación torácica revela estertores bila­ terales. ¿Cuál es la causa más probable? Aunque deben descartarse la insuficiencia cardíaca congestiva, la sobrecarga hídrica, el síndrome de distrés respiratorio del adulto y la aspiración de contenido gástrico, la causa más probable es el edema pulmonar por presión negativa (EPPN). El EPPN aparece por la generación de presiones intrapleurales negativas cuando el paciente inspira con una glotis cerrada u obstruida. Si bien las presiones intrapleurales varían de –5 a –10 cmH2O durante un ciclo respiratorio normal, la inspiración con una glotis cerrada puede generar entre ∼–50 y ∼-100 cmH2O de presión. Estos aumentos de presión negativa incrementan el retorno venoso al tórax y a los vasos pulmonares, aumentando el gradiente de presión hidrostática transcapilar y provocando el edema pulmonar. El inicio del edema se ha observado entre 3 y 150 minutos tras el episodio que 226 Capítulo 32 Cuidados postanestésicos lo provoca. Algunos autores denominan a este síndrome lesión pulmonar por presión negativa (LPPN) dado que las secreciones pulmonares rosadas o francamente sanguinolentas sugieren que se ha producido cierto grado de lesión alveolar durante los intentos por respirar con una glotis cerrada. 14. ¿Cómo se trata el edema pulmonar por presión negativa? Una vez se ha aliviado la obstrucción, el tratamiento es sintomático. El edema pulmonar suele resolverse en 12-24 horas. En ocasiones puede ser necesario el tratamiento continuado con oxígeno, con presión positiva continua y con ventilación mecánica con presión positiva teleespiratoria, en función de la gravedad del trastorno de intercambio gaseoso. Los diuréticos solamente deberían administrarse si el paciente presenta una sobrecarga de líquido intravascular o quizá en los casos más graves. P U N TOS CLAVE: C ui dados y co m pli caci ones postanest és icos 1. Los cuidados postanestésicos forman parte del proceso continuado de cuidados perioperatorios y son responsabilidad del anestesiólogo. 2. Una oxigenación adecuada, el dolor postoperatorio y las NVPO son problemas habituales que retrasan el alta de la URPA. 15. Describa un protocolo para la evaluación de la hipertensión y la taquicardia postoperatorias. Una fase hiperdinámica postoperatoria no es un suceso infrecuente. Entre las causas observadas con frecuencia y fácilmente tratables se encuentran: dolor, hipoventilación, hipercapnia, hipotermia con temblores, distensión vesical e hipertensión esencial. Asimismo es necesario considerar la hipoxemia, la hipertermia y sus causas, la anemia, la hipoglicemia, las taquiarritmias, el síndrome de abstinencia (p. ej., farmacológica y alcohólica), la isquemia miocárdica, la administración de medicaciones anteriores y las enfermedades coexistentes. Raramente el estado hiperdinámico puede ser reflejo de hipertiroidismo, feocromocitoma o hipertermia maligna. 16. ¿Qué puede causar hipotensión en la fase postoperatoria? Una pérdida de sangre anterior o actual, el secuestro de líquidos en el tercer compartimento y una reposición insuficiente de la volemia se manifiestan en forma de hipotensión. La isquemia miocárdica o la insuficiencia cardíaca pueden presentarse como hipotensión, al igual que la sepsis o la anafilaxia. 17. ¿Cómo debe tratarse la hipotensión? Considere el tipo de intervención quirúrgica, los sucesos intraoperatorios, los fármacos y los antecedentes. Evalúe la pérdida de sangre y la diuresis. Revise el ritmo cardíaco en el ECG y considere realizar un ECG de 12 derivaciones. La expansión del volumen con soluciones cristaloides balanceadas es el tratamiento de primera línea. La elevación de las piernas y la posición de Trendelenburg pueden ser útiles de forma transitoria. Las circunstancias pueden requerir la administración de coloides o concentrados de hematíes. Si la expansión del volumen intravascular no resulta satisfactoria, puede ser necesario administrar vasopresores o inotropos, pero el empleo de estos fármacos necesita una mayor evaluación. 18. ¿Bajo qué circunstancias un paciente tarda en despertar? La suposición inicial es que en estos pacientes quedan efectos residuales de un fármaco. Si la disminución de la conciencia persiste más allá de un período razonable de observación, debe plantearse la presencia de causas ventilatorias, metabólicas o que afecten al sistema nervioso central (SNC). ¿El paciente tiene antecedentes de convulsiones y está en fase postictal? Debe considerarse una isquemia del SNC provocada por la disminución de la perfusión o por fenó- Capítulo 32 Cuidados postanestésicos 227 menos embólicos. ¿El paciente ha tenido episodios isquémicos del SNC o ictus documentados? La analítica debe incluir la gasometría arterial así como determinaciones de los niveles séricos de sodio y glucosa. Si éstos son normales, quizá sea necesario realizar una tomografía computarizada cerebral. 19. Comente los aspectos que rodean a la aparición de náuseas y vómitos post­ operatorios. Las NVPO siguen siendo un problema significativo y complejo tras la anestesia. Retrasan el alta de la URPA y provocan ingresos hospitalarios no previstos, y son una causa recurrente de insatisfacción del paciente. Tanto el procedimiento quirúrgico como los fármacos anestésicos utilizados pueden aumentar el riesgo de NVPO. Los procedimientos de riesgo son la cirugía laparoscópica, la cirugía de los genitales, las craneotomías y las intervenciones realizadas en hombros, oído medio o músculos oculares. Los factores propios del paciente son el sexo femenino, no fumador, NVPO previos o antecedentes de cinetosis y niños en edad escolar. Los fármacos anestésicos que se asocian con mayor frecuencia con NVPO son los opioides, los anestésicos halogenados y el óxido nitroso. El propofol tiene la incidencia más baja entre los fármacos inductores y se ha utilizado de forma eficaz como medicación de rescate. La evaluación del riesgo debe hacerse basándose en estos factores, y el tratamiento profiláctico o la alteración del plan anestésico dependen de los datos de la eficacia. El rescate de las NVPO (es decir, el tratamiento una vez se han presentado NVPO) requiere un equilibrio entre los efectos beneficiosos del tratamiento y sus efectos secundarios y coste. 20. ¿Deben recibir los pacientes ambulatorios un tratamiento diferente en la unidad de recuperación postanestésica? El objetivo de los cuidados postanestésicos de los pacientes ambulatorios es conseguir que esté listo para salir a la calle. El dolor debe tratarse con fármacos de acción corta como el fentanilo. Cuando sea posible se emplearán analgesia no opioide y bloqueos nerviosos. En la fase 2 de la recuperación debe utilizarse la analgesia oral, tal como se ha prescrito para el postoperatorio en domicilio. Después de la anestesia regional, las extremidades deben protegerse si se moviliza al paciente, y la deambulación debe ser asistida si las paresias segmentarias transitorias hacen que el movimiento sea inestable. Ningún paciente quirúrgico ambulatorio debe ser dado de alta después de recibir medicación sedante sin un acompañante, para garantizar su traslado seguro a su lugar de residencia. © Elsevier. Fotocopiar sin autorización es un delito 21. ¿Es necesario que los pacientes ambulatorios toleren la ingesta oral antes de ser dados de alta de la unidad de recuperación postanestésica? La tolerancia de líquidos claros antes del alta puede alargar la permanencia en la URPA. No está claro que la capacidad para tolerar líquidos claros disminuya la evolución adversa y en estos momentos no se recomienda como requerimiento para el alta de una URPA. Sin embargo, puede ser útil en pacientes seleccionados. 22. Un paciente ha sido sometido a anestesia general para una intervención am­ bulatoria. La recuperación ha transcurrido sin problemas, pero el paciente no tiene a nadie que lo lleve a casa. ¿Qué debe hacerse? Debe solicitarse a los pacientes que dispongan de un acompañante que los lleve a casa tras la anestesia, pues se ha demostrado que reduce los sucesos adversos. La persona responsable podrá informar rápidamente de cualquier episodio adverso que se produzca. El paciente en este caso debe permanecer en el centro sanitario, posiblemente bajo observación la primera noche o hasta que disponga de un acompañante. 23. Al diseñar una unidad de recuperación postanestésica para un nuevo centro quirúrgico ambulatorio, el consejo de administración quiere que todos los pa­ cientes permanezcan en dicha unidad como mínimo durante 1 hora para su recuperación. ¿Esta estancia mínima es razonable? Aunque este período pueda ser razonable, la American Society of Anesthesiologists no ha emitido ninguna recomendación para la estancia mínima en la URPA. La duración de la estancia debe determinarse de forma individualizada. Debería diseñarse un protocolo de alta que permita a los pacientes alcanzar los objetivos postoperatorios que les permitirán recibir el alta. 228 Capítulo 32 Cuidados postanestésicos P á g ina w e b http://www.asahq.org/ Bibliografía Recomendada 1. ASA Task Force on Post Anesthesia Care: Practice guidelines for postanesthesia care. Anesthesiology 96:742–752, 2002. 2. Feeley TW, Macario A: The postanesthetic care unit. In Miller RD, editor: Miller’s anesthesia, ed 6, Philadelphia, Elsevier Churchill Livingstone, 2005, pp 2701–2728. 3. Gan TJ, Meyer T, Apfel CC, et al: Consensus guidelines for managing postoperative nausea and vomiting. Anesth Analg 96:62–71, 2003. Cardiopatía isquémica Tamas Seres, MD, PhD Capítulo 33 VI. Anestesia y enfermedad sistémica 1. Nombre los factores de riesgo conocidos de desarrollo de la cardiopatía isqué­ mica. La edad, el sexo masculino y los antecedentes familiares son factores de riesgo que no se pueden modificar. El tabaquismo, la hipertensión arterial, la alimentación poco saludable, la hiperlipemia, el sedentarismo, la obesidad y la diabetes mellitus son modificables y en todos los adultos deben considerarse factores de riesgo para los que es probable que las intervenciones reduzcan el riesgo de cardiopatía isquémica (CI). 2. Describa el flujo sanguíneo coronario normal. El flujo sanguíneo coronario (FSC) es de alrededor de 225 ml/min, que representa el 4-5% del gasto cardíaco total en adultos sanos. El FSC aumenta tres o cuatro veces para suministrar los nutrientes adicionales al corazón necesarios a niveles máximos de ejercicio. El FSC se determina por el gradiente de presión entre la aorta y el ventrículo. El FSC experimenta cambios fásicos durante la sístole y la diástole en el ventrículo izquierdo. Se reduce a su valor más bajo durante la sístole, sobre todo en el área subendocárdica, debido a la compresión que ejerce el músculo ventricular izquierdo alrededor de los vasos intramusculares y al reducido gradiente de presión entre la aorta y el ventrículo izquierdo (presión sistólica aórtica-presión sistólica del ventrículo izquierdo). Durante la diástole, el músculo cardíaco se relaja y deja de obstruir el flujo sanguíneo a través de los capilares del ventrículo izquierdo. El gradiente de presión es alto durante la diástole (presión diastólica aórtica-presión telediastólica ventricular izquierda). Los cambios fásicos del FSC son mucho menores en el ventrículo derecho porque su fuerza contráctil es mucho más débil que la del ventrículo izquierdo y porque entre él y la aorta el gradiente de presión es alto durante todo el ciclo cardíaco. 3. Describa la anatomía coronaria. En el 80-90% de individuos domina el sistema de la arteria coronaria derecha que irriga el nódulo sinusal (sinoauricular) (60%), nódulo auriculoventricular (85%) y el ventrículo derecho. En el 84% de casos termina en forma de arteria descendente posterior (ADP). La oclusión de la arteria coronaria derecha puede provocar bradicardia, bloqueo cardíaco e infarto de miocardio (IM) inferior o ventricular derecho. La arteria coronaria principal izquierda da lugar a la arteria circunfleja y la arteria descendente anterior izquierda (ADI), que irriga gran parte del tabique interventricular (ramas septales) y la pared ventricular izquierda (ramas diagonales). Cuando la arteria circunfleja da lugar a la ADP, se dice que hay dominancia de la circulación izquierda, y la circulación coronaria izquierda irriga todo el tabique y el nódulo auriculoventricular. En el 40% de pacientes la arteria circunfleja irriga el nódulo sinusal. Una estenosis sustancial de la arteria coronaria principal izquierda (enfermedad de la principal izquierda) o de la arteria circunfleja proximal y descendente anterior izquierda (equivalente a la principal izquierda) puede asociarse a una depresión grave de la función miocárdica durante la isquemia. 4. Explique los factores determinantes de la demanda y aporte de oxígeno del mio­­ cardio. La demanda de oxígeno miocárdico está determinada por la tensión y la contractilidad de su pared. La tensión (T) de la pared es el producto de la presión (P) intraventricular, el radio (R) y el grosor de la pared (h): T 5 P 3 R/2h © 2011. Elsevier España, S.L. Reservados todos los derechos 229 230 Capítulo 33 Cardiopatía isquémica El aumento del volumen ventricular (precarga) y el de la presión arterial (poscarga) incrementan la tensión de la pared y la demanda de O2. El incremento de la contractilidad como respuesta a un estímulo simpático o a los fármacos inotrópicos aumenta también la demanda de O2. Un aumento de la frecuencia cardíaca incrementa la contractilidad, pero disminuye el diámetro ventricular y la tensión de su pared. Por tanto, en gran parte el aumento de la demanda de O2 por la mayor contractilidad es compensado por la reducción de la demanda de O2 que acompaña la menor tensión de la pared. La demanda de O2 aumenta porque se realizan más contracciones por minuto. El suministro de oxígeno al miocardio viene determinado por el contenido en O2 y el FSC. El contenido de O2 puede calcularse por la siguiente ecuación: Contenido de O2 5 [1,39 ml de O2/g de hemoglobina 3 hemoglobina (g/dl) 3 saturación (%)] 1 [0,003 3 PaO2] El FSC viene determinado por la presión de perfusión coronaria, el tiempo disponible de perfusión y la permeabilidad de las arterias coronarias. La presión de perfusión coronaria se altera por la hipotensión diastólica, la hipertrofia ventricular izquierda y el aumento de la presión telediastólica del ventrículo izquierdo. El tiempo diastólico de perfusión disminuye en la taquicardia. 5. ¿Cuáles son las manifestaciones clínicas de la isquemia miocárdica? Las manifestaciones clínicas de la isquemia miocárdica son diversas. Se asume que la manifestación clásica de la isquemia coronaria es la angina de pecho con o sin signos de arritmia o de insuficiencia cardíaca. Sin embargo, la isquemia miocárdica puede manifestarse como insuficiencia ventricular o arritmias sin angina, o puede ser clínicamente asintomática. La naturaleza dinámica de la estenosis coronaria es responsable de los cambios del calibre de un vaso, lo que puede producir dolor en reposo unas veces y angina con el esfuerzo, de intensidad variable, en otras. 6. ¿Cómo se clasifica la angina? La Canadian Cardiovascular Society ha introducido un sistema de clasificación de la angina: Clase IAngina durante el ejercicio extenuante o rápido con actividades laborales o recreativas Clase IIAngina al andar o subir escaleras rápidamente, al subir cuestas o andar más de dos manzanas en terreno llano, o al subir más de un tramo de escaleras a paso normal Clase IIIAngina al andar una o dos manzanas en terreno llano y subir un tramo de escaleras a paso normal Clase IV Angina presente con un bajo nivel de actividad física o en reposo 7. Describa la patogenia de un infarto de miocardio perioperatorio. La causa de un IM suele ser agregación plaquetaria, vasoconstricción y formación de un trombo en el sitio de una placa ateromatosa en el interior de una arteria coronaria. Teóricamente, el aumento súbito de la demanda de O2 miocárdico (p. ej., taquicardia, hipertensión arterial) o la disminución del suministro de O2 (p. ej., hipotensión, hipoxemia, anemia, taquicardia, oclusión coronaria) pueden precipitar el IM en pacientes con CI. No obstante, los estudios recientes han confirmado que la mayor parte de acontecimientos isquémicos perioperatorios no están relacionados con alteraciones hemodinámicas, lo que sugiere que los acontecimientos intracoronarios pueden ser importantes en el origen de la isquemia perioperatoria. 8. ¿Qué factores clínicos aumentan el riesgo de infarto de miocardio perioperato­ rio después de cirugía no cardíaca? Son las cardiopatías activas, los factores de riesgo clínico y variables pronósticas clínicas menores, basados en un algoritmo para la estratificación del riesgo y el uso apropiado de las pruebas diagnósticas de pacientes cardíacos sometidos a cirugía no cardíaca, establecidos por el American College of Cardiology/American Heart Association (ACC/AHA) Task Force on Perioperative Evaluation (2007). Las guías integran los factores de riesgo clínico, la capacidad de ejercicio y el procedimiento quirúrgico para el proceso de la toma de decisiones. Se describen con mayor detalle en el capítulo 17. Capítulo 33 Cardiopatía isquémica 231 9. ¿Cuál es la definición de infarto de miocardio reciente y previo? En función de la disminución del riesgo de reinfarto perioperatorio, la American College of Cardiology National Database define un IM reciente como el acontecido >7 días pero ≤30 días antes de la cirugía. Un IM previo se define como aquel acontecido >30 días antes de la cirugía. 10. ¿Qué tipo de cirugía influye en la estratificación del riesgo de isquemia periope­ ratoria? La cirugía de alto riesgo (riesgo de acontecimientos cardíacos adversos perioperatorios >5%) incluye los procedimientos aórticos y vasculares mayores y los vasculares peri­ féricos. Los procedimientos de riesgo intermedio (riesgo de acontecimientos cardíacos adversos perioperatorios <5%) son: endarterectomía carotídea, cirugía maxilofacial, cirugía intraperitoneal e intratorácica, cirugía ortopédica y cirugía de la próstata. Los procedimientos de bajo riesgo (riesgo de acontecimientos cardíacos adversos perioperatorios <1%) son los endoscópicos, los superficiales, la cirugía de cataratas y de mama. © Elsevier. Fotocopiar sin autorización es un delito 11. ¿Cómo puede valorarse la función cardíaca con la anamnesis y la exploración física? Si la capacidad de ejercicio del paciente es excelente, incluso en presencia de CI, es muy probable que pueda tolerar el estrés quirúrgico. La intolerancia al ejercicio en ausencia de enfermedad pulmonar o sistémica indica una reserva cardíaca insuficiente. Hay que preguntar a todos los pacientes sobre su capacidad para realizar las actividades propias de la vida diaria, como se describe en la clasificación canadiense de la angina, o en la clasificación de la New York Heart Association (NYHA) de la tolerancia al ejercicio. La capacidad de subir dos o tres tramos de escaleras sin síntomas importantes (angina, disnea, síncope) suele indicar una reserva cardíaca adecuada >4 equivalentes metabólicos (MET) de capacidad de ejercicio (1 MET equivale a 3,6 ml/kg/min de consumo de O2 en reposo). Antes de la operación, hay que buscar signos y síntomas de insuficiencia cardíaca congestiva, incluyendo disnea, ortopnea, disnea paroxística nocturna, edema maleolar, distensión yugular, un tercer ruido cardíaco, crepitantes y hepatomegalia. 12. ¿Cuándo se debe considerar una prueba de esfuerzo no invasiva antes de la ci­­ rugía no cardíaca? Las guías integran los factores de riesgo clínico, la capacidad de ejercicio y el procedimiento quirúrgico para el proceso de la toma de decisiones. Las pruebas de esfuerzo no invasivas se considerarán cuando sus resultados modifiquen el tratamiento de los pacientes. Los ejemplos incluyen: Los pacientes con cardiopatías activas en quienes se planifica cirugía no cardíaca deben valorarse y tratarse según las guías del ACC/AHA antes de la cirugía programada no cardíaca. Los pacientes con tres o más factores de riesgo clínico y baja capacidad funcional que requieren cirugía vascular. Los pacientes con al menos uno o dos factores de riesgo clínico y baja capacidad funcional que requieren cirugía no cardíaca de riesgo intermedio. Los pacientes con al menos uno o dos factores de riesgo clínico y una capacidad funcional satisfactoria que se someten a cirugía vascular. 13. ¿Qué pruebas realizadas por el consultor cardiólogo ayudan a valorar mejor a los pacientes con sospecha de cardiopatía isquémica o con cardiopatía isqué­ mica conocida? El electrocardiograma (ECG) durante el ejercicio es una prueba no invasiva que intenta reproducir los cambios isquémicos detectados en el ECG (depresión del ST = 1 mm del obtenido en situación basal) o los síntomas mientras el paciente realiza ejercicio a su capacidad máxima. La información obtenida se relaciona con los umbrales de frecuencia cardíaca y presión arterial que puede tolerar. Las frecuencias cardíacas máximas, la respuesta de la presión arterial así como los síntomas clínicos ayudan a interpretar los resultados. 232 Capítulo 33 Cardiopatía isquémica La gammagrafía con talio durante el esfuerzo aumenta la sensibilidad y la especificidad del ECG durante el ejercicio. El talio 201 es un isótopo captado casi totalmente por la circulación coronaria miocárdica, y, por tanto, puede visualizarse radiográficamente. Las áreas mal perfundidas que se llenan más tarde con el contraste delimitan las áreas de miocardio en riesgo de isquemia. Los defectos de perfusión fijos indican regiones de miocardio i­nfartadas. La gammagrafía con talio y dipiridamol es útil en pacientes incapaces de hacer ejercicio. Esta prueba es necesaria en aquellos con vasculopatía periférica y riesgo elevado de CI y cuyas pruebas de esfuerzo están limitadas por la claudicación. El dipiridamol es un potente vasodilatador coronario que determina un flujo diferencial entre las arterias coronarias sanas y las enfermas, diferencia detectada mediante la gammagrafía con talio. La ecocardiografía puede utilizarse para valorar la función del ventrículo izquierdo y de las válvulas, y para medir la fracción de eyección. La ecocardiografía de estrés (ecodobutamina) sirve para valorar alteraciones nuevas del movimiento regional de la pared o su agravación en el corazón sometido a estrés farmacológico. Se considera que las áreas de anomalías del movimiento de la pared tienen riesgo de isquemia. La angiografía coronaria es el patrón oro para definir la anatomía coronaria. Permite valorar la función valvular y ventricular, y medir los índices hemodinámicos. Dado que la angiografía es un procedimiento invasivo, se reserva para pacientes que requieren una valoración adicional, en función de los exámenes previos o con una elevada probabilidad de presentar coronariopatía grave. P U NTOS CLAVE: Cardiopatía Is quémica 1. Es preciso integrar las variables pronósticas clínicas, el procedimiento quirúrgico y la capacidad de ejercicio en el proceso de la toma de decisiones para evitar acontecimientos cardíacos perioperatorios adversos. 2. Es preciso determinar y tratar a los pacientes con cardiopatías activas (angina inestable o grave, IM reciente) antes de la cirugía programada no cardíaca. 3. También se debe considerar el riesgo del procedimiento quirúrgico. Los pacientes programados para cirugía vascular corren un riesgo muy alto de acontecimientos isquémicos perioperatorios. Los pacientes con una capacidad de ejercicio muy satisfactoria, incluso en presencia de cardiopatía isquémica, podrán tolerar el estrés de la cirugía no cardíaca. La capacidad para subir dos o tres tramos de escaleras sin síntomas sustanciales (angina, disnea) suele ser la indicación de una reserva cardíaca suficiente. El tipo de revascularización aguda debe planificarse cuidadosamente porque los pacientes portadores de un stent liberador de fármacos requieren tratamiento antiagregante plaquetario doble durante al menos un año. 14. ¿Cuáles son las principales indicaciones de la revascularización coronaria an­ tes de la cirugía no cardíaca? Coincidiendo con la ACC/AHA 2004 Guideline Update para cirugía de revascularización coronaria, los pacientes mencionados a continuación requieren revascularización coronaria (mediante bypass de la arteria coronaria o una intervención coronaria percutánea) antes de la cirugía no cardíaca: Pacientes con angina estable portadores de una estenosis sustancial de la arteria coronaria principal izquierda. Pacientes con angina estable portadores de enfermedad de tres vasos. El beneficio para la supervivencia es mayor cuando la fracción de eyección ventricular izquierda es <50%. Capítulo 33 Cardiopatía isquémica 233 Pacientes con angina estable portadores de enfermedad de dos vasos con estenosis significativa de la ADI proximal y una fracción de eyección <50% o isquemia demostrable en una prueba no invasiva. Pacientes con angina inestable de alto riesgo o IM sin elevación del segmento ST. Pacientes con IM agudo con elevación del segmento ST. 15. En un paciente se programa cirugía tras una intervención coronaria percutánea. ¿Qué medidas ha de tomar? Tras una intervención coronaria percutánea (ICP), el paciente requiere tratamiento antiagregante plaquetario doble (ácido acetilsalicílico y clopidogrel). La interrupción del tratamiento para el procedimiento quirúrgico entraña un alto riesgo de trombosis de la arteria coronaria y de acontecimientos miocárdicos en el período perioperatorio. El momento apropiado de la cirugía sigue siendo motivo de investigación, pero son aceptables las guías descritas a continuación: Tras angioplastia con balón, la cirugía no urgente puede efectuarse después de 14 días bajo tratamiento con ácido acetilsalicílico, pero, en condiciones ideales, estos pacientes deben recibir tratamiento antiagregante plaquetario doble durante 4-6 semanas. Tras la implantación de un stent metálico o liberador de fármacos, la cirugía no urgente puede efectuarse después de 30-45 días o >365 días, respectivamente, dejando el tratamiento con ácido acetilsalicílico. 16. ¿Por qué razón los pacientes portadores de stents liberadores de fármacos ne­ cesitan un tiempo más prolongado que los portadores de stents metálicos? La Food and Drug Administration aprobó los stents liberadores de fármacos usados en la práctica clínica actual después de que los ensayos clínicos demostraran una eficacia significativamente mayor que la de los stents metálicos sin recubrimiento en el tratamiento de las oclusiones de la arteria coronaria, junto con menores tasas de acontecimientos cardíacos adversos mayores (en general, definidos como una variable combinada de mortalidad + IM + intervención repetida debido a reestenosis). Los fármacos (sirolimús, paclitaxel) liberados del stent inhiben la formación de superficie endotelial en el interior del stent, y, por lo tanto, requieren una duración más prolongada del tratamiento antiagregante plaquetario doble. © Elsevier. Fotocopiar sin autorización es un delito 17. ¿Es preciso continuar toda la medicación cardíaca durante el período periope­ ratorio? Los pacientes con antecedentes de CI suelen recibir medicación destinada a reducir la demanda de O2 miocárdico a través de una disminución de la frecuencia cardíaca, la precarga, poscarga o estado contráctil (bloqueantes b, antagonistas del calcio y nitratos) y de un aumento del aporte de O2 a través de vasodilatación coronaria (nitratos). En general, estos fármacos deben administrarse durante todo el período perioperatorio. 18. ¿Cómo deben administrarse los bloqueantes b a pacientes de alto riesgo? Los bloqueantes b deben administrarse a pacientes sometidos a cirugía vascular y con un riesgo cardíaco elevado debido al hallazgo de isquemia en las pruebas preoperatorias. Es probable que estén indicados para pacientes sometidos a cirugía vascular o de riesgo intermedio en quienes la valoración perioperatoria identifica una coronariopatía o más de un factor de riesgo clínico. Por último, este tratamiento debe continuar en pacientes sometidos a cirugía que ya lo reciben para la angina, arritmia sintomática o para hipertensión arterial. 19. ¿Administraría una infusión profiláctica de nitroglicerina intraoperatoria? No está clara la utilidad de la nitroglicerina intraoperatoria como fármaco profiláctico en la prevención de la isquemia miocárdica y la morbilidad cardíaca para pacientes de alto riesgo sometidos a cirugía no cardíaca, en particular los que han precisado tratamiento con nitratos para el control de una angina. La recomendación del uso profiláctico de nitroglicerina debe considerar el plan anestésico y la hemodinámica del paciente y tener en cuenta que durante la anestesia y la cirugía tanto la vasodilatación como la hipovolemia son frecuentes. 234 Capítulo 33 Cardiopatía isquémica 20. ¿Qué hallazgos en el electrocardiograma respaldan el diagnóstico de cardiopa­ tía isquémica? El ECG de 12 derivaciones en reposo sigue siendo un instrumento de cribado eficaz y de bajo coste para detectar la CI. Hay que identificar la depresión o la elevación del segmento ST, la inversión de la onda T, un IM antiguo demostrado por las ondas Q, las alteraciones de conducción y ritmo, y la hipertrofia ventricular izquierda. Cambios isquémicos en las derivaciones II, III y aVF sugieren enfermedad coronaria derecha, las derivaciones I, aVL, V5 y V6 monitorizan la distribución de la arteria circunfleja, y las derivaciones V1-V4 examinan la distribución de la ADI. 21. ¿Cuándo se recomienda un electrocardiograma de 12 derivaciones en reposo? En pacientes con al menos un factor de riesgo clínico (antecedentes de CI, insuficiencia cardíaca compensada o previa, enfermedad vascular cerebral, diabetes mellitus e insuficiencia renal) que se someten a procedimientos quirúrgicos vasculares. Los pacientes con coronariopatía, arteriopatía periférica o vasculopatía cerebral conocida que se someten a procedimientos quirúrgicos de riesgo intermedio. Es razonable en pacientes sin factores de riesgo clínico que se someten a procedimientos quirúrgicos vasculares. 22. ¿Cuánto tiempo debe esperar un paciente con un infarto de miocardio reciente para someterse a una intervención quirúrgica no cardíaca programada? Después de un IM, el riesgo de reinfarto durante la cirugía se consideraba que dependía del intervalo transcurrido entre ambos. El grupo de trabajo del ACC/AHA ha eliminado el intervalo arbitrario de 6 meses, y sugiere que la cirugía programada solamente se asocia con un riesgo prohibitivo en las 4-6 primeras semanas. El estado funcional del paciente después del restablecimiento de un IM es más importante que el intervalo absoluto de tiempo. Los pacientes con síntomas persistentes pueden ser candidatos a una revascularización coronaria antes de someterse a una intervención no cardíaca. 23. Reseñe los objetivos hemodinámicos de la inducción y el mantenimiento de la anestesia general en pacientes con cardiopatía isquémica. El objetivo del anestesiólogo es mantener el equilibrio entre el suministro y la demanda de O2 miocárdico durante el período perioperatorio. Durante la inducción, hay que evitar las oscilaciones amplias de la frecuencia cardíaca, y de la presión arterial, y no se administrará ketamina porque provoca taquicardia e hipertension arterial. La laringoscopia no debe prolongarse, por lo que el anestesiólogo mitigará su estímulo y el de la intubación añadiendo opioides, bloqueantes b o lidocaína laringotraqueal o intravenosa. Los anestésicos de mantenimiento se seleccionarán a partir de la función ventricular del paciente. En aquellos con buena función ventricular izquierda, los efectos depresores cardíacos y vasodilatadores de los anestésicos halogenados pueden reducir la demanda de O2 miocárdico. En pacientes con disfunción ventricular izquierda se suele elegir una técnica basada en opioides para evitar una depresión miocárdica adversa. Son de elección los relajantes musculares con efectos cardiovasculares mínimos. La presión arterial y la frecuencia cardíaca deben mantenerse dentro de límites normales, y esto se logra eliminando el estímulo simpático con una analgesia adecuada y tratando enérgicamente la hipertensión arterial (p. ej., anestésicos, nitroglicerina, nitroprusiato, bloqueantes b), la hipotensión (p. ej., líquidos, fenilefrina, fármacos inotrópicos) y la taquicardia (p. ej., líquidos, anestésicos, bloqueantes b). 24. ¿Qué monitorización intraoperatoria es útil para detectar la isquemia? La derivación precordial V5 es la derivación única más sensible del ECG para detectar la isquemia, y debe monitorizarse de forma sistemática en pacientes con riesgo de CI. La derivación II detecta isquemia de la distribución de la arteria coronaria derecha y es la más útil para controlar la onda P y el ritmo cardíaco. 25. ¿Usaría sistemáticamente la ecocardiografía transesofágica en pacientes con riesgo cardíaco alto sometidos a cirugía no cardíaca? La ecocardiografía transesofágica (ETE) puede ofrecer una monitorización intraoperatoria continua de la función ventricular izquierda. En pacientes de alto riesgo, la detección de anomalías regionales del movimiento de la pared con esta técnica es el monitor más sensible de isquemia Capítulo 33 Cardiopatía isquémica 235 miocárdica. No obstante, ningún estudio ha demostrado claramente un cambio en el pronóstico a partir de su uso sistemático. Por esta razón, su elección se deja a discreción del equipo asistencial anestésico. 26. ¿Es razonable el uso sistemático de un catéter de arteria pulmonar para la opti­ mización de los pacientes de alto riesgo? ¿Cuál es su posible beneficio? No se ha demostrado que en pacientes con CI el uso de un catéter de la arteria pulmonar mejore el pronóstico; por lo tanto, se limitará a un reducido número de pacientes seleccionados que están inestables y que tienen múltiples procesos comórbidos. Cuando se utiliza, la presión de oclusión (enclavamiento) de la arteria pulmonar ofrece una estimación de la presión telediastólica ventricular izquierda, que es una guía útil para optimizar la fluidoterapia. Los aumentos súbitos de la presión de enclavamiento pueden indicar una disfunción ventricular izquierda aguda debida a isquemia. Véase el Capítulo 26. Bibliografía Recomendada 1. Fleisher LA, Beckman JA, Brown KA, et al: ACC/AHA 2007 Guidelines on perioperative cardiovascular evaluation and care for noncardiac surgery. Circulation 116:1971–1996, 2007. 2. Newsome LT, Kutcher MA, Royster RL: Coronary artery stents. Part 1. Evolution of percutaneous coronary intervention. Anesth Analg 107:552–569, 2008. © Elsevier. Fotocopiar sin autorización es un delito 3. Newsome LT, Weller RS, Gerancher JC, et al: Coronary artery stents. Part II. Perioperative considerations and management. Anesth Analg 107:570–590, 2008. Capítulo 34 Insuficiencia Cardíaca Tamas Seres, MD, PhD 1. ¿Qué es la insuficiencia cardíaca? La insuficiencia cardíaca (IC) es un síndrome clínico complejo que puede ser consecuencia de un trastorno cardíaco estructural o funcional que afecte a la capacidad del ventrículo para llenarse de sangre o eyectarla. Sus manifestaciones primordiales son la disnea y la fatiga, que pueden limitar la tolerancia al ejercicio, y la retención de líquidos, que puede provocar congestión pulmonar y edema periférico. Algunos pacientes presentan intolerancia al ejercicio pero apenas signos de retención de líquidos, mientras que otros refieren sobre todo edema y apenas manifiestan disnea o fatiga. Puesto que no todos presentan una sobrecarga de volumen en el momento de la valoración inicial o ulterior, el término insuficiencia cardíaca es de elección sobre el más antiguo de insuficiencia cardíaca congestiva. 2. Nombre las causas de insuficiencia cardíaca. En Estados Unidos, las causas más habituales de IC son la coronariopatía, la hipertensión arterial sistémica, la miocardiopatía dilatada y las valvulopatías (Tabla 34-1). Ta b l a 3 4 - 1 . C a u s a s d e i n s u f ici e n ci a c a r d í a c a Anomalías mecánicas Sobrecarga de presión Estenosis aórtica, hipertensión arterial sistémica, hipertensión pulmonar Sobrecarga de volumen Insuficiencia valvular, anemia, tirotoxicosis, cortocircuitos circulatorios Restricción del llenado ventricular Estenosis mitral, pericarditis constrictiva, hipertrofia ventricular izquierda Enfermedad miocárdica Primaria Miocardiopapatías hipertróficas restrictivas o dilatadas Secundaria Coronariopatía y miocardiopatía isquémica Alcoholismo, enfermedades tiroideas, feocromocitoma, cardiomiopatía urémica Miocarditis bacteriana, vírica, parasitaria y micótica Drogas: doxorubicina, heroína y cocaína Metales: sobrecarga de hierro, intoxicación por plomo (saturnismo) o cobalto Conectivopatías: enfermedad reumatoide, lupus eritematoso, esclerodermia Enfermedades neurológicas: distrofia muscular o miotónica Enfermedades hereditarias: glucogenosis, mucopolisacaridosis Otras enfermedades: amiloidosis, leucemia, posradioterapia 236 © 2011. Elsevier España, S.L. Reservados todos los derechos Capítulo 34 Insuficiencia Cardíaca 237 3. Describa la clasificación de la insuficiencia cardíaca. Estadio A: pacientes con coronariopatía, hipertensión arterial o diabetes mellitus en quienes todavía no se demuestra disfunción del ventrículo izquierdo (VI), hipertrofia del VI o distorsión de la geometría de la cámara ventricular. Estadio B: pacientes asintomáticos pero en quienes se demuestra hipertrofia del VI, distorsión de la geometría de la cámara ventricular y/o disfunción sistólica o diastólica del VI. Estadio C: pacientes con síntomas actuales o previos de IC asociada a cardiopatía estructural subyacente. Estadio D: pacientes con IC resistente al tratamiento médico que pueden ser candidatos a estrategias de tratamiento avanzado especializado, como los procedimientos de soporte circulatorio mecánico para facilitar la eliminación de líquidos, las infusiones continuas de inotropos, el trasplante de corazón o los cuidados paliativos. Este sistema de clasificación reconoce que hay factores de riesgo y requisitos estructurales establecidos para el desarrollo de la IC (estadios A y B), y que las intervenciones terapéuticas introducidas incluso antes de la aparición de la disfunción del VI o de los síntomas pueden reducir la morbilidad y la mortalidad. © Elsevier. Fotocopiar sin autorización es un delito 4. ¿Cómo se clasifica la gravedad de la insuficiencia cardíaca? En general, el estado de los pacientes con IC puede clasificarse en función de los síntomas, deterioro del estilo de vida o gravedad de la disfunción cardíaca. La clasificación de la New York Heart Association (NYHA) se usa para valorar las limitaciones sintomáticas de la IC y la respuesta al tratamiento: Clase I: la actividad física habitual no induce síntomas. La disnea aparece con el ejercicio extenuante o prolongado durante la actividad laboral o recreativa. Clase II: la actividad física habitual induce síntomas. El paciente refiere disnea al caminar o subir escaleras rápidamente o al subir una cuesta. Andar más de dos manzanas en terreno llano y subir más de un tramo de escaleras a velocidad normal no inducen síntomas. Clase III: la actividad inferior a la habitual induce síntomas. El paciente refiere disnea al andar una o dos manzanas en terreno llano o al subir un tramo de escaleras a ritmo normal. Clase IV: un bajo grado de actividad física induce disnea o aparece en reposo. La clasificación de la NYHA describe el estado funcional de pacientes con los estadios C o D de la IC. La gravedad de los síntomas suele fluctuar incluso en ausencia de cambios en el tratamiento, que pueden producir efectos favorables o adversos sobre la capacidad funcional en ausencia de cambios apreciables de la función ventricular. Algunos pacientes pueden demostrar una recuperación importante si se produce mejoría de las anomalías estructurales y funcionales. En general, el tratamiento farmacológico produce mejoría prolongada y ha de continuarse de forma indefinida. 5. ¿Cuáles son las principales alteraciones cardíacas en pacientes con insuficiencia cardíaca? La disfunción del VI se inicia por alguna lesión o tensión en el miocardio y, en general, es un proceso progresivo. Su principal manifestación es un cambio en la geometría y estructura del VI, de tal modo que la cámara se dilata y/o hipertrofia y se hace más esférica, un proceso denominado remodelado cardíaco. Se observan patrones específicos que acontecen como respuesta al aumento impuesto de la carga. Con una sobrecarga de presión, durante la sístole, el aumento de la tensión de la pared inicia la adición paralela de nuevas miofibrillas, lo que induce el engrosamiento de la pared y una hipertrofia concéntrica. Con una sobrecarga de volumen, la tensión de la pared aumenta durante la diástole, lo que inicia la adición de nuevos sarcómeros en serie, dando lugar a un aumento de tamaño de la cámara y a una hipertrofia excéntrica. La dilatación ventricular permite que la cámara eyecte un volumen sistólico suficiente con menos acortamiento muscular, pero con un aumento de la tensión de la pared según lo descrito por la relación de Laplace: Tensión de la pared 5 P 3 R/2h donde P es la presión intracavitaria, R es el radio de la cámara y h el grosor de la pared de la cámara. 238 Capítulo 34 Insuficiencia Cardíaca El aumento de la tensión de la pared se asocia a una mayor demanda de O2 para el mismo rendimiento. La hipertrofia miocárdica con un mayor grosor de la pared permite que el corazón supere la sobrecarga de presión con una disminución de la tensión de la pared. 6. ¿En qué consiste la ley de Frank-Starling? La ley de Frank-Starling determina que la fuerza o la tensión desarrollada por una fibra muscular depende del grado hasta el que se ha distendido. En una situación clínica, cuando aumenta la cantidad de flujo sanguíneo que llega al corazón (aumento de la precarga), sus paredes se distienden. El músculo cardíaco se contrae con mayor fuerza y, dentro de unos límites, vacía las cámaras expandidas con un mayor volumen sistólico. Hay una longitud óptima de los sarcómeros y, por lo tanto, una longitud óptima de la fibra a partir de la que se obtiene la contracción más intensa. En general, el VI trabaja a un volumen telediastólico con longitudes de la fibra inferiores a las óptimas. La implicación clínica de esto es que el volumen sistólico aumenta con una precarga creciente hasta que se alcanza la longitud óptima de la fibra del miocardio. Un aumento adicional de la precarga induce una disminución del volumen sistólico. 7. ¿Cómo se calcula el gasto cardíaco? ¿Cuál es el gasto y el índice cardíaco nor­ mal? El gasto cardíaco (GC) es la cantidad de sangre que el corazón bombea durante 1 minuto. Sus principales determinantes son: GC 5 VS 3 FC donde GC es la presión arterial/resistencia periférica total, VS es el volumen sistólico y FC la frecuencia cardíaca. El GC varía ampliamente con el nivel de actividad del organismo. El valor medio para adultos en reposo es alrededor de 5 l/min. Para las mujeres, este valor es un 10-20% inferior. Aumenta en proporción al área de superficie corporal. Para comparar el GC de individuos de diferente complexión corporal se introdujo el término de índice cardíaco (IC), que es el GC por metro cuadrado de área de superficie corporal. El IC medio para adultos es alrededor de 3 l/min/m2. Hay límites definidos de la cantidad de sangre que el corazón puede bombear. El corazón sano, que funciona sin una estimulación nerviosa excesiva, puede bombear una cantidad de retorno venoso de hasta unas 2,5 veces el retorno venoso normal, que es un GC de unos 13 l/min. La estimulación nerviosa aumenta la FC y la contractilidad. Estos dos efectos pueden aumentar el GC hasta 25 l/min. 8. ¿Cuál es la relación entre el ejercicio y el gasto cardíaco? El aporte de O2 es el producto del GC y el contenido de O2 en sangre arterial. El ejercicio aumenta el consumo de O2 corporal. Este aumento de la demanda de O2 se satisface incrementando el GC. La IC da lugar a un desajuste entre el consumo de O2 tisular y la perfusión tisular en función del GC generado a determinado nivel de ejercicio. Este desequilibrio crea hipoxemia tisular, acidosis y la incapacidad para mantener el ejercicio al nivel en el que se produce el desequilibrio. 9. ¿Qué es la disfunción sistólica? Los signos y síntomas de IC pueden deberse a una anomalía de la función sistólica que provoca una disminución de la fracción de eyección (FE) o una anomalía de la función diastólica que induce una alteración del llenado ventricular. La disfunción sistólica induce una disminución de la eyección de sangre desde el VI. La FE disminuye, el volumen telesistólico y telediastólico aumentan y el VI se dilata. El volumen sistólico puede ser normal, pero es generado por un ventrículo dilatado, con un aumento de la tensión de la pared y del consumo de O2. En este estado patológico, el VI posee menos capacidad de reserva para superar la carga de presión o de volumen, que se manifiesta por una disminución de la capacidad de ejercicio (Figura 34-1, Bucle 3). 10. ¿Qué es la disfunción diastólica? En muchos pacientes la disfunción diastólica puede acontecer con una FE normal del VI. Las principales características de la disfunción diastólica del VI son el deterioro de su relajación o Capítulo 34 Insuficiencia Cardíaca 239 © Elsevier. Fotocopiar sin autorización es un delito Figura 34-1. Bucles de presión-volumen del ventrículo izquierdo (VI) con función normal (bucle 1), con disfunción diastólica (bucle 2) y con disfunción sistólica (bucle 3). AB, llenado diastólico; BC, contracción isovolumétrica; CD, eyección; DA, relajación isovolumétrica. En la disfunción diastólica, uno de los problemas puede ser el deterioro de la distensibilidad del VI, que se manifiesta por una presión telediastólica elevada del VI. El volumen sistólico y la fracción de eyección son normales. Este bucle puede representar la disfunción diastólica en la hipertensión arterial o en la estenosis aórtica con hipertrofia del VI (bucle 2). En la disfunción sistólica el VI está dilatado, el volumen sistólico es normal o inferior a lo normal; hay un aumento de los volúmenes telediastólico y telesistólico ventricular izquierdo. La presión telediastólica puede ser normal o mayor de lo normal, en función de la distensibilidad del VI. Este bucle puede representar una miocardiopatía dilatada (bucle 3). distensibilidad o ambos. El llenado diastólico precoz depende de la rapidez de la relajación ventricular, caracterizada por la recaptación de calcio del citosol en el retículo sarcoplasmático de los miocitos, una acción dependiente de la energía. El llenado diastólico tardío (contracción auricular) depende de la distensibilidad del VI, que es la relación entre el cambio del volumen ventricular y el de la presión diastólica ventricular. En la disfunción diastólica el tamaño de la cavidad del VI puede ser normal, pero la isquemia, la hipertrofia miocárdica, la constricción pericárdica, la fibrosis o las enfermedades miocárdicas alteran el proceso de llenado diastólico. La disfunción sistólica con un VI dilatado y una presión telediastólica elevada del VI se acompañan de una disfunción diastólica sustancial debido a la disminución de la relajación y a la distensibilidad del VI (véase la Figura 34-1, Bucle 2). 11. En la insuficiencia cardíaca, ¿tienen las respuestas neurohumorales ­significado terapéutico? Aunque diversos factores pueden acelerar el proceso del remodelado del VI, se dispone de pruebas sustanciales de que la activación del sistema neurohumoral endógeno desempeña un importante papel en el remodelado cardíaco y, por lo tanto, en la progresión de la IC. En estos pacientes se detecta un aumento de los valores circulantes o tisulares de noradrenalina, angiotensina II, aldosterona, endotelina, vasopresina y citocinas, que puede afectar de forma adversa a la estructura y función del corazón. Estos factores neurohumorales no sólo aumentan el estrés hemodinámico sobre el ventrículo, provocando retención de sodio y vasoconstricción periférica, sino que también pueden ejercer efectos tóxicos directos sobre las células cardíacas y estimular la fibrosis miocárdica, lo que puede alterar aún más la arquitectura y afectar al trabajo del corazón. 240 Capítulo 34 Insuficiencia Cardíaca Los bloqueantes y los inhibidores de la enzima conversora de la angiotensina (IECA) son las piedras angulares del tratamiento de la IC porque atenúan los efectos lesivos de los mediadores neurohumorales sobre la actividad del corazón. 12. ¿Cuáles son los síntomas de presentación de la insuficiencia cardíaca? Los síntomas principales pueden ser la disnea al esfuerzo y la fatiga. El paciente también puede referir disnea paroxística nocturna, nicturia, tos, sibilancias, dolor en el cuadrante superior derecho, anorexia y náuseas y vómitos. Aunque en general se considera que la IC es un proceso hemodinámico, en muchos estudios se ha indicado una falta de relación entre los parámetros de la actividad cardíaca y los síntomas producidos por la enfermedad. Pacientes con un valor muy bajo de la FE pueden encontrarse asintomáticos (estadio B), mientras que aquellos con una FEVI preservada pueden experimentar una discapacidad muy importante (estadio C). No se comprende por completo la evidente discordancia entre la FE y el grado de deterioro funcional pero, en parte, podría explicarse por alteraciones de la distensibilidad ventricular, insuficiencia valvular, restricción pericárdica, anomalías del ritmo y de la conducción cardíacos y de la función ventricular derecha. Además, en los pacientes ambulatorios numerosos factores no cardíacos pueden contribuir sustancialmente a la intolerancia al ejercicio. Estos factores incluyen, entre otros, los cambios de la función vascular periférica, fisiología del músculo esquelético, dinámica pulmonar, actividad neurohumoral y vegetativa refleja y manejo del sodio renal. 13. ¿Qué signos físicos indican insuficiencia cardíaca? La palpación cardíaca puede revelar una expansión del área del impulso (dilatación ventricular) o un impulso sostenido enérgico con la hipertrofia del VI. La auscultación revela un ritmo de galope con un S3 o S4 secundario al deterioro del llenado del VI o una contracción auricular intensa, respectivamente. Es preciso investigar la presencia de soplos de valvulopatías. La insuficiencia cardíaca grave puede dar lugar a cianosis. Con frecuencia, la exploración respiratoria pone de relieve estertores localizados predominantemente en ambas bases pulmonares. La disminución del murmullo vesicular secundaria a un derrame pleural es más frecuente en pacientes con IC crónica. Se considera anómala una distensión venosa yugular >4 cm por encima del ángulo esternal medida con el paciente semirreclinado formando un ángulo de 45°. P U N T OS CLAVE: Insuficiencia ca rdíaca 1. Los signos y síntomas de IC pueden deberse a una anomalía de la función sistólica que induce una disminución de la FE o una anomalía de la función diastólica que induce un defecto del llenado ventricular. 2. Los pacientes con IC descompensada no son candidatos a cirugía programada y requieren algunos días para optimizar la función cardíaca. 3. En circunstancias urgentes está indicada una monitorización invasiva (vía arterial, catéter en la arteria pulmonar y ecocardiografía transesofágica) para guiar la fluidoterapia y valorar la respuesta a los fármacos anestésicos y al tratamiento inotrópico o vasodilatador. 4. Los pacientes con una disminución de la reserva miocárdica son más sensibles a los efectos depresores cardiovasculares provocados por los anestésicos, pero la mayoría de agentes pueden administrarse si se hace cuidadosamente y con monitorización de las respuestas hemodinámicas. 14. ¿Qué pruebas de laboratorio son útiles para valorar al paciente con insuficiencia cardíaca? Una radiografía de tórax anteroposterior y lateral puede detectar cardiomegalia o signos de congestión vascular pulmonar, incluidos la ingurgitación perihiliar de las venas pulmonares, la redistribución de la trama vascular pulmonar o los derrames pleurales. Capítulo 34 Insuficiencia Cardíaca 241 © Elsevier. Fotocopiar sin autorización es un delito Con frecuencia, el electrocardiograma es inespecífico, pero suelen estar presentes arritmias ventriculares o supraventriculares; anomalías de la conducción, y signos de hipertrofia, isquemia o infarto miocárdico. La ecocardiografía permite valorar el tamaño de la cámara, el movimiento de la pared, la función valvular y el grosor de la pared del VI. El volumen sistólico puede determinarse por métodos Doppler. La FE puede calcularse determinando el volumen telediastólico y el telesistólico. La función diastólica se valora estudiando el patrón de flujo a través de la válvula mitral y la vena pulmonar superior izquierda usando la técnica Doppler. La angiografía con radioisótopos ofrece una valoración reproducible y precisa de la FE del VI y ventrículo derecho. Con frecuencia, se determinan los electrolitos séricos, la gasometría arterial, las pruebas de función hepática (PFH) y el hemograma. En muchos pacientes con IC se observa hiponatremia por la activación del sistema de la vasopresina o por el tratamiento con IECA. El tratamiento con diuréticos puede provocar hipopotasemia e hipomagnesemia. Con frecuencia está presente algún grado de uremia prerrenal, hipocalcemia e hipofosfatemia. La congestión hepática puede inducir un aumento de la concentración de bilirrubina y anomalías de las PFH. El aumento de los valores del péptido natriurético cerebral puede contribuir a la sospecha diagnóstica de IC o dar lugar a su consideración cuando se desconoce el diagnóstico, pero no se debe utilizar de forma aislada para confirmar o excluir su presencia. 15. ¿Qué estrategias de tratamiento se usan en los diferentes estadios de la insuficiencia cardíaca? Estadio A: pacientes en riesgo elevado de presentar IC. En pacientes en riesgo elevado de padecer IC, es preciso controlar la hipertensión arterial sistólica y diastólica, dislipemia, alteraciones del tiroides y diabetes mellitus. Se aconsejará a los pacientes que dejen de fumar, que eviten el consumo excesivo de alcohol y que no consuman drogas ya que aumentan el riesgo de IC. Los pacientes con vasculopatía aterosclerótica conocida requieren un seguimiento para la prevención secundaria. Los IECA o los bloqueadores del receptor de la angiotensina II pueden ser útiles en la prevención de la IC en pacientes con antecedentes de vasculopatía aterosclerótica, diabetes mellitus o hipertensión arterial. Estadio B: pacientes con anomalías estructurales o remodelado cardíaco que no mamifiestan síntomas de IC. Todas las recomendaciones del estadio A son pertinentes para pacientes con anomalías estructurales cardíacas que no han manifestado síntomas. Para todos aquellos con antecedentes recientes o remotos de infarto de miocardio (IM), con independencia del valor de la FE o la presencia de IC, están indicados bloqueantes e IECA. Además, estos fármacos están indicados en todos los pacientes sin antecedentes de IM con una disminución de la FEVI sin síntomas de IC. Estadio C: pacientes con síntomas actuales o previos de IC. Pacientes con disminución de la FEVI: Las medidas citadas como recomendaciones para pacientes en estadio A y B también son apropiadas para los pacientes en estadio C. Los diuréticos y la restricción salina están indicados en los pacientes con síntomas actuales o previos de IC, con disminución de la FEVI que presentan signos de retención hídrica. Los IECA y/o los bloqueantes (usando uno de los tres para los que se ha demostrado una disminución de la mortalidad, es decir, bisoprolol, carvedilol y succinato de metoprolol de liberación modificada) se recomiendan para todos los pacientes con síntomas actuales o previos de IC y una disminución de la FEVI a menos que estén contraindicados. La adición de un antagonista de la aldosterona es razonable en pacientes seleccionados con síntomas moderados o graves de IC y una disminución de la FEVI. En aquellos de alto riesgo puede instaurarse tratamiento con un cardioversor-desfibrilador implantable y resincronización cardíaca. Pacientes con FEVI normal: La hipertensión arterial sistólica y diastólica debe controlarse en pacientes con IC y FEVI normal. La frecuencia ventricular debe controlarse en los pacientes con fibrilación auricular. Los diuréticos están indicados para controlar la congestión pulmonar y el edema periférico. 242 Capítulo 34 Insuficiencia Cardíaca La revascularización coronaria puede ser una alternativa adecuada en pacientes con coronariopatía en quienes se considera que la isquemia miocárdica sintomática o demostrable tendrá un efecto adverso sobre la función cardíaca. Estadio D: pacientes con IC terminal refractaria. Dichos pacientes presentan síntomas en reposo o con un esfuerzo mínimo. No pueden efectuar la mayor parte de actividades de la vida diaria, con frecuencia muestran signos de caquexia cardíaca y, en general, requieren hospitalizaciones repetidas y/o prolongadas para un tratamiento intensivo. Un paso decisivo en su tratamiento satisfactorio es el reconocimiento y el control estricto de la retención hídrica. Estos individuos representan el estadio más avanzado de la IC y deben considerarse para estrategias de tratamiento especializado, como la asistencia circulatoria mecánica, tratamiento inotrópico posi­tivo intravenoso continuo, referirse para un trasplante cardíaco o un ingreso en un centro sociosanitario. 16. En la preparación de la anestesia en pacientes con insuficiencia cardíaca, ¿qué medidas debe considerar? Los pacientes con IC en estadio A o B presentan un estado funcional satisfactorio; por lo tanto, pueden someterse a cirugía tras la valoración preoperatoria habitual. En la IC en estadio C, se debe valorar el estado funcional del paciente según lo establecido en las guías de la NYHA, y se deben revisar los signos de IC descompensada. Los pacientes con disnea, progresión de la disnea u otro cambio del estado clínico son candidatos apropiados para someterse a monitorización no invasiva preoperatoria de la función del VI y posponer la cirugía programada hasta su compensación. La IC en estadio D representa a los pacientes de clase IV de la NYHA que son resistentes al tratamiento médico habitual. Pueden recibir fármacos inotrópicos intravenosos o tratamiento con un dispositivo de asistencia circulatoria y requieren un tratamiento anestésico especial para la cirugía no cardíaca. 17. ¿Cuál sería la conducta a seguir en un paciente con insuficiencia cardíaca descompensada? En general, los pacientes con IC descompensada no son candidatos a los procedimientos quirúrgicos programados. Está indicado esperar algunos días para optimizar la función cardíaca. En circunstancias urgentes está indicada una monitorización invasiva (vía arterial, catéter en la arteria pulmonar) para guiar la fluidoterapia y valorar la respuesta a los anestésicos y al tratamiento inotrópico o vasodilatador. La ecocardiografía transesofágica es muy útil para valorar el efecto de la fluidoterapia sobre el corazón, medir el volumen sistólico y el GC, y valorar la función sistólica y diastólica. 18. ¿Qué anestésicos puede utilizar en la insuficiencia cardíaca descompensada? El objetivo del tratamiento anestésico sigue siendo evitar la depresión miocárdica. En general, los barbitúricos y el propofol producen una depresión muy profunda de la función cardíaca y de la presión arterial cuando se utilizan para la inducción de la anestesia general. El etomidato produce pocas aberraciones del estado cardiovascular, aunque, en el contexto de una hipovolemia, puede aparecer hipotensión. La administración de ketamina puede provocar un aumento del GC y de la presión arterial, que es secundario al aumento de la actividad simpática. Sin embargo, en pacientes con un aumento de la actividad simpática por una IC descompensada, la ketamina actúa como agente inotrópico negativo y puede causar hipotensión e IC. Los efectos adversos cardiovasculares (disminución de la presión arterial) son leves cuando se administran benzodiazepinas en dosis sedantes, pero llegan a ser moderados cuando se administran dosis de inducción o en combinación con opiáceos. Todos los agentes anestésicos halogenados potentes son depresores miocárdicos, pero las dosis bajas suelen ser bien toleradas. Para el paciente con un compromiso grave de la función miocárdica, es útil la anestesia basada en opioides con o sin un halogenado a dosis bajas. El remifentanilo, un opioide de acción corta, puede ser especialmente apropiado para procedimientos quirúrgicos breves. Capítulo 34 Insuficiencia Cardíaca 243 19. ¿Está contraindicada la anestesia regional en pacientes con insuficiencia cardíaca? No. Cuando se administra con precaución, la anestesia regional es una técnica anestésica aceptable. De hecho, una reducción modesta de la poscarga puede aumentar el GC. Son preferibles técnicas regionales continuas (subaracnoideas o epidurales) porque se asocian con la pérdida gradual del tono simpático, que puede tratarse con una titulación de los líquidos y de fármacos vasoactivos. Durante la anestesia regional se requiere una monitorización invasiva. Una vía arterial es importante para mantener la presión arterial en unos límites apropiados, y, en casos seleccionados, el catéter de la arteria pulmonar puede ser de utilidad. 20. ¿Cómo proporcionaría soporte al corazón descompensado por insuficiencia cardíaca durante la anestesia? Con frecuencia, los pacientes con IC requieren soporte circulatorio intraoperatorio y postoperatorio. Tras la optimización de la precarga y poscarga, se ha demostrado que los fármacos inotrópicos como la dopamina o la dobutamina son eficaces en los estados de bajo GC y producen cambios modestos en la resistencia vascular sistémica a dosis más bajas. En la IC grave pueden requerirse fármacos más potentes como la adrenalina. Los inhibidores de la fosfodiesterasa III como la milrinona, con propiedades inotrópicas y vasodilatadoras, pueden mejorar la función hemodinámica. En la insuficiencia ventricular, el volumen sistólico se relaciona inversamente con la poscarga, y la reducción de la poscarga del VI con fármacos vasodilatadores como el nitroprusiato y la nesiritida también es eficaz para aumentar el GC. P á gina w eb Disfunción sistólica y diastólica http://www.uptodate.com Bibliografía Recomendada 1. Crawford MH: Current Diagnosis and Treatment in Cardiology, ed 2, New York, McGraw-Hill, 2003. 2. Fleisher LA: Anesthesia and Uncommon Diseases, ed 5, Philadelphia, Saunders, 2006. 3. Fleisher LA, Beckman JA, Brown KA, et al: ACC/AHA Guidelines on perioperative cardiovascular evaluation and care for noncardiac surgery: Executive summary. Circulation 116:1971–1996, 2007. © Elsevier. Fotocopiar sin autorización es un delito 4. Hunt SA, Abraham WT, Chin MH, et al: ACC/AHA Guideline update for the diagnosis and management of chronic heart failure in the adult: Task force on practice guidelines. Circulation 112:e154–e235, 2005. Capítulo 35 Valvulopatías Tamas Seres, MD, PhD 1. Explique la fisiopatología básica de la valvulopatía. Las valvulopatías causan una carga crónica de presión y volumen, y ambas determinan una respuesta ventricular característica llamada hipertrofia ventricular. La hipertrofia ventricular se define como un aumento de la masa del ventrículo izquierdo (VI). Las sobrecargas de presión producen una hipertrofia ventricular concéntrica, con un incremento del grosor de la pared ventricular y una cámara cardíaca de tamaño normal. La sobrecarga de volumen da lugar a una hipertrofia excéntrica con una cámara cardíaca dilatada. 2. Describa los hallazgos comunes en la historia y la exploración física de pacientes con valvulopatías. La mayoría de soplos cardíacos sistólicos no significan una cardiopatía, y muchos se relacionan con aumentos fisiológicos de la velocidad del flujo sanguíneo. Los soplos diastólicos casi siempre representan procesos patológicos y requieren una valoración cardíaca más detallada, al igual que la mayoría de los soplos continuos. Una historia de fiebre reumática, abuso de drogas por vía intravenosa, embolización a diferentes órganos, enfermedades genéticas como el síndrome de Marfan, cirugía cardíaca en la infancia o un soplo cardíaco deben alertar al médico sobre la posibilidad de una valvulopatía. La tolerancia al ejercicio suele estar disminuida, y los pacientes muestran signos y síntomas de insuficiencia cardíaca congestiva, que consisten en disnea, ortopnea, fatiga, crepitantes pulmonares, congestión venosa yugular, congestión hepática y edemas maleolares. En pacientes con el VI hipertrofiado puede haber angina y la fibrilación auricular suele acompañar al aumento de tamaño de las aurículas. 3. ¿Qué pruebas están indicadas para valorar las valvulopatías? La ecocardiografía con tecnología Doppler es el método diagnóstico fundamental en la valoración de las valvulopatías cardíacas. Permite medir el tamaño y la función de las cavidades cardíacas, los gradientes de presión a nivel de las válvulas, y valorar las áreas de la válvula y la gravedad de la enfermedad. La ecocardiografía se recomienda para: Pacientes asintomáticos con soplos diastólicos, soplos continuos, soplos holosistólicos, soplos mesosistólicos de grado 3 o más intensos, soplos sistólicos tardíos, soplos asociados con clicks de eyección o soplos que irradian al cuello o la espalda. Pacientes con soplos cardíacos y signos o síntomas de insuficiencia cardíaca, isquemia/ infarto de miocardio, síncope, tromboembolismo, endocarditis infecciosa u otras pruebas clínicas de cardiopatía estructural. El electrocardiograma (ECG) debe examinarse en busca de isquemia, arritmias, agrandamiento auricular e hipertrofia ventricular. La radiografía de tórax puede mostrar un aumento del tamaño de las cavidades, sugerir hipertensión pulmonar o poner de manifiesto un edema pulmonar o un derrame pleural. El cateterismo cardíaco se utiliza para la valoración de estos pacientes antes de la cirugía, sobre todo para diagnosticar una enfermedad coronaria. Este método permite visualizar las cámaras cardíacas y medir presiones en las diferentes cavidades, así como determinar los gradientes de presión a través de las válvulas. 4. ¿Qué utilidad tiene la ecocardiografía en la anestesia? La ecocardiografía transesofágica (ETE) puede emplearse en el quirófano durante el tratamiento quirúrgico de las valvulopatías. Permite revaluar la gravedad de la enfermedad valvular y los problemas estructurales y funcionales que conlleva. La evaluación de la reparación valvular o 244 © 2011. Elsevier España, S.L. Reservados todos los derechos Capítulo 35 Valvulopatías 245 del funcionamiento de la válvula protésica es parte importante del manejo del paciente. Puede analizarse la función sistólica y diastólica de los dos ventrículos antes y después de la circulación extracorpórea, lo que permite programar y seguir un plan terapéutico apropiado. 5. ¿Qué otra monitorización ayuda al anestesiólogo en el período perioperatorio? Además de los controles estándar propuestos por la American Society of Anesthesiologists, un catéter intraarterial permite medir latido-a-latido la presión arterial y un acceso continuo a la sangre para la toma de muestras. Los catéteres de arteria pulmonar permiten al anestesiólogo medir el gasto cardíaco, la saturación venosa mixta y las presiones intracardíacas, incluso la presión pulmonar capilar enclavada, que es un índice importante de la función y del llenado ventricular derecho e izquierdo y sirve para guiar la fluidoterapia intravenosa y la terapia inotrópica. © Elsevier. Fotocopiar sin autorización es un delito 6. ¿Qué es un bucle presión-volumen? Un bucle presión-volumen relaciona la presión del VI con su volumen en un ciclo cardíaco completo. Cada lesión valvular ofrece un perfil único que sugiere los cambios fisiológicos compensatorios del VI. 7. ¿Cómo es un bucle presión-volumen normal? El segmento AB es el llenado ventricular, BC es la contracción isovolumétrica, CD es la eyección, y DA es la relajación isovolumétrica. D representa el cierre de la válvula aórtica; A, la abertura de la válvula mitral; B, el cierre de la válvula mitral, y C, la abertura de la válvula aórtica. El volumen sistólico (VS) es la distancia entre las líneas DA y BC en una curva normal. El volumen telesistólico (VTS) puede medirse en el punto D, y el volumen telediastólico (VTD) en el punto B. La pendiente de la relación presión-volumen telesistólicos (RPVTS) es una medida de la contractilidad. Un desplazamiento horizontal en el sentido de las agujas del reloj de la pendiente representa una disminución de la contractilidad (Figura 35-1). Figura 35-1. Bucle presión-volumen de un corazón con capacidad normal. AB, llenado ventricular; BC, contracción isovolumétrica; CD, eyección; DA, relajación isovolumétrica; A, apertura de la válvula mitral; B, cierre de la válvula mitral; C, apertura de la válvula aórtica; D, cierre de la válvula aórtica. La curva de relación presión-volumen telesistólicos (RPVTS) es un índice independiente de la carga de la contractilidad miocárdica. Si la contractilidad aumenta, la curva RPVTS se desplaza en sentido contrario a las agujas del reloj. El bucle presión-volumen es una herramienta excelente para la caracterización de la función del corazón en diferentes situaciones patológicas. VI, ventrículo izquierdo. 8. Describa la fisiopatología de la estenosis aórtica. La estenosis aórtica (EA) se clasifica como una obstrucción valvular, subvalvular o supravalvular del tracto de salida del flujo del VI. La hipertrofia concéntrica (engrosamiento de la pared ventricular con tamaño normal de la cámara) aparece como respuesta al aumento de la presión sistólica intraventricular y la tensión de la pared necesarios para mantener el flujo anterógrado. La relajación ventricular disminuye, lo que da lugar a disfunción diastólica. La disminución de la distensibilidad del VI se acompaña de un aumento de su presión telediastólica. La contractilidad y la fracción de eyección (FE) suelen mantenerse hasta una fase tardía en el proceso patológico. La contracción auricular puede representar hasta el 40% del llenado ventricular (normalmente, el 20%). En los países en desarrollo, la valvulopatía reumática sigue siendo la causa más ­habitual de EA. En Norteamérica y Europa, la EA se debe principalmente a la calcificación de una válvula trivalva nativa o a una válvula bicúspide congénita. Con frecuencia, los pacientes presentan angina, síncope o insuficiencia cardíaca congestiva. Pueden presentar angina al esfuerzo en ausencia de coronariopatía porque 246 Capítulo 35 Valvulopatías el miocardio engrosado está predispuesto a la isquemia y el aumento de la presión telediastólica del VI reduce la presión de perfusión coronaria. La esperanza de vida con síntomas de angina es de unos 5 años. Una vez aparece el síncope, la esperanza de vida media es de 3-4 años. Cuando aparece la insuficiencia cardíaca congestiva, la esperanza de vida media es de 1-2 años. 9. ¿Cómo puede calificar la gravedad de la estenosis aórtica mediante ecocardiografía? La gravedad de la EA se clasifica en función de una serie de datos hemodinámicos y de la historia natural utilizando las definiciones del área de la válvula, el gradiente medio de presión y la velocidad del chorro (jet) aórtico (Tabla 35-1). Ta b l a 3 5 - 1 . G r av e d a d d e l a e s t e n o s i s a ó r t i c a Área de la válvula aórtica (cm2) Gradiente medio de presión de la válvula aórtica (mmHg) Velocidad del chorro aórtico (m/s) Leve Grave >1,5 <25 <3 <1 >40 >4 10. ¿Cuál es la indicación para la sustitución de la válvula aórtica en la estenosis aórtica? Según las guías de 2006 del American College of Cardiology/American Heart Association (ACC/ AHA), la sustitución de la válvula aórtica está indicada en los siguientes pacientes: Pacientes sintomáticos con EA grave. Pacientes con EA grave que se someten a cirugía de revascularización coronaria. Pacientes con EA grave sometidos a cirugía de la aorta o de otras válvulas cardíacas. Pacientes con EA grave y disfunción sistólica del VI (fracción de eyección <50%). Es razonable para pacientes con EA moderada sometidos a cirugía coronaria o cirugía de la aorta u otras válvulas cardíacas. 11. ¿Cómo son los cambios compensadores en el ventrículo izquierdo representados por el bucle de presión-volumen? Debido a la estenosis aórtica, el VI trabaja a presiones intraventriculares más altas para generar un volumen sistólico normal. La mayor tensión sistólica de la pared inicia el engrosamiento miocárdico y la hipertrofia del VI (HVI). El VI hipertrofiado se ­caracteriza por una elevada contractilidad para conseguir el trabajo de presión (Figura 35-2). La HVI disminuye la tensión de la pared durante la sístole, lo que mejora la relación del Figura 35-2. Bucle presión-volumen en la estenosis aórtica trabajo sistólico con la de(EA) comparado con el bucle normal. Para generar un volumen manda de oxígeno. A medida sistólico normal, la presión intraventricular se eleva por el que aumenta la EA, la presión gradiente de presión a nivel de la válvula aórtica. La presión sistólica del VI aumenta hasta telediastólica es más alta de lo normal en casos en los que la un nivel al cual la HVI no hipertrofia del VI altera la distensibilidad del VI. La contractilidad puede normalizar la tensión miocárdica es mayor de lo normal. de la pared. En este punto, el Capítulo 35 Valvulopatías 247 corazón empieza a dilatarse, lo que induce una disfunción sistólica y una disminución del gasto cardíaco (GC). 12. ¿Cuáles son los objetivos hemodinámicos en el manejo de la anestesia en los pacientes con estenosis aórtica? Los pacientes deben tener un volumen intravascular suficiente para llenar el ventrículo no distensible. Hay que mantener la contractilidad para superar el elevado gradiente de presión a través de la válvula aórtica. Una reducción de la presión arterial o de la resistencia periférica no disminuye la poscarga del VI, porque hay una resistencia fija contra la eyección de sangre, pero sí disminuye la perfusión coronaria, con el gran riesgo de aparición de isquemia subendocárdica y muerte súbita. Se deben evitar las frecuencias cardíacas extremas. La bradicardia lleva a una disminución del GC en los pacientes con un volumen sistólico relativamente fijo. La taquicardia puede producir isquemia con un tiempo diastólico limitado para la perfusión coronaria. El mantenimiento del ritmo sinusal es mandatario por la importancia de la contracción auricular en el llenado del VI. Una cardioversión de urgencia está indicada en el paciente que sufre un compromiso hemodinámico grave por arritmia. © Elsevier. Fotocopiar sin autorización es un delito 13. Explique el manejo de los pacientes con estenosis aórtica después del recambio valvular aórtico. Después de la cirugía, disminuye la presión telediastólica del VI y aumenta el volumen sistólico; sin embargo, el VI hipertrofiado aún precisa una precarga alta para funcionar adecuadamente. Una función miocárdica deprimida sugiere una protección miocárdica inadecuada durante la cirugía, por la dificultad en la perfusión del VI hipertrofiado. Los fármacos inotrópicos (p. ej., dopamina, dobutamina, adrenalina) pueden mejorar la capacidad del VI en estos casos. 14. Describa la fisiopatología de la insuficiencia aórtica. En la insuficiencia aórtica (IA) crónica hay una sobrecarga de volumen diastólico del VI porque parte del volumen sistólico regurgita a través de la válvula aórtica incompetente durante la diástole. Los pacientes presentan un gran volumen telediastólico y sistólico. La carga de volumen ­genera una elevada tensión de la pared en la diástole, lo que inicia una hipertrofia excéntrica (ventrículo izquierdo dilatado con pared normal o engrosada). El aumento del área del orificio regurgitante, la bradicardia (aumento relativo del tiempo invertido en diástole) y el aumento de la resistencia vascular sistémica incrementan la cantidad de flujo regurgitante. En la IA crónica puede haber un aumento destacado de la distensibilidad y del volumen sistólico, mientras que la contractilidad disminuye gradualmente (Figura 35-3). La IA puede deberse a patología estructural de las valvas o a un aumento de tamaño de la raíz aórtica. En los países en desarrollo, la causa más frecuente es la cardiopatía reumática. En los países desarrollados, su causa más habitual es la dilatación de la raíz aórtica, una válvula aórtica bicúspide congénita o la endocarditis infecciosa. Las causas de IA aguda son la endocarditis infecciosa, la disección aórtica (síndrome de Marfan) y la que se presenta tras valvulotomía con balón aórtico o tras el fracaso de la corrección quirúrgica. En condiciones ideales, los pacientes con IA crónica deben someterse a cirugía de sustitución valvular antes del inicio de la lesión miocárdica irreversible. En la IA aguda, el VI está sometido a una sobrecarga de volumen masiva y rápida con un aumento de la presión telediastólica. La hipotensión y el edema pulmonar pueden requerir cirugía urgente de sustitución valvular (véase la Figura 35-3). 15. ¿Qué parámetros se utilizan en ecocardiografía para clasificar la gravedad de la insuficiencia aórtica? Véase la Tabla 35-2. 16. ¿Cuál es la indicación de la sustitución de la válvula aórtica en la insuficiencia aórtica? Según las guías de 2006 del ACC/AHA, la cirugía de sustitución de la válvula aórtica está indicada en los siguientes pacientes: Pacientes sintomáticos con IA grave con independencia de la función sistólica del VI. Pacientes asintomáticos con IA grave crónica y disfunción sistólica del VI (PE ≤50%) en reposo. Pacientes asintomáticos con IA grave crónica que se someten a cirugía de revascularización coronaria o cirugía de la aorta o de otras válvulas cardíacas. 248 Capítulo 35 Valvulopatías Figura 35-3. Bucles de presión-volumen en la insuficiencia aórtica (IA) comparados con el bucle normal. En la IA aguda aumentan el volumen telediastólico y telesistólico. El volumen sistólico puede aumentar, ser normal o disminuir, lo que depende de la gravedad de la valvulopatía. El volumen ventricular izquierdo (VI) aumenta durante el período de relajación isovolumétrica (segmento DA). La presión telediastólica (segmento AB, punto Bt) es alta. La contractilidad está disminuida debido a la sobredistensión miocárdica. En la IA crónica aumentan el volumen telediastólico, telesistólico y sistólico. El gasto cardíaco es normal, y la contractilidad disminuye. Así mismo, el volumen del VI aumenta durante el período de relajación isovolumétrica (segmento DA), pero la presión telediastólica (segmento ABt, punto Bt) es normal; por consiguiente, el corazón posee una reserva diastólica para adaptarse a las limitaciones de carga de volumen o presión. VI, ventricular izquierdo. Ta b l a 3 5 - 2 . G r av e d a d d e l a i n s u f i c i e n c i a a ó r t i c a Amplitud del chorro en la ecografía Doppler color (% del diámetro del TSVI) Vena contracta en la ecografia Doppler color (cm) Volumen regurgitante (ml) Fracción regurgitante (%) Área del orificio regurgitante (cm2) Tamaño del ventrículo izquierdo Leve Grave <25 >65 <0,3 <30 <30 <0,1 Normal >0,6 ≥60 ≥50 ≥0,3 Aumentado TSVI, tracto de salida del ventrículo izquierdo. Es razonable para pacientes asintomáticos con IA grave y función sistólica normal del VI (FE ≥50%) pero con grave dilatación del VI (dimensión telediastólica >75 mm o dimensión telesistólica >55 mm). 17. ¿Cómo es el bucle de presión-volumen en la insuficiencia aórtica aguda y crónica? En la IA aguda, el volumen telesistólico y telediastólico aumenta. El volumen sistólico puede aumentar, ser normal o disminuir, según la gravedad del proceso. Durante el período de relajación isovolumétrica, el volumen del VI aumenta. La presión telediastólica es alta. La presión teledias- Capítulo 35 Valvulopatías 249 tólica >25-30 mmHg se manifiesta en forma de edema pulmonar. La contractilidad disminuye debido a la sobredistensión del miocardio. No hay reserva diastólica, por lo que el corazón no puede aumentar el VS con un aumento de la precarga o la poscarga (véase la Figura 35-3). En la IA crónica, aumentan los volúmenes telediastólico, telesistólico y sistólico. El GC es normal, aunque la contractilidad está disminuida. A pesar del aumento del VTD del VI, la presión telediastólica es normal; por lo tanto, el corazón dispone de una reserva diastólica para aumentar el volumen sistólico con una mayor precarga o poscarga (véase la Figura 35-3). 18. ¿Cuáles son los objetivos hemodinámicos en el manejo anestésico de pacientes con insuficiencia aórtica? En la IA aguda el objetivo es obtener la presión arterial sistémica tolerable más baja para aumentar el VS y el GC. Es necesaria una precarga apropiada para mantener el flujo anterógrado. Una taquicardia modesta reduce los volúmenes ventriculares y limita el tiempo disponible para la regurgitación. Debe mantenerse la contractilidad; si es necesario, pueden administrarse agonistas adrenérgicos b. La dobutamina es un fármaco ideal porque no aumenta la poscarga. La reducción de la poscarga aumenta el flujo anterógrado pero puede ser necesario aumentar la cantidad de líquidos administrados para mantener la precarga. Los aumentos de la poscarga dan lugar a un aumento de la presión telediastólica del VI y a hipertensión pulmonar. 19. Explique los cambios hemodinámicos en pacientes con insuficiencia aórtica después del recambio valvular aórtico. Después de la cirugía, la presión y el VT del VI disminuyen. Se debe aumentar la precarga, administrando volumen para mantener el llenado del VI dilatado. La disminución de la contractilidad miocárdica requiere inotropos o un tratamiento de soporte con balón intraaórtico. 20. ¿Cuál es la fisiopatología de la estenosis mitral? A medida que se estrecha el orificio de la válvula mitral (VM), la aurícula izquierda experimenta una sobrecarga de presión. A diferencia de otras lesiones valvulares, el VI muestra una carga relativamente baja de volumen debido a la obstrucción del flujo sanguíneo anterógrado desde la aurícula. El aumento de la presión auricular puede transmitirse al circuito pulmonar y, por lo tanto, dar lugar a hipertensión pulmonar e insuficiencia cardíaca derecha. La aurícula sobredistendida es propensa a la fibrilación con la pérdida consiguiente de la sístole auricular, lo que provoca una disminución del llenado ventricular y del GC. Los síntomas (fatiga, disnea al esfuerzo y hemoptisis) pueden agravarse cuando se produce un aumento del GC (p. ej., durante el embarazo, una enfermedad, la anemia y el ejercicio). La estasis sanguínea en la aurícula izquierda constituye un riesgo de formación de trombo y embolización sistémica. La estenosis mitral (EM) suele ser secundaria a una enfermedad reumática (80-90% de casos), endocarditis infecciosa (3,3%) y calcificación del anillo mitral (2,7%). La estenosis crítica de la válvula aparece 10-20 años después de la enfermedad reumática inicial. © Elsevier. Fotocopiar sin autorización es un delito 21. ¿Qué parámetros se utilizan en la ecocardiografía para clasificar la gravedad de la estenosis mitral? Véase la Tabla 35-3. Ta b l a 3 5 - 3 . G r av e d a d d e l a e s t e n o s i s m i t r a l Gradiente medio de presión de la válvula mitral (mmHg) Área de la válvula (cm2) Presión sistólica de la arteria pulmonar (mmHg) Leve Grave <5 >1,5 <30 >10 <1 >50 22. ¿Cuál es la indicación de la sustitución de la válvula mitral en la estenosis mitral? Según las guías de 2006 del ACC/AHA, la cirugía de la VM está indicada en los siguientes pacientes: La cirugía de la VM (con reparación si es posible) está indicada en pacientes con EM moderada o grave sintomática (clase funcional III-IV de la NYHA) cuando: No se dispone de valvulotomía percutánea con balón mitral. 250 Capítulo 35 Valvulopatías Cuando la valvulotomía percutánea con balón mitral está contraindicada debido a la presencia de trombos en aurícula izquierda a pesar del tratamiento anticoagulante o debido a la presencia de una insuficiencia mitral (IM) concomitante moderada o grave. La morfología de la válvula no es favorable a una valvulotomía percutánea con balón mitral en un paciente con un riesgo quirúrgico aceptable. Los pacientes sintomáticos con EM moderada o grave también portadores de IM moderada o grave deben recibir tratamiento de sustitución de la VM a menos que, en el momento de la cirugía, sea posible la reparación valvular. La sustitución de la VM es razonable para pacientes con EM grave e hipertensión pulmonar grave (presión sistólica de la arteria pulmonar >60 mmHg) con síntomas de clase funcional I-II de la NYHA que no se consideran candidatos a valvulotomía percutánea con balón mitral o reparación quirúrgica de la VM. 23. ¿Cómo es el bucle presiónvolumen en la estenosis mitral respecto al normal? Los volúmenes telediastólico, telesistólico y sistólico son bajos, por el limitado flujo de llegada al VI. El VI genera una presión arterial baja. La contractilidad está disminuida por el llenado crónicamente deficiente del VI (Figura 35-4). 24. ¿Cuáles son las consideraciones anestésicas en la estenosis mitral? Figura 35-4. Bucle presión-volumen en la estenosis El volumen intravascular debe ser mitral (EM) comparado con el bucle normal. En la EM, el suficiente para mantener el flujo los volúmenes telesistólico, telediastólico y sistólico son a través de la válvula estenótica. pequeños. El ventrículo izquierdo (VI) genera poca presión Una frecuencia cardíaca lenta es arterial. La contractilidad disminuye por el bajo llenado crónico del VI. beneficiosa, puesto que permitirá mayor tiempo para que la sangre pase a través de la válvula y para que aumente el llenado ventricular. Debe mantenerse el ritmo sinusal para un llenado adecuado del VI, puesto que la contracción auricular contribuye, aproximadamente, en un 30% del VS. El bajo llenado crónico del VI lleva a una contractilidad ventricular baja, incluso después de la restauración de un llenado normal. Hay que evitar los fármacos inotrópicos negativos. Los incrementos de la resistencia vascular pulmonar exacerban la insuficiencia ventricular derecha, de modo que hay que evitar la acidosis, la hipoxemia y la hipercapnia. Por esta razón, los efectos depresores respiratorios de la medicación sedante preoperatoria pueden ser especialmente nocivos. 25. Explique el manejo postoperatorio de pacientes con estenosis mitral después del recambio valvular mitral. Una disminución de la presión auricular izquierda disminuye la resistencia vascular pulmonar y la presión de la arteria pulmonar, y aumenta el GC. Sin embargo, la función del VI puede disminuir, por el bajo llenado crónico del VI, especialmente después de la circulación extracorpórea. Hay que conseguir un aumento de la precarga y la reducción de la poscarga con el fin de mejorar el flujo sanguíneo anterógrado. Pueden hacer falta los inotropos o el tratamiento de soporte con balón intraaórtico para mejorar la función sistólica del VI. 26. Describa la fisiopatología de la insuficiencia mitral. Las causas de valvulopatía primaria y de IM crónica incluyen el prolapso de la VM, la endocarditis infecciosa, traumatismos, cardiopatía reumática, fármacos (ergotamina, pergolida) y Capítulo 35 Valvulopatías 251 la hendidura valvular congénita. Las causas secundarias incluyen la cardiopatía isquémica, una disfunción sistólica del VI y la miocardiopatía hipertrófica. En la IM crónica, el VI y la aurícula izquierda muestran sobrecarga de volumen, que inducen un aumento del VTD del VI con una presión telediastólica normal. El volumen telesistólico del VI es normal, de modo que el VS es alto, pero parte de este VS escapa, a través de la válvula incompetente, hacia la aurícula izquierda. La FE suele ser alta por la baja resistencia a la regurgitación. Una FE del 50% indica una disfunción importante del VI. Una aurícula izquierda grande, muy distensible, puede mantener una presión auricular izquierda casi normal, a pesar de grandes volúmenes de regurgitación. Al igual que en la IA, el flujo que regurgita depende del tamaño del orificio valvular, del tiempo disponible para el flujo que regurgita (bradicardia) y del gradiente de presión transvalvular. En la IM aguda, el volumen y la presión telediastólicos aumentan; y el circuito pulmonar y las cavidades cardíacas derechas están sometidos a aumentos súbitos de presión y volumen, que pueden precipitar una hipertensión pulmonar aguda, un edema pulmonar y una insuficiencia cardíaca derecha. La IM aguda puede aparecer en el contexto de desplazamiento de los velos causado por prolapso de la VM, una endocarditis infecciosa o un traumatismo. Las cuerdas tendinosas pueden experimentar una rotura espontánea o a partir de un traumatismo, de una endocarditis infecciosa o de la fiebre reumática. Los músculos papilares pueden romperse debido a un infarto agudo de miocardio o un traumatismo. 27. ¿Qué parámetros se utilizan en ecocardiografía para clasificar la gravedad de la insuficiencia mitral? Véase la Tabla 35-4. Ta b l a 3 5 - 4 . G r av e d a d d e l a i n s u f i c i e n c i a m i t r a l © Elsevier. Fotocopiar sin autorización es un delito Área del chorro en la ecografía Doppler color (cm2) Área del chorro en la ecografía Doppler color (% de la aurícula izquierda) Vena contracta en la ecografía Doppler color (cm) Volumen regurgitante (ml) Fracción regurgitante (%) Área del orificio regurgitante (cm2) Tamaño auricular y ventricular izquierdos Leve Grave <4 <20 <0,3 <30 <30 <0,1 Normal >8,0 >40 >0,7 ≥60 ≥50 ≥0,3 Aumentado 28. ¿Cuál es la indicación de la cirugía de sustitución de la válvula mitral en la insu­ ficiencia mitral? Según las guías de 2006 del ACC/AHA, la cirugía de la VM está indicada en los siguientes pacientes: Pacientes sintomáticos con IM grave aguda. Pacientes sintomáticos (clase funcional II, III o IV de la NYHA) con IM grave crónica. Pacientes asintomáticos con IM grave crónica y disfunción leve o moderada del VI (FE 30-60% y/o dimensión telesistólica ≥40 mm pero ≤55 mm). Se recomienda la reparación de la VM más que la sustitución valvular en la mayoría de pacientes con IM crónica grave que requieren cirugía. 29. ¿Cómo cambia el bucle presión-volumen en la insuficiencia mitral respecto al normal? En la IM aguda, el VTD aumenta con la presión telediastólica elevada. El VTD es normal o está disminuido, el VS está elevado, pero el volumen de eyección a la aorta es relativamente pequeño según el volumen de regurgitación (Figura 35-5). En la IM crónica, el VTD está aumentado, con una presión telediastólica normal por el proceso de remodelado miocárdico crónico. El volumen telesistólico es normal. Un VS muy elevado 252 Capítulo 35 Valvulopatías permite un GC anterógrado a pesar de una regurgitación importante. La contractilidad está disminuida (véase la Figura 35-5). Figura 35-5. Bucle presión-volumen en la insuficiencia mitral (IM) comparado con el bucle normal. En la IM aguda, el volumen telediastólico aumenta con la presión telediastólica elevada. El volumen telesistólico es normal o bajo, debido a que parte del volumen sistólico regurgita hacia la aurícula izquierda de baja presión durante el período de contracción isovolumétrica (segmento BC). En la IM crónica, el volumen telediastólico es elevado, con una presión telediastólica ligeramente elevada o normal. El volumen telesistólico es normal o alto, dependiendo de la gravedad de la IM y de la función sistólica del ventrículo izquierdo (VI). El volumen cardíaco eyectado es suficiente para mantener un gasto cardíaco adecuado. La contractilidad está deprimida. P U N T OS CLAVE: Valvulopat ías 1. En la EA los objetivos hemodinámicos son el mantenimiento de la volemia, la contractilidad, la resistencia vascular periférica y el ritmo sinusal al mismo tiempo que se evitan frecuencias cardíacas extremas. Las arritmias asociadas con hipotensión requieren cardioversión con carácter urgente. 2. En el paciente con IA los objetivos hemodinámicos son el aumento de la precarga, el mantenimiento de la contractilidad, una frecuencia cardíaca normal o alta y la reducción de la poscarga. 3. En pacientes con EM, los objetivos hemodinámicos son el mantenimiento de la volemia, la poscarga, ritmo sinusal y una frecuencia cardíaca más lenta. Se evitará la hipoxemia, la hipercapnia y la acidosis porque pueden aumentar la resistencia vascular pulmonar. Los fármacos sedantes se administrarán con precaución. 4. En el paciente con IM, los objetivos hemodinámicos son el mantenimiento de la volemia, la contractilidad y el aumento de la frecuencia cardíaca al mismo tiempo que se reduce la poscarga. Al igual que en la EM, se evitarán situaciones que aumenten la resistencia vascular pulmonar. 30. ¿Cuáles son los objetivos hemodinámicos del manejo anestésico de la insuficiencia mitral? El volumen intravascular debería mantenerse para rellenar totalmente el VI dilatado. El mejor nivel de aumento de precarga para el paciente se basa en la respuesta clínica a la carga de Capítulo 35 Valvulopatías 253 fl­ uidos. La bradicardia aumenta el volumen de regurgitación, disminuyendo el volumen eyectado en la aorta. Una frecuencia cardíaca normal o ligeramente elevada ayuda a disminuir el volumen de flujo de regurgitación. Mantener la contractilidad mediante fármacos inotrópicos con efectos reductores de la poscarga (dobutamina o milrinona). La reducción de la poscarga aumenta el flujo anterógrado y disminuye la regurgitación. Como en la EM, hay que evitar los fármacos y las maniobras que aumentan la resistencia vascular pulmonar. 31. Explique el manejo hemodinámico después del recambio o la reparación valvular mitral en un paciente con insuficiencia mitral. Un vez la válvula está colocada en su sitio, el VI tiene que inyectar el VS completo a la aorta. Este aumento inmediato de la carga de presión aumenta la tensión del VI y compromete la FE. Por tanto, pueden ser necesarios fármacos inotrópicos o estrategias de soporte con balón intraaórtico hasta que el VI se adapte al nuevo estado hemodinámico. La precarga debe aumentarse para llenar totalmente el VI dilatado. Bibliografía Recomendada 1. Bonow RO, Carabello BA, Chatterjee K, et al: ACC/AHA Guidelines for the Management of patients with valvular heart disease. Circulation 114:450–527, 2006. © Elsevier. Fotocopiar sin autorización es un delito 2. Sukernik M, Martin DE: Anesthetic management for the treatment of valvular heart diseases. In Hensley FA, Martin GP, Gravlee GP, eds. A practical approach to cardiac anesthesia, ed 4, Philadelphia, Lippincott Williams & Wilkins, 2008, pp 316–347. Capítulo 36 Patología AÓRTICA OCLUSIVA Luke Osborne, MD 1. Defina la vasculopatía aórtica. La patología aórtica oclusiva se caracteriza por cambios ateroscleróticos dentro de la aorta (en general, de la aorta abdominal) que se extienden a la arteria ilíaca y a la femoral y dan lugar a la hipoperfusión de los órganos vitales y de las extremidades inferiores. Es frecuente la afectación de la bifurcación ilíaca y de las arterias renales; también es posible encontrar cambios aneurismáticos. El 70% de aneurismas aórticos son infrarrenales y el 30% incluyen las arterias renales. 2. ¿Qué factores de riesgo y enfermedades coexistentes son habituales en estos pacientes? Los factores de riesgo son el tabaquismo, los antecedentes familiares, la obesidad, la enfermedad aterosclerótica en otras regiones, la edad avanzada y el sexo masculino. Las enfermedades subyacentes más habituales son la hipertensión arterial, la cardiopatía isquémica, la insuficiencia cardíaca (IC), la enfermedad pulmonar obstructiva crónica (EPOC), la diabetes mellitus, la nefropatía crónica y la arteriopatía carotídea. 3. ¿Cuál es la progresión natural de la vasculopatía aórtica? La historia natural de la patología aneurismática se caracteriza por un aumento de tamaño continuo. Cuando el diámetro del aneurisma es ≥6 cm se debe efectuar una corrección quirúrgica abierta o endovascular. La incidencia de rotura aumenta con el tamaño (en el primer año, para aneurismas de 5,5-5,9 cm, un 9,4% de probabilidades de rotura, que aumenta hasta el 32,5% para aneurismas ≥7 cm). En Estados Unidos, la tasa de mortalidad nacional de la corrección programada de un aneurisma abdominal con cirugía abierta es <5%. Para la reparación de una rotura aguda, la mortalidad perioperatoria sigue siendo alta, del orden del 50%. La mortalidad de la cirugía abierta en los aneurismas torácicos varía del 5 al 14%. Las técnicas endovasculares han reducido la mortalidad. La tasa de supervivencia es del 92% en el primer año y del 67% a los 5 años. La patología aórtica oclusiva provoca una hipoperfusión distal a la oclusión. A diferencia de la cirugía para la patología aneurismática, el tratamiento de la patología oclusiva debe instaurarse cuando el paciente manifiesta síntomas y fracasa el tratamiento médico. 4. Describa la preparación preoperatoria de los pacientes con patología asociada. El objetivo de la valoración preoperatoria es optimizar cualquier disfunción orgánica de importancia. Coronariopatía: es la principal causa de mortalidad y morbilidad perioperatorias. El infarto de miocardio afecta al 4-15% de pacientes y en el 30% se detecta IC en el postoperatorio de la corrección del aneurisma. Si el paciente presenta un síndrome coronario agudo, IC descompensada, valvulopatías graves o arritmias importantes, debe someterse a pruebas diagnósticas cardiológicas preoperatorias, incluida una ecocardiografía, una prueba de esfuerzo y una angiografía coronaria. También puede estar claramente indicada la valoración de las arterias coronarias en presencia de insuficiencia renal, antecedentes de IC o de enfermedad vascular cerebral, o si el paciente es portador de diabetes mellitus o no puede alcanzar un nivel de equivalente metabólico (MET) de 4. Respiratoria: se ha mencionado que la EPOC es muy frecuente en estos pacientes. La exploración física, las pruebas de función pulmonar, la gasometría arterial y la radiografía de tórax pueden indicar aplicar espirometría incentivada preoperatoria y tratamiento broncodilatador y antibiótico. 254 © 2011. Elsevier España, S.L. reservados todos los derechos Capítulo 36 Patología AÓRTICA OCLUSIVA 255 Renal: en la corrección quirúrgica programada de la aorta infrarrenal, la incidencia de disfunción renal postoperatoria es del 3% y hasta del 30% en la de la aorta torácica. La causa principal de insuficiencia renal es una nefropatía preexistente. Debe definirse el grado de disfunción renal, y el paciente requiere una hidratación adecuada. Una hipertensión arterial mal controlada debe optimizarse. Si el paciente requiere un estudio con contraste antes de la cirugía, es necesaria su hidratación adecuada antes de la administración del contraste y la exposición a la cantidad mínima posible de contraste; se evitarán los estudios repetidos. Enfermedad vascular cerebral: deben buscarse signos y síntomas de insuficiencia vascular cerebral. La hipoperfusión cerebral durante la cirugía puede provocar un ictus. Si se detecta estenosis carotídea, antes de la corrección del aneurisma aórtico, puede ser necesaria una endarterectomía. Los pacientes con hipertensión arterial crónica también presentan cambios de la autorregulación cerebral, y ésta es la segunda justificación para adecuar el tratamiento preoperatorio de la hipertensión. Diabetes mellitus: debe estar bien controlada. © Elsevier. Fotocopiar sin autorización es un delito 5. Cite la monitorización intraoperatoria apropiada para la cirugía aórtica. Los parámetros de monitorización de referencia incluyen la pulsioximetría y la de la presión arterial no invasiva y la temperatura. Es esencial la monitorización continua del ritmo cardíaco (derivación II) y de la isquemia (derivación V5). También es esencial la monitorización habitual del aparato de anestesia, incluida la capnografía y la concentración de oxígeno suministrado. La monitorización intraarterial detecta rápidamente las oscilaciones de la presión arterial y facilita la toma de muestras para el laboratorio. Es fundamental la monitorización de la diuresis con un catéter de Foley y urinómetro. En presencia de disfunción miocárdica y valvulopatía es apropiado el uso de un catéter para monitorizar la presión venosa central, un catéter en la arteria pulmonar y/o la ecocardiografía transesofágica. Si se considera que la isquemia de la médula espinal es un riesgo, pueden ser útiles los potenciales evocados somatosensoriales y motores. 6. Describa las implicaciones fisiológicas del pinzamiento y despinzamiento aór­ ticos. El pinzamiento aórtico aumenta la poscarga ventricular izquierda. La preparación del pinzamiento incluye el aumento de la profundidad de la anestesia, el tratamiento con vasodilatadores (nitroglicerina o nitroprusiato sódico) y posiblemente la administración de bloqueantes a o antagonistas del calcio. En alrededor del 90% de pacientes que se someten a un pinzamiento de aorta torácica y en alrededor de un 40% de los que se someten a un pinzamiento de la aorta infrarrenal se produce una disminución del flujo sanguíneo renal. Hay una redistribución del flujo renal a la corteza y una disminución de la filtración glomerular. Estos cambios persisten y sobrepasan la retirada del pinzamiento. La posibilidad de una disminución clínicamente profunda del flujo sanguíneo de la arteria espinal anterior es más probable en la corrección de un aneurisma de la aorta torácica y tiene el riesgo de isquemia de la médula espinal; en ciertos casos, se ha instaurado un drenaje lumbar del líquido cefalorraquídeo para mitigar las consecuencias de la disminución de la presión de perfusión de la médula espinal. Tras el despinzamiento se observan hipotensión y una disminución de la resistencia vascular sistémica. Los metabolitos isquémicos, el ácido láctico y el potasio que regresan a la circulación central deprimen la contractilidad y potencian la hipotensión. 7. Revise los objetivos anestésicos de estos pacientes quirúrgicos. Anestesia, analgesia, amnesia y relajación muscular. Se mantendrá el gasto cardíaco y la perfusión coronaria y se limitará la carga de trabajo miocárdico controlando la frecuencia cardíaca y la poscarga, en particular durante el pinzamiento aórtico. Cuando sea necesario, se repondrá la pérdida hemática mediante un tratamiento agresivo con soluciones cristaloides, coloides y sangre o hemoderivados. La hemorragia masiva probablemente provocará una coagulopatía que requerirá su corrección. 256 Capítulo 36 Patología AÓRTICA OCLUSIVA Se mantendrá la oxigenación y la ventilación, guiadas por la gasometría arterial. Unas presiones ventilatorias excesivas pueden comprometer la precarga. El mejor modo de preservar la función renal es mantener una volemia, gasto cardíaco y oxigenación normales. En particular en pacientes con diabetes, es preciso monitorizar y controlar la glucemia. El tratamiento con insulina no sólo controla la hiperglucemia, sino que también previene la cetoacidosis y puede acelerar la curación de la herida y mejorar la evolución a largo plazo. Durante el pinzamiento aórtico o una hipoperfusión prolongada, la hipoperfusión de la arteria espinal anterior hace correr al paciente un riesgo de paraplejía, en especial durante la cirugía de la aorta torácica. Antes del despinzamiento, es prudente administrar una carga intravenosa de líquidos. En ocasiones puede ser necesario volver a pinzar la aorta o dejarla pinzada parcialmente para permitir al paciente el tiempo necesario para estabilizarse. 8. ¿Qué medidas intraoperatorias puede tomar para preservar la función renal? La incidencia de lesión renal aguda tras la corrección programada de un aneurisma infrarrenal es del orden del 3%. Sin embargo, la mortalidad en estos pacientes es del 40% y su incidencia no ha cambiado en décadas. El mayor factor pronóstico de disfunción renal postoperatoria es una nefropatía preexistente. No se puede presuponer que la perfusión renal es suficiente sólo por la cantidad de diuresis ya que ésta no se correlaciona con la función renal postoperatoria. La estimulación de la diuresis con diuréticos (furosemida y manitol) y dopamina no garantiza que la función renal se preservará en el período postoperatorio. Los factores más importantes que influyen en la función renal postoperatoria son la función renal preoperatoria, el grado de enfermedad aórtica y la duración del pinzamiento. Por esta razón, es primordial optimizar la función renal antes de la cirugía, mantener la euvolemia y la perfusión renal y reducir a un mínimo el tiempo de pinzamiento. En el período perioperatorio también es preciso evitar los fármacos nefrotóxicos (p. ej., gentamicina) o los que disminuyen el flujo sanguíneo renal (fármacos antiinflamatorios no esteroides). Para la prevención de la insuficiencia renal se han administrado dopamina, furosemida, manitol y fenoldopam (un agonista selectivo del receptor tipo 1 de la dopamina), pero no se dispone de pruebas de su eficacia o éstas son controvertidas. En el mejor de los casos, las pruebas de que las dosis bajas de dopamina (2 mg/kg/min) producen efectos positivos son dudosas. Además, esta amina tiene el efecto adverso de inducir taquicardia y aumentar el trabajo cardíaco en pacientes predispuestos a una enfermedad miocárdica. La furosemida puede causar hipoperfusión renal en los estados hipovolémicos e inducir desequilibrios electrolíticos. Las evidencias sobre la protección renal con manitol son poco concluyentes pero sigue utilizándose para estimular la diuresis previa al pinzamiento. Muchos médicos consideran que este diurético osmótico tiene efectos beneficiosos renales porque aumenta el flujo sanguíneo cortical y reduce el edema endotelial y la congestión vascular. El fenoldopam es un fármaco antihipertensivo que dilata los vasos renales y esplácnicos. Este incremento del flujo sanguíneo renal puede ser ventajoso pero se requiere un mayor número de estudios prospectivos. 9. ¿Cuáles son las ventajas potenciales de la analgesia epidural postoperatoria? La anestesia epidural puede suprimir el tono simpático y la respuesta al estrés al mismo tiempo que proporciona una analgesia excelente. Esto limita el trabajo miocárdico porque atenúa la taquicardia y las fluctuaciones hipertensivas en pacientes predispuestos a isquemia cardíaca. También proporciona una analgesia postoperatoria sin una sedación excesiva. No obstante, una preocupación con la analgesia neuroaxial es la formación de un hematoma en el contexto de una anticoagulación. Se considera una medida sin riesgos siempre que haya transcurrido como mínimo una hora desde la aplicación del catéter epidural hasta la heparinización del paciente. 10. ¿Cuáles son las preocupaciones específicas de la corrección endovascular del aneurisma aórtico? La corrección endovascular de la aorta es una técnica relativamente nueva en la que se usan stents introducidos a través de una arteria (en general, la femoral) y guiados hasta la aorta por medio de fluoroscopia. El paciente debe permanecer inmóvil durante el procedimiento pero en Capítulo 36 Patología AÓRTICA OCLUSIVA 257 general es apropiada una anestesia neuroaxial o local. Esta última presenta la ventaja de requerir menos tratamiento de soporte con líquidos y vasopresores, aunque, comparada con la anestesia general, se asocia al mismo grado de complicaciones pulmonares y cardíacas. Habitualmente, sólo son necesarios una vía arterial y la monitorización estándar, pero siempre es posible la conversión a un procedimiento abierto por lo que está justificado disponer de buenos accesos intravenosos. En conjunto, las técnicas endovasculares requieren menor tratamiento de soporte hemodinámico y líquidos, y la mortalidad a 30 días para la corrección de los aneurismas aórticos abdominales es inferior a la de la cirugía abierta (el 3% comparado con el 4%). Por otra parte, las complicaciones cardíacas, pulmonares, renales y hemorrágicas son menores. 11. Describa los aspectos principales del tratamiento de un paciente con rotura aguda de un aneurisma aórtico abdominal. Los principales determinantes de la morbilidad y mortalidad son la extensión, el tamaño y la localización de la rotura. La rotura de la capa aórtica intimal y medial tiene menos mal pronóstico a corto plazo ya que se forma un seudoaneurisma. Aunque la hemorragia es mínima, existe el riesgo de que aumente la poscarga proximalmente y que se produzca isquemia distal. Un mayor desgarro aórtico provoca una hemorragia rápida y sustancial. Una rotura retroperitoneal puede ser más estable temporalmente que la rotura intraabdominal, que es casi siempre mortal. La reanimación debe realizarse ya en el quirófano puesto que es necesaria una intervención quirúrgica rápida para prevenir la muerte del paciente. Debe obtenerse un control rápido de la vía aérea para optimizar la ventilación y la oxigenación. El objetivo inicial es mantener la perfusión y la oxigenación del corazón y el cerebro. Los esfuerzos deben dirigirse a restablecer la volemia. Son necesarias múltiples vías intravenosas con catéteres de gran calibre, al igual que una monitorización intraarterial y probablemente de la presión venosa central. La ecocardiografía transesofágica o el cateterismo de la arteria pulmonar pueden ser inestimables en presencia de una disfunción miocárdica preexistente, pero tiene prioridad restablecer la volemia y el tratamiento de la coagulopatía inevitable. Es preciso disponer de 10 unidades de sangre, de donante universal, y se avisará al banco de sangre ya que probablemente requerirá una transfusión masiva, con necesidades de plasma congelado fresco, concentrados de plaquetas y crioprecipitado. Las alteraciones de la coagulación se monitorizarán con tromboelastografía. La presión arterial puede requerir tratamiento de soporte inotrópico o cronotrópico, a pesar de que la reanimación con líquidos es la base del tratamiento. El objetivo ideal es mantener una presión arterial sistólica de 80-100 mmHg, aunque debe haber comunicación sobre los objetivos hemodinámicos con los cirujanos. P U N T OS CLAVE: P atología aórt ica oclus i va © Elsevier. Fotocopiar sin autorización es un delito 1. Las enfermedades coexistentes son muy frecuentes e incluyen la coronariopatía, la hipertensión arterial, EPOC, nefropatía crónica y diabetes mellitus. Estas comorbilidades tienen una importante influencia en la evolución final. 2. Según lo establecido por las 2007 ACC/AHA Guidelines, la valoración preoperatoria determina la necesidad de las pruebas complementarias y exploraciones. 3. La causa más habitual de mortalidad perioperatoria es la cardiopatía. La insuficiencia renal postoperatoria también influye de manera decisiva en el pronóstico. 4. Los objetivos de la anestesia son el mantenimiento de la volemia, al igual que atenuar los cambios hemodinámicos agudos y graves que acontecen con el pinzamiento y despinzamiento de la aorta. 12. Describa los elementos importantes de los cuidados postoperatorios. Es esencial ingresar al paciente en una unidad de cuidados intensivos. Cardíacos: es preciso supervisar a los pacientes en busca de isquemia e hipotensión. La incidencia de isquemia miocárdica es máxima alrededor del tercer día postoperatorio. Pulmonares: muchos pacientes permanecen intubados después de la cirugía si tenían previamente una función pulmonar mala, presentan disfunción ventricular izquierda o si se 258 Capítulo 36 Patología AÓRTICA OCLUSIVA han producido pérdidas masivas de líquidos. La analgesia epidural puede ser beneficiosa para desconectar al paciente de la ventilación mecánica. Renales: es importante monitorizar la concentración de electrolitos, los marcadores de la función renal y la diuresis para valorar la insuficiencia renal y el equilibrio hídrico. Otras complicaciones son la hemorragia, disfunción protésica, isquemia intestinal, ictus, acontecimientos embólicos e hipoperfusión de la extremidad. Bibliografía Recomendada 1. Greenberg RK, Lytle B: Endovascular repair of thoracoadominal aneurysms. Circulation 117:2288–2296, 2008. 2. Jones DR, Lee HT: Perioperative renal protection: best practice and research. Clin Anaesthesiol 22:193–215, 2008. 3. Kee ST, Dake MD: Endovascular stent grafting. In Jaffe RA, Samuels SI, editors: Anesthesiologist’s manual of surgical procedures, ed 3, Philadelphia, Lippincott Williams and Wilkins, 2004, pp 313–316. 4. Oliver WC Jr, Nuttall GA, Cherry KJ, et al: A comparison of fenoldopam with dopamine and sodium nitroprusside in patients undergoing cross-clamping of the abdominal aorta. Anesth Analg 103:833–840, 2006. Gurdev S. Rai, MD, y Luke Osborne, MD Capítulo 37 Patología Vascular Intracraneal Y Cerebral 1. ¿Qué es la insuficiencia vascular cerebral? La insuficiencia vascular cerebral es consecuencia de un suministro insuficiente de flujo sanguíneo, oxígeno y/o glucosa cerebral. Se desarrolla isquemia cerebral y, si no se corrige el proceso subyacente al cabo de 3-8 minutos, la consecuencia es una lesión neurológica. 2. Compare la isquemia global con la isquemia focal. La isquemia global hace referencia a la hipoxia global (insuficiencia respiratoria, asfixia) o al paro circulatorio durante el cual el cerebro no se perfunde. La isquemia focal es el resultado de acontecimientos vasoconstrictores, traumáticos, hemorrágicos, embólicos o ateroscleróticos. Si la causa subyacente se revierte rápidamente (es decir, se restablecen la perfusión y la oxigenación) puede evitarse la lesión neurológica. 3. ¿Cómo se manifiesta la insuficiencia vascular cerebral? Las manifestaciones incluyen los episodios isquémicos transitorios (EIT) y los accidentes vasculares cerebrales (AVC). Los EIT son de inicio agudo, y suponen disfunción neurológica durante minutos a horas (<24 horas), se resuelven espontáneamente y se asocian a resultados normales de la tomografía computarizada (TC). Los AVC pueden presentarse de forma aguda o progresar crónicamente con el tiempo (minutos a días). Los ictus pueden clasificarse como menores, con una recuperación completa final, o mayores, con una discapacidad grave y permanente o la muerte. Además de las anomalías vasculares cerebrales, los AVC se asocian a otras comorbilidades, incluidas la hipertensión arterial, diabetes, coagulopatías, fibrilación auricular, valvulopatía mitral, endocarditis y abuso de sustancias. Un tercer grupo de pacientes experimenta disfunción neurológica durante más de 24 horas, con un restablecimiento espontáneo y completo al cabo de 1-2 semanas. Este fenómeno se conoce como déficit neurológico isquémico reversible y, desde un punto de vista fisiopatológico, debe agruparse con los EIT. 4. ¿Cuál es la etiología de los ictus y/o episodios isquémicos transitorios? La aterosclerosis en la bifurcación de la arteria carótida común es el origen de la mayor parte de los episodios isquémicos. Pueden desalojarse el propio trombo o las placas/detritos embólicos y desplazarse hasta el cerebro, dando lugar a secuelas neurológicas. La rápida resolución de los EIT (al cabo de 24 horas) es el resultado de los mecanismos inherentes del organismo para destruir dichos émbolos. Se cree que la isquemia del tronco cerebral y del lóbulo temporal y occipital se debe a una disminución transitoria del flujo sanguíneo o de la presión arterial en el sistema vertebrobasilar. La propia hipoperfusión cerebral secundaria a la estenosis aterosclerótica es responsable de menos del 10% de acontecimientos isquémicos. 5. En el pronóstico neurológico después de un episodio de insuficiencia vascular cerebral, ¿intervienen otros factores? Contribuyen a las secuelas neurológicas el tipo y el tamaño de la placa o el émbolo, el sitio de la isquemia, la magnitud de la circulación colateral, la duración de la hipoperfusión, al igual que la respuesta inherente del cerebro. © 2011. Elsevier España, S.L. Reservados todos los derechos 259 260 Capítulo 37 Patología Vascular Intracraneal Y Cerebral 6. Enumere los factores de riesgo de accidente vascular cerebral/episodio isquémico transitorio. La hipertensión arterial y el tabaquismo son los factores de riesgo más importantes. Las cardiopatías (p. ej., hipertrofia ventricular izquierda, fibrilación auricular, miocardiopatía, endocarditis y valvulopatías) son los principales factores de riesgo. Otros son la edad avanzada, diabetes, hiperlipemia, coagulopatías, cualquier tipo de vasculopatía y antecedentes maternos de ictus. En un paciente con EIT, el riesgo de experimentar ictus a los 5 años es del orden del 35%. 7. ¿Qué pacientes son candidatos a endarterectomía carotídea? En un 5-10% de la población adulta se auscultan soplos asintomáticos. Un estudio prospectivo de 1989 efectuado en 566 pacientes con soplos carotídeos asintomáticos reveló una tasa de ictus o EIT en el primer año del 2,5%, comparado con el 0,7% entre aquellos sin soplos carotídeos. El European Carotid Surgery Trial (ECST) demostró que la endarterectomía carotídea (EAC) no está indicada para la mayoría de los pacientes con estenosis moderada (30-69%), aunque estén sintomáticos. Sin embargo, la tasa de ictus o EIT aumenta considerablemente con una estenosis cada vez mayor, alcanzando una tasa del 46% al año para las >80%. Se acepta que tanto los pacientes sintomáticos como los asintomáticos con estenosis >70% son candidatos a EAC. En la actualidad, para pacientes que cumplen estos criterios pero que son candidatos quirúrgicos por su alto riesgo, se coloca un stent carotídeo. La implantación de un stent es una alternativa a la EAC en esta población de pacientes seleccionados y sólo requiere anestesia local y una pequeña incisión femoral. 8. Defina la autorregulación cerebral. ¿Cómo está afectada en la enfermedad vascular cerebral? ¿Cuáles son las implicaciones anestésicas? La autorregulación cerebral es la capacidad del cerebro para mantener un flujo sanguíneo cerebral relativamente constante (40-60 ml/100 g/min) a lo largo de unos límites amplios de presión arterial de 50-150 mmHg. La estenosis o la obstrucción de la arteria carótida interna provocan una disminución de la presión distal a la obstrucción. Con el fin de mantener el flujo sanguíneo cerebral, la vasculatura cerebral se dilata. A medida que progresa el grado de obstrucción de la carótida, los vasos cerebrales distales a la obstrucción se dilatan al máximo. En este momento, los vasos cerebrales pierden su capacidad de autorregulación. El flujo sanguíneo cerebral se hace pasivo y depende de la presión arterial sistémica. Por esta razón, es de importancia decisiva mantener la presión arterial de los pacientes candidatos a EAC, porque su reserva autorreguladora es mínima o nula para compensar las reducciones de la presión arterial inducidas por la anestesia. 9. ¿Cómo se alteran las respuestas cerebrales a la hipercapnia y la hipocapnia en la enfermedad vascular cerebral? ¿Cuáles son las implicaciones anestésicas? Los vasos cerebrales normales son muy sensibles a la presión parcial arterial de CO2 (PaCO2), se dilatan como respuesta a la hipercapnia y se contraen como respuesta a la hipocapnia. Sin embargo, en las regiones cerebrales isquémicas y ya dilatadas al máximo, esta relación desaparece, y las respuestas a la hipercapnia e hipocapnia pueden ser paradójicas. Dado que los vasos cerebrales en un área de isquemia están ya dilatados al máximo, la hipercapnia puede inducir dilatación de tan sólo aquellos con respuesta normal fuera del área isquémica. Este fenómeno, denominado robo, deriva el flujo de sangre fuera del área isquémica y compromete aún más la perfusión. Por otro lado, la hipocapnia puede provocar vasoconstricción en regiones sanas, derivando el flujo hasta áreas ligeramente perfundidas. Este fenómeno se denomina efecto Robin Hood o del robo invertido. Por lo tanto, en general, en pacientes que se someten a EAC se recomienda mantener una normocapnia. 10. ¿Cuál es el flujo sanguíneo cerebral normal? ¿A qué nivel se considera que un flujo sanguíneo cerebral es isquémico? En el ser humano, el flujo sanguíneo cerebral normal es de 40-60 ml/100 g/min (el 15% del gasto cardíaco). La tasa metabólica cerebral de O2 en el adulto es de 3-4 ml/100 g/min (el 20% del consumo de O2 de todo el organismo). Se denomina flujo sanguíneo regional cerebral (FSCr) Capítulo 37 Patología Vascular Intracraneal Y Cerebral 261 crítico al flujo sanguíneo cerebral al que la isquemia se hace evidente en el electroencefalograma (EEG), de 18-20 ml/100 g/min. 11. ¿Cómo afectan los anestésicos inhalatorios a la perfusión cerebral y al índice metabólico cerebral? En el cerebro sano, el flujo sanguíneo varía directamente con la tasa metabólica cerebral de O2. Se dice que los anestésicos inhalatorios desacoplan esta relación. Disminuyen la tasa metabólica cerebral de O2, pero, al mismo tiempo, inducen dilatación de los vasos cerebrales; por tanto, incrementan el flujo sanguíneo cerebral. 12. ¿Qué monitorización requieren los pacientes sometidos a endarterectomía carotídea? Además de la monitorización estándar, está indicada la monitorización continua de la presión intraarterial. La cirugía carotídea no conlleva grandes desplazamientos de líquidos y rara vez es necesaria la monitorización de la presión venosa central o de la arteria pulmonar. Puesto que existe la posibilidad de una hemorragia no controlada de la arteria carótida, se recomienda un acceso intravenoso con un catéter de gran calibre. También se recomiendan vías intravenosas adicionales para el uso de fármacos vasoactivos y anestésicos. 13. Para la endarterectomía, ¿es preferible la anestesia regional o la general? No se dispone de estudios controlados aleatorizados prospectivos que demuestren que una técnica sea superior a la otra a largo plazo. En último término, la elección de una u otra se basa en las preferencias y conveniencias del paciente, en la experiencia y habilidad del cirujano y del anestesiólogo y en la disponibilidad de monitorización de la perfusión cerebral. © Elsevier. Fotocopiar sin autorización es un delito 14. ¿Cuáles son las ventajas de la anestesia regional para la endarterectomía? La principal ventaja de la anestesia regional es la posibilidad de hacer una valoración neurológica continua del paciente cooperador y despierto, y así valorar la suficiencia de la perfusión cerebral. Sin embargo, puede convertirse en una desventaja si el paciente sufre isquemia cerebral. En esta situación, la isquemia cerebral da lugar a desorientación, ventilación y oxigenación insuficientes y a la alteración del campo quirúrgico. Con frecuencia, para obtener de una máxima protección cerebral se requiere la conversión a anestesia general, pero la intubación endotraqueal en esta situación puede ser difícil. La sedación suele alterar la valoración neurológica en el paciente despierto, y debe dosificarse cuidadosamente. Se dispone de algunas evidencias que indican que la tasa de mortalidad a 30 días y de hemorragia postoperatoria disminuyen con la anestesia regional. 15. ¿Cuáles son las ventajas y desventajas de la anestesia general para pacientes sometidos a endarterectomía carotídea? Las ventajas de la anestesia general son el control de la vía aérea, un campo operatorio sin alteraciones y la capacidad de aumentar al máximo la perfusión cerebral si aparece isquemia. La principal desventaja de la anestesia general es la pérdida de la valoración neurológica continua del paciente despierto. 16. ¿De qué métodos de monitorización se dispone para la perfusión cerebral durante la anestesia general? Las técnicas disponibles son la medición de la stump pressure (es decir, la presión retrógrada con la arteria carótida pinzada), el EEG intraoperatorio, el control de los potenciales somatosensoriales evocados, la determinación de la saturación de O2 en la vena yugular o transconjuntival, el eco-Doppler transcraneal y las técnicas de lavado de trazadores. No se ha demostrado que ninguno de estos métodos mejore el resultado, y ninguno se ha aceptado de modo universal como el de elección. 17. ¿Proporcionan las stump pressures una información fiable de la perfusión ­cerebral? No. La stump pressure es la presión del segmento de la arteria carótida interna inmediatamente cefálica al pinzamiento del vaso. Se supone que esta presión representa la presión transmitida desde la arteria carótida y vertebral contralateral a través del polígono de Willis. La stump pressure 262 Capítulo 37 Patología Vascular Intracraneal Y Cerebral no se correlaciona con el flujo. Algunos pacientes con presiones inferiores a 50 mmHg manifiestan una perfusión adecuada, mientras que otros con una stump pressure «adecuada» han experimentado una lesión isquémica. 18. ¿Proporciona el electroencefalograma intraoperatorio información útil durante la endarterectomía carotídea? No se dispone de datos que demuestren que, durante la EAC, la monitorización del EEG dé lugar a un mejor resultado para el paciente. Aunque es un indicador muy sensible y precoz de la isquemia cortical global, su especificidad no es suficiente y se asocia a resultados falsos positivos (aunque pocos falsos negativos). Otro punto no aclarado es el tiempo de isquemia necesario antes de que se detecten cambios en el EEG. De hecho, cuando ya han aparecido cambios en el EEG, el daño irreversible puede estar ya totalmente establecido. 19. ¿Cuáles son las complicaciones postoperatorias más frecuentes de la endarterectomía carotídea? Hipotensión: una complicación habitual que se considera debida al seno carotídeo intacto que responde a presiones arteriales más altas después de resecar la placa ateromatosa. Esta hipotensión responde a la fluidoterapia y a la administración de vasopresores. Hipertensión arterial: también frecuente, pero cuyo mecanismo es menos claro. Obviamente, la alta incidencia de hipertensión preoperatoria, en particular si está mal controlada, puede dar lugar a una hipertensión postoperatoria lábil. También puede ser consecuencia de la denervación o la lesión traumática intraoperatoria del seno carotídeo. Debido a su alta asociación con la aparición de nuevos déficits neurológicos, la hipertensión postoperatoria debe controlarse y tratarse de forma enérgica considerando las presiones sanguíneas basales de los pacientes. Hiperperfusión cerebral: tras la corrección de la estenosis, el flujo sanguíneo cerebral puede aumentar en hasta el 200%. La hipertensión mal controlada contribuye a esta complicación. Los síntomas y los efectos adversos de la hiperperfusión son cefaleas, dolor facial y ocular, edema cerebral, náuseas y vómitos, convulsiones y hemorragia intracerebral. La presión arterial de estos pacientes debe controlarse cuidadosamente, de preferencia sin utilizar vasodilatadores cerebrales. Obstrucción de la vía aérea: es consecuencia de los hematomas y el edema tisular. Su tratamiento consiste en restablecer la vía aérea, si es necesario intubar al paciente, abrir la incisión y drenar el hematoma. Los problemas respiratorios también pueden ser consecuencia de la parálisis de las cuerdas vocales por lesión del nervio laríngeo recurrente y por la paresia del nervio frénico después del bloqueo del plexo cervical. Como es predecible, la función quimiorreceptora de los cuerpos carotídeos se pierde en muchos pacientes tras la EAC, como se demuestra por la pérdida completa de la respuesta respiratoria a la hipoxia y un incremento medio de la PaCO2 en reposo de 6 mmHg. La mayoría de ictus asociados a EAC se producen en el postoperatorio como consecuencia de factores quirúrgicos, como trombosis o émbolos desde el lugar de la cirugía. Los ictus espontáneos y progresivos postoperatorios son emergencias quirúrgicas que requieren una exploración rápida. 20. ¿Cuáles son las principales causas y manifestaciones de la hemorragia subaracnoidea espontánea? La rotura de un aneurisma intracraneal es la causa más habitual de hemorragia subaracnoidea (HSA) (75-80%). Los factores de riesgo son el tabaquismo y la hipertensión sistémica. La rotura depende del tamaño del aneurisma, con una probabilidad del 6% anual en los ≥25 mm de diámetro. Otras causas son las malformaciones arteriovenosas (MAV ≈5%), las idiopáticas (≈14%), los tumores hemorrágicos y las vasculitis. La HSA se manifiesta a menudo con intensas cefaleas frontales u occipitales, asociadas a déficits neurológicos, fotofobia, rigidez de nuca y náuseas/vómitos. También puede revelarse como una pérdida temporal de la conciencia e incluso la muerte. Los cambios del electrocardiograma (cambios de la onda T y el segmento ST) y los signos de edema pulmonar al cabo de 2 días de la hemorragia son consecuencia de la liberación de catecolaminas. Establecer un diagnóstico precoz e instaurar medidas terapéuticas rápidas disminuye la morbilidad y mortalidad del paciente. Capítulo 37 Patología Vascular Intracraneal Y Cerebral 263 21. Defina la clasificación de Hunt-Hess del estado neurológico después de hemorragia subaracnoidea espontánea. Grado I: asintomático, cefaleas y/o rigidez de nuca mínima. Grado II: cefaleas/rigidez de nuca moderada/grave (parálisis de pares craneales, a menudo el III par). Grado III: confusión, somnolencia o déficit focal ligero. Grado IV: estupor, hemiparesia, rigidez de descerebración precoz, trastornos vegetativos. Grado V: coma profundo, rigidez de descerebración, aspecto de moribundo. © Elsevier. Fotocopiar sin autorización es un delito 22. Describa el tratamiento de los aneurismas intracraneales tras una hemorragia subaracnoidea espontánea. Una intervención quirúrgica precoz (con la implantación de un clip en el aneurisma) en el plazo de las 72 primeras horas de la hemorragia inicial mejora el pronóstico neurológico, pero el tratamiento precoz puede ser técnicamente difícil como consecuencia del edema cerebral y de las enfermedades concomitantes mal controladas. Con frecuencia, la cirugía se retrasa hasta que ha disminuido el riesgo de máximo vasoespasmo. El tratamiento inicial consiste en la monitorización y estabilización hemodinámicas cuidadosas, la administración de laxantes suaves para prevenir los esfuerzos defecatorios, reposo en cama y analgésicos. Si el paciente está anticoagulado se revertirá la anticoagulación. Si un paciente no presenta déficits neurológicos, está alerta y su presión de perfusión cerebral (PPC) es apropiada, puede administrarse tratamiento antihipertensivo, pero la mayor parte de hipertensos no se tratan para mantener la PPC. Cuando es necesario el control de la presión arterial, en general se evitan el nitroprusiato o la nitroglicerina porque aumentan el flujo sanguíneo cerebral; una alternativa aceptable es el labetalol. La administración de fibrinolíticos es motivo de controversia y no se recomienda. Los glucocorticoides no confieren beneficios ni riesgos. Si el paciente está estuporoso, tiene una postura descerebrada o está en coma, pueden estar indicados procedimientos radiológicos intervencionistas, la ventriculostomía o la trepanación. Los pacientes candidatos a la implantación de coils aneurismáticos con frecuencia presentan enfermedades concomitantes no controladas. Los procedimientos radiológicos intervencionistas se han convertido en el tratamiento de elección para grupos de pacientes seleccionados tras la rotura de un aneurisma cerebral. 23. ¿Por qué es tan importante el pinzamiento en el tratamiento de la hemorragia subaracnoidea como consecuencia de la rotura de un aneurisma? El resangrado y el vasoespasmo son dos complicaciones precoces y devastadoras de la HSA. La principal causa de mortalidad en los pacientes tras una HSA, el resangrado puede producirse años después del inicial, pero en el 20% de los aneurismas el acontecimiento se observa en las 2 primeras semanas, detectándose el máximo riesgo en las 24 primeras horas después del sangrado. La intervención quirúrgica es la única medida para su prevención, siendo la razón de la colocación precoz de un clip. El vasoespasmo es causa de isquemia cerebral diferida después de la HSA. Puede presentarse como un continuum neurológico que oscila desde la somnolencia hasta el ictus. Se cree que su causa es la presencia de sangre subaracnoidea alrededor del polígono de Willis, a nivel de las cisternas basales. La sangre puede ser extraída en el momento del pinzamiento para disminuir el vasoespasmo. El 30% de los pacientes muestra signos y síntomas de vasoespasmo a los 4-14 días de la rotura del aneurisma. 24. ¿Cómo se diagnostica el vasoespasmo? ¿Qué pacientes corren riesgo? Los pacientes en riesgo de vasoespasmo son los que están hipertensos al ingreso, los mayores de 60 años, aquellos con disminución del nivel de conciencia, gran cantidad de sangre en el espacio subaracnoideo demostrada en la TC, hidrocefalia y mal estado general. La depleción de la volemia, la hidrocefalia, la sepsis y las alteraciones electrolíticas deben tenerse en cuenta como causas alternativas de deterioro neurológico agudo. La angiografía permite demostrar claramente el vasoespasmo, que afecta a la arteria cerebral media en el 75% de los casos. Su fisiopatología es compleja y mal conocida, pero se cree que está relacionada con los mediadores liberados por la destrucción de los hematíes en el espacio subaracnoideo. Con el vasoespasmo se pierde la autorregulación de los vasos. A menudo, si se sospecha que existe vasoespasmo, la cirugía se pospone. 264 Capítulo 37 Patología Vascular Intracraneal Y Cerebral 25. Describa las opciones terapéuticas en caso de sospecha de vasoespasmo después de hemorragia subaracnoidea espontánea. Tradicionalmente, el vasoespasmo se ha tratado con una estrategia hipertensiva, hipervolémica y de hemodilución (HHH). La hipervolemia se obtiene con la administración de coloides, con valores objetivo de presión venosa central de 8-12 mmHg o una presión de enclavamiento de la arteria pulmonar de 18-20 mmHg. El nivel deseado del hematocrito es de 27-30, lo que reduce la viscosidad y mejora la microcirculación. Si se implanta un clip en el aneurisma, pueden utilizarse vasopresores (dopamina, fenilefrina) para inducir hipertensión, siendo el objetivo una presión arterial media del orden de 20-30 mmHg mayor que la presión sistólica basal. El aumento de la presión de perfusión atenuará la isquemia cerebral y favorecerá el flujo sanguíneo hasta las áreas transicionales de lesión (denominadas penumbra isquémica). En general, los antagonistas del calcio (AC) se inician de forma empírica después de una HSA. No todos los estudios han demostrado que estos fármacos disminuyan de forma constante la incidencia de vasoespasmo (con procedimientos angiográficos o clínicamente). El nimodipino, un AC, mejora el pronóstico de la HSA y debe utilizarse con una monitorización apropiada. Se desconoce su mecanismo global de acción en este contexto, pero la disminución de la acción plaquetaria, la dilatación de las arteriolas de pequeño calibre y la reducción de la excitotoxicidad mediada por el calcio se consideran posibles etiologías. Puede efectuarse una angioplastia y, en presencia de un vasoespasmo segmentario en la angiografía, puede infundirse papaverina. P U N T OS CLAVE: P atolog ía vascula r int r acraneal y cereb ral 1. La aterosclerosis en la bifurcación de la arteria carótida común es el origen de la mayor parte de acontecimientos isquémicos cerebrales. 2. La autorregulación del flujo cerebral suele mantener un flujo sanguíneo cerebral relativamente constante a lo largo de un amplio rango de presiones arteriales. Es muy importante mantener la presión arterial de los pacientes sometidos a endarterectomía carotídea porque su reserva autorreguladora es mínima o inexistente para contrarrestar las disminuciones de la presión arterial inducidas por la anestesia. 3. Los vasos cerebrales sanos son muy sensibles a la PaCO2, dilatándose como respuesta a la hipercapnia y contrayéndose como respuesta a la hipocapnia. No obstante, en las áreas cerebrales isquémicas y vasodilatadas al máximo, esta relación se pierde y las respuestas a la hipercapnia e hipocapnia pueden ser paradójicas. 4. En el cerebro sano, el flujo sanguíneo cerebral varía directamente con la tasa metabólica cerebral. Se dice que los anestésicos inhalatorios desacoplan esta relación en el sentido de que reducen la tasa metabólica cerebral al mismo tiempo que dilatan los vasos sanguíneos cerebrales y aumentan el flujo sanguíneo cerebral. 5. No se ha demostrado que alguna técnica anestésica particular para la EAC mejore el resultado. 6. Durante la EAC ninguno de los métodos de monitorización del flujo sanguíneo cerebral ha demostrado mejorar el pronóstico, y ninguno se ha aceptado ampliamente como monitorización. 7. La clave del tratamiento de la HSA es su diagnóstico precoz y un tratamiento quirúrgico en un plazo de 72 horas. El vasoespasmo debe tratarse con la terapia «HHH». 26. ¿Cómo se puede mejorar la exposición quirúrgica y proteger el cerebro durante la cirugía del aneurisma? La hipocapnia se utiliza para relajar el cerebro, pero la isquemia cerebral en zonas de perfusión mínima es motivo de preocupación, por lo que suele evitarse. Después de abrir la duramadre, se Capítulo 37 Patología Vascular Intracraneal Y Cerebral 265 administra manitol con el objetivo de facilitar la exposición y relajar el cerebro. Puede colocarse un catéter lumbar para drenaje del líquido cefalorraquídeo (LCR), una vez abierta la duramadre. La concentración de glucosa debe mantenerse entre 80 y 120 mg/dl para prevenir lesiones neurológicas adicionales. Antes de clipar el aneurisma, los neurocirujanos colocan transitoriamente clips de oclusión en la arteria nutricia. La mayoría de estudios han demostrado que esto se tolera durante 10-14 minutos. El riesgo de lesión isquémica va aumentando con el tiempo hasta los 31 minutos de pinzamiento temporal, momento en el cual la posibilidad es casi del 100%. Se debe considerar aplicar medidas de protección cerebral con dosis altas de barbitúricos durante la oclusión temporal para prevenir la isquemia cerebral, hipertensión inducida, hipotermia ligera y la supresión de descargas en el EEG. Utilizar el EEG para controlar los efectos de la oclusión y/o la supresión de la actividad del EEG. En general, el mantenimiento de la PPC y la optimización del tiempo de oclusión vascular son las medidas óptimas de protección cerebral. 27. ¿Qué es una malformación arteriovenosa cerebral? Las MAV son anomalías vasculares congénitas que aparecen habitualmente durante el estadio fetal de desarrollo, cuando se forman los lechos capilares. Su desarrollo se detiene, y se esta­ blecen comunicaciones directas entre las arterias y las venas. A medida que se desarrolla el cerebro, la MAV adquiere mayor flujo sanguíneo arterial y se convierte en un sistema de cortocircuito de alto flujo y baja resistencia. Aumentan de tamaño a medida que adquieren mayor riego sanguíneo. 28. ¿Cómo se presentan en general las malformaciones arteriovenosas? La mayoría de MAV se hacen sintomáticas a los 40 años de edad, y se manifiestan en general en forma de hemorragia (casi el 50%), convulsiones (17 al 50%) o cefaleas (7 al 45%). Con menor frecuencia, pueden detectarse déficits neurológicos focales, hipertensión intracraneal o insuficiencia cardíaca por aumento del gasto cardíaco. La hemorragia, la epilepsia y los déficits neurológicos son las indicaciones tradicionales de la cirugía, pero las nuevas técnicas (endo­ vasculares y microquirúrgicas/radiación) permiten una intervención quirúrgica más agresiva de los aneurismas antes de su rotura. La edad también es un factor importante en la indicación quirúrgica. © Elsevier. Fotocopiar sin autorización es un delito 29. ¿Cuáles son las modalidades terapéuticas habituales de las malformaciones ar­­ teriovenosas? El tratamiento conservador se reserva para las MAV inoperables (es decir, por razones de tamaño, localización, etc.). En la actualidad, éstas pueden tratarse con radiocirugía y embolización endovascular. La radiocirugía dirige la radiación a la MAV para inducir una fibrosis y la obliteración de los vasos comunicantes. La embolización se utiliza a menudo para disminuir el tamaño de la lesión antes de la cirugía, con lo que se reduce el riesgo de hemorragia intraoperatoria y la hiperemia postoperatoria. La resección quirúrgica sigue siendo el tratamiento definitivo de las MAV, eliminando prácticamente el riesgo de hemorragia después de su resección. 30. Describa la estrategia anestésica para la resección quirúrgica de una malformación arteriovenosa. Lo más importante es evitar los episodios de hipertensión agudos. Es imperativa una monitorización invasiva de la presión arterial y la disponibilidad de una vía de acceso intravenoso de gran calibre ante la posibilidad de una pérdida masiva y rápida de sangre. Esta pérdida puede disminuir mediante una embolización preoperatoria. Algunos cirujanos siguen recomendando dosis altas de barbitúricos, hipocapnia, hipotermia y una hipotensión prudente como medidas de protección cerebral. 31. ¿Qué es el síndrome clínico de hiperperfusión cerebral con presión de perfusión normal? Este fenómeno de edema cerebral también se denomina pérdida de la autorregulación cerebral. Se observa con frecuencia en la resección o la embolización de una MAV. El cortocircuito de alto flujo y baja resistencia que se asocia a las MAV grandes puede ser suficientemente importante para producir una hipoperfusión crónica en el tejido cerebral que rodea la lesión ya que los 266 Capítulo 37 Patología Vascular Intracraneal Y Cerebral vasos que irrigan la región del cerebro hipoperfundida han perdido la autorregulación. Una vez resecado el cortocircuito, todo el flujo sanguíneo se desvía a los tejidos cerebrales previamente mal perfundidos, y los vasos dilatados al máximo son incapaces de contraerse. Esto puede dar lugar a un edema cerebral, hiperperfusión y hemorragia en las áreas circundantes. El mecanismo preciso de cómo y por qué ocurre no se ha dilucidado. La disfunción neurológica tras estos episodios es la causa más importante de morbilidad y mortalidad después de cirugía de MAV. Las modalidades terapéuticas para la hiperperfusión son: hiperventilación, diuresis osmótica (manitol), mantener al paciente en una posición con la cabeza elevada, hipotensión deliberada, coma barbitúrico e hipotermia moderada. Bibliografía Recomendada 1. Rabinstein AA, Wijdicks EF: Cerebral vasospasm in subarachnoid hemorrhage. Curr Treat Options Neurol 7:99–107, 2005. 2. Roubin GS, Iyer S: Realizing the potential of carotid artery stenting: proposed paradigms for patient selection and procedural technique. Circulation 113:2021–2030, 2006. 3. Sacco RL: Guidelines for prevention of stroke in patients with ischemic stroke or transient ischemic attack: a statement for healthcare professionals from the American Heart Association/American Stroke Association Council on Stroke. Stroke 37:577–617, 2006. 4. Suarez JI, Tarr RW, Selman WR: Aneurysmal subarachnoid hemorrhage. N Engl J Med 354:387–396, 2006. 5. van Gijn J, Kerr RS, Rinkel GJ: Subarachnoid haemorrhage. Lancet 369:306–318, 2007. Malcolm Packer, MD Capítulo 38 Hiperreactividad bronquial 1. Defina hiperrreactividad bronquial, en particular, el asma. Este término se utiliza para describir una familia de enfermedades que comparten una especial sensibilidad de las vías respiratorias a los estímulos físicos, químicos o farmacológicos. Esta sensibilidad se manifiesta como una respuesta broncoconstrictora, y se observa en pacientes con asma, enfermedad pulmonar obstructiva crónica (EPOC), enfisema, enfermedades víricas de las vías respiratorias superiores y otros trastornos. La American Thoracic Society define el asma como «una enfermedad caracterizada por una respuesta incrementada de la tráquea y los bronquios a varios estímulos que se manifiesta por estrechamiento de gran parte de la vía aérea, y cuya gravedad cambia espontáneamente o con el tratamiento». El asma se manifiesta por episodios de disnea, tos y sibilancias. Estos síntomas se relacionan con un incremento en la resistencia al flujo aéreo en las vías respiratorias del paciente. 2. ¿Cuáles son los diferentes tipos de asma? Aunque el común denominador es la hiperreactividad de las vías respiratorias, el asma puede subdividirse en dos grupos: alérgica (extrínseca) e idiosincrásica (intrínseca). No obstante, algunos expertos creen que deberían descartarse los términos extrínseco e intrínseco. Todos los tipos de asma se asocian a hiperreactividad de vías respiratorias, inflamación e interacción entre estímulos alergénicos y no alergénicos. Se supone que el asma alérgica es el resultado de una respuesta a antígenos, como el polvo y el polen, mediada por la inmunoglobulina E (IgE). Entre los mediadores liberados se hallan la histamina, los leucotrienos, las prostaglandinas, bradicinina, tromboxano y factor quimiotáctico eosinófilo. Su liberación provoca inflamación, extravasación capilar en las vías respiratorias, incremento de la secreción mucosa y contracción de la musculatura lisa bronquial. El asma idiosincrásica está mediada por estímulos no antigénicos, que comprenden el ejercicio, el frío, la contaminación y las infecciones. El broncoespasmo está causado por un incremento del tono parasimpático (vagal). Aunque los estímulos primarios difieren, se liberan los mismos mediadores que en el asma alérgica (y en algunos pacientes con este tipo de asma se detecta un aumento del tono vagal). 3. ¿Qué enfermedades mimetizan el asma? Obstrucción de las vías respiratorias superiores e inferiores por tumores, aspiración de cuerpo extraño o estenosis. Insuficiencia ventricular izquierda (asma cardíaca) y embolismo pulmonar. Reflujo gastroesofágico y aspiración. Enfermedades respiratorias víricas (p. ej., virus respiratorio sincitial). Reacciones alérgicas y anafilaxia. Una anamnesis y una exploración física minuciosas contribuirán a diferenciar estas enfermedades de la hiperreactividad bronquial. 4. ¿Cuáles son las características importantes de la historia clínica en un paciente asmático? Duración de la enfermedad. Frecuencia, factores desencadenantes y duración de los episodios. ¿Ha necesitado alguna vez el ingreso hospitalario? ¿Ha requerido el ingreso en la unidad de cuidados intensivos o intubación? © 2011. Elsevier España, S.L. Reservados todos los derechos 267 268 Capítulo 38 Hiperreactividad bronquial ¿Qué medicamentos utiliza, incluidos los de mantenimiento y aliviadores de los síntomas, para las crisis, de dispensación libre y corticosteroides? 5. ¿Qué hallazgos físicos se asocian al asma? El síntoma físico más habitual son las sibilancias espiratorias. La sibilancia es un signo de obstrucción del flujo aéreo, y se asocia a menudo con una fase espiratoria prolongada. Los pacientes utilizan los músculos respiratorios accesorios a medida que el asma empeora progresivamente. En un paciente con síntomas floridos una auscultación que no revela hallazgos puede indicar una insuficiencia respiratoria inminente porque no hay el suficiente movimiento de aire para inducir sibilancias. Los pacientes también pueden manifestar taquipnea y deshidratación, adoptar una postura en bipedestación o respirar con los labios fruncidos. La cianosis es un signo tardío y de mal pronóstico. 6. ¿Qué pruebas preoperatorias debe solicitar? La anamnesis orienta la solicitud juiciosa de pruebas preoperatorias. En un paciente con asma leve que sólo usa medicación según las necesidades y en la actualidad goza de buena salud, no son necesarias más pruebas. Los pacientes sintomáticos sin una valoración reciente requieren una atención cuidadosa. Las pruebas más solicitadas son las de función pulmonar, que permiten una valoración rápida y simple del grado de obstrucción y su reversibilidad (véase Capítulo 9). Una comparación entre los valores obtenidos en el paciente con los de referencia ayuda a valorar el grado de obstrucción. Una exacerbación grave se correlaciona con una tasa de flujo espiratorio máximo (PEFR) o un volumen espiratorio forzado en el primer segundo (FEV1) menores del 30-50% del valor de referencia, que, para la mayoría de adultos, representa una PEFR de menos de 120 l/min y un FEV1 de menos de 1 l. Las pruebas deben repetirse después del tratamiento un broncodilatador para valorar la reversibilidad y la respuesta al tratamiento. La gasometría en sangre arterial no suele ser de ayuda. Para la valoración de la enfermedad pocas veces están indicados electrocardiogramas, radiografías de tórax y hemogramas, salvo que características particulares en la presentación del paciente sugieran otros diagnósticos (p. ej., fiebre y estertores indicativos de neumonía). 7. Describa la base del tratamiento del asma. La base del tratamiento siguen siendo los agonistas adrenérgicos b. Los agonistas selectivos b2, como el salbutamol, la terbutalina y el fenoterol, ofrecen mayor especificidad de broncodilatación mediada por receptores b2 y pocos efectos adversos (p. ej., taquiarritmias y temblor asociados a los agonistas b1). El salbutamol puede administrarse por vía oral, nebulizado o con inhaladordosificador. La terbutalina es eficaz nebulizada, por vía subcutánea o por infusión intravenosa continua (con esta última vía se requiere precaución por la posibilidad de hipopotasemia, acidosis láctica y taquiarritmias). La adrenalina está disponible para uso subcutáneo en pacientes con asma grave. Los pacientes con coronariopatía toleran mal la taquicardia y la mayoría necesita un agonista adrenérgico b2. Como norma, es de elección la vía inhalatoria. 8. ¿Qué otros fármacos y vías de administración se utilizan en el asma? Corticosteroides: la reversión de la inflamación de la vía aérea disminuye la producción de moco y potencia la relajación del músculo liso inducida por los agonistas adrenérgicos b. Los corticosteroides se recomiendan en pacientes con asma moderada o grave o para quienes han requerido corticosteroides en los 6 últimos meses. Su inicio de acción tiene lugar a las 1-2 horas de la administración. La metilprednisolona es muy utilizada por sus potentes efectos antiinflamatorios y mineralocorticoides débiles. Sus efectos adversos son: hiperglucemia, hipertensión arterial, hipopotasemia y alteraciones del humor, incluida psicosis. Su administración crónica o prolongada se asocia con miopatía cuando se administran relajantes musculares. Pueden administrarse por vía oral, mediante inhalador-dosificador o por vía intravenosa. Agentes anticolinérgicos: inducen broncodilatación y bloquean los receptores colinérgicos muscarínicos en las vías aéreas; en consecuencia, atenúan la broncoconstricción provocada por los irritantes inhalados y asociada a los bloqueantes b. Son de particular utilidad en pacientes con EPOC o una obstrucción importante de las vías respiratorias (FEV1 <25% del valor de referencia). El ipratropio, el glicopirrolato y la atropina pueden administrarse mediante nebulización, y el ipratropio está disponible en forma de inhalador-dosificador. Capítulo 38 Hiperreactividad bronquial 269 Teofilina: el uso de teofilina en el asma es controvertido. La teofilina produce efectos broncodilatadores y mejora la función del diafragma. Es preciso sopesar dichos beneficios frente a los numerosos efectos adversos: temblor, náuseas y vómitos, palpitaciones, taquiarritmias y convulsiones. Hasta disponer de pruebas definitivas, muchos investigadores recomiendan que este tratamiento sólo se inicie en pacientes con asma aguda que no mejoran con dosis máximas de agonistas b y corticosteroides. Es indispensable una cuidadosa monitorización de los niveles plasmáticos. La teofilina se administra por vía oral, mientras que la aminofilina, su forma hidrosoluble, se administra por vía intravenosa. Cromoglicato sódico: es un estabilizador de los mastocitos indicado para el tratamiento de mantenimiento prolongado. Confiere mayores beneficios en pacientes menores de 17 años de edad con asma moderada o grave inducida por el ejercicio. Su efecto adverso es irritación local mínima de la faringe con la inhalación. Puede administrarse mediante un sistema multidosis o como polvo seco en un turboinhalador. No es eficaz y, de hecho, está contraindicado en las crisis agudas de asma. Modificadores de leucotrienos: son relativamente nuevos en el tratamiento del asma leve o moderada. Estos fármacos compiten selectivamente con los receptores LTd4 y LTe4 o inhiben directamente la vía de la lipooxigenasa en el metabolismo del ácido araquidónico. Hoy día su administración se limita al tratamiento a largo plazo de un grupo seleccionado de pacientes. Metotrexato o sales de oro: pueden ser requeridos en pacientes con asma grave. Ambos producen efectos adversos, y se reservan para pacientes que no toleran los corticosteroides (Tabla 38-1). © Elsevier. Fotocopiar sin autorización es un delito Ta b l a 3 8 - 1 . M e d i c a c i ó n ú t i l pa r a l o s pa c i e n t e s c o n h i p e r r e a c t i v i d a d bronquial Fármaco Dosis Comentarios Salbutamol Puede ser necesario repetir el tratamiento Terbutalina 2,5 mg en 3 ml de suero fisiológico para nebulización o 2 pulsaciones mediante inhalador-dosificador 0,3-0,4 mg, subcutánea Adrenalina 0,3 mg, subcutánea Corticosteroides Metilprednisolona, 60-125 mg, intravenosa según necesidades cada 6 horas, o prednisona 30-50 mg/día, oral Ipratropio, 0,5 mg por nebulización o 4-6 pulsaciones mediante inhalador-dosificador; atropina 1-2 mg por nebulización 5 mg/kg, intravenosa cada 30 minutos (dosis de carga en pacientes no tratados previamente con el fármaco) Anticolinérgicos Teofilina EPOC, enfermedad pulmonar obstructiva crónica. Si es necesario, puede repetirse cada 20 minutos hasta tres dosis Si es necesario, puede repetirse cada 20 minutos hasta tres dosis Las dosis se reducen progresivamente a la primera oportunidad Útil en hiperreactividad bronquial grave y en la EPOC Después de la dosis de carga, comenzar infusión continua a un ritmo adecuado a la edad y a la gravedad de la enfermedad; se requiere precaución por la posibilidad de interacciones farmacológicas 270 Capítulo 38 Hiperreactividad bronquial 9. ¿Cuál es la preparación preoperatoria óptima del paciente con hiperreactividad bronquial? Se clasificará a los pacientes de acuerdo con la urgencia de la operación requerida y sus antecedentes de hiperreactividad bronquial. En pacientes con una intervención quirúrgica programada, pero que refieren sibilancias activas, se administrará tratamiento y se pospondrá el procedimiento hasta su resolución. Los pacientes asintomáticos sin crisis recientes de asma, no tratados y sin antecedentes de enfermedad grave no requieren tratamiento o, a lo sumo, agonistas adrenérgicos b. Los pacientes con asma leve (FEV >80%) y síntomas continuados o recientes requieren 1 tratamiento con agonistas adrenérgicos b. Los pacientes con asma moderada (FEV 65-80%) deben continuar recibiendo agonistas adre1 nérgicos b y doblar la dosis de corticosteroides inhalados una semana antes de la intervención, o iniciar este tratamiento por vía oral 2 días antes de la intervención. Si presentan síntomas, deben iniciar tratamiento adrenérgico b y con corticosteroides por vía oral. Los factores importantes que merecen una consideración antes de iniciar estos últimos incluyen los siguientes: ¿Tiene antecedentes de ingreso en la unidad de cuidados intensivos o de haber sido sometido a ventilación mecánica en relación con su enfermedad? ¿Ha recibido corticosteroides en los 6 últimos meses? ¿Corre riesgo de insuficiencia suprarrenal? Los pacientes con asma grave (FEV <65%) deben recibir tratamiento adrenérgico b y 1 2 días antes de la cirugía, corticosteroides por vía oral. En pacientes con FEV1 <70% se observa una mejora de la función pulmonar con ambas clases de fármacos en tan sólo 24 horas de tratamiento. La combinación de ambos también reduce sustancialmente las sibilancias postintubación comparado con los adrenérgicos b solos. Por último, los pacientes sometidos a cirugía abdominal superior o torácica y los casos urgentes corren un riesgo especial y requieren tratamiento agresivo. 10. Revise las ventajas e inconvenientes de los anestésicos de inducción en pacientes asmáticos. Los anestésicos de inducción intravenosa usados en pacientes asmáticos son oxibarbitúricos, tiobarbitúricos, ketamina y propofol. En los estudios de laboratorio los tiobarbitúricos inducen broncoconstricción, y pueden asociarse a broncospasmo clínico. Su causa más habitual es el estímulo de la intubación, y se requieren dosis altas de barbitúricos para inhibir este efecto satisfactoriamente. La ketamina produce efectos broncodilatadores bien conocidos secundarios a la liberación de catecolaminas endógenas con efectos agonistas b2. Produce un ligero efecto relajante directo sobre el músculo liso. El propofol disminuye la resistencia y los reflejos de las vías respiratorias. La lidocaína intravenosa es un adyuvante útil para mitigar la respuesta a la laringoscopia y a la intubación. La inducción con mascarilla con halotano o sevoflurano es un método excelente para inhibir los reflejos de la vía aérea y relajar directamente la musculatura lisa de las vías respiratorias. Además, estos agentes tienen un sabor mucho menos desagradable que el isoflurano o el desflurano. El atracurio y el mivacurio son relajantes musculares de administración frecuente para los que se ha demostrado la liberación de histamina, por lo que pueden inducir broncoconstricción. El vecuronio, el rocuronio y el pancuronio no se asocian a la liberación de histamina. El cisatracurio se asocia con menos liberación de histamina en comparación con el atracurio. 11. ¿Qué agentes pueden utilizarse para el mantenimiento de la anestesia? El sevoflurano, el halotano y el isoflurano son efectivos para bloquear los reflejos de la vía aérea y la broncoconstricción; el sevoflurano parece ser el más efectivo. Los anestésicos inhalatorios se han utilizado en unidades de cuidados intensivos para lograr broncodilatación en pacientes intubados con asma grave, mejorando los índices de resistencia respiratoria (flujos inspiratorio y espiratorio) y disminuyendo la hiperinsuflación y la presión positiva teleespiratoria intrínseca (PEEP). Los opioides en dosis altas bloquean los reflejos de la vía aérea, pero no causan broncodilatación directa. La administración de morfina continúa siendo controvertida por su actividad liberadora de histamina. La anestesia basada en opioides puede causar problemas con depresión respiratoria en situaciones urgentes (en particular, en pacientes con EPOC que tienen un componente asmático). Capítulo 38 Hiperreactividad bronquial 271 Los relajantes musculares con un núcleo bencilisoquinolínico como la d-tubocurarina, el atracurio y el mivacurio, liberan histamina de los mastocitos tras su administración. También pueden fijarse directamente a los receptores muscarínicos en los ganglios, terminaciones nerviosas y musculatura lisa de la vía aérea. En teoría ambos mecanismos pueden incrementar la resistencia de las vías respiratorias. Los relajantes musculares con un núcleo aminoesteroide, como el pancuronio y el vecuronio, continúan administrándose sin riesgos en pacientes asmáticos. En pacientes con broncoespasmo, los relajantes musculares mejoran la distensibilidad de la pared torácica, pero no modifican el tono del músculo liso de la vía aérea ni la distensibilidad pulmonar. Su uso prolongado en pacientes asmáticos sometidos a ventilación mecánica se asocia a un aumento de la concentración de creatincinasa y a una miopatía clínicamente manifiesta. © Elsevier. Fotocopiar sin autorización es un delito 12. ¿Cuáles son las complicaciones de la intubación y la ventilación mecánica en los pacientes asmáticos? El estímulo de la intubación provoca un incremento significativo de la resistencia de la vía aérea. La disminución del flujo espiratorio impide el vaciado completo del aire intraalveolar y en las vías respiratorias de pequeño calibre, por lo que habrá hiperinsuflación pulmonar. Un atrapamiento sustancial de aire puede inducir hipotensión por medio del incremento de la presión intratorácica y la disminución del retorno venoso. El neumomediastino y el neumotórax también son causas potenciales de descompensación respiratoria aguda. Diversos parámetros de la función del ventilador proporcionan información sobre la mejoría o agravación del estado del paciente. La presión meseta (presión medida al final de la inspiración y antes del inicio de la espiración, calculada como promedio durante una pausa de 0,4 segundos) se correlaciona en algún grado con complicaciones cuando se alcanzan presiones >30 cmH2O. La autoPEEP es un parámetro de la presión telespiratoria (obtenida al final de la espiración mientras se mantiene momentáneamente ocluida la salida espiratoria) y en pacientes con broncoespasmo se puede correlacionar con las presiones alveolares. Sin embargo, la autoPEEP no se correlaciona específicamente con complicaciones. Para medir la presión meseta y la autoPEEP es necesario que el paciente esté relajado. Los pacientes tratados con dosis altas de corticosteroides y relajantes musculares de forma prolongada corren un riesgo de miopatía grave. El pancuronio y el vecuronio producen los efectos más graves, pero cualquier relajante muscular lo puede producir. Se han desarrollado algunas guías para la ventilación mecánica del paciente con broncoespasmo: La ventilación con presión soporte permite la ventilación espontánea en el paciente sedado con un menor trabajo de la respiración y un menor riesgo de barotrauma. Se aumentará el tiempo espiratorio disminuyendo la frecuencia respiratoria, incrementando la velocidad de flujo inspiratorio para disminuir el tiempo inspiratorio, e incrementando directamente la relación inspiración/espiración. Se requiere precaución con PEEP aplicada por el ventilador. Se reducirá el volumen minuto, permitiendo una hipoventilación controlada y una hipercapnia permisiva. 13. ¿Cuáles son las causas de sibilancias intraoperatorias y las respuestas correctas en pacientes asmáticos con broncoespasmo agudo? Las causas incluyen las secreciones de las vías respiratorias, cuerpos extraños, edema pulmonar (asma cardíaca), obstrucción del tubo endotraqueal, tubo endotraqueal en la carina o introducido en el bronquio principal, la respuesta alérgica o anafiláctica a los fármacos y el asma. Muchos fármacos inducen sibilancias en pacientes asmáticos, incluidos los bloqueantes adrenérgicos b, los relajantes musculares y el ácido acetilsalicílico. Después de verificar cuidadosamente la posición del tubo endotraqueal y auscultar el murmullo vesicular bilateral, se incrementa el oxígeno inspirado hasta un 100%, y, si el paciente lo tolera desde un punto de vista hemodinámico, se profundiza la anestesia. Deben corregirse los factores desencadenantes, como la infusión de fármacos, la mala posición del tubo endotraqueal y otras causas de estimulación de las vías respiratorias. Puede ser útil modificar los parámetros pautados en el ventilador (véase la Pregunta 14). Se administrarán fármacos según se indica en la Pregunta 7. 272 Capítulo 38 Hiperreactividad bronquial P U N TOS CLAVE: Hi perreactivi dad bron qui al 1. El paciente con hiperreactividad bronquial corre mayor riesgo de broncoconstricción intraoperatoria, manifestada por un aumento de las presiones máximas de las vías respiratorias, dificultades ventilatorias e hipoxemia. 2. Casi todos los pacientes con hiperreactividad bronquial se beneficiarán de un tratamiento broncodilatador preoperatorio. 3. En pacientes con sibilancias activas en quienes se ha programado cirugía, ésta se retrasará hasta la resolución terapéutica del componente reactivo de la enfermedad respiratoria y de otros factores contribuyentes y haber obtenido un control satisfactorio. 14. Describa las técnicas de despertar de la anestesia para pacientes asmáticos bajo anestesia general endotraqueal. Las alternativas en pacientes sometidos a anestesia general e intubados son la extubación con el paciente despierto o con un plano más profundo de anestesia. El tubo endotraqueal es una causa habitual de broncoespasmo significativo, y su retirada con anestesia profunda inhalatoria en un paciente con respiración espontánea conduce a menudo a un despertar sin incidentes. Las extubaciones con planos anestésicos profundos deben evitarse en pacientes con vía aérea difícil, pacientes con obesidad mórbida y pacientes con el estómago lleno. 15. ¿Cuáles son los nuevos tratamientos disponibles para los anestesiólogos en pacientes asmáticos con broncoespasmo? Sulfato de magnesio: se ha administrado a pacientes con crisis asmática. En teoría, el magnesio interfiere con la contracción del músculo liso mediada por el calcio y disminuye la liberación de acetilcolina en la unión neuromuscular. Reduce el broncoespasmo inducido por histamina y metacolina en estudios controlados, pero, hasta la fecha, los estudios clínicos no han podido demostrar una respuesta significativa. Heliox: una mezcla de helio y oxígeno que disminuye la resistencia a la vía aérea, la presión máxima en la vía aérea y los niveles de PaCO2, cuando se administra a pacientes en respiración espontánea y mecánica. La mezcla contiene un 60-80% de helio y un 20-40% de oxígeno y es menos densa que el aire. La menor densidad permite un flujo menos turbulento y disminuye significativamente la resistencia al flujo. El dispositivo para la administración de Heliox en pacientes intubados es voluminoso, salvo que la máquina de anestesia esté ya equipada. El tubo endotraqueal Lita-Tube permite la instilación intraoperatoria de lidocaína por encima y por debajo de las cuerdas del paciente intubado. Esta técnica disminuye la estimulación de la vía aérea desde el tubo endotraqueal y puede prevenir el broncoespasmo reflejo. Oxigenación por membrana extracorpórea: el uso de oxigenación venovenosa y la eliminación de CO2 permiten un soporte ventilatorio mínimo (reposo pulmonar) y la eliminación de valores muy altos de CO2 con la consiguiente mejoría del pH. P á g inas web American Academy of Allergy, Asthma, and Immunology http://www.aaai.org Asthma and Allergy Foundation of America http://www.aafa.org Capítulo 38 Hiperreactividad bronquial 273 Bibliografía Recomendada 1. Apter A: Advances in the care of adults with asthma and allergy in 2007. J Allergy Clin Immunol 121:839–844, 2008. 2. Bishop MJ: Preoperative corticosteroids for reactive airway? Anesthesiology 100:1047–1048, 2004. 3. Chonghaile M, Higgins B, Laffey J: Permissive hypercapnea: role in protective lung ventilatory strategy. Curr Opin Crit Care 11:56–62, 2005. 4. Doherty G, Chisakuta A, Crean P: Anesthesia and the child with asthma. Pediatr Anesth 15:446–454, 2005. 5. Jean L, Brown RH: Should patients with asthma be given preoperative medications including steroids? In ­Fleisher LA, editor: Evidence-based practice of anesthesiology. Philadelphia, Saunders, 2004, pp 77–81. 6. Szelfler S: Advances in pediatric asthma. J Allergy Clin Immunol 121:614–619, 2008. © Elsevier. Fotocopiar sin autorización es un delito 7. Watanabe K, Mizutani T, Yamashita S: Prolonged sevoflurane therapy for status asthmaticus. Pediatr Anesth 18:543–545, 2008. Capítulo 39 Broncoaspiración Malcolm Packer, MD 1. ¿Qué es la broncoaspiración y qué diferencia la neumonitis por broncoaspiración de la neumonía por broncoaspiración? La broncoaspiración es el paso de material de la faringe a la tráquea y los pulmones. Este material aspirado puede proceder del estómago, esófago, cavidad oral o nariz. El material puede ser sólido, como el particulado (comida o un cuerpo extraño), o líquido, como sangre, saliva o el contenido gastrointestinal. La broncoaspiración del contenido gástrico puede acontecer por un vómito, que consiste en la propulsión activa desde el estómago hasta el esófago, o puede ser pasiva, por regurgitación. La neumonitis por broncoaspiración describe la respuesta inflamatoria inicial después de la broncoaspiración y la neumonía por broncoaspiración describe la consolidación junto con la inflamación. 2. ¿Con qué frecuencia se da la broncoaspiración y cuál es la tasa de morbilidad y mortalidad? Los resultados de varios estudios retrospectivos y prospectivos demuestran una incidencia de 1-7 casos de broncoaspiración significativa por cada 10.000 anestesias. Los estudios sobre anestesia pediátrica demuestran una incidencia de casi el doble. La estancia hospitalaria media es de 21 días, en su mayor parte en la unidad de cuidados intensivos. Las complicaciones varían desde un broncoespasmo y neumonía hasta un síndrome de distrés respiratorio agudo, abscesos pulmonares y empiema. La tasa media de mortalidad es del 5%. 3. ¿Cuáles son los factores de riesgo de broncoaspiración? Pacientes pediátricos y de edad avanzada. Emergencias. Tipo de cirugía (más habitual en la cirugía de esófago, abdominal superior o laparotomía urgente). Ingesta reciente (las guías de ayuno preoperatorio de la cirugía programada se describen en el Capítulo 17). Retraso del vaciado gástrico y/o disminución del tono del esfínter esofágico inferior (diabetes, obstrucción del orificio de salida gástrico, hernia de hiato). Fármacos (p. ej., opioides, anticolinérgicos). Traumatismos. Embarazo. Dolor y estrés. Disminución del nivel de conciencia. Obesidad mórbida (también después de cirugía bariátrica y la pérdida ponderal consiguiente). Dificultades en la intubación. Enfermedad neuromuscular (disminuye la capacidad de proteger la tráquea). Enfermedad esofágica (p. ej., esclerodermia, acalasia, divertículos, divertículo de Zenker). 4. ¿Qué precauciones se requieren antes de la inducción anestésica para prevenir la broncoaspiración o disminuir sus secuelas? La principal precaución es detectar a los pacientes con riesgo. Los pacientes deberían tener un período adecuado de ayuno para aumentar las probabilidades de estómago vacío. Los fárma- 274 © 2011. Elsevier España, S.L. Reservados todos los derechos Capítulo 39 Broncoaspiración 275 cos gastrocinéticos, como la metoclopramida, se consideran beneficiosos porque estimulan el ­vaciado gástrico, pero no hay datos congruentes que respalden esta posición. Es útil aumentar el pH gástrico con antiácidos no particulados como el citrato de sodio o antagonistas de los receptores de la histamina (H2), que disminuyen la producción de ácido. Hoy día están comercializados varios antagonistas H2, entre los que el anestesiólogo puede elegir (p. ej., cimetidina, ranitidina y famotidina). La cimetidina fue el primero que se comercializó y sigue siendo de uso difundido. A pesar de que aumenta el pH gástrico, produce importantes efectos adversos, incluida hipotensión, bloqueo cardíaco, disfunción del sistema nervioso central, disminución del flujo sanguíneo hepático y retraso significativo del metabolismo de muchos fármacos. La ranitidina, un antagonista H2, más reciente, produce menos efectos adversos; sólo se han documentado unos pocos casos de disfunción del sistema nervioso central y bloqueo cardíaco. La famotidina es tan potente como la cimetidina y la ranitidina, pero no produce efectos adversos. Para ser efectivos en la inducción, los antagonistas H2 deben administrarse 2-3 horas antes del procedimiento, aunque administrados cerca del momento de la inducción pueden conferir beneficios tras la extubación. No se ha demostrado que los inhibidores de la bomba de protones solos o combinados con antagonistas H2 sean más eficaces. La colocación de una sonda orogástrica o nasogástrica antes de la inducción de la anestesia se recomienda en pacientes con oclusión intestinal. © Elsevier. Fotocopiar sin autorización es un delito 5. ¿Cuál es la conducta a seguir en un paciente con dificultades de intubación y en riesgo de broncoaspiración? Una alternativa es la anestesia locorregional cuando sea apropiada para la cirugía, y se ha demostrado claramente su utilidad en caso de cesárea, ya que esta población de pacientes corre un alto riesgo de broncoaspiración. En la anestesia general cuando el paciente no presenta una vía aérea difícil es preferible una inducción de secuencia rápida con presión cricoidea. Persiste la controversia sobre la eficacia y los riesgos potenciales de ejercer presión cricoidea, pero, hasta la fecha, se recomienda para las intubaciones de secuencia rápida. En caso de dificultades de intubación puede ser necesaria la inserción del tubo endotraqueal con el paciente despierto para permitir la respiración espontánea y proteger la vía aérea frente a la broncoaspiración. La intubación con el paciente despierto se facilita mediante dispositivos como la transiluminación, los broncoscopios de fibra óptica y los equipos de intubación retrógrada. Contribuye al bienestar del paciente el uso prudente de sedación y un anestésico local tópico. La sedación excesiva y la anestesia tópica pueden impedir la protección de la vía aérea por el propio paciente. Por tanto, contribuye a una intubación sin riesgos mantener al paciente despierto y aplicar el anestésico local sólo a la vía aérea por encima de la glotis. La intubación endotraqueal no garantiza la ausencia de broncoaspiración. El material puede entrar alrededor del manguito del tubo endotraqueal que esté deshinchado total o parcialmente. 6. Describa los cuadros clínicos causados por los tres principales tipos de broncoaspiración: líquidos ácidos, líquidos no ácidos y sólidos particulados. La broncoaspiración de material ácido con un pH inferior a 2,5 y volúmenes de más de 0,4 ml/kg causa de inmediato la pérdida de la integridad de la membrana alveolocapilar, provocando edema intersticial, hemorragia intraalveolar, atelectasia y aumento de la resistencia de la vía aérea. Es habitual la hipoxia. Aunque estos cambios suelen comenzar unos minutos después del acontecimiento precipitante, pueden empeorar durante un período de horas. La primera fase de la respuesta es una reacción directa del pulmón al ácido, a la que se denomina neumonitis química. La segunda fase, que acontece horas más tarde, se debe a una respuesta de los leucocitos o inflamatoria a la lesión original, y puede provocar insuficiencia respiratoria. La broncoaspiración de líquido no ácido destruye el surfactante, provoca colapso alveolar y atelectasia. Es habitual la hipoxia. La destrucción de la arquitectura pulmonar y la respuesta inflamatoria tardía no son tan importantes como en la broncoaspiración ácida. La broncoaspiración de sólidos particulados, como alimentos, induce tanto una obstrucción física de la vía aérea como una respuesta inflamatoria posterior relacionada con la presencia de un cuerpo extraño. Pueden aparecer áreas alternantes de atelectasia e hiperexpansión. Los pacientes manifiestan hipoxia e hipercapnia debidas a la obstrucción física del flujo aéreo. Si el ácido se mezcla con el material particulado, la lesión con frecuencia es aún mayor y el cuadro clínico más grave. 276 Capítulo 39 Broncoaspiración 7. Revise los signos y síntomas clínicos tras la broncoaspiración. En más del 90% de casos de broncoaspiración aparece fiebre, y en al menos el 70%, taquipnea y estertores. La tos, cianosis y sibilancias se observan en un 30-40% de casos. Durante la anestesia, la broncoaspiración puede acontecer sin síntomas, por lo que pasará desapercibida para el anestesiólogo. Cualquier cambio clínico citado previamente del curso esperado puede indicar una broncoaspiración. Los cambios radiológicos requieren horas para desarrollarse y no se detectarán, en particular si la radiografía se efectúa poco después del acontecimiento. 8. En un paciente con sospecha de broncoaspiración, ¿cuándo se considera que no corre riesgos? El paciente que no muestra ninguno de los signos o síntomas mencionados previamente y que no requiere administrar oxígeno al cabo de 2 horas se restablece por completo. 9. Describa el tratamiento de la broncoaspiración. En cualquier paciente con sospecha de broncoaspiración, se solicitará una radiografía de tórax y requiere como mínimo varias horas de observación. El tratamiento se basa en las medidas de soporte. Se realizará una broncoaspiración inmediata con el aspirador de las vías respiratorias. Si se detecta insuficiencia respiratoria, se iniciarán oxigenoterapia suplementaria y soporte ventilatorio. En pacientes con insuficiencia respiratoria, con frecuencia se detecta atelectasia con colapso alveolar, y pueden responder a la presión teleespiratoria positiva. Los pacientes con broncoaspiración de material particulado pueden requerir broncoscopia para la extracción del material obstructivo. No deben administrarse antibióticos excepto cuando sea probable la broncoaspiración de microorganismos anaeróbicos o gramnegativos, como en la oclusión intestinal. Sin embargo, una agravación del curso clínico durante los días siguientes indica la necesidad de administrar un antibiótico de amplio espectro. En los estudios efectuados en seres humanos no se ha demostrado que los corticosteroides sean de utilidad. El lavado traqueal con suero fisiológico o bicarbonato sódico no ha demostrado su utilidad y en realidad puede agravar el estado del paciente. Los tratamientos más agresivos de la broncoaspiración ya se hacen en la unidad de cuidados intensivos. La instilación de surfactante, la ventilación por oscilación a alta frecuencia, el óxido nítrico y la posición prono han demostrado resultados prometedores en pacientes con broncoaspiración grave. P U N TOS CLAVE: Br oncoaspirac ión 1. Numerosos subgrupos de pacientes corren un mayor riesgo de broncoaspiración, incluidos los que se presentan para cirugía urgente, aquellos con el estómago lleno, oclusión intestinal o retraso del vaciado gástrico, obesos, traumáticos o mujeres embarazadas, los pacientes con dolor o los tratados con opioides, y los que no puedan proteger su propia vía aérea, como aquellos con una disminución del nivel de conciencia o una enfermedad neuromuscular. 2. Dichos pacientes requieren profilaxis para disminuir la gravedad de la broncoaspiración, y fármacos antiácidos, antagonistas de los receptores H2 e inhibidores de la bomba de protones, administrados antes de la cirugía en un intervalo apropiado para el inicio de acción. En pacientes con oclusión intestinal se requiere descompresión gástrica antes de la inducción de la anestesia. 3. Si está indicada, la anestesia regional es ideal para pacientes con riesgo de broncoaspiración. Cuando se requiere anestesia general en pacientes sin dificultades para la intubación, la técnica de elección es la inducción de secuencia rápida con presión cricoidea. En pacientes con dificultades para la intubación puede ser necesario proceder con el paciente despierto. 4. Si se produce broncoaspiración, el tratamiento es básicamente de soporte. Capítulo 39 Broncoaspiración 277 Bibliografía Recomendada 1. Cohen NH, Yanakakis M: Is there an optimal treatment for aspiration? In Fleisher LA, editor: Evidence-based practice. Philadelphia, Saunders, 2004, pp 125–129. 2. Jean J, Compe`re V, Fourdrinier V: The risk of pulmonary aspiration after weight loss due to bariatric surgery. Anesth Analg 107:1257–1259, 2008. 3. Kluger M, Visvanathan T, Myburgh J: Crisis management during anesthesia: regurgitation, vomiting and aspiration. Qual Saf Health Care 14:4–9, 2005. 4. Marrano G, Marco L: Selected medicated (saline vs. surfactant) bronchoalveolar lavage in severe aspiration syndrome in children. Pediatr Crit Care Med 8:476–481, 2007. 5. Neelakanta G, Chikyarapra A: A review of patients with pulmonary aspiration of gastric contents during anesthesia reported to the departmental quality assurance committee. J Clin Anesth 18:102–107, 2006. © Elsevier. Fotocopiar sin autorización es un delito 6. Tasch M: What reduces the risk of aspiration? In Fleisher LA, editor: Evidence-based practice. Philadephia, Saunders, 2004, pp 118–124. Capítulo 40 Enfermedad pulmonar obstructiva crónica Howard J. Miller, MD 1. Defina la enfermedad pulmonar obstructiva crónica. La enfermedad pulmonar obstructiva crónica (EPOC) constituye un espectro de entidades que incluyen el enfisema, la bronquitis crónica y la bronquitis asmática. Se caracteriza por un incremento progresivo de la resistencia a la respiración. La limitación del flujo aéreo puede deberse a la pérdida de la recuperación elástica o a la obstrucción de las vías respiratorias de pequeño calibre (o a ambas). El incremento de la resistencia puede tener algún grado de reversibilidad. Los principales síntomas son la tos, la disnea y las sibilancias. 2. ¿Cuáles son las características del asma y de la bronquitis asmática? Asma Esta enfermedad heterogénea se caracteriza por la obstrucción reversible de las vías respiratorias. Los factores precipitantes incluyen el ejercicio, el epitelio de los animales, el polen y la intubación. Los síntomas mejoran con tratamiento broncodilatador e inmunosupresor. Bronquitis asmática Consiste en la obstrucción de las vías respiratorias, tos productiva crónica y broncoespasmo episódico. Puede ser consecuencia de una progresión del asma o de la bronquitis crónica. Apenas mejora con tratamiento broncodilatador; siempre persiste algún grado de obstrucción de las vías respiratorias. 3. Describa la bronquitis crónica y el enfisema. Bronquitis crónica: se caracteriza por tos, producción de esputo, infección recurrente, y obstrucción de las vías respiratorias con evolución durante meses a años. En pacientes con bronquitis crónica se observan hiperplasia de las glándulas productoras de moco, tapones de moco, inflamación y edema, fibrosis peribronquiolar, disminución del calibre de las vías respiratorias y broncoconstricción. La disminución de la luz debida al moco y a la inflamación incrementa la resistencia al flujo aéreo. Enfisema: se caracteriza por una disnea progresiva y tos variable. La destrucción de la malla reticular de fibras de colágeno y elástica de las paredes alveolares, sin fibrosis resultante, origina un aumento anormal de los espacios aéreos. Además, la pérdida de soporte de la vía aérea conduce a un estrechamiento y al colapso de las vías respiratorias durante la espiración (atrapamiento de aire). 4. Enumere los factores que favorecen el desarrollo de enfermedad pulmonar obs­­ tructiva crónica. Tabaquismo: el tabaquismo provoca disfunción ciliar, reduce los macrófagos alveolares; da lugar a un incremento de la proliferación de las glándulas mucosas y de la producción de moco; incrementa la respuesta inflamatoria en el pulmón, provocando una mayor liberación de enzimas proteolíticas; reduce la integridad del surfactante, y provoca hiperreactividad de las vías respiratorias. Exposición ocupacional y ambiental: los epitelios de los animales, el tolueno y otros agentes químicos, distintas gramíneas, algodón, el dióxido de azufre y dióxido de nitrógeno en la contaminación atmosférica. 278 © 2011. Elsevier España, S.L. Reservados todos los derechos Capítulo 40 Enfermedad pulmonar obstructiva crónica 279 Infección recurrente: bacterias, microorganismos atípicos (Mycoplasma) y virus (incluido el virus de la inmunodeficiencia humana [VIH], que puede producir un cuadro parecido al enfisema). Factores familiares y genéticos: existe una predisposición a la EPOC, y es más frecuente en los hombres que en las mujeres. El déficit de a1-antitripsina es una enfermedad genética que produce autodigestión del tejido pulmonar por las proteasas, y debe sospecharse en los pacientes más jóvenes con bullas basilares en la radiografía de tórax. El tabaquismo acelera su presentación y progresión. 5. Durante la anamnesis preoperatoria, ¿qué información debe obtener? Antecedentes de tabaquismo: número de paquetes/día y duración en años. Disnea, sibilancias, tos productiva y tolerancia al ejercicio. Hospitalizaciones por EPOC, incluida la necesidad de intubación y ventilación mecánica. Medicación, incluida oxigenoterapia domiciliaria y uso de corticosteroides, sistémicos o inhalados. Infecciones pulmonares recientes, exacerbaciones o cambios en las características del esputo. Pérdida de peso, que puede ser consecuencia de una enfermedad pulmonar terminal o cáncer de pulmón. Síntomas de insuficiencia cardíaca derecha, como edema maleolar, hepatomegalia, ictericia y anorexia secundaria a congestión esplácnica y hepática. 6. ¿Qué características diferencian a los congestivos cianóticos «azules»? Disneicos acianóticos (enfisema) En general, más mayores (>60 años de edad) Acianóticos Delgados Tos mínima disneicos acianóticos «rosados» de los Congestivos cianóticos (bronquitis crónica) Relativamente jóvenes Cianóticos Sobrepeso Tos productiva crónica; sibilancias frecuentes © Elsevier. Fotocopiar sin autorización es un delito 7. Enumere los hallazgos físicos anormales en pacientes con enfermedad pulmo­ nar obstructiva crónica. Taquipnea y uso de músculos accesorios. Abolición del murmullo vesicular o disminución focal, sibilancias o roncus. La distensión venosa yugular, el reflujo hepatoyugular y el edema maleolar sugieren insuficiencia cardíaca derecha. La palpación de la intensidad de los pulsos periféricos es un parámetro indirecto del volumen sistólico. 8. ¿Qué pruebas de laboratorio son útiles? Recuento de leucocitos y hematocrito: su aumento sugiere infección e hipoxemia crónica, respectivamente. Electrolitos: la concentración de bicarbonato aumenta para neutralizar la acidosis respiratoria crónica si el paciente retiene CO2. Puede aparecer hipopotasemia con el uso repetido de agonistas adrenérgicos b. Radiografía de tórax: se examinará en busca de hiperinsuflación pulmonar, bullas o tabicaciones, diafragma aplanado, aumento del espacio aéreo retrosternal, atelectasias, cardiomegalia, infiltrados, derrames, masas o neumotórax. Electrocardiograma: disminución del voltaje, signos de hipertrofia auricular (ondas P altas en las derivaciones II y V1) o ventricular derecha (desviación del eje a la derecha, relación R/S en V6 ≤1, aumento de la onda R en V1 y V2, bloqueo de rama derecha) y arritmias. Son frecuentes las arritmias auriculares, especialmente la taquicardia auricular multifocal y la fibrilación auricular. Gasometría en sangre arterial: puede valorar la hipoxemia, hipercapnia y equilibrio ácidobase, y el grado de compensación. En el Capítulo 9 se describe la espirometría. 280 Capítulo 40 Enfermedad pulmonar obstructiva crónica 9. ¿Cómo afecta un aumento crónico de la presión parcial de CO2 en sangre ar­ terial (PaCO2) al estímulo respiratorio en un paciente con enfermedad pulmonar obstructiva crónica? En pacientes con EPOC se observa una disminución del estímulo respiratorio como respuesta a los niveles de CO2. Un aumento crónico de los valores de PaCO2 produce un incremento de la concentración de bicarbonato en el líquido cefalorraquídeo (LCR). Tiene lugar un «reajuste» de los quimiorreceptores respiratorios localizados en el bulbo raquídeo a mayores concentraciones de CO2. Por esta razón, hay una disminución del estímulo respiratorio secundario al CO2. En estos pacientes, el estímulo respiratorio es más dependiente de la PaO2. 10. ¿Cuáles son los efectos perjudiciales de la administración de oxígeno en estos pacientes? La inhalación de O2 al 100% puede incrementar el desajuste ventilación-perfusión a través de la inhibición de la vasoconstricción pulmonar hipóxica (VPH). La VPH es un mecanismo autorregulador de la vasculatura pulmonar que disminuye el flujo sanguíneo en las áreas mal ventiladas del pulmón, lo que garantiza la disponibilidad de mayor flujo sanguíneo para el intercambio de gases en las áreas mejor ventiladas del pulmón. La inhibición de la VPH da lugar a una mayor perfusión en las áreas mal ventiladas del pulmón, contribuyendo a la hipoxemia y/o hipercapnia. Se recomienda administrar siempre la mínima oxigenoterapia necesaria para alcanzar el objetivo deseado, es decir, unos valores de pulsioximetría del 90-95%. 11. ¿Cómo afectan la cirugía y la anestesia general a la mecánica pulmonar? Después de numerosos procedimientos quirúrgicos y de la anestesia general, la capacidad vital se reduce en un 25-50%, y el volumen residual aumenta en un 13%. Las incisiones abdominales superiores y las toracotomías son las que más afectan a la mecánica pulmonar, seguidas de las incisiones abdominales inferiores y las esternotomías. El volumen de reserva espiratoria disminuye un 25% después de cirugía abdominal inferior y un 60% tras cirugía torácica y abdominal superior. El volumen corriente disminuye un 20%, y la distensibilidad pulmonar y la capacidad funcional residual disminuyen un 33%. Las consecuencias pueden ser atelectasia, hipoventilación, hipoxemia e infección pulmonar. La resolución de muchos de estos cambios requiere un mínimo de 1-2 semanas. 12. ¿Qué factores se asocian con un incremento de la morbilidad o mortalidad pe­ rioperatoria? El aumento de la morbilidad se debe a la hipoxemia, hipercapnia aguda como consecuencia de la hipoventilación, una infección pulmonar, la intubación prolongada y la ventilación mecánica. Se prolonga la estancia tanto en la unidad de cuidados intensivos como hospitalaria, y la mortalidad aumenta. En pacientes sometidos a lobectomía o neumonectomía debe disponerse de los resultados de las pruebas de función pulmonar y la gasometría en sangre arterial superiores a los mencionados en la Tabla 40-1. Si no se cumple cualquiera de los criterios referidos previamente, están Ta b l a 4 0 - 1 . Va l o r e s d e l a f u n c i ó n p u l m o n a r a s o c i a d o s c o n u n a m ay o r m o r ta l i d a d / m o r b i l i d a d p e r i o p e r at o r i a * PFP Cirugía abdominal Toracotomía Lobectomía/neumonectomía CVF FEV1 FEV1/CVF FEF25-75 VR/CPT PaCO2 <70% <70% <50% <50% <70% <1 l <50% <50% <50% o <2 l <1 l <50% > 45-55 mmHg 45-50 mmHg 40% CPT, capacidad pulmonar total; CVF, capacidad vital forzada; FEF25-75, flujo espiratorio forzado en la fase mesoespiratoria; FEV1, volumen espiratorio forzado en el primer segundo; PFP, pruebas de función pulmonar; VR, volumen residual. *Porcentajes de los valores de referencia. Capítulo 40 Enfermedad pulmonar obstructiva crónica 281 indicados exámenes preoperatorios adicionales para determinar el cociente riesgo-beneficio de la resección pulmonar. Las pruebas preoperatorias incluyen estudios de la función de ambos pulmones por separado, perfusión regional, ventilación regional, oclusión regional con balón bronquial y oclusión con balón en arteria pulmonar. Un volumen espiratorio forzado en el primer segundo (FEV1) <800 ml en un paciente de 70 kg es, casi sin ninguna duda, incompatible con la vida, y es una contraindicación absoluta de la resección pulmonar debido a la alta incidencia de ventilación mecánica prolongada. 13. Cite los fármacos administrados en general en el tratamiento de la enfermedad pulmonar obstructiva crónica y su mecanismo de acción. Véase la Tabla 40-2. Ta b l a 4 0 - 2 . F á r m a c o s a d m i n i s t r a d o s pa r a t r ata r l a e n f e r m e d a d p u l m o n a r o b s t r u c t i va c r ó n i c a Clases y ejemplos Acciones Agonistas adrenérgicos b: salbutamol, metaproterenol, fenoterol, terbutalina, adrenalina Aumento de la adenilato ciclasa, incrementando el AMPc y disminuyendo el tono del músculo liso (broncodilatación); los de acción corta (albuterol, terbutalina y adrenalina) son de elección en las exacerbaciones agudas La inhibición de la fosfodiesterasa aumenta el AMPc, potencia las catecolaminas endógenas y mejora la contractilidad diafragmática; estimulantes respiratorios centrales Antiinflamatorios y estabilizantes de la membrana; inhiben la liberación de histamina, potencian los agonistas b Bloquean la acetilcolina en los receptores posganglionares, disminuyendo el GMPc y relajando el músculo liso de las vías respiratorias También es un estabilizador de membrana, impide la desgranulación de mastocitos, pero debe administrarse profilácticamente Inhibición de la producción/antagonismo de leucotrienos; zafirlukast, antagonismo de leucotrienos; antiinflamatorio; usado junto a corticosteroides; sin embargo, puede considerarse un tratamiento antiinflamatorio de primera elección para pacientes que no pueden recibir corticosteroides Metilxantinas: aminofilina, teofilina Corticosteroides: metilprednisolona, dexametasona, prednisona, cortisol Anticolinérgicos: atropina, glicopirrolato, ipratropio Cromoglicato sódico © Elsevier. Fotocopiar sin autorización es un delito Antileucotrienos: zileutón, montelukast AMPc, adenosín monofosfato cíclico; GMPc, guanosín monofosfato cíclico. 14. ¿Qué tratamientos puede instaurar para reducir el riesgo pulmonar periopera­ torio? Abandono del tabaquismo. La abstención de fumar en las 48 horas previas a la cirugía disminuye los niveles de carboxihemoglobina. La curva de disociación de la oxihemoglobina se desvía a la derecha, permitiendo una mayor disponibilidad de O2 para los tejidos. 282 Capítulo 40 Enfermedad pulmonar obstructiva crónica La abstención de fumar 4-6 semanas antes de la cirugía se asocia a una disminución de la incidencia de complicaciones pulmonares. La abstención de fumar 2-3 meses antes de la cirugía confiere todos los beneficios mencionados previamente, junto con una mejora en la función ciliar, mejora de la mecánica pulmonar y una disminución de la producción de esputo. Optimice el tratamiento farmacológico. Se continuará con la medicación hasta el día de la cirugía. Detecte y trate las infecciones pulmonares subyacentes. Aumente al máximo el tratamiento de soporte nutricional, la hidratación y la fisioterapia torácica. Instaure una analgesia postoperatoria efectiva, que permita una tos más eficaz, la obtención de grandes volúmenes corrientes respiratorios y una deambulación precoz después de la cirugía. 15. En pacientes con enfermedad pulmonar obstructiva crónica, ¿confieren venta­ jas las técnicas de anestesia regional? La anestesia regional, incluido el bloqueo neuroaxial y de extremidades, evita la intubación endotraqueal. Sin embargo, el bloqueo subaracnoideo o epidural por encima del dermatoma T10 puede reducir la tos efectiva debido a la disfunción de los músculos abdominales, provocando una disminución del aclaramiento del esputo y atelectasia. Respecto a la anestesia del plexo braquial, se corre el riesgo de neumotórax o bloqueo del nervio frénico, provocando parálisis hemidiafragmática. La administración de sedación durante o después de este proceso puede reducir el estímulo respiratorio, y la dosis debe ajustarse cuidadosamente hasta obtener los efectos deseados. Los anestésicos locales infundidos mediante catéteres insertados en la fascia del plexo braquial o en el espacio epidural lumbar y torácico proporcionan una analgesia postoperatoria muy buena. Las técnicas neuroaxiales mejoran la mecánica pulmonar y permiten administrar opioides en dosis mucho más bajas y con menor sedación, en comparación con las otras vías parenterales. 16. ¿Qué fármacos puede utilizar para inducir y mantener la anestesia general? Puede administrar sin riesgos todos los fármacos de inducción de referencia. La ketamina produce broncodilatación secundaria a sus efectos simpaticomiméticos y por antagonismo directo de los mediadores broncoconstrictores, pero las secreciones aumentan de forma considerable. Se dispone de pruebas anecdóticas de las propiedades broncodilatadoras del propofol. La lidocaína intravenosa administrada antes de la intubación puede ayudar a abolir los reflejos directos de la vía aérea. Todos los anestésicos halogenados producen broncodilatación. El desflurano es un irritante de las vías aéreas, pero a pesar de todo rara vez es un problema una vez que el paciente está intubado; tiene la ventaja de ser eliminado rápidamente una vez se interrumpe el tratamiento. El óxido nitroso incrementa el volumen y la presión de bullas; por esta razón, incrementa el riesgo de barotrauma y neumotórax. Además, el óxido nitroso puede incrementar la resistencia vascular pulmonar y la presión arterial pulmonar. Puede producir efectos especialmente adversos en pacientes en quienes coexista hipertensión pulmonar o cor pulmonale. Por tanto, el óxido nitroso no debe administrarse a pacientes con EPOC. 17. Describa los problemas específicos de la relajación muscular (y de su rever­ sión) en pacientes con enfermedad pulmonar obstructiva crónica. El atracurio y la d-tubocurarina inducen la liberación de histamina, por lo que se recomienda evitarlos. La succinilcolina también produce liberación de histamina, y, cuando se considere su uso, es preciso sopesar los beneficios frente a los riesgos de la parálisis rápida y la intubación endotraqueal. Los anticolinesterásicos (neostigmina y edrofonio) invierten los efectos de los relajantes no despolarizantes. En teoría pueden precipitar el broncoespasmo y la broncorrea secundaria a la estimulación de los receptores muscarínicos posganglionares. Sin embargo, en clínica, rara vez se observa broncoespasmo después de su administración, posiblemente porque se usan con anticolinérgicos (atropina o glicopirrolato). 18. Analice la elección de opioides en estos pacientes. Los opioides disminuyen los reflejos de la vía aérea y profundizan la anestesia. La morfina produce liberación de histamina y debe utilizarse con precaución. La hidromorfona, el fentanilo, el Capítulo 40 Enfermedad pulmonar obstructiva crónica 283 sufentanilo y el remifentanilo no inducen la liberación de histamina. Siempre ha de considerar los efectos depresores respiratorios residuales de los opioides al término de la cirugía. 19. Defina la autoPEEP. El atrapamiento de aire se conoce como autoPEEP (presión positiva teleespiratoria) y es el resultado de la interrupción de la respiración antes de que la espiración completa haya finalizado. La autoPEEP se produce un deterioro de la oxigenación y ventilación, así como un compromiso hemodinámico con disminución de la precarga y aumento de la resistencia vascular pulmonar. El aumento del tiempo espiratorio disminuye la probabilidad de autoPEEP. Para ello se incrementa la fase espiratoria de la ventilación y se disminuye la frecuencia respiratoria. P U N TOS CLAVE: E nfermedad pulm ona r obstructiva cr ónica 1. Los pacientes con un componente reactivo sustancial (y reversible) de su enfermedad pulmonar requieren una preparación preoperatoria cuidadosa, incluido tratamiento con agonistas b inhalados y posiblemente corticosteroides. 2. En pacientes con un componente reactivo sustancial se considerarán alternativas a la anestesia general. Un paciente con sibilancias activas no es un candidato apropiado a un procedimiento quirúrgico programado. 3. No todas las sibilancias son asma. Se considerará también una obstrucción mecánica de las vías respiratorias, la insuficiencia cardíaca congestiva, una reacción alérgica, embolismo pulmonar, neumotórax, aspiración e intubación endobronquial. 4. Los pacientes con bronquitis crónica pueden requerir tratamiento antibiótico, agonistas b inhalados, y medidas para movilizar y reducir el esputo antes de la cirugía para mejorar la evolución. El abandono del tabaquismo es muy beneficioso a largo plazo. © Elsevier. Fotocopiar sin autorización es un delito 5. En pacientes en quienes se programan resecciones pulmonares son necesarias pruebas de función pulmonar para garantizar que no se reseca más pulmón del que sea compatible con la vida. Las resecciones poco prudentes pueden dar lugar a un paciente dependiente del respirador. 20. Establezca el diagnóstico diferencial de las sibilancias intraoperatorias. Broncoconstricción (recuerde que no todas las sibilancias son asma). Obstrucción mecánica del tubo endotraqueal por secreciones o acodamiento. Aspiración del contenido gástrico o cuerpo extraño (p. ej., diente). Intubación endobronquial (sobre todo, intubación del bronquio principal derecho). Anestesia insuficiente. Edema pulmonar (cardiogénico o no cardiogénico). Neumotórax. Embolismo pulmonar. 21. ¿Cómo tratará el broncoespasmo intraoperatorio? Se administrará O al 100% y ventilación manual, permitiendo el suficiente tiempo espirato2 rio. Se identificará y corregirá la patología subyacente. Véase la Pregunta 20. Se instaurará tratamiento: Resolución de las obstrucciones mecánicas. Aumento de la dosis de anestésicos halogenados y/o administración de lidocaína, ketamina o propofol intravenosos. 284 Capítulo 40 Enfermedad pulmonar obstructiva crónica Se administrarán agonistas adrenérgicos b: nebulizados a través del tubo endotraqueal (p. ej., albuterol), por vía subcutánea (p. ej., terbutalina) o por vía intravenosa (p. ej., adrenalina o terbutalina). Se administrarán broncodilatadores adrenérgicos: nebulizados a través del tubo endotraqueal (p. ej., ipratropio) o por vía intravenosa (p. ej., atropina o glicopirrolato). También son tratamientos recomendados la aminofilina intravenosa y los corticosteroides. A pesar de que es controvertida, la extubación puede ser beneficiosa porque el tubo endotraqueal puede ser un estímulo para la broncoconstricción. 22. ¿Qué factores determinan la necesidad de ventilación mecánica postoperatoria? Los pacientes que presenten una PaCO2 >45-50 en reposo, FEV1 <1 l, capacidad vital forzada (CVF) <50-70% del valor de referencia o FEV1/CVF <50% pueden necesitar ventilación mecánica postoperatoria, especialmente en caso de cirugía torácica y abdominal superior. Hay que considerar el grado de preparación del paciente en el preoperatorio, la frecuencia respiratoria y el trabajo de respiración, el volumen corriente y la fuerza inspiratoria negativa generada por el paciente, los parámetros de la gasometría arterial y la temperatura corporal. ¿Están presentes un bloqueo neuromuscular o efectos residuales de los anestésicos? ¿Es satisfactoria la analgesia? 23. En pacientes con enfermedad pulmonar obstructiva crónica, ¿deben evitarse los antagonistas de los receptores H2? La estimulación de los receptores H1 induce broncoconstricción y la de los receptores H2 broncodilatación. En teoría, los antagonistas de los receptores H2 pueden inducir una estimulación sin oposición de los receptores H1 e inducir broncoconstricción. Muchos pacientes con EPOC reciben corticosteroides, presentan gastritis o úlcera péptica y reciben antagonistas H2. Su uso debe individualizarse, y deben observarse los pacientes en busca de posibles efectos adversos. 24. Al término de la cirugía en pacientes con enfermedad pulmonar obstructiva crónica, ¿se procederá a la extubación con anestesia profunda o el paciente despierto? Siempre que sea posible, el procedimiento quirúrgico se efectuará con anestesia regional, evitando la anestesia endotraqueal. Si se requiere anestesia general, quizá la anestesia con mascarilla facial o con mascarilla laríngea pueda evitar la estimulación inherente a la intubación endotraqueal. En un paciente intubado con hiperreactividad bronquial, los reflejos de la vía aérea disminuyen con el uso de lidocaína (intravenosa o intratraqueal) y agonistas adrenérgicos b nebulizados. Algunos pacientes pueden ser candidatos a la extubación con anestesia profunda, pero no se recomienda en aquellos en riesgo de aspiración y con vía aérea difícil. En general, la extubación con anestesia profunda se efectúa mientras el paciente respira espontáneamente, con anestesia profunda con un agente halogenado, y supresión de los reflejos de la vía aérea. La extubación con anestesia profunda no es una garantía del 100% frente al broncoespasmo durante el despertar del paciente. Bibliografía Recomendada 1. Stoller JK: Acute exacerbations of chronic obstructive pulmonary disease. N Engl J Med 346:988–994, 2002. 2. Sutherland ER, Cherniack RM: Management of chronic obstructive pulmonary disease. N Engl J Med 350:2689– 2697, 2004. James B. Haenel, RRT, y Jeffrey L. Johnson, MD CAPÍTULO 41 Síndrome de distrés respiratorio agudo 1. ¿Cuál es la diferencia entre una lesión pulmonar aguda y el síndrome de distrés respiratorio agudo? En 1992, el North American-European Consensus Committee (NAECC) sobre el síndrome de distrés respiratorio agudo (SDRA) se reunió con el objetivo de proporcionar una definición más clara y uniforme de la lesión pulmonar aguda (ALI o acute lung injury) y del SDRA. Dos años más tarde, la ALI se definió como un proceso inflamatorio agudo que daba lugar a un aumento de la permeabilidad pulmonar. La presentación clínica de ambos procesos desde un punto de vista de la cronología, etiologías, aspecto en la radiografía de tórax y ausencia de hipertensión auricular izquierda primaria es comparable. En realidad, la ALI y el SDRA son la misma entidad pero el grado de hipoxemia es más intenso en el SDRA. Es importante destacar que el grado de hipoxemia sólo refleja la gravedad de la enfermedad, pero no predice la mortalidad. 2. ¿Cómo definiría el síndrome de distrés respiratorio agudo? En general, se utilizan tres definiciones clínicas: la definición del NAECC, la puntuación de Murrary de lesión pulmonar (Murrary Lung Injury Score) y la definición Delphi (Tabla 41-1). La definición del NAECC ofrece dos ventajas: la primera es que proporciona un método de clasificar a los pacientes con formas de lesión pulmonar menos graves o más leves, y la segunda es que TA B L A 4 1 - 1 . D e f i n i c i o n e s d e l e s i ó n pul m o n a r a g u d a ( A L I ) y sí n d r o m e d e d i st r é s r e sp i r ato r i o a g u d o ( S DR A ) ( A m e r i ca n - Eu r op e a n C o n s e n sus C o n f e r e n c e ) Criterios de lesión pulmonar aguda (ALI) Inicio: agudo Oxigenación: PaO2/FiO2 ≤300 mmHg (con independencia de la PEEP) Infiltrados bilaterales en la radiografía de tórax anteroposterior Presión de oclusión de la arteria pulmonar: <8 mmHg o sin pruebas clínicas de hipertensión arterial Criterios de SDRA Igual que lo anterior excepto: Oxigenación: PaO2/FiO2 ≤200 mmHg (con independencia de la PEEP) Criterios de Murray Puntuación de lesión pulmonar aguda (Lung Injury Score) Puntuación de la radiografía de tórax Sin consolidación alveolar Consolidación alveolar: un cuadrante Consolidación alveolar: dos cuadrantes 0 1 2 Consolidación alveolar: tres cuadrantes Consolidación alveolar: cuatro cuadrantes 3 4 (Continúa) © 2011. Elsevier España, S.L. reservados todos los derechos 285 286 CAPÍTULO 41 Síndrome de distrés respiratorio agudo TA B L A 4 1 - 1 . D e f i n i c i o n e s d e l e s i ó n pul m o n a r a g u d a ( A L I ) y sí n d r o m e d e d i st r é s r e sp i r ato r i o a g u d o ( S DR A ) ( A m e r i ca n - Eu r op e a n C o n s e n sus C o n f e r e n c e ) ( c o n t . ) Puntuación de hipoxemia PaO2/FiO2 ≥300 0 PaO2/FiO2 225-299 1 PaO2/FiO2 175-224 2 PaO2/FiO2 100-174 3 PaO2/FiO2 ≤100 4 Puntuación de PEEP (en paciente ventilado) PEEP ≥5 cmH2O 0 PEEP 6-8 cmH2O 1 PEEP 9-11 cmH2O 2 PEEP 12-14 cmH2O 3 PEEP ≥15 cmH2O 4 Puntuación de distensibilidad del sistema respiratorio Distensibilidad ≥80 ml/cmH2O 0 Distensibilidad 60-79 ml/cmH2O 1 Distensibilidad 40-59 ml/cmH2O 2 Distensibilidad 20-39 ml/cmH2O 3 Distensibilidad ≤19 ml/cmH2O 4 El valor final se obtiene dividiendo la suma del total entre el número de componentes usados: sin lesión pulmonar, 0; lesión pulmonar leve o moderada, 1-2,5; lesión pulmonar grave (SDRA), 2,5. DELPHI Definición de SDRA Momento: inicio agudo Oxigenación: PaO2/FiO2 ≤200 con PEEP >10 Infiltrados bilaterales en la radiografía de tórax Ausencia de insuficiencia cardíaca congestiva o presencia de factores de riesgo reconocidos de SDRA PEEP, presión teleespiratoria positiva; SDRA, síndrome de distrés respiratorio agudo. la definición es lo suficientemente simple para aquellos con una experiencia incluso limitada a su aplicación inmediata. A diferencia de otras definiciones, en ella no se hace referencia al nivel establecido de presión positiva teleespiratoria (PEEP). Esta ausencia de un nivel mínimo de PEEP y de otros ajustes del ventilador mantiene la simplicidad de la definición del NAECC pero hace que sea demasiado inespecífica. Por ejemplo, en un paciente con una PEEP de 5 cmH2O el cociente de la PaO2/FiO2 podría ser <200; pero, tras una maniobra de reclutamiento (MR) con un nivel mayor de PEEP, 5 minutos más tarde, el mismo paciente podría tener un valor de PaO2/FiO2 >300. 3. ¿Cuáles son los factores de riesgo en el síndrome de distrés respiratorio agudo? Históricamente, el SDRA se ha descrito como una reacción inflamatoria muy intensa, homogénea y fulminante del parénquima pulmonar debida a una variedad de agresiones. En la actualidad, la clasificación e identificación de los factores de riesgo se basan en el mecanismo directo o indirecto del acontecimiento desencadenante de la lesión del parénquima pulmonar (véase la Tabla 41-2). CAPÍTULO 41 Síndrome de distrés respiratorio agudo 287 TA B L A 4 1 - 2 . C las i f i cac i ó n d e aco n t e c i m i e n tos p r e c i p i ta n t e s asoc i a d os co n l e s i ó n pul m o n a r a g u d a y sí n d r o m e d e d i st r é s r e sp i r ato r i o a g u d o Lesión pulmonar directa Lesión pulmonar indirecta Broncoaspiración del contenido gástrico Contusión pulmonar Infecciones pulmonares difusas Sepsis Traumatismo multisistémico asociado a shock Transfusión masiva >6 unidades de concentrado de hematíes en ≤12 horas Sobredosis Pancreatitis aguda Circulación extracorpórea (poco frecuente) Síndrome de embolismo graso Bacterianas Micóticas Víricas Pneumocystis Lesión por inhalación Casi ahogamiento © Elsevier. Fotocopiar sin autorización es un delito Además de establecer su epidemiología e incidencia, la estratificación de los factores de riesgo basada en la etiología pulmonar o extrapulmonar del SDRA tiene importantes implicaciones. Se han identificado notables diferencias mecánicas en la distensibilidad de los pulmones y de la pared torácica del paciente basadas en una causa pulmonar o extrapulmonar. El SDRA resultante de una enfermedad pulmonar directa se asocia de forma predominante con la consolidación del tejido pulmonar; por lo tanto, en el mejor de los casos, la respuesta de un pulmón rígido a una MR con PEEP puede ser escasa en el mejor de los casos y en cambio entraña un riesgo de sobredistensión de los alvéolos normales. En cambio, el pulmón que sufre una agresión indirecta muestra mayor edema intersticial y colapso alveolar difuso. Con frecuencia, la aplicación de una MR con PEEP en esta situación da lugar a una mejoría destacada de la distensibilidad pulmonar y de la oxigenación. 4. ¿Cuál es la causa más habitual y la tasa de mortalidad del síndrome de distrés respiratorio agudo? En el pasado, la sepsis era el factor de riesgo más habitual para el desarrollo del SDRA. En la década de 1980, en tres estudios prospectivos se valoraron los factores de riesgo en el SDRA, y la sepsis se identificó en el 43% de casos. El diagnóstico más habitual asociado al SDRA, documentado en el National Institutes of Health (NIH) Acute Respiratory Distress Syndrome Network (ARDS NET) fue la neumonía (incidencia del orden del 35%); la incidencia de sepsis como factor etiológico es del 27%. La dificultad de interpretación de los datos de mortalidad es que la definición de este síndrome ha cambiado como mínimo en tres ocasiones. No obstante, en tres ensayos aleatorizados, a gran escala, que incluyeron en total a más de 2.000 pacientes, se proporcionaron datos homogéneos de la tasa de mortalidad que varió del 33,9 al 36,3%. 5. Describa la patogenia del síndrome de distrés respiratorio agudo. A pesar de más de 30 años de investigación clínica y básica de laboratorio, no se han aclarado los mecanismos que generan el SDRA. Una intensa reacción pulmonar inflamatoria dirigida inicialmente a la membrana intersticial y alveolocapilar es común a todos los factores de riesgo y acontecimientos desencadenantes. Como resultado de la lesión de la membrana endotelial y de la membrana epitelial alveolar, la inundación del espacio alveolar con exudados proteínicos que contienen un elevado número de neutrófilos produce un cortocircuito grave y la alteración del intercambio de gases. La atracción de los leucocitos polimorfonucleares (PMN) hasta la 288 CAPÍTULO 41 Síndrome de distrés respiratorio agudo lesión pulmonar se ha relacionado con la presencia de citocinas proinflamatorias, endotoxinas, trombina, complemento y factor de crecimiento endotelial vascular. La lesión pulmonar y otras disfunciones orgánicas pueden exacerbarse y perpetuarse por una ventilación mecánica inapropiada, lo que sugiere la combinación de una lesión bioquímica y biofísica por sobredistensión alveolar y lesión de cizallamiento relacionada con la repetida abertura y cierre de las vías respiratorias distales, que exacerban la lesión del parénquima. 6. Describa los estadios del síndrome de distrés respiratorio agudo. Con independencia de la etiología específica, en general las anomalías clínicas, radiológicas e histopatológicas progresan a través de tres fases superpuestas: una fase aguda o exudativa, una proliferativa y, por último, una fase fibrótica, también referida como SDRA tardío. Identificar cada fase en un paciente es complejo y puede estar influido por otras variables de confusión, como los episodios de neumonía asociada al ventilador y los efectos lesivos de la ventilación mecánica. 1. La fase exudativa persiste alrededor de una semana y clínicamente se caracteriza por síntomas de distrés respiratorio (disnea y taquipnea), hipoxemia refractaria, infiltrados radiológicos bilaterales de distribución parcheada y, desde un punto de vista anatomopatológico, por secuestro de neutrófilos. 2. La fase proliferativa se manifiesta precozmente en la segunda semana. Desde un punto de vista clínico, persiste una reducida distensibilidad pulmonar debido al edema y la sustitución de la fibrina y detritos celulares por colágeno dentro del espacio intraalveolar. Hay hipoxemia persistente y aumento del espacio muerto alveolar que dificulta la eliminación de CO2. La hipertensión pulmonar se agrava progresivamente a medida que se destruye la red capilar, y la proliferación de la íntima induce una reducción del área total de intercambio gaseoso. Radiológicamente, hay infiltrados difusos alveolares y broncogramas aéreos en la radiografía de tórax. Histológicamente, está presente una mayor cantidad de exudado inflamatorio, que se corresponde con la presencia de PMN y el comienzo de la proliferación de fibroblastos en el intersticio y los alvéolos. 3. Al cabo de unos 10 días, aparece la fase fibrótica o tardía del SDRA. Desde un punto de vista clínico, la distensibilidad pulmonar se reduce marcadamente, con valores de distensibilidad estática de tan sólo 10-20 cmH2O, lo que induce un aumento tanto del trabajo de la respiración como de la dependencia del ventilador. La radiografía de tórax revela opacidades lineales compatibles con fibrosis. La correlación histopatológica es la cicatrización progresiva de los pulmones debida a un aumento espectacular de los niveles de colágeno. Durante esta última fase del SDRA, muchos investigadores han empleado corticosteroides para atenuar las respuestas inflamatorias del huésped. 7. ¿Cuál es la presentación habitual de los pacientes que desarrollan síndrome de distrés respiratorio agudo? Al cabo de 24 horas de la identificación de un factor de riesgo, el 80% de pacientes presenta disfunción respiratoria, y a las 72 horas el resto de pacientes progresa hasta manifestar signos de compromiso respiratorio. La mayoría de pacientes estarán sometidos a ventilación mecánica por la inestabilidad fisiológica derivada de la lesión. No es posible predecir la magnitud de la hipoxemia (refractaria a la administración de O2 suplementario), pero puede estar exacerbada por la función pulmonar y la volemia basal del paciente y un gasto cardíaco insuficiente, así como por la gravedad del factor de riesgo precipitante. La distensibilidad pulmonar disminuye con una agravación del cortocircuito intrapulmonar, como se demuestra por el aumento de las presiones alveolares máximas (presión de meseta estática). Esto refleja la disminución del volumen del pulmón aireado por el edema persistente, la atelectasia y la consolidación del pulmón afectado. Es importante destacar que la distensibilidad reducida refleja la falta de elasticidad del tejido pulmonar que participa en la ventilación y no la del consolidado, lleno de líquido. En los pacientes no sedados son habituales la taquipnea y el «hambre de aire», con un aumento de la ventilación minuto. La auscultación de los pulmones es sorprendentemente normal y, en general, el volumen de las secreciones aspiradas del tubo endotraqueal es mínimo. CAPÍTULO 41 Síndrome de distrés respiratorio agudo 289 8. ¿Hay alguna enfermedad pulmonar que mimetice el síndrome de distrés respi­ ratorio agudo? De acuerdo con los criterios del NAECC, diversas enfermedades pulmonares parenquimatosas no infecciosas difusas cumplen todos los criterios necesarios de ALI/SDRA (véase la Tabla 41-3). En la mayoría de pacientes que cumplen estos criterios se establece el diagnóstico inicial de ALI/SDRA, secundario a neumonía. Aunque la neumonía es una de las causas más prevalentes de SDRA, la etiología infecciosa puede encontrarse en alrededor del 50% de casos. Los pacientes que se presentan sin un factor de riesgo evidente de neumonía deben someterse a broncoscopia para un lavado alveolar, y pueden requerir una biopsia pulmonar abierta para excluir con certeza una causa infecciosa. El diagnóstico erróneo de un paciente con una causa no infecciosa del inicio de la alteración de la función pulmonar aguda puede hacer que deje de recibir un tratamiento apropiado con corticosteroides sistémicos. TA B L A 4 1 - 3 . C ausas d e e n f e r m e d a d e s pul m o n a r e s n o i n f e cc i osas a g u d as Neumonía intersticial aguda Neumonía eosinófila aguda Bronquiolitis obliterante aguda con neumonía organizativa Hemorragia alveolar difusa Neumonía por hipersensibilidad aguda © Elsevier. Fotocopiar sin autorización es un delito 9. ¿Se dispone de tratamientos farmacológicos para el síndrome de distrés respi­ ratorio agudo? Por desgracia, a pesar del establecimiento de una red NIH (ARDS NET) de grupos interactivos de tratamiento de cuidados críticos que participaron en ensayos multicéntricos, prospectivos, aleatorizados y controlados, no se ha encontrado ningún tratamiento farmacológico eficaz. Se han examinado los inhibidores de la tromboxano sintetasa, óxido nítrico (NO), corticosteroides, surfactante, N-acetilcisteína, prostaciclina inhalada, ventilación líquida parcial con perfluorocarbono, proteína C activada y otros agentes, aunque sin que se haya obtenido una eficacia convincente. 10. Por consiguiente, ¿ninguno de estos fármacos tiene utilidad en pacientes con un síndrome de distrés respiratorio agudo refractario? El hecho de que ningún fármaco haya demostrado una disminución de la tasa de mortalidad no significa que un paciente individual no pueda manifestar una respuesta favorable a un tratamiento farmacológico. Por ejemplo, el NO inhalado, previamente considerado un tratamiento prometedor por su capacidad para producir una vasodilatación pulmonar selectiva y resolver la desigualdad ventilación-perfusión, no ha demostrado una disminución de la tasa de mortalidad. Sin embargo, en un paciente moribundo con hipoxemia refractaria, en los ensayos efectuados con NO inhalado se ha obtenido sistemáticamente una mejoría de la oxigenación y de la hemodinámica pulmonar en el 60% de pacientes. Estos beneficios son de corta duración y disminuyen durante un período de 24-48 horas; pero este tiempo adicional permite que sean eficaces otros tratamientos, como los antibióticos. De forma parecida, en un estudio reciente efectuado por la ARDS NET sobre la tolerabilidad y eficacia de los corticosteroides administrados en el SDRA persistente, se concluyó que no está justificada la administración sistemática de metilprednisolona. No obstante, hasta la fecha, se han efectuado cinco ensayos que han incluido a 518 pacientes tratados con corticosteroides como parte de un protocolo de SDRA y han demostrado una mejora significativa del intercambio de gases, junto con una disminución de los marcadores de inflamación y de la duración de la ventilación mecánica y de la estancia en la unidad de cuidados intensivos (UCI). De hecho, por lo que respecta al SDRA refractario, ningún tratamiento es sistemático; por esta razón, las decisiones sobre el tratamiento farmacológico avanzado han de valorarse a la luz del estado fisiológico del paciente. 290 CAPÍTULO 41 Síndrome de distrés respiratorio agudo 11. ¿Hay una estrategia de fluidoterapia óptima en el síndrome de distrés respira­ torio agudo? Recientemente, la ARDS NET demostró que una fluidoterapia conservadora que da lugar a un equilibrio hídrico negativo en el día 7 (–136 ± 491 ml) en comparación con una fluidoterapia liberal (6.992 ± 502 ml) se traducía en un menor número de días conectado al ventilador, de estancia en la UCI y sin aumento de la insuficiencia de órganos distintos del pulmón. Además, el uso de un catéter de arteria pulmonar comparado con un catéter venoso central no demostró diferencias en el pronóstico. 12. ¿La ventilación mecánica puede acelerar o retrasar la curación del síndrome de distrés respiratorio agudo? Sí. El síndrome de ALI/SDRA consiste en un patrón de consolidación pulmonar muy heterogéneo. Rápidamente, en el curso de la lesión pulmonar estos cambios heterogéneos de la morfología pulmonar dan origen a tres zonas que consisten en regiones pulmonares sanas: unas zonas potencialmente reclutables en la porción media, regiones pulmonares declives consolidadas y áreas de tejido pulmonar hiperinsuflado. Como consecuencia de los cambios estructurales progresivos que se producen en el parénquima pulmonar, una lesión pulmonar asociada al ventilador (VALI) puede ser consecuencia de una mala distribución del volumen corriente (VT) y de las presiones elevadas de la vía aérea, lo que induce una sobredistensión en las zonas de aireación normal. Esta lesión pulmonar causada por volúmenes ventilatorios altos se conoce como volutrauma. Pero la lesión del parénquima también se produce cuando los pulmones son ventilados con un volumen pulmonar bajo y con bajas presiones teleespiratorias. Aunque no se ha dilucidado por completo, la formación de este contexto de bajo volumen pulmonar es consecuencia del aumento de estrés de cizallamiento debido a la repetida abertura y cierre de los bronquiolos y alvéolos ocluidos por la deficiencia de surfactante. Esta región de bajo volumen se denomina atelectrauma. Sin duda, hay que obtener un equilibrio entre el suministro de una presión de meseta inspiratoria suficiente (presión alveolar máxima) y, al mismo tiempo, evitar que las presiones teleespiratorias sean insuficientes. 13. ¿Cómo debe ser la ventilación de pacientes con síndrome de distrés respirato­ rio agudo? Como consecuencia de las crecientes evidencias de la mayor morbilidad y mortalidad asociadas a la VALI, los médicos han prestado atención a la provisión de estrategias protectoras pulmonares en pacientes con ALI/SDRA. Se han efectuado numerosos ensayos clínicos que han comparado la eficacia de una estrategia de bajo VT con los valores más tradicionales. El ensayo a mayor escala fue un estudio de la ARDS NET, que reclutó a 861 pacientes y comparó un VT de 6 ml/kg de peso corporal ideal con un VT de 12 ml/kg. En el grupo de menor VT, si la presión de meseta teleespiratoria persistía en valores >30 cmH2O, se permitió una reducción hasta 4 ml/kg, mientras que en el grupo tratado con la estrategia tradicional no se redujo el VT a menos que las presiones de meseta fueran >50 cmH2O. La mortalidad fue del 39,8% en el grupo tratado con la estrategia tradicional y del 31% en el grupo tratado con un VT bajo, es decir, una disminución del 20%. En otras palabras, por cada 10 pacientes ventilados con una estrategia protectora pulmonar se salvará una vida. 14. Defina la maniobra de reclutamiento pulmonar y las diferentes técnicas usa­ das. La MR pulmonar se define como la aplicación de un aumento prolongado de la presión de la vía aérea con el objetivo de revertir la atelectasia, seguida de la aplicación de un grado suficiente de PEEP para garantizar que el pulmón permanezca «abierto». Se utilizan varias técnicas (Tabla 41-4). La mayoría de las MR se realizan de forma intermitente, mediante la manipulación del ventilador mecánico, mientras que algunas son continuas. A pesar de que las MR se aceptan como parte de la estrategia de protección pulmonar de ALI/ SDRA, los conocimientos sobre su aplicación todavía son incompletos: qué pacientes obtendrán beneficios, lesión pulmonar directa frente a lesión indirecta, duración óptima, momento de aplicación, aplicación sistemática o sólo durante los episodios hipóxicos agudos, y si la PEEP basal hace que la respuesta sea diferente. CAPÍTULO 41 Síndrome de distrés respiratorio agudo 291 TA B L A 4 1 - 4 . T é c n i cas usa d as pa r a la m a n i ob r a d e r e cluta m i e n to Ventilación convencional Modos no convencionales Posición Insuflación prolongada/CPAP CPAP de 30-40 cmH O 2 Ventilación de alta frecuencia Oscilación de alta frecuencia Ventilación en decúbito prono Uso de posición de Trendelenburg inversa; mantener para PEEP 12-24 horas Posición en decúbito supino Mantener la cabecera de la cama a 30-45° lateralizando la posición con frecuencia PEEP Ventilación con liberación de 1. Aumentos incrementales presión de la vía aérea Ventilación con en 2,5-5 cmH2O Hasta un aumento de la relación P/F relación inversa del 2. Modo VCP: FR 10/min, I:E control de presión 1: PIP 20 cmH2O, aumento de la PEEP hasta 30-40 cmH2O durante 2 minutos Adición de suspiros (grandes volúmenes corrientes periódicos) Considerar la respiración espontánea © Elsevier. Fotocopiar sin autorización es un delito CPAP, presión positiva continua de las vías respiratorias; FR, frecuencia respiratoria; I:E, relación inspiración/ espiración; PEEP, presión teleespiratoria positiva; PIP, presión inspiratoria máxima; VCP, ventilación controlada por presión. 15. ¿Cómo actúa la ventilación en decúbito prono? El principal defecto pulmonar que se observa en la tomografía computarizada (TC) de pacientes en decúbito supino con SDRA es la opacificidad de las áreas del pulmón dependientes de la gravedad, como consecuencia de la atelectasia y la consolidación. Claramente, la inundación del espacio alveolar por formación de edema es responsable, en parte, de la atelectasia, pero el desequilibrio mecánico, causado por desplazamiento cefálico del diafragma por la ventilación de presión positiva, disminuye la distensibilidad torácica y abdominal, incrementa la presión pleural en las regiones pulmonares dorsales, y el peso del corazón provoca la compresión de las regiones pulmonares inferiores, y todos estos efectos, en conjunto, agravan la atelectasia y facilitan el desequilibrio de la ventilación-perfusión (V/Q). Es importante destacar que la gravedad influye poco en la heterogeneidad de la perfusión pulmonar; por lo tanto, con independencia de su posición, las regiones dorsales del pulmón siempre reciben una perfusión preferente. Es probable que las mejoras de la oxigenación por utilización de la posición en decúbito prono sean consecuencia de: Reclutamiento de los campos pulmonares dorsales colapsados al redistribuir el edema pulmonar a las regiones anteriores. Incremento del movimiento del diafragma estimulando la ventilación. Eliminación de los efectos compresivos del corazón en los campos pulmonares inferiores, con la consiguiente mejora de la ventilación regional. El mantenimiento de la perfusión pulmonar dorsal frente a la mejora de su ventilación da lugar a un mejor ajuste V/Q. 16. La ventilación efectuada en decúbito prono, ¿ofrece un beneficio de supervi­ vencia a los pacientes con síndrome de distrés respiratorio agudo? Desde 2001 se han publicado más de nueve ensayos prospectivos aleatorizados sobre ventilación efectuada en decúbito prono en pacientes en estado crítico. Tan sólo en 2008 se han 292 CAPÍTULO 41 Síndrome de distrés respiratorio agudo publicado cuatro metaanálisis sobre ventilación efectuada en decúbito prono en alrededor de 1.562 pacientes. Todos estos ensayos excepto dos utilizaron una forma de estrategia ventilatoria protectora pulmonar. El hallazgo claro de todos estos estudios es que la ventilación de estas características da lugar a una mejoría constante de la oxigenación pero, lamentablemente, no demuestra una influencia clara en la mortalidad. P U N TOS CLAVE: Sí ndrome de distré s respiratorio agudo 1. Históricamente la sepsis se ha identificado como el factor de riesgo más habitual de SDRA. 2. Se considera que la ALI se debe a dos mecanismos: Sobredistensión de un pulmón cuya aireación es normal utilizando volúmenes corrientes elevados. Colapso pulmonar que acontece como consecuencia de ventilar los pulmones con bajos volúmenes y presiones teleespiratorias. 3. Los ajustes de la ventilación mecánica de pacientes con SDRA o ALI son un volumen corriente de 6-8 ml/kg de peso corporal ideal y la limitación de las presiones de meseta a <30 cmH2O. 4. La PEEP debe ajustarse para prevenir el colapso telespiratorio. 5. La FiO2 debe ajustarse para mantener saturaciones de O2 del 88-92%. Bibliografía Recomendada 1. Calfee CS, Matthay MA: Nonventilatory treatments for acute lung injury and ARDS. Chest 131:913–920, 2007. 2. Ferguson NA, Frutos-Vivar F, Esteban A, et al: Acute respiratory distress syndrome: underrecognition by clinicians and diagnostic accuracy of three clinical definitions. Crit Care Med 33:2228–2234, 2005. 3. Girard TD, Bernard GR: Mechanical ventilation in ARDS: a state-of-the-art review. Chest 131:921–929, 2007. 4. Matthay MA: Treatment of acute lung injury. Proc Am Thorac Soc 5:297–299, 2008. 5. Meade MO, Cook DJ, Guyatt GH, et al: Ventilation strategy using low tidal volumes, recruitment maneuvers, and high positive end-expiratory pressure for acute lung injury and acute respiratory distress syndrome: a randomized controlled trial. JAMA 299:637–645, 2008. 6. Mercat AM, Richard JC, Vielle B, et al: Positive end-expiratory pressure setting in adults with acute lung injury and acute respiratory distress syndrome: a randomized controlled trial. JAMA 299:646–655, 2008. 7. Meduri GM, Marik PE: Steroid treatment in ARDS: a critical appraisal of the ARDS network trial and the recent literature. Intensive Care 34:61–69, 2008. 8. Shuster KM, Alouidor R, Barquist ES: Nonventilatory interventions in the acute respiratory distress syndrome. J Intensive Care Med 23:19–33, 2008. James Duke, MD, MBA CAPÍTULO 42 Hipertensión pulmonar 1. Defina la hipertensión pulmonar. Aunque no hay unos límites de presión en la arteria pulmonar aceptados ampliamente, se considera que existe hipertensión pulmonar (HTP) cuando la presión pulmonar sistólica es >25 mmHg en presencia de valores normales de gasto cardíaco (GC) y de presión de enclavamiento capilar pulmonar. Durante el esfuerzo, se considera que existe HTP con una presión en la arteria pulmonar (PAP) >30 mmHg. 2. Mencione los procesos que producen hipertensión pulmonar. Se dice que la HTP es idiopática si no se identifican causas secundarias, como enfermedad pulmonar (congénita o parenquimatosa), cardiopatía (p. ej., cortocircuitos, estenosis mitral, insuficiencia ventricular izquierda), tromboembolismo pulmonar o enfermedad vascular pulmonar obliterante, conectivopatía (en especial de la familia de la esclerodermia), fármacos vasoconstrictores (p. ej., el anorexígeno fenfluramina) o hipertensión portal. Aunque es poco frecuente en la población general, las poblaciones en riesgo incluyen aquellas con conectivopatías y portadoras del virus de la inmunodeficiencia humana. Antaño la HTP idiopática se denominaba primaria, es un diagnóstico de exclusión, afecta a uno o dos individuos por millón de habitantes, en ocasiones tiene carácter familiar y es más frecuente en mujeres que en hombres. Comparado con las causas secundarias de HTP, los valores de la PAP suelen ser más altos en la idiopática. 3. Describa la fisiopatología y la evolución natural de la hipertensión pulmonar. La lesión de la célula endotelial induce un desequilibrio entre las moléculas vasodilatadoras y las vasopresoras. Se observa una disminución de los vasodilatadores endógenos óxido nítrico (NO) y prostaciclina (PGI2), al mismo tiempo que hay un aumento de las moléculas vasoconstrictoras tromboxano y endotelina. No obstante, la vasoconstricción parece ser tan sólo una parte de la respuesta porque la trombosis, inflamación, generación de radicales libres e hiperplasia del músculo liso también son características habituales en la HTP. De hecho, una característica destacada es el remodelado vascular. La circulación pulmonar se caracteriza por un flujo elevado y una baja resistencia. Los cambios del GC, presión de las vías respiratorias y gravedad afectan más a la circulación pulmonar que a la sistémica. El ventrículo derecho (VD) es de paredes finas y se adapta mejor a los cambios de volumen que de presión. Para adaptarse a los aumentos del flujo como, por ejemplo, durante el ejercicio, se reclutan vasos no abiertos, vasos permeables distendidos, y la resistencia vascular pulmonar (RVP) puede disminuir. Por lo tanto, estos mecanismos normales de adaptación pueden acomodar aumentos del flujo de tres a cinco veces sin aumentos sustanciales de la PAP. En las fases iniciales de la evolución de la enfermedad, la sobrecarga de presión induce una hipertrofia del VD sin cambios sustanciales del GC o de las presiones de llenado del VD en reposo o durante el ejercicio. A medida que progresa, aumenta el grosor de la pared de los vasos y las células musculares lisas se hipertrofian y su número aumenta. Los vasos son menos distensibles, y el área transversal real de los vasos de la circulación pulmonar disminuye. Con el ejercicio puede disminuir el GC a pesar de los aumentos modestos de las presiones telediastólicas del VD (PTDVD). El VD apenas posee mecanismos para aumentar la contractilidad. Con el tiempo, aparece insuficiencia del VD (fracción de eyección del VD <45%), y el paciente manifiesta síntomas incluso en reposo. El flujo sanguíneo miocárdico del VD se compromete y se desarrolla insuficiencia tricuspídea secundaria a la distensión del VD, lo que aumenta aún más la PTDVD y agrava la insuficiencia. Además, la función diastólica del ventrículo izquierdo © 2011. Elsevier España, S.L. Reservados todos los derechos 293 294 CAPÍTULO 42 Hipertensión pulmonar (VI) puede deteriorarse y puede comprometerse el llenado del VI por excesiva incursión septal en él, con la disminución consiguiente del GC. Sin tratamiento, la HTP suele ser mortal, con una supervivencia media de 2,8 años. Las tasas de supervivencia al año, 3 y 5 años son del 68, 48 y 34%, respectivamente. Durante el embarazo la tasa de mortalidad es del 30-50%, y la mayoría de expertos recomiendan finalizar la gestación en fases precoces de la misma, sin esperar a que llegue a término. 4. ¿Cuál es el riego sanguíneo del ventrículo derecho? Depende de que la dominancia sea de la arteria coronaria izquierda o de la derecha. En general, las arterias coronarias descendentes anteriores izquierda y derecha irrigan el tabique y las porciones de la pared libre del VD. Normalmente, la pared libre del VD es perfundida durante la sístole y la diástole. Durante la HTP, la función del VD se relaciona directamente con la presión arterial sistémica. 5. ¿Cómo se calcula la resistencia vascular pulmonar y cuáles son los valores normales? RVP = (PAP media – PAI)/flujo sanguíneo pulmonar donde PAI es la presión auricular izquierda. Con frecuencia, el flujo sanguíneo pulmonar es sustituido por el GC, aunque los cortocircuitos intracardíacos y otros hacen que sus valores no sean iguales. La RVP normal es de 1,1-1,4 unidades Woods o del orden de 90-120 dynas/s/cm–5. (Una unidad Woods corresponde a 240 dynas/s/cm–5.) Una RVP >300 dynas/s/cm–5 es indicativa de HTP. 6. ¿Cuáles son las características electrocardiográficas y radiológicas de la enfer­ medad? En general, en el electrocardiograma se demuestra una desviación del eje a la derecha, hipertrofia del VD (ondas R altas en V1-V3), sobrecarga del VD (inversión de la onda T en V1-V3), onda S en V6, y aumento de la amplitud de las ondas P en las derivaciones II, III y aVF. Aunque la fibrilación auricular es poco frecuente, su presencia se considera un signo de mal pronóstico porque no está disponible la contribución auricular al llenado ventricular. Se han observado anomalías radiológicas en más del 90% de casos. En la radiografía de tórax las anomalías indicativas de HTP incluyen la prominencia del VD y del tronco arterial pulmonar hiliar, y la rápida disminución de la trama vascular, la hiperclaridad de la periferia pulmonar y la disminución del espacio aéreo retrosternal. 7. ¿Qué signos y síntomas indican hipertensión pulmonar? Síntomas Disnea, inicialmente con el esfuerzo (en último término, casi todos los pacientes con HTP experimentan disnea). Angina (50% de pacientes). Cansancio (20% de pacientes). Debilidad. Síncope. Signos precoces Aumento del componente pulmonar de S2. Desdoblamiento de S2. Cuarto ruido cardíaco ventricular. Soplo diastólico precoz de insuficiencia tricúspide. Estremecimiento del VD. Signos tardíos Distensión venosa yugular (ondas V sistólicas gigantes). Edema periférico. Cianosis. Tercer ruido o galope S3 del VD. Ascitis y hepatomegalia. CAPÍTULO 42 Hipertensión pulmonar 295 8. Describa las anomalías observadas en las pruebas de función pulmonar. Las pruebas de función pulmonar demuestran un defecto restrictivo leve, secundario a la falta de distensibilidad de la vasculatura pulmonar. La gasometría en sangre arterial revela grados variables de hipoxemia. © Elsevier. Fotocopiar sin autorización es un delito 9. ¿Cuáles son las pruebas diagnósticas adicionales disponibles para valorar la hipertensión pulmonar? ¿Qué resultados son predecibles? Un ecocardiograma es un excelente método no cruento para el seguimiento de la progresión de la enfermedad. Las características ecocardiográficas de HTP incluyen: aumento de las dimensiones del VD, VI pequeño, engrosamiento del tabique interventricular, prolapso sistólico de la válvula mitral y anomalías del movimiento septal. La medición de la PAP y la RVP mediante ecoDoppler pulsado se correlaciona con los valores determinados en el cateterismo cardíaco. La gammagrafía pulmonar de perfusión es de mucha importancia en los pacientes en quienes se sospecha tromboembolismo pulmonar. A diferencia de la HTP primaria (HTPP), la enfermedad tromboembólica se trata con anticoagulantes y tromboendarterectomía. En estos pacientes, pero no aquellos con HTPP, la gammagrafía pulmonar demuestra defectos segmentarios. La angiografía pulmonar está indicada en pacientes en quienes se demuestran defectos segmentarios en la gammagrafía de perfusión, pero debe efectuarse con precaución en pacientes con HTP. Aunque no está contraindicado, el procedimiento se asocia a riesgos, que incluyen hipotensión, deterioro de la oxigenación y paro cardíaco, por lo que deben sopesarse cuidadosamente frente a los posibles beneficios. En particular, los pacientes con insuficiencia del VD y aumento de la PTDVD no toleran el procedimiento. Por último, el cateterismo cardíaco es indispensable para confirmar el diagnóstico de HTP y descartar cortocircuitos intracardíacos como causa. En la HTP, el cateterismo puede ser técnicamente difícil y requerir la inserción de un catéter con guía. La detección de un aumento de la presión de enclavamiento capilar es una indicación de cateterismo cardíaco izquierdo para descartar una estenosis mitral, una cardiopatía congénita y una insuficiencia cardíaca izquierda como causas de HTP. El grado hasta el cual la PAP y la RVP pueden disminuir de forma aguda con la administración de un vasodilatador refleja el grado hasta el cual la contracción del músculo liso contribuye al estado hipertensivo y sugiere el posible beneficio del tratamiento vasodilatador. 10. Describa los tratamientos de referencia para pacientes con hipertensión pul­ monar. En general, se administra oxigenoterapia, cuyo objetivo es mantener las saturaciones en valores >90%. En pacientes con insuficiencia ventricular derecha, congestión hepática y edema periférico, están indicados diuréticos, aunque una diuresis excesiva puede disminuir la precarga del VD y el GC. Con frecuencia, se instaura tratamiento anticoagulante (en general, warfarina por vía oral con dosis ajustadas hasta obtener una tasa o índice normalizado internacional [INR] de 1,5-2,0), porque los pacientes corren un elevado riesgo de acontecimientos tromboembólicos (asociados a una elevada mortalidad). Cuando hay signos de insuficiencia del VD y en pacientes con arritmias auriculares (p. ej., taquicardia auricular multifocal, fibrilación auricular y flúter auricular) se administran glucósidos cardíacos, a pesar de que, cuando se administra digoxina a pacientes tratados con diuréticos, es necesaria una supervisión cuidadosa de la concentración sérica de electrolitos. El tratamiento vasodilatador se describe más adelante. Por último, algunos pacientes con HTP, el trasplante de pulmón o de corazón-pulmón debe considerarse una de las opciones actuales aunque de coste elevado. 11. ¿De qué fármacos se dispone para tratar la hipertensión arterial pulmonar? Se han investigado casi todas las clases de vasodilatadores, incluidos los vasodilatadores directos del músculo liso, los antagonistas adrenérgicos a, los antagonistas adrenérgicos b, antagonistas del calcio, prostaglandinas, inhibidores de la fosfodiesterasa e inhibidores de la enzima conversora de la angiotensina. Los fármacos intravenosos disponibles para uso intraoperatorio y en la unidad de cuidados intensivos son nitroglicerina, nitroprusiato, prostaglandina E1 (alprostadilo), PGI2, fentolamina e isoproterenol. Los antagonistas del calcio son el tratamiento ambulatorio actual de elección. Dosis altas de nifedipino, diltiazem o amlodipino 296 CAPÍTULO 42 Hipertensión pulmonar han producido disminuciones de la PAP y de la RVP, junto con una regresión de la hipertrofia del VD. El verapamilo no está indicado por sus efectos inotrópicos negativos. Los inhibidores de la fosfodiesterasa III milrinona y amrinona se han utilizado satisfactoriamente para tratar la HTP después de cirugía cardíaca. La adenosina puede reducir la RVP y se ha administrado junto con antagonistas del calcio. Sin embargo, debido a sus efectos inotrópicos y cronotrópicos negativos sobre la conducción nodal sinusal y atrioventricular, debe utilizarse con precaución en pacientes con cardiopatía isquémica. Por último, en la actualidad están disponibles los antagonistas del receptor de la endotelina, que son el bosentano, el sitaxsestano y el ambrisentano. 12. Un paciente con antecedentes de hipertensión pulmonar se programa para un procedimiento quirúrgico. ¿Cómo debe monitorizarlo intraoperatoriamente? Además de la monitorización estándar, la monitorización invasiva se considera imprescindible en pacientes con HTP. La monitorización de la presión intraarterial permite una valoración latido a latido de la presión arterial y gasometrías frecuentes de sangre arterial. La monitorización de la presión venosa central (PVC) es poco precisa cuando hay insuficiencia tricuspídea o en caso de disminución de la distensibilidad del VD. La inserción de un catéter en la arteria pulmonar permite el control directo de la PAP y de la presión auricular derecha, y la valoración indirecta del volumen del VI y de su función a través de la medición de las presiones de oclusión pulmonar. No obstante, es preciso tener en cuenta que en los pacientes con HTP el cateterismo de la arteria pulmonar tiene mayor riesgo de rotura del vaso. La ecocardiografía transesofágica (ETE) es de especial utilidad para valorar la volemia, la función del VI y del VD y la insuficiencia valvular, y para la detección precoz de las anomalías segmentarias del movimiento de la pared secundarias a isquemia miocárdica. Debido a la preocupación de rotura de la arteria pulmonar, la ETE puede evitar la necesidad de cateterismo de este vaso si se tiene experiencia. 13. ¿Qué medidas intraoperatorias pueden disminuir la hipertensión pulmonar? Puesto que la hipoxemia y la hipercapnia aumentan la PAP, se optimizará la oxigenación y ventilación del paciente. En comparación con los vasos sistémicos, la hipoxia provoca constricción de los vasos pulmonares. Las maniobras de reclutamiento pueden mejorar el ajuste ventilación-perfusión, pero se evitará la hiperinsuflación. Unos niveles elevados de presión teleespiratoria positiva (PEEP) pueden provocar constricción de los vasos de las regiones bien ventiladas del pulmón, disminuyendo la PO2. Deben evitarse valores de PEEP >15 cmH2O. Se valorará la función miocárdica; una presión creciente de la arteria pulmonar puede ser secundaria a una insuficiencia del VI. Si la isquemia se asocia a una disminución del GC, se considerará la infusión de nitroglicerina para mejorar la perfusión coronaria. Los fármacos inotrópicos, como la dobutamina o la dopamina, pueden aumentar la contractilidad y mejorar el GC. Se valorará la volemia. Aunque el VD es menos sensible a la precarga que el VI, valores de PVC <10 mmHg indican la necesidad de aumentarla. Antes de la cirugía, puede efectuarse una prueba de carga de volumen endógeno elevando las piernas del paciente. En los pacientes que responden se observa una mejora de la presión arterial con esta maniobra y, por lo tanto, serán candidatos a la fluidoterapia intraoperatoria. Los que no responden posiblemente presentan insuficiencia del VD, y la fluidoterapia intraoperatoria puede agravarla. Se corregirá la acidosis y se prestará atención a la hipotermia. Tanto las anomalías acidobásicas como la hipotermia inducen un aumento de la PAP. Los efectos de la acidosis se agravan en presencia de hipoxemia. Se sugiere una hiperventilación moderada (con una PaCO2 de unos 30 mmHg). Se profundizará la anestesia. La liberación de catecolaminas aumentará la PAP. Si hay insuficiencia del VD, se considerará la administración de inotropos. Los inhibidores de la fosfodiesterasa III milrinona y amrinona impiden la degradación del guanosín monofosfato cíclico (GMPc) y aumentan la contractilidad del VI al mismo tiempo que dilatan la vasculatura pulmonar. La dobutamina también es una opción. CAPÍTULO 42 Hipertensión pulmonar 297 Si hay hipotensión sistémica y la perfusión coronaria está en riesgo, los vasoconstrictores pueden ser superiores a una carga de volumen y a los inotropos. Debido al equilibrio entre los efectos adrenérgicos α y β, la noradrenalina es el vasoconstrictor de elección. Debe administrarse con precaución porque aumenta la PAP. Se considerará la administración de vasodilatadores de acción directa. Se abordarán más adelante con mayor detalle. 14. Describa el efecto de los anestésicos halogenados y del óxido nitroso (no ní­ trico) sobre la circulación pulmonar. Cuando se utiliza como parte de la anestesia de mantenimiento, se ha demostrado que el isoflurano a una concentración alveolar mínima (CAM) de 1-1,2 reduce la PAP y la RVP y mejora el GC en este contexto. Se supone que el mecanismo es una acción directa sobre el músculo liso vascular pulmonar. De los anestésicos halogenados, es probable que el isoflurano produzca el mayor efecto. Así mismo, los niveles CAM sugeridos mantienen la PaO2, lo que indica que la vasoconstricción pulmonar hipóxica no se inhibe a esta profundidad de la anestesia. Sin embargo, es preciso incrementar con precaución la dosis de isoflurano y de cualquier otro anestésico halogenado debido al riesgo de deterioro de la función del VD. El óxido nitroso puede aumentar la RVP y atenuar la vasoconstricción pulmonar hipóxica; es preferible evitar su utilización en la HTP. 15. ¿Cuáles son los efectos de los anestésicos intravenosos sobre la presión de la arteria pulmonar y la vasoconstricción pulmonar hipóxica? Se ha demostrado que las infusiones de propofol disminuyen la PAP y la RVP. También pueden producir una disminución simultánea de la presión arterial media. Los anestésicos intravenosos producen efectos mínimos sobre la vasoconstricción pulmonar hipóxica y la oxigenación. Los opiáceos no producen efectos vasodilatadores directos, pero pueden atenuar el efecto vasoconstrictor de los estímulos dolorosos perjudiciales. En niños con cortocircuitos intracardíacos, la ketamina puede impedir la inversión de un cortocircuito de izquierda a derecha porque incrementa la resistencia vascular sistémica hasta un mayor grado que la RVP. © Elsevier. Fotocopiar sin autorización es un delito 16. ¿Es una opción la anestesia regional? La anestesia epidural se ha usado sin riesgos en pacientes con HTP. Los cambios agudos de la resistencia vascular sistémica asociados a la anestesia subaracnoidea sugieren que ésta es de elección. Sigue recomendándose una monitorización invasiva. La pérdida de fibras cardioaceleradoras presentes desde T1 a T4 puede dar lugar a una bradicardia adversa. Antes del procedimiento, se aumentará con precaución la precarga, y estarán disponibles fármacos para tratar una disminución aguda de la resistencia vascular sistémica o de la frecuencia cardíaca. 17. Describa las ventajas y desventajas de los nitritos vasodilatadores intrave­ nosos. Debido a su disponibilidad inmediata, facilidad en el ajuste de la dosis y su empleo generalizado, los nitritos intravenosos son vasodilatadores de uso difundido en el tratamiento de un aumento agudo de la PAP. Los más usados son la nitroglicerina y el nitroprusiato sódico, y su mecanismo de acción es la liberación de NO. La nitroglicerina presenta la ventaja de producir vasodilatación coronaria; puesto que es sobre todo venodilatadora, puede disminuir en exceso la precarga. La infusión de nitroglicerina se inicia con una dosis de alrededor de 1 mg/kg/min y, en general, produce una disminución uniforme de las presiones vasculares. Con dosis 3 mg/kg/min, la venodilatación puede ser excesiva, con una disminución de la precarga y requiriendo un aumento de la cantidad de líquido administrado como fluidoterapia. El nitroprusiato sódico (NPS) es sobre todo un vasodilatador arterial muy potente. La infusión se inicia con una dosis del orden de 0,5-1 mg/kg/min, y se ajusta cuidadosamente hasta obtener el efecto deseado. El NPS es muy eficaz para reducir la poscarga. A pesar de su potencia y el riesgo de producir hipotensión excesiva, es bien tolerado en tratamientos cortos. El uso prolongado se asocia con taquifilaxia y posible toxicidad por cianuro, uno de sus principales metabolitos. 298 CAPÍTULO 42 Hipertensión pulmonar A pesar de sus efectos sobre la RVP, los nitritos no son selectivos y también disminuyen la presión arterial sistémica y entrañan un riesgo de isquemia miocárdica, en particular en el contexto de una hipertrofia ventricular. Además, la dilatación de los vasos sanguíneos pulmonares que producen no es selectiva, aumentan la perfusión de los alvéolos mal ventilados e incrementan el desajuste ventilación-perfusión, dando lugar a hipoxemia. 18. Describa las propiedades del óxido nítrico. El NO es una pequeña molécula producida por el endotelio vascular. Formado a partir de la acción de la NO sintetasa sobre la arginina, el NO alcanza el músculo liso vascular y estimula la guanilatociclasa, lo que da lugar a la formación de 3",5"- GMPc. Más tarde, el GMPc produce la relajación del músculo liso y vasodilatación. El NO se administra por inhalación; cruza la membrana alveolar hasta el endotelio vascular e induce relajación del músculo liso. Sin embargo, cuando alcanza la circulación, se une rápidamente a la hemoglobina (con una afinidad 1.500 veces mayor que la del monóxido de carbono) y se desactiva; por lo tanto, carece de efectos vasodilatadores sistémicos. Además, puesto que sólo se distribuye a los alvéolos perfundidos, puede aumentar el flujo sanguíneo hasta los alvéolos ventilados. El rango de dosis es amplio, pero la dosis administrada habitual es de 20-40 partes por millón. La desactivación del NO al penetrar en la circulación también limita su eficacia al período en el cual se administra por inhalación. Puesto que su almacenamiento en oxígeno produce óxidos tóxicos de nitrógeno, en particular dióxido de nitrógeno (NO2), el NO se almacena en nitrógeno y se mezcla con los gases del ventilador inmediatamente antes de su administración. Debe tenerse en cuenta la posibilidad de un aumento de los niveles de metahemoglobina durante su administración. Produce efectos proinflamatorios y antiinflamatorios cuyo significado no se comprende por completo. También afecta a la agregación y adhesión plaquetarias. 19. Describa la utilidad terapéutica y las limitaciones del óxido nítrico en la hiper­ tensión pulmonar. Durante la valoración de un paciente con un diagnóstico de HTP, se usa NO inhalado (y epoprostenol o adenosina intravenosos) para valorar la respuesta vasodilatadora. Una respuesta positiva es una disminución de la PAP media de 10 mmHg hasta un valor <40 mmHg y un GC que se mantiene o aumenta. Los pacientes con esta respuesta son candidatos a un tratamiento prolongado con antagonistas del calcio por vía oral. La circulación extracorpórea (CEC) induce una lesión endotelial pulmonar, probablemente debida a una lesión de isquemia-reperfusión, aunque es posible que participen otros factores. Aumentan los valores de los vasoconstrictores tromboxano y endotelina mientras que disminuyen los de los vasodilatadores PGI2 y NO endógeno. La HTP después de un una CEC es una variable pronóstica de una mayor mortalidad e infarto de miocardio postoperatorio. El NO se ha probado como tratamiento de la HTP tras cirugía valvular, corrección de cardiopatías congénitas y trasplante de corazón; los resultados no han sido constantes. También se ha utilizado como terapia puente hasta el trasplante de pulmón. Se han emprendido numerosas investigaciones sobre la eficacia del NO para mejorar la oxigenación y la HTP en el síndrome de distrés respiratorio del adulto (SDRA). Los factores que producen HTP en el SDRA incluyen la destrucción del parénquima, microtrombos, colapso de las vías respiratorias, vasoconstricción pulmonar y los efectos adversos de la PEEP. Aunque la oxigenación mejora, si se valoran todos los datos disponibles no hay estudios aleatorizados controlados que demuestren una mejora del pronóstico cuando el SDRA se trata con NO. Numerosos procesos neonatales se asocian con HTP, incluidas las hernias diafragmáticas congénitas, cardiopatías congénitas, además de la HTP persistente del recién nacido. En la actualidad, el NO sólo está aprobado para uso en lactantes con SDRA. La HTP portal es una complicación de la cirrosis y la hipertensión portal y se había considerado previamente una contraindicación del trasplante de hígado. Se ha demostrado que el epoprostenol confiere algunos beneficios, mientras que los del NO han sido menos convincentes. CAPÍTULO 42 Hipertensión pulmonar 299 P U N T OS CLAVE: Hipertens ión pulmona r 1. Fluidoterapia adecuada (infusiones de líquidos). 2. Optimización de la oxigenación y la ventilación. 3. Corrección del equilibrio acidobásico. 4. Monitorización de la temperatura corporal para obtener normotermia. 5. Disminución de la respuesta vegetativa al estrés con una profundización de la anestesia. 6. Administración de tratamiento vasodilatador. 20. ¿Qué son los prostanoides y sus análogos terapéuticos? Los prostanoides están presentes en el endotelio vascular y actúan a través de receptores específicos de las prostaglandinas estimulando la adenilatociclasa y aumentando el adenosín monofosfato cíclico. Las prostaglandinas relajan el músculo liso e inhiben la agregación plaquetaria. La producción natural de PGI2 disminuye en la HTP. Cuando el epoprostenol, un análogo de la PGI2, se administra en infusión intravenosa continua, tiene una semivida de 2-3 minutos. Al igual que los nitritos, los prostanoides por vía intravenosa carecen de selectividad pulmonar, por lo que entrañan un riesgo de hipotensión sistémica y disminución de la perfusión coronaria del VD. Los análogos de los prostanoides disponibles en la actualidad pueden administrarse por inhalación, por vía subcutánea o por vía oral. Por inhalación presentan algunas limitaciones porque la nebulización no es suficientemente eficiente para la distribución del fármaco hasta las vías respiratorias distales. 21. ¿Cuál es el valor de la adenosina? La adenosina relaja las células musculares lisas de la circulación pulmonar. Su semivida es de tan sólo 9 segundos; por lo tanto, cuando se administra por vía intravenosa, sus acciones se limitan relativamente a la circulación pulmonar. A pesar de que es un vasodilatador potente, aumenta el desequilibiro ventilación-perfusión. © Elsevier. Fotocopiar sin autorización es un delito 22. ¿Qué son los inhibidores de la fosfodiesterasa-5? La fosfodiesterasa-5 (PDE5) es una enzima que degrada el GMPc. Los inhibidores de la PDE-5 son vasodilatadores administrados por vía oral que impiden su degradación y potencian el efecto del NO. Los disponibles en la actualidad son el zaprinast y el sildenafilo. Cuando se usan junto con NO o prostanoides producen efectos sinérgicos. Bibliografía Recomendada 1. Alam S, Palevsky HI: Standard therapies for pulmonary arterial hypertension. Clin Chest Med 28:91–115, 2007. 2. Blaise G, Langleben D, Hubert B: Pulmonary arterial hypertension. Anesthesiology 99:1415–1432, 2003. 3. Fischer LG, Van Aken H, Bürkle H: Management of pulmonary hypertension: physiological and pharmacological considerations for the anesthesiologist. Anesth Analg 96:1603–1616, 2003. 4. Granton J, Moric J: Pulmonary vasodilators—treating the right ventricle. Anesthesiology Clin 26:337–353, 2008. 5. McLaughlin VV, Mcgoon MD: Pulmonary arterial hypertension. Circulation 114:1417–1431, 2006. CAPÍTULO 43 Disfunción hepática perioperatoria Matthew J. Fiegel, MD 1. ¿Cuál es la función fisiológica normal del hígado? El hígado humano está formado por cuatro lóbulos anatómicos (izquierdo, derecho, caudado, cuadrado) y ocho lóbulos quirúrgicos (I-VIII). El hígado recibe aproximadamente el 20-25% del gasto cardíaco y contiene un 10-15% del volumen sanguíneo total. La vena porta aporta el 75% del flujo de sangre del hígado y el 50% de sus requerimientos de oxígeno. Casi todas las proteínas plasmáticas son sintetizadas en el hígado. Entre éstas destacan la albúmina, la α1-glicoproteína ácida, la seudocolinesterasa, y todos los factores de coagulación a excepción de los factores III, IV y VIII. El hígado también interviene en el metabolismo de los hidratos de carbono, lípidos y colesterol y en la síntesis biliar. El hígado produce un 20% del hemo del organismo. Asimismo posee una función inmunitaria ya que las células hepáticas de Kupffer filtran las bacterias de la sangre venosa esplácnica. Por último, el hígado actúa como el órgano principal de metabolismo y detoxificación farmacológicos. A través de tres reacciones hepáticas (fases I, II y III), los fármacos son metabolizados a una forma más hidrosoluble y son excretados en la orina o la bilis. Las reacciones de fase I utilizan la familia de proteínas del citocromo P-450 y son reacciones de oxidación, reducción o hidrólisis. Las reacciones de fase II sufren conjugación con sustancias como el ácido glucurónico y aminoácidos. En las reacciones de fase III, las proteínas hepáticas endógenas utilizan el trifosfato de adenosina para excretar diferentes sustancias. En el hígado, los compuestos nitrogenados se degradan a urea. 2. ¿Cuál es la causa más habitual de hepatopatía parenquimatosa aguda? Las infecciones víricas son responsables de la mayoría de los casos de hepatitis aguda. Tradicionalmente, la hepatitis B (HBV) era la forma más habitual de hepatitis vírica aguda. Sin embargo, con la aparición de la vacuna de la HBV, la hepatitis A y la C están constituyendo un gran porcentaje de casos en todo el mundo. El virus de Epstein-Barr y el citomegalovirus también provocan hepatitis aguda. Entre las causas no víricas destacan los fármacos y las toxinas. Las lesiones hepáticas inducidas por fármacos (DILI, drug induced liver injury) se asemejan a la hepatitis vírica aguda y están causadas en su mayor parte por alcohol, antibióticos y fármacos antiinflamatorios no esteroideos. Las DILI que provocan un aumento de la bilirrubina tienen una tasa de mortalidad del 10%. 3. ¿Qué es la cirrosis? La cirrosis, la secuela más grave de la hepatitis crónica, se caracteriza por la muerte difusa de las células hepáticas, provocando la formación de tejido fibroso y la regeneración nodular del tejido hepático. La distorsión consecuente de la circulación hepática extiende aún más la lesión celular y resulta en una reducción progresiva de las células hepáticas que, eventualmente, se manifiesta como deterioro de la función hepática. El fallo hepático de síntesis, indicado por la prolongación del tiempo de protrombina (TP)/ratio internacional normalizada (INR), disminución de la concentración sérica de albúmina, y deterioro de los mecanismos de detoxificación que resultan en una encefalopatía, a menudo se denomina hepatopatía terminal. 4. Describa los trastornos neurológicos en pacientes con cirrosis. La disfunción del sistema nervioso central se presenta como encefalopatía hepática, oscilando entre confusión y coma, y puede ser secundaria a un aumento del consumo de proteína de la dieta o a hemorragia gastrointestinal. El aumento de los niveles de amoniaco no se correlaciona con el grado de encefalopatía. El tratamiento consiste en una dieta baja en proteínas, lactulosa y rifaximina. El fallo hepático agudo fulminante puede presentarse con edema cerebral y aumento de la presión intracraneal. 300 © 2011. Elsevier España, S.L. Reservados todos los derechos CAPÍTULO 43 Disfunción hepática perioperatoria 301 5. ¿Qué cambios pulmonares se producen en un paciente con cirrosis? La hipoxemia arterial con hiperventilación compensatoria puede ser secundaria a una atelectasia por ascitis/hidrotórax o a síndrome hepatopulmonar (SHP). El SHP está causado por un cortocircuito arteriovenoso (AV) intrapulmonar. La hipertensión portal y la neovascularización son responsables de estos cortocircuitos AV. Las características clínicas del SHP son platipnea (disnea en posición erguida) y ortodesoxia (disminución de la saturación en posición erguida). Son indicativas de desigualdades de la ventilación/perfusión. La hipertensión pulmonar portal (HTPP), definida como una presión media de la arteria pulmonar mayor de 25 mmHg, se observa en el 2-4% de los pacientes con cirrosis. Su etiología no está clara. Una HTPP grave es una contraindicación para un trasplante de hígado. 6. Describa los cambios en el sistema cardiovascular en pacientes con cirrosis. A medida que progresa la enfermedad hepática, la mayoría de los pacientes desarrollan un estado circulatorio hiperdinámico, caracterizado por una disminución de las resistencias periféricas totales y un aumento compensador del gasto cardíaco. El volumen circulante de plasma aumenta en respuesta a la vasodilatación, y aumenta el flujo de sangre periférica. Aunque el volumen de sangre total aumenta, los pacientes con cirrosis tienen un volumen de sangre arterial eficaz disminuido. El gradiente de oxígeno AV se estrecha como consecuencia del aumento de los cortocircuitos periféricos. Por consiguiente, la saturación mixta de oxígeno venoso es mayor de lo normal. La respuesta a los fármacos vasopresores está disminuida en casos de cirrosis. © Elsevier. Fotocopiar sin autorización es un delito 7. ¿Qué es el síndrome hepatorrenal? ¿Cómo se diferencia de la insuficiencia re­ nal aguda en los pacientes con hepatopatía terminal? Ambos tipos de insuficiencia renal se producen en pacientes con cirrosis y se caracterizan por oliguria y aumentos en la creatinina sérica. La etiología en ambos casos es una hipoperfusión renal. La diferenciación es importante porque el tratamiento y el pronóstico varían. El síndrome hepatorrenal (SHR) se produce en los pacientes cirróticos con hipertensión portal y ascitis. El SHR se define como una creatinina plasmática >1,5 mg/dl y una concentración urinaria de sodio <10 mmol/l en ausencia de otras enfermedades renales. Se cree que la etiología es una hipoperfusión renal consecuencia de una disminución de las prostaglandinas vasodilatadoras y un amplio secuestro esplácnico de sangre. El SHR se produce de dos formas tipo I y II. El SHR de tipo I progresa rápidamente y requiere diálisis y trasplante inmediato. El SHR de tipo II es menos grave y responde a los tratamientos conservadores, como administración de terlipresina e intervenciones de derivación portosistémica intraportal transhepática. La insuficiencia renal aguda (IRA) está causada por una disminución del flujo de sangre a los riñones. Puede ser consecuencia de hemorragias (p. ej., rotura de varices), secuestro esplácnico de sangre, formación de ascitis o deshidratación. La restauración del volumen de sangre arterial corrige típicamente la IRA, pero puede progresar a una necrosis tubular aguda. En los casos de necrosis tubular aguda se ha perdido la capacidad para retener sodio. El análisis de orina mostrará un nivel de sodio de 50 a 70 mmol/l y la presencia frecuente de cilindros tubulares. 8. Describa la evaluación de la volemia y el manejo de líquidos en los pacientes con síndrome hepatorrenal. La optimización del flujo sanguíneo renal por corrección de la hipovolemia puede prevenir que la lesión renal progrese durante la cirugía en estos pacientes. La evaluación de la volemia puede ser difícil, ya que las presiones venosas centrales son a menudo elevadas a pesar de la hipovolemia relativa debida a un incremento en la presión retrógrada en la vena cava inferior por aumento del tamaño hepático o su proceso de cicatrización. Debería realizarse una prueba con carga de volumen como tratamiento inicial de la oliguria. A pesar de que se produce una mejoría inmediata en más de una tercera parte de los pacientes tratados, el SHR provoca una insuficiencia renal progresiva a no ser que mejore la función hepática. 9. ¿Qué trastornos gastrointestinales y hematológicos se producen durante la ci­ rrosis? Las complicaciones gastrointestinales se producen como consecuencia de la hipertensión portal (>10 mmHg). La hipertensión portal lleva a la aparición de colaterales venosas portosistémicas, incluidas las varices esofagogástricas. Un tercio de la mortalidad en los pacientes con cirrosis corresponde a la rotura de varices hemorrágicas. ISBN: 978-84-8086-757-3; PII: B978-84-8086-757-3.00043-6; Autor: DUKE; Documento ID: 00043; Capítulo ID: c0215 302 CAPÍTULO 43 Disfunción hepática perioperatoria Entre los trastornos hematológicos destacan: anemia, trombocitopenia y coagulopatía. La anemia es secundaria a hemorragia gastrointestinal, mala nutrición y depresión de la médula ósea. La trombocitopenia está causada por secuestro esplácnico, depresión de la médula ósea y destrucción inmunomediada. La coagulopatía está causada por la disminución de la síntesis de factores de la coagulación, fibrinólisis acelerada y coagulación intravascular diseminada. 10. ¿Qué pruebas de función hepática se utilizan para detectar la lesión celular he­ pática? Las enzimas citosólicas alanina aminotransferasa (ALT) y aspartato aminotransferasa (AST) se liberan en la sangre como resultado del incremento en la permeabilidad de la membrana o de la necrosis celular. Tienden a aumentar y a disminuir en paralelo, aunque la AST es eliminada más rápidamente de la circulación por el sistema reticuloendotelial. Sus niveles no están afectados por cambios en la función renal o biliar. A diferencia de la ALT, que está confinada principalmente en los hepatocitos, la AST se encuentra en el corazón y el músculo esquelético, páncreas, riñón y hematíes. Por tanto, la AST pierde especificidad como única prueba diagnóstica. La ALT es más específica pero menos sensible para la detección de la enfermedad hepática. 11. Describa las pruebas de laboratorio utilizadas para evaluar la función de sínte­ sis hepática y sus limitaciones. Todos los factores de la coagulación se sintetizan en el hígado. El factor VIII es sintetizado por las células sinusoidales del endotelio hepático. El TP/INR determina indirectamente la cantidad de factores de la coagulación disponibles y, por tanto, se emplea para evaluar la función de síntesis hepática. La elevación del TP/INR no es específica de enfermedad hepática y se altera, por ejemplo, en las hemofilias y la coagulación intravascular diseminada. La deficiencia de vitamina K, debido a malabsorción en casos de hepatopatía o enfermedad gastrointestinal, y el tratamiento anticoagulante también pueden prolongar el TP/INR. Una vez se han descartado otras enfermedades, el TP/INR resulta un indicador pronóstico sensible de lesión hepatocelular aguda. La albúmina se sintetiza sólo en el hígado y también refleja la capacidad de síntesis hepática. Sin embargo, las pérdidas renales y gastrointestinales pueden afectar a los niveles plasmáticos, al igual que los cambios en la permeabilidad vascular en pacientes críticos. Una reducción en la síntesis causada por una hepatopatía puede necesitar hasta 20 días para su detección debido a la elevada vida media plasmática de la albúmina. Por tanto, los niveles bajos de albúmina en suero son indicadores más útiles de hepatopatía crónica. 12. ¿Qué pruebas de laboratorio se emplean para diagnosticar hepatopatía colestá­ sica? La fosfatasa alcalina (FA), la γ-glutamiltransferasa (GGT) y la 5′-nucleotidasa se utilizan habitualmente para evaluar la función del tracto biliar. Estas enzimas se localizan en las membranas celulares del epitelio biliar. La FA se halla en una gran variedad de tejidos y aumenta en una serie de procesos, como enfermedad ósea y embarazo. El origen hepático de una FA elevada suele sospecharse por el contexto clínico y por el aumento simultáneo de la GGT y la 5′-nucleotidasa. 13. ¿Cómo pueden utilizarse los resultados de laboratorio para clasificar el riesgo perioperatorio en pacientes con cirrosis? En las hepatopatías agudas, las concentraciones plasmáticas de transaminasas suelen aumentar de 10 a 100 veces su valor normal. Las concentraciones plasmáticas se asocian con gran destrucción de hepatocitos y una elevada tasa de mortalidad del paciente. Pueden encontrarse también concentraciones plasmáticas relativamente normales en pacientes en las fases iniciales y finales de la hepatopatía aguda, reflejando necrosis celular masiva, y están asociadas con una mortalidad muy elevada. El TP/INR suele estar muy prolongado, lo que refleja una disminución de la capacidad de síntesis. Los niveles de albúmina suelen ser normales. La mortalidad de la cirugía intraabdominal en pacientes con hepatopatía aguda grave se aproxima al 100%. Las pruebas de función hepática se han utilizado también para predecir la evolución tras la cirugía en pacientes con deterioro hepático crónico. El sistema de puntuación de Child (Tabla 43-1) se utilizó inicialmente para clasificar el riesgo en pacientes sometidos a procesos de derivación portosistémica. Utilizando este método se identificaron tasas de mortalidad a 30 días del 10%, del 14 al 31%, y del 51 al 80% en las clases Child A, B y C, respectivamente, cuando fueron sometidos a CAPÍTULO 43 Disfunción hepática perioperatoria 303 TA B L A 4 3 - 1 . C la s i f i cac i ó n m od i f i cada d e C h i ld - T u r cott e - P u g h Puntos Presentación 1 2 3 Albúmina (g/dl) INR Bilirrubina (mg/dl) Ascitis Encefalopatía >3,5 <1,7 <2 Ausente Ninguna 2,8-3,5 1,7-2,3 2-3 Moderada Grado I-II <2,8 >2,3 >3 Tensa Grado III-IV Clase A = 5-6 puntos; Clase B = 7-9 puntos; Clase C = 10-15 puntos. INR, International Normalized Ratio. TA B L A 4 3 - 2 . Mod e lo d e e cuac i ó n e n la h e patopatía t e r m i n al Puntuación MELD = 3,8 × log (e) (bilirrubina, mg/dl) + 11,2 × log (e) (INR) + 9,6 log (e) (creatinina, mg/dl) MELD <10 = mortalidad perioperatoria baja MELD 10-14 = mortalidad perioperatoria moderada MELD >14 = mortalidad perioperatoria grave INR, International Normalized Ratio; MELD, Model for End-Stage Liver Disease. © Elsevier. Fotocopiar sin autorización es un delito cirugía no cardíaca. De forma más reciente se ha creado el sistema de puntuación Model for EndStage Liver Disease (MELD) como método más objetivo para evaluar la mortalidad en pacientes cirróticos (Tabla 43-2). Cuando se comparó con el sistema de puntuación Child, el MELD fue un sistema predictivo de riesgo perioperatorio superior en pacientes con cirrosis. Puntuaciones MELD <10, de 10 a 14 y >14 se correlacionan bien con la clasificación Child A, B y C. 14. ¿Qué factores de riesgo de hepatopatía pueden identificarse mediante la anam­ nesis médica y la exploración física? En la Tabla 43-3 se enumeran los factores de riesgo de hepatopatía obtenidos fácilmente de una breve historia médica. La exploración física puede evidenciar estigmas de hepatopatía crónica, como ascitis, hepatoesplenomegalia, arañas vasculares, cabeza de medusa y ginecomastia. En los pacientes con estos signos o antecedentes de ictericia o hepatopatía deben realizarse pruebas de función hepática antes de la cirugía. 15. ¿Qué es la ictericia? La ictericia es una coloración visible amarilla o verdosa, que se observa generalmente en la esclerótica en primer lugar, causada por el aumento de la bilirrubina sérica. Niveles de 2 a 2,5 mg/dl (normal de 0,5 a 1 mg/dl) provocan ictericia. La oxidación de la bilirrubina a biliverdina da el tono verdoso observado a menudo. 16. Diferencie entre hiperbilirrubinemia no conjugada y conjugada. Es esencial realizar la diferenciación para hacer un diagnóstico diferencial de la ictericia. Los aumentos de la fracción sérica de bilirrubina no conjugada suelen estar relacionados con cambios en el recambio de los hematíes y sus precursores. La hiperbilirrubinemia conjugada siempre significa disfunción hepática o biliar. 304 CAPÍTULO 43 Disfunción hepática perioperatoria TA B L A 4 3 - 3 . Facto r e s d e r i e s g o d e h e patopatía Factor de riesgo Ejemplo Hepatitis vírica Abuso de drogas intravenosas, transfusión, tatuajes, contacto con personas infectadas Alcohol, fármacos de prescripción (p. ej., paracetamol, haloperidol, tetraciclina, isoniazida, hidralazina, captopril y amiodarona) Lupus eritematoso sistémico, sarcoidosis, enfermedad del tejido conjuntivo mixto Hemocromatosis, enfermedad de Wilson, fibrosis quística, deficiencia de 1-antitripsina y enfermedad de almacenamiento del glucógeno Enfermedad de Crohn y colitis ulcerosa/colangitis esclerosante primaria Drogas Enfermedad autoinmune Enfermedad metabólica Enfermedad inflamatoria intestinal 17. Enumere las causas frecuentes de hiperbilirrubinemia no conjugada y conjugada. La hiperbilirrubinemia no conjugada se define como un aumento de la bilirrubina sérica total en el que la fracción conjugada no sobrepasa el 15%. Las causas se enumeran en la Tabla 43-4. TA B L A 4 3 - 4 . C au s a s d e b i l i r r ub i n e m i a n o co n j u g ada Causa Ejemplo Hemólisis Transfusión de sangre incompatible, circuito extracorpóreo arterial/venoso, defectos congénitos o adquiridos (p. ej., anemia hemolítica autoinmune o inducida por fármacos, deficiencia de glucosa-6-fosfatasa) Hematoma retroperitoneal o pélvico Deficiencia congénita (síndrome de Gilbert) o ausencia completa de uridina difosfato glucuroniltransferasa hepática (síndrome de Crigler-Najjar) Reabsorción de hematoma Deficiencias enzimáticas Las elevaciones de bilirrubina conjugada están causadas por una disfunción de los hepatocitos y/o estasis intrahepática o extrahepática. La Tabla 43-5 presenta un diagnóstico diferencial de estasis biliar. 18. ¿Cuáles son las principales causas de lesión de los hepatocitos? Véase la Tabla 43-6. 19. ¿Cómo pueden producir disfunción hepática los gases anestésicos inhalato­ rios? A pesar de ser infrecuentes, todos los fármacos inhalatorios pueden provocar inflamación o muerte de los hepatocitos por toxicidad directa. Las reacciones adversas están causadas por los productos metabólicos de los fármacos inhalatorios halogenados. Generalmente el grado de metabolismo de los fármacos es: halotano > sevoflurano > enflurano > isoflurano > desflurano. El halotano, el fármaco con un grado más alto de metabolismo, se asocia con una disfunción hepática leve hasta en un 30% de los individuos expuestos y se manifiesta como una elevación transitoria de la AST y ALT hepáticas. CAPÍTULO 43 Disfunción hepática perioperatoria 305 TA B L A 4 3 - 5 . C au s a s d e ob s t r ucc i ó n / e s ta s i s b i l i a r Obstrucción extrahepática Obstrucción intrahepática Tumor (conducto biliar, páncreas y duodeno) Colecistitis Cirrosis biliar primaria Fármacos (estrógenos, esteroides anabolizantes, tetraciclina y ácido valproico) Nutrición parenteral total Embarazo Estenosis biliar Colangitis ascendente Colangitis esclerosante TA B L A 4 3 - 6 . C au s e s d e l e s i ó n d e l h e patoc i to Causa Ejemplo Infección Hepatitis A, B y C; citomegalovirus; virus de Epstein-Barr Paracetamol, isoniazida, fenitoína, hidralazina, α-metildopa, sulfasalazina Neumonía Pruebas de función hepática anormales en el 68-93% de los pacientes tratados con NPT durante más de 2 semanas Oxígeno arterial bajo o interferencia con su utilización periférica como la intoxicación por cianuro y monóxido de carbono Presión venosa aumentada (p. ej., insuficiencia cardíaca congestiva, embolia pulmonar y ventilación con presión positiva) Presión arterial disminuida (p. ej., hipovolemia, vasopresores y pinzamiento aórtico cruzado) Fármacos Sepsis Nutrición parenteral total (NPT) Hipoxemia © Elsevier. Fotocopiar sin autorización es un delito Isquemia Con muy poca frecuencia se producen reacciones idiosincrásicas inmunomediadas en individuos expuestos a anestésicos halogenados. La formación de inmunocomplejos tiene relación con el grado de metabolismo. Puesto que el halotano presenta el mayor grado de metabolismo, la hepatitis como consecuencia de la exposición al halotano es la más frecuente. Sin embargo, dado que el uso de halotano es actualmente muy poco frecuente en Estados Unidos y en Europa, no es probable que se produzca este problema. 20. ¿Cómo alteran los fármacos inhalatorios el flujo sanguíneo hepático? Todos estos fármacos dilatan la arteria hepática y los vasos sanguíneos preportales. Esta dilatación disminuye la presión arterial hepática media y aumenta la estasis venosa en los vasos esplácnicos. El flujo portal disminuye. El resultado global es una perfusión hepática subóptima. Sin embargo, a niveles por debajo de una concentración alveolar minima (CAM) de 1, el isoflurano, el sevoflurano y el desflurano sólo disminuyen mínimamente el flujo sanguíneo hepático. Además, la autorregulación de la arteria hepática queda abolida, y el flujo sanguíneo se hace dependiente de la presión. Esto suele ser bien tolerado en pacientes con función hepática normal ya que la demanda metabólica también disminuye por estos fármacos. Los pacientes con hepatopatía son más susceptibles a las lesiones secundarias debido a una perfusión deficiente preexistente y, por tanto, deben ser anestesiados con niveles por debajo de 1 CAM. 306 CAPÍTULO 43 Disfunción hepática perioperatoria P u n t o s clav e: Disfunción h ep ática peri ope ratoria 1. Los pacientes con hepatopatía terminal tienen una circulación hiperdinámica con aumento del gasto cardíaco y disminución de las resistencias vasculares sistémicas. 2. A pesar de que la vena porta aporta más del 75% del flujo de sangre hepática total, solamente entre el 45 y el 55% de los requerimientos de oxígeno son aportados por esta parte de la circulación. 3. Debido a la gran reserva hepática, cuando se hacen evidentes los signos y síntomas clínicos de insuficiencia hepática ya se ha producido una alteración significativa de la función fisiológica. 4. Dadas las complicaciones perioperatorias potenciales de hemorragia gastrointestinal, sepsis, insuficiencia renal y sobrecarga de volumen, la cirugía programada no debe realizarse en pacientes cirróticos de clase Child C (MELD >14). 5. Los pacientes con hepatopatía pueden precisar un manejo perioperatorio delicado. Las coagulopatías deben corregirse antes de la cirugía, las dosis farmacológicas deben ser juiciosas durante la intervención y los pacientes cirróticos deben mantenerse monitorizados tras la cirugía. 21. ¿Cuáles son los objetivos del tratamiento preoperatorio en un paciente con he­ patopatía? Deben determinarse el tipo y la gravedad de la hepatopatía. Deben suspenderse las cirugías programadas en los pacientes con hepatitis aguda o cirrosis tipo Child C (MELD >14). Se debe realizar una revisión completa de los sistemas orgánicos, buscando de forma específica encefalopatía, ascitis, hipertensión portal e insuficiencia renal. Debe realizarse una evaluación analítica completa que incluya transaminasas, bilirrubina, albúmina, perfil metabólico básico, hemograma completo con plaquetas y perfil de coagulación. En casos de cirugía mayor, la coagulopatía debe corregirse a un INR <1,5, las plaquetas deben corregirse a >100 × 109, y el fibrinógeno a >100 mg/dl. El tromboelastograma puede ser útil para guiar el tratamiento cuando se corrige una coagulopatía preexistente. 22. ¿Cuáles son los objetivos del tratamiento intraoperatorio en un paciente con hepatopatía? La preservación del flujo sanguíneo hepático y de la función hepática existente es la clave. La hipoxemia, la hemorragia y la hipotensión pueden reducir el flujo sanguíneo hepático, de modo que deberían evitarse siempre que sea posible. La elección de los fármacos y su dosificación deben ser juiciosas. El quirófano debe calentarse y debe estar disponible un dispositivo de infusión rápida de líquidos calentados. La anestesia regional es una buena opción si no existe coagulopatía. 23. ¿Qué ajustes deben realizarse en los fármacos anestésicos en un paciente con hepatopatía? Los fármacos de inducción propofol, etomidato y ketamina tienen un cociente de extracción hepática elevado y su perfil farmacocinético permanece relativamente invariable en cirrosis de leve a moderada. En casos de hipoalbuminemia importante puede observarse una respuesta exagerada a la inducción con tiopental. A pesar de que el nivel de seudocolinesterasa está disminuido en la hepatopatía, la prolongación clínica de la succinilcolina no es significativa. Los relajantes musculares no despolarizantes de núcleo esteroideo y acción intermedia como el vecuronio y el rocuronio muestran un efecto prolongado en pacientes cirróticos. Su duración prolongada se ve acentuada con la administración repetida. Los relajantes de tipo bencil-isoquinolina como el atracurio y el cisatracurio tienen una eliminación independiente de los órganos, y su duración no se ve afectada por la hepatopatía. CAPÍTULO 43 Disfunción hepática perioperatoria 307 Las benzodiazepinas metabolizadas por reacciones oxidativas de fase I como el midazolam y el diazepam tienen una duración de acción prolongada. El lorazepam, que se elimina mediante glucuronidación de fase II, sufre un metabolismo normal. Todas las benzodiazepinas deben dosificarse de forma juiciosa en pacientes con hepatopatías. Todos los opioides, con la excepción del remifentanilo, son metabolizados por el hígado. La morfina y la meperidina tienen una vida media prolongada en casos de hepatopatía y pueden precipitar una encefalopatía hepática. El fentanilo, aunque es metabolizado por completo en el hígado, no tiene un efecto clínico prolongado en casos de cirrosis. Por tanto, el fentanilo y el remifentanilo son los opioides de elección en las hepatopatías. Bibliografía Recomendada 1. Befeler A, Palmer D: The safety of intra-abdominal surgery in patients with cirrhosis. Arch Surg 140:650–654, 2005. 2. Millwala F, Nguyen GC: Outcomes of patients with cirrhosis undergoing non-hepatic surgery: risk assessment and management. World J Gastroenterol 13:4056–4063, 2007. © Elsevier. Fotocopiar sin autorización es un delito 3. Mushlin P, Gelman: Hepatic physiology and pathophysiology. In Miller R, editor: Miller’s anesthesia, ed 6, Philadelphia, Elsevier Churchill Livingstone, 2005, pp 743–775. CAPÍTULO 44 Función renal y anestesia James Duke, MD, MBA 1. Describa la anatomía del ri­ ñón. Los riñones son órganos pares situados de forma retroperitoneal contra la pared abdominal posterior. A pesar de que el peso combinado de ambos riñones es sólo de 300 g (alrededor del 0,5% del peso corporal total), reciben el 20-25% del gasto cardíaco total. Las arterias renales son ramas de la aorta, originadas por debajo de la arteria mesentérica superior. Las venas renales drenan en la vena cava inferior. La inervación es abundante; las fibras constrictoras simpáticas se distribuyen por los plexos celíaco y renal. No hay efecto vasodilatador simpático o inervación parasimpática. Las fibras del dolor, principalmente de la pelvis renal y la uretra superior, entran en la médula espinal a través de los nervios esplácnicos. En un corte transversal del riñón se observan tres zonas: córtex, médula externa y médula interna (Figura 44-1). El 80% del flujo sanguíneo renal se distribuye hacia las estructuras corticales. Cada riñón contiene alrededor de 1 millón de nefronas. Las nefronas se clasifican como superficiales (alrededor del 85%) o yuxtamedulares, dependiendo de su localización y de la longitud de los túbulos. Todas las nefronas se originan en el córtex. El glomérulo y la cápsula se conocen en conjunto como el corpúsculo renal. Cada cápsula de Bowman se conecta a un túbulo proximal, que es contorneado dentro de su trayecto cortical, 308 Figura 44-1. El esquema describe una nefrona de asa corta y otra de asa larga y el sistema colector (no está dibujado a escala). Dentro del córtex está dibujado un trayecto medular con un trazo discontinuo. 1, corpúsculo renal incluyendo la cápsula de Bowman y el glomérulo (penacho glomerular). 2, tubo contorneado proximal. 3, túbulo proximal recto. 4, rama delgada descendente. 5, rama delgada ascendente. 6, túbulo distal recto. 7, mácula densa localizada dentro de la porción final del cuello de la rama gruesa ascendente. 8, tubo contorneado distal. 9, túbulo conector de la nefrona yuxtamedular que forma un arco. 10, túbulo cortical colector. 11, conducto conector de la médula extensa. 12, conducto colector de la médula interna. (De Friz W, Bankir I: A standard nomenclature for structures of the kidney. Am J Physiol 254:F1, 1998, con permiso.) © 2011. Elsevier España, S.L. reservados todos los derechos CAPÍTULO 44 Función renal y anestesia 309 pero se convierte en una rama recta en la extremidad en el córtex externo; en este punto, el túbulo se conoce como el asa de Henle. El asa de Henle de las nefronas superficiales desciende sólo hacia la unión intermedular, donde hace una vuelta de horquilla, se hace más gruesa, y retrocede ascendiendo hacia el córtex, donde se aproxima y toca el glomérulo con un grupo de células conocidas como el aparato yuxtaglomerular (AYG). Las nefronas superficiales forman el túbulo contorneado distal, que emerge para formar los túbulos colectores dentro del córtex. Los corpúsculos renales de las nefronas yuxtamedulares se localizan en el tejido cortical yuxtamedular. Tienen grandes asas de Henle que descienden profundamente en el tejido medular; las asas también vuelven a ascender hacia el tejido cortical, donde forman los túbulos contorneados distales y los túbulos colectores. Estas nefronas (el 15% del total) son responsables de la conservación del agua. Alrededor de 5.000 túbulos se unen para formar los conductos. Los conductos emergen hacia los cálices menores, que, a su vez, emergen para formar los cálices mayores. Los cálices mayores se unen y forman la pelvis renal, la zona más cefálica de la uretra. 2. Enumere las principales funciones del riñón. Regulación y composición del volumen líquido corporal. Equilibrio ácido-base. Metabolismo y excreción de las sustancias no esenciales, incluidos los fármacos. Elaboración de la renina, que está relacionada con mecanismos de regulación extrarrenal. Funciones endocrina y metabólica, como la secreción de eritropoyetina, conversión de vitamina D y homeostasis del calcio y fosfato. © Elsevier. Fotocopiar sin autorización es un delito 3. Describa la función glomerular y tubular. La filtración glomerular resulta en la producción de unos 180 l de líquido glomerular por día. La filtración no requiere el gasto de energía metabólica, más bien está causada por un equilibrio entre las fuerzas hidrostáticas y oncóticas. La tasa de filtración glomerular (TFG) es el índice más importante de función renal intrínseca. La TFG normal es de 125 ml/min en hombres, ligeramente menor en mujeres. La función tubular reduce el líquido filtrado de 180 l/día a alrededor de 1 l/día de líquido excretado, alterando su composición mediante transporte activo y pasivo. El transporte es pasivo cuando es el resultado de fuerzas físicas, como los gradientes eléctricos o de concentración. Cuando el transporte se realiza contra el gradiente electroquímico o de concentración, se necesita energía metabólica, y el proceso se denomina activo. Las sustancias pueden ser reabsorbidas o secretadas de los túbulos, y pueden moverse bidireccionalmente, aprovechando ambos transportes activo y pasivo. La dirección de tránsito para las sustancias reabsorbidas es desde los túbulos al intersticio y luego a la sangre, mientras que la dirección para las sustancias secretadas es desde la sangre hacia el intersticio y luego a los túbulos. La secreción es la principal vía de eliminación de fármacos y toxinas, especialmente cuando están fijados a proteínas plasmáticas. 4. Revise el mecanismo de acción y los efectos significativos de los diuréticos habitualmente utilizados. Véase la Tabla 44-1. 5. Describa los aspectos particulares del flujo sanguíneo renal y su control. El flujo sanguíneo renal (FSR), de alrededor de 1.200 ml/min, se mantiene correctamente (autorregulación) a presiones arteriales de 80-180 mmHg. El córtex requiere alrededor del 80% del flujo sanguíneo para realizar sus funciones reguladoras y secretoras, y la médula externa recibe el 15%. La médula interna recibe un pequeño porcentaje del FSR; un flujo mayor lavaría los solutos responsables de la alta tonicidad (1.200 mOsm/kg) de la médula interna. Sin esta hipertonicidad no sería posible la concentración urinaria. El control del FSR se realiza mediante influencias hormonales y neuronales extrínsecas e intrínsecas; el objetivo principal de la regulación del flujo sanguíneo es mantener el FSR. El estado euvolémico, sin estrés, tiene un tono simpático basal bajo. Con estrés ligero o moderado, el FSR disminuye ligeramente, pero constriñe las arteriolas eferentes, manteniendo FSR. Durante 310 CAPÍTULO 44 Función renal y anestesia TA B L A 4 4 - 1 . D i u r é t i co s * Fármaco (ejemplo) Lugar de acción Acción y efectos colaterales Inhibidores de la anhidrasa carbónica (acetazolamida) Túbulo contorneado proximal Tiazidas (hidroclorotiazida) Segmento cortical dilutor (entre la rama ascendente y el TCD que responde a la aldosterona) Diuréticos ahorradores de potasio (espironolactona, triamtereno) Diuréticos del asa (furosemida, bumetadina, ácido etacrínico) Inhibición competitiva de la aldosterona en el TCD Diuréticos osmóticos (manitol, urea) Filtrado en el glomérulo pero no reabsorbido; crea gradientes osmóticos en los túbulos; excreción de agua y algo de sodio Inhibe la reabsorción de sodio; interfiere con la excreción de H; hipercloremia acidosis hipopotasémica Inhibe la reabsorción de sodio; acelera el intercambio sodio-potasio (hipopotasemia); disminuye la TFG en estados de contracción de volumen Inhibiendo la aldosterona, previene la reabsorción de sodio y el intercambio sodio-potasio Potente diurético; actúa en procesos clave de la concentración de orina; vasodilatador renal; hipopotasemia; puede producir hipovolemia La hiperosmolalidad reduce el agua celular; capacidad limitada para excretar sodio; vasodilatador renal Inhibe la reabsorción de Cl– en la extremidad gruesa del asa de Henle TCD, túbulo contorneado distal; TFG, tasa de filtración glomerular. *Con excepción de los diuréticos osmóticos, todos los diuréticos interfieren con la conservación de sodio. períodos de estrés intenso (p. ej., hemorragia, hipoxia, procedimientos quirúrgicos mayores), ambos, FSR y la TFG, disminuyen secundariamente a la estimulación simpática. El eje renina-angiotensina-aldosterona también tiene efecto sobre el FSR. Una enzima proteolítica formada en la mácula densa del AYG, la renina, actúa sobre el angiotensinógeno dentro de la circulación para producir angiotensina I. Las enzimas del pulmón y del plasma convierten la angiotensina I en angiotensina II, que es un potente vasoconstrictor renal (especialmente, de la arteriola eferente) y un factor para la liberación de aldosterona. Durante períodos de estrés, los niveles de angiotensina son elevados, y contribuyen (conjuntamente con la estimulación simpática y las catecolaminas) a disminuir el FSR. Las prostaglandinas (PG) también se encuentran en el riñón. La PGE2 y la PGE3 son mediadores intrínsecos del flujo sanguíneo y producen vasodilatación. 6. Describa la secuencia de acontecimientos asociados con la disminución del flujo sanguíneo renal. La respuesta inicial a la disminución del FSR es preservar la ultrafiltración a través de la redistribución del flujo sanguíneo hacia los riñones, vasodilatación selectiva de las arteriolas aferentes y vasoconstricción eferente arteriolar. La hipoperfusión renal resulta en absorción activa de sodio y absorción pasiva de agua en el asa ascendente de Henle. La demanda de oxígeno se incrementa CAPÍTULO 44 Función renal y anestesia 311 en un área particularmente vulnerable a la disminución del aporte de oxígeno. Los mecanismos compensadores simpatoadrenales redistribuyen el flujo sanguíneo desde el córtex externo hacia el córtex interno y la médula. Si la hipoperfusión renal persiste o empeora independientemente de los primeros mecanismos compensadores a medida que el sodio se reabsorbe en el asa ascendente, el sodio adicional se libera en la mácula densa, produciendo vasoconstricción aferente arteriolar y disminución de la filtración glomerular. Debido a que disminuye la TFG, se libera menos soluto en el asa ascendente. Debido a que se libera menos soluto, se reabsorbe menos (un proceso que requiere energía); así, se necesita menos oxígeno, y el efecto neto es que la vasoconstricción arteriolar aferente disminuye los procesos que consumen oxígeno. El resultado, sin embargo, es la oliguria. No obstante, el riñón trata de mantener el volumen intravascular y, hasta ese punto, el proceso descrito se ha denominado éxito renal. En realidad, la oliguria es una mala medida de la función renal ya que lo más habitual es que la insuficiencia renal aguda (IRA) sea no oligúrica. 7. ¿Qué factores de riesgo preoperatorios se asocian con insuficiencia renal post­ operatoria? Los factores preoperatorios de riesgo renal (incremento del nitrógeno ureico sanguíneo [BUN] y de creatinina y una historia de disfunción renal), disfunción ventricular izquierda, edad avanzada, ictericia y diabetes mellitus son predictores de disfunción renal postoperatoria. Los pacientes sometidos a cirugía cardíaca o aórtica tienen un riesgo particular de desarrollar insuficiencia renal postoperatoria. © Elsevier. Fotocopiar sin autorización es un delito 8. Comente las principales causas de insuficiencia renal aguda perioperatoria. La IRA se define como una disminución significativa de la TFG durante un período de 2 semanas o menos. La insuficiencia renal, o azoemia, puede clasificarse según las etiologías prerrenal, renal y posrenal. La azoemia prerrenal se debe a la disminución del FSR, y constituye alrededor del 60% de todos los casos de IRA. En el contexto perioperatorio, la isquemia puede deberse a perfusión inadecuada desde la sangre y a pérdidas de volumen. Otros mecanismos son la hipoperfusión secundaria a disfunción miocárdica o cortocircuito de la sangre fuera de los riñones, como en la sepsis. Las causas renales suponen el 30% de todos los casos de IRA. La necrosis tubular aguda (NTA) es la causa principal, y puede deberse a isquemia o a toxinas. Las nefrotoxinas son los medios de radiocontraste, antibióticos aminoglucósidos y fluoruros derivados del metabolismo de anestésicos halogenados. La hemólisis y la lesión muscular (produciendo hemoglobinuria y mioglobinuria) también son causas de IRA intrínseca. Las causas posrenales (el 10% del total de causas) se deben a nefropatía obstructiva, y pueden observarse en hombres con prostatismo y obstrucción uretral por enfermedades pélvicas. El término «lesión renal aguda» está sustituyendo al término «fallo renal agudo». 9. ¿Qué alteraciones analíticas se observan en la insuficiencia renal? Los pacientes presentan uremia (aumento del BUN y la creatinina), hiperpotasemia, hiperfosfatemia, hipocalcemia, hipoalbuminemia y acidosis metabólica. También están anémicos y presentan disfunción plaquetaria y leucocitaria, lo que les hace más susceptibles a la hemorragia y la infección. 10. Comente las distintas pruebas de laboratorio y su utilidad en la detección de la insuficiencia renal aguda. Los índices de la función renal pueden dividirse a grandes rasgos en medidas de la función glomerular o tubular. Las medidas de la eliminación evalúan la función glomerular, mientras que la capacidad para concentrar orina y retener sodio son índices de la función tubular. La mayoría de las pruebas de función renal no son sensibles ni específicas para predecir disfunciones renales perioperatorias y se ven afectadas por muchas variables comunes en el contexto perioperatorio. El amoniaco generado por el metabolismo de los aminoácidos en el hígado se convierte en BUN. La urea se elimina rápidamente mediante filtración glomerular pero también es reabsorbida en los túbulos. Así pues, el BUN no puede utilizarse como marcador de la filtración glomerular, solamente la azoemia. La creatinina es el producto final del metabolismo del fosfato de creatinina y se genera a partir del músculo y es gestionada por el riñón de una forma relativamente uniforme. 312 CAPÍTULO 44 Función renal y anestesia La carne de la dieta también es una fuente de creatinina. La creatinina sérica (CrS) es una función de la masa muscular, y factores como la actividad, la dieta y la hemodilución alteran su concentración en suero. La CrS puede estar aumentada de forma artificial por los barbitúricos o las cefalosporinas. Otras variables adicionales no renales pueden ser responsables también de la elevación del BUN y la creatinina, como el aumento de la absorción de nitrógeno, traumatismos musculares por quemaduras o lesiones, hipercatabolismo, hepatopatía, cetoacidosis diabética, reabsorción de hematomas, hemorragia gastrointestinal, hiperalimentación y muchos fármacos (p. ej., corticosteroides). La relación habitual entre BUN y creatinina es 10:1, y un cociente mayor de 20:1 implica un síndrome prerrenal. La elevación de la CrS es un signo tardío de insuficiencia renal. La relación entre CrS y TFG es inversa y exponencial. Es decir, un aumento doble de la CrS es reflejo de una reducción a la mitad de la TFG. Esto es de gran importancia clínica con niveles bajos de CrS; un aumento de CrS de 4 a 8 mg/dl no representa una gran disminución absoluta de la TFG porque la TFG ya está notablemente disminuida a 4 mg/dl. Cuando la función renal es estable, utilizando nomogramas, la creatinina es una medida razonable de la TFG. Sin embargo, la medición de la CrS es inexacta cuando la TFG varía rápidamente. La TFG puede reducirse un 50% o más antes de observar un aumento anormal de la CrS. Dado que la creatinina es producida por la masa muscular, en las situaciones en las que se ha producido un desgaste sustancial (p. ej., enfermedad crónica, edad avanzada) los niveles de creatinina pueden ser normales a pesar de una TFG notablemente reducida. La TFG disminuye con la edad. Un individuo sano de 20 años tiene una TFG de unos 125 ml/ min; un paciente sano de 60 años tiene una TFG de unos 60 ml/min. La CrS no empieza a aumentar hasta que la TFG cae a alrededor de los 50 ml/min. La TFG puede estimarse utilizando estudios poblacionales basados en la edad, CrS, sexo y peso de los pacientes. El método de Cockroft y Gault utiliza la siguiente fórmula para estimar la TFG: TFG = (140 – edad) × peso (kg)/ (CrS × 72). Ésta es la fórmula para los hombres, y el resultado se multiplica por 0,85 para determinar la TFG en mujeres. Es obvio que esto sobrestima la TFG en pacientes obesos cuando se usa el peso corporal total y no el peso ideal. Esta fórmula también puede sobrestimar la TFG en pacientes caquécticos en quienes la producción de creatinina es baja. El aclaramiento de creatinina (ClCr) es una prueba sensible de función renal. La creatinina se filtra en el glomérulo y no se reabsorbe. También existe cierta secreción de creatinina en los túbulos, y esto provoca una sobrestimación de un 15% del ClCr. (En la actualidad, el aclaramiento de inulina, un azúcar polifructosa, es el patrón oro de la medición de la TFG porque se filtra en el glomérulo y no se reabsorbe ni se secreta en los túbulos.) Durante mucho tiempo se ha creído que la determinación del ClCr requería la obtención de orina en 12-24 horas. De hecho, si la CrS varía rápidamente, el cálculo del ClCr basado en una orina de 24 horas y una única determinación de creatinina puede ser inexacto. Además, este método requiere que la obtención de orina sea meticulosa, y no lograrlo constituye una fuente común de error de laboratorio. Se cree que las pruebas de recogida al azar durante 2 horas son razonablemente exactas, y las pruebas de recogida seriada durante 2 horas serían particularmente útiles en casos en que la función renal presenta un deterioro agudo. La Tabla 44-2 describe varias pruebas de función renal. TA B L A 4 4 - 2 . Va r i a s p r u e ba s d e fu n c i ó n r e n al Prueba Valores normales Valores anormales Comentarios Gravedad específica 1,010-1,030 Azoemia prerrenal >1,030; pérdida de capacidad concentradora <1,010 Inespecífico; afectado por glucosa, manitol, diuréticos, contrastes radiológicos, enfermedad endocrina >50 definitivamente asociado con alteración renal Inespecífico, influenciado por una gran variedad de procesos BUN sérico (mg/dl) 10-20 (Continúa) CAPÍTULO 44 Función renal y anestesia 313 © Elsevier. Fotocopiar sin autorización es un delito TA B L A 4 4 - 2 . Va r i a s p r u e ba s d e fu n c i ó n r e n al ( c o n t . ) Prueba Valores normales Valores anormales Comentarios Creatinina sérica (mg/dl) 0,8-1,3 (hombres) 0,6-1,0 (mujeres) Se duplica el valor de la creatinina asociado con un 50% de reducción de la TFG Indicador tardío de insuficiencia renal; los valores normales reflejan disminución de la función a medida que la edad del paciente aumenta y la masa muscular disminuye Ni sensible ni específica, sólo tiene valor en situaciones extremas Cociente de Entre 20 y 40:1 creatinina en orina-plasma (U:PCR): proporción de agua filtrada por los glomérulos que es reabsorbida Sodio urinario (UNa) U ≈ 20 Na (mEq/l) NTA <20:1; azoemia prerrenal >40:1 Fracción de sodio excretado (FENa): aclaramiento de sodio como porcentaje del aclaramiento de creatinina Aclaramiento de creatinina (ml/min) 1-3% Azoemia prerrenal: FENa <1%; NTA-FENa >3% 100-125 Disminución 60-100 de la reserva renal; alteración renal benigna 40-60; insuficiencia renal <25 ml/min IRA >60-80; azoemia prerrenal <20 Cambia con los líquidos de reanimación; afectado por aldosterona, ADH, diuréticos Puede no ser preciso en la fase inicial de la enfermedad (cuando se necesitaría más); también inespecífico, afectado por diuréticos Una buena prueba para medir la TFG; requiere recolección de orina durante 24 horas, pero una recolección de 2 horas puede ser suficientemente precisa ADH, hormona antidiurética; BUN, nitrógeno ureico en sangre; IRA, insuficiencia renal aguda; NTA, necrosis tubular aguda; TFG, tasa de filtración glomerular. 11. ¿Qué son las medidas de la función tubular? En oposición a las medidas de función glomerular descritas previamente (creatinina, TFG, ClCr), las pruebas de función tubular describen la capacidad del riñón para concentrar la orina y manejar el sodio. Las pruebas de concentración diferencian entre la azoemia prerrenal (deshidratación, disminución de la perfusión renal) y la NTA y demuestran alteraciones 24-48 horas antes 314 CAPÍTULO 44 Función renal y anestesia de que aumenten el BUN y la creatinina. Las mediciones de la función tubular no proporcionan estimaciones de la reserva renal. Durante la hipovolemia, los túbulos renales retienen sodio y agua, provocando una orina concentrada, relativamente hiponatrémica. La capacidad de concentración se pierde en los casos de NTA, resultando en un aumento del volumen de orina diluida rica en sodio. Como se ha mencionado, en la NTA la pérdida de la capacidad de concentración puede detectarse 24-48 horas antes de que empiece a aumentar el BUN o la creatinina. Otras pruebas de función tubular son el cociente de osmolaridad orina:plasma, el aclaramiento de agua libre, el cociente creatinina urinaria:plasmática, el sodio urinario (UNa) y la excreción fraccionada de sodio (FENa). En casos de hipovolemia o deshidratación, el UNa es menor de 20 mEq/l. En la NTA, el UNa supera los 60 mEq/l. Sin embargo, los diuréticos pueden aumentar el UNa a este nivel a pesar de la hipovolemia. 12. ¿En qué momento se pierde la reserva renal y los pacientes desarrollan eviden­ cias analíticas de insuficiencia renal? Los pacientes permanecerán asintomáticos con solamente un 40% de nefronas funcionales. La insuficiencia renal describe el estado en el que solamente permanecen entre un 10 y un 40% de las nefronas y, dado que no existe reserva renal, estos pacientes tienen riesgo de desarrollar una IRA con cualquier lesión renal como hipovolemia y la administración de nefrotoxinas. Los pacientes requieren diálisis cuando solamente quedan menos del 10% de las nefronas. En términos de ClCr, los pacientes con insuficiencia renal tienen un ClCr menor de 40 ml/min, con fallo renal tienen un ClCr menor de 25 ml/min, y requieren diálisis cuando el ClCr es menor de 10 ml/min. 13. Comente la utilidad de la diuresis en la evaluación de la función renal. El volumen de orina se determina fácilmente mediante la inserción de una sonda de Foley permanente conectada a un urómetro. Es necesario un volumen diario de 400 a 500 ml de orina para excretar los desechos nitrogenados. En adultos, una diuresis insuficiente (oliguria) se suele definir como <0,5 ml/kg/h. La TFG disminuye por los efectos de la anestesia, la actividad simpática, las influencias hormonales y la redistribución de sangre lejos de las nefronas corticales. Invariablemente, la diuresis disminuye a medida que disminuye la presión arterial; así pues, la oliguria perioperatoria no es infrecuente, suele ser de origen prerrenal y no refleja una IRA. Una diuresis normal no descarta una insuficiencia renal. 14. ¿Cuál es la mejor forma de proteger a los riñones durante la cirugía? No existen recetas mágicas para prevenir la IRA perioperatoria. La mejor forma de mantener la función renal durante la cirugía es asegurar un volumen intravascular adecuado, mantener el gasto cardíaco y evitar los fármacos que disminuyen la perfusión renal. 15. ¿Desempeña algún papel la dopamina en la preservación renal? Actualmente existe una considerable evidencia de que la dopamina no es renoprotectora (es decir, no mejora la perfusión renal) ni mejora la perfusión esplácnica (véase el Capítulo 15). 16. Describa los efectos de los anestésicos halogenados en la función renal. La anestesia general deprime temporalmente la función renal medida por la producción de orina, la TFG o el FSR, y la excreción de electrolitos. El deterioro renal suele ser de corta duración y completamente reversible. El mantenimiento de la presión arterial sistémica y la hidratación preoperatoria disminuyen el efecto sobre la función renal. La anestesia intradural y epidural también parecen deprimir la función renal, pero no en la misma magnitud que la anestesia general. Se ha señalado la nefrotoxicidad inducida por flúor con anestésicos halogenados utilizados en el pasado (p. ej., metoxiflurano). El sevoflurano, un anestésico halogenado de uso actual, tiene el flúor como producto metabólico (alrededor del 3,5% de la carga total de flúor aparece en la orina como flúor inorgánico; la concentración pico de alrededor de 25 mmol aparece al cabo de 2 horas de interrumpir el agente). La amplia experiencia con sevoflurano (especialmente en Japón) confirma su seguridad. Su baja solubilidad si se compara con metoxiflurano puede explicar las diferencias; simplemente, hay menos sevoflurano en los depósitos lipídicos para ser posteriormente metabolizados a flúor, y la «carga» completa de flúor es menor. CAPÍTULO 44 Función renal y anestesia 315 Un producto adicional de la descomposición del sevoflurano se conoce como compuesto A, y se detecta mayoritariamente durante las técnicas anestésicas de bajo flujo. A pesar de que la insuficiencia renal se detecta en modelos animales, estos problemas no se han observado en seres humanos. 17. ¿Cuál es el mejor relajante en pacientes con insuficiencia renal? Se prefiere el atracurio porque tiene una degradación espontánea bajo condiciones fisiológicas (degradación de Hofmann e hidrólisis éster). Debido a que el atracurio es hidrosoluble, los pacientes con la composición acuosa corporal alterada pueden requerir grandes dosis iniciales para producir una relajación rápida, pero dosis más pequeñas y menos frecuentes para mantenerla. La succinilcolina puede utilizarse en pacientes con insuficiencia renal si la concentración sérica de potasio es inferior a 5 mEq/l (Tabla 44-3). TA B L A 4 4 - 3 . R e la j a n t e s m u s cula r e s y e x c r e c i ó n r e n al © Elsevier. Fotocopiar sin autorización es un delito Galamina Tubocurarina Metocurina Pancuronio Pipecuronio 90% 45% 43% 40% 38% Doxacurio Vecuronio Atracurio Rocuronio Mivacurio 30% 15% 10% 10% 10% 18. ¿Cómo deben tratarse perioperatoriamente los pacientes con insuficiencia re­ nal? La preparación preoperatoria es beneficiosa para los pacientes con enfermedad renal terminal (ERT), que tienen hasta un 20% de mortalidad en las intervenciones quirúrgicas de urgencia. Las principales causas de muerte son: sepsis, arritmias y disfunción cardíaca. La inestabilidad hemodinámica es frecuente. Desde el punto de vista de la disfunción renal, puede existir una disminución de la capacidad para concentrar orina, disminución de la capacidad para regular el líquido y el sodio extracelulares, dificultad para el manejo de las cargas ácidas, hiperpotasemia y alteración en la excreción de fármacos. La alteración renal se acompaña de anemia, disfunción plaquetaria urémica, arritmias, derrame pericárdico, disfunción miocárdica, hipertensión crónica, neuropatías, malnutrición y susceptibilidad a las infecciones. Deben evitarse los fármacos nefrotóxicos (p. ej., anfotericina, AINE, aminoglucósidos). Si hay que utilizar contraste radiológico, debe considerarse la utilidad real y, por tanto, la necesidad de la prueba. Si el estudio con contraste está definitivamente indicado, el paciente debe hidratarse bien, y la dosis de contraste debe limitarse al mínimo necesario. Los fármacos utilizados habitualmente de forma perioperatoria pueden tener efectos aumentados en pacientes con insuficiencia renal crónica. Dado que estos pacientes son hipoalbuminémicos, los fármacos que se unen a proteínas como los barbitúricos y las benzodiazepinas pueden presentar niveles séricos incrementados. Tanto la morfina como la meperidina tienen metabolitos que se excretan por los riñones. La succinilcolina aumenta el potasio extracelular pero puede utilizarse si el potasio sérico es normal. La hiperpotasemia debe tenerse en cuenta en pacientes con ERT que desarrollan arritmias ventriculares o parada cardíaca. La rápida administración de cloruro de calcio controla los efectos cardíacos de la hiperpotasemia hasta que puedan adoptarse otras medidas (administración de insulina y glucosa, hiperventilación, administración de bicarbonato de sodio y resinas quelantes de potasio, y diálisis) para desplazar el potasio hacia el espacio intracelular y disminuir el potasio corporal total. Antes de la cirugía, los pacientes deben estar euvolémicos, normotensos, normonatrémicos, normopotasémicos, no acidóticos ni gravemente anémicos, y sin disfunciones plaquetarias significativas. Idealmente deben someterse a diálisis el día de la cirugía o el día anterior. La diálisis suele corregir la disfunción plaquetaria urémica y es mejor realizarla durante las 24 horas previas a la intervención, aunque también puede administrarse 1-desamino-8-d-arginina vasopresina (DDAVP) si persiste la hemorragia. Otras indicaciones de diálisis aguda son: síntomas urémicos, taponamiento pericárdico, hemorragia, hipervolemia, insuficiencia cardíaca congestiva, hiperpotasemia y acidosis grave. 316 CAPÍTULO 44 Función renal y anestesia Los pacientes con ERT y disfunción ventricular izquierda o que son sometidos a intervenciones mayores con cambios significativos de la volemia requieren una monitorización invasiva para guiar la fluidoterapia. Debe seguirse estrictamente una técnica aséptica cuando se inserta cualquier tipo de catéter. En las intervenciones menores, los líquidos deben limitarse a la reposición de las pérdidas urinarias u otras pérdidas insensibles. El suero fisiológico es el líquido de elección ya que no tiene potasio. Sin embargo, si es necesario administrar un gran volumen de líquidos, la administración de suero fisiológico puede provocar una acidosis metabólica hiperclorémica. Los casos de esta magnitud requieren claramente una monitorización invasiva y análisis de laboratorio repetidos. P U N T OS CLAVE: Función renal y anestes i a 1. Los factores de riesgo renal preoperatorio (aumento de la creatinina y antecedentes de disfunción renal), disfunción ventricular izquierda, edad avanzada, ictericia y diabetes mellitus son predictores de disfunción renal postoperatoria. 2. Los pacientes sometidos a cirugía cardíaca o aórtica tienen un riesgo particular de desarrollar insuficiencia renal postoperatoria. 3. La mayoría de las pruebas de función renal no son sensibles ni específicas para predecir la disfunción renal perioperatoria y están afectadas por muchas variables comunes al contexto perioperatorio. 4. La succinilcolina puede utilizarse si la concentración sérica de potasio es <5 mEq/l. 5. La mejor forma de mantener la función renal durante la cirugía es asegurar un volumen intravascular adecuado, mantener el gasto cardíaco y evitar los fármacos que disminuyen la perfusión renal. 19. ¿Qué se logra durante la hemodiálisis? La sangre se retira del paciente y fluye hacia una membrana semipermeable, de una superficie entre 1 y 1,8 m2. A través de la membrana existe un dializado con concentraciones normales de electrolitos. Los electrolitos y los productos de desecho siguen sus gradientes de concentración. Además, las sustancias alcalinas del dializado van hacia el paciente. La presión negativa en el dializado provoca un exceso de retirada de líquido. La duración de la hemodiálisis (HD) depende de la velocidad del flujo y suele ser de unas 4 a 6 horas. Las velocidades de flujo altas se asocian con cambios rápidos en los electrolitos y la volemia y son mal toleradas por el paciente. Normalmente estos pacientes se someten a diálisis tres veces por semana. La mortalidad anual asociada con la diálisis intermitente es del 5%. Los pacientes críticos con IRA, hipotensión y sepsis frecuentemente toleran mal la HD. En este caso se utiliza una HD veno-venosa continua (CVVHD) o una hemofiltración veno-venosa continua (CVVHF). Durante la CVVHF solamente se retira líquido, mientras que la CVVHD también retira los productos de desecho, metabolitos ácidos y potasio. Bibliografía Recomendada 1. Devabeye YA, Van den Berghe GH: Is there still a place for dopamine in the modern intensive care unit? Anesth Analg 98:461–468, 2003. 2. Moitra V, Diaz G, Sladen RN: Monitoring hepatic and renal function. Anesthesiol Clin 24:857–880, 2006. 3. Playford HR, Sladen RN: What is the best means of preventing perioperative renal dysfunction. In Fleisher LA, editor: Evidence-based practice of anesthesiology, Philadelphia: Saunders, 2004, pp 181–190. 4. Wagener G, Brentjens TE: Renal disease: the anesthesiologist’s perspective. Anesthesiol Clin 24:523–547, 2006. Matthew Hall, MD CAPÍTULO 45 Aumento de la presión intracraneaL Y TRAUMATISMO CRANEAL 1. Defina el aumento de la presión intracraneal. El aumento de la presión intracraneal (PIC) se define normalmente como una presión mantenida mayor de 20 mmHg dentro del espacio subaracnoideo. La PIC normal es, aproximadamente, de 10 a 18 mmHg. 2. ¿Cuáles son los factores determinantes de la presión intracraneal? El contenido que ocupa el espacio del cráneo, el cerebro (85%), el líquido cefalorraquídeo (LCR) (10%) y el volumen de sangre cerebral (15%) está todo contenido en el volumen virtualmente fijo del cráneo. Un aumento de volumen de cualquiera de los contenidos causará un aumento de la PIC. 3. ¿Cómo se mide la presión intracraneal? Hay varias técnicas disponibles, incluidos catéteres ventriculares, tornillo subdural-subaracnoideo, transductores epidurales y dispositivos de fibra óptica intraparenquimatosos. El método estándar es una ventriculostomía, en la que se introduce un catéter plástico en el ventrículo lateral mediante una trepanación en el cráneo. El catéter se conecta a una alargadera llena de suero fisiológico y se transduce la presión. Además, el catéter puede utilizarse para drenar el LCR a través de una válvula pop-off fijada en 20 cm de H2O. Otro método habitual es el tornillo subaracnoideo, que se coloca también mediante una trepanación pero no requiere inserción a través del tejido cerebral ni identificación de la posición del ventrículo. Una tercera técnica requiere la inserción de un haz de fibra óptica a través de una pequeña trepanación. El haz de fibra óptica detecta cambios en la cantidad de luz reflejada a distancia de un diafragma en su extremidad sensible a la presión. Sin embargo, el haz de fibra óptica está sometido a variaciones en las mediciones a lo largo del tiempo y no puede recalibrarse in situ. Además, los métodos intraparenquimatoso y subdural están limitados por la imposibilidad de extraer LCR y tratar la PIC. Los monitores de PIC de fibra óptica de última generación realizan simultáneamente la medida de la PIC, flujo local de sangre cerebral con Doppler, pH, PO2 y PCO2, y evitan todos los posibles problemas infecciosos de un sistema transductor relleno de líquido. 4. Resuma las situaciones que suelen provocar elevación de la presión intracra­ neal. Véase la Tabla 45-1. 5. Describa los síntomas de presión intracraneal aumentada. Los síntomas aislados asociados con el incremento de la PIC son: dolor de cabeza, vómitos, papiledema, somnolencia, pérdida de conciencia y cambios de comportamiento. Otros síntomas graves, como posturas patológicas (descerebrado), parálisis nerviosa oculomotora, alteraciones en los reflejos del tronco cerebral y anormalidades en los patrones respiratorios (incluida la apnea) están probablemente causados por distorsión en el tronco cerebral o isquemia secundaria a herniación inminente. El reflejo de Cushing, consistente en hipertensión y bradicardia, se debe probablemente a isquemia medular, y se observa cuando la PIC se aproxima a la presión sistémica arterial. © 2011. Elsevier España, S.L. Reservados todos los derechos 317 318 CAPÍTULO 45 Aumento de la presión intracraneaL Y TRAUMATISMO CRANEAL TA B L A 4 5 - 1 . C A US A S COMUNES DE PRESIÓN INTR A CR A NE A L ELE VA D A Aumento del volumen de LCR Aumento del volumen de sangre Aumento del volumen de tejido cerebral Hidrocefalia comunicante Hemorragia intracerebral (aneurisma o MAV) Hematoma epidural o subdural Neoplasia Hidrocefalia obstructiva Hipertensión maligna Edema cerebral (ACV, por encefalopatía, metabólico, traumático) Quistes ACV, accidente vascular cerebral; LCR, líquido cefalorraquídeo; MAV, malformación arteriovenosa. 6. Comente las posibles consecuencias del aumento de la presión intracraneal. Además de producir los síntomas anteriores, el aumento de la PIC puede acarrear una disminución en la presión de la perfusión cerebral, que puede provocar una isquemia cerebral regional o global. Posteriores elevaciones de la PIC pueden provocar herniación del contenido cerebral (a través de la hoz del cerebro, la tienda o el foramen magnum). 7. ¿Cuáles son los factores que determinan la presión de perfusión cerebral? La presión de perfusión cerebral se define como la diferencia entre la presión arterial media (PAM) y la PIC o presión venosa central, que suele ser más alta. 8. ¿Qué es la elastancia intracraneal? ¿Por qué es clínicamente importante? La elastancia intracraneal, habitualmente es conocida como complianza o distensibilidad intracraneal, y hace referencia a la variación de la PIC de acuerdo con el volumen intracraneal. Debido a que los componentes intracraneales pueden cambiar sus volúmenes hasta cierto punto (p. ej., el movimiento del LCR desde el compartimento intracraneal al compartimento nuclear), la PIC permanece en cierto modo constante en un rango limitado de volúmenes. Sin embargo, cuando los mecaFigura 45-1. Elastancia intracraneal. PIC, presión nismos compensadores se agointracraneal. tan, la PIC aumenta rápidamente con los posteriores incrementos de volumen (Figura 45-1). 9. ¿Cómo se regula el flujo sanguíneo cerebral? El flujo sanguíneo cerebral (FSC) está acoplado a la tasa metabólica cerebral por un mecanismo no bien identificado, pero que involucra al potasio, hidrógeno, iones de calcio, adenosina, óxido nítrico y/o prostaglandinas. En general, los aumentos de la tasa metabólica cerebral para el oxígeno (CMRO2) conducen a un aumento del FSC, a pesar de que el incremento en el flujo está CAPÍTULO 45 Aumento de la presión intracraneaL Y TRAUMATISMO CRANEAL 319 retardado en 1-2 minutos. Hay otros parámetros que influyen en el flujo. Específicamente, el incremento en la presión parcial de CO2 en la sangre arterial (PaCO2) es un potente vasodilatador cerebral. De modo similar, una disminución en la presión parcial de oxígeno (PaO2) en la sangre arterial por debajo de 50 mmHg incrementa mucho el FSC. Las variaciones en PAM también pueden resultar en grandes incrementos o disminuciones del FSC, pero en un amplio rango (50-100 mmHg) el FSC es casi constante. Esta constancia de FSC por encima de un rango de presiones se conoce como autorregulación. La hipertensión arterial crónica desplaza la curva de autorregulación hacia la derecha. Después de una lesión cerebral, como un golpe, un tumor acompañado de edema o un traumatismo, puede interrumpirse la autorregulación y el FSC se vuelve dependiente de la presión (Figura 45-2). © Elsevier. Fotocopiar sin autorización es un delito Figura 45-2. Regulación del flujo sanguíneo cerebral (FSC). PA, presión arterial sanguínea; PAM, presión arterial media. 10. ¿Cuál es el objetivo de los cuidados anestésicos en pacientes con la presión intracraneal elevada? Debido a que los pacientes con PIC elevada pueden estar alcanzando la ascensión de la curva de elastancia, en la que un pequeño cambio en el volumen conlleva un gran aumento en la PIC, el objetivo de los cuidados anestésicos es utilizar todos los medios posibles para reducir el volumen intracraneal. 11. ¿Pueden ayudar a este objetivo las intervenciones preoperatorias? Tradicionalmente se han utilizado varias técnicas para reducir el volumen intracraneal antes de la cirugía. La restricción suave de líquidos (la ingesta de un tercio a la mitad de los requerimientos diarios de mantenimiento) puede disminuir la PIC durante un período de varios días. Los corticosteroides son particularmente efectivos en la disminución del edema asociado con tumores. 320 CAPÍTULO 45 Aumento de la presión intracraneaL Y TRAUMATISMO CRANEAL 12. ¿Cómo se alcanza el objetivo de reducir el volumen intracraneal con la induc­ ción de anestesia? Hay medidas que se utilizan para la inducción de anestesia que se aplican para reducir el volumen de sangre cerebral. Los agentes de inducción intravenosa preferidos son el tiopental y el propofol, porque ambos reducen el FSC y la CMRO2. Deben evitarse la ketamina y el etomidato, porque la ketamina incrementa el FSC y la PIC, y la formulación de etomidato propilenglicol puede inducir déficits neurológicos en tejidos con riesgo. Los opioides tienen un efecto variable en el FSC, pero se utilizan normalmente para mitigar la respuesta simpática a la intubación laringoscópica y traqueal. Sin embargo, hay que ser precavido con los opioides en el paciente con ventilación espontánea, porque la hipoventilación puede llevar a un incremento de la PaCO2 y, por tanto, del FSC. Coadyuvantes frecuentemente utilizados en la inducción son la lidocaína intravenosa, un vasoconstrictor cerebral que mitiga la respuesta a la intubación, y los bloqueantes b de acción rápida, como el esmolol, que mitiga la hipertensión sistémica debida a laringoscopia. 13. ¿Cómo se modera la presión intracraneal durante el mantenimiento de la anes­ tesia? La mayoría de las maniobras intraoperatorias para controlar la PIC dependen de la reducción del volumen de sangre cerebral o del contenido total de agua del cerebro. El volumen de sangre se reduce al mínimo por hiperventilación para disminuir la PaCO2 (de 25 a 30 mmHg), que resulta en una vasoconstricción cerebral transitoria, y por la utilización de fármacos anestésicos que disminuyen el FSC. Deben limitarse los fármacos halogenados a menos de 1 CAM. El óxido nitroso debe evitarse porque aumenta tanto el FSC como la CMRO2 y puede ser neurotóxico. Manteniendo al paciente en una posición con la cabeza ligeramente elevada se favorece el drenaje venoso. El agua cerebral puede disminuirse de forma intensa con diuréticos como el manitol (bolo de 0,25 a 1 g/kg) y/o la furosemida. Además, los líquidos intravenosos deben limitarse a la cantidad mínima necesaria para mantener la función cardíaca. El cirujano puede drenar el LCR directamente del campo quirúrgico o utilizar un catéter intraventricular para reducir el volumen intracraneal total. Si la oxigenación no es un problema, debe evitarse la presión positiva teleespiratoria (PEEP) porque puede transmitirse al compartimento intracraneal. Si la PEEP es necesaria para la ventilación, la cabecera de la cama debe elevarse para evitar un aumento de la PIC causado por la disminución del retorno venoso. 14. ¿Es la hiperventilación una estrategia razonable para el tratamiento de la pre­ sión intracraneal a largo plazo? La hiperventilación (lograr una PaCO2 de 0 a 25 mmHg) disminuye la PIC como consecuencia de la vasoconstricción cerebral, disminuyendo el volumen de sangre cerebral. Este efecto está mediado por un aumento del pH cerebral. Esta respuesta se produce y es efectiva durante el curso de varias horas. Sin embargo, el pH cerebral disminuye por un descenso gradual en la concentración de bicarbonato en el LCR de nueva formación. Así, la hiperventilación resulta inefectiva para disminuir la PIC después de 24-48 horas. Debería evitarse una hiperventilación por debajo de una PaCO2 de 25 mmHg ante una posible isquemia cerebral focal causada por una profunda disminución del FSC. 15. ¿Qué líquidos intravenosos se utilizan durante la cirugía para reducir al mínimo la presión intracraneal? En general deben evitarse las infusiones cristaloides hipotónicas porque pueden incrementar el contenido cerebral de agua. El suero fisiológico normal puede ser superior al Ringer lactato debido a la mayor cantidad de sodio y menor contenido en agua libre. Algunos centros reaniman con volúmenes pequeños (4 ml/kg) de suero fisiológico hipertónico para reducir al mínimo la cantidad de agua libre en casos de PIC elevada. Deben evitarse las soluciones que contienen glucosa debido a la evidencia de que empeoran la evolución neurológica si se produce ­isquemia en presencia de hiperglicemia. Por tanto, la hiperglicemia (glucosa sérica >180 mg/dl) debe tratarse con insulina. Las soluciones coloidales no son superiores a las soluciones ­cristaloides. CAPÍTULO 45 Aumento de la presión intracraneaL Y TRAUMATISMO CRANEAL 321 P U N TOS CLAVE: M edid as para di sm inu ir la presión intracraneal 1. Elevación de la cabecera de la cama. 2. Analgesia y ansiólisis. 3. Osmoterapia (manitol 1 g/kg/24 horas o dosis en bolo de manitol de 0,25 a 1 g/kg o suero fisiológico hipertónico al 3% 15 ml/kg). 4. Furosemida. 5. Drenaje intraventricular. 6. Corticosteroides (dexametasona para edema relacionado con tumor). 7. Evitar la hipervolemia. 8. Hiperventilación (PaCO2 25-30 mmHg). 9. Coma barbitúrico (10 mg/kg administrados en 30 minutos y posteriormente 1 a 2 mg/kg/h). 16. ¿Cuáles son los efectos de los anestésicos halogenados en el flujo sanguíneo cerebral? Todos los anestésicos halogenados utilizados habitualmente han demostrado incrementar el FSC y disminuir la CMRO2. La respuesta del FSC a los cambios en la PaCO2 se conserva. © Elsevier. Fotocopiar sin autorización es un delito 17. ¿Cómo pueden afectar los relajantes neuromusculares a la presión intracra­ neal? Se ha demostrado que la succinilcolina incrementa la PIC, pero el significado clínico de este incremento transitorio continúa siendo dudoso. Por tanto, en casos de cirugía emergente en pacientes con el estómago lleno, es aceptable una inducción de secuencia rápida con succinilcolina. Los agentes despolarizantes utilizados habitualmente no tienen efecto en la PIC y pueden utilizarse de forma segura. 18. Comente las estrategias para controlar la presión intracraneal al despertar de la anestesia. Los bloqueantes b como el esmolol y el labetalol pueden administrarse en dosis controladas para atenuar el aumento del tono simpático presente durante el despertar. Son particularmente útiles dada su capacidad para causar vasodilatación periférica sin provocar vasodilatación cerebral, lo que aumentaría el FSC. El nitroprusiato, un vasodilatador de acción directa, también es útil para controlar la presión arterial cuando se administra en infusión, pero puede empeorar la PIC por una vasodilatación cerebral. La cabecera de la cama debe elevarse y se debe evitar la hipercarbia. P U N T OS CLAVE: Factores que afectan al flu jo san guíneo cerebral 1. Presión de perfusión cerebral. 2. PaO2. 3. PaCO2. 4. Metabolismo (CMRO2). 322 CAPÍTULO 45 Aumento de la presión intracraneaL Y TRAUMATISMO CRANEAL 19. Si las medidas anteriores fallan en el control de la presión intracraneal, ¿qué otras medidas pueden aplicarse? Se ha utilizado el coma barbitúrico en pacientes refractarios a otros métodos de control de la PIC. La dosis clásica de pentobarbital es de 10 mg/kg, administrados en 30 minutos, como carga, seguidos de tres dosis horarias de 5 mg/kg. Esta dosis suele proporcionar un nivel sérico terapéutico de 30-50 mg/ml. Normalmente, se consigue el mantenimiento dosificando 1-2 mg/kg/h. P U N TOS CLAVE: Ag entes que hay que ev itar cuando existe aumento de la presió n i ntracraneal 1. Ketamina. 2. Óxido nitroso. 3. Líquido vascular hipotónico o que contenga glucosa. 4. Altas concentraciones de anestésicos halogenados. 20. ¿Cuáles son los mecanismos subyacentes a un traumatismo cerebral? El daño cerebral tras un traumatismo cerebral puede dividirse en dos categorías: 1. Daño por el mecanismo primario de la lesión. 2. Daño por lesiones secundarias (hipotensión, hipoxia). El mecanismo primario (p. ej., accidente de tráfico, disparo) puede provocar daño focal o global en el tejido cerebral. El daño focal está causado principalmente por traumatismos penetrantes, contusiones o hemorragia intracraneal. Por otro lado, el daño global suele ser consecuencia de lesiones axonales difusas en las que la rápida desaceleración y rotación provoca un cizallamiento entre la materia gris y blanca neocortical. Las lesiones primarias pueden no responder a las intervenciones terapéuticas. Por el contrario, las lesiones secundarias por hipoperfusión o hipoxia que suelen producirse en la unidad de cuidados intensivos o en el quirófano deben prevenirse, para que no haya un deterioro adicional del estado del paciente. 21. ¿Cuáles son los objetivos anestésicos en un paciente con traumatismo cere­ bral? Como se ha mencionado anteriormente, los objetivos anestésicos en el manejo de un paciente con traumatismos cerebrales deben dirigirse a prevenir las lesiones secundarias. El tejido cerebral ya lesionado es extremadamente susceptible a la hipoperfusión y la hipoxia. La intubación debe lograrse rápidamente, asegurando la estabilidad hemodinámica y manteniendo la oxigenación adecuada. La perfusión cerebral adecuada debe monitorizarse de forma estrecha y debe mantenerse una presión de perfusión cerebral entre 60 y 80 mmHg. Generalmente es deseable una PAM >90 y debería lograrse con reanimación y la administración de vasopresores. También debe controlarse el aumento en la PIC con las medidas mencionadas anteriormente. Cabe destacar que la autorregulación cerebral con frecuencia está abolida en casos de LCT, y la hipertensión también puede ser nociva de forma similar al empeorar el edema vasogénico, lo que provoca un aumento de la PIC y una posterior disminución de la presión de perfusión cerebral. En casos de LCT, la demanda de oxígeno puede estar incrementada como consecuencia de una liberación desproporcionada de neurotransmisores excitatorios, y la hipoxia puede empeorar la lesión isquémica. 22. En un paciente con traumatismo craneal, ¿cómo debe priorizarse el ti