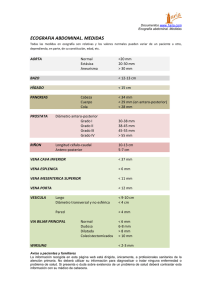
TOMA DE MUESTRA DE SANGRE EN PEQUEÑOS Y GRANDES ANIMALES 2019 DOCENTES DE ANALISIS CLINICO MV Babini Sandra MV Morilla Gricelda MVBenzoni Anabela MV Rossi Sofía Adsc. Casasnova Gastón Índice temático TOMA DE MUESTRA DE SANGRE EN ANIMALES DOMÉSTICOS. 1. INDICE 2. MEDIDAS DE PROTECCION PERSONAL 3. MATERIALES UTILIZADOS EN LA TOMA DE MUESTRA DE SANGRE Elementos de sujeción. Tijeras. Algodón y Antisépticos. Agujas, Jeringas. Recipientes de recolección. Anticoagulantes. 4. VENAS DE ELECCION PARA LA VENIPUNCION Anatomía topográfica de las venas de elección. Vena cefálica. Vena safena. Vena yugular. Vena femoral. Vena caudal media. Vena mamaria craneal. Vena cava craneal. 5. MANIOBRAS SEMIOLOGICAS PARA LA EXTRACCION DE SANGRE Caninos. Felinos. Equinos. Ovinos y Caprinos. Suinos. Bovinos. 6. CONSERVACION Y ALMACENAMIENTO DE LA MUESTRA Muestras para química sanguínea. 7. ENVIO DE LA MUESTRA Anexo I. Anticoagulantes. Anexo II. Protocolo de análisis. Referencias Bibliográficas. TOMA DE MUESTRA DE SANGRE EN PEQUEÑOS Y GRANDES ANIMALES. Este capítulo tiene como objetivo considerar los procedimientos y maniobras semiológicas para la toma de muestra de sangre en las distintas especies animales. El estudio morfológico y bioquímico de la sangre es un examen complementario válido como control tanto en animales sanos como enfermos y debería utilizarse de rutina ya que su aplicación en el diagnóstico, pronóstico y control del tratamiento constituye una herramienta elemental para el médico clínico. Para interpretar correctamente los resultados obtenidos de una muestra sanguínea, el médico veterinario debe disponer de datos precisos; lo que lleva implícito cumplir con las siguientes condiciones: Contactar con el laboratorio previo a la extracción. Preparar los materiales para la extracción. Preparar el paciente, seleccionar la vena y realizar maniobras de sujeción. Identificar la muestra. Realizar una adecuada conservación y almacenamiento de la misma. Enviar correctamente la muestra al laboratorio. Los métodos de examen de una muestra de sangre pueden ser de tres tipos: Hematológicos: la mayoría de estos exámenes se llevan a cabo con una muestra sin coagular, por lo que se debe usar el ANTICOAGULANTE apropiado. Bioquímicos: estos exámenes exigen distintos métodos de tratamiento para la sangre y dependiendo del carácter del test requerido, se utilizará suero o plasma, siendo muy importante conocer cuáles son los anticoagulantes permitidos para cada determinación. Serológicos: estos test requieren generalmente de suero por lo tanto serán muestras de sangre coagulada; para su obtención se espera hasta la formación del coágulo, se centrifuga la muestra y se separa el suero. NO SE UTILIZA ANTICOAGULANTE. Para prevenir las alteraciones de los componentes de la sangre que serán estudiados, los exámenes deberían comenzar después de la extracción, tan pronto como sea posible. Idealmente debe realizarse de inmediato o en su defecto, dentro de la hora de su recolección. Se debe evitar la hemólisis y el cambio de volumen debido a diluciones o evaporaciones. 1. MEDIDAS DE PROTECCIÓN PERSONAL. Toda maniobra se debe realizar de manera cuidadosa y en las mejores condiciones, con el fin de obtener una muestra adecuada. Es importante siempre tomar medidas de protección personal ya que los animales a los que se les realizan estos procedimientos pueden ser portadores de enfermedades zoonóticas. Usar guardapolvo, mameluco o chaquetilla: de preferencia, aquellos que cubran los brazos y gran parte del cuerpo hasta las rodillas, para proteger la piel y la ropa de la contaminación. Estos deben utilizarse durante todo el tiempo en que se realice la maniobra. Al terminar deben ser retirados y colocados en una bolsa plástica para aislar del resto de las pertenencias personales (cuaderno, lapicera, etc), no deben llevarse hacia áreas no contaminadas (biblioteca, comedor universitario, baño, etc). Los guantes: deben ser utilizados SIEMPRE que se realice una extracción de sangre, estos reducen el riesgo de contaminación por contacto, pero no previenen de accidentes punzantes con aguja. Deben ser ceñidos con el fin de facilitar la maniobra, evitar tocarse los ojos, la boca, objetos como lapicera, teléfono, cuaderno con el fin de evitar su contaminación. Al finalizar la maniobra deben ser retirados cuidadosamente, y desechados en un lugar adecuado para residuos patológicos (bolsas rojas). En algunos casos será necesario usar barbijo, anteojos y protector facial, su finalidad es la de proteger el rostro de posibles salpicaduras. 2. MATERIALES UTILIZADOS EN LA TOMA DE MUESTRA DE SANGRE. 2.1. Elementos de sujeción. En canino y felino, se debe utilizar bozal (Fig. 1); en bovino se puede utilizar bozal, mocheta o instalaciones adecuadas como brete y cepo. Dependiendo de la docilidad del animal, en el equino es necesario bozal, mordaza y/o trabones. En el cerdo se utiliza lazo ad-hoc. Figura 1. elemento de sujeción (uso de bozal en canino y equino). 2.2. Tijeras. Para efectuar tricotomía, las indicadas son curvas de punta roma. 2.3. Algodón y antisépticos. Los más frecuentes son: alcohol etílico de 96°, povidona yodada, alcohol yodado, etc. 2.4. Agujas. Constan de tres partes: cono, pabellón y bisel. Se clasifican según la longitud y diámetro del pabellón. Ej. agujas 45:8, el primer número se refiere al largo del pabellón expresado en milímetros y el segundo, al diámetro o calibre expresado en décimas de milímetro, el cual variará según la especie animal y la vena a punzar. Hay agujas descartables (cono de material plástico) y agujas hipodérmicas (cono de acero inoxidable), más utilizadas para trabajos con bovinos (Fig. 2). Figura 2. agujas descartables e hipodérmicas. De izquierda a derecha: aguja cono verde 40:8, aguja cono rosa 30:12, aguja cono verde 25:8. 2.5. Jeringas. Constan de tres partes: cono, camisa con escala graduada y émbolo. Existen de vidrio y de plástico, estas últimas descartables. Hay de distintos volúmenes, de cono céntrico y excéntrico; a presión y a rosca. Las más utilizadas en la actualidad son las jeringas descartables de plástico (Fig. 3). Figura 3. Jeringa descartable 10 ml. 2.6. Recipientes de recolección (tubos de khan o hemólisis). Deben estar químicamente limpios, secos y desengrasados. Para sangre coagulada o suero, sangre entera o plasma, el tamaño del recipiente depende de la cantidad de la muestra necesaria. Se pueden usar tubos de Khan o hemólisis (Fig. 4), tubos cónicos para centrifuga, con sus distintos tipos de tapones y fabricados con diferentes materiales como polipropileno, polietileno y vidrio. Figura 4. Tubos de Khan 10 ml. Otra forma de recolección de la muestra de sangre, es por utilización de tubos “Vacutainer” para extracción de sangre con sistema de vacío (Fig. 5), éstos pueden ser de vidrio y plástico, de distintos tamaños, ya sea sólo o con distintos tipos de anticoagulantes y/o conservantes o con el agregado de gránulos, que tienen la particularidad de permitir la obtención del suero por decantación sin necesidad de centrifugar. El diseño de su tapón de seguridad evita el contacto directo con la microgota de sangre tras la extracción, previene de salpicaduras y de dispersión de gotas durante su apertura, mejorando las condiciones de bioseguridad del personal de laboratorio. Figura 5. Esquema de tubo Vacutainer. 1. Tubo estéril al vacío desechable (contenedor); 2. Aguja estéril desechable; 3. Soporte de plástico o Holder; diferentes opciones de mercado de vacutainer, agujas, soportes, tubos y aguja alada o butterfly. 2.7. Anticoagulantes. Luego de la extracción, se coloca la sangre en contacto con el anticoagulante. Es necesario conocer las características de los mismos y de esta manera darle el uso adecuado, algunos de los anticoagulantes pueden provocar alteraciones cuali y cuantitativas en los exámenes e inducir a interpretaciones erróneas de los resultados (ver anexo I). Anticoagulantes más comúnmente utilizados. Sal di sódica y di potásica del ácido etilen diamino tetra acético (EDTA) Oxalato balanceado. Citrato trisódico. Heparina. EDTA (Sequestrene di potásico K2 EDTA, sequestrene disódico Na2 EDTA). EDTA (sal del ácido etilen diamino tetra acético). Es el anticoagulante de elección para el estudio de la morfología celular. Las sales sódicas o potásicas se usan en la proporción de 1-2 mg/ml de sangre, su exceso (más de 2 mg de EDTA por ml de sangre) provoca la deshidratación del eritrocito, afectando indirectamente la determinación del hematocrito o volumen celular aglomerado (VCA) y los índices hematimétricos como el volumen corpuscular medio (VCM) y la concentración de la hemoglobina corpuscular media (CHCM). No afecta la determinación de hemoglobina (g/dl). Ventajas: La preparación del frotis sanguíneo puede realizarse algunas horas (6–12 hs) después de la recolección de sangre, sin efectos adversos sobre los resultados siempre que la misma esté conservada a 4–8 ºC. Si debe enviarse a un laboratorio distante es preferible confeccionar un extendido directo de una gota recién extraída, secarlo al aire y remitirlo con la muestra. La muestra de sangre puede permanecer a temperatura ambiente si es analizada dentro de la primera hora de su extracción. De lo contrario deberá conservarse refrigerada entre 4-8 ºC, en estas condiciones es posible la realización de hematocrito, dosaje de hemoglobina y contaje de células por un período de 24 hs posteriores a la extracción. Nunca debe congelarse ya que este procedimiento hemoliza los eritrocitos. Si se dispone de EDTA en polvo (la droga debe estar seca y finamente molida), resulta práctico preparar los tubos o frascos con anticoagulante de la siguiente manera: sobre una espátula de madera se realizan dos canaladuras, una con una capacidad aproximada de 4 mg y la otra en el otro extremo con capacidad aproximada de 10 mg de EDTA; se introduce la espátula en el recipiente con droga y luego se quita el exceso con una segunda espátula y se deposita el contenido en un tubo o frasco. De esta forma se puede preparar en forma rápida, gran cantidad de tubos con 4 ó 10 mg de EDTA para 2 -3 ml y 5 ml de sangre respectivamente. Otra forma es preparar una solución al 1 % en agua destilada y colocar 0,5 ml de esta solución en cada tubo (o una gota de una solución al 10 %) que luego es sometida a deshidratación a temperatura ambiente o en estufa a no más de 50° C. De esta manera se obtienen los tubos secos con anticoagulante suficiente para 5 ml de sangre. Comercialmente se dispone de anticoagulante EDTA estabilizado para uso en hematología. El sequestrene dilitio Li2EDTA es usado como anticoagulante para estudios de sodio y potasio, sólo es útil para el contaje de glóbulos si la muestra se examina dentro de la hora de extracción. Desventajas: El contaje de plaquetas debe realizarse dentro de la primera hora de extracción ya que el EDTA no inhibe la agregación plaquetaria. EDTA más fluoruro de sodio, el fluoruro de sodio es un anticoagulante, utilizado para preservar la sangre destinada al análisis de glucosa e intermediarios de los carbohidratos. Es anticoagulante porque se combina con el calcio formando un complejo y preserva la sangre por ser el fluoruro un inhibidor de las enzimas glucolíticas. El inconveniente de su escasa solubilidad en sangre se contrarresta mezclando el fluoruro con una pequeña cantidad de oxalato de potasio. Las muestras tratadas de esta manera no sirven para estudios morfológicos de las células a causa de la deformación y hemólisis que sufren las mismas cuando se disuelve el material. Es el anticoagulante de elección para la determinación de glucosa cuando las muestras no puedan ser procesadas dentro de las dos horas de su recolección. Este anticoagulante se provee comercialmente. EDTA cálcico, este anticoagulante no se emplea como tal, sino con fines terapéuticos en las intoxicaciones con plomo. Oxalato. La mezcla de oxalato amónico y oxalato de potasio en partes 3:2, mantiene la sangre en forma líquida indefinidamente, pero la morfología celular empieza a alterarse después de 30 min. Desventajas: Oxalato de potasio: Deshidratación del eritrocito. Oxalato de amonio: Tumefacción del eritrocito. Ambos: Alteraciones de los leucocitos, consistentes en la fagocitosis de los cristales por los neutrófilos y cambios en la morfología nuclear, caracterizados por gemación en linfocitos, hendiduras o divisiones en monocitos e hipersegmentación en neutrófilos. Por ser tóxicos, no deben emplearse en transfusiones. Debido a la incorporación de iones potasio, radical amonio y al secuestro de calcio sanguíneo, no se deben emplear en determinaciones de niveles de potasio, calcio plasmático, fosfatasa alcalina, urea y otros. Para evitar los efectos de deshidratación y tumefacción del eritrocito se puede utilizar una combinación de 0,8 g. de oxalato de potasio y 1,2 g. de oxalato de amonio disueltos en 100 ml de agua destilada, en una proporción de 0,1 ml por cada 1 ml de sangre. Citrato. (Citrato trisódico Na3C6H5O7 ). Se emplea en medicina en forma de solución, no como sal seca. La concentración de la solución depende de la sal que se emplea: a) Solución al 3,13 % de Na3C6H5O7 2 H2O. b) Solución al 3,8 % de 2Na3C6H5O7 11 H2O. La solución se añade a la sangre en la proporción: 1) 1:4 (anticoagulante: sangre) para la determinación de la velocidad de eritrosedimentación por el método de Westergreen. 2) 1:9 (anticoagulante: sangre) para la determinación de algunas pruebas de coagulación. Citrato de sodio (citrato di sódico), se emplea en la preparación de ACD o solución “B” de citrato dextrosa ácido cítrico que se utiliza en las transfusiones de sangre. Consiste en: citrato di sódico deshidratado 1,37 g., ácido cítrico anhidro 0,44 g., glucosa 1,47 g. y agua destilada en cantidad suficiente para 100 ml. Se esteriliza a vapor fluente en autoclave, 30 min. Se emplea en la proporción de 1:4 (ACD:sangre). Heparina. Es un mucopolisacárido que contiene sulfato de glucosamina y ácido glucurónico. Es producido en el hígado y sus propiedades anticoagulantes son debidas a la inhibición de las enzimas que participan en la coagulación. La heparina para uso médico, es una preparación estéril que contiene la sal sódica de un ácido orgánico completo y tiene la propiedad de retardar la coagulación de la sangre. La actividad anticoagulante de la sal de heparina tiene un rango de 100-150 UI/mg., la concentración óptima es de 0,1 a 0,2 mg/ml de sangre. Para preparar los tubos: añadir 0,1 de una solución al 0,75 % y se dejan evaporar a temperatura ambiente. Esta cantidad de heparina es suficiente para 5 ml de sangre. Ventajas: No altera el volumen del eritrocito, aunque esté en exceso. La sal de litio puede emplearse cuando se requiere plasma para las determinaciones bioquímicas de calcio, sodio o urea. Desventajas: Altera la morfología de los leucocitos, pues interfiere con la coloración, resultando en una apariencia turbia de las células, por lo que no se recomienda para estudios morfológicos de la sangre. No debe emplearse para determinación de fibrinógeno o para estudios de coagulación (tiempo de coagulación). La coagulación de sangre solamente se retrasa, (no más de 10 horas) no se evita. La coagulación se producirá lentamente. Ver anexo I. Cuadro de Anticoagulantes. 3. CONSIDERACIONES GENERALES PARA UNA CORRECTA TOMA DE MUESTRA. 3.1. Es condicionante para que un estudio hematológico represente el real estado de salud del animal evitar que se estrese, esto provoca con gran rapidez modificaciones significativas en la composición celular de la sangre, aún en animales sanos. La mera presencia de personas extrañas, ruidos desconocidos o las maniobras de sujeción, provocan en el animal un estado de estrés que produce un incremento en el contaje total de eritrocitos y leucocitos, con modificaciones de la fórmula leucocitaria relativa. La simple punción venosa efectuada por un extraño puede provocar un aumento de la concentración de eritrocitos en sangre periférica, en el orden del 10 al 15%. 3.2. El uso de tranquilizantes en individuos indóciles, también puede producir modificaciones en los constituyentes sanguíneos y deberá tenerse en cuenta el fármaco utilizado, dosis y duración de su efecto en la interpretación de los resultados hematológicos. 3.3. Seleccionar el material adecuado (elementos de sujeción, agujas, jeringas, anticoagulantes, tubos o frascos de recolección, etc.). Estos variarán según la especie animal y el diámetro de la vena a punzar. 3.4. Sujetar correctamente el animal (se sugiere una maniobra en particular para cada vena en las distintas especies). 3.5. Respetar una metodología secuencial en la maniobra de venipunción y extracción de sangre, como se sugiere a continuación: 3.5.1. Localizar la vena. Se puede realizar por inspección y palpación mediante presión suave e intermitente con el dedo índice y mayor sobre la zona de proyección del vaso sanguíneo. La consistencia de la vena es elástica y el contenido fluctuante. 3.5.2. Efectuar la tricotomía. Esta maniobra se debe realizar porque favorece las condiciones de asepsia, además permite una mejor visualización de la vena. 3.5.3. Realizar la antisepsia. Se debe realizar con algodón embebido en antiséptico sobre la zona a punzar, del centro a la periferia, a favor y en contra de la dirección del pelo. 3.5.4. Fijar la vena. Existen dos métodos de fijación: uno consiste en estirar la piel sobre el vaso sanguíneo en el sitio de punción. Esta maniobra tiene como desventaja que al presionar la vena se pierde la visualización de la misma. El otro método se logra colocando el dedo pulgar sobre el vaso sanguíneo presionando inmediatamente por debajo del sitio de punción. 3.5.5. Ingurgitar la vena. Realizar presión sobre la vena por encima del punto de punción indicado para cada vena, con el fin de provocar la dilatación de la misma. Esta maniobra no debe realizarse durante un tiempo prolongado debido a que la alteración del flujo venoso producirá modificaciones en los constituyentes celulares de la sangre. 3.5.6. Realizar la venipunción. Se debe realizar con el bisel de la aguja hacia arriba, en ángulo de 35º-45° lo que facilita el ingreso de sangre, se debe direccionar la aguja siguiendo el recorrido del vaso sanguíneo. Utilizar jeringa y aguja acoplada. 3.5.7. Traccionar el émbolo. Proceder a la tracción del émbolo de la jeringa lentamente para extraer sangre hasta el volumen deseado, no realizar la extracción con demasiada prisa, ya que la vena puede colapsarse y la turbulencia generada provoca espuma y hemólisis, lo cual debe evitarse. 3.5.8. Dejar de ingurgitar. Antes de retirar la aguja, es fundamental dejar de ingurgitar, de esta manera se evita la formación de hematomas. 3.5.9. Retirar la aguja. 3.5.10. Realizar hemostasia. Con el algodón embebido en antiséptico, presionar suavemente sobre el punto de punción para favorecer la hemostasia. Esta maniobra debe continuarla el ayudante para que el operador pueda acondicionar la muestra. 3.5.11. Trasvasar la sangre. Desacoplar la aguja de la jeringa y verter la sangre en el recipiente ad hoc por suave deslizamiento contra las paredes del recipiente. Evitar la formación de espuma y hemólisis. 3.5.12. Homogeneizar la muestra. En caso de usar anticoagulante, se debe realizar con el tubo en posición horizontal suaves movimientos de rotación e inversión en un ángulo de 45º (aproximadamente 30-50 movimientos), para favorecer el contacto de la sangre con el anticoagulante. Los movimientos deben ser suaves para evitar formación de espuma y hemólisis. 3.5.13 Preservar y conservar la muestra obtenida en condiciones apropiadas para su procesamiento (Ver en punto 6). 4. VENAS DE ELECCIÓN PARA VENIPUNCIÓN. ESPECIE VENA DE EXTRACCIÓN En caninos, felinos y rumiantes menores Vena yugular. las venas de elección son: Vena femoral. Vena cefálica. Vena safena. En equinos se utiliza: Vena yugular. En bovinos, se extrae sangre de: Vena yugular. Vena coccígea media o caudal media. Vena mamaria craneal o vena abdominal subcutánea o vena de la leche En cerdos se prefiere: Vena cava craneal. Vena media de la oreja. Vena coccígea ventral. Lugares alternativos (v.yugular, seno orbital, vena safena y en algunos casos se puede recurrir al corte de la punta de la cola). En todas las especies si se requieren mínimos volúmenes de sangre se puede optar por realizar una pequeña incisión en: Mucosa labial. Borde de la oreja. Cara interna o externa del pabellón auricular. Almohadilla plantar (gato y perro) En estos casos la muestra se recoge en un microhematocrito heparinizado y el extendido sanguíneo se realiza directamente de la gota de sangre que fluye de la incisión. 4.1. Anatomía topográfica de las venas de elección. 4.1.1. Vena cefálica. Pertenece al sistema venoso cutáneo, situada superficialmente debajo de la piel, sin acompañamiento arterial. Asciende por la cara anterior del radio (antebrazo), pasa por fuera de la cara flexora del codo hasta la entrada del tórax, abocando en la vena yugular externa (Fig. 6). Figura 6. disección del antebrazo. Vista externa. A. Músculo extensor radial del carpo. B. Vena cefálica. C. Rama externa superficial del nervio radial. D. Radio. 4.1.2. Vena safena. A la altura del maléolo lateral de la tibia se observan dos ramas, craneal y caudal, que se unen y se dirigen por la cara lateral de la tibia hacia proximal y caudal siendo claramente visibles a este nivel por su superficialidad. Luego continúan por caudal, profundizándose en el extremo distal del surco muscular medio del muslo (entre los músculos bíceps femoral y semitendinoso), (Fig. 7). Figura 7. disección superficial externa de la tibia. A. Cóndilo externo del fémur. B. Vena safena externa. C. Rama caudal de la vena safena externa y músculo peronéo corto. 4.1.3. Vena yugular. Se origina a la altura de la segunda vértebra cervical por la confluencia de la vena liguofacial y la vena maxilar. Corre por el surco yugular (ubicado entre el músculo esternomandibular y el músculo braquiocefálico) en dirección al tórax. En el bovino está separada de la arteria carótida en todo su trayecto por el músculo esternomandibular y omohiodeo. (Fig. 8). En el equino, sólo en la mitad anterior de su recorrido por la gotera yugular, está separada de la arteria por el músculo omohioideo (Fig. 8). Figura 8. disección del cuello donde se observa la v. yugular. Vista izquierda en equino y bovino. 4.1.4. Vena femoral. Se encuentra en la región proximal, cara interna del muslo, a nivel del borde anterior del pubis, acompañando a la arteria femoral, detrás del músculo sartorio. Continúa hacia proximal con el nombre de iliaca externa (Fig. 9). Figura 9. disección de la superficie interna de la pelvis y el muslo. A. Arteria y vena femoral acompañadas por el nervio safeno. B. Nervio safeno. 4.1.5. Vena caudal media o coccígea media. Acompaña a la arteria del mismo nombre. Pasa por los arcos hemales de las vértebras coccígeas (Fig. 10). Figura 10. parte caudal del canal vertebral. Corte transversal de la cola. 1. Disco intervertebral, 2. Vena caudal media, 3. Arteria caudal media, 4. Apófisis hemal. 4.1.6. Vena mamaria craneal o vena de la leche o abdominal subcutánea. Es muy voluminosa en hembras en lactancia. Generalmente es flexuosa y emerge en el borde anterior de la mama a unos 5-8 cm. de la línea alba. Se dirige hacia craneal y lateral donde se profundiza debajo del musculocutáneo, terminando en la vena toráxica interna (Fig. 11). Figura 11. vista izquierda. A. Glándula mamaria. B. Vena mamaria. 4.1.7. Vena cava craneal. Se forma en la porción ventral a la entrada del tórax por la confluencia de las dos venas yugulares y las dos venas subclavias. Se dirige hacia caudal por la línea media abriéndose en el mediastino anterior y luego se desvía hacia la derecha al interior del atrio derecho a nivel de la cuarta costilla (Fig. 12). Figura 12. disección del tórax. Vista derecha. A. Tráquea. B. Vena yugular externa. C. Vena cava craneal. D.Esternón. 5. MANIOBRAS SEMIOLÓGICAS PARA LA EXTRACCIÓN DE SANGRE. 5.1. Caninos: Es necesario colocar el bozal al animal antes de iniciar las maniobras de sujeción. Vena cefálica. Ej. Vena cefálica derecha. Se debe colocar el animal en decúbito esternal; se necesita de un ayudante para su sujeción, el cual se ubica del lado izquierdo del animal, con el antebrazo izquierdo rodea el cuello del perro y lleva la cabeza hacia su cuerpo alejándola del operador que realiza la extracción de sangre. Con el brazo derecho pasa por sobre el dorso del animal utilizando su codo y antebrazo para la sujeción del tren posterior y con la mano derecha sujeta el miembro anterior derecho a nivel de la articulación del codo y hace presión sobre la cara dorsal del radio, de esta forma ingurgita la vena (Fig. 13). El operador se ubica a craneal del animal, con la mano izquierda inmoviliza la vena y con la derecha realiza la venipunción en la cara dorsal del antebrazo a nivel del tercio medio (Fig. 13). Se utilizan agujas 25:7, 25:8, 40:7, 40:8. Figura 13. Sujeción del perro para la extracción de sangre de vena cefálica derecha e ingurgitación a la altura del codo. Zona de proyección de la vena en la cara dorsal del antebrazo. Vena safena. Ej. Vena safena derecha. Se debe colocar el animal en decúbito lateral izquierdo, se necesita de un ayudante para la sujeción del mismo quien se coloca hacia el dorso del animal, apoya el antebrazo izquierdo sobre el cuello del perro inmovilizando la cabeza y con la mano sujeta los miembros anteriores a nivel de la articulación del carpo. Con el brazo derecho apoya el antebrazo sobre la región de la cadera sujetando el tren posterior y con la mano sujeta y realiza presión en la cara posterior de articulación de la rodilla, para ingurgitar la vena (Fig. 14). El operador se ubica a ventral del animal, con la mano izquierda palpa e inmoviliza la vena y con la derecha realiza la venipunción en el tercio medio de la cara lateral de la tibia (Fig. 14). Se utilizan agujas 25:7, 25:8, 40:7, 40:8. Figura 14. sujeción del perro para extracción de sangre de vena safena derecha. Ingurgitación de vena safena a la altura de la rodilla y venipunción. Vena yugular. Ej. vena yugular derecha. Existen dos métodos de sujeción. Uno consiste en colocar el animal en decúbito esternal; el ayudante se ubica del lado izquierdo del perro, con la mano izquierda toma el hocico y lo apoya firmemente sobre su cuerpo dirigiendo la cabeza hacia su hombro izquierdo de tal forma que la desplaza en un ángulo de 45°. Cruza su brazo derecho sobre el tronco del animal para hacer presión con la mano sobre la gotera yugular a nivel de la entrada del tórax, de esta forma ingurgita la vena (Fig. 15). El operador se coloca frente al animal, hacia la derecha y realiza la venipunción en el tercio medio de la gotera yugular. En ese caso no se fija la vena, al estirar el cuello esta se tensa y no se desplaza al punzarla. Figura 15. sujeción del perro en decúbito esternal e ingurgitación de la vena yugular derecha para extracción de sangre. En el otro método de sujeción para la vena yugular se debe colocar el animal en decúbito lateral izquierdo. El ayudante se ubica hacia el dorso del perro, con una mano sostiene la cabeza dirigiendo el hocico levemente hacia atrás, el brazo contrario lo apoya sobre el tronco del animal y con la mano del mismo brazo sujeta los miembros anteriores llevándolos hacia atrás, se necesita de otro ayudante para sujetar el tren posterior, en caso de un animal indócil o de talla grande (Fig. 16). El operador se coloca a ventral del animal, con la mano izquierda ingurgita la vena haciendo presión en la gotera yugular a la entrada del tórax y con la derecha realiza la venipunción (Fig. 16). Agujas 25:7, 25:8, 40:7, 40:8. Figura 16. sujeción del perro en decúbito lateral para extracción de sangre de vena yugular e ingurgitación y extracción de sangre. Vena femoral. Ej. vena femoral izquierda: se coloca el animal en decúbito lateral izquierdo. El ayudante se ubica hacia dorsal, apoya su antebrazo izquierdo sobre el cuello y con la mano sujeta los miembros anteriores a nivel de la articulación del carpo. El miembro posterior del canino debe ser colocado en flexión y abducción para despejar la zona donde se realiza la venipunción. La mano derecha del ayudante debe pasar por delante de la tibia del miembro posterior que está en abducción para inmovilizarlo y con los dedos realiza presión e ingurgita sobre el canal femoral en la región proximal del muslo (Fig. 17). El operador se coloca en ventral del animal, con la mano izquierda sujeta el miembro posterior derecho y con la derecha realiza la venipunción a la altura del tercio medio del canal femoral. Agujas 25:7, 25:8, 40:7, 40:8. Figura 17. sujeción del perro para extracción de sangre de vena femoral izquierda. Maniobra de ingurgitación. 5.2. Felinos: La sujeción de esta especie en general es de mayor dificultad, por su temperamento y su capacidad escurridiza, debiendo las personas protegerse no solo de las mordidas sino también de sus garras. Cuando el animal es muy indócil se puede realizar una leve sedación del mismo con el fin de lograr una correcta extracción de sangre. Se utilizan las mismas venas que en el canino. Agujas: 25:6, 25:7 y en gato grande 25:8. Vena yugular. El ayudante debe sentarse y debe sujetar al gato (también en posición sentado) contra su cuerpo, presentando el vientre al operador; apoya su antebrazo en la zona abdominal del animal y con la mano sostiene ambos miembros anteriores. Con la otra mano debe sujetar la cabeza colocándola de tal forma que el dedo pulgar presione a nivel de la frente y los dedos índice, medio y anular los ubica en ventral entre las dos ramas de la mandíbula; de este modo fija el hocico e inmoviliza la mordida, eleva la cabeza dirigiéndola hacia su hombro, así estira el cuello y tensa la vena (Fig. 18). El operador se ubica a ventral del animal y por presión con el dedo pulgar a nivel de la entrada del tórax ingurgita la vena, con la otra mano realiza la venipunción. Esta vena resalta bien y es inmovilizada con facilidad por extensión del cuello. Para evitar rasguños desde los miembros posteriores del animal, se pueden envolver los extremos dístales con un lienzo, gasa o similar sujetándolos con tela adhesiva (Fig. 18). Figura 18. sujeción en felinos para la extracción de sangre de v. yugular y su localización. Punción de v. yugular. Otro modo de sujetar al gato consiste en colocar una toalla sobre la mesa, poner el animal en estación sobre ella y envolver su cuerpo, dejando libre la cabeza; con esta maniobra nos protegemos de rasguños. El ayudante con el brazo sostiene firmemente al felino sobre la mesa y con la mano contraria toma la cabeza, inclinándola hacia un costado (Fig. 19). El operador se coloca a craneal del animal, con una mano palpa e ingurgita la vena en la entrada del tórax sobre el canal yugular y con la otra mano realiza la venipunción (Fig. 19). Figura 19. sujeción e ingurgitación del gato para extracción de sangre de la vena yugular. Otra forma de sujeción puede realizarse con el animal en decúbito lateral; se necesita de dos ayudantes, uno sujeta la cabeza y las manos como se indicó anteriormente y el otro sujeta el tren posterior. Vena cefálica. Con el felino en decúbito esternal, se sujeta con una mano a nivel de la nuca y la otra a nivel de la grupa, ejerciendo fuerte presión sobre la mesa; a veces es conveniente colocar debajo un almohadón o lienzo o se puede envolver al animal en una toalla o similar para evitar rasguños, dejando libre el miembro anterior que se utilizará para la extracción (Fig. 20). El operador se coloca frente al gato y toma el miembro anterior a la altura del carpo, de esta manera no puede realizar la ingurgitación, por lo que requiere de un ayudante o disponer de una banda elástica a modo de torniquete. La ingurgitación debe efectuarse a la altura del codo en su cara dorsal (Fig. 20). Figura 20. maniobra de sujeción con el felino envuelto en una toalla. Extracción de sangre de la vena cefálica derecha. Vena safena. El ayudante coloca al animal en decúbito lateral y lo envuelve con una toalla, lienzo o similar, dejando libre el miembro posterior de la vena a punzar, lo sujeta con firmeza sobre la mesa. El operador se ubica en ventral del animal, coloca un torniquete sobre la articulación femoro-tibio-rotuliana, con la mano izquierda inmoviliza la vena a la vez que sujeta el miembro y con la derecha realiza la venipunción (Fig. 21). Figura 21. sujeción del gato para la extracción de sangre de la vena safena. Vena femoral. Ej. femoral izquierda. Se coloca el gato en decúbito lateral izquierdo, el ayudante se ubica hacia el dorso del animal. Toma con la mano izquierda el pliegue cutáneo del cuello o apoya el antebrazo izquierdo sobre el cuello y con la mano del mismo brazo sujeta los miembros anteriores. Con la mano derecha toma el miembro posterior que queda hacia arriba colocándolo en flexión y abducción, con los dedos índices y mayor ejerce presión en la región proximal del muslo, sobre el canal femoral del miembro que apoya sobre la mesa para producir la ingurgitación de la vena a punzar. El operador se coloca en ventral del gato, con la mano izquierda toma el miembro posterior y lo extiende para proceder a la venipunción (Fig. 22). Figura 22. sujeción del gato para la extracción de sangre de la vena femoral. 5.3. Equinos. Vena yugular. Ej. yugular izquierda. El ayudante sujeta al equino, de preferencia solo con bozal, pues el uso concomitante de otros métodos como mordaza o elevarle el miembro anterior, puede aumentar la excitación provocando modificaciones en los constituyentes sanguíneos; solo serán utilizados si el animal es muy indócil. El operador se ubica a lateral (lado izquierdo), mirando hacia el cuello del equino, de este modo vigila los movimientos de la cabeza y del miembro anterior. Con la mano izquierda toma el cuello desde ventral y con el dedo pulgar presiona sobre la vena a la entada del tórax. Con la mano derecha realiza la venipunción preferentemente a la altura del tercio medio de la gotera yugular, ya que en el tercio inferior la arteria carótida se ubica muy próxima a la vena yugular y debe evitarse su punción (Fig. 23). Agujas desde 25:8, 40:8 hasta 25:12, 40:12. Figura 23. ingurgitación y extracción de sangre de la vena yugular en equinos. 5.4. Ovinos y Caprinos. Vena yugular. Ej. yugular derecha. La técnica puede realizarse solo por el operador o ayudado por una persona. La maniobra descripta es realizada por una sola persona; el animal se coloca sentado, la persona con sus pies sujeta los cuartos traseros y con sus rodillas fija la cruz, pasa el brazo izquierdo por delante del cuello y lo desplaza al lado opuesto a la extracción ingurgita la vena con la misma mano, presionando sobre la gotera yugular en su tercio inferior y con la mano derecha realiza la venipunción. En el caso de contar con un ayudante, la misma se encargará de la sujeción. Con el animal en estación el ayudante lo cabalga y presiona con las rodillas a la altura de la cruz, lo dirige contra un poste del corral o pared para trabar el tren posterior y evitar que este escape hacia atrás, luego con una mano lo toma del mentón dirigiendo la cabeza hacia arriba y atrás, con la otra mano sujeta desde las orejas o cuernos; de este modo queda expuesta la vena yugular; el operador ingurgitará y realizará la venipunción. En caso de ovinos en que no esté permitido el esquilado de la zona se deberá separar el vellón para localizar la vena. Se pueden usar agujas 25:8, 40:8 hasta 25:10, 40:10. (Fig. 24). Figura 24. ingurgitación y extracción de sangre de la vena yugular en caprinos. Vena cefálica. Un ayudante realiza la sujeción del animal del mismo modo que se explicó para la vena yugular. El operador se coloca frente al mismo, con la mano izquierda toma el miembro anterior e inmoviliza la vena y con la derecha realiza la venipunción a altura del tercio medio del radio. Se utilizan las mismas agujas. Vena safena y femoral. Las maniobras de sujeción son las mismas que las descriptas para caninos. Se utilizan las agujas mencionadas anteriormente. 5.5. Suinos. Vena yugular externa: para animales adultos de más de 20 Kg El animal debe sujetarse con una cuerda del hocico, debe llevarse hacia atrás y el cuello debe estirarse bien. Esto se logra mejor si el cerdo se encuentra en estación. La cuerda se coloca detrás de los dientes caninos de modo que no se resbale tan fácilmente o pueda moverse rostralmente hacia el cartílago nasal, un área que claramente es incómoda para los cerdos. Es necesario evitar que el cerdo se mueva hacia delante. El sitio de punción correcto está en el punto más profundo de la ranura yugular formado. Hay que insertar la aguja en su totalidad, ya que a veces es difícil dar con el vaso sanguíneo debido a la gran cubierta adiposa. Número de agujas 60:10 ó 75:10. Vena coccígea o de la cola. La maniobra se realiza con el animal en estación, se recomienda solo en animales adultos, el ayudante se coloca a un lado, lo sujeta con un lazo del hocico y lo fija tratando de inmovilizarlo. El operador sostiene la cola en posición vertical hacia arriba, coloca la aguja en ángulo de 45 grados en un punto cercano a la base de la cola e introduce la aguja suavemente hasta localizar el vaso. Se colecta la cantidad requerida, se retira la aguja y se hace presión a fin de favorecer la hemostasia (Fig. 25). Figura 25. extracción de sangre de vena coccígea. Venas de la oreja. Se aborda en la cara externa del pabellón auricular (en la mitad de su recorrido) o en la cara interna, para lo cual se pliega la oreja sobre la nuca. El animal puede estar de pie o en decúbito lateral. Cuando el animal está de pie, se le aplica un lazo en la mandíbula superior para inmovilizarlo. Para ingurgitar la vena se coloca una banda elástica que rodea la base de la oreja (Fig. 26). Cuando se aplica presión en la base de la oreja las venas se congestionan. Se debe limpiar la piel con tela de algodón y alcohol quirúrgico, antes de proceder a la punción con agujas 25:7 o 25:8. Figura 26. extracción de sangre de la vena externa de la oreja. Venipunción. Vena cava craneal. Se abordará con el cerdo en distintas posiciones dependiendo de la edad y tamaño. En caso de cerdos chicos, se coloca en decúbito dorsal. El ayudante sostiene con una mano los miembros posteriores y con la otra sujeta los miembros anteriores desplazándolos hacia caudal. El operador se ubica a craneal, con una mano fija la cabeza y con la otra introduce la aguja. El sitio de punción se localiza en el tercio inferior del cuello, sobre el surco yugular, palpando el manubrio del esternón, aproximadamente 3 cm. a craneal y lateral de la punta del esternón se encuentra una hendidura en la cual se introduce la aguja en dirección medial y ligeramente caudodorsal (Fig. 27). Las agujas a utilizar deben ser largas como las 60:10 ó 75:10. Figura 27. sujeción de los lechones para la extracción de sangre de la vena cava craneal con el animal en decúbito dorsal y con el animal en decúbito lateral. Venipunción. Si el cerdo es grande se lo sujeta con una cuerda de la mandíbula superior que pasa por detrás de los colmillos y se lo sujeta a un poste o clavija, manteniéndole estirada la cabeza y cuello, con el eje mayor del cuerpo en línea recta. El operador se ubica lateralmente mirando hacia caudal y precede a la punción del sitio de elección ya detallado. La aguja utilizada en animales de gran talla es 75:10 ó 80:12 (Fig. 28). Figura 28. cerdo en estación para la extracción de sangre de la vena cava craneal. Vena mamaria: con Vacutainer La vena de la leche (vena abdominal subcutánea) es fácilmente visible a lateral de los pezones de pequeños cerdos. Para la extracción de sangre se utiliza un tubo de vacío y una aguja de calibre 20. La aguja se inserta en la vena que es más visible. Los cerdos que pesen más de 50 kg deben ser inmovilizados como se ha descrito anteriormente usando una cuerda en el hocico. La vena se palpa y se realiza la punción en la piel en el punto donde se siente la vena más claramente. El tubo de vacío se conecta y la aguja se mueve alrededor cuidadosamente hasta que la vena es perforada. El operario debe estar de pie en el lado derecho del animal e inserta la aguja rostral. Esto generalmente se considera la mejor posición para operadores diestros. En el lado izquierdo del animal es normalmente más fácil insertar la aguja en sentido caudal. 5.6. Bovinos. Vena yugular. La maniobra se puede realizar sujetando al bovino con un bozal. El operador se ubica a lateral, mirando hacía craneal; con la mano izquierda realiza la presión sobre la gotera yugular para poner turgente la vena. Con la mano derecha realiza la venipunción en el tercio medio o superior del surco yugular. Debido a que la piel en esta especie es gruesa y ofrece mucha resistencia, la punción se debe realizar con un golpe seco y firme. En caso de contar con instalaciones adecuadas se sujeta el animal en el cepo. El ayudante coloca la mocheta haciendo girar la cabeza del bovino hacia la derecha (si tomamos como ej. yugular izquierda). El operador apoya su espalda firmemente sobre la cabeza del animal (para evitar golpes); con la mano izquierda ingurgita la vena haciendo presión en la gotera yugular a la entrada del tórax y con la derecha realiza la venipunción con agujas descartables hipodérmicas desde 25:10 a 40:20, en el tercio medio o superior del surco yugular (Fig. 29). Figura 29. localización e ingurgitación de la vena yugular Vena caudal media o coccígea media. El o los animales se colocan en el brete y el operador con la mano izquierda eleva la cola del bovino hasta formar un ángulo de 90° con la región del periné, para evitar el estiramiento y subsecuente colapso de la vena. Con la mano derecha se localiza por palpación el espacio intervertebral entre la 4 y 7 vértebra coccígea lo que corresponde aproximadamente a tres través de dedos a caudal de la base de la cola (Fig. 30). La punción se realiza teniendo en cuenta que la vena pasa por la línea media entre los músculos ventrales de la cola (Fig. 30). Es de hacer notar que esta vena no se puede ingurgitar ni palpar por lo tanto la punción se realiza a ciegas. Las agujas a usar pueden ser desde 15:15 a 25:8. Figura 30. localización, antisepsia y extracción de sangre de la vena coccígea. Vena abdominal subcutánea (vena mamaria). Se puede usar satisfactoriamente en hembras en lactancia, por el gran calibre que ésta adquiere. Se aconseja el uso de agujas de pequeño diámetro pues existe el riesgo de la formación de hematomas. Agujas 25/6, 25/7. El operador se ubica a lateral mirando hacia caudal. Con la mano izquierda inmoviliza la vena y con la derecha realiza la venipunción. 6. CONSERVACIÓN Y ALMACENAMIENTO DE LA MUESTRA. En términos generales se deben tener en cuenta las siguientes precauciones: Evitar la contaminación. Utilizar recipientes limpios, secos, desengrasados y cerrados. Inhibir o disminuir el metabolismo celular in vitro, en caso de necesitarse suero o plasma es conveniente separar la fracción celular con rapidez o inhibir su metabolismo, ya sea con sustancias químicas o disminuyendo la temperatura. Evitar evaporación debido a que se incrementa la concentración de los constituyentes no volátiles. Para ello colocar la muestra en recipientes cerrados y refrigerar inmediatamente. Refrigeración vs. congelación: las muestras para hematología jamás se deben congelar. La conservación se debe realizar a temperatura de refrigeración respetando los tiempos. En lo posible realizar el frotis antes de mezclar la sangre con el anticoagulante, especialmente cuando se requiere la identificación de hemoparásitos (ej. Mycoplasma felis, Babesia canis). Respetar la relación anticoagulante: muestra. Si la muestra no puede ser enviada antes de las 6 horas transcurridas desde su recolección, REALIZAR EL FROTIS SANGUÍNEO Y REFRIGERAR EL TUBO, de esta forma se mantendrán inalteradas las características requeridas para el adecuado desarrollo de los exámenes. MUESTRAS PARA QUÍMICA SANGUÍNEA Evitar la exposición a la luz para no provocar la desnaturalización de algunas sustancias que interesan investigar (ej. bilirrubina). Evitar LIPEMIA y HEMÓLISIS, ya que interfieren con diversas determinaciones. Ej.: enzimas, hemoglobina. Usar de preferencia suero o plasma heparinizado. Sólo algunas determinaciones se pueden realizar con sangre con EDTA (albúmina, proteína plasmática, fibrinógeno, urea). Las muestras obtenidas sin anticoagulante, deben ser enviadas lo más pronto posible al laboratorio para obtener el suero, de lo contrario, dejar la muestra a temperatura ambiente hasta que se retraiga el coágulo y exude el suero, separar y luego refrigerar. Si la refrigeración ocurre antes de la retracción del coágulo la muestra podría hemolizarse. Para determinar glucosa sanguínea remitir al laboratorio inmediatamente luego de extraída (dentro de las 2 hs) o utilizar como inhibidor de la glucólisis el EDTA fluoruro de sodio. 7. ENVIO DE LA MUESTRA. La muestra debe ser identificada en forma correcta y legible. Se debe acompañar del protocolo de envío (Ver anexo II): o Reseña: especie, raza, edad, sexo, peso, identificación, nombre del propietario, domicilio, teléfono. o Anamnesis: diagnóstico presuntivo, tratamiento instaurado, análisis solicitado, análisis anteriores, material remitido, profesional que lo solicita. El material de envío debe ser resistente a golpes. Respetar la reglamentación del transporte postal: o Efectuar una encomienda de modo que el material transportado no signifique un riesgo para la salud. o De fácil manejo. o Envase con cierre hermético, de material absorbente, resistente a golpes. o Caracterizar la muestra, por ejemplo: Material biológico, infeccioso, frágil, etc. El RESPONSABLE de las condiciones de la muestra transportada es el REMITENTE. Análisis Clínico / Toma de muestra de sangre Anexo I. Anticoagulantes. PRODUCTO Oxalato potasio Amonio. Citrato sodio. E.D.T.A. MODO DE ACCIÓN MODO DE USO UTILIDAD No se usa en trasfusiones, ni determinaciones de niveles plasmáticos de de Compleja 0,1 ml/ml K, Ca, y Ca++ sangre Fosfatasa (Irreversible). Alcalina, Urea y otros. de Compleja Ca++ Compleja Ca++ DESVENTAJAS Altera la morfología celular luego de 30 min. (Ox. de K: deshidratación, Ox de Amonio: tumefacción celular). Cambios en la morfología nuclear caracterizados por gemación de linfocitos, hendiduras o divisiones en monocitos, hipersegmentación en neutrófilos, cristales en citoplasma. Es el apropiado para recolectar plasma para estudio de coagulación, 0,1 ml/ml plaquetas para sangre estudios Dilución de muestra. funcionales y recuento de hematíes. También es el indicado para recolectar y almacenar sangre destinada a transfusiones. Excelente para Exceso deshidrata la morfología célula, disminuye el celular. tamaño celular y su 1 – 2 mg/ml Es el preferido coloración, pero la Hb sangre para uso no se ve alterada. hematológico. La muestra puede preservarse 24 hs a 4–8 ºC (refrigerada). Compleja Ca++ e inhibe enzimas 1 – 2 mg/ml utilizadas en E.D.T.A. con el consumo sangre Fluoruro de glucosa. Excelente para Alteraciones de la morfología celular y determinación algo de hemólisis. de glucosa. Facultad de Agronomía y Veterinaria 1 Análisis Clínico / Toma de muestra de sangre Heparina Interfiere el pasaje mg/ml Protrombina 1–2 sangre a Trombina por fijarse a la antitrombina III. No altera el volumen del eritrocito. Es el apropiado para ser usado en aves y reptiles. Interfiere coloración de leucocitos, no permite ver morfología y coloración de los eritrocitos. No puede emplearse en muestras donde se analizará el fibrinógeno o en estudios de coagulación 2 Facultad de Agronomía y Veterinaria Análisis Clínico / Toma de muestra de sangre Anexo II. Solicitud de análisis. 3 Facultad de Agronomía y Veterinaria Análisis Clínico / Toma de muestra de sangre REFERENCIA BIBLIOGRAFICA. 1. Allen, A. (1975). Atlas de Cirugía Canina. Ed. UTEHA. 2. Benjamín, M. (1984).Manual de Patología Clínica en Veterinaria. Ed. Limusa. 3. Bush, B. M. (1982). Manual del Laboratorio Veterinario de Análisis Clínicos. Ed. Acribia, Zaragoza, España. 4. Caldas, E. M. (1985). Propedéutica Clínica en Medicina Veterinaria. Universidad Federal de Bahia. Ctro. Edit e Didacticoa UFBA. 5. Duncan, J. R; Preassa, K. W. (1986). Veterinary Laboratory Medicin Clinical Pathology. Iowa University Press. Awes. Iowa. 6. Ford, R. B. (1992). Signos Clínicos y Diagnóstico en Pequeños Animales. Ed. Panamericana. 7. García, A. D.C. ( ) “Cirugía de los Animales Domésticos. 8. Goic, G. A.; Chamorro, Z. G. (1996). Semiología Médica. Ed. Mediterránea. 9. Irvine, C. H. G. (1958). The Blood Picture in the Race Horse I. The Normal Erythrocyte and Hemoglobin Status. A Dynamic Concept. J.Amer. Vet. Med. As., 133:97. 10. Jaksch, W.; Glaswiscnig, E. (1978). Propedéutica Clínica de las Enfermedades Internas y de la Piel de los Animales Domésticos. Ed. Acribia 11. Kelly, W. (1972). Diagnóstico Clínico Veterinario. Ed. C.E.C.S.A. 12. Marek, M. (1973). Diagnóstico Clínico de las Enfermedades Internas de los animales Domésticos. Ed. Labor S.A. 13. Mc Curnin, P. (1993). Diagnóstico Físico y procedimientos Clínicos en Animales Pequeños. Ed. Intermédica. 14. Rosember, G. (1978). Exploración Clínica de los Bovinos. Ed. Hemisferio Sur SA. 15. Schalm, O. (1981). Hematología Veterinaria . Ed. Hemisferio Sur. 16. Forchetti, O.; Maffrand, C.; Mortara, L.; Babini, S. (2002). Hematología Veterinaria. Material de estudio de Análisis Clínico, Facultad de Agronomía y Veterinaria de la U.N.R.C. 17. Popesko, P. ( ).Atlas de anatomía topográfica de los animales domésticos. Tomo I (cabeza y cuello) tomo II (tronco) Tomo III (Pelvis y miembros). Segunda edición. Editorial Salvat. 18. MV, MSc. Gloria Casas. (2014) “Protocolo para toma de muestra en porcinos”. UNIVERSIDAD NACIONAL DE COLOMBIA SEDE BOGOTA 4 Facultad de Agronomía y Veterinaria
Anuncio
Documentos relacionados
Descargar
Anuncio
Añadir este documento a la recogida (s)
Puede agregar este documento a su colección de estudio (s)
Iniciar sesión Disponible sólo para usuarios autorizadosAñadir a este documento guardado
Puede agregar este documento a su lista guardada
Iniciar sesión Disponible sólo para usuarios autorizados