SERVICIO DE
GERIATRIA DEL
HOSPITAL VICTOR
LAZARTE ECHEGARAY
ASISTENTE:
DR. SEGUNDO VIGO AYASTA
COLABORADORES:
- MC SULLY RODRÍGUEZ CASTRO
- MC KRISS RUIZ
- MC ANTONIO VARGAS
AÑO 2022
0
INDICE DE CONTENIDOS
- MANUAL DE FUNCIONES DEL SERVICIO DE GERIATRIA
5
- PRINCIPALES DIAGNOSTICOS Y SINDROMES EN EL
SERVICIO DE GERIATRIA
8
- GUIA DE PRÁCTICA CLÍNICA DE DIAGNÓSTICO Y TRATAMIENTO DE HTA
DE EN EL ADULTO MAYOR
I.
FINALIDAD
9
II.
OBJETIVO
9
III.
AMBITO DE APLICACIÓN
9
IV.
PROCESO O PROCEDIMIENTO A ESTANDARIZAR
9
V.
CONSIDERACIONES GENERALES
10
VI.
CONSIDERACIONES ESPECIFICAS
13
VII.
ANEXOS
27
VIII.
REFERENCIAS BIBLIOGRÁFICAS
34
- GUIA DE PRÁCTICA CLÍNICA DE DIAGNÓSTICO Y TRATAMIENTO DE LA
DEPRESIÓN EN EL ADULTO MAYOR
I.
FINALIDAD
38
II.
OBJETIVO
38
III.
AMBITO DE APLICACIÓN
38
IV.
PROCESO O PROCEDIMIENTO A ESTANDARIZAR
38
V.
CONSIDERACIONES GENERALES
39
VI.
CONSIDERACIONES ESPECIFICAS
42
VII.
ANEXOS
59
VIII.
REFERENCIAS BIBLIOGRÁFICAS
61
- GUIA DE PRÁCTICA CLÍNICA DE DIAGNÓSTICO Y TRATAMIENTO DE
DEMENCIA EN LA ENFERMEDAD DE ALZHEIMER EN EL ADULTO MAYOR
I.
FINALIDAD
N
II.
OBJETIVO
N
III.
AMBITO DE APLICACIÓN
N
IV.
PROCESO O PROCEDIMIENTO A ESTANDARIZAR
N
V.
CONSIDERACIONES GENERALES
N
1
VI.
CONSIDERACIONES ESPECIFICAS
N
VII.
ANEXOS
N
VIII.
REFERENCIAS BIBLIOGRÁFICAS
N
- GUIA DE PRÁCTICA CLÍNICA DE DIAGNÓSTICO Y TRATAMIENTO DE
DIABETES MELLITUS CON COMPLICACIONES PERIFÉRICAS EN EL
ADULTO MAYOR
I.
FINALIDAD
N
II.
OBJETIVO
N
III.
AMBITO DE APLICACIÓN
N
IV.
PROCESO O PROCEDIMIENTO A ESTANDARIZAR
N
V.
CONSIDERACIONES GENERALES
N
VI.
CONSIDERACIONES ESPECIFICAS
N
VII.
ANEXOS
N
VIII.
REFERENCIAS BIBLIOGRÁFICAS
N
- GUIA DE PRÁCTICA CLÍNICA DE DIAGNÓSTICO Y TRATAMIENTO DE
DEMENCIA VASCULAR EN EL ADULTO MAYOR
I.
FINALIDAD
N
II.
OBJETIVO
N
III.
AMBITO DE APLICACIÓN
N
IV.
PROCESO O PROCEDIMIENTO A ESTANDARIZAR
N
V.
CONSIDERACIONES GENERALES
N
VI.
CONSIDERACIONES ESPECIFICAS
N
VII.
ANEXOS
N
VIII.
REFERENCIAS BIBLIOGRÁFICAS
N
- GUIA DE PRÁCTICA CLÍNICA DE DIAGNÓSTICO Y TRATAMIENTO DE
ENFERMEDAD DE PARKINSON EN EL ADULTO MAYOR
I.
FINALIDAD
N
II.
OBJETIVO
N
III.
AMBITO DE APLICACIÓN
N
IV.
PROCESO O PROCEDIMIENTO A ESTANDARIZAR
N
V.
CONSIDERACIONES GENERALES
N
VI.
CONSIDERACIONES ESPECIFICAS
N
2
VII.
ANEXOS
N
VIII.
REFERENCIAS BIBLIOGRÁFICAS
N
- GUIA DE PRÁCTICA CLÍNICA DE DIAGNÓSTICO Y TRATAMIENTO DE
SINDROME DE FRAGILIDAD EN EL ADULTO MAYOR
I.
FINALIDAD
N
II.
OBJETIVO
N
III.
AMBITO DE APLICACIÓN
N
IV.
PROCESO O PROCEDIMIENTO A ESTANDARIZAR
N
V.
CONSIDERACIONES GENERALES
N
VI.
CONSIDERACIONES ESPECIFICAS
N
VII.
ANEXOS
N
VIII.
REFERENCIAS BIBLIOGRÁFICAS
N
- GUIA DE PRÁCTICA CLÍNICA DE DIAGNÓSTICO Y TRATAMIENTO DE
DETERIORO COGNITIVO LEVE EN EL ADULTO MAYOR
I.
FINALIDAD
N
II.
OBJETIVO
N
III.
AMBITO DE APLICACIÓN
N
IV.
PROCESO O PROCEDIMIENTO A ESTANDARIZAR
N
V.
CONSIDERACIONES GENERALES
N
VI.
CONSIDERACIONES ESPECIFICAS
N
VII.
ANEXOS
N
VIII.
REFERENCIAS BIBLIOGRÁFICAS
N
- GUIA DE PRÁCTICA CLÍNICA DE DIAGNÓSTICO Y TRATAMIENTO DE
SINDROME DE DISMOVILIDAD EN EL ADULTO MAYOR
I.
FINALIDAD
N
II.
OBJETIVO
N
III.
AMBITO DE APLICACIÓN
N
IV.
PROCESO O PROCEDIMIENTO A ESTANDARIZAR
N
V.
CONSIDERACIONES GENERALES
N
VI.
CONSIDERACIONES ESPECIFICAS
N
VII.
ANEXOS
N
VIII.
REFERENCIAS BIBLIOGRÁFICAS
N
3
- GUIA DE PRÁCTICA CLÍNICA DE DIAGNÓSTICO Y TRATAMIENTO DE
SINDROME TRASTORNO DE LA MARCHA EN EL ADULTO MAYOR
I.
FINALIDAD
N
II.
OBJETIVO
N
III.
AMBITO DE APLICACIÓN
N
IV.
PROCESO O PROCEDIMIENTO A ESTANDARIZAR
N
V.
CONSIDERACIONES GENERALES
N
VI.
CONSIDERACIONES ESPECIFICAS
N
VII.
ANEXOS
N
VIII.
REFERENCIAS BIBLIOGRÁFICAS
N
- GUIA DE PRÁCTICA CLÍNICA DE DIAGNÓSTICO Y TRATAMIENTO DE
SINDROME DE CAÍDAS EN EL ADULTO MAYOR
I.
FINALIDAD
N
II.
OBJETIVO
N
III.
AMBITO DE APLICACIÓN
N
IV.
PROCESO O PROCEDIMIENTO A ESTANDARIZAR
N
V.
CONSIDERACIONES GENERALES
N
VI.
CONSIDERACIONES ESPECIFICAS
N
VII.
ANEXOS
N
VIII.
REFERENCIAS BIBLIOGRÁFICAS
N
- GUIA DE PRÁCTICA CLÍNICA DE DIAGNÓSTICO Y TRATAMIENTO DE
DOLOR CRÓNICO EN EL ADULTO MAYOR
I.
FINALIDAD
N
II.
OBJETIVO
N
III.
AMBITO DE APLICACIÓN
N
IV.
PROCESO O PROCEDIMIENTO A ESTANDARIZAR
N
V.
CONSIDERACIONES GENERALES
N
VI.
CONSIDERACIONES ESPECIFICAS
N
VII.
ANEXOS
N
VIII.
REFERENCIAS BIBLIOGRÁFICAS
N
MANUAL DE FUNCIONES DE SERVICIO DE GERIATRÍA DEL HVLE
4
a) Brindar atención médica de salud en la especialidad de geriatría para el
tratamiento de enfermedades de alta complejidad a los pacientes, en el
marco de las normas, guías clínicas, procedimientos asistenciales y
demás normativa técnica vigente.
b) Identificar y diagnosticas las enfermedades ocupacionales de los
pacientes que se atienden en el servicio.
c) Coordinar con los servicios del Hospital Víctor lazarte Echegaray para una
adecuada y oportuna atención de las interconsultas, evaluación
multidisciplinaria para los casos clínicos complejos y otros necesarios para
la atención oportuna.
d) Brindar información oportuna al paciente sobre su situación actual de
salud, tratamientos, procedimientos y otros datos relacionados con la
atención, en el marco del respeto de los derechos del paciente y las
normas vigentes de salud.
e) Supervisar el correcto uso y/o funcionamiento de los viene estratégicos,
así como de mantenimiento de equipos médicos asignados al servicio de
geriatría.
f) Elaborar la cartera de servicios de salud que corresponda al ámbito de su
competencia, según las prioridades sanitarias, la oferta y demanda y las
normes vigentes, así como realizar las acciones para su implementación,
control y evaluación respectiva.
g) Identificar la capacidad operativa máxima del servicio de geriatría.
h) Recoger información respecto a la productividad del servicio, de los
resultados o beneficios en la salud de los pacientes, así como la calidad y
satisfacción lograda.
5
i) Identificar las necesidades de capacitación del personal del servicio a su
cargo.
j) Ejecutar las acciones para la optimización de los procesos a su cargo, para
reducir los tiempos de espera para la prestación de los servicios.
k) Ejecutar las disposiciones descritas en los acuerdos de gestión, según
corresponda.
l) Ejecutar acciones de articulación de los servicios y unidades prestadores
de servicio al interior del departamento, así como con los demás
departamentos de la gerencia clínica.
m) Ejecutar técnicas, procedimientos, pruebas y otras acciones en torno a la
calidad, seguridad del paciente y gestión de riesgos.
n) Identificar la ocurrencia de prácticas inseguras y otros riesgos que afecten
la salud ocupacional del personal a su cargo, que afecten la atención del
paciente en el servicio y adoptar las acciones educativas al personal
profesional u otras medidas que sean necesarias.
o) Elaborar, actualizar y proponer las guías de práctica clínica, protocolos,
manuales, procedimientos e instructivos técnicos relacionados a la
actividad asistencial de las especialidades que se brindan en el servicio,
así como supervisar su implementación y evaluar la adherencia de estos.
p) Desarrollar proyectos de investigación autorizados, realizar docencia de
pre y post grado y proponer la actualización y capacitación del personal
de servicio en el marco de la normatividad vigente.
q) Elaborar la programación asistencial de la atención del servicio, en base a
la brecha oferta demanda y demás información relevante.
r) Supervisar su cumplimiento y adoptar las medidas correctivas necesarias.
6
s) Implementar las normas de sistema de referencia y contrarreferencia y
proponer las acciones y recursos que se requiera.
t) Elaborar y sustentar los requerimientos del personal, bienes estratégicos
y otros recursos y servicios necesarios para la operatividad del servicio.
u) Mantener actualizada la información en los registros, formatos, y sistemas
de información institucional que se genera en el servicio, así como
implementar las acciones correctivas que correspondan.
v) Elaborar los informes, reportes, y demás documentos sobre la gestión,
resultados, incapacidad temporal, reclamos, y quejas de los pacientes, y
otros que sean requeridos por la gerencia del Hospital Lazarte.
w) Implementar las recomendaciones de las acciones de control, supervisión,
u otros para la mejora del servicio.
x) Planificar y ejecutarlas actividades del servicio, así como, controlar y
evaluar el cumplimento de las metas, e indicadores, de efectividad y
calidad de la atención, efectuar las acciones correctivas, en caso
corresponda.
y) Cumplir con las normas de bioseguridad, de seguridad y salud en el
trabajo, código de ética institucional, trasparencia, acceso, y protección de
la información, de control interno y de gestión de la calidad, así como, con
toda disposición que emita la jefatura inmediata superior, en el ámbito de
su competencia.
z) Otras funciones que le asigne la Gerencia del Hospital Víctor Lazarte
Echegaray en el ámbito de su competencia.
PRINCIPALES DIAGNÓSTICOS DEL SERVICIO DE GERIATRIA DEL AÑO
2019 AL 2022 DEL HOSPITAL VICTOR LAZARTE ECHEGARAY
7
1. HIPERTENSIÓN ARTERIAL
CIE 10
I10
2. EPISODIO DEPRESIVO MODERADO
CIE 10
F32.1
3. DEMENCIA EN LA ENFERMEDAD DE ALZHEIMER
CIE 10
F00.1
4. DIABETES MELLITUS CON COMPLICACIONES PERIFÉRICAS
CIE 10
E13.5
5. DEMENCIA VASCULAR, NO ESPECIFICADA
CIE 10
F01.9
6. ENFERMEDAD DE PARKINSON CIE 10
CIE 10
G 20
PRINCIPALES SINDROMES DEL SERVICIO DE GERIATRIA DEL AÑO 2019
AL 2022 DEL HOSPITAL VICTOR LAZARTE ECHEGARAY
1. SINDROME DE FRAGILIDAD EN EL ADULTO MAYOR
2. DETERIORO COGNITIVO LEVE EN EL ADULTO MAYOR
3. SINDROME DE DISMOVILIDAD EN EL ADULTO MAYOR
4. SINDROME DE TRASTORNO DE LA MARCHA EN EL ADULTO MAYOR
5. SINDROME DE CAÍDAS EN EL ADULTO MAYOR
6. DOLOR CRÓNICO EN EL ADULTO MAYOR
GUIA DE PRÁCTICA CLÍNICA DE DIAGNÓSTICO Y TRATAMIENTO DE
HIPERTENSIÓN ARTERIAL EN EL ADULTO MAYOR
I.
FINALIDAD
8
La presente guía tiene como finalidad dar las recomendaciones sobre el
diagnóstico y tratamiento de la Hipertensión Arterial en el Adulto Mayor,
atendidos en el servicio de Geriatría del Hospital Víctor Lazarte Echegaray de la
ciudad de Trujillo.
II.
OBJETIVO
Promover la detección, evaluación diagnóstico y tratamiento de la Hipertensión
Arterial en el Adulto Mayor atendidos en el servicio de Geriatría del Hospital Víctor
Lazarte Echegaray de la ciudad de Trujillo.
III.
AMBITO DE APLICACIÓN
La presente Guía de práctica clínica tiene como ámbito de aplicación a la
población adulta mayor con sospecha o con diagnóstico establecido de
Hipertensión arterial que asisten al consultorio externo de Geriatría del Hospital
Víctor Lazarte Echegaray de Trujillo, incluyendo a la población referida de otros
servicios del hospital. También puede servir como referente para los demás
hospitales ESSALUD que brinden atenciones de salud en todo el Perú.
IV.
PROCESO O PROCEDIMIENTO A ESTANDARIZAR
a) Diagnóstico de Hipertensión arterial en el Adulto Mayor.
b) Tratamiento de Hipertensión arterial en el Adulto Mayor.
4.1 Nombre y código CIE 10:
Hipertensión Arterial CIE 10: I 10
Enfermedad Cardiaca Hipertensiva CIE 10: I 11
Enfermedad Renal Hipertensiva CIE 10: I 12
Enfermedad Cardiorrenal Hipertensiva CIE 10: I 13
Hipertensión Secundaria CIE 10: I15
V.
CONSIDERACIONES GENERALES
5.1 Definición:
9
La hipertensión arterial sistémica se define tradicionalmente como una tensión
arterial sistólica (PAS) 140 mm Hg o tensión arterial diastólica (PAD) 90 mm Hg,
como promedio de 3 mediciones tomadas adecuadamente en 2 o más en visitas
médicas. (1)
5.2 Etiología:
La etiología de la hipertensión arterial es desconocida, sin embargo se considera
el resultado de numerosos factores genéticos y ambientales que se combinan
para provocar efectos en el sistema cardiovascular y en la estructura renal. (2)
5.3 Fisiopatología
El concepto actual sobre la enfermedad hipertensiva es el de una enfermedad
vascular, sistémica, inflamatoria,
crónica y progresiva.
Partiendo de ese concepto genérico, se desprende que el vaso sanguíneo es el
órgano primario de afección, y dentro de esa estructura está el endotelio; este
órgano (endotelio) es vital en la homeostasis vascular pues de su funcionamiento
normal depende el equilibrio del sistema cardiovascular y por ende de la salud
integral del individuo.
La presión arterial está regulada por numerosos factores neuro-hormonales de
acción sistémica y local, que
funcionan en circuitos de autorregulación, manteniéndola dentro de límites
estrechos.
Diversos factores como herencia y estilo de vida, sistema nervioso simpático
hiperactivado, ingesta excesiva . de sal, hormonas o sustancias liberadas por el
endotelio enfermo, pueden modificar el gasto cardiaco y/o las resistencia vascular
periférica, iniciando la HTA.
La Angiotensína ll (de acción sistémica y/a titular), potente vasocanstrictora y
facilitadora del crecimiento celular, es el principal determinante de la persistencia
de la HTA.
10
La disfunción endotelial, que acompaña a la HTA, promueve la proliferación
celular así como la liberación de muchas sustancias vasoactivas, protrombóticas
y procoagulantes que ulteriormente precipitarán en aterosclerosis precoz.
En la HTA, la hipertrofia e hiperplasia vascular, el aumento de la matriz
extracelular, el incremento de la resistencia vascular periférica, explican la
hipertrofia
miocárdica
y
el
desarrollo
de
complicaciones:
vasculares
(aterosclerosis), cardiacas (insuficiencia cardiaca, isquemia miocárdica y
arritmias), cerebral (hemorragia, isquemia, encefalopatía) y nefrológicas
(insuficiencia renal).
La coexistencia de hipertensión arterial con síndromes geriátricos como
fragilidad, depresión y deterioro cognoscitivo, genera activación de vías
fisiopatológicas comunes como el estrés oxidativo, hipercatabolismo, resistencia
a la insulina, deficiencia de vitamina D que lleva a desenlaces adversos como la
disminución de la funcionalidad, institucionalización, caídas y muerte. (3)
5.4 Aspectos Epidemiológicos:
-
Las condiciones clínicas de HTA y sobrepeso/obesidad, se consideran
pandémicas.
-
Generalmente la prevalencia varía según las regiones y su procedencia
rural o urbana.
-
Los estudios reportan prevatencias de hipertensión arterial esencial del
orden del 20 al 30% (> de 140/90 mmHg.)
-
En nuestro país el estudio realizado por la Sociedad Peruana de
Cardiología en el 2006, reveló prevalencias de 27.3%, 22.1% y 22.7% a
nivel de la costa, sierra alta y selva, respectivamente; con un promedio
nacional de 23.7%. El sobrepeso/obesidad fue el factor de riesgo
modificable más frecuentemente encontrado en la población hipertensa,
en dicho estudio.
-
La enfermedad cardiovascular es responsable del 29.2% de muertes
(OMS 2003), muchas de las cuales son prevenibles.
11
-
Cada año alrededor de 20 millones de personas sobreviven a un ataque
cardiaco y accidente cerebrovascular, con los cO5tos que ello representa
en cuidados clínicos.
-
Se estima que los países en vías de desarrollo se incrementará la
prevalencia de la enfermedad hipertensiva en el orden del 65%.
-
La HTA es responsable del 30% de los casos de insuficiencia renal crónica
y representa el factor de riesgo más importante de los accidente5 cerebrovasculare5 (75%).
-
La hipertensión arterial es un factor de riesgo importante para el desarrollo
de enfermedad cerebrovascular y cardiaca isquémica. Segú n datos del
Análisis de Situación de Salud de la Dirección General de Epidemiología2005, la tasa bruta de mortalidad según primeras causas por enfermedad
cerebrovascular fue de 25.9 x 100,000 y por enfermedad isquémica del
corazón de 22.61 x 100,000 para el periodo 1999-2002.
-
En el Perú, se estima que existen 5.5 millones de personas que sufren de
hipertensión arterial (22.1 %), según medición de la Encuesta Demográfica
y de Salud Familiar (ENDES). Por cada cinco peruanos adultos mayores
tiene hipertensión, y que aparecen cuatro nuevos casos por 100 personas
en un año, además solo la mitad de los pacientes hipertensos tienen el
diagnóstico previo de su condición. (4)
5.5 Factores de riesgo asociados:
Los factores de riesgo asociados se clasifican:
No Modificables:
•
Edad, mayor de 55 en varones y 65 en mujeres
•
Sexo Masculino
•
Antecedentes familiares de hipertensión arterial
•
Diabetes
•
Tabaquismo
•
Dislipidemia
•
Sedentarismo
Modificables:
12
•
Stres5 / Depresión
•
Obesidad
•
Hipertrofia ventricular izquierda
•
Resistencia a la insulina
•
Factores trombogénicos
•
Homocisteína
•
Triglicéridos / Lipoproteína elevados en sangre
La hipertensión en el adulto mayor se asocia a enfermedad vascular cerebral, así
como alteraciones en la estructura y función, perfusión y metabolismo cerebral
por lo que es frecuente encontrar alteraciones en la función cognoscitiva. (9)
VI.
CONSIDERACIONES ESPECIFICAS
6.1 Cuadro Clínico:
6.1.1 Signos y síntomas:
La HTA es esencialmente asintomática (70% a 80% de los casos).
Están descritos algunos signos y síntomas clásicos y poco frecuentes como:
cefalea, tinnitus, mareos, escotomas o epistaxis.
6.1.2 Interacción cronológica:
Se debe tener en cuenta entre la hipertensión arterial sub clínica y el tiempo de
las manifestaciones clínicas, pues cuanto más precoz el diagnostico, disminuye
las complicaciones de la HTA en los órganos blanco
6.2 Diagnóstico:
6.2.1 Criterios de Diagnóstico:
Los procedimientos diagnósticos comprenden: La historia médica, evaluación
clínica, mediciones repetidas de la presión arterial y exámenes de laboratorio e
instrumentales.
Estos procedimientos tienen los siguientes objetivos:
13
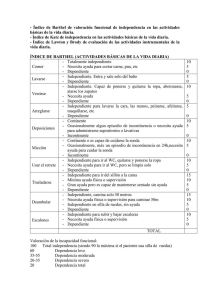
a) Determinar los niveles de presión arterial (Tabla N° 1).
b) Buscar potenciales causas secundarias.
c) Determinar el riesgo cardiovascular global, según los factores de riesgo
presentes y/o daño de órgano blanco. (Tabla N° 3)
TABLA N° 1. CLASIFICACIÓN DE LA PRESIÓN ARTERIAL EN LOS
ADULTOS DE 20 AÑOS A MES
Normal
< 120
< 80
Pre-
120-139 y/o
80-89
Hipertensión
140-159 y/o
90-99
Estadio 1
160-179 y/o
z100-109
hipertensión
Estadio 2
El valor más alto de la presión sistólica o diastólica establece el estadío del
cuadro hipertensivo
Cuando la presión sistólica o diastólica se sitúan en categoría diferentes, la
presión mayor debe ser utilizado para la clasificación del estadío
6.2.2 Datos Relevantes de la Historia Clínica:
-
Filiación: Sexo, edad, raza.
-
Historia familiar de hipertensión arterial, accidente cerebro vascular,
enfermedad coronaria y muerte prematura o súbita en familiares cercanos.
-
Perfil psicosocial, factores ambientales, síntomas de depresión, ansiedad
o pánico, situación laboral y grado de escolaridad.
-
Enfermedad actual: Tiempo del diagnóstico de la HTA por profesional de
la salud y niveles de presión,
-
Reacción adversa a medicamentos (RAM), así como consumo de
medicamentos o drogas que pueden afectar la presión arterial, dolor
precordial (síntomas de daño de arteria coronaria), signos y síntomas
14
sugestivos de insuficiencia cardiaca, insuficiencia vascular-cerebral, daño
renal, indicios de HTA secundaria.
-
Indagar y registrar sobre los diversos factores de riesgo: Tabaquismo,
sobrepeso, obesidad, sedentarismo, dislipidemia, entre otros.
-
Averiguar sobre hábitos alimentarios: consumo de sal, alcohol, grasas
saturadas y cafeína.
6.2.3 Examen Físico:
Evaluar:
-
Peso
-
Talla.
-
Índice de masa corporal.
-
Perímetro abdominal.
-
Inspección: facies y aspecto sugestivo de HTA secundaria (Síndrome de
Cushing).
-
Medición de la presión arterial, pulso y frecuencia cardiaca.
-
Determinar presencia de edema.
-
Palpación y auscultación de arteria carótida, verificar ingurgitación yugular
y palpación de la tiroides.
-
Examen precordial, para descartar hipertrofia ventricular y/o crecimiento
de cavidades cardiacas.
-
Examen Pulmonar, auscultación de estertores.
-
Examen
abdominal,
auscultación
de
soplos
abdominales,
masa
abdominal.
-
Examen de fondo de ojo
6.2.4 Metodología para la Medición de la Presión Arterial:
-
Para la medición de la PA usar tensiómetro calibrado y validado. Se
sugiere tensiómetro de mercurio.
-
La persona debe estar sentada, en reposo por lo menos 5 minutos antes
de la toma de PA, con los pies apoyados en el piso y el brazo descubierto,
extendido y apoyado a la altura del corazón. La persona no debe haber
15
fumado o ingerido previamente café, alcohol u otras bebidas calientes en
los 30 minutos previos.
-
En la primera visita se debe realizar la medición de la presión arterial en
ambos brazos y considerar el brazo de mayor valor para mediciones
futuras.
-
El brazalete debe ser colocado a 2 cm. por encima de la flexura del codo.
El tamaño del brazalete debe ser apropiado. (Ver tabla 2).
-
Insuflar hasta que desaparezca el pulso palpatorio (presión arterial
sistólica palpatoria),
-
Luego de determinar la presión sistólica palpatoria, una siguiente
insuflación debe ser hecha hasta 30 mmHg. por encima del nivel de
desaparición del pulso palpatorio y la velocidad del desinflado a 2 mmHg/
segundo.
-
La presión arterial sistólica (PAS), es el punto de aparición del primer ruido
o chasquido percibido con el estetoscopio sobre la arteria y la presión
arterial diastólica (PAD), es el punto antes de la desaparición de los ruidos.
Se debe obtener al menos tres registros de presión arterial sistólica y
diastólica en intervalos de dos minutos. Considerar el valor promedio para
el análisis y clasificación final.
-
Además, medir la PA al menos tres (3) minutos después de ponerse de
pie en personas con diabetes mellitus, sospecha de hipotensión ortostática
y en personas adultas mayores.
TABLA N°2: TAMAÑO DE BRAZALETE (ADULTOS):
Circunferencia del brazo.
Brazalete (cámara de aire)
22 a 26 cm
12 x 22 cm.
27 a 34 cm.
16 x 30 cm.
35 a 44 cm.
16 x 36 cm.
16
45 a 52 cm.
16 x 42 cm.
6.2.5 Estratificación del Riesgo Cardiovascular:
Recordar que un mejor control de la HTA puede no mejorar sustancialmente el
riesgo cardiovascular de un individuo. La PA debe considerarse como un
componente mós del perfil de riesgo de la persona. Además, la HTA coexiste a
menudo con otros faCtore5 de riesgo cardiovascular, sobretodo metabólicos
como dislipidemia, diabetes y obesidad. En la Tabla N° 3 se describe las variables
para la estratificación de riesgo.
TABLA N° 3: VARIABLES PARA LA ESTRATIFICACIÓN DE RIESGO
Factores de Riesgo
-
Varones > 55 años
Cardiovascular
-
Mujeres > 65 años o menopausia precoz
(FRCV)
-
Tabaquismo
-
Dislipidemia
° Colesterol Total > 200 mg/dl o
Colesterol-LDL > 130 mg/dl o
° Colesterol-HDL en varones <40 mg/dl,
mujeres <50 mg/dl o
° Triglicérido >150 mg/dl
-
Historia
de
enfermedad
cardiovascular (ECV) prematura
en familiar de 1º grado ngina,
infarto
de
revascularización
miocardio,
miocárdica,
muerte súbita):
° En familiares varones < 55 años
° En familiares mujeres < 65 años
-
Obesidad abdominal (perímetro abdominal):
° En varones > 102 cm.
° En mujeres > 88 cm.
-
Glucosa sérica en ayunas mayor de 100 mg/dl
17
-
Síndrome metabólico (SM): 3 ó más de los
siguientes criterios:
° Obesidad abdominal
° Glucemia mayor de 100 mg/dl
° PA > 130/85 mmHg
° Colesterol-HDL en varones <40 mg/dl ,
Mujeres <50 mg/dl
° Triglicéridos séricos en ayuna >150 mg/dl
Daño
de
Órgano
-
Blanco (sub clínico)
Se
determina
acuerdo
a
Hipertrofia
ventricular izquierda
(ECG o
ecocardiograma)
de
-
íntima-media
la
>
0,9
mm)
o
placa
aterosclerótica
capacidad resolutiva
en el 2do o 3er nivel
Engrosamiento de la pared carotidea (espesor
-
de atención
Velocidad onda de pulso carótida-femoral > 12
mis
-
índice tobillo/brazo < 0,9
-
Incremento ligero de la creatinina sérica
(H:1,3-1,5 mg/dl; M:1,2-1,4 mg/dl)
-
Disminución del filtrado glomerular (< 60
mil/min/1,73 m‘) o depuración de creatinina en
24 horas (< 60 ml/min)
-
Microalbuminuria (30-300 mg/24 h; albúminacreatinina: H: 22, M: 31 mg/g)
Diabetes
-
Glucosa plasmática basal >126 mg/dl en
medidas repetidas o Glucosa plasmática
postsobrecarga oral >200 mg/dl
Daño
de
Blanco
Órgano
-
(clínico)
° Ictus Isquémico
° Hemorragia cerebral
Enfermedad
Cardiovasular
Renal
Enfermedad Cerebrovascular:
° Ataque Isquémico Transitorio
o
-
Enfermedad Cardiaca:
° Infarto de Miocardio
° Angina
18
° Revascularización coronaria
° Insuficiencia cardiaca congestiva
-
Enfermedad Renal:
° Nefropatía diabética
Deterioro renal (creatinina H > 1,5; M > 1,4
mg/dl)
-
Proteinuria (> 300 mg/24 h)
-
Enfermedad Vascular Periférica
-
Retinopatía avanzada:
-
o
-
Edema de papila
Hemorragias o exudados
6.3 Exámenes Auxiliares:
6.3.1
Patología Clínica:
Los exámenes rutinarios permiten identificar da ño de los órganos blancos
incluyen:
-
Hemoglobina, glicemia, creatinina, depuración de creatinina (calculada o
idealmente cuantificada), potasio y ácido úrico.
-
Determinación de niveles de lípidos después de 12 horas de ayuno (incluir
colesterol total, LDL colesterol, HDL colesterol y triglicéridos).
-
Examen de orina completa y microalbuminuria.
6.3.2
Exámenes especializados complementarios:
Electrocardiograma.
-
De no contar con |a factibilidad de realizar alguno de los exámenes
auxiliares, derivarlo al establecimiento de mayor resolución para su
ejecución, y posterior contrarreferencia.
6.4 Manejo Según Nivel de complejidad y capacidad resolutiva
-
El objetivo del manejo adecuado de la HTA, es alcanzar niveles de PA <
140/90 mmHg, lo que permitirá la reducción de las complicaciones
cardiovasculares.
19
-
En personas con diabetes, síndrome metabólico o con enfermedad renal,
se requiere que el nivel PA sea < 130/80 mmHg.
-
Es importante involucrar a la familia en el manejo integral de la persona con
hipertensión arterial.
6.4.1 Medidas generales y preventivas:
En el tratamiento es indispensable modificar los estilos de vida, que incluyen:
-
Mantener peso ideal.
-
Realizar actividad física.
-
Reducción de consumo de sal
-
Reducción de grasas saturadas Evitar consumo de alcohol
-
Eliminación del consumo de tabaco
Beneficios de las modificaciones en los estilos de vida (Ver Tabla 4):
-
Reduce los niveles de PA.
-
Mejora la eficacia de los fármacos antihipertensivos.
-
Disminuye el riesgo cardiovascular.
Las modificaciones en los estilos de vida individuales o combinados pueden lograr
efectos similares o superiores a los alcanzados por un fármaco antihipertensivo.
TABLA N° 4. MODIFICACIONES EN LOS ESTILOS DE VIDA PARA EL
MANEJO DE LA HIPERTENSION ARTERIAL
20
6.4.2
Terapéutica del deterioro cognitivo leve
Para el manejo de la HTA están incluidos los siguientes fármacos: Inhibidores de
enzima convertidora de angiotensina (IECA), bloqueadores de los receptores de
angiotensina (BRA), beta bloqueadores, bloqueadores de los canales de calcio
(BCC) y diuréticos tipo tiazidas. (Ver anexo N° 1, 2 y 3)
Esquema de Tratamiento Sugerido
El esquema de tratamiento propuesto, será aplicado a todo hipertenso que no
presente diabetes mellitus o daño (clínico o subclínico) de órgano blanco, en cuyo
caso la persona tendrá que ser referido al siguiente nivel de atención. Ver en la
Tabla N° 3 las Variables en la estratificación de riesgo.
Esquema 1: Si tiene menos de 3 factores de riesgo Cardiovascular e HTA Estadio
1 (Ver Tabla N° 3 y Flujograma):
Paso 1: Iniciar tratamiento con un IECA (Enalapril);
Paso 2: De no lograr el objetivo (PA< 40/90 mmHg), añadir un diurético (Hidro
clorotiazida);
Paso 3: De no lograr el objetivo, añadir un calcioantagonista (Amlodipino).
En cada caso se evaluará la respuesta terapéutica a las 4 semanas de iniciado
el tratamiento.
21
Esquema 2: Si tiene 3 ó más factores de riesgo cardiovascular o HTA Estadío 2:
Paso 1: Iniciar tratamiento combinado de un IECA (Enalapril) con un diurético
(Hidroclorotiazida);
Paso 2: De no lograr el objetivo, añadir un calcioantagonista(Amlodipino).
En cada caso se evaluará la respuesta terapéutica a las 2 a 4 semanas, de
iniciado el tratamiento. Si a pesar del uso de los esquemas sugeridos y
modificación de los estilos de vida, no se logre un adecuado control de la presión
arterial tendrán que ser referidos al nivel de atención inmediato superior.
Para la dosis y frecuencia del antihipertensivo a utilizar ver Anexo N° 3.
6.4.3
Efectos adversos o colaterales con el tratamiento:
En el tratamiento antihipertensivo se debe tener en cuenta los efectos adversos
o indeseado que aparece con las dosis habitualmente utilizadas, los cuales están
relacionados con factores dependientes del propio medicamento: dosis, duración
del tratamiento, vía de administración (oral, sobre la piel, inyectable, etc.) y/o
factores dependientes del paciente: edad, sexo, etnia, estado de salud,
embarazo, lactancia.
Los principales efectos adversos de los medicamentos antihipertensivos se
describen en el Anexo 1: Fármacos para el tratamiento de la hipertensión arterial,
y
Anexo
N°
2:
Indicaciones
y
contraindicaciones
de
los
fármacos
antihipertensivos.
6.4.4 Manejo según nivel de complejidad y capacidad resolutiva.
Primer Nivel de Atención
-
Realizar actividades de información, educación, y comunicación en la
población general y/o con factores de riesgo cardiovascular.
-
Promover los cambios de estilo de vida en personas con factores de riesgo
cardiovascular.
-
Realizar tamizaje de hipertensión arterial en la población.
22
-
Identificar los factores de riesgo: según las variables de estratificación
{Tabla N° 3)
-
Manejo integral de hipertensos no complicados (cambio de estilo de vida,
participación del núcleo familiar, adherencia al tratamiento, entre otros).
-
Se referirá a establecimientos de salud de mayor resolución a pacientes
que presenten los siguientes problemas:
o Alto riesgo cardiovascular con presencia de múltiples factores de
riesgo.
o Los pacientes que requieren manejo de hipertensión arterial con
daño de órgano noble (hipertrofia ventricular izquierda, disfunción
ventricular izquierda, insuficiencia renal crónica no terminal) serán
referidos a centros de tercer nivel.
o Manejo de pacientes con complicaciones vasculares agudas
(síndromes
coronarios
agudos,
insuficiencia
cardiaca
descompensada, accidentes cerebro vasculares, disección de
aorta, etc.).
o Manejo de paciente con insuficiencia renal crónica terminal.
o Manejo de pacientes con hipertensión severa o refractaria al
tratamiento
Segundo Nivel de Atención (Referencial)
- Realizar actividades de información, educación, ycomunicación a la
población en general y/o con factores de riesgo cardiovascular.
- Promover los cambios de estilo de vida en personas con factores de riesgo
cardiovascular.
- Realizar tamizaje de hipertensión arterial en la población.
- Manejo integral de hipertensos de estadio 1 y 2 con o sin complicaciones
crónicas y/o factores de riesgo cardiovascular.
- Se referirá a establecimientos de salud del tercer nivel de atención a
pacientes que presenten los siguientes problemas :
o
Manejo de pacientes con complicaciones vasculares agudas:
Síndromes
coronarios
agudos,
insuficiencia
cardiaca
descompensada, eventos cerebro vasculares, disección de
aorta, etc.
23
o
Manejo de pacientes con insuficiencia renal crónica terminal.
o
Manejo de pacientes con hipertensión severa o refractaria al
tratamiento.
Tercer Nivel de Atención (Referencial)
-
Manejo integral de hipertensos de estadio 1, 2 y complicados.
-
Manejo integral de hipertensos que presenten los siguientes problemas:
o Los pacientes que requieren manejo de hipertensión arterial con
daño de órgano blanco: Hipertrofia ventricular izquierda, disfunción
ventricular izquierda, insuficiencia renal crónica no terminal.
o Manejo de pacientes con complicaciones vasculares agudas:
Síndromes
coronarios
agudos,
insuficiencia
cardiaca
descompensada, eventos cerebro vasculares, disección de aorta,
etc.
o Manejo de paciente con insuficiencia renal crónica terminal.
o Manejo de pacientes con hipertensión severa o refractaria al
tratamiento.
6.5 COMPLICACIONES:
El exceso de presión en las arterias mantenida durante un período de
años y no tratada puede llevar a un gran número de complicaciones:
-
Corazón: Angina, infarto de miocardio, hipertrofia ventricular izquierda,
insuficiencia cardiaca.
-
Cerebro: Enfermedad vascular cerebral isquémica, hemorrágica o
embólica, demencia multiinfarto.
-
Riñón: Insuficiencia renal crónica, estenosis arterial renal,
microalbuminuria / proteinuria.
-
Sistema Vascular: Aneurisma de aorta, claudicación intermitente.
-
Ojos: Retinopatía hipertensiva
6.6 CRITERIOS DE REFERENCIA Y CONTRARREFERENCIA
Del Primer al Segundo Nivel
-
Pacientes con hipertensión arterial no controlada a pesar del
24
tratamiento instaurado.
-
Paciente con diabetes mellitus.
-
Paciente con sospecha de compromiso de órgano noble.
-
Paciente con urgencia hipertensiva no resuelta.
-
Paciente con aparición de complicaciones de HTA.
Del Segundo al Tercer Nivel
-
Hipertensión arterial severa o refractaria al tratamiento.
-
Disfunción ventricular izquierda aguda.
-
Insuficiencia renal crónica terminal.
-
Paciente con emergencia hipertensiva.
-
Paciente con sospecha de hipertensión arterial secundaria.
-
Paciente con complicaciones vasculares agudas.
Contrarreferencia.
-
Pacientes con estadío 1 y/ó 2 con complicaciones crónicas
estabilizados del nivel 3 al nivel 2 de atención.
25
6.7 Flujograma para el tratamiento de la Hipertensión:
VII.
ANEXOS:
26
Anexo 01
FÁRMACOS PARA EL TRATAMIENTO DE LA HTA
Diuréticos:
Los diuréticos son fármacos con buenatoIerancia,con pocos efectos metabólicos
adversos a las dosis necesarias y efectos beneficiosos sobre la morbilidad
cerebrovascular. Son la base de la terapia antihipertensiva en la mayoría de los
tratamientos.
Los diuréticos tipo tiazidas:
-
Reducen la presión arterial por disminución del vo|umen plasmático y la
resistencia arterial periférica.
-
Según
estudios
incluyendo
el
Antihypertensive
and
Lipid-
LoweringTreatmen£to Prevent Heart AttackTrial (ALLHAT), los diuréticos
no han sido superados en la prevención de las complicaciones
cardiovasculares secundarias a la hipertensión.
-
Los diuréticos incrementan la eficacia antihipertensiva de esquemas con
multifármacos (especialmente con los agentes bloqueante del sistema
renina angiotensina aldosterona), útiles en lograr el control de la PA.
-
A pesar de los resultados aún están siendo subutilizados.
-
Las tiazidas deberían ser la terapia inicial para la mayoría de pacientes
con hipertensión ya sea solos o en combinación con Inhibidores de Enzima
Convertidora de Angiotensina (IECA), Antagonista de Receptores de
Angiotensina II (BRA), beta bloqueadores (88) o Bloqueadores de Canales
de Calcio (BCC) (Nivel de evidencia A).
-
Las tiazidas no deberían ser usadas en pacientes con función renal menor
del 30%. Para este grupo los diuréticos de asa constituyen una alternativa
Inhibidores de Enzima Convertidora de Angiotensina {IECA):
-
Los IECA disminuyen la producción de angiotensina II y la actividad del
sistema nervioso simpático e incrementan la bradikinina.
27
-
Son de c|aro beneficio probado en disminuir la progresión de la
insuficiencia renal crónica y tener una poderosa influencia en el control de
la insuficiencia cardiaca progresiva, atenuando su morbilidad y mortalidad.
-
Su uso está recomendado, salvo contraindicación formal, en pacientes
hipertensos con insuficiencia cardiaca congestiva, disfunción ventricular
izquierda sintomática, post-infarto de miocardio y en nefropatía diabética
y no diabética (Nivel de evidencia A).
-
Causan tos seca no productiva en 20 % de los pacientes tratados e
hiperkalemia.
-
Se debe vigilar los niveles de creatinina y/o función renal y niveles de
potasio al inicio y periódicamente.
-
En pacientes con estenosis de arteria renal bilateral o en personas
monorrenos con estenosis de arteria renal deben evitarse los IECA. En
estos pacientes la tasa de filtración glomerular es dependiente del efecto
vasoconstrictor eferente de la angiotensina ll. Los IECA producen
vasodilatación de la arteriola eferente pudiendo disminuir la función renal.
Bloqueadores de Canales de Calcio:
-
Los bloqueadores de canales de calcio son agentes vasodilatadores.
-
Se clasifican en dihidropiridinas y no dihidropiridinas.
-
En contraste a las dihidropiridinas, los agentes no dihidropiridinas
(Verapamil y Diltiazem) tienen efectos sobre el sistema de conducción
cardiaca, disminuyendo la frecuencia cardiaca y retardando la velocidad
de conducción, así como también tienen efecto inotrópico negativo por lo
que deben evitarse en pacientes con falla cardíaca.
-
Debe evitarse el uso de bloqueadores de canales de calcio de acción
corta. Se ha reportado que el nifedipino de liberación inmediata precipitó
28
eventos isquémicos y podría incrementar la mortalidad coronaria en
pacientes con infarto de miocardio previo.
-
Los bloqueadores deloscanales decalciodihidropiridínicos deliberación
sostenidaydeacción prolongada (Nifedipino de liberación sostenida,
Amlodipino, Felodipino) y los no dihidropiridínicos, muestran una eficacia
similar a los diuréticos y los Beta bloqueadores en las complicaciones
cardiovasculares de los hipertensos. (Nivel de evidencia A)
-
Su uso está recomendado en pacientes hipertensos con hipertensión
sistólica aislada, angina de pecho, insuñciencia arterial periférica,
embarazo, y en las personas de edad avanzada y en las de raza negra.
-
Los bloqueadores de calcio no dihidropiridínicos están contraindicados en
pacientes con bloqueo auricoventriculares (ll y III grado) e insuficiencia
cardiaca congestiva.
-
Las reacciones adversas más comunes en general son el edema
periférico, cefalea, bochorno, y con particular frecuencia con los
dihidropiridínicos. Con los no dihidropiridínicos las reacciones pueden ser
estreñimiento, bradicardia y trastornos de conducción.
Beta bloqueadores:
-
Existe máxima evidencia que los betabloqueadores están especialmente
indicados en pacientes hipertensos con cardiopatía isquémica (angina e
infarto de miocardio) (Nivel de evidencia A), insuficiencia cardiaca (Nivel
de evidencia A),taquiarritmias, taquicardia en reposo y excesiva
taquicardia en situaciones de estrés físico o emocional.
-
En insuficiencia cardiaca los betabloqueadores que han demostrado
beneficio en reducir morbi- mortalidad son Carvedilol, Bisoprolol y
Metoprolol (Nivel de evidencia A). La asociación de inhibidores ECA y beta
bloqueadores ha demostrado mejorar Ta calidad y tiempo de vida de
pacientes con disfunción ventricular izquierda sintomática.
29
-
Existe evidencia con ensayos randomizados que los beta bloqueadores
reducen sustancialmente la morbi-mortalidad cardiovascular en pacientes
hipertensos. Tal beneficio es igualmente evidente en pacientes diabéticos.
(Nivel de evidencia A).
-
Las reacciones adversas más comunes son bradicardia, broncoespasmo,
depresión, empeoramiento de los síntomas de insuficiencia arterial
periférica,
disfunción
eréctil,
enmascaramiento
de
síntomas
de
hipoglicemia o prolongación en la recuperación de hipoglicemia en
diabéticos. No deben usarse en pacientes con asma, enfermedad
pulmonar obstructiva crónica, insuficiencia cardiaca descompensada y
bloqueo cardiaco.
Antagonistas de Receptores Angiotensina II IBRA):
-
Los antagonistas de los receptores de angiotensina ll bloquean
selectivamente los receptores AT 1.
-
A diferencia de los IECA, los BRA bloquean el sistema renina angiotensina
pero no estimulan la bradikinina (vasodilatador y mediador de la tos por
IECA).
-
La angiotensina II contribuye en el cuadro clínico de hipertensión de dos
formas principales: 1) Acción vasoconstrictora directa e indirecta y 2)
Efectos trófícos (promueve el crecimiento) sobre el corazón y vasos
sanguíneos.
-
La eficacia de los BRA es similar a otras clases principales de agentes
antihipertensivos, pero con menos efectos adversos.
-
Originalmente mostrados como agentes alternativos en caso de
intolerancia a los IECA por la presencia de tos, se ha ampliado
notablemente su espectro de cardio, nefro y neuroprotección (hipertroña
30
ventricular izquierda, accidente cerebrovascular isquémico, insuficiencia
cardiaca,
entre
otras);
y
tiene
las
mismas
indicaciones
y
contraindicaciones.(Nivel de evidencia A).
-
Los BRA han demostrado ser eficaces para . la nefroprotección en
pacientes con diabetes tipo 2 y recientemente han sido incluidos como
terapia de primera línea en pacientes diabéticos tipo 2 que presentan
proteinuria y microalbuminuria. (Nivel de evidencia A).
-
Las contraindicaciones para su uso son embarazo, hiperkalemia y
estenosis bilateral de arteria renal.
En los casos de prevención secundaria (enfermedad coronaria y
cerebrovascular) está indicado el empleo de ácido acetil salicílico a bajas
dosis (75 a 100 mg/dia); y en los casos de prevención primaria, depende
del nivel de riespo cardiovascular y aquellos con riespo incrementado
también es pertinente. También se muestra beneficio en los pacientes
diabéticos.
El uso de estatinas está en función del riesgo cardiovascular total y el nivel
sérico de LDL colesterol, según las guías internacionales publicadas
ANEXO 2
INDICACIONES Y CONTRAINDICACIONES DE LOS FÁRMACOS
ANTIHIPERTENSIVOS
31
ANEXO 3
32
DOSIS Y FRECUENCIA DE ANTIHIPERTENSIVOS ORALES
VIII.
REFERENCIAS BIBLIOGRÁFICAS
33
1) Schoenenberger AW, Schoenenberger-Berzins R, Erne P. Arterial
hypertension
in
elderly
patients.
Cardiovascular
Medicine
2014;17(3):76-81.
2) Ramsay SE, Arianayagam DS, Whincup PH, et al. Cardiovascular risk
profile and frailty in a population-based study of older British men.
Heart 2015;101:616–622
3) Chen MA. Frailty and cardiovascular disease: potential role of gait
speed in surgical risk stratification in older adults. J Geriatr Cardiol.
2015;12(1):44-56.
4) Ruiz-Alejos A, CarrilloLarco RM, Bernabé-Ortiz A. Prevalencia e
incidencia de hipertensión arterial en Perú:revisión sistemática y
metaanálisis.Rev
Peru
Med
Exp
Salud
Publica.
2021;38(4):5219doi:https://doi.org/10.17843/rpmesp.2021.384.8502.
5) Forman JP, Stampfer MJ, Curhan GC. Diet and lifestyle risk factors
associated
with
incident
hypertension
in
women.
JAMA.
2009;302(4):401
6) Basile J, Bloch MJ. Overview of hypertension in adults. In: UpToDate,
Forman JP (Ed), UpToDate, Waltham, MA, 2015. Disponible en
http://www.Uptodate.com
7) Pant S, Neupane P, Ramesh KC, Barakoti M. Hypertension in the
elderly: Are we all on the same wavelength? World J Cardiol.
2011;3(8):263-6
8) Wolk R, Somers VK. Overview of cardiovascular aging. Advances in
Cell Aging Gerontology 2002;11:1-22
9) Elias ME, Robbins MA, Budge MM, Elias PK et al. Studies of Aging,
Hypertension and Cognitive Functioning: With Contributions from the
Maine-Syracuse Study. In: Mattson MP, Costa PT, and Siegler IC
34
editors. Advances in cell aging and gerontology. Vol. 14. Recent
advances in psychology and aging. Amsterdam. Elsevier. 2014
10) Beevers G, Lip G, O'Brien E. ABC of hypertension. The
pathophysiology of hypertension. BMJ 2001; 322; 912-916.
11) Bryan Williams. Hypertension guidelines in the UK: a time for change.
Br J Cardiol 2006; 13: 233-237.
12) Cornier M, Dabelea D, Hernández T, Lindstrom R, Steig A, Stob N et
al. The Metabolic Syndrome. Endocr Rev 2008 29: 777-822.
13) Camión M, Becerra L, Pinto J, Postigo R. Características clínicas y
seguimiento a 30 días de pacientes con síndrome isquémico coronario
agudo. Rev Soc Peru Med Interna 2007; vol 20 (2): 53-5”9.
14) Chobanian AV, Bakris GL, Black HR, et al, and the National High
Blood Pressure Education Program Coordinating Committee, The
Seventh Report of the Joint National Committee on Prevention,
Detection, Evaluation, and Treatment of High Blood Pressure.The
JNC 7report. JAMA. 2003; 289:3560- 3572.
15) Getz G, Reardon C. Nutrition and Cardiovascular Disease. Arterioscler
Thromb Vasc Biol. 2007; 27:2499-2506.
16) Grundy S, Cleeman J, Bairey Merz C, Brewer H, Clark L, Hunninghake
D, Pasternak R, Smith S, Stone N for the Coordinating Committee of
the Nationa! Cholesterol Education Program. Implications of Recent
Clinical Trials for the National Cholesterol Education Program. Adult
Treatment Panel III Guidelines Circulation. 2004; 110:227-239.
17) Jamerson K,WeberM, BakrisG, DahlofB, Pitt B, et al. Benazepril plus
amlodipine or hydrochlorothiazide for hypertension in high-risk
patients. N. Engl . Med 2008; 359:241 7-28.
35
18) Lindholm Lh, Carlberg B, Samuelsson 0. Should b-blockers remain
first choice in the treatment of primary hypertension? a meta-analysis.
Lancet 2005; 366:T 545-53.
19) Mason Jm, Dickinson Ho, Nicolson Dj, Campbell F, Ford Ga, Williams
B. The diabetogenic potential of thiazide-type diuretic and beta-blocker
combinations in patients with hypertension. J Hypertens. 2005:3:177781.
20) Mancia G, De Backer G, Dominiczak A, Cifkova R, Fagard R,
Germano G, Grassi G et al. 2007 Guidelines for the Management of
Arterial Hypertension. The Task Force for the Management of Arterial
Hypertension of the European Society of Hypertension (ESH) and of
the European Society of Cardiology (ESC). Journal of Hypertension
2007, 25:1105—1187.
21) Ministerio de Salud Brasil, Cuaderno de Atención Básica N° 15,
Departamento de Atención Básica, Secretaría de Atención de Salud,
2006
22) Onusko E. Diagnosing Secondary Hypertension. Am Fam Physician
2003; 67:67-74.
23) Perkovic V, Huxley R, Wu Y, Prabhakaran D, MacMahon S. The
Burden of Blood Pressure-Related Disease: A Neglected Priority for
Global Health. Hypertension 2007; 50:991-997.
24) Staessen J; Kuznetsova T; Stolarz K. Hypertension Prevalence and
Stroke Mortality Across Population. JAMA. 2003; 289(18):2420-2422.
25) Staessen J, Wang J, Thijs L. Cardiovascular protection and blood
pressure reduction: a meta-analysis. Lancet 2001; 358: 1305—15.
26) Williams B, Poulter Nr, Brown Mj et al. Guidelines for management of
hypertension: report of the fourth working party ofthe British
36
Hypertension Society, 2004-bhs iv. J Hum Hypertens 2004; 18:13985.
27) World Health Organization, International Society of Hypertension
Writing Group. 2003 World Health Organization (WHO)/International
Society of Hypertension (ISH) statement on management of
hypertension. Journal of Hypertension 2003; 21: 1983-1992.
GUIA DE PRÁCTICA CLÍNICA DE DIAGNÓSTICO Y TRATAMIENTO DE LA
DEPRESIÓN EN EL ADULTO MAYOR
I.
FINALIDAD
La presente guía tiene como finalidad dar las recomendaciones sobre el
diagnóstico y tratamiento de la Depresión en los Adultos Mayores, atendidos en
37
el servicio de Geriatría del Hospital Víctor Lazarte Echegaray de la ciudad de
Trujillo.
II.
OBJETIVO
Promover la detección, evaluación diagnóstico y tratamiento de la Depresión en
los Adultos Mayores, atendidos en el servicio de Geriatría del Hospital Víctor
Lazarte Echegaray de la ciudad de Trujillo.
III.
AMBITO DE APLICACIÓN
La presente Guía de práctica clínica tiene como ámbito de aplicación a la
población adulta mayor con sospecha o con diagnóstico establecido de
Depresión, que asisten al consultorio externo de Geriatría del Hospital Víctor
Lazarte Echegaray de Trujillo, incluyendo a la población referida de otros
servicios del hospital. También puede servir como referente para los demás
hospitales ESSALUD que brinden atenciones de salud en todo el Perú.
IV.
PROCESO O PROCEDIMIENTO A ESTANDARIZAR
(1) Diagnóstico de la Depresión en el Adulto Mayor.
(2) Tratamiento Depresión en el Adulto Mayor.
4.1 Nombre y código CIE 10:
La CIE-10 clasifica la depresión mayor dentro los trastornos del humor o afectivos
(F30- F39). La categoría F32 incluye el episodio depresivo y la F33 la de trastorno
depresivo recurrente, y la primera se subdivide a su vez en:
F32.0 Episodio depresivo leve
F32.1 Episodio depresivo moderado
F32.2 Episodio depresivo grave sin síntomas psicóticos
F32.3 Episodio depresivo grave con síntomas psicóticos
F32.8 Otros episodios depresivos
F32.9 Episodio depresivo, no especificado
V.
CONSIDERACIONES GENERALES
38
5.1 Definición:
La depresión se presenta como un conjunto de síntomas de predominio
afectivo (tristeza patológica, apatía, anhedonia, desesperanza, decaimiento,
irritabilidad, sensación subjetiva de malestar e impotencia frente a las
exigencias de la vida) aunque, en mayor o menor grado, también están
presentes síntomas de tipo cognitivo, volitivo y somático, por lo que podría
hablarse de una afectación global psíquica y física, haciendo especial énfasis
en la esfera afectiva.
La posibilidad diagnóstica de un trastorno depresivo se suele plantear a partir
de datos observacionales poco específicos, como el deterioro en la apariencia
y en el aspecto personal, enlentecimiento psicomotriz, tono de voz bajo, facies
triste, llanto fácil o espontáneo, disminución de la atención, verbalización de
ideas pesimistas (culpa, hipocondría, ruina…) alteraciones del sueño y quejas
somáticas inespecíficas. La base para distinguir estos cambios patológicos
de los ordinarios, viene dada por la persistencia de la clínica, su gravedad, y
el grado de deterioro funcional y social.
Muchos casos de depresión son claramente apreciables en la práctica clínica,
aunque resulte difícil establecer su autonomía diagnóstica respecto a otras
entidades psicopatológicas. Así, por ejemplo, frecuentemente se percibe el
trastorno depresivo asociado a ansiedad con diversas combinaciones
sintomáticas en sus manifestaciones. La depresión también puede concurrir
con el abuso de alcohol y otras sustancias, y con algunas enfermedades
orgánicas cerebrales y sistémicas4. También es frecuente su asociación con
trastornos de la conducta alimentaria y algunos trastornos de la personalidad.
Además, es más común entre personas con enfermedad física crónica y la
relación entre ambas es recíproca, ya que los problemas físicos pueden
exacerbar la depresión y a su vez la depresión puede afectar negativamente
al curso de la patología física. La depresión también es un factor de riesgo
para algunas patologías físicas, como es el caso de las enfermedades
cardiovasculares.
39
La depresión se puede iniciar a cualquier edad, aunque su mayor prevalencia
se produce entre los 15 y 45 años, por lo que tiene un gran impacto en la
educación, la productividad, el funcionamiento y las relaciones personales. La
sintomatología del trastorno puede ser distinta con la edad: los jóvenes
muestran síntomas fundamentalmente comportamentales, mientras que los
adultos mayores tienen con mayor frecuencia síntomas somáticos.
5.2 Etiología:
Las causas son varias. Una es la pérdida de su vitalidad, cambio en su ritmo de
vida, disminución de sus funciones y capacidades. Otras son las pérdidas que va
teniendo a su alrededor de figuras significativas e importantes, como pude ser:
gente de su edad, de su pareja, la separación de los hijos y las familias, así como
pérdidas laborales. También repercute el inicio de una serie de enfermedades
crónico degenerativas que con la edad empiezan a llegar. La merma económica
puede ser factor predisponente para una depresión; no es lo mismo que sea
trabajador en activo a que tenga alguna limitante, como una pensión o que incluso
no tenga ninguna entrada económica.
5.3 Fisiopatología:
Se ha formulado que distintas circunstancias de naturaleza fisiológica pueden
influir sobre los pacientes y, a través de la modificación del funcionalismo
neurofísiológico y bioquímico, son capaces de determinar cambios que darán
lugar a la manifestación de síntomas depresivos. De hecho, existe un volumen
importante de hallazgos que han sido implicados en la fisiopatología de la
depresión. Sin embargo, al igual que ocurre con el tema de la etiopatogenia, no
hay una definición clara de la situación. Durante las tres últimas décadas se ha
prestado una importante atención al estudio de los aspectos biológicos de la
depresión como:
-
La presencia de un patrón distintivo de síntomas y signos (alteraciones del
sueño, apetito, disminución de la libido, etc.) que sugieren que estos
40
síntomas neurovegetativos pueden ser debidos a una alteración de la
función en el cortex prefrontal, diencéfalo, y del sistema límbico.
-
La respuesta a los tratamientos somáticos tales como antidepresivos y
terapia electroconvu!siva, así como las observaciones de que la depresión
puede ser también inducida como efecto secundario por ingesta de
medicaciones.
-
De todos modos, conviene señalar que la identificación de una alteración
biológica no prueba necesariamente que exista una relación causal con la
depresión.
5.4 Aspectos Epidemiológicos:
Una de cada cinco personas sufrirá de depresión en algún momento de su vida
y en el Perú se calcula que un 12% aproximadamente la sufre. Según la
Asociación Psiquiátrica Americana, el 150/0 de las personas que la sufren
intentan el suicidio, La prevalencia de los trastornos depresivos en los
establecimientos de salud del MINSA fue de 4.8% y de 5.1 % en, cifras que están
muy por debajo a lo registrado a nivel mundial. Los estudios epidemiológicos de
la salud mental realizados por el Instituto Nacional de Salud Mental "Honorio
Delgado Hideyo Noguchi", reportan que la prevalencia de vida de trastornos
mentales según la CIE-10 respecto al episodio depresivo registró en Lima y
Callao 18.2%; en la Sierra 16.2% y en la Selva 21.4%
5.5 Factores de riesgo asociados:
1. Estilos de vida.
La carencia de estabilidad y/o afectividad puede desencadenar la
aparición de la depresión, en la infancia o en la adolescencia. Una familia
coherente y comunicativa minimiza los factores de riesgo, mientras que
las familias rígidas maximizan estos factores. Entre estas últimas figuran
los casos de inestabilidad emocional de los padres, especialmente de la
madre, ya que la depresión materna es un elemento determinante para la
depresión del niño, así como también las familias con continuos problemas
y discusiones, y las familias separadas, aunque en este caso los niños
tienden a asumir esta nueva situación al cabo de un año, si sus padres
41
mantienen una buena relación tras la separación. Una sólida red de
soporte social es importante para la prevención y recuperación de la
depresión, por consiguiente el soporte de la familia y amigos ha de ser
saludable y positivo. Un estudio de mujeres deprimidas demostró, sin
embargo, que los padres tanto sobreprotectores como muy distantes
estaban asociados a una recuperación lenta de la depresión. Los estudios
indican que las personas con creencias religiosas tienen un menor riesgo
de depresión. Por tanto, las fuentes menos estructuradas como la
meditación u otros métodos de autorrealización espiritual constituyen
parte de esta red de soporte social para la depresión.
2. Factores hereditarios:
Existe un mayor riesgo de padecer depresión clínica cuando hay
una historia familiar de la enfermedad, lo que indicaría una
predisposición biológica, riesgo algo mayor para las personas con
trastorno bipolar. Sin embargo, no todas las personas que tienen
una historia familiar tendrán la enfermedad, si tenemos en cuenta
que la depresión grave también puede ocurrir en personas sin
antecedentes familiares de este tipo, lo que sugiere que existen
factores adicionales causales de depresión, ya sean factores
bioquímicos, o ambientales que producen estrés, y otros factores
psicosociales.
VI.
CONSIDERACIONES ESPECIFICAS
6.1 Cuadro Clínico:
6.1.1 Signos y síntomas:
-
Tristeza patológica: Se diferencia de la tristeza como estado
de ánimo "normal", cuando alcanza un nivel tal que interfiere
negativamente en la vida cotidiana, tanto en lo social como
en lo familiar y sexual, presentándose sin motivo aparente o
tras un acontecimiento significativo; como una sensación
muy profunda en la que el paciente se siente como si hubiera
perdido el placer de vivir, con graves dificultades para brindar
amor o afecto, lo cual aumenta sus sentimientos de culpa.
42
-
Desgano y anhedonia: el sujeto se torna apático, "sin ganas
de vivir" y nada le procura placer.
-
Ansiedad: es la acompañante habitual del deprimido, que
experimenta una extraña desazón, como un trasfondo
constante. Cuando la ansiedad prima en el cuadro clínico,
estamos frente a una depresión ansiosa. Por el contrario,
cuando predomina la inhibición, se trata de una depresión
inhibida y quienes la padecen son personas malhumoradas,
irritables y agresivas.
-
Insomnio: al paciente le cuesta conciliar el sueño y, además,
se despierta temprano y malhumorado. En algunos casos,
que constituyen minoría, puede presentarse la hipersornnia
(exceso de horas de sueño).
-
Alteraciones del pensamiento: imagina tener enfermedades
de todo tipo; surgen ideas derrotistas, fuertes sentimientos
de culpa, obsesiones. El pensamiento sigue un curso lento y
monocorde, la memoria se debilita y la distracción se torna
frecuente.
-
Alteraciones somáticas: por lo coml~m surgen dolores
crónicos o erráticos así como constipación y sudoración
nocturna. Se experimenta una persistente sensación de
fatiga o cansancio.
-
Alteraciones del comportamiento: el paciente tiene la
sensación de vivir arrinconado, rurniando sus sinsabores.
Puede estar quieto, de manos cruzadas, o explotar en
violentas crisis de angustia o en ataques de llanto por
motivos insignificantes. Le resulta difícil tomar decisiones y
disminuye su rendimiento en el trabajo.
-
Modificaciones del apetito y del peso: la mayoría de los
pacientes pierde el apetito y, en consecuencia, provoca la
disminución de peso.
-
Pérdida del placer: en lo sexual, se llega a la impotencia en
el hombre o a la frigidez en la mujer; también disminuye y
tiende a desaparecer el disfrute en el trabajo, el deporte, los
43
juegos y otras actividades que anteriormente le eran
gratificantes.
-
Culpa excesiva: siente con exceso la carga de una culpa
inexistente, lo cual puede llevar a delusiones.
-
Pensamiento
suicida:
los
pacientes
presentan
una
preocupación exagerada por la muerte y alimentan
sentimientos autodestructivos.
-
Disminución de la energía: se produce un cansancio
injustificado, a veces con variaciones durante el día, muy a
menudo más acentuado por la mañana. Las personas
afectadas suelen sentirse más fatigadas por la mañana que
por la tarde.
6.1.2 Interacción cronológica:
-
En el adulto la depresión algunas veces presenta una causa
aparente y otras no. El ánimo depresivo puede surgir como
reacción ante una enfermedad física, ante el fallecimiento de
un ser querido, como consecuencia de estar sometido a un
estrés continuado o sobrecargado de trabajo, o secundaria
al hecho de estar desempleado o de tener problemas
económicos, de vivienda o en las relaciones con los demás,
pero a diferencia de lo que ocurre en la depresión, la reacción
es mucho menos intensa y de corta duración.
-
Los adultos mayores tienen mayor tendencia a presentar
sintomas melancólicos, como: pérdida del placer en todas o
casi todas las cosas, falta de reactividad a estímulos
placenteros,
empeoramiento
psicomotrices,
anorexia,
del
pérdida
humor,
de
alteraciones
peso,
agitación,
sentimientos de culpa excesivos o inapropiados. Los adultos
mayores tienen más probabilidades que la gente joven de
presentar, ideas delirantes del tipo de culpabilidad, nihilismo
(negación
de
toda
creencia),
persecución,
celos
y
44
melancolía. El suicidio esta muy ligado en esta época con la
depresión geriátrica.
6.1.3 DEPRESION ASOCIADA A OTRAS ENFERMEDADES:
-
Enfermedad de Alzheimer: Es una demencia que produce
una alteración neurodegenerativa que suele aparecer a
partir de los 65 años, aunque también puede presentarse en
personas más jóvenes. El 10 % de los enfermos de
Alzheimer padecen depresión mayor. Entre un 30% y 40%
pueden sufrir depresiones de menor gravedad o ciertos
síntomas depresivos. La depresión incrementa el deterioro
de las capacidades mentales. La depresión es un mal
común entre los que padecen de demencia. En las fases
iniciales de la enfermedad de Alzheimer la depresión reduce
la capacidad de pensar con claridad y de llevar acabo las
tareas de cada día. También aumenta la posibilidad de que
se produzcan cambios en el comportamiento, tales como
inquietud y agresión. Los adultos de edad avanzada que
padecen Alzheimer y depresión juntas, suelen mostrar
signos de mejoría lenta cuando se le administran
medicamentos antidepresivos.
-
Diabetes: Las personas que padecen diabetes son dos
veces más propensas a sufrir depresión, según señalan los
investigadores en la revista Diabetes Careo Mientras la
depresión afecta en la población general entre 10% Y 250/0
de mujeres y 5% a 12% de varones, entre diabéticos esta
cifra aumenta hasta 33%. Si bien cualquier enfermedad
crónica incrementa el riesgo de depresión, la correlación con
diabetes es particularmente fuerte debido a las numerosas
complicaciones de este padecimiento, así como a los
cambios en el estilo de vida que tienen que hacer quienes la
padecen.
-
Cáncer: La depresión es una afección comórbida, un
síndrome incapacitante que afecta aproximadamente del
45
15% al 25% de los pacientes con cáncer. Un elemento
crítico en el tratamiento del paciente es el poder reconocer
los índices presentes de depresión para poder establecer el
grado apropiado de intervención, que podría abarcar desde
una consejería leve, a grupos de apoyo, medicación o
psicoterapia.
-
Infarto de miocardio: La apanclon de un evento coronario
agudo conlleva efectos devastadores sobre el estado de
ánimo de las personas que lo sufren, debido a que las
personas que sufren un infarto suelen ser personas que
hasta ese momento se consideraban sanas, y a partir de ese
momento se encuentran sometidos a una terapia médica
muy agresiva. Esto hace que frecuentemente estos
pacientes presenten trastornos depresivos de diversos
grados.
-
HIV/AIDS: Casi el 85% de los individuos infectados por HIV
exhiben algún síntoma de depresión durante el curso de su
enfermedad. El diagnóstico de depresión en la enfermedad
por H IV puede ser complicado por factores como: tristeza
apropiada en relación con una enfermedad que amenaza la
vida, aflicción aguda y duelos múltiples, u otras reacciones
psicológicas. Existen otros diagnósticos que también deben
ser
considerados,
como:
depresión
debida
a
una
enfermedad médica general, a abuso de sustancias o a
medicación relacionada al HIV, sepsis secundaria a
infección
oportunista,
neoplasias
sistémicas,
o
complicaciones a nivel del SNC. La ideación suicida en el
contexto de enfermedad por H IV no debería considerarse
una reacción normal o comprensible a tener una
enfermedad fatal y estigmatizante. Clínicamente, debería
ser vista como un signo de enfermedad depresiva.
6.2 Diagnóstivo:
46
6.2.1 Criterios de Diagnóstico:
Las pautas diagnósticas de acuerdo a la Clasificación Internacional de
Enfermedades - Décima Versión de la O. M. S. (C.I.E.-10)
a) Síntomas del Episodio depresivo:
• Humor depresivo
• Pérdida de la capacidad de interesarse y disfrutar de las cosas
(anhedonia)
• Disminución de la vitalidad con relación al nivel de actividad y cansancio
exagerado
• Pérdida de la confianza en si mismo y sentimientos de inferioridad
• Pensamientos de culpa y de ser inútil
• Trastornos de sueño (insomnio o hipersomnia)
• Trastornos del apetito (anorexia o hiperorexia)
• Pensamientos y actos suicidas.
b) Para el diagnóstico del episodio depresivo se requiere de una duración
de dos semanas; aunque períodos más cortos pueden ser aceptados
si los síntomas son excepcionalmente graves o de comienzo brusco.
c) Muchos ancianos que están deprimidos pueden quejarse de síntomas
físicos (dolores) u otros estados anímicos (confusión, agitación, ansiedad
e irritabilidad) relacionados con la depresión en lugar de quejarse de la
depresión. A menudo no pueden o no quieren expresar sus sentimientos
o incluso no son conscientes de que están deprimidos. Sus síntomas a
menudo son ignorados o confundidos con otras afecciones propias de los
ancianos, como el Alzheimer o la Enfermedad de Parkinson, la demencia,
alteraciones tiroideas, artritis, embolia cerebral, cáncer, enfermedades
cardiacas y otras alteraciones crónicas.
6.2.2 Diagnóstico Diferencial:
Se debe diferenciar la depresión clínica, que es lo suficientemente grave
e incapacitante para requerir intervención, de la tristeza o angustia, que
forman parte normal de la experiencia humana. La disfunción social u
47
ocupacional, o un nivel elevado de angustia distinguen la depresión de la
tristeza transitoria, que es una consecuencia de la vida normal. En
personas con tristeza los niveles de angustia y funcionalidad son
proporcionales al evento vital desencadenante. Entre la información de
importancia que distinguen la depresión, se incluyen: haber sufrido un
episodio depresivo previo o intento de suicidio; una historia familiar de
alteraciones del comportamiento; ausencia de apoyo social; haber
atravesado situaciones de la vida estresantes; abuso del alcohol u otras
sustancias adictivas y la concurrencia de enfermedad crónica, dolor o
discapacidad. Trastorno adaptativo con estado de ánimo depresivo: Surge
desencadenado por un estrés claramente identificable que ha tenido lugar
en las últimas semanas. La reacción desaparece bien por desaparecer el
suceso desencadenante o por alcanzar el paciente un nuevo nivel
adaptativo en su funcionamiento. Duelo no complicado: Se trata de una
reacción normal frente a una pérdida afectiva. A veces pueden aparecer
síntomas semejantes a la depresión mayor, principalmente ideas de culpa
(centradas en no haber hecho lo suficiente por la persona fallecida; nunca
tienen características delirantes). También ideas de muerte, más como
deseo de reunirse con la persona fallecida que como deseo de quitarse la
vida. Sólo si se prolonga un tiempo superior a seis meses o alcanza una
intensidad invalidante se considera que se ha complicado con depresión
y se tratará corno tal.
Una variedad de enfermedades y condiciones pueden tener semejanza
con un trastorno depresivo:
-
Farmacológicas Uso de corticosteroides; anticonceptivos;
reserpina; a-metildopa; anticolinesterasas; insecticidas;
abstinencia
fenotiazinas;
anfetamínica;
cirnetidina;
talio;
mercurio;
SIDA;
neumonía
indometacina;
cicloserina;
vincristina;
vinblastina
-
Infecciosas
viral;
hepatitis
viral;
mononucleosis infecciosa; tuberculosis
-
Endocrinas
Hipo-hipertiroidismo;
hiperparatiroidismo;
postparto; Enfermedad de Cushing (hiperadrenalismo);
48
Enfermedad de Addison (insuficiencia adrenal), diabetes
mellitus
-
Inmunológica Inmunológicas LES; artritis reumatoidea
-
Neurológica Esclerosis múltiple; Enfermedad de Parkinson;
trauma encefalocraneano; crisis convulsivas parciales
complejas
(epilepsia
del
lóbulo
temporal);
tumores
cerebrales; enfermedad cerebrovascular; demencia; apnea
del sueño
-
Nutricional Deficiencias vitamínicas (812 , C, ácido fólico,
niacina, tiamina)
-
Neoplásica Cáncer de cabeza de páncreas; carcinomatosis
diseminada
6.3 Exámenes Auxiliares:
En nuestro medio no se dispone de pruebas de laboratorio ni marcadores
biológicos que puedan utilizarse como medio para la detección rutinaria
para diagnosticar la depresión. El diagnóstico de la depresión es
fundamentalmente clínico. Existen sin embargo dos tipos de ayuda
diagnóstica:
1. Escalas auxiliares para evaluar la gravedad inicial y la evolución del
tratamiento.
2. Exámenes de laboratorio para confirmar el diagnóstico.
3. Pruebas psicológicas.
Ninguna de estas ayudas es indispensable.
La más conocida de las escalas es la Escala de la Depresión de Hamilton.
No es diagnóstica; consta de 17 ítems que se califican numéricamente.
Valora inicialmente la gravedad del cuadro y es útil como criterio objetivo
para evaluar el progreso del tratamiento.
Si bien existen varias pruebas paraclínicas las dos más útiles son:
49
• Prueba de supresión de la dexametasona (TDM) (versión abreviada).
Consiste en la determinación de los niveles de cortisol basal seguida de la
administración de 2 mg de dexametasona alrededor de las 12 m. Al día
siguiente se cuantifican nuevamente los niveles de cortisol plasmático a
las 7 a.m. y las 4 p.m. En condiciones fisiológicas la presencia de la
dexametasona en el organismo induce una reducción significativa en los
niveles de cortisol. En caso de no hacerlo, la prueba se considera positiva
(tanto el TDM como algunas condiciones de la corteza suprarrenal
producen este efecto).
• La tomografía cerebral por emisión de fotón simple (conocida por su sigla
en inglés: SPECT). Este examen de medicina nuclear consiste en la
evaluación cuantitativa del flujo sanguíneo cerebral.
Para el primer nivel de atención se dispone de diversas escalas de
autoevaluación, que realiza el propio paciente o el personal de los
establecimientos de salud, entre ellas contamos con la Escala de Salud
Personal (ESP) que fue validada y evaluada en población peruana que
identifica un trastorno mental a determinar. Asimismo se cuenta con el
Cuestionario de Autoaplicación (Self Report Question - SRQ) (Ver Anexo
2) que permite identificar grupos de signos y síntomas presentes y que si
sumado un puntaje, que indica el cuestionario, deberá ser evaluado por el
médico del establecimiento, quien confirmará o no la probabilidad
diagnóstica, entre ellas el de depresión.
6.4 Manejo Según Nivel de complejidad y capacidad resolutiva
6.4.1 Medidas generales y preventivas
La depresión afecta a entre un 50/0 y un 9% de la población adulta que
acude a la consulta médica y casi la mitad de estos casos no son
detectados ni tratados. Los factores de riesgo para la depresión incluyen
el sexo femenino, historia familiar de depresión, situación de desempleo y
enfermedad crónica.
Las medidas generales para la prevención de la depresión toman las
siguientes orientaciones:
50
a.- En la política social • la defensa de los grupos de población con alto
índice de malestar • la extensión del apoyo social informativo y emocional
a toda la población, en particular a los grupos de familias densos y con
limitadas oportunidades educativas.
b.- En la acción sanitaria:
• la facilitación de una calidad de vida suficiente a los enfermos somáticos
crónicos
• la supresión del consumo de alcohol y otras drogas
c.- En el trabajo
• la organización empresarial con un suficiente grado de intercomunicación
personal a todos los niveles
Medidas individuales preventivas
El desenvolvimiento adecuado ante el stress es muy importante, tanto que
en la depresión situacional se puede utilizar como el referente selectivo de
máximo riesgo depresivo el índice de vulnerabilidad de la personalidad en
relación con el estrés, conjugándose dos variables: el individuo y el
ambiente.
La dedicación de un tiempo suficiente a la relación social para poder
construir un soporte sociofamiliar, que sirva de amortiguador a los factores
psicosociales determinantes de depresión es una actividad que siempre
debe ser considerada. Esta especie de amortiguador brinda al sujeto
apoyo social de tipo emocional, instrumental e informativo. Aquí nos
referimos sobre todo al apoyo emocional, capaz de contrarrestar la
sensación de soledad. La orientación preventiva idónea de este tipo de
intervención se evidenciará por el cultivo de una verdadera comunicación
con los familiares, los amigos y los compañeros, que debería ser
estructurada como vínculo confidencial al menos con relación a dos
personas.
51
La práctica sistemática de un grado de ejercicio físico suficiente para
prevenir la depresión va desde una actividad deportiva hasta contentarse
con un paseo acelerado o el andar rápido en los ratos de ocio, medida
esta última recomendable a quienes no disponen de preparación para el
deporte o que están afectados por algún proceso de debilidad física.
Este plan de movimientos activos toma un sentido antidepresivo cuando
se practica al menos con una frecuencia de tres o cuatro veces a la
semana con una duración entre veinte y cuarenta minutos. Sus efectos
beneficiosos antidepresivos son múltiples: la elevación de la autoestima,
el refuerzo positivo de la imagen corporal, la estimulación de la capacidad
de autocontrol, la oxigenación de todo el organismo, la mejora de la
circulación en el sistema nervioso central, el incremento de las tasas
cerebrales de noradrenalina y otros neurotransmisores y el aumento
plasmático del colesterol bueno (HDL).
La eficacia antidepresiva del plan de movimientos o ejercicios deportivos
se potencia cuando su desarrollo se produce al aire libre (actividad física
aeróbica) y en presencia de la luz natural. Para los más recalcitrantes a
abandonar el sedentarismo se les puede recomendar el ir andando al
trabajo, el aparcar distanciados del lugar de destino, el renunciar al uso de
ascensor y el pasear cuando se tengan ganas.
Dentro del estilo de vida regular aquí indicado, hay que respetar como un
hábito saludable el mantenimiento fijo de la hora de acostarse, como un
hábito, lo que supone una medida de prevención importante para la
preservación del ritmo sueño/vigilia. La preferencia por acostarse más bien
temprano y levantarse también temprano conduce al adelantamiento de la
presentación del sueño lento, con lo que se facilita su sincronización con
el sueño rápido, a la par que se evita la desincronización causada por la
presentación precoz del sueño rápido, el marcador biológico más
constante en el síndrome depresivo. Las comidas regladas por una dieta
normocalórica no dejan de ser operativas en la prevención de la depresión,
52
en parte directamente y en parte al evitar el sobrepeso, terreno muy
favorable para la incidencia de la depresión.
La autoprotección contra las enfermedades orgánicas toma aquí un
especial énfasis en las cuatro clases de procesos somáticos más
propensos a complicarse con un estado depresivo: los sumamente graves,
los crónicos y debilitantes, los extremadamente dolorosos y los cerebrales.
Debe conocerse además que el efecto depresógeno producido por el
trastorno somático en sí es a menudo potenciado por el influjo de los
medicamentos empleados y mucho más por el consumo de alcohol u otras
drogas y por la limitación psicosocial impuesta por la dolencia somática en
forma de estrés, aislamiento, inactividad y brusco cambio en los hábitos
de vida, elementos que deben evitarse en la medida de lo posible.
6.4.2 Tratamiento Médico:
Se propone el uso de los inhibidores selectivos de la recaptación de
serotonina (IRSS) por carecer de efectos sobre la recaptación de
noradrenalina y sobre receptores colinérgicos, histaminérgicos y
adrenérgicos, por lo cual son mejor tolerados y facilitan el cumplimiento
del tratamiento a largo plazo. Además por tener una cinética lineal pueden
administrarse de inicio en la dosis terapéutica y mantenerse con una toma
única diaria. No poseen efectos cardiotóxicos ni disminuyen el umbral
convulsivo. No se han registrado casos letales por sobredosis con
monodroga. Así mismo se ha tenido en cuenta la accesibilidad económica
del usuario.
Plan A para depresión:
1. Iniciar con Fluoxetina: 1 tableta de 20 mg por las mañanas en forma
diaria.
2. Si en la cuarta semana la puntuación del Hamilton no mejoró a 13 o
menos, incrementar 1 tableta de Fluoxetina 20 mg al mediodía.
3. Si en la sexta semana la puntuación del Hamilton no mejora a 13 o
menos, derivarlo al Servicio de Psiquiatría o a un Centro Especializado.
53
4. Si la respuesta es favorable, mantener el tratamiento por 24 meses con
controles cada mes durante el primer semestre y luego al noveno mes,
al año, al año y medio y a los dos años de iniciado el tratamiento.
5. Al cabo de dos años, evaluar condiciones del paciente a fin de
continuar
o
suspender
consideraciones
actuales
gradualmente
de
la
el
tratamiento.
Asociación
Las
Psiquiátrica
Norteamericana (A.P.A.) para mantener o retirar el tratamiento son las
siguientes: Primer y segundo episodio de depresión: retiro gradual de
medicación. Tercer episodio de depresión o ser mayor de 45 años:
considerar mantener tratamiento de por vida.
Si la ansiedad y el insomnio no mejoran con la administración matutina
o aparece acatisia, se recomendaría su cambio. Si éste se hace de un
inhibidor de la recaptación de la serotonina (IRSS) a otro IRSS no es
necesario el período libre de droga antes de medicar con el siguiente
antidepresivo (wash out).
Plan B para depresión:
1. Iniciar con Sertralina a la dosis recomendada de 50 mg/día. Debe
ser administrada una vez al día y en la mañana.
2. Si en la sexta semana no se advierte modificación en la puntuación
del Hamilton para depresión a 13 o menos, transferirlo al Servicio
de Psiquiatría o a un centro especializado.
Los IRSS pueden ser asociados a ansiolíticos durante las dos
primeras semanas de tratamiento, cuando la depresión se
acompaña de manifestaciones de ansiedad de moderada
intensidad. Podría considerarse en este caso el empleo de
Clonazepan en dosis de 2 mgl día como promedio, en dosis
fraccionada mañana y noche o sólo por la noche.
6.4.3 Signos de alarma
54
En los pacientes con mayor riesgo de suicidio la selección inicial del
antidepresivo
es
un
punto
de
particular
importancia.
Estudios
observacionales sugieren que los ATC más antiguos como amitriptilina son
más tóxicos en sobredosis y tienen mayor probabilidad de causar muertes
que los ISRS. Actualmente no hay datos suficientes que relacionen los
ISRS con comportamientos suicidas. Además, hay que tener en cuenta
que el riesgo de suicidio puede incrementarse en las fases iniciales de
tratamiento con cualquier antidepresivo y la sobredosis de cualquiera de
estos fármacos puede ser fatal. A este respecto es importante tener
precaución con el número de envases prescritos al inicio del tratamiento
en algunos pacientes a fin de evitar un intento de suicidio por sobredosis.
6.4.4 Criterios de alta
Criterios de alta para depresión: Dos años después de evidencia clínica
de resolución de la crisis. Escala de S.R.Q.- 18, puntúa menos de 9.
Escala de Hamilton para depresión puntúa 7 o menos. Criterios de
seguimiento de control para depresión: Menos de dos años después de
evidencia clínica de resolución de la crisis. Escala de Hamillon para
depresión puntúa 13 o menos.
6.4.5 Pronóstico:
Aproximadamente el 70 por ciento de los pacientes con depresión mayor
responden al tratamiento de primera línea con monoterapia farmacológica.
Del 30 por ciento restante que no responde al tratamiento inicial, un
número importante responde con clases alternativas de antidepresivos.
Sin embargo, y a pesar de todos estos resultados, también es necesario
señalar que existe un importante porcentaje de pacientes que no se
beneficia de estos progresos. Los datos de algunos estudios señalan que
un alto número de pacientes con depresión de reciente diagnóstico no
recibe un tratamiento adecuado en términos de posología y duración, y
que muchos casos de los considerados rebeldes son realmente casos de
tratamiento inadecuado.
55
Estudios recientes afirman que un 15 por ciento de los pacientes con
depresión evolucionan a la cronicidad. No obstante, el tratamiento con
psicofármacos y/o psicoterapia, consiguen en la inmensa mayoría de los
casos, aliviar parcialmente o en su totalidad los síntomas. Una vez se han
superado los síntomas de la depresión convendrá seguir bajo tratamiento
antidepresivo el tiempo necesario para evitar posibles recaídas.
En algunos casos, el tratamiento deberá prolongarse de por vida. La
presencia de características psicóticas en el trastorno depresivo mayor
refleja una enfermedad severa y es un factor de pronóstico desalentador.
Sin embargo, comúnmente se tiene éxito a corto plazo, aunque
generalmente es de esperarse una recurrencia de los síntomas. En
términos generales, los síntomas de la depresión tienen una tasa más alta
de recurrencia que los de la psicosis y es posible que los pacientes deban
tomar medicamentos por mucho tiempo.
La depresión es una enfermedad frecuente entre los adolescentes y tiende
a seguir un curso crónico con recaídas en la etapa del adulto joven.
Además, con frecuencia se encuentra acompañada por otros trastornos
psiquiátricos encabezado por abuso de sustancias psicoactivas. Dada la
importancia de esta enfermedad entre las personas jóvenes, resulta de
vital importancia que los médicos mejoren su sensibilidad hacia el
diagnóstico y motiven a los pacientes para iniciar el tratamiento respectivo.
6.5 Complicaciones:
El 15% de los deprimidos termina suicidándose. Interacciones. La mas severa,
pero menos frecuente, corresponde a la administración concomitante de un IMAO
con un antidepresivo tricíclico (ATC). El síndrome resultante puede causar
toxicidad del SNC severa, con la presencia de hiperpirexia, convulsiones y coma.
Aunque se ha usado la asociación en forma segura, no se recomienda, aunque
se ha demostrado que esta terapia es más efectiva que la terapia de
antidepresivos tricíclicos solos.
56
6.6 Criterios de Referencia y contrarreferencia
6.6.1 Criterios de referencia
Depresión muy severa o severa de acuerdo a la puntuación de la
Escala de Hamilton para depresión o paciente con riesgo suicida:
transferencia a Hospital con Servicio de Psiquiatría o a un centro
especializado. Si el paciente presenta un estresor de difícil solución
a corto plazo considerar psicoterapia de apoyo una sesión semanal
por 8 semanas para manejo del t conflicto por los médicos tratantes
o psicólogo de acuerdo a las pautas enseñadas en el curso inicial
de capacitación. Si los conflictos persisten derivarlo al Servicio de
Psiquiatría o a un Centro Especializado.
6.6.2 Criterios de contrarreferencia
Estabilización clínica del paciente Remisión de riesgos para la
integridad del paciente.
6.7 Flujograma:
57
VII.
ANEXOS
58
59
VIII.
REFERENCIAS BIBLIOGRÁFICAS
60
1) Organización Mundial de la Salud (1992). CIE - 10 Trastornos Mentales y
del Comportamiento: Descripciones Clínicas y Pautas para el Diagnóstico.
Madrid: Meditor.1992.
2) Programa Anual 2000-2001 de Formación continuada acreditada para
Médicos
de
Atención
Primaria
Fisiopatología
de
la
depresión
http://www.medynetcom/elmedico/aula/tema19/depresion3.htm 7-07-06
3) Epidemiología de la Salud mental en el Perú. Instituto Nacional de Salud
mental
"Honorio
Delgado
-
Hídeyo
Noguchi"
-
http://www.mínsa.gob.pe/iesmhdhn/oeaide.htm 7 07-06
4) Henriksson M, Isometsa E, Hietanen PS Mental disorders in cancer
suicides. 1995
5) Lloyd-Williams M, Friedman 1. Depression in paliative care patients-a
prospective study. Eur J Cancer Care 2001
6) Manejo psiquiátrico de la infección por HIV y del SIDA. Fuente:
www.mednet. org uy/spu/revista/j un2002/02_ to. pdf.
7) Dr
Rozados
Laboratorio
bioquímico
(general,
neuroquímicos.
neuroendocrinos) http://www.depresion.psicomag.com/laborat bioq.php.
7-07-06
8) Javier León, MD Sección de Psiquiatría Fundación Santa Fe de Bogotá:
http://www.fepafem.org.ve/Guias_de_Urgencias/Alteraciones_psiquiatric
as/Depresion.pdf
9) Véliz, José (1996) Validez y Confiabilidad del Cuestionario de Autoreportaje de Síntomas (S.R.O.) en personal de Sanidad de la Policía
Nacional. Tesis de Maestría en Medicina de la Universidad Peruana
Cayetano Heredia. Lima - Perú.
10) Novara J.; Sotillo C.; Warthon D. Estandarización de las Escalas de Beck,
Hamilton y Zung para depresión en Lima Metropolitana. Instituto Nacional
de Salud Mental "Honorio Delgado - Hideyo Noguchi". Lima - Perú.
GUIA DE PRÁCTICA CLÍNICA DE DIAGNÓSTICO Y TRATAMIENTO DE
DEMENCIA EN LA ENFERMEDAD DE ALZHEIMER EN EL ADULTO MAYOR
I.
FINALIDAD
61
La presente Guía tiene como finalidad dar las recomendaciones sobre el Diagnóstico
y Tratamiento de la Demencia en la Enfermedad de Alzheimer para aquellas
personas que sufren pérdida de sus capacidades cognitivas, dispongan de una
atención con calidad y con garantía necesaria para que la continuidad de cuidados
a prestar sea posible.
II.
OBJETIVO
Promover la detención, evaluación, diagnóstico y tratamiento de la demencia en la
Enfermedad de Alzheimer de la persona adulta mayor.
III.
ÁMBITO DE APLICACIÓN
La presente Guía de Práctica Clínica tiene como ámbito de aplicación a la población
adulta mayor con sospecha de demencia por Enfermedad de Alzheimer que asisten
al consultorio externo del servicio de Geriatría del Hospital Víctor Lazarte Echegaray
incluyendo a la población referida de otros servicios del Hospital. También puede
servir como referente para los demás hospitales ESSALUD que brinden atenciones
de salud en todo el país.
IV.
PROCESO O PROCEDIMIENTO A ESTANDARIZAR
a) Diagnóstico de Demencia por Enfermedad de Alzheimer
b) Tratamiento de Demencia por Enfermedad de Alzheimer
Nombre y código CIE 10:
DEMENCIA EN LA ENFERMEDAD DE ALZHEIMER: F00.1
V.
CONSIDERACIONES GENERALES
5.1 Definición:
La enfermedad de Alzheimer (EA), es un trastorno neurodegenerativo
progresivo que ocasiona deterioro de la memoria, el pensamiento y el
comportamiento.
Presentan un cambio de las siguientes áreas: lenguaje, capacidad de toma
de decisiones, juicio, atención y otras áreas de la función mental y la
personalidad. Es el trastorno cognitivo más común en la ancianidad.
5.1.1 Tipos de EA:
Según su aparición, la EA se puede clasificar en dos tipos: 1) La EA familiar
(fAD) de inicio temprano (antes de los 60 años) y con un patrón de
herencia mendeliana (autosómica dominante) y 2) La EA de inicio tardío
o esporádico (sAD), que aparece después de los 60 años y en ausencia
de un patrón de herencia consistente. Menos del 1% de los casos de EA,
62
son de tipo familiar. Estos casos son debidos a mutaciones raras y
completamente penetrantes en tres genes distintos que codifican la proteína
precursora amiloide (APP) en el cromosoma 2, las proteínas presenilina-1
(PSEN1) en el cromosoma 14 y presenilina-2 (PSEN2) en el cromosoma 1.
La forma más prevalente de la enfermedad es la sAD y parece estar
influenciada tanto por los factores de riesgo genéticos comunes y raros como
por el medio ambiente. El factor de riesgo más común es el alelo e4 del gen
de la apoliproteína E (ApoE) y el riesgo aumenta en función del número de
copias de ApoE4.
5.2 Etiología:
En las últimas décadas, la hipótesis etiológica dominante ha sido la
denominada hipótesis amiloide, que atribuye la enfermedad al depósito
cerebral excesivo de la proteína β-amiloide (Aβ) en las placas neuríticas, junto
con la aparición de ovillos neurofibrilares de τ. La Aβ procede de una proteína
de mayor tamaño, la PPA, una glucoproteína presente en la membrana celular
y ampliamente difundida en el organismo, cuyo gen se encuentra en el brazo
largo del cromosoma 21. Fue identificada por primera vez en 1987. Existen tres
isoformas de la proteína: PPA695, PPA751 y PPA770. La primera de ellas es
la más frecuente en el cerebro. La secuencia de aminoácidos de la PPA es
característica de las proteínas de membrana con una porción extracelular. La
PPA es metabolizada a través de diferentes vías proteolíticas. La ruta más
frecuente, mediada por α-secretasas, conduce a la formación de péptidos
derivados de la PPA solubles (PPAs), que poseen una serie de funciones
reparadoras y promotoras del desarrollo celular. En cambio, la Aβ es un péptido
de 39-43 aminoácidos que resulta de la rotura de la PPA, realizada por β- y γsecretasas, con conocidas propiedades neurotóxicas, y que tiende a formar
agregados fibrilares insolubles creando placas de amiloide a través de un
proceso de polimerización y condensación en núcleos. Diversos estudios
avalan que los oligómeros solubles de Aβ se encuentran en equilibrio dinámico
con los depósitos fibrilares insolubles y que pueden unirse a diversos
componentes de membranas plasmáticas neuronales u otras estirpes celulares
(p. ej., vasculares) para inducir formas complejas de disfunción sináptica y
desorganización del funcionamiento de la red neuronal, a través de
mecanismos
que
pueden
incluir
una
alteración
de
la
respuesta
inmune/inflamatoria, la desregulación de los canales de calcio (elevación de
los niveles de calcio intracelulares) o la acumulación de elementos oxidantes (
Mucke y Selkoe, 2012 ).
63
La prueba principal de la capacidad patógena de Aβ radica en las formas
precoces debidas a mutaciones (APP, PSN1, PSN2), en las que se encuentra
una producción excesiva de la misma. Anteriormente se creía que las
mutaciones en las presenilinas conducían a una producción excesiva de Aβ42,
pero hoy se les atribuye la producción de péptidos más largos e insolubles,
como Aβ43. La presencia de τ hiperfosforilada es también una de las
características de la EA y resulta crucial para las manifestaciones clínicas del
Trastorno Neurocognitivo Mayor(TNM)-EA, que incluso se correlacionan mejor
con la presencia de ovillos que de placas, pero cada vez existen más datos
que sugieren que la taupatía ocurre de forma secundaria a la polimerización de
Aβ.
5.3 Fisiopatología:
Existe déficit de múltiples neurotransmisores; sin embargo, el más común
es la disminución en los niveles de acetilcolina, debido a una pérdida de
las terminales nerviosas colinérgicas presinápticas. Estos déficits
colinérgicos son más evidentes en las áreas del cerebro involucradas en
la memoria y la cognición, es decir, la corteza frontal y el hipocampo. La
importancia del sistema colinérgico para un funcionamiento cognitivo
óptimo está avalada por los resultados de estudios de biopsias y postmorten de pacientes con enfermedad de Alzheimer, que demuestran que
la pérdida de marcadores colinérgicos, como la AcetilColinTransferasa,
está correlacionada con la severidad de la disfunción cognitiva a lo largo
de la vida.
Actualmente existen dos teorías que tratan de explicar los déficits
cognitivos de la EA: Teoría de desconexión cortical y Teoría
colinérgica.
Teoría de desconexión cortical: La degeneración neurofibrilar en la
corteza entorrinal, portal cortical del hipocampo (HC), se distribuyen en las
cortezas II (que junto a la capa III forman la vía perforante hacia el HC) y
la región IV (que recibe la eferencia desde el HC) de manera que el HC
queda aislado de la neocorteza. Esto se une al déficit de glutamato y otros
neuropéptidos (neuropéptido Y, oxitocina, vasopresina y somatostatina) en
las cortezas de asociación (desconexión córtico-cortical) que correlaciona
con la afasia, la apraxia y la agnosia, así como con los trastornos
visuoespaciales y ejecutivos.
Teoría colinérgica: En estados avanzados se observa una disminución de
más de 90% de la actividad de la acetilcolinesterasa lo que identifica un
64
compromiso dramático del sistema colinérgico en esta enfermedad. Esto
ocasiona el deterioro mnémico inicial y progresivo. La degeneración
selectiva del núcleo basal de Meynert (principal eferencia colinérgica hacia
neocortex) y de los núcleos septal y de la banda diagonal de broca
(eferencia colinérgica subcortical, en especial hacia el HC) provocan un
déficit progresivo de la memoria anterógrada. Existen evidencias de
cambios tempranos en el flujo cerebral regional, lo que pudiera
relacionarse con la degeneración en la población colinérgica que tiene un
efecto regulador. Esto se conoce como teoría colinérgico-vascular
5.4 Aspectos epidemiológicos:
Se estima que la prevalencia mundial de la demencia es de hasta 24
millones, y se prevé que se duplicará cada 20 años hasta el año 2040. La
prevalencia de la EA en personas mayores de 65 años es del 5 –10%,
aumentando hasta el 50% después de los 85 años.
5.5 Factores de riesgo asociados:
Se han presentado diferentes hipótesis que demostraron que entre un 10-20
% de los casos de EA es de origen genético y que el 80 % restante está
relacionado con factores ambientales. Se especificó que los que más
contribuyen al riesgo de la EA serían: baja reserva cognitiva, hábito de fumar,
depresión, obesidad, consumo de alcohol, hipertensión y diabetes mellitus,
contribuyendo cada factor al riesgo de EA entre un 2-20 %
VI.
CONSIDERACIONES ESPECIFICAS
6.1 CUADRO CLÍNICO:
El comienzo del trastorno es típicamente insidioso, y el curso progresivo. En
general, se ven afectadas primero la memoria y las funciones ejecutivas, para
pasar luego al lenguaje, las capacidades visoespaciales y, finalmente, la
cognición social. En conjunto, la duración de la fase de TNM es de 7-10 años.
No obstante, también pueden aparecer variantes con predominio de
alteración de otras funciones, como el lenguaje o síntomas psiquiátricos y
alteraciones del comportamiento (Gale et al., 2018). Hasta el 90% de los
casos puede presentar algún tipo de trastorno psiquiátrico o del
comportamiento a lo largo del curso del TNM por EA. Por ejemplo, síntomas
como depresión, ansiedad o insomnio pueden ocurrir en cualquier momento
65
de la evolución. Otros síntomas, como fenómenos de tipo psicótico (delirios,
alucinaciones), negativismo, irritabilidad, agresividad o deambulación
errática, son frecuentes en las fases medias y avanzadas. La pérdida
funcional es progresiva, comenzando por las actividades instrumentales
avanzadas, para concluir en un estado de dependencia absoluta. Los
síntomas neurológicos, como mioclonías, disfagia, alteraciones de la
motricidad (marcha), rigidez o crisis epilépticas, son característicos de las
fases más avanzadas. Contamos, por lo tanto, con cuatro tipos de síntomas:
cognitivos, psiquiátricos, funcionales y neurológicos.
6.2 DIAGNÓSTICO:
CRITERIOS CLÍNICOS:
Declive en el funcionamiento intelectual que abarca funciones como la
memoria,
el lenguaje, praxias, las gnosias, así como las funciones
ejecutivas y que con el paso del tiempo genera una pérdida o deterioro
global en cada uno de dichos procesos cognitivos.
Criterios del International Working Group(IWG) para el diagnóstico de
la EA:
Los avances de la investigación y las limitaciones del constructo clínico del
Deterioro Cognitivo Leve (DCL) han llevado al IWG a reclasificar la EA
como una entidad clínico-biológica, proponiendo el diagnóstico en estadios
66
precoces y preclínicos. Así, en el año 2007, Bruno Dubois et al. publicaron
los criterios de investigación para el diagnóstico de EA basados en la
presencia de una alteración significativa de la memoria episódica, además
de uno o más de los siguientes criterios que apoyan el diagnóstico: 1)
Presencia de atrofia del lóbulo temporal medial; 2) Biomarcador anormal
en el LCR: concentraciones bajas de β-amiloide, concentraciones
incrementadas de τ o fosfo-τ, o bien una combinación de estas tres; 3)
patrón específico funcional cerebral mediante PET, y 4) mutación
autosómica dominante probada con un familiar de primer grado afectado.
6.3 TERAPÉUTICA
DE
LA
DEMENCIA
POR
ENFERMEDAD
DE
ALZHEIMER:
NIVEL I
Establecimiento de salud que cuenta con la atención de un Médico Cirujano
General y no tiene apoyo de exámenes auxiliares de laboratorio e imágenes
67
para el diagnóstico. El paciente debe ser remitido a nivel II.
NIVEL II
Establecimiento de salud ya se puede contar con un Médico especialista
en Neurología o Geriatría. El diagnóstico clínico inicial puede ser realizado por
el especialista.
NIVEL III
Los pacientes deben ser evaluados clínicamente, se les debe realizar
estudios de imágenes, laboratorio y pruebas Neuropsicológicas para el
diagnóstico diferencial y en algunos casos el estudio genético. Así mismo el
tratamiento sintomático debe realizarse en este nivel.
MANEJO AMBULATORIO:
Prácticamente la totalidad de casos de pacientes con enfermedad de
Alzheimer pueden ser manejados ambulatoriamente independientemente
del estadio.
MANEJO EN HOSPITALIZACIÓN:
Aquellos casos que necesiten una modificación terapéutica y que puedan
ocasionar riesgo de deterioro de la función cognitiva o funcional, aquellos
con problemas médicos diferentes a la enfermedad en mención y que
requieran exámenes auxiliares especiales y/o tratamiento parenteral, aquellos
que requieran evaluación clínica por un período prolongado para evaluar
eficacia y/o seguridad del tratamiento.
MANEJO EN UNIDADES CRÍTICAS:
Cuando se presente alguna complicación o intercurrencia médica, distinta a la
enfermedad en mención, que requiera soporte ventilatorio, monitorización
cardiaca constante, evaluación permanente del estado de conciencia.
TRANSFERENCIA:
68
Cuando el paciente requiera procedimientos diagnósticos o quirúrgicos que no
se realicen en la institución.
MANEJO TERAPÉUTICO
•
Manejo específico:
Terapia física aplicada al estadio y en coordinación con el médico rehabilitador
y terapista físico, a un promedio de tres veces por semana.
El uso de fármacos específicos está indicado en estadio leve a moderado
(MMSE 12).
En la actualidad no existe tratamiento para curar la EA. Los tratamientos
farmacológicos actuales son paliativos, reduciendo los síntomas en un rango
aproximado de 6-12 meses. Existen 4 medicamentos aprobados por la FDA
para tratar los síntomas de la EA, diferenciados en dos grupos:
A)
inhibidores de la colinesterasa (ChEI): Donepezilo, Rivastigmina y
Galantamina. B) Modulador de receptor N-metil-D-aspartato (NMDAR) no
competitivo: Memantina.
A) Inhibidores
de
colinesterasa:
Las
personas
con
EA
pierden
progresivamente las neuronas colinérgicas del núcleo basal de Meynert y
otros núcleos septales distribuidos por la corteza, provocando un déficit
colinérgico general. Los ChEI aumentan los niveles sinápticos de
acetilcolina, ya que inhiben la enzima que degrada a esta molécula. El
donepezilo es el de mayor vida media y su dosificación es de una vez al
día. La rivastigmina se comercializa en forma de parche transdérmico de
liberación continua.
B) Modulador del NMDAR no competitivo: El NMDAR es un receptor
ionotrópico activado tras la unión simultánea de glutamato y glicina. La
activación del NMDAR causa la apertura de los canales catiónicos
postsinápticos, generando una corriente postsináptica excitadora. En
condiciones patológicas, la activación excesiva de NMDAR puede estar
asociada a toxicidad y muerte neuronal mediada por exceso de entrada de
calcio. La memantina es un antagonista del NMDAR no competitivo y
de baja afinidad. Inhibe la neurotoxicidad mediada por glutamato
desarrollada en el proceso de muerte neuronal existente en la EA, sin
69
bloquear la función fisiológica del receptor. Su uso está indicado en la EA
moderada a grave, actuando de forma leve sobre la actividad cognitiva y
síntomas neuropsiquiátricos. Los efectos clínicos observados con este
tratamiento podrían estar mediados por mecanismos alternativos no
identificados aún. Al igual que los ChEI, la memantina no actúa sobre la
progresión de la enfermedad y su uso no está recomendado en las fases
leves de la EA.
•
Estimulación cognitiva:
Se basa en la teoría de la neuroplasticidad. Incluye terapias de reorientación
en la realidad, intervenciones cognitivas dirigidas a los ejercicios diarios
(pasatiempos como las sopas de letras, o los juegos de atención), los juegos
de ordenador dirigidos (Brain training)
•
Ejercicio físico:
El ejercicio físico previene el deterioro cognitivo leve. Un mínimo de 2 horas
de paseo, 3 veces por semana.
•
Soporte sistémico:
Uso de cama con barandas en caso de enfermedad avanzada.
Dieta completa en estadios iniciales.
Dieta completa rica en fibra y residuo en estadio intermedio.
Dieta blanda rica en fibra y residuo en estado avanzado.
Consejería y apoyo psicológico en todos los estadios.
Consejería y apoyo psicológico a los familiares directos y cuidadores en todos
los estadios.
MONITOREO Y EVOLUCION DEL PROBLEMA
La mejoría o empeoramiento clínico se objetivará a través de la realización de
evaluaciones primarias de eficacia mediante la Escala de Evaluación de la
Enfermedad de Alzheimer – Subescala cognitiva (ADAS-Cog) y el Estudio
Cooperativo de la Enfermedad de Alzheimer – Impresión Clínica Global del
Cambio (ADCS-CGIC). Para las evaluaciones secundarias de eficacia se
realizará el Estudio Cooperativo de la Enfermedad de Alzheimer.
70
CRITERIOS DE EGRESO:
El paciente hospitalizado será dado de alta cuando se haya culminado la
evaluación clínica que motivó la hospitalización o se haya logrado un
tratamiento beneficioso estable, asimismo cuando el paciente haya
recuperado completa o parcial autonomía y se garantice el cumplimiento en
domicilio de las medidas farmacológicas y no farmacológicas prescritas.
El paciente deberá ser controlado de por vida ambulatoriamente a intervalos
no menor a un mes ni mayor a tres meses cuando sea posible, por lo que no
se cumple el criterio de alta definitiva.
6.5 COMPLICACIONES
Soporte a las funciones Vitales:
Evaluación de las funciones vitales como presión arterial, frecuencia cardiaca
y temperatura corporal.
En el caso de hipotensión arterial colocar suero hipertónico por vía parenteral
En el caso de distress respiratorio colocar por cánula nasal oxígeno a 3-4 litros
/ minuto
En el caso de hipertermia administrar medios físicos si esta no excede de
38,5°C y antipiréticos parenteral si es mayor a esta temperatura.
Si existe problemas de deglución colocar sonda nasogástrica.
Si existe retención urinaria colocar sonda vesical.
6.6 CRITERIOS DE REFERENCIA Y CONTRAREFENCIA
La referencia se hará:
NIVEL I
El paciente que acude a un puesto de salud con síntomas de fallas de
memoria, atención o dificultad para el desempeño en las actividades en la vida
diaria, agitación, se aplicarán las medidas especificadas anteriormente y se
hará referencia a un hospital de nivel II.
NIVEL II
71
En este nivel los pacientes serán estabilizados con medidas terapéuticas para
mejorar los síntomas neuropsiquiatricos, se realizará TAC. Los pacientes que
cursen con mala evolución clínica y requieran monitoreo o precisar el
diagnóstico genético serán referidos a un nivel III
6.7 FLUXOGRAMA
72
VII.
ANEXOS
73
74
MINI – MENTAL STATE EXAMINATION (MMS)-TEST DE FOLSTEIN
75
76
TEST DEL RELOJ
Consideramos el test como positivo
si el valor de la suma de las tres
puntuaciones (esfera, números y
manecillas) en las dos condiciones
del test (orden y copia) es menor o
igual a 15, y como negativo si la
suma de las puntuaciones es
superior a 15.
0
1
ESCALA DE DETERIORO GLOBAL (GDS-FAST)
2
3
4
5
VIII.
REFENCIA BIBLIOGRAFIA O BIBLIOGRAFIA
1-Hammer GD, McPhee SJ, Kwok Y. Fisiopatología de la enfermedad: una
introducción a la medicina clínica. 8th edition. ed. México, D.F: McGraw-Hill
Interamericana Editores, S. A. de C. V.s; 2020.
2-Long JM, Holtzman DM. Alzheimer Disease: An Update on Pathobiology
and Treatment Strategies. Cell (Cambridge) 2019 Oct 03,179(2):312-339.
3-Álvarez Sánchez Mario, Pedroso Ivonne, de la Fe Amado, Padrón Sánchez
Arnoldo, Álvarez Sánchez Marilet, Álvarez Lázaro. Fisiopatología de la
Enfermedad de Alzheimer. Revista Mexicana de Neurociencia Mayo-junio,
2008; 9(3): 196-201
4-Martín Carrasco, Manuel. Trastorno Neurocognitivo Mayor: Enfermedad de
Alzheimer. Psiquiatría Geriátrica, Tercera Edición. Elseiver-España. 2021.
Capítulo 11, 185-205
5-Cuevas-Cianca, Sofía Isabel, Pérez-Cortés, Erwin Josuan. Fisiopatología
del Alzheimer. Entorno UDLAP, núm. 7, 4-15, enero 2019.
6-García González, Claudia. Fisiopatología y tratamiento en la Enfermedad
de Alzheimer. Departamento de Ciencias Médicas Básicas. Facultad de
Farmacia. Julio 2020-2021.
7-Borrell, Faustina Mercedes Armenteros. Enfermedad de Alzheimer y
factores de riesgo ambientales. Revista Cubana de Enfermería. EneMar2017, Vol. 33.
8-Guías de Práctica Clínica de Diagnóstico y Tratamiento-Servicio de
Geriatría. Hospital Nacional Arzobispo Loayza.12 de marzo del 2021.
6
GUIA DE PRÁCTICA CLÍNICA DE DIAGNÓSTICO Y TRATAMIENTO DE
DIABETES MELLITUS CON COMPLICACIONES PERIFERICAS EN EL
ADULTO MAYOR
I.
FINALIDAD
II.
OBJETIVO
III.
AMBITO DE APLICACIÓN
IV.
PROCESO O PROCEDIMIENTO A ESTANDARIZAR
V.
CONSIDERACIONES GENERALES
VI.
CONSIDERACIONES ESPECIFICAS
VII.
ANEXOS
VIII.
REFERENCIAS BIBLIOGRÁFICAS
7
GUIA DE PRÁCTICA CLÍNICA DE DIAGNÓSTICO Y TRATAMIENTO DE
DEMENCIA VASCULAR, NO ESPECIFICADA EN EL ADULTO MAYOR
I.
FINALIDAD
La presente guía tiene como finalidad dar las recomendaciones sobre
el diagnóstico y tratamiento de la demencia vascular, observaremos el
componente vascular de los trastornos neurocognoscitivos en los
pacientes con múltiples enfermedades crónicas, es por ello, la
importancia de la actualización de esta guía y su aportación para el
entendimiento de las principales características de esta entidad
patológica.
II.
OBJETIVO
Promover la detección, evaluación, diagnóstico y tratamiento de la
demencia vascular de la persona adulto mayor.
III.
AMBITO DE APLICACIÓN
La presente Guía de Práctica Clínica tiene como ámbito de aplicación
a la población adulta mayor con sospecha de Demencia Vascular que
asisten al consultorio externo del Servicio de Geriatría del Hospital
Víctor Lazarte Echegaray incluyendo a la población referida de otros
servicios del hospital. También puede servir como un referente para
los demás hospitales ESSALUD que brinden atenciones en todo el
país.
IV.
PROCESO O PROCEDIMIENTO A ESTANDARIZAR
a) Diagnóstico de Demencia Vascular en el Adulto Mayor
b) Tratamiento de la Demencia Vascular en el Adulto Mayor
8
4.1 Nombre y código CIE 10:
Demencia Vascular: F01.9
V.
CONSIDERACIONES GENERALES
5.1 Definición:
El termino de demencia vascular comprende a todas aquellas demencias
secundarias a una o varias lesiones vasculares cerebrales, de cualquier
etiología (Molinuevo JL, 2009).
Este término incluye las siguientes entidades:
Demencia multi-infarto: demencia secundaria a la repetición de infartos
corticales en el territorio de arterias de calibre mediano o grande. Es la
forma de DV que más se ajusta al patrón clásico de demencia de inicio
agudo y evolución escalonada con empeoramientos relacionados con
nuevos eventos vasculares. Los déficits cognoscitivos y focales dependen
de la localización de los infartos.
Demencia por infarto estratégico: demencia debida a un infarto en una
localización tal que afecta a varias funciones cognitivas. Se incluyen las
demencias debidas a infartos en tálamo paramediano, giro angular, rodilla
de la cápsula interna, caudado bilateral o territorio profundo de la arteria
cerebral anterior.
Demencia vascular subcortical: acumulación de infartos lacunares o
lesiones vasculares de la sustancia blanca periventricular y profunda por
enfermedad de los vasos pequeños, habitualmente hipertensiva
(arteriolosclerosis); también puede ser diabética, por angiopatía amiloide,
angiopatías hereditarias como la arteriopatía cerebral autosómica
dominante con infartos subcorticales y leucoencefalopatía (CADASIL),
estados de hipercoagulabilidad o hipoxia. El curso suele ser progresivo
con deterioro mental de tipo frontosubcortical, signos focales, lentitud,
alteración de la marcha e incontinencia.
9
Demencia post-ictus: cualquier tipo de demencia que se desarrolla
después de un ictus.
Demencia mixta: el hallazgo anatomopatológico más frecuente en los
estudios poblacionales de demencia es la combinación de distintas
alteraciones (amiloidopatía, sinucleinopatía, taupatía y enfermedad
vascular). El término demencia mixta se aplica habitualmente a la
combinación de Enfermedad de Alzheimer y enfermedad vascular.
Demencia por lesiones hemorrágicas.
5.2 ETIOLOGIA
Los factores de riesgo cardiovascular que contribuyen para el desarrollo
de demencia vascular se han clasificado en modificables y no
modificables.
No modificables: Edad, sexo, grupo étnico (raza negra, hispana y
asiática), historia familiar.
Modificables: Hipertensión arterial, diabetes mellitus, hiperlipidemia,
fibrilación auricular, tabaquismo, obesidad, enfermedad carotidea,
homocisteinemia.
Se debe considerar a pacientes con alto riesgo para deterioro
cognoscitivo vascular a aquellos que presentan los siguientes factores de
riesgo:
Hipertensión.
Edad mayor a 65 años.
Hiperlipidemia.
Diabetes mellitus.
Evidencia clínica de evento vascular cerebral.
Hallazgos en imágenes de neurodiagnóstico de evento vascular cerebral
y/o leucoencefalopatía.
Daño a otros órganos diana (ojo, riñón, corazón).
10
Aquellos pacientes con cambios cognoscitivos o funcionales que son
clínicamente evidentes o reportados durante la realización de la historia
clínica.
Todos los pacientes con factores de riesgo cardiovascular y aquellos con
evidencia clínica de evento vascular cerebral o ataque isquémico
transitorio deberán ser considerados con alto riesgo para deterioro
cognoscitivo de origen vascular.
Los factores de riesgo para demencia después de un evento vascular
cerebral (EVC) incluyen: edad avanzada, bajo nivel educativo, sexo
femenino, factores de riesgo vascular, accidente cerebrovascular de
localización estratégica, la presencia de múltiples EVC y atrofia global o
temporal. Para la demencia vascular en ausencia de EVC, son similares
los factores de riesgo, pero toma mayor relevancia la edad avanzada y los
componentes que incrementan el riesgo cardiovascular.
CONSIDERACIONES ESPECÍFICAS
VI.
6.1 DIAGNÓSTICO CLÍNICO
El proceso diagnóstico para demencia vascular, inicia con la sospecha
de deterioro cognoscitivo, ya sea por parte del propio afectado o de
algún familiar cercano.
El diagnóstico de la demencia vascular es predominantemente clínico
y debe estar basado en 3 características principales:
1. Pérdida de función(es) cognoscitiva(s).
2. Lesiones cerebro-vasculares demostradas por algún método de
imagen.
11
3. Relación temporal entre las lesiones vasculares y la demencia (3
meses). Además de la exclusión de otras causas de demencia.
Los dominios cognoscitivos que deben de ser evaluados para el
diagnóstico de demencia son:
Atención y velocidad de procesamiento: atención sostenida,
dividida y selectiva, procesamiento de información, etc.
Función ejecutiva frontal: planeación, autocorrección, toma de
decisiones, memoria de trabajo, juicio, etc.
Memoria y aprendizaje: memoria inmediata, memoria reciente y
memoria de reconocimiento.
Lenguaje: producción, recepción, nominación, repetición,
sintaxis y gramática, etc.
Habilidad
perceptual
visuoconstruccional:
construcción,
percepción visual, razonamiento, etc.
Praxias, gnosias y percepción corporal: praxias, gnosias,
orientación izquierda/derecha, cálculo, reconocimiento facial,
etc.
Cognición social: reconocimiento de emociones, inhibiciones
sociales apropiadas, empatía, etc.
El diagnóstico de demencia debe incluir una evaluación cognoscitiva
objetiva formal con instrumentos validados.
La evaluación cognoscitiva es fundamental para el diagnóstico y debe
realizarse en todos los pacientes. Debe incluir las siguientes
herramientas:
1. Evaluación cognoscitiva global.
2. Evaluación detallada de los principales dominios cognoscitivos
afectados en daño vascular, incluyendo la memoria, funciones ejecutivas
y funciones instrumentales.
12
Se recomienda realizar la evaluación cognoscitiva global mediante alguna
de los siguientes instrumentos:
Evaluación del Estado Mental Mínimo (MMSE)
Evaluación Cognitiva Montreal (MoCA).
La evaluación de los principales dominios cognoscitivos afectados en
demencia vascular se podrá realizar con los siguientes instrumentos:
Criterios del NINDS/AIREN.
Criterios VASCOG.
Para establecer el diagnóstico de demencia, la MMSE posee una
sensibilidad del 60-80% y una especificidad del 80- 89%. El punto de corte
establecido para normalidad es ≥ 26 puntos para individuos con 5-8 años
de escolaridad y de 22 para individuos con 0-4 años de escolaridad. (Ver
Anexo 6.3, Cuadro 1).
La Evaluación Cognitiva Montreal (MoCA), tiene un desempeño similar al
MMSE, para el tamizaje del deterioro cognoscitivo. Valora la atención
/concentración, funciones ejecutivas,
contenido del pensamiento,
memoria, lenguaje cálculo y la orientación. Una puntuación de 25 o menor
(máximo de 30), se considera como deterioro cognoscitivo. Posee una
Sensibilidad 95% y Especificidad 45%. (Ver Anexo 6.3, Cuadro 2).
Es recomendable utilizar el instrumento MoCA para el diagnóstico de
pacientes con sospecha de demencia vascular debido a que evalúa de
manera más amplia la función ejecutiva.
Para facilitar el diagnóstico de demencia vascular, se recomienda utilizar
los criterios diagnósticos del National Institute of Neurological Disorders
and
Stroke/Association
Internationale
pour
la
Recherche
et
l’Enseingement en Neurosciences (NINDS/AIREN), de gran especificidad
13
(alrededor de 95%) pero muy baja sensibilidad (menos de 43%). (Ver
Cuadro 6.3, Cuadro 3).
También, se recomienda aplicar los criterios VASCOG para el diagnóstico
de demencia vascular. Debido a que en ellos no es necesario que exista
falla en la memoria y disminución de dos o más funciones cognitivas
afectadas. Un individuo con deterioro grave en un solo dominio
cognoscitivo, en algunos casos puede tener la discapacidad suficiente
como para justificar el diagnóstico de deterioro cognoscitivo vascular
mayor. (Ver Cuadro 6.3, Cuadro 4).
Es recomendable realizar la diferenciación entre demencia vascular,
enfermedad de Alzheimer o la co-existencia de las 2 entidades, para esto
se recomienda utilizar la Escala de isquemia de Hachinski, con el fin de
identificar de mejor manera el tratamiento y la prevención.
La Escala de isquemia de Hachinski es un instrumento clínico para
diferenciar la demencia tipo Alzheimer, demencia vascular o la coexistencia de ambas entidades consta de 13 elementos, cada uno genera
una puntuación distinta y de acuerdo a la suma de éstos se clasifica en:
1. Puntuación menor o igual a 4, sugiere demencia tipo Alzheimer. 2.
Puntuación mayor o igual a 7, sugiere demencia vascular. 3. Puntuación
de 5 y 6, sugiere la coexistencia de demencia vascular y enfermedad de
Alzheimer. (Ver Cuadro 6.3, Cuadro 5).
La Escala de isquemia de Hachinski tiene una sensibilidad del 89% y una
especificidad de 89% para diferenciar demencia vascular de Enfermedad
de Alzheimer, motivo para lo cual fue diseñada. Sin embargo, la
especificidad es baja al comparar demencia vascular con el patrón mixto,
es solo de 17%; al comparar enfermedad de Alzheimer con patrón mixto
fue 29.4%.
14
Es recomendable la realización de una evaluación neuropsicológica
detallada mediante pruebas específicas cuando existen discrepancias
entre la impresión clínica y las pruebas de tamizaje, dudas diagnósticas o
bien cuando las quejas se limitan a un solo dominio cognitivo o son de
corta evolución.
La depresión puede ser la causa subyacente o un contribuyente del
deterioro cognoscitivo. De la misma manera, puede ser un acompañante
de la demencia vascular como un resultado directo del daño neurológico.
En pacientes con deterioro cognoscitivo se deberá realizar una evaluación
de síntomas depresivos y del estado de ánimo en general con escalas
para tal efecto, como por ejemplo la Escala de Depresión Geriátrica
(Geriatric Depression Scale GDS). (Ver anexo 6.3, Cuadro 6).
En pacientes con deterioro cognoscitivo, es importante diferenciar entre
demencia, delirium y depresión, conocidas como las tres “D” ya que existe
la posibilidad que se asocien entre sí. (Ver anexo 6.3, Cuadro 7).
6.2 DIAGNÓSTICO POR IMAGEN
Aunque la evaluación clínica detallada es la base para el diagnóstico en
el paciente con sospecha de demencia, actualmente diferentes
sociedades a nivel mundial, recomiendan que la imagen estructural
debiera utilizarse en la evaluación de pacientes con sospecha de
demencia para excluir otras patologías cerebrales y ayudar a establecer
el subtipo.
De acuerdo con los criterios NINDS-AIREN, la evaluación con estudios de
neuroimagen es un elemento esencial para el diagnóstico de demencia
vascular y sin este componente, el diagnóstico de demencia vascular se
15
considera como “posible” en el mejor de los casos. (Ver Anexo 6.3,
Cuadro 3).
Se debe de realizar estudios de neuroimagen para el abordaje de los
pacientes con sospecha de demencia vascular.
Los estudios de neuroimagen permiten identificar causas de demencia
potencialmente corregible, reconocer cambios vasculares e identificar
hallazgos específicos que pueden facilitar el diagnóstico diferencial entre
los tipos de enfermedades neurodegenerativas.
Se deberá realizar una tomografía axial computarizada (TAC) y/o
resonancia magnética (RM) para la detección de componentes vasculares
en el paciente con deterioro cognoscitivo o demencia.
Debido a la prevalencia de demencia vascular y lesiones ocupativas,
realizar una TAC, seguida por RM en aquéllos casos necesarios, es el
abordaje más específico y con mejor perfil costo-efectividad.
El diagnóstico de demencia vascular sólo se debe realizar cuando las
lesiones vasculares puedan explicar el déficit cognoscitivo.
6.3 MEDIDA DE TRATAMIENTO NO FARMACOLÓGICO
Se recomienda la conformación de un equipo multidisciplinario
para la atención integral del paciente con demencia vascular. Se
sugiere la intervención de personal capacitado en geriatría,
psiquiatría, neurología, nutrición trabajo social, terapia física,
ocupacional y del lenguaje, según sea el caso y de acuerdo a la
capacidad institucional.
Se recomienda informar el diagnóstico al paciente y a su familia, ya
que se ha demostrado que la información recibida no predispone o
genera un trastorno en la persona afectada.
16
Se recomienda otorgar información a pacientes y familiares sobre
la demencia, su evolución, manifestaciones clínicas, tratamiento
integral y soporte al cuidador que les permita planificar su futuro.
Se deben implementar estrategias de rehabilitación adaptadas a
las limitaciones mentales y funcionales, así como de las
habilidades cognoscitivas remanentes del individuo e identificar las
necesidades y objetivos de los pacientes y los cuidadores.
En
pacientes
con
demencia
vascular
sin
limitación
en
transferencias y marcha, se recomienda la realización de actividad
física al menos 30 minutos 3 veces por semana.
En pacientes con demencia vascular la actividad física mejora los
síntomas neuro-psiquiátricos y la sobrecarga del cuidador.
Se recomienda un programa de ejercicio estructurado así como
actividades recreativas para mantener la funcionalidad y movilidad;
mejorar la calidad de vida y la autopercepción de bienestar.
El deterioro de las actividades básicas e instrumentales de la vida
diaria son una de las características principales de la demencia y
forma parte de la evaluación integral, además son útiles para
seguimiento del grado de deterioro o los cambios en la evolución
de la demencia.
Es importante trabajar sobre el ambiente en donde vive la persona
con demencia vascular, esto incluye:
Disminuir o eliminar los objetos que represente un riesgo físico
para el paciente;
Limitar el acceso a los toma-corriente, gas, tomas de agua
caliente.
Evitar modificaciones en el ambiente del paciente que lo sometan
a estrés innecesario.
Mantener los objetos en lugares fijos.
Limitar la presencia de estímulos sensitivos intensos.
Control adecuado de las salidas del hogar.
17
Señalización de los objetos o lugares de uso cotidiano.
6.4 MANEJO CONDUCTUAL DE LA DEMENCIA VASCULAR
El término “manejo conductual”, se utiliza para referirse a las
intervenciones estructuradas, sistemáticamente aplicadas por un tiempo
determinado llevadas a cabo por los cuidadores bajo la supervisión de un
experto en ésta área. Se ha demostrado que el manejo conductual reduce
la depresión, verbalizaciones repetitivas, agresividad y trastornos de la
alimentación hasta por 6 meses después de las intervenciones.
Se ha demostrado que el manejo conductual reduce la depresión,
verbalizaciones repetitivas, agresividad y trastornos de la alimentación
hasta por 6 meses después de las intervenciones.
Se
recomienda
utilizar
el
manejo
conductual
por
un
experto
(neuropsicólogo) para reducir la frecuencia de depresión y alteraciones en
el comportamiento en pacientes con demencia.
Se
recomienda
utilizar
el
manejo
conductual
por
un
experto
(neuropsicólogo) para reducir la frecuencia de depresión y alteraciones en
el comportamiento en pacientes con demencia.
La estimulación cognoscitiva se puede llevar a cabo a través de
actividades recreacionales (paseos, juegos, convivencia) o bien, de
manera formal:
Programas psicológicos de evocación de memoria.
Solución de problemas.
Actividades que fomenten la fluencia verbal (lectura). Estas estrategias
han demostrado tener, aunque limitado, un impacto positivo en las
funciones cognoscitivas.
18
Se debe ofrecer estimulación cognoscitiva a los pacientes con demencia
vascular
Las siguientes terapias no han demostrado utilidad en los pacientes con
demencia vascular:
Música
Terapia con luz
Aromaterapia
Estimulación multisensorial
6.5 TRATAMIENTO
FARMACOLOGICO
DE
LA
DEMENCIA
VASCULAR
6.5.1 TRATAMIENTO
DE
LOS
FACTORES
DE
RIESGO
CARDIOVASCULAR
-
Es razonable como medida de prevención primaria en paciente
con alto riesgo cardiovascular el adecuado control de diabetes,
hipertensión arterial y dislipidemia, así como la modificación en
los estilos de vida (reducción de peso en caso de obesidad,
cese del hábito tabáquico, disminución en el consumo de
alcohol) para prevenir la aparición de demencia vascular.
-
Las personas con deterioro cognoscitivo/demencia y evidencia
clínica o radiológica de enfermedad cerebrovascular deben
recibir tratamiento para factores de riesgo cardiovascular (ej.
Hipertensión, diabetes, otros). Estas medidas son eficaces en
prevenir nuevos eventos (prevención secundaria) más que en
mejorar la función cognoscitiva.
-
La
demencia
vascular
condiciona
menor
tiempo
de
supervivencia y mayor mortalidad, por lo que se recomienda
iniciar y mantener la prevención secundaria.
19
-
Se recomienda la disminución de la presión arterial para
disminuir
el
riesgo
de
demencia
post-enfermedad
cerebrovascular, así como controlar la hipertensión arterial en
adultos jóvenes para así disminuir el riesgo de demencia en
adultos mayores
-
El uso de medicamentos antihipertensivos (ej. IECA o ARA2)
ha demostrado reducir la tasa de deterioro cognoscitivo en
áreas específicas en adultos mayores con hipertensión.
-
Se recomienda mantener una presión arterial menor de 150/90
mmHg en adultos mayores, pero con presión diastólica mayor
a 60-65 mmHg, ya que presiones arteriales bajas incrementan
el deterioro cognoscitivo, probablemente por disminución en la
perfusión cerebral.
-
Existe menor evidencia con respecto al control de la
hiperglucemia o diabetes mellitus como tratamiento en la
demencia vascular. Al momento, no existe evidencia que
relacione el tipo o intensidad del tratamiento antidiabético con
la prevención o manejo de la demencia vascular en diabetes
mellitus 2.
-
Sin embargo, el aumento de 1% en Hb1Ac del nivel de control
en pacientes diabéticos, se asocia a mayor grado de deterioro
cognoscitivo.
-
Hasta que no se pruebe lo contrario, se recomienda alcanzar
un adecuado control glucémico para la prevención de
complicaciones asociadas a la diabetes, entre ellas, la
enfermedad cerebrovascular y el deterioro cognoscitivo
asociado a EVC.
-
El uso de estatinas para el tratamiento de la demencia vascular
no ha sido demostrado, a pesar de disminuir colesterol y su
efecto pleiotrópico en la función vascular. Al momento, no
existen
estudios
aleatorizados
que
hayan
demostrado
20
reducción en el deterioro cognoscitivo o demencia con el uso
de estatinas.
-
El uso de antiagregantes plaquetarios reduce el riesgo de
eventos cerebro-vasculares recurrentes. Sin embargo ningún
antiagregante plaquetario produce un efecto en la función
cognoscitiva y o en su declinación.
-
El clopidogrel no presenta los efectos adversos del dipiridamol
pero no es superior a aspirina en la reducción eventos cerebrovasculares.
-
Mientras que la eficacia del ácido acetil salicílico en la
prevención secundaria del evento vascular cerebral está
establecida, no hay estudios que demuestren la eficacia del
ácido acetil salicílico u otros antiagregantes plaquetarios en la
prevención o el tratamiento del deterioro cognoscitivo de la
demencia vascular.
-
Se recomienda usar antiagregantes plaquetarios de acuerdo a
indicación médica previa (ej. cardiopatía isquémica, EVC
previo) para prevención secundaria y disminuir riesgo de nuevo
EVC, pero no como manejo farmacológico para la demencia
vascular.
-
Algunos estudios han evaluado los efectos de un tratamiento
“multidimensional” que incluye aspectos geriátricos y la
identificación y reducción de todos los factores de riesgo
vascular modificables.
-
Se recomienda realizar un abordaje integral de los factores de
riesgo cardiovascular, que incluye: intervenciones en el estilo
de vida, ejercicio físico, suspensión de tabaquismo; y cuando lo
amerite, tratamiento con antiagregante plaquetario, estatinas y
tratamiento antihipertensivo.
21
6.5.2 TRATAMIENTO DE LA DEMENCIA VASCULAR
-
Las opciones terapéuticas actuales para limitar el déficit cognoscitivo en
demencia vascular, incluyen medicamentos desarrollados para la
Enfermedad de Alzheimer y que han probado eficacia para dicha
enfermedad. Los fármacos incluyen los inhibidores de acetilcolinesterasa
(Ach-i) y los antagonistas del receptor N-metil-D-aspartato (NMDA).
-
De manera general los Ach-i incrementan la cantidad disponible de
acetilcolina a nivel cerebral, incluyen al donepezilo, rivastigmina y
galantamina.
-
Los
antagonistas
NMDA
modifican
la
transmisión
neuronal
glutaminérgica, inhibiendo la excito-toxicidad y por lo tanto protegiendo
contra lesión neurológica. Actualmente solo incluye a la memantina.
-
Tanto los Ach-i como los antagonistas de NMDA han demostrado retrasar
el deterioro cognoscitivo, al menos de manera temporal, en la enfermedad
de Alzheimer, por lo que se ha traslapado su uso a otro tipo de demencias.
-
La galantamina (Ach-i) también ha demostrado utilidad discreta en la
demencia vascular, mejorando la cognición global incluyendo memoria y
función ejecutiva, sin embargo no se observó superioridad contra el
placebo para mejorar actividades de la vida diría.
-
Los Ach-i (rivastigmina, donepezilo y galantamina) producen pequeños
beneficios estadísticamente significativos en la cognición en estudios pero
con un significado clínico incierto en pacientes con demencia vascular
leve a moderada.
-
La memantina (inhibidor NMDA) se ha estudiado en demencia vascular
leve, moderada y severa. Un metaanálisis y una revisión sistemática,
concluyeron un beneficio pequeño con significado clínico incierto. Solo en
la revisión sistemática, el uso por 6 meses en demencia moderada a
severa, encontró beneficio clínico discreto.
22
-
La evidencia disponible actualmente a través de revisiones sistemáticas
concluye que puede haber un beneficio en ciertos aspectos específicos
de la cognición con el uso de estos agentes, sin embargo el uso
terapéutico para deterioro cognoscitivo vascular o demencia vascular no
está demostrado. Los agentes estudiados son:
-
Piracetam.
-
Vitamina B1.
-
Vitamina B6.
-
Vitamina B12.
-
Vitamina E.
-
Ácido fólico.
-
Ginkgo biloba.
-
Homeopatía.
-
Ácidos grasos.
-
Omega-3.
-
Nicergolina.
-
Pentoxifilina.
-
Citidindifosfocolina (citicolina).
No se recomienda la prescripción de los siguientes
suplementos con la intención de prevenir, mejorar o tratar el
deterioro cognoscitivo y/o demencia vascular:
-
Ginkgo biloba.
-
Vitaminas B1-B6-B12.
-
Ácido fólico.
-
Omega-3.
-
Ácidos grasos Tampoco se recomienda utilizar los siguientes fármacos
con la finalidad de tratar el estado cognoscitivo en la demencia vascular y
el deterioro cognoscitivo vascular:
-
Piracetam.
-
Nicergolina.
23
-
Pentoxifilina.
-
Citicolina.
-
Homeopatía.
-
Hasta el momento la suplementación con vitamina y/o folato no ha
demostrado ser efectiva para prevenir o mejorar la demencia por lo que
no se recomienda su utilización como tratamiento.
-
Para la elección tratamiento farmacológico de demencia vascular debe
considerarse el nivel de conocimiento del cuidador primario respecto a la
enfermedad.
-
Se debe investigar exhaustivamente la presencia de síndromes
geriátricos coexistentes en el adulto mayor con deterioro cognoscitivo,
que puedan confundirse con éste o empeorar su presentación clínica.
-
El término “síntomas conductuales y psicológicos de la demencia” se
utiliza para describir un espectro amplio de síntomas no cognoscitivos
como: apatía, depresión, ansiedad, psicosis o hiperactividad. Su
identificación es esencial para el diagnóstico y tratamiento.
-
Se recomienda evaluar los “síntomas conductuales y psicológicos de la
demencia” en cada paciente con sospecha de demencia vascular para
ofrecer un manejo integral de acuerdo al resultado de la valoración de
estos.
-
El tratamiento farmacológico de los “síntomas conductuales y psicológicos
de la demencia” se utilizará solo en presencia de síndromes específicos
o que impacten la calidad de vida o seguridad del paciente. Por ejemplo,
el uso de antipsicóticos (convencionales o atípicos) pueden ser útiles en
el manejo de la agresividad, psicosis o agitación psicomotriz.
6.5.3 PRONÓSTICO
-
Los pacientes con demencia vascular tienen mayor mortalidad que el
resto de la población y aquéllos con Enfermedad de Alzheimer de la
24
misma edad. Esto es debido a mayor riesgo de enfermedad coronaria y
de evento vascular cerebral recurrente.
-
Estudios de seguimiento a largo plazo indican que aquéllos pacientes que
desarrollan demencia después de un evento vascular cerebral presentan
menor supervivencia a largo plazo, muerte asociada a los trastornos
cognoscitivos y pérdida funcional en las actividades básicas e
instrumentales de la vida diaria.
-
La media de supervivencia para los pacientes con deterioro cognoscitivo
de origen vascular se estima en 3.5 años.
-
El 60% de los sobrevivientes de un evento vascular cerebral evolucionan
a demencia vascular y se relaciona con una disminución de las
actividades de la vida diaria básicas e instrumentales.
-
La demencia vascular se presenta en un 26% dentro de los primeros 3
meses posterior al evento vascular cerebral afectando de forma negativa
la recuperación y asociándose con un grado elevado de mortalidad,
alrededor de 61%.
-
La
progresión
del
déficit
cognoscitivo
y
el
tiempo
para
la
institucionalización es similar entre la enfermedad de Alzheimer y la
demencia vascular.
6.5.6 CRITERIOS DE REFERENCIA Y CONTRARREFERENCIA
-
En el paciente con diagnostico establecido de demencia vascular, se
recomienda evaluar la progresión del deterioro cognoscitivo por lo menos
cada 3 meses, dado que se presenta una amplia gama de
manifestaciones en cada paciente. Por lo anterior, se recomienda
reconocer con prontitud las necesidades del paciente y familiar para
derivar al personal de la salud correspondiente (geriatra, neurólogo,
psiquiatra, neuropsicólogo, nutriólogo, terapeuta ocupacional, físico y del
lenguaje) a segundo y tercer nivel de atención oportunamente.
-
En las unidades de primer nivel de atención que no cuenten con la
infraestructura suficiente para el cumplimiento de las recomendaciones de
25
la presente guía, deberán referir al paciente para su atención a otra unidad
de mayor capacidad resolutiva, en los términos de la regionalización de
los servicios y los lineamientos delegacionales en la materia.
-
En las unidades de primer nivel de atención ante la sospecha de demencia
vascular, el paciente deberá ser enviado al servicio de neurología o
geriatría para su evaluación y complementación diagnóstica.
VII.
ANEXOS
26
CUADRO 1 A
27
CUADRO 1 B
28
29
CUADRO 2
30
CUADRO 3
31
32
CUADRO 4
CUADRO 5
33
CUADRO 6
CUADRO 7
34
CARACTERÍSTICAS
DIFERENCIALES
ENTRE
DELIRIUM,
DEPRESIÓN Y DEMENCIA
35
ALGORITMO DEL TRATAMIENTO DE LA DEMENCIA VASCULAR
36
VIII.
REFERENCIA BIBLIOGRÁFICA O BIBLIOGRAFIA
1. Aalten P, Verhey FR, Boziki M, Brugnolo A, Bullock R, Byrne EJ, Camus
V, Caputo M, Collins D, De Deyn PP, Elina K, Frisoni G, Holmes C, Hurt
C, Marriott A, Mecocci P, Nobili F, Ousset PJ, Reynish E, Salmon E,
Tsolaki M, Vellas B, Robert PH. Consistency of neuropsychiatric
syndromes across dementias: results from the European Alzheimer
Disease Consortium. Part II. Dement Geriatr Cogn Disord. 2008;25
2. Abbatecola AM, Rizzo MR, Barbieri M, Grella R, Arciello A, Laieta MT,
Acampora R, Passariello N, Cacciapuoti F, Paolisso G. Postprandial
plasma glucose excursions and cognitive functioning in aged type 2
diabetics. Neurology. 2006
3. Allan LM, Rowan EN, Thomas AJ, Polvikoski TM, O'Brien JT, Kalaria RN.
Long-term incidence of depression and predictors of depressive
symptoms in older stroke survivors. Br J Psychiatry. 2013 Dec;203(6):45360.
4. Ballard C, Sauter M, Scheltens P, He Y, Barkhof F, van Straaten EC, van
der Flier WM, Hsu C, Wu S, Lane R. Efficacy, safety and tolerability of
rivastigmine capsules in patients with probable vascular dementia: the
VantagE study. Curr Med Res Opin. 2008
5. Ballard C, Corbett A. Management of neuropsychiatric symptoms in
people with dementia. CNS Drugs. 2010 Sep;24
37
6. Berminggham SL. The Appropiate Use of Neuroimaging in the Diagnostic
Work-Up of Dementia: an Economic Literature Review and CostEfecctiveness Analysis. On Health Technol Assess Ser. 2014; 14
7. Beynon R, Sterne JA, Wilcock G, Likeman M, Harbord R, Astin M, et al. Is
MRI better than CT for detecting a vascular component to dementia? A
systematic review and meta-analysis. BMC Neurol. 2012;
8. Birks J, McGuinness B, Craig D. Rivastigmine for vascular cognitive
impairment. Cochrane Database Syst Rev. 2013;
9. Folstein MF, Folstein SE, McHugh PR. "Mini-mental state". A practical
method for grading the cognitive state of patients for the clinician.
10. Gorelick PB, Scuteri A, Black SE, Decarli C, Greenberg SM, Iadecola C,
Launer LJ, Laurent S, Lopez OL, Nyenhuis D, Petersen RC, Schneider JA,
Tzourio C, Arnett DK, Bennett DA, Chui HC, Higashida RT, Lindquist R,
Nilsson PM, Roman GC, Sellke FW, Seshadri S. American Heart
Association Stroke Council, Council on Epidemiology and Prevention,
Council on Cardiovascular Nursing, Council on Cardiovascular Radiology
and Intervention, and Council on Cardiovascular Surgery and Anesthesia.
Vascular contributions to cognitive impairment and dementia: a statement
for
healthcare
professionals
from
the
American
Heart
Association/American Stroke Association.
11. Hachinski VC, Iliff LD, Zilhka E, Du Boulay GH, McAllister VL, Marshall J,
Russell RW, Symon L.Cerebral blood flow in dementia. Arch Neurol. 1975
Sep;32(9):632-7.
38
GUIA DE PRÁCTICA CLÍNICA DE DIAGNÓSTICO Y TRATAMIENTO DE
ENFERMEDAD DE PARKINSON EN EL ADULTO MAYOR
I.
FINALIDAD
Promover una atención de calidad a las personas afectadas con la enfermedad
de Parkinson (EP) basada en la mejor evidencia científica disponible así como
en la experiencia clínica y prácticas de médicos expertos en la atención de
personas con enfermedad de Parkinson.
II.
OBJETIVO
Que la presente Guía contribuya a estandarizar la atención clínica de las
personas afectadas con la enfermedad de Parkinson en los diferentes niveles de
atención propiciándose una atención oportuna v adecuada.
Sin embargo, y basado en la presente Guía, se tendrá que individualizar para
cada paciente, la toma de decisiones en lo referente el diagnóstico, tratamiento,
seguimiento así como el equipo multidisciplinario con el que se cuente en el
momento.
El seguimiento a cabalidad de la presente Guía no garantiza la evolución
favorable de los pacientes, pues la evolución, respuesta al tratamiento,
complicaciones y reacciones adversas son multifactoriales.
No es objetivo de esta Guía la organización y planificación de los diferentes
establecimientos de salud donde se atiendan pacientes con EP.
39
III.
AMBITO DE APLICACIÓN
3.1 Usuarios de la presente Guía
Médico Cirujano del Nivel l.
Médico Neurólogo del Nivel ll.
Médico Neurólogo del Nivel lll
3.2 Escenarios Clínicos a los que se refiere la Guía
Cualquier establecimiento de salud en el territorio peruano que cuente con
consulta ambulatoria, servicio de hospitalización, servicio de emergenc¡a y
unidades de Cuidados Intensivos.
IV.
PROCESO O PROCEDIMIENTO A ESTANDARIZAR
Nombre: Enfermedad de Parkinson
Código CIE 10: G20
V.
CONSIDERACIONES GENERALES
5.1 DEFINICIÓN
La enfermedad de Parkinson es un desorden degenerativo del sistema nervioso
central, en donde existe una pérdida neuronal progresiva de varios núcleos
principalmente en tronco encefálico y se caracteriza principalmente por un
trastorno motor debido a la presencia de un temblor de reposo, rigidez muscular
(incremento en el tono muscular) e hipoquinesia o bradiquinesia (lentitud de los
movimientos) así como síntomas no motores varios. se presenta en la adultez
por encima de los 40 años en el de 90% casos. posee una forma de inicio
insidiosa y una evolución progresiva.
40
5.2 ETIOLOGIA
La etiología aún es desconocida pero se presume una interacción entre una
susceptibilidad neuronal de causa genética y cierto tipo de exposición a algún
factor del medio ambiente no identificado. En un cinco a diez por ciento de casos
se identifican formas familiares, es decir más de una persona con la enfermedad
en una familia. En muchas de ellas se ha identificado mutaciones genéticas que
alteran la adecuada conformación de proteínas intracelulares (alfa-sinucleina,
ubiquitina-protesoma, etc.) e inclusive se ha determinado que una mutación
genética (LRRK2) explicaría ciertos casos de EP esporádica.
5.3 FISIOPATOLOGIA
La pérdida progresiva de neuronas dopaminérgicas en los núcleos del tronco
cerebral, principalmente la sustancia negra, genera una disminución de los
niveles de dopamina en el estriado generándose una hiperfunción de ciertos
núcleos como el globus pálido interno y el núcleo subtalámico ocasionando la
aparición de los síntomas motores" (temblor, rigidez, hipoquinesia). A medida
que la disminución de dopamina es mayor los síntomas motores se intensifican
y se extienden a otras áreas del cuerpo con el avance de la enfermedad. La
pérdida progresiva de neuronas en otros núcleos del sistema nervioso central,
conteniendo . otros neurotransmisores (serotonina, noradrenalina, etc.) genera
la aparición de los denominados síntomas no motores en esta enfermedad
(depresión, alteración del sueño, hiposmia, deterioro cognitivo, depresión, etc.)
altamente prevalentes en esta enfermedad.
5.4 ASPECTOS EPIDEMIOLÓGICOS
La EP está presente a nivel mundial afectando todas las razas. Tiene una
prevalencia de 1/11000 habitantes y en la población mayor de 6s años es de
i/100 habitantes con una discreta mayor afectación en hombres que en mujeres.
En el Perú se ha encontrado una distribución homogénea en el país.
41
5.5 FACTORES DE RIESGO ASOCIADOS A LA ENFERMEDAD DE
PARKINSON
No existen factores de riesgo definidos para adquirir la enfermedad salvo el
incremento de edad y la presencia de la enfermedad en un familiar directo.
Asímismo, el ser portador de algunos de los genes determinados relacionados a
la EP eleva El riesgo de padecer de EP. El sexo, raza o geografía no son factores
de riesgo demostrados.
VI.
CONSIDERACIONES ESPECIFICAS
6.1 CUADRO CLÍNICO
Alteraciones motoras: El inicio de la enfermedad está dado por la aparición de
algunos de los componentes del trastorno motor o síndrome parkinsoniano
(temblor, rigidez o hipoquinesia). El trastorno motor se presenta de manera
unilateral, comprometiendo indistintamente miembro superior o inferior para
luego de cierto tiempo extenderse al otro hemicuerpo. Estos síntomas se van
incrementando con el avance de la enfermedad. Con los años se asocia
alteraciones del equilibrio y estabilidad postural con riesgo de caídas así como
trastornos de la marcha (pasos más cortos, “congelamientos” para iniciar la
marcha o girar, etc). Otros síntomas motores complementarios son la hipofonía
(disminución del tono de la voz), la hiponimia, (reducción en la expresividad
facial) y la postura flexionada del tronco.
Alteraciones no motoras:
1) Síntomas
neuropsiquiátricos:
Los
más
frecuentes
son
ansiedad, depresión, deterioro cognitivo (demencia), y psicosis.
La depresión afecta hasta el 40% de los pacientes con EP y
puede preceder a los síntomas típicos de la EP. Diversas
escalas han sido validadas para cuantificar la severidad de la
depresión (Escalas de Depresión de Hamilton, MontgomeryAsberg, etc.) La demencia se presenta en hasta el 30% de los
pacientes con EP y puede llegar al 80% en etapas avanzadas
42
de la enfermedad. Se manifiesta con pérdida de las funciones
de ejecución de órdenes, de aprendizaje, y la fluidez verbal.
compromete el desempeño en las actividades de la vida diaria
afectando la calidad de vida de los pacientes, y junto a la
psicosis, es la causa más común de la necesidad de cuidados
en
el
hogar,
supervisión
de
enfermería
e
incluso
institucionalización. Las pruebas que evalúan función mental
pueden ser tan simples H, S como la Prueba de Folstein (Minimentai test) o la de Montreal (Montreal Cognitive EE i
Assessment - MoCA) hasta el Inventario Neuropsiquiátrico
(Neuropsychiatric lnventory) o 20% y el 40% de los pacientes
con medicación antiparkinsoniana y aunque todos los fármacos
antiparkinsonianos pueden producir psicosis se ha demostrado
que existe mayor riesgo de alucinaciones visuales con los
medicamentos dopaminérgicos.
2) Trastornos del sueño: Muy prevalentes en la EP. Los más
frecuentes son el Insomnio el cual suele tener un origen
multifactorial (nicturia, dificultad para girar en la cama,
calambres, pesadillas, y dolor), , la somnolencia diurna
excesiva y el disturbio de comportamiento de la fase REM. En
este último se presentan movimientos vigorosos y violentos
(patadas o puñetazos) que aparecen durante la fase REM del
sueño. El paciente puede autolesionarse o dañar a su pareja.
Estos síntomas pueden aparecer en las fases iniciales de la
enfermedad, incluso antes de los síntomas típicos.
3) Síntomas digestivos: Incluye el estreñimiento, pérdida de peso,
sialorrea excesiva y la disfagia.
4) síntomas urinarios: El aumento en la frecuencia de micción
durante la noche es a menudo la primera manifestación,
seguido por la urgencia diurna y la incontinencia urinaria. La
disminución de la capacidad de la vejiga debido a una
43
hiperactividad del musculo detrusor es el hallazgo más común
durante la evaluación urodinámica.
5) Disfunción sexual: Abarca desde la disminución de la libido
(tanto en hombres como en mujeres) hasta la hipersexualidad.
Esta última se presenta con más frecuencia en hombres como
un efecto adverso de los fármacos dopaminérgicos. También se
ha descrito disfunción eréctil y alteración de la eyaculación en
los pacientes varones con EP
6) Fatiqa: Es un motivo de consulta frecuente en la EP, a menudo
en fases tempranas de la enfermedad. Aunque la fatiga está
asociada a la depresión y a los problemas del sueño su
verdadera fisiopatología es desconocida
7) Hiposmia: Existe una reducción o pérdida de la olfación en la
mayoría de pacientes con EP, incluso desde antes de la
aparición de los primeros síntomas motores.
Etapas de la EP: La evolución de la EP se establece a través de la escala de
Hoehn-Yark la que se basa en la progresión del trastorno motor y comprende 5
estadios (Ver anexos).
Clasificación de la EP según edad de inicio: Parkinson juvenil: inicio antes de los
20 años; Parkinson de inicio temprano: inicio entre los 20 V 40 años: Parkinson
del adulto: inicio después de los 40 años.
6.2 DIAGNÓSTICO
6.2.1 Criterios Clínicos El diagnóstico de EP se establece de manera clínica
aunque la tasa de error diagnóstico puede llegar a ser alta. Por ello los criterios
más empleados y aceptados son los propuestos por el Banco de Cerebros de
Parkinson del Reino Unido (UKPDBB) y son:
Inicio unilateral del trastorno motor
Evolución progresiva
44
Asimetría persistente del trastorno motor a lo largo de la
enfermedad . Presencia de temblor de reposo
Excelente respuesta a levodopa
Respuesta adecuada a levodopa por 5 años
Presencia de disquinesias inducidas por levodopa
Evolución mayor a 10 años
Además debe excluirse la posibilidad de alguna causa de parkinsonismo
secundario (medicamentos, tóxico, etc.) o la existencia en el examen clínico de
signos neurológicos atípicos para una EP (oftalmoplejia, síndrome cerebeloso,
gran disautonomia, etc.) y que hagan sospechar en un posible parkinsonismo
atípico (ver más adelante)
6.2.2 Criterios de Laboratorio
No existe ningún examen de laboratorio que confirme o niegue la existencia de
una EP, salvo el estudio anatomo-patológico post-mortem
6.2.3 Criterios por lmágenes
No existe estudio de Imágenes que permita el diagnóstico de EP sin embargo se
vienen estudiando posibles marcadores imagenológicos como: a) Ecografía de
sustancia negra: se aprecia una hiperecogenicidad en la sustancia negra del
mesencéfalo en los pacientes con EP comparados con Personas sanas. b)
Resonancia Magnética (3T o más): se aprecia una hiposeñal de los nigrosomas
en la sustancia negra en los pacientes con EP comparados con personas sanas.
Ambos no se usan de manera rutinaria para establecer el diagnostico de
enfermedad de Parkinson y faltarían ser validados en nuestra población.
6.2.4 Diagnóstico Diferencial.
Parkinsonismos secundarios: una exhaustiva anamnesis
permite identificar el antecedente de consumo y/o
exposición a drogas, medicamentos, tóxicos u otros que
45
tengan capacidad de inducir un síndrome parkinsoniano.
De otro modo, los estudios del cerebro con tomografía
y/o resonancia magnética pueden evidenciar una
hidrocefalia, depósito de minerales en ganglios basales
o
múltiples
lesiones
¡squémicas
cerebrales
que
expliquen el cuadro clínico.
Parkinsonismo-plus o atípicos: son enfermedades
neurodegenerativas que tienen en común con la EP la
presencia del síndrome parkinsoniano pero además
presentan signos o síndromes clínicos atípicos como
piramidalismo,
ataxia
cerebelosa,
demencia,
disautonomía severa, etc. Un adecuado examen
neurológico en la consulta inicial o la evaluación clínica
periódica a lo largo de la evolución permitirá evidenciar
la aparición de dichos síndromes. Los estudios de
neuroimágenes son útiles para los estadios intermedios
y avanzados de estos parkinsonismos-plus. Algunos de
ellos
son
Atrofia
multisistémica
y
la
Parálisis
supranuclear progresiva, entre otros.
6.3
MANEJO
SEGÚN
NIVEL
DE
COMPLEJIDAD
Y
CAPACIDAD
RESOLUTIVA
6.3.1 Según nivel de complejidad:
Nivel l: Establecimiento de salud que cuenta con la atención de un médico
cirujano general. Ante sospecha de parkinsonismo el paciente debe ser remitido
al nivel ll.
46
Nivel ll: Establecimiento de salud donde se puede contar con un médico
especialista en neurología. El diagnóstico clínico inicial puede ser realizado por
éste e iniciarse tratamiento farmacológico en este nivel de atención. Si en ese
nivel se cuenta con Medicina Física y Rehabilitación deberá referirse al paciente
para orientación sobre ejercicios y terapia física acorde al estadio de su
enfermedad.
Nivel lll: Deberá referirse a este nivel para ser evaluado por neurólogos con
experiencia en movimientos involuntarios cuando exista duda en el diagnóstico,
la evolución sea tórpida y la respuesta a la medicación no brinde los beneficios
esperados requiriendo reajuste de dosis, adición de fármacos, etc. En este nivel
de atención los pacientes deberán ser evaluados clínicamente de manera
exhaustiva aplicándose escalas motoras (UPDRS - ver anexos), conductuales,
afectivas y cognitivas. Según el caso, se les debe realizar estudios de imágenes
y de laboratorio para el diagnóstico diferencial. En este nivel se podrá contar con
un equipo multidisciplinario para el manejo integral de la EP. El paciente y la
familia pueden beneficiarse del apoyo y consejería brindada por un psicólogo.
Un neuropsicólogo deberá realizar evaluaciones periódicas de los cambios en la
función mental. Un psiquiatra deberá participar en casos de síntomas psicóticos
severos o depresión severa. El equipo de terapistas deberá ocuparse de la
fisioterapia, terapia ocupacional y terapia de lenguaje.
6.3.2 Según Capacidad Resolutiva.
Manejo ambulatorio:
Prácticamente todos los pacientes con EP pueden ser atendidos periódicamente
de manera ambulatoria independientemente del estadio. Se deberá identificar
precozmente la aparición de síntomas no motores y tratarlos de ser el caso así
como la aparición de complicaciones motoras de la levodopa.
Manejo en hospitalización:
47
Se hospitalizarán sólo aquellos casos en los cuales resulte difícil identificar de
manera ambulatoria el tipo, frecuencia e intensidad de las complicaciones
motoras (disquinesias, fluctuaciones). Asimismo, cuando se presente algún
problema médico intercurrente que ponga en riesgo la vida o integridad física del
paciente (neumonía, infección urinaria. etc.).
Manejo en unidades críticas:
Cuando se presente una complicación de la enfermedad o intercurrencia médica
distinta a la enfermedad de fondo, que requiera soporte ventilatorio,
monitorización cardiaca, evaluación del estado de conciencia, sedación, etc.
Transferencia:
Cuando el paciente requiera procedimientos o tratamiento especializado que no
se realice en la lnstitución.
6.4 TERAPÉUTICA.
Puesto que hasta el momento de elaborar la presente guía no se dispone de
ningún tratamiento demostrado que modifique la progresión de la enfermedad,
el tratamiento disponible es sintomático.
6.4.1 Medidas generales y preventivas
Dieta completa rica en fibra y residuo para combatir o prevenir
estreñimiento.
Dieta blanda rica en fibra y residuo en estadio avanzado (por
estreñimiento y disfagia). Consejería y apoyo psicológico en todos los
estadios.
Mantenimiento de actividad física (continuar trabajando, caminatas,
etc.)
Promover una rutina diaria de ejercicios en domicilio adecuado al
estadio de la enfermedad y edad del paciente
48
Uso de bastón, andador o ayuda de terceros para deambular en caso
de inestabilidad postural con riesgo de caídas
6.4.2 Manejo específico:
Tratamiento farmacológico
49
(*) No disponible en Perú a la fecha de redacción de la presente Guía.
Consideraciones prácticas:
El manejo individual de cada paciente requiere la cuidadosa consideración de
una serie de factores, incluyendo los síntomas predominantes, la edad, la etapa
de la enfermedad, el grado de incapacidad funcional y el nivel de actividad física,
situación laboral, enfermedades concomitantes, estado cognitivo, entre otros.
La lista precedente de fármacos solo está orientada a mejorar los síntomas
motores de la enfermedad de Parkinson (temblor, rigidez, hipoquinesia). Los
inhibidores MAO-B (selegilina o rasagilina) tienen poco efecto sintomático y
pueden usarse en monoterapia al inicio de la enfermedad. Además tendrían un
efecto aparentemente enlentecedor del avance de la enfermedad.
50
Se evitará la asociación de inhibidores MAO-B con antidepresivos del tipo
inhibidores de la recaptación de serotonina.
Los agonistas dopaminérgicos podrán emplearse como primera línea del
tratamiento sintomático en pacientes menores de 60 años.
Los anticolinergicos deberán reservarse para pacientes en quienes temblor, no
haya deterioro cognitivo y no excedan los 60 años de edad. La levodopa es el
fármaco sintomático más potente y una vez iniciado por el resto de la enfermedad
incrementándose según el compromiso motor lo valla requiriendo.
Los inhibidores coMT se adicionan a cada dosis de levodopa solo cuando se
identifique fluctuación motora por el uso crónico de levodopa del tipo agotamiento
del efecto ("wearing-off"). El trastorno del control de impulsos (TCl) generado por
los agonistas dopaminérg¡cos, y también la levodopa, consiste en el fracaso para
resistir un impulso, tendencia o tentación de realizar un acto que es perjudicial
para los demás o para el propio individuo. Las personas con TCI experimentan
un mayor impulso de realizat el acto antes del mismo, así como una gratificación
al cometer el acto. Algunos ejemplos son el juego compulsivo (ludopatía), la
cleptomanía, los atracones de comida, las compras compulsivas, el fenómeno
de punding (comportamiento estereotipado que comprende rituales motores
automáticos, sin finalidad) y la hipersexualidad.
Tratamiento Quirúrqico.
Esta indicado en aquellos casos que no respondan adecuadamente al
tratamiento farmacológico debido a que se requiere demasiada dosis diaria de
revodopa y/o agonistas dopaminérgicos o por presencia incapacitante de
disquinesias. Las dos alternativas disponibles son: lesión destructiva del: a)
tálamo (talamotomía) en caso de temblor refractario, b) del globus pálido interno
(palidotomíaj o c) núcleó subtalámico (subtalamotomía) y la Estimulación
cerebral profunda (DBS por sus siglas en inglés) que consiste en la implantación
de unos electrodos a nivel del globus pálido interno o núcleo subtalámico unidos
51
a un estimulador de alta frecuencia inhibiendo la hiperfunción de alguno de estos
núcleos.
Tratamiento No farmacológico . Fisioterapia
se recomienda ofrecer a las personas con EP de inicio reciente un tratamiento
rehabilitador basado en fisioterapia con un abordaje interdisciplinario que ponga
especial énfasis en la rehabilitación funcional del paciente. se recomienda utilizar
programas de ejercicios de fortalecimiento y estiramiento así como el ejercicio
aeróbico supervisado. otras técnicas complementarias a ser consideradas son el
baile, danza, tai-chi y yoga.
La fisioterapia debe de estar disponible para los pacientes con EP durante toda
la enfermedad. se debe prestar especiar atención a: la re-educación de la
marcha, con mejora del equilibrio; mejorar la iniciación del movimiento; mejorar
la independencia funcional, incluyendo la movilidad y las actividades de la vida
diaria. Finalmente deberá brindarse consejo con respecto a la seguridad del
entorno.
52
Consideraciones prácticas sobre manejo de síntomas no motores:
Depresión: La depresión leve es difícil de diagnosticar en los pacientes con EP
y deberá emplearse algunas de las escalas estandarizadas aceptadas para el
diagnóstico de depresión. Se recomienda que el manejo de la depresión en
personas con EP sea personalizado considerando en particular la terapia
53
coexistente y las comorbilidades que presente. La elección del tratamiento
antidepresivo dependerá de la experiencia previa del profesional y las
condiciones clínicas del paciente. Antes de iniciar algún antidepresivo deberá
suspenderse previamente la selegilina por el riesgo de síndrome serotoninérgico.
Se recomienda valorar otras alternativas no farmacológicas para el tratamiento
de la depresión en personas con EP, como puede ser la psicoterapia. Se
recomienda que el manejo de la depresión grave asociada a la EP se realice de
forma multidisciplinaria con la participación de un psiquiatra.
Ansiedad: Los síntomas de ansiedad son muy frecuentes en la EP y se estima
que al menos la tercera parte de los pacientes la padecen. Puede ir desde
intranquilidad hasta verdaderos ataques de pánico.
Psicosis: La conducta a seguir ante síntomas psicóticos (principalmente
alucinaciones) consiste en investigar posible infección concomitante, suspender
si fuera el caso y en este orden los anticolinérgicos, inhibidores MAO-B y luego
reducir y/o suspender agonistas dopaminérgicos. No deberá modificarse la dosis
total diaria de levodopa porque los síntomas motores podrían empeorar. Si los
síntomas persistieran iniciar alguno de los antipsicóticos referidos en la tabla
correspondiente. El uso de clozapina requiere monitoreo semanal de neutrófilos
y granulocitos en sangre. Está contraindicado el uso de antipsicóticos típicos
(haloperidol, clorpromazina, etc.) en pacientes con EP.
Trastornos del sueño: Antes de considerar la prescripción de medicamentos se
recomienda una buena higiene del sueño, evitar la ingesta de estimulantes por
la tarde (p.ej. café o té), establecer un patrón regular de sueño, entorno y
temperatura del dormitorio confortable, restricción de las siestas durante el día,
recomendar hacer ejercicio regular y adecuado para inducir mejor el sueño,
revisar toda la medicación y evitar los fármacos que afecten el sueño o la
situación de alerta, o que puedan interactuar con otra medicación (p.ej.
selegilina, antihistamínicos, antagonistas H2, antipsicóticos y sedantes).
54
Estreñimiento: se recomienda realizar cambios en la dieta aumentando la
ingesta de líquidos y fibra, si es necesario con suplementos de fibra y
suavizantes de heces asimismo se recomienda incrementar la actividad física.
se deberá indagar y valorar los tratamientos que frecuentemente causan
estreñimiento (antidepresivos tricíclicos, loperamida, codeína y opioides,
antimuscarínicos y algunos antiparkinsonianos).
Síntomas digestivos (nauseas, plenitud gástrica): Se recomienda el uso de
domperidona para los síntomas gastrointestinales (anorexia, nausea v vómitos
asociados al tratamiento con levodopa y agonistas dopaminérgicos). se
contraindica el uso de metoclopramida en pacientes con EP debido al posible
empeoramiento de los síntomas motores.
6.5 MONITOREO Y EVOLUCIÓN
La evolución clínica de los pacientes con EP se determina periódicamente de
manera ambulatoria procurando que el paciente tenga el mayor tiempo del día
beneficio sintomático (estadios "on") y la menor cantidad posible de tiempo con
síntomas motores intensos (estadio "off'). para e o se solicitará al paciente que
marque durante unos días previos a la consulta en un cuadro (ver anexos) las
horas del día en donde se encuentra en estadios "on" y "off' en relación a los
horarios de la medicación antiparkinsoniana. Asimismo se detectará y tratara la
aparición de síntomas no motores.
6.6 CRITERIOS DE ALTA
La EP es una enfermedad crónica de curso progresivo requiriendo controles
periódicos permanentes de manera ambulatoria durante toda la vida del paciente
con EP. Cuando el paciente sea hospitalizado por alguna complicación o
intercurrencia será dado de alta cuando se haya terminado la situación médica
o quirúrgica que motivó su internamiento
55
6.7 PRONÓSTICO
La EP es una enfermedad progresiva y no se dispone de un tratamiento curativo
ni que retarde la enfermedad. Las causas frecuentes de fallecimiento están
asociadas a la postración en etapas avanzadas (Estadio V de la escala de Hoehn
y Yahr) como neumonía por bronco-aspiración secundaria a disfagia, sepsis,
desnutrición severa.
6.8 COMPLICACIONES
Las complicaciones más frecuentes en un paciente con EP moderada a
avanzada son: infecciones urinaria y respiratoria, disfagia con atoros,
estreñimiento severo con síndromes sub-oclusivos por impactación fecal,
escaras, pérd¡da de peso, psicosis.
6.9 CRITERIOS DE REFERENCIA Y CONTRA-REFERENCIA
Todo establecimiento de salud con menor complejidad de resolución deberá
transferir a los pacientes con EP a uno de mayor complejidad para el manejo
integral y especializado para luego ser contra-referidos a establecimientos de
salud que cuenten con neurólogo y proseguir su tratamiento
56
VII.
ANEXOS
57
Escala Unificada de valoración de la enfermedad de Parkinson (Unified
Parkinson Disease Rating Scale UPDRS) lll parte: Escala motora
58
59
60
VIII.
REFERENCIA BIBLIOGRÁFICAS
1. BraakH,De|TrediciK,RubUeta|.stagingofbrainpatho|ogyre|atedtosporadic
Parkinson's disease. Neurobiology of ageing 2OO3 '24;197 -211
2. cosentino c, Nuñez Y, Torres L. Prevalence of non-motor Symptoms in
peruvian patients with Parkinson's disease. Arquivos de Neuropsiquiat¡ia
2013;71 (4): 216-9
3. Fox S, Katzenschlager R, Lim SY et al. The Movement Disorder society
EvidenceBased Medicine Review update: Treatments for the Motor
Symptoms of Park¡nson's disease. Mov Disord 2o11;26 (S3): 2-41
4. Grupo de trabajo de la Guía de Práctica clínica para el Manejo de
Pacientes con Enfermedad de Parkinson. Guía de Práctica clínica para el
Manejo de Pacientes con Enfermedad de Parkinson. Ministerio de
sanidad, servicios Sociales e igualdad. Instituto Aragonés de ciencias de
la salud; 2014. Guías de Práctica clínica en el SNS.
5. Horstink M. Tolosa E, Bonuccelli C et al. Review of the therapeutic
management of parkinson's disease. Report of a joint task force of the
European Federation of Neurological societies and the Movement
Disorder society- European Section. (MDS-ES) Part II: early (complicated)
Parkinson's disease. European Journal of Neurology. 2006;13: 1170-85.
6. Horstink M. Tolosa E, Bonuccelli C et al. Review of the therapeutic
management of Parkinson's disease. Report of a joint task force of the
European Federation of Neurological Societies (EFNS) and the Movement
Disorder Society European Section (MDS-ES). Part ll: late (complicated)
61
Parkinson's disease. European. Journal of Neurology. 2006; 1 3: 1 186202.
7. Hughes AJ, Ben-shlomo Y, Daniel SE, Les AJ. Whai features improve the
accuracy of clinical diagnosis in Parkinson's drsease: a clinicopathologic
study. Neurology 1992; 42:1142-6
8. Hughes AJ, Daniel SE, Ben-Shlomo Y, Lees AJ. The accuracy of
diagnosis of parkinsonian syndromes in a specialist movement disorder
service. Brain 20O2;12:861- 70
9. Miyasaki JM; Shannon K, Voon V et al. Practice parameter: evaluation and
treatment of depression, psychosis, and dementia in Parkinson disease
(an
evidence-based
review).
Report
of
the
Quality
Standards
Subcommittee of the American Academy of Neurology. Neurology.
2006;66: 996-1002.
10. National Collaborating Centre for Chronic Conditions. Parkinson's
disease: national clinical guideline for diagnosis and management in
primary and secondary care. London: Royal College of Physicians, 2006.
11. Pahwa R, Factor S, Lyon KE et al. Practice Parameter: treatment of
Parkinson disease with motor fluctuations and dyskinesia (an evidencebased review): report of the Quality Standards Subcommittee of the
American Academy of Neurology. Neurology. 2006;66: 983-95.
12. Seppi K, Weintraub D, Coelho M et al. The Based Medicine Review
Update: Treatments for the Motor Symptoms of Parkinson´s Disease. Mov
Disord 201 1; 26(53): 42-80
62
GUIA DE PRÁCTICA CLÍNICA DE DIAGNÓSTICO Y TRATAMIENTO DE
SINDROME DE FRAGILIDAD EN EL ADULTO MAYOR
I.
FINALIDAD
Uniformizar concepto en Síndrome de fragilidad para la realización de un
cribado precoz en su detección y realización inmediata de intervención en
fragilidad.
II.
OBJETIVO
Detección de un cribado precoz en fragilidad del Adulto Mayor.
III.
AMBITO DE APLICACIÓN
Población adulta mayor que asiste a consulta de geriatría en Hospital
Victor Lazarte Echegaray.
IV.
PROCESO O PROCEDIMIENTO A ESTANDARIZAR
4.1 Nombre y Código CIE 10:
NOMBRE
CIE -10
Problemas relacionados con limitación de actividades por Z73.6
discapacidad
Problemas relacionados con movilidad reducida
Z74.0
Problemas relacionados con necesidad de ayuda para el Z74.1
cuidado personal
Problemas relacionados con necesidad de asistencia Z74.2
domiciliaria y que ningún miembro del hogar puede
proporcionar
63
Problemas relacionados con la necesidad de supervisión Z74.3
continua
V.
CONSIDERACIONES GENERALES
1. Definición:
La fragilidad es un estado de pre-discapacidad, de riesgo de
desarrollar nueva discapacidad desde una situación de limitación
funcional incipiente en el diagnóstico de enfermedad. (1)
“Un síndrome médico con múltiples causas y factores que contribuyen
a su desarrollo, caracterizado por la disminución de la fuerza,
resistencia y funciones fisiológicas reducidad que aumentan la
vulnerabilidad de un individuo en el desarrollo de la dependencia
funcional y/o su muerte.” (2)
2. Etiología:
Es multifactorial, sin puerta única de entrada ni desencadenante, sino
que sigue un modelo diferente, basado en disminución de reserva
funcional de sistemas que interactúan la enfermedad aguda y crónica,
la multimorbilidad, los tratamiento prescritos y otros factores, como
síndromes geriátricos, factores personales y ambientales, para
generar el fenotipo final. También la carga de la enfermedad de los
diferentes sistemas, factores genéticos, hormonales, inflamatorios,
neuromusculares, energéticos, nutricionales y estrés oxidativo. (3)
3. Fisiopatología:
La fragilidad es multifactorial, aunque se ha prpuesto que la piedra angular
sobre la que se asienta es la pérdida de masa muscular asociada al
envejecimiento o sarcopenia.
64
El músculo esquelético es el sistema corporal que más energía consume
en reposo, por lo que su reducción supone un descenso de la cantidad de
energía consumida en reposo. Así mismo , la sarcopenia disminuye la
energía consumida con el ejercici, ya que los sujetos se mueven menos,
caminan más lento, tienen mayor fatiga y evitan el ejercicio. Ambos
procesos suponen un descenso en el gasto energético total que produce
una regulación a la baja del apetito, con el consiguiente descenso en la
ingesta de nutrientes, que causa menor síntesis proteica.
Este esquema fue inicialmente postulado por LP Fried, denominándose
ciclo de la fragilidad, aunque posteriormente ha sido completado con
otros elementos. (Ver figura 1)
Figura 1. Ciclo de Fragilidad
Añadido a estos fenómenos, exìste un estado de inflamación crónica de
bajo grado característico de la edad anciana, desencadenado por el
estrés oxidativo y por la producción de citoquinas desde diferentes
sistemas corporales, entre los que destaca la grasa visceral (en el
65
músculo la grasa intramuscular), y que se hace más evidente en los
frágiles. Por inflamación se conoce la regulación al alza de determinadas
citoquinas pro inflamatorias que ocurre en la edad adulta y durante las
enfermedades crónicas asocíadas al envejecimiento, destacando la IL —
6, IL — 1, TNF — alfa y el IFN — alfa. Esta activación de citoquinas
produce, como efectos deletéreos, inflamación crónica, liberación de
reactantes de fase aguda hepáticos, insulinorresistencia y actividad
osteoclástíca. Para contrarrestar este estado inflamatorio, ei organismo
actúa a través de las citoquinas antiinflamatorias I L- 4, IL - 10, IL — 13
producíendo activación del eje hipotálamo — hipófíso — suprarrenal, y
originando una elevación del cortisol, que causará secundariamente, y
como efectos no deseados, resorción ósea, lipolisis, catabolismo proteico,
gluconeogénesis y disfunción inmune, según el sistema sobre el que
actué, producíendo en último término fragilidad y enfermedad crónica. La
coexistencia de fenómenos inflamatoríos en el anciano va a tener un
efecto negativo sobre el metabolismo, la densidad ósea, la fuerza, la
tolerancía al ejercicio, el sistema vascular, la cogníción y el afecto,
colaborando con última instancia a desencadenar el fenotipo de fragilidad.
Siendo la fragilidad un proceso multifactorial, no es de extrañar que
muchos elementos se hayan implicado en su patogenia, entre los que
cabe destacar la desregulación neuroendocrina (relaciõn con niveles de
testosterona, eje GH / IGF — 1, cortisol, estradiol, DHEA, leptina, ghrelina,
obestatina, o vitamina D), la disfunción endotelial y la presencia de un
estado procoagulante, favorecídos por el estrés oxidativo y la inflamación
crónica, que pueden desencadenar aterosclerosis, con el consiguiente
daño visceral, deterioro cognitivo, depresión , obesidad, osteoporosis,
resistencia insulínica, alteraciones del ritmo circadiano y alteraciones del
equilibrio y marcha entre otros.
4. Aspectos epidemiológicos
66
Según INEI en Perú, hasta junio 2020, tenemos una población estímada
de 32 625 948 personas, con una esperanza de vida de 75 años.
Como resultado de los grandes cambios demográficos experimentados
en las últimas décadas en el pais, la estructura por edad y sexo de la
población está experimentando cambios signifìcativos. En la década de
los años cíncuenta, la estructura de la población peruana estaba
compuesta básicamente por níños/as; así de cada 100 personas 42 eran
menores de 15 años; en el año 2020 son menores de 15 años 25 de cada
100 habitantes. En este proceso de envejecimiento de la población
peruana, aumenta la proporción de la población adulta mayor de 5,7% en
el año 1950 a 12,7% en el año 2020. En este informe técnico se considera
como personas adultas mayores a la población de 60 años y más en
concordancia con el criterio adoptado por las Naciones Unidas.
Gráfico N° 01
Perú: Pirâmide de la población en 1950
67
ca
Gráfico N° 02
Perú: Pirámide de la población en 2020
5. Factores de riesgo asociado
i. Sociodemográficos
1. Edad avanzada
2. Sexo femenino
3. Baja escolaridad
4. Ingresos familiares bajos.
ii. Estilos de vida
1. Tabaquismo
2. Dependencia en al menos una actividad básica de
la vida diaria.
iii. Factores hereditarios y adquiridos
68
1. Enfermedad coronaria
2. EPOC
3. Enfermedad cerebro vascular
4. Diabetes Mellitus
5. HTA
6. Artritis
7. Anemia
8. Fractura de cadera después de los 55 años
9. Bajos desempeños cognoscitivos
10. Dos o más caídas en el último año
11. Síntomas depresivos
12. Índice de masa corporal a 18,5 o mayor de 25
13. Uso de terapia de reemplazo hormonal
14. Hospitalización reciente
VI.
CONSIDERACIONES ESPECIFICAS
1. CUADRO CLÍNICO
i.
Signos y síntomas
-
Pérdida de peso no intencionado
-
Debilidad muscular
-
Lenta velocidad para marchar
-
Agotamiento
-
Pobre actividad física
69
ii.
Interacción cronológica
Ver Figura. 2.
Fig. 2. Evolución de la capacidad funcional y fragilidad en la persona ado/fa
mayor.
iii.
Gráficos, diagramas, fotografías
En febrero y agosto del 2007 se evaluó a 246 personas adultas mayores de Lima
metropolitana
70
71
2. DIAGNOSTICO
1. Criterios de diagnóstico:
- Fenotipo de Fragilidad L. Fried (ver anexo 1)
- Cuestionario de Frail (ver anexo 2).
- Short Physical Performance Battery (SPPB) (ver anexo 3)
2. Diagnóstico diferencial
Discapacidad: toda pérdida o anormalidad, permanente o temporal, de
una estructura o función psicológica, fisiológica o anatómica. (Según
OMS)
Comorbilidad: La presencia de uno o más trastornos {o enfermedades)
además de la enfermedad o trastorno primario. El efecto de estos
trastornos o enfermedades adicionales.
Envejecimiento: Proceso biológico por el que los seres vivos se hacen
viejos, que comporta una serie de cambios estructurales y funcionales que
aparecen con el paso del tiempo y no son consecuencia de enfermedades
ni accidentes.
Sarcopenia: Síndrome caracterizado por una progresiva y generalizada
pérdida de masa y fuerza muscular esquelétíca con riesgo de resultados
negativos como discapacidad física, peor calidad de vida y muerte.
3. EXAMENES AUXILIARES
72
a) Patología clínica:
- Dimero d
- Factor activados de plasminógeno tisular
- IL- 6 (Interleuquina 6)
- PCR (proteína C reactiva)
- IGF-1 (factor de crecimiento ínsulínoide-1)
- TNF alfa (factor de necrosis tumoral alfa)
- Testosterona
- DHEA (andrógeno suprarrenal dihidroepiandrosterona)
- Vitamina D Hemoglobina Hematocrito
- Vitamina B12
- TSH
- T4
- Perfil lipídico
- Albúmina
- Hemograma
- Nitrógeno ureico en orina
- Zinc.
b) Imágenes:
-
Absorciometría radiológica de doble energía (DEXA) o densitometría
muscular
-
Resonancia magnética
-
Tomografía axial computarizada
-
Bioimpedancia
-
Ultrasonido muscular
c) Procedimientos complementarios:
73
-
Antropometria
-
Fuerza de prensión manual isométrica (dinamómetro) Bateria breve
de rendimiento físico (SPPB)
-
Velocidad de la marcha
-
Timed get up and go (levántate y anda).
4. MANEJO
SEGÚN
NIVEL
DE
COMPLEJIDAD
Y
CAPACIDAD
RESOLUTIVA
i. Medidas generales y preventivas
Ejercicio Físico:
- Es la mejor alternativa terapéutica para el abordaje de la fragilidad, y por
tanto la sarcopenia.
- Ayuda a mantener masa muscular.
- Mejora capacidad aeróbica.
- Previene osteoporosis
- Reduce ansiedad y mejora calidad de vida.
- Ejercicios de potencia muscular en extremidades superiores mediante
pesas y poleas.
- Ejercicios de resistencia como natación y ciclismo. Realizarlo 20 a 30
minutos tres veces por semana.
- Actividad física 30 a 60 minutos al dia, sesiones de 10 minutos cada uno
con un total de 150 a 300 minutos a la semana, para mantener resistencia,
equilibrio y flexibilidad.
- En el anciano pre-frágil, el entrenamiento de resistencia se realizará en
24 semanas con series de repeticiones 3 a 7 veces por semana.
Nutrición:
74
- Medición
de peso en cada
consulta.
Atención
a la pérdida
ínvoluntaria de mayor íguaí 10% en menos de un año
- Evaluación de causas de baja ingesta alimentaria:
• Situación dental
• Acceso al alimento (socioeconómico)
• Habilidad para comer y preparar alimentos
• Ingesta y apetito
• Dietas restrictivas
-
Evaluar comorbilídad y polifarmacia
-
Despistaje de disfagia (ictus)
- Suplementación oral: 400KcaI diarias durante un mes, después de
optìmizar dieta.
- Evaluaciõn MNA (Mini Nutritional Assessment)
- Consumo de proteínas 1,0 — 1,2 g/kg/d. Ancianos sanos.
- Adultos mayores con enfermedad aguda o crónica requieren 1,21,5g/Kg/d.
- Adultos mayores con enfermedad o lesión severa o malnutrición
marcada requieren 2g/Kg/d.
- Adultos mayores con enfermedad renal crónica avanzada FG merior
30mI/min, sin diálisis son excepción, necesitan limitar su ingesta proteica
0,8g/Kg/d.
*Nutrición más ejercicio consiguen mejorar la situación de fragilidad a
corto plazo (3 meses) con efectos mantenidos sobre densidad mineral
ósea y niveles de vitamína D.
ii. Terapéutica
-
Vitamina C: 141 — 190 mg / d (consumo reduce el riesgo de
aterosclerosis; además se está estudiando su papel en la función
cognitiva. !5!
75
-
Vitamina D: 800 UI/d reduoe en un 22% el riesgo de Gaída.
iii. Efectos Adversos:
No aplica
iv. Signos de alarma:
No aplica
v. Criterios de alta:
No aplica
vi. Pronóstico:
Los Adultos mayores frágiles tienen un riesgo elevado de discapacidad y son los
que más se benefician de intervenciones preventivas. Independientemente de la
presencia de comorbilidades, la fragilidad es un factor pronóstico para
discapacidad en actividades de la vida diaria.
- Cada criterio de fragilidad (L. Freud) confiere un valor pron6stiœ y sumatoria
de ello incrementa el riesgo de mortalidad hasta el 38% y de discapacidad fisica
de 52% a 7.5 años.
Aspectos que confieren peor pron6stiœ: socio demográficos, biomédicos,
funcionales y afectivos.
5. COMPLICACIONES:
76
El tornado de la fragilidad. Ejemplifica la evolución dinámica de la pérdida de las
funciones homeostáticos y su interacción con las fuerzas entrópicos que
envuelven al anciano frágil conduciéndolo al abatimiento funcional y la muerte
situada en el fondo.
Figure 3. El tornado de la fragilidad
6. CRITERIOS DE REFERENCIA Y CONYRAREFERENCIA
El paciente adulto mayor con criterios diagnósticos de fragilidad se debe referir
de acuerdo a grado de complejidad al establecimiento de salud que corresponda
para el manejo integral del paciente adulto mayor, garantizando una atención
oportuna y eficaz.
7. FLUjOGRAMA
a) Esquema de derivación al paciente adulto mayor de
Atención primaria a la Atención secundaria
77
HOSPITAL VICTOR LAZARTE ECHEGARAY
b) Esquema de atención secundaria:
78
HOSPITAL VICTOR LAZARTE ECHEGARAY
c) Cribado de Fragilidad:
79
ADULTOS MAYORES DE 60 AÑOS ATENDIDOS EN EL HOSPITAL VICTOR
LAZARTE ECHEGARAY
80
VII.
ANEXOS
ANEXO 1: FENOTIPO DE FRAGILIDAD DE LP FRIED
81
ANEXO 2: CUESTIONARIO DE FRAIL
82
83
VIII.
REFERENCIAS BIBLIOGRÁFICAS
(1) Martín Lesende I, Gorroñogoitia A, Gómez J, Baztán JJ, Abizanda P, El
anciano frágil. Detección y manejo en atención primaria. Aten Primaria
2010; 42 (7): 388-93.
(2) Morley JE, Vellas B, Van Kan GA, Anker SD, Bauer JM, Bernabei R, et
al. Frailty consensus: a call to action. J Am Med Dir Assoc.
2013;14(6):392-7. doi: 10.1016/j.jamda.2013.03.022.
(3) Ramos P, Abízabda P, et al. Guía de práctica clínica en Geriatria:
Fragilidad y nutrición en el anciano. Sociedad Española de Geriatría y
Gerontología. 2014
(4) INEI, Situación de la población Adulta Mayor julio- agosto - setiembre
2020. Informe técnico N° 4 diciembre Z020.
(5) Ministerio de Sanidad, Servicios Sociales y Sanidad. Documento de
consenso sobre prevención de fragilidad y caídas en la persona mayor.
Estrategia de promoción en la Salud y de prevención en el SNS. Junio
2014
(6) Varela L, Ortiz P, Chávez H. Síndrome de Fragilidad en adultos
mayores de la comunidad de Lima Metropolitana. Rev Soc Peru Med
Interna 2008; vol 21 (1).
84
(7) Cordero M, Fuentes L, et al. Guía de práctica clinica GPC. Prevención,
Diagnóstico y Tratamiento del Síndrome de Fragilidad en el Anciano.
Grupo GPC IMSS Oaxtepec Oct. 201a.
(8) Salado Morales L. La Fragilidad en el anciano. Universidad de
Cantabria; 2014.
GUIA DE PRÁCTICA CLÍNICA DE DIAGNÓSTICO Y TRATAMIENTO DE
DETERIORO COGNITIVO LEVE EN EL ADULTO MAYOR
I.
FINALIDAD
La presente Guía tiene como finalidad dar las recomendaciones sobre el
Diagnóstico y Tratamiento del Deterioro Cognitivo Leve para aquellas
personas que sufren pérdida de sus capacidades cognitivas dispongan de
una atención con calidad y con garantía necesaria para que la continuidad
de cuidados a prestar sea posible.
II.
OBJETIVO
Promover la detección, evaluación, diagnóstico y tratamiento del deterioro
cognitivo leve de la persona adulta mayor.
III.
AMBITO DE APLICACIÓN
La presente Guía de Práctica Clínica tiene como ámbito de aplicación a la
población adulta mayor con sospecha de deterioro cognitivo que asisten
al consultorio externo del servicio de Geríatría del Hospital Victor Lazarte
Echegaray incluyendo a la población referida de otros servicios del
hospital. También puede servir como referente para los demás hospitales
que brinden atenciones de salud en todo el pais
85
IV.
PROCESO O PROCEDIMIENTO A ESTANDARIZAR
a)
Diagnóstico de Deterioro Cognitivo Leve en el Adulto Mayor
b)
Tratamiento de Deterioro Cognitivo Leve en el Adulto
Mayor: (Intervenciones cognitivas y ejercicio fisico).
4.1 Nombre y código CIE 10:
Deterioro Cognitivo Leve: F06.7
V.
CONSIDERACIONES GENERALES
5.1 DEFINICIÓN:
Deterioro Cognitivo Leve es un estado transicional o intermedio entre la
cognición normal y una demencia.
Es la disminución del rendimiento de las funciones intelectuales desde un
nivel previo más elevado. Ver figura 1.
Se refiere a un déficit mensurable en la cognición en al menos un dominio,
en ausencia de demencia o deterioro en las actividades diarias de la vida
86
LA
ASOCIADO A
LA EDAD
DCL
Figura 1 Continuum del rendimiento cognitivo.
5.2
Etiología:
El desarrollo del deterioro cognitivo leve, se caracteriza por una alteración
cognitiva adquirida y prolongada de una o varias funciones cognitivas que no
corresponde a un síndrome focal y no cumple criterios suficientes de gravedad
como para ser calificada como demencia.
Los factores de riesgo para el desarrollo del DCL pueden estar relacionados con
los aspectos etiológicos o etiopatogénicos de la enfermedad. Estos factores
pueden ser utilizados para valorar el riesgo de la enfermedad: Factores
demográficos,
factores
genéticos,
factores
cardiovasculares,
factores
sensoriales y estilos de vida.
Clasificación del Deterioro cognitivo leve:
o DLC AMNESICO, afectación exclusiva de la memoria
87
o DLC AMNESICO NULTIDOMINIO, alteración de otras funciones, además de
la memoria, como por ejemplo del lenguaje y funciones ejecutorias, praxias,
gnosias, etc.
o DLC NO AMNESICO, no sea memoria
o DLC NO AMNESICO MULTIDOMINIO, afectación de más de una función
cognitiva que no sea la memoria.
5.3
Fisiopatología:
El deterioro cognitivo leve de la Enfermedad de Alzheimer se ubica en algún
punto intermedio del continuum entre el envejecimiento normal y la demencia,
ya que estas personas presentan cantidades variables de depósito de betaamiloide y ovillos neurofibrilares en los Ióbulos temporales mediales.
En relación a la actividad del sistema colinérgico, De Kosky y colaboradores
hallaron que la actividad de la colina acetiltransferasa se encontraba elevada en
el hipocampo y la corteza frontal en pacientes con deterioro cognitivo leve, ya
que observaron una regulación de la misma en estas zonas del cerebro, lo cual
podría corresponder a un mecanismo compensatorio
88
5.4
Aspectos epidemiológicos:
En personas mayores de 75 años la tasa de prevalencia de deterioro cognitivo
leve se encuentra entre el 3 al 20%. *’ siendo los más frecuentes el subtipo
amnésíco vs el no amnésico, en una proporción 2:1. !4) Las cifras de incidencia
varían del 8 -58 por 1000 personas/año.
5.5 Factores de riesgo asociados:
Factores de riesgo relacionados con el deterioro cognitivo
EDAD + ALTERACIONES SENSORIALES + ESTILOS DE VIDA
Fig. 2 Factores de Riesgo relacionados con el Deterioro cognitivo.
López y colaboradores, en el estudio Cardiovascular Health Study, observaron
que el riesgo de desarrollar deterioro cognitivo leve incluía al genotipo APO E4
(para el DCL tipo amnésico), depresión, factores raciales (afroamericanos), bajo
nivel educacional, atrofía e infartos identificados en la resonancia magnética y la
presencia de enfermedad cardiovascular y diabetes
5.5.1 Medio Ambiente:
89
No aplica
5.5.2 Estilos de vida:
La dieta Mediterránea, la actividad física regular, hábitos de sueño regulares, la
estimulación cognitiva y una vida socialmente activa son los factores
relacionados con el estilo de vida que permitirían enlentecer el desarrollo de
demencia y serían especialmente aconsejables a la población en general y
especialmente a pacientes con deterioro cognitivo leve
VI.
CONSIDERACIONES ESPECIFICAS
Cuadro Clínico
6.1
6.1.1 Signos y Síntomas:
Los pacientes con DCL manifiestan principalmente deterioro de memoria,
sobre todo memoria episódica; siendo conscientes de sus deficiencias.
Otras molestias cognitivas, como trastornos del lenguaje (dificultad para
encontrar la palabra deseada), de atención (dificultad para seguir o
centrarse en una conversación), y de habilidades visoespaciales
(desorientación en entornos familiares) podrían configurar un DCL-muIt.
Es fundamental para el diagnóstico una historia dirigida a identificar
distintos aspectos de deterioro cognitivo, como algunos de los siguientes:
Dificultad en aprender y retener la información nueva.
Dificultad con tareas complejas especialmente de planificación.
Capacidad de razonamiento (ser resolutivo en problemas
imprevistos).
90
Orientación.
Lenguaje (disnomias, anomias, parafrasias).
Comportamiento.
Se debe incidir en el inicio de los síntomas cognitivos, ritmo de la
progresión,
empeoramientos
recientes
y
factores
relacionados,
historresencia de síntomas psiquiátricos acompañantes, fármacos y
sustancias tóxicas que consume o ha consumido, cambios en la
personalidad, repercusión en actividades básicas de vida diaria (ABVD) y
actividades instrumentales de vida diaria (AIVD), actividades que ha
dejado de hacer, síntomas neurológicos acompañantes e historia familiar
de demencia.
6.2 Diagnóstico:
6.2.1 Criterios de Diagnóstico
Criterios diagnósticos para deterioro cognitivo leve según Petersen:
A.
Evidencia de un declive cognitivo modesto desde un nivel previo de
mayor desempeño en uno o más de uno de los dominios cognitivos
referidos:
1.
Preocupación del individuo, de un tercero informado o del
facultativo con respecto a un declive modesto en las funciones cognitivas.
2.
Declive en el desempefio neuropsicoiógico, implicando un
desempeño en los tests del rango de una a dos desviaciones estándares
por debajo de lo esperado en la evaluación neuropsicológica reglada o
ante una evaluación clínica equivalente.
91
B.
Los déficits cognitivos son insuficientes para interferir con la
independencia (p. ej., actividades instrumentales de la vida diaria, tareas
complejas como manejo de medicación o de dinero), pudiendo ser preciso
esforzarse más, utilizar estrategias compensatorias o hacer una
acomodación para mantener la independencia.
C.
Los déficits cognitivos no ocurren exclusivamente en el contexto de
un Delirium.
D.
Los déficits cognitivos no son atribuibles de forma primaria a la
presencia de otros trastornos mentales (p. ej., trastorno depresivo mayor,
esquizofrenia).
Exploración Neuropsicológica:
La valoración debe incluir examen de la atención, orientación, lenguaje,
memoria, habilidades constructivas, cálculo, razonamiento y capacidad de
abstracción.
Existen
numerosas
herramientas
neuropsicológicas
que
pueden
emplearse para este fin, pero antes de utilizar cualquiera de ellas conviene
conocer la técnica de administración, la fiabilidad y validez, su
sensibilidad, especificidad y sensibilidad a los cambios.
Debe tenerse en cuenta la influencia de factores como déficits
sensoriales, ansiedad, depresión, edad y nivel educativo a la hora de
interpretar ¡os resultados.
Algunos de los tests breves que se han mostrado útiles en la detección
del deterioro cognitivo son: (ver cuadro 1).
92
93
INSTRUMENTOS DE VALORACION DEL DETERIORO COGNITIVO
Mini Mental State Examination (MMSE): el más empleado, examina la
orientación, atención, cálculo, memoria inmediata y diferida, capacidad
visuoespacial, lenguaje y habilidad constructiva. Para incrementar su valor
predictivo se recomienda corregir la puntuación en función de la edad y del nivel
educativo.
Memory lmpairment Screen (MIS): es una prueba breve (se pasa en cuatro
minutos) que explora la memoria, con cuatro ítems de recuerdo libre y facilitado.
Test de los siete minutos: contiene una selección de sub tests que exploran
aspectos fundamentales que se alteran en la EA: test de recuerdo facilitado,
fluidez por categorías, test de orientación temporal y dibujo de un reloj
Los resultados de los tests deben interpretarse en conjunción con los datos de
la historia. Si éstas sugieren deterioro cognitivo pero la exploración
neuropsicológica está por encima del punto de corte, puede deberse a un nivel
educativo alto, depresión o deterioro cognitivo leve. Una puntuación baja sin
datos en la historia de deterioro puede indicar un bajo nivel cultural, pero también
un escaso reconocimiento de los síntomas por parte del paciente o la familia.
Los pacientes con resultados por debajo del punto de corte requieren una
evaluación neuropsicológica detallada, que proporcione información sobre el
perfil neuropsicológico, lo que puede contribuir al diagnóstico etiológico.
De acuerdo con la escala de deterioro global (GDS- Reisberg), los estadios que
se corresponden con deterioro cognitivo leve son GDS 2 y GDS 3
•
GDS 1 (normalidad)
•
GDS 2 (sujeto normal con quejas subjetivas de memoria)
•
GDS 3 (deterioro cognitivo leve)
6.2.2 Diagnóstico Diferencial:
Diagnóstico diferencial de Deterioro Cognitivo Leve:
a) Delírium: el curso clínico suele ser agudo-subagudo, con fluctuaciones
importantes en el estado mental, y alteraciones en el grado de atención y en el
nivel de conciencia. Es importante su detección porque indica la existencia de
94
enfermedades médicas subyacentes con elevada mortalidad si no se tratan a
tiempo.
b) Depresión: influye negativamente sobre las funciones cognitivas, y puede
confundirse con una demencia, aunque también pueden coexistir en el mismo
paciente. Los pacientes con depresión suele tener más quejas subjetivas de
pérdida de memoria, con frecuencia tienen enlentecimiento psicomotor y escasa
motivación en la realización de los test.
95
6.3 EXAMENES AUXILIARES:
El diagnóstico de deterioro cognitivo leve se basa en una evaluación clínica
completa.
96
El principal objetivo de las pruebas complementarias es descartar causas
potencialmente reversibles de deterioro cognitivo leve, o la presencia de
comorbilidades que puedan contribuir a las alteraciones cognitivas, así como
descartar otros posibles diagnósticos y, en el caso de los estudios de
neuroimagen, apoyar el diagnóstico de los procesos neurodegenerativos.
6.3.1 Patología clínica:
Estudio básico de laboratorio:
•
Hemograma y VSG (velocidad de sedimentación globular).
•
TSH (por sus siglas en inglés, Thyroid-Stimulating Hormone).
•
Iones: incluyendo sodio y calcio.
•
Glucemia y perfil lipidico.
•
Función renal y hepática.
•
Vitamina B12 y ácido fólico.
•
Serología de VIH: solo está indicada si hay antecedentes de riesgo
o clínica compatible
6.3.2 Imágenes:
•
Resonancia Magnética Nuclear Cerebral:
•
Tomografía Espiral Multicorte Cerebral
6.3.3 Exámenes especializados complementarios:
Los estudios de biomarcadores en líquido cefalorraquídeo (tau y proteína
betaamiloide) podrían realizarse solo en casos seleccionados para afinar
el diagnóstico etiológico.
6.4
MANEJO SEGÚN NIVEL DE COMPLEJIDAD Y CAPACIDAD
RESOLUTIVA
97
6.4.1 Medidas generales y preventivas
El abordaje preventivo de los factores de riesgo modificables puede reducir el
riesgo de deterioro cognitivo leve y evitar su progresión, como muchos de los
factores de riesgo son factores de riesgo no transmisibles, las principales
recomendaciones se basan en la reducción de riesgos de enfermedades
cardiovasculares y de nutrición.
6.4.2 Terapéutica del deterioro cognitivo leve:
AI momento actual no hay evidencia sólida a favor del uso de algún fármaco para
prevenir o revertir el DCL. El tratamiento es eminentemente no farmacológico;
hay evidencias del beneficio del uso de estrategias como las intervenciones
cognitivas y el ejercicio físico.
Estimulación cognitiva: Se basa en la teoría de la neuroplasticidad. Incluye
terapias de ‘reorientación en la realidad’, intervenciones cognitivas dirigidas a los
ejercicios diarios (pasatiempos como las ‘sopas de letras’ o los juegos de
atención), los juegos de ordenador dirigidos (Brain training). !”)
•
Terapia de reorientación a la realidad (información sobre su entorno fisico
y social). Mejoría cognitiva, conductuales y funcional.
•
Terapia de la reminiscencia: utiliza elementos del pasado del paciente
(fotos, música, videos).
•
Terapia de la validación: Establecer vías de comunicación con el paciente
a través de la aceptación de la realidad tal como la vive el mismo.
•
Entrenamiento cognitivo: Se realiza sobre funciones concretas (memoria,
atención, etc.) realizando ejercicios de repetición.
Ejercicio físico
98
El ejercicio físico previene el deterioro cognitivo leve. Un minimo de dos horas
de paseo tres veces por semana.
Dieta mediterránea
Ingesta elevada de pescado (preferentemente azul), verduras, legumbres, frutas,
cereales y aceites de oliva y semillas. Disminución en la ingesta de carnes
{especialmente rojas) y grasas saturadas.
Control de factores de riesgo vascular
Hipertensión arterial, diabetes, dislipidemía, tabaco, obesidad
Práctica de aficiones
Jardinería, cocina, viajes. Estimulan las funciones cognitivas y previenen su
deterioro.
Mantener relaciones sociales
Soledad y aislamiento son factores que se asocian con mayor deterioro cognitivo.
-
Se debe evaluar la salud psico-física del cuidador. La sobrecarga del mismo
es frecuente y puede distorsionar la información suministrada.
-
La psi coeducación de la familia y cuidadores colabora efectivamente en el
tratamiento del paciente.
6.4.3 Efectos adversos o colaterales con el tratamiento
No se han descrito efectos adversos del tratamiento no farmacológico en DCL
99
6.4.4 Signos de alarma
La progresión rápida del deterioro cognitivo o una evolución atípica obliga a una
evaluación pronta del caso para descartar factores descompensantes o la
posibilidad de algún diagnóstico diferencial.
6.4.5 Criterios de alta
No aplica ya que los pacientes tendrán seguimiento y controles periódicos en
nuestro servicio de forma indefinida.
6.4.6 Pronóstico
El pronóstico global del paciente depende del control adecuado de factores de
riesgo y control adecuado de las comorbilidades, así como de la implementación
oportuna del tratamiento no farmacológico indicado.
6.5 COMPLICACIONES
-
Riesgo incrementado de desarrollar demencia.
-
Riesgo de desarrollo de delirio y otros síndromes geriátricos.
6.6 CRITERIOS DE REFERENCIA Y CONTRAREFERENCIA
Criterios de referencia:
-
Pacientes adultos mayores
-
Quejas de memoria reportados por el propio paciente o su familiar.
Criterios de contrarreferencia:
100
-
Una vez evaluados y establecido su diagnóstico y plan de atención los
pacientes serán monitoreados periódicamente y aquellos que fueron
referidos serán contrarreferidos a su establecimiento de origen.
6.7 FLUJOGRAMA:
101
VII.
ANEXOS
102
ANEXO 2: Mini Mental Test Examination (T. Folstein)
VALORACIÓN MENTAL: ESTADO COGNITIVO:
Mini Mental State Examination (T. Folstein)
EXPLORE Y PUNTUE SIGUIENDO ESTRICTAMENTE LAS
NORMAS ESTANDARIZADAS
ORIENTACION ( EL EXPLORADOR NO DEBE CORREGIR
LAS RESPUESTAS ERRÓNEAS)
¿En qué año estamos?
0
1
¿En qué estación del año estamos?
¿Qué dia del mes es hoy?
¿Qué día de la semana es hoy?
¿En qué mes del año estamos?
¿En qué país estamos?
¿En qué provincia estamos?
¿En qué ciudad estamos?
¿Dónde estamos en este momento?
¿En qué piso o planta estamos?
0
1
0
1
0
0
1
0
1
0
1
0
1
0
1
0
1
FIJACION
Nombre 3 objetos a intervalos de 1 segundo: bicicleta,
cuchara, manzana.
Dé 1 punto por cada respuesta correcta y repita los nombres
hasta que los aprenda
0 1 2 3 4
ATENCION Y CALCULO
A. Series de 7. Restar de 7 en 7. Parar después de cinco
respuestas
B. Deletrear al revés la palabra mundo (Puntúe la mejor de
las dos opciones)
MEMORIA
0 1 2 3 4
103
104
Pregunte los nombres de los 3 objetos ( bícicleta, cuchara y
0 12 3
manzana)
LENGUAJE Y PRAXIS CONSTRUCTIVA
Señale un lápiz y un reloj, que el pcte. los denomine. 1 punto
cada respuesta correcta
0 12
Haga que el paciente repita : ni sîes, ni noes, ni peros
0
1
Haga que el paciente siga tres õrdene9
Coja este papel con la mano derecha, dõblelo por la mitad y
déjelo sobre la mesa
Dé un punto par cada sección de la orden hecha
correctamente.
0 12 3
El Paciente tiene que leer y hacer Io siguiente : Cierre los
ojos
0
1
Haga que el paciente. escriba una frase (sujeto, verbo y
predicado)
No puntúe las faltas de ortografía
0
1
Haga que el paciente copie el dibujo (dos pentágonos en
intersección)
0
1
30 = Normal 24 : Deterioro Cognitivo 19-23 : Deterioro
Cognitivo Leve 14-18 deterioro Cognitivo Moderado < 14 :
Deterioro cognitivo grave
Max 30
puntos
105
Anexo 3: Test del Reloj
TEST DEL RELOJ
106
TRO positivo si el valor de la suma de las tres puntuaciones (esfera, números y
manecillas) “a la orden” es menor o igual a 6
Anexo 4: Escala de Deterioro Global (GD - FAST)
107
VIII.
REFERENCIAS BIBLIOGRÁFICAS
1.
Montenegro, P. M. 2012. Evaluación y diagnóstico del deterioro
cognitivo leve. Revista de logopedía, foniatría y audiologia. volumen 32
abrí-junio 2012. Pág. 47-56.
2.
Armas J., carrasco M., Angell S. et al. Aproximación a los criterios
diagnósticos para la definición del deterioro cognitivo leve. Revista
Electrónica de las Ciencias Médicas en Cienfuegos. 2009. Medisur; 7(6).
3.
Psicología y Neuropsicología. Diferencia entre: envejecimiento
normal, deterioro cognitivo leve y demencia. 12 febrero 2017.
https://neuropsicologia.saludyeducacioníntegraI.com/diferencias-entreenvejecimiento-normal-deterioro-cognitivo-leve-y-demencia/.
4.
Pose, M., Manes, F. 2010. Deterioro cognitivo leve. Acta
Neurología Colombia Volumen 26. N03 Suplemento 3:1. Pág. 10.
5
Arriola M. E. 2017. Sociedad Españiola de Geriatría y Gerontología.
Deterioro cognitivo leve en el adulto mayor. Documento de consenso.
Pág. 8.
6.
Lopez T. José A. Deterioro Cognitivo leve. ¿Es la antesala de la
demencia? Sociedad española de geriatria y gerontologia. Apr 25, 2018.
https://www.sIideshare.net/RevistaHumanízar/deterioro-cognitivo-levees-la- antesala-de-la-demencia?from action-save
108
7.
Menéndez, G, M. Martinez R. M. fernandez B, Lopez A. 2011.
Archivo de medicina. Estilo de vida y riesgo de padecer demencia. Vol. 7
No. 3:1.
8.
Custodio N., Herrera E., Lira D. et al. 2012. Deterioro cognitivo leve:
¿dónde termina el envejecimiento normal y empieza la demencia? Anales
de la Facultad de Medicina. v.T3 n.4 Lima oct./dic. 2012.
9.
Lopez-Alvarez J. Agüera- Ortíz L. 2015. Nuevos criterios
diagnósticos de la demencia y la enfermedad de Alzheimer. Psicogeriatria
2015; 5 (1).
10.
Tirapu J.
2007. La
evaluación
neuropsico!
9
ca
Psychosocial Intervention vol.16 no.2 Madrid.
11.
Claver-Martin M. Instrumentos de valoración del deterioro cognitivo.
Psicogeriatría 2008; 0: 9-15.
12.
Amor S., Martín E. Tratado de Geriatría para Residentes. Sociedad
Española de Geriatría y Gerontología Principe de Vergara, 1o
D.Madrid.2010, cap.16.
109
GUIA PRÁCTICA CLÍNICA DE DIAGNÓSTICO Y TRATAMIENTO DE SÍNDROME
DE DISMOVILIDAD EN EL ADULTO MAYOR
IX.
FINALIDAD
La presente Guía tiene como finalidad brindar atención adecuada, diagnóstico
oportuno y manejo integral del síndrome de dismovilidad en los pacientes adultos
mayores del Hospital Víctor Lazarte Echegaray.
X.
OBJETIVO
Evitar la pérdida de la movilidad y funcionalidad del paciente adulto mayor
Evaluar y monitorizar la intervención terapéutica
Mejorar la salud y calidad de vida del adulto mayor
ÁMBITO DE APLICACIÓN
XI.
La presente Guía de Práctica Clínica tiene como ámbito de aplicación a la población
adulta mayor que asisten al consultorio externo del servicio de Geriatría del Hospital
Víctor Lazarte Echegaray incluyendo a la población referida de otros servicios del
Hospital. También puede servir como referente para los demás hospitales ESSALUD
que brinden atenciones de salud en todo el país.
XII.
PROCESO O PROCEDIMIENTO A ESTANDARIZAR
c) Diagnóstico y Tratamiento de Síndrome de Dismovilidad en el Adulto Mayor
Nombre y código CIE 10:
SINDROME DE DISMOVILIDAD EN EL ADULTO MAYOR: Z74.0
XIII.
CONSIDERACIONES GENERALES
5.1. DEFINICIÓN:
110
El síndrome de inmovilidad se define como el descenso de la capacidad para
desempeñar las actividades de la vida diaria por deterioro de las funciones
motoras.
Se caracteriza por una reducción de la tolerancia a la actividad física que
provoca debilidad muscular generalizada y, en casos graves, pérdida de
automatismos y reflejos posturales. (1,2)
Otro grupo incluye el término de “desplazamiento”, definiéndolo como la
“restricción, generalmente involuntaria, en la capacidad de transferencia y/o
desplazamiento de una persona a causa de problemas físicos, funcionales o
psicosociales.”
No obstante, se ha comprobado que el deterioro de las actividades de la vida
diaria, progresa no sólo a partir de deterioro de las funciones motoras, sino
desde el deterioro progresivo de cualquiera de las esferas: biológica,
psíquica, social, espiritual o funcional, lo que, eso sí, termina por afectar de
alguna manera la capacidad de moverse del paciente. (3)
5.2. ETIOLOGÍA:
Enfermedad articular degenerativa.
Estados post-fractura de cadera.
Enfermedad vascular cerebral (EVC)
Falta de acondicionamiento físico, asociado a enfermedad aguda o
dolor.
Estados depresivos
Dolor
Medicamentos
(ejemplo:
benzodiacepinas,
metoclopramida,
cinarizina, haloperidol, etc.) (4)
111
112
113
5.3.
FISIOPATOLOGÍA
Con el envejecimiento se produce una limitación en las actividades
desarrolladas de forma fisiológico por lo que los sistemas del organismo
y que pueden hacer al anciano más sensible a factores externos. Todos
estos cambios se verán potenciados en el anciano con inmovilidad. Los
principales cambios que se presentan son a nivel cardiovascular
(disminución del gasto cardiaco, fracción de eyección y distensibilidad del
ventrículo izquierdo), respiratorio (disminución de la capacidad vital y la
presión de oxígeno, alteración del reflejo tusígeno y la movilidad ciliar),
musculo esquelético (disminución de la fuerza muscular, coexistencia de
osteoporosis y marcha senil) y sistema nervioso (alteración del sistema
propioceptivo y reflejos) (4)
5.4.
ASPECTOS EPIDEMIOLÓGICOS
Generalmente las mayores a 65 años presentan dificultad de movimiento
en un 18% y mayores a 75 años en un 50%. La prevalencia de síndrome
de inmovilidad aumenta con la edad. De un 7 a un 22% de los ancianos
hospitalizados sufren de restricciones físicas; el 50% de los ancianos
hospitalizados en forma aguda fallecen a los 6 meses (4)
5.5.
FACTORES DE RIESGO ASOCIADOS
Las principales causas de inmovilidad en el adulto mayor son la falta
de fuerza o debilidad, la rigidez, el dolor, alteraciones del equilibrio,
114
reposo prolongado en cama, caídas, fractura de cadera y problemas
psicológicos, entre otros. (5)
5.5.1. MEDIO AMBIENTE:
Medio ambiente físico, familiar y social.
5.5.2. ESTILO DE VIDA:
Estilo de vida sedentario secundario la progresión de la Dismovilidad.
5.5.3. FACTORES HEREDITARIOS:
No aplica.
XIV.
CONSIDERACIONES ESPECIFICAS
6.1. CUADRO CLÍNICO
6.1.1. SIGNOS Y SINTOMAS
Cualquier trastorno de la locomoción capaz de afectar la realización de
distintas actividades de la vida diaria, y que puede en algunos casos llegar
hasta la inmovilidad.
6.1.2. INTERACCIÓN CRONOLOGICA
Dismovilidad aguda: existe un lapso corto entre la ocurrencia del evento
desencadenante y el diagnóstico, que puede incluso ser inmediato. Esto
permite sindicar claramente una enfermedad causal. Además, el nivel de
funcionalidad previo del paciente es normal, lo que es muy frecuente de
observar. Dismovilidad larvada: en general va progresando lentamente, los
periodos de paso entre una etapa y otra, se hacen laxos, y las etapas sufren
115
periodos de traslape, lo que dificulta determinar la etapa precisa en que se
encuentra. (4)
El tiempo que se trata de hacer el diagnóstico es mayor, y las enfermedades
causales, generalmente varias, suelen perderse en el tiempo, al igual que en
el momento en el que se comenzó a establecer la dismovilidad. (4)
116
6.1.3. GRÁFICOS
117
6.2.
DIAGNÓSTICO:
6.2.1. CRITERIOS DIAGNÓSTICOS
La
evaluación
geriátrica
integral
es
un
proceso
diagnostico
multidisciplinar, dinámico, y pluridimensional, diseñado para identificar y
cuantificar los problemas físicos, funcionales, psíquicos, y sociales, que
provocan alteraciones que con frecuencia llevan al adulto mayor a la
incapacidad como a la inmovilidad.
6.2.2. DIAGNÓSTICO DIFERENCIAL
No aplica
6.3.
EXAMENES AUXILIARES:
6.3.1. DE PATOLOGIA CLINICA
Según la sospecha ejemplo: TSH, T4L, Hb, Vitamina B12.
6.3.2. DE IMÁGENES
Según la sospecha ejemplo: RX, TAC, RM.
6.3.3. DE EXAMENES ESPECIALIZADOS COMPLEMENTARIOS.
No aplica.
6.4.
MANEJO SEGÚN NIVEL DE COMPLEJIDAD Y CAPACIDAD
RESOLUTIVA
118
El manejo debe ser proactivo y no reactivo; se deben prevenir los
problemas informando al paciente y familiares sobre las posibles
complicaciones y no sólo en solucionar los problemas. La intervención
de terapia ocupacional en personas que presentan el síndrome de
inmovilidad propone una intervención que no pretende cambiar las
carencias fisiológicas o psicológicas, sino facilitar el desempeño en
diversas actividades de loa vida diaria mediante la activación de
dichas actividades a través de diferentes métodos compensatorios
como las modificaciones ambientales, el equipamiento adecuado y la
asistencia. (4)
6.4.1. MEDIDAS GENERALES Y PREVENTIVAS
La mejor medida preventiva es mantener el grado de movilidad.
Diversos estudios coinciden en señalar el ejercicio físico como
principal factor para prevenir la inmovilidad.
Los beneficios del ejercicio físico no disminuyen con la edad.
Mejora la fuerza muscular, y, por tanto, mejora la deambulación,
incrementa la masa ósea, mejora la hiperglicemia, retrasando el inicio
de tratamiento de la insulina, disminuye los niveles de triglicéridos en
sangre y aumenta el colesterol HDL. Disminuye la ansiedad y los
síntomas depresivos.
A nivel cardiovascular, disminuye la respuesta hipertensiva, y mejora
la capacidad de reserva cardiaca, y la extracción de oxigeno de
tejidos periféricos.
Para ancianos frágiles están recomendados ejercicios de baja
intensidad y aérobicos.
En ancianos hospitalizados o institucionalizados es fundamental
potenciar la realización de actividades fuera de la habitación, y de
acuerdo con sus posibilidades.
Se recomienda en ancianos sanos, <75 años: ejercicios de moderada
a alta intensidad aeróbicos, y de resistencia, y en >75 años, ejercicios
de moderado esfuerzo o de fortalecimiento. En ancianos entrenados
que se puede realizar ejercicios aeróbicos de alta intensidad. (7)
119
6.4.2. TERAPEÚTICA
El tratamiento se basa en el diagnóstico integral del paciente: diagnóstico
motor, diagnóstico de enfermedades concomitantes, y diagnóstico social.
(Cuadro 2,3 y4) (7)
120
6.4.3. SIGNOS DE ALARMA
Reducción de la tolerancia a la actividad física provocando debilidad
muscular generalizada y, en casos graves, dependencia total. (7)
6.4.4. CRITERIOS DE ALTA
No aplica
6.4.5. PRONÓSTICO
En relación con la evolución de las etapas de Dismovilidad y su cuadro clínico
asociado. (7)
121
6.5. COMPLICACIONES
Los sistemas más afectados por la inmovilidad son el cardiovascular y
músculo esquelético.
-Cardiovascular: presenta alteración de flujo sanguíneo con aumento del
retorno venoso y disminución de las frecuencias cardiaca, que puede
provocar tendencia sincopal y fatigabilidad. Trombo embolismo, hipotensión
ortostatica.
-Músculo esquelético: presenta una disminución de hasta un 55%de fuerza
muscular a las 6 semanas de inmovilización y de 1-3%al día. Atrofia muscular
de predominio en músculos flexores. Las articulaciones más afectadas son
las de tobillo y cadera, con debilidad en la estructura de soporte por la
disminución del contenido de agua y recambio de colágeno provocando
desorganización de sus fibras.
Hay también pérdida de masa ósea dependiendo del estrés al que sea
sometido el hueso, dentro de las cuales las vértebras son la más susceptible.
Puede ocurrir osteoporosis por inmovilización y posturas viciosas.
-Respiratorio: se presenta un aumento en la producción de moco, hay
disminución del movimiento ciliar. Pude ocurrir bronconeumonía por
aspiración.
También se presenta calcificación costocondral provocando
disminución de la expansión de la caja torácica. Disminución de la capacidad
vital y aumento del volumen residual.
-Genitourinario: presencia de cálculos e infecciones urinarias recurrentes.
Sistema nervioso: alteración del equilibrio y coordinación.
-Sistema
digestivo:
anorexia,
trastornos
de
deglución,
reflujo
gastroesofágico, constipación
-Sistema endocrino: hiperglicemia causada por resistencia a la insulina.
Aumento de parathormona deficiencia inmunológica. Balances minerales
negativos.
122
-Piel: si lo asociamos directamente al adulto mayor, los cambios en la piel
en el envejecimiento los vuelve más susceptibles a desarrollar necrosis
cutánea. La presión continua sobre la piel mayor al riego capilar de 32mmhg
por más de 2 horas favorece al desarrollo de ulceras de presión. Otros
factores que las favorecen son la fricción, desnutrición e hipoxemia. (4)
6.6. PREVENCIÓN
Se puede dividir en primaria, secundaria y terciaria.
-Primaria: se busca mantener el grado de movilidad, el ejercicio de ajustará
según la patología y severidad de la misma. En el caso de los ancianos
enfermos más frágiles se les recomienda ejercicios de baja intensidad y
aeróbicos; en cambio en los ancianos hospitalizados o institucionalizados, en
fundamental potenciar las actividades fuera de la habitación según
posibilidad. Los ejercicios se recomiendan suspender en caso de dolor,
disnea, mareos o inestabilidad. (4)
-Secundaria: una vez insaturada la inmovilidad, es muy importante la
detención precoz. Una vez detectada la clínica, se debe incluir una serie de
adaptaciones del entorno que favorezcan los desplazamientos y estimulen el
mantenimiento de la autonomía. Dentro de las medidas se encuentran, el
evitar barreras arquitectónicas, estimular la independencia y adaptaciones
técnicas (facilidad para abrir las puertas, pasillos y habitaciones amplias,
retirar muebles que interfieran con la deambulación, utilizar bandillas para el
apoyo, adecuada iluminación entre otras. (4)
123
-Terciaria: incluye tratamiento complicaciones.
6.7. CRITERIOS DE REFERENCIA Y CONTRAREFERENCIA
CRITERIOS DE REFERENCIA:
-Pacientes adultos mayores
-Pacientes con diagnóstico de dismovilidad
CRITERIOS DE CONTRAREFERENCIA:
-Una vez evaluados y establecido el diagnóstico y plan de atención, los
pacientes serán monitoreados periódicamente y aquellos que fueron
referidos serán contrareferidos a su establecimiento de origen.
6.8. FLUXOGRAMA
124
XV.
ANEXOS
125
ANEXO 1: ETAPAS DE LA DISMOVILIDAD
ANEXO 2: CONTINUM DE LA DISMOVILIDAD EN ADULTOS MAYORES
(DINAMARCA 2012)
XVI.
REFENCIA BIBLIOGRAFIA O BIBLIOGRAFIA
126
1. DR. DINAMARCA, JOSÉ. RECONCEPTUALIZACIÓN DEL SÍNDROME DE
INMOVILIDAD. HOSPITAL GERIÁTRICO DE LIMACHE. CHILE. 2004
2. JIMÉNEZ ROJAS, C Y CARRILLO MANRIQUE, B. MANUAL DE GERIATRÍA
SALGADO ALBA, EDITORIAL MASSON, 3ª EDICIÓN, BARCELONA 2002.
3. GONZÁLEZ
MONTALVO,
J
Y
ALARCÓN
ALARCÓN,
T.
GRANDES
SÍNDROMES GERIÁTRICOS, CONCEPTO Y PREVENCIÓN DE LOS MÁS
IMPORTANTES, MEDICINE 2003, 8 (108):5778-5785).
4. GONZÁLEZ, L. SINDROMRE DE INMOVILIZACION EN EL ADULTO MAYOR.
REVISTA MÉDICA DE COSTA RICA Y CENTROAMERICA LXXI. 2015 (616).
551-555
5. SECRETARIA DE SALUD EN MÉXICO. GUÍA DE PRÁCTICA CLÍNICA.
INTERVENCIONES DE ENFERMERIA EN LA ATENCION DEL ADULTO
MAYOR CON SÍNDROME DE INMOVILIDAD. MEXICO. 2014.
6. DINAMARCA, JL. DISMOVILIDAD EN GERITRIA: UNA DÉCADA DEFINIENDO
UN CONCEPTO CLÍNICO. HOSPITAL VIÑA DEL MAR. 2012. 68(2). 15-19.
7. GUÍAS DE PRÁCTICA CLÍNICA DE DIAGNÓSTICO Y TRATAMIENTOSERVICIO DE GERIATRÍA. HOSPITAL NACIONAL ARZOBISPO LOAYZA.12
DE MARZO DEL 2021.
GUIA PRÁCTICA CLÍNICA DE DIAGNÓSTICO Y TRATAMIENTO DEL
TRASTORNO DE LA MARCHA EN EL ADULTO MAYOR
127
I.
FINALIDAD
La presente Guía tiene como finalidad brindar atención adecuada, diagnóstico
oportuno y manejo integral del trastorno de la marcha en los pacientes adultos
mayores del Hospital Víctor Lazarte Echegaray.
II.
OBJETIVO
III.
Detección temprana del trastorno de la marcha en adulto mayor.
ÁMBITO DE APLICACIÓN
La presente Guía de Práctica Clínica tiene como ámbito de aplicación a la población
adulta mayor que asisten al consultorio externo del servicio de Geriatría del Hospital
Víctor Lazarte Echegaray incluyendo a la población referida de otros servicios del
Hospital. También puede servir como referente para los demás hospitales ESSALUD
que brinden atenciones de salud en todo el país.
IV.
PROCESO O PROCEDIMIENTO A ESTANDARIZAR
a) Diagnóstico y Tratamiento del Trastorno de la Marcha en el Adulto Mayor.
Nombre y código CIE 10:
OTRAS ANORMALIDADES DE LA MARCHA Y MOVILIDAD Y LAS NO
ESPECIFICADAS: R26.8
DIFICULTAD PARA CAMINAR, NO CLASIFICADA EN OTRA PARTE: R26.2
V.
CONSIDERACIONES GENERALES
5.1. DEFINICIÓN:
128
Lentificación de la velocidad de la marcha, inestabilidad, alteración en las
características del paso (base, longitud, rangos del movimiento), o
modificación en la sincronía de ambas, por sobre lo esperable para la edad,
generando ineficacia para el desplazamiento y alterando las actividades de
la vida diaria. (1)
Los trastornos de la marcha son problemas frecuentes en la edad geriátrica
y constituyen un factor limitante de las actividades de la vida diaria, aun en
ausencia de enfermedad, debido a que se altera la estabilidad de la posición
erguida, el control del equilibrio y la coordinación del movimiento. Esto
supone una pérdida de la ambulación independiente y aumento de la
morbilidad; además, se considera un factor importante para el ingreso a
residencias de ancianos. (2)
5.2. ETIOLOGÍA:
Evaluar las causas de los trastornos de la marcha y el equilibrio en los
ancianos no es un trabajo fácil ni sencillo. Puede ser una tarea ardua
reconocer y diagnosticar, en el ámbito de la atención primaria, estas
alteraciones que se pueden presentar como manifestaciones sutiles, no muy
diferenciadas de los cambios relacionados con la edad; frecuentemente sin
poder constatar una única causa (pueden ser multifactoriales hasta en el
75% de los casos), y con múltiples enfermedades que pueden evolucionar
simultáneamente.
La casuística sobre el origen de estas alteraciones puede variar dependiendo
del ámbito de estudio practicado. En una consulta de neurología, las causas
más frecuentes se relacionan con: ataxia sensorial (18%), miopatía (17%,
sobre todo
cervical),
accidente
vasculocerebral
(15%),
parkinsonismo
(12%),
hidrocefalia normotensiva y alteraciones cerebelosas y sensoriales (visuales,
vestibulares, propioceptivas). En cambio, en estudios comunitarios, los
trastornos osteoarticulares son más frecuentes que los neurológicos, hasta
representar en alguna publicación el 43% de todos los trastornos de la
marcha, seguidos por la hipotensión ortostática. También el dolor articular,
129
en individuos mayores de 88 años que viven en la comunidad, puede ser la
causa más destacada de
estas dificultades, en uno de cada tres casos. (3)
A consecuencia del envejecimiento observamos: cambios en la postura del
cuerpo; un menor balanceo en las extremidades superiores; la longitud del
paso disminuye y se amplía la base de sustentación; la velocidad se reduce
un 1% cada año a partir de la década de los 60; se prolonga la fase bipodal,
y
se
producen
diferentes
niveles
de
afectación
en
el
sistema
musculoesquelético que participa en la marcha (como el tobillo, el pie, la
rodilla, la cadera, la columna vertebral y la masa muscular). Véase la tabla 1.
(3)
La marcha senil se caracteriza por una postura del cuerpo con discreta
proyección anterior de cabeza, flexión del tronco, caderas y rodillas. Las
extremidades superiores tienden a realizar un menor balanceo y el
desplazamiento vertical del tronco se reduce. El largo del paso disminuye y
el ancho del paso se incrementa levemente. Los ancianos tienen una fase
de balanceo reducida a expensas de la fase de doble apoyo. El doble apoyo
aumenta con la edad de un 15-20% del ciclo de marcha hasta el 25-30%.
Durante la fase de doble apoyo el centro de gravedad se encuentra entre los
130
pies, lo que favorece la estabilidad. El ritmo al caminar se relaciona con el
largo de las piernas y no cambia excepto que existan patologías. (4)
5.3. FISIOPATOLOGÍA
El ciclo normal de la marcha se define como el período entre los puntos en
los que el talón del mismo pie toca el suelo.
El patrón del movimiento rítmico de la marcha humana se establece a nivel
de la médula espinal, donde los llamados generadores de patrones centrales,
es decir, grupos coordinados de interneuronas controlan la activación
alternada entre músculos agonistas y antagonistas durante el ciclo de la
marcha.
131
Como se mencionó anteriormente, para una marcha normal es necesario la
normal actividad de varias funciones y sistemas: función locomotora (para
iniciar y sostener una marcha rítmica), equilibrio, reflejos posturales, función
e integración sensorial motora, sistema músculo-esquelético y función
cardiopulmonar.
Los nervios aferentes del sistema visual, vestibular y propioceptivo proveen
información esencial de la posición del cuerpo y sus segmentos. Un sistema
central integrado por áreas en la corteza frontal, los ganglios basales, el
tronco encefálico y el cerebelo interpreta la información recibida y selecciona
el programa motor para caminar.
El sistema eferente que compromete las vías descendentes incluye la vía
piramidal, los nervios periféricos, la placa neuromuscular y músculos.
En las últimas décadas se demostró la influencia del estado cognitivo en el
patrón de la marcha; las funciones ejecutivas frontales, la percepción
visuoespacial y la atención contribuyen a la seguridad durante la marcha y al
planeamiento para evitar obstáculos. (5)
Aunque algunas veces la caída tiene una causa única, lo más común es que
tenga un origen multifactorial, en el que interaccionan:
a) Factores intrínsecos o propios de la persona, se pueden considerar:
las
alteraciones
fisiológicas
propias
del
envejecimiento,
las
enfermedades agudas y crónicas que presenta la persona mayor, así
como el efecto de los tratamientos farmacológicos que recibe por ellas.
b) Factores extrínsecos o ambientales, son los relativos al ambiente en
que se mueve la persona mayor, como elementos arquitectónicos, de
luminosidad, elementos de uso personal. Su contribución al porcentaje
total de caídas es superior al 50%.
c) Factores circunstanciales, son los relacionados con la actividad que se
está realizando, como los relativos a la altura en que se desarrolla la
acción (bipedestación, sedestación, subido en una altura), la velocidad
(caminar despacio, deprisa, correr), etc. Entre las actividades que se
132
asocian con más frecuencia a las caídas figuran levantarse y meterse en
la cama, sentarse y levantarse de la silla, subir y bajar escaleras. (6)
El riesgo de caída aumenta linealmente con el número de factores. Pero por
ello no debe concluirse que las caídas son un fenómeno inevitable en el
adulto mayor, ya que muchos de estos factores de riesgo son modificables o
evitables. (6)
FACTORES QUE ALTERAN EL EQUILIBRIO EN EL ADULTO MAYOR
5.4. ASPECTOS EPIDEMIOLÓGICOS
Los trastornos de la marcha se incrementan con la edad. En un estudio
efectuado en 467 personas se detectaron trastornos de la marcha en
individuos de 65 a 74 años (13%), 75 a 84 años (28%) y de 85 años o más
(44%).
133
Las irregularidades del equilibrio implican riesgos de caídas y lesiones
relacionadas con éstas. Cada año, 20 a 30% de los ancianos que viven de
forma independiente sufre caídas. En 25% de los casos se produce una
lesión de consideración y en 5% una fractura. La frecuencia de las caídas
secundarias a las anormalidades de la marcha y sus consecuencias, como
las fracturas de cadera y la subsiguiente necesidad de hospitalización o
atención en casa, conduce muchas veces a la pérdida de la capacidad
ambulatoria y es el comienzo de un deterioro progresivo del estado funcional
y la salud. (2)
5.5. FACTORES DE RIESGO ASOCIADO
MEDIO AMBIENTE
Movilidad
Fuerza
ESTILOS DE VIDA
Habito corporal
Tipo de calzado
FACTORES HEREDITARIOS
Edad
Sexo
VI.
CONSIDERACIONES ESPECIFICADAS
6.1. CUADRO CLINICO
6.1.1. SIGNOS Y SINTOMAS
- Evolución de trastorno de la marcha en el tiempo
-Sincope
-Vértigo
-Caída
134
-Temblor
-Falta de fuerza
-Dolor
-Rigidez
-Alteración sensitiva
-Síndromes Geriátricos: deterioro cognitivo, incontinencia, constipación,
polifarmacia.
6.1.2. INTERACCIÓN CRONOLÓGICA
- Capacidad de la marcha intra y extra domiciliaria
- Disminución de la velocidad
- Disminución de la longitud de la zancada y aumento de su anchura
- Disminución de la longitud del paso
- Disminución de la cadencia
- Disminución del ángulo del pie con el suelo
- Prolongación de la fase bipodal
- Reducción de tiempo de balanceo/tiempo de apoyo
- Aumento de anchura del paso y disminución de la altura. Pérdida del
balanceo de los brazos
- Reducción de las rotaciones pélvicas
- Menor rotación de cadera y rodilla
135
6.1.3. GRÁFICOS, DIAFRAGMAS
Datos obtenidos del artículo de la Revista Médica Herediana, sobre
Velocidad de la marcha en adultos mayores de la comunidad en Lima, Perú.
(7,8)
136
6.2 DIAGNÓSTICO
6.2.1. CRITERIOS DE DIAGNÓSTICO
-Lentificación de la velocidad de la marcha.
-Alteración de las características del paso (base, longitud, rangos de
movimiento)
-Inestabilidad o modificación en la sincronía de ambas extremidades
inferiores (EEII).
-Desviación en la trayectoria. (8)
6.2.2. DIAGNÓSTICO DIFERENCIAL O VARIEDADES DE MARCHA
ANORMAL
Marcha con steppage: Se produce por paresia de los músculos
dorsiflexores del pie en las polineuritis, lesiones del nervio ciático poplíteo
externo o ciático mayor, lesiones de la cola de caballo, algunas formas de
esclerosis lateral amiotrófica o miopatías distales. El paciente eleva mucho
la rodilla al dar el paso, con el pie colgante, y al caer es la punta o la planta,
no el talón, las que golpean sobre el suelo. Al no poder levantar la punta del
pie, el paciente tropieza con alfombras y escalones, sufre frecuentes
esguinces de tobillo y se cae al suelo con facilidad.
Marcha de pato o miopática: Se debe a la debilidad de los erectores del
tronco y de los grandes músculos (glúteos, iliopsoas) de la cintura pelviana.
Es característica de las distrofias musculares y las atrofias musculares
espinales. Con un equilibrio del tronco muy inestable, el paciente camina
bamboleando las caderas con las piernas separadas y el vientre prominente
(aumento de la lordosis lumbar).
Marcha tabética: Se debe a trastornos importantes de la sensibilidad
profunda (posición articular). La falta de seguridad en la marcha aumenta
cuando se suprime la ayuda visual y el signo de Romberg es positivo. Los
137
pacientes caminan con los ojos fijos en el suelo a cada paso que dan, que
suele ser brusco golpeando el suelo. Este tipo de marcha se observa en la
tabes (neurosífilis) y en las polineuritis sensitivas paraneoplásicas o
familiares, en algunos casos de síndrome de Guillain-Barré, en la esclerosis
múltiple y en la carencia de vitamina B 12.
Marcha espástica: Se caracteriza por la hipertonía de una o ambas piernas
que no se flexionan por la rodilla. La pierna se avanza tiesa, incluso con el
pie en ligera flexión y rotación interna (equino-varo) y la planta del pie roza
con el suelo. En casos extremos, por la hipertonía de los músculos aductores
del muslo, el paciente avanza penosamente una pierna que se cruza delante
de la otra a cada paso (marcha en tijera).
Marcha cerebelosa: Es propia de las lesiones del vermis. Se caracteriza por
el desequilibrio tanto con ojos abiertos como con ojos cerrados. En casos
leves se pone de manifiesto en la marcha en tándem (contar pies). En casos
graves, el paciente anda con las piernas separadas, titubea, busca apoyo,
da pasos cortos dismétricos, puede sufrir oscilación de la cabeza y el tronco,
si se para le cuesta encontrar la posición de equilibrio y puede caer,
generalmente hacia atrás.
Marcha parkinsoniana: En fases precoces, el paciente arrastra algo los
pies, da pasos cortos, descompone el giro en dos o tres movimientos, va con
la cabeza y el tronco algo inclinados y bracea poco. Más adelante aparece
pérdida del equilibrio y tendencia a caer hacia atrás (retropulsión) o hacia
delante (propulsión) por la pérdida de reflejos posturales. La tendencia a
inclinarse hacia delante provoca una aceleración de los pasos o festinación.
También se observa dificultad para iniciar el paso, en los giros o en pasos
estrechos (congelación o freezing). Marcar un ritmo (el paso como los
soldados) puede ayudar a vencer momentáneamente el bloqueo.
En la apraxia de la marcha no hay dificultad para mover las piernas en
sedestación o decúbito, pero no se pueden despegar los pies del suelo ni se
138
puede dar un paso estando de pie. Es característica de la hidrocefalia del
adulto.
Marcha senil: Los trastornos de la marcha en los ancianos, como los del
equilibrio y las caídas, suelen ser multifactoriales. No obstante, algunas
personas mayores tienen una marcha cautelosa, insegura, buscando apoyo
sin que presenten ninguna anomalía objetiva en el examen neurológico. (4)
6.3. EXÁMENES AUXILIARES
6.3.1. PATOLOGÍA CLÍNICA
ESTUDIO BÁSICO DE LABORATORIO (7)
-
Hemograma y VSG (velocidad de sedimentación globular)
-
TSH (por sus siglas en inglés, Thyroid-Stimulating Hormone)
-
Iones: incluyendo sodio y calcio
-
Glucemia y perfil lipídico
-
Función renal y hepática
-
Vitamina B12 y ácido fólico
6.3.2. IMÁGENES (4)
139
6.3.3. EXÁMENES ESPECIALIZADOS COMPLEMENTARIOS
Test de Romberg progresivo: se solicita al paciente que se mantenga
parado, con los pies juntos durante 10 segundos, con los ojos abiertos y
cerrados; luego se repite con los pies en semitandem y tándem para
aumentar la sensibilidad del test. Los pacientes con déficits vestibulares y
propioceptivos pierden estabilidad al cerrar los ojos.
Apoyo Monopodal: tiempo que se mantiene el paciente sobre un pie. Es un
muy buen predictor de caídas. Menos de 5 segundos es anormal.
Test de alcance funcional: mide la distancia que un paciente puede
alcanzar con su brazo extendido mientras permanece de pie sin desplazar
sus pies. Este test predice caídas cuando es menos de 10 cm.
Test “get up and go”: es sencillo de realizar en la clínica cotidiana. El
paciente debe levantarse de una silla sin usar los brazos, caminar tres metros
en línea recta, girar y regresar a sentarse en la silla sin utilizar los brazos,
controlando el tiempo que lleva realizarla. Tiene buena correlación con
movilidad funcional y equilibrio. El tiempo mayor a 14 segundos se asoció a
mayor riesgo de caídas.
Test de la tarea doble: evalúa la capacidad de marcha mientras el paciente
realiza una tarea cognitiva como nombrar animales o restar números. La
marcha cautelosa o enlentecida al realizar la doble tarea es característico de
las alteraciones corticales o subcorticales, mientras que los pacientes con
trastornos ansiosos mejoran su marcha al concentrarse en una segunda
tarea.
Test de velocidad de marcha: se mide el tiempo en segundos que demora
el paciente en recorrer 10 metros en línea recta. Menos de 1m/s es predictor
de eventos adversos en la tercera edad. La velocidad de marcha mayor a
0,8mts/seg se correlaciona con una buena capacidad de marcha extra
domiciliaria en pacientes con secuelas de ACV.
140
Test de marcha de 6 minutos: mide el número de metros recorridos al
caminar en un trayecto de 30 metros ida y vuelta durante seis minutos.
Permite obtener la velocidad de marcha y se correlaciona con la condición
aeróbica, capacidad funcional y morbimortalidad.
Escala de equilibrio de Berg: valora diversos aspectos como transferencias
de sedente a bípedo, bipedestación con ojos cerrados o pies juntos,
monopedestación, tándem, alcance funcional, recoger un objeto del suelo,
entre otras. Su puntuación máxima es de 56 puntos y cuando es menor de
46 predice la aparición de caídas. Es realizado por kinesiólogos entrenados.
Test de Tinetti: permite una valoración más objetiva del equilibrio y de la
marcha para detectar riesgo de caídas. Tiene que ser realizado por personal
de salud entrenado y demora 10 a 20 min. El puntaje máximo es 28 puntos
y el punto de corte para riesgo de caída es 20 puntos.
Posturografía: evalúa objetivamente el control postural a través del estudio
del movimiento del centro de presión de cuerpo. Entrega información sobre
el funcionamiento de los sistemas visual, somato-sensorial y vestibular,
estrategias de movimiento para el mantenimiento del mismo, límites de
estabilidad de la persona y capacidad de control voluntario de su centro de
gravedad para evaluación y tratamiento. (4)
6.4. MANEJO SEGÚN NIVEL DE COMPLEJIDAD Y CAPACIDAD
RESOLUTIVA
6.4.1. MEDIDAS GENERALES Y PREVENTIVAS
Un programa regular de marcha 30 min/día es la mejor y la más sencilla
fórmula para mantener la movilidad.
La prevención también incluye:
-
Estiramiento
-
Ejercicios para mejorar el equilibrio
141
-
Entrenamiento de resistencia esto para mantener los rangos articulares,
fuerza muscular y control motor (8)
6.4.2. TERAPÉUTICA
El tratamiento, si bien no es específico, debe ser multidisciplinario: medidas
generales como tratamiento del dolor, suplementos (vitamina D, vitamina
B12, tiamina), referir a fisiatría para rehabilitación de la marcha, equilibrio y
de la postura, suspensión de fármacos, cirugía de cataratas, tratamiento de
estados depresivos y otros trastornos afectivos; además de modificaciones
del entorno. (5,9)
Siempre estaría recomendada la acción del rehabilitador en conjunto con el
fisioterapeuta, en cuanto a la prescripción de ejercicios para tratar
determinadas condiciones y mejorar alteraciones de la marcha. Realizar
ejercicios enfocados a potenciar el balance articular, la postura y la dirección
de la marcha, el peso y la velocidad consiguen un efecto beneficioso para
esta.
No obstante, el resultado del tratamiento se pierde en unas semanas, con lo
que hay que educar al paciente para que continúe con ellos en su casa, de
forma pautada y permanente.
Para ayudar a los pacientes con dificultad para la deambulación de forma
autónoma, y así evitar las caídas de forma secundaria y el síndrome
poscaída, tenemos diversas ayudas técnicas. Disponemos de: bastones de
mano o convencionales; de tipo canadiense; andadores de dos, de cuatro
patas y de ruedas. (3)
Los programas de ejercicios producen mejores resultados si incluyen una
variedad de ejercicios de resistencia, rangos articulares, flexibilidad,
fortalecimiento y equilibrio en forma individualizada. (Recomendación grado
A por nivel de evidencia I)
142
Antes de realizar ejercicios se debe controlar el dolor utilizando la fisioterapia
pertinente. Algunos ejemplos son el calor superficial (compresas calientes,
infrarrojo), calor profundo (onda corta) y electro analgesia (TENS). Luego se
debe mejorar la condición aeróbica, movilidad articular, elongación de los
músculos flexores, (que habitualmente están contraídos) y fortalecimiento de
músculos peroneos, tibial anterior, gastronemios, cuádriceps, glúteos,
iliopsoas y estabilizadores dinámicos del tronco. En pacientes con dolor
difuso de tronco y/o EEII y limitación de su movilidad por dolor y/o déficit de
fuerza el uso de piscina termal produce alivio del dolor y permite trabajar los
rangos de movimiento y la fuerza.
La reeducación del equilibrio comienza promoviendo el equilibrio en posición
sedente con apoyo, luego sin apoyo, bípedo estático, hasta llegar a bípedo
dinámico. Se puede incorporar el uso de elementos para equilibrio estático
y dinámico como balones, plata-formas bidireccionales o multidireccionales,
cama elástica y colchonetas de distintas densidades (nivel de evidencia tipo
III).
Algunos pacientes deben llevar un cinturón de asistencia para evitar caídas.
Los ejercicios de Frenkel se pueden incorporar para mejorar el equilibrio en
giros. El trabajo del esquema corporal se refuerza al realizarlo frente a un
espejo. En esta etapa se debe incluir el entrenamiento en transferencias.
Se ha postulado que el entrenamiento con vibración corporal completa sería
beneficioso para mejorar la fuerza, la densidad mineral ósea y el equilibrio,
bien tolerado por los pacientes y sin efectos adversos (recomendación B).
Consiste en la aplicación de frecuencias vibratorias variables creadas
mecánicamente por una plataforma vibratoria y transmitida al cuerpo a través
de los pies o las manos que están en contacto con la plataforma, por lo que
el cuerpo automáticamente se ajusta a este mecanismo de estimulación,
respondiendo con un reflejo de estiramiento muscular que se va
acomodando constantemente.
143
Se encontró que, en adultos mayores institucionalizados, 6 semanas de
entrenamiento con vibración corporal mejora el equilibrio y la movilidad. Otro
estudio demostró el efecto beneficioso de un programa de entrenamiento con
vibración corporal más terapia convencional (fortalecimiento, equilibrio,
marcha), por sobre la terapia convencional en la velocidad de marcha en 10
mts y el tiempo de apoyo monopodal en adultos mayores.
El entrenamiento de la locomoción puede iniciar con arnés de sujeción, en
especial cuando el equilibrio del paciente es precario. Luego barras
paralelas, progresando hasta la marcha con ayudas técnicas. Una vez que
el paciente camina con seguridad sobre terreno plano puede comenzar el
reentrenamiento en escaleras y terreno irregular. Al subir escaleras se inicia
subiendo la extremidad no afectada y se desciende primero con la pierna
afectada. Es importante que se le enseñe al paciente la manera correcta de
ponerse de pie si se cae y a que aprenda cómo utilizar sus ayudas técnicas
en estos casos. (4)
AYUDAS TÉCNICAS PARA LA MARCHA
Consisten en bastones de mano o convencional, bastones tipo canadiense,
andador de cuatro patas (fijos o articulados), andadores de dos ruedas y dos
patas, andadores de cuatro ruedas. La ayuda técnica ejerce su función a
través de modificaciones en el equilibrio (aumenta la base de sustentación
para dar una mayor sensación de seguridad), descarga de articulaciones o
partes blandas (reduce la demanda mecánica y el peso sobre las
extremidades inferiores lesiona-das) y propulsión (ayuda a compensar un
déficit de fuerza que afecta a la progresión del paso).
Las ayudas técnicas eventualmente podrían alterar los patrones normales de
marcha, en relación a la simetría entre los hemicuerpos cuando se usan
bastones o a la pérdida de braceo cuando se usan andadores. Sin embargo,
en la rehabilitación geriátrica se prefiere privilegiar la seguridad en la marcha
que otorgan las ayudas técnicas antes que la simetría. (4)
144
6.4.3. EFECTOS ADVERSOS O COLATERALES CON EL TRATAMIENTO
No aplica
6.4.4. SIGNOS DE ALARMA
No aplica
6.4.5. CRITERIOS DE ALTA
No aplica
6.4.6. PRONÓSTICO
6.5. COMPLICACIONES
-Caídas
-Deterioro funcional
-Morbilidad
-Ingresos a residencias de larga estadía
6.6. CRITERIOS DE REFERENCIA Y CONTRAREFENCIA
Ver fluxograma (ANEXO 1)
145
VII.
ANEXOS
ANEXO 1: FLUXOGRAMA
146
ANEXO 2: VGI EN TRASTORNO DE LA MARCHA
147
148
ANEXO 3: TEST DE TINETTI
149
150
ANEXO 4: TEST DE SPPB
151
VIII.
REFERENCIA BIBLIOGRAFICA
1. LAM, R. OFFICE MANAGEMENT OF GAIT DISORDERS IN THE ELDERLY.
CAN FAM PHYSICIAN. 2011; 57(7):765-70.
2. MOLINA CARRIÓN, L. PRÁCTICA DE LA GERIATRIA. TRASTORNOS DE LA
MARCHA EN EL PACIENTE ANCIANO. TERCERA EDICION. CAPÍTULO 76.
MC GRAW HILL.
3. RIU SUBIRANA, S. VALORACIÓN DE LA MARCHA EN LOS ANCIANOS.
ACTUALIZANDO LA PRÁCTICA ASISTENCIAL. BARCELONA. ESPAÑA. FMC.
2020;27(1):4-10
4. LORENA CERDA A, L. MANEJO DEL TRASTORNO DE MARCHA DEL
ADULTO MAYOR. SERVICIO DE MEDICINA FÍSICA Y REHABILITACIÓN,
HCUCH. REV. MED. CLIN. CONDES - 2014; 25(2) 265-275.
5. IGIRIO GAMERO, J. TRASTORNOS DE LA MARCHA EN EL ADULTO MAYOR.
NEU-RNT-2. 2017. PÁGINAS 1-7.
6. FORMACIÓN MÉDICA CONTINUADA EN ATENCIÓN PRIMARIA (FMC).
CAÍDAS
Y
ALTERACIONES
DE
LA
MARCHA
EN
EL
ANCIANO.
PROTOCOLOS. DICIEMBRE DEL 2011. VOL. 18. NÚM. S5. PÁGINAS 1-13.
7. GUÍAS DE PRÁCTICA CLÍNICA DE DIAGNÓSTICO Y TRATAMIENTOSERVICIO DE GERIATRÍA. HOSPITAL NACIONAL ARZOBISPO LOAYZA.12
DE MARZO DEL 2021.
8. VARELA PINEDO, L. VELOCIDAD DE LA MARCHA EN ADULTOS MAYORES
DE LA COMUNIDAD EN LIMA, PERÚ. REV MED HERED V.20 N.3 LIMA JUL.
2009.
9. LÁZARO DEL NOGAL, M. PROTOCOLO DIAGNÓSTICO DE LAS CAÍDAS Y
TRASTORNOS DE LA MARCHA EN EL ANCIANO RESIDENTE EN LA
COMUNIDAD. SERVICIO DE GERIATRÍA. HOSPITAL CLÍNICO SAN CARLOS.
MADRID. ESPAÑA. Medicine. 2018;12(62):3675-8.
152
GUIA DE PRÁCTICA CLÍNICA DE DIAGNÓSTICO Y TRATAMIENTO DE
SINDROME DE CAÍDAS EN EL ADULTO MAYOR
I.
FINALIDAD
La presente Guía tiene como finalidad dar las recomendaciones sobre la
prevención, diagnóstico y tratamiento del síndrome de caídas de los pacientes
adultos mayores del Hospital Víctor Lazarte Echegaray.
Una atención con calidad y garantía necesaria para que la continuidad de
cuidados a prestar sea posible
II.
OBJETIVO
1. Identificar pacientes en riesgo de sufrir caídas.
2. Valoración integral de caso para determinar factores de intervención.
3. Brindar atención integral a la persona que ha sufrido caída.
III.
ÁMBITO DE APLICACIÓN
La presente Guía de Práctica Clínica tiene como ámbito de aplicación para todos
los pacientes adultos mayores con síndromes de caídas que asisten al
consultorio externo de Geriatría del Hospital Víctor Lazarte Echegaray y demás
servicios y pabellones del Hospital.
IV.
PROCESO O PROCEDIMIENTO A ESTANDARIZAR
Diagnóstico y tratamiento de Síndrome de Caídas del Adulto Mayor
4.1 Nombre y código CIE 10:
Síndrome de caídas: W19.9
153
V.
CONSIDERACIONES GENERALES
5.1 Definición
La organización Mundial de la Salud (OMS) define caída como la consecuencia
de cualquier acontecimiento que precipita al paciente al suelo, contra su
voluntad. (1)
Esta precipitación suele ser repentina, involuntaria e insospechada y puede ser
confirmada por el paciente o un testigo. La aparición de más de dos caídas en 6
meses se considera como síndrome de caídas.
5.2 Etiología
Generalmente son de etiología multifactorial ya que asocia la sumatoria de
factores
ambientales,
sociales,
físicos,
también
enfermedades
y/o
medicamentos.
Durante el proceso normal del envejecimiento, nuestro cuerpo experimenta
ciertos cambios degenerativos secundarios a la edad, como lo son: la reducción
del control muscular, rigidez muscular, marcha inestable, alteración de los
reflejos posturales, alteración de los baroreceptores, alteraciones auditivas,
neuroendocrinas, entre otras; los cuales vuelven vulnerable al anciano mientras
realiza sus actividades habituales.
5.3 Fisiopatología
El ser humano es bípedo y una de sus características es que su centro de
gravedad se encuentra en la pelvis que representa un punto elevado sobre una
base de soporte estrecha. Para contrarrestar la gravedad el centro de equilibrio
154
debe lograr una fuerza en reacción al suelo y opuesta a La gravedad en el plano
vertical que se localiza en el medio de la base de soporte.
Con los años la postura se modifica (Cambios degenerativos en eje esquelético
axial, redistribución de grasa), alterando el punto equilibrio sin modificar la base
de sustentación lo que resulta en un desplazamiento del eje corporal lo que
modifica las fuerzas y reduce el balance.
El equilibrio puede ser alterado por dos tipos de eventos:
-
Alteraciones internas: inducidas por el sujeto para la cual se
realizan ajustes posturales anticipados previos al movimiento
para contrarrestar su efecto desestabilizante.
-
Alteraciones externas o inesperadas: derivadas del entorno. Se
desencadenan respuestas posturales que en sujetos jóvenes y
sanos son rápidos y automáticas.
Se requiere de un SNC integro para lograr responder a esto con las
contracciones musculares necesarias. Es posible que en ancianos estos
mecanismos se pierdan.
5.4 Aspectos Epidemiológicos
La caídas en la población anciana son un problema de salud pública , con
consecuencias médicas y económicas notables. Se estimó que en el año 2020
el costo generado alcanzó unos 30. 000 millones de euros.
El riesgo de caer y hacerlo más veces aumenta con la edad. Aproximadamente
el 30% de las personas mayores de 65 años, independientes y autónomas,
sufren una caída una vez al año. Este porcentaje, asciende hasta el 35% en los
mayores de 75 años y el 50% en los mayores de 80 años. La tasa de fallecimiento
por caídas aumenta de forma exponencial con el aumento de edad en ambos
sexos, y en todos los grupos raciales por encima de los 75 años.
Las caídas son más frecuentes en las mujeres, aunque conforme avanzan los
años , la tendencia es a igualarse. Además , que dos terceras partes de los
ancianos que se caen sufrirán una nueva caída en los siguientes seis meses.
155
El registro en la historia clínica de antecedente de caída se considera un factor
predictor de fractura de cadera en el futuro.
La mayoría de las caídas se producen en lugares cerrados, sin encontrar relación
con algún momento concreto del día ni época del año. Los lugares más
frecuentes de caída son el baño, el dormitorio y la cocina. La actividad que más
favorece la caída es caminar.
Aproxidamente el 10% de las caídas se producen en las escaleras, siendo más
peligroso el descenso; los primeros y últimos escalones son los más peligrosos.
5.5 Factores de riesgo asociados
5.5.1 Medio ambiente
Causas extrínsecas: relacionadas con el entorno del paciente, por es
conocimiento del entorno y de las medidas de precaución.
EXTRÍNSECAS
Barandilla de la cama inadecuada
Freno de la cama inadecuado o defectuoso
Iluminación no adecuada
Timbre de llamada muy retirado o inaccesible
Mobiliario no adecuado
Servicio inaccesible y sin asideros y si adaptador para WC.
Suelo mojado deslizante
Desorden
Ropa y calzado inadecuado
Espacios reducidos
INTRÍNSECAS
Movilización y deambulación sin solicitar ayuda en pacientes
con déficit de movilidad
156
Edad superior a 65 años o inferior a 5 años
Estado de confusión, desorientación y/o alucinación
Impotencia funcional (amputación de miembro, paresia,
parálisis, Parkinson, artrosis) o inestabilidad motora y debilidad
muscular por inmovilización prolongada.
Alteraciones oculares o sensitivas
Postoperatorio inmediato
Sedación o ingestión de fármacos que produzcan depresión del
nivel de conciencia o mareos.
Alcoholismo y/o drogadicción
Actitud resistente, agresiva, o temerosa
Hipotensión
Hipoglicemia
Ansiedad relacionada con el patrón de eliminación en enfermos
que deben permanecer en reposo absoluto.
Enfermedades neurológicas (epilepsia, convulsiones)
Enfermedades
cardiacas
(arritmias,
portadores
de
marcapasos)
Enfermedades del aparato respiratorio (disnea, hipercapnia)
Portadores de dispositivos externos que puedan interferir en la
movilidad y deambulación (sondas vesicales, drenajes, pies de
gotero, bastones, andadores)
Antecedentes de caídas
Dificultad cognitiva, para comprender enseñanzas, o bien el
idioma.
5.5.2 Estilos de vida:
No aplica
5.5.3 Factores hereditarios:
No aplica
157
VI.
CONSIDERACIONES ESPECÍFICAS
6.1 Cuadro Clínico
6.1.1 Signos y síntomas
La presencia de una o más caídas, y se evalúa de la siguiente manera:
Establecer factores de riesgo intrínsecas y extrínsecos que favorezcan la
caída.
Tiempo y fecha de las caídas
Circunstancias de las caídas
Consecuencias de la caída: muerte, lesiones, largo tiempo en el suelo, miedo
de caer, reducción en la actividad e independencia.
Prueba de Tinetti: menor de 19 puntos tiene riesgo de caídas.
Prueba de Levántate y anda (“Get up and go”): mayor a 20 segundos tiene
riesgo de caídas.
A la exploración física: valorar signos vitales, déficit- sensoriales, valoración de
la marcha y la postura, estado musculo-esquelético principalmente dolor, arcos
de movilidad y fuerza, exploración neurológica, valoración podológica y del
calzado. Hay que hacer énfasis en el sistema cardiovascular con monitoreo de
la frecuencia cardíaca en busca de bradicardia, taquicardia u otras alteraciones
del ritmo, es importante realizar determinaciones de la presión arterial en
decúbito y en bipedestación con intervalos de 1,3, y 5 minutos en busca de
variaciones importantes que pudieran explicar el origen de la caída. En la
auscultación del cuello se busca datos que sugiera enfermedad de la arteria
carótida.
6.1.2 Interacción cronológica
158
Caída accidental: es aquella que generalmente se produce por una causa ajena
al adulto mayor sana (Ej: Tropiezo) y que no vuelva a repetirse.
Caída repetida: expresa la persistencia de factores predisponentes como:
enfermedades crónicas múltiples, fármacos, pérdidas sensoriales, ect.
Caída prolongada: es aquella en la que el adulto mayor permanece en el suelo
por más de 15 o 20 minutos por incapacidad de levantarse sin ayuda.
Los adultos mayores que tienen mayor prevalencia de caídas prolongadas son:
aquellos de 80 años o más, con debilidad de miembros, con dificultades para las
actividades del vivir diario y/o toman medicación sedante.
6.1.3 Gráficos , diagramas
GRÁFICO 1: DIAGNÓSTICO ETIOLÓGICO DE LAS CAÍDAS.
159
160
6.2 Diagnóstico
6.2.1. Criterios de diagnóstico
Un correcto abordaje diagnóstico, requiere un interrogatorio adecuado sobre los
aspectos que a continuación se relacionan. Estas preguntas nos ayudan a
analizar la posible participación de factores que pudieron estar asociados (la
presencia de factores extrínsecos puede orientar a una causa accidental).
¿Cuándo y cómo fue la caída?
¿En qué lugar sucedió y si hubo testigos de la caída?
161
Sobre todo en caso con pérdida de conciencia
¿Le había sucedido esto antes?
Muy importante en casos de trastornos cardíacos, isquemias cerebrales o
estados convulsivos que pueden haberse presentado anteriormente.
¿Sucedió después de comer?
En el adulto mayor no es rara la hipotensión postpandrial (después de comer).
¿La caída fue después de cambiar de posición rápidamente
(levantarse súbitamente de estar acostado o sentado)?
Esta información correlaciona con hipotensión ortostática, la cual se corrobora
cuando al tomarle la presión al paciente, estando sentado y luego al estar de pie,
muestra una caída de la T/A sistólica de 20 mg o más mm/Hg.
¿Tuvo pérdida del estado de conciencia?
Si la hubo, habrá que sospechar causa cardíaca (arritmias o bloqueos cardíacos)
o convulsiones (sobre todo si hubo presencia de incontinencia).
¿Tuvo
síntomas
asociados
como
palpitaciones
que
pudieran indicar una arritmia cardiaca?, o ¿Síntomas
neurológicos focales que pudieran sugerir una isquemia
cerebral?
Evaluar la presencia de datos como fiebre, taquipnea, taquicardia, dolor de
pecho e hipotensión que pueden hacer pensar en procesos de tipo infeccioso,
infarto agudo de miocardio (IAM), tromboembolia pulmonar (TEP) o de sangrado
gastrointestinal.
Si el paciente se marea al mover la cabeza hacia la izquierda o la derecha, o al
girarla súbitamente, habrá que pensar en vértigo, sin embargo, en caso de que
las caídas estén asociadas a movimientos extremos laterales de la cabeza o se
asocien a signos de focalización neurológica (problemas visuales, etc.) deberá
descartarse insuficiencia vertebro-basilar.
162
¿El paciente tuvo simplemente debilidad súbita de las
piernas?
Este dato es relevante cuando se han descartado las causas anteriores, ya que
podría tratarse de "ataques de caída", entidad inespecifica para algunos autores
discutibles, pero que se caracteriza por la debilidad súbita de las extremidades
inferiores y la caída sin pérdida del estado de conciencia.
¿Qué medicamentos toma el paciente?
Finalmente, es muy importante la revisión de diversos medicamentos
potencialmente causantes de hipotensión y por ende predisponentes para la
presencia de caídas, entre los más importantes estan los antihipertensores,
diuréticos, los medicamentos bloqueadores autonómicos, los antidepresivos los
hipnóticos, los ansioliticos, algunos antinflamatorios no esteroides (AINES) y los
medicamentos psicotrópicos.
Una caída puede ser el reflejo de una enfermedad aguda
La evaluación sistematizada de los factores intrínsecos debe proporcionar
evidencias importantes de caídas en las personas mayores. La misma persona
puede caerse en diferentes ocasiones por distintas razones. La caída de origen
desconocido es un diagnóstico de exclusión - siempre debe buscarse la causa,
es decir, nunca utilizar caída de origen accidental, siempre plantear los factores
intrínsecos o extrínsecos.
En todo paciente anciano con antecedente de caida sin lesiones se recomienda
realizar el test Get Up and Go (observar cómo se levanta de una silla sin brazos,
caminar unos pocos pasos y volver a sentarse).
También se debe evaluar:
1. Esfera funcional.
Conocimiento del nivel de dependencia para las actividades básicas e
instrumentadas de vida diaria, ya que éste se asocia a un mayor riesgo de
caídas. Preguntaremos también sobre el grado de movilidad, pues existe una
163
fuerte correlación entre la pérdida de movilidad y el riesgo de caída directamente
proporcional.
2. Esfera mental y psicoafectiva.
Tanto el deterioro cognitivo como los estados depresivos son situaciones que se
asocian a caídas
3. Esfera social.
Apoyo familiar presente, convivencia y recursos sociales de que dispone el
paciente, así como las características de la vivienda.
Trastornos del equilibrio y de la marcha. El interés de evaluar un trastorno de la
marcha está en poder llegar a conocer el mecanismo por el que se ha producido
y la entidad responsable del mismo, todo ello encaminado a instaurar un
tratamiento.
Otras pruebas para la valoración del equilibrio son la estación unipodal y la
marcha en tándem.
El control postural intrínseco es bueno, si el paciente puede mantenerse sobre
un pie durante 30 segundos con los ojos abiertos y caminar en tándem durante
3-4 metros. La permanencia durante menos de 5 segundos en estación unipodal
se considera un signo de fragilidad en el anciano. Es un factor de riesgo de caída
con traumatismo en los ancianos con buen estado de salud. El riesgo de caída
grave que requiera asistencia se multiplica por tres. Estos ancianos no pueden
recuperar el equilibrio cuando resbalan.
Escala de Tinetti. Consta de dos subescalas para la marcha y para el equilibrio.
Identifica individuos con alto riesgo de caídas, pero no detecta pequeños
cambios. Puntuaciones entre 19 y 24 representan riesgo de caídas, siendo éste
elevado por debajo de 19.
Timed up and go. Se mide en segundos el tiempo que el paciente tarda en
levantarse de una silla con brazos, caminar tres metros y volver a la silla. La
mayoría lo hacen en menos de 10 segundos, entre 10 y 20 segundos; emplean
los individuos frágiles, y más de 20 aquellos que tienen alto riesgo de caidas.
164
Evaluación del entorno. Debemos preguntar acerca de las características de la
vivienda, escaleras, suelos, mobiliario, etc.
En la mayoría de los casos, será posible identificar la causa más probable de la
caída del paciente, o bien tener sospecha de la misma, sin embargo, algunas de
las probables etiologías requerirán de evaluación especializada o de la
realización de estudios diagnósticos, no siempre disponibles en el primer nivel
de atención, como en el caso de algunos tipos de arritmias cardiacas, infarto
agudo de miocardio o ante la posibilidad de valvulopatía (electrocardiograma,
ecocardiograma, o holter de 24 hrs.); el estudio de un síndrome convulsivo o una
posible enfermedad vascular cerebral (electroencefalograma, tomografía axial
computarizada de cráneo, doppler de carótidas y resonancia magnética nuclear);
en una probable
trombo-embolia pulmonar (gammagrama ventilatorio-
perfusorio).
Radiografía de columna cervical: Son útiles en pacientes con alteraciones de la
marcha, espasticidad de miembros inferiores hiperreflexia que sugieren
espondilosis cervical o estrechez de canal raquídeo.
6.3.3 De exámenes especializados complementarios:
Existe una asociación entre sincope y caídas y los ancianos pueden no darse
cuenta de los episodios de pérdida de conciencia. Ante esta sospecha debe
realizarse holter y/o ecocardiograma (en pacientes con soplo para evaluar su
importancia hemodinámica o diagnosticar miocardiopatía hipertrófica).
Audiometría: en pacientes con vértigo asociados a caida.
6.4 Manejo según nivel de complejidad y capacidad resolutiva
6.4.1 Medidas generales y preventivas
Los objetivos de la prevención de caídas son conseguir la máxima movilidad del
anciano, reducir el riesgo de caídas y su morbimortalidad.
165
Como en otros aspectos de la geriatría, el abordaje debe ser interdisciplinario,
coexistiendo actuaciones médicas, rehabilitadoras, psicosociales y del entorno
ambiental.
Conocer qué enfermedades y qué medicamentos pueden provocar caídas.
Revisar la visión y prestar atención al cuidado de los pies.
Revisar el tipo de calzado y evitar ropas largas
Reanudar actividades de la vida diaria tan pronto como sea posible
después de la caída.
Si se produce una caída, aunque no haya daños, se debe informar al
médico, ya que dicha caída puede ser secundaria a una enfermedad de
base (1)
6.4.2 Terapéutica
1. Principios básicos del tratamiento
a) Valorar y tratar la lesión física
b) Valorar y tratar la lesión psíquica (temores del paciente y la familia)
c) Tratar alteraciones subyacentes
d) Evaluar el uso de fármacos: Cambios en la medicación si son
adecuados
e) Proporcionar terapia física y educación
Readiestramiento de la marcha
Fortalecimiento muscular
Educación para el uso de ayudas auxiliares para la deambulación.
Educación en relación con el uso correcto de zapatos.
f) Disminuir los riesgos ambientales
Visita domiciliaria para revisión de riesgos de caídas
Educación en relación con:
Mobiliario seguro y de tamaño correcto
Eliminación de obstáculos
Iluminación adecuada
Barandas seguras
166
2. Pautas para el tratamiento de problemas subyacentes a las caídas
a) Abordaje y Manejo de Problemas Cardiovasculares: Arritmias, estenosis
aórtica
hipotensión postural. Derivar a especialista para
estudio, sindicación de tratamiento y seguimiento
b) Abordaje y Manejo de Problemas Neurológícos: Crisis isquémica
transitoria
c) Trastorno convulsivo, Hidrocefalia normotensiva, Enfermedad de Parkinson,
Espondilosis cervical, daño visual. Derivar a especialista para estudio, indicación
de tratamiento y seguimiento.
d) Trastornos del pie, trastornos de la marcha: evaluación y tratamiento
podiátrico, zapatos de ajuste correcto, educación física y kinesiterapia, enseñar
comportamientos adaptativos.
e)
Abuso
de
fármacos
antihipertensivos):
(sedantes,
eliminación
de
laxantes
fármacos
alcohol,
enseñar,
psicotrópicos,
comportamientos
adaptativos.
f) Abordaje y manejo de los riesgos ambientales.
6.4.3 Efectos adversos o colaterales en el tratamiento:
No aplica
6.4.4. Signos de alarma:
El adulto mayor presenta traumatismos fisicos moderados o graves.
> El adulto mayor no puede levantarse
El adulto mayor presenta un síndrome de post-caida.
> Alteración del nivel de conciencia
6.4.5 Criterios de alta
Valorar la necesidad de seguimiento por consulta externa de Geriatría y la
conveniencia de aportar suplementos de vitamina D para la reducción del riesgo
de caídas.
Proporcionar información sobre los beneficios de la vitamina D, alimentación,
estilo de vida y tratamiento para la prevención de la osteoporosis para reducir el
riesgo de fracturas.
167
Entregar recomendaciones para la prevención de caídas.
6.4.6 Pronóstico
El pronóstico depende de las consecuencias, de la incapacidad previa y si se
produce en personas aisladas. Un tercio de las personas con estas
caracteristicas fallecen en un año.
6. 5 Complicaciones
Lesiones de tejidos blandos
Fracturas (cadera, fémur, húmero, muñeca, costillas)
Hematoma subdural.
Hospitalización (complicaciones de la inmovilización)
Discapacidad (limitación de la movilidad por lesión física, restricción de
la deambulación por temor)
Riesgo de institucionalización: de 20 a 50% de los pacientes que han
sufrido caídas con lesiones secundarias graves, como fractura de cadera
que requirieron hospitalización, son institucionalizados en residencias o
asilos.
Muerte: los pacientes que han sufrido una caída que requirió manejo
intrahospitalario por fractura tienen un rango de mortalidad de 20 a 30%
dentro del primer año posterior a la fractura, pero en los primeros días
su mortalidad se eleva si sufrió una caída de largo tiempo o es un
paciente institucionalizado. (1)
6. 6 Criterios de referencia y Contrarreferencia
El paciente adulto mayor que sufre una caída debe ser evaluado en el
establecimiento de salud más cercano a su vivienda.
Una vez estabilizado se debe evaluar si la caída tuvo graves consecuencias se
debe referir de acuerdo a grado de complejidad al establecimiento de salud que
168
corresponda para el manejo integral del paciente adulto mayor, garantizando una
atención oportuna y eficaz.
6.7 Fluxograma
169
VII.
ANEXOS
170
171
172
ANEXO 4: ESCALA DE TINETTI PARA EL EQUILIBRIO Y PARA LA MARCHA
173
2. ESCALA DE TINETTI PARA LA MARCHA
174
VIII. REFERENCIAS BIBLIOGRÁFICAS
1. Álvarez L. Síndrome de Caídas en el Adulto Mayor. Revista Médica de
Costa Rica y Centroamérica LXXI (617) 807 - 810, 2015.
2. Sociedad Española de Geriatría y Gerontología. Príncipe de Vergara.
Tratado de Geriatría para Residentes, 2010 1° Edición. Madrid.
3. Brocklehurst Textbook of Geriatric medicine and Gerontology. 2007.
6taEdición.New York, USA.
4. Silva J. Caídas en el adulto mayor y su relación con la capacidad
funcional.Rev. Latino-Am. Enfermagem 20(5).sep.-oct. 2012.
5. Guía
de
Diagnóstico
y manejo.
Caídas.
Parte
II
OPS.
165-
179.http://www.sld.cu.
6. Quintar E. Giber F. Caídas en el adulto mayor. Actualizaciones en
Osteología,VOL.10 N° 3-2014 Buenos Aires.
7. Kane R., Joseph G. Ousiander e Itamar B. Abrass, "inestabilidad y
caídas",Geriatría Clínica. 20125ta. Edición, Paltex., México.
8. Morales P. Caídas en el anciano. Servicio de Geriatría. 2007. Geriatría del
Hospital Español de México. VOL. 50. No 6 Noviembre-Diciembre.
9. Bonaga B., López E., Recomendaciones para la prevención de Caídas en
pacientes hospitalizados 2019. CHUA. Junio.
10. Varas F., Castro E. Pérula L. et al. Caidas en ancianos de la comunidad:
Prevalencia, consecuencias y factores asociados. Atención Primaria 2006;38(8):
450-5.
11. Guía de Práctica Clínica para la Prevención de Caídas en el adulto mayor.
Revista Médica del IMSS. 2005. Vol. 43, número 5, septiembre-octubre.
12. Galván Y., Moreno C. El síndrome de Caídas y la calidad de vida
relacionada con la salud en el adulto mayor. Archivos en medicina familiar.
2010. Volumen 12, numero 1. Enero - marzo.
175
GUIA DE PRÁCTICA CLÍNICA DE DIAGNÓSTICO Y TRATAMIENTO DE
DOLOR CRÓNICO EN EL ADULTO MAYOR
I. FINALIDAD:
Contribuir con el adecuado diagnóstico y tratamiento del dolor crónico en adultos
mayores mediante evidencia científica disponible y adecuada al
contexto nacional.
II.OBJETIVO:
1. Evaluar y monitorizar el dolor crónico en adultos mayores.
2. Optimizar el manejo del dolor crónico en adultos mayores.
III.ÁMBITO DE APLICACION:
La presente Guía es aplicable a los pacientes adultos mayores con dolor crónico
y está dirigida a los médicos que participan de los equipos
multidisciplinarios de manejo de adultos mayores con dolor.
IV.PROCEDIMIENTO A ESTANDARIZAR:
DIAGNÓSTICO Y TRATAMIENTO DE DOLOR CRONICO EN ADULTOS
MAYORES
4.1. NOMBRE Y CÓDIGO CIE 10:
(R52.1) Dolor crónico intratable
(R52.2) Otro dolor crónico
(R52.9) Dolor, no especificado
V. CONSIDERACIONES GENERALES.
5.1. DEFINICIÓN
176
La definición de dolor más aceptada actualmente, es la de la Asociación Mundial
para el Estudio del Dolor (IASP) la que lo caracteriza como: "una experiencia
sensorial y emocional desagradable, asociada con un daño tisular, real o
potencial, o descrita en términos de dicho daño" (1) asimismo ésta define al dolor
neuropático como: "el iniciado o causado por una lesión primaria o disfunción del
sistema nervioso central o periférico"
El Grupo de Interés Especial sobre Dolor Neuropático [Special Interest Group on
Neuropathic Pain (NeuPSIG)] de la IASP, propuso a finales del 2007 una nueva
definición de dolor neuropático como "el dolor que se origina como consecuencia
directa de una lesión o enfermedad que afecta al sistema somatosensorial". (2)
En esta nueva definición el término "enfermedad", se refiere a procesos
patológicos específicos, como por ejemplo: inflamación, enfermedades
autoinmunes o canalopatías; mientras que la palabra "lesión, se refiere a un daño
macro o microscópicamente identificable. (2)
Para el año 2014, la Asociación Internacional para el Estudio del Dolor (IASP) en
ocasión de realizar una campaña global contra el Dolor Neuropático (DN),
propuso la siguiente definición: "Dolor causado por una lesión o por una
enfermedad del sistema nervioso somatosensorial*, reemplazando la antigua
definición de dolor neuropatico. (3)
Se define como dolor crónico al que dura más de 3 meses, o perdura más allá
del proceso de curación normal, que puede ser continuo o intermitente y de
suficiente duración e intensidad como para afectar negativamente el bienestar
del paciente y su calidad de vida.(4)
Las Naciones Unidas definen a los adultos mayores como aquellas personas con
más de 65 años, pero es difícil señalar cuál es la edad en la que una persona
pasa a ser considerada como anciano.
5.2. ETIOLOGIA
El dolor crónico en adultos mayores se presenta con mayor frecuencia en
articulaciones, espalda y miembros inferiores (*) El dolor nociceptivo puede ser
producido por la inflamación de tejidos, deformidades articulares, lesiones
intrínsecas y destrucción de las estructuras afectadas; como ocurre en los casos
de artritis y artrosis. No se debe olvidar que algunas alteraciones metabólicas
como la artropatía por pirofosfato cálcico que se expresan con la edad así como
la gota. Con la edad también se adquiere predisposición a ciertos reumatismos
inflamatorios como la polimialgia reumática. Así mismo los procesos de origen
cardiovascular son causa frecuente de dolor como los procesos isquémicos,
cutáneos y subcutáneos. (5)
177
Es importante también mencionar el papel de las alteraciones neurológicas
periféricas en dolor neuropático periférico como en la diabetes mellitus, la
neuralgia post herpética entre otras.
5.3. FISIOPATOLOGÍA
Los nociceptores son las neuronas del sistema nervioso periférico responsables
de la detección y la transmisión de los estímulos nocivos. Se distinguen dos tipos
de nociceptores según las fibras que participan en la transmisión del dolor: las
de tipo a delta (fibras mielínicas, pequeñas, con conducción rápida que
responden a estímulos nocivos de tipo mecánico) y las de tipo C (amielínicas,
con velocidad de conducción más lenta, que responden a estímulos nocivos
mecánicos, térmicos o químicos).
Posteriormente la información de estas fibras llegan a los ganglios de la raíz
dorsal y luego a la región posterior de las mismas y envían sus axones por vías
cruzadas a centros supra espinales, bulares y talamicos para mediante la
liberación de neurotransmisores transfiriendo la información desde la periferia al
sistema nervioso central. (6) Ver figura 1
En enfermedades neurológicas participan además factores neuropáticos, por
excitación anormal de los axones aferentes que transportan las sensaciones
dolorosas, aparte de la sensibilización central de cualquier dolor crónico.
En los adultos mayores se han comunicado algunos hallazgos particulares en
torno al dolor como: descenso de la nocicepción para estimulos de presion,
aumento de la tolerancia al dolor cutáneo y reducción de la tolerancia al dolor
profundo así como tiempo de reacción más largo a la percepción del primer dolor;
sin que todo esto signifique una menor manifestación dolorosa en este grupo
etario en particular.
178
Entre un 50 a un 80% de la población mayor de 65 años presenta dolor.
Según los datos del estudio "Pain in Europe", el 11% de la población española
sufre dolor crónico, estos porcentajes alcanzan en población mayor de 65 años
al 70%. Datos procedentes del "Acove Project" indican que el 25 a 40% de la
población anciana que vive en la comunidad presenta dolor crónico; cifra que
asciende a 70 - 80% en población institucionalizada. Asimismo el 90% de estos
refieren no controlar de manera adecuada el dolor.
En estudios se ha reportado que la artrosis es la principal causa de dolor
osteomuscular crónico: 72,6% de los mayores de 65 años. Además 12,8% de
estos presentan poli neuropatías dolorosas; en el caso de diabetes mellitus:
tres cuartas partes de los pacientes diabéticos que presentan neuropatía lo
manifiestan como dolorosa, destacan además en este grupo el hipotiroidismo y
la poli neuropatía urémica. Respecto a la neuralgia post herpética se presenta
en 50% después de los 60 años y en 75% a partir de los 70 años.
5.5. FACTORES DE RIESGO ASOCIADOS
El dolor crónico de origen osteomuscular es más frecuente en el sexo femenino
y aumenta de manera directa a la edad, por lo que esta última es considerada
por algunas revisiones como factor de riesgo.
Entre los factores de riesgo asociados a dolor neuropático destacan: Diabetes
mellitus, hipotiroidismo, abuso de alcohol, trauma, deficiencia nutricional:
179
Vitamina B, tratamiento farmacológico, falla de la función renal, infección previa
de herpes entre otros. Es importante además considerar al Parkinson y los
diferentes tipos de demencia, enfermedades más prevalentes en el adulto
mayor, como patologías con desarrollo de dolor neuropático de origen central.
5.5.1 Medio Ambiente
El dolor es un fenómeno complejo con aspectos físicos, conductuales,
cognitivos, emocionales, espirituales y aspectos interpersonales. Esta naturaleza
multidimensional del dolor debe ser evaluada y considerada en los pacientes. El
paciente enfrenta su experiencia al dolor ante una enfermedad amenazante de
la vida en el contexto de sus creencias, espiritualidad y experiencias. Hay alguna
evidencia que aparte del tratamiento convencional fortalecer la fe religiosa es
importante en algunas enfermedades; asimismo los factores psicológicos
pueden tener una profunda influencia en la percepción del dolor y de cómo los
pacientes responden conductual y emocionalmente.
5.5.2 Estilos de Vida
La percepción que la administración de opioides en el manejo de dolor causa de
manera frecuente adicción es un problema prevalente que interfiere en el
adecuado control de este, por lo que los proveedores de salud deben educar a
los pacientes, familiares y otros profesionales acerca del miedo inapropiado de
adicción, ya que esta es rara cuando no hay historia de abuso de sustancias y
se hace seguimiento de su prescripción.
5.5.3 Factores hereditarios
El dolor crónico de origen osteomuscular es más frecuente en el sexo femenino
y aumenta de manera directa a la edad, por lo que esta última es considerada
por algunas revisiones como factor de riesgo.
Hasta el momento son escasos los estudios de asociación entre genes y
percepción del dolor. Entre los diversos genes candidatos que participan en la
síntesis, transporte y función de las proteínas implicadas en las diferentes etapas
de la transmisión de la sensación dolorosa se mencionan: Receptor de
capsaicina (VR1); interleucinas; gen MOR (receptor opioide Mu), KOR (receptor
opioide kappa), DOR (receptor opioide delta) y ORL respecto al sistema opioide;
alelo DRD2- A1 en el dopaminérgico; alelo S y su proteína 5-HTTLPR en el
serotoninérgico de igual manera el polimorfismo en el transportador y receptor
GABA han sido nombrados.
VI. CONSIDERACIONES ESPECIFICAS.
6.1. CUADRO CLINICO
6.1.1. Signos y Síntomas:
180
Respecto al dolor nociceptivo: muscular o inflamatorio; destacan síntomas y
signos como dolor, debilidad muscular, fatigabilidad, entre otras. En caso de
inflamación se presenta además calor, rubor y tumefacción en el lugar de dolor.
Los signos y síntomas que inducen a pensar en dolor neuropático se definen por
las características de este, en especial su descripción
(quemante, punzante, urente, electrizante, etc.) y distribución (dermatomas); es
frecuente que se acompañe de alodinia, sensación dolorosa ante estímulos no
dolorosos y en ocasiones de alteraciones simpáticas.
6.1.2. Interacción cronológica:
No aplica
6.1.3 Gráficos, diagramas, fotografías
181
182
183
GRAFICO 5.- ESCALA DE VALORACIÓN DEL DOLOR MEDIANTE EL COMPORTAMIENTO
EN EL ADULTO MAYOR.
184
GRAFICO 6: CUESTIONARIO BREVE DEL DOLOR
185
GRAFICO 7: CUESTIONARIO DE DOLOR NEUROPÁTICO DN4
GRAFICO 8: SCREENING TOOL PARA LA DETECCIÓN DEL DOLOR NEUROPÁTICO
LOCALIZADO
186
187
188
189
6.2.2 Diagnóstico diferencial:
No aplica
6.3 Exámenes auxiliares
6.3.1 Patología clínica:
Exámenes de laboratorio: Se puede considerar realizar hemograma, función tiroidea,
electrolitos, azoados, glucosa o niveles de vitamina B12, niveles de fármaco (digoxina,
litio) que requieran control y por supuesto electrocardiograma; que sirven para
descartar causas tratables como: anemia, deshidratación, hipoglicemia o hiperglicemia.
Si existen síntomas sugerentes de enfermedad coronaria o electrocardiograma alterado
debe tomarse enzimas cardiacas.
No existe un lineamiento para la toma de paraclínicos, la decisión de solicitar estudios
depende del criterio médico obtenido tras la historia clínica y el examen físico.
6.3.2 De imágenes:
El estudio de un sindrome convulsivo o una posible enfermedad vascular cerebral
(electroencefalograma, tomografía axial computarizada
de cráneo, doppler de carótidas y resonancia magnética nuclear); en un probable
trombo-embolia pulmonar (gammagrama ventilación-perfusión).
6.3.3 De exámenes especializados complementarios
Ante la sospecha de disfunción neuronal se pueden utilizar estudios de conducción
nerviosa y electromiografía.
6.4. MANEJO SEGÚN NIVEL DE COMPLEJIDAD Y CAPACIDAD RESOLUTIVA.
6.4.1 Medidas generales y preventivas
Entre estas destacan: ejercicios cardiovasculares y actividad física, terapia cognitivoconductual, apoyo psicosocial y manejo de estrés, mantener la presión arterial bajo
control asi como una alimentación equilibrada, suspender el tabaquismo y modificar (en
caso necesario)
condiciones laborales. Es importante dar el tratamiento adecuado para el control de las
patologías que puedan estar involucradas en dolor como el control glucémico en
diabetes mellitus, reemplazo hormonal en caso de hipotiroidismo, suplemento
vitamínico en caso de deficiencia de vitamina B, entre otras.
6.4.2 Terapéutica
190
Es importante reconocer cambios en ciertos aspectos asociados al envejecimiento,
como el retraso en el vaciamiento gástrico, descenso de masa magra: lo que lleva a
aumento del volumen de distribución y vida media de fármacos liposolubles,
disminución de albumina, metabolismo hepático menos eficaz así como disminución del
filtrado glomerular. También existe una mayor sensibilidad a los fármacos de acción
central, mientras que esta disminuye en los sistemas adrenérgico y colinérgico.
Los analgésicos como el paracetamol están indicados en el dolor de intensidad leve a
moderado y en dolor de intensidad moderada a severa pueden usarse combinados con
opioides; tienen techo terapéutico. El paracetamol es el de elección para el inicio de
tratamiento y mantenimiento en dolor persistente en especial en el musculo esquelético
debido a la eficacia demostrada y al perfil de seguridad. La dosis diaria máxima
recomendada es de 4 g / día aunque FDA recomienda disminuirla a 3,25 g/ dia por
toxicidad hepática subclínica, puede utilizarse en insuficiencia renal o cardiaca y no
interfiere con los anticoagulantes.
Respecto a los AINES y COXIB hay que tomarlos con extrema precaución en ancianos, y
no es recomendable su asociación. Su uso podría darse cuando hay componente
inflamatorio asociado. Se prefiere AINE de vida media corta evitando aquellos con
semivida larga con mayor riesgo de acumulación de dosis. El tiempo de administración
debe ser el menor posible y de preferencia mediante vía oral
Para el uso de opioides en ancianos se recomienda empezar a dosis más bajas, entre 25
y 50 % de la dosis en jóvenes. Se puede iniciar con formulación de corta duración:
tramadol, tapentadol, morfina para un ajuste rápido y una vez establecidas las
necesidades de dosis se debe cambiar a formulación retardada: tapentadol. La vía oral
es de elección para el dolor estable, o de inicio en dolor leve moderado asi como la vía
parenteral (subcutánea o intravenosa) en perfusión continua o a intervalos en el caso
de tramadol y morfina.
Es importante una titulación cuidadosa basada en la respuesta individual, cada 24 a 48
horas en función de las dosis de rescate precisadas. En general no hay techo analgésico
en los opioides potentes y la dosis está determinada por el control analgésico, tolerancia
o aparición de efectos secundarios. Respecto a las dosis equianalgésicas hay que tener
en cuenta que no hay datos específicos para pacientes ancianos, que hay una variación
interindividual en el metabolismo y tomar en cuenta la tolerancia cruzada. Siempre es
importante dejan un opioide como medicación de rescate en caso de dolor irruptivo,
anticipándose a éste.
La selección de los analgésicos debe ser individualizada, considerando los efectos
benéficos, los efectos potenciales sobre las comorbilidades, los efectos colaterales o
deletéreos y la rapidez de acción para los casos en los cuales es imperativo el alivio
rápido del dolor. Es así que que los antidepresivos tricíclicos se consideran en segunda
191
línea a evitar en adultos mayores, a diferencia del joven donde son de primera elección
(dolor neuropático), prefiriendo el uso de los otros grupos farmacológicos, asimismo
según varias guías de práctica clínica, deben considerarse los agentes tópicos como
lidocaína al 5% como primera elección para el manejo farmacológico del dolor
neuropático localizado en adultos mayores.
La NICE Clinical Guideline recomienda que la terapia combinada, comúnmente prescrita
para dolor neuropático, pueda ser una buena opción en el tratamiento escalonado de
este tipo de dolor, principalmente durante el manejo de tratamiento temprano, en el
que las drogas prescritas no tienen efecto inicial.
6.4.3 Efectos Adversos o Colaterales con el Tratamiento:
La comorbilidad y la polifarmacia aumentan la posibilidad de interacciones y reacciones
adversas, por lo que estas son dos veces más frecuentes en los adultos mayores que en
los jóvenes.
El paracetamol se encuentra totalmente contraindicado en pacientes con fallo hepático.
Y en el caso de los AINEs, estos son uno de los fármacos más implicados en reacciones
adversas en adultos mayores, por lo que se debe considerar siempre el daño potencial
a nivel gastrointestinal (por lo que se recomienda utilizar preferentemente un
COXIB o un inhibidor de bomba de protones como omeprazol en pacientes con riesgo
alto) además del cardiovascular (se prefiere utilizar un AINE no selectivo, aunque no
están exentos de riesgo) y renal. Están contraindicados de forma absoluta en
enfermedad ulcerosa péptica activa, insuficiencia renal crónica y cardiaca.
Respecto a los opioides: su uso con una cuidadosa titulación, prevención e información
adecuada sobre los posibles efectos secundarios puede asegurar adherencia y eficacia
al tratamiento en la mayoría de los casos. Entre los efectos secundarios de este grupo
destacan los del sistema gastrointestinal: estreñimiento, como más frecuente y
persistente; náuseas y vómitos, sobre todo al inicio del tratamiento pero que
desaparece a los pocos días; prurito y retención urinaria.
Más raros son: toxicidad neurológica, efectos cardiológicos (sobre todo con metadona),
efectos en el eje hipotalámico hipofisario y depresión respiratoria en especial con
agonistas puros de los receptores Mu. La mayoría de los efectos adversos de los opioides
disminuyen con el uso a largo plazo, excepto el estreñimiento, y es importante
considerar que los efectos secundarios de los opioides son de naturaleza funcional con
mucho menor potencial de provocar daño que los AINES.
La presentación transdérmica es una opción para los adultos mayores en especial si
presentan deterioro cognitivo, para asegurar el cumplimiento terapéutico y en los que
presentan trastorno de la deglución. No se debe olvidar que el propio efecto adverso es
inversamente proporcional al dolor.
192
El efecto secundario al tratamiento para dolor neuropático dependerá del fármaco
administrado. Así por ejemplo: antidepresivos: efectos
anticolinérgicos (boca seca, constipación, retención urinaria, hipotensión ortostática),
toxicidad cardíaca (taquicardia ventricular, ectopia ventricular, agravamiento de
bloqueos de conducción), empeoramiento de trastornos de la marcha y del deterioro
cognitivo en personas de tercera edad.
6.4.4. Signos de Alarma
Si el paciente no obtiene mejoría, indicarle que debe acudir, utilizando las vías de
comunicación existentes a urgencias o a la consulta extraordinaria.
6.4.5 Criterios de Alta:
Se puede considerar al cese de los síntomas dolorosos.
6.4.6 Pronóstico:
Se sugiere programar la visita de seguimiento según cada caso en particular. Esto con el
objeto de garantizar un periodo suficiente para que la titulación permita alcanzar niveles
estables del fármaco en sangre.
6.5 Complicaciones:
• Disminución de la movilidad y riesgo de riesgo de trombosis;
• Atelectasias y neumonías aspirativas
• Disminución de la inmunidad y aumento del riesgo de infecciones en los post operados
inmediatos;
• Cardiovasculares: taquicardia, hipertensión y mayor riesgo de isquemia
coronaria
Aumento del cortisol e hiperglicemia;
Náuseas, vómitos y estreñimiento asociados a la medicación analgésica
Angustia, ansiedad y alteración del sueño,
• Riesgo aumentado de depresión en los post operados.
• Toxicidad hepática y renal asociada a la medicación analgésica y mayor riesgo de
interacciones farmacológicas
• Exacerbación o descompensación de las diversas comorbilidades así como las
funciones de órganos en especial
6.6 Criterios de Referencia y Contrareferencia
193
Criterio de referencia:
Pacientes adultos mayores que pueden provenir del servicio de emergencia,
hospitalización o consulta ambulatoria.
Criterios de contrarefencia:
Una vez evaluados y establecido su diagnóstico y plan de atención los pacientes serán
monitoreados periódicamente y aquellos que fueron referidos serán contrareferidos a
su establecimiento de origen.
Los casos de dolor crónico severo o de manejo complejo serán derivados a la Unidad de
Tratamiento de Dolor.
6.7 Fluxograma
194
VII. ANEXOS
195
196
VIII. REFERENCIAS BIBLIOGRÁFICAS
197
1. Pérez J. Versión actualizada de la definición de dolor de la IASP: un paso adelante o
un paso atrás. Revista de la Sociedad Española del Dolor. 2020. vol.27 N°.4 Madrid
jul./ago.
2. Treede RD, Jensen TS, Campbell JN et al. Neuropathic pain: redefinition and a grading
system for clinical and research purposes. Neurology 2008; 70:1630-5.
3. IASP International association for the study of pain. Letter from the IASP President.
2018. https://www.iasp: pain.org/Advocacy/Content.aspx?ItemNumber=3932.
4. Sociedad Española de Geriatria y Gerontología. Dolor Cronico en el Anciano. Gaia de
Buena práctica en Geriatria. 2012.
5. Noceda J. Características del dolor osteomuscular crónico en pacientes de atención
primaria. Revista Sociedad Española del Dolor. 2006; 13; (5): 287-93.
6. Álamo C. Cabezón L. et al. Sociedad Española de Geriatría y Gerontología. Dolor
oncológico en el anciano. Guía de buena práctica en geriatría. 2013.
7. Gil P. López J. Puerto M. Sociedad Española de Geriatría y Gerontología. Manual de la
buena práctica en cuidado de las personas mayores. 2013. Madrid.
8. Guevara U., Covarrubias A. et al. Consenso para el Manejo del Dolor Neuropático.
Practice guidelines for neuropathic pain management. Revista de Investigation Clinica.
2006; 58(2):126-38.
9. Adult Cancer Pain. NCCN - National Comprensive Cancer Network – Clinical Practice
Guideline in Oncology (NCCN Guideline). Version 2.2016.
10. Mencías AB, Rodríguez JL. Consideraciones sobre el empleo de opioides en el dolor
crónico del paciente geriátrico. Rev. Soc. Esp. Dolor. 2008. 7: 463-474.
11. Medwave 2004 Jun;4(5):e2751 doi: 10.5867/medwave.2004.05.2751.
12. Grupo de Trabajo de la Guía de Práctica Clínica sobre Cuidados Paliativos. Guía de
Práctica Clínica sobre Cuidados Paliativos. Madrid. 2008.
198