asignatura: patologia medica i.
Anuncio

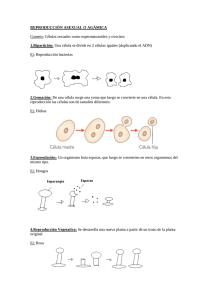
UNIVERSIDAD NACIONAL AUTONOMA DE HONDURAS EN EL VALLE DE SULA CATEDRATICA: Dra. Elizabeth Casco de Nuñez. ALUMNA: Glenda Yessenia Fonseca R. 20062000240 ASIGNATURA: PATOLOGIA MEDICA I. SECCION: 13:30 FECHA: 28 de agosto del 2011 SAN PEDRO SULA/ CORTES. CELULAS MADRES. Son células que tienen la capacidad de diferenciarse y originar células de la sangre y del sistema inmunológico así como también dar origen a células de diferentes tejidos y órganos como las células del sistema nervioso, del páncreas, hígado, corazón, vasos sanguíneos, hueso, cartílago, tejido adiposo y otros tipos celulares. Se espera que en un futuro cercano las células madres se utilicen para reparar daños cerebrales (derrames), lesiones de médula espinal, generar nuevos vasos sanguíneos y tratar enfermedades crónicas devastadoras para la sociedad como lo son el Alzheimer, el Parkinson, la Diabetes, enfermedades hepáticas y distrofia muscular. Las células madre tienen dos características importantes que las distinguen de otros tipos de células: 1. La primera de ellas es que son células no especializadas que se renuevan ilimitadamente. 2. La segunda es que bajo ciertas condiciones fisiológicas o experimentales, se las puede inducir a que se conviertan en células con funciones especiales tales como células musculares cardíacas o células de páncreas que produzcan insulina. Este tipo de células las podemos clasificar en células madre embrionarias y células madre adultas, que poseen diversas funciones y características. Toda célula madre (sin importar su origen) tiene tres características generales: son capaces de dividirse y de renovarse por períodos largos; son no especializadas; y pueden dar lugar a tipos especializados de célula. Una de las características fundamentales de una célula madre es que no tiene ninguna estructura de tejido específica que le permita realizar funciones especializadas. Una célula madre no puede trabajar con sus células vecinas para bombear sangre a través del cuerpo (como una célula del músculo del corazón); no puede llevar las moléculas de oxígeno a través de la circulación sanguínea (como una célula de la sangre); y no puede encender señales electroquímicas a otras células que permitan que el cuerpo se mueva o hable (como una neurona). Sin embargo, las células madre no especializadas pueden dar lugar a células especializadas, incluyendo las células del músculo del corazón, las células de la sangre, o las neuronas. CELULAS MADRES TOTIPOTENCIALES El termino “totipotencial” (del latín totus, que significa completo) hace referencia al potencial que tienen estas células de generar un embrión completo (tejido embrionario y extraembrionario). “Pluri” (del latín plures, que significa muchos o varios) es utilizado para describir las células madres pluripotentes que pueden dar origen a progenitores que forman cualquiera de las tres capas germinales embrionarias: mesodermo, endodermo y ectodermo. Una llamada célula madre totipotente puede crecer y formar un organismo completo, tanto los componentes embrionarios (como por ejemplo, las tres capas embrionarias, el linaje germinal y los tejidos que darán lugar al saco vitelino), como los extraembrionarios (como la placenta). Las células madres totipotenciales, solamente se pueden obtener durante los primeros días después de la fertilización, justo en el momento en el que el cigoto se ha constituido en una mórula para comenzar el proceso de segmentación de 2 hasta 32 blastómeros (68 h), organizándose en una capa periférica denominada trofoblastos. Los blastómeros del trofoblasto se multiplican rápidamente y se separan de las células centrales para conformar una cavidad entre el trofoblasto (futura placenta) y el embrioblasto (futuro individuo) llamado blastocele, adquiriendo el pre-embrión el nombre del blastocisto. Al efectuarse estas dos separaciones, las células de un blastocisto ya no son totipotentes, puesto que una sola célula ya no es capaz de generar un individuo completo. Las células de la masa celular interna del blastocisto ahora son células pluripotenciales. En resumen: se inicia la gastrulación y posteriormente la organogénesis, para culminar en el feto, y al nacimiento en el neonato. CELULAS PLURIPOTENCIALES Tienen la habilidad de diferenciarse a cualquiera de los tejidos procedentes de las 3 capas embrionarias. Llamadas también células mesenquimales. CELULA FORMA Circular con núcleo central COMPROM ETIDA NO UBICACIÓN TIEMPO ORIGINA Cigoto, mórula y blastómeros 1a semana de vida intrauterina Células embrionarias y extraembrionarias que originan nuevos seres. Blastocisto Masa celular interna Cordón umbilical Adulto: pulpa Embrionales: 2a a 8a semana Fetales: 8a semana Derivados de las 3 capas germinales: endodermo mesodermo ectodermo TOTIPOTENCIAL PLURIPOTENCIAL Fibroblastoide forma fusiforme Prolongaci nes citoplasmática s Núcleo central Y prominente NO La apoptosis: La apoptosis o "muerte celular programada" es una forma de suicidio celular genéticamente definida, que ocurre de manera fisiológica durante la morfogénesis, la renovación tisular y en la regulación del sistema inmunitario. Determinados hechos celulares pueden ser explicados por trastornos en la regulación de los genes responsables de la apoptosis, como es el caso de la transformación y la progresión tumorales. En este trabajo revisamos las características fundamentales de este mecanismo de muerte celular, sus variaciones morfológicas, bioquímicas, los genes involucrados y su papel en el desarrollo de malignidades, entre otros aspectos de interés. Los mecanismos que regulan la muerte celular son esenciales para el normal desarrollo y mantenimiento de la homeostasia. Las células crecen controladamente gracias a la expresión de nuevos genes que inducen señales de muerte en estadios definidos de diferenciación y en respuesta a estímulos fisiológicos determinados. En los años 80 se introduce el término griego de apoptosis que significa "caída de las hojas de un árbol o de los pétalos de una flor", para definir las características morfológicas particulares de un tipo de muerte celular fisiológica, programada genéticamente, que difiere de la muerte celular patológica o necrosis celular. Se considera a la apoptosis como un mecanismo fisiológico de muerte (inherente al desarrollo celular), que se desencadena por diversas señales, las cuales pueden ser fisiológicas, o por estimulaciones exógenes ambientales. Estas señales pueden actuar sobre receptores de superficie y causar la activación en cascada de proteínas citoplasmáticas; ello trae como resultado la activación de un programa genético que conduce, generalmente, a la nucleolisis por la acción de las endonucleasas. Este mecanismo de muerte celular interviene en importantes fenómenos fisiológicos como: embriogénesis, mantenimiento de la homeostasia, renovación tisular y desarrollo y funcionamiento del sistema inmunitario. Los trastornos en la regulación de la apoptosis por diferentes vías, están presentes en la etiopatogenia de diversas enfermeddes autoinmunes, neurodegenerativas, y también se sugiere que participen en el Síndrome de Inmunodeficiencia Adquirida (SIDA). Debido a que la apoptosis puede considerarse como un proceso de eliminación de células defectuosas, la desregulación de los genes que codifican las proteínas relacionadas con la apoptosis, puede ser la causa del desarrollo de diversos tumores. CARACTERÍSTICAS MORFOLÓGICAS DE LA APOPTOSIS Las características de la célula apoptótica difieren de las observadas en las células que sufren necrosis. En este último fenómeno la muerte es un proceso "pasivo" que no requiere de síntesis proteica, y es causado por la pérdida de la homeostasia. Se caracteriza por daño mitocondrial, rotura de la membrana, lisis celular y liberación de su contenido al medio extracelular. Contrariamente, la apoptosis es un proceso activo que implica síntesis proteica, en el cual la célula sufre una condensación nuclear y citoplasmática. Sus características morfológicas revelan condensación de la cromatina nuclear, desintegración nucleolar, disminución del tamaño nuclear, compactación del citoplasma y de organelo (excepto mitocondrias y ribosomas), alteraciones del citoesqueleto y aspecto de burbuja de la membrana, aunque no se rompa. Durante el proceso final ocurre fragmentación del DNA debido a una ruptura internucleosomal del DNA y se forman fragmentos nucleares recubiertos de membrana (cuerpos apoptóticos), que son fagocitados sin evidencia de reacción inflamatoria. RECEPTORES DE MEMBRANA CELULAR QUE MEDIAN APOPTOSIS Un avance importante para la investigación de la apoptosis se logró cuando se indentificó un antígeno (Ag) de membrana celular capaz de inducir señales de apoptosis. Este receptor se denominó Fas o Apo-1, cluster de diferenciación (CD) 95, y es una proteína transmembrana tipo II glicosilada de aproximadamente 43 kD que se expresa constituitivamente en gran variedad de tejidos normales y líneas tumorales. El interés en este receptor aumentó cuando se demostró, en modelos murinos, que las mutaciones en el gen que codifica a este receptor, se relacionan con trastornos linfoproliferativos por la incapacidad de producir apoptosis. El Fas/Apo-1 es miembro de la superfamilia de los Factores de Necrosis Tumoral (TNF), entre los que se encuentran los Receptores TNF tipo I y II, el receptor del factor de crecimiento neuronal (NGF), CD40 y CD27. El ligando del Fas/Apo-1 es una proteína de membrana tipo II de 40 kD miembro de la familia del TNF que está altamente expresado en linfocitos activados.La unión del Ag de membrana Fas/Apo1 con su ligando y con anticuerpos antagonistas, es una de las vías de inicio de señales para la apoptosis.Existe una relación estrecha entre la participación del ligando Fas y la citotoxicidad mediada por los linfocitos T CD8+, mecanismo efector de gran importancia en la respuesta inmune antitumoral. El papel de la interacción Fas/Apo-1 y su ligando en cáncer no está bien establecido; sin embargo, su papel en la apoptosis sugiere su participación como supresores del tumor. Por ejemplo, la inactivación de las señales vía Fas debido a la baja expresión de este Ag en la membrana, puede llevar a la célula a una supervivencia anormal y contribuir al desarrollo y progresión de malignidades.20 MECANISMOS BIOQUÍMICOS DE LA APOPTOSIS Las vías bioquímicas involucradas en la apoptosis se encuentran actualmente en investigación. Se conoce que los linfocitos y la mayoría de las células nucleadas experimentan ruptura internucleosomal del DNA mediante endonucleasas Ca2+ Mg2+ dependiente, entre las que se encuentran la NUC-18, la DNAsa I y la DNAsa II. Sin embargo, existen múltiples evidencias de apoptosis en células enucleadas, por tanto el mecanismo apoptótico puede no interesar al núcleo. Ciertos experimentos realizados en células enucleadas de nematodos que sufren apoptosis, han evidenciado la existencia de más de una vía de apoptosis, donde los cambios citoplasmáticos pueden ser decisivos. En esta especie se han definido varios genes que codifican proteínas citoplasmáticas relacionadas con la apoptosis, como la Ced-3 (ICE-enzima convertidora de IL1 b), Ced-4 y la Ced-9. En los mamíferos existe la proteasa "ICE like" que forma una familia de proteasas suicidas y es homóloga a la proteína Ced-3 de nematodos, también se observa homología entre los genes Ced-9 nematodos y bcl-2 de mamíferos, ambos inhibidores de la apoptosis. GENES INVOLUCRADOS EN LA APOPTOSIS FAMILIA DE GENES bcl-2 El bcl-2 (B cell leukemia/lymphoma 2 genes) fue el primer proto-oncogen detectado y fue asociado con procesos malignos de las células B. Durante la maduración de las células B puede ocurrir una traslocación cromosomal 14,18 en el gen bcl-2; ello provoca un aumento en la expresión de la proteína citoplasmática Bcl-2, que origina inhibición de la apoptosis en células B y da por resultado la supervivencia de la célula transformada. Está demostrado que la sobreexpresión del gen bcl-2 en linformas inducidos experimentalmente, se asocia con la proliferación neoplásica por los efectos inhibitorios de Bcl-2 sobre las vías de apoptosis. Este gen facilita el aumento de la supervivencia de la célula transformada y de este modo aumenta la posibilidad de futuras aberraciones genéticas que pueden conducir a la progresión maligna. La expresión de este gen en algunos tipos de cáncer es un marcador de mal pronóstico. El gen bcl-2 forma parte de una familia de genes que intervienen en la regulación de la supervivencia de la célula. Los miembros de la familia Bcl-2 están integrados por: Bcl-2, Bax, Bad, Bcl-X1, Bcl-Xs, Mcl-1. El destino de una célula de morir o sobrevivir está determinado por las diferencias en la expresión de estas proteínas, actuando algunas como promotoras y otras como inhibidoras de las señales de apoptosis. Es importante destacar que Bcl-2 no confiere protección a la célula contra la apoptosis, ni en la selección negativa de células autorreactivas del timo, ni en los mecanismos citotóxicos de los linfocitos T citotóxicos (CTL). Tampoco se aprecia su efecto protector sobre las células B inmaduras que sufren apoptosis por entrecruzamiento IgM ni en la activación de la célula vía receptor Fas/TNF.26 El bcl-2 se expresa de manera importante durante estadios muy tempranos de la diferenciación de células B y T, y también está altamente expresado en la etapa de diferenciación final de los linfocitos; es por ello que las células en estadios intermedios de desarrollo son más susceptibles a la muerte celular. OTROS GENES Es conocido que ciertos oncogenes y genes supresores de tumor influyen en el mecanismo de muerte celular programada; tal es el caso de los genes c-myc y nur-77, que a pesar de estar asociados con la progresión del ciclo celular participan en la inducción de apoptosis en algunas células, también se encuentra el gen bcl-2 que como ya ha sido descrito, bloquea la apoptosis cuando es sobreexpresadoy el gen p53, cuyo requerimiento se produce en casos de daño genómico. La expresión de estos genes puede inducir a algunos tipos de cáncer a la apoptosis. Esto sugiere que la muerte celular programada es un mecanismo de defensa contra la transformación maligna. El gen p53 ha sido llamado guardián del genoma por ser el encargado de bloquear la división celular cuando las células han sufrido daño en su material genético. Este bloqueo lo lleva a cabo deteniendo las células en la fase G1 del ciclo celular, con el objetivo de que se produzca la reparación del DNA antes de que se replique. Este gen mantiene la integridad del genoma ya que estimula la apoptosis en las células en las que el daño en el DNA ha sido sustancial. En diversos tipos celulares incluyendo los linfocitos, la sobreexpresión de p53 conduce directamente a la apoptosis. La pérdida de la función normal del gen p53 puede conducir al desarrollo de neoplasias malignas; de hecho son muy frecuentes las alteraciones en este gen en una variedad de cánceres humanos (más del 50 % de los tumores humanos están asociados a mutaciones en p53). Hay evidencias que hacen pensar que el alto riesgo de la transformación maligna en ausencia de p53 funcional, probablemente origina una oportunidad reducida de reparar el DNA y una incapacidad de eliminar por apoptosis la célula dañada no reparada. Aunque es desconocida la base real de la apoptosis inducida por este gen. Los timocitos de ratón que pierden copias funcionales del p53 son incapaces de desarrollar apoptosis luego de ser irradiados; estas células responden normalmente a glucocorticoides y a señales a través del receptor. Se ha evidenciado que los genes involucrados en una vía de apoptosis no necesariamente juegan una importante función en otra vía. Así por ejemplo nur77 se requiere para la apoptosis mediada por el receptor de células T (TCR), no siendo importante en la muerte celular por glucocorticoides o radiación ionizante. A pesar de esto, se ha observado en ratones deficientes de nur77, muerte celular mediada por el receptor, sugiriéndose que, o bien este gen no es requerido in vivo para la apoptosis, o existe un gen estrechamente relacionado con él que puede compensar su deficiencia. Estudios anteriores sugieren la influencia de la expresión de nur77 en la proliferación o la diferenciación celular. El producto de nur77 es una proteína que pertenece a la familia del receptor nuclear de hormonas esteroides y su efecto en la apoptosis está dado porque actúa como un factor de transcripción que regula la expresión de genes involucrados en la muerte celular. Otro regulador fisiológico del ciclo celular que participa en la apoptosis es la proteína Myc, que es producto del proto-oncogen c-myc. La sobreexpresión del gen c-myc pudiera resultar en mitosis o apoptosis en dependencia de la disponibilidad de otros factores que estimulan el crecimiento celular.32 De esta forma la expresión incrementada de Bcl-2 en presencia de un aumento de c-myc prococa una inhibición de la apoptosis mediada por c-myc, lo que explica la cooperación que se produce entre ambos genes en el origen de las neoplasias. Además del papel que juega la apoptosis en el origen del cáncer, su modulación también pudiera influir en el tratamiento de esta enfermedad. PAPEL DE LA APOPTOSIS EN EL SISTEMA INMUNITARIO La muerte celular programada es muy importante para el desarrollo y funcionamiento del sistema inmunitario, debido a que interviene en los eventos de formación del repertorio de células T y B, en los mecanismos de tolerancia central y periférica, en la eliminación de células autorreactivas, en el establecimiento de la memoria inmunológica y en los mecanismos citolíticos de células asesinas naturales y linfocitos T citotóxicos. Es conocido que el 95 % de los timocitos son eliminados en el timo por mecanismos de apoptosis, proceso denominado selección negativa (deleción clonal), el cual elimina la existencia de clones T autorreactivos. También en la médula ósea existe un proceso similar de deleción de clones B, autorreactivos en el estadio B inmaduro por entrecruzamiento de la inmunoglobulina de superficie en ausencia de señales coestimulatorias. No obstante, la apoptosis no se restringe a las células inmaduras. También los linfocitos T maduros, bajo ciertas condiciones, pueden sufrir apoptosis, lo que corrobora su papel inmunorregulador. Entre los factores que pueden inducir apoptosis en células maduras están: los glucocorticoides y las radiaciones gamma, la estimulación del complejo TCR/CD3 por anticuerpos monoclonales,26 Ags nominales y superantígenos y la estimulación de los receptores CD2, Fas/Apo-1 y TNF. Se ha demostrado que la sensibilidad para lograr la apoptosis es más lenta en células maduras y requiere previa activación. La ruta que siguen los linfocitos T al ser estimulados depende de una serie de elementos que determinan si la célula prolifera, o si muere por apoptosis. Célula animal y célula vegetal. Las células son la porción más pequeña de materia viva capaz de realizar todas las funciones de los seres vivos, es decir, reproducirse, respirar, crecer, producir energía, etc. Existen dos tipos de células con respecto a su origen, células animales y células vegetales: En ambos casos presentan un alto grado de organización con numerosas estructuras internas delimitadas por membranas. La membrana nuclear establece una barrera entre el material genético y el citoplasma. Las mitocondrias, de interior sinuoso, convierten los nutrientes en energía que utiliza la planta. Diferencias entre células animales y vegetales Tanto la célula vegetal como la animal poseen membrana celular, pero la célula vegetal cuenta, además, con una pared celular de celulosa, que le da rigidez. La célula vegetal contiene cloroplastos: organelos capaces de sintetizar azúcares a partir de dióxido de carbono, agua y luz solar (fotosínteis) lo cual los hace autótrofos (producen su propio alimento) , y la célula animal no los posee por lo tanto no puede realizar el proceso de fotosíntesis. Pared celular: la célula vegetal presenta esta pared que está formada por celulosa rígida, en cambio la célula animal no la posee, sólo tiene la membrana citoplasmática que la separa del medio. Una vacuola única llena de líquido que ocupa casi todo el interior de la célula vegetal, en cambio, la célula animal, tiene varias vacuolas y son más pequeñas. Las células vegetales pueden reproducirse mediante un proceso que da por resultado células iguales a las progenitoras, este tipo de reproducción se llama reproducción asexual. Las células animales pueden realizar un tipo de reproducción llamado reproducción sexual, en el cual, los descendientes presentan características de los progenitores pero no son idénticos a él. Mitosis. Mitosis es la división nuclear más citocinesis, y produce dos células hijas idénticas durante la profase, prometafase, metafase, anafase y telofase. La interfase frecuentemente se incluye en discusiones sobre mitosis, pero la interfase técnicamente no es parte de la mitosis, más bien incluye los etapas G1, S y G2 del ciclo celular. Interfase & mitosis Interfase : La célula está ocupada en la actividad metabólica preparándose para la mitosis (las próximas cuatro fases que conducen e incluyen la división nuclear). Los cromosomas no se disciernen claramente en el núcleo, aunque una mancha oscura llamada nucleolo, puede ser visible. La célula puede contener un par de centriolos ( o centros de organización de microtubulos en los vegetales ) los cuales son sitios de organización para los microtubulos. Profase La cromatina en el núcleo comienza a condensarse y se vuelve visible en el microscopio óptico como cromosomas. El núcleolo desaparece. Los centríolos comienzan a moverse a polos opuestos de la célula y fibras se extienden desde los centrómeros. Algunas fibras cruzan la célula para formar el huso mitótico. Prometafase La membrana nuclear se disuelve, marcando el comienzo de la prometafase. Las proteínas de adhieren a los centrómeros creando los cinetocoros. Los microtubulos se adhieren a los cinetocoros y los cromosomas comienzan a moverse. Metafase Fibras del huso alinean los cromosomas a lo largo del medio del núcleo celular. Esta línea es referida como, el plato de la metafase. Esta organización ayuda a asegurar que en la próxima fase, cuando los cromosomas se separan, cada nuevo núcleo recibirá una copia de cada cromosoma. Anafase Los pares de cromosomas se separan en los cinetocoros y se mueven a lados opuestos de la célula. El movimiento es el resultado de una combinación de: el movimiento del cinetocoro a lo largo de los microtubulos del huso y la interacción física de los microtubulos polares. Telofase Los cromatidos llegan a los polos opuestos de la célula, y nuevas membranas se forman alrededor de los núcleos hijos. Los cromosomas se dispersan y ya no son visibles bajo el microscopio óptico. Las fibras del huso se dispersan, y la citocinesis o la partición de la célula puede comenzar también durante esta etapa. Citocinesis En células animales, la citocinesis ocurre cuando un anillo fibroso compuesto de una proteína llamada actína, alrededor del centro de la célula se contrae pellizcando la célula en dos células hijas, cada una con su núcleo. En células vegetales, la pared rígida requiere que un placa celular sea sintetizada entre las dos células hijas. ANATOMIA HEPATICA. El hígado está localizado en la región del hipocondrio derecho del abdomen (normalmente no sobrepasa el límite del reborde costal), llenando el espacio de la cúpula diagragmática, en donde puede alcanzar hasta la quinta costilla, y se relaciona con el corazón a través del centro frénico, a la izquierda de la cava inferior. Normalmente es blando y depresible, y está recubierto por una cápsula fibrosa. Sobre esta cápsula fibrosa se aplica el peritoneo en la mayor porte de la superficie del hígado (excepto en el área desnuda del hígado). Macroscópicamente está dividido en cuatro lóbulos: 1. Lóbulo derecho, el más voluminoso. 2. Lóbulo izquierdo, extendido sobre el estómago. 3. Cuadrado, en la base, de menor tamaño que los anteriores, entre la fosa de la vesícula biliar y el ligamento redondo. 4. Lóbulo caudado, situado en la parte posterior de la base del hígado, entre el surco de la vena cava inferior y la fisura del ligamento venoso. Clínicamente, y quirúrgicamente sobre todo, se emplea el concepto de segmento hepático, basándose en las divisiones arteriales y en el hecho de que haya pocas anastomosis entre segmentos. Si miramos por la cara antero-superior el hígado podemos distinguir de derecha a izquierda un segmento posterior, en el borde del lado derecho, seguido de un segmento anterior, un segmento medial y un segmento lateral que forma el límite izquierdo. El hígado se relaciona principalmente con estructuras situadas al lado derecho del abdomen, muchas de las cuales dejan una impresión en la cara inferior del lóbulo derecho del hígado. Así tenemos de atrás a adelante la impresión cólica, la impresión duodenal, pegada a la fosa cística, y la impresión renal, menos marcada. En la cara inferior del lóbulo izquierdo están la impresión gástrica y la escotadura del esófago en el borde posterior. Las relaciones con el diafragma y con el corazón completan los órganos vecinos al hígado. La base del hígado da entrada al hilio hepático, que no es sino la zona de entrada del omento (epiplón) menor con la vena porta, la arteria hepática y la salida del conducto hepático. El omento (epiplón) menor (fijado en una prominencia de la cara inferior denominada tubérculo omental) reviste el fondo de los surcos de la base del hígado (surco del ligamento venoso, surco del ligamento redondo) y alcanza el borde posterior de la cara inferior, en donde el peritoneo que lo recubre pasa a revestir el diafragma y la pared posterior formando el ligamento hepatorrenal. Por delante el peritoneo reviste la cara diafragmática hasta su límite superior, en donde salta a revestir la cara abdominal del diafragma. Entre los dos repliegues de peritoneo que saltan de la superficie del hígado al diafragma queda comprendida la cara desnuda del hígado, zona en la que el peritoneo no recubre la cápsula hepática. Por esta zona la cava inferior se relaciona con el hígado y recibe las venas hepáticas. En la cara diafragmática se encuentra el ligamento falciforme, el cual se extiende hasta alcanzar la zona umbilical. Por su borde libre corre el ligamento redondo del hígado (restos de la vena umbilical embrionaria). Este resto de la vena umbilical se unen a las venas subcutáneas periumbilicales que irradian desde el ombligo, las cuales drenan en la vena ilíaca externa y finalmente en la cava inferior. En casos patológicos con hipertensión portal estas venas se dilatan formando el fenómeno de la cabeza de medusa. El ligamento falciforme puede ser considerado como los restos del mesogastrio ventral (en la porción no desarrollada del septum transversum por la invasión embrionaria del brote duodenal) que se extiende por el mesogastrio ventral y que contribuye a la formación del hígado. Este ligamento, al llegar a la parte posterior de la cara diafragmática del hígado se divide en dos hojas, dando lugar al ligamento coronario (límite superior del área desnuda del hígado). Cada una de estas hojas se dirige hacia cada uno de los bordes derecho e izquierdo del hígado, en donde se una a la hoja peritoneal de la cara visceral del hígado que se refleja sobre el diafragma, formando los ligamentos triangulares derecho e izquierdo (éste último más definido que el derecho). La estructura del hígado va a seguir estrechamente las divisiones de la vena porta. Tras la división en ramos segmentarios, las ramas de la vena porta, acompañadas de las de la arteria hepática y de las divisiones de los conductos hepáticos, se encuentran juntos en el espacio porta (vena interlobulillar, arteria interlobulillar y conductillos interlobulillares).Cada espacio porta se encuentra en la confluencia de los lobulillos hepáticos, que son formaciones más o menos hexagonales de células hepáticas y que posee en el centro la vena centrolobulillar. La confluencia de venas centrolobulillares da lugar a las venas hepáticas, que finalmente drenan en la vena cava inferior. Por lo tanto, la sangre rica en nutrientes de la absorción intestinal (vena porta) y en oxígeno (arteria hepática) se mezclan en los sinusoides hepáticos (espacios entre hepatocitos), para elaborar los metabólicamente y sinterizar las sales biliares. Fenómenos infecciosos, tóxicos, inflamatorios, etc., desestrucuran los lobulillos hepáticos y los espacios porta, conduciendo a la hipertensión portal porque este flujo vascular está obstaculizado.El drenaje linfático del hígado corre a cargo de vasos que desembocan hacia la cava inferior o hacia los ganglios hepáticos que siguen el recorrido inverso de la arteria hepática. El aporte nervioso también le proviene del plexo celíaco que inerva al hepático, mezcla de fibras simpáticas y parasimpáticas. Estos nervios llegan al hígado junto a la arteria hepática. Vía intrínseca o mitocondrial: La mitocondria no es sólo la productora de energía de la célula, es también un arsenal. La mitocondria secuestra un potente cóctel de proteínas proapoptóticas. La más prominente entre ellas es el citocromo c, el humilde transportador de electrones. Varios trabajos han revelado que el citocromo c es todo lo contrario a inocuo y que además de su implicación en la fosforilación oxidativa mitocondrial, es uno de los componentes requeridos para la activación de la caspasa-9 en el citosol (Li P, 1997). No se conoce exactamente cómo el citocromo c atraviesa la membrana externa, pero está claro que la familia de Bcl-2 está íntimamente implicada en la regulación de este proceso. El nombre de la familia se debe al primer miembro, que fue aislado como un gen implicado en el linfoma de células B (de ahí el nombre bcl, B-cell lymphoma) que es homólogo del represor de la apoptosis ced-9 de C. elegans . Esta familia consta de 19 miembros que se ha clasificado en tres grupos basándose en similitudes estructurales y funcionales. Cada miembro posee al menos uno de los cuatro motivos conservados denominados dominios de homología con Bcl-2 (Bcl-2 homology domains, BH ): BH1-BH4. Los miembros del grupo I, como Bcl-2 y Bcl-X L , poseen actividad antiapoptótica y se caracterizan por tener los cuatro dominios BH (BH1-BH4). Además poseen una cola hidrofóbica en el C-terminal que localiza la proteína en la membrana externa de la mitocondria. El grupo II consta de miembros de la familia de Bcl-2 con actividad proapoptótica, como por ejemplo Bax y Bak. Tienen estructura similar a las del grupo I pero carecen del dominio BH4. Estudios de estructura y función sugieren que la actividad anti y proapoptótica está determinada por una región relativamente larga que incluye dos hélices a que participan en la inserción a la membrana. Los miembros del grupo III también tienen actividad proapoptótica. Todos ellos se caracterizan por la presencia de un único dominio BH3, además pueden o no tener región transmembrana. Los miembros más característicos son Bid, Bad, Bim, Bik. La función clave de los miembros de la familia de Bcl-2 es regular la liberación de factores proapoptóticos, en particular el citocromo c, desde el compartimento intermembranal de la mitocondria hasta el citosol (Adams JM, 1998; Antonsson B, 2000). ¿Cómo controlan los miembros de la familia de Bcl-2 la muerte celular? Parece ser que se pasan la mayoría del tiempo simplemente intentando bloquear el siguiente movimiento del otro. Algunos miembros de la familia pueden homodimerizar pero, lo que es más importante, pueden formarse heterodímeros de miembros pro y antiapoptóticos (Adams JM, 1998; Antonsson B, 2000; Reed JC, 1997). En una primera aproximación, la heterodimerización puede simplemente resultar en una neutralización mutua de las proteínas pro y antiapoptóticas unidas. Por tanto, el problema consiste sólo en comparar los niveles totales de miembros pro y antiapoptóticos de la familia: células con más proteínas pro muerte son más sensibles a la apoptosis; células con exceso de miembros de la familia protectora serán normalmente resistentes. Recientemente se ha identificado un inhibidor de las IAPs de mamíferos, denominado Smac (second mitochondria-derived activator of caspases) (Du C, 2000) o DIABLO ( direct IAP-binding protein with low pI ) ( Verhagen AM, 2000). Smac/DIABLO se une a los miembros de la familia de las IAPs y neutraliza su actividad antiapoptótica. Curiosamente, Smac/DIABLO es una proteína mitocondrial normal pero su liberación al citosol celular induce apoptosis, presumiblemente siguiendo las mismas ruta de salida que el citocromo c. Por tanto, si una célula está comprometida a sufrir apoptosis y libera el contenido mitocondrial al citosol, entonces Smac/DIABLO secuestra las proteínas IAPs y se asegura que estas proteínas no intenten parar el programa en curso. La vía mitocondrial se ejecuta en respuesta a intromisiones externas y a daño en el DNA. Las distintas vías de respuesta convergen en la mitocondria, a menudo a través de la activación de miembros proapoptóticos de la familia de Bcl-2. Excepto Bcl-2, que está la mayoría del tiempo anclado a membranas intracelulares, algunos miembros de los grupos II y III, incluyendo Bax, Bad, Bim y Bid, pueden localizarse tanto en el citosol como en orgánulos (Gross A, 1999; Li H, 1998; Wolter KG, 1997; Puthalakath H, 1999). La forma citosólica de estas proteínas es un reservorio inactivo pero preparado para la batalla. Las señales proapoptóticas redirigen estas proteínas a la mitocondria donde tendrá lugar la lucha por el destino de la célula. La activación de miembros proapoptóticos puede producirse a través de proteolisis, defosforilación y probablemente otros mecanismos (Adams JM, 1998; Antonsson B, 2000). Los miembros pro y antiapoptóticos de la familia de Bcl-2 se encuentran en la superficie de la mitocondria donde regulan la salida del citocromo c por un mecanismo todavía debatido. Si los miembros proapoptóticos ganan, una gran cantidad de moléculas son liberadas desde la mitocondria. La principal de estas moléculas liberadas es el citocromo c, que se asocia con Apaf-1 y después con la procaspasa-9 (y posiblemente otras proteínas) para formar el apoptosoma. Las proteínas de choque térmico (heat-shock proteins, HSP) actúan en múltiples pasos regulando la apoptosis (Jaattela M, 1999; Xanthoudakis S, 2000). El apoptosoma hidroliza la procaspasa-3 a caspasa-3 que se encarga de ejecutar la apoptosis generando distintos subprogramas cuya suma resultará en el desmantelamiento ordenado y en la muerte de la célula. Vía extrínseca o de los receptores de muerte: Los receptores de muerte de la familia del receptor de TNF (TNFR) incluyen TNFR1, Fas (CD95), DR3/WSL y los receptores del ligando inductor de apoptosis relacionado con el TNF (TNF-related apoptosis-inducing ligand, TRAIL)/Apo-2L (TRAIL-R1/DR4, TRAIL-R2/DR5). Los miembros de esta familia están caracterizados por presentar de dos a cinco copias de un dominio extracelular rico en cisteína. Los receptores de muerte también poseen un dominio intracelular en el C-terminal del receptor denominado dominio de muerte (death domain, DD ). Cuando un ligando se une a estos receptores se puede producir la muerte por apoptosis de la célula que los posee. El miembro de los receptores de muerte más estudiado y relevante en Inmunología es el CD95 o Fas. La oligomerización, más probablemente la trimerización, del CD95 tras la unión de su ligando, FasL, es requerida para la transducción de la señal apoptótica. Un complejo de proteínas se asocia con el CD95 activado. Este complejo de señalización inductor de muerte (death-inducing signalling complex,DISC ) se forma en el segundo de los receptores trimerizados. Primero, el adaptador FADD (Fas-associated death domain) o Mort1 se une a través de su dominio de muerte al dominio de muerte del CD95. FADD también presenta el denominado dominio efector de muerte (death-effector domain, DED ), y, de nuevo por interacciones homólogas, recluta en el DISC la procaspasa-8 (o FLICE) que contiene un DED. Después, la procaspasa-8 es activada proteolíticamente y la caspasa-8 activa es liberada del DISC al citoplasma formando un heterotetrámero de dos subunidades pequeñas y dos grandes (Muzio M, 1996). La caspasa-8 activa rompe varias proteínas de la célula incluyendo la procaspasa-3, que resulta en su activación y en la finalización de la muerte celular. La inhibición de esta ruta es realizada por proteínas que contienen dos DED y que se unen al complejo CD95-FADD. Esto inhibe el reclutamiento y la activación de la caspasa-8, antiguamente conocida como FLICE, de ahí el nombre de proteínas inhibidoras de FLICE (FLICE-inhibitory proteins, FLIP ) (Thome M, 1997; Hu S, 1997; Bertin J, 1997; Yeh WC,2000). La vía de los receptores de muerte y la vía mitocondrial convergen a nivel de la activación de la caspasa-3. El solapamiento y la integración de las dos vías se debe a Bid, un miembro proapoptótico de la familia de Bcl-2. La caspasa-8 media la ruptura de Bid incrementando enormemente su actividad proapoptótica que resulta en su translocación a la mitocondria donde promueve la liberación del citocromo c. Hay que tener en cuenta que en la mayoría de las condiciones, este solapamiento es mínimo, y las dos vías operan de manera independiente. El ciclo de Krebs (conocido también como ciclo de los ácidos tricarboxílicos o ciclo del ácido cítrico) es un ciclo metabólico de importancia fundamental en todas las células que utilizan oxígeno durante el proceso de respiración celular. En estos organismos aeróbicos, el ciclo de Krebs es el anillo de conjunción de las rutas metabólicas responsables de la degradación y desasimilación de loscarbohidratos, las grasas y las proteínas en anhídrido carbónico y agua, con la formación de energía química. El ciclo de Krebs es una ruta metabólica anfibólica, ya que participa tanto en procesos catabólicos como anabólicos. Este ciclo proporciona muchos precursores para la producción de algunos aminoácidos, como por ejemplo el cetoglutarato y el oxalacetato, así como otras moléculas fundamentales para la célula. El ciclo toma su nombre en honor del científico anglo-alemán Hans Adolf Krebs, que propuso en 1937 los elementos clave de la ruta metabólica. Por este descubrimiento recibió en 1953 el Premio Nobel de Medicina. La hematopoyesis o hemopoyesis es el proceso de formación, desarrollo y maduración de los elementos formes de la sangre (eritrocitos, leucocitos y plaquetas) a partir de un precursor celular común e indiferenciado conocido como célula madre hematopoyética pluripotencial o stem cell. Las células madre que en el adulto se encuentran en la médula ósea son las responsables de formar todas las células y derivados celulares que circulan por la sangre. Durante las primeras semanas embrionarias se encuentran células madres en el saco vitelino, las cuales van diferenciándose en células eritroides, provistas de hemoglobina embrionaria. Desde el tercer mes hasta el séptimo de embarazo, las células madre migran, primero al hígado fetal, y después al bazo fetal, donde sigue la hematopoyesis. Desde el séptimo mes, va disminuyendo la hematopoyesis en el hígado y bazo, hasta que desaparece para la época del nacimiento, y va adquiriendo preeminencia el papel de la médula ósea. CÉLULAS Y TEJIDOS DEL SISTEMA INMUNE. El sistema inmune de los vertebrados superiores está compuesto por una variedad de células morfológica y funcionalmente diferentes, que se diferencian a partir de células primordiales pluripotenciales. Todos estos tipos celulares ejercen funciones diferentes, interaccionando constantemente entre sí. Estas interacciones pueden estar mediadas por contacto físico o a través de factores solubles que ejercen su función en células con receptores específicos. Las células que forman el sistema inmune se organizan a su vez en tejidos y órganos, estructuras que reciben el nombre genérico de sistema linfoide. Los tejidos y órganos linfoides se pueden dividir en primarios o centrales y en secundarios o periféricos. Los órganos primarios son los lugares de la linfopoyesis, mientras que los periféricos son los lugares de interacción entre las distintas células y tienen como misión proveer un ambiente favorable para que se desencadenen las respuestas inmunológicas. 2.1 Las células del sistema inmune: Ya vimos en el capítulo anterior cuáles eran los tipos celulares fundamentales tanto de la inmunidad innata como de la adquirida . Todas las células del s. inmune provienen de células madre pluripotenciales o stem cells. Del hígado embrionario surge la médula ósea , allí existen stem cells que dan lugar a todas las células. Las células stem de la médula ósea siguen dos líneas fundamentales de diferenciación : · · Del progenitor mieloide o promielocito derivan los eritrocitos e inflamocitos , este último grupo se subdivide en : · · · · Existen múltiples células dendríticas con distintos precursores (tanto mieloides como linfoides). Del progenitor linfoide derivan : · · · · a) Promielocito : Tiene forma esférica, es el precursos entre otros de los granulocitos. Tiene gránulos 1º azurófilos, Aparato de Golgi (AG) muy desarrollado, y un núcleo sencillo. Su Retículo endoplásmico rugoso (RER) está poco desarrollado. linaje mieloide, linaje linfoide. Megacariocitos: que van a originar las plaquetas, Mastocitos, Granulocitos (Eosinófilos , Basófilos y Neutrófilos) Fagocitos (Eosinófilos , Neutrófilos , Macrófagos y Monocitos) Algunas células dendríticas, Linfocitos B, Linfocitos T (tanto cooperadores Th, como citotóxicos Tc) Linfocitos NK, b) Granulocitos: · Neutrófilo o Polimorfonuclear : presentan núcleo multilobulado, con AG poco desarrollado y gránulos primarios y secundarios además de gránulos de glucógeno. · Eosinófilo : su núcleo es, normalmente, bilobulado. Presenta un AG poco desarrollado y gránulos con centro cristalino. · Basófilo : núcleo con lobulaciones suaves.Tiene gránulos primarios, otros con cristaloides y estructuras lamelares concéntricas y gránulos pequeños con glucógeno. Su RER y AG están poco desarrollados. c) Mastocitos : Durante un tiempo se creyó que mastocitos y basófilos eran el mismo tipo de células (la primera en tejidos y la segunda en la sangre). Hoy se sabe que son dos estirpes celulares diferentes con funciones muy similares: liberación de mediadores inflamatorios (en tejidos o en sangre, respectivamente). Los mastocitos tienen un núcleo sencillo y gran profusión de microvilli en su superficie. Pero además, hay otras diferencias entre ambos tipos celulares : 1º-Los basófilos viven en sangre periférica y los mastocitos en el tejido conectivo y mucosas. 2º-Los basófilos tienen núcleo bilobulado y los mastocitos núcleo sencillo. 3º-El diámetro de los basófilos es de 10 micras y los mastocitos llegan a las 30 micras. 4º-Los basófilos tienen gránulos de glucógeno y los mastocitos no. 5º-Los gránulos en los mastocitos son más pequeños y están en mayor número. d) Plaquetas . Son células anucleadas que derivan del megacariocito, por fragmentación. Presentan grandes vacuolas y gránulos (de glucógeno entre otros) .En su citoplasma hay microtúbulos concentrados en la zona exterior. e) Monocitos y Macrófagos : El macrófago pueden tener forma y función diferentes según el tejido en el que se encuentren, además de recibir distintos nombres: · Monocito al macrófago en sangre, · Histiocito al macrófago en los tejidos, · Osteoclasto al macrófago en los huesos , · Microglía a los macrófagos del tejido nervioso. · Célula de Kupffer: macrófagos del hígado Todos ellos hacen dos cosas: 1) fagocitan y digieren patógenos y 2) avisan mediante factores solubles a otras células para que echen una mano con la infección y para reparar el posible desaguisado que haya hecho el patógeno. En cualquier caso , presentan un núcleo simple o ligeramente lobulado. Su AG es mediano; en el macrófago existen vacuolas fagocíticas, lisosomas (1º ´s y 2º´s).Sus mitocondrias son filamentosas. Presentan cuerpos multilaminares y pueden aparecer pseudópodos en la superficie celular (en el caso de los macrófagos) o microvellosidades (en el caso de los monocitos). f) Linfocitos T y B : Los linfocitos T y B, cuando no están activados presentan un gran núcleo simple rodeado por una aureola de citoplasma (en anillo), AG pequeño , pocos gránulos y RER poco desarrollado. Además tiene gran número de ribosomas libres. Los linfocitos B, al activarse deben sintetizar Inmunoglobulinas; sufren una diferenciación final a Células Plasmáticas . Para una síntesis activa de proteínas, su RER y AG ocupan gran parte del contenido celular y su núcleo pasa a ocupar menos espacio y presenta una estructura en rueda de carro (la heterocromatina representa los radios). g) Linfocitos NK : También llamados Linfocitos grandes granulares (LGL): tienen un núcleo simple, con un AG mediano y gran profusión de gránulos (para su función lítica) en el citoplasma. h) Células dendríticas : Poseen velos o pseudópodos de gran envergadura, su citoplasma es claro con pocos gránulos. Las mitocondrias se han redondeado. Su núcleo es simple con un nucleolo. Su AG y RER están poco desarrollados. Existen tres tipos dependiendo de la localización: I)Las células dendríticas del tejido linfoide se denominan interdigitantes .Existen en la médula ósea y timo. También se llaman de la zona marginal, cuando están presentes en bazo. II)Las células dendríticas de los tejidos sólidos no linfoides se denominan células de Langerhans (cuando se localizan en la epidermis) y células inersticiales (corazón y riñón). III)Las células dendríticas de los fluidos se denominan células veladas (conductos linfáticos aferentes) o células dendríticas sanguíneas. 2.2 Funciones y gestión de receptores para antígenos: En sangre no existen ni mastocitos ni macrófagos . Los linfocitos tienen 3 subtipos fundamentales (T: 70-75 %, B: 15 – 20 %, NK 5-10%). Las plaquetas son las más abundantes, seguida por neutrófilos, linfocitos, y otras células. · A parte de fagocitar, los macrófagos inician la respuesta inmune y son responsables de la hipersensibilidad retardada y los neutrófilos fagocitan en respuesta a señales (complemento y anticuerpos). Durante la Fagocitosis: se forman fagosomas y al fusionarse con lisosomas se lisa la bacteria.Los eosinófilos pueden llegar a fagocitar aunque su función principal es la respuesta frente a parásitos : los gránulos del eosinófilo les exocita y las sustancias liberadas (toxinas ) atacan al parásito.Tienen actividad citotóxica y neurotóxica. · Exocitosis e inflamación: los mastocitos y basófilos reconocen patógenos concretos y liberan sus gránulos al medio, provocando reacciones de hipersensibilidad. En sus gránulos, se encuentran grandes cantidades de mediadores inflamatorios preformados provocando: a)vasodilatación, b)quimiotáxis, c)edema (hinchazón), d) extravasación de células al tejido. Uno de los componentes de los gránulos provoca quimiotáxis , son las quimiocinas. Su concentración disminuye progresivamente al alejarse del foco de liberación y atraen a macrófagos y leucocitos y a mastocitos. · Las células NK realizan una función de vigilancia de ausencias , al perder una célula marcadores que deberían tener la asesinan. Esto sucede en procesos tumorales e infecciones virales. Para realizar sus funciones, estas células presentan una serie de receptores en su superficie celular : a) Algunos reconocen estructuras del propio patógeno: existen en células de la inmunidad natural, fagocitos, dendrocitos e inflamocitos. Incluyen receptores MR (manosa), SR (scavenger), LPSR (lipopolisacáridos) que reconocen estas sustancias directamente en la superficie de los patógenos. b) Otros reconocen patógenos opsonizados por proteínas del sistema inmune: como las Inmunoglobulinas (FcR) o fragmentos de activación del sistema de complemento (CR). Estos receptores están presentes en células de la inmunidad innata (fagocitos, dendrocitos, inflamocitos, linfocitos NK) y de la inmunidad adaptativa (Linfocitos B). c) Receptores de linfocitos NK: NKPR1 (receptor de lisis) reconoce azúcares en la superficie de otras células , KIR (receptor de inhibición) reconoce péptidos propios en la cavidad de moléculas MHC de clase I. Hay un equilibrio entre receptores de lisis e inhibitorios para decidir si la célula NK va a proceder o no a la lisis de la célula diana. d) Receptores específicos de linfocitos T y B: los linfocitos T presentan el TcR (en sus 2 formas: g-d o a-b) y los linfocitos B presentan el BcR (que incluye la Inmunoglobulina de superficie. Estos receptores reconocen el patógeno en pequeños péptidos dentro del antígeno HLA (caso del linfocito T) o intacto y en solución (caso del linfocito B). Además, los linfocitos T pueden ser de dos tipos: cooperadores (Th) o citotóxicos (Tc), según su función. En cada caso presentan un co-rreceptor diferente: CD4 y CD8 alternativamente que reconoce porciones conservadas de los antígenos HLA de clase II o clase I, respectivamente. 2.3 Los órganos linfoides se pueden clasificar en: órganos linfoides primarios o centrales y secundarios o periféricos (desde un punto de vista funcional) y encapsulados y difusos (desde un punto de vistaanatómico-estructural). En los órganos linfoides primarios es donde se produce la diferenciación de linfocitos (linfopoyesis) T y B. La de linfocitos B ocurre en hígado fetal y médula ósea. La de linfocitos T sucede en el timo. En los órganos linfoides secundarios se presentan los antígenos y se monta la respuesta inmune específica (ganglios linfáticos, bazo, MALT [tejido linfoide asociado a mucosas]) Los conductos linfáticos se distribuyen por todo el organismo, llegan a todas las zonas y tienen cadenas de ganglios intercalados. Destacan las cadenas ganglionares localizadas en la zona inguinal, axilar y amigdalar. El punto de conexión entre vasos linfáticos y vasos sanguíneos es el llamado Ducto (o conducto) torácico: la linfa se vuelca en la vena subclavia. No hay que confundir el concepto de “ganglio linfático” con el de folículo linfoide . Estos últimos no son otra cosa que acumulaciones de linfocitos que adquieren forma esférica. Es un modo, pues, de organización de tejidos linfoides. Existen folículos linfoides en todos los órganos linfoides encapsulados: ganglios, bazo, timo. Además, en los órganos linfoides difusos (como el MALT) se han observado la presencia de folículos linfoides en unas estructuras denominadas Placas de Peyer, pero no en el resto del tejido. Los tejidos: el sistema Linfoide . 2.4 a) La médula ósea está formada por islotes de células hematopoyéticas situados en el interior de los huesos. Todas las células del sistema inmune se originan a partir de las células hematopoyéticas primordiales pluripotentes (células stem) de la médula ósea a través de los linajes mieloide y linfoide. Durante la edad fetal estas funciones se realizan por el hígado, que abandona esta actividad después del nacimiento. Además, la médula ósea actúa como órgano linfoide secundario (diferenciación final de células B a células plasmáticas). b) Los precursores de los Linfocitos T llegan por vía arterial llegan a la corteza y a través de los capilares pasan a la médula .De la médula salen por los capilares venosos. Los linfocitos se diferencian en el trayecto de la corteza a la médula. La diferenciación consiste en la presentación por parte de las células epiteliales de sus proteínas HLA sucediendo la llamadaselección positiva. Después las células dendríticas y los macrófagos enseñan a los timocitos los antígenos HLA con péptidos propios en su hendiduda (selección negativa).Con esta selección se eliminan el 95 % de los posibles linfocitos T. La selección positiva (elimina linfocitos T con receptores poco apropiados) se realiza en la corteza y en la selección negativa (médula ) se eliminan los linfocitos que reconocen elementos propios del organismo. 2.5 a) Presenta dos vías; las de entrada son conductos linfáticos aferentes , venas postcapilares y arterias postcapilares. La de salida es un conducto linfático eferente. Existen tres zonas estructuralmente distinguibles: -corteza , en esta zona existen células B y folículos linfoides. Estos folículos pueden ser primarios (presentan células B vírgenes en reposo) o secundarios (presentan centros germinales con Linfocitos B activados tras la presentación de antígenos) -paracorteza, muy rica en linfocitos T. -médula , en esta zona se encuentran los linfocitos maduros que están listos para salir del ganglio. b) En la pulpa blanca se realiza la presentación de antígenos. Los linfocitos llegan por la arteria esplénica y capilares arteriales y salen por las venas y vasos linfáticos eferentes. En la pulpa blanca existen folículos linfoides. c) Son agrupaciones de tejido linfoide no encapsulado, situado en la lámina propia y áreas submucosas de los tractos gastro-intestinal (GALT), respiratorio (BALT) y tracto génitourinario. Tiene particular interés (dada su extensión) el tejido asociado a la mucosa gastrointestinal o GALT. Órganos Linfoides Primarios. Médula Ósea: Timo: Órganos Linfoides secundarios: Ganglio Linfático: Bazo : Tejido Linfoide Asociado a Mucosas (MALT): En las microvellosidades de los enterocitos existen redes capilares y vénulas además de un conducto linfático que recibe el nombre de “lacteal”. Los linfocitos están dispersos (tejido difuso) en todo el tejido, salvo en las placas de Peyer, donde existen folículos linfoides no encapsulados pero que aparecen agrupados. 2.6 Recirculación de linfocitos en el organismo: Hay 2 sistemas circulatorios en el cuerpo: la sangre y la linfa. La sangre llega hasta todos los tejidos a través de arterias, arteriolas y capilares arteriales. Parte del fluido sanguíneo de los tejidos drena y entra en los conductos linfáticos eferentes. Así los canales linfáticos forman una red, cuando confluyen varios canales se constituyen los núdulos linfáticos a los que llegan varios conductos aferentes (de entrada), y que drenan por un único eferente (de salida). Finalmente, la linfa encuentra el camino hacia el llamado Ducto torácico que es donde la linfa se vuelca a la sangre (el ducto torácico se funde con la vena subclavia). Una característica única de los linfocitos es que pueden cruzar el cuerpo a través de la sangre y la linfa. Este tráfico de sangre a linfa se denomina “recirculación linfocitaria”. Los linfocitos abandonan los tejidos infectados hacia los ganglios linfáticos regionales. Allí, son activados tras encontrar células presentadoras de antígeno. Una vez activados, vía conductos linfáticos se vuelcan en el ducto torácico a la circulación sanguínea. Y por último, a través de la circulación vuelven al tejido infectado para ejercer su función. La hiperplasia es el aumento de tamaño de un órgano o de un tejido, debido a que sus células han aumentado en número. Puede producirse en los tejidos cuyas células se pueden multiplicar. Ocurre en forma fisiológica en las glándulas mamarias durante la lactancia, la hiperplasia del endometrio en el ciclo menstrual, la FSH hace crecer el endometrio y los estrógenos ováricos, el 14º día, la progesterona detiene este crecimiento. Patológicamente hay hiperplasia de la próstata en el anciano -hiperplasia benigna de la próstata-, hiperplasia en el bocio tiroideo, etc. Hipertrofia es el nombre con que se designa un aumento del tamaño de un órgano cuando se debe al aumento correlativo en el tamaño de lascélulas que lo forman; de esta manera, el órgano hipertrofiado tiene células mayores, y no nuevas. Se distingue de la hiperplasia, caso en el que un órgano crece por aumento del número de células, no por un mayor tamaño de éstas. La palabra atrofia proviene del griego àtrophos que significa "sin nutrición". En términos biológicos consiste en una disminución importante del tamaño de la célula y del órgano del que forma parte, debido a la pérdida de masa celular. Las células atróficas muestran una disminución de la función pero no están muertas. En histología se llama metaplasia al cambio de un epitelio maduro por otro maduro que puede tener un parentesco próximo o remoto. Los fenómenos de metaplasia son completamente normales en los tejidos embrionarios que tienden naturalmente a diversificar, madurar y especializar sus células. También tienen lugar a partir de células madre, tanto embrionarias como de los individuos adultos. En ciertas ocasiones la metaplasia implica una regresión en la especialización o maduración de las células hacia formas más primitivas para más tarde madurar hacia otra clase de células. Esto puede ocurrir como una respuesta fisiológica a cierto tipo de cambios o bien formar parte de los fenómenos que suelen acompañar a los cánceres.