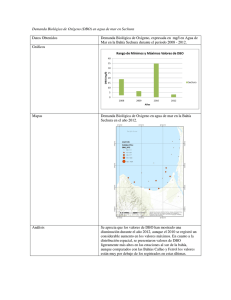
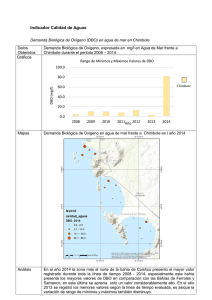
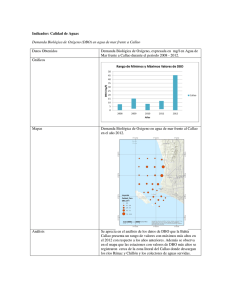
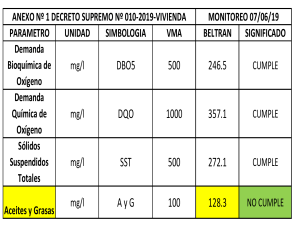
Caracterización de efluentes líquidos DOCENTE: LIC. ADRIANA MASCIOTTA CÁTEDRA: PROCESOS BIOLÓGICOS CARRERA: INGENIERIA AMBIENTAL Parámetros para la caracterización de efluentes líquidos Físicos Temperatura Color Olor pH Sólidos Químicos Materia orgánica DBO DQO Sustancias solubles en éter etílico (SSEE) Sulfuros totales Nitrógeno y fósforo Demanda de cloro Cianuros Hidrocarburos totales Detergentes (SRAO o SAAM) Sustancias fenólicas Metales (As, Cr, Hg, Pb,Cd) DETERMINACION DE MATERIA ORGANICA Criterio adoptado En lugar de determinar directamente la cantidad de cada compuesto orgánico individual se estima la cantidad total de ellos a través de algunos otros parámetros Medida del contenido de materia orgánica Los métodos más usados en el laboratorio son: Sólidos suspendidos volátiles Demanda bioquímica de oxígeno – DBO Método por dilución Método respirometrico Demanda química de oxígeno – DQO Carbono orgánico total – COT Oxidabilidad con permanganato de potasio (KMnO4) Demanda bioquímica de oxigeno Por Norma se acordó medir la DBO a 5 días temperatura de incubación de 20°C DBO5 Demanda bioquímica de oxígeno MO + O2 microorgan ismos → CO2 + H 2O Se mide el oxígeno disuelto utilizado por los microorganismos en la oxidación de la materia orgánica Es una medida indirecta de la materia orgánica biodegradable El ensayo es un intento de simular en el laboratorio las condiciones de un cuerpo de agua Condiciones del ensayo suficiente oxigeno disuelto (OD) durante todo el período del ensayo población de microorganismos suficiente en cantidad y variedad de especies, (inóculo) condiciones ambientales adecuadas y nutrientes necesarios para el desarrollo de los microorganismos Degradación de compuestos orgánicos Primera fase DBO carbonacea Segunda fase DBO nitrogenada Cinética de la primera fase Degradación carbonacea La DBO se formula como una reacción de primer orden dLt − α Lt dt dLt − = K´Lt dt Lt: DBO que queda en el agua en el tiempo t Donde K´ es una constante de velocidad de degradación de primer orden con unidades de tiempo-1. Integrando y reordenando Lt ln = − K´ t L Lt = e − K ´ t = 10− K t L K` K= 2.303 L = DBO total a t = 0 Lt = DBO remanente (que queda en el agua) al tiempo t t = periodo de tiempo desde t=0 K´ y K = constantes empíricas de velocidad de decaimiento usando base e y base 10 respectivamente La DBO remanente en el tiempo t Lt = L e − K ´ t L = DBO total Lt = DBO remanente Si llamamos y a la DBO consumida en la reacción en un tiempo t, y = L − Lt = L − L e − K ´t = L (1 − e − K ´t ) DBO a 5 días: y5 = L − L5 = L(1 − e −5 K ´ ) Segunda fase Nitrificación Durante la hidrólisis de las proteínas se produce materia no carbonácea como el amoniaco Algunas bacterias autótrofas son capaces de utilizar oxigeno para oxidar amoniaco a nitrito a y nitratos Fuente de carbono es el dióxido de carbono (C inorgánico) La demanda de oxigeno de la materia nitrogenada causada por bacterias autótrofas se conoce como segunda fase de la DBO Reacciones de Nitrificación 3 NH 3 + O2 → HNO2 + H 2O 2 1 HNO 2 + O2 → HNO3 2 Reacción total NH 3 + 2O2 → H 2O + HNO3 La segunda fase de la DBO se expresa en forma similar a la primera: y N = LN (1 − e −KNt ) Curva de la DBO total Primera etapa: los microorganismos responsables de la oxidación de la materia orgánica carbonacea se multiplican muy rápidamente Segunda etapa: los microorganismos responsables de la oxidación de la materia orgánica nitrogenada se multiplican a una velocidad menor y se alcanza su máxima población después de un periodo de tiempo. Comienza a los 8 – 10 días después que la oxidación carbonacea ha comenzado Determinar la DBO de 1 día y la DBO ultima para un agua residual cuya DBO a los 5 días es de 200 mg/L. La constante de reacción K´es igual a 0,23 1 - DBO ultima y5 = L − L5 = L(1 − e −5 K ´ ) 200 = L(1 − e −5(0, 23) ) = L(1 − 0,316) L = 293 mg / L 2 - DBO de un día y1 = L(1 − e −0, 23(1) ) = 293(1 − 0,795) = 293(0,205) y1 = 60mg / L Medida del contenido de materia orgánica Demanda Teórica de Oxígeno DTeO Es el oxígeno necesario para la oxidación completa de la materia orgánica Se determina a partir de formulas químicas Demanda carbonacea Demanda nitrogenada ¿Cual es la demanda teórica de oxigeno de la glicina? Formula de la glicina CH2(NH2)COOH Demanda carbonacea 3 CH 2 ( NH 2 )COOH + O2 → NH 3 + 2CO2 + H 2O 2 Demanda nitrogenada 3 NH 3 + O2 → HNO2 + H 2 O 2 1 HNO2 + O2 → HNO3 2 DTeO = 3 1 moles deO2 / mol de glicina 2 DTeO = 112 g O2/mol DBO por método respirometrico Los microorganismos consumen O2 El CO2 liberado por los microorganismos es absorbido por NaOH El equipo mide una disminución de presión Mediante un algoritmo lo traduce en un valor de DBO Demanda química de oxígeno DQO Mide la cantidad de oxígeno equivalente necesario para oxidar químicamente la materia orgánica de una muestra Demanda química de oxígeno Una alícuota de muestra es digerida a una temperatura de 150 ºC durante 2 horas, con una solución ácida de dicromato de potasio. Para facilitar la oxidación de algunos compuestos orgánicos, se agrega un catalizador Medida del contenido de materia orgánica DBO mide materia orgánica degradada por la acción de los microorganismos MATERIA BIODEGRADABLE Medida del contenido de materia orgánica DQO Mide la materia orgánica susceptible de ser oxidada por un oxidante químico fuerte como el dicromato MATERIA ORGÁNICA TOTAL Relación DBO/DQO Carbono orgánico total Se produce una oxidación completa de la materia orgánica en condiciones muy controladas La oxidación del carbono a dióxido de carbono se produce a 950 ºC en presencia de catalizador El ensayo mide todo el carbono total como CO2 en mg/l El carbono inorgánico como carbonatos y bicarbonatos debe eliminarse por acidificación y aireación Se mide el dióxido de carbono por espectrometría IR OXIGENO CONSUMIDO DEL PERMANGANATO El ensayo tiene por objeto medir la materia orgánica existente en aguas y efluentes Es útil cuando no se practica DBO, o como dato complementario de esta última. El oxidante es el KMmO4 PRACTICA DE LABORATORIO DETERMINACION DE LA DEMANDA BIOQUIMICA DE OXÍGENO A 5 DÍAS Método por dilución DETERMINACION DE LA DEMANDA BIOQUIMICA DE OXÍGENO A 5 DÍAS Una muestra de efluente es diluida con agua de dilución especialmente preparada Nutrientes Oxigeno Inoculo Se determina la concentración de oxígeno antes y después de 5 días de incubación a 20 ºC DBO5 = (OD inicial – OD final) x fc fc = factor de corrección por dilución de la muestra Demanda bioquímica de oxígeno Ensayo normalizado Referencia: Standard Methods for the Examination of Water and Wastewater Requisitos de la norma Controles presencia de cloro pH agua de dilución (nutrientes + buffer) dilución adecuada temperatura de la incubación características de los frascos inoculo controles de calidad equipamiento calibrado Conservación/almacenamiento Conservar las muestras a 4ºC hasta su análisis. El tiempo máximo de almacenamiento previo al análisis es de 48 hs. Envases sin cámara de aire Toma y preparación de la muestra Es necesario eliminar un inhibidor del desarrollo de los microorganismos CLORO Toma y preparación de la muestra Muestras que contienen cloro Se detecta la presencia de cloro Por reacción positiva con solución de ortotolidina o DPD en placa de toque (DPD: N, N diethyl-pphenilenediamina) Tiras reactivas al cloro Eliminación de cloro Se agrega una solución de sulfito de sodio u otro reductor Hasta que se obtenga reacción negativa Toma y preparación de la muestra Todas las muestras Medir el pH con tiras indicadoras de pH. Si este no se encuentra entre 6.0 y 8.0 ajustar usando la solución acida ó alcalina según sea necesario. Condiciones ambientales Realizar el ensayo en el laboratorio con condiciones ambientales adecuadas para DBO Mantener la temperatura a 20 ± 3ºC durante la realización del ensayo Retirar las muestras de la heladera y permitir que tomen la temperatura del local antes de comenzar el ensayo. Equipos Balanza analítica Incubadora: controlada a 20 ± 1º C Equipo de aireación para pecera Medidor de OD Preparación del agua de dilución Agregar a agua destilada soluciones: buffer de fosfato, sulfato de magnesio, cloruro de calcio, cloruro férrico Mezclar Saturar con oxígeno agitando con una varilla y dejar destapado el recipiente hasta su uso Llevar a la temperatura de 20 ± 3º C antes de usar Preparar el agua de dilución diariamente Frascos empleados en el ensayo de DBO volumen de 300 ml tapa de vidrio esmerilada boca acampanada cierre hidráulico Inóculo Se puede emplear como fuente de inóculo agua del río donde se vierten los efluentes agua del Río de la Plata barros de planta de tratamiento biológica inoculo liofilizado comercial No filtrar, ya que la filtración puede remover los microorganismos Mantener siempre en la heladera Suspensión de inóculo Preparación: Retirar de la heladera el inóculo y airear a temperatura ambiente mediante el equipo de aireación, por lo menos 24 horas antes de su uso ETAPA CRITICA Elección de las diluciones DBO5 = (OD inicial – OD final) Si la muestra tiene mucha materia orgánica Si la muestra esta demasiado diluida OD final = 0 mg de O2/l OD final ≈ OD inicial Es necesario diluir la muestra Se diluyo demasiado la muestra Preparación de las diluciones Preparar las diluciones directamente en frascos de DBO con agua de dilución recién preparada Realizar como mínimo tres diluciones de la muestra de modo que al menos en una de ellas se cumplan los siguientes requisitos después de los 5 días de incubación: un OD final de al menos 1,0 mg/l una deflexión mínima de OD de 2,0 mg/l Selección de los porcentajes de dilución de la muestra (P) Depende del valor de DBO de la muestra estimado en base a: antecedentes de la misma valor de DQO teniendo en cuenta que el valor de DBO nunca puede superar el de DQO. características origen Diluciones recomendadas 0,01% a 1,0% para efluentes industriales concentrados 1 a 5 % para líquidos cloacales 5 a 25 % para efluentes tratados 25 a 100% para aguas naturales Volumen de muestra en 300 ml Registrar la dilución realizada en cada frasco como porcentaje P Procedimiento Agitar el envase que contiene la muestra antes de realizar la toma a fin de lograr que la alícuota sea representativa Tomar cada alícuota con una pipeta o probeta según corresponda y agregarla a los frascos de DBO individuales. Agitar la suspensión de inóculo y agregar 1 ml a cada frasco. Completar el llenado de cada frasco por agregado de suficiente agua de dilución de modo que al insertar la tapa no se produzcan burbujas. Tapar los frascos con fuerza y mezclar por inversión manual. Determinación del OD inicial y final Instrumental: electrodo sensible al oxígeno, membrana semipermeable Recomendado Químico: fijación y determinación indirecta del oxígeno por volumetría Medición de Oxigeno disuelto Control de calidad Método químico Soluciones estándar Material volumétrico calibrado Balanza calibrada Sonda calibrada Calibración interna Verificar por comparación con el método químico Incubación de la muestra Colocar en la incubadora a 20 ± 1º C frascos de DBO tapados y sellados Incubadora Debe estar calibrada Se debe asegurar la temperatura durante los 5 días Uso de data logger Determinación del OD final Después de 5 días ± 6 horas de incubación determinar el OD empleando el mismo método aplicado para OD inicial en todas las muestras Sonda Químico Cálculos y resultados Para cada frasco de DBO que tenga: una deflexión mínima de 2,0 mg/l al menos 1,0 mg/l de OD final Calcular la DBO : DBO5 ( mg / l ) = (Odi − Odf ) x100 P Odi = OD inicial de la muestra diluida inmediatamente después de la preparación, en mg/l Odf = OD final de la muestra diluida después de 5 días de incubación a 20 ºC, en mg/l P = Porcentaje de dilución en % Controles internos de calidad OD residual mínimo y deflexión mínima de OD Solo se consideran validos aquellos frascos, incluidos los controles en los que se obtiene • Deflexión mínima de OD de 2,0 mg/l. • OD final de al menos 1,0 mg/l después de los 5 días de incubación Confiabilidad de los resultados Control de blancos de agua de dilución Control mediante el empleo de solución patrón Equipos calibrados/verificados Material de vidrio Balanza Incubadora Sonda de medición de OD Solución patrón acido glutámico – glucosa Se prepara una solución patrón de DBO conocida y se siembra junto con las muestras PRACTICA DE LABORATORIO DETERMINACION DE SÓLIDOS SUSPENDIDOS TOTALES, FIJOS Y VOLATILES Sólidos ST: residuo que queda luego de evaporación a 103ºC – 105ºC Sólidos totales SST: materia que queda retenida por un filtro SDT: materia que pasa través de un filtro Sólidos disueltos totales a SDT SSF: residuo que queda luego de la calcinación a 550ºC SSV: fracción que se elimina en la calcinación Sólidos suspendidos totales SST Sólidos suspendidos fijos SSF Sólidos suspendidos volátiles SSV Sólidos suspendidos volátiles La determinación es útil para el control de la operación de plantas de tratamiento de efluentes Ofrece una aproximación de la cantidad de materia orgánica presente en la fracción sólida de los efluentes BIOMASA Sólidos suspendidos totales SST Una muestra bien mezclada se filtra a través de un filtro Millipore tipo AP40 y el residuo retenido sobre el filtro se seca hasta peso constante a 103 – 105º C. El incremento en el peso del filtro representa los sólidos suspendidos totales. Determinación de sólidos suspendidos Equipo empleado Cálculos Sólidos suspendido s totales (mg / L) = (C − D ) x1000 volúmen de muestra ( ml ) C = peso filtro + residuo seco, (mg) D = peso filtro, (mg) SÓLIDOS SUSPENDIDOS FIJOS Y VOLÁTILES SSF y SSV El residuo obtenido a partir de la determinación de sólidos suspendidos totales se incinera a peso constante a 550º C en una mufla Los sólidos retenidos en el filtro representan los sólidos suspendidos fijos La pérdida de peso por la incineración corresponde a los sólidos suspendidos volátiles. Cálculos Sólidos suspendido s fijos (mg / L) = ( E − D ) x1000 volúmen de muestra (ml ) Sólidos suspendidos volatiles (mg / L) = (C − E ) x1000 volúmen de muestra ( ml ) E = filtro + residuo después de la incineración, (mg) Confiabilidad de los resultados Uso de material/equipos calibrados Material volumétrico Estufa Mufla Balanza Conclusiones El alumno deberá presentar un informe donde consignara la siguiente información: Datos de la muestra analizada Metodología y equipamiento empleado Resultados obtenidos considerando los criterios de calidad Interpretación de los resultados, estableciendo: Si las muestras pueden ser consideradas un efluente crudo o tratado Cumplimiento con los limites de vuelco en base a la normativa vigente