Escuela Universitaria De Ciencias De La Salud
Anuncio

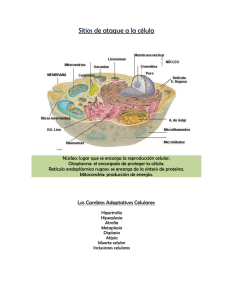
UNIVERSIDAD NACIONAL AUTÓNOMA DE HONDURAS Escuela Universitaria De Ciencias De La Salud Trabajo De Investigación. PATOLOGÍA 2011 Catedrática: DRA. ELIZABETH DE NUÑEZ Responsable: BLANCA MARÍA VINDEL RUÍZ 20083000036 CÉLULAS MADRE. Célula madre (en inglés, stem cell), célula no diferenciada capaz de experimentar divisiones ilimitadas y producir células hijas que pueden dar origen a los distintos tipos de células presentes en el organismo. Las células madre de un embrión son capaces de transformarse en células de cualquier tejido u órgano. También hay células madre en los tejidos adultos, aunque su capacidad de diferenciación es mucho más limitada. Se distinguen varios tipos. Las células madre totipotenciales surgen en las primeras divisiones del óvulo fecundado. Son células madre embrionarias capaces de dar lugar a cualquier otro tipo de célula y, por lo tanto, a un organismo completo. Las células madre pluripotenciales están presentes en el estadio de blastocisto de un embrión. Son también células embrionarias capaces de diferenciarse en casi todos los tipos celulares. Las células madre multipotenciales o células madre adultas se encuentran en algunos tejidos de los adultos, como la médula ósea, pero también se hallan en el feto y en el cordón umbilical. Su capacidad de diferenciación parece algo menor, aunque no es del todo conocida. Debido a su capacidad para diferenciarse en cualquier tipo de célula, las células madre pueden regenerar tejidos dañados por enfermedades, traumatismos, o simplemente por el envejecimiento. A ello se debe el gran interés que ha despertado este tipo de células, lo que ha favorecido que, en la actualidad, sean objeto de múltiples estudios de investigación. ORIGEN DE LAS CÉLULAS MADRE Cuando un gameto masculino fecunda un óvulo se origina una célula madre. Algunos científicos consideran que el cigoto constituye en sí mismo una célula madre, mientras que otros creen que debe experimentar primero varias divisiones para dar origen a estas células. Las células madre se diferenciarán en células sanguíneas, del tejido óseo, musculares o de la piel y, en definitiva, en todas las células especializadas que forman parte de los tejidos del cuerpo humano. No obstante, en los individuos adultos hay un pequeño número de células madre que permanece en cada órgano del cuerpo, sobre todo con objeto de reparar los daños que se puedan producir en esos tejidos. Si bien, todas las células pueden dividirse para producir copias idénticas, solo las células madre pueden originar distintos tipos de células especializadas. Debido a esta capacidad, las células madre podrían constituir el tratamiento inicial de una gran variedad de enfermedades como la enfermedad de Alzheimer y la enfermedad de Parkinson. Sin embargo, para poder estudiar las posibles aplicaciones médicas de estas células, los científicos necesitan líneas celulares de células madre. Esas líneas son colonias de células madre que crecen y se multiplican en el laboratorio en un medio de cultivo, es decir, en una sustancia que contiene los nutrientes necesarios para su desarrollo. Estas líneas celulares proporcionan a los científicos el material necesario para las investigaciones. Sin embargo, las células madre también envejecen y parece que pierden parte de su capacidad de diferenciación. En otras palabras, estas células madre no son tan versátiles como las jóvenes. La excepción parecen ser las células madre adultas procedentes de la médula ósea, que mantienen su capacidad de transformarse en cualquier tipo de célula. Por esa razón, las células madre adultas de la médula ósea y las células madre de los embriones serían las herramientas más adecuadas para ser utilizadas en tratamientos médicos. Los científicos han abierto dos líneas de investigación para determinar las aplicaciones médicas de las células madre. En una primera aproximación, se trata de desarrollar células que puedan ser trasplantadas para combatir una enfermedad específica. Por ejemplo, los pacientes con una enfermedad hepática podrían recibir células madre de hígado. En un futuro próximo, es posible que ciertos tratamientos médicos incluyan, de forma habitual, dosis ocasionales de células madre, algo parecido a dosis de refuerzo que ayuden a que el organismo sea capaz de luchar contra las enfermedades y reparar los tejidos lesionados. El segundo tipo de investigación se centra en el estudio de cómo el propio organismo utiliza este tipo de células. Tal vez actúen como almacenes celulares que se activan y desactivan según las necesidades del individuo. A pesar del futuro prometedor que ofrece el uso terapéutico de este tipo de células, en la actualidad las investigaciones con células madre son objeto de una gran controversia, sobre todo en lo referente a su origen, ya que en su mayoría proceden de embriones y, en concreto, de aquellos desechados en los tratamientos de infertilidad. Durante el tratamiento conocido como fecundación in vitro, los óvulos extraídos del ovario de una mujer se unen con los espermatozoides del hombre en el laboratorio. En algunos casos se fecunda más de un óvulo y se obtienen embriones extras. Las células madre se obtienen de embriones en los estadios iniciales de división. La utilización de las células madre en la investigación médica plantea una pregunta fundamental: ¿esas células provienen de tejidos humanos o de seres humanos como tal? Algunas personas se oponen a la utilización de cualquier elemento que proceda de embriones considerados viables (es decir, capaces de crecer), incluidas las células madre. Por tanto, para aquellas personas que comparten esta postura, el uso de las células madre supone la destrucción de una vida humana. El punto de vista opuesto es defendido por aquellos que piensan que estos embriones nunca se convertirían en seres humanos, ya que serían eliminados o se mantendrían congelados para futuras investigaciones, razón por la que consideran que este material debería utilizarse, especialmente si eso sirve para curar algunas enfermedades. Aquellos que se oponen al uso de las células madre de embriones señalan que existe una diversidad de tejidos alternativos, como la médula ósea o el cordón umbilical, de los que es posible extraer células madre. No obstante, todavía no está claro si las células madre procedentes de estos tejidos tienen la misma capacidad de diferenciación que las células madre embrionarias y, por tanto, poseen el mismo potencial para el tratamiento de las enfermedades. Más polémica todavía resulta la creación de embriones mediante técnicas de clonación con el fin de obtener células madre. Esta posibilidad ha suscitado un importante debate ético y numerosos países han prohibido los experimentos que contemplan la clonación humana. Para muchos, la clonación terapéutica supone la destrucción de embriones durante el proceso de obtención de las células madre, la posible explotación de las mujeres como donantes de óvulos y el riesgo de que las nuevas técnicas puedan conducir a la clonación de seres humanos. La clonación terapéutica pretende la clonación de células madre con la misma carga genética del paciente y su manipulación para convertir dichas células en células especializadas de cualquier tipo de tejido. Posteriormente, estas células se reintroducirían en el organismo del propio paciente con el fin de ayudar a curar una determinada enfermedad o reparar los tejidos dañados. Como las células son genéticamente similares, presumiblemente las células trasplantadas no serían rechazadas por el sistema inmunológico del paciente. INVESTIGACIÓN MÉDICA Fue en 1981 cuando los científicos consiguieron, por primera vez, cultivos de células madre embrionarias de ratón. Aunque este hito marcó el desarrollo de numerosos trabajos de investigación, hasta 1998 no se logró el cultivo en laboratorio de células madre de origen humano. En ese año, dos equipos de investigadores anunciaron por separado que habían aislado y cultivado células madre humanas procedentes, en un caso, de embriones en fase de blastocisto y, en el otro, de fetos abortados. Los equipos de investigación estaban dirigidos por los biólogos John Gearhart, de la Universidad de Johns Hopkins, y James Thomson, de la Universidad de Wisconsin en Madison. A finales de la década de 1990, los científicos descubrieron muchas otras características de estás células, como que las células madre adultas procedentes de un tejido concreto, como es la sangre, pueden originar células de otros tipos de tejidos, como por ejemplo células nerviosas (neuronas). Uno de los resultados más interesantes fue obtenido por el investigador Fred Gage en el Instituto Salk para Estudios Biológicos, quien demostró que el cerebro humano adulto puede crear nuevas neuronas. Antes del descubrimiento de Gage los neurobiólogos asumían que nuestro cerebro no creaba ninguna célula nueva después del nacimiento. Presumiblemente, esta capacidad proviene de las células madre de este tejido. Hoy, a principios del siglo XXI, los investigadores todavía no han desarrollado ninguna aplicación clínica real de los cultivos de células madre. No obstante, mucho antes de que fueran aisladas, las células madre ya se habían utilizado en el tratamiento de algunas enfermedades. En 1968 los científicos desarrollaron, con éxito, el primer trasplante de médula ósea, un procedimiento por el cual un paciente recibe una infusión de células sanas de médula ósea. El propósito de dicho transplante era restaurar la capacidad de la médula de generar células sanguíneas en pacientes que habían recibido tratamientos intensos con quimioterapia, que habían dañado profundamente ese tejido. Los investigadores sospechaban que las células madre presentes en el implante de médula ósea eran las responsables del éxito de dicha técnica. En la actualidad, el trasplante de médula ósea se ha convertido en un tratamiento habitual para ciertos tipos de cáncer (leucemia, linfoma) y otras enfermedades de la sangre o de los huesos. Sobre las células madre hay grandes perspectivas pero también grandes disputas en el campo de las ciencias y de la medicina. Sin duda, los estudios sobre el embrión humano estimularon el interés por este tipo de células y desde 1998 se lograron descubrir los medios técnicos para aislarlas y cultivarlas IN VITRO. Estas células madre obtenidas de un embrión resultaran muy interesantes para los biólogos y la medicina, además son únicas porque proliferan y pueden servir en cualquiera célula del organismo. Sin embargo estas células suscitan problemas éticos y morales porque para poder obtener estas células se debe destruir el embrión, lo que significa destruir una vida. Además crean a los científicos serios problemas por el rechazo que se produce por parte de las defensas inmunitarias del organismo en el momento en que son trasplantadas al paciente. Por el contrario, se ha visto que otras “células madre” pueden ser más eficaces; estas células se llaman “adultas” si se encuentran en las diferentes partes del organismo o también se llaman “umbilicales” se recogen de la sangre del cordón umbilical. La obtención de estas células no plantean ningún problema de índole ético o moral, además son bien aceptadas por el organismo de los pacientes, sin embargo no tienen proliferación abundante y no pueden aplicarse a todas las célula del organismo, por ese motivo, algunos científicos usan más células embrionarias a pesar de los serios problemas a los que hemos aludido. CÉLULAS TOTIPOTENCIALES Del latín totuspotens, "totus" (todo) y "potens" (poder o habilidad), el término célula totipotencial es utilizado en biología para referirse a células que poseen la capacidad de dar origen a varios otros tipos celulares, incluso pudiendo una sola de estas células dar origen a millones de células, tejidos, órganos, hasta incluso embriones. CÉLULAS PLURIPOTENCIALES las células madre pluripotenciales tienen la habilidad de diferenciarse a tejidos procedentes de cualquiera de las tres capas embrionarias y, por último, las células madre multipotenciales, son capaces de diferenciarse a distintos tipos celulares procedentes de la misma capa embrionaria. CUATRO PUNTOS DE ATAQUE CELULAR Las mitocondrias La membrana celular. El núcleo. Retículo endoplásmico rugoso. ASPECTOS GENERALES DE LA RESPUESTA CELULAR AL ESTRÉS Y A LOS ESTÍMULOS NOCIVOS La célula normal está limitada a un abanico bastante estrecho de función y estructura por sus programas genéticos de metabolismo, diferenciación y especialización; por las restricciones de las células de la vecindad, y por la disponibilidad de sustratos metabólicos. Sin embargo, es capaz de responder a las demandas fisiológicas normales, manteniendo un estado estable denominado HOMEOSTASIA. Los tipos de estrés fisiológicos más intensos y algunos estímulos patológicos pueden dar lugar a un número de ADAPTACIONES CELULARES fisiológicas y morfológicas, durante los cuales se alcanzan nuevos, pero alterados, estados estables, preservando la viabilidad de la célula y modulando su función según responde a tales estímulos. Si se sobrepasan los límites de la respuesta adaptativa a un estímulo, o en ciertas situaciones cuando la célula está expuesta un agente lesivo o a estrés, se sucede una secuencia de acontecimientos que se denomina LESIÓN CELULAR reversible hasta cierto punto, pero si el estímulo persiste o es bastante intenso, la célula alcanza un punto de no retorno y sufre lesión celular IRREVERSIBLE y finalmente, MUERTE CELULAR. Diferentes tipos de estrés pueden inducir cambios celulares y tisulares distintos. Los trastornos metabólicos en las células pueden asociarse con ACÚMULOS INTRACELULARES de diversas sustancias, incluyendo proteínas, lípidos e hidratos de carbono, calcio. Finalmente, el ENVEJECIMIENTO CELULAR también se acompaña de cambios morfológicos y funcionales característicos. ADAPTACIONES DIFERENCIACIÓN CELULARES DE CRECIMIENTO Y HIPERPLASIA Es el aumento en el número de células en un órgano o tejido, dando lugar habitualmente a un aumento del volumen del órgano o tejido. Frecuentemente está asociada a la hipertrofia. Por ejemplo, el crecimiento inducido hormonalmente en el útero implica a la vez un número aumentado de células musculares y células epiteliales y el agrandamiento de esas células. HIPERPLASIA FISIOLÓGICA, la cual a su vez puede ser HORMONAL, que aumenta la capacidad funcional de un tejido cuando se necesita, por ejemplo, la proliferación del epitelio glandular de la mama femenina en la pubertad y durante el embarazo y, COMPENSADORA, que aumenta la masa tisular tras el daño resección parcial, ejemplo, la proliferación de las células hepáticas residuales y la regeneración del hígado después de una hepatectomía parcial. La hiperplasia generalmente se debe a una producción local aumentada de factores de crecimiento, niveles aumentados de receptores de FC en las células respondedoras, o activación de una determinada vía de señalización intracelular. Todos estos cambios dan lugar a la producción de factores de transcripción que activan muchos genes celulares, incluyendo genes que codifican FC, de una proliferación celular. En la hiperplasia hormonal, las propias hormonas actúan como factores de crecimiento y desencadenan la transcripción de diversos genes celulares. El aumento de la masa tisular también se consigue por el desarrollo de nuevas células a partir de CELULAS MADRE. Por ejemplo, la hiperplasia hepática en la hepatitis crónica, en la cual está comprometida la capacidad proliferativa de los hepatocitos. HIPERPLASIA PATOLOGICA, la mayoría de las cuales están producidas por un estímulo hormonal excesivo o factores de crecimiento que actúan sobre las células diana. Por ejemplo, la hiperplasia endometrial, el equilibrio entre estrógenos y progesterona está alterado, lo cual da lugar a aumentos absolutos o relativos de estrógenos con la hiperplasia subsiguiente de las glándulas endometriales y es causa frecuente de hemorragia menstrual anormal. La hiperplasia prostática es otro ejemplo de hiperplasia patológica en respuesta a los andrógenos. La hiperplasia patológica constituye un terreno fértil en el cual puede surgir posteriormente la proliferación cancerosa. La hiperplasia también es una respuesta importante de las células del tejido conectivo en la curación de heridas en las que, la proliferación de fibroblastos y vasos sanguíneos ayuda a la reparación debido a los factores de crecimiento, los cuales también están implicados con ciertas infecciones víricas, tales como el papiloma virus que produce verrugas en la piel. Hiperplasia epitelial bucal HIPERTROFIA Se refiere a un aumento en el tamaño de las células, lo que da lugar a un aumento en el tamaño del órgano. El aumento del tamaño de las células se debe a la síntesis de más componentes estructurales producida por un aumento de la demanda funcional o por estimulación hormonal específica. Por ejemplo, los músculos de los físicoculturistas, son el resultado de un aumento del tamaño de las fibras musculares individuales en respuesta de la demanda. Así, la carga de trabajo está compartida por una mayor masa de componentes celulares y a cada fibra muscular se le ahorra un exceso de trabajo y de esta manera escapa a la lesión. La célula muscular agrandada consigue un nuevo equilibrio, permitiéndole funcionar a un mayor nivel de actividad. El mecanismo implica muchas vías de transducción de señal, dando lugar a la inducción de un número de genes que, a su vez, estimulan la síntesis de numerosas proteínas celulares. En el corazón existen dos grupos de señales: los DESENCADENANTES MECÁNICOS tales como la distensión, y los DESENCADENANTES TRÓFICOS, tales como los factores de crecimiento polipeptídicos y los agentes vasoactivos. Finalmente alcanza un límite más allá del cual el agrandamiento de la masa muscular ya no es capaz de compensar el aumento de la carga y se sigue de insuficiencia cardiaca. O sea que la hipertrofia puede ser fisiológica o patológica. ATROFIA La disminución en el tamaño de la célula por pérdida de sustancia celular se conoce como atrofia y puede culminar con la muerte celular. LA ATROFIA FISIOLOGICA es común durante el principio del desarrollo. Algunas estructuras embrionarias, tales como la notocorda y el conducto tirogloso sufren atrofia durante el desarrollo fetal. El útero disminuye de tamaño poco después del parto. LA ATROFIA PATOLÓGICA depende de la causa subyacente y puede ser localizada o generalizada: Carga de trabajo disminuida (atrofia por desuso), cuando un miembro roto se inmoviliza con una escayola o cuando el paciente está sujeto a un reposo completo en cama, rápidamente se sigue de una atrofia muscular esquelética. Pérdida de inervación (atrofia por denervación). La función normal del músculo esquelético depende de su suministro neurológico. El daño en los nervios da lugar a una atrofia rápida de las fibras musculares dirigidas por esos nervios. Riego sanguíneo disminuido (isquemia). En la vida adulta tardía, el cerebro sufre una atrofia progresiva, presumiblemente porque la aterosclerosis restringe su riego sanguíneo. Nutrición inadecuada, la caquexia en la malnutrición calórico proteica (marasmo) se asocia con el uso del músculo esquelético como fuente de energía después de haberse agotado otras reservas como los almacenes adiposos. También se ve en pacientes con enfermedades crónicas y cáncer. Pérdida del estímulo endocrino. La pérdida de estímulo estrogénico tras la menopausia da lugar a la atrofia fisiológica del endometrio, el epitelio vaginal y la mama. Envejecimiento (atrofia senil) se asocia con pérdida celular, que se ve típicamente en los tejidos que contienen células permanentes, particularmente el corazón y el cerebro. Presión. Un tumor benigno en crecimiento puede producir atrofia en los tejidos circundantes comprimidos y es, probablemente el resultado de cambios isquémicos por el compromiso del riego sanguíneo. El mecanismo de atrofia quizás afectan el equilibrio entre la síntesis proteica y su degradación. En muchas situaciones la atrofia se acompaña también de un aumento marcado en el número de VACUOLAS AUTOFÁGICAS ligadas a membrana dentro de la célula que contienen fragmentos de componentes celulares, un ejemplo son los gránulos de lipofucsina (atrofia parda). METAPLASIA Es un cambio reversible por lo cual una célula de tipo adulto (epitelial o mesenquimal) se sustituye por otro tipo celular adulto. La metaplasia epitelial más frecuente es de columnar a escamoso, como ocurre en el tracto respiratorio como respuesta a la irritación crónica. En el fumador habitual, las células epiteliales columnares ciliadas normales de la tráquea y de los bronquios están, a menudo sustituidas localmente o difusamente por células epiteliales escamosas estratificadas. Si persisten las influencias que predisponen a la metaplasia pueden inducir transformación neoplásica en el epitelio metaplásico. Otro ejemplo es el esófago de Barret. La metaplasia del tejido conectivo es la formación de cartílago, hueso o tejido adiposo (tejidos mesenquimales) en tejidos que normalmente no contienen esos elementos. Por ejemplo, la formación de hueso en el músculo, denominada miositis osificante, ocasionalmente ocurre tras una fractura ósea. La metaplasia es el resultado de una reprogramación de las células madre hacia un linaje particular que se lleva a cabo mediante señales generadas por citocinas, factores de crecimiento, y componentes de la matriz extracelular en el entorno de las células. En el proceso están implicados genes de diferenciación y específicos de tejido. ANAPLASIA Alteración de las células que modifica su proceso de diferenciación y provoca que adopten un aspecto primitivo y desdiferenciado. Los procesos anaplásicos son frecuentes en los tumores malignos, aunque en grados variables. Se suele reservar a los tumores con pérdida casi total de la diferenciación celular y, por tanto, habitualmente agresivos. NEOPLASIA Tumor producido por la multiplicación incontrolada de células. Según el grado de diferenciación de sus células y la capacidad invasiva y metatársica se dividen en benignas y malignas LESION Y MUERTE CELULARES La lesión celular es el resultado de un estrés celular tan intenso que las células ya no son capaces de adaptarse o de una exposición celular a agentes inherentemente lesivos y puede progresar a través de un estadío reversible y culminar con la muerte celular. En la lesión celular reversible hay reducción de la fosforilación oxidativa, la depleción de ATP y la hinchazón celular producida por cambios en las concentraciones iónicas y el aflujo de agua. Con el daño continuado, la lesión se hace irreversible, en cuyo momento la célula no puede recuperarse, sufren invariablemente cambios morfológicos que se reconocen como MUERTE CELULAR. Existen dos tipos de muerte celular, la necrosis y la apoptosis. CAUSAS DE LESION CELULAR Privación de oxígeno. La hipoxia es una deficiencia de oxígeno que produce lesión celular reduciendo la respiración aeróbica oxidativa. Deber distinguirse de la isquemia, que es una pérdida del riego sanguíneo por un flujo sanguíneo obstaculizado o por drenaje venoso reducido en un tejido y compromete el suministro no sólo de oxígeno sino también de sustratos metabólicos, incluyendo glucosa, y por tanto, se lesionan más rápido y más intensamente que los tejidos hipóxicos. Agentes físicos, incluyen el traumatismo mecánico, las temperaturas extremas (quemaduras y frío intenso), los cambios súbitos en la presión atmosférica, la radiación y la descarga eléctrica. Agentes químicos y fármacos. Los productos químicos simples como la glucosa o la sal en concentraciones hipertónicas pueden producir lesión celular directamente o alterando la homeostasia electrolítica de las células. Incluso el oxígeno, en concentracio0nes altas, es altamente tóxico. Venenos como el arsénico, cianuro o sales de mercurio. Contaminantes ambientales y aéreos, insecticidas y herbicidas, riesgos industriales y ocupacionales, como el monóxido de carbono y el asbesto, el alcohol y narcóticos y la variedad siempre creciente de drogas terapéuticas. Agentes infecciosos, abarcan desde virus submicroscópicos hasta las grandes tenias y establecen daño tisular causando directamente la muerte celular, liberar toxinas que destruyen a las células a distancia o inducir respuestas celulares en el huésped y producen daño tisular por mecanismos inmunológicos. Trastornos genéticos que pueden dar lugar a un defecto tan grave como las malformaciones congénitas asociadas como el S. de de Down. Los errores innantos del metabolismo, es otro ejemplo. Desequilibrios nutricionales, las desnutriciones calórico proteicas, las deficiencias de vitaminas o autoimpuestos como ocurre en la anorexia nerviosa. La obesidad y la aterosclerosis. ATIPIA CELULAR Se llaman atípias celulares a las alteraciones que afectan a la forma de las celulas, su tamaño y el proceso de división de las mismas. Sencillamente es un cambio en la morfologia celular normal. Estos cambios pueden detectarse cuando se estudian al microscopio los tejidos o las células aisladas, y están causados por procesos inflamatorios o tumorales, tanto benignos como malignos. Segun la intensidad de los cambios pueden dividirse en atipias de alto grado o de bajo grado. La detección de las atipias celulares es muy importante en medicina, adquiriendo especial interes en el estudio de los frotis del cuello uterino para la deteccion temprana del cancer de cervix (Prueba de Papanicolaou). Cuando las células de un organismo se exponen a agentes tóxicos, responden con cambios en su morfología que a veces alteran su apariencia (atipia reactiva). Estas deben distinguirse de las producidas por transformaciones cancerosas o precancerosas. Cuando ello no es posible pueden clasificarse como atipias de significado incierto. MUERTE CELULAR. Durante el desarrollo y también en estado adulto, hay numerosas células que degeneran y mueren. La muerte celular es un proceso fisiológicopatológico que conduce a la eliminación celular y que tiene una función esencial en la homeostasis de los tejidos y en los estados patológicos. La muerte celular pode ocurrir por: Necrosis. Apoptosis. A) Necrosis: es un proceso pasivo que no requiere una activa participación de la célula y acontece cuando la célula se encuentra ante condiciones extremas no fisiológicas. El origen de todos los desórdenes necróticos es un desequilibrio osmótico. La permeabilidad de la membrana plasmática se altera, produciendose entrada del agua, por lo que se produce un aumento de volumen. La cromatina nuclear forma pequeños agregados, el RE y las mitocondrias se dilatan por la entrada de agua. Los ribosomas se desorganizan y los lisosomas se rompen. Como etapa final, los orgánulos estallan, la membrana plasmática y la envoltura nuclear se segrega y el contenido intracelular se vierte al exterior promoviendo una respuesta inflamatoria. b) Apóptosis: el término apoptosis se utiliza cómo similar a la muerte celular programada, que sería un proceso de suicidio celular específico que implica un encogimiento y condensación de la célula. El citoesqueleto se colapsa, la envoltura nuclear se rompe y el ADN nuclear se fragmenta. La superficie celular se altera, presentando propiedades que provocan que la célula moribunda sea fagocitada inmediatamente, de manera que no se produce ningún vertido del contenido celular. INCLUSIONES CELULARES Sustancias químicas presentes en el citoplasma de las células, generalmente macromoléculas, no rodeadas por una membrana. El glucógeno, los triglicéridos y la melanina son ejemplos típicos de inclusiones celulares. BIBLIOGRAFÍA www.tesisdeinvestig.blogspot.com www.esmas.com/salud/home/avances www.introduccionpatologi.blogcindario.com www.esacademic.com/dic.nsf/es_mediclopedia www.biologia.edu.ar