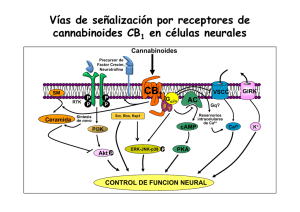
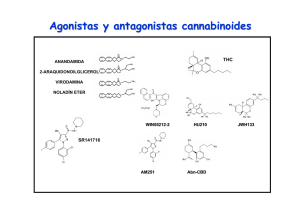
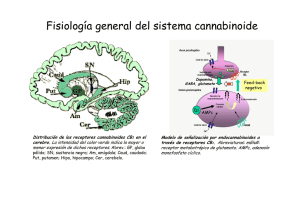
Universidad de Colima FACULTAD DE MEDICINA EFECTOS DE LOS CANABINOIDES SOBRE EL MÚSCULO ESQUELÉTICO Tesis para optar por el título de Maestra en Ciencias Fisiológicas Que presenta: Méd. Cir. Part. Mónica del S. Ortiz Mesina Asesor: Dr. Miguel Huerta Viera Co-asesora: Dra. Xóchitl A. R. Trujillo Trujillo Colima, Colima, Agosto de 2005 Con gran cariño y amor a mis padres J. Jesús Ortiz A. y Rosa María Mesina de O. por contar siempre con su apoyo y alentarme en el trabajo diario. A mis hermanos Angélica y Jesús por su apoyo y los debates sobre las acciones diarias. Agradecimientos: A mis asesores, los Dres. Miguel Huerta Viera y Xóchitl A. R. Trujillo Trujillo, por su paciencia, enseñanza y el haberme permitido trabajar en su laboratorio. A la Lic. Martha Patricia Rivera de la F. por su apoyo y consejos. A mis compañeros Arael, Karla, Blas, Gina, Mario y Antonio por hacer que estos dos años fueran amenos. ii Índice ÍNDICE DE TABLAS Y FIGURAS. --------------------------------------------------------------------------------------- 1 RESUMEN ---------------------------------------------------------------------------------------------------------------------- 3 ABSTRACT --------------------------------------------------------------------------------------------------------------------- 4 INTRODUCCIÓN ------------------------------------------------------------------------------------------------------------- 5 EPIDEMIOLOGÍA DEL CONSUMO DE LA MARIHUANA ------------------------------------------------------ 7 RESEÑA HISTÓRICA DEL USO DE LA MARIHUANA ------------------------------------------------------------------------- 7 EPIDEMIOLOGÍA -------------------------------------------------------------------------------------------------------------- 9 CANABINOIDES ------------------------------------------------------------------------------------------------------------ 11 ENDOCANABINOIDES ------------------------------------------------------------------------------------------------------- 13 Síntesis y liberación ---------------------------------------------------------------------------------------------------- 15 EXO-CANABINOIDES-------------------------------------------------------------------------------------------------------- 18 Agonistas ---------------------------------------------------------------------------------------------------------------- 18 Antagonistas/Agonistas inversos de los receptores a canabinoides.--------------------------------------------- 20 SÍNTESIS QUÍMICA DE ENDOCANABINOIDES ----------------------------------------------------------------------------- 21 CAPTURA Y DEGRADACIÓN DE LOS ENDOCANABINOIDES -------------------------------------------------------------- 22 SÍNTESIS, DEGRADACIÓN, ACCIÓN CELULAR DEL ENDOCANABINOIDE ANANDAMIDA. ----------------------------- 23 RECEPTORES A CANABINOIDES-------------------------------------------------------------------------------------------- 24 CANABINOIDES Y RECEPTORES (MECANISMO DE ACCIÓN). ------------------------------------------------------------ 26 LA ACTIVACIÓN DE LOS RECEPTORES CB1 Y CB2 EJERCEN DIFERENTES EFECTOS CELULARES. ------------------ 29 CANABINOIDES Y EL CONTROL MOTOR.------------------------------------------------------------------------ 30 LOS CANABINOIDES Y LA UNIÓN NEUROMUSCULAR. ----------------------------------------------------- 34 EFECTOS DE LOS CANABINOIDES EN LA UNIÓN NEUROMUSCULAR. --------------------------------------------------- 37 CANABINOIDES Y EFECTOS DIRECTOS EN EL MÚSCULO ESQUELÉTICO.-------------------------- 38 i El papel del Ca2+ en la contracción muscular---------------------------------------------------------------------- 39 Acople excitación-contracción---------------------------------------------------------------------------------------- 39 EFECTOS DE LOS CANABINOIDES EN EL MÚSCULO ESQUELÉTICO ----------------------------------------------------- 41 EFECTO DE UN CANABINOIDE SOBRE LAS CONTRACTURAS POR CAFEÍNA EN LAS FIBRAS MUSCULARES ESQUELÉTICAS LENTAS DE RANA. ----------------------------------------------------------- 42 Metodología ------------------------------------------------------------------------------------------------------------- 42 Soluciones --------------------------------------------------------------------------------------------------------------- 43 Registro de contractura por cafeína: -------------------------------------------------------------------------------- 44 Análisis de datos-------------------------------------------------------------------------------------------------------- 44 Resultados --------------------------------------------------------------------------------------------------------------- 45 PERSPECTIVAS.------------------------------------------------------------------------------------------------------------ 47 BIBLIOGRAFÍA: ------------------------------------------------------------------------------------------------------------ 49 ii Índice de Tablas y Figuras. FIGURA 1 CANNABIS SATIVA. TOMADA DE EROWID.ORG --------------------------------------------------------------------- 7 TABLA 1 ESTIMACIÓN DE LA PREVALENCIA DEL CONSUMO MUNDIAL DE SUSTANCIAS ILÍCITAS, 2000-2001. -------- 9 FIGURA 2 ESTRUCTURA QUÍMICA DEL Δ9-TETRAHIDROCANABINOL (TOMADO DE IVERSEN, 2003). ----------------- 11 FIGURA 3. ESTRUCTURA QUÍMICA DE LOS CINCO LIGANDO CANNABINOIDES ENDÓGENOS IDENTIFICADOS RECIENTEMENTE. (TOMADO DE DE PETROCELLIS Y COLS., 2004). ------------------------------------------------ 14 FIGURA 5 ESQUEMATIZA LA POSIBLE VÍA DE FORMACIÓN DEL 2-ARAQUIDONILGLICEROL (TOMADO DE FREUND Y COLS., 2003). ------------------------------------------------------------------------------------------------------------ 16 FIGURA 6 VÍAS BIOQUÍMICAS PARA LA SÍNTESIS, DEGRADACIÓN Y ACCIÓN CELULAR DEL CANABINOIDE ENDÓGENO ANANDAMIDA. (TOMADO DE RODRIGUEZ DE FONSECA Y COLS., 2005). ----------------------------------------- 17 FIGURA 7 ESTRUCTURA QUÍMICA DE TRES AGONISTAS A LOS RECEPTORES CANABINOIDES NO EICOSANOIDES (Δ9THC, CP 55,940 Y WIN 55,212,2) (MODIFICADO DE PERTWEE, 2001). ------------------------------------------ 19 FIGURA 8 ESTRUCTURA QUÍMICA DE ALGUNOS AGONISTAS EICOSANOIDES (MODIFICADO DE PERTWEE, 2001). --- 19 TABLA 2 EFICACIA RELATIVA DE LOS AGONISTAS A LOS RECEPTORES A CANABINOIDES. (TOMADO DE PERTWEE, 2001) --------------------------------------------------------------------------------------------------------------------- 20 TABLA 3 CLASIFICACIÓN FARMACOLOGICA DE LOS PRINCIPALES ANTAGONISTAS/AGONISTA INVERSO Y LA SELECTIVIDAD POR EL RECEPTOR CANABINOIDE. (MODIFICADO DE PERTWEE, 2001; INFORMACIÓN DE TOCRIS.COM) ------------------------------------------------------------------------------------------------------------ 21 FIGURA 9 MUESTRA EL ESQUEMA DEL RECEPTOR CANABINOIDE CB1 (TOMADO DE CAYMAN CHEMICALS). -------- 25 FIGURA 10 HOMOLOGÍA EN LA SECUENCIA DE AMINOÁCIDOS ENTRE LOS RECEPTORES CB1 Y CB2. (MODIFICADO DE WATSON, 2000) --------------------------------------------------------------------------------------------------------- 26 FIGURA 11 DISTRIBUCIÓN DE LOS RECEPTORS CANABINOIDES CB1 EN EL CEREBRO DE RATA, REBELADOS POR UNA AUTORRADIOGRAFIA DE LA UNIÓN DE UN AGONISTA DE ALTA AFINIDAD MARCADO RADIOACTIVAMENTE EN UN CORTE SAGITAL DE CEREBRO. (TOMADO DE IVERSEN, 2003). ------------------------------------------------- 32 FIGURA 12 SE ESQUEMATIZA LA MORFOLOGÍA DE UNA PLACA TERMINAL EN LA UNIÓN NEUROMUSCULAR QUE CONSTA DE UN AXÓN MIELINIZADO Y UNA FIBRA MUSCULAR, SEÑALÁNDOSE LAS VESÍCULAS DEL 1 NEUROTRANSMISOR (ACETILCOLINA) LAS ZONAS ACTIVAS, LA HENDIDURA SINÁPTICA TAMBIÉN LLAMADO ESPACIO ÍNTERSINÁPTICO, LA MEMBRANA POSTSINÁPTICA(TOMADO DE SIEGEL, 1999) ----------------------- 35 FIGURA 13 MUESTRA LA LOCALIZACIÓN DE LAS VESÍCULAS SINÁPTICAS EN LAS ZONAS ACTIVAS DE LA MEMBRANA PRESINÁPTICA (MODIFICADO DE SIEGEL, 1998)--------------------------------------------------------------------- 35 FIGURA 14 MICROGRAFÍA DE ESCANEO ELECTRÓNICO DE UNIÓN NEUROMUSCULAR EN RANA (TOMADA DE ALBERTS, 2002). -------------------------------------------------------------------------------------------------------- 38 FIGURA 15. CUANDO SE ESTIMULA EL MÚSCULO SE ACTIVAN LOS CANALES DE SODIO Y CLORO, DE ESTA MANERA AL PROPAGARSE EL POTENCIAL DE ACCIÓN LLEGA A LOS TUBULOS T DONDE ACTIVA A LOS CANALES DE DIHIDROPIRIDINA (CANAL DE CALCIO VOLTAJE DEPENDIENTE TIPO L) QUE ESTAN ACOPLADOS A LOS CANALES DE RIANODINA DEL RETICULO SARCOPLÁSMICO CON LA CONSECUENTE LIBERACIÓN DE CALCIO DEL RETÍCULO SARCOPLÁSMICO (TOMADO DE BERCHTOLD Y COLS., 2000) .----------------------------------------------------- 40 FIGURA 17 REGISTRO DE LA TENSIÓN INDUCIDA POR CAFEÍNA A 4 MM SE MUESTRA EN LÍNEA NEGRA, LA TENSIÓN INDUCIDA POR CAFEÍNA 4 MM MÁS EL AGONISTA ACPA (1 μM) SE MUESTRA EN LÍNEA ROJA ---------------- 45 FIGURA 18 REGISTRO DE LA TENSIÓN MUSCULAR INDUCIDA CON CAFEÍNA (4 MM) EN LÍNEA NEGRA; SE MUESTRA EN AZUL EL REGISTRO DE LA TENSIÓN INDUCIDA POR CAFEÍNA 4 MM 20 MINUTOS DESPUÉS DE LA APLICACIÓN DEL AGONISTA ACPA 1 μM. --------------------------------------------------------------------------- 46 FIGURA 19 REGISTRO DE LA TENSIÓN MUSCULAR POR LA CONTRACTURA INDUCIDA POR CAFEÍNA EN MÚSCULO CRURALIS DE RANA EN COLOR NEGRO; LA TENSIÓN MUSCULAR DE LA CONTRACTURA INDUCIDA POR CAFEÍNA 8 MM CON EL ANTAGONISTA ACPA 1 μM SE MUESTRA DE COLOR ROJO.---------------------------------------- 46 2 Resumen La Cannabis sativa ha sido utilizada por el hombre desde hace miles de años. El ingrediente psicoactivo principal es el Δ9-tetrahidrocanabinol que interactúa sobre los receptores a canabinoides. Ejerciendo diversos efectos: euforia, percepción alterada, sedación, deterioro en la memoria, analgesia, anti-emesis y estimulación del apetito. Los principales receptores a canabinoides (CB1 y CB2), el primero localizado en las terminales de células nerviosas y el receptor CB2 en órganos linfoides. Otros receptores blanco son el receptor vaniloidil, y los receptores semejantes a CB. De los efectos por canabinoides, el mas estudiado es el control motor, siendo esto por tres vías distintas: sistema nervioso central, placa motora y músculo esquelético, sin embargo son pocas las referencias de los efectos en músculo esquelético, aunque recientemente se tienen evidencias de regulación por canabinoides de la liberación de Ca2+ durante el acople excitación-contracción y de la presencia de ARNm para CB1 en músculo esquelético. 3 Abstract The Cannabis sativa has been used by humans for thousands of years. The major psychoactive ingredient is Δ9-tetrahidrocanabinol, which interacts with the cannabinoid receptors exerting effects diverse as euphoria, altered perception, sedation, impairment memory, analgesia, anti-emesis and stimulation of the apetite. The major cannabinoid receptors are CB1 and CB2, being the first located at the terminals of nerve cells. The CB2 receptor has been located at lymphoid organs. Others target receptors are vanilloid receptor and “CB-like” receptors. From the cannabinoid effects the most studied is the motor control, which is due to three ways: central nervous system, neuromuscular junction and skeletal muscle however, there are few reference on skeletal muscle effects, although recent evidence show the regulation by cannabinoid analogues on the mobilization of Ca2+ on the excitation-contraction coupling and on the presence of mRNA for CB1 in skeletal muscle. 4 Introducción La planta de la marihuana (Cannabis sativa) ha sido utilizada por el hombre desde hace aproximdamente tres mil años A. C. por su psicoactividad; se le ha relacionando con la muerte plasmada esta interpretación en los rituales de ciertas culturas, ha formado parte del conjunto farmacológico en cierta época, ha sido inspiración para la composición de obras épicas, actualmente es considerada como la droga más consumida a nivel mundial, sin embargo también se le reconocen sus propiedades farmacológicas y su posible potencial benéfico en la aplicación en la practica clínica como paliativo en varias patologías, como por ejemplo en la esclerosis múltiple para alivio del dolor y en pacientes con caquexia como las victimas del SIDA para estimular el apetito. El ingrediente psicoactivo principal de la planta es el Δ9-tetrahidrocanabinol, aislado e identificado por Gaoni y Mechoulam en 1964, este compuesto interactúa sobre los receptores llamados canabinoides (CB). La acción de los derivados de los canabinoides es a través de los receptores, los diversos efectos de esta droga están bien documentados en los individuos consumidores de marihuana, por ejemplo: euforia, alteración de la percepción y en la función motora, sedación, deterioro en la memoria, analgesia, anti-emesis y estimulación del apetito (Voth, 1997). Se han descrito dos tipos de receptores a canabinoides el CB1 y el CB2, actualmente ya están clonados; estos pertenecen a la superfamilia de receptores 7 transmembranales acoplados a proteínas G. El primero en ser descrito fue el receptor CB1, localizado principalmente en las 5 terminales de las células nerviosas, el sistema reproductivo, algunos sistemas glandulares y la microcirculación. El receptor a canabinoide CB2 es encontrado en múltiples órganos linfoides, con una alta expresión en los linfocitos B, moderada en monocitos y polimorfonucleares y baja en los linfocitos T y en las células de la microglia. Los organismos sintetizan canabinoides los cuales se denominan endocanabinoides. De esta manera, otros receptores blanco de los endocanabinoides son el receptor vaniloidil, y los receptores semejantes CB, localizados en el lecho vascular y los segundos en el axón terminal glutamatérgica. En la literatura uno de los efectos de los canabinoides mas estudiados es sobre el control motor, que puede ser por tres diferentes vías: • Por medio del sistema nervioso central, debido principalmente a la distribución de los receptores CB1, que se han localizado en la corteza motora, cerebelo, hipocampo y ganglios basales, por su localización también se ha relacionado con la regulación de tres diferentes neurotransmisores, la dopamina, el GABA y el glutamato (Sullivan 1999; Auclair, 2000; Katona y cols., 2001; Szabo 2004). • A nivel de placa motora, se ha demostrado una regulación en la transmisión sináptica en esta, disminuyendo la frecuencia de los potenciales miniatura, así como la amplitud de estos (Sánchez-Pastor y cols., 2004). • Por acción directa sobre el músculo esquelético (Vásquez y cols., 2000; Velasco y cols., 2002; Sánchez-Pastor y cols., 2004; Velasco y cols., 2004). 6 Epidemiología del consumo de la Marihuana Reseña Histórica del uso de la marihuana El origen de la palabra marihuana es desconocida, existen dos versiones acerca de las raíces del origen: la mexicana la deriva de “María Juana”, y la otra de origen portugués, de “marigu-ano” que significa “intoxicado. La planta marihuana pertenece a la familia Cannabaceae, genero Cannabis y a la especie sativa (ver figura 1), se conocen otras dos especies: C. Indica y C. Ruderalis (Spinella, 2001). En sus diversas variedades que están distribuidas en todo el mundo. Sin embargo, es a partir de la Cannabis sativa que se obtienen dos derivados principales: la marihuana propiamente dicha y el hachís obtenida como resina. Figura 1 Cannabis Sativa. tomada de erowid.org El empleo de la marihuana se conoce desde aproximadamente el año 3000 a.C., y era utilizada por los chinos como complemento alimenticio, y en los siglos siguientes el cáñamo derivado de esta planta fue utilizado para elaborar textiles y prendas finas (Belsasso, 2002; Spinella, 2001) La aplicación principal de la marihuana con propósitos medicinales apareció por primera vez en la farmacopea china alrededor del año 2727 a.C. Teniendo como antecedente sus propiedades curativa, los textos sagrados hindúes del Atharvaveda, la consideran como hierba sagrada. También fue utilizada en los rituales dedicados al Dios Shiva. Entre los años 7 700 y 600 a.C., la marihuana ya era considerada como un buen narcótico, puesto que fue registrada como tal en los textos persas del Zoroastrismo Zend-Avesta. Los escitas asociaron el Cannabis con la muerte, enterrando a sus muertos con bolsas de cuero y semillas de la planta, ritual que fue descubierto en una tumba a finales de 1940 en las montañas de Tien Shan (actualmente Kazajistán). Para el año 430 a.C. Herodoto realizó descripciones de su uso recreativo y ritual entre los escitas, y en el año 100 a.C. reaparece con sus propiedades psicotrópicas en los textos de herbolaria china. Durante los dos primeros siglos de la era cristiana, el Cannabis, en Roma era empleado como medicamento por Galeno como parte del conjunto farmacológico de su trabajo. De esa manera, en los siglos subsiguientes su uso fue difundido por Europa y Asia. El Cannabis llegó a Egipto durante el siglo XII extendiéndose rápidamente entre la población, y durante la invasión por las fuerzas napoleónicas (1798) a este país, Napoleón Bonaparte vio el uso indiscriminado que se hacía del hachís, por lo que prohibió su uso; al regresar sus tropas a Francia, lamentablemente gran parte de estos lo hicieron con este hábito. Dadas las diversas adicciones que surgieron por Europa y Asia (principalmente alcohol, opio y hachís), alentaron a Mohammed ebn Soleiman a escribir el poema épico Benk u Bode (a mediados del siglo XVI), donde narra la batalla entre el vino y el hachís. La aparición del Cannabis en América data de 1840, aunque posiblemente se conociera desde antes, por los viajes que ya se realizaban entre ambos continentes y a la gran variedad del Cannabis en el mundo. Gran Bretaña prohibió su uso definitivamente en 1926. En Estados Unidos para el año 1937, el Cannabis era considerado federalmente ilegal. En el transcurso del siglo XX, las producciones en Líbano, Grecia y Marruecos invaden Europa. La producción de Afganistán se destaca y su calidad compite fuertemente con la de otros lugares, considerándose hoy en día como una de las variedades más potentes. (Belsasso. 2002; Spinella, 2001; erowid.org). 8 Epidemiología Los reportes de organizaciones internacionales contra las drogas indican que el Cannabis es la droga ilegal más consumida en el mundo. Datos de la Oficina de las Naciones Unidas contra la Droga y el Delito (ONUDD) reportaron que hay aproximadamente 200 millones de personas consumidoras de alguna sustancia ilícita, cifra que corresponde al 3.4 % de la población mudial, siendo el Cannabis la más consumida, seguida de las anfetaminas, la cocaína y los opioides. La ONUDD informó también que el 2.7% de la población mundial total y el 3.9% de las personas de 15 años o más han consumido Cannabis al menos una vez entre los años 2000 y 2001, datos que se muestran en la tabla 1(Organización Mundial de la Salud, 2004). Tabla 1 Estimación de la prevalencia del consumo mundial de sustancias ilícitas, 2000-2001. Información tomada de la OMS 2004. En América, se estima que existen alrededor de 45 millones de personas consumidoras de Cannabis. Desde el punto de vista de consumo de drogas, en nuestro país la Encuesta 9 Nacional de Adicciones (ENA) de 1993 reportó que el 3.9% de la población de 12 a 65 años declararon haber consumido drogas ilegales alguna vez en su vida y entre las drogas empleadas con mayor frecuencia en los 30 días anteriores a la encuesta estaba el Cannabis (0.2%), así mismo el 3.3% de los entrevistados manifestó haber consumido el Cannabis alguna vez en su vida. En 1998, la ENA da a conocer estadísticas donde se señala que el consumo de drogas aumento en el país, informando que el Cannabis sigue siendo la droga más consumida.( paho.org; La salud en las Américas, 2002). 10 Canabinoides Los canabinoides son compuestos derivados de la planta Cannabis sativa, de la cual se extraen 400 compuestos químicos de la planta, siendo 61 los compuestos considerados dentro del grupo de los canabinoides (Spinella, 2001); de los canabinoides obtenidos de la marihuana, el Δ9-tetrahidrocanabinol (Δ9-THC) es el principal responsable de las propiedades psicoactivas de la planta, el cual fue aislado e identificado con técnicas de cromatografía por Gaoni y Mechoulam en 1964. Su estructura química se muestra en la figura 2. Δ9-THC Figura 2 Estructura química del Δ9-tetrahidrocanabinol (Tomado de Iversen, 2003). En años posteriores a la prohibición del consumo de la marihuana en los Estados Unidos, fue sugerido su uso en el tratamiento de varias patologías. Actualmente el empleo de análogos sintéticos del Δ9-tetrahidrocanabinol y los derivados de la planta Cannabis sativa en los humanos es con fines paliativos y tiene sus indicaciones clínicas precisas que incluyen la nausea asociada a la quimioterapia, en la esclerosis múltiple para alivio del dolor (véase mas 11 adelante) (Voth y Schwartz, 1997; Felder y Glass, 1998). En 1992 en Estados Unidos se publico la aprobación por parte de la Food and Drug Administration (FDA) del empleo de un análogo sintético canabinoide, el dronabinol (capsulas de 2.5, 5 y 10 mg) como estimulante del apetito, teniendo como indicación la aplicación en pacientes con caquexia, como ejemplo las víctimas del Síndrome de Inmuno Deficiencia Adquirida (SIDA) (Felder y Glass, 1998; fda.gov). Otra de las indicaciones clínicas para la aplicación de este análogo canabinoide es el alivio del dolor central en pacientes con esclerosis múltiple, Svendsen y cols. (2004) en su estudio doble ciego realizado en pacientes con diagnostico de esclerosis múltiple y dolor neurológico, se aplico dronabinol vía oral a dosis máxima diaria de 10 mg o placebo, durante tres semanas. Los resultados reportan una disminución del dolor, así como un alto numero de pacientes con efectos adversos en pacientes con dronabinol que los pacientes con placebo siendo los más frecuentemente reportados el vértigo y el mareo, especialmente durante la primera semana de tratamiento, la habilidad funcional de los pacientes con esclerosis múltiple no cambio. De un estudio de efectos a corto y largo plazo en el control de la espasticidad por canabinoides en humanos, fueron publicados recientemente los primeros resultados, siendo este seguimiento el más largo realizado a la fecha sobre el uso del Δ9-THC en la clínica; reportando ausencia en la mejoría de la espasticidad, pero subjetivamente los pacientes si lo perciben y refieren como tal. Estos resultados preliminares aunque son incongruentes el estudio de seguimiento continua y se sugiere en el comunicado que tal vez se encuentre mayor beneficio a largo plazo que los hallados en la primera parte del estudio (Boletín de IACM, 2005). 12 Para que el compuesto psicoactivo Δ9-THC ejerza sus efectos debe estar presente un receptor; el primer indicador de la naturaleza molecular de este receptor canabinoide fue el descubrimiento que el Δ9-THC produce una disminución en la concentración del segundo mensajero monofosfato de adenosina cíclico (AMPc) en las células de neuroblastoma (Howlett y cols., 1984), donde reportan una inhibición del cAMP por los compuestos Δ8-THC y Δ9-THC a concentraciones micromolares, lo cual no fue bloqueado por atropina, yohimbina o naloxona, sugiriendo que esta inhibición no involucraba receptores opiaceos. Así al describirse posteriormente la presencia del receptor de membrana al canabinoide Δ9-THC, fue sugerido una síntesis de canabinoides por el propio organismo denominados endocanabinoides, lo que dio paso a un sistema de señalización endógena conocida ahora como sistema endocanabinoide (Elphick y Egertová, 2001) Endocanabinoides Los canabinoides endógenos también denominados endocanabinoides, son derivados de ácidos grasos poliinsaturados, representados por el ácido araquidónico. Estos compuestos presentan semejanza a otros transmisores lipídicos eicosanoides como las prostaglandinas o leucotrienos (Arévalo-Martín y cols., 2002). Diversos estudios realizados revelan la existencia de otras estructuras relacionadas con los mensajeros lipídicos que incluyen a la palmitiletanolamida o eloiletanolamida, los cuales no activan los receptores canabinoides, sin embargo presentan importancia fisiológica al participar en los procesos de inflamación, control de dolor, alimentación y metabolismo de los lípidos (Freund y cols., 2003) Los endocanabinoides hasta ahora caracterizados en su vía de síntesis, son derivados del acido araquídonico conjugado con etanolamida o glicerol. En la figura 3 se representa la 13 estructura química de cinco endocanabinoides identificados en el cerebro, en el plasma y en el tejido periférico de diversas especies animales. Estos son la Anandamida, 2- Araquidonoilglicerol (2-AG), Virodamina, 2-Araquidonil gliceril éter noladin (noladin éter), N-Araquidonoil-dopamina (NADA) (De Petrocellis y cols., 2004). Anandamida 2-Araquidonoil-glicerol Noladin Etér Virodamina N-Araquinodoil-Dopamina Figura 3. Estructura química de los cinco ligando cannabinoides endógenos identificados recientemente. (Tomado de De Petrocellis y cols., 2004). El arquidoniletanolamida (anandamida) es un derivado del acido araquidonico identificado por Devane y cols. en el cerebro porcino (1992). Las concentraciones del canabinoide endogeno anandamida en el cerebro es 200 veces mayor que el 2-AG. Teniendo en cuenta que el 2-AG es un intermediario metabólico de los lípidos mientras que la anandamida es el producto de la hidrolisis de un fosfolípido de la membrana celular. 14 Síntesis y liberación La síntesis de la anandamida es el producto de la hidrólisis del N-araquidonoilfosfatidiletanolamina (NAPE). En la figura 4 se esquematiza uno de los posibles mecanismos de la formación de anandamida. La anandamida es sintetizada por la enzima N-aciltranferasa (NAT) al catalizar la transferencia de acido araquidónico desde la fosfatidilcolina a la cabeza del grupo de fosfatidiletanolamina. Esta reacción puede ser iniciada por el aumento intracelular de Ca2+ y es regulada por el AMPc, que aumenta la actividad de la NAT por fosforilación mediada por la proteína kinasa A (PKA) dependiente de AMPc. La liberación de anandamida desde NAPE es catalizada por una fosfolipasa D (por sus siglas en ingles, PLD) específica. La actividad de PLD es ampliamente regulada por la activación de el receptor ionotrópico glutamato N-metil-D-Aspartato (NMDA), por receptores neuronales nicotínico α7 o por estimulación de un receptor metabotrópico de los principales neurotransmisores incluyendo la dopamina, el glutamato y la acetilcolina en neuronas corticales (Stella y Piomelli, 2001; Freund y cols., 2003). Figura 4 En esta figura se ilustra el mecanismo propuesto para la formación de anandamida. (Tomado de Freund y cols., 2003). 15 La síntesis y liberación de 2-AG difiere de la síntesis de la anandamida, ya que por ser un monoglicerido, su síntesis es asociada al metabolismo del triacilglicerol, por la activación de un receptor dependiente de fosfolipasa C fosfatidil-inositol específico (PLC). Existen dos rutas posibles para la biosíntesis del 2-AG, las cuales se resumen en la figura 5. La hidrólisis de los fosfolípidos de la membrana mediada por la fosfolipasa C (PLC) puede producir diacilglicerol (DAG), el cual subsecuentemente es convertido a 2-AG por actividad de la lipasa diacilglicerol (DGL). La vía alternativa, es la fosfolipasa A1 (PLA1) la cual puede generar lisofosfolípido, al hidrolizarse a 2-AG por actividad liso-PLC. Acil Araquidonil Fosfatidilinositol Acil Araquidonil Araquidonoil OH Araquidonil 2-AG Figura 5 esquematiza la posible vía de formación del 2-araquidonilglicerol (Tomado de Freund y cols., 2003). 16 Una vez sintetizados la anandamida y el 2-AG, se tienen dos vías posibles de interacción con receptores: 1) se unen a los receptores a canabinoides (CB) de la misma célula donde son formados, por difusión en la membrana celular ó 2) pueden ser liberados al espacio extracelular. De esta manera la activación de los receptores metabotrópicos acoplados a PLC y lipasa diacilglicerol (DGL), es una vía que sistemáticamente permite el incremento en la producción de 2-AG. Aunque la formación de 2-AG es dependiente de Ca2+, y la regulación es independiente de la síntesis y liberación de anandamida. En la figura 6, se observa el modelo dinámico de síntesis, degradación y acción celular de los endocanabinoides (Rodríguez de Fonseca y cols., 2005) Figura 6 Vías bioquímicas para la síntesis, degradación y acción celular del canabinoide endógeno anandamida. (Tomado de Rodriguez de Fonseca y cols., 2005). 17 Exo-canabinoides Como se señalo anteriormente, el Δ9-THD es el principal responsable de las propiedades psicoactivas de la Cannabis sativa. Además de este, otros canabinoides como el Δ8-THC, el canabinol y el canabidiol también se encuentran en esta planta. A partir de la estructura química de estos se han desarrollado los canabinoides sintéticos, exocanabinoides (Arevalo-Martín y cols., 2002). De los canabinoides sintéticos, se clasifica según la interacción que tienen con el receptor en agonistas, antagonistas y los bloqueadores de la acido graso amida hidrolasa (responsable de la hidrólisis de la anandamida). Agonistas Los agonistas a los receptores canabinoides se dividen esencialmente en cuatro grupos químicos: clásicos, no clásicos, aminoalquilindol y los eicosanoides. Los canabinoides clásicos consisten en derivados dibenzopiranos y derivados de los componentes de la planta cannabis o de sus análogos sintéticos. Entre los más estudiados de estos se incluye a los psicotrópicos de la planta, Δ9-tetrahidrocanabinol (Δ9-THC), Δ8-THC y el canabinoide sintético 11-hidroxi- Δ8-THC-dimetilheptil (HU-210). Los canabinoides no clásicos, son similares en estructura a los canabinoides clásicos, es decir, estos consisten en análogos bicíclicos del Δ9-THC carentes del anillo pirano. Como ejemplos son el CP 55940, CP 55244, CP 50556 (L-nantradol) y el desacetil-L-nantradol. Del tercer grupo aminoalquilindol, el prototipo inicial es el WIN 55,212-2. Este grupo contiene compuestos diferentes en estructura de los canabinoides clásicos y no clásicos (ver figura 7). 18 Figura 7 estructura química de tres agonistas a los receptores canabinoides no eicosanoides (Δ9-THC, CP 55,940 y WIN 55,212,2) (modificado de Pertwee, 2001). La última familia de moléculas con actividad canabimimética se desarrolló a partir del descubrimiento de los endocanabinoides, el miembro prototipo del grupo de los eicosanoides es la anandamida. La mayoría de los agonistas de los receptores a canabinoides contienen un centro quiral y esto les confiere una estéreo selectividad en los ensayos farmacológicos, algunos de estos son el araquidonilcyclopropamida (ACPA), R-+-metanandamida y el araquidonil-2-cloroetilmida (ACEA) (ver figura 8). Figura 8 estructura química de algunos agonistas eicosanoides (modificado de Pertwee, 2001). 19 La afinidad de los agonistas a los receptores canabinoides ya se ha establecido. En la tabla 2 se muestra la afinidad de los agonistas por los receptores a canabinoides, observando que se han identificado tres compuestos selectivos para CB1 sin demostrarse su afinidad para CB2, el resto ha demostrado afinidad para ambos receptores a canabinoides CB1/CB2. Tabla 2 Eficacia relativa de los agonistas a los receptores a canabinoides. (tomado de Pertwee, 2001) Ligando CB1 CB2 1) Δ9-THC +++ + 2) HU-210 +++++ +++++ 3) CP 55940 +++++ +++++ 4) WIN 55,212-2 +++++ +++++ 5) Anandamida ++++ + 6) ACEA +++++ - 7) ACPA ++++ - - +++++ 8) JHW-133 Señalando con + la selectividad del agonista por el receptor Antagonistas/Agonistas inversos de los receptores a canabinoides. Los antagonistas de los receptores canabinoides, son considerados a su vez como agonistas inversos, los cuales no solo bloquean el efecto del agonista, sino al actuar sin presencia del agonista nos dan el efecto contrario al agonista. Son dos los grupos principales: los diarilpirazoles, como el SR141716A, el cual es un ligando altamente potente y selectivo 20 para el receptor CB1 y los Benzofuranos, siendo representativo el LY320135 y el AM630 (Pertwee, 2001; Howlett y Cols., 2002) en la tabla 3 se muestran los principales antagonistas, señalando su clasificación como antagonista, agonista inverso y su selectividad para los receptores canabinoides. Tabla 3 clasificación farmacologica de los principales antagonistas/agonista inverso y la selectividad por el receptor canabinoide. (modificado de Pertwee, 2001; información de tocris.com) Antagonista CB1 CB2 1) SR141716A A/I - 2) AM281 A/I - 3) AM251 A - 4) AM630 - A/I 5) O-2050 A - 6) LY320135 A/I - Clasificación farmacológica de los principales antagonistas/agonista inverso (A/ AI) y la selectividad por el receptor canabinoide. Síntesis química de endocanabinoides Lon endocanabinoides que se han sintetizado recientemente son el noladin éter, virodamina y el N-araquidonoil dopamina (NADA) (ver figura 3). A la fecha, es controversial el hallazgo del noladin éter en tejidos de mamíferos, puesto que el único acil éter encontrado en animales es el 2-acil- éter (De Petrocellis y cols., 2004). El N-araquidonoil-dopamina fue 21 sintetizado por Bisogno y cols. en el año 2000, reportando una selectividad 40 veces mayor para los receptores CB1 sobre los CB2. El noladin éter fue aislado de cerebro de porcino, y se identifico su estructura química por medio de espectrometría de masa, resonancia magnética nuclear. Este compuesto se une a los receptores canabinoides CB1 con alta afinidad in vitro [la constante de disociación (KD) es de 21 nM] ejerciendo efectos semejantes a los canabinoides en el ratón in vivo, incluyendo sedación, inmovilidad, hipotermia y antinocicepción (Hanus y cols., 2001). La virodamina fue aislada en cerebro de rata, identificando su estructura química por medio de espectrometría de masa. Este compuesto mostró activar los receptores CB1 débilmente en un ensayo de unión con 35S-guanosin-5’-O-(3-tiotrifosfato) marcado (GTPγS) (concentración media efectiva 1.9 μM) donde mostró una actividad agonista parcial. Sin embargo, la virodamina disminuye la temperatura corporal en ratón, aunque es menos efectiva que la anandamida (Porter y cols., 2002). Captura y degradación de los endocanabinoides La vía de señalización endocanabinoide termina en un proceso de dos pasos que incluye la internalización del endocanabinoide y su hidrólisis por dos sistemas enzimáticos específicos. La primera es mediada por un transportador ampliamente distribuido en el cerebro (AT), aunque las evidencias de su presencia son dudosas, Glaser y cols., (2003) en su trabajo reportan en base a sus observaciones en la cinética de la hidrólisis de la anandamida, que esta entra a la célula por un proceso de difusión simple. Otros trabajos que apoyan la presencia del transportador refieren que es una molécula que trabaja de manera similar a otros transportadores lipídicos, es decir, facilita la captura de anandamida y 2-AG sin consumo de 22 energía. La hipótesis de la presencia del transportador deriva de las observaciones realizadas en ciertas líneas celulares en donde la acumulación de anandamida es saturable y puede ser bloqueada por el AM404 (Giuffrida y cols., 2001; Fegley y cols., 2004; Alger, 2004). Debe aclararse que los procesos de transporte y degradación del endocanabinoide son independientes. La degradación de los endocanabinoides es realizada por dos sistemas enzimáticos específicos: la acido graso amida hidrolasa (FAAH) y la monoacilglicerido lipasa (MAGL) (Rodriguez de Fonseca y cols.,2005). Síntesis, degradación, acción celular del endocanabinoide anandamida. En la figura 6 se muestra una revisión de las vías para la síntesis, degradación y acciones celulares del canabinoide endógeno anandamida. En el primer paso, la andamida es liberada desde un lípido precursor de la membrana, el N-araquidonoil-fosfatidiletanolamina (NAPE) por la acción de una fosfolipasa D especifica (PLD) que a su vez es activada por la despolarización o la estimulación de un receptor acoplado a proteína G (GPCR). La biosíntesis del NAPE es catalizada por una enzima de la membrana, la Naciltransferasa (NAT) activada por el calcio (Ca2+) y AMPc. La anandamida actúa como un mensajero retrógrado en los receptores a canabinoides (CB1) presinápticos donde regula la liberación del neurotransmisor (NT) a través de un segundo sistema de transducción [principalmente por el Ca2+ incorporado a través de los canales de calcio dependientes de voltaje (VGCC)] de la membrana presináptica (Felder y cols., 1993). Otro de los efectos de este endocanabinoide es actuar como un neuromodulador del sistema mayor de transmisores, incluyendo la dopamina, en las células postsinápticas en donde regula la excitabilidad y la 23 plasticidad sináptica, a través de la modulación de los canales de potasio (K+) y por las proteinas quinasas (PK) incluyendo la proteína quinasa A. La acción de la anandamida finaliza a través de un proceso de dos pasos, que incluye primero la recaptación celular de la anandamida a través de un transportador especifico (AT) y segundo, la degradación por hidrólisis enzimático a acido araquidónico (AA) y etanolamida por la enzima ácido grasa amidohidrolasa (FAAH) (Rodríguez de Fonseca y cols., 2005) Receptores a canabinoides Los receptores a canabinoides reciben este nombre por unirse a compuestos canabinoides, como el Δ9-THC y ejercer una respuesta metabólica. Pertenecen a la familia de receptores 7 dominios transmembrana, por estar constituidos por 7 segmentos ubicados en la membrana celular y además son activadores de las proteínas G de la familia Gi/o. Para referirse a los tipos de receptores a canabinoides, estos son denotados por la abreviación CB por las siglas en ingles de canabinoid y brain, y numerado en el orden en que fueron descubiertos (CB1, CB2) (Howlett y cols., 2002). Los dos principales tipos son el CB1 y el CB2, que han sido caracterizados molecularmente. Hasta la fecha se han descrito otros dos receptores blanco, los no-CB1 no-CB2, Hajos y cols. (2001) reporta una modulación de la neurotransmisión glutamatérgica con el agonista WIN55,212,1 y Breivogel y cols. (2001) demuestra la actividad de los canabinoides en cerebro de rata knockout (CB1 -/-); el otro receptor blanco de los canabinoides son los receptores vaniloidil demostrado por Zigmunt y cols. (1999), en su trabajo muestra una activación de estos receptores por anandamida presentando bloqueo por el antagonista al receptor vaniloidil 8-37 CGRP, pero no por el antagonista canabinoide SR141716A. 24 El receptor CB1 de rata fue clonado por Matsuda y cols. en 1990. Los receptores CB1 de rata, ratón y humano muestran una semejanza en la secuencia de aminoácidos entre el 97 y 99 %, en la figura 9 se muestra el esquema del receptor CB1. Este tipo de receptores CB1 están localizados principalmente en cerebro donde se encuentran altamente localizados en la corteza cerebral, el hipocampo, los ganglios basales y el cerebelo, sin embargo, presentan bajos niveles de expresión en el hipotálamo y la medula espinal, y están ausentes en los centros respiratorios del tallo cerebral, apoyando la observación clínica de la baja letalidad de una sobredosis de Cannabis (Herkemhan y cols., 1990). Figura 9 muestra el esquema del receptor canabinoide CB1 (tomado de Cayman Chemicals). El receptor CB2 fue clonado por Munro y cols. en 1993, y este receptor CB2 de ratón posee un 82% de semejanza en la secuencia de aminoácidos con respecto al receptor CB2 de humano. Este receptor CB2 se ha localizado principalmente en células del sistema inmune con una alta expresión en los linfocitos B, moderada en monocitos y polimorfonucleares, baja en los linfocitos T, en las células de la microglia y en tejidos como el hígado y la retina. Ambos tipos de receptores CB1 y CB2, muestran una homología del 48% entre ellos (Howlett y cols., 2002). Ver figura 10. 25 Figura 10 Homología en la secuencia de aminoácidos entre los receptores CB1 y CB2. (Modificado de Watson, 2000) Aún cuando los receptores CB1 y CB2 se localizan principalmente en tejido neuronal y células inmunes, respectivamente. Matias y cols., (2002) por medio de RT-PCR y la técnica de Western immunoblotting encontraron que las células dendríticas las cuales derivan de células madres de la medula ósea y son células presentadoras de antígenos del sistema inmune, expresan cantidades cuantificables de ambos receptores, CB1 y CB2. Canabinoides y receptores (mecanismo de acción). La activación de los receptores a canabinoides CB1 y CB2 por un agonista, activa un número de vías de la transducción de la señal a través de las proteínas G, de la familia Gi/o. Al activarse el receptor el cual esta acoplado a una proteína Gi/o, esta proteína se disocia en dos subunidades, la Giα y el dímero βγ. Liberada la subunidad Giα, esta regula a la adenilil ciclasa, desencadenando una inhibición en la producción del AMP cíclico. Referente al dímero βγ, este media la regulación de los canales iónicos, la vía de la proteína quinasa activadas por mitógeno (MAPK) y la fosfatidil-inositol-3-quinasa (PI3K) (Howlett y cols., 26 2002). Así la activación de los receptores canabinoides CB1 causa inhibición de la adenilil ciclasa, la cual es sensible a la toxina pertussis, confirmando que esta activación es a través de proteínas Gi/o, también, esta activación bloquea los canales de Ca2+ tipo L en las células del músculo liso de las arterias cerebrales (Gebremedhim y cols., 1999) y los canales de Ca2+ tipo N y P/Q de la terminal presináptica (Mackie y Hille, 1992), activa los canales de K+ (McAllister y cols., 1999; Mackie y cols., 1995) y la vía de las MAPK (Bouaboula y cols., 1995). Las neuronas del sistema nervioso central la regulación de corrientes intracelulares de Ca2+ liberado desde almacenes intracelulares (Netzeband y cols., 1999). Sin embargo los cannabinoides también presenta un efecto contrario en el acople a la adenil ciclasa vía proteína Gs sensible a la toxina pertussis (Bohnaus y cols., 1998). La activación de los receptores CB2 involucra la inhibición de la adenililciclasa y activación de MAPK (Bouaboula y cols., 1996). Gebremedhim y cols. (1999) reportaron que en el músculo liso de las arterias cerebrales de gato expresaba acido ribonucleico mensajero (ARNm) para el receptor CB1. Identificando la corriente de Ca2+ tipo L probaron un agonista cannabinoide, el WIN55,212,2 que indujo una inhibición de esta corriente [máximo de 82 ± 4% a concentración 100 nM], estos efectos inhibitorios fueron bloqueados por el antagonista a receptor CB1, SR141716A y la toxina perstussis. Esto fue correlacionado con el papel que desempeñan los receptores CB1 en la regulación del tono de las arterias cerebrales y la reactividad por modulación del flujo de Ca2+ a través de los canales de Ca2+ tipo L. Los trabajos realizados por Mackie y Hille (1992), reportan en los canales de Ca2+ tipo N y P/Q una relación entre la activación del receptor canabinoide y la amplitud de la corriente de calcio (ICa) en células del neuroblastoma NG108-15 utilizando el agonista WIN55,212,2. 27 Sus estudios revelaron que la activación de ese receptor reduce la amplitud de la corriente de calcio voltaje dependiente, siendo una inhibición potente (100 nM) y reversible. Esta inhibición es bloqueada por la toxina pertussis, sin alteración en la corriente de Ca2+ al tratamiento con (análogos del AMPc resistentes a la hidrólisis) junto con inhibidores de la fosfodiesterasa, sugiriendo de esta manera que la vía de transducción entre el receptor canabinoide y el canal de calcio involucra una proteína de unión a GTP sensible a la toxina pertussis y que esta vía es independiente del metabolismo del AMPc. En trabajos posteriores, Mackie y cols. (1995) demostraron en células AtT20 transfectadas con el cDNA de CB1 de cerebro de rata, que el agonista canabinoide WIN55,212-2 aumenta el flujo de corriente de potasio (Kir) por la vía de una proteína G sensible a la toxina pertussis, así como una inhibición de las corrientes de calcio tipo Q. Utilizando un sistema de expresión heterologa, McAllister y cols. (1999) caracterizaron farmacológicamente el acople del receptor canabinoide que activa los canales rectificadores entrantes de K+ (GIRK) en oocitos de Xenopus laevis. Reportando que los receptores CB1 y CB2 se acoplan de manera diferente a estos canales, y demostrando el acople de los receptores CB1 a los canales GIRK, donde la anandamida produjo un 46% del aumento de corriente y el acople de los receptores CB2 con WIN 55,212-2 fué menos eficiente. Bonhaus y cols. (1998), demostraron el acople de los receptores canabinoides a las proteínas Gi/o y Gs. Como también cuantificaron la potencia y actividad intrínseca de los agonistas canabinoides en la estimulación o inhibición de la acumulación de AMPc. En su trabajo reportaron que el orden de la potencia de los agonistas canabionides en el incremento o inhibición de la acumulación del AMPc estimulado por forskolina en las células CHO que expresaron los receptores hCB1, fue idéntico, HU-210 > CP-55,940 > THC > WIN-55,212-2 > anandamida. 28 En el estudio realizado por Chemin y cols. (2001) sobre la inhibición directa de los canales de calcio tipo T por el endocanabiode anandamida, sus resultados sugieren que la andamida actúa intracelularmente y demuestran que la inhibición de los canales de calcio tipo T por la anandamida puede regular la excitabilidad neuronal de manera independiente de los receptores canabinoides. La activación de los receptores CB1 y CB2 ejercen diferentes efectos celulares. Las corrientes de calcio entrantes en la membrana presináptica son requeridas para la liberación del neurotransmisor en las sinapsis del sistema nervioso central. Los canabinoides al activar los receptores CB1 de estas terminales inhiben los canales de Ca2+ presinápticos, lo cual podría ser el mecanismo para la inhibición de la liberación del neurotransmisor desde las terminales presinápticas que expresan el receptor CB1. Así la inhibición de los canales de calcio puede ser el mecanismo por el cual los cannabinoides inhiben la liberación de los neurotransmisores (MacKie y Hille, 1992; Felder y Glass, 1998; Sullivan, 1999; Chemin y cols., 2001; Elphick y Egertova, 2001; Freund y cols., 2003; Iversen, 2003; Arevalo-Martín y cols., 2002). En los leucocitos, los canabinoides al actuar sobre los receptores CB2 inducen una inhibición del adenilil ciclasa, dando lugar a una reducción en la señalización por AMPc que se correlaciona con una disminución en la función inmune de este tipo celular(Arevalo-Martín y cols., 2002). 29 Canabinoides y el control motor. Uno de los efectos más documentados de los canabinoides, es sobre el control motor (Arevalo-Martín y cols., 2002). Los estudios realizados en sistema nervioso central sobre el efecto de los canabinoides en la regulación del control motor concluyen en tres puntos principales: • Los canabinoides son capaces de producir cambios en la actividad motora en humanos y en animales de experimentación. (Rodríguez de Fonseca y cols., 1998; ArevaloMatrín y cols, 2002) • Los diversos elementos que conforman el sistema endocanabinoide (los ligandos endógenos y sus receptores), se encuentran presentes de forma abundante en los ganglios basales, los cuales son importantes en la regulación del control motor y el movimiento (Herkenham y cols., 1990; Egertova y cols., 1998; Egertova y Elphick, 2001; Iversen, 2003). • Los canabinoides alteran la funcionalidad de tres neurotransmisores con importante participación a nivel de los ganglios basales, es decir, la dopamina, el GABA y el glutamato (Sullivan 1999; Auclair y cols., 2000; Katona y cols., 2001; Szabo y cols., 2004). La falla en la funcionalidad de los ganglios basales en el control motor se manifiesta en el habla y el movimiento (dificultad para caminar, movimientos involuntarios, espasmos musculares, aumento del tono muscular). Que se correlaciona con los datos de los efectos motores producidos por la administración de diferentes tipos de canabinoides en modelos 30 animales apoyando la idea de que el sistema endocanabinoide participa de manera importante a nivel de los ganglios basales, y la distribución de los receptores a canabinoides así lo sugiere. Herkenham y cols. (1990) realizaron el primer mapeo de la distribución de los receptores a canabinoides en el cerebro de diferentes mamiferos incluyendo rata y humano, por medio de estudios autoradigráficos, utilizando radioligandos y el agonista marcado ([H3]CP-55,940) que posee alta afinidad al receptor CB1. Su estudio reveló que los sitios de unión mas denso de los radioligandos y el agonista marcado fue en los núcleos de los ganglios basales [en la sustancia nigra pars reticulata y el globo pálido], en hipocampo y cerebelo (ver figura 10). La validez del estudio fue confirmado por Zimmer y cols. (1999), empleando ratones manipulados genéticamente con la ausencia de la expresión del receptor CB1 (ratones knockout), en los cuales no fueron detectados los sitios de unión al canabinoide (Iversen, 2003). Hay reportes por parte de Egertova y cols. (1998) quienes realizaron un análisis de la distribución de FAAH comparándolo con la distribución de los receptores a CB1 por inmunohistoquímica, y evidenciaron la cercana correspondencia en distribución y los patrones de expresión para ambos, FAAH y el receptor CB1. Estos resultados apoyaron la participación de la FAAH en los mecanismos de señalización canabinoide en cerebro. Los estudios realizados por Egertova y Elphick (2001), con anticuerpos para la señalización de las regiones amino y carboxilo terminal del receptor CB1, mostraron que los receptores CB1 están localizados principalmente en el axón y en la terminal nerviosa, y están ausentes en el soma o las dendritas. La densidad de los receptores a canabinoides en las regiones del cerebro humano y de animales (Herkenham y cols., 1990) es diferente, de acuerdo a la región de que se trate, particularmente la región frontal contiene alta densidad de receptores para CB1. También se observa una alta densidad en los ganglios basales y en el cerebelo, ver figura 11. Los receptores CB1 están relativamente ausentes en los núcleos del tallo cerebral, lo cual pudiera explicar la baja 31 toxicidad de los cannabinoides cuando se presenta una sobredosis (Herkenham y cols., 1990; Iversen, 2003) Figura 11 Distribución de los receptors canabinoides CB1 en el cerebro de rata, rebelados por una autorradiografia de la unión de un agonista de alta afinidad marcado radioactivamente en un corte sagital de cerebro. Las regiones marcadas son: Cb = cerebelo; CbN = núcleo cerebelar profundo; cc = cuerpo calloso; EP = núcleo entopeduncular; Fr = corteza frontal; FrPaM = corteza frontoparietal area motora; GP = globo palido; Hi = hipocampo; IC = colliculus inferior; LP = talamo postero lateral; Me = núcleo amigdaloide medial; PO = corteza olfatoria primaria; PCRt = núcleo reticular parvocelular; SNR = sustancia nigra reticular; Tu = tubérculo olfatorio; VP = talamo ventroposterior. (Tomado de Iversen, 2003). Las sustancias sintéticas o endógenas que activan directa o indirectamente los receptores CB1 producen efectos inhibitorios a nivel motor, que se manifiesta en roedores por descensos de la actividad espontánea y en la frecuencia de aparición de actividades noambulatorias, y desarrollo de la inactividad llegando incluso a la catalepsia (Rodríguez de Fonsea y cols., 1998; Arevalo-Martín y cols., 2002). Por el contrario, el bloqueo de estos 32 receptores con antagonistas selectivos como el SR141716A produce hiperlocomoción. Al emplear a dosis bajas algunos agonistas CB1 se han podido evidenciar efectos estimuladores, pero la mayor parte de los autores asumen que la activación de los receptores CB1 conlleva un marcado efecto hipoquinético. No obstante, se debe mencionar que existen variaciones en cuanto a la magnitud y/o la duración de los efectos de los distintos tipos de canabinoides, variaciones que están relacionadas con sus diferencias en cuanto a la afinidad por los receptores, potencia farmacológica y/o estabilidad metabólica (Arevalo-Martín y cols., 2002) Los efectos motores provocados por la activación de los receptores CB1 con los diferentes tipos de canabinoides endógenos o exógenos, son el resultado de la capacidad de estas sustancias de interferir en la actividad de los tres principales neurotransmisores implicados en la funcionalidad de los ganglios básales, es decir, dopamina (Patel y cols., 2003), GABA (Katona y cols., 2001; Tsuo y cols., 1998) y glutamato (Rodríguez de Fonseca y cols., 1998; Sullivan, 1999; Auclair y cols., 2000; Iversen,, 2003) La relevancia que presenta el sistema endocanabinoide en el circuito de los ganglios basales, es la regulación de la liberación de varios neurotransmisores: la dopamina aparece como neurotransmisor en las neuronas que van de las substancia nigra al cuerpo estriado y cuya disfunción origina la enfermedad de Parkinson. Mientras el GABA lo hace principalmente en las neuronas estriatales que proyectan hacia la substancia nigra y el núcleo entopenduncular (vía directa), o hacia el globo pálido (vía indirecta), y cuya disfunción origina la enfermedad de Huntington u otras patologías con alteraciones coreicas (movimientos involuntarios) (Rodríguez de Fonseca y cols., 1998) 33 Los Canabinoides y la unión neuromuscular. Los efectos de los canabinoides en el control motor no solo son a nivel del sistema nervioso central afectando la neurotransmisión, sino existen evidencias indirectas del efecto sobre la unión neuromuscular. A continuación detallaré algunos aspectos estructurales y funcionales de la unión neuromuscular. Los primeros estudios detallados sobre la transmisión sináptica fueron realizados en la unión neuromuscular. Esta unión esta formada por un axón mielinizado y una fibra muscular. El axón mielinizado se origina desde una neurona motora localizada en la medula espinal y termina en una serie de terminales desmielinizadas que corren longitudinalmente a lo largo de la fibra muscular. Esta asociación de la unión neuromuscular también es conocida como placa terminal. Las zonas activas son las regiones especializadas en la liberación del transmisor, están orientadas opuestamente a los sitios de invaginación de la membrana postsináptica. Existen aproximadamente 300 zonas activas por unión neuromuscular. Las zonas activas en la terminal nerviosa muestran contener vesículas de neurotransmisor, de 50 a 60 nm de diámetro habiendo aproximadamente 500, 000 vesículas en toda la zona activa en una unión neuromuscular (figura 12). Se estima que en promedio una vesícula contiene 20,000 moléculas de acetilcolina (ACh) (Siegel y cols.,1999). Sin embargo, otros autores mencionan que cada vesícula contiene aproximadamente 5000 moléculas de ACh (Purves y cols., 2001). 34 Figura 12 se esquematiza la morfología de una placa terminal en la unión neuromuscular que consta de un axón mielinizado y una fibra muscular, señalándose las vesículas del neurotransmisor (acetilcolina) las zonas activas, la hendidura sináptica también llamado espacio íntersináptico, la membrana postsináptica(Tomado de Siegel, 1999) La membrana postsináptica, se localiza opuesta al sitio de liberación del transmisor también se encuentra altamente especializada consistiendo en pliegues de la membrana plasmática que presenta una alta densidad a los receptores a ACh nicotínicos (nAChRs). La lámina basal con la matriz de proteínas es importante para la formación y mantenimiento de la unión neuromuscular. La acetilcolinesterasa (AChE), es una enzima que hidroliza la ACh a acetato y colina para inactivar el neurotransmisor, se encuentra asociado con la lámina basal.(figura 13) (Siegel, 1999). Figura 13 Muestra la localización de las vesículas sinápticas en las zonas activas de la membrana presináptica 35 (Modificado de Siegel, 1998) Cuando se estimula una neurona motora se produce una despolarización de la placa terminal. En 1952, Fatt y Katz observaron que los potenciales espontáneos de aproximadamente 1 mV ocurrían en la placa terminal motora. Cada cambio de potencial individual tenia un curso temporal similar a las repuestas evocadas en la membrana muscular que resultaban de la estimulación eléctrica del nervio motor. Estos pequeños potenciales espontáneos fueron llamados potenciales miniatura de placa terminal (MEPPs). Debido a que los MEPPs son reducidos por los antagonistas nicotínicos como la D-tubocurarina e incrementan en amplitud y duración por el inhibidor de AChE prostigmina, se concluyo que son desencadenados por la liberación de ACh. Debido a que los cambios en el potencial de acción son grandes para contar la interacción de moléculas individuales de ACh en la placa terminal, Fatt y Katz postularon que era un reflejo de liberación en paquetes o cuantos de moléculas de ACh desde la terminal nerviosa. Posteriormente, Fatt y Katz observaron que cuando la concentración de Ca2+ es reducida y la concentración de Mg2+ incrementada, los potenciales de placa evocados se disminuyeron sin alterar el tamaño de los MEPPs espontáneos. Katz y Miledi demostraron la importancia del Ca2+ en la liberación del neurotransmisor. En la unión neuromuscular de rana perfundida con solución salina con Mg2+ pero deficiente en Ca2+, demostraron que al despolarizar eléctricamente la terminal nerviosa en ausencia de Ca2+, no se evoca el potencial de placa. Si un pulso de Ca2+ es aplicado justamente antes de la despolarización, se evoca el potencial de placa. Esto ultimo contrasta con la ausencia del potencial de placa si el pulso de Ca2+ es inmediatamente seguido de la despolarización. Los potenciales de placa ocurren cuando el pulso de Ca2+ es tan corto como 1 36 mseg precedente al inicio del pulso despolarizante. Estos experimentos demostraron la importancia de la presencia de Ca2+ en la terminal nerviosa en el momento de la despolarización para que se lleve a cabo la liberación del neurotransmisor (Siegel y cols., 1999; Kandel y cols., 2000). Efectos de los canabinoides en la unión neuromuscular. Los estudios realizados en los años 70 por Layman y Milton (1971) observaron que el Δ9-THC disminuye la respuesta a estímulos eléctricos en el íleo de cobayo y en ocasiones potencía la respuesta mediada por la acetilcolina. Gill y cols., en 1970, en vasa deferentes la respuesta disminuye levemente a trenes cortos de estímulos eléctricos a baja intensidad, con gran respuesta a descargas fuertes únicas. Layman y Milton en 1971 no observaron efecto del Δ9-THC en la preparación de nervio frénico de rata o preparación de rectus de rana; sin embargo, Kayaalp y cols. (1974) reportaron el bloqueo neuromuscular, con evidencia para un bloqueo parcial de la conducción axonal en la preparación de rata después de una larga incubación con Δ9-THC. En 1975, Hoekman y cols. en su trabajo sobre transmisión neuromuscular en diafragma de rata sugieren una alteración en la función presináptica en la unión neuromuscular por el Δ9-THC. Identificados los componentes del sistema endocanabinoide, en 1994 Van der Kloot en su trabajo sobre los efectos de la anandamida en la unión neuromuscular, reporta que este compuesto bloquea la enzima adenilato ciclasa en la unión neuromuscular en la rana, Por los resultados de su trabajo es el primero en reconocer la presencia de un receptor canabinoide en la terminal nerviosa motora. 37 En la unión neuromuscular de la rana (ver figura 14), Sánchez-Pastor y cols. (2004) reportaron que al emplear directamente un agonista canabinoide se observo una disminución en la frecuencia de los potenciales miniaturas y la disminución en la amplitud de estos, proponiéndose la presencia de los receptores a canabinoides CB1 en la placa terminal de la unión neuromuscular de rana, los cuales modulan la liberación del transmisor. Figura 14 Micrografía de escaneo electrónico de unión neuromuscular en rana (Tomada de Alberts, 2002). Canabinoides y efectos directos en el músculo esquelético. El músculo esquelético es el efector del movimiento y de los más estudiados en estructura y función, sin embargo, es un tejido donde se tiene poco conocimiento de los efectos de los canabinoides que contribuyan a explicar el control motor. 38 El papel del Ca2+ en la contracción muscular Uno de los componentes reguladores de la contracción muscular, es el ión Ca2+.. Su función reguladora como segundo mensajero ha sido demostrada en tres aspectos generales: 1) el mecanismo de activación, específicamente en el sistema troponina-tropomiosina asociado con los filamento de actina; 2) en los músculos lisos de vertebrados, el Ca2+ junto con calmodulina (CaM), activa la quinasa de la cadena ligera de la miosina, que inicia la contracción muscular; 3) la unión directa del Ca2+ a la miosina, que regula la contracción en los músculos de ciertos invertebrados, por ejemplo el scallop (Berchtold y cols., 2000). Uno de los componentes principales en el acople excitación-contracción involucrados en la liberación del ión Ca2+ esta el receptor a rianodina, este receptor es un canal de la membrana del retículo sarcoplásmico que libera el Ca2+ desde el interior de este y es modulado por diversos ligandos endógenos y exógenos, siendo la cafeína uno de estos activadores exógenos. Muñiz y cols., (1992), mostraron los efectos de la cafeína en las fibras musculares lentas de rana, sugiriendo que la cafeína promueve la liberación de calcio desde el retículo sarcoplásmico. En trabajos realizados por Bhat y cols. (1997), utilizando un sistema de expresión heterológa demostraron que la cafeína indujo apertura de los canales de rianodina de manera dependiente de la concentración, sugiriendo que el sitio de unión de la cafeína reside en la porción amino terminal del receptor de rianodina. Acople excitación-contracción La activación de las vías motoras en el sistema nervioso central como consecuencia de un reflejo o un movimiento intencionado activa las motoneuronas del asta anterior de la medula espinal, el potencial de acción se propaga a través de la membrana del axón motor desencadenando la liberación de acetilcolina (ACh) desde las vesículas localizadas dentro de 39 las terminales del axón motor, esta ACh difunde a través de la hendidura sináptica y se une a los receptores específicos en el sarcolema causando un potencial de placa que puede alcanzar el umbral para el inicio de un potencial de acción. Este potencial de acción del músculo se propaga por el sarcolema despolarizando los tubulos transversos (tubulos T), ocasionando la activación de los canales de dihidropiridina y consecuentemente que el Ca2+ se libere desde la cisternas laterales del retículo sarcoplásmico (RS). Los iones de Ca2+ difunden hacia los sarcomeros dando lugar a la activación de los puentes cruzados. Cuando el músculo ya no es estimulado la concentración de Ca2+ disminuye rápidamente por la acción de la ATPasa- Ca2+ del RS con la consecuente relajación del músculo. En la figura 15 se muestra que posterior al estimulo del músculo con un pulso por arriba del umbral nos da un potencial de acción que activa los canales de sodio y cloro, esta despolarización al propagarse por los tubulos T activan los canales de dihidropiridina (canales de Ca2+ tipo L) permitiendo la entrada de Ca2+ al interior de la célula muscular y activando los canales de rianodina con la consecuente liberación de Ca2+ por parte del retículo sarcoplásmico (Franzini-Armstrong, 1999; Favero, 1999). Figura 15. cuando se estimula el músculo se activan los canales de sodio y cloro, de esta manera al propagarse el potencial de acción llega a los tubulos T donde activa a los canales de dihidropiridina (canal 40 de calcio voltaje dependiente tipo L) que estan acoplados a los canales de rianodina del reticulo sarcoplásmico con la consecuente liberación de calcio del retículo sarcoplásmico (Tomado de Berchtold y cols., 2000) . Efectos de los canabinoides en el músculo esquelético A la fecha, las evidencias que se tienen del efecto directo de los canabinoides sobre el músculo esquelético se ubican en tres puntos principales: • Efectos de canabinoides sobre las propiedades mecánicas del músculo esquelético lento. • Efecto de canabinoides sobre las propiedades mecánicas del músculo esquelético rápido. • Presencia de ARNm que codifica para receptor a canabinoide CB1 en fibras de músculo esquelético rápido y lento. Los estudios iniciales del efecto directo de los canabinoides en músculo esquelético fueron realizados por Vásquez y cols (2000), quienes investigaron la respuesta mecánica de las fibras musculares esqueléticas lentas de la rana al agonista canabinoide WIN55,212-2. Reportando una reducción en la tensión pico y una disminución en la tensión total producida por potasio, efectos que fueron reversibles. Con esos resultados obtenidos, se sugirió que la tensión evocada por la solución de alto potasio en fibras musculares esqueléticas lentas de rana puede ser modulada por canabinoides. 41 En las fibras musculares rápidas de rana, Velasco y cols (2002) aplicaron directamente el canabinoide (WIN55,212-2) reportando un enlentecimiento en la activación de la contractura y una disminución en la tensión pico y total. Estos efectos fueron revertidos. Con esos resultados se sugierió que la generación de la tensión isométrica puede ser modificada por el canabinoide debido a la alteración en la liberación del calcio desde el retículo sarcoplásmico y probablemente por la reducción de la concentración intracelular total de ese ión. Recientemente Sánchez-Pastor y cols., (2004) reportaron la presencia de ARNm que codifica para el receptor a canabinoide CB1 de músculo esquelético tanto en fibras lentas como rápidas de rana y de pollo, siendo los niveles de expresión menores en el músculo lento que en el músculo rápido. Efecto de un canabinoide sobre las contracturas por cafeína en las fibras musculares esqueléticas lentas de rana. Con la finalidad de explorar el efecto directo de un canabinoide (ACPA, agonista selectivo para el receptor CB1) sobre las contracturas inducidas por cafeína en las fibras musculares esqueléticas lentas de rana. Realice el trabajo que se describe a continuación. Metodología Para el estudio de los efectos del agonista del receptor a canabinoides CB1 (ACPA) se emplearon ranas adultas de la especie pipiens (figura 16). Se diseco el fascículo tónico del músculo cruralis 42 Figura 16 rana pipiens Las ranas se sacrificaron por decapitación, con posterior desmedulación con estilete. Enseguida se diseco el músculo cruralis, colocándolo en una caja de petri con fondo de resina transparente (Sylgard). Se fijó el músculo con alfileres entomológicos (minuties) al fondo de la cámara, bañado por solución Ringer normal (Véase soluciones). Bajo microscopio estereoscópico se retiró el exceso de tejido conectivo del músculo para obtener fascículos delgados (0.5 – 1.0 mm de grosor). Soluciones La solución Ringer normal (en mM): NaCl 117.5; KCl 25; CaCl2 1.8; la solución fue ajustada a un pH de 7.4 con Imidazol-Cl 2 mM. En la solución alto potasio (40 mM): fue preparada sustituyendo equimolarmente el sodio por el potasio de la solución normal. La solución de cafeína: se realizo con la solución Ringer normal agregando volúmenes necesarios de cafeína para obtener las concentraciones requeridas a partir de soluciones madre, se utilizaron a dos concentraciones (4 y 8 mM). 43 Registro de contractura por cafeína: La preparación del músculo fue colocada en una cámara de registro experimental, la cual consta de dos depósitos, uno con dos placas deslizables para colocación de la preparación y las placas deslizables se ajustan a la anchura del canal para la perfusión de las soluciones de registro y otro depósito donde se retiran las soluciones. El músculo se fijo por el extremo proximal al fondo de la cámara y el extremo distal al gancho del transductor mecanoeléctrico (Transductor Cambridge Technology, Inc., series 400A force trasnducer system) conectado al amplificador (CyberAmp 320 Axon instruments). Se registro la tensión de la contractura muscular inducida por cafeína (a las concentraciones de 4 y 8 mM) con una duración de 4 minutos, se dio un período de recuperación (20 minutos), después se aplico el fármaco (ACPA 1 μM) para incubar la preparación durante 4 minutos, posteriormente se registro la tensión de la contractura inducida con solución de cafeína (4 y 8 mM) y el fármaco (ACPA 1 μM) con una duración de 4 minutos. Análisis de datos De las contracturas inducidas por cafeína a las concentraciones de 4 y 8 mM se midió la tensión máxima (tensión pico) y la tensión total (área bajo la curva de tensión). Realizando el análisis con computadora con procesador celeron, “software” Clampfit versión 9.0. Las mediciones fueron normalizadas con respecto a las contracturas control. Los valores se representan como media ± error estándar de la medida de 4 y 5 experimentos (n). La 44 significancia de los promedios se determinó empleando la prueba estadística “t” de Student, siendo considerados como significativos los valores de p<0.05. Resultados Con 4 mM de cafeína, la tensión máxima disminuyó hasta un 87.92 ± 10.65% (p= 0.063, n=4) y la tensión total se redujo a un 91.31 ± 9.22% (p= 0.1, n=4) con respecto al control. En la figura 17 se muestra un registro representativo de la tensión muscular inducida por cafeína (4mM) y el efecto del ACPA (1 μM) sobre la tensión inducida. Figura 17 registro de la tensión inducida por cafeína a 4 mM se muestra en línea negra, la tensión inducida por cafeína 4 mM más el agonista ACPA (1 μM) se muestra en línea roja En las contracturas musculares inducidas por cafeína (4 mM) 20 minutos después de la aplicación del agonista ACPA (1 μM), la tensión máxima disminuyó hasta un 80.46 ± 8.25% (p= 0.003, n=4) y la tensión total se redujo a un 80.81 ± 10.14% (p= 0.009, n=4) con respecto al control inicial. En la figura 18 se muestra un registro representativo. 45 Figura 18 Registro de la tensión muscular inducida con cafeína (4 mM) en línea negra; se muestra en azul el registro de la tensión inducida por cafeína 4 mM 20 minutos después de la aplicación del agonista ACPA 1 μM. Cuando se incrementó la concentración de cafeína a 8 mM, en presencia de ACPA 1 μM, la tensión máxima disminuyó hasta un 77. 56 ± 6.43 % (p= 0.008, n= 5) y la tensión total a 75.46 ± 5.55 % (p= 0.002, n=5) con respecto al control. En la figura 19 se muestra un registro representativo del efecto del ACPA a concentración de 1 μM en una contractura muscular inducida por cafeína (8 mM) en las fibras musculares de cruralis. Figura 19 Registro de la tensión muscular por la contractura inducida por cafeína en músculo cruralis de rana en color negro; la tensión muscular de la contractura inducida por cafeína 8 mM con el antagonista ACPA 1 μM se muestra de color rojo. 46 Estos resultados obtenidos nos sugieren que el canabinoide ACPA a concentración 1 µM afecta la liberación de calcio del retículo sarcoplásmico en las fibras musculares esqueléticas lentas de la rana. Perspectivas. De acuerdo a la literatura del campo se ha observado que el estudio del efecto de los canabinoides a nivel de sistema nervioso central es amplio y resalta como uno de los principales el de control motor. Las evidencias de los mecanismos donde los canabinoides ejercen efecto sobre el control del movimiento, se pueden ubicar en tres niveles: 1) en sistema nervioso central, 2) a nivel de placa neuromuscular y posiblemente en base a las evidencias antes mencionadas, 3) en el mecanismo de contracción muscular. A pesar de los numerosos estudios sobre el mecanismo por el cual los canabinoides ejercen su efecto en el control motor, a nivel de placa neuromuscular y en la contracción muscular, específicamente, es en el músculo esquelético donde es poco lo que se conoce hasta ahora. Los estudios de los efectos de los canabinoides en las contracturas inducidas por potasio y por cafeína en músculo esquelético sugieren que estos compuestos afectan el acople excitación contracción de las fibras musculares lentas aumentando el retardo en la liberación de Ca2+ del retículo sarcoplásmico, sin descartar una regulación de los otros componentes involucrados en el mecanismo de excitación contracción, sin embargo falta mucho por hacer para validar estos efectos. 47 Con la evidencia de la presencia de ARNm codificante para el receptor a canabinoide CB1 en músculo esquelético rápido y lento de rana y pollo, resulta importante realizar mayores estudios desde varios aspectos: 1) la caracterización del efecto de los canabinoides sobre el acople excitación-contracción en músculo esquelético lento y rápido, 2) determinar mediante inmunocitoquímica la presencia de los receptores canabinoides a nivel de la membrana de la terminal presináptica y en la membrana de la célula muscular, 3) caracterizar la vía de señalización desencadenada por la acción de los agonistas canabinoides, 4) cuantificación de las concentraciones de calcio en citoplasma en presencia de los canabinoides. 48 Bibliografía: 1. Alger, B. (2004). Endocannabinoids: Getting the message across. Proceedings of the National Academy of Sciences of the United States of America, 101 (23), 8512–8513. 2. Arévalo-Martín, A., Baño, M.D., Berrendo, F., Cabranes, A., Carrascosa, A.J., de Lago, E., Díaz-Laviada, I., Gómez, M., González, S., Guaza, C., Guzmán, M., LastresBecker, I., López-Rodríguez, M.L., Maldonado, R., Manzanares, J., Mato, S., MolinaHolgado, E., Núñez-Domínguez, L., Ortega-Gutiérrez, S., Pazos, A., Ramos, J.A., Romero, J., Sagrado, O., Puig, J.S., Viso, A., Viveros, P. (2002). Guía Básica sobre los cannabinoides. Madrid: Universidad Complutense de Madrid. 3. Auclair, N., Otani, S., Soubrie, P., y Crepel, F. (2000). Cannabinoids modulate synaptic strength and plasticity at glutamatergic synapses of rat prefrontal cortex pyramidal neurons. The Journal of Neurophysiology , 83 (6), 3287-3293. 4. Belssaso, G., Estañol, B., y Juárez, H. (2002). Nuevas estrategias Farmacológicas en el tratamiento de las adicciones. México: Secretaria de Salud. 5. Berchtold, M.W., Brinkmeier, H., y Müntener, M. (2000). Calcium Ion in Skeletal Muscle: Its Crucial Role for Muscle Function, Plasticity, and Disease. Physiological Reviews, 80 (3), 1216-1265. 6. Bhat, M.B., Zhao, J., Zang, W., Balke, C.W., Takeshima, H., Wier, W.G., y Ma, J. (1997). Caffeíne-induced release of intracellular Ca2+ from Chinese hamster ovary cell expressing skeletal muscle ryanodine receptor. Effects on full-length and carboxyl- 49 terminal portion of Ca2+ release channels. The Journal of General Physiology, 110 (6), 749-762. 7. Bisogno, T., Melck, D., Bobrov, M.Y., Gretskaya, N.M., Bezuglov, V.V., De Petrocellis, L., Di Marzo, V. (2000). N-acyl-dopamines: novel synthetic CB1 cannabinoid-receptor ligands and inhibitor of anandamide inactivation with cannabimimetic activity in vitro and in vivo. Biochemical Journal, 351, 817-824. 8. Bonhaus, D.W., Chang, L.K., Kwan, J., y Martin, G.R. (1998). Dual activation and inhibition of adenylyl cyclase by cannabinoid receptor agonists: evidence for agonistspecific trafficking of intracellular responses. The Journal of Pharmacology and Experimental Therapeutics, 287 (3), 884-888. 9. Bouaboula M, Poinot-Chazel C, Marchand J, Canat X, Bourrie B, Rinaldi-Carmona M, Calandra, B., Le Fur, G., y Casellas, P. (1996). Signaling pathway associated with stimulation of CB2 peripheral cannabinoid receptor. Involvement of both mitogenactivated protein kinase and induction of Krox-24 expression. European Journal of Biochemistry, 237 (3),704-11. 10. Bouaboula, M., Poinot-Chazel, C., Bourrie, B., Canat, X., Calandra, B., RinaldiCarmona, M., Le Fur, G., y Casellas, P. (1995). Activation of mitogen-activated protein kinases by stimulation of the central cannabinoid receptor CB1. Biochemical Journal, 312, 637–641. 11. Breivogel, C.S., Griffin, G., Di Marzo, V., y Martin, B.R. (2001). Evidence for a new G protein-coupled cannabinoid receptor in Mouse brain. Molecular Pharmacology, 60 (1), 155-162. 50 12. Chemin, J., Monteil, A., Perez-Reyes, E., Nargeot, J., y Lory, P. (2001). Direct inhibition of T-type calcium channels by the endogenous cannabinoid anandamide. The European Molecular Biology Organization Journal, 20 (24), 7033-7040. 13. De Petrocellis, L., Cascio, M.G., y Di Marzo, V. (2004). The endocannabinoid system: a general view and latest additions. British Journal of Pharmacology, 141, 765-774 14. Devane, W.A., Hanus, L., Breuer, A., Pertwee, R.G., Stevenson, L.A., Griffin, G., Gibson, D., Mandelbaum, A., Etinger, A., y Mechoulam, R. (1992). Isolation and structure of a brain constituent that binds to the cannabinoid receptor. Science, 258, 1946-1949. 15. Drogas ilícitas. (2002). La Salud en las Américas, p. 200. 16. Egertóva, M., Giang, D.K., Cravatt, B.F., y Elphick, M.R. (1998). A new perspective on cannabinoid signaling: complementary localization of fatty acid amide hydrolase and the CB1 receptor in rat brain. Proceedings of the Royal Society B: Biological Sciences, 265, 2081-2085. 17. Elphick, M.R., y Egertová, M. (2001). The neurobiology and evolution of cannabinoid signaling. Philosophical Transactions of the Royal Society B: Biological Sciences 356, 381-408. 18. Favero, T.G. (1999). Sarcoplasmic reticulum Ca2+ release and muscle fatigue. Journal of Applied Physiology, 87, 471-483. 19. Fegley, D., Kathuria, S., Mercier, R., Li,C., Goutopoulos, A., Makriyannis, A., y Piomelli, D. (2004). Anandamide transport is independent of fatty-acid amide hydrolase activity and is blocked by the hydrolysis-resistant inhibitor AM 1172. . Proceedings of the National Academy of Sciences of the United States of America, 101 (23), 8756-8761. 51 20. Felder, C., y Glass, M. (1998). Cannabinoid receptor and their endogenous agonist. Annual Review of Pharmacology and Toxicology, 38, 179-200. 21. Felder, C.C., Briley, E.M., Axelrod, J., Simpson, J.T., Mackie, K., y Devane, W.A. (1993). Anandamide, an endogenous cannabimimetic eicosanoid, binds to the cloned human cannabinoid receptor and stimulates receptor-mediated signal transduction. . Proceedings of the National Academy of Sciences of the United States of America, 90, 7656-7660. 22. Franzini-Armstrong, C. (1999). The sarcoplasmic reticulum and the control of muscle contraction. The FASEB Journal, 2, 266-270. 23. Freund, T.F., Katona, I., y Piomelli, D. (2003). Role of endogenous cannabinoids in synaptic signaling. Physiological Reviews, 83, 1017-1066. 24. Gaoni, Y. y Mechoulam, R. (1964). Isolation, structure and partial synthesis of an active constituent of hashish. Journal of the American Chemical Society, 86, 16461647. 25. Gebremedhin, D., Lange, A.R., Campbell, W.B., Hillard, C.J., y Harder, D.R. (1999). Cannabinoid CB1 receptor of cat cerebral arterial muscle functions to inhibit L-type Ca2+ channel current. American Journal of Physiology-Heart and Circulatory Physiology, 276, H2085-H2093. 26. Giuffrida, A., Beltramo, M., y Piomelli, D. (2001). Mechanisms of endocannabinoid inactivation: biochemistry and pharmacology. The Journal of Pharmacology and Experimental Therapeutics, 298 (1), 7-14. 27. Glaser, S.T., Abumrad, N.A., Fatade, F., Kaczocha, M., Studholme, K.M., y Deutsch, D.G. (2003). Evidence against the presence of an anandamide transporter. Proceedings 52 of the National Academy of Sciences of the United States of America, 100, (7), 42694274. 28. Hajos, N., Ledent, C., y Freund, T.F. (2001). Novel cannabinoid-sensitive receptor mediates inhibition of glutamatergic synaptic transmission in the hippocampus. Neuroscience, 106 (1), 1-4. 29. Hanus, L., Abu-Lafi, S., Fride, E., Breuer, A., Vogel, Z., Shalev, D.E., Kustanovich, I., y Mechoulam, R. (2001). 2-Arachidonyl glyceryl ether, an endogenous agonist of the cannabinoid CB1 receptor. Proceedings of the National Academy of Sciences of the United States of America, 98 (7), 3662-3665. 30. Herkenham, M., Lynn, A.B., Little, M.D., Johnson, M.R., Melvin, L.S., de Costa, B.R., y Rice, K.C. (1990). Cannabinoid receptor localization in brain. Proceedings of the National Academy of Sciences of the United States of America, neurobiology, 87, 1932-19636. 31. Hoekman, T.B., Dettbarn, W.D., y Klausner, H.A. (1975). Actions of Δ9tetrahydrocannabinol on neuromuscular transmission in the rat diaphragm. Neuropharmacology, 15, 315-319. 32. Howlett, A.C. y Fleming, R.M. (1984). Cannabinoid inhibition of adenylate cyclase. Pharmacology of the response in neuroblastoma cell membranes. Molecular Pharmacology, 26 (3), 532-538. 33. Iversen, L. (2003). Cannabis and the brain. Brain, 126 (6), 1252-1270 34. Kandel, E.R., Schwartz, J.H., Jessell, T.M. (2000). Trasmitter release. En: Principles of neural science (4a Ed.) (pp: 253-279). USA: McGraw-Hill Medical. 53 35. Katona, I., Rancz, E.A., Acsády, L., Ledent, C., Mackie, K., Hájos, N., y Freund, T.F. (2001). Distribution of CB1 Cannabinoid Receptors in the Amygdala and their Role in the Control of GABAergic Transmission. The Journal of Neuroscience, 21 (23), 95069518. 36. Kayaalp, S.O., Kaymakcalan, S., Verimer, T., Ilhan, M., y Onur, R. (1974). In vitro neuromuscular effects of delta9-trans-tetrahydrocannabinol (THC). Arch Int Pharmacodyn Ther., 212 (1), 67-75. 37. Mackie, K., Lai, Y., Westenbroek, R., y Mitchell, R. (1995). Cannabinoids activate an inwardly rectifying potassium conductance and inhibit Q-type calcium currents in AtT20 cells transfected with rat brain cannabinoid receptor. The journal of neuroscience, 15 (10), 6552-6561. 38. Mackie, K., y Hille, B. (1992). Cannabinoid inhibit N-type calcium channels in neuroblastoma-glioma cells. Proceedings of the National Academy of Sciences of the United States of America, 89 (9), 3825-9. 39. Matias, I., Pochard, P., Orlando, P., Salzet, M., Pestel, J., y Di Marzo, V. (2002). Presence and regulation of the endocannabinoid system in human dendritic cells. European Journal of Pharmacology, 269, 3771-3778. 40. Matsuda, L.A., Lolait, S.J., Brownstein, M.J., Young, A.C., y Bonner, T.I. (1990). Structure of a cannabinoid receptor and functional expression of the cloned DNA. Nature, 346 (6284), 561-4. 41. McAllister, S. D., Griffin G., Satin, L.S., y Abood, M.E. (1999). Cannabinoid receptors can activate and inhibit G protein-coupled inwardly rectifying potassium channels in a xenopus oocyte expression system. The Journal of Pharmacology and Experimental Therapeutics, 291 (2), 618-626. 54 42. Muñiz, J., Huerta, M., Dueñas, J., Trujillo, X., y Elizalde, A. (1992). Caffeine and Theophylline Contractures in Tonic Skeletal Muscle Fibers of the Frog. Japanese Journal of Physiology, 42, 711-720. 43. Munro, S., Thomas, K.L., y Abu-Shaar, M. (1993). Molecular characterization of a peripheral receptor for cannabinoids. Nature, 365 (6441), 12-3. 44. Netzeband, J.G., Conroy, S.M., Parsons, K.L., y Gruol, D.L. (1999). Cannabinoids enhance NMDA-elicited Ca2+ signals in cerebellar granule neurons in culture. The Journal of Neuroscience, 19 (20), 8765-8777. 45. Neurociencia del consumo y dependencia de sustancias psicoactivas. (2004). Organización Mundial de la Salud Ginebra. Suiza: Organización Mundial de la Salud. 46. Patel, S., Rademacher, D.J., Hillard, C.J. (2003). Differential Regulation of the Endocannabinoids Anandamide and 2-Arachidonylglycerol within the Limbic Forebrain by Dopamine Receptor Activity. The Journal of Pharmacology and Experimental Therapeutics, 306 (3), 880-888. 47. Pertwee, R.G. (2001). Cannabinoid receptor ligands. Tocris review, 16. 48. Porter, A.C., Sauer, J-M, Kinierman, M.D., Becker, G.W., Berna, M.J., Bao, J., Nomikos, G.G., Carter, P., Bymaster, F.P., Leese, A.B., y Felder, C.C. (2002). Characterization of a Novel Endocannabinoid, Virodhamine, with Antagonist Activity at the CB1 Receptor. The Journal of Pharmacology and Experimental Therapeutics, 301 (3), 1020-1024. 49. Purves, D., Augustine, G.J., Fitzpatrick, D., Katz, L.C., LaMantia, A.-S., McNamara, J.O., Williams, S.M. (2001). Neuroscience. Sunderland (MA): Sinauer Associates, Inc. 55 50. Rodríguez de Fonseca, F., Del Arco, I., Bermudez-Silva, F.J., Bilbao, A., Cippitelli, A., y Navarro, M. (2005). The endocannabinoide system: physiology and pharmacology. Alcohol & alcoholism, 40 (1), 2-14. 51. Rodriguez de Fonseca, F., Del Arco, I., Martín-Calderón, J.L., Gorriti, M.A., y Navarro, M. (1998). Role of the endogenous Cannabinoid System in the Regulation of Motor Activity. Neurobiology of Disease, 5, 483-501. 52. Sánchez-Pastor, E., Trujillo, X., Huerta, M., Castro, E., Vásquez, C., y Andrade F. (2004). Presence of mRNA for cannabinoid receptor (CB1) in frog and chicken skeletal muscle fibers (2179-Pos/B276). Abstract, Biophysical society 48th Annual Meeting. Baltimore. 53. Sánchez-Pastor, E., Trujillo, X., Huerta, M., Vásquez, C., Castro, E., y Andrade F. (2005). Effects of WIN55,212-2 and ACPA on frog neuromuscular transmisión (1497Pos/B483). Abstract. Biophysical Society 49th Annual Meeting. Long Beach, California. 54. Siegel, G. J., Agranoff, B.W., Albers, R.W., Fisher, S.K., y Uhler, M.D. (1999). Basic Neurochemistry, Molecular, Cellular, And Medical Aspects. Philadelphia: Lippincott,Williams & Wilkins. 55. Spinella, M. (June 2001). The Psychopharmacology of Herbal Medicines: Plant Drugs That Alter Mind, Brain, and Behavior. Cambridge: MIT Press 56. Stella, N. y Piomelli, D. (2001). Receptor-dependent formation of endogenous cannabinoids in cortical neurons. European Journal of Pharmacology, 425 (3), 189196. 56 57. Sullivan, J.M. (1999). Mechanisms of Cannabinoid-Receptor-Mediated Inhibition of Synaptic Transmission in Cultured Hippocampal Pyramidal Neurons. Journal of Neurophysiology, 82, 1286-1294. 58. Svendsen, K.B. Jensen, T.S., y Bach, F.W. (2004). Does the cannabinoid dronabinol reduce central pain in multiple sclerosis? Randomized double blind placebo controlled crossover trial. British Medical Journal, 329 (7460), 253-260. 59. Szabo, B., Than, M., Thorn, D., y Wallmichrath, I., (2004). Analysis of the effects of cannabinoids on synaptic transmission between basket and purkinje cells in the cerebellar cortex of the rat. The Journal of Pharmacology and Experimental Therapeutics, 310, 915-925. 60. Tsuo, K., Brown, S., Sañudo-Peña, M.C., Mackie, K., y Walker, J.M. (1998). Immunohistochemical Distribution of Cannabinoid CB1 Receptors in the Rat Central Nervous System. Neuroscience, 83 (2), 393-411. 61. Van der Kloot, W. (1994). Anandamide, a naturally-occurring agonist of the cannabinoid receptor, blocks adenylate cyclase at the frog neuromuscular junction. Brain research, 649, 181-184. 62. Vásquez, C., Velasco, R., Huerta, M., Trujillo, X., Marín, J.L., Andrade, F., y Hernández, L. (2000). Effect of cannabinoids on slow skeletal muscle fibers of the frog (812.6). Abstract Viewer/Itinerary Planner. Society for Neurocience. Online. 63. Velasco, R., Vasquez, C., Trujillo, X., y Huerta., M. (2002). Effect of cannabinoids on excitation-contraction coupling in fast skeletal muscle fibers of the frog (857.3). Abstract Viewer/Itinerary Planner. Washington, DC: Society for Neuroscience. Online. 64. Voth, E.A. y Schwartz, R. H. (1997). Medicinal Applications of Delta-9Tetrahydrocannabinol and Marijuana. Annals of Internal Medicine, 126 (10), 791-798. 57 65. Watson, S.J., Benson, J.A. Jr, Joy, J.E. (2000). Marijuana and medicine: assessing the science base: a summary of the 1999 Institute of Medicine report. Archives of General Psychiatry, 57, 547-552. 66. Whilson, R.I., y Nicoll, R.A. (2002). Endocannabinoide signaling in the brain. Science, 296, 678-682. 67. Zimmer, A., Zimmer, A. M., Hohmann, A.G., Herkenham, M., y Bonner, T.I. (1999). Increased mortality, hypoactivity, and hypoalgesia in cannabinoid CB1 receptor knockout mice. Proceedings of the National Academy of Sciences of the United States of America, Neurobiology, 96 (10), 57805785. 68. Zygmunt, P.M., Petersson, J., Andersson, D.A., Chuang, H., Sorgard, M., Di Marzo, V., Julius, D. y Hogestatt, E.D. (1999). Vanilloid receptors on sensory nerves mediate the vasodilator action of anandamide. Nature, 400 (6743), 452-7. Sitios visitados de internet. 69. Boletín de IACM, enero (2005). Obtenido de la red mundial en mayo del 2005: http://www.acmed.org/spanish/home.htm 70. Catálogo de productos en canabinoides, obtenido de la red mundial en junio del 2005: http://www.tocris.com/shop/Catalogue.php?ItemId=47351 71. FDA Drug and Biologics Approvals (1992). Obtenido de la red mundial en mayo del 2005: http://www.fda.gov/bbs/topics/ANSWERS/ANS00463.html 72. Salud en las Américas, México (1998). Obtenido de la red mundial en mayo del 2005: http://www.paho.org/spanish/HIA1998/Mexico.pdf 58