Termodinámica Energía Trabajo mecánico: Calor:
Anuncio
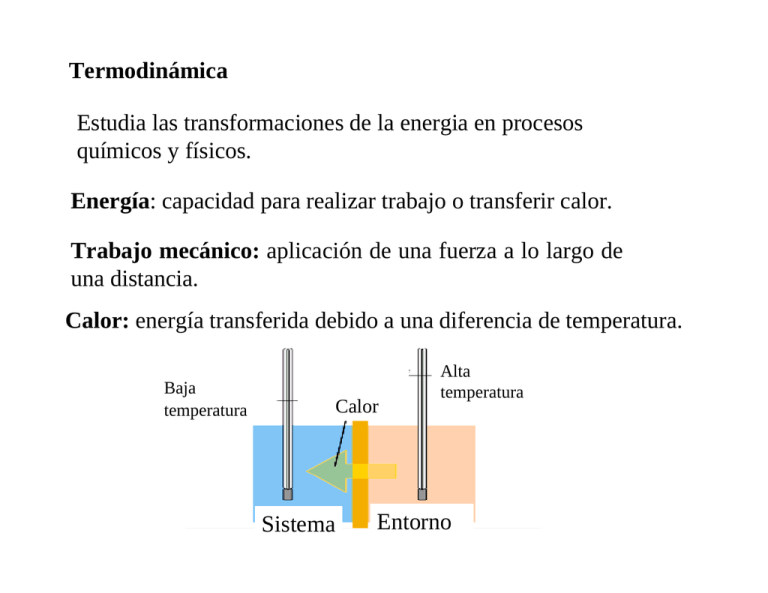
Termodinámica Estudia las transformaciones de la energia en procesos químicos y físicos. Energía: capacidad para realizar trabajo o transferir calor. Trabajo mecánico: aplicación de una fuerza a lo largo de una distancia. Calor: energía transferida debido a una diferencia de temperatura. Baja temperatura Calor Sistema Alta temperatura Entorno Sistema: porción del universo seleccionada para su estudio. Entorno: lo que está alrededor del sistema. Sistemas abiertos cerrados aislados abierto cerrado aislado intercambian masa y Energía con el entorno intercambian Energía con el entorno no intercambian ni masa ni Energía con el entorno sistema abierto : cuerpo humano, automóviles sistema cerrado : baterías. sistema aislado: termos Sistema adiabático: no intercambia calor con el entorno. Universo: sistema +entorno. altitud Funciones de estado: dependen sólo del estado del sistema y no del camino por el que se llegó a ese estado. Ej.: P, V, T. d2 d1 ∆h Las distancias recorridas (d1, d2) no son funciones de estado. La diferencia de altura (∆h) entre dos puntos si es función de estado. Propiedades de las funciones de estado: 1. Fijando los valores de algunas de ellas quedan fijadas todas las demás. 2. Los cambios en las funciones de estado dependen sólo del estado final e inicial. Las conclusiones termodinámicas en cuanto a las posibilidades de cambio de un sistema están basadas en los cambios que acompañan a las funciones de estado. Calor específico (C): cantidad de calor requerida para elevar 1 grado centígrado la temperatura de 1 gr de sustancia ∆q C= m∆t m : masa de sustancia ∆t : diferencia de temperatura Ej.:agua , C = 1 cal/gr 0 reordenando se puede calcular la cantidad de calor de un proceso ∆q = mC∆t Capacidad calorífica: cantidad de calor requerida para elevar 1 grado centígrado la temperatura de un mol de sustancia [c] =cal/ 0 mol Medida de los cambios de calor. Calorimetría Calorímetro adiabático: no intercambia calor con el exterior Σq = 0 mc∆t + E∆t + Qreacción = 0 Calor absorbido o cedido por el agua contenida en el calorímetro Calor absorbido o cedido por distintas partes del calorímetro Calor y trabajo Experimento de Joule Midió la conversión de energía mecánica en calor. Pesas que caen hacen girar un conjunto de paleta y calientan el agua. Con el peso de los cuerpos y su descenso se mide el trabajo mecánico y con la masa de agua y su elevación de T se calculó el calor. 1 cal = 4,18 joules. 1 cal = 4,18 joules Aparato empleado por Joule en la medición del equivalente mecánico del calor. Las masas conocidas m se enrollan por medio de la manivela sobre el cilindro. La cuerda pasa por dos poleas P perfectamente bien engrasadas. La altura de las masas sobre el suelo es conocida, y la temperatura del agua se controla mediante el termómetro. Trabajo (w) w = fuerza x distancia Trabajo presión-volumen de un gas: El gas realiza trabajo contra la presión externa P Presión externa (P) Pistón Cambio de volumen ∆V d2 d1 A w = fuerza x distancia= Fext (d2 – d1)= (Fext /A)(d2 – d1)A= Pext (V2 –V1) = Pext ∆V Convención termodinámica W = - P∆V Cuando el sistema realiza trabajo durante la expansión (∆V > 0) el trabajo tiene signo negativo Expansión y compresión de un gas ideal Compresión Expansión disminución de volumen, el entorno realiza trabajo sobre el sistema aumento de volumen, el sistema realiza trabajo sobre el entorno w >0 w<0 V2 < V1 V2 > V1 ∆V = V2 – V1 < 0 ∆V = V2 – V1 > 0 W = -P ∆V > 0 W = -P ∆V < 0 ∆E= q + w = q - P∆V V2 es el volumen final y V1 el volumen inicial El trabajo no es función de estado, depende del camino 10 P(atm) 10 P(atm) 8 6 5 4 2 0 0 0 2 4 6 8 10 12 V(litros) a) Expansión irreversible en una etapa W = -1atm(10-1)litros=-9 (l.atm) 0 2 4 6 8 10 V(litros) b) Expansión irreversible en dos etapas W1 = -5atm(2-1)litros=-5 (l.atm) W2 = -1atm(10-2)litros=-8 (l.atm) WT = W1 + W2 = -13 (l.atm) El trabajo realizado por el sistema es mayor en dos etapas que en una sola 10 8 8 P(atm) P(atm) 10 6 4 2 0 6 4 2 0 2 4 6 8 10 0 0 2 V(litros) w = −(∑ p∆V ) 4 6 8 10 V(litros) Para un cambio infinitesimal en la presión (proceso reversible) 10 P(atm) 8 6 w = − ∫ pext dV 4 2 0 0 2 4 6 8 10 V(litros) pext≅pgas nRT ⎡ V 2⎤ = − ∫ pext dV = − ∫ dV = − nRT ⎢ln ⎥ V 1 V ⎣ ⎦ v1 v1 v2 wrev v2 Trabajo máximo de expansión isotérmica de un gas ideal Primera ley de la termodinámica Ley de conservación de la energía. La energía total del universo permanece constante. ∆Ε = q + w ∆E cambio en la energía interna q > 0 El sistema absorbe calor del entorno q< 0 El sistema libera calor al entorno w > 0 El entorno realiza trabajo sobre el sistema w < 0 El sistema realiza trabajo sobre el entorno ∆Ε > 0 El sistema absorbe energía del entorno ∆Ε < 0 El sistema libera energía al entorno Convención moderna ∆E = q + w w = -P∆V Convención antigua ∆E = q - w w = P∆V w>0 w<0 Trabajo realizado por el entorno sobre el sistema Trabajo realizado por el entorno sobre el sistema w<0 w>0 Trabajo realizado por el sistema sobre el entorno Trabajo realizado por el sistema sobre el entorno q < 0 calor cedido por el sistema al entorno q > 0 calor absorbido por el sistema desde el entorno Energía interna, E Estado final ∆E Trabajo , w Calor, q Estado inicial ∆E = q + w Reservas de energía interna Sistema Calor ∆E= q - P ∆V A V cte, ∆E = qv qv = Cv ∆t ∆E = Cv ∆t Trabajo Entalpía H = E + PV ∆H = ∆E + ∆(PV) A p cte ∆H = ∆E +P ∆V ∆E = q + w ∆H = q + w +P ∆V= q - P ∆V+ P ∆V A P cte ∆H = qp ∆H = Cp ∆t • Transformaciones isotérmicas (T cte) Paredes adiabáticas P= 0 ∆E = 0 • w = 0. q = 0 Transformaciones isotérmicas ∆E = 0 • Transformaciones adiabáticas (q=0) ∆E = q + w = 0 - P∆V ∆H = ∆E + ∆(PV) = -P∆V + P∆V = 0 a p cte Transformaciones a p y T cte ∆H = ∆E +∆(PV) = ∆E + P∆V Gases P∆V = ∆nRT a T cte ∆H = ∆E + ∆nRT Líquidos y sólidos ∆V≈0; P∆V ≈0; ∆H = ∆E


