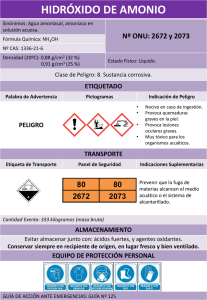
REPORTE DE RESULTADOS Nombres: Chapi Mamani Josué Diego (100%) Ttito Imata David Samuel (100%) Grupo: 1 CUESTIONARIO 1. Cuantos gramos de propano hay en un balón de 10 litros en condiciones normales 2. Un barómetro de mercurio indica una presión atmosférica de 570 mm Hg a 20º C en Arequipa. ¿Cuál será la presión de Arequipa expresada en Pascales, y en atmósferas; sabiendo que el Hg a 20º C tiene una densidad de 13,545 g/cm3 3. El volumen de una muestra de HCl gaseoso puro fue de 189 ml. A 25 ªC y 180 mmHg. Se disolvió completamente en 60 ml. De agua y se tituló con una solución de hidróxido de sodio, para neutralizar el ácido clorhídrico. Calcule la molaridad del de la solución de hidróxido de sodio 4. En un balón de acero de 5 litros de capacidad se introducen 28 g de nitrógeno y 24 g de oxígeno a 127 ºC. determinar la presión de la mezcla gaseosa y la presión parcial de cada gas en Pascales y atmósferas ● Diámetro de émbolo: 2,5 cm = 25 ∗ 10−3 m, el radio = 12.5 ∗ 10−3 m ● Área de la base de la jeringa: A = 𝜋 ∗ 𝑟2 = 3,1416 ( 12,5*10^-3 m)^2 = 7,0686*10^-4 m2⇒ 7 ∗ 10−4 ● Presión barométrica: en N/m2 Pbar =102524,901 N/m2 ● Presión interna, fuerza de émbolo sobre el fondo de la jeringa ( masa en kg, aceleración de gravedad 9,8 m/s2 Pi(1) = (m1 g)/A Pi(2) = (m1 + m2) g/A Pi(3) = (m1 + m2 + m3) g/A , etc. ● Presión absoluta: Pabs(1) = Pi(1) + Pbar Pabs(2) = Pi(2) + Pbar Pabs(3) = Pi(3) + Pbar , etc Presión interna (N/m^2) Presión abs Presión abs 64,3 ∗ 10−3 900,2 103425,101 4447249,343*10^-6 42*^10^-6 699,2 ∗ 10−3 10689 113213,901 4754983,842*10^-6 3 40*10^-6 1337 ∗ 10−3 29407 131931,901 5277276,04*10^-6 4 37*10^-6 2112 ∗ 10−3 58975 161499,901 5975496,337*10^-6 5 30*10^-6 2880 ∗ 10−3 99295 201819,901 6054597,03*10^-6 Nro Volumen (m^3) 1 43*10^-6 2 Masa total (Kg) Realizar la gráfica correspondiente (V contra P) Experimento Nº 2 Volumen del balón Vm = 250 cm3 Volumen total Vt = Vm + (Vf – Vi) Item Temperatura C Vi( cm^3) Vf(cm^3) Vt(cm^3) V / T = K (cm3/K) 1 16 0 5 255 255 = 0,882 16 + 273 2 17,1 0 8 258 258 = 0,889 17,1 + 273 3 20,5 0 10,7 260,7 260,7 = 0.888 20,5 + 273 4 21,8 0 14 264 264 = 1,020 21,8 + 237 Experimento Nº 3 Anotar e indicar que conclusión daría al respecto Al calentarse el hidróxido de amonio para evaporarlo, se liberó el amonio y posteriormente se pasó por un tubo dobles a la mezcla de agua destilada y fenolftaleína. Seguidamente, se puede observar como los tubos adquirían un color rosa (Difusión gaseosa) Formula la ecuación respectiva 𝐿𝐿𝐿 𝐿𝐿 𝐿𝐿𝐿ℎ𝐿𝐿 = 𝐿𝐿 𝐿𝐿 =√ 𝐿𝐿 𝐿𝐿 Tiempo que demora en aparecer la aceleración 29 segundos Calcula la velocidad de la difusión Primer tramo=8 cm Segundo Tramo= 11 cm 𝐿𝐿𝐿𝐿𝐿𝐿𝐿𝐿𝐿 = √82 + 112 = 13,601𝐿𝐿 13,601𝐿𝐿 = 0.13601𝐿 𝐿 = 𝐿/𝐿 = 0.13601/29 = 0.00469