SESION6ClasificacionynomenclaturadelasenzimasSitioactivoRegulacionenzimatica
Anuncio
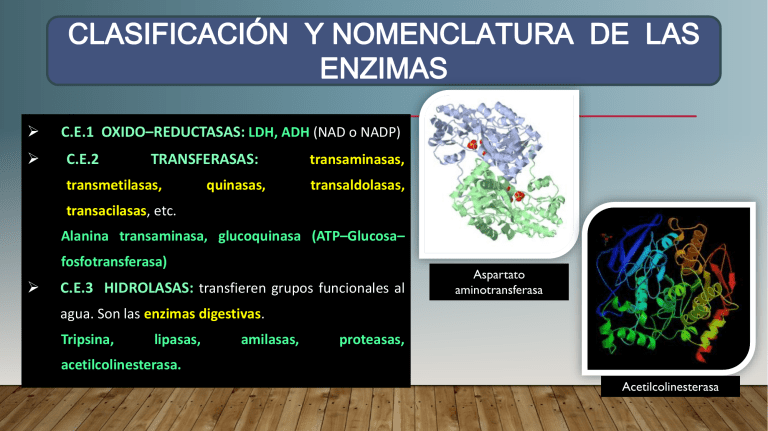
CLASIFICACIÓN Y NOMENCLATURA DE LAS ENZIMAS C.E.1 OXIDO–REDUCTASAS: LDH, ADH (NAD o NADP) C.E.2 TRANSFERASAS: transmetilasas, quinasas, transaminasas, transaldolasas, transacilasas, etc. Alanina transaminasa, glucoquinasa (ATP–Glucosa– fosfotransferasa) C.E.3 HIDROLASAS: transfieren grupos funcionales al Aspartato aminotransferasa agua. Son las enzimas digestivas. Tripsina, lipasas, amilasas, proteasas, acetilcolinesterasa. Acetilcolinesterasa … Clasificación y nomenclatura de las enzimas C.E.4 LIASAS: adición de grupos a dobles enlaces o formación de dobles enlaces x eliminación de grupos. No hay hidrólisis ni oxidación (desarboxilaciones, desaminaciones). Piruvato descarboxilasa, aldolasa, fumarato hidratasa (fumarasa). C.E.5 ISOMERASAS: Reacciones de isomerización. Según Fumarato hidratasa el tipo de isomería que catalizan se denominan racemasas, epimerasas, cis– trans–isomerasas, tautomerasas, mutasas. Fosfofructoisomerasa, alanina racemasa, triosa-fosfato-isomerasa. Alanina racemasa … Clasificación y nomenclatura de las enzimas C.E.6 LIGASAS: Catalizan la ligadura o unión de dos sustratos. Formación de enlaces C-C, Glutamina sintetasa (12 sub unidades) C-S, C - O y C - N mediante reacciones de condensación acopladas a la ruptura de la molécula de ATP. Glutamina sintetasa, citrato sintetasa, piruvato carboxilasa (piruvato - dióxido de carbono ligasa). Piruvato carboxilasa (tetrámero) … Clasificación y nomenclatura de las enzimas Los estudios sobre la especificidad de sustrato de las enzimas han conducido al concepto de la existencia de una complementariedad. Una relación como la de “la llave y la cerradura” entre la molécula de sustrato y una zona específica situada sobre la superficie de la molécula de enzima, llamada Sitio Activo o Sitio Catalítico o Centro Activo. Se Forma el complejo Enzima – Sustrato (ES). … el sitio activo … el sitio activo 1) PROXIMIDAD y ORIENTACIÓN del sustrato al sitio catalítico. El sustrato debe acercarse y orientarse de manera precisa al sitio activo de la enzima. 2) TENSIÓN y DISTORSION del enlace susceptible. El sustrato induce un cambio conformacional en la enzima, la que a su vez tensiona al sustrato para transformarlo. 3) CATÁLISIS ACIDO-BASE GENERAL, es la aceleración de una reacción que se logra por la transferencia de un protón. Depende del pH. Los sitios activos de las enzimas tienen grupos de cadenas laterales que actúan como donadores o aceptores de protones. 4) CATÁLISIS COVALENTE, en donde algunas enzimas reaccionan con sus sustratos para formar complejos Enzima-Sustrato (ES) unidos por covalencia, que al ser inestables forman los productos de la reacción. ZIMÓGENOS: Precursores inactivos que deben ser modificados covalentemente para volverse activos. La activación es en parte autocatalítica ya que cuando una pequeña parte de la enzima es activada, ésta activa al resto del cimógeno. Son principalmente las enzimas digestivas proteolíticas, y la activación se desencadena como consecuencia de la llegada de los alimentos al tubo digestivo. El pepsinógeno es activado por los iones H+ del estómago a PEPSINA activa. Tripsinógeno El tripsinógeno es activado por la enteropeptidasa a TRIPSINA activa. Una vez activada, la tripsina activa a otros cimógenos pancreáticos como el quimotripsinógeno y proelastasa a QUIMOTRIPSINA y ELASTASA respectivamente. La trombina es una enzima proteolítica que existe bajo una forma inactiva: la PROTROMBINA. La protrombina es activada por la tromboquinasa a TROMBINA activa. La trombina cataliza la transformación del fibrinógeno en FIBRINA, lo cual provoca la coagulación de la sangre. … Regulación de la actividad enzimática Una molécula de enzima puede catalizar varios cientos e incluso millones de moléculas de sustrato. Las enzimas no modifican el equilibrio de reacción en las reacciones reversibles y disminuyen la energía de activación necesaria para que se produzca la reacción química. Además de la actividad catalítica, algunas enzimas poseen actividad reguladora. Aparte de su eficiencia catalítica y su especificidad, la actividad de estas enzimas puede ser regulada en forma reversible. … Regulación de la actividad enzimática Una enzima reguladora tiene un segundo sitio para la unión de ligandos fuera de su centro activo SITIO REGULADOR. Los sitios regulador y catalítico son regiones distintas de la proteína. En la mayor parte de los sistemas multienzimáticos, la primera enzima de la secuencia es la “enzima reguladora”; las demás enzimas de la secuencia, siguen a la enzima reguladora. Existen dos clases de enzimas reguladoras: Enzimas alostéricos o Regulados No Covalentemente. (Alostérico significa otro espacio, otro sitio) Enzimas regulados covalentemente. Las actividades de las enzimas reguladoras son sensibles a los inhibidores y a los activadores metabólicos. Existen sitios de unión múltiples en las enzimas reguladoras. Las enzimas alostéricas poseen un sitio catalítico, al que se une el sustrato y se transforma, pero también poseen uno o más sitios reguladores o alostéricos a los que se unen las moléculas de los metabolitos que ejercen el efecto regulador y que reciben el nombre de efectores o moduladores; éstos no son alterados químicamente por la enzima. Los moduladores alostéricos se fijan en forma no covalente a las enzimas que regulan. El efector o modulador altera la afinidad de la enzima por su sustrato, modificando su actividad catalítica. … caract. enzimas reguladoras y alostéricas En el sitio alostérico se unen sustancias que pueden activar o inhibir la actividad enzimática Modulador alostérico positivo – Modulador alostérico negativo. Con pocas excepciones, las enzimas reguladoras tienen estructura cuaternaria. Con frecuencia una enzima reguladora se puede desnaturalizar parcialmente in vitro con pérdida de sus propiedades reguladoras, pero no con pérdida de su actividad catalítica. … caract. enzimas reguladoras y alostéricas En algunos casos el sustrato y el efector son los mismos compuestos: SISTEMA HOMOTRÓPICO en otros casos son diferentes: SISTEMA HETEROTRÓPICO. Este proceso, llamado DESENSIBILIZACION, refuerza la conclusión de que los sitios catalítico y regulador tienen lugar en sitios diferentes de la Ribonucleótido reductasa enzima. Ej.: Ribonucleótido reductasa, piruvato UDP – N acetilglucosamina transferasa, aspartato carbamil transferasa, hexoquinasa, fosfofructoquinasa, acetil CoA carboxilasa, citrato sintasa, α – cetoglutarato deshidrogenasa, piruvato quinasa, entre otras. hexoquinasa … caract. enzimas reguladoras y alostéricas Control alostérico … enzimas alostéricas









