MANUAL TÉCNICO
ICACI
L
B
501
ÓN
PU
Programa Ampliado de
Inmunización Familiar y
Comunitaria
Serie: Documentos Técnico-Normativos
La Paz - Bolivia
2022
MANUAL TÉCNICO
ICACI
L
B
501
ÓN
PU
Programa Ampliado de
Inmunización Familiar y
Comunitaria
Serie: Documentos Técnico-Normativos
La Paz - Bolivia
2022
R-BO
QW806
M665m
No.501
2022
Bolivia. Ministerio de Salud y Deportes. Dirección de Epidemiologia.
Programa Ampliado de Inmunización Familiar y Comunitario.
Manual Técnico Programa Ampliado de Inmunización Familiar y Comunitario/
Ministerio de Salud y Deportes. Coaut. 3 ed. La Paz: Oruro Artes Graficas, 2022
420p.: ilus. (Serie: Documentos Técnico - Normativos No. 501 )
Depósito legal: 4-1-24-2022 P.O.
I. PROGRAMAS DE INMUNIZACIÓN
II. VACUNACIÓN MASIVA^sorganización & administración
III. VACUNAS^sprovisión y distribución
IV. ENFERMEDADES PREVENIBLES POR VACUNACIÓN^sprevención y control
V. PLANIFICACIÓN EN SALUD COMUNITARIA^smétodos
VI. DIRECTRICES PARA LA PLANIFICACIÓN EN SALUD
VII. POLÍTICAS PÚBLICAS DE SALUD
VIII. AGENCIAS GUBERNAMENTALES
IX. MANUAL
X. BOLIVIA
1. t.
2. Serie
MANUAL TÉCNICO PROGRAMA AMPLIADO DE INMUNIZACIÓN FAMILIAR Y COMUNITARIA
Puede obtenerse mayor información en htpp://www.minsalud.bo, Programa Ampliado de Inmunización Familiar
y Comunitaria , Calle Capitán Ravelo Nº 2199
Telf.: 2442473 - 2124231 – Fax: 2442473
R.M.: N° 0042
Depósito Legal: N° 4-1-24-2022 P.O.
ELABORACIÓN:
Programa Ampliado de Inmunización Familiar y Comunitaria (Anexo Editorial)
Lic. Rosmery Azurduy
Responsable PAI La Paz
Lic. Teresa Bonifaz
Gestora de Calidad del PAI
Dra. Pamela Callisaya
Responsable de Vigilancia PAI
Lic Claudia Carrizales
Gestora de Calidad del PAI
Lic. Juaquin Gironda
Logístico PAI
Dr Carlos Echazú Torres
Responsable de Vigilancia epidemiologica ESAVI
Dr. Max Enriquez
Responsable PAI Nacional
Ing. Efrain Loza
Responsable cadena de frio
Dr Jhemys Molina
Experto en sistemas de información
Comité de Identidad Institucional y Publicaciones
Dr. Alvaro Terrazas Peláez
Dr. Juan Marca Rodriguez Morales
Dra. Diana Noya Pérez
Dr. Dante David Ergueta Jiménez
Dra. Miriam Nogales Rodríguez
Dra. María del Carmen Del Carpio
Dra. Rosario Quiroga
Consultora PAI OPS
Lic. Paula Vera
Comunicadora PAI
Dr Adalid Zamora
Presidente CNI
Diseño Gráfico:
Lic Ilsen Castillo
Lic. María Salinas
Dra. Sdenka Maury Fernández
Dra. Tania Huanca Uluri
Lic. Rodrigo Omar Chipana Cortez
Lic. Mariel Silvana Churruarrin Orozco
Sr. Marcelo Martinez Quisbert
LA PAZ: Programa Ampliado de Inmunización Familiar y Comunitaria – Unidad de Prevencion y Control de
Enfermedades – Dirección General de Epidemiologia – Viceministerio de Promoción, Vigilancia Epidemiologica y
Medicina Tradional – Comité de Identidad Institucional y Publicaciones – Viceministerio de Gestión del Sistema
Sanitario – Ministerio de Salud y Deportes – 2022
©Ministerio de Salud y Deportes 2022
Esta publicación es propiedad del Ministerio de Salud y Deportes del Estado Plurinacional de Bolivia, se autoriza
su reproducción, total o parcial, a condición de citar la fuente y la propiedad.
Impreso en Bolivia
Autoridades
Dr. Jeyson Marcos Auza Pinto
MINISTRO DE SALUD y DEPORTES
Lic. María Renee Castro Cusicanqui
VICEMINISTRA DE PROMOCIÓN
VIGILANCIA EPIDEMIOLÓGICA Y
MEDICINA TRADICIONAL
Dra. Alejandra Lucia Hidalgo Ugarte
VICEMINISTRA DE SEGUROS DE
SALUD Y GESTIÓN DEL
SISTEMA ÚNICO DE SALUD
Dr. Álvaro Terrazas Peláez
VICEMINISTRO DE GESTIÓN
DEL SISTEMA SANITARIO
Dr. Freddy Armijo Zubieta
DIRECTOR GENERAL DE EPIDEMIOLOGÍA
Dra. Mariana Camila Ramírez López
JEFE DE UNIDAD DE PREVENCIÓN Y
CONTROL DE ENFERMEDADES
Dr. Max Enríquez Nava
RESPONSABLE DEL PROGRAMA
AMPLIADO DE INMUNIZACIÓN
Presentación
El Ministerio de Salud y Deportes pone a disposición del personal de salud el presente
Manual técnico del Programa Ampliado de Inmunización Familiar y Comunitario
con la finalidad de asegurar el acceso universal a una vacunación de calidad. Este
documento se constituye en el soporte técnico obligatorio para la ejecución de las
actividades de vacunación sean estas públicas o privadas.
Para la actualización del manual técnico se ha contado con el concurso de expertos
del Comité Nacional de Inmunización y del equipo técnico del PAI, tanto de los
niveles departamentales como del nivel nacional. Equipo de profesionales que
logró una combinación de conocimiento y experiencia que garantiza la solvencia
del mismo.
La vacunación es una de las herramientas más costo efectiva de la salud pública,
existen evidencias objetivas de su impacto en la salud de la población. A la fecha,
se han erradicado enfermedades como la Viruela y la Poliomielitis, eliminado el
Sarampión, la Rubéola y el Síndrome de Rubéola Congénita; están bajo control
epidemiológico la Difteria, Tos Ferina, Tétanos Neonatal, Fiebre Amarilla. Asimismo,
hay una disminución sostensible de meningitis, neumonías y diarreas graves en la
internación en hospitales y todo esto fue posible gracias a la vacunación infantil.
La vacunación es un bien público, y como tal, todas y todos los bolivianos tenemos
derecho a ser vacunados y el personal de salud es garante del cumplimiento del
derecho a la vacunación de calidad. Esto será posible con la aplicación de estas
normas.
Grandes son los esfuerzos del gobierno nacional en asegurar el abastecimiento de
vacunas e insumos para toda la población objetivo y en actualizar permanentemente
las normas técnicas, por lo que exhortamos al personal de salud a su fiel
cumplimiento y a los Gobiernos Autónomos Municipales a dar las condiciones
necesarias para que toda la población acceda a la vacunación segura.
Introducción
El manual técnico del Programa Ampliado de Inmunización Familiar Comunitaria es el
documento normativo que establece los procesos y procedimientos de la vacunación en todo
el sistema de salud, público, seguros a corto plazo y privados con o sin fines de lucro.
Este documento es actualizado periódicamente por el PAI Nacional con el asesoramiento del
Comité Nacional de Inmunización y la OPS a la luz de nuevas evidencias y la inclusión de
nuevas vacunas.
Los capítulos del manual técnico tienen un orden lógico que permite al personal de salud
introducirse en los conceptos básicos y más importantes del PAI, desde lo más general hasta
lo específico. En esta última versión actualizada se ha incluido los capítulos de: Sistema de
Información y de Comunicación Social.
El capítulo 1, Conociendo el PAI, expone el marco conceptual del programa, sus objetivos,
metas, visión, misión, marco legal y los componentes del programa. El capítulo 2, Conociendo
las vacunas, detalla conceptos básicos de la vacunación e inmunización. Posteriormente, en
el capítulo 3, Las vacunas del PAI, describe cada una de las vacunas aplicadas en el esquema
nacional, su composición, contraindicaciones y ESAVI.
En el capítulo 4, Estrategias de vacunación, se recomienda la aplicación de estrategias y
tácticas de vacunación siguiendo procesos de micro planificación local y en el marco de la
emergencia sanitaria.
El capítulo 5, Vigilancia epidemiológica, se expone las diferentes y complementarias
modalidades de vigilancia epidemiológica que deben realizarse en todos los niveles con
metas de control epidemiológico exigentes como son: la eliminación y erradicación.
El capítulo 6, Sistema de información del PAI, es un capítulo nuevo que incluye el registro
nominal electrónico de la vacunación - RNVe, y los indicadores que se construyen en cada
uno de los niveles y que permiten medir el desempeño mensual del PAI.
El capítulo 7, Cadena de frío, establece los procedimientos estrictos para asegurar el poder
inmunológico de las vacunas, conservándolas en cadena de frío de manera adecuada desde el
laboratorio de los productos hasta la vacunación de la población objetivo. De la misma forma,
el capítulo 8, Logística, se establece las normas de programación, distribución y control de
uso de las vacunas en cada uno de los niveles.
La capacitación, supervisión, monitoreo y evaluación, expuestos en el capítulo 9, ratifica la
importancia de la capacitación y del control de la gestión a través del monitoreo y supervisión
que permite al PAI mantener los logros alcanzados mediante la aplicación de medidas
correctivas.
Y finalmente, el capítulo 10, Comunicación social del PAI, explica la importancia de la
comunicación en el desarrollo estratégico de la vacunación, la planificación de acciones que
acompañen los procesos técnicos imprescindibles para la implementación del PAI en un
marco de autonomías y descentralización.
Los contenidos técnicos de cada capítulo han sido revisados y validados por los equipos
técnicos de los nueve SEDES.
Este manual técnico es referencia para consulta, procesos de capacitación y contiene los
estándares de calidad que se supervisan, auditan y evalúan.
Resolución Ministerial
Índice
1.
Conociendo al PAI
17
2.
Conociendo las vacunas
43
3.
Las vacunas del PAI
71
4.
Estrategias de vacunación
149
5.
Vigilancia epidemiológica en el PAI
165
6.
Sistema de información del PAI
197
7.
Cadena de frío
231
8.
Logística
289
9.
Capacitación, supervisión, monitoreo y evaluación
361
10.
Comunicación social del PAI
385
Comité editorial
411
Bibliografía
415
Acrónimos
AB
Auto Bloqueante
AD
Auto Destructible
AGEMED
Agencia Estatal de Medicamentos y Tecnología en Salud
ALS
ANC
Autoridad local de salud
Antineumocócica
ARN
Autoridad Regulatoria Nacional
BAC
Búsqueda Activa Comunitaria
BAI
Búsqueda Activa Institucional
BCG
Bacilos Calmete y Guerin, vacuna que previene formas graves de tuberculosis
bOPV
Vacuna Oral antipoliomielítica bivalente
BEAR
Brigadas Especiales de Acción Rápida
dT
difteria y Tétanos adulto, vacuna que previene la difteria y tétanos
CaCu
Cáncer de Cérvico Uterino
CCI
Comité de Cooperación Interagencial
CDI
Comité Departamental de Inmunización
CDFV
Centro Departamental de Fármaco Vigilancia
CAI
Comité de Análisis de Información
CEASS
CNI
Central de Abastecimiento y Suministros de Salud
Comité Nacional de Inmunización
CENETROP
Centro Nacional de Enfermedades Tropicales
CIE 10
Clasificación Internacional de Enfermedades, décima versión
COVID-19
Enfermedad por SARS CoV2
CPE
Constitución Política del Estado
DGE
Dirección General de Epidemiologia
ENCOVA
Encuesta Nacional de Coberturas de Vacunación
EDSA
Encuesta Nacional de Demografía y Salud
EPV
Enfermedades Prevenibles por Vacuna
EPP
Equipo de protección personal
ES
Establecimientos de Salud
ESAVI
Eventos Supuestamente Atribuibles a las Vacunas e Inmunizaciones
EVADIE
Eventos de Especial Interés
FA
Fiebre amarilla
GAM
Gobierno Autónomo Municipal
GAD
Gobierno Autónomo Departamental
GEV
Gestión Efectiva de Vacunas
HiB
Haemophilus influenzae tipo B
IDH
Impuesto Directo a los Hidrocarburos
ID
Intradérmica
IM
Intramuscular
INE
Instituto Nacional de Estadística
INLASA
Instituto Nacional de Laboratorios de Salud
IPV
Vacuna antipoliomielítica inactivada
MSD
Ministerio de Salud y Deportes
MRC
Monitoreo Rápido de Coberturas
NB
Neumonías bacterianas
ONG
Organismo No Gubernamental
OPS/OMS
Organización Panamericana de la Salud/Organización Mundial de la Salud
OPV
Vacuna oral antipoliomielítica
PAI
Programa Ampliado de Inmunización
PFA
Parálisis flácida aguda
PND
Plan Nacional de Desarrollo
POA
Programa Operativo Anual
PEPS
Primeros en expirar primeros en salir
PSD
Plan sectorial de desarrollo
RISS
Redes Integrales de Servicios de Salud
RNVe
Registro Nacional de Vacunación Electrónico
RSI
Reglamento Sanitario Internacional
SAFCI
Salud Familiar Comunitaria Intercultural
SALMI
Sistema de Administración Logística de Medicamentos e Insumos
SC
Subcutánea
SD
Síndrome de Down
SDRC
Síndrome de dolor regional complejo
SEDES
Servicio Departamental de Salud
SEGIP
Servicio General de Identificación Personal
SGB
Síndrome de Guillain Barré
SIDA
Síndrome de inmunodeficiencia Adquirida
SIAL
Sistema de Información para la Administración y Logística
SNIS-VE
Sistema Nacional de Información de Salud- Vigilancia Epidemiológica
SNC
Sistema nervioso central
SOAP
Software de Atención Primaria en Salud
SPPO
Síndrome de taquicardia ortostática postural
SRC
Síndrome de Rubéola Congénita
SRP
Sarampión, Rubéola y Paperas, vacuna contra estas enfermedades
SR
Sarampión, Rubéola, vacuna contra estas enfermedades
SUS
Sistema Único de Salud
TGN
Tesoro General de la Nación
VINUVA
Vigilancia de Nuevas Vacunas
VPH
Virus del Papiloma Humano
VSSM
Gestión de existencia de suministros de vacunación
CAPÍTULO 1
CONOCIENDO AL PAI
Índice
1.1
El Programa Ampliado de Inmunización
20
1.2
Objetivos
20
1.2.1
Objetivo General
20
1.2.2
Objetivos Específicos
20
1.3
Metas
20
1.4
Visión
21
1.5
Misión
21
1.6
Principios y valores
21
1.7
Política de calidad
21
1.8
Marco legal
21
1.8.1
Constitución Política del Estado
21
1.8.2
Ley Marco de Autonomías y Descentralización
21
1.8.3
Ley de Hidrocarburos
22
1.8.4
Ley N°3300, Ley de vacunas
22
1.8.5
Ley N°1737, Ley del medicamento
23
1.9
Organización y planificación del PAI
23
1.9.1
Organización
24
1.9.2
Planificación
33
1.10
Componentes del PAI
39
1.10.1
Cadena de Frío
39
1.10.2
Logística
39
1.10.3
Vigilancia epidemiológica de las enfermedades prevenibles por vacunas
39
1.10.4
Capacitación
40
1.10.5
Supervisión
40
1.10.6
Monitoreo y evaluación
40
1.10.7
Vacunación segura
41
1.10.8
Investigación
41
1.10.9
Comunicación
41
1.11
Estrategias de vacunación
41
1.11.1
Oportunidades perdidas
41
1.11.2
Vacunas del esquema nacional
42
1.1 El Programa Ampliado de Inmunización
Es un programa de prevención, vigilancia y control de las enfermedades prevenibles por vacunas
que se desarrolla de manera metódica, estratégica, gerencial, operativa y comprometida
con las naciones del mundo, para lograr coberturas universales de vacunación y vigilancia
eficiente de las enfermedades prevenibles por vacuna en la perspectiva de erradicar, eliminar
y controlar dichas enfermedades.
1.2 Objetivos
1.2.1 Objetivo General
Reducir el riesgo de enfermar y morir por enfermedades inmunoprevenibles en todos los
grupos de edad a lo largo de la vida.
1.2.2 Objetivos Específicos
* Garantizar la disponibilidad oportuna y suficiente de vacunas del esquema nacional.
* Mejorar la accesibilidad de toda la población a los servicios de vacunación gratuita.
* Lograr la sostenibilidad financiera de las vacunas, la operativización de la vacunación y
de la vigilancia epidemiológica de las enfermedades prevenibles por vacunas y el control
de brotes.
* Brindar un servicio eficiente con vacuna de calidad, segura y gratuita a nivel nacional.
* Fortalecer el sistema de vigilancia epidemiológica para que detecte oportunamente
cambios en el comportamiento de las enfermedades prevenibles por vacuna, mantener y
mejorar los indicadores de calidad.
* Mitigar el impacto de la vacunación en el medio ambiente.
* Asegurar la cadena de frío de las vacunas (conservación, almacenamiento y transporte)
desde el almacén departamental, municipal y establecimientos de salud, hasta el
beneficiario final, vale decir a la comunidad.
Serie: Documentos Técnico Normativos
* Garantizar una cobertura de vacunación mayor o igual al 95% con el esquema nacional de
vacunación en cada municipio.
20
1.3 Metas
* Consolidada la erradicación de la poliomielitis en Bolivia.
* Consolidada la eliminación del sarampión, la rubeola, el síndrome de la rubeola congénita
y el tétanos neonatal en Bolivia.
* Controlada la difteria, tosferina, hepatitis B, fiebre amarilla, neumonías y meningitis por
tuberculosis, Haemophilus tipo b y neumococo, así como las diarreas graves por rotavirus.
* Disminuida la incidencia del cáncer cérvico uterino.
* Controlada la morbimortalidad por la COVID – 19.
1.4 Visión
Las familias bolivianas ejercen su derecho a la vacunación oportuna, de calidad y segura en
todo el territorio nacional.
1.5 Misión
La misión del PAI es la reducción de la morbimortalidad en el país, mediante la vacunación
universal, gratuita y segura para todas las familias bolivianas y los residentes en el país, además
de la vigilancia oportuna de casos para garantizar el control, eliminación y erradicación de
enfermedades inmunoprevenibles.
1.6 Principios y valores
* Competencia profesional.
* Compromiso con la sociedad.
* Innovación permanente.
* Transparencia.
* Utilidad pública.
1.7 Política de calidad
1.8 Marco legal
1.8.1 Constitución Política del Estado
El Artículo 35 establece que el Estado, en todos sus niveles, protegerá el derecho a la salud
promoviendo políticas públicas orientadas a mejorar la calidad de vida, el bienestar colectivo
y el acceso gratuito a los servicios por parte de la población.
El Artículo 37 señala que el Estado tiene la obligación indeclinable de garantizar y sostener
el derecho a la salud, que se constituye en una función suprema y primera responsabilidad
financiera y se priorizará la promoción de la salud y la prevención de las enfermedades.
1.8.2 Ley Marco de Autonomías y Descentralización
El artículo 81 referido a salud establece las siguientes competencias:
Manual Técnico del Programa Ampliado de Inmunización
El Programa Ampliado de Inmunización contribuye a disminuir la morbilidad y mortalidad
por enfermedades prevenibles por vacunas, aplicando procesos de mejora continua para
alcanzar excelencia en el cumplimiento a su misión, visión, principios y valores. Fomentando
el desarrollo del recurso humano, apoyando las iniciativas innovadoras y creativas del
personal de salud comprometido con el desempeño estratégico y operacional del programa,
contribuyendo así a la salud de toda la población, sin discriminación de ningún tipo y en el
marco de la interculturalidad.
21
Gobiernos Autónomos Departamentales
* Elaborar y ejecutar programas y proyectos departamentales de promoción de salud y
prevención de enfermedades en el marco de la política de salud.
Gobiernos Autónomos Municipales
* Ejecutar el componente de atención de salud haciendo énfasis en la promoción de la
salud y la prevención de enfermedades en las localidades urbanas y rurales.
Gobiernos Autónomos Indígena Originario Campesinos
* Formular y aprobar planes locales de salud de su jurisdicción, priorizando la promoción
de la salud y la prevención de enfermedades y riesgos en el marco de la Constitución
Política del Estado y la Política Nacional de Salud.
1.8.3 Ley de Hidrocarburos
El Artículo 57 indica que el impuesto directo a los hidrocarburos IDH, será destinado al sector
salud en un 4% en el caso de los departamentos productores, en un 2% por cada departamento
no productor.
Todos los beneficiarios destinarán los recursos recibidos por Impuesto Directo a los
Hidrocarburos (IDH), para los sectores de educación, salud y caminos, desarrollo productivo y
todo lo que contribuya a la generación de fuentes de trabajo.
1.8.4 Ley N°3300, Ley de vacunas
Promulgada en diciembre del año 2005, crea y regula el sistema de inmunizaciones preventivas,
para todos los habitantes de Bolivia. Establece la asignación de fondos nacionales para
la compra de vacunas y la operativización de la vacunación de acuerdo con la situación
epidemiológica.
Esta Ley tiene los siguientes objetivos:
Serie: Documentos Técnico Normativos
* Establecer una política sanitaria nacional de prevención, en cumplimiento a su obligación
constitucional.
22
* Programar, organizar, ejecutar y controlar las acciones tendientes a garantizar la
obligatoriedad y gratuidad de la prevención de enfermedades inmunoprevenibles a través
de los servicios de vacunación.
* Proveer los recursos económicos permanentes y necesarios para el cumplimiento de los
objetivos señalados.
Además, en su Artículo 2 declara que, para el Estado, todas las actividades relacionadas con
la inmunización de enfermedades prevenibles, son una prioridad nacional, siendo que la salud
es un derecho de la población boliviana.
Por lo tanto, esta ley garantiza el financiamiento para la adquisición de vacunas y otros
suministros del PAI, así como para las acciones del programa y otras que el Estado pudiese
determinar a través de la Ley de Presupuesto General del Estado.
1.8.5 Ley N°1737, Ley del medicamento
Tres Artículos hacen referencia a las vacunas como medicamentos especiales, velando por la
calidad, uso:
Artículo 2.- La presente Ley, regula la fabricación, elaboración, importación, comercialización,
control de calidad, registro, selección, adquisición, distribución, prescripción y dispensación
de medicamentos de uso humano, así como de medicamentos especiales, como vacunas,
hemoderivados, alimentos de uso médico, cosméticos, productos odontológicos, dispositivos
médicos, productos homeopáticos y productos medicinales naturales y tradicionales.
Artículo 3.a.
b.
c.
d.
e.
f.
g.
h.
i.
Garantizar medicamentos que tengan calidad y eficacia comprobada, preservando que
la relación beneficio riesgo, sea favorable a la salud y que sean accesibles a todos los
habitantes del país.
Establecer un universo racional de medicamentos de costo beneficio favorable para la
comunidad, acorde con las necesidades de patologías prevalentes en el país.
Establecer normas para la creación de sistemas de fármaco vigilancia de uso racional
y de información sobre el medicamento.
Establecer las normas para la importación de medicamentos.
Reglamentar la oferta en el mercado nacional de productos farmacéuticos terminados,
naturales, homeopáticos, cosméticos, odontológicos, radiofármacos, biológicos,
hemoderivados, dietéticos.
Establecer la validación del procesamiento, el control de calidad y estabilidad de los
medicamentos.
Reglamentar y normar la donación de medicamentos.
Normar las actividades de la Comisión Farmacológica Nacional.
Normar la información, promoción y publicidad de los medicamentos, estableciendo las
normas éticas de promoción.
1.9 Organización y planificación del PAI
La organización y planificación del PAI contribuye a dar cumplimiento a una función del
estado que es la de garantizar la protección de la salud del 100% de la población; para ello se
requiere del cumplimiento de responsabilidades en todos los niveles de Estado, de acuerdo a
las competencias que asigna la ley de autonomías.
La organización y planificación pueden enfrentar retos muy importantes como:
* La corresponsabilidad de los niveles de gestión nacional, departamental y municipal, para
asignación de recursos humanos y financieros en todos los niveles para la erradicación,
eliminación y el control de las enfermedades prevenibles por vacuna.
Manual Técnico del Programa Ampliado de Inmunización
Así mismo, reconoce los biológicos como Medicamentos especiales, en el inciso f del
Artículo 4: Medicamentos especiales, biológicos, hemoderivados, dietéticos, odontológicos,
cosméticos radiofármacos, dispositivos médicos, substancias para diagnóstico y reactivos
para laboratorio clínico.
23
* El trabajo multidisciplinario para abordar las barreras para la vacunación y mitigar el
efecto de los movimientos antivacunas.
* Incorporación permanente de nuevas vacunas con el respectivo fortalecimiento en la
cadena de frío y otras tecnologías requeridas.
1.9.1 Organización
Para mantener la erradicación, eliminación y el control de las EPV, se requiere de una
organización efectiva en todos los niveles estatales, de acuerdo a las competencias que
asigna la Ley de Autonomías. De esta manera, el PAI se constituye en un sistema compuesto
de recursos humanos, normas técnicas y administrativas, que interactúan entre sí.
A.
Organización del PAI a nivel Nacional
A nivel nacional, el PAI depende de la Dirección General de Epidemiología, la cual depende del
“Viceministerio de Promoción, Vigilancia Epidemiológica y Medicina Tradicional”.
Los componentes del programa son:
* Área de vigilancia
* Área de gestión de calidad
* Área de logística y cadena de frío.
Jefatura PAI
Coordinador técnico
Secretaria
Comunicador
Área de informática
y Estadística
CCI
CNI
Figura 1: Organización del PAI
Serie: Documentos Técnico Normativos
Área de
vigilancia
Fuente: PAI/MSYD
24
Enfermedades
erradicadas y
eliminadas
Vigilancia EPV
Vigilancia
centinela
ESAVI
Área de gestión
de calidad
Gestora de
calidad 1
Gestora de
calidad 2
Gestora de
calidad 3
Área de logística
y cadena de frío
Área de
administración
Recepción
almacén y
distribución
Contador
Conservación
de vacunas
Auxiliar de
contabilidad
Mantenimiento
de equipos
Desaduanizador
Auxiliares de
logística y de
cadena de frío
A continuación, se puede encontrar el detalle de funciones de las áreas y componentes del
programa.
Funciones de la Jefatura del PAI a Nivel Nacional
* Elabora, promueve y hace seguimiento a la implementación de políticas, planes nacionales
estratégicos y anuales de inmunización.
* Formula, actualiza e implementa las normas técnicas del programa e implementa
recomendaciones del CNI.
* Gestiona y promueve la asignación de recursos financieros nacionales e internacionales
para actividades prioritarias del PAI en todos los niveles.
* Garantiza la adquisición y distribución oportuna de biológicos, jeringas e insumos en
base a la programación anual.
* Desarrolla planes de equipamiento, mantenimiento, reposición y de contingencia para el
funcionamiento adecuado de la cadena de frío.
* Analiza periódicamente la información de todos los componentes del PAI a través de
indicadores trazadores.
* Implementa sistemas de vigilancia epidemiológica regular, centinela y especializada,
promoviendo el análisis, difusión y toma de decisiones.
* Gestiona la implementación de planes de intervención para acciones focalizadas,
intensivas o extensivas con los responsables departamentales del PAI.
* Realiza seguimiento a la implementación integral del Registro Nominal de Vacunación
electrónica RNVe.
* Promueve la implementación de programas de educación continua multimedia.
* Promueve la implementación del plan de comunicación e información permanente para
la vacunación.
* Promueve y Analiza las supervisiones gerenciales y operativos
Funciones de área de gestión de calidad
* Contribuyen a la rectoría del programa con el seguimiento a la implementación de la
política de gestión de calidad del PAI a nivel nacional en el sector público, seguros a corto
plazo y privados.
* Hacen seguimiento al cumplimiento de los POA para la implementación del PAI, para el
mantenimiento preventivo y correctivo de los equipos de cadena de frío.
* Planifican, coordinan, implementan, sistematizan los planes anuales de seguimiento y
evaluación a la implementación del PAI en los nueve departamentos.
Manual Técnico del Programa Ampliado de Inmunización
* Establece políticas de calidad del Programa, mecanismos de supervisión y mejora
continua.
25
* Analizan la información global del PAI: coberturas de vacunación, indicadores de
desempeño de la vigilancia epidemiológica y de las supervisiones, emite recomendaciones
periódicas a los SEDES.
* Mantienen actualizado el mapeo de las áreas de riesgo, el control de calidad de la
información de la vacunación y de las acciones operativas.
* Desarrollan, fomentan e implementan protocolos de investigación operativa para planes
de mejora del PAI.
* Apoyan el seguimiento e investigación de los casos sospechosos de enfermedades
inmunoprevenibles y la implementación oportuna de medidas de control epidemiológico.
* Promueve, coordina, realiza y analiza las supervisiones gerenciales y operativas
Funciones del área de vigilancia epidemiológica:
Vigilancia de enfermedades erradicadas, eliminadas y bajo control
* Aseguran el funcionamiento de la vigilancia de EPV eliminadas, erradicadas y bajo control
utilizando los indicadores de desempeño y recomiendan la toma de decisiones en todos
los niveles.
* Realizan control de calidad de la notificación mediante la Búsqueda Activa Institucional
(BAI) y Búsqueda Activa Comunitaria (BAC)
* Apoyan la planificación para la compra de reactivos e insumos, la gestión de muestras
desde el nivel local hasta el laboratorio nacional, el seguimiento a los resultados de
laboratorios y la retroalimentación a nivel nacional.
* Monitorean, hace seguimiento y apoyo técnico en el control de brotes o de eventos de
EPV.
* Retroalimentan la información a través de boletines semanales de vigilancia
* Participan en los CAI de los SEDES de acuerdo a la prioridad epidemiológica.
* Conforma la secretaria del Comité Nacional de Inmunización.
Serie: Documentos Técnico Normativos
Vigilancia Centinela
26
* Aseguran el funcionamiento de la vigilancia centinela a través del monitoreo de indicadores
de desempeño de los hospitales y laboratorios.
* Promueve el análisis de los datos de la vigilancia centinela en el PAI en todos los niveles
* Hacen seguimiento al funcionamiento de comités clínicos de asesoramiento en cada
hospital.
* Realizan control de calidad de los datos introducidos al sistema de Vigilancia de Nuevas
Vacunas (VINUVA) y emiten boletines electrónicos mensuales de vigilancia centinela.
Vigilancia de ESAVI
* Asegura el funcionamiento de la vigilancia de ESAVI y la utilización de resultados para
recomendar la toma de decisiones en todos los niveles.
* Realiza el seguimiento continuo y sistemático a la ocurrencia de ESAVI en coordinación
con AGEMED y SNIS-VE, actualiza sistemáticamente la base de datos de ESAVI graves y
asegura la documentación completa de cada caso.
* Apoya el funcionamiento de los nueve comités departamentales de ESAVI y brinda
asistencia técnica al proceso de investigación de ESAVI graves.
* Revisa periódicamente resultados de ensayos clínicos de laboratorios y de estudios post
mercadeos en el desarrollo de las vacunas en el mundo.
* Participa en el Comité Nacional de ESAVI, Comité Nacional de Inmunización y Comité de
Fármaco Vigilancia.
* Elabora reportes semanales para su inclusión en boletín del PAI.
Funciones del área de logística y de cadena de frío
Funciones de logística
* Somete a aprobación de la jefatura del PAI la programación anual de vacunas y jeringas
en formato para el fondo rotatorio PAHO 173, confirma proformas y estado de llegada de
vacunas e insumos a OPS.
* Participa en el proceso de desaduanización desde el llenado de formulario para AGEMED
hasta su extracción final.
* Realiza el ingreso de jeringas al almacén de CEASS.
* Elabora documentación de respaldo de recepción y descargo de llegada de vacunas e
insumos.
* Asegura el abastecimiento oportuno y suficiente de vacunas, jeringas y otros insumos
en base al plan de distribución trimestral y de acuerdo al principio de Primeros en Expirar
Primeros en Salir (PEPS).
* Realiza el inventario físico de forma mensual y por requerimiento, en almacén CEASS y
PAI Nacional.
* Actualiza kardex de ingreso y egresos, monitorea, analiza el uso y los saldos de vacunas
y jeringas por SEDES y realizá control de calidad al Kardex.
* Recibe, verifica y distribuye materiales para logística, promoción, campañas y otros.
Funciones de cadena de frío
* Garantiza el manejo de cadena de frío de las vacunas y los insumos, durante la recepción,
almacenamiento y distribución.
* Realiza la recepción de vacunas e insumos en cadena de frío y CEASS y las ordena por
lotes y fecha de caducidad.
* Envía las vacunas a los departamentos verificando las cantidades y lotes de acuerdo a los
comprobantes de despacho y principio PEPS.
Manual Técnico del Programa Ampliado de Inmunización
* Realiza la implementación a nivel nacional de sistemas de control de insumos aprobados
por el Ministerio de Salud y Deportes.
27
* Actualiza el inventario de equipos de cadena de frío de forma trimestral.
* Actualiza la georreferencia del inventario de cadena de frío de manera semestral.
* Actualiza la información de capacidad de almacenamiento a nivel nacional.
* Elabora e implementa planes y estudios de monitoreo continuo de temperatura de las
cámaras donde se almacenan las vacunas.
* Lleva el registro de las salidas de vacunas con los pesos, volúmenes y temperatura de
cajas enviadas.
* Actualiza regularmente al personal sobre el preparado y embalado de las cajas de vacunas.
* Da seguimiento de la llegada y entrega de vacuna e insumos a los departamentos.
* Innova estrategias para mejora del área.
* Mantiene organizadas y limpias las cámaras y equipos de cadena de frío.
* Monitorea temperatura de todos los equipos.
* Planifica el mantenimiento regular y en situación de emergencia de la cadena de frío,
actualizado y descentralizado por niveles.
* Asegura el plan de contingencia de cadena de frío, descentralizado por niveles y lo
actualiza.
Comité Nacional de Inmunización - CNI
Este comité está conformado por especialistas epidemiólogos, pediatras, alergólogos,
patólogos, infectólogos, inmunólogos, ginecólogos, internistas, biólogos y salubristas con
amplia experiencia en el PAI, así como otros profesionales relacionados con la salud, quienes
llevan a cabo y fomentan discusiones de tipo científico relacionadas con el proceso de
inmunización. La directiva se renueva cada dos años.
El Comité Nacional de Inmunización (CNI), de acuerdo a la Ley N°3300 del 12 de diciembre de
2005, cumple las siguientes funciones:
Serie: Documentos Técnico Normativos
* Asume la defensa del PAI en el Órgano Ejecutivo, Asamblea Legislativa, Gobiernos
Departamentales y Municipales, Asociaciones Sociales, iglesias, medios de comunicación
y otros.
28
* Recomienda la incorporación de nuevas vacunas al esquema nacional en base a evidencia.
* Recomienda actualizaciones a las bases legales y normas técnicas del PAI en función
a la situación y vigilancia epidemiológica nacional, y a las metas y compromisos
internacionales.
* Emite recomendaciones a los resultados del monitoreo periódico de progresos del PAI y
evaluación de resultados.
* Sugiere y apoya investigaciones para la gerencia técnica del PAI.
* Coordina e impulsa en universidades y otras instituciones formadoras de recursos
humanos la inclusión y evaluación en los programas de enseñanza el componente PAI
global.
* Apoya la organización y funcionamiento de Comités Departamentales de Inmunización
para el monitoreo del PAI regional a través del seguimiento de sus filiales departamentales.
* Actúa como portavoz oficial especialmente en momentos de crisis debido a ESAVI u otros
eventos que requieran de respaldo técnico.
* Aquellas que le encomiende el Ministerio de Salud y Deportes.
Comité de Cooperación Interagencial - CCI
Organiza la cooperación externa al programa en base a planes de acción quinquenales y
anuales consensuados y revisados periódicamente. Este apoyo es complementario a la
fuente principal de financiamiento del programa que es el Tesoro General de la Nación (TGN),
ya que éste provee los recursos necesarios para la compra de vacunas, jeringas y cajas de
bioseguridad. Este Comité, además, presta su apoyo en los aspectos técnicos referidos a las
actividades del PAI.
B.
Organización del PAI a nivel departamental
El PAI departamental depende técnicamente del Ministerio de Salud y Deportes, y
administrativamente del SEDES.
Funciones de la Jefatura del PAI a nivel departamental
* Asegura el cumplimiento a las políticas nacionales de inmunización a nivel departamental.
* Coordina, analiza y difunde de manera periódica la información relativa a coberturas de
vacunación, utilización de vacunas, desempeño de la vigilancia de las EPV para la toma
oportuna de decisiones.
* Elabora planes quinquenales y operativos anuales, identificando estrategias que
garanticen el cumplimiento de metas.
* Gestiona y garantiza recursos de los Gobiernos Autónomos Departamentales y Gobiernos
Autónomos Municipales.
* Asegura el abastecimiento permanente de vacunas, jeringas e insumos necesarios en
todas las redes integrales de servicios de salud del departamento.
* Supervisa, monitorea y evalúa el cumplimiento de las actividades de vacunación y
vigilancia en el sector público, privado, seguridad social y otros.
* Implementa el programa de educación continua del PAI, para capacitar al personal de
salud y de otras instituciones formadoras de recursos humanos en salud.
* Participa en los CAIs, proponiendo alternativas innovadoras de mejora continua.
Manual Técnico del Programa Ampliado de Inmunización
* Promueva la implementación de actividades complementarias a fin de lograr los objetivos
y metas del PAI.
29
* Fortalece el funcionamiento continuo del Comité Departamental de Inmunización CDI y
del Comité de Vigilancia de ESAVI.
* Promueve, coordina, realiza y analiza las supervisiones gerenciales y operativas.
De la misma forma que en el nivel central, en el nivel departamental se cuenta con 3 áreas: 1.
Gestión de la calidad; 2. Vigilancia epidemiológica; y 3. Logística y cadena de frío. El personal
asignado a las áreas debe dar cumplimiento a las funciones específicas descritas ajustadas
para el nivel departamental.
Brigadas especiales de acción rápida BEAR
Estas brigadas, dependientes del Ministerio de Salud y Deportes bajo responsabilidad del
PAI, fueron creadas el año 2000 para dar respuesta rápida a emergencias, como el brote
de sarampión. Actualmente están destinadas a apoyar la oportuna vacunación y vigilancia
epidemiológica del PAI en la investigación y bloqueo epidemiológico de casos sospechosos.
Este personal operativo es capacitado y actualizado por el PAI departamental de forma
continua con la introducción de nuevas vacunas y vigilancia epidemiológica.
Sus funciones son:
* Operativizar la vacunación, de acuerdo a las normas establecidas para cada caso
sospechoso.
* Realizar sistemáticamente búsqueda activa institucional, comunitaria y monitoreo rápido
de coberturas de las enfermedades inmunoprevenibles.
* Realizar educación y promoción de la vacunación en diferentes espacios planificados,
como ferias, mercados, colegios, etc.
* Adicionalmente realizan otras actividades prioritarias, de acuerdo a necesidad del
Programa, fortaleciendo el control de las EPV.
Serie: Documentos Técnico Normativos
C. Organización del PAI a nivel de las Coordinaciones de Redes de Servicios
de Salud
30
Cada Coordinación de Red cuenta con un responsable del PAI que puede ser la o el responsable
de salud pública, la Jefa de Enfermeras o el responsable de epidemiología; siempre tomando
en cuenta los recursos humanos disponibles en cada red, y debe ser designado en forma
escrita.
Las principales funciones que debe desempeñar el responsable del PAI de la Coordinación de
Red son:
* Dar cumplimiento a las políticas nacionales del PAI.
* Gestionar y garantizar mediante POA, el apoyo necesario ante las autoridades locales,
para las actividades operativas del PAI.
* Monitorear y evaluar permanentemente la situación epidemiológica de las enfermedades
inmunoprevenibles, las coberturas de vacunación con todo el esquema nacional y la
utilización de vacunas y jeringas.
* Garantizar la pronta respuesta a los requerimientos del PAI que se generan en cada
establecimiento de salud de la Red.
* Supervisar y monitorear de forma sistemática y periódica los componentes del PAI en los
establecimientos de salud que se encuentran bajo su coordinación; para lo que deben
utilizar los instrumentos de supervisión (que se detallan en el capítulo correspondiente).
En base a los resultados elaborar planes de fortalecimiento de todos los componentes
del PAI.
* Implementar estrategias locales para el logro de los objetivos y metas del PAI.
* Identificar barreras a la vacunación, proponer soluciones oportunas e implementar un
sistema de mejora continua en los componentes del programa.
* Promover el reconocimiento al recurso humano, como una forma de motivación.
* Programar y distribuir las vacunas, jeringas e insumos de acuerdo al principio de Primeros
en Expirar Primeros en Salir (PEPS) a todos los establecimientos de salud.
* Consolidar y analizar el uso de vacunas, jeringas y cajas de desecho seguro, en base al
control de calidad y de la programación.
* Promueve, coordina, realiza y analiza las supervisiones operativas.
D.
Organización del PAI a nivel del establecimiento de salud
Los aspectos indispensables a tomar en cuenta para una adecuada organización de las
actividades de vacunación y vigilancia en un establecimiento de salud son:
* Que el personal de salud de cumplimiento a la normativa del Programa.
* Asignar un ambiente adecuado, exclusivo y de fácil acceso para la vacunación regular.
* Asignar otro ambiente para los equipos de cadena de frío con aire acondicionado para la
adecuada conservación de las vacunas, resguardo de jeringas y cajas de desecho seguro.
* Garantizar la disponibilidad del mobiliario e insumos para la vacunación, además de
equipos de protección personal, como batas, barbijos, gorros, mascarilla facial e insumos
necesarios para guardar las medidas de higiene y bioseguridad.
El vacunatorio debe contar como mínimo con:
* Una mesa con dos sillas.
* Refrigerador con dos termómetros (exclusivo para el PAI).
* Termo, con un termómetro.
* Caja fría para los paquetes fríos.
* Biológicos, jeringas autodesactivables y desechables, cajas de desecho seguro, algodón,
solución jabonosa y alcohol en gel según su programación.
Manual Técnico del Programa Ampliado de Inmunización
* Contar con un responsable o un encargado del PAI en cada establecimiento de salud que
puede ser el director o la jefa de enfermeras. En los centros de salud en los que exista un
solo funcionario, automáticamente éste será el responsable del PAI. Sin embargo, en las
actividades de vacunación todo el personal es corresponsable del éxito de las mismas.
31
* Lavamanos.
* Jabón líquido o en barra.
* Tapete de piso sopado en lavandina para el ingreso.
* Cuadernos de registros de vacunación dentro y fuera de servicios.
* Equipo de computación e impresora para la implementación del RNVe.
* Hoja de monitoreo diario de temperatura.
* Cuadro de monitoreo mensual de coberturas.
* Libretas de salud y desarrollo integral infantil de la niña y niño y/o carnet de vacunación.
* Fichas epidemiológicas.
* Manuales actualizados del PAI.
“El ambiente asignado para la vacunación debe ser accesible visible y señalizado
para la vacunación a demanda de la población, de esta manera evitamos
oportunidades perdidas”.
Funciones del jefe de área o establecimiento de salud
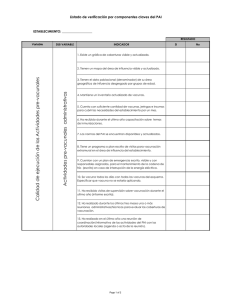
* Analiza y grafica las coberturas de vacunación y los indicadores de vigilancia epidemiológica
del PAI, para su análisis e implementación de estrategias de fortalecimiento y para la
mejora continua. del PAI.
* Gestiona recursos económicos, logísticos y técnicos con el Gobierno Autónomo Municipal
respectivo, para ejecutar el plan de vacunación y contar con los recursos necesarios
destinados a los estipendios, refrigerios, gasolina, transporte, viáticos, comunicación
social y otros que se requieran.
* Asegura para su población objetivo, la disponibilidad y utilización oportuna de vacunas,
jeringas, cajas de desecho seguro, insumos y material de escritorio.
* Supervisa la calidad de la ejecución de todos los componentes del PAI, particularmente
de la vacunación, del registro, de la cadena de frío y de la vigilancia de las EPV.
Serie: Documentos Técnico Normativos
* Realiza periódicamente el control de calidad de la información de la vacunación
* Realiza el seguimiento e investigación de los casos de inmunoprevenibles captados o
reportados dentro de su área de influencia o responsabilidad.
* Socializa los lineamientos técnicos actuales con el equipo de salud.
* Da cumplimiento al POA para el mantenimiento preventivo y correctivo de los equipos de
cadena de frío.
* Mantiene actualizado el monitoreo de la información semanal de la vigilancia de
enfermedades inmunoprevenibles.
* Mantiene actualizado el mapeo de las áreas de riesgo.
* En actividades y campañas de vacunación y control de brotes debe planificar la cantidad
de brigadas y supervisores necesarios para cubrir toda el área de su jurisdicción, tomando
32
en cuenta la densidad, dispersión y accesibilidad de la población. En el área urbana debe
contar el número de manzanos y dividirlo entre cuatro, la cantidad resultante serán los
manzanos que se deben asignar a cada brigada. Debe asignar un supervisor por cada
cuatro brigadas.
* Gestiona ante las autoridades superiores los recursos necesarios para capacitar a las
brigadas y supervisores.
* Mantiene una comunicación fluida con los supervisores para respaldar la consistencia de
la información.
* Realiza el monitoreo rápido de coberturas después de la intervención de las brigadas.
* Envía la información consolidada y analizada a los niveles superiores correspondientes.
* Valida, analiza el uso de vacunas y su factor perdida.
1.9.2
Planificación
La planificación del PAI en todos los niveles, es por resultados, esto quiere decir que las
actividades identificadas como prioritarias siempre apuntan al logro de los objetivos trazados.
La planificación del programa se refleja en:
* Planes estratégicos o quinquenales.
* Planes o programaciones operativas anuales.
* Microplanes de actividades de vacunación.
El plan estratégico es el marco de referencia nacional y departamental; coincide con gestiones
gubernamentales, define metas a mediano y largo plazo y está basado en las prioridades
nacionales y las metas adoptadas en la región de Las Américas.
El micro plan es el resultado de un proceso de planificación que va de abajo hacia arriba, es un
método de trabajo que permite desarrollar de manera ordenada y sistemática, la programación,
organización, coordinación, ejecución y evaluación de las campañas de vacunación a nivel
local, validando la información utilizada en el terreno y resultados, siendo el nivel local
responsable de la oferta y de la respuesta a la demanda de los servicios de vacunación.
El nivel local debe estar en condiciones de afrontar el desafío para realizar campañas
de vacunación en el menor tiempo posible y lograr la meta del ≥95%, cumpliendo con los
indicadores de los criterios establecidos de eficacia, homogeneidad, oportunidad y eficiencia,
evitando la improvisación de las actividades y generación de crisis; determinando las
estrategias y tácticas de vacunación más efectivas, la gestión de los recursos requeridos en
el plan de acción local, según componente, actividades y costo.
Los pasos del proceso de planificación incluyen:
* Diagnóstico de la comunidad.
Manual Técnico del Programa Ampliado de Inmunización
El plan de acción y la programación operativa anual se derivan del plan estratégico y es una
herramienta muy importante para la gerencia del PAI en todos los niveles.
* Inventario de recursos disponibles.
33
* Formulación de objetivos cuantitativos y cualitativos.
* Identificación de prioridades y metas.
* Selección de estrategias y tácticas de vacunación.
* Programación de actividades con metas, recursos y cronograma.
* Monitoreo y evaluación.
Para implementar actividades del PAI es necesario conocer la situación de la comunidad
tomando en cuenta los siguientes aspectos:
A.
Datos demográficos
Para el trabajo del PAI se requieren los datos de población total y por edad para cada una de
las vacunas, por ello, oficialmente el PAI utiliza los denominadores poblacionales provenientes
del SNIS-INE. Sin embargo, a nivel local también se utilizarán para el análisis y toma de
decisiones los datos de las carpetas familiares, módulo de información básica del SNIS y
censos comunitarios.
Además, es importante tomar en cuenta el número de comunidades que deben ser atendidas
por el establecimiento de salud, las características culturales o religiosas de la zona,
distancias en kilómetros y tiempo de recorrido (isocronas), delimitación geográfica del ámbito
de responsabilidad, censo actualizado de guarderías, unidades educativas, asilos y otras
instituciones.
B.
Croquis de ubicación
Cada establecimiento de salud debe contar con un croquis actualizado general del área
o comunidades que están bajo su responsabilidad, incluyendo otros servicios de salud
existentes, la distribución de la cadena de frío, vías de comunicación, distancias en kilómetros
(isocronas) y los límites del área.
Los croquis por comunidades deben proporcionar información complementaria como
nombres de las calles, referencias de los servicios de salud, equipos de cadena de frío, iglesias,
escuelas, mercados y otros puntos que resulten de importancia. Los mapas georeferenciales
son muy útiles, al igual que la identificación de las casas con niños menores de 5 años.
34
Figura 2: Croquis de ubicación
Serie: Documentos Técnico Normativos
A continuación se presenta un ejemplo:
C.
Inventario de recursos disponibles
Realizar un inventario de recursos disponibles, ayuda a identificar las fortalezas y
debilidades de los servicios de salud, para luego elaborar un plan que dé respuesta a los
problemas identificados e incluirlos en el POA. Esta información es útil para la definición de
estrategias y programación de actividades de vacunación y vigilancia de las enfermedades
inmunoprevenibles.
Elementos que deben considerarse en un inventario de recursos:
*
Ubicación de los establecimientos de salud por niveles de atención y tipo de dependencia.
*
Identificar el equipo de cadena de frío existente en cada establecimiento de salud; evaluar
si está equipado de acuerdo a norma y si corresponde para la población que atiende. Si
existe déficit incluir en el POA.
*
Transporte. (cuatro ruedas: ambulancias, otro; motocicletas, bicicletas)
*
Personal de salud, Médicos, enfermeras, auxiliares, odontólogos y otros.
D. Ubicación de los establecimientos de salud y vacunatorios públicos,
seguros a corto plazo, ONG y privados
Los establecimientos de salud, pueden prestar un servicio satisfactorio a la población que
reside en un radio de cinco kilómetros, puesto que, si las personas que viven más lejos, no
cuentan con un sistema de transporte público, tendrán menos posibilidades de acceder a
éste.
Todo establecimiento de salud que tenga bajo su responsabilidad una población mayor a 3.000
habitantes debe gestionar ante su Gobierno Autónomo Municipal, el ambiente, mobiliario,
equipos e insumos necesarios descrito en el inciso D y en Capítulo de Cadena de Frío
Transporte
Los Gobiernos Autónomos Departamentales y Municipales deben asegurar:
* Medios de transporte para traslado de las vacunas y otros insumos.
* Presupuesto para pago de combustible, pago de fletes y otros gastos relacionados con el
transporte de vacunas y otros insumos.
F.
Personal de salud
Para los vacunatorios de mayor afluencia en especial en área urbana, el municipio debe
asegurar personal exclusivo para la vacunación continua, establecer días, horas o jornadas
laborales de acuerdo a la demanda de la población.
Se debe evaluar si el recurso humano de salud es o no suficiente para satisfacer las necesidades
de vacunación de la población bajo su responsabilidad.
Si el personal de salud está motivado y capacitado en todos los componentes del PAI.
Manual Técnico del Programa Ampliado de Inmunización
E.
35
G.
Los aspectos culturales
El conocimiento de los principales valores culturales, por parte del personal, es de gran
importancia para saber el concepto del proceso salud enfermedad de la comunidad y detectar
posibles elementos facilitadores al accionar de los procesos de vacunación.
Los usos y costumbres permiten conocer las estructuras organizativas de las comunidades
y detectar posibles aliados estratégicos a efecto de la incorporación de la comunidad en
los aspectos de gestión, así como en actividades de vigilancia epidemiológica y apoyo en la
vacunación.
H.
Conocimiento de la situación de salud
Las coberturas de vacunación y los indicadores de vigilancia, permiten identificar a la población
no vacunada, es decir susceptible de enfermar y medir el estado de alerta del servicio de salud
frente a casos sospechosos de EPV que deben ser detectados tempranamente para realizar
las medidas de control normadas. Este análisis debe dar como resultado la formulación de
estrategias y tácticas para revertir esta situación.
I.
Abogacía para la gestión de recursos
Existe una corresponsabilidad de todos los niveles de gestión; por lo tanto, cada uno de los
niveles debe aportar con los recursos humanos y financieros necesarios, para las actividades
de vacunación, vigilancia y control de las EPV.
Las autoridades de salud, en cada uno de los niveles de gestión, tales como el director del
establecimiento, los coordinadores/gerentes de red, deberán realizar actividades de abogacía
a los niveles correspondientes, para lograr los recursos necesarios y llevar adelante las
actividades operativas. Los lineamientos técnicos para realizar la abogacía se encuentran en
el capítulo de comunicación y movilización social.
J.
Plan de vacunación nivel operativo
Serie: Documentos Técnico Normativos
Se deben formular objetivos medibles para el plan de vacunación a nivel departamental,
municipal, de coordinación de red o del establecimiento de salud, en base a la población
meta, número de comunidades, número de personal se debe definir las estrategias y tácticas
a aplicar. Es importante que cada nivel tenga objetivos cuantitativos que nos permita luego
medir y evaluar el plan
36
Ejemplos de objetivos cuantitativos:
* Vacunar a 238 niños menores de 1 año con dosis completas de vacuna BCG, antipolio,
pentavalente, antirotavirus y antineumocócica.
* Vacunar a 300 niños de 12 a 23 meses, con dos dosis de SRP, antiamarílica, 4ta dosis de
pentavalente y antipolio.
* Vacunar a 280 niños de 4 años con 5ta dosis de pentavalente y antipolio.
* Vacunar a 130 niñas de 10 años con dos dosis de VPH.
Otro tipo de ejemplos:
* Capacitar a 14 auxiliares de enfermería en la aplicación de las vacunas inyectables y
registro adecuado.
* Programar y ejecutar la vacunación de 11 comunidades en cuatro ocasiones durante el
año.
* Implementar el registro nominal de vacunación electrónica en 12 establecimientos de
salud.
También es importante contar con objetivos de proceso o cualitativos que permitan evaluar
las actividades programadas para vacunar a la población objetivo.
Ejemplos de objetivos cualitativos:
* Conocer las barreras culturales de la comunidad frente a la vacunación y abordarlas de
manera culturalmente sensible.
* Posicionar la vacunación en la comunidad como una medida necesaria en la lucha contra
la propagación del coronavirus.
* Sensibilizar a las autoridades respecto a la necesidad de asignar presupuestos coherentes
a las necesidades del PAI.
* Motivar a las adolescentes con información sobre la protección que les ofrece la vacuna
del VPH.
* Involucrar y movilizar a los líderes locales en favor de la vacunación.
* Mejorar las prácticas de vacunación.
* Mejorar la calidad del dato en el establecimiento de salud.
K.
Definición de prioridades, desafíos y metas
Los grupos de población prioritarios para las actividades del PAI son:
Grupo
Niñas y niños menores de 1 año
Niñas y niños de 1 año
Vacuna
BCG
Anti poliomielítica
Anti-rotavirus
Anti neumococo
Anti pentavalente
Anti-influenza
Anti sarampión
Anti amarílica
Anti poliomielítica
Antipentavalente
Anti influenza
Manual Técnico del Programa Ampliado de Inmunización
Tabla N°1: Población prioritaria
37
Niñas y niños menores de dos a cuatro años
Anti sarampión
Anti amarílica
Anti poliomielítica
Anti pentavalente
Niñas de 10 años
VPH
Embarazadas
dT
Población susceptible
COVID-19
Mujeres y hombres de 7 a 49 años
dT adulto
Personas con una enfermedad de base, adultos mayores
de 60 años , embarazadas y personal de salud.
Anti influenza
COVID-19
Fuente: PAI / MSYD
La razón para esta priorización es que los menores de cinco años son afectados con mayor
frecuencia por las enfermedades inmunoprevenibles. Las niñas y niños menores de un año
presentan más complicaciones si se enferman, la muerte en este grupo etario se produce con
más frecuencia.
Se vacuna con dT a mujeres y hombres en edad reproductiva y productiva con el fin de
protegerlos contra la difteria y el tétanos. El valor agregado de vacunar a las mujeres en edad
fértil se debe al alto riesgo de tétanos en el recién nacido, sobre todo si el parto se produce en
el domicilio.
Si bien la fiebre amarilla afecta principalmente a las personas en edad productiva y en zonas
donde existe el vector, Bolivia ha definido la inclusión de una dosis de esta vacuna en el
esquema nacional de vacunación a niños de 1 año de edad, garantizando así el control de
esta enfermedad en el país.
Adicionalmente el PAI programa campañas de vacunación de puesta al día priorizando
municipios de riesgo.
Serie: Documentos Técnico Normativos
L.
38
Selección de estrategias y tácticas de vacunación
De acuerdo a las características de la población y a los recursos disponibles, el personal de
cada establecimiento de salud, debe seleccionar y consensuar con la comunidad una o más
estrategias y tácticas que garanticen la cobertura al 100% de la población con esquemas
completos de vacunación.
M.
Implementación de planes de mejora continua
Frente a las debilidades de cada centro de salud, se formulan planes de mejora continua
a partir de una plantilla con los indicadores de desempeño de vacunación y de vigilancia,
se identifican los que no se cumplen para realizar los ajustes necesarios y superar dichas
debilidades.
N.
Política de vacunación al personal de salud
La política de vacunación al personal de salud prevé la aplicación de las vacunas contra la
hepatitis B, dT, SR, Influenza y anti COVID-19; para ello se implementará el registro nominal
electrónico para el seguimiento al cumplimiento del esquema de vacunación.
O.
Evaluaciones de resultados gerenciales y operativos
La evaluación de los resultados gerenciales se hará en función al logro de los objetivos y
metas, asignación de recursos para el fortalecimiento del PAI que fueron logrados a través de
abogacía frente a las autoridades pertinentes.
También se debe evaluar el cumplimiento de la planificación de las actividades, viendo el
alcance de los resultados, y si se han cumplido los principios de efectividad, eficacia y, sobre
todo, si el personal a cargo de las actividades de gestión y operativos, está debidamente
capacitado para implementar estrategias efectivas.
1.10
Componentes del PAI
Para asegurar la protección de la población objeto de la vacunación, el PAI desarrolla sus
acciones a través de los siguientes componentes:
1.10.1
Cadena de Frío
Es un proceso que asegura la correcta conservación, almacenamiento y transporte de las
vacunas, desde que salen de la fábrica productora de la vacuna, hasta el momento de la
vacunación.
1.10.2
Logística
1.10.3 Vigilancia epidemiológica de las enfermedades prevenibles
por vacunas
Es la estrategia que permite la detección, notificación, investigación y documentación de todo
caso sospechoso de enfermedad prevenible por vacunación, que se presente en cualquier
nivel de la red de servicios público, seguro a corto plazo y privado para la ejecución de medidas
de control.
Este sistema también permite conocer el impacto de la inmunización, detectar oportunamente
eventos, brotes epidémicos, importaciones de virus e identificar susceptibles, para la toma de
decisiones.
La vigilancia se la puede realizar bajo dos modalidades:
* Vigilancia pasiva, es notificada por la demanda espontánea de la población y la información
es registrada por el SNIS.
Manual Técnico del Programa Ampliado de Inmunización
Es un sistema que garantiza la disponibilidad de las vacunas, jeringas e insumos para la
vacunación, con una adecuada programación, distribución y monitoreo de la utilización en
cada uno de los niveles de atención y gestión del sistema de salud.
39
* Vigilancia activa, es la captación de casos sospechosos de enfermedades
inmunoprevenibles por el personal de salud que realiza atención medica identificando
casos de interés del PAI. Y luego confirmar la ausencia o presencia de casos que pueden
ser a través de la búsqueda institucional en los establecimientos de salud y comunitaria
que se realiza en la comunidad.
1.10.4
Capacitación
Mediante este componente, el PAI facilita la implementación de su programa de educación
continua, basado en competencias del personal de salud. Es un proceso que fortalece los
conocimientos, destrezas y competencias del personal de salud que gerencia el PAI o aplica
las vacunas. Utiliza complementariamente medios virtuales y presenciales en procura de la
certificación del personal gerencial y operativo, vinculado a la vacunación y/o a la vigilancia
de las EPV. Todo el personal asignado al PAI debe cumplir con los cursos definidos para la
función que ejerce y también los cursos optativos para complementar su formación.
1.10.5
Supervisión
Es un proceso de asesoría técnica, donde se recopila información sobre el manejo de normas
y procedimientos, los logros obtenidos y las dificultades identificadas; analiza el desarrollo
de las actividades y las compara con las metas y el plan de trabajo; realiza si es necesario,
acciones correctivas o complementarias para lograr los objetivos y metas, para mejorar el
rendimiento de las actividades.
Es el proceso de seguimiento que permite observar cómo se está dando el cumplimiento de las
normas, procedimientos y las actividades desarrolladas por el personal de salud y proceder, si
fuese el caso, a reconducir la calidad de los procesos. Fundamentalmente, toda supervisión
es capacitante, nunca punitiva, sino que es orientadora, educativa y formativa.
Debe ser llevada a cabo por personal debidamente capacitado, el cual aplica un conjunto de
técnicas, instrumentos y procedimientos cuando visita a un determinado servicio de salud,
con miras a brindar asistencia técnica al personal supervisado, con el objetivo de elevar los
niveles de excelencia técnica del mismo.
Serie: Documentos Técnico Normativos
1.10.6
40
Monitoreo y evaluación
El monitoreo es el seguimiento periódico a la ejecución de un plan, para asegurar que el
cumplimiento progrese de acuerdo a lo planificado. Para ello, se utilizan los indicadores de
proceso de gestión, coberturas de vacunación y de vigilancia epidemiológica entre otros, se
verifica el avance hacia los objetivos y metas del PAI, así como adoptar medidas correctivas
oportunas desde el nivel local hasta el nivel nacional.
La evaluación es el proceso que determina el grado de modificación de los problemas de salud
a consecuencia de la implementación de un plan, en el caso del PAI, nos permite verificar el
nivel de protección de una cohorte de niñas o niños protegidos contra una u otra enfermedad
(de acuerdo al esquema nacional), otra forma de evaluar los resultados del PAI es la ausencia
de una o más enfermedades (Control, eliminación o erradicación).
1.10.7
Vacunación segura
Este componente prioritario del PAI, asegura la utilización de vacunas de calidad, desde la
adquisición de vacunas precalificadas por la OMS, garantizando el transporte, almacenamiento
adecuado de las mismas, prácticas de inyección segura en el momento de la vacunación, la
vigilancia de ESAVI, y la protección del medio ambiente. (Vacunador, vacunado y el desecho
final).
Este componente incluye las alianzas con los medios de comunicación para dar mensajes
claros a la población sobre la seguridad de la vacunación y mantener su confianza en las
vacunas.
1.10.8
Investigación
Componente que permite al PAI alimentar y respaldar la toma de decisiones gerenciales, a
nivel nacional y también a nivel local. A nivel nacional, por ejemplo, los estudios de costoefectividad y de costo–beneficio son imprescindibles para la introducción de nuevas vacunas
al esquema nacional. A nivel local, para identificar, de acuerdo a cada realidad, barreras en la
vacunación, prácticas de vacunación de la población y poder implementar en consecuencia
estrategias de abordaje.
1.10.9
Comunicación
Es indudable que el PAI ha obtenido logros importantes a lo largo de su historia y que el
impacto de sus acciones en la población ha sido significativo, sin embargo, es muy importante
que estos logros, no solo se mantengan en el tiempo, sino que se profundicen mediante la
difusión de información clave y concientización de la población. Uno de los desafíos del PAI
es la de fortalecer la confianza de la población en las nuevas vacunas, como es el caso de la
vacuna anti COVID-19.
Para el logro de este cometido, la comunicación es un arma poderosa que fortalece al PAI.
Estrategias de vacunación
Son las acciones planificadas que ayudan a conseguir mejores resultados y que se constituyen
en formas de ofertar las vacunas a la población dentro o fuera de servicio para disminuir los
factores de riesgo de morbimortalidad infantil, manteniendo coberturas de vacunación que
garanticen la protección a la población boliviana (alcanzar coberturas > a 95%), en el marco
de la política SAFCI en los niveles de atención del sistema de salud.
1.11.1
Oportunidades perdidas
Se denomina como “oportunidad perdida de vacunación”, cuando una persona, de cualquier
grupo de edad elegible para ser vacunada, asiste por algún motivo a un establecimiento de
salud, no investigan su estado vacunal y por consiguiente no recibe las vacunas que requiere.
Por lo cual el PAI recomienda al personal de salud investigar el estado vacunal de todos los
usuarios que llegan a los servicios de salud y vacunarlos según corresponda.
Manual Técnico del Programa Ampliado de Inmunización
1.11
41
1.11.2
Vacunas del esquema nacional
El Estado Plurinacional de Bolivia, en base a las recomendaciones del Comité Nacional
de Inmunización, garantiza la compra de vacunas del esquema nacional con fondos del
Tesoro General de la Nación. Este esquema nacional de vacunación, es permanentemente
actualizado de acuerdo a las necesidades de la población y a la disponibilidad de la tecnología
en inmunizaciones.
Serie: Documentos Técnico Normativos
Debe ser cumplido en todos los vacunatorios del país sin discriminación alguna, garantizando
el cumplimiento del derecho a la vacunación en la edad correspondiente, número de dosis y
en definitiva el esquema completo.
42
CAPÍTULO 2
CONOCIENDO LAS
VACUNAS
Índice
2.1
2.2
2.2.1
2.2.2
2.2.3
2.3
2.4
2.5
2.6
2.7
2.8
2.9
2.10
2.11
2.11.1
2.11.2
2.11.3
2.11.4
2.11.5
2.11.6
2.11.7
2.12
2.12.1
2.12.2
2.12.3
2.12.4
2.12.5
2.12.6
2.12.7
2.12.8
2.12.9
2.12.10
2.12.11
2.12.12
2.13
2.13.1
2.13.2
2.13.3
2.13.4
2.13.5
2.13.6
2.14
Introducción
Tipos de vacunas
Las vacunas vivas atenuadas
Las vacunas inactivadas o muertas
Vacunas anti COVID-19
Componentes de la vacuna
Vía de administración de vacunas
Región anatómica
Dosis
Edad de vacunación
Interferencia entre vacunas o anticuerpos circulantes
Contraindicaciones
Vacunación en situaciones especiales
Vacunación para personas con enfermedades previas
Tuberculosis
VIH
Inmunoglobulinas
Corticoides
Hepatitis B
Ictericia neonatal
Embarazo
Coadministración con otros productos
Vacunación antirrábica de uso humano
Tratamiento contra malaria
Antibióticos
Trastornos neurológicos
Síndrome de Guillain-Barré
Epilepsia
Enfermedades genéticas (incluido el Síndrome de Down)
Afecciones neurológicas crónicas
Enfermedades desmielinizantes
Fístula de LCR no resuelta
Implante coclear
Administración simultánea de múltiples vacunas
Vacunación segura
Calidad e inocuidad de las vacunas
Transporte y almacenamiento seguro
Inyecciones seguras
Disposición final segura
Vigilancia de ESAVI
Política de frascos abiertos
Esquema nacional de vacunación
46
47
48
48
49
50
51
52
53
53
56
57
57
59
59
59
59
60
60
60
60
60
60
60
60
60
61
61
61
61
61
61
62
62
62
62
63
64
67
67
68
70
2.1 INTRODUCCIÓN
Este capítulo contiene conceptos generales de las vacunas y de la vacunación, aspectos
básicos respecto a tipos de vacuna, edad, dosis, intervalos, contraindicaciones absolutas y
relativas, seguridad que deben ser conocidos por todo el personal de salud.
Las vacunas
Las vacunas son suspensiones de microorganismos vivos, inactivos o muertos, fracciones de
los mismos o partículas proteicas sintéticas, que al ser administrados inducen una respuesta
inmune que previene la enfermedad a la que está dirigida. El objetivo de la vacunación es la
inducción de la inmunidad protectora de larga duración, simulando en lo posible la infección
natural, es la producción de linfocitos de memoria prolongada que respondan de una forma
rápida y organizada al estímulo externo.
Inmunidad
Es la capacidad del organismo de combatir o eliminar cualquier material o substancia extraña
que sobrepase las barreras biológicas entre el cuerpo y exterior, el sistema inmunitario está
organizado en un sistema inmune innato y un sistema inmune adquirido.
El sistema inmune innato es de rápida respuesta, pero altamente inespecífico y no genera
memoria. El sistema inmune adquirido es de respuesta lenta, con alta especificidad y genera
memoria inmunológica.
El componente celular de la inmunidad innata lo forman las células fagocíticas (principalmente
neutrófilos, macrófagos y células dendríticas) mientras que el componente humoral está
constituido por las proteínas del sistema del complemento.
El componente celular de la inmunidad adquirida incluye los linfocitos T (linfocitos T-CD4+
o T colaboradores y linfocitos T-CD8+ o T citotóxicos) y los linfocitos B, mientras que el
componente humoral lo forman los anticuerpos o inmunoglobulinas.
Serie: Documentos Técnico Normativos
Las células natural killer (NK) forman un tipo especial de linfocitos “inespecíficos”, a medio
camino entre el sistema innato y adquirido.
46
Nuestro sistema inmunitario se organiza en el tejido linfoide periférico, que incluye los ganglios
linfáticos, el bazo y el tejido no encapsulado de las mucosas (MALT).
Mecanismos de respuesta inmune
Son dos mecanismos por los que el cuerpo humano puede potenciar la respuesta inmune
activa o pasiva.
Activa que consiste en la estimulación del sistema inmune por la exposición a un agente
mediante un microorganismo o a un antígeno (vacuna), lo que produce una respuesta humoral
o de producción de anticuerpos y activación de líneas celulares de defensa.
Pasiva que adquiere una persona sin haber estado jamás expuesta al micro organismo,
mediante la transferencia adoptiva de anticuerpos o linfocitos T específicos frente al
microorganismo desde una persona dotada de una inmunidad específica (plasma). Otro
ejemplo de inmunización pasiva es el paso de anticuerpos maternos a través de la placenta al
feto, que permite a los recién nacidos combatir las infecciones antes de adquirir la capacidad
para producirlos por sí mismos.
Una vacuna de calidad segura es aquella que cumple consistentemente con los niveles
apropiados de pureza, potencia, seguridad y eficacia. El laboratorio productor es el responsable
principal de la calidad de la vacuna. Todas las vacunas del PAI son adquiridas a través del
Fondo Rotatorio de Vacunas de la OPS, las mismas que son precalificadas por la Organización
Mundial de la Salud (OMS) o como en el caso de las vacunas anti COVID-19 están aprobadas
en la lista de uso de emergencia sanitaria o son aprobadas por autoridades regulatorias
nacionales estrictas. Todas ellas han cumplido con requisitos rigurosos que aseguran su
calidad, inocuidad y eficacia.
2.2
Tipos de vacunas
En general las vacunas de acuerdo al antígeno pueden ser vacunas vivas atenuadas o vacunas
inactivadas o muertas.
Tabla N°2: Clasificación de las vacunas y el esquema boliviano
Clasificación
Vacunas vivas atenuadas
Virales
Fraccionadas
Bacterianas
Subunidades
Toxoides
Polisacáridas
Polisacáridos puros
Polisacáridos conjugados
Antipolio Oral (bOPV)
SRP
SR
Anti-rotavirus
Anti amarílica
BCG
IPV
Rabia
Anti Influenza
Pertussis
Anti-hepatitis B
Anti Influenza
Pertussis acelular
VPH
Contra difteria
Contra tétanos
Neumococo 13valente
Haemophlilus tipo b
Manual Técnico del Programa Ampliado de Inmunización
Bacterianas
Vacunas inactivas o muertas
Enteras
Virales
Tipo de vacuna
47
Vacunas contra la COVID-19
Vacunas de
vacunas que usan uno o varios
ácidos nucleicos genes del coronavirus para provocar
(ADN, ARN)
una respuesta inmunitaria.
Vacunas de
vectores virales
Vacunas de
virus completo
BNT162 (3 LNP-mRNAs),
también conocida como
“Comirnaty” Pfizer
mRNA-127 Moderna
ChAdOx1-2 - (AZD1222)
(AstraZeneca)
Gamaleya, SputnikV,
Janssen.
vacunas que usan un virus (vector
replicante o no replicante) para
transportar genes del coronavirus
a las células y provocar una
respuesta inmunitaria.
vacunas que usan una versión debilitada Vacuna de virus inactivado
(atenuada) o inactivada del coronavirus
contra el SARS-CoV-2 (Vero
para provocar una respuesta inmunitaria. cell), nombre de la vacuna:
BBIBP-CorV (sinopharm)
Fuente: PAI/MSyD
2.2.1
Las vacunas vivas atenuadas
Son producidas por modificación del virus o bacteria en laboratorio, el organismo resultante
retiene su capacidad de replicación y de producir inmunidad duradera, usualmente no causa
enfermedad. Entre sus desventajas están la replicación sin control y la interacción con otros
antígenos y anticuerpos, por lo que estas vacunas no se aplican en personas con compromiso
inmunológico VIH (+), con leucemia o personas que están utilizando algunos medicamentos.
2.2.2
Las vacunas inactivadas o muertas
Serie: Documentos Técnico Normativos
Esta vacuna se compone de microorganismos inactivados (térmica o químicamente), de
fracciones o subunidades de los mismos, incapaces de reproducirse. Y, por ello, incapaces de
producir la enfermedad en el huésped o de transmitirse a otro sujeto. Se destruye la capacidad
del patógeno para replicarse, pero se mantiene “intacto” para que el sistema inmune lo pueda
reconocer.
48
Estas vacunas generalmente no son afectadas por los anticuerpos maternos circulantes en
los primeros meses de vida y, por lo tanto, generan respuesta inmune a menor edad. Además,
son más estables y toleran mejor las condiciones ambientales cambiantes.
Por lo general, estimulan fundamentalmente la inmunidad humoral y preparan la memoria
inmunológica e incluso en algunos casos, sobre todo cuando se administran con adyuvantes
o sistemas de liberación, pueden estimular la inmunidad mediada por linfocitos T, requieren
siempre de múltiples dosis.
Vacunas en base a células enteras: este tipo de vacunas contienen el virus o la bacteria
completa tal el caso del componente antipertusis de la pentavalente o DPT.
Vacunas fraccionadas: las vacunas de fracciones o subunidades son preparaciones purificadas
o sintetizadas de determinados componentes (proteínas, péptidos, carbohidratos, toxoides) de
microorganismos. Solo incluyen los antígenos que mejor estimulan el sistema inmunológico.
En algunos casos, estas vacunas utilizan epítopos, las porciones determinantes del antígeno
que los anticuerpos o las células T reconocen y a las cuales se adhieren. Debido a que estas
vacunas contienen solo los antígenos esenciales, las reacciones adversas son menores.
Vacunas de fracciones constituidas por proteínas, sintéticas: son vacunas que contienen
epítopos microbianos con mayor capacidad inmunogénica sintetizados con gran especificidad
en laboratorio mediante la tecnología de ADN recombinante.
Las vacunas obtenidas por ingeniería genética: en estas vacunas la producción artificial
de proteínas de superficie y sus fracciones activas, mediante clonaje molecular y síntesis
orgánica, presentan algunas ventajas sobre las vacunas tradicionales, debido principalmente
a que no son infecciosas; además de no producir eventos secundarios indeseables.
Vacunas con toxoides: para la elaboración de estas vacunas se toman estas toxinas y se las
inactiva en base a formalina, solución formaldehido y agua esterilizada. Estas toxinas “con
acción tóxica destruida” se denominan toxoides, son muy seguras para utilizarlas. Cuando el
sistema inmunológico recibe una vacuna con toxoides inocuos aprende a combatir la toxina
natural. El sistema inmunológico produce anticuerpos que captura y bloquean la toxina como
las vacunas dT y pentavalente que contienen estos toxoides.
Vacunas polisacáridas: estas vacunas son el único tipo de vacuna inactiva cuyo antígeno está
compuesto de largas cadenas de moléculas de glucosa que forman la cápsula externa de la
superficie de ciertas bacterias; pueden ser de dos tipos, puros y conjugados.
Vacunas polisacáridas conjugadas: estas vacunas resultan de la conjugación de los antígenos
polisacáridos capsulares con proteínas transportadoras, fundamentalmente las atóxicas de
toxina diftérica, tetánica o de proteína de membrana del meningococo B. A diferencia de las
simples, son inmunógenas desde los primeros meses de la vida, confieren inmunidad duradera,
y generan fenómenos de memoria inmunológica con las revacunaciones.
2.2.3
Vacunas Anti COVID-19
Las vacunas de ácidos nucleicos que se subdividen en ADN y ARNm contienen material del
virus que causa la COVID-19, el cual instruye a nuestras células a crear una proteína inocua
que es exclusiva del virus. Una vez que nuestras células copian la proteína, destruyen el
material genético de la vacuna. Nuestro organismo reconoce que esa proteína no debería
estar presente y crea linfocitos T y linfocitos B que recordarán cómo combatir el virus que
causa la COVID-19 si nos infectamos en el futuro.
Las vacunas de virus inactivados incluyen versiones inactivadas del SARS COV2, estos
virus muertos carecen de la capacidad de producir enfermedad. Este tipo de vacuna suele
producir una menor reaccion inmunologica pero con la ventaja de ser mas seguras. Una vez
que recibimos la vacuna, nuestro organismo reconoce que el virus inactivado no debería estar
presente y crea linfocitos T y anticuerpos que recordarán cómo combatir el virus vivo causante
de la COVID-19 si nos infectamos en el futuro.
Manual Técnico del Programa Ampliado de Inmunización
En la actualidad, hay tres tipos principales de vacunas contra la COVID-19:
49
Las vacunas de vectores virales que pueden ser replicativas y no replicativas, contienen
una versión modificada de otro virus diferente del virus que causa la COVID-19. Dentro de la
envoltura del virus modificado, hay material del virus que causa la COVID-19. Esto se llama
“vector viral”. Una vez que el vector viral está en nuestras células, el material genético les da
instrucciones a las células para que produzcan una proteína que es exclusiva del virus que
causa la COVID-19. Con estas instrucciones, nuestras células hacen copias de la proteína.
Esto despierta en nuestro organismo una respuesta y empieza a crear linfocitos T y linfocitos
B que recordarán cómo combatir el virus si nos llegamos a infectar en el futuro.
2.3
Componentes de la vacuna
Antígeno: sustancia que estimula la producción de anticuerpos.
Líquido de suspensión: puede ser agua destilada o solución salina o el medio biológico donde
se ha producido el inmunobiológico.
Adyuvantes: hidróxido y fosfato de aluminio, escualeno, ASO3 y ASO4 (productos naturales)
Tienen una actividad inmunoestimulante, sin ser inmunogénicos. En algunas vacunas con
microorganismos muertos y fracciones de los mismos se utilizan compuestos de aluminio,
alumbre o calcio para incrementar la respuesta inmune. No representan ningún peligro para el
ser humano, las vacunas que los contienen deben ser administradas intramuscularmente. Si
son administradas subcutáneamente pueden generar reacciones adversas locales (nódulos
subcutáneos en el sitio de inyección de las vacunas), y contienen cristales de aluminio.
Estabilizador: gelatina que suele ser de origen porcino, que puede ser causante de reacciones
alérgicas.
Preservantes o conservantes: el timerosal contiene etil mercurio, derivado biodegradable y
metabolizable del mercurio que no se acumula en el organismo. Se utiliza para prevenir o
inhibir crecimiento bacteriano en los cultivos virales o en el producto final o para estabilizar
el antígeno. Es bacteriostático de bacterias gram positivas y gram negativas y activo frente a
hongos y levaduras en frascos multidosis.
Serie: Documentos Técnico Normativos
Antibióticos neomicina: se usan para prevenir la contaminación bacteriana del producto
durante su fabricación. Se han descrito tanto reacciones locales como sistémicas con este
antibiótico, por lo que hay que estar alertas.
50
Medio de cultivo biológico: células de embrión de pollo, la prevalencia de alergia al huevo en la
infancia se estima en 2%, en pacientes sensibilizados puede ocasionar reacciones alérgicas.
Proteínas residuales de levadura: utilizadas en la fabricación de cultivos de Saccharomyces
cerevisiae, tienen el riesgo teórico de producir reacción alérgica de 1 por 1.000.000 de dosis.
Aunque no se ha detectado inducción de Ig E específica frente a proteínas de levadura, tras la
vacunación ni en personas con antecedentes de reacciones de hipersensibilidad inmediata.
Se recomienda precaución en personas que hayan desarrollado una reacción anafiláctica a
una dosis anterior de vacuna.
2.4
Vía de administración de vacunas
Es la forma en que una vacuna ingresa al organismo para tener efecto inmunológico. Se
tienen establecidas vías específicas para cada vacuna con el propósito de evitar efectos
indeseables, locales o generales, y para asegurar una máxima eficacia de la vacuna. La rapidez
de la absorción, depende de la vía de administración elegida para cada vacuna.
Las vías de administración se clasifican en orales y parenterales (intradérmica, subcutánea e
intramuscular).
Vía oral
Se utiliza para la administración de las
vacunas antipolio y antirotavÍrica. Mediante
esta vía, la vacuna se absorbe a través de la
mucosa gastrointestinal.
b.
Figura 3: Vía oral
a.
Vía parenteral
Las vacunas inyectables deben aplicarse
en el lugar donde la inmunogenicidad sea
mayor. Se deben usar agujas con la longitud
y calibre adecuados.
Vía de administración intradérmica para aplicar de manera correcta, el ángulo de la jeringa debe
ser de 15º. Se aplica la vacuna BCG por las características del tejido y su poca distribución de
vasos sanguíneos. Su absorción es lenta; porque admite muy poca cantidad de líquido vacunal.
Vía subcutánea: para aplicar la vacuna correctamente el ángulo de la jeringa debe ser de
45º. Se aplican las vacunas SRP, SR y antiamarílica, debido a que el tejido subcutáneo al ser
irrigado y laxo, facilita la expansión del proceso inflamatorio local producido por la vacuna y,
su absorción.
Manual Técnico del Programa Ampliado de Inmunización
Existen tres tipos de técnicas, intradérmica,
subcutánea e intramuscular. Se administra
la vacuna BCG por vía intradérmica, por
vía subcutánea las vacunas de SRP, SR y
Antiamarílica; y por vía intramuscular las
vacunas de influenza, VPH, dT, Antihepatitis
B, Neumocócica IPV, Pentavalente y Anti
COVID-19.
Figura 4: Vía parenteral
Cada vacuna tiene su vía específica
de administración, con el fin de evitar
efectos indeseables tanto locales como
generalizados (ESAVl).
51
Vía intramuscular: para aplicar correctamente el ángulo de la jeringa debe ser de 90º. Esta
vía se utiliza para las vacunas pentavalente, dT, influenza, hepatitis B, antineumocócica, la
vacuna inyectable contra la poliomielitis (IPV) y anti COVID-19. Esta vía permite aplicar mayor
cantidad de líquido vacunal, produciéndose con mayor rapidez la absorción a través de los
capilares sanguíneos y generando una pronta respuesta inmunitaria.
Importante: Las vacunas como la pentavalente, dT y hepatitis B, que contienen
adyuvantes de hidróxido de aluminio, no deben aplicarse por vía intradérmica ni
subcutánea porque producen granulomas y necrosis.
Ninguna vacuna debe aplicarse por vía intravenosa.
2.5
Región anatómica
a.
Fuente: PAI/MSyD
Figura 7: Región del muslo
Serie: Documentos Técnico Normativos
Figura 6: Región del muslo
Figura 5: Región deltoidea
La vacuna se debe aplicar cuatro dedos por
debajo de la articulación acromion clavicular o
en el tercio medio de la cara externa del músculo
deltoides.
Esta región se utiliza para la inyección
intramuscular en mayores de 1 año.
La persona a vacunar debe estar sentada y se
debe cumplir estrictamente con lo indicado, para
evitar lesiones en el nervio circunflejo (rama del
plexo braquial)
Fuente: PAI/MSyD
52
Región deltoidea
b.
Región del muslo
Esta área abarca la superficie comprendida
entre el trocánter mayor (parte superior del
fémur) y el cóndilo externo del fémur (parte
inferior de este hueso) y se divide en tres
tercios. La inyección debe aplicarse en el tercio
medio en la cara anterior lateral externa del
muslo, vale decir en el músculo vasto externo.
Esta región se utiliza para inyección intra
muscular en menores de 1 año.
2.6
Dosis
Es la cantidad de vacuna que se administra cada vez. Medida específica que es el resultado de
estudios experimentales y clínicos para asegurar la respuesta inmunológica, pues una mayor
cantidad no aumenta la protección y una dosis menor no logra la respuesta esperada.
A. Número de dosis
Es el número de veces que se administra determinada vacuna. Para una adecuada inmunización,
se debe cumplir con el número de dosis establecido para cada vacuna en el esquema de
vacunación.
B. Intervalo entre dosis
El intervalo normado entre dosis está definido por la mejor respuesta inmunológica de cada
vacuna, por ejemplo, la respuesta óptima entre las tres primeras dosis de las vacunas antipolio,
pentavalente, antineumocócica, antirotavírica es de 2 meses.
Los esquemas acortados con intervalo mínimo de 1 mes solo se utilizan en caso de brotes.
No existe intervalo máximo entre dosis, debido a que las células T, guardan la memoria del sistema
inmunitario, por lo tanto, no es necesario reiniciar el esquema de vacunación.
Para la anti COVID-19 varía de acuerdo al tipo de vacuna desde 21 días a tres meses. Este intervalo
de vacunación se actualiza permanentemente de acuerdo a recomendaciones de la OMS.
2.7
Edad de vacunación
Son varios los factores que intervienen para determinar la edad adecuada para la vacunación.
Incluyen los riesgos específicos de enfermar según el grupo de edad, la epidemiología de
la enfermedad, la madurez del sistema inmune, la capacidad para responder a una vacuna
específica y la interferencia por inmunidad pasiva transferida por la madre.
Vacuna
BCG
Pentavalente
Número
de dosis
Única
Edad
Primera
Segunda
2 meses
4 meses
Tercera
6 meses
Cuarta
De 18 a 23
meses.
Recién nacido
Intervalo optimo Consideraciones
entre dosis
generales
Se la puede administrar,
hasta antes de cumplir
el año de edad (hasta
los 11 meses, 29 días).
Excepcionalmente se
puede iniciar o completar
A los 2 meses
dosis hasta los 4 años
de la 1ra.
y 11 meses de edad.
A los 2 meses
Es importante recuperar
de la 2da.
a niños no vacunados.
Al año de la
Se debe aplicar la dosis
tercera.
Manual Técnico del Programa Ampliado de Inmunización
Tabla N°3: Vacuna, edad, dosis, intervalo óptimo entre dosis
53
Antipolio IPV
Antipolio OPV
Quinta
4 años
Primera
2 meses
Tercera
4 meses
A los 2 meses
de la 2da.
Segunda
6 meses
Cuarta
18 meses
Quinta
4 años
A los 2 meses
de la 1ra.
Al año de la
tercera.
A los 2 años
y medio de
la cuarta.
Antineumocócica Primera
Segunda
Serie: Documentos Técnico Normativos
Antirotavirus
54
Anti Influenza
Pediátrica
2 meses
4 meses
Tercera
6 meses
Primera
Segunda
2 meses
4 meses
Primera
Segunda
De 6 a 11
meses
7 meses
Única
12 a 23 meses
A los 2 años
y medio de
la cuarta.
A los 2 meses
de la 1ra.
A los 2 meses
de la 2da.
A los 2 meses
de la 1ra.
Al mes de la
1ra dosis.
que corresponde sin
reiniciar la vacunación.
Cuando existe intervalos
largos, entre una y otra
dosis, existe memoria
inmunológica.
En el caso de haber
antecedentes de no
vacunación previa y
si el niño es mayor de
un año, se debe iniciar
con la vacuna IPV.
Excepcionalmente
se puede completar
esquema hasta los
4 años, 11 meses
y 29 días.
Hasta los 11 meses
y 29 días.
No se administran
refuerzos.
Excepcionalmente
se puede completar
esquema hasta los
11 meses y 29 días.
Considerar que mientras
más oportunamente se
administre la 2da. dosis
(hasta los 6 meses),
mayor será la efectividad
para la prevención
de la enfermedad.
Es importante que los
menores de 1 año tengan
las 2 dosis de la vacuna.
Sarampión,
Rubeola y
Paperas
SRP
Primera
12 meses
Segunda
De 18 a 23
meses.
Antiamarílica
Única
De 12 a 23
meses.
VPH
(Virus Papiloma
Humano)
Primera
dT
(*)
Primera
Niñas de
10 años
Niñas de
10 años
7 a 9 años
Segunda
Segunda
Primera
Al contacto.
A los 6 meses
de la 1ra.
Al contacto.
A los 2 meses
de la 1ra
Al contacto
Segunda
Al mes de la 1ra
Tercera
A los 6 meses
de la 2da
Al contacto.
1 mes.
6 meses.
Primera
Segunda
Tercera
Personal
de salud y
estudiantes
de ciencias
de la salud de
último año y
personas
de riesgo.
En caso de presencia de
casos confirmados de
sarampión dentro del
área, se recomienda que
el intervalo entre dosis
debe ser de 2 meses.
Una sola dosis genera
anticuerpos; no
necesita revacunarse
cada 10 años.
Caso de viajeros a
lugares endémicos,
deben vacunarse 10
días antes del viaje.
Excepcionalmente
se puede vacunar
hasta los 59 años.
No se administran
refuerzos.
No se administran
refuerzos.
Manual Técnico del Programa Ampliado de Inmunización
Hepatitis B
10 a 49 años
A los 6 meses
de la 1ra dosis.
55
Anti Influenza
adultos
SR
**Anti COVID-19
Única
Personal
de salud,
embarazadas,
mayores de
60 años y
enfermos
crónicos.
Única
De 5 a 49
años.
Dos dosis De 18 años
en adelante.
Al contacto.
Al contacto.
Dependiendo
del tipo de
vacuna.
Se priorizan grupos
vulnerables.
Los intervalos entre dosis se deben respetar, salvo en situación de control de brote.
(*) Se debe completar las dosis de dT de acuerdo a dosis pendientes de Pentavalente.
(**) Es posible que a futuro exista vacunas con una sola dosis y se determine edades diferentes de aplicación.
Fuente: PAI/MSyD.
2.8
Interferencia entre vacunas o anticuerpos
circulantes
La presencia de anticuerpos circulantes contra un antígeno vacunal puede reducir o eliminar
completamente la respuesta inmunológica de una vacuna. El grado de interferencia depende
del tipo de vacuna administrada y de la cantidad de anticuerpos en la sangre.
* Las vacunas de virus vivos atenuados deben replicarse para lograr una respuesta inmune.
La existencia de anticuerpos contra algunos de los antígenos contenidos en la vacuna,
puede impedir esa replicación. Es el caso de las vacunas SRP y antiamarílica deben ser
administradas simultáneamente; si no es posible, se debe esperar cuatro semanas entre
una y otra para evitar la interferencia en la efectividad entre ambas vacunas.
Serie: Documentos Técnico Normativos
* Vacunas vivas orales como la antipolio y antirotavírica, no interfieren con otras vacunas
vivas parenterales, como la pentavalente y anti neumococo; se deben administrar
simultáneamente.
56
* Las vacunas vivas, SRP, SR, antiamarílica y antipolio/ipv, pueden ser afectadas por la
administración de inmunoglobulinas, puesto que éstas no permiten la replicación de
los microorganismos contenidos en la vacuna. Se debe esperar 3 meses. Si ocurre a la
inversa se debe esperar al menos 2 semanas.
* Las vacunas inactivadas como la pentavalente, la dT, influenza, Antihepatitis B,
antineumocócica no son afectadas con la administración de inmunoglobulinas.
Es necesario que el personal de salud dialogue respetuosamente con la madre o tutor del
niño o niña, para que acepte la administración de vacunas inyectables simultaneas, ya que
esto no causará mayores molestias y más bien resultará en su beneficio. Así se evita las
oportunidades perdidas de vacunación.
2.9
Contraindicaciones
Son situaciones especiales en las que una vacuna no debe ser administrada. Es habitual que
se presenten situaciones donde existan las siguientes restricciones.
A. Contraindicaciones absolutas
* Reacción alérgica grave a una anterior dosis.
* Contraindicaciones especificas se describen en cada vacuna.
B. Falsas contraindicaciones
Mencionamos las más frecuentes:
* Historia familiar o individual de alergias inespecíficas.
* Historia de alergia a los antibióticos contenidos en las vacunas (salvo reacción
anafiláctica).
* Historia familiar de convulsiones después de vacunaciones.
* Historia familiar de muerte súbita en el contexto de la vacunación.
* Antecedentes individuales de convulsiones febriles.
* Enfermedad neurológica conocida, resuelta y estable o secuelas de enfermedades
neurológicas.
* Desnutrición.
* Reacciones leves a dosis previas de vacunas.
* Enfermedad aguda leve (rinitis, catarro, diarrea).
* Tratamiento antibiótico.
* Contacto reciente con una persona con patología infecciosa.
* Tratamiento con bajas dosis de corticoides, por vía oral o inhalatoria.
* Fase de convalecencia de alguna enfermedad.
2.10
Vacunación en situaciones especiales
Tabla N°4: Vacuna, edad, dosis y vía de administración en condiciones excepcionales
Vacuna
Edad
BCG
Recién nacido.
BCG
De 1 a 4 años
11 meses con
29 días.
Condición excepcional Dosis y vía de
administración
Prematuro con peso
0,1 ml
normal (por encima
Vía intradérmica
de los 2.000 Kg).
Contacto con
tuberculosis pulmonar.
0,1ml
Vía intradérmica
Manual Técnico del Programa Ampliado de Inmunización
* Lactancia.
57
Antineumocócica
Menores de
5 años.
Antineumocócica
De acuerdo
a la edad.
Serie: Documentos Técnico Normativos
Hepatitis B
58
De acuerdo
a la edad.
Comorbilidad crónica:
Nefropatías, diabetes,
hemoglobinopatías,
infección por
VIH, Síndrome de
Down neoplasia e
inmunosuprimidos.
Paciente con VIH Sida
Personas que conviven
con inmunodeprimidos.
Personas mayores a
60 años con problemas
neurológicos, diabéticos,
renales, demencia
y Parkinson.
Fracturas y fisuras
de cráneo.
Pacientes con
hemodiálisis
y enfermedad
Crónica renal.
Personas con
trasplante de órgano
sólido y precursores
hematopoyéticos.
1 dosis de 0,5ml
Vía intramuscular
Según prescripción
médica.
Una dosis de 0,5ml
Vía intramuscular según
prescripción médica.
Deben recibir las 3 dosis.
< de 1 año: 10mg
1 a 20 años: 20mg
De 20 años a más: 40mg
Esquemas acortados
/acelerados. Si el
recuento de anticuerpos
es <10Ul/ml luego de
completar el primer
esquema de vacunación
se administra un nuevo
esquema de 3 dosis. Si
no se obtiene respuesta
adecuada se considerará
que no respondió.
En pacientes con
diálisis y trasplantados
renales se debe medir
niveles de anticuerpos
anualmente y aplicar
dosis de refuerzo si los
niveles caen debajo del
nivel de protección.
Influenza
estacional
De acuerdo a la
edad y grado de
vulnerabilidad.
Sarampión
Rubeola
SR
Mayores de
5 años.
Fiebre amarilla
Vacunación
en viajeros.
Fuerzas Armadas,
0.5 ml
Policías, Bomberos,
Vía intramuscular
población privada
de su libertad
(cárceles) y centros
de rehabilitación.
Personal que trabaja en 0,5ml dosis
aeropuertos, viajeros,
Vía subcutánea
administrativos de
la cadena hotelera
La vacunación del viajero debe realizarse con
la debida anticipación (10 días antes, para
asegurar que las vacunas recomendadas se
puedan aplicar en la secuencia adecuada).
Si el viaje es imprevisto aún con poco tiempo antes
de la partida pueden tomarse medidas preventivas.
Tener en cuenta:
Edad y sexo.
Inmunizaciones previas.
Área geográfica que visitará.
Duración del viaje.
Tipo de hospedaje (hoteles,
camping, aire libre u otros).
Fuente: PAI/MSyD
2.11
Tuberculosis
En caso de enfermedad activa no tratada, está contraindicada la vacuna triple viral.
2.11.2
VIH
Es recomendable no administrar vacuna BCG u OPV a hijos de madres con VIH; ni fiebre
amarilla a personas con infección por VIH.
2.11.3
Inmunoglobulinas
Las vacunas vivas, SRP, SR, anti- amarílica y además la vacuna antipolio/IPV, pueden ser
afectadas por la administración de inmunoglobulinas, puesto que no permiten la replicación
de los microorganismos contenidos en la vacuna. Se debe esperar 3 meses. Y si ocurre a la
inversa, se debe esperar al menos 2 semanas.
Manual Técnico del Programa Ampliado de Inmunización
2.11.1
Vacunación para personas con enfermedades
previas
59
2.11.4
Corticoides
Niños y niñas que están recibiendo corticoides en dosis de 2 mg/kg día, hasta 20 mg/día
durante dos o más semanas, no pueden recibir vacunas de virus vivos atenuados.
2.11.5
Hepatitis B Todo niño, niña o persona con enfermedad hepática debe tener su esquema completo; no hay
vacuna que esté contraindicada.
2.11.6
Ictericia neonatal
No hay contraindicación a ninguna vacuna. En caso de hospitalización, cada servicio de
neonatología, debe indicar las vacunas necesarias al momento del alta.
2.11.7
Embarazo
De manera general, todas las vacunas vivas están contraindicadas por el riesgo teórico de
afectación al feto; sin embargo, en circunstancias específicas en consulta con especialistas
infectólogos y/o vacunólogos, la aplicación de estas vacunas puede realizarse, valorando el
riesgo de exposición; por ejemplo: la vacuna antiamarílica.
Si se administrara una vacuna viva y anti COVID-19 sin saber que la mujer está embarazada,
se debe hacer un seguimiento obstétrico estricto.
2.12
2.12.1
Coadministración con otros productos
Vacunación antirrábica de uso humano
Debe recibir el esquema completo y espera 30 días para recibir la dosis que corresponda de
anti COVID-19.
2.12.2
Tratamiento contra malaria
En general, no presenta contraindicación para la administración de las vacunas incluidas en
el esquema de vacunación.
Serie: Documentos Técnico Normativos
2.12.3
60
Antibióticos
El tratamiento con antibióticos no interfiere con la respuesta a las vacunas inactivadas o
vivas.
2.12.4
Trastornos Neurológicos
Las personas con afecciones neurológicas o del neuro-desarrollo deben recibir todas las
inmunizaciones de rutina, incluida la vacuna anual contra la gripe, con excepción de las dosis
repetidas de cualquier vacuna que se administren dentro de las 6 semanas siguientes al inicio
de un episodio de Síndrome de Guillan Barre.
En presencia de una enfermedad neurológica evolutiva, inestable o no filiada, es recomendable
retrasar las vacunas que pudieran desestabilizar la enfermedad, como las vacunas con
componente de tosferina, hasta que el paciente esté estable o con un diagnóstico definitivo.
2.12.5
Síndrome de Guillain-Barré
En el síndrome de Guillain-Barré (SGB) no se considera una contraindicación, sino una
precaución para la administración de las vacunas contra la gripe y el tétanos, los beneficios
de la vacuna justificarían su administración anual.
No se recomiendan las inmunizaciones durante la fase aguda del SGB, ni durante el año
siguiente; posteriormente se debe analizar primero la administración de las vacunas de forma
individual.
2.12.6
Epilepsia
En principio, para los niños epilépticos no está contraindicada ninguna vacuna; sin embargo,
la pentavalente y SRP (en casos muy raros), puede aumentar el riesgo de convulsiones,
aunque éstas son auto limitadas, asociadas a la fiebre y no dejan secuelas. En caso de
crisis convulsivas secundarias a procesos febriles, se recomienda, de forma general, la
administración de antitérmicos profilácticos.
Vacunar con sinopharm con precaución en personas con epilepsias no controladas y otros
trastornos neurológicos progresivos.
2.12.7
Enfermedades genéticas (incluido el Síndrome de Down)
Las personas con síndrome de Down (SD) tienen particular predisposición a padecer
infecciones, en particular durante sus primeros 5 años de vida; por la asociación del síndrome
con una inmunodeficiencia primaria multifactorial, pero que no suele contraindicar a ninguna
vacuna.
En general, estos pacientes deben recibir todas las vacunas indicadas en el esquema vacunal.
2.12.8
Afecciones neurológicas crónicas
2.12.9
Enfermedades desmielinizantes
En aquellos individuos portadores de alguna enfermedad neurológica desmielinizante se
recomienda tener precaución para la administración de vacuna contra VPH. Si bien no se ha
demostrado asociación causal, el riesgo no debe descartarse, por lo que es recomendable que
se consulte con el médico tratante el beneficio versus los riesgos de dicha vacunación.
2.12.10
Fístula de LCR no resuelta
La existencia de fístulas de LCR post TEC que comunican la base de cráneo con la nasofaringe,
entrañan el riesgo de migración de bacterias del tracto respiratorio alta, hacia las meninges
causando su compromiso, a veces con carácter recurrente. Considerar protección contra S.
pneumoniae y H. influenzae tipo b.
Manual Técnico del Programa Ampliado de Inmunización
Los pacientes afectados por parálisis cerebral infantil, secuelas de accidentes vasculares, del
SNC y otras afecciones neurológicas que llevan a postración suelen contraer una neumonía
bacteriana o viral, por lo que las vacunas antineumocócicas, Haemophilus influenzae tipo b e
influenza están indicadas de acuerdo al esquema de vacunación.
61
2.12.11
Implante coclear
Estos pacientes tienen un riesgo incrementado de padecer meningitis y otitis media; por ello,
está especialmente recomendada la vacunación antineumocócica secuencial debiendo ser
esta completa con esquemas 3+1 y posteriormente refuerzo con VNP23. Solo deben recibir
una única dosis de esta vacuna a lo largo de su vida. También deben recibir la vacuna contra
el Hib (Haemophilus influenzae tipo b) y la influenza anual desde los 6 meses de edad.
2.12.12
Administración simultánea de múltiples vacunas
El sistema inmune tiene la capacidad de responder simultáneamente a infinidad de antígenos,
por lo que la administración de varias vacunas al mismo tiempo, no significa riesgo alguno, ni
aumenta las reacciones adversas y evita visitas repetidas en corto tiempo al establecimiento
de salud.
2.13
Vacunación segura
62
Figura 8: Vacunación segura
Serie: Documentos Técnico Normativos
La vacunación segura constituye un componente prioritario de los programas de vacunación,
está constituido por diferentes componentes que interactúan permanentemente y son
ejecutadas simultánea y paralelamente por varios actores e instituciones, dentro y fuera del
país. El sistema de vacunación segura procura garantizar la utilización de vacunas de calidad,
transporte y almacenamiento seguro de las vacunas, prácticas de inyección segura, vigilar los
eventos supuestamente atribuibles a la vacunación o inmunización (ESAVI), disposición final
segura de los desechos y fortalecer las alianzas con los medios de comunicación para dar
mensajes claros a la población sobre las estrategias, prioridades y seguridad de la vacunación.
Fuente: PAI/MSyD.
2.13.1
Calidad e inocuidad de las vacunas
Las vacunas son resultados del desarrollo científico basado en ensayos clínicos controlados,
efectuados con la base técnica y ética requerida. Dichos ensayos siguen las siguientes fases:
* Preclínicos, toxicidad en animales.
* Fase I, o primera vez que se utiliza en los humanos; orientada a la seguridad de la vacuna,
la prueba del principio activo, reactogenicidad; población < 100 voluntarios.
* Fase II, inicio de la investigación en la población objetivo, orientada a evaluar la seguridad
y eficacia de la vacuna; dosis y esquema; población 200 a 500 individuos.
* Fase III, etapa de estudios comparados, orientada a evaluar la eficacia del producto;
interferencia con otras vacunas; este estudio se hace entre cientos y miles de individuos.
* Fase IV, etapa que contempla aspectos de seguridad y postmercadeo.
Eficacia - seguridad – son estudios experimentales (ensayos prospectivos aleatorizados) y
estudios observacionales (cohortes, casos control, tasa de ataque secundarios, comportamiento
de serotipos, etc.), en miles y decenas de miles. Los ensayos clínicos determinan cuales son
los resultados de la vacuna desde el punto de vista inmunológico y los ESAVI más frecuentes,
es decir, los que se presentan en las poblaciones estudiadas (1:50,000, por ejemplo), mismos
que se presentan durante el proceso de licenciamiento por el país productor a la Autoridad
Regulatoria Nacional para licencias internacionales y se muestran en el prospecto inicial de
vacuna.
Vigilancia postmercadeo – una vez licenciada e iniciada su utilización en población abierta,
se mantienen sistemas de vigilancia estandarizados para observar el comportamiento de la
vacuna a gran escala. De esta manera se pueden identificar efectos menos frecuentes o raros,
que no fueron evidentes durante los ensayos clínicos (1:1’000,000, por ejemplo).
Los procesos productivos empleados son efectuados utilizando estándares de buenas prácticas
de manufactura, así mismo debe ser fiscalizada de manera independiente por las Autoridades
Regulatorias Nacionales, el PAI junto a AGEMED con la asistencia técnica del Comité Nacional
de Inmunización y el Comité Nacional de Farmacovigilancia recomiendan aspectos técnicos
como la administración concomitante con otras vacunas, otros medicamentos, indicaciones
y contra indicaciones clínicas de uso de las vacunas, esquemas de vacunación.
2.13.2
Transporte y almacenamiento seguro
Para garantizar la potencia inmunizante de las vacunas, desde su elaboración hasta su
administración, la vacuna debe estar conservada en cadena de frío. El tipo de vacuna define
la norma de su conservación en la cadena de frío (entre +2º C y +8ºC, a -18ºC, a 70ºC). Las
vacunas que no han sido conservadas de acuerdo a normas pueden sufrir las siguientes
alteraciones:
* Pérdida de eficacia.
* Pérdida acumulativa e irreversible de la potencia inmunogénica.
* Cambios en la seguridad.
* Toxicidad de los productos de degradación.
* Aumento de la reactogenicidad local de las vacunas.
* Reducción del periodo de validez.
Manual Técnico del Programa Ampliado de Inmunización
Las vacunas son productos biológicos, su correcta conservación y transporte es indispensable
para garantizar su efectividad y evitar eventos adversos.
63
El monitoreo de la temperatura durante el transporte y en los diferentes niveles de la cadena
de frío debe ser continuo. El registro de temperatura es obligatorio en la recepción y entrega
de las vacunas en todos los niveles. Se tienen investigaciones operativas que revelan que en
el transporte es cuando existe más riesgo de congelación.
Prueba de agitación de las vacunas
La “prueba de agitación” fue diseñada para detectar daño por congelación en las vacunas
adsorbidas en adyuvantes de aluminio sensibles a la congelación como las vacunas DTP, dT,
Td, TT, tifoidea y contra la hepatitis B. Esas vacunas nunca deben congelarse porque esto
reduce su inmunogenia.
Cuando esas vacunas se congelan, el contenido de alumbre se suelta, tiende a aglomerarse y
sedimenta más rápido que en las vacunas que no han sufrido daño por congelación.
Si usted sospecha que se ha congelado una vacuna (por ejemplo, el termómetro marca <0C de
temperatura), realice una “prueba de agitación”.
Paso 1: Congele un vial de vacuna hasta que esté sólido; este será su vial de control –
etiquételo.
Paso 2: Permita que el vial CONGELADO se descongele completamente.
Paso 3: Seleccione una muestra de cada vacuna que usted sospecha se ha congelado –
etiquete ese vial como “SOSPECHOSO”.
Paso 4: Agite los viales CONGELADO y SOSPECHOSO.
Paso 5: Póngalos al revés y observe los viales CONGELADO y SOSPECHOSO uno al lado del
otro para comparar su velocidad de sedimentación (5-15 minutos).
Si el vial SOSPECHOSO sedimenta más lentamente que el vial CONGELADO ÚSELO (véase las
figuras a la izquierda).
Si el vial SOSPECHOSO sedimenta a la misma velocidad o más rápido que el vial CONGELADO
NO LO USE.
Serie: Documentos Técnico Normativos
Se debe realizar una Prueba de Agitación para cada grupo de vacuna.
64
Toda vacuna que tiene como adyuvante hidróxido de aluminio o fosfato de aluminio no debe
ser congelada (Vacunas pentavalente y dT).
2.13.3
Inyecciones seguras
Se define como inyección segura aquella que no perjudica al sujeto, no expone al proveedor
del servicio a ningún riesgo evitable y no produce ningún desecho que pueda ser peligroso
para otras personas.
Figura 9: Inyecciones seguras
Se basa en tres criterios importantes:
Fuente: PAI/MSyD.
A. Seguridad para quien recibe la inyección
Los aspectos relacionados con la seguridad para quien recibe la inyección de una vacuna
tienen que ver con la potencia, inocuidad y conservación de la vacuna, el manejo apropiado de
los frascos multidosis de vacuna abiertos, las técnicas de administración y el uso adecuado
de jeringas, buenas prácticas de almacenamiento y la reducción de los errores programáticos.
Fuente: PAI/MSyD.
Manual Técnico del Programa Ampliado de Inmunización
Figura 10: Siete correctos pasos
De manera práctica, el cumplimiento de los siete correctos pasos (adaptado de enfermería)
garantiza la seguridad de quien será vacunado.
65
Tabla N° 5: Buenas prácticas para inyecciones seguras
En el vacunatorio
Para la vacunación
Organice un ambiente seguro de vacunación. Higienice las manos.
Almacene solo vacunas y diluyentes
del PAI en la cadena de frío.
NO guarde medicamentos, reactivos,
muestras, ni otras sustancias, es un peligro.
Dentro del refrigerador ubique las vacunas
de acuerdo a su termo sensibilidad.
Aplique la metodología PEPS para
la utilización de las vacunas.
Monitoreo de temperatura de los equipos de
cadena de frío los siete días de la semana
y dos veces al día durante todo el año.
Aplique la política de frascos abiertos
para las vacunas multidosis.
Investigue si existe alguna
contraindicación para la vacunación.
Revise el lugar de inyección y la vía
correcta de aplicación de cada vacuna.
Verifique que sea la vacuna correcta.
Reconstituya correctamente las
vacunas con sus propios diluyentes
Administre la dosis correcta en
las cantidades indicadas.
Lea las etiquetas para verificar si son
correctas, revise fecha de expiración.
Proporcione toda la información sobre
las vacunas que se está administrando
y recomendaciones a la familia.
Fuente: PAI/MSyD.
B. Seguridad para el personal de salud
Las normas de aplicación de vacunas fueron pensadas también en la seguridad del personal
de salud, los accidentes que ocurren en los servicios de salud pueden ser evitados.
Serie: Documentos Técnico Normativos
* Prever el movimiento de la persona durante y después de la aplicación de vacunas
inyectables para evitar pinchazos con la aguja, en el caso de niños indicar a la madre la
posición correcta para la aplicación de la vacuna.
66
* No re-tapar agujas ni retirarlas después de aplicar las vacunas para prevenir pinchazos.
* Eliminar directamente las jeringas en las cajas de desecho.
* Utilizar solo el 80% de la capacidad de las cajas y colocarlas en un lugar establecido para
el desecho final oportuno.
* No acumular cajas de desecho seguro en el establecimiento de salud.
C.
Seguridad para la comunidad y el medio ambiente
Las cajas de desecho seguro con material corto punzante ya contaminado, deben ser
destruidas:
* Idealmente mediante incineración en equipos ubicados en lugares alejados de los
servicios de salud.
* En áreas urbanas entrega de las cajas de desecho a los carros de patógenos.
* Disponerlos en celdas de seguridad o rellenos sanitarios autorizados por la Alcaldía
Municipal.
* En establecimientos rurales que cuenten con terreno, disponer las cajas llenas en fosas
de seguridad de acuerdo a norma de Manejo de los Desechos peligrosos generados en
los Establecimientos de Salud.
Los frascos de vacunas usados o vencidos deben recolectarse en un recipiente y para la
disposición final utilizar los siguientes pasos:
* Desactivación química con hipoclorito de sodio al 1%
* Esterilizar los viales en autoclave y enviar al relleno sanitario municipal
* Desechar en una fosa de seguridad. Es esencial considerar que los viales que contienen
residuos biológicos, son materiales de desechos peligrosos.
2.13.4
Disposición final segura
En el marco de la Ley de gestión integral de residuos Nº755, la disposición final de los residuos
debe realizarse en rellenos sanitarios u otras instalaciones de confinamiento, las mismas
que deben contar con la infraestructura y equipamiento acorde al tipo de residuo, cantidad y
volumen, cumpliendo todas las condiciones técnicas, ambientales y de seguridad durante su
construcción, operación y cierre.
Estas instalaciones deberán funcionar prioritariamente para residuos no aprovechables. La
ubicación y funcionamiento de los rellenos sanitarios, debe realizarse de acuerdo a normas
técnicas y ambientales, una vez agotada la vida útil de los rellenos, éstos deben ingresar a
procesos de clausura, post clausura y rehabilitación cuando corresponda, con los controles
técnicos y ambientales correspondientes realizados por la autoridad competente.
2.13.5
Vigilancia de ESAVI
ESAVI, es cualquier situación de salud desfavorable, no intencionada, que ocurre después de
la administración de una vacuna y es supuestamente atribuido a esta. Puede ser un signo,
un síntoma, enfermedad o hallazgo anormal de laboratorio. Si bien existe una relación o
asociación temporal, no implica necesariamente una relación de “causa y efecto”.
La vigilancia de ESAVI comprende la definición operacional de ESAVI que desencadena la
captación y notificación de un caso, su investigación clínica, epidemiológica y de laboratorio
y que concluye con la clasificación final del evento.
La interacción de las vacunas con el organismo puede generar respuestas no deseadas
que son conocidas durante los ensayos clínicos, también existe el riesgo de defectos en la
fabricación, en el transporte y manipulación o de cualquier índole que afecta la calidad de la
vacuna, así como fallas en los dispositivos empleados en la administración de la vacuna o
diluyente.
Manual Técnico del Programa Ampliado de Inmunización
Se prohíbe la quema de residuos en sitios de disposición final, así como en aquellos en que la
norma técnica lo establezca expresamente.
67
Se debe tomar en cuenta por una parte que los beneficios de la vacunación superan
geométricamente los riesgos y que la mayor parte de las vacunas se las administra durante
los primeros años de vida y es cuando los niños son más vulnerables a ciertas enfermedades
que pueden ser coincidentes a la vacunación y equivocadamente asociadas.
La vigilancia de los ESAVI es uno de los procesos que contribuye de manera importante en la
vigilancia postmercadeo (fase IV) de las vacunas.
2.13.6
Política de frascos abiertos
Todos los frascos abiertos de vacunas multidosis precalificadas por la OMS deben descartarse
al final de la sesión de inmunización, o dentro de las seis horas de haberse abierto, cualquiera
que ocurra primero.
Algunos frascos de vacuna se podrán mantener y usar hasta 28 días después de haber sido
abierto si cumple con los cuatro criterios siguientes:
1. Que la vacuna esté actualmente precalificada por la OMS.
2. Que la vacuna tenga aprobación para ser usada hasta 28 días después de haberse abierto
el frasco, según lo determinado por la OMS.
3. Que la fecha de expiración de la vacuna no haya vencido
4. Que el frasco de la vacuna haya estado almacenado y que continúe almacenado a la
temperatura recomendada por la OMS o el fabricante, y la vacuna no debe estar dañada
por congelación
Situaciones de campañas y actividades extramuro
Las vacunas si cumplen los cuatro criterios definidos anteriormente, deben retornar a cadena
de frío para su conservación y utilización en base a procedimientos de manejo adecuado, con
la finalidad de disminuir el riesgo de contaminación de los viales hasta por 28 días. Se alienta a
que los programas departamentales de inmunización adapten su política según corresponda
a diferentes entornos.
Serie: Documentos Técnico Normativos
Tabla N°6: Política de frascos abiertos en campañas extramuro
68
Vacunas
Tiempo de uso
Política
Los frascos de
vacunas líquidas
multidosis
de bOPV, IPV,
dT, Influenza
pediátrica
y adulta.
Pueden ser
utilizadas durante
cuatro semanas
como máximo.
Que las vacunas multidosis cumplan con los 4
criterios
1. Que la vacuna esté actualmente precalificada por
la OMS.
2. Que la vacuna tenga aprobación para ser usada
hasta 28 días después de haberse abierto el frasco,
cuente con registro y hora de apertura según lo
determinado por la OMS.
BCG, Fiebre
Amarilla, SR
multidosis.
Utilizar dentro
de las 6 horas
después de su
reconstitución
con su diluyente.
IPV unidosis
Antirotavírica
Pentavalente
Antineumocócica
SRP
SR
anti Hepatitis B
Contra VPH
Al instante.
3. Que la fecha de expiración de la vacuna no haya
vencido.
4. Que el frasco de la vacuna haya estado almacenado
y que continúe almacenado a la temperatura
recomendada por la OMS o el fabricante; y la
vacuna no debe estar dañada por congelación.
Garantizar la utilización de técnicas asépticas en la
extracción del biológico y en el caso de OPVb que no
haya existido contacto con mucosas.
Pfizer, Sinopharm, Una vez abierto
Astrazéneca.
el vial se utiliza
de inmediato,
se desecha
al finalizar la
jornada.
Sputnik
Una vez abierto
el vial se utiliza
de inmediato
hasta 2 horas.
Manual Técnico del Programa Ampliado de Inmunización
IMPORTANTE: Siempre registrar fecha / hora de apertura del frasco multidosis.
Fuente: Política de Frascos Abiertos Multidosis (PFAM) de la OMS, 2014.
69
2.14
Esquema nacional de vacunación
70
Figura 11: Esquema Nacional de Vacunación
Serie: Documentos Técnico Normativos
En Bolivia se aplican 11 vacunas a lo largo de la vida, según el siguiente esquema de vacunación:
Fuente: PAI/MSyD.
CAPÍTULO 3
LAS VACUNAS DEL PAI
Índice
3.1
Introducción
74
3.2
Vacuna BCG
74
3.3
Vacuna Poliomielitis inactivada (IPV)
77
3.4
Vacuna Antipolio Oral (OPV)
81
3.5
Vacuna Pentavalente
84
3.6
Vacuna Antirotavírica
87
3.7
Vacuna Antineumocócica (13 - valente)
90
3.8
Vacuna contra Sarampión, Rubeola y Parotiditis (SRP)
93
3.9
Vacuna Antiamarílica
97
3.10
Vacuna contra la Influenza
100
3.11
Vacuna contra Sarampión - Rubeola (SR)
104
3.12
Vacuna contra el Virus del Papiloma Humano (VPH)
108
3.13
Vacuna dT para adultos
112
3.14
Vacuna Antihepatitis B
115
3.15
Vacuna Anti COVID-19 Astrazeneca
118
3.16
Vacuna Anti COVID-19 Sinopharm
121
3.17
Vacuna Anti COVID-19 Pfizer
125
3.18
Vacuna Anti COVID-19 Spunik v
131
3.19
Vacuna Anti COVID-19 Janssen
136
3.20
Vacuna Anti COVID-19 Moderna
142
3.1
INTRODUCCIÓN
En este capítulo se exponen las vacunas incluidas en el esquema nacional de vacunación, su
contenido ha sido construido en un orden parecido para facilitar su comprensión, se inicia con
una breve descripción de la vacuna, presentación, composición, efectividad, edad, dosis, vía,
lugar de administración, casos excepcionales, eventos esperados, contraindicaciones, uso
simultáneo con otra vacuna y procedimiento para aplicar la vacuna.
Serie: Documentos Técnico Normativos
3.2
74
VACUNA BCG
Descripción
La vacuna BCG contiene cepas atenuadas de Mycobacterium bovis
que forman una suspensión de bacilos vivos (Calmette Guerin),
capaces de replicarse una vez administrada la vacuna.
Tipo de vacuna
Bacteriana.
Presentación
Vacuna liofilizada en frascos de 10 dosis de 1 ml con diluyente
(solución salina específica).
Vacuna líquida, tiene presentación en frascos de 1, 5 y 10 dosis.
Composición
Principio activo: cepa viva atenuada de Bacilo Calmette Guerin. Cada
0,1 ml contiene entre: 2 x10 y 8 x10 C.F.U. Reconstituir con inyección
de cloruro sódico.
Excipientes: Glutamato de sodio
Tiempo de duración
una vez abierto
el frasco
Seis horas.
Efectividad
La eficacia de la vacuna es del 80% en el primer mes de nacimiento
y luego va disminuyendo.
Edad y esquema
de vacunación
Recién Nacido, prematuro a partir de 2.000 gramos de peso.
Dosis
0.1 ml
Número de dosis
Única.
Intradérmica, en el músculo deltoides del brazo derecho.
Consideraciones
generales
Se la puede administrar, hasta antes de cumplir el año de edad.
Casos excepcionales
En caso de contacto de niño/niña de 1 a 4 años 11 meses con 29
días con un paciente con Tuberculosis Pulmonar, se puede colocar
una dosis única de 0,1ml intradérmica.
Eventos esperados
Muy frecuentes: Es normal que se produzca una reacción leve en el
sitio en el que se aplicó la vacuna.
Frecuente: De dos a tres semanas después de la vacunación, en el
punto de la inyección se producirá una pequeña pápula de 4 a 8mm.
Su cicatrización ocurrirá espontáneamente dentro de seis a doce
semanas, dejando una cicatriz pequeña y redonda.
Raro: Absceso en el punto de la inyección o ganglios que llevan
excepcionalmente a la supuración.
Contraindicaciones
Prematuros con un peso menor a 2000 gramos.
No aplicar a niñas y niños inmunodeprimidos, que padecen cáncer o
con tratamiento inmunosupresor, cortico esteroides y radioterapia.
Uso simultaneo
con otra vacuna
Se puede aplicar simultáneamente con cualquier vacuna sean estas
virales o bacterianas.
Procedimiento para aplicar la vacuna BCG
Insumos y materiales
requeridos
*
*
*
*
Termo con paquetes fríos acordes al modelo y termómetro.
Vacuna BCG.
Diluyente específico.
Jeringa desechable de 1ml con aguja de 22Gx1 ½ para reconstituir
la vacuna.
* Jeringa AD de 0.1ml con aguja 27G x 3/8 para inyectar la vacuna.
* Torundas humedecidas en agua estéril o jabonosa.
Manual Técnico del Programa Ampliado de Inmunización
Vía y lugar de
administración
75
Procedimientos
previos a la
vacunación
Serie: Documentos Técnico Normativos
Procedimientos
para la vacunación
76
* Caja de desecho seguro, exclusivo para jeringas y agujas sin
cobertor.
* Bolsas para desechar la envoltura de la jeringa, torunda, frasco
de la vacuna de acuerdo a la norma de clasificación de desechos.
* Libreta de Salud y Desarrollo Integral Infantil.
* Material necesario de registro de vacunación.
* Lavarse las manos con la técnica adecuada.
* Sacar del termo el frasco de vacuna, comprobando que sea la
correcta.
* Verificar la fecha de expiración, lote y aspecto de la vacuna.
* Romper el frasco del diluyente, envolviendo el cuello con una gasa
estéril o algodón para evitar cortes en los dedos del vacunador.
* Cargar el diluyente con la jeringa de 1ml y la aguja 22 Gx1 ½.
* Introducir la aguja en el frasco que contiene la vacuna apoyándola
en la pared del recipiente e introducir suavemente el diluyente.
* Para asegurar una buena mezcla, tomar el frasco y realizar
movimientos circulares, hasta lograr una suspensión homogénea.
* Una vez hecha la mezcla, extraer la vacuna del frasco con la jeringa
auto bloqueante y la aguja 27 Gx3/8", aspirando 0.1 ml de vacuna
que es la dosis indicada.
* Comprobar que la dosis a aplicar sea, efectivamente, de O,1ml.
* Administre inmediatamente.
* Pedir al familiar de la niña o niño que le descubra el brazo derecho, en
el tercio medio de la cara externa del musculo deltoides.
* Limpiar con una torunda humedecida en agua estéril, hervida o
jabonosa, la región donde se va aplicar la vacuna.
* Con un movimiento de arriba hacia abajo, cuidando de no volver a
pasar la torunda por la parte limpia.
* Sostener la región a aplicar con los dedos índice y el pulgar.
* Introducir la aguja asegurándose que el bisel de la aguja este hacia
arriba e inyectar debajo de la superficie de la piel manteniendo la
jeringa con una inclinación de quince grados.
* Presione lentamente, el émbolo para introducir la vacuna a medida
que esto se hace, debe formarse una pápula.
* Retirar la aguja suavemente rotándola al mismo tiempo para que el
bisel quede hacia abajo y evitar que se produzca pérdidas de vacuna
aplicada.
* Desechar la jeringa, con la aguja sin tapar en la caja de desecho
seguro.
* El resto del material utilizado (envoltura de la jeringa, torunda, frasco
de la vacuna) desechar clasificando de acuerdo a las normas de
desecho seguro.
Registro
Recomendaciones
comunicación
interpersonal
3.3
Toda actividad de vacunación, se la debe registrar en el RNVe,
Cuaderno respectivo; además en la Libreta de Salud Infantil o Carnet
de Salud Infantil.
* Recomendar a la madre que no se debe realizar curaciones de la
pápula y que después puede provocar queloides o cicatrices en el
lugar de la aplicación.
* Es importante recalcar a la madre que, si da de lactar o se duerme
el niño, debe colocar en posición adecuada, para evitar dolor en el
sitio de la aplicación y bronco aspiración.
* En caso de llanto persistente y/o fiebre, acudir al establecimiento
de salud más próximo.
VACUNA ANTIPOLIOMIELITICA INACTIVADA (IPV)
La vacuna es preparada con suspensiones representativas de los 3
serotipos inactivados con formol: 1, 2 y 3.
Tipo de vacuna
Presentación
Viral inactivada.
Vacuna líquida, tiene presentación en frascos de 1, 5 y 10 dosis.
Composición
Principio activo, producidos en células Vero.
* Virus de la poliomielitis tipo 1 cepa Mahoney (inactivado)40 UDa.
* Virus de la poliomielitis tipo 2 cepa MEF-1 (inactivado) 8 UD.
* Virus de la poliomielitis tipo 3 cepa Saukett (inactivado)32 UD.
Excipientes: 2-fenoxietanol, Formaldehído, Medio 199 de Hanks,
Solución diluyente. La IPV puede contener trazas de estreptomicina,
neomicina o polimixina B.
Los viales multidosis de IPV pueden ser utilizados por un período de
hasta 28 días, si se cumplen los criterios.
Tiempo de uso una
vez abierto el frasco
Manual Técnico del Programa Ampliado de Inmunización
Descripción
77
Serie: Documentos Técnico Normativos
Efectividad
78
Edad y esquema
de vacunación
Una dosis:
* De 19 a 46 % contra el virus de la poliomielitis tipo 1.
* De 32 a 63 % contra el tipo 2.
* De 28 a 54 % contra el tipo 3.
Dos dosis: De 40 a 93 % contra los tres tipos y más de 90 % cuando
la vacunación se inicia después de las 8 semanas de edad.
A los dos meses la primera dosis y a los seis meses la tercera dosis.
(Donde la segunda es bOPV).
Dosis
Número de dosis
Vía y lugar de
administración
0.5 ml
Dos dosis.
Intramuscular, en el tercio medio de la cara antero lateral externa del
muslo derecho.
Consideraciones
generales
* La IPV es sensible a la congelación (a diferencia de la vacuna oral
contra la poliomielitis).
* En el caso de haber antecedentes de no vacunación previa y si el
niño es mayor de un año, se debe iniciar con la vacuna IPV.
* La prueba de agitación no sirve para determinar si la IPV se ha
congelado porque la vacuna no contiene adyuvante de aluminio.
* Ante la sospecha de congelación de la IPV se debe desechar el vial.
* Excepcionalmente, se puede iniciar el esquema más tarde y si el
niño es mayor de un año, se debe iniciar con la vacuna IPV.
* Es importante recuperar a niños menores de 5 años no vacunados.
* Se debe aplicar la dosis que corresponde sin reiniciar la vacunación,
en intervalos largos, porque existe memoria inmunológica.
Casos excepcionales
Eventos esperados
Contraindicaciones
Uso simultaneo
con otra vacuna
* De 0,5 a 1,5% de los lactantes vacunados pueden presentar
enrojecimiento en el sitio de la inyección.
* Pueden presentar dentro de las 24 a 48 horas después de la
vacunación:
• 3 a 11 % hinchazón.
• 14 a 29 % dolor.
• 0,1 % fiebre transitoria.
Reacción alérgica a la dosis previamente administrada, encefalopatía,
fiebre o convulsiones.
Alergias documentadas o conocidas a la estreptomicina, la
neomicina o la polimixina B.
Antecedentes de reacción alérgica después de una inyección previa
de IPV.
Se puede aplicar simultáneamente con cualquier vacuna, sean
estas virales y bacterianas. Por ejemplo, Vacuna antirrotavírica;
pentavalente (DPT, Haemophilus influenzae tipo b, Hepatitis B);
antineumocócica.
Procedimiento para aplicar la vacuna IPV
Insumos y materiales
requeridos
Manual Técnico del Programa Ampliado de Inmunización
Procedimientos
previos a la
vacunación
* Termo con paquetes fríos acordes al modelo y termómetro.
* Vacuna IPV.Jeringa de 0,5 ml autodestructible con aguja de
23Gx1”.
* Torundas humedecidas en agua estéril o jabonosa.
* Desechar la jeringa con la aguja sin tapar en la caja de desecho
seguro
* Caja de desecho seguro, exclusivo para jeringas y agujas sin
cobertor.
* Bolsas para desechar la envoltura de la jeringa, torunda, frasco
de la vacuna de acuerdo a la norma de clasificación de desechos.
* Libreta de Salud y Desarrollo Integral Infantil.
* Material necesario de registro de vacunación.
* Lavarse las manos con la técnica adecuada.
* Sacar del termo el frasco de vacuna, comprobando que sea la
correcta.
* Verificar la fecha de expiración, lote y aspecto de la vacuna.
* Sostener el frasco por la cubierta metálica para que la vacuna no
se caliente.
* Quitar el sello plástico superior del frasco de la vacuna y limpiar
el tapón con una torunda humedecida en agua estéril o jabonosa,
(sin exprimirla en el mismo envase).
* Extraer la vacuna del frasco utilizando la jeringa AD de 0.5 ml con
aguja 23Gx1”.
79
Procedimientos
para la vacunación
Registro
Serie: Documentos Técnico Normativos
Recomendaciones
comunicación
interpersonal
80
* Verificar que la dosis de vacuna a aplicar sea de 0,5 ml.
* Administre inmediatamente.
* Pedir al familiar de la niña o niño que le descubra el muslo derecho
(cara anterior y externa) en menores de un año. Y el deltoides
izquierdo en mayores de un año.
* Limpiar con una torunda humedecida en agua estéril, hervida o
jabonosa, la región donde se va aplicar la vacuna.
* Con un movimiento de arriba hacia abajo, cuidando de no volver a
pasar la torunda por la parte limpia.
* Sostener la región a aplicar con los dedos índice y el pulgar.
* Introducir la aguja a noventa grados en relación al muslo o al
brazo.
* Si se observa presencia de sangre en la jeringa, se debe retirar la
aguja e introducir nuevamente en otro lugar.Presione lentamente
el émbolo para introducir la vacuna.
* Fijar suavemente la piel con una torunda, cerca del sitio donde
está insertada la aguja.
* Retirar la jeringa inmediatamente después de haber introducido
la vacuna.
* Presionar ligeramente con una torunda, en el sitio de inyección.
* Desechar la jeringa, con la aguja sin tapar en la caja de desecho
seguro.
* El resto del material utilizado (envoltura de la jeringa, torunda,
frasco de la vacuna) desechar clasificando de acuerdo a las
normas de desecho seguro.
Toda actividad de vacunación, se la debe registrar en el RNVe,
Cuaderno respectivo; además en la Libreta de Salud Infantil o Carnet
de Salud Infantil.
Recomendar a los familiares:
* La fecha de la siguiente dosis, recalcando la importancia de que
se cumpla con el esquema de vacunación.
* La importancia de completar las cinco dosis de antipolio, para
asegurar la protección que se espera en el menor de 5 años.
* Que de presentarse algún síntoma y que este continúa por más
de 48 horas o se agrava, deben acudir al establecimiento de salud
más cercano.
* En caso de llanto persistente y/o fiebre, acudir al establecimiento
de salud más cercano.
* Es importante recalcar a la madre que, si da de lactar o se duerme
el niño, debe colocarlo en posición adecuada para evitar el dolor
en el sitio de la aplicación y la bronco aspiración.
* Insistir en el cuidado adecuado de la libreta de salud.
3.4
VACUNA ANTIPOLIO ORAL (bOPV)
Descripción
Tipo de vacuna
Presentación
Composición
Edad y esquema
de vacunación
Dosis
Número de dosis
Vía y lugar de
administración
Principio activo:
* Vacuna bivalente de virus atenuados de poliomielitis (cepa Sabin).
* Vacuna bOPV Cepas Sabin tipo 1 (Lsc ,2ab).
* Cepas Sabin Tipo 3 ( Leon 12ª,1b).
Excipientes:
* Cloruro de magnesio, L – arginina polisorbato 80, sulfato de
neomicina, sulfato de polimixina, rojo de fenol.
* En Bolivia se realizó el cambio (switch) en abril del año 2016, de la
vacuna OPV a la vacuna bOPV.
Uso máximo hasta cuatro semanas de acuerdo a política de frasco
abierto.
Con el esquema completo se alcanza una efectividad superior al
95%.
* 4 meses segunda dosis.
* 18 a 23 meses cuarta dosis.
* 4 años quinta dosis.
Dos gotas.
Tres dosis.
Oral.
Manual Técnico del Programa Ampliado de Inmunización
Tiempo de uso una
vez abierto el frasco
Efectividad
Vacuna bivalente de virus atenuado de la cepa Sabin de los serotipos,
I, III que producen anticuerpos secretores a nivel intestinal.
Viral atenuada.
Esta vacuna viene en frascos con goteros de plástico de 20 dosis
(40 gotas), para administración por vía oral.
81
Consideraciones
generales
Casos excepcionales
Serie: Documentos Técnico Normativos
Eventos esperados
82
Contraindicaciones
En el caso de haber esquemas interrumpidos, NO se debe reiniciar
esquema, debido a que las dosis previas, han generado memoria
inmunológica.
* Se puede aplicar la tercera dosis hasta los 4 años y 11 meses de
edad.
* Se puede iniciar el esquema más tarde. Es importante recuperar a
niños no vacunados.
* Se debe aplicar la dosis que corresponde sin reiniciar la vacunación,
en intervalos largos, porque existe memoria inmunológica.
<1% Leves:
* Fiebre, irritabilidad, malestar general, diarrea, cefalea.
Grave:
* Muy raramente se puede presentar parálisis, similar a la de la
enfermedad, causada por la vacuna. Se espera que se produzca
1 caso en 1.400.000 a 3.000.000 vacunados, especialmente
después de la segunda dosis.
* Respecto a la posibilidad de que se produzca en contactos de
riesgo, ésta es de 1 en 5.900.000.
* Hipersensibilidad a los componentes de la vacuna. polimixina o
neomixina.
* En personas inmunodeprimidas se recomienda no administrar
esta vacuna (VIH).
* Hipersensibilidad a una reacción previa.
Uso simultaneo
con otra vacuna
Se puede aplicar simultáneamente con cualquier vacuna sean estas
virales y bacterianas.
Procedimiento para aplicar la vacuna bOPV
Insumos y materiales
requeridos
Procedimientos
previos a la
vacunación
Registro
Procedimiento para
la vacunación
Termos con paquetes fríos acordes al modelo y termómetro.
Vacuna antipolio.
Cuadernos y libreta de vacunación.
Recipiente de desechos infecciosos y comunes (el frasco de la
vacuna antipolio, debe ser desechado en el recipiente de color
azul según la norma de bioseguridad).
* Lavarse las manos con la técnica adecuada.
* Sacar del termo el frasco de la vacuna observar la presentación de
la vacuna (multidosis).
* Leer la etiqueta y comprobar que sea la vacuna correcta, además
se debe verificar la fecha de expiración y lote.
* Sostener el frasco en forma vertical y retirar la tapa metálica del
frasco y colocar el gotero.
Toda actividad de vacunación, se la debe registrar en el RNVe,
cuaderno respectivo; además en la Libreta de Salud Infantil o Carnet
de Salud Infantil.
* Retirar la tapa del gotero sin tocar la punta para evitar que se
contamine.
* Sostener el gotero por la parte central.
* Colocar el gotero, hacia abajo, a cinco centímetros de la boca para
evitar que el gotero se contamine.
* Presionar el gotero suavemente y administrar dos gotas de vacuna.
* Sostener firmemente la cara del niño o niña como se muestra en
la fotografía
* Luego de aplicar la vacuna, colocar la tapa del gotero.
* Registrar la fecha de apertura en el mismo frasco y tener en
cuenta que una vez abierto, en el servicio dura cuatro semanas
con adecuada cadena de frío.
* En caso de que el niño lo escupa o vomite la vacuna es importante
repetir la dosis.
* No se debe usar ninguna vacuna cuando se note cambio de
coloración del biológico, u observe aspecto extraño, ni antes ni
después de abrir el frasco.
* Indicar a los familiares la fecha de la siguiente dosis, recalcando
la importancia de que se cumpla con el esquema de vacunación.
* Recomendar el desecho adecuado de los pañales desechables.
* Recomendar la higiene adecuada en la preparación de los
alimentos.
* Insistir en el lavado de manos posterior al uso de sanitario y
cambio de pañales.
Manual Técnico del Programa Ampliado de Inmunización
Recomendaciones
comunicación
interpersonal
*
*
*
*
83
3.5
VACUNA PENTAVALENTE
Descripción
Tipo de vacuna
Presentación
Composición
Serie: Documentos Técnico Normativos
Efectividad
84
Edad y esquema
de vacunación
Dosis
Número de dosis
Vía y lugar de
administración
La vacuna pentavalente previene contra la tosferina, difteria, tétanos
y enfermedades invasivas por Haemophilus influenzae tipo b (Hib)
y hepatitis B.
Vacuna combinada de bacterias muertas de Bordetella Pertussis,
toxoides tetánico y diftérico Ag de superficie del virus de la hepatitis
B y polisacárido de Hib
Frascos unidosis con suspensión de color blanquecino de 0,5 ml.
Toxoide diftérico, toxoide tetánico, bacilos muertos de Bordetella
pertusis, preparado purificado del antígeno de superficie del virus
de la Hepatitis B, oligosacárido capsular purificado y polisacárido
capsular de Haemophilus lnfluenzae tipo b y como adyuvante,
fosfato de aluminio.
La eficacia de la vacuna para las enfermedades son las siguientes:
* 100% para toxoide tetánico y diftérico.
* De 85% para pertussis.
* De 95 al 98% para hepatitis B.
* Superior al 95% para neumonías y meningitis por Hib.
* Primera dosis a los dos meses.
* Segunda dosis a los cuatro meses.
* Tercera dosis de los seis meses.
* Cuarta dosis a los 18 a 23 meses.
* Quinta dosis a los cuatro años.
0.5 ml.
Cinco dosis.
Menor de 1 año: Intramuscular, en el tercio medio de la cara antero
lateral externa del muslo izquierdo.
Mayor de 1 año: Intramuscular, en el músculo deltoides del brazo.
Tiempo de duración
una vez abierto
el frasco
Consideraciones
generales
Al instante.
Manual Técnico del Programa Ampliado de Inmunización
Toda vacuna que tiene como coadyuvante hidróxido de aluminio o
fosfato de aluminio no deben ser congeladas. (Vacunas pentavalente
y dT).
Para saber si la vacuna dT o pentavalente ha sido congelada, realice
la prueba de congelación.
Casos excepcionales: Se puede aplicar las primeras tres dosis hasta los 4 años y 11 meses
de edad.
Se puede iniciar el esquema más tarde. Es importante recuperar a
niños no vacunados.
Se debe aplicar la dosis que corresponde sin reiniciar la vacunación,
en intervalos largos, porque existe memoria inmunológica.
Eventos esperados
Leves, <50%: Reacción local, dolor, tumefacción, enrojecimiento
Fiebre.
Irritabilidad y síntomas inespecíficos <60%.
Llanto persistente 1.000 - 60.000/1millón.
Anafilaxia 20/1.000.000.
Encefalopatía 1/1millón.
Contraindicaciones
Reacción alérgica a la dosis previamente administrada, encefalopatía,
fiebre o convulsiones.
Uso simultaneo
Se puede aplicar simultáneamente con cualquier vacuna sean estas
con otra vacuna
virales y bacterianas.
85
Procedimiento para aplicar la vacuna PENTAVALENTE
Insumos y materiales
requeridos
*
*
*
*
*
*
*
Procedimientos
previos a la
vacunación
*
*
*
*
*
*
*
Procedimientos
para la vacunación
*
*
*
*
Serie: Documentos Técnico Normativos
*
86
*
*
*
*
*
*
Termo con paquetes fríos acordes al modelo y termómetro.
Vacuna pentavalente.
Jeringa de 0,5 ml autodestructible con aguja de 23Gx1".
Torundas humedecidas en agua estéril o jabonosa.
Caja de desecho seguro, exclusivo para jeringas y agujas sin
cobertor.
Material para desechar la envoltura de la jeringa, torunda, frasco
de la vacuna de acuerdo a la norma de clasificación de desechos.
Libretas de Salud y Desarrollo Infantil integral/ carnet de salud
infantil.
SOAPS/cuaderno de registro de vacunación.
Lavarse las manos con la técnica adecuada.
Sacar del termo el frasco de vacuna, comprobando que sea la
correcta.
Verificar la fecha de expiración, lote y aspecto de la vacuna.
Sostener el frasco por la cubierta metálica para que la vacuna no
se caliente.
Quitar el sello plástico superior del frasco de la vacuna y limpiar
el tapón con una torunda humedecida en agua estéril o jabonosa,
(sin exprimirla en el mismo envase).
Extraer la vacuna del frasco utilizando la jeringa de 0.5 ml
autodestructible con aguja 23Gx1".
Verificar que la dosis de vacuna a aplicar sea de 0,5 ml.
Administre inmediatamente.
Pedir al familiar del niño o niña que le descubra el muslo izquierdo
(cara anterior y externa) en menores de un año. Y el deltoides
izquierdo en niños mayores de un año.
Limpiar con una torunda humedecida en agua estéril, hervida o
jabonosa, la región donde se va aplicar la vacuna.
Con un movimiento de arriba hacia abajo, cuidando de no volver a
pasar la torunda por la parte limpia.
Sostener la región a aplicar con los dedos índice y el pulgar.
Introducir la aguja a noventa grados en relación al muslo o al
brazo.
Si se observa presencia de sangre en la jeringa, se debe retirar la
aguja e introducirla nuevamente en otro lugar.
Presione lentamente el émbolo para introducir la vacuna.
Fijar suavemente la piel con una torunda, cerca del sitio donde
está insertada la aguja.
Retirar la jeringa inmediatamente después de haber introducido
la vacuna.
Registro
Recomendaciones
comunicación
interpersonal
3.6
* Desechar la jeringa, con la aguja sin tapar en la caja de desecho
seguro.
* El resto del material utilizado (envoltura de la jeringa, torunda,
frasco de la vacuna) desechar clasificando de acuerdo a las
normas de bioseguridad.
Toda actividad de vacunación, se la debe registrar en el RNVe,
cuaderno respectivo; además en la Libreta de Salud Infantil o Carnet
de Salud Infantil.
* Recomendar a la madre o padre de familia que se debe evitar el
uso de paños calientes, ungüentos en el sitio de la administración
de la vacuna.
* Es importante recalcar a la madre que, si da de lactar o se duerme
el niño, debe colocar en posición adecuada, para evitar el dolor en
el sitio de inyección y bronco aspiración.
* En caso de llanto persistente y/o fiebre, acudir al establecimiento
de salud más cercano.
VACUNA ANTIROTAVÍRICA
Descripción
Tipo de vacuna
Presentación
Es una suspensión de virus vivos, atenuados de la cepa RlX4414,
que proporciona inmunidad heterotípica contra infecciones
gastrointestinales por otras cepas de rotavirus.
Vacuna de virus atenuados.
Se presenta en jeringuilla de 1.5 ml de suspensión transparente,
incolora, sin partículas visibles, lista para ser administrada por vía
oral. No requiere reconstitución o dilución.
Manual Técnico del Programa Ampliado de Inmunización
87
Composición
Tiempo de duración
una vez abierto
el frasco
Efectividad
Edad y esquema
de vacunación
Dosis
Número de dosis
Vía y lugar de
administración
Serie: Documentos Técnico Normativos
Consideraciones
generales
Casos excepcionales
88
Eventos esperados
Contraindicaciones
Principio activo:
* Rotavirus virus atenuados humano.
* Cepa RIX4414.
Excipiente:
* Sacarosa, adipato disodico, Medio de Eagle Modificado por
Dulbecco (DMEM), agua estéril.
Al instante.
La efectividad es del 90 % contra diarreas severas causadas por
rotavirus con dos dosis.
Primera dosis a los dos meses.
Segunda a los cuatro meses.
1,5 ml.
Dos dosis.
Oral (todo el contenido de la jeringa).
Mientras más oportunamente se administre la 2da. dosis (hasta los
6 meses), mayor será la efectividad.
En niños con esquemas atrasados o interrumpidos, se puede
administrar mientras sea menor de un año, pero antes de los 6
meses es mas oportuna su efectividad.
Leves: Se calcula que el 10% de los vacunados presente fiebre,
diarrea, vómito, flatulencia y dolor abdominal. Si estos síntomas se
agravan se debe acudir al establecimiento de salud más cercano.
Hipersensibilidad conocida por aplicación previa de la vacuna.
Niñas/niños con antecedentes de enfermedad gastrointestinal
crónica, incluyendo cualquier malformación congénita no corregida
(divertículo de Meckel).
Uso simultaneo
con otra vacuna
Vacunas vivas orales como la antipolio y antirotavírica, no interfieren
con otras vacunas vivas parenterales, como la pentavalente y anti
neumococo; se pueden administrar simultáneamente.
Procedimiento para aplicar la vacuna ANTIROTAVIRICA
Insumos y materiales
requeridos
*
*
*
*
*
Procedimientos
previos a la
vacunación
Procedimiento para
la vacunación
*
*
*
*
*
*
*
*
*
*
*
Registro
Toda actividad de vacunación, se la debe registrar en el RNVe,
Cuaderno respectivo; además en la Libreta de Salud Infantil o Carnet
de Salud Infantil.
Recomendaciones
comunicación
interpersonal
* Explique a los padres o acompañantes del menor acerca de la
vacuna, cuantas dosis precisa, que enfermedad previene y la
importancia de cumplir con la siguiente dosis y que vacunas le
falta.
* Recordar a los padres/madres de familia la importancia de la
tenencia y cuidado de la libreta de salud.
* Importancia del lavado de manos posterior al cambio de pañales/
uso del sanitario.
Manual Técnico del Programa Ampliado de Inmunización
*
*
Termo con paquetes fríos acordes al modelo y termómetro.
Jeringuilla con la vacuna antirotavírica.
Cajas de desecho seguro.
Recipientes para desechos infecciosos y comunes para la
envoltura de la jeringuilla, torundas de acuerdo a la norma de
clasificación de desechos.
Libreta de salud y desarrollo infantil integral/carnet de salud
infantil.
SOAPS/ cuadernos de registros de vacunación.
Lavarse las manos con la técnica adecuada.
Sacar del termo la jeringuilla con la vacuna.
Verificar la fecha de expiración, lote, aspecto, consistencia y color
del contenido de la jeringuilla.
Agitar suavemente la jeringuilla.
Quitar el cobertor de goma de la jeringuilla.
Solicitar al familiar que sostenga a la niña o niño en sus brazos e
impida que se mueva.
Sostener con una mano la cara del menor.
Con la otra mano, administrar lentamente la vacuna hacia un lado
de la boca para evitar que el menor escupa la vacuna.
Mantener la boca cerrada durante 30 a 60 segundos y verificar
que la vacuna sea deglutida.
Desechar la jeringuilla en la caja de bioseguridad.
En el caso de que el menor la escupa o vomite la vacuna, no se
repite la dosis.
Esta vacuna no debe inyectarse bajo ninguna circunstancia.
89
* Higiene adecuada en la preparación de alimentos y objetos de
juego del niño.
3.7
VACUNA ANTINEUMOCÓCICA (13 - VALENTE)
Descripción
Tipo de vacuna
Presentación
Serie: Documentos Técnico Normativos
Composición
Tiempo de uso una
vez abierto el frasco
Efectividad
Edad y esquema
de vacunación
Dosis
90
Es una vacuna Inactiva compuesta por sacáridos del antígeno
capsular del Streptococo neumoniae serotipos 1, 3, 4, 5, 6ª, 6B, 7F,
9V, 14, 18C, 19ª, 19F y 23F conjugados con la proteína diftérica CRM
197.
Vacuna bacteriana conjugada de 13 serotipos.
Es una suspensión líquida, en frascos unidosis de 0,5 ml.
Principio activo:
* Sacáridos del antígeno capsular del Streptococo Pneumoniae,
serotipos 1, 3, 4, 5, 6A, 6B, 7F, 9V,14, 18C, 19A, 19F y 23F conjugados
con proteína diftérica CRM 197. Como adyuvante 0,125 mg de
aluminio.
Excipientes:
* Conjugados con proteína diftérica CRM 197. Como adyuvante,
fosfato de aluminio 0,125 mg, Polisorbato 80, cloruro de sodio,
agua.
Al instante.
Tiene una efectividad de hasta un 97 % contra enfermedades
neumocócicas severas (meningitis y neumonías), siempre y cuando
se apliquen las tres dosis.
Primera dosis a los dos meses.
Segunda dosis a los cuatro meses.
Tercera dosis a los seis meses.
0,5 ml.
Número de dosis
Vía y lugar de
administración
Tres dosis.
Intramuscular, en el tercio medio de la cara antero lateral externa del
muslo derecho.
Consideraciones
generales
Casos excepcionales
No se administran refuerzos.
Eventos esperados
Procedimiento para aplicar la vacuna ANTINEUMOCOCICA (13 - VALENTE)
Insumos y materiales
requeridos
*
*
*
*
*
Termo con paquetes fríos acorde al modelo y termómetro.
Vacuna antineumocócica.
Jeringa AD de 0,5 ml AD con aguja de 23Gx1”.
Torundas humedecidas en agua estéril o jabonosa.
Caja de desecho seguro, exclusivo para jeringas y agujas sin
cobertor.
* Bolsas para desechar la envoltura de la jeringa, torunda, frasco
de la vacuna de acuerdo a la norma de clasificación de desechos.
Manual Técnico del Programa Ampliado de Inmunización
Contraindicaciones
Uso simultaneo
con otra vacuna
Menores de 5 años con comorbilidad crónica (Nefropatías,
cardiopatías, Diabetes, hemoglobinopatías, Síndrome de Down,
neoplasia e inmunosuprimidos), se aplica 1 dosis de 0,5ml vía
intramuscular.
Paciente con VIH Sida, de acuerdo a prescripción médica.
Muy frecuentes: dolor local.
Frecuentes: fiebre menor a 39°C, el 30% dolor en el sitio de inyección,
malestar general, irritabilidad, pérdida del apetito, somnolencia,
erupción cutánea, diarrea y vómito.
Hipersensibilidad a alguno de los componentes de la vacuna.
Se puede aplicar simultáneamente con cualquier vacuna sean estas
virales y bacterianas.
91
Procedimientos
previos a la
vacunación
*
*
*
*
*
*
*
*
Procedimiento para
la vacunación
*
*
*
*
*
*
*
*
*
*
Serie: Documentos Técnico Normativos
*
*
92
*
Registro
*
Libreta de Salud y Desarrollo Integral Infantil.
Material necesario de registro de vacunación.
Lavarse las manos con la técnica adecuada.
Sacar del termo el frasco de vacuna, comprobando que sea la
correcta.
Verificar la fecha de expiración, lote y aspecto de la vacuna.
Sostener el frasco por la cubierta metálica para que la vacuna no
se caliente.
Quitar el sello plástico superior del frasco de la vacuna y limpiar
el tapón con una torunda humedecida en agua estéril o jabonosa,
(sin exprimirla en el mismo envase).
Extraer la vacuna del frasco utilizando la jeringa de 0.5 ml
autodestructible con aguja 23Gx1".
Verificar que la dosis de vacuna a aplicar sea de 0,5 ml.
No olvidar que se debe aplicar a 2 centímetros de la vacuna IPV.
Pedir al familiar de la niña o niño que le descubra el muslo derecho
(cara anterior y externa).
Limpiar con una torunda humedecida en agua estéril, hervida o
jabonosa, la región donde se va aplicar la vacuna.
Con un movimiento de arriba hacia abajo, cuidando de no volver a
pasar la torunda por la parte limpia.
Sostener la región a aplicar con los dedos índice y el pulgar.
Introducir la aguja a noventa grados en relación al muslo.
Si se observa presencia de sangre en la jeringa, se debe retirar
la aguja e introducir nuevamente. Presione lentamente el émbolo
para introducir la vacuna.
Fijar suavemente la piel con una torunda, cerca del sitio donde
está insertada la aguja.
Retirar la jeringa inmediatamente después de haber introducido
la vacuna.
Presionar ligeramente con una torunda, en el sitio de inyección.
Desechar la jeringa, con la aguja sin tapar en la caja de desecho
seguro.
El resto del material utilizado (envoltura de la jeringa, torunda,
frasco de la vacuna) desechar clasificando de acuerdo a las
normas de desecho seguro.
Toda actividad de vacunación, se la debe registrar en el RNVe,
Cuaderno respectivo; además en la Libreta de Salud Infantil o
Carnet de Salud Infantil.
Recomendaciones
comunicación
interpersonal
3.8
* Evitar el uso de paños calientes, ungüentos en el sitio de la
administración de la vacuna.
* En caso de presentar llanto persistente y/o fiebre, acudir al
establecimiento de salud más cercano.
* Es importante recalcar a la madre que, si da de lactar o se duerme
el niño, debe colocar en posición adecuada, para evitar el dolor en
el sitio de aplicación y bronco aspiración.
VACUNA SARAMPIÓN, RUBEOLA Y PAROTIDITIS (SRP)
Descripción
Tipo de vacuna
Presentación
Efectividad
Edad y esquema
de vacunación
Dosis
Número de dosis
Vía y lugar de
administración
Virus vivos atenuados de la rubéola (cepa Wistar RA27/3), sarampión
(cepa Edmonston-Zagreb) y parotiditis (cepa Leningrad-Zagreb),
neomicina y albúmina.
La efectividad es mayor al 95% si se aplica a partir de los doce meses.
* Primera dosis a los 12 meses de edad.
* Segunda dosis a los 18 a 23 meses de edad.
0.5 ml.
Dos dosis.
Subcutánea, en el músculo deltoides del brazo izquierdo
Manual Técnico del Programa Ampliado de Inmunización
Composición
La vacuna SRP es una suspensión de cepas de virus vivos atenuados
de sarampión (Edmonston-Zagreb), virus de parotiditis (LeningradZagreb) y virus de la rubeola (Wistar RA27/3), Neomicina y albúmina.
Viral.
La vacuna SRP se presenta en frascos obscuros de 1, 5 y 10 dosis
en forma liofilizada, con diluyente especifico de 0,5 ml, 2,5 ml y 5ml.
93
Tiempo de uso una
vez abierto el frasco
Consideraciones
generales
Casos excepcionales
Serie: Documentos Técnico Normativos
Eventos esperados
94
Contraindicaciones
Al instante.
En caso de presencia de casos confirmados de sarampión dentro del
área, se recomienda que el intervalo entre dosis debe ser de 1 mes.
Se puede aplicar la segunda dosis a las 4 semanas de haber recibido
la primera dosis.
Se recomienda vacunar con la SRP a partir del año hasta los menores
de 5 años (no debe administrarse a mayores de cinco años debido
a que el componente de parotiditis de la vacuna podría causar
encefalitis).
Excepcionalmente, se puede completar dosis con SRP hasta los 4
años, 11 meses y 29 días y después de los 5 años con SR.
Del 5 al 15% de los vacunados pueden presentar fiebre entre los días
7 a 12 después de la vacunación.
El 5% puede presentar erupción generalizada que comienza entre el
día 7 al 10 después de la vacunación y dura de 1 a 2 días.
El componente de rubeola puede producir linfoadenopatía, artralgia
en un 25%, artritis en un 10% mayormente en susceptibles,
adolescentes y personas mayores.
El componente de parotiditis podría causar encefalitis dentro de los
30 días posteriores a la vacunación.
Todos estos eventos son pasajeros, pero, si llegaran a prolongarse
más allá del tiempo previsto, se debe acudir al establecimiento de
salud más cercano o comunicarse con su médico.
Reacciones alérgicas a los componentes de la vacuna (neomicina o
hipersensibilidad al huevo).
Pacientes inmunodeprimidos (leucemia, linfomas, SIDA y con
tratamiento de quimioterapia o corticoides).
Las personas que han recibido inmunoglobulina deben esperar un
mínimo de doce semanas para recibir esta vacuna.
Uso simultaneo
con otra vacuna
Recomendaciones
especiales sobre
la vacuna SRP
Procedimiento para aplicar la vacuna SARAMPION, RUBEOLA Y PAPERAS
Insumos y materiales
requeridos
* Termo con paquetes fríos acordes al modelo y termómetro.
* Vacuna SRP.
* Jeringas para la preparación 1ml 25Gx1 y administración de 0,5
ml auto destructibles con aguja de 25Gx5/8.
* Diluyente específico de la vacuna.
* Torundas humedecidas en agua estéril o jabonosa.
Manual Técnico del Programa Ampliado de Inmunización
No se debe administrar a pacientes en condiciones febriles de 38°C
o más.
Alergia grave a la primera dosis la vacuna.
Reacción anafiláctica o hipersensibilidad a algún componente de la
vacuna: gelatina, neomicina, sorbitol, etc.
Inmunodeficiencia asintomáticos (salvo infección por el virus
de la inmunodeficiencia humana en ciertas condiciones) o
inmunodepresión, incluyendo la causada por determinados
medicamentos.
Se puede administrar simultáneamente con cualquier vacuna de
virus vivos atenuados, se puede aplicar simultáneamente el mismo
día, si no fuera posible aplicar con un intervalo mínimo de 30 días.
* La alergia a la penicilina no es contraindicación
* No hay evidencia que la vacuna SRP agrave la tuberculosis.
* Se puede administrar a pacientes con leucemia en remisión y
que no hayan recibido terapia inmunosupresora en los últimos 3
meses.
* Se puede administrar la vacuna contra el sarampión, a los dos
años del trasplante de médula ósea, pero NO contra la rubéola ni
contra las paperas.
* Se puede administrar la vacuna de 3 a 6 meses de haber recibido
inmunoterapia/radioterapia, siempre que la enfermedad de base
esté en remisión.
* Se puede vacunar después de 4 semanas de haber recibido
esteroides o corticoides.
* Se puede vacunar a los 3-5 meses de haber recibido hemoderivados/
inmunoglobulinas.
* En caso de brote de Sarampión, se debe iniciar la vacunación, a
partir de los 6 meses. Cuando existan madres o padres que estén
viajando con niños de 6 meses a lugares donde existan casos
confirmados de sarampión se debe iniciar la vacunación (riesgo
epidemiológico).
* En caso de que existan casos confirmados en el área, se recomienda
aplicar la segunda dosis con un intervalo de 1 mes, con carácter
excepcional (riesgo epidemiológico).
95
Procedimientos
previos a la
vacunación
Serie: Documentos Técnico Normativos
Procedimiento para
la vacunación
96
* Caja de bioseguridad para desecho seguro, exclusivo para jeringas
y agujas sin cobertor.
* Recipientes para desechos infecciosos y comunes para la
envoltura de la jeringa, torunda, frasco de la vacuna de acuerdo a
la norma de clasificación de desechos.
* Bolsas para desechar la envoltura de la jeringa, torunda, frasco
de la vacuna de acuerdo a la norma de clasificación de desechos.
* Libreta de Salud y Desarrollo Integral Infantil.
* Material necesario de registro de vacunación.
* Lavado de manos con la técnica adecuada.
* Sacar del termo el frasco de vacuna y su respectivo diluyente,
comprobando que sean los correctos.
* Verificar la fecha de expiración, Nº de lote, aspecto de la vacuna,
verificando su presentación si es unidosis o multidosis y su
diluyente específico.
* Sostener el frasco por la cubierta metálica para que la vacuna no
se caliente.
* Quitar el sello plástico superior del frasco de la vacuna y limpiar
el tapón con una torunda humedecida en agua estéril o jabonosa,
(sin exprimirla en el mismo envase).
* Utilizar la jeringa de 1 ml 25G x 1 para cargar el diluyente específico.
* Introducir el diluyente lentamente, apoyando el bisel de la aguja,
por las paredes en el frasco de vacuna.
* Agitar levemente el frasco con la vacuna para asegurar una mezcla
* Extraer la vacuna del frasco utilizando otra jeringa de 0.5 ml AD
con aguja 25Gx5/8”.
* Verificar que la dosis de vacuna a aplicar sea de 0,5 ml.
* Administre inmediatamente.
* Pedir que descubran el brazo izquierdo de la niña o niño.
* Limpiar con una torunda humedecida en agua estéril, hervida
o jabonosa, la región del tercio superior del brazo, donde se va
aplicar la vacuna.
* Con un movimiento de arriba hacia abajo, cuidando de no volver a
pasar la torunda por la parte limpia.
* Tomar el sitio de inyección de la vacunación con los dedos índice
y pulgar.
* Introducir la aguja con el bisel hacia arriba en un ángulo de 45
grados con relación a la piel.
* Soltar la piel, empujar el émbolo suavemente para aplicar la
vacuna.
* Presionar lentamente, el émbolo para introducir la vacuna.
* Retirar la jeringa inmediatamente después de haber introducido la
vacuna con un movimiento firme.
* Presionar el lugar de aplicación de la vacuna con una torunda, sin
masajear, para evitar el derrame de la vacuna hacia otros tejidos.
* Desechar la jeringa, con la aguja sin tapar en la caja de desecho
seguro.
* Desechar el resto del material utilizado (envoltura de la jeringa,
torunda, frasco de la vacuna) clasificando de acuerdo a las normas
de bioseguridad.
Registro
* Toda actividad de vacunación, se la debe registrar en el RNVe,
Cuaderno respectivo; además en la Libreta de Salud Infantil o
Carnet de Salud Infantil.
Recomendaciones
comunicación
interpersonal
* Informar y programar con los familiares la fecha de aplicación de
la 2da dosis.
* Conversar con los familiares sobre la importancia de completar el
esquema de vacunación.
* También se debe informar a los padres acerca de las enfermedades
que se previenen con esta vacuna.
3.9
VACUNA ANTIAMARÍLICA
Descripción
Manual Técnico del Programa Ampliado de Inmunización
Tipo de vacuna
Presentación
Es una suspensión de virus vivos atenuados de la cepa 17D-204,
cultivada en huevos de gallina
Viral.
Es una suspensión liofilizada en frascos de vidrio de 5 o 10 dosis
con diluyente de 2.5 ml y 5 ml, respectivamente.
97
Composición
Serie: Documentos Técnico Normativos
Tiempo de uso una
vez abierto el frasco
Efectividad
Edad y esquema
de vacunación
Dosis
Número de dosis
Vía y lugar de
administración
98
Consideraciones
generales
Casos excepcionales
Eventos esperados
Contraindicaciones
Principio activo:
* Suspensión de virus vivos atenuados, contiene la cepa 17D-204c,
cultivada en embriones de pollo.
Excipientes:
* Lactosa sorbitol, clorhidrato de L- histidina, L- alanina, cloruro
de sodio, potasio, fosfato di sódico di hidratado, fosfato mono
potásico anhidro, cloruro de calcio, sulfato de magnesio y agua.
Uso máximo hasta seis horas.
Superior al 90 %.
Dosis única aplicada entre los 12 a 23 meses.
0.5 ml.
Única.
Subcutánea, en el músculo deltoides del brazo derecho.
Una sola dosis genera anticuerpos; no necesita revacunarse cada
10 años.
Se puede vacunar a los 6 o 9 meses en casos especiales de riesgo al
virus en zonas endémicas.
Si está infectado con VIH pero no presenta síntomas activos de esta
enfermedad, puede recibir la vacuna.
* 0-42% muy frecuentes pueden presentar fiebre, dolor de cabeza y
mialgia.
* 2-5% frecuente dolor y enrojecimiento en el lugar de la inyección.
* Raro 4-5/millón Encefalitis en <6 meses y en >60 años.
* Muy raro 1-3/millón enfermedad viscerotrópica.
* Alergia al principio activo o a cualquiera de los componentes de la
vacuna o a los huevos o a las proteínas de pollo.
* Edad inferior a 6 meses o mayor a 60 años.
Uso simultaneo
con otra vacuna
* Pacientes inmunosuprimidos con tratamiento de corticoides o
quimioterapia.
* Pacientes con VIH que presenten síntomas activos de la infección.
* Antecedentes de problemas con el timo o de extirpación.
* Enfermedad acompañada de fiebre alta o moderada o una
enfermedad aguda. Se debe retrasar la vacunación.
* Embarazadas.
Se administra simultáneamente con la SRP.
Procedimiento para aplicar la vacuna ANTI AMARILICA
Insumos y materiales
requeridos
*
*
*
*
*
*
*
*
*
*
*
*
*
Procedimiento para
la vacunación
*
*
Manual Técnico del Programa Ampliado de Inmunización
Procedimientos
previos a la
vacunación
*
*
*
*
*
*
*
Termo con paquetes fríos acorde al modelo y termómetro.
Vacuna Fiebre Amarilla.
Diluyente específico de la vacuna.
Jeringa de 0,5 ml AD con aguja de 25Gx5/8 para aplicar la vacuna.
Jeringa desechable 5 ml con aguja de 22G X 1 ½ para reconstituir
la vacuna.
Torundas humedecidas en agua estéril o jabonosa.
Caja de desecho seguro, exclusivo para jeringas y agujas sin
cobertor.
Desechar el resto del material utilizado (envoltura de la jeringa,
torunda, frasco de la vacuna) clasificando de acuerdo a las normas
de bioseguridad.
Libreta de Salud y Desarrollo Integral Infantil.
Material necesario de registro de vacunación.
Lavarse las manos con la técnica adecuada.
Sacar del termo el frasco de vacuna y el diluyente.
Verificar la fecha de expiración, lote y aspecto de la vacuna.
Con la jeringa de 5 ml, extraer el diluyente de su ampolla.
Introducir el diluyente en el frasco de la vacuna deslizándolo por la
pared del mismo, evitando que se produzca espuma.
Mezclar el contenido, suavemente, con movimientos circulares
hasta tener una suspensión homogénea.
Una vez preparada la vacuna, extraer 0,5 ml en la jeringa AD con la
aguja 25G x 5/8”.
Verificar que la dosis a aplicar sea de 0,5 ml.
Administre inmediatamente.
Anotar en el frasco fecha y hora de la reconstitución de la vacuna.
No se debe utilizar después de seis horas.
Pedir al familiar del niño o niña que le descubra el brazo derecho,
el tercio superior de la cara externa del musculo deltoides y le
sostenga con firmeza.
Limpiar con una torunda humedecida en agua estéril, hervida o
jabonosa, la región donde se va aplicar la vacuna.
99
Registro
Recomendaciones
comunicación
interpersonal
3.10
VACUNA CONTRA LA INFLUENZA
Serie: Documentos Técnico Normativos
Descripción
100
* Con un movimiento de arriba hacia abajo, cuidando de no volver a
pasar la torunda por la parte limpia.
* Sostener la región a aplicar con los dedos índice y el pulgar.
* Introducir la aguja con el bisel hacia arriba, en un ángulo de 45
grados.
* Presione lentamente el émbolo, para introducir la vacuna.
* Retirar la jeringa inmediatamente después de haber introducido
la vacuna.
* Presionar ligeramente con una torunda, en el sitio de inyección.
* Desechar la jeringa, con la aguja sin tapar en la caja de desecho
seguro.
* El resto del material utilizado (envoltura de la jeringa, torunda,
frasco de la vacuna) desechar clasificando de acuerdo a las
normas de desecho seguro.
* Toda actividad de vacunación, se la debe registrar en el RNVe,
Cuaderno respectivo; además en la Libreta de Salud Infantil o
Carnet de Salud Infantil.
* Indicar que una dosis de esta vacuna es suficiente.
* En caso de llanto persistente y/o fiebre, acudir al establecimiento
de salud más cercano.
* Informar a los familiares sobre la importancia de complementar el
esquema de vacunación y las enfermedades que se previenen con
las otras vacunas.
Tipo de vacuna
Presentación
Vacuna de virus inactivados, fraccionados, trivalente porque contiene
las cepas A(H1N1), A(H3N2) y tipo B, capaces de mutar por otras
cepas circulantes en el medio.
Está hecha mediante virus de influenza fraccionados e inactivados
por inoculación en la cavidad alantoica de huevos embrionados para
mantener la antigenicidad. El antígeno del virus de influenza esta
inactivado con formaldehido.
Viral.
Frasco con suspensión líquida de 5 ml para 10 dosis.
Principio activo: Vacuna trivalente de virus inactivados,
fraccionados (Cepas AH1N1, AH3N2 Y TIPO B),
contiene 45µg de hemaglutinina (HA) por cada dosis
de 0.5ml en una relación recomendada de 15 µg de
HA para cada una de las tres cepas gripales.
A/Victoria/2570/2019(IVR-215) cepa análoga (A/
Victoria/2570/2019(H1N1) pdm09.
A (Hong Kong/267½019/VIR-208) cepa análoga (A/
Hong Kong/267½019(H3N2) y B/Victoria /705/2019(BVR11) cepa análoga (B/Washington/02/2019).
Excipiente:
Una dosis de 0.25ml contiene 7.5 µg de HA de
cada una de las tres cepas de influenza.
La presentación multidosis contiene timerosal agregado como
conservante; cada dosis de 0.5ml contiene 24.5 µg de mercurio
y cada dosis de 0.25 ml contiene 12.25 µg de mercurio.
Tiempo de uso una
vez abierto el frasco
Uso máximo hasta cuatro semanas de acuerdo a política de frasco
abierto.
Efectividad
Su efectividad llega hasta un 90% en personas sanas.
Edad y esquema
de vacunación
De seis a 11 meses:
* 1ra dosis (al contacto).
* 2da. Dosis (al mes de la 1ra dosis).
Dosis única para:
* Niños y niñas de 12 a 23 meses.
* Mayores de 60 años.
* Enfermos crónicos.
* Embarazadas.
* Personal de salud.
Dosis
* Para niñas y niños de 6 a 23 meses 0.25 ml.
* Para mayores de 60 años, enfermos crónicos, embarazadas y
personal de salud 0.5 ml.
Número de dosis
* Dos dosis (menores de 11 meses).
* Dosis única (mayores de 12 meses).
Vía y lugar de
administración
* Para niños y niñas de 6 a 23 meses: Intramuscular, en el tercio
medio de la cara antero lateral externa del muslo izquierdo.
* Para mayores de 60 años, enfermos crónicos, embarazadas y
personal de salud: Intramuscular, en el músculo deltoides del
brazo derecho.
Manual Técnico del Programa Ampliado de Inmunización
Composición
101
Serie: Documentos Técnico Normativos
102
Consideraciones
generales
Es importante que los menores de un año tengan las dos dosis de la
vacuna.
Esta vacuna debe ser administrada cada año antes del invierno en la
población vulnerable.
Registrar la fecha de apertura en el frasco y tener en cuenta que la
duración de esta vacuna es de cuatro semanas con la cadena de frío
adecuada.
Casos excepcionales
Fuerzas Armadas, Policías, Bomberos, Población privada de su
libertad (cárceles), centros de rehabilitación.
Eventos esperados
Muy frecuente: 10-15% de personas vacunadas presenten dolor,
enrojecimiento e inflamación en el sitio de la inyección. Estas
molestias durarán, generalmente, de uno a dos días.
Menos frecuentes: Menos del 1% de los vacunados podrían presentar
fiebre, escalofríos y dolor muscular.
Muy Raro: Menos de uno por cada millón de personas vacunadas
podría presentar Síndrome de Guillain – Barré.
Reacciones adversas locales:
* Sensibilidad (dolor por el roce en el sitio de la inyección).
* Dolor (sin roce).
* Enrojecimiento.
* Hinchazón.
* Moretón.
Eventos adversos sistémicos:
* Cefalea.
* Malestar general.
* Dolor muscular.
* Nauseas.
* Resfrío/ temblores.
* Fiebre.
Contraindicaciones
Antecedentes de reacción anafiláctica a dosis anteriores.
Presentación del Síndrome de Guillain-Barré con dosis anteriores.
Uso simultaneo
con otra vacuna
Se puede aplicar simultáneamente con otras vacunas del esquema.
Procedimientos para administrar la vacuna contra la INFLUENZA
Insumos y materiales
requeridos
Procedimientos
previos a la vacuna
Manual Técnico del Programa Ampliado de Inmunización
Procedimiento para
la vacunación
* Termo con paquetes fríos acordes al modelo y termómetro.
* Vacuna contra la Influenza pediátrico o de adulto.
* Jeringa de 1 ml con aguja de 23Gx1" para aplicar la vacuna a niñas
y niños.
* Jeringa de 0,5 ml autodestructible con aguja de 22Gx1 ½" para
aplicar la vacuna a mayores de edad.
* Torundas humedecidas en agua estéril o jabonosa.
* Caja de desecho seguro, exclusivo para jeringas y agujas sin
cobertor.
* Bolsas para desechar la envoltura de la jeringa, torunda, frasco
de la vacuna de acuerdo a la norma de clasificación de desechos.
* Libreta de Salud y Desarrollo Integral Infantil.
* Material necesario de registro de vacunación.
* Lavado de las manos con la técnica adecuada.
* Sacar del termo el frasco de vacuna comprobando que sea la
correcta.
* Verificar la fecha de expiración, lote y aspecto de la vacuna, retirar la
cubierta del frasco y limpiar el tapón con una torunda humedecida
en agua estéril o jabonosa, (sin exprimirla en el mismo envase).
* Extraer la vacuna pediátrica del frasco con la jeringa de 1 ml con
aguja 23Gx1"para menores de 2 años.
* Extraer la vacuna para mayores del frasco con la jeringa auto
bloqueante 0,5ml con aguja 22Gx1½" para adultos la dosis
indicada.
* Anotar en el frasco fecha y hora de la apertura de la vacuna
* Descubrir el sitio para la vacunación en el niño; menores de un año
en el muslo y el brazo en mayores de un año para la administración
de la vacuna.
* Limpiar el área donde se colocará la inyección con una torunda y
realizando un movimiento de arriba hacia abajo, cuidando de no
volver a pasar la torunda por el mismo sitio.
* Con una mano, tomar la piel entre los dedos pulgar e índice.
* Con la otra mano, tomar la jeringa, con el bisel de la aguja hacia
arriba y colocarla en un ángulo de 90 grados.
* Aplicar la vacuna por vía intramuscular profunda (90 grados).
* Observar si en la jeringa hay sangre, en ese caso, retirarla sin
extraer completamente la aguja para introducirla nuevamente en
otro lugar.
* Presionar lentamente el émbolo de la jeringa para introducir la
vacuna.
* Fijar ligeramente la piel con una torunda humedecida en agua
hervida o jabonosa cerca del sitio donde está inserta la aguja.
103
* Retirar la jeringa inmediatamente después de haber introducido
la vacuna.
* Presionar ligeramente con una torunda, en el sitio donde se
insertó la aguja sin masajear, para evitar la fuga de vacuna hacia
otros tejidos.
* Desechar la jeringa con la aguja sin tapar en la caja de desecho
seguro.
* El resto de material utilizado (envoltura de la jeringa, torunda, etc.)
desechar clasificando de acuerdo a las normas de bioseguridad.
Registro
* Toda actividad de vacunación, se la debe registrar en el RNVe,
Cuaderno respectivo; además en la Libreta de Salud Infantil o
Carnet de Salud Infantil.
Recomendaciones
/educación
interpersonal
Antes:
* Explique el tipo de vacuna, de acuerdo a la edad cuanta dosis
precisa, que enfermedad previene.
* Informar a los familiares sobre la importancia de completar el
esquema de vacunación y las enfermedades que se previenen
con las otras vacunas.
Serie: Documentos Técnico Normativos
3.11
104
VACUNA SARAMPIÓN – RUBEOLA (SR)
Descripción
La vacuna SR es una suspensión de cepas de virus vivos atenuados
de sarampión (Edmonston-Zageb) y virus de la Rubéola (Wistar RA
27/3).
Tipo de vacuna
Viral.
Presentación
La vacuna se presenta en forma liofilizada en frasco oscuro
unidosis con diluyente de 0,5 ml. También existen frascos de 5 y
10 dosis con diluyente de 5 ml.
Principio Activo: Suspensión de cepas de virus vivos atenuados
de sarampión (Edmonston-Zagreb) y virus de la rubeola (Wistar
RA27/3)
Tiempo de uso una
vez abierto el frasco
Una vez abierto tiene un uso máximo de seis horas.
Efectividad
Mayor al 95%.
Edad y esquema
de vacunación
Mayores de 5 años de acuerdo a la situación epidemiológica
Dosis
0.5 ml.
Número de dosis
Una dosis.
Vía y lugar de
administración
Subcutánea, en el músculo deltoides del brazo izquierdo.
Consideraciones
generales
Si existieran casos confirmados de sarampion, se debe aplicar una
dosis a los mayores de 5 años que no recibieron ninguna vacuna
contra el sarampion antes.
* .Administrar a pacientes con leucemia en remisión y que no hayan
recibido terapia inmunosupresora en los últimos 3 meses.
* Administrar la vacuna a los dos años del trasplante de médula
ósea (solo sarampión, NO rubeola ni paperas).
* Vacunar a los VIH positivos asintomáticos, que estén en control
de sus cargas virales, aplicando la segunda dosis a las 4 semanas
de haber recibido la primera dosis.
* Administrar la vacuna de 3 a 6 meses de haber recibido
inmunoterapia/radioterapia, siempre que la enfermedad base esté
en remisión.
* Vacunar después de 4 semanas de haber recibido esteroides o
corticoides.
Casos excepcionales
Manual Técnico del Programa Ampliado de Inmunización
Composición
105
Eventos esperados
Frecuente:
* Durante las 24 horas posteriores a la vacunación se puede
presentar dolor leve y sensibilidad en el sitio de la inyección.
Poco frecuentes:
* Del 5 al 15% de los vacunados pueden presentar fiebre entre los
días 7 a 12 después de la vacunación.
* El componente de rubeola puede producir linfoadenopatía,
artralgia en un 25%; artritis en un 10% mayormente en susceptibles,
adolescentes y personas mayores.
* El 2% de los vacunados puede presentar erupción generalizada
que comienza entre el día 7 al 10 después de la vacunación y dura
de 1 a 2 días.
Muy raro:
* La vacuna muy raramente causa reacciones alérgicas como la
urticaria, prurito y erupciones cutáneas alérgicas dentro de 24
horas después de la vacunación.
Contraindicaciones
* La vacuna no debe ser administrada a mujeres embarazadas,
debido al riesgo teratógeno.
* Si hay Enfermedad febril aguda >38,5 °C, debe posponerse la
vacunación hasta que remita la fiebre.
* Si hubo vacunación previa con vacuna de virus vivos en las
últimas 4 semanas, no vacunar para evitar la interferencia en la
respuesta inmunológica.
* En personas que han recibido gammaglobulinas humanas o
transfusiones sanguíneas, debe retrasarse la vacunación.
Uso simultaneo
con otra vacuna
Se puede aplicar simultáneamente con cualquier vacuna sean estas
virales o bacterianas.
Procedimientos para administrar la vacuna SARAMPION, RUBEOLA
Serie: Documentos Técnico Normativos
Insumos y materiales
requeridos
106
* Termo con paquetes fríos y termómetro.
* Vacuna SR.
* 2 Jeringas : para preparación una jeringa de 1ml 25 Gx1 y para la
administracion jeringa AD de 0,5 ml con aguja de 25Gx5/8.
* Diluyente específico de la vacuna.
* Torundas humedecidas en agua estéril o jabonosa.
* Caja de desecho seguro, exclusiva para jeringas y agujas sin
cobertor.
* Bolsas para desechar la envoltura de la jeringa, torunda, frasco
de la vacuna de acuerdo a la norma de clasificación de desechos.
* Libreta de Salud y Desarrollo Integral Infantil.
* Material necesario de registro de vacunación.
* Lavado de manos con la técnica adecuada.
* Sacar del termo el frasco de vacuna y su respectivo diluyente
comprobando que sean los correctos.
* Verificar la fecha de expiración, lote y aspecto de la vacuna, según
su presentación si es unidosis o multidosis y verificar si es el
diluyente específico.
* Sostener el frasco por la cubierta metálica para que la vacuna no
se caliente.
* Quitar el sello plástico superior del frasco de la vacuna y limpiar
el tapón con una torunda humedecida en agua estéril o jabonosa,
(sin exprimirla en el mismo envase).
* Anotar en el frasco la fecha y hora de la reconstitución de la
vacuna, si fuese multidosis.
* Utilizar la jeringa de 1ml 25 Gx1” para la dilucion
* Introducir el diluyente lentamente, apoyando el bisel de la aguja,
por las paredes en el frasco de vacuna.
* Agitar levemente el frasco para asegurar una mezcla homogénea.
* Extraer la vacuna del frasco utilizando otra jeringa de 0.5 ml AD
con aguja 25Gx5/8”
* Verificar que la dosis de vacuna a aplicar sea de 0,5 ml
* Administrar inmediatamente.
* No usar la vacuna después de seis horas de reconstituida la
vacuna.
Procedimiento para
la vacunación
* Descubrir el sitio de la inyección para la administración de la vacuna.
* Limpiar con una torunda humedecida en agua estéril, hervida o
jabonosa, la región donde se va aplicar la vacuna.
* Con un movimiento de arriba hacia abajo, cuidando de no volver a
pasar la torunda por la parte limpia.
* Sostener la región a aplicar con los dedos índice y el pulgar.
* Introducir la aguja a cuarenta y cinco grados en relación al brazo.
* Presionar lentamente el émbolo de la jeringa para introducir la
vacuna.
* Fijar suavemente la piel con una torunda, cerca del sitio donde está
insertada la aguja.
* Retirar la jeringa inmediatamente después de haber introducido la
vacuna.
* Presionar ligeramente con una torunda, en el sitio de inyección.
* Desechar la jeringa, con la aguja sin tapar en la caja de desecho
seguro.
Manual Técnico del Programa Ampliado de Inmunización
Procedimientos
previos a la
vacunación
107
* El resto del material utilizado (envoltura de la jeringa, torunda,
frasco de la vacuna) desechar clasificando de acuerdo a las
normas de desecho seguro.
Registro
* Toda actividad de vacunación, se la debe registrar en el RNVe y en
el carnet de vacunación.
Recomendaciones
/ educación
interpersonal
* Informar sobre las enfermedades que previene esta vacuna.
* Socializar la importancia del lavado de manos.
Serie: Documentos Técnico Normativos
3.12
108
VACUNA CONTRA EL VIRUS DEL PAPILOMA HUMANO (VPH)
Descripción
La vacuna protege contra la infección por el VPH que causan las
verrugas genitales, el cáncer de cuello uterino y algunos otros tipos
de cánceres. La vacuna contra el VPH es casi totalmente efectiva
para proteger contra la infección del VPH de los tipos incluidos en
la vacuna.
La vacuna del VPH sirve principalmente para prevenir el cáncer
cervicouterino y se administra a las mujeres antes del inicio sexual.
Tipo de vacuna
Vacuna recombinante en base a proteína.
Presentación
La vacuna VPH, se presenta en forma líquida, blanco, turbio en
frascos de vidrio de 1,5 y 10 dosis. No usar el producto si hay
partículas presentes o si aparece decolorado.
Principio activo:
* Proteina L1 (Saccharomyces cerevisiase) 20 µg de VPH6,40 µg de
VPH11,40 µg VPH16 y 20 µg de VHP 18.
Excipientes:
* Sustrato - Levadura.
* Adyuvante - Sulfato de hidroxifosfato de aluminio; 225 µg de
aluminio amorfo.
Otros componentes: Cloruro de Sodio, L – Histidina, polisorbato 80,
borato de sodio 35 µg y agua para inyección.
Tiempo de uso una
vez abierto el frasco
Al instante.
Efectividad
La eficacia de la vacuna del 98,2% (IC 95% 93,3 - 99,8) frente a NIC2+
relacionados con los genotipos incluidos en la vacuna (VPH 6, 11,
16 y 18) en mujeres susceptibles a estos genotipos.
La eficacia frente a neoplasia intraepitelialvulvar y vaginal de alto
grado (grado 2+) relacionadas con los genotipos incluidos en la
vacuna fue del 100% (IC 95% 82,6-100) en mujeres susceptibles
La eficacia frente a verrugas genitales relacionadas con los genotipos
VPH 6 y 11 cercana al 100% en individuos susceptibles, y una
eficacia frente a todas las verrugas genitales (independientemente
del genotipo) del 83% (Muñoz et al., 2010).
Edad y esquema
de vacunación
Niñas de diez años.
Primera dosis al contacto y segunda dosis a los seis meses de la
primera.
Dosis
0.5 ml.
Número de dosis
Dos dosis.
Vía y lugar de
administración
Intramuscular, en el músculo deltoides del brazo izquierdo.
Manual Técnico del Programa Ampliado de Inmunización
Composición
109
Serie: Documentos Técnico Normativos
110
Consideraciones
generales
*
*
*
*
Casos excepcionales
* Se puede iniciar o completar el esquema más tarde.
* Es importante recuperar a niñas de 11 años con una sola dosis.
* Se debe aplicar la dosis que corresponde sin reiniciar la vacunación,
en intervalos largos, porque existe memoria inmunológica.
Eventos esperados
Leves: dolor y enrojecimiento en sitio de inyección
Moderados:
* Dolor en sitio de inyección con incapacidad temporal.
* Dolor y enrojecimiento con incapacidad temporal.
* Fiebre igual o >38ºC.
* Sincope.
* Absceso infeccioso.
Graves:
* Reacción alérgica.
* Shock anafiláctico.
* Otros.
Contraindicaciones
*
*
*
*
Uso simultaneo
con otra vacuna
No hay interferencia de la vacuna contra el VPH con otras vacunas
del PAI.
Se puede usar de manera segura en personas inmunocomprometidas
(ya sea por enfermedad o por medicamentos), cuyo tratamiento
haya concluido 3 meses antes; y/o personas infectadas con el VIH,
deben recibir 3 dosis.
No se ha comprobado interferencia de la vacuna contra el VPH con
otros medicamentos.
La vacuna VPH puede administrarse junto con otras vacunas
con microorganismos vivos o no; se recomienda que se utilicen
jeringuillas y lugares de inyección diferentes.
Debe administrarse la vacuna VPH junto con una dosis de dT si
corresponde.
La vacuna es sensible a la congelación.
No debe congelarse nunca.
Debe protegerse de la luz (fotosensibles).
Las vacunas de la VPH en ubicar en la segunda bandeja del
refrigerador.
* La niña debe permanecer sentada por 15 minutos despues del
acto de vacunación.
* No se administran refuerzos.
Alergia grave a la primera dosis la vacuna.
Embarazo.
No se debe administrar a niñas menores de 9 años.
Se pospone la vacunación en niñas que padecen una afección
febril aguda y grave>38,5 °C. hasta que se recupere.
* Administrar con precaución en niñas con antecedente de
trombocitopenia o con algún trastorno de coagulación.
Procedimiento para aplicar la vacuna VPH
Insumos y materiales
requeridos
*
*
*
*
*
Procedimientos
previos a la
vacunación
* Lavarse las manos con la técnica adecuada.
* Sacar del termo el frasco de vacuna, comprobando que sea la
correcta.
* Verificar la fecha de expiración, lote y aspecto de la vacuna.
* Sostener el frasco por la cubierta metálica para que la vacuna no
se caliente.
* Quitar el sello plástico superior del frasco de la vacuna y limpiar
el tapón con una torunda humedecida en agua estéril hervida o
jabonosa, (sin exprimirla en el mismo envase).
* Extraer la vacuna del frasco utilizando la Jeringa de 1 ml 25Gx1”
* Verificar que la dosis de vacuna a aplicar sea de 0,5 ml.
* Administre inmediatamente.
Procedimientos
para la vacunación
* Sentar a la niña.
* Pedirle que se descubra el brazo izquierdo.
* Limpiar con una torunda humedecida en agua estéril, hervida o
jabonosa, la región donde se va aplicar la vacuna.
* Con un movimiento de arriba hacia abajo, cuidando de no volver
a pasar la torunda por la parte limpia.
* Sostener la región a aplicar con los dedos índice y el pulgar.
* Introducir la aguja a noventa grados en relación al brazo.
* Si se observa presencia de sangre en la jeringa, se retira
ligeramente redireccionando la aguja.
* Presione lentamente, el émbolo para introducir la vacuna.
* Fijar suavemente la piel con una torunda, cerca del sitio donde
está insertada la aguja.
* Retirar la jeringa inmediatamente después de haber introducido
la vacuna.
* Presionar ligeramente con una torunda, en el sitio de inyección.
* Eliminar la jeringa, con la aguja sin tapar en la caja de desecho
seguro.
* Desechar el resto del material utilizado (envoltura de la jeringa,
torunda, frasco de la vacuna), clasificando de acuerdo a las
normas de desecho seguro.
Termo con paquetes fríos acorde al modelo y termómetro.
Vacuna VPH.
Jeringa de 1 ml 25Gx1”.
Torundas humedecidas en agua estéril, hervida o jabonosa.
Caja de desecho seguro, exclusivo para jeringas y agujas sin
cobertor.
* Bolsas para desechar la envoltura de la jeringa, torunda, frasco
de la vacuna de acuerdo a la norma de clasificación de desechos.
* Material necesario de registro de vacunación.
* SOAPS/cuaderno de registro de vacunación.
Manual Técnico del Programa Ampliado de Inmunización
111
Registro
Toda actividad de vacunación, se la debe registrar en el RNVe y en
el carnet de vacunación.
Recomendaciones
comunicación
interpersonal
Antes:
* Explicar el tipo de vacuna, cuanta dosis precisa, qué enfermedades
previene, qué vacunas tiene y qué le falta.
Después:
* Mantener la niña vacunada sentada por espacio de 15 minutos.
* Evitar el uso de paños calientes, fríos o ungüentos en el sitio de la
administración de la vacuna.
* Explicar la necesidad de la segunda dosis y programarla.
* En caso de llanto persistente y/o fiebre, acudir al establecimiento
de salud más cercano.
Serie: Documentos Técnico Normativos
3.13
112
VACUNA dT PARA ADULTOS
Descripción
La vacuna Antidiftérica y antitetánica para adultos consiste en una
preparación de anatoxina diftérica previamente destoxificada y
prurificada
Tipo de vacuna
Bacteriana.
Presentación
Es una suspensión líquida de color blanco grisáceo, en frascos de
vidrio de 10 dosis.
Composición
Principio activo:
* Toxoide diftérico, toxoide tetánico.
Excipientes:
* Timerosal como conservante.
Efectividad
La eficacia de la vacuna 95% para difteria y tétanos.
Edad y esquema
de vacunación
* De 7 a 9 años: dos dosis, la primera al contacto y la segunda a los
dos meses.
* De 10 a 49 años: tres dosis, la primera al contacto, la segunda
al mes de la primera y la tercera a los seis meses de la segunda
dosis.
0.5 ml.
Número de dosis
* Dos dosis en niños de 7 a 9 años, tres dosis en personas de 10 a
49 años.
* De acuerdo a antecedentes vacunales, completar o iniciar
esquema. (5 dosis)
Tiempo de uso una
vez abierto el frasco
Uso máximo hasta cuatro semanas de acuerdo a política de frasco
abierto.
Vía y lugar de
administración
Intramuscular, en el músculo deltoides del brazo.
Consideraciones
generales
Esta vacuna no puede ser congelada, de existir dudas debe realizarse
la prueba de agitación.
Casos excepcionales
Embarazadas que no puedan demostrar su vacunación, deben
recibir dos dosis de dT.
Eventos esperados
Leves: inflamación leve acompañada por fiebre transitoria,
indisposición e irritabilidad. Ocasionalmente puede formarse un
nódulo en el sitio de la inyección,
Graves No reportadas.
Contraindicaciones
Reacción severa a una dosis previa de la vacuna de toxoide diftérico
y tetánico.
Se recomienda no aplicar a personas con síndrome de Guillam Barré
en las últimas 6 semanas previas.
No aplicar a menores de 5 años.
La inmunización debe ser aplazada durante el curso de una
enfermedad aguda.
Manual Técnico del Programa Ampliado de Inmunización
Dosis
113
Uso simultaneo
con otra vacuna
Se puede aplicar simultáneamente con cualquier vacuna sean estas
virales y bacterianas.
Serie: Documentos Técnico Normativos
Procedimiento para aplicar la vacuna dT
114
Insumos y materiales
requeridos
* Termo con paquetes fríos acorde al modelo y termómetro.
* Vacuna dT.
* Jeringa de 0,5 ml AD con aguja de 22Gx1½ para adultos de 10 a
49 años, y 23Gx1-0,5ml para niñas y niños de 7 a 9 años.
* Torundas humedecidas en agua estéril, hervida o jabonosa.
* Caja de desecho seguro, exclusivo para jeringas y agujas sin
cobertor.
* Bolsas para desechar la envoltura de la jeringa, torunda, frasco
de la vacuna de acuerdo a la norma de clasificación de desechos.
* Libreta de Salud y Desarrollo Integral Infantil, Carnet de
vacunación.
* Material necesario de registro de vacunación.
Procedimientos
previos a la
vacunación
* Lavarse las manos con la técnica adecuada.
* Sacar del termo el frasco de vacuna, comprobando que sea la
correcta.
* Verificar la fecha de expiración, lote y aspecto de la vacuna.
* Cuando se sospecha que la vacuna ha sido congelada realizar la
prueba de congelación.
* Sostener el frasco por la cubierta metálica para que la vacuna no
se caliente.
* Quitar el sello plástico superior del frasco de la vacuna y limpiar
el tapón con una torunda humedecida en agua estéril o jabonosa,
(sin exprimirla en el mismo envase).
* Extraer la vacuna del frasco utilizando la jeringa correspondiente
de acuerdo al grupo de edad.
* Verificar que la dosis de vacuna a aplicar sea de 0,5 ml.
* Administre inmediatamente.
Procedimientos
para la vacunación
* Solicitar a la persona que se descubra el hombro izquierdo o
derecho.
* Limpiar con una torunda humedecida en agua estéril, hervida o
jabonosa, la región donde se va aplicar la vacuna.
* Con un movimiento de arriba hacia abajo, cuidando de no volver
a pasar la torunda por la parte limpia.
* Sostener la región a aplicar con los dedos índice y el pulgar.
* Introducir la aguja a noventa grados en relación al muslo o al
brazo.
* Si se observa presencia de sangre en la jeringa, se retira
ligeramente redireccionando la aguja.
* Presionar lentamente, el émbolo para introducir la vacuna.
* Fijar suavemente la piel con una torunda, cerca del sitio donde
está insertada la aguja.
* Retirar la jeringa inmediatamente después de haber introducido
la vacuna.
* Presionar ligeramente con una torunda, en el sitio de inyección.
* Desechar la jeringa, con la aguja sin tapar en la caja de desecho
seguro.
* El resto del material utilizado (envoltura de la jeringa, torunda,
frasco de la vacuna) desechar clasificando de acuerdo a las
normas de desecho seguro.
Toda actividad de vacunación, se la debe registrar en el RNVe y en
el carnet de vacunación.
Recomendaciones
para la comunicación
interpersonal
* Explique el tipo de vacuna, cuantas dosis se precisa, que
enfermedades previene, que vacunas tiene y que le falta.
* Informar sobre la importancia del cumplimiento de las 5 dosis y
las enfermedades que se previenen con esta vacuna.
* Evitar el uso de paños calientes, fríos o ungüentos en el sitio de la
aplicación de la vacuna
3.14
VACUNA ANTIHEPATITIS B
Descripción
Es una vacuna inactiva recombinante que contiene la subunidad de
antígeno de superficie (HBsAg) del virus de la hepatitis B, purificado
y obtenido por la técnica de ADN, tiene hidróxido de aluminio como
adyuvante y 0.005% de timerosal como conservante.
Tipo de vacuna
Viral.
Presentación
Frasco unidosis de 1 ml con una suspensión homogénea de color
blanquecino con 20 μg de antígeno de superficie purificado de la
hepatitis B.
Manual Técnico del Programa Ampliado de Inmunización
Registro
115
Serie: Documentos Técnico Normativos
116
Composición
Vacuna inactiva recombinante contiene la subunidad de antígeno
de superficie (HBsAg) del virus de la hepatitis B. purificado y
obtenido por la técnica de ADN, contiene hidróxido de aluminio
como adyuvante y 0.005% de timerosal como conservante.
Tiempo de uso una
vez abierto el frasco
Al instante.
Efectividad
La efectividad de la vacuna es del 95 al 98 % con tres dosis.
Edad y esquema
de vacunación
Personal de salud y grupos de riesgo.
Dosis
1 ml.
Número de dosis
Tres dosis:
* La 1ra. al contacto.
* La 2da. al mes de la 1ra. dosis.
* La 3ra. a los 6 meses de la 2da dosis.
Vía y lugar de
administración
Intramuscular, en el músculo deltoides del brazo.
Consideraciones
generales
No se administran refuerzos.
Casos excepcionales
* Pacientes con hemodiálisis y Enfermedad Crónica renal.
* Personas con trasplante de órgano sólido y precursores
hematopoyéticos; deben recibir las 3 dosis:
• < de 1 año: 10 μg (recien nacido 0.5ml)
• >1 año 20 μg (1 ml)
Eventos esperados
Entre el 3 y el 20% de personas vacunadas pueden presentar
dolor, calor y tumefacción en el sitio de aplicación de la vacuna,
especialmente en adultos. La fiebre se produce en un porcentaje
menor.
Contraindicaciones
* Reacciones anafilácticas a dosis previas.
* Personas que están cursando con hepatitis B.
Uso simultaneo
con otra vacuna
Se puede aplicar simultáneamente con cualquier vacuna sean estas
virales y bacterianas.
Procedimientos para aplicar la vacuna ANTIHEPATITIS B
*
*
*
*
*
*
Procedimientos
previos para la
vacunación
* Lavado de las manos con la técnica adecuada.
* Sacar del termo el frasco de vacuna, comprobando que sea la
correcta.
* Verificar la fecha de expiración, lote y aspecto de la vacuna.
* Realizar la prueba de agitación cuando se sospecha que la vacuna
ha sido congelada.
* Sostener el frasco por la cubierta metálica para que la vacuna no
se caliente.
* Quitar el sello plástico superior del frasco de la vacuna y limpiar
el tapón con una torunda humedecida en agua estéril o jabonosa,
(sin exprimirla en el mismo envase).
Termo con paquetes fríos acordes al modelo y termómetro.
Vacuna contra la Hepatitis B.
Jeringa de 1 ml autodestructible con aguja de 22Gx1½", para aplicar.
Torundas humedecidas en agua estéril o jabonosa.
Caja de desecho seguro, exclusivo para jeringas y agujas sin cobertor.
Recipientes para desechos infecciosos y comunes (envoltura de
la jeringa, torunda, frasco de la vacuna) de acuerdo a la norma de
clasificación de desechos.
* Libretas de Salud y Desarrollo Infantil integral/ carnet de salud
infantil.
* SOAPS/cuaderno de registro de vacunación.
Manual Técnico del Programa Ampliado de Inmunización
Insumos y materiales
requeridos
117
* Extraer la vacuna del frasco utilizando la jeringa de 1 ml
autodestructible con aguja 22Gx1½”.
* Con la jeringa de administración, extraer del frasco toda la vacuna
y dejar una pequeña burbuja de aire en la jeringa para que arrastre
el residuo de vacuna que queda en la luz de la aguja.
* Verificar que la dosis de vacuna a aplicar sea de 1 ml.
* Administrar inmediatamente.
Procedimiento para
la vacunación
* Descubrir el brazo izquierdo para aplicar la vacuna.
* Una vez descubierto el lugar donde se aplicará la inyección, se
debe limpiar el área con una torunda humedecida en agua estéril,
hervida o jabonosa, con un movimiento de arriba hacia abajo,
cuidando de no volver a pasar la torunda por la parte que ya se
limpió.
* Con una mano, tomar la piel entre los dedos pulgar e índice.
* Con la otra mano, sujetar la jeringa, con el bisel de la aguja hacia
arriba y en un ángulo de 90 grados puncionar en la región indicada.
* Asegurarse de que no se ha puncionado un vaso sanguíneo. Si
aparece sangre, retirar lentamente la aguja, pero sin extraerla
completamente y cambiar la dirección de la misma.
* Soltar la piel, empujar el émbolo suavemente para aplicar la
vacuna.
Serie: Documentos Técnico Normativos
* Fijar ligeramente la piel con una torunda, cerca del sitio donde
está insertada la aguja.
* Retirar la jeringa inmediatamente después de haber introducido la
vacuna con un movimiento firme.
* Presionar el lugar de aplicación de la vacuna con una torunda, sin
masajear, para evitar la fuga de vacuna hacia otros tejidos.
* Desechar la jeringa con la aguja sin tapar en la caja de desecho
seguro.
* El resto del material utilizado (envoltura de la jeringa, torunda,
frasco de la vacuna) desechar clasificando de acuerdo a las
normas de bioseguridad.
118
Registro
Toda actividad de vacunación, se la debe registrar en el RNVe y en
el carnet de vacunación.
Recomendaciones
para la educación
interpersonal
Antes:
* Explique el tipo de vacuna que recibirá, qué enfermedad previene,
cuantas dosis debe recibir, revisar el carnet de salud que vacunas
tiene y qué le falta.
* Evitar el uso de paños calientes, fríos o ungüentos en el sitio de la
administración de la vacuna.
* Explicar la importancia de recibir las 3 dosis y programarle para
las subsiguientes dosis hasta completar.
3.15
VACUNA anti covid-19 ASTRAZENECA
La vacuna es un vector viral recombinante, lo que significa que se
usa un virus como medio de entrega. Usa una versión debilitada
del virus del resfriado común de los chimpancés que codifica
instrucciones para fabricar proteínas del nuevo coronavirus y
generar una respuesta inmunológica y prevenir la infección.
Tipo de vacuna
Vector viral.
Presentación
Frasco multidosis de 5 ml. con solución incolora ligeramente parda
u opaca, libre de partículas.
Composición
Principio Activo: Adenovirus de chimpancé, Contiene:5 x 10 10 (pv)
partículas de la vacuna ChAdOx1 nCoV-19 contra el Coronavirus.
Excipientes: L: histidina, Clorhidrato de L-Histidina monohidrato,
cloruro de magnesio hexahidrato, Polissorbato 80, Etanol, Sacarosa,
Cloruro de sodio, ácido etilendiaminotetraacético (EDTA), agua para
inyecciones.
Tiempo de uso una
vez abierto el frasco
Utilizar dentro de las 6 horas siguientes.
Efectividad
Mayor al 70%.
Edad y esquema
de vacunación
Mayores de 18 años.
Dosis
0.5 ml.
Número de dosis
Dos dosis (al contacto y segunda dosis a los 28 a 90 días).
Conservación
Refrigeración de +2° C a +8° C.
Vía y lugar de
administración
Intramuscular, en el músculo deltoides del brazo izquierdo.
Manual Técnico del Programa Ampliado de Inmunización
Descripción
119
Consideraciones
generales
No se han establecido la seguridad y la eficacia de Covishield en
niños y adolescentes (< de 18 años).
Casos excepcionales: Las personas inmunocomprometidas, pueden tener una respuesta
inmune relativamente débil.
Se debe administrar con precaución a personas con trombocitopenia
y cualquier trastorno de la coagulación.
Eventos esperados
Muy frecuentes (≥1/10):
* Sensibilidad, dolor, calor, picor o moratón en el lugar de la inyección,
fatiga, escalofríos, dolor de cabeza, náuseas, vómitos, mialgia,
artralgia.
Frecuentes (≥1/100 a <1/10):
* Hinchazón o enrojecimiento en el lugar de la inyección, fiebre (≥38 °C).
Serie: Documentos Técnico Normativos
Poco frecuentes (≥1/1 000 a <1/100):
* Linfadenopatía, apetito disminuido, mareo, dolor abdominal,
hiperhidrosis (sudoración excesiva), prurito, exantema.
Muy raros (< 1/10 000):
* Se han notificado casos de trastorno neuroinflamatorio (mielitis
transversa), pero no se ha establecido una relación causal con la
vacuna ChAdOx1-S/nCoV 19 [recombinante].
120
Contraindicaciones
Se debe posponer la vacunación de personas con enfermedad febril
aguda severa (temperatura corporal superior a 38,5 °C) hasta que
desaparezca la fiebre.
Se debe posponer la vacunación de personas con COVID-19 aguda
hasta que se hayan recuperado de la enfermedad y se cumplan los
criterios para el fin de su aislamiento.
La presencia de infecciones leves, como los resfriados, o fiebre de
baja intensidad, no debe atrasar la vacunación.
Uso simultaneo
con otra vacuna
* Se puede aplicar simultáneamente con otra vacuna sean estas
virales o bacterianas.
* Se recomienda respetar un intervalo de 14 días para la aplicación
de otras vacunas.
Procedimientos para administrar la vacuna ASTRAZENECA
* Termo con paquetes fríos acorde al modelo y termómetro.
* Vacuna Astrazeneca.
* Frascos unidosis: para la administración una jeringa de 1 ml con
aguja de 25Gx 1“ o 1ml 22G x 1 ½
* Torundas humedecidas en agua estéril o jabonosa.
* Caja de desecho seguro, exclusiva para jeringas y agujas sin
cobertor.
* Bolsas para desechar la envoltura de la jeringa, torunda, frasco
de la vacuna de acuerdo a la norma de clasificación de desechos.
* Material necesario de registro de vacunación.
Procedimientos
previos a la
vacunación
* Lavado de manos con la técnica adecuada.
* Verificar y registrar la temperatura del termo.
* Sacar del termo el frasco de la vacuna. comprobando que sea el
correcto.
* Verificar la fecha de expiración, lote y aspecto de la vacuna, según
su presentación sostener el frasco por la cubierta metálica para
que la vacuna no se caliente.
* Quitar el sello plástico superior del frasco de la vacuna y limpiar
el tapón con una torunda humedecida en agua estéril o jabonosa,
(sin exprimirla en el mismo envase).
* Agitar levemente el frasco para asegurar una mezcla homogénea
antes de utilizar.
* Extraer la dosis correcta del frasco utilizando la jeringa de 1 ml
25G x 1 “ o la de 1ml 22G x 1½.
* Verificar que la dosis de vacuna a aplicar sea de 0,5 ml
* Administrar inmediatamente.
Manual Técnico del Programa Ampliado de Inmunización
Insumos y materiales
requeridos
121
Procedimiento para
la vacunación
* Descubrir el sitio de la inyección para la administración de la
vacuna.
* Limpiar con una torunda humedecida en agua estéril, hervida o
jabonosa, la región donde se va aplicar la vacuna.
* Con un movimiento de arriba hacia abajo, cuidando de no volver
a pasar la torunda por la parte limpia.
* Sostener la región a aplicar con los dedos índice y el pulgar.
* Introducir la aguja a noventa grados en relación al brazo.
* Presionar lentamente el émbolo de la jeringa para introducir la
vacuna.
* Fijar suavemente la piel con una torunda, cerca del sitio donde
está insertada la aguja.
* Retirar la jeringa inmediatamente después de haber introducido
la vacuna.
* Presionar ligeramente con una torunda, en el sitio de inyección.
* Desechar la jeringa, con la aguja sin tapar en la caja de desecho
seguro.
* El resto del material utilizado (envoltura de la jeringa, torunda,
frasco de la vacuna) desechar clasificando de acuerdo a las
normas de desecho seguro.
Registro
* Toda actividad de vacunación, se la debe registrar en el RNVe y en
el carnet de vacunación.
Recomendaciones
para la educación
interpersonal
* Evitar el uso de paños calientes o ungüentos en el sitio de la
administración de la vacuna.
* Acudir al Establecimiento de Salud más cercano si presenta algún
malestar.
* Mantener las medidas de bioseguridad: uso de barbijo, higiene de
manos frecuente y distanciamiento social.
Serie: Documentos Técnico Normativos
3.16
122
VACUNA anti covid-19 SINOPHARM
Descripción
Previene contra el SARS- CoV-2 utiliza virus inactivados, producida
por el Instituto de Productos Biológicos de Beijing - China.
Tipo de vacuna
Viral inactivada.
Presentación
Frasco unidosis de 0,5 ml y multidosis de 1 ml, que contiene de 6,5
U de antígeno coronavirus nuevo inactivado.
Principio activo:
Celulas del virus SARS-CoV2 inactivado
Excipientes: Hidrogenofosfato de disodio, cloruro de sodio,
dihidrogenofosfato de sodio, adyuvante de hidróxido de aluminio.
Tiempo de uso una
vez abierto el frasco
Al instante.
Efectividad
Mayor al 70%.
Edad y esquema
de vacunación
-De 5 a 11 años.
-Mayores de 18 años
Dosis
0.5 ml.
Número de dosis
Dos dosis con intervalo de 21 días.
Vía y lugar de
administración
Intramuscular, en el músculo deltoides del brazo izquierdo.
Manual Técnico del Programa Ampliado de Inmunización
Composición
123
Consideraciones
generales
Se establecio la seguridad de la vacuna en el grupo de 5 a 11 años.
Casos excepcionales
Las personas inmunocomprometidas, pueden tener una respuesta
inmune relativamente débil.
Se debe administrar con precaución a personas con trombocitopenia,
cualquier trastorno de la coagulación.
Eventos esperados
Más frecuentes:
Locales:
Muy frecuentes (>10%): dolor en el sitio de la inyección.
Frecuentes (1-10%): eritema, hiperemia, prurito, edema y/o
hinchazón en el sitio de la inyección Poco frecuentes <1% rash
cutáneo en el sitio de la inyección.
Generales:
Frecuentes (1-10%): fatiga, fiebre transitoria, cefalea, diarrea, tos,
disnea.
Poco frecuentes <1%: náuseas, vómito y mialgias, artralgias,
somnolencias, mareos y anorexia.
Contraindicaciones
Trastornos de la sangre como disminución en plaquetas
(trombocitopenia) o trastornos de coagulación debido al riesgo de
sangrado.
Pacientes que estén recibiendo terapia inmunosupresora.
Trastorno motor incontrolado, personas con antecedentes de shock,
enfermedades neurológicas progresivas.
Si es paciente con epilepsias no controladas.
Uso simultaneo
con otra vacuna
* Se puede aplicar simultáneamente con otra vacuna, sean estas
virales o bacterianas.
Procedimientos para administrar la vacuna Sinopharm
Serie: Documentos Técnico Normativos
Insumos y materiales
requeridos
124
* Termo con paquetes fríos acorde al modelo y termómetro.
* Vacuna Sinopharm.
* Frascos unidosis: para la administración una Jeringa 1 ml 25G x
1 “ o la de 1ml 22G x 1½.
* Torundas humedecidas en agua estéril o jabonosa.
* Caja de desecho seguro, exclusiva para jeringas y agujas sin
cobertor.
* Bolsas para desechar la envoltura de la jeringa, torunda, frasco
de la vacuna de acuerdo a la norma de clasificación de desechos.
* Material necesario de registro de vacunación.
* Lavado de manos con la técnica adecuada.
* Verificar y registrar la temperatura del termo.
* Sacar del termo el frasco de la vacuna. comprobando que sea el
correcto.
* Verificar la fecha de expiración, lote y aspecto de la vacuna, según
su presentación sostener el frasco por la cubierta metálica para
que la vacuna no se caliente.
* Quitar el sello plástico superior del frasco de la vacuna y limpiar
el tapón con una torunda humedecida en agua estéril o jabonosa,
(sin exprimirla en el mismo envase).
* Agitar levemente el frasco para asegurar una mezcla homogénea
antes de utilizar.
* Extraer la dosis correcta del frasco utilizando la Jeringa 1 ml 25G
x 1 “ o la de 1ml 22G x 1½.
* Verificar que la dosis de vacuna a aplicar sea de 0,5 ml.
* Administrar inmediatamente.
Procedimiento para
la vacunación
* Descubrir el sitio de la inyección para la administración de la
vacuna.
* Limpiar con una torunda humedecida en agua estéril, hervida o
jabonosa, la región donde se va aplicar la vacuna.
* Con un movimiento de arriba hacia abajo, cuidando de no volver
a pasar la torunda por la parte limpia.
* Sostener la región a aplicar con los dedos índice y el pulgar.
* Introducir la aguja a noventa grados en relación al brazo.
* Presionar lentamente el émbolo de la jeringa para introducir la
vacuna.
* Fijar suavemente la piel con una torunda, cerca del sitio donde
está insertada la aguja.
* Retirar la jeringa inmediatamente después de haber introducido
la vacuna.
* Presionar ligeramente con una torunda, en el sitio de inyección.
* Desechar la jeringa, con la aguja sin tapar en la caja de desecho
seguro.
* El resto del material utilizado (envoltura de la jeringa, torunda,
frasco de la vacuna) desechar clasificando de acuerdo a las
normas de desecho seguro.
Registro
* Toda actividad de vacunación, se la debe registrar en el RNVe y en
el carnet de vacunación.
Manual Técnico del Programa Ampliado de Inmunización
Procedimientos
previos a la
vacunación
125
Recomendaciones
para la educación
interpersonal
Serie: Documentos Técnico Normativos
3.17
126
* Evitar el uso de paños calientes o ungüentos en el sitio de la
administración de la vacuna.
* Acudir al Establecimiento de Salud más cercano si presenta algún
malestar.
* Mantener las medidas de bioseguridad: uso de barbijo, higiene de
manos frecuente y distanciamiento social. Informar sobre el tipo
de vacuna que se está colocando.
VACUNA ANTI COVID-19 PFIZER
Descripción
Vacuna contra la COVID-19 denominada BioNTech, de Pfizer, Se
recomienda su uso independientemente de las variantes presentes
en el país.
Tipo de vacuna
Plataforma de RNA mensajero.
Presentación
Es un concentrado congelado (0.45 ml.), estéril, sin preservantes,
multidosis, para dilución antes de su administración.
Composición
Principio activo:
* Nucleósido modificado ARN mensajero (ARN mod) que codifica la
glicoproteína (S) de SARS-CoV-2.
Excipientes:
* Lípidos ((4-hidroxibutil) azanediil) bis (hexano-6,1-diil)
bis (2-hexildecanoato),2 - [(polietilenglicol) -2000] -N, Nditetradecilacetamida, 1,2-Distearoil-snglicero-3-fosfocolina y
colesterol), cloruro de potasio, fosfato monobásico de potasio,
cloruro de sodio, fosfato de sodio dibásico dihidrato y sacarosa.
Diluyente:
* Cloruro de sodio al 0.9%, estéril, sin conservantes, en un vial de
10 mL. Se debe usar 1.8mL de diluyente para cada vial (frasco)
de 6 dosis.
* La solución salina de 0.9 % es el único diluyente que debe
utilizarse.
Tiempo de uso una
vez abierto el frasco
Luego de 6 horas, descartar el frasco con toda la vacuna no usada o
al final de la sesión de vacunación, lo que ocurra primero.
Efectividad
La eficacia de la vacuna es del 95%. Con dos dosis.
Edad y esquema
de vacunación
* Mayores de 12 años.
* Dos dosis administradas en intervalo de 3 a 4 semanas. (21-28
días).
* Si se adelanta o atrasa la segunda dosis por fuera de los intervalos
recomendados, no es necesario administrar más dosis.
* La segunda dosis se puede retrasar hasta las 6 semanas después
de la primera dosis. Ambas dosis son necesarias para generar
protección.
* Ojo: la poblacion menor a 12 años utiliza otra presentacion de
Pfizer, no se puede utilizar dosis de adultos en este grupo de edad
Dosis
0.3 ml. cada dosis, después de la dilución.
Número de dosis
Dos dosis.
Vía y lugar de
administración
Intramuscular, en el músculo deltoides del brazo izquierdo.
Manual Técnico del Programa Ampliado de Inmunización
127
Serie: Documentos Técnico Normativos
128
Temperatura de
almacenamiento y
de conservación
Almacenar a ultra bajas temperaturas:
* Congelador de -80°C a -60°C
* Caja de transporte térmica de -90°C a -60°C, por 30 días (debe ser
rellenada con hielo seco cada 5 días si se abre 2 veces al día por
3 minutos cada vez).
Conservación:
* Entre +2 y +8ºC por 30 días.
Temperatura de
almacenamiento
del diluyente
Temperatura ambiente (hasta 30°C).
Sensibilidad al
congelamiento
Viales descongelados: no congelar nuevamente.
Vacuna diluida: no congelar.
Sensibilidad a la luz
Minimizar la exposición a la luz del vacunatorio.
Se debe evitar la exposición directa a la luz solar o a luz ultravioleta.
Consideraciones
generales
Pueden ser vacunados:
* Personas con comorbilidades como obesidad, diabetes,
enfermedad cardiovascular crónica, enfermedad respiratoria
crónica o infecciones estables y bien controladas como hepatitis
B o C.
* Personas mayores de 18 años de edad.
Gestantes: todavía no hay suficiente evidencia de la seguridad de
la vacuna en este grupo. No obstante, pueden ser vacunadas si los
beneficios de la vacunación sobrepasan el riesgo de presentación
de algún evento secundario de la vacuna. No se recomienda que las
mujeres se realicen una prueba de embarazo antes de vacunarse ni
tampoco se recomienda retrasar la decisión de embarazo por este
motivo. Esta es una vacuna que contiene ARNm, el cual no ingresa al
núcleo celular y se degrada rápidamente, por lo que biológicamente y
clínicamente no debería tener efectos negativos sobre el embarazo.
Mujeres que dan de lactar: La OMS no recomienda suspender la
lactancia debido a la vacunación. Al ser una vacuna que contiene
ARNm, biológicamente y clínicamente no debería tener efectos
negativos sobre el lactante. En este sentido se debería ofrecer la
vacunación a las mujeres que dan de lactar y que forman parte de
los grupos de riesgo para COVID-19.
Personas con inmunosupresión grave: todavía no hay suficiente
evidencia de seguridad en este grupo, que se considera podría tener
una respuesta inmunológica reducida a la vacunación.
No obstante, si son parte de un grupo de riesgo pueden ser vacunados,
dado que se trata de una vacuna ARNm. Se debe informar acerca
de la seguridad y eficacia de la vacuna deben ser provistos a las
personas para la toma de decisión.
Personas con enfermedades autoinmunes: pueden ser vacunadas si
no tienen contraindicaciones.
Precauciones
Eventos esperados
Uso simultaneo
con otra vacuna
/ medicamento
Se puede aplicar simultaneamente con otra vacuna, sea esta viral
o bacteriana.
Manual Técnico del Programa Ampliado de Inmunización
Contraindicaciones
Personas que viven con VIH (PVVIH): si están bien controladas se
pueden vacunar. Aún no hay evidencia de su seguridad en PVVIH.
No se recomienda realizar pruebas de diagnóstico de VIH.
Personas con historia de parálisis de Bell (parálisis facial): No hay
evidencia concluyente de relación causal.
Personas que han recibido anticuerpos monoclonales o plasma
convaleciente pueden ser vacunadas pasados los 90 días después
de finalizado el tratamiento, a fin de evitar que el tratamiento
interfiera con la generación de inmunidad.
* Personas con antecedente de anafilaxia a algún otra vacuna o
medicamento inyectable, pueden recibir la vacuna, pero deben
recibir información respecto a la posibilidad de que puedan
presentar una reacción alérgica grave.
* Se recomienda su aplicación en un establecimiento de salud con
asistencia médica. El riesgo debe ser evaluado en relación al
beneficio de la vacunación.
* Personas con fiebre (temperatura igual o mayor a 38.5°C) NO debe
ser vacunadas, hasta que se hayan recuperado.
* Personas con COVID-19 debe ser vacunadas cuando se hayan
recuperado de la enfermedad y hayan concluido con su periodo
de aislamiento.
* Personas con infecciones leves como resfriados o con alza
térmica de menor importancia, pueden ser vacunadas.
La mayoría de los eventos adversos presentados fueron leves o
moderados y desaparecieron en pocos días.
Eventos comunes (≥1/100):
* Dolor en la zona de administración puede haber dolor, edema,
rubor, fatiga, escalofríos, cefalea, náuseas, mialgias, artralgias.
Eventos poco comunes (≥1/1000 a <1/100):
* Linfadenopatía, insomnio, dolor en la extremidad donde se
administró la vacuna, malestar general, picazón en zona de
vacunación.
Eventos muy raros (<1/10,000):
* Parálisis facial (parálisis de Bell).
* Anafilaxia.
* Historia de anafilaxia a alguno de los componentes de la vacuna.
En particular a personas con historia conocida de reacción
alérgica grave al polietilenglicol.
* Personas que desarrollaron anafilaxia luego de la primera dosis,
no deben recibir la segunda dosis.
129
Serie: Documentos Técnico Normativos
Procedimiento para aplicar la vacuna Pfizer
130
Insumos y materiales
requeridos
* Termo con paquetes fríos acorde al modelo y termómetro.
* Vacuna Pfizer.
* Para aplicar vacuna: Jeringa autodesactivable de 0.3 ml. o Jeringa
1 ml 25G x 1 “ o la de 1ml 22G x 1½.
* Para dilución: Jeringa de 5 ml., con aguja 22 G x 1½” .
* No reutilizar estas jeringas y descartar (autodesactivable).
* Torundas humedecidas en agua estéril o jabonosa.
* Caja de desecho seguro, exclusivo para jeringas y agujas sin
cobertor.
* Bolsas para desechar la envoltura de la jeringa, torunda, frasco
de la vacuna de acuerdo a la norma de clasificación de desechos.
* Material necesario de registro de vacunación.
Procedimientos
previos a la
vacunación
* Lavarse las manos con la técnica adecuada.
* Sacar del termo el frasco de vacuna, comprobando que sea la
correcta.
* Verificar la fecha de expiración, lote y aspecto de la vacuna.
* Verificar que la vacuna es una suspensión blanquecina uniforme;
no usar si el color no es uniforme o si hay partículas en ella.
* Descongelar antes de diluir
* Se puede descongelar en el refrigerador de 2°C a 8°C en 3 horas
aproximadamente.
* Diluir antes de usar
* Antes de la dilución, invertir el vial cuidadosamente 10 veces. NO
AGITAR.
* Verifique que la ampolla del diluyente es de cloruro de sodio al 0.9%
y que se mantiene a temperatura ambiente entre +2 °C y +25 °C.
* Limpie el cuello de la ampolla del diluyente con torunda humedecida
en agua estéril, hervida o jabonosa, a continuación, rómpala con
cuidado para evitar accidentes.
* Aspire 1.8 mL del diluyente, con una jeringa desechable de 5 mL
* Retire la tapa del frasco de la vacuna y limpie con una torunda
humedecida en agua estéril, hervida o jabonosa a la parte del hule
del mismo, deje secar, a continuación, introduzca la jeringa cargada
con 1.8 mL de cloruro de sodio al 0.9% en el frasco.
* Igualar la presión interna del frasco absorbiendo 1.8 ml. de aire
antes de retirar la jeringa de dilución.
* Descartar la jeringa de dilución (no reutilizar) y descartar el frasco
del diluyente.
* Delicadamente, invertir el vial con la vacuna diluida 10 veces para
mezclar. NO AGITAR.
* Registrar el día y hora de dilución en la etiqueta del frasco.
* Obtener el volumen de la dosis al momento de la administración.
No se recomienda mantener jeringas precargadas. Usar toda la
vacuna dentro de las siguientes 6 horas a partir de la dilución.
Procedimientos
para la vacunación
* Pedir a la persona a vacunar que se descubra el hombro izquierdo
(cara anterior y externa).
* Limpiar con una torunda humedecida en agua estéril, hervida o
jabonosa, la región donde se va aplicar la vacuna.
* Con un movimiento de arriba hacia abajo, cuidando de no volver
a pasar la torunda por la parte limpia.
* Sostener la región a aplicar con los dedos índice y el pulgar.
* Introducir la aguja a noventa grados en relación al brazo.
* Si se observa presencia de sangre en la jeringa, se retira
ligeramente redireccionando la aguja.
* Presione lentamente, el émbolo para introducir la vacuna.
* Fijar suavemente la piel con una torunda, cerca del sitio donde
está insertada la aguja.
* Retirar la jeringa inmediatamente después de haber introducido
la vacuna.
* Presionar ligeramente con una torunda, en el sitio de inyección.
* Desechar la jeringa, con la aguja sin tapar en la caja de desecho
seguro.
Registro
* Toda actividad de vacunación, se la debe registrar en el RNVe.
Recomendaciones
para la comunicación
interpersonal
* Recomendar que debe:
* Evitar el uso de paños calientes o ungüentos en el sitio de la
administración de la vacuna.
* Acudir al Establecimiento de Salud más cercano si presenta algún
malestar.
* Mantener las medidas de bioseguridad: uso de barbijo, higiene de
manos frecuente y distanciamiento social.
Manual Técnico del Programa Ampliado de Inmunización
* El resto del material utilizado (envoltura de la jeringa, torunda,
frasco de la vacuna) desechar clasificando de acuerdo a las
normas de desecho seguro.
* Si queda un remanente en los frascos multidosis descartelo, y no
obtenga una dosis extra con los volumenes residuales.
131
Serie: Documentos Técnico Normativos
3.18
132
VACUNA anti covid-19 SPUTNIK V
Descripción
Vacuna contra la COVID-19 denominada SPUTNIK V, fue la primera
en ser registrada, y utiliza un vector de dos adenovirus humanos
distintos en los cuales se incluyo material genetico de SARS-COV2 .
Tipo de vacuna
Vector viral no replicativo
Presentación
Es un concentrado congelado de 0.5 ml y 3ml.
Composición
Primera dosis
Principio activo:
* Partículas recombinantes de adenovirus humano del serotipo 26,
que contienen el gen de la proteína S del virus SARS-CoV-2, en
una cantidad de (1,0 ± 0,5) x 1011 partículas / dosis.
Excipientes:
* 1,21 mg de Tris (hidroxilmetil) aminometano.
* 2,19 mg de cloruro de sodio, 25 mg de sacarosa, 102 μg de cloruro
de magnesio hexahidrato, 19 μg de sal sódica dihidrato de EDTA,
80-250 μl de polisorbato, 2,5 μl de etanol 95%, solvente para
preparaciones inyectables hasta 0,5 ml.
Segunda dosis
Principio activo:
* Partículas recombinantes de adenovirus humano del serotipo 5,
que contienen el gen de la proteína S del virus SARS-CoV-2, en
una cantidad de (1,0 ± 0,5) x 1011 partículas / dosis.
Excipientes:
* 1,21 mg de Tris (hidroxilmetil) aminometano,2,19 mg de cloruro
de sodio, 25 mg de sacarosa, 102 μg de cloruro de magnesio
hexahidrato, 19 μg de sal sódica dihidrato de EDTA, 80-250 μl de
polisorbato, 2,5 μl de etanol 95%, solvente para preparaciones
inyectables hasta 0,5 ml.
Dos horas posteriores a la descongelación del frasco multidosis.
Las ampollas unidosis de uso inmediato.
Efectividad
La eficacia de la vacuna es del 92% con dos dosis.
Edad y esquema
de vacunación
Mayores de 18 años.
Dosis
0.5 ml. cada dosis.
Número de dosis
Dos dosis administradas en intervalo de 3 semanas (21 dias) como
minimo y 12 semanas como máximo (3 meses). Ambas dosis son
necesarias para generar protección.
Vía y lugar de
administración
Intramuscular, en el músculo deltoides del brazo izquierdo.
Temperatura de
almacenamiento y
de conservación
Almacenar a bajas temperaturas:
Congelador de -18°C
Conservar entre +2 y +8ºC por dos horas, posterior a la congelación
del frasco multidosis.
Sensibilidad al
congelamiento
Viales descongelados.
No congelar nuevamente.
Sensibilidad a la luz
Minimizar la exposición a la luz del vacunatorio.
Se debe evitar la exposición directa a la luz solar o a luz ultravioleta.
Manual Técnico del Programa Ampliado de Inmunización
Tiempo de uso una
vez abierto el frasco
133
Serie: Documentos Técnico Normativos
Consideraciones
generales
134
Pueden ser vacunados:
* Personas con comorbilidades como obesidad, diabetes,
enfermedad cardiovascular crónica, enfermedad respiratoria
crónica o infecciones estables y bien controladas como hepatitis
B o C.
* Personas mayores de 18 años de edad. Gestantes: todavía no
hay suficiente evidencia de la seguridad de la vacuna en este
grupo. No obstante, pueden ser vacunadas si los beneficios de
la vacunación sobrepasan el riesgo de presentación de algún
evento secundario de la vacuna. No se recomienda que las
mujeres se realicen una prueba de embarazo antes de vacunarse
ni tampoco se recomienda retrasar la decisión de embarazo por
este motivo. Esta es una vacuna que contiene ARNm, el cual no
ingresa al núcleo celular y se degrada rápidamente, por lo que
biológicamente y clínicamente no debería tener efectos negativos
sobre el embarazo.
Mujeres que dan de lactar: la OMS no recomienda suspender la
lactancia debido a la vacunación. Al ser una vacuna que contiene
ARNm, biológicamente y clínicamente no debería tener efectos
negativos sobre el lactante. En este sentido se debería ofrecer la
vacunación a las mujeres que dan de lactar y que forman parte de
los grupos de riesgo para COVID-19.
Personas con inmunosupresión grave: todavía no hay suficiente
evidencia de seguridad en este grupo, que se considera podría
tener una respuesta inmunológica reducida a la vacunación. No
obstante, si son parte de un grupo de riesgo pueden ser vacunados,
dado que se trata de una vacuna ARNm. Se debe informar acerca
de la seguridad y eficacia de la vacuna deben ser provistos a las
personas para la toma de decisión.
Personas con enfermedades autoinmunes: pueden ser vacunadas
si no tienen contraindicaciones.
Personas que viven con VIH (PVVIH): si están bien controladas se
pueden vacunar. Aún no hay evidencia de su seguridad en PVVIH.
No se recomienda realizar pruebas de diagnóstico de VIH.
Personas con historia de parálisis de Bell (parálisis facial). No hay
evidencia concluyente de relación causal.
Personas que han recibido anticuerpos monoclonales o plasma
convaleciente pueden ser vacunadas pasados los 90 días después
de finalizado el tratamiento, a fin de evitar que el tratamiento
interfiera con la generación de inmunidad.
Eventos esperados
La mayoría de los eventos adversos presentados fueron leves o
moderados y desaparecieron en pocos días.
Eventos comunes (≥1/100):
* Dolor en la zona de administración puede haber dolor, edema,
rubor, fatiga, escalofríos, cefalea, náuseas, mialgias, artralgias.
Eventos poco comunes (≥1/1000 a <1/100):
* Linfadenopatía, insomnio, dolor en la extremidad donde se
administró la vacuna, malestar general, picazón en zona de
vacunación.
Eventos muy raros (<1/10,000):
* Parálisis facial (parálisis de Bell).
* Anafilaxia.
Contraindicaciones
* Historia de anafilaxia a alguno de los componentes de la vacuna.
En particular a personas con historia conocida de reacción
alérgica grave al polietilenglicol.
* Personas que desarrollaron anafilaxia luego de la primera dosis,
no deben recibir la segunda dosis.
Precauciones
Personas con antecedente de anafilaxia a algún otra vacuna o
medicamento inyectable, pueden recibir la vacuna, pero deben recibir
información respecto a la posibilidad de que puedan presentar una
reacción alérgica grave.
Se recomienda su aplicación en un establecimiento de salud con
asistencia médica. El riesgo debe ser evaluado en relación al
beneficio de la vacunación.
Personas con fiebre (temperatura igual o mayor a 38.5°C) NO debe
ser vacunadas, hasta que se hayan recuperado.
Personas con COVID-19 debe ser vacunadas cuando se hayan
recuperado de la enfermedad y hayan concluido con su periodo de
aislamiento.
Personas con infecciones leves como resfriados o con alza térmica
de menor importancia, pueden ser vacunadas.
Debe haber un intervalo mínimo de 14 días para la administración
de otras vacunas contra otras enfermedades. Aún no hay datos
sobre coadministración con otras vacunas o medicamentos.
Procedimiento para aplicar la vacuna SPUTNIK V
Insumos y materiales
requeridos
*
*
*
*
*
Termo con paquetes fríos acorde al modelo y termómetro.
Vacuna Sputnik V
Para aplicar vacuna: Jeringa 1 ml 25G x 1 “ o la de 1ml 22G x 1½..
Torundas humedecidas en agua estéril o jabonosa.
Caja de desecho seguro, exclusivo para jeringas y agujas sin
cobertor.
* Bolsas para desechar la envoltura de la jeringa, torunda, frasco
de la vacuna de acuerdo a la norma de clasificación de desechos.
* Material necesario de registro de vacunación.
Manual Técnico del Programa Ampliado de Inmunización
Uso simultaneo
con otra vacuna/
medicamento
135
Serie: Documentos Técnico Normativos
136
Procedimientos
previos a la
vacunación
* Lavarse las manos con la técnica adecuada.
* Sacar del termo el frasco de vacuna, comprobando que sea la
correcta.
* Verificar la fecha de expiración, lote y aspecto de la vacuna.
* Sostener el frasco por la cubierta metalica para que la vacuna no
se caliente.
* Verificar que la vacuna es una suspensión blanquecina uniforme;
no usar si el color no es uniforme o si hay partículas en ella.
* Descongelar antes de usar la vacuna:
* Descongelar a una temperatura ambiente por 7 a 30 minutos y
luego introducir en el termo a una temperatura de +2°C a +8°C si
es frasco multidosis.
* Quitar el sello plastico superior del frasco y limpiar el tapón con
una torunda esteril humedecida en agua esteril o jabonosa (sin
exprimirla en el mismo envase)
* Extraer la dosis correcta del frasco utilizando la jeringa 1 ml 25G
x 1 “ o la de 1ml 22G x 1½.
* Verificar que la dosis de vacuna a aplicar sea de 0,5 ml.
* Administrar inmediatamente.
Procedimientos
para la vacunación
* Pedir a la persona a vacunar que se descubra el hombro izquierdo
(cara anterior y externa)
* Limpiar con una torunda humedecida en agua estéril, hervida o
jabonosa, la región donde se va aplicar la vacuna.
* Con un movimiento de arriba hacia abajo, cuidando de no volver
a pasar la torunda por la parte limpia.
* Sostener la región a aplicar con los dedos índice y el pulgar.
* Introducir la aguja a noventa grados en relación al brazo.
* Si se observa presencia de sangre en la jeringa, se retira
ligeramente redireccionando la aguja.
* Presione lentamente, el émbolo para introducir la vacuna.
* Fijar suavemente la piel con una torunda, cerca del sitio donde
está insertada la aguja.
* Retirar la jeringa inmediatamente después de haber introducido
la vacuna.
* Presionar ligeramente con una torunda, en el sitio de inyección.
* Desechar la jeringa, con la aguja sin tapar en la caja de desecho
seguro.
* El resto del material utilizado (envoltura de la jeringa, torunda,
frasco de la vacuna) desechar clasificando de acuerdo a las
normas de desecho seguro.
* Si queda un remanente en los frascos multidosis descartelo, y no
obtenga una dosis extra con los volumenes residuales.
Registro
Toda actividad de vacunación, se la debe registrar en el RNVe y en
el carnet de vacunación.
Recomendaciones
para la comunicación
interpersonal
* Evitar el uso de paños calientes o ungüentos en el sitio de la
administración de la vacuna.
* Acudir al Establecimiento de Salud más cercano si presenta algún
malestar.
* Mantener las medidas de bioseguridad: uso de barbijo, higiene de
manos frecuente y distanciamiento social.
3.19
VACUNA Anti COVID-19 JANSSEN
Descripción
La vacuna consiste en un vector de adenovirus recombinante tipo
26 (Ad26) de replicación incompetente que expresa la proteína
pico (S) del coronavirus-2 (SARS-CoV-2) del síndrome respiratorio
agudo severo en una conformación estabilizada OMS 2021. El vector
Ad26 que expresa la proteína SARS-CoV-2 S se cultiva en la línea
celular PER.C6® TetR, en medios que contienen aminoácidos y no
proteínas de origen animal. Después de la propagación, la vacuna
se procesa mediante varios pasos de purificación, se formula con
ingredientes inactivos y se envasa en viales [ FDA, 2021].
Tipo de vacuna
Vector viral.
Presentación
La vacuna Janssen COVID-19 es una suspensión estéril para
inyección intramuscular de incolora a ligeramente amarilla,
transparente a muy opalescente. Forma de dosificación de un vial
multidosis (5 dosis de 0,5 ml por vial) OMS, 2021.
Manual Técnico del Programa Ampliado de Inmunización
137
Serie: Documentos Técnico Normativos
138
Composición
Principio activo:
* Adenovirus tipo 26 que codifica la glucoproteína pico del SARSCoV-2 (Ad26.COV2-S) no menos de 2,5 x 10 ^ 10 partículas de
virus o no menos de 8,92 log10 unidades infecciosas (UI) en cada
0.5 mL.
Excipientes:
* Ácido cítrico monohidrato Citrato trisódico dihidrato Etanol
2-hidroxipropil-β-ciclodextrina (HBCD) Polisorbato 80 Cloruro
de sodio Hidróxido de sodio Ácido clorhídrico Agua para
preparaciones inyectables.
Tiempo de uso una
vez abierto el frasco
Al instante. La vacuna restante se debe utilizar dentro de las
siguientes seis horas.
Efectividad
La eficacia de la vacuna es del 92% Con dos dosis.
Edad y esquema
de vacunación
* A partir de los 18 años.
* Al contacto.
Dosis
0.5 ml.
Número de dosis
Dosis única.
Vía y lugar de
administración
Intramuscular, en el músculo deltoides del brazo izquierdo.
Temperatura de
almacenamiento y
de conservación
Conservación entre +2 y +8ºC.
Sensibilidad al
congelamiento
No congelar.
* Minimizar la exposición a la luz.
* Se debe evitar la exposición directa a la luz solar o a luz ultravioleta.
Consideraciones
generales
Pueden ser vacunados:
* El uso de Ad26.COV2.S en mujeres embarazadas solo si los
beneficios de la vacunación para la mujer embarazada superan
los riesgos potenciales.
* Personas con comorbilidades como obesidad, diabetes,
enfermedad cardiovascular crónica, enfermedad respiratoria
crónica o infecciones estables y bien controladas como hepatitis
B o C.
Eventos esperados
* La mayoría de los eventos adversos presentados fueron leves o
moderados y desaparecieron en pocos días.
Eventos comunes:
* Dolor en la zona de administración, edema, rubor, fatiga, cefalea,
náuseas.
Eventos poco comunes:
* Malestar general, visión borrosa, convulsiones, dificultad para
respirar, dolor en el pecho, hinchazón de las piernas, dolor en las
piernas, dolor abdominal persistente o moretones inusuales en la
piel o petequias.
Eventos muy raros:
* Trombocitopenia
* Anafilaxia
* Trombosis.
Contraindicaciones
La vacuna Janssen COVID-19 está contraindicada en personas con
antecedentes conocidos de una reacción alérgica grave a cualquier
componente de la vacuna.
Manual Técnico del Programa Ampliado de Inmunización
Sensibilidad a la luz
139
Precauciones
* Personas que hayan tenido previamente el síndrome de
extravasación capilar no se vacunen con la vacuna COVID-19 de
Janssen.
* La vacunación debe posponerse en personas que padecen una
enfermedad febril aguda grave o una infección aguda.
* Un síndrome muy raro de coagulación sanguínea combinado
con recuentos bajos de plaquetas aproximadamente de 3 a 15
días después de la vacunación con Ad26.COV2.S, descrito como
síndrome de trombosis con trombocitopenia (STT).
* Pueden ocurrir reacciones relacionadas con la ansiedad o el
estrés en asociación con la vacunación. Es importante que se
tomen precauciones para evitar lesiones por desmayos.
* Las personas vacunadas deben buscar atención médica inmediata
si desarrollan los siguientes síntomas; dolores de cabeza intensos
o persistentes, visión borrosa, confusión, convulsiones, dificultad
para respirar, dolor en el pecho, hinchazón de las piernas, dolor en
las piernas, dolor abdominal persistente o moretones inusuales
en la piel o petequias unos días después de la vacunación.
* El uso de Ad26.COV2.S en mujeres embarazadas solo si los
beneficios de la vacunación para la mujer embarazada superan
los riesgos potenciales por ejemplo, que algunas mujeres
embarazadas tienen un mayor riesgo de infección o tienen
comorbilidades que aumentan su riesgo de enfermedad grave.
* En personas con trastornos hemorrágicos u otras afecciones que
aumentan el riesgo de hemorragia, como terapia anticoagulante,
trombocitopenia y hemofilia.
Coadministración
de otras vacunas
/ medicamentos
Se puede administrar conjuntamente con otras vacunas de acuerdo
a la edad. (como Anti Influenza, Antiamarilica, dT)
Serie: Documentos Técnico Normativos
Procedimiento para aplicar la vacuna Janssen
140
Insumos y materiales
requeridos
* Termo con paquetes fríos y termómetro.
* Vacuna Janssen
* Para aplicar vacuna: Jeringa 1 ml 25G x 1 “ o la de 1ml 22G x 1½.
* Torundas humedecidas en agua estéril o jabonosa.
* Caja de desecho seguro, exclusivo para jeringas y agujas sin
cobertor.
* Bolsas para desechar la envoltura de la jeringa, torunda, frasco
de la vacuna de acuerdo a la norma de clasificación de desechos.
* Material necesario de registro de vacunación.
Procedimientos
previos a la
vacunación
* Lavarse las manos con la técnica adecuada.
* Sacar del termo el frasco de vacuna, comprobando que sea la
correcta.
* Verificar la fecha de expiración, lote y aspecto de la vacuna.
* Sostener el frasco por la cubierta metálica para que la vacuna no
se caliente.
* Verificar que la vacuna es una suspensión blanquecina uniforme;
no usar si el color no es uniforme o si hay partículas en ella.
* Quitar el sello plástico superior del frasco de la vacuna y limpiar
el tapón con una torunda humedecida en agua estéril o jabonosa,
(sin exprimirla en el mismo envase).
* Agitar levemente el frasco para asegurar una mezcla homogénea
antes de utilizar.
* Extraer la dosis correcta del frasco utilizando la Jeringa 1 ml 25G
x 1 “ o la de 1ml 22G x 1½.
* Verificar que la dosis de vacuna a aplicar sea de 0,5 ml.
* Administrar inmediatamente.
Procedimientos
para la vacunación
* Pedir a la persona a vacunar que se descubra el hombro izquierdo
(cara anterior y externa).
* Limpiar con una torunda humedecida en agua estéril, hervida o
jabonosa, la región donde se va aplicar la vacuna.
* Con un movimiento de arriba hacia abajo, cuidando de no volver
a pasar la torunda por la parte limpia.
* Sostener la región a aplicar con los dedos índice y el pulgar.
* Introducir la aguja a noventa grados en relación al brazo.
* Si se observa presencia de sangre en la jeringa, se retira
ligeramente redireccionando la aguja
Registro
* Toda actividad de vacunación, se la debe registrar en el RNVe y en
el carnet de vacunación.
Manual Técnico del Programa Ampliado de Inmunización
* Presionar lentamente, el émbolo para introducir la vacuna.
* Fijar suavemente la piel con una torunda, cerca del sitio donde
está insertada la aguja.
* Retirar la jeringa inmediatamente después de haber introducido
la vacuna.
* Presionar ligeramente con una torunda, en el sitio de inyección.
* Desechar la jeringa, con la aguja sin tapar en la caja de desecho
seguro.
* El resto del material utilizado (envoltura de la jeringa, torunda,
frasco de la vacuna) desechar clasificando de acuerdo a las
normas de desecho seguro.
* Si queda un remanente en los frascos multidosis descartelo, y no
obtenga una dosis extra con los volumenes residuales.
141
Recomendacionescomunicación
interpersonal
Serie: Documentos Técnico Normativos
3.19
142
* Evitar el uso de paños calientes o ungüentos en el sitio de la
administración de la vacuna.
* Acudir al Establecimiento de Salud más cercano si presenta algún
malestar.
* Mantener las medidas de bioseguridad: uso de barbijo, higiene de
manos frecuente y distanciamiento social.
VACUNA Anti COVID-19 moderna
Descripción
La vacuna contra la COVID-19 de MODERNA es una vacuna que contiene
una molécula de ARN mensajero (ARNm) encapsulada en nanopartículas
lipídicas que codifica para la proteína de la espiga o proteína “S” del
SARS-CoV-2. Al administrarse la vacuna, se lleva a cabo la traducción
del ARNm a nivel intracelular produciendo temporalmente la proteína
S. Posteriormente, el sistema inmune reconoce a la proteína S del
SARS-CoV-2 producida como un antígeno. Esto provoca una respuesta
inmune, tanto de células T como de células B, generando anticuerpos
neutralizantes y contribuyendo a la protección contra la COVID-19.
Tipo de vacuna
Plataforma ARN mensajero
Presentación
Suspensión multidosis congelada, estéril y sin conservantes.
* Principio
activo:ARNmmonocatenario
producido
mediante
transcripción in vitro de las correspondientes plantillas de ADN libre
de células, que codifica para la proteína de la espiga (proteína S) del
SARS-CoV-2, en una cantidad de 100mcg/dosis (incorporado en
nanopartículas lipídicas SM-102)
* Excipientes: Lípido SM-102 (heptadecano-9-il 8-{(2-hidroxietil)[6oxo-6- (undeciloxi)hexil]amino}octanoato), colesterol, 1,2-diestearoilsn-glicero-3-fosfocolina
(DSPC),
1,2-dimiristoil-rac-glicero-3metoxipolietilenglicol-2000 (PEG2000 DMG), trometamol, clorhidrato
de trometamol, ácido acético, acetato de sodio trihidrato, sacarosa,
agua para preparaciones inyectables.
* Esta vacuna contiene menos de 1 mmol de sodio (23 mg) por dosis de
0.5 mL, es decir, se considera esencialmente “libre de sodio”.
Tiempo de uso una
vez abierto el frasco
Una jornada laboral de 6hrs.
Efectividad
94%
Edad y esquema
de vacunación
* Mayores de 18 a 59 años de edad, 2 dosis.
Dosis
0.5ml. cada dosis
Número de dosis
Dos dosis administradas con un intervalo de 28 días, ambas dosis son
necesarias para generar protección.
Una dosis de refuerzo
Vía y lugar de
administración
Intramuscular, en el músculo deltoides del brazo izquierdo.
Temperatura de
almacenamiento y
de conservación
Almacenar a bajas temperaturas entre -25 y -15°C
Conservar entre +2 a +8°C
Vial descongelado y sin abrir en refrigerador entre +2 y +8°C hasta 30
días.
Vial descongelado y abierto por 6hrs.
Sensibilidad al
congelamiento
Viales descongelados No congelar nuevamente.
Sensibilidad a la luz
* Minimizar la exposición a la luz del vacunatorio.
* Se debe evitar la exposición directa a la luz solar o luz ultravioleta
Manual Técnico del Programa Ampliado de Inmunización
Composición
143
Serie: Documentos Técnico Normativos
144
Consideraciones
generales
* Se recomienda la vacunación a personas con comorbilidades como
enfermedad pulmonar crónica, patologías cardiacas significativas,
obesidad severa, diabetes, enfermedad hepática e infección por el
virus de la inmunodeficiencia humana (VIH), que se ha determinado
aumentan el riesgo de sufrir COVID 19 severa.
* Las personas inmunodeprimidas pueden tener una respuesta inmune
menor a la vacuna. No obstante, si forman parte de un grupo en el que
se recomienda la vacunación, podrán ser vacunadas.
* Las personas con condiciones autoinmunitarias sin contraindicaciones
a la vacunación podrán ser vacunadas.
* Las personas infectadas por el VIH debidamente controladas por
medio de terapia antirretroviral altamente activa y que formen parte
de un grupo recomendado para la vacunación podrán ser vacunadas.
* Se debe posponer la vacunación durante al menos 90 días en personas
a las que se les hayan administrado anticuerpos monoclonales o
plasma de convaleciente como parte de un tratamiento contra la
COVID 19, para evitar la interferencia del tratamiento en la respuesta
inmune inducida por la vacuna.
Eventos esperados
* Los eventos adversos (EA) característicos identificados en mayores
de 18 años, así como en estudios de otras vacunas contra la COVID-19,
son principalmente leves o moderados y resuelven en su totalidad a
los pocos días de la vacunación. Más frecuentes:
* Locales:
* Muy frecuente (≥1/10): dolor, edema y/o hinchazón en el sitio de la
inyección, linfadenopatía axilar homolateral.
* Frecuentes (≥1/100 a < 1/10): eritema, reacción urticariana o rash
cutáneo local, reacción retardada en el sitio de inyección (dolor,
eritema, hinchazón).
* Poco frecuentes (≥ 1/1.000 a < 1/100): prurito en el sitio de la inyección.
y Raros (≥1/10.000 a < 1/1.000):
* Generales:
* Muy frecuente (≥1/10): cefalea, náuseas, vómitos, fatiga, fiebre
transitoria, escalofríos, mialgias, artralgias.
* Frecuentes (≥1/100 a < 1/10): rash o exantema.
* Raros (≥1/10.000 a < 1/1.000): parálisis facial aguda periférica, edema
facial.
* En la población de 12-17 años, los eventos adversos identificados
más frecuentemente fueron:
* Locales:
* Muy frecuente (≥1/10): edema y/o hinchazón en el sitio de la inyección,
hinchazón/sensibilidad axilar homolateral.
* Generales:
* Muy frecuente (≥1/10): cefalea, náuseas, vómitos, mialgias, artralgias,
fatiga, fiebre transitoria, escalofríos.
• Historia conocida de anafilaxia ante cualquiera de los componentes de
la vacuna. En particular, no debe administrarse ARNm-1273 a personas
con una historia conocida de anafilaxia ante el polietilenglicol (PEG).
• A las personas que hayan experimentado anafilaxia tras la primera
dosis no se les debe administrar una segunda dosis de la vacuna
ARNm 1273 u otra vacuna ARNm frente a la COVID 19 (por ejemplo,
COMIRNATY® de Pfizer-BioNTech).
Precauciones
* Para personas con historia previa conocida de anafilaxia a cualquier
otra vacuna o terapia inyectable, deber realizarse una evaluación del
riesgo por un especialista. Estas personas podrán ser vacunadas,
pero se les debe asesorar respecto de los riesgos de la anafilaxia.
* Estos riesgos deben valorarse frente a los beneficios de la vacunación.
* Todas las personas deben ser vacunadas en entornos sanitarios con
capacidad para el tratamiento inmediato de la anafilaxia, y deberán
permanecer en observación 15 minutos tras la vacunación; las
personas con historia previa de anafilaxia deberán permanecer en
observación 30 minutos tras la vacunación.
* Las alergias alimentarias, de contacto o estacionales, incluyendo a
los huevos, la gelatina y el látex, no se consideran precauciones o
contraindicaciones.
* Se debe posponer la vacunación de personas que presenten
enfermedad febril aguda severa (temperatura corporal superior a 38,5
°C) hasta que desaparezca la fiebre.
* Se debe posponer la vacunación de personas con COVID 19 aguda
hasta que se hayan recuperado de la enfermedad aguda y se cumplan
los criterios para el fin de su aislamiento.
Coadministración
de otras vacunas
/ medicamentos
Se puede administrar conjuntamente con otras vacunas de acuerdo a
la edad
Procedimiento para aplicar la vacuna MODERNA
Insumos y materiales
requeridos
*
*
*
*
*
*
Termos en paquetes fríos acorde al modelo y termómetro.
Vacuna Moderna.
Para aplicar vacuna: Jeringa 1 ml 25G x 1 “ o la de 1ml 22G x 1½.
para inyección intramuscular.
Torundas humedecidas en agua estéril o jabonosa.
Caja de desecho seguro, exclusivo para jeringas y agujas sin
cobertor.
* Bolsas para desechar la envoltura de la jeringa, torunda, frasco
de la vacuna de acuerdo a la norma de clasificación de desechos.
* Material necesario de registro de vacunación.
Manual Técnico del Programa Ampliado de Inmunización
Contraindicaciones
145
Serie: Documentos Técnico Normativos
146
Procedimientos
previos a la
vacunación
* Lavarse las manos con la técnica adecuada.
* Sacar del termo el frasco de vacuna, comprobando que sea la
correcta.
* Verificar la fecha de expiración, lote y aspecto de la vacuna.
* Verificar que la vacuna es una suspensión blanquecina uniforme;
no usar si el color no es uniforme o si hay partículas en ella.
* Descongelar antes de usar la vacuna:
* Descongelar a una temperatura ambiente por 7 a 30 minutos y
luego introducir en el termo a una temperatura de +2°C a +8°C si
es frasco multidosis.
* Extraer la dosis correcta del frasco utilizando la Jeringa 1 ml 25G
x 1 “ o la de 1ml 22G x 1½.
* Verificar que la dosis de vacuna a aplicar sea de 0,5 ml.
* Administrar inmediatamente.
Procedimientos
para la vacunación
* Pedir a la persona a vacunar que se descubra el hombro izquierdo
(cara anterior y externa)
* Limpiar con una torunda humedecida en agua estéril, hervida o
jabonosa, la región donde se va aplicar la vacuna.
* Con un movimiento de arriba hacia abajo, cuidando de no volver
a pasar la torunda por la parte limpia.
* Sostener la región a aplicar con los dedos índice y el pulgar.
* Introducir la aguja a noventa grados en relación al brazo.
* Si se observa presencia de sangre en la jeringa, se retira
ligeramente redireccionando la aguja.
* Presione lentamente, el émbolo para introducir la vacuna.
* Fijar suavemente la piel con una torunda, cerca del sitio donde
está insertada la aguja.
* Retirar la jeringa inmediatamente después de haber introducido
la vacuna.
* Presionar ligeramente con una torunda, en el sitio de inyección.
* Desechar la jeringa, con la aguja sin tapar en la caja de desecho
seguro.
* El resto del material utilizado (envoltura de la jeringa, torunda,
frasco de la vacuna) desechar clasificando de acuerdo a las
normas de desecho seguro
Registro
* Toda actividad de vacunación, se la debe registrar en el RNVe.
Recomendacionescomunicación
interpersonal
* Evitar el uso de paños calientes o ungüentos en el sitio de la
administración de la vacuna.
* Acudir al Establecimiento de Salud más cercano si presenta algún
malestar.
* Mantener las medidas de bioseguridad: uso de barbijo, higiene de
manos frecuente y distanciamiento social.
Manual Técnico del Programa Ampliado de Inmunización
147
148
Serie: Documentos Técnico Normativos
CAPÍTULO 4
ESTRATEGIAS DE
VACUNACIÓN
Índice
4.1
Introducción
144
4.2
Estrategias y tácticas de vacunación permanente
144
4.2.1
Vacunación en establecimientos de salud (dentro)
144
4.2.2
Vacunación fuera del establecimiento de salud
144
4.2.3
Vacunación por concentración
146
4.3
Estrategia de vacunación intensiva
146
4.3.1
Jornadas de vacunación
146
4.3.2
Campañas de vacunación
146
4.3.3
Vacunación en puestos fijos (puntos masivos)
146
4.3.4
Vacunación a través de equipos móviles
146
4.3.5
Canalización
146
4.3.6
Por convocatoria de redes sociales
147
4.4
Oportunidades perdidas
147
4.4.1
Prácticas del personal de salud
147
4.4.2
Percepciones de la comunidad
147
4.4.3
Acciones para evitar las oportunidades perdidas de vacunación
148
4.5
Vacunación en emergencia sanitaria
148
4.5.1
Pre vacunación
148
4.5.2
Durante la vacunación
149
4.5.3
Inmunización durante la pandemia de COVID-19
150
4.6
Bioseguridad en la vacunación
151
4.6.1
Uso apropiado de las jeringas
152
4.6.2
Bioseguridad para el trabajador de salud
152
4.6.3
Las cajas de desecho seguro
152
4.6.4
Para el manejo de corto punzantes
153
4.6.5
Inactivación química
153
4.6.6
Seguridad de la comunidad y el medio ambiente
153
4.6.7
Disposición final
155
4.1
INTRODUCCIÓN
Las estrategias de vacunación son las modalidades que utilizan los equipos de salud para
vacunar a la población. Casi siempre combinan varias formas a fin de lograr la cobertura
universal (100% de la población bajo su responsabilidad), de esta forma se garantiza la
protección contra las enfermedades inmunoprevenibles.
4.2
ESTRATEGIAS Y TÁCTICAS DE VACUNACIÓN PERMANENTE
Consiste en la aplicación diaria de todas las vacunas, todos los días del año, en todos los
establecimientos de salud, complementándose con las tácticas de vacunación en puestos
fijos, puntos de vacunación masiva, casa por casa y equipos móviles; organizan la vacunación
por concentración y/o canalización hacia los servicios de salud.
4.2.1
Vacunación en establecimientos de salud (dentro)
Es la estrategia de vacunación más utilizada; en gran medida porque la demanda espontánea
de la población ha ido incrementándose progresivamente a través de los años. Para que sea
exitosa es indispensable que en los establecimientos de salud ofrezcan en general servicios
de calidad y calidez y, que no existan oportunidades perdidas de vacunación.
Ventajas
* Contribuye a una atención integral en los servicios de salud.
* Utiliza equipos y documentación disponibles en los establecimientos de salud.
* El trabajo se realiza en ambientes y condiciones adecuadas.
* Manejo y conservación garantizada de la cadena de frío.
* Reduce las oportunidades perdidas de vacunación.
* Disminuye el desperdicio de vacunas.
* Facilita la supervisión.
4.2.2
Serie: Documentos Técnico Normativos
A.
152
Vacunación fuera del establecimiento de salud
Táctica casa por casa
Es la estrategia de vacunación que generalmente se aplica en las comunidades o localidades
sin servicios de salud o en aquellas donde existen bolsones de población con esquemas de
vacunación incompletos.
Existen varias modalidades de vacunación fuera de servicio, entre las que citamos la
vacunación casa por casa, puestos fijos y equipos móviles.
Esta estrategia de vacunación consiste en que el personal de salud hace un recorrido casa
por casa en la comunidad o barrio correspondiente a su área de acción, con la finalidad
de identificar a niñas, niños y personas adultas que, al no tener todas las vacunas, deben
recibirlas.
Esta estrategia se aplica cuando, después de un análisis de indicadores de coberturas y
seguimiento, el personal de salud ve la necesidad de incrementar las coberturas del esquema
de vacunación.
B.
Ventajas
* Mejora el conocimiento del área de su responsabilidad.
* Mejora el conocimiento de la situación de salud y la condición de las familias, sobre todo
en lo que hace a las determinantes de la salud.
* Genera una mayor confianza entre la población y el personal de salud.
* Identifica las necesidades de vacunación y las causas por las cuales la población no acude
al establecimiento de salud, en base a este diagnóstico propone posibles alternativas de
solución.
* Impulsa al personal de salud a ejecutar acciones de promoción y prevención.
* Compromete mayor participación de la comunidad.
C.
Materiales necesarios para la vacunación fuera de servicio
* Croquis de la comunidad o barrio.
* Vacunas.
* Termo o caja fría con paquetes fríos más termómetro, dependiendo de la distancia y el
tiempo de desplazamiento.
* Recipientes para colocar las vacunas.
* Jeringas de acuerdo al tipo de vacuna.
* Torundas empapadas en agua hervida o agua jabonosa.
* Descontaminante (alcohol en gel u otros para desinfección de las manos).
* Bolsas o recipientes para desechos comunes
* Cuaderno de registro fuera de servicio o planillas de registro.
* Libretas de salud y desarrollo infantil integral, y comprobantes de vacunación.
* Tizas.
* Fichas epidemiológicas y material para la toma de muestras.
* Cartilla de enfermedades inmunoprevenibles.
* Formulario de búsqueda activa comunitaria.
* Formulario de monitoreo rápido (opcional).
* Identificación.
Manual Técnico del Programa Ampliado de Inmunización
* Caja de desecho seguro.
153
4.2.3
Vacunación por concentración
Esta estrategia está dirigida a población concentrada en lugares definidos como ser guarderías,
colegios, asilos, congregaciones, club de madres, etc. Permite ampliar las coberturas con
disminución de tiempo, esfuerzo y recursos.
4.3
ESTRATEGIA DE VACUNACIÓN INTENSIVA
4.3.1
Jornadas de vacunación
Son eventos de un solo día, tienen por objetivo incrementar coberturas de vacunación en
tiempos cortos. Requieren de una planificación estricta, participación de todos los sectores
sociales y de una estrategia de comunicación social multimedial.
4.3.2
Campañas de vacunación
Son eventos de duración variable, una semana o un mes y pueden ser realizadas a nivel
nacional, departamental, municipal o local, de acuerdo a las necesidades que se tengan. El
objetivo de las campañas es incrementar las coberturas, controlar las epidemias o adelantarse
a épocas de mayor incidencia de casos.
Para tener éxito con la campaña, se requiere contar con todos los recursos necesarios tales
como vacunas e insumos, brigadas de vacunación (vacunadores, registradores y supervisores),
estrategia de comunicación y difusión multimedia, recursos financieros para la logística,
participación intersectorial e institucional y de la estructura social en salud.
4.3.3
Vacunación en puestos fijos (puntos masivos)
Son puntos que se organizan en sitios con gran afluencia de personas como Universidades,
colegios, coliseos, iglesias, parques, mercados, etc. Esta estrategia facilita el acceso masivo
de la población a las vacunas y a la promoción de los beneficios de la vacunación.
4.3.4
Vacunación a través de equipos móviles
Serie: Documentos Técnico Normativos
Son vacunaciones que se ofertan a poblaciones concentradas, comunidades o localidades de
difícil acceso o sin servicios de salud, mediante equipos o brigadas móviles que se organizan
en base al personal de salud de la red de servicios local, municipal y departamental.
154
Esta estrategia debe aplicarse sistemática y periódicamente las veces que sea necesario para
completar esquemas de vacunación.
El responsable de la organización y funcionamiento de las brigadas móviles de vacunación es
el director del establecimiento de salud. Las brigadas de vacunación deberán ser conformadas
por un mínimo de dos personas: un vacunador y un registrador, cuando se tiene cuatro
brigadas, se debe añadir un supervisor.
4.3.5
Canalización
Esta táctica de vacunación complementaria se utiliza para detectar a niñas, niños o adultos
que no han recibido vacunas o sus esquemas de vacunación son incompletos y referirlos
al puesto fijo o al establecimiento de salud para su vacunación. En general, participan en la
aplicación de esta táctica voluntarios de la comunidad, líderes de las organizaciones sociales
y otros proveedores de salud. El método que se utiliza es la visita casa por casa.
4.3.6
Por convocatoria de redes sociales
Esta táctica puede aplicarse en situaciones de riesgo de aglomeración de personas, por
riesgo epidemiológico para convocar y programar la vacunación en puestos de vacunación o
establecimientos.
4.4
OPORTUNIDADES PERDIDAS
Una oportunidad perdida de vacunación se produce cuando una persona elegible para ser
vacunada, asiste por cualquier otro motivo a un establecimiento de salud y no recibe las
vacunas requeridas.
Las oportunidades perdidas de vacunación se deben principalmente a:
* Falsas contraindicaciones.
* La actitud del equipo de salud.
* A creencias de la comunidad.
4.4.1
Prácticas del personal de salud
* Existen días y horarios preestablecidos para la vacunación de algunas vacunas o para
todas.
* El personal de salud considera que abrir un frasco multidosis para vacunar a una sola
persona produce una pérdida innecesaria de vacuna.
* El personal no investiga el estado vacunal ni solicita el Carnet de Salud Infantil a los niños
menores de 5 años que asisten al servicio de salud.
* En el servicio no se encuentra el personal de salud capacitado para aplicar las vacunas.
* El trato que se brinda en el servicio, sobre todo en la primera atención, no es satisfactorio
para las y los usuarios.
* Estrategia de entrega de fichas de atención limitada.
* Tiempo de espera largo.
4.4.2
Percepciones de la comunidad
* Renuencia de los padres para aceptar las vacunas debido a experiencias familiares
negativas con la inmunización.
* Factores de tipo religioso.
Manual Técnico del Programa Ampliado de Inmunización
* El personal de salud vacuna a demanda y tiene una actitud pasiva.
155
4.4.3
Acciones para evitar las oportunidades perdidas de
vacunación
* Garantizar la existencia de todas las vacunas, jeringas e insumos necesarios para la
vacunación a través de una programación oportuna y real en los establecimientos de
salud.
* Ofrecer la vacunación en los establecimientos de salud, todos los días durante el día.
* Promover la atención integral en el marco del continuo de la vida. Los médicos deben
solicitar el CSI o la Libreta de Salud Infantil, a fin de conocer el estado vacunal, de acuerdo
con la edad.
* Contar con personal de salud capacitado sobre la importancia de evitar las oportunidades
perdidas.
* Informar a la población sobre el esquema de vacunación y las enfermedades que se
previenen. En cada oportunidad que se presente, en las salas de espera, consultorios,
hospitales y también en los eventos comunitarios.
* Capacitar al personal de salud acerca de las contraindicaciones reales para la aplicación
de las vacunas.
* Lograr que cada trabajador de las instituciones de salud sea un promotor de la vacunación
universal.
* Cuando los pobladores acudan los servicios de salud, por cualquier motivo, revisar el CSI
y aplicar las dosis o vacunas faltantes.
4.5
VACUNACIÓN EN EMERGENCIA SANITARIA
4.5.1
Pre vacunación
En el marco de una emergencia sanitaria se debe procurar planificar a detalle antes de iniciar
la vacunación, considerando los siguientes puntos:
Serie: Documentos Técnico Normativos
* Actualizar datos de instituciones con poblaciones cautivas (asilos, guarderías, hogares
de niños, albergues y otros).
156
* Elaborar lista de niñas, niños con esquemas incompletos de vacunación para recuperarlos
posterior a la emergencia.
* Establecer contacto con las fundaciones, ligas, asociaciones, guarderías, asilos,
albergues y otros para la coordinación a través de citas programadas para la vacunación
en poblaciones cautivas.
* Realizar análisis de la red de vacunatorios por accesibilidad y producción.
* Seleccionar vacunatorios que deben extender días y horarios de vacunación, pasada la
cuarentena.
* Evaluar la ubicación del vacunatorio implementando las medidas de seguridad para el
personal y usuarios.
* Actualizar el protocolo y flujograma de bioseguridad (triaje, limpieza, desinfección de
ambiente vacunatorio y protección personal).
* Asegurar disponibilidad de antisépticos para higiene de manos del personal de salud y
los usuarios en el servicio.
* Programar insumos para la limpieza del vacunatorio y equipos de protección para el
personal de salud.
* Asignar y reasignar al personal necesario al servicio de vacunación.
* Capacitar al personal de los vacunatorios para el triaje de padres, madres y niños para la
identificación de sintomatología respiratoria.
* Asegurar el aprovisionamiento adecuado de todos los biológicos e insumos y la
operatividad adecuada de la cadena de frío.
* Organizar el distanciamiento social en las salas de espera.
* Asegurar ambientes ventilados y con las condiciones adecuadas de bioseguridad
(limpieza y desinfección de los ambientes con la frecuencia adecuada).
* En los establecimientos de salud con prestaciones de atención de parto vacunar BCG.
* Vacunar a demanda, priorizando grupos vulnerables y aprovechar todas las oportunidades
posibles de vacunación en que la población acude a los establecimientos de salud.
* Establecer de acuerdo a organización, ampliar horarios y días de vacunación.
4.5.2
Durante la vacunación
* Vacunación en servicio.
* Asegurar el acceso directo al servicio de vacunación (sin fichas, ni filas).
* Vacunación en instituciones con poblaciones cautivas programadas.
* Vacunación con brigadas móviles priorizando zonas con mayor carga poblacional, riesgo
de brotes y epidemiológicamente vulnerables.
* Mantener las medidas de bioseguridad en todos los procedimientos de la vacunación
dentro y fuera de servicio.
* Asegurar el cumplimiento de la norma de desecho seguro en servicios de vacunación.
* Activar el monitoreo de vacunación y la vigilancia comunitaria.
* Socializar por todos los medios de comunicación los horarios y días de vacunación en
todos los niveles de salud.
* Relevar la importancia de la vacunación en todos los ámbitos y a todo nivel.
* Difundir ampliamente la importancia de la prevención a través de la vacunación.
Manual Técnico del Programa Ampliado de Inmunización
* Ampliar los horarios y días de vacunación de acuerdo a la factibilidad y operatividad de
los establecimientos y personal de salud.
157
4.5.3
Inmunización durante la pandemia de COVID-19
Tabla N°7: Fases de la vacunación en pandemia COVID-19
Componentes
Serie: Documentos Técnico Normativos
Vacunación
institucional
158
Vacunación en
puestos móviles
Fase 1
Sin Casos
Fase 2
Casos
esporádicos
Mantener el
programa de
vacunación de
rutina y usar
medidas de
protección del
personal de salud
y cumplir con las
recomendaciones
distanciamiento
físico.
Contar con plan
de vacunación
por grupo de
edad y programar
los horarios
de acuerdo a
esquema de
vacunación,
cumpliendo con
las medidas de
bioseguridad.
Fase 3
Conglomerados
Implementar
puestos fijos
en lugares
estratégicos
ofertando todas
las vacunas
a demanda
y cumplir las
medidas de
bioseguridad.
Fase 4
Transmisión
comunitaria
Contar con
un plan de
vacunación
con la oferta de
vacunas para la
población que
viene a demanda
espontanea a
los servicios de
salud y cumplir
las medidas de
bioseguridad.
Identificar
Reubicación
Reubicación
ambientes físicos del servicio de
del servicio de
para reubicar
vacunación
vacunación
los servicios de
fuera del área
fuera del área
vacunación.
de triaje, para
de triaje para
reducir el riesgo.
reducir el riesgo.
Informar por
Ofertar la
Ofertar la
medios masivos a vacunación
vacunación
la población sobre a grupos
a grupos
la continuidad
vulnerables,
vulnerables,
de la vacunación
utilizando
utilizando
e importancia
medidas de
medidas de
de asistir a citas
protección del
protección del
programadas
personal de salud personal de salud
en sus
y cumplir con las y cumplir con las
establecimientos recomendaciones recomendaciones
de salud.
de
de
distanciamiento
distanciamiento
físico.
físico.
Vacunación
Vacunación
Vacunación
fuera de servicio, fuera de servicio, fuera de servicio,
según esquema
según esquema
según esquema
de vacunación,
de vacunación,
de vacunación,
con medidas de
con medidas de
con medidas de
bioseguridad,
bioseguridad,
bioseguridad,
distanciamiento
distanciamiento
distanciamiento
físico y medidas
físico y medidas
físico y medidas
de protección del de protección del de protección del
personal de salud. personal de salud. personal de salud.
Informar a la
población sobre
la continuidad
de los servicios
de vacunación.
Informar a la
población sobre
la continuidad
de los servicios
de vacunación.
Priorizar
enfermedades
prevenibles por
vacunación que
puedan causar
brotes, como
el sarampión,
poliomielitis,
difteria, influenza
y fiebre amarilla.
Vacunación
Evaluación de
comunitaria en las la conveniencia
zonas afectadas
de realizar la
y de acuerdo a
vacunación
las enfermedades comunitaria
prevenibles por
en zonas
vacunación
afectadas con
que puedan
las condiciones
causar brotes.
epidemiológicas.
Fuente: Organización Panamericana de la Salud, 2020.
4.6
BIOSEGURIDAD EN LA VACUNACIÓN
Es la aplicación de un conjunto de normas preventivas que debe aplicar el personal de salud,
para evitar el contagio por la exposición de agentes infecciosos, sean físicos, químicos o
biológicos, sobre todo sangre y fluidos corporales, que pueden provocar daño, debido a su
Manual Técnico del Programa Ampliado de Inmunización
Priorizar
enfermedades
prevenibles por
vacunación
puedan causar
brotes, como
el sarampión,
poliomielitis,
difteria, influenza
y fiebre amarilla.
Vacunación
Mantener la
Oferta de
comunitaria en
vacunación
vacunación a
respuesta a brotes comunitaria
demanda, hasta
o campañas
de acuerdo a
ver reducido
la normativa
el riesgo de
nacional.
transmisión y
la capacidad
del sistema de
salud se haya
recuperado lo
suficiente como
para reanudar
estas actividades.
Vacunación a
De acuerdo al esquema, priorizar la vacunación contra la influenza,
personal de salud sarampión rubeola, fiebre amarilla, hepatitis B y anticovid- 19.
Vigilancia
Vigilancia de las
Fortalecer la vigilancia de las enfermedades prevenibles
epidemiológica
enfermedades
por vacunación, con las medidas de protección
prevenibles por
del personal de salud y distanciamiento físico.
vacunación de
acuerdo a la
norma nacional
Monitoreo
Indicadores establecidos (PENTA3, OPV3, SRP2, en todos los niveles.
Monitoreo de abastecimiento de biológicos e insumos.
Operatividad de cadena de frío.
Verificación y disponibilidad de elementos de protección del personal.
Recursos
Fortalecer sus conocimientos en el manejo de la clasificación
humanos
y desechos generados en los servicios de vacunación.
Capacitar al personal en EPP y control de infecciones.
Entrenamiento para mejorar la capacidad de
responder a las dudas de los usuarios.
159
carácter contaminante; están destinadas a proteger a personas, áreas hospitalarias y medio
ambiente de la exposición a agentes potencialmente infecciosos o considerados de riesgo
biológico.
4.6.1
Uso apropiado de las jeringas
Preparar y administrar las vacunas con una jeringa nueva, de preferencia auto bloqueante AD.
Guía para el uso de jeringas auto bloqueantes AD:
* Comprobar el tipo de jeringa, aguja, vacuna, dosis, edad del paciente y vía de administración.
* Verificar la fecha de expiración de la jeringa. Si ha expirado debe desecharlas.
* El envase de la jeringa debe estar en buenas condiciones. Si está roto o abierto se debe
desechar.
* Las jeringas con envase de papel deben abrirse sin tocar la aguja o la punta de la jeringa.
* Insertar la aguja en el frasco y extraer la dosis correcta.
* Limpiar el área en la que será aplicada la inyección.
* Inyectar la dosis con el bisel de la aguja hacia arriba.
* Después de la inyección, colocar directamente la jeringa sin re encapuchar la aguja en la
caja de desecho seguro.
* Nunca se debe tapar ni remover la aguja una vez usada.
4.6.2
Bioseguridad para el trabajador de salud
El PAI también se preocupa por la bioseguridad de los trabajadores de salud, por ello recomienda
las siguientes previsiones:
* El uso de jeringas auto destructibles no permite su reutilización.
* No caminar con las jeringas destapadas por el área de vacunación.
4.6.3
Las cajas de desecho seguro
Deben utilizarse tomando en cuenta sus instrucciones:
Serie: Documentos Técnico Normativos
* Armar la caja antes de su uso.
160
* Ubicarla en el lugar donde se administra la vacuna.
* Colocar solo jeringas con agujas sin tapar, no otros materiales.
* Llenar hasta la ¾ partes de la caja.
* Cada caja debe ser usada una sola vez.
* Nunca extraer los desechos.
* Cerrar y sellar la caja antes de transportarla.
* La caja debe llevar un rotulo que indique que se trata de desechos peligrosos.
4.6.4
Para el manejo de corto punzantes
Los elementos corto punzantes deben ser desechados inmediatamente luego de su uso, para
lo cual debe utilizar las cajas de desecho seguro, que deben cumplir con algunos requisitos:
* Resistencia mínima de penetración, de material rígido e impermeable resistente al
traspaso por las agujas; con un aditamento que permite su remoción.
* Debe tener una única vía de entrada, que impide la introducción de las manos y con una
tapa de seguridad que una vez colocada no pueda ser retirada.
* Tendrá demarcado claramente las 3/4 partes de su volumen.
* Con la identificación de los residuos que contiene, y el símbolo correspondiente de
Residuos Hospitalarios Peligrosos.
* Etiqueta con breve indicación de uso.
* Desechar únicamente material corto punzante.
* Cuando los desechos en el interior del recipiente alcancen las 3/4 partes de su volumen,
deberá taparse y enviar para su tratamiento.
* Las jeringas deben desecharse inmediatamente después de ser utilizadas.
* Nunca extraer los desechos.
* Una vez utilizada la aguja, no se debe colocar su cobertor ni manipular.
* Cuando trabaje fuera del establecimiento de salud, también utilice las cajas de desecho
seguro.
* Las vacunas son residuos bio-sanitarios sujetos a normas para su eliminación correcta.
por lo que es importante realizar la inactivación química.
* Cerrar y sellar la caja antes de transportarla.
* La gestión de desechos del material de vacunación, comienza con la clasificación, su
separación, su almacenamiento transporte, y por último su tratamiento y eliminación
final.
4.6.5
Inactivación Química
Los frascos de vacuna multidosis, tienen un periodo de uso de seis horas y si existe saldos
de vacuna no utilizados, se debe aplicar el procedimiento de la inactivación química con el
hipoclorito al 1% para lo cual se debe programar de acuerdo a la necesidad.
4.6.6
Seguridad de la comunidad y el medio ambiente
Todos los vacunatorios deben aplicar la Norma Boliviana NB 69001- 69009 de acuerdo a los
niveles de atención.
Tener en cuenta que los residuos que se generan en el PAI corresponden a las siguientes
clases y sub clases:
Manual Técnico del Programa Ampliado de Inmunización
* Cada caja debe ser usada una sola vez.
161
Tabla N°8: Clases de residuos
Clase de residuo
Subclase de residuo
Tipo de residuo
Clase A Infecciosos
Sub Clase A-1
Vacunas vencidas o mal
conservadas (calentadas,
congeladas, sobrantes
de frascos multidosis
y frascos vacíos).
Algodones utilizados para
la limpieza de la región
donde se aplica la vacuna.
Cortopunzantes (cajas de
desecho seguro, llenas de
jeringas con agujas).
Similares a los domésticos
(papel, cartón, plástico,
cobertores, etc.).
Subclase A-2
Subclase A-4
Clase C Comunes
En los establecimientos de salud nivel I, II y III del área urbana y rural, para la disposición de los
residuos sub clase A, se utilizarán las cajas de desecho seguro para residuos punzocortantes,
en el marco de lo estipulado en la NB 69003. Para los residuos sub clase A-1, A-2 y los comunes
se utilizarán recipientes de plástico.
Serie: Documentos Técnico Normativos
Tabla N°9: Subclases de residuos
162
Subclase
Qué contiene
Manejo inicial
Manejo final
A–1
Vacunas vencidas,
mal conservadas
(calentadas,
congeladas, sobrantes
de frascos multidosis
y frascos vacíos).
Coloque en bolsas azules
para su destino final.
En caso de reutilizar
los frascos de vacunas
para otros fines,
tratarlos con hipoclorito
de sodio al 1%.
A-2
Torundas de algodón.
Coloque en las bolsas
rojas de plástico.
Traslado al
almacenamiento en
espera de la empresa
(urbano) que las llevará
a su destino final.
En el área rural,
trasladar bajo norma
de bioseguridad
para enterrarlas.
Traslado al
almacenamiento en
espera de la empresa
(urbano) que las llevará
a su destino final.
En el área rural,
trasladar bajo norma
de bioseguridad
para enterrarlas.
A-4
Cortopunzantes
(cajas de desecho
seguro llenas de
jeringas con agujas).
Coloque las jeringas
en la caja de desecho
seguro, sin volver a
tapar la aguja (incluye
jeringas de rotarix).
Clase C
Comunes
asimilables a los
domésticos (papel,
cartón, plástico,
cobertores, etc.).
Colocar en bolsas
negras, recipientes de
desechos comunes o
clasificar para reciclar.
4.6.7
A.
Traslado al
almacenamiento en
espera de la empresa
(urbano) que las llevará
a su destino final.
En el área rural,
trasladar bajo norma
de bioseguridad
para enterrarlas.
Traslado al
almacenamiento en
espera de la empresa
(urbano) que las llevará
a su destino final.
En el área rural,
trasladar bajo norma
de bioseguridad
para enterrarlas.
Disposición final
Celdas de seguridad en rellenos sanitarios
B.
Micro celdas en los predios del establecimiento de salud
En los municipios donde no se cuenta con sistemas de recolección municipal, los residuos
que se generan en el establecimiento de salud, deben ser confinados en micro celdas que
generalmente, se construyen en los predios del establecimiento de salud. Estas micro celdas
se usan para minimizar los efectos de los residuos sobre el personal de salud y la población
en general.
C.
Entierro de los residuos
En los municipios que no cuentan con celdas de seguridad en rellenos sanitarios ni con micro
celdas en los predios del establecimiento de salud, los residuos deben ser enterrados en áreas
de la misma comunidad, pero que estén alejadas de escuelas y ríos, además que no tengan
afluencia de personas.
Manual Técnico del Programa Ampliado de Inmunización
En las ciudades que cuentan con sistemas diferenciados de recolección de desechos, los
residuos infecciosos generados en los establecimientos de salud, son confinados en celdas
de seguridad ubicadas en el interior de los rellenos sanitarios, con lo cual se garantiza que
éstos no se conviertan en un riesgo para la comunidad y el medio ambiente.
163
D.
Incineración
Serie: Documentos Técnico Normativos
Consiste en someter los desechos a una temperatura mayor a 800° y reducirlos a cenizas.
Esta es la manera más segura de eliminar agentes patógenos y reducir el volumen de basura
al mínimo.
164
CAPÍTULO 5
VIGILANCIA
EPIDEMIOLOGICA EN EL
PAI
Índice
5.1
5.2
5.2.1
5.2.2
5.2.3
5.2.4
5.3
5.4
5.4.1
5.4.2
5.4.3
5.4.4
5.4.5
5.4.6
5.4.7
.5
5.5.1
5.5.2
5.5.3
5.5.4
5.6
5.7
5.7.1
5.7.2
5.7.3
5.7.4
5.8
5.9
5.10
5.11
5.12
5.12.1
5.12.2
5.12.3
5.12.4
5.12.5
5.12.6
5.12.7
5.12.8
5.12.9
5.12.10
5.12.11
5.12.12
5.12.13
Introducción
Eventos bajo vigilancia en el PAI
Vigilancia de enfermedades prevenibles por vacunación
Vigilancia de eventos relacionados con la vacunación
Vigilancia de situaciones o factores de riesgo
Vigilancia de eventos supuestamente atribuibles a la vacunación e inmunización
Marco conceptual
Etapas de la vigilancia epidemiológica de las enfermedades prevenibles por vacuna
Recolección de datos
Notificación
Investigación
Análisis de datos
Interpretación de la información
Implementación de medidas de control
Difusión de información
Modalidades de vigilancia en las EPV
Vigilancia comunitaria
Vigilancia regular
Vigilancia especializada
Vigilancia en Hospitales Centinela
Actividades complementarias regulares de la vigilancia de las EPV
Organización y funciones / responsabilidades por niveles
Establecimientos de Salud
Coordinación-gerencia de red/municipio
PAI Departamental
PAI Nacional
Rol y redes de laboratorio en la vigilancia de las EPV
Comité Nacional de Inmunización
Plan de sostenibilidad de la erradicación de la polio y eliminación del sarampión
Adecuación y actualización permanente
Vigilancia de enfermedades prevenibles por vacuna
Sarampión y rubeola
Síndrome de rubeola congénita
Poliomielitis
Difteria
Tosferina
Tétanos neonatal
Fiebre amarilla
Meningitis tuberculosa, BCG
Hepatitis b
Parotiditis
Neumonías bacterianas en niños menores de 5 años
Meningitis bacteriana en niños menores de 5 años
Diarreas por rotavirus en niños menores de 5 años
160
160
160
162
162
162
162
165
165
166
167
167
168
168
168
169
169
170
170
171
171
172
172
172
173
174
175
175
175
176
176
176
178
179
181
182
183
183
184
184
184
185
185
186
5.1
INTRODUCCIÓN
En este capítulo se establecen normas, estandarizan conceptos que serán el fundamento
para la adecuada ejecución de los procedimientos en la vigilancia epidemiológica, tiene
alcance en todo el territorio nacional, en todos los niveles de salud y en los subsectores:
público, de la seguridad social a corto plazo, privados y de convenio.
La Vigilancia Epidemiológica es un componente imprescindible del Programa Ampliado
de Inmunización, es la herramienta fundamental que permite:
* Proveer información para la adecuada toma de decisiones en la planificación para la
prevención, control de las EPV y eventos relacionados con la vacunación.
* Determinar oportunamente factores o situaciones de riesgo y la acumulación de
susceptibles.
* Detectar oportunamente cambios en la ocurrencia, distribución de las EPV y eventos
relacionados con la vacunación.
* Identificar, cuantificar, monitorear las tendencias, patrones de las EPV y eventos
relacionados con la vacunación en las poblaciones objeto del programa.
* Observar los cambios en los patrones de ocurrencia de los agentes patógenos (cepas
y tipos) y huéspedes para la presencia de EPV.
* Detectar oportunamente brotes y nuevos agentes patógenos.
* Implementar y evaluar las medidas de prevención y control en el PAI.
* Mantener la erradicación y eliminación en Bolivia de la Poliomielitis, Sarampión,
Rubéola y SRC con una vigilancia activa en todo el territorio nacional.
El Programa Ampliado de Inmunización:
* Formula e implementa planes de prevención y respuesta rápida a brotes.
* Desarrolla investigaciones y estudios para la introducción de nuevas vacunas.
Serie: Documentos Técnico Normativos
* Monitorea la vacunación segura, los Eventos Supuestamente Atribuibles a la Vacunación
e Inmunización (ESAVI) y los Eventos Adversos de Especial Interés (EVADIE).
168
5.2
Eventos bajo vigilancia en el PAI
En el PAI se realiza vigilancia de enfermedades prevenibles por vacunación, eventos de salud
relacionados con la vacunación, situaciones o factores de riesgo, Eventos Supuestamente
Atribuibles a la Vacunación e Inmunización y Eventos Adversos de Especial Interés .
5.2.1
Vigilancia de Enfermedades Prevenibles por
Vacunación
Se realiza la vigilancia de enfermedades prevenibles por vacunación que son sujeto de
control por medio del esquema nacional de vacunación. La definición operativa de “caso
sospechoso” es clave para la detección y notificación, esta definición de caso es sindrómica,
por ejemplo:
* Vigilancia de Parálisis Flácida Aguda (PFA), que permitiría captar no solamente una
sospecha de Poliomielitis, sino también de otras enfermedades que cursan con
parálisis flácida como el Síndrome de Guillán – Barré, Mielitis Transversa, Neuritis
Traumática entre otras.
* Vigilancia de la Enfermedad Febril Eruptiva, aunque se utiliza principalmente para la
captación de Sarampión y Rubeola, esta vigilancia también podría detectar dengue,
parvovirus B19 y otras enfermedades virales que cursan con fiebre y erupción.
Este tipo de vigilancia, permite la detección inicial de los casos, pero posteriormente deben
ser clasificadas adecuadamente, de acuerdo a criterios epidemiológicos, clínicos y de
laboratorio.
La vigilancia de algunas enfermedades inmunoprevenibles, están bajo la responsabilidad
de otros programas y en algunos casos son parte de registros estadísticos que se analizan
en períodos más largos; esto se observa en la siguiente tabla.
Tabla N°10: enfermedades sujetas a vigilancia
SUJETA A
VIGILANCIA
SI (1)
SI
VACUNA
ENFERMEDAD QUE PREVIENE
BCG
Pentavalente
Antipolio
Antineumocócicas
Formas graves de Tuberculosis
Difteria, Tétanos, Coqueluche, Hepatitis
B, Neumonías y Meningitis por HiB
Poliomielitis
Neumonías y Meningitis
Anti rotavirus
Diarreas severas por rotavirus
SI
Anti influenza
estacional pediátrica
SRP
Influenza estacional
SI (2)
Sarampión, Rubéola, Parotiditis
SI
Antiamarílica
Fiebre Amarilla
SI
Virus del Papiloma
Humano (VPH)
dT Adulto
Cáncer cérvico uterino
SI (3)
Difteria, Tétanos Neonatal y Tétanos
del Adulto (hombres y mujeres)
SI
Anti Influenza
estacional Adulto
ANTI COVID- 19
Influenza Estacional
SI (2)
COVID-19
SI (4)
Manual Técnico del Programa Ampliado de Inmunización
(1) Programa Tuberculosis.
(2) Programa Influenza, toma en cuenta niños y adultos.
(3) Programa Cáncer, se realiza investigación.
(4) Dirección General de Epidemiologia / MSyD.
SI
SI
169
5.2.2
Vigilancia de eventos relacionados con la vacunación
Sujetos a vigilancia por el nuevo Reglamento Sanitario Internacional (RSI2005):
* Enfermedades erradicadas: Poliomielitis por virus salvaje o por el virus derivado de la
vacuna en zonas con coberturas de vacunación muy bajas por largo tiempo.
* Enfermedades eliminadas: Sarampión, Rubéola y Síndrome de Rubéola congénita.
5.2.3
Vigilancia de situaciones o factores de riesgo
* Bajas coberturas de vacunación (estratificación de municipios de riesgo).
* Acumulación de susceptibles: personas sin vacunar.
* Desastres naturales: inundaciones o sequías que provocan concentraciones de población
vacunada y no vacunada en refugios, campamentos.
* Epidemias o pandemias: circulación del virus que expone a poblaciones de susceptibles.
* Conflictos sociales: que interrumpen la vacunación, aumentando la población susceptible.
5.2.4
Vigilancia de Eventos Supuestamente Atribuibles a la
Vacunación e Inmunización (ESAVI) y Eventos adversos de
especial interés (EVADIE)
El Evento Supuestamente Atribuible a la Vacunación o Inmunización (ESAVI), es cualquier
situación de salud desfavorable, no intencionada, que ocurre después de la administración de
una vacuna y es supuestamente atribuido a esta.
Puede ser un signo, un síntoma, enfermedad o hallazgo anormal de laboratorio. Si bien existe
una relación o asociación temporal, no implica necesariamente una relación de “causa y
efecto”.
Serie: Documentos Técnico Normativos
Un EVADIE (Evento Adverso De Especial Interés) es un evento científico y médico especificado
por el fabricante y que debe ser monitoreado y comunicado rápidamente por el personal que
investiga, tiene potencial asociación causal con la vacuna y necesita ser cuidadosamente
monitoreada y confirmada para futuros estudios.
170
Todo medicamento incluidas las vacunas, puede causar efectos adversos graves y no graves;
con las vacunas, la mayoría son leves y autolimitados. Sin embargo, la aplicación de las
vacunas a menores de 5 años coincide con la mayor incidencia de enfermedades infantiles,
por lo que pueden ser atribuidas a la vacunación e inmunización.
El PAI vigila los ESAVI y EVADIE como parte de la Vacunación Segura.
5.3
Marco conceptual
Es necesario clarificar algunos conceptos que permitan comprender los alcances de los
procesos de la vigilancia epidemiológica en el PAI mencionados a continuación:
Incidencia: Se refiere al número de casos nuevos de una determinada enfermedad, en una
población con riesgo de desarrollar la misma, en un periodo específico de tiempo.
Prevalencia: Número de casos nuevos y antiguos de una enfermedad, presentes en una
determinada población, en un periodo específico de tiempo.
Caso índice: Es el primer caso que se presenta en una familia o grupo definido que ha sido
identificado por el sistema de vigilancia.
Caso primario: Es el individuo que introdujo la enfermedad en una población determinada, en
una familia o en un grupo específico. No necesariamente es el primer caso diagnosticado.
Conglomerados: Número inusual de casos o eventos relativamente poco comunes en un
mismo espacio y/o tiempos determinados, en número mayor a lo esperado atribuibles al azar.
Agente infeccioso: Es un organismo (bacteria, virus, hongo, helminto, etc.) capaz de producir
una infección o enfermedad infecciosa.
Reservorio de agentes infecciosos: Cualquier ser humano, animal, artrópodo, planta, suelo o
materia (o una combinación de estos), en donde normalmente vive y se multiplica un agente
infeccioso; depende de este reservorio para su supervivencia, es el lugar donde se reproduce
y es de donde pueda ser transmitido a un huésped susceptible.
Modo de transmisión de agentes infecciosos: Cualquier mecanismo, en virtud del cual, un
agente infeccioso se propaga de una fuente o de un reservorio a una persona. Los mecanismos
de transmisión son: directa, indirecta y aérea.
* Directa: Es la transmisión que se da de persona a persona
* Aérea: A través del aire, es la diseminación de aerosoles microbianos transportados
hacia una puerta de entrada apropiada, generalmente el tracto respiratorio. Los aerosoles
microbianos son suspensiones aéreas de partículas constituidas total o parcialmente por
microorganismos.
Periodo de incubación: Es el intervalo de tiempo que transcurre entre la exposición a un agente
infeccioso y la aparición del primer signo o síntoma de la enfermedad.
Periodo de transmisibilidad: Períodos en los cuales el agente infeccioso puede pasar de una
persona infectada a otra, de un animal infectado al hombre o viceversa. Esta transmisión
puede ser de una manera directa o indirecta.
Susceptible: Se refiere a cualquier persona o animal que considera que no posee suficiente
resistencia contra un agente patógeno determinado, si llega a entrar en contacto con él.
Manual Técnico del Programa Ampliado de Inmunización
* Indirecta: A través de objetos o materiales contaminados tales como juguetes, pañuelos,
instrumentos quirúrgicos, agua, alimentos, leche, productos biológicos, incluyendo suero
y plasma.
171
Inmunidad: Es la capacidad de resistencia, expresada en la presencia de anticuerpos o células,
que tienen una acción específica contra el microorganismo causante de una enfermedad
infecciosa determinada.
Factores de riesgo: Es una circunstancia o eventualidad que incrementa la probabilidad de
ocurrencia de un evento específico, tal como una enfermedad; no necesariamente es el factor
causal.
Tasa de ataque: Es la tasa de incidencia acumulada de una infección, en un grupo y periodo
determinado, durante una epidemia y que suele expresarse en porcentajes (casos por 100).
Tasa de ataque secundaria: Cuando se trata de enfermedades transmisibles, expresa el número
de casos entre los contactos familiares o en instituciones, ocurridos dentro del periodo de
incubación aceptado, después de la exposición a un caso primario y en relación con el total
de dichos contactos; puede limitarse a los contactos susceptibles cuando estos se pueden
identificar.
La tasa de infección: expresa la incidencia de casos (nuevos) manifiestos y asintomáticos.
Tasa de morbilidad: Expresa al número de personas de una población determinada que se
enferman durante un periodo específico.
Tasa de mortalidad: Es la razón entre el número de personas muertas durante un periodo
específico y el número en riesgo de morir durante el mismo periodo. La tasa de mortalidad no
debe confundirse con la de letalidad.
La tasa total o bruta de mortalidad: Incluye las muertes por todas las causas y se expresa
como el número de defunciones por 1000 habitantes; mientras que la tasa de mortalidad
específica, incluye a las muertes producidas por una enfermedad determinada y generalmente
se expresa por 100.000 personas. La población base puede definirse según sexo, edad u otras
características.
Serie: Documentos Técnico Normativos
Tasa de letalidad: Es la relación entre el número de personas que fallecen por una determinada
enfermedad y el número total de personas afectadas por esa enfermedad en un periodo dado;
suele expresarse en porcentaje. La tasa de letalidad es un indicador de la gravedad de una
enfermedad.
172
Historia natural de la enfermedad: Es el curso de los acontecimientos que ocurren en el
organismo humano, desde que se produce la exposición al riesgo (agente etiológico), hasta
el inicio y desarrollo de la enfermedad y posterior desenlace (curación, secuela producida por
la enfermedad o muerte).
Figura 12: Historia natural de la enfermedad
Es una herramienta que permite conocer el curso de una enfermedad prevenible por
vacunación, en su comportamiento natural; es decir, en ausencia de tratamiento o medida de
intervención, tomando en cuenta la triada ecológica de agente – huésped – medio ambiente.
Fuente: PAI / MSyD.
Esta herramienta, permite al personal, relacionar las características de una enfermedad con los
niveles de prevención y con las medidas de control; en base a los períodos de la enfermedad,
se puede establecer su pronóstico en función a las medidas de prevención y control. Permite,
además, correlacionarlas con las EPV sujetas a vigilancia para ser ingresadas en el sistema
de notificación del Sistema Nacional de Información en Salud-Vigilancia Epidemiológica
(SNIS-VE).
5.4
Etapas de la vigilancia epidemiológica de las
enfermedades prevenibles por vacuna
Son seis etapas básicas de la vigilancia, se llevan a cabo en todos los tipos o modalidades de
la vigilancia de las enfermedades prevenibles por vacuna y en otros eventos relacionados con
Manual Técnico del Programa Ampliado de Inmunización
En esta herramienta, todos los criterios epidemiológicos, clínicos y de gabinete, son
relacionados con las fases de una enfermedad (preclínica o prepatogénica y clínica o
patogénica), mostrando el curso de la misma y su pronóstico sin intervención reflejada en la
siguiente imagen.
173
la vacunación antes descritos; pueden poseer características específicas, dependiendo del
evento en cuestión.
5.4.1
Detección
Es la captación de los casos sospechosos; para ello, el personal de salud en cada nivel, debe
mantener una actitud de alerta permanente, con el propósito de identificar las “situaciones”
que deben ingresar en el sistema de vigilancia.
Las herramientas con las que se cuenta para distinguir e identificar estas “situaciones” son:
Registro de los datos del Evento de Salud
Recolección de datos
Es el proceso más importante, a la vez, el más costoso y difícil de la vigilancia de las EPV,
puesto que define el INSUMO que ingresa al sistema de vigilancia.
La calidad de un sistema de vigilancia se mide por la calidad de los datos recolectados, lo que
demuestra la importancia de este proceso.
Las actividades de recolección de datos son: la detección y el registro de los datos del evento
de salud, bajo vigilancia en fichas epidemiológicas estandarizadas. (anexo.)
.
Definiciones operativas de EPV y ESAVI
Una definición operativa, es un conjunto de criterios clínicos, de laboratorio y epidemiológicos
de las EPV o del evento relacionado con la vacunación para la vigilancia, seleccionados y
agrupados estratégicamente, que sirve al personal de salud para reconocer e identificar el
evento sujeto a vigilancia.
174
Las definiciones operativas, son permanentemente tomadas en cuenta, de manera regular y
rutinaria, en el momento de atender a un paciente, aplicar una vacuna, monitorear el estado
Figura 13: Enfermedades
para notificación inmediata
Serie: Documentos Técnico Normativos
Las definiciones operativas, son emitidas por niveles normativos, tanto nacionales como
internacionales, haciendo prevalecer criterios de sensibilidad y especificidad y en dependencia
de la situación epidemiológica y los objetivos del sistema de vigilancia, en un momento
determinado.
* Sarampión
* Fiebre Amarilla
* Rubeola
* Influenza AHN1 AHN3
* Síndrome de Rubeola Congénita
* COVID -19
* Tosferina/Coqueluche
* Parálisis Flácida Aguda (Polio)
* Difteria
de salud, etc. pues permiten al personal de salud reconocer e identificar el evento sujeto a
vigilancia, para ser ingresado en el sistema de vigilancia de las EPV.
5.4.2
Notificación
La notificación debe ser oportuna, ágil, de calidad e integra a la instancia pertinente, los tipos
de notificación que se aplica en el PAI son:
* Notificación de casos (Inmediata): es la transmisión de la información de los casos
individuales, realizados de manera inmediata. La notificación se realiza ante la sospecha
clínica por tratarse eventos que requieren una rápida identificación, manejo y control. Esta
se realiza dentro de las 24 horas de ocurrido el caso, utilizando como vía de comunicación
el teléfono, Whatsapp, fax, correo electrónico, etc.
Son nueve enfermedades sujetas a notificación inmediata:
* Notificación semanal (Regular): se efectúa el consolidado de todos los casos
presentados en una semana epidemiológica determinada. La notificación se realiza ante
un caso sospechoso, que posteriormente se ratifica o rectifica de acuerdo a resultados de
la investigación y laboratorio.
* Se utiliza como vía de comunicación, el formulario 301 b del SNIS-VE, el correo electrónico
al inmediato superior de acuerdo a protocolo, flujo de información y toma/envió de
muestras (Tabla N°11).
* Notificación Semanal Negativa: Un aspecto importante en la vigilancia del PAI, es el
registro y notificación de la inexistencia de casos, registrándolos con el numeral 0 (cero)
en el formulario de la semana epidemiológica correspondiente; esta modalidad se aplica
en fases de eliminación o erradicación de enfermedades prevalentes por vacuna.
Tabla N°11: ENFERMEDADES DE NOTIFICACIÓN SEGÚN REGISTRO EN FORMULARIO 301 DEL SNISVE/MINISTERIO DE SALUD Y DEPORTES
MEDIATA
* Tétanos neonatal/Adulto
*
Rubéola
*
Hepatitis viral B
*
Parálisis Flácida Aguda (Polio)
*
Parotiditis
*
Síndrome de Rubeola Congénita
*
Tosferina/Coqueluche
*
Difteria
*
Fiebre Amarilla
*
Influenza AHN1 AHN3
*
COVID -19
Fuente: PAI / MSyD.
Manual Técnico del Programa Ampliado de Inmunización
INMEDIATA * Sarampión
175
5.4.3
Investigación
Con apoyo de la ficha epidemiológica, se investigan los aspectos epidemiológicos de los
casos sospechosos, a partir de la construcción de la línea de tiempo. S e puede identificar
fuente de infección, cadenas de trasmisión de la enfermedad, investigación de contactos
directos e indirectos, estado vacunal, aspectos clínicos, para establecer compatibilidad con
las características típicas/específicas de la enfermedad, toma de muestras y su transporte
hasta el laboratorio de referencia.
5.4.4
Análisis de datos
El análisis involucra, principalmente, un proceso de descripción y comparación de datos,
con relación a características y atributos de: tiempo, lugar y persona; así como entre los
diferentes niveles organizativos del sistema de salud.
Tienen el propósito de:
* Establecer las tendencias de la enfermedad, a fin de detectar y anticipar la ocurrencia de
cambios en su comportamiento.
* Sugerir los factores asociados con el posible incremento o descenso de casos y/o
defunciones, e identificar los grupos sujetos a mayor riesgo.
* Identificar las áreas geográficas que requieren medidas de control.
Este análisis de los indicadores permite:
* Conocer el avance en el cumplimiento de las metas y el logro de los objetivos.
* Informar sobre una situación determinada y su evolución en el tiempo.
* Muestra resultados y no solamente la relación causa y efecto.
* Muestra los niveles de rendimiento y desempeño alcanzado en la actividad.
* Proveen una base de datos para el control, monitoreo y evaluación.
Los indicadores que se conforman y analizan en el sistema de vigilancia, son los siguientes:
Serie: Documentos Técnico Normativos
* Indicadores de Prevención: Cobertura, tasa de deserción por vacunas, Monitoreo Rápido
de Coberturas (MRC), acúmulo de susceptibles por una enfermedad.
176
* Indicadores de Control: Porcentaje de vacunación en barridos/bloqueos.
* Indicadores de erradicación y eliminación: Indicadores de desempeño de vigilancia por
enfermedad y descritos en detalle en el Manual de Vigilancia Epidemiológica de las EPV.
5.4.5
Interpretación de la información
La interpretación de los hallazgos del análisis, sirve para la generación de hipótesis, para lo
cual debe tenerse en consideración una serie de posibles explicaciones y alternativas,
tomando en cuenta el contexto y la realidad de cada situación específica.
De esta manera, la información recopilada en cada uno de los eventos sujetos a vigilancia
en el PAI, es contrastada con factores tales como el aumento de la población, la migración, la
introducción de nuevos métodos diagnósticos, el mejoramiento de los sistemas de notificación,
el cambio en la definición de casos, y la posibilidad de problemas con la validez de los datos
de vigilancia por subregistro, sesgos o duplicación de notificaciones que pueden producir
resultados equivocados o falsos.
5.4.6
Implementación de medidas de control
Dependiendo de los resultados de la investigación, de acuerdo al tipo de enfermedad y al
patógeno que se está investigando, se implementan medidas de control a través de la
vacunación. Estas medidas incluyen Monitoreos rápidos de cobertura, (MRC) para detectar
susceptibles, rastrillaje casa a casa, en lugares de estudio o trabajo, Búsqueda Activa
Institucional y Comunitaria.
5.4.7
Difusión de información
La difusión periódica de la información que resulte del análisis e interpretación de los datos
recolectados y de las medidas de control tomadas, constituye una de las etapas cruciales de
la vigilancia, puesto que integra la información con las instancias que realizan las acciones
correspondientes.
El fin de la difusión de la información de la vigilancia de las EPV y de los eventos asociados a
la vacunación es el de fortalecer la capacidad local en el análisis y evaluación de las acciones
de control.
Los instrumentos de difusión son variados: impresos o digitales, boletines, revistas. Su éxito
radica en la regularidad de su impresión.
5.5
MODALIDADES DE VIGILANCIA EN LAS EPV
La vigilancia de las EPV, se la realiza en cuatro modalidades complementarias:
* Vigilancia comunitaria
* Vigilancia especializada
* Vigilancia en hospitales centinela
5.5.1
Vigilancia comunitaria
Es la vigilancia simplificada que realiza la comunidad mediante la participación voluntaria
de líderes comunitarios, actores sociales, iglesia, maestros, organizaciones juveniles y
miembros de organizaciones de base que se transforman en informantes activos de los
casos sospechosos de enfermedades prevenibles por vacunación que se presenten en sus
lugares de residencia.
Estos líderes son el canal de comunicación entre la comunidad y el sistema de salud,
representado por el personal del establecimiento de salud del primer nivel.
Manual Técnico del Programa Ampliado de Inmunización
* Vigilancia regular
177
Actividades:
* El personal de salud debe contactarse con las diferentes organizaciones existentes en su
área e informarles regularmente sobre todas las EPV.
* Conformar una red de vigilantes que periódicamente informen al centro de salud.
* Investigar los reportes de la vigilancia comunitaria para confirmar o descartar los casos y
para motivar el funcionamiento de la misma.
La vigilancia comunitaria, de acuerdo a la obtención de la información, puede ser:
* Vigilancia pasiva: Los líderes comunitarios comunicarán al personal de salud la ocurrencia
de casos sospechosos de EPV en la comunidad, además de los rumores, noticias respecto
a ESAVI o información en contra las vacunas (antivacunas).
* Vigilancia Activa: El personal de salud busca la información de la red de informantes
comunitarios, sobre la ocurrencia o no de casos sospechosos de EPV, información sobre
ESAVI o contra las vacunas (antivacunas).
5.5.2
Vigilancia regular
Es la que se realiza en todos los establecimientos de salud del territorio nacional, de los
subsectores públicos, seguridad a corto plazo y privados. Todas las EPV son de notificación
individual, obligatoria e inmediata, en base a la definición de casos sospechosos.
* La periodicidad es por semana epidemiológica y sigue los niveles establecidos por el
SNIS-VE.
* La obtención y análisis de la información de casos sospechosos de EPV, se obtienen de
las fichas epidemiológicas; en base al análisis, se implementan las acciones de control,
mediante la vacunación dirigida a contactos y grupos de riesgo.
* Las intervenciones y los resultados, deben analizarse en los Comités de Análisis de la
Información (CAI), de los diferentes niveles del sistema.
Serie: Documentos Técnico Normativos
La vigilancia regular, de acuerdo a su forma de obtención de información es:
178
* Vigilancia pasiva: El paciente (caso sospechoso de cualquier EPV), demanda servicios en
el establecimiento de salud; el personal de salud, motivado e informado, lo detecta como
caso sospechoso, notifica y registra la ficha epidemiológica, además de registrarlo en la
historia clínica, cuadernos de consulta externa o de emergencias según corresponda.
Sigue el mismo procedimiento frente a la ocurrencia de un ESAVI.
* Vigilancia activa: El responsable de vigilancia de las EPV del establecimiento de salud,
antes de reportar la semana epidemiológica, corrobora los datos mediante entrevistas
al personal médico y de enfermería, y la revisión de cuadernos de consulta externa,
de emergencia o de los expedientes clínicos de internación (BAI), para confirmar la
ausencia o presencia de casos que son objetos de notificación, denuncia o comentarios,
en relación a EPV y Eventos Relacionados con la Vacunación.
5.5.3
Vigilancia especializada
Es la vigilancia que se realiza, a un problema de salud en particular, debido a compromisos
internacionales o prioridades nacionales.
En Bolivia, el PAI conjuntamente el SNIS-VE y los departamentos, han seleccionado 304
Establecimientos de Salud de los subsectores público, seguridad social y privados para la
implementación de esta vigilancia; esta selección, se la ha realizado por tipo de servicios, por
volumen de consultas, accesibilidad, puntos fronterizos/turísticos para realizar la vigilancia en
la detección, notificación e investigación de casos de EPV y en particular de las enfermedades:
Poliomielitis, Sarampión y Tosferina.
Esta vigilancia:
* Permite tener un alto grado de certeza, acerca de la ocurrencia o no de la enfermedad que
se está vigilando, puesto que genera información de alta calidad.
* Utiliza elementos de la vigilancia activa y se caracteriza por una rápida detección, acción
inmediata y prevención específica.
La vigilancia especializada, de acuerdo a su forma de obtención de información es:
* Activa: Realiza Búsqueda Activa Institucional antes de reportar; de esta manera se
certifica la notificación semanal negativa.
5.5.4
Vigilancia en hospitales centinela
Es la vigilancia que se realiza a un problema de salud en particular, debido a compromisos
internacionales o prioridades nacionales. En Bolivia, esta vigilancia se la realiza en cuatro
hospitales pediátricos, que evalúan el impacto de la vacunación para meningitis, neumonías
bacterianas y diarreas graves por rotavirus. Los casos son captados de acuerdo a definición de
caso, con criterios clínico, epidemiológico y laboratoriales.
La vigilancia centinela, de acuerdo a su forma de obtención de información es:
* Activa: Se realiza búsqueda activa institucional, para mejorar la tasa de captación de
casos.
5.6
ACTIVIDADES COMPLEMENTARIAS REGULARES DE LA VIGILANCIA DE LAS EPV
La principal actividad complementaria en vigilancia epidemiológica del PAI es la denominada
Búsqueda Activa, es una metodología de control de calidad de la vigilancia y tiene el fin de
identificar casos que no han sido reportados, son de dos tipos:
Manual Técnico del Programa Ampliado de Inmunización
* Pasiva: Se detectan pacientes de acuerdo a la definición de casos.
179
* Búsqueda Activa Institucional (BAI), consiste en la revisión semanal de diagnósticos,
historias o expedientes clínicos de consulta externa, internación y emergencias. El
personal de salud debe realizar cada mes, la acción de “buscar la información” se
refiere a ir más allá de las fronteras de nuestro servicio, indagando pacientes de otras
especialidades, otros diagnósticos, visitas de familiares, personal de salud, utilizando
instrumentos de recolección de información particulares, diseñados para tal efecto.
* Búsqueda Activa Comunitaria (BAC), donde el personal de salud, sale a buscar la
información sobrepasando las fronteras del establecimiento. A partir del sondeo
sistemático en la comunidad, por entrevistas casa por casa, líderes comunitarios,
residentes, lugares de concentración masiva de la población, puntos fronterizos,
guarderías-escuelas-colegios, instituciones; buscando casos sospechosos o probables
de EPV que no hayan sido notificados a la institución de salud correspondiente.
Para la realización de la BAI y BAC se debe realizar una planificación adecuada utilizando
los instrumentos de recolección de información, capacitando al personal de salud y líderes
comunitarios.
5.7
ORGANIZACIÓN Y FUNCIONES / RESPONSABILIDADES POR NIVELES
5.7.1
Establecimientos de Salud
La función y responsabilidad del director del Establecimiento de salud en el proceso de
vigilancia de las EPV son:
* Designar formalmente al responsable de Vigilancia epidemiológica de las EPV y ESAVI
* Organizar la vigilancia comunitaria de acuerdo a la realidad local. Identificando y
capacitando a líderes de la comunidad en elementos básicos de vigilancia de las EPV y
ESAVI.
* Motivar y capacitar de manera regular a todo el personal del Establecimiento de Salud
para la detección y notificación de las EPV y ESAVI.
Serie: Documentos Técnico Normativos
* Detectar y notificar inmediatamente la aparición de casos sospechosos de EPV y ESAVI.
180
* Vigilar el comportamiento de factores de riesgo: coberturas de vacunación, percepciones
de la comunidad respecto a la importancia, sus beneficios y la seguridad de la vacunación.
* Sistematizar, consolidar, analizar e interpretar la información que genera la Vigilancia
Epidemiológica de las EPV, comparando los datos, observando tendencias y otros
necesarios.
* Participar en la ejecución de actividades de control epidemiológico
* Realizar la investigación completa del caso de EPV, eventos, brote o ESAVI.
* Informar a su inmediato superior del área de su jurisdicción, los resultados del análisis y
los problemas que a su nivel no tienen solución.
* Difundir al personal de salud y a la comunidad, los resultados de la vigilancia y del control
de EPV.
5.7.2
Coordinación-Gerencia de Red/Municipio
* Si bien hay un responsable de la vigilancia de las EPV en cada red, designado de manera
formal; sin embargo, todo el personal de salud de este nivel debe apoyar de manera
obligatoria en este componente.
* Monitorear semanalmente, el cumplimiento de la notificación de las EPV y de los eventos
asociados a la vacunación en toda la red.
* Realizar BAI y BAC en un muestreo de Establecimientos de Salud, como control de calidad
a la vigilancia de su red, cuatro veces al año.
* Revisar, consolidar y analizar, de manera sistemática, la información de vigilancia de las
EPV y eventos asociados a la vacunación.
* Determinar acciones a desarrollar con el fín de dar soluciones oportunas y eficaces a las
situaciones detectadas.
* Reportar al nivel superior la información obtenida, luego del análisis realizado; destacando
los de mayor complejidad, magnitud y aquellos que requieren solución de un nivel mayor
de competencia.
* Evaluar el funcionamiento de la vigilancia, en la red de establecimientos de salud, de
acuerdo a los resultados alcanzados y cambios en el estado de salud de sus áreas de
intervención asignadas.
* Organizar la capacitación de manera continua al personal de salud, en sus áreas de
intervención asignadas.
* Brindar asesoría permanente a todo el personal, para el cumplimiento de las actividades
de vigilancia y control epidemiológico.
* Incentivar y facilitar la realización de investigaciones pertinentes, para la identificación de
riesgos que limitan el control de las EPV y de los eventos asociados a la vacunación.
5.7.3
PAI Departamental
* Coordinar, monitorear y supervisar las actividades técnicas – científicas - gerenciales y
administrativas del componente de Vigilancia de las EPV del PAI, para lograr la ejecución
eficiente de los procesos de inmunización.
* Planificar, organizar y presidir los equipos de Vigilancia Epidemiológica, para lograr los
objetivos operativos, funcionales y de impacto; con el fin de controlar, contener, eliminar
y erradicar un evento por EPV.
* Emitir opinión técnica – científica, según competencia del área, frente a contingencias
adversas por EPV, ESAVI y otras situaciones relacionadas con la vacunación. facilitando
la toma de decisión oportuna por el programa a nivel departamental.
Manual Técnico del Programa Ampliado de Inmunización
* Diseminar la información epidemiológica actualizada de la situación de las EPV y de las
coberturas de vacunación.
181
* Capacitar de manera continua en procesos de vigilancia de enfermedades prevenibles por
vacunación, epidemiología, contención y respuesta. Además de realizar la retroalimentación
al interior de todo el equipo departamental y en cascada a los diferentes niveles del PAI.
* Elaborar, analizar y proyectar el perfil epidemiológico del Programa Ampliado de
Inmunización para facilitar la toma de decisiones.
* Normar y facilitar la implementación de políticas, normas y procedimientos, emitidos por
el ente rector en la vigilancia de las EPV, ESAVI y otros eventos, para mejorar la respuesta
ante riesgos evidentes y el control de los mismos en coordinación con otros programas
de Epidemiología del SEDES para la atención de personas y el desarrollo de servicios de
salud entre otros.
* Facilitar, supervisar la elaboración de informes técnico - operativos según persona, tiempo
y lugar; para autoridades superiores y según requerimiento, orientados hacia la toma de
decisiones en base al análisis de información de vigilancia del PAI.
* Elaborar boletines
de
Vigilancia
Epidemiológica del Programa Ampliado de
Inmunización con la retroalimentación de información y el análisis del mismo, orientado
a la toma de decisiones en diferentes niveles.
* Incorporar en el POA anual actividades y recursos requeridos para la sostenibilidad de los
procesos de Vigilancia Epidemiológica de las EPV y gestionar la ejecución de los recursos
de forma mensual y trimestral.
5.7.4
PAI Nacional
* Estimulación y creación de alianzas estratégicas de cooperación técnica y de apoyo
financiero para la Vigilancia de las EPV en todos los niveles.
* Formulación y seguimiento de los indicadores de interés local, departamental y nacional;
alineados con indicadores de proceso, a nivel regional e internacional para el logro de los
objetivos del PAI.
* Evaluar la gestión en base al cumplimiento de indicadores de Vigilancia de EPV, a nivel
nacional, departamental y local.
Serie: Documentos Técnico Normativos
* Brindar un proceso sostenido de asistencia técnica, supervisión y control de los diferentes
niveles de carácter nacional en los subsectores público, seguridad a corto plazo y privados.
182
* Promover y supervisar la elaboración de diagnósticos y líneas de base integrales.
* Actualización e implementación permanente del sistema de información del PAI,
orientándolos a los procesos de vigilancia de las EPV.
* Elaboración y actualización de guías técnicas que orienten, en los diferentes niveles, al
personal de salud responsable de la vigilancia de las EPV.
* Consolidación y análisis de los datos de cobertura y otra información con evaluación de
las áreas de riesgo y programación de actividades de acuerdo priorización de riesgos.
* Presentación de datos para el boletín epidemiológico y su posterior difusión oficial.
* Notificación al programa de Vigilancia Epidemiológica nacional e internacional de los
casos; envío de muestras y fichas de vigilancia; evaluación de contactos en conjunto con
los equipos de salud de los diferentes niveles; evolución y cierre del caso.
* Promoción de la vacunación segura, con evidencia del análisis de información
proveniente de la vigilancia epidemiológica.
* Generación de información epidemiológica y estudio de costos que permitan la
introducción de nuevas vacunas de importancia en salud pública.
* Apoyo al desarrollo técnico y tecnológico en los diferentes niveles, con el fin de fortalecer
la capacidad de procesamiento y análisis de información, para dar respuesta inmediata
al control de brotes.
* Promover el análisis permanente para el desarrollo de estrategias con el fin de disminuir
oportunidades perdidas en vacunación.
* Desarrollar de acuerdo a sus competencias, el marco legal y la reglamentación
correspondiente para la mejora de los procesos de vigilancia regular, comunitaria y
especializada en los subsectores (públicos, de la seguridad social y privados).
5.8
Rol y redes de laboratorio en la vigilancia de las
EPV
* Apoyar la vigilancia de las enfermedades prevenibles por vacuna, fortalecimiento de la
capacidad de respuesta de los laboratorios de salud.
* Lograr la calidad en los procesos de toma de muestra, procesamiento y análisis de
resultados para los diferentes eventos sujetos a vigilancia.
* Identificar puntos estratégicos de apoyo laboratorial a toda la red de salud, en los
diferentes niveles (nacional, departamental y local)
* Garantizar la provisión de insumos de laboratorio, para los procesos de toma de muestra
y análisis.
* Integrarse a las redes de vigilancia de la región nacional e internacional.
5.9
Comité Nacional de Inmunización
El Comité Nacional de Inmunización (CNI), tiene un rol fundamental en la vigilancia, sus
funciones establecidas son:
* Recomendar la incorporación de nuevas vacunas al esquema nacional en base a evidencia.
* Sugerir y apoyar investigaciones para la gerencia del PAI
* Apoyar el estudio y clasificación de casos probables de EPV y ESAVI.
* Actuar de portavoz oficial especialmente en momentos de crisis por ESAVI u otros eventos
que requieran respaldo técnico.
Manual Técnico del Programa Ampliado de Inmunización
* Garantizar la calidad de los procesos laboratoriales, en la complementariedad de los datos
de la notificación obligatoria.
183
5.10
PLAN DE SOSTENIBILIDAD DE LA ERRADICACION DE LA POLIO Y ELIMINACIÓN DEL SARAMPIÓN
En todos los niveles del sistema de salud Nacional, Departamental y Municipal, se debe
programar y asignar recursos para las actividades de Vigilancia y Control Epidemiológico de
las EPV en el Plan Operativo Anual (POA), con el objetivo de prevenir la ocurrencia de brotes, el
control oportuno de los mismos, con el fin de evitar la propagación de brotes en la población
susceptible.
Los componentes que deben ser financiados son:
* Planes de mitigación, prevención y control de brotes de la enfermedad
* Evaluación de riesgo de la enfermedad: vigilancia de enfermedad, de coberturas y de
factores de riesgo.
* Gestión de la información: investigación del brote, salas situacionales, boletines.
* Actividades de actualización y capacitación.
* Formación de Equipos de Respuesta Rápida a nivel nacional, departamental, de
coordinación de redes, de municipio y establecimiento de salud.
* Intervenciones colectivas: vacunación en municipios con baja cobertura, vacunación de
control de brote.
* Intervenciones individuales: hospitalización, pruebas complementarias.
* Gestión de muestras de laboratorio.
5.11
ADECUACIÓN Y ACTUALIZACIÓN PERMANENTE
Un sistema de Vigilancia no es un sistema cerrado, por el contrario, tiene diferentes cambios
que obedecen a:
* Ingreso de nuevas vacunas al programa.
* Cambio de políticas y estrategias.
Serie: Documentos Técnico Normativos
* Cambios en definiciones operativas a nivel internacional y nacional.
* Introducción de nuevos actores.
Estos cambios, pueden involucrar la adecuación y actualización permanente de los materiales,
instrumentos de detección, notificación, análisis, etc. por lo que las revisiones de los Manuales
se realizan cada tres años por ley y cada vez que se requiera algún cambio sustancial.
El personal de salud y otros actores que se encuentren involucrados en el trabajo del Programa
Ampliado de Inmunización, tienen la obligación de conocer dichos cambios e implementarlos
inmediatamente, porque existe la necesidad de estandarización en conceptos y procesos, que
van desde el nivel internacional y nacional. Caso contrario la lucha contra las Enfermedades
Prevenibles por Vacunación encuentra interrupciones en la cadena efectiva de procesos.
5.12
184
VIGILANCIA DE ENFERMEDADES PREVENIBLES POR VACUNA
5.12.1
SARAMPIÓN Y RUBEOLA
Enfermedades infecciosas virales, eruptiva, febril que se transmite de persona a persona; se
caracteriza por una erupción máculopapular en la piel que suele comenzar en la cabeza y
descender al resto del cuerpo.
a.
DEFINICIONES DE CASO
Para efectos de la vigilancia epidemiológica de sarampión y rubéola, se consideran las
siguientes definiciones operacionales:
Caso sospechoso
Persona de cualquier edad que presente fiebre y exantema máculopapular (no vesicular).
Todo caso en el que se sospeche de sarampión o rubéola.
Caso confirmado por laboratorio
Todo caso sospechoso en quien una o más de las siguientes pruebas sea positiva.
* IgM específica positiva;
* Seroconversión: aumento significativo en los títulos de IgG en sueros pareados (agudo y
convaleciente);
* Aislamiento viral o detección del RNA por RT-PCR;
* Detección de una secuencia del virus salvaje
Las pruebas de IgM continúan siendo las pruebas requeridas en la vigilancia para confirmar
una infección aguda. El cumplimiento de una de las pruebas confirma infección reciente.
Caso confirmado por nexo epidemiológico
Caso confirmado por clínica
Caso sospechoso que clínicamente cumple con la definición de caso, pero no cuenta con
muestras adecuadas de laboratorio ni con la investigación epidemiológica completa. Se
considera un fallo del sistema de vigilancia.
Caso descartado
Caso sospechoso con investigación epidemiológica completa, con resultados de laboratorio
negativos y sin nexo epidemiológico.
Caso importado
Caso confirmado que según la investigación epidemiológica estuvo expuesto al virus fuera de
Bolivia, durante los 7 a 21 días anteriores al inicio del exantema.
Manual Técnico del Programa Ampliado de Inmunización
Caso sospechoso en el que se demuestra asociación epidemiológica con uno o más casos
confirmados por laboratorio.
Caso relacionado con importación
185
Es el caso confirmado, en el que su Infección fue adquirida localmente y que forma parte
de una cadena de transmisión originada por un caso importado, el cual está sustentado
con evidencias epidemiológicas y/o virológicas que tienen menos de 12 meses de haberse
instaurado en el país.
Caso endémico
Es el caso confirmado que no salió del país, según las pruebas epidemiológicas y virológicas
forma parte de una cadena de transmisión endémica en el país, que ha estado circulando en
el país por un periodo de 12 meses o más.
Caso de fuente desconocida
Caso confirmado en el cual no se pudo detectar la fuente de infección; para fines prácticos es
parte de una cadena de transmisión de un caso importado.
Caso post vacunal
Persona que ha recibido una dosis de la vacuna en las últimas 6 semanas antes de la erupción,
y ésta tiene una duración no mayor a tres días, sin otra sintomatología y no existe ningún otro
caso en la zona.
B.
INDICADORES BASICOS DE CUMPLIMIENTO PARA LA EVALUACION DE LA VIGILANCIA DE SARAMPION/RUBEOLA
* Porcentaje de sitios que notifican semanalmente:
Por lo menos el 90% de los servicios de salud designados como Unidades de Notificadoras
deben presentar informes cada semana sobre la presencia o ausencia de casos
* Tasa anual de notificación de 2 casos sospechosos de sarampión/rubéola por 100.000
habitantes:
Este indicador permite ver se está vigilando y notificando casos ya que cada departamento
debe captar y notificar 2 casos por 100.000 habitantes.
* Porcentaje de casos sospechosos investigados dentro 48 horas.
Serie: Documentos Técnico Normativos
Este indicador mide la capacidad de respuesta oportuna del sistema y facilita la toma de
decisiones oportuna para impedir la propagación de la enfermedad.
* Porcentaje de casos sospechosos de sarampión con una muestra de sangre adecuada.
Se debe obtener una muestra de sangre durante los 30 días posteriores al inicio del
exantema el indicador debe cumplirse en un 90%.
* Porcentaje de muestras que llegan al laboratorio menor a los 5 días después de haber
colectado la muestra:
* Porcentaje de casos sospechosos con resultados de laboratorio reportados hasta 4 días
después de la recepción de la muestra:
* Los resultados de las muestras analizadas deben ser notificados al PAI dentro de los 4
días siguientes a la llegada de la muestra al laboratorio.
5.12.2
186
SÍNDROME DE RUBEOLA CONGÉNITA
Es la complicación más grave de la rubéola y aparece como consecuencia de la infección
del feto por el virus de la rubéola durante el primer trimestre del embarazo, se caracteriza
por manifestaciones transitorias, estructurales permanentes o de aparición tardía.
Caso sospechoso de SRC
Se considera como caso sospechoso de SRC, a todo niño menor de un año de edad, de
quien el trabajador de salud sospecha que tiene SRC debido a que:
* Se ha detectado una o más de las siguientes anormalidades luego del nacimiento:
cataratas congénitas, defectos cardiacos congénitos, púrpura o hipoacusia.
* Hay una historia de infección por rubéola (confirmada o sospechosa), de la madre
durante el embarazo.
Caso de SRC confirmado mediante pruebas de laboratorio
Es un caso sospechoso de SRC que ha sido confirmado por laboratorio (es decir, positivo
al anticuerpo de IgM contra la rubéola).
Caso de SRC confirmado clínicamente
Es un caso sospechoso de SRC, sin confirmación de laboratorio (por lo general, a falta
de una muestra apropiada) y clínicamente corresponde a la enfermedad, estos casos se
considera una falla del sistema de vigilancia.
Infección por rubéola congénita únicamente
Esta clasificación se usa para todo neonato nace de una mujer infectada durante el
embarazo. Estos lactantes son positivos al anticuerpo de IgM contra la Rubéola; sin embargo,
no hay hallazgos clínicos compatibles con el SRC. Estos casos deberán ser descartados y
clasificados con infección por rubéola congénita (IRC). Es probable que los lactantes con
SRC e IRC eliminen el virus de la rubéola y sean muy infecciosos.
Casos descartados de SRC
Se puede descartar un caso sospechoso de SRC, si hay una muestra adecuada de suero del
lactante que es negativa a los anticuerpos de IgM contra rubéola.
5.12.3
POLIOMIELITIS
La poliomielitis es una enfermedad infecto contagiosa, vírica aguda, cuya gravedad varía
desde una infección asintomática hasta enfermedad febril inespecífica, meningitis aséptica,
enfermedad paralítica y muerte.
a.
Definiciones de caso
Caso Sospechoso
Manual Técnico del Programa Ampliado de Inmunización
Por consiguiente, se deben instituir medidas de control de la infección apropiadas para
todos los casos sospechosos de SRC e IRC.
187
Cualquier persona menor de 15 años de edad que presente parálisis flácida aguda por
cualquier razón, exceptuando los traumatismos graves, o toda persona de cualquier edad
en que se sospeche poliomielitis.
Caso confirmado
Es aquel caso probable en el cual se aísla el poliovirus salvaje o el poliovirus derivado de la
vacuna, con parálisis residual o sin ella.
Caso compatible
Es aquel caso probable que, en la visita de seguimiento a los 60 días de iniciada la parálisis,
presenta parálisis residual compatible con polio, o cuando al caso probable no tiene
seguimiento o falleció en dicho período y no se cuenta con una muestra de heces adecuada.
Debido a esto, no se puede demostrar la ausencia o presencia del virus y debe ser clasificado
como caso compatible, lo cual evidencia fallas en el sistema de vigilancia.
Caso confirmado asociado a la vacuna
Enfermedad paralítica aguda en la que se cree que el virus vacunal es la causa de la
enfermedad. Antes de clasificar un caso como asociado a la vacuna, hay que tener en
cuenta que se debe cumplir al menos, con los siguientes requisitos:
* Ser un caso clínico típico de poliomielitis (incluidas las secuelas)
* Haber recibido OPV entre 4 y 40 días antes del inicio de la enfermedad
* Haber estado en contacto con un niño vacunado con OPV en los 75 días previos
* Aislar el virus vacunal de su muestra de heces
* Haber desarrollado la enfermedad con la primera dosis de OPV que tiene mayor
probabilidad de ocasionar la parálisis.
Este es un evento adverso raro, y el riesgo es mayor con la primera dosis de la vacuna (1
por 1.400.000 a 3.400.000 de primeras dosis).
Serie: Documentos Técnico Normativos
Caso confirmado por poliovirus derivado de la vacuna (PVDV)
188
Es aquel caso probable en el que se aísla un poliovirus derivado de la vacuna (PVDV),
es un virus que ha mutado en más de 1% respecto de la cepa original Sabin (VDPV) y
que ha revertido a la neurovirulencia. Con una parálisis residual o sin ella. Son casos
extremadamente raros que ocurren cuando hay bajas coberturas en forma sostenida o
cuando las personas inmunodeprimidas excretan el virus.
Caso descartado
Caso probable en el que se tomó una muestra adecuada y no se aisló poliovirus salvaje o
poliovirus derivado de la vacuna. Con investigación completa, sin nexo epidemiológico a
otro caso confirmado por laboratorio y no tiene secuelas de parálisis después de los 60
días de inicio de la parálisis.
B.
INDICADORES BASICOS DE CUMPLIMIENTO PARA LA EVALUACION DE LA VIGILANCIA DE PFA
* Porcentaje de cumplimiento de la notificación semanal negativa:
Todas las semanas debe haber notificación semanal exista o no casos, quiere decir que
el sistema está pensando en la posibilidad de reintroducción del virus de polio, aunque
no haya casos confirmados en el país, las unidades notificadoras serán definidas para
que se realice la actividad de notificación como parte de los requisitos internacionales
de erradicación, el porcentaje mínimo aceptable es de 90% siendo lo ideal el 100%.
* Tasa de parálisis flácida aguda:
Se ha establecido como norma en la región de las Américas la tasa de 1 caso por 100.000
habitantes menores de 15 años como mínimo aceptable. Cuando la población es muy
pequeña se debe hacer las estimaciones de cada cuantos años debería notificarse un
caso de PFA reportado para tener una idea del intervalo de tiempo en el cual se podría
encontrar al menos un caso de parálisis flácida.
* Porcentaje de casos de investigados dentro de las 48 horas:
Este indicador permite evaluar la rapidez con que actúa el sistema en la investigación
de un caso sospechoso de polio, después de realizada la notificación por el servicio de
salud, se acepta un 90% como cumplimiento mínimo adecuado.
* Toma de muestra adecuada de heces:
* Una muestra adecuada de heces es cuando se toma dentro de los 15 días de iniciada
la parálisis (8 gr si es pastosa y 5 ml si es líquida)
* Porcentaje de casos de parálisis flácida aguda con seguimiento dentro de los 60 días
de inicio de la parálisis.
* Diagnostico final de los casos descartados:
Este indicador es importante porque significa que la investigación es completa y que
se pudo llegar a un diagnóstico final concreto, la clasificación final de los casos la
realiza el PAI Nacional que debe revisar las fichas epidemiológicas, resultados de
investigación, resultados de laboratorio para descartar o confirmar los casos probables
de PFA, así mismo se debe realizar la retroalimentación de los resultados a los niveles
correspondientes para su conocimiento (Coordinación de Red, Municipio y servicio de
salud).
5.12.4
DIFTERIA
La difteria es una enfermedad infecto contagiosa, se manifiesta por la formación de
pseudomembranas en las amígdalas, faringe, laringe, mucosas (nasal y otras) y en la piel.
Manual Técnico del Programa Ampliado de Inmunización
La investigación de PFA concluye solamente cuando se hace una visita al caso dentro de
los 60 días del inicio de la Parálisis, con el fin de observar la evolución de la enfermedad
y comprobar si existen secuelas, por ejemplo, si se pierde el caso es clasificado como
compatible, de ahí la importancia el rastro de los casos, en caso de migración a otro
distrito y/o región se debe comunicar para que se continúe con el seguimiento.
189
Los pacientes presentan un cuadro febril generalmente no muy intenso, con evolución lenta,
pero con estado general comprometido.
Caso sospechoso
Toda persona que presente faringitis, laringitis o amigdalitis, además de una pseudomembrana
adherente y grisácea en las amígdalas, faringe o nariz.
Caso confirmado por laboratorio
Cuando los resultados de laboratorio son positivos.
Caso confirmado por nexo epidemiológico
Todo caso sospechoso que tenga nexo epidemiológico con un caso confirmado por laboratorio.
Caso clínicamente confirmado
Se considera a todo caso que no cuente con muestra para laboratorio y que presenta:
* Lesión, comprometiendo pilares y úvula.
* Pseudomembranas sospechosas en amígdalas, faringe y nariz que no se hayan
recolectado.
5.12.5
TOSFERINA
Es una enfermedad bacteriana, infecciosa, contagiosa, aguda de las vías respiratorias, se
caracteriza por una tos que se hace paroxística y puede durar varios meses. Es más grave en
los lactantes y en los niños de corta edad, quienes pueden padecer accesos de tos paroxística
que terminan en un estridor inspiratorio característico.
Caso sospechoso
Es una persona que presente tos de ≥2 semanas de duración, o tos de cualquier duración en
el caso de los menores de 1 año de edad o en situaciones de brote, sin otra causa aparente,
acompañada con al menos uno o más de los siguientes síntomas, basado en la observación
o el reporte de los padres:
Serie: Documentos Técnico Normativos
* Paroxismos.
190
* Estridor inspiratorio.
* Vómito posterior a la tos o vómito sin otra causa aparente.
* Apnea (solamente en el menor de 1 año).
* Médico sospecha tosferina.
Caso confirmado por laboratorio
Todo caso sospechoso con confirmación por laboratorio a través:
* Aislamiento de la B. pertussis (Cultivo).
* Detección de la secuencia genómicas de B. pertussis por medio de PCR.
* Elevación de IgG para la toxina pertussis en un individuo ≥ 11 años de edad, un año o más
después de la administración de última dosis de vacuna.
Caso confirmado por nexo epidemiológico
Caso sospechoso que ha tenido contacto estrecho con un caso confirmado por laboratorio (o
con un caso confirmado por nexo epidemiológico en situaciones de brote) en las 3 semanas
previas al inicio de la tos.
Caso confirmado clínicamente
Caso probable en el cual no se ha confirmado otro diagnóstico por laboratorio.
Caso probable
Caso sospechoso que no cumple con los criterios de confirmación (laboratorio o nexo), o
en el cual no se realizaron pruebas de laboratorio o estas resultaron negativas (muestra no
recolectada de manera oportuna según la etapa de la enfermedad, muestra mal transportada,
falso negativo).
Caso descartado
Caso sospechoso en el cual se documentó otro diagnóstico.
5.12.6
TÉTANOS NEONATAL
Enfermedad infecciosa aguda que se presenta en el recién nacido, en los primeros 28 días de
vida, con dificultad en la succión, llanto persistente e irritabilidad.
Caso sospechoso
Caso confirmado
Todo recién nacido que se alimentó y lloró normalmente en los primeros dos días de vida, pero
que presentó signos y síntomas de la enfermedad entre los 3 y 28 días de vida, además de
inhabilidad para succionar (trismos), seguido de rigidez muscular generalizada o convulsiones
(espasmo muscular).
Caso descartado
Pacientes en los que la investigación epidemiológica ha definido que no se trata de tétanos.
5.12.7
FIEBRE AMARILLA
Enfermedad infecciosa, viral aguda, febril, endémica y potencialmente epidémica, transmitida
por mosquitos vectores. El cuadro clínico va desde formas asintomáticas, febril moderada
hasta formas graves con alta letalidad.
Manual Técnico del Programa Ampliado de Inmunización
Recién nacido de 3 a 28 días que, después de haber succionado y llorado normalmente durante
los primeros días, presenta imposibilidad progresiva de alimentarse y llanto constante. También
son sospechosas las muertes de neonatos con diagnóstico indefinido y que presenten las
características señaladas.
191
Caso sospechoso
Individuo con cuadro febril agudo durante siete días, que resida o haya permanecido en algún
área de riesgo para la fiebre amarilla, en los últimos quince días y que no haya sido vacunado.
Un área de riesgo para fiebre amarilla se define como una zona donde haya habido ocurrencia
de casos humanos, epizootias (presencia de monos muertos) o aislamiento viral en mosquitos.
Caso confirmado
Todo caso sospechoso que haya sido confirmado por laboratorio o presente nexo
epidemiológico con un caso confirmado por laboratorio.
Caso descartado
Es un caso sospechoso con pruebas de laboratorio negativas.
5.12.8
MENINGITIS TUBERCULOSA, BCG
Es la forma más grave y letal de la tuberculosis, mediante la cual pequeños tubérculos son
sembrados en el cerebro y meninges.
Caso sospechoso
Cualquier caso que se sospeche de meningitis y haya tenido evolución de signos meníngeos
de dos a ocho semanas.
Caso confirmado
Se confirma mediante bacteriología positiva para Mycobacterium tuberculosis, en el líquido
cefalorraquídeo.
5.12.9
HEPATITIS B
Serie: Documentos Técnico Normativos
La hepatitis B, es una enfermedad de origen viral, de evolución aguda o crónica, afecta el hígado
produciendo inflamación y respuesta autoinmunitaria. Su gravedad varía considerablemente,
desde una infección asintomática, a enfermedad subaguda con ictericia o un cuadro de
Hepatitis fatal fulminante. La hepatitis B se conoce también con el nombre de Hepatitis por
suero, ictericia, por suero homólogo o hepatitis por antígeno Australia.
192
Caso sospechoso
Toda persona que presente ictericia o elevación de las transaminasas a más de 2,5 veces el
valor normal no atribuible a otras causas, y al menos uno de los siguientes síntomas: malestar
general, dolores musculares o articulares, astenia, hiporexia, náuseas, vómitos o fiebre
Caso confirmado
Todo caso sospechoso que tenga un diagnóstico de hepatitis por laboratorio (pruebas
de antígenos o anticuerpos específicos para los diferentes virus o carga viral), o por nexo
epidemiológico
5.12.10
PAROTIDITIS
La parotiditis, es una enfermedad infecciosa aguda que origina una inflamación no supurada
de las glándulas parótidas, pero que puede afectar también al mismo tiempo -aunque en
forma aislada- otras glándulas, principalmente las salivales, los testículos, las meninges y el
páncreas. Esta enfermedad ataca sobre todo a niñas, niños y jóvenes.
Caso sospechoso
Toda persona que presente inflamación uni o bilateral de las glándulas parótidas/salivales
por más de dos días, sin otra causa aparente.
Caso confirmado
La confirmación de esta enfermedad es clínica.
5.12.11
NEUMONÍAS BACTERIANAS EN NIÑOS MENORES DE 5 AÑOS
Caso sospechoso de neumonía
Todo paciente menor de 5 años hospitalizado con diagnóstico clínico de neumonía adquirida
en la comunidad. Se d e f i n e c o m o h o s p i t a l i z a d o , todo paciente con indicación médica
de ingreso hospitalario.
Caso probable de neumonía bacteriana
Todo caso sospechoso e n el que la radiografía de tórax, muestre u n patrón radiológico
compatible con neumonía b a c t e r i a n a .
Caso confirmado de neumonía bacteriana
Todo caso probable de neumonía bacteriana, en el cual se identificó H. influenzae, S.
pneumoniae u otra bacteria en la sangre o en el líquido pleural.
Caso descartado de neumonía bacteriana
Caso de neumonía inadecuadamente investigado
Todo caso sospechoso que no cuenta con radiografía de tórax. Excepcionalmente, un caso
sospechoso sin radiografía, pero con identificación de S. pneumoniae, H. influenzae, N.
meningitidis u otra bacteria, será clasificado como caso confirmado. Todo caso probable,
en el cual no se cuenta con resultado de hemocultivo.
5.12.12
MENINGITIS BACTERIANA EN NIÑOS MENORES DE 5 AÑOS La meningitis es una inflamación de las membranas que recubren el cerebro, cerebelo y
la médula ósea, sitios anatómicos circundados por el espacio subaracnoideo, por donde
circula el líquido cefalorraquídeo (LCR).
Para los efectos de la vigilancia epidemiológica, se considerarán las siguientes definiciones
de caso:
Manual Técnico del Programa Ampliado de Inmunización
Todo caso sospechoso en el que la radiografía de tórax no muestra un patrón radiológico
compatible con neumonía bacteriana.
Caso sospechoso de meningitis
Todo paciente menor de 5 años hospitalizado con diagnóstico clínico de meningitis.
193
Caso probable de meningitis bacteriana.
Todo caso s o s p e c h o s o en el cual e l examen d e l LCR, e s compatible con meningitis
bacteriana, es decir, que presenta al menos una de las características siguientes.
* Aspecto turbio
* Leucocitos aumentados (>100/mm3)
* Leucocitos entre 10-100/mm3
* Elevación de proteínas (>100 mg/dL) o
* Disminución de la glucosa (<40 mg/dL)
Caso confirmado de meningitis bacteriana
Todo caso sospechoso en e l que se identificó S. pneumoniae, H. influenzae y N. meningitis
u otra bacteria en LCR o en sangre.
Caso descartado de meningitis bacteriana
* Todo caso sospechoso cuyo examen de LCR no es compatible con etiología
bacteriana y en el que no se ha identificado ninguna bacteria en LCR ni en sangre.
* Todo caso probable en el cual se ha identificado u n agente etiológico no bacteriano.
Caso de meningitis inadecuadamente investigado
Todo caso sospechoso en el que no se obtuvo muestra de LCR, ni se identificó agente
bacteriano alguno en el hemocultivo.
5.12.13
DIARREAS POR ROTAVIRUS EN NIÑOS MENORES DE 5 AÑOS
Caso sospechoso
Todo niño menor de 5 años hospitalizado por diarrea aguda.
Se def ine como:
Serie: Documentos Técnico Normativos
* Niño menor de 5 años: todo niño de cero a cuatro años, 11 meses y 29 días de edad.
* Hospitalizado: el niño ingresado a la sala de rehidratación o sala de hospitalización y
que reciba rehidratación oral o parenteral en el ambiente hospitalario, aunque no sea
ingresado en la sala de hospitalización.
* Diarrea aguda: tres o más evacuaciones líquidas o semilíquidas en las últimas 24 horas,
con hasta 14 días de duración.
Si bien la consistencia de las heces es más importante que el número de evacuaciones,
hay que considerar que los niños con lactancia materna exclusiva suelen presentar heces
líquidas.
Deben ser considerados los siguientes criterios de exclusión:
* Tener 5 años de edad cumplidos o más.
* Presentar diarrea prolongada (más de 14 días de duración).
194
* Haber sido hospitalizado por otra razón, aunque presente diarrea.
* Haber tomado la muestra de heces después de 48 horas post ingreso hospitalario, por
el riesgo de tratarse de infección hospitalaria.
* Haber sido referido a los hospitales centinela desde otros centros, en los cuales hayan
permanecido hospitalizado, por más de 24 horas, por el cuadro de diarrea en curso.
Caso confirmado
Caso sospechoso que tiene una muestra de heces, cuyo resultado de laboratorio es
positivo para rotavirus. En brotes, se confirman aquellos en los que se establezca el nexo
epidemiológico con un caso confirmado por laboratorio.
Caso inadecuadamente investigado
Caso sospechoso en el cual no se logró obtener el resultado de la prueba por laboratorio, ni
establecer un nexo epidemiológico con un caso confirmado, en brotes.
Caso descartado
Caso sospechoso que tiene una muestra de heces oportuna, cuyo resultado de laboratorio
es negativo para rotavirus. Se define como oportuna la muestra de heces tomada hasta 48
horas post-ingreso hospitalario.
Manual Técnico del Programa Ampliado de Inmunización
195
196
Serie: Documentos Técnico Normativos
CAPÍTULO 6
SISTEMA DE
INFORMACIÓN DEL
PROGRAMA AMPLIADO
DE INMUNIZACIONES
Índice
6.1
Introducción
192
6.2
Sistema de información del PAI
192
6.2.1
Enfoque
193
6.2.2
Atributos de la información del PAI
193
6.3
Elementos del sistema de información del PAI
194
6.4
Estructura y flujo del sistema de información a nivel nacional
194
6.4.1
Flujo de la información
196
6.4.2
Ciclo de la información
197
6.5
Funciones por nivel de gestión de la información
201
6.6
Indicadores de monitoreo y evaluación de coberturas de vacunación
202
6.7
Reporte de la información de vacunación por niveles
207
6.8
Monitoreo al cumplimiento de meta mensual con todas las vacunas
dentro y fuera de servicio
208
6.8.1
Accesibilidad de la población a las vacunas
209
6.8.2
Tasa de deserción
211
6.8.3
Indicador de integralidad
211
6.9
Reporte del registro nominal de vacunación electrónica
213
6.9.1
Reporte diario
213
6.9.2
Reporte consolidado
213
6.9.3
Reporte de indicadores
213
6.9.4
Indicador de oportunidad
214
6.10
Establecer las normas del registro nominal de vacunación electrónica
215
6.10.1
Beneficios del RNVe
215
6.10.2
Ventajas del RNVe
215
6.10.3
Módulos del RNVe
216
6.11
El control de la calidad del dato
219
6.12
Modelo de retroalimentación del análisis de la información de la
vacunación
220
6.1 INTRODUCCIÓN
Los responsables de salud gerenciales y operativos, en todos los niveles del sistema de salud,
necesitan información relevante, confiable y oportuna para su uso adecuado en la toma de
decisiones. Asimismo, proporcionan datos para el monitoreo y la rendición de cuentas, tanto
para los niveles ejecutivos del sistema como para la población.
El PAI utiliza varios sistemas de información relacionados con la vacunación, vigilancia
epidemiológica de enfermedades prevenibles por vacuna, cadena de frío, logística y vigilancia
de eventos supuestamente atribuibles a la vacunación e inmunización, con diferentes grados
de desarrollo, articulación y uso.
En este capítulo se describe y norma lo referente a la información de vacunación para
proporcionar al personal de salud los procedimientos de registro, revisión, consolidación,
monitoreo y análisis de la información, con el uso de instrumentos estandarizados y validados
por el Programa.
6.2 SISTEMA DE INFORMACIÓN DEL PAI
Los logros alcanzados por el PAI a la fecha, se han sustentado en uno de los pilares más
importantes como es el de la información; su mérito ha consistido en demostrar con hechos
concretos, expresados en el dato inicialmente, y avanzar a la información para poder tomar
decisiones oportunas.
De esta manera, la gestión de la información, permite, conocer la población objetivo, que, a
través de la expresión cuantitativa, orienta las intervenciones certeras, buscando favorecer a
los más necesitados. Esta actitud no cambió a lo largo de los años y permitió avanzar en la
lucha contra las enfermedades prevenibles por vacunas.
Sin embargo, no solo se necesita que exista un sistema de información, sino que éste sea
oportuno y de calidad; debe ser capaz de generar una cultura de la información, promoviendo
el conocimiento de la captación, revisión, procesamiento y análisis del dato para el uso y toma
de decisiones.
Serie: Documentos Técnico Normativos
A partir de la gestión y de la necesidad del programa PAI, se creó el Sistema de Información
para:
200
* Seguimiento adecuado y oportuno del cumplimiento del esquema de vacunación de niños
y niñas.
* Identificación de niños y niñas con esquemas incompletos o no vacunados.
* Identificación de áreas geográficas para intervenciones oportunas.
* Reducción de bolsones de susceptibles.
* Acceso a la libreta de salud infantil.
* Disposición del Sistema de Registro Nominal de Vacunación Electrónica (RNVe).
6.2.1
ENFOQUE
El enfoque del sistema de información del PAI se basa en dos pilares fundamentales: los
procesos y la calidad.
Se define como proceso a la secuencia ordenada y lógica de actividades repetitivas, que
se realizan en el acto de vacunación e información, desde el nivel operativo hasta el nivel
gerencial, con el propósito de transformar las entradas al sistema en salidas o resultados
programados para la población y las autoridades con un valor agregado.
El sistema de información se aplica a la gestión por procesos que orienta un trabajo cooperativo
y crea una cultura de programa distinto, más abierto, menos jerárquico, más orientado a
obtener resultados.
Se define como calidad al atributo que debe tener toda información para que sea útil en la
identificación de problemas y necesidades en su respuesta oportuna y eficiente.
La gestión de calidad de la información es el conjunto de normas interrelacionadas que
pretende crear constancia en el control de calidad, con el propósito de mejora continua, y la
generación de evidencia robusta para los tomadores de decisión.
Bajo este enfoque se necesita tres tipos de acciones: i) control de calidad, ii) mejora de nivel o
cambio significativo y iii) planeación de la mejora que conducirán a la calidad de la información.
La gestión de la información por procesos y con calidad contribuirá a lograr la satisfacción del
usuario (autoridad y población), alinear los procesos con la misión, visión, objetivo, actividades
y estrategias para el logro de las metas del PAI.
6.2.2
ATRIBUTOS DE LA INFORMACIÓN DEL PAI
* Accesibilidad: para la disposición del usuario independientemente del nivel al que
pertenezca.
* Oportunidad: para que los datos estén disponibles a tiempo en los distintos niveles.
* Pertinencia: que da la correlación entre los datos y las expectativas o demandas de los
usuarios.
* Continuidad: para la garantía en la gestión de la información, y esta sea sin interrupciones
y de forma permanente.
* Integridad: de la información para que esta sea completa, y refleje la totalidad de las
acciones de vacunación, de vigilancia y de la cadena de suministros generada en los
diferentes niveles y subsistemas de salud.
* Fiabilidad: se refiere al potencial del dato para resultar confiable, con base a su precisión,
consistencia, integridad y suficiencia.
Manual Técnico del Programa Ampliado de Inmunización
* Confiabilidad: del buen funcionamiento y brinda el respaldo de los registros.
201
6.3
ELEMENTOS DEL SISTEMA DE INFORMACIÓN DEL PAI
El Sistema de información del PAI es un conjunto de elementos que interactúan entre sí con el
fin de apoyar y sustentar las actividades del programa. Estos elementos son:
* Los recursos humanos: son quienes capturan, procesan, y analizan los datos producidos
por las actividades de vacunación, vigilancia y de la cadena de suministros
* La población objetivo: que se constituye en el denominador poblacional con base al cual
se calcularán los indicadores. En Bolivia estos datos están determinados por los censos
y las proyecciones de población que son estimadas por año y son proporcionados por
el Instituto Nacional de Estadística (INE) a través del SNIS-VE.
* Los criterios de vacunación: son las normas técnicas y operativas para la aplicación de
las vacunas y su correspondiente registro.
* Lineamientos del sistema: se refiere a los procedimientos que se han determinado para el
registro de datos, su procesamiento y el flujo de éstos, incluyendo las fechas establecidas
para la transferencia de datos de un nivel a otro.
* Gestión de datos: se encarga de la recopilación, almacenamiento, control de calidad,
procesamiento y flujo, compilación y análisis.
* Productos de información: son los datos analizados y presentados como información
procesada.
* Instrumentos de registro y consolidación: representado por los formularios, herramientas
manuales y digitales que permitirán la captura y procesamiento de datos.
* Software o sistema informático: constituye el programa computacional que permite
el ingreso de datos, actualmente son consolidados de dosis aplicadas mensualmente,
gestiona la base de datos, y facilita el análisis de la información.
* Base de datos: conjunto de datos electrónicos almacenados de manera organizada.
Serie: Documentos Técnico Normativos
* Indicadores: medición que refleja una situación determinada para una población
específica.
202
* Política de difusión y uso: datos a disposición de quienes toman las decisiones y facilitan
el uso de esa información.
6.4
ESTRUCTURA Y FLUJO DEL SISTEMA DE INFORMACIÓN A NIVEL NACIONAL
El Sistema de Salud del país tiene tres niveles de gestión de información: nacional,
departamental y coordinaciones de red, incluyendo los establecimientos de salud de todos
los subsectores: público, seguridad social a corto plazo y privado.
Figura 14: Niveles de gestión de la información en Bolivia
Fuente: SNIS/VE - MSyD.
El Ministerio de Salud y Deportes cumple con la función rectora, normativa, de dirección,
coordinación, evaluación, fijación y ejecución de esas políticas en el sector salud.
Fuente: SNIS/VE - MSyD.
La vacunación es universal y se debe vacunar indistintamente en cualquier establecimiento
de salud, por ello, la información debe ser recolectada en todos los subsectores: público,
privado, seguros a corto plazo y ONGs para el cálculo de coberturas (de no ser así no se
cumple con el atributo de integridad).
Manual Técnico del Programa Ampliado de Inmunización
Figura 15: Niveles de atención
en salud en Bolivia
El Sistema de Salud en el país tiene tres niveles de atención, tal como se muestra en la figura
N° 15.
203
6.4.1
Flujo de la Información
Figura 16: Flujo de información de salud
Los establecimientos de salud registran los datos de los procesos de vacunación,
sistematizados en los instrumentos del PAI, y en las herramientas informáticas Software de
Atención Primaria en Salud (SOAPS) y el Registro Nominal de Vacunación Electrónica (RNVe)
administrados por el SNIS-VE. Siguen una ruta que pasa por diferentes niveles de gestión
hasta su consolidación nacional final en el Ministerio.
Fuente: SNIS/VE - MSyD.
Serie: Documentos Técnico Normativos
Cada uno de esos niveles de gestión constituye un filtro de control de calidad del dato.
204
•
Si no se utiliza el SOAPS, la información manual de la vacunación va del establecimiento
de salud a la coordinación de red, donde es consolidada electrónicamente para seguir con
el flujo hasta SEDES y, posteriormente, al nivel nacional. En este proceso se debe vigilar
y asegurar que toda la información de los establecimientos ingrese a la consolidación
mensual de la información.
•
Si ya se utiliza el SOAPS, se debe verificar que no exista fuga de información por razones
de actualización del sistema, del equipo u otros; el nivel departamental (SNIS/PAI) es
responsable de la integridad de la información.
•
La información de vacunación debe ser consolidada y enviada, con calidad, completa,
confiable y oportuna. Las decisiones correctivas se hacen a partir de información oportuna
y de calidad.
Figura 17: Sistema de SOAPS
Fuente: PAI MSyD.
6.4.2
Ciclo de la Información
Manual Técnico del Programa Ampliado de Inmunización
Figura 18: Ciclo de información de salud
Serie de momentos dispuestos en forma secuencial y enlazadas entre sí, que van desde el
registro de los datos de las actividades de vacunación y vigilancia, hasta el uso final de la
información por parte del Sistema de Salud.
Fuente: PAI MSyD.
205
A.
Fase de Captación
La captación es la primera fase del proceso de información; en esta instancia las actividades
de vacunación cumplidas por el personal de salud son registradas en los instrumentos
correspondientes.
Los instrumentos de captación del PAI son:
* Carnet de salud infantil
* Libreta de salud y desarrollo infantil integral
* Carnet de vacunación
* Historia clínica
* Historia perinatal
* Carpetas familiares
* Fichas epidemiológicas.
Registro manual del acto de vacunación
Todas las vacunas aplicadas en el día deben ser registradas en el cuaderno de vacunación
dentro o fuera del servicio, según corresponda. Además de registrar, también, en el carné de
salud infantil o libreta de salud y desarrollo infantil integral y carné de vacunación.
* Se debe registrar con letra legible el nombre y apellidos del vacunado.
* Fecha de nacimiento, con base al cual se calcula la edad y las vacunas que requiere de
acuerdo con el esquema nacional.
* Género.
* Previo a la vacunación, revisar el estado vacunal en el carnet de salud infantil, o en la
libreta de salud y desarrollo infantil integral, carnet de vacunación, carpeta familiar y
determinar cuál o cuáles le corresponde recibir.
Serie: Documentos Técnico Normativos
* De acuerdo con la edad administrar las vacunas que le corresponden y registrar con
bolígrafo las dosis aplicadas.
206
* Anotar con lápiz fecha de aplicación de próximas dosis, vacunas y realizar el mismo
procedimiento.
LIBRETA DE SALUD Y DESARROLLO
INTEGRAL INFANTIL
FOTOGRAFÍA
Nombres y apellidos de la niña o niño:
Sexo:
Masculino:
Femenino:
Número único de identificación C.I.:
Lugar de nacimiento:
Fecha de nacimiento:
Año:
Mes:
Día:
Grupo sanguíneo (A- B- O)
Autoidentificación:
B.
Hora:
Rh
Fase de Sistematización
En esta fase, los datos captados son organizados en los instrumentos de sistematización,
con el propósito de facilitar su procesamiento y análisis.
El instrumento de sistematización del PAI es el cuaderno de vacunación dentro y fuera del
establecimiento. Diariamente se debe revisar el registro de vacunados, verificar la consistencia
de los datos, edad, cantidad de dosis y totalizar las vacunas administradas en el día.
Fase de Consolidación
Los formularios de consolidación oficiales implementados por el SNIS-VE y codificados como
registros administrativos por el INE con variables del PAI son los siguientes:
* Formulario 301a: Informe Mensual de Producción de Servicios, I Nivel.
* Formulario 301b: Informe Mensual de Producción de Servicios, II y III nivel.
* Formulario 302a: Notificación para la Vigilancia Epidemiológica, I Nivel.
Son formularios que consolidan los datos estadísticos de cada establecimiento de salud.
En el formulario 301a se registran todas las variables relativas a vacunación, tienen las dosis
aplicadas dentro y fuera de servicio, por tipo de vacuna, por dosis y desglosadas por edades
simples; por grupos vulnerables y población en general; de acuerdo al esquema de vacunación
vigente en el país.
Manual Técnico del Programa Ampliado de Inmunización
C.
207
En el formulario 301b se registran las variables de vacunación de BCG a RN y dT a embarazadas,
información que debe ser consolidada para el análisis de coberturas.
Serie: Documentos Técnico Normativos
En el Formulario 302a se registran todas las variables relativas a enfermedades
inmunoprevenibles desglosadas por grupos de edad.
208
D.
Fase de Procesamiento
Es la transformación de los datos del PAI a información. Los datos de vacunados, por tipo de
vacuna, edad y dosis que se transforman en indicadores de proceso, acceso, oportunidad,
cobertura, deserción o seguimiento, integralidad y esquema completo.
Se tiene dos tipos de procesamiento:
* Manual
* Automatizado.
E.
Fase de Análisis
Es comprender e interpretar la situación de vacunación, comparando las coberturas
alcanzadas, las vacunas administradas y las metas mensuales. Fase en la que los equipos de
decisión del PAI, en los diferentes niveles, analizan la información para conocer la realidad, en
materia de vacunación, de un establecimiento, una coordinación de Red, un SEDES, o del país.
F.
Fase de uso y retroalimentación
Una vez analizada la información y determinados los factores que viabilizan u obstaculizan
mejores niveles de vacunación, se debe elaborar planes de mejora con actividades clave,
tiempo de ejecución y responsables de la implementación para su posterior seguimiento y
evaluación.
La retroalimentación del proceso de vacunación se realiza por niveles y consiste en determinar
si el progreso está acorde a lo programado; se felicita a los niveles que cumplen con la meta
mensual y a los que no cumplen se dan lineamientos técnicos para recuperar oportunamente
a los no vacunados. Su formato facilita la lectura de los datos procesados. La herramienta
empleada es la gráfica de monitoreo mensual de coberturas de vacunación por tipo de vacuna.
La retroalimentación se da por dos modalidades: i) directa en reuniones de análisis de la
información institucional, y en reuniones con la comunidad (CAI), y, ii) de manera indirecta a
través de informes técnicos de retroalimentación.
6.5
FUNCIONES POR NIVEL DE GESTIÓN DE LA INFORMACIÓN
Municipio
Consolidación
Procesamiento
Análisis
Retroalimentación
Establecimiento de salud
Sistematización
Nivel de gestión
Captación /
registro
Tabla N°12: Ciclo de la información por nivel de gestión
X
X
X
X
X
X
X
X
X
X
Manual Técnico del Programa Ampliado de Inmunización
De manera esquemática las funciones que desempeñan los diferentes niveles de atención, en
las fases del ciclo de la información del PAI, se pueden resumir de la siguiente manera:
209
Coordinación de red
X
X
X
X
SEDES
X
X
X
X
Nacional
X
X
X
X
Fuente: SNIS-VE / MSyD.
6.6
INDICADORES DE MONITOREO Y EVALUACIÓN DE COBERTURAS DE VACUNACIÓN Para el monitoreo y evaluación del desempeño del PAI se utilizan los siguientes indicadores
de resultado:
* Acceso
* Coberturas
* Tasas de deserción/Seguimiento
* Integralidad
* Oportunidad
* Esquema completo.
Tabla N°13: FActibilidad de Indicadores de monitoreo y evaluación de coberturas
Vacuna
Acceso
Cobertura
Tasa
Oportunidad Deserción/
seguimiento
Integralidad/
simultaneidad
Esquema
completo
Serie: Documentos Técnico Normativos
Menor de 1 año
210
BCG
Dosis única Dosis única
Antipolio
1ra. dosis
3era dosis
Pentavalente
1ra. dosis
3era dosis
Antineumocócica
1ra. dosis
3era dosis
Antirotavírica
1ra. dosis
2da dosis
Anti influenza
1ra. dosis
2da dosis
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
De 1 año (12 a 23 meses)
SRP
1ra. dosis
2da dosis
Antiamarílica
Dosis única
Anti influenza
Dosis única
Antipolio
4ta dosis
Pentavalente
4ta dosis
De 4 años
Antipolio
5ta dosis
Pentavalente
5ta dosis
De 10 años
1ra dosis
2da dosis
X
X
X
X
dT
5ta dosis
Refuerzo
X
X
Anticovid - 19
1ra dosis
2da dosis
X
X
X
X
VPH
7 a 49 años
Antiinfluenza
grupos
vulnerables
Dosis única
X
Fuente: PAI / MSyD.
En la Región de Las Américas se han seleccionado indicadores denominados trazadores por
grupo de edad y responden a compromisos internacionales que permiten comparaciones y
metas comunes de erradicación o eliminación.
* En menores de 1 año de edad: se toman la 3ra dosis de pentavalente y la vacuna
antipoliomielítica.
* En niñas y niños de 1 año de edad la vacuna SRP-2.
* En niñas de 10 años la vacuna VPH-2.
Esto no significa que no se deben construir indicadores con todas las vacunas del esquema
nacional. A continuación, un resumen de indicadores de acceso, de cobertura, tasas de
deserción, de integralidad, de esquema completo y de oportunidad.
Tabla Nº14: Construcción de indicadores
Indicador
Acceso
Interpretación
Construcción
Mide la proporción de
En niñas y niños menores de 1 año:
niños que han sido
Nº de 1ras dosis de pentavalente en < de 1 año x 100
captados con 1ras
la población total del
Nº de 1ras dosis de IPV en < de 1 año x 100
Población total < de 1 año
grupo objetivo. Se
De la misma forma se construye para las demás vacunas:
espera un resultado
Nº de dosis única de BCG en < de 1 año x 100
mayor a 95%.
Población total < de 1 año
Nº de 1ras dosis de antirotavírica en < de 1 año x 100
Población total < de 1 año
Nº de 1ras dosis de antineumocócica en < de 1 año x 100
Población total < de 1 año
Nº de 1ras dosis de antiinfluenza en < de 1 año x 100
Población total de 6 a 11m
En niñas y niños de un año de edad:
Nº de 1ras dosis de SRP en niñas y niños de 12 a 23m x 100
Población total de 12 a 23m
En niñas y niños de 10 años de edad:
Nº de 1eras dosis de VPH en niñas de 10 años x 100
Manual Técnico del Programa Ampliado de Inmunización
dosis en relación con
Población total < de 1 año
Población total de niñas de 10 años
211
Mide la proporción
Población objetivo COVID-19:
de personas que
Nº de 1eras dosis de vacuna AntiCovid-19 x 100
han sido captadas
Población total objetivo
con 1ras dosis de
vacuna anticovid-19
en relación con la
población total del
grupo objetivo.
Cobertura
Mide la proporción de
En niñas y niños menores de un año de edad:
niños que han recibido
Nº de dosis única de BCG < de 1 año x 100
dosis completas de
acuerdo al esquema
de vacunación por
edad y tipo de vacuna.
Solo con dosis
completas se asegura
protección.
Se espera un
resultado mayor a
95% para obtener
coberturas óptimas.
Población total < de 1 año
Nº de 3ras dosis de pentavalente en < de 1 año x 100
Población total < de 1 año
Nº de 3ras dosis de antipolio en < de 1 año x 100
Población total < de 1 año
Nº de 3ras dosis de antineumocócica en < de 1 año x 100
Población total < de 1 año
Nº de 2das dosis de antirotavirus en < de 1 año x 100
Población total < de 1 año
Nº de 2das dosis de anti influenza < de 1 año x 100
Población total de 6 a 11m
En niñas y niños de un año de edad:
Nº de 2das dosis de SRP en niñas y niños de 12 a 23m x 100
Población total de 12 a 23m
Nº de dosis única de antiamarílica en niñas y niños de 12 a 23m x 100
Población total de 12 a 23m
Nº de dosis única de anti influenza en niñas y niños de 12 a 23m x 100
Población total de 12 a 23m
Nº de 4tas dosis de pentavalente en niñas y niños de 12 a 23m x 100
Población total de 12 a 23m
Nº de 4tas dosis de antipolio en niñas y niños de 12 a 23m x 100
Serie: Documentos Técnico Normativos
Población total de 12 a 23m
212
En niñas y niños de cuatro años de edad:
Nº de 5tas dosis de pentavalente en niñas y niños de 4 años x 100
Población total de 4 años
Nº de 5tas dosis de antipolio en niñas y niños de 4 años x 100
Población total de 4 años
En niñas de 10 años de edad:
Nº de 2das dosis de VPH en niñas de 10 años x 100
Población total de niñas de 10 años
Mide la proporción
de personas que
han recibido dosis
Población objetivo COVID-19:
Nº de 2das dosis de vacuna AntiCovid-19 + N° de Dosis únicas x 100
Población total objetivo
completas de
acuerdo al esquema
de vacunación
anticovid-19.
Tasa de
deserción
Mide la proporción de
Este indicador se aplica para todas las vacunas que tienen más de
la población objetivo
una dosis:
que habiendo iniciado
Nº de 1ras dosis pentavalente – 3ras dosis pentavalente en < de 1 año X 100
el esquema con 1ras
Nº de 1ras dosis de pentavalente
dosis no regresan
para completar todas
las dosis normadas
para la edad y de
acuerdo al esquema.
Se espera que el 95%
de los que iniciaron su
esquema lo completen.
Se mide esta capacidad
a través de la tasa
de deserción que no
debe ser mayor a 5%.
Mide la proporción de
la población objetivo
Nº de 1ras dosis – 2das dosis anticovid-19 X 100
Nº de 1ras dosis anticovid-19
que habiendo iniciado
el esquema con 1ras
completar todas las
dosis normales de la
vacuna AntiCovid-19.
Integralidad o Mide la capacidad
simultaneidad del personal de
salud de administrar
simultáneamente todas
las vacunas de acuerdo
En niñas y niños menores de 1 año:
3ra de OPV - 3ra de pentavalente X 100
3ra de OPV
3ra de OPV - 3ra de neumococo X 100
3ra de OPV
a edad y esquema
En niñas y niños de 1 año:
nacional, reduciendo
1ra de SRP – dosis única de Anti amarílica X 100
el número de visitas
que debe hacer la
familia al vacunatorio.
Además, se evita la
interferencia en la
3ra de OPV
Se sigue la misma metodología con otras vacunas.
Manual Técnico del Programa Ampliado de Inmunización
dosis no regresan para
213
respuesta inmunitaria
a vacunas con virus
vivo o atenuado cuando
no se administran
simultáneamente
(SRP y FA).
Este indicador
mide la capacidad
de promocionar la
vacunación completa,
calidad de la técnica
de vacunación, detecta
oportunidades perdidas
de vacunación por
diferentes motivos:
desconocimiento
del esquema,
desabastecimiento
o falsas
contraindicaciones.
No debe haber una
diferencia mayor a
5% entre las dosis
de las vacunas que
Esquema
completo
corresponden.
Mide la proporción de
Niñas y niños menores de 1 año:
niños que han recibido
Nº de niños < 1 año con BCG, 2da antirotavírica,
todas las vacunas del
3ra penta, 3ra OPV, 3ra antineumo, 2da anti influenza x 100
esquema nacional de
acuerdo a su edad.
Población total menor de 1 año
Niñas y niños 12 a 23 meses:
Nº de niños de 12 a 23 m con antiamarílica,
Serie: Documentos Técnico Normativos
2da dosis de SRP, anti influenza, 4ta OPV, 4ta penta X 100
Población total de niñas y niños de 12 a 23m
Mide la proporción
de personas con
Población objetivo
esquema completo de
Oportunidad
vacuna AntiCov-19.
Mide la proporción de
Niñas y niños menores de 1 año:
la población objetivo
Nº de niñas y niños con BCG antes de los 28d de nacido X 100
que recibe sus
Población total < de 1 año
vacunas en el tiempo
Nº de niñas y niños con
normado, asegurando
3ra dosis de pentavalente hasta 6 meses X 100
así la efectividad
214
Nº de personas con esquema completo de vacuna anticovid-19 X 100
Población total < de 1 año
de la vacuna.
Niñas y niños 12 a 23 meses:
Nº de niñas y niños de 18 meses con 2das dosis de SRP X 100
Población total de 12 a 23 meses
Niñas de 10 años:
Nº de niñas de 10 años con 2das dosis de VPH X 100
Total de niñas de 10 años
6.7
REPORTE DE LA INFORMACIÓN DE VACUNACIÓN POR NIVELES
El sistema de información de vacunación del PAI, sea manual o electrónico, debe generar
reportes para apoyar el proceso de monitoreo y de evaluación de los indicadores y de los
compromisos de gestión del PAI para la toma de decisiones oportuna y eficaz.
Frecuencia: debe ser mensual en todos los niveles de gestión del sistema.
Responsables: son los generadores de información, autoridades en los diferentes niveles de
los establecimientos de salud, coordinadores de red, responsables del PAI de los SEDES y del
nivel nacional.
A quiénes: a las autoridades del nivel inmediato superior, y a la estructura social de la población.
Modalidades: de rutina todos los meses por escrito, verbalmente en Consejos técnicos,
Comités de Análisis de la Información y en reuniones de análisis específicas del PAI.
Tipos de reportes básicos
Tabla N°15: Reportes Básicos
RNVe (individualizado y consolidados)
1. Cumplimiento de la meta
mensual con todas las vacunas
dentro y fuera de servicio.
2. Accesibilidad de la población
a las vacunas.
1. Reporte diario
2. Reporte consolidado
3. Reporte de listados
4. Reporte de indicadores:
3. Seguimiento al estado vacunalTasa de deserción.
4. Integralidad- simultaneidad
de las vacunas.
5. Esquemas completos de
vacunación acorde a la edad.
• Oportunidad
• Coberturas por cohorte
de nacimiento
Los mismos del sistema manual:
• Meta mensual
• Accesibilidad
• Seguimiento
• Integralidad
• Oportunidad
• Esquemas completos
Manual Técnico del Programa Ampliado de Inmunización
Manual (consolidados)
Fuente: MSyD.
215
6.8
MONITOREO AL CUMPLIMIENTO DE META MENSUAL CON TODAS LAS VACUNAS DENTRO Y FUERA DE SERVICIO
La cobertura anual esperada en el PAI es de 100%, por tanto, el progreso mensual debería
ser de 8.3%, Se debe realizar con todas las vacunas y con todas las dosis aplicadas dentro y
fuera de servicio; calcular la meta mensual de su ámbito de responsabilidad, luego sumar lo
que se vacuno dentro y fuera de servicio, permite diseñar estrategias para recuperar a los no
vacunados en el mes siguiente.
En relación la vacuna anticovid-19, el PAI emitirá instructivos específicos para el monitoreo de
coberturas con base a nuevas evidencias científicas.
Tabla N° 16: Sistematización
Vacuna
Pentavalente
1era dosis
2da dosis
Serie: Documentos Técnico Normativos
3era dosis
4ta dosis
5ta dosis
Variables
Ene
Feb
Mar Abr
May
Jun
Jul
Ago
Sep
Oct
Nov
Dic
Meta mensual
Vacunados
en el mes
Acumulado de
vacunados
Porcentaje de
cobertura
Meta mensual
Vacunados
en el mes
Acumulado de
vacunados
Porcentaje de
cobertura
Meta mensual
Vacunados
en el mes
Acumulado de
vacunados
Porcentaje de
cobertura
Meta mensual
Vacunados
en el mes
Acumulado de
vacunados
Porcentaje de
cobertura
Meta mensual
Vacunados
en el mes
Acumulado de
vacunados
Porcentaje de
cobertura
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
(8,3%)
Fuente: PAI / MSyD.
216
Figura 19: Monitoreo de cobertura de vacunación
en niños y niñas menores de 1 año
Registrar los datos y graficar, si el acumulado está en la franja roja quiere decir que no se está
cumpliendo con la meta mensual, y hay que ejecutar un plan de acción.
100%
81,2%
75,0%
63,1%
68,7%
56,2%
49,5%
43,2%
36,7%
29,0%
21,6%
14,2%
90%
80%
70%
60%
50%
40%
30%
20%
7,3%
10%
0
0%
Fuente: PAI / MSyD.
Además, esta figura permite comparar con el año anterior y advertir precozmente algún
decremento no esperado, la causa y la acción correctiva oportuna.
6.8.1
Accesibilidad de la población a las vacunas
Tabla N° 17: Sistematización de accesibilidad
Establecimiento de
salud/(municipio/
red)/SEDES (a)
Total establecimiento
de salud/(municipio/
red)/SEDES
Población
objetivo (b)
Vacunados
Vacunados
Total
con
con
vacunados
pentavalente pentavalente
con
1era dosis
1era dosis
pentavalente
dentro de
fuera de
1era dosis
servicio (c)
servicio (d)
(c + d)
%
porcentaje
(c + d x 100)
(b)
Manual Técnico del Programa Ampliado de Inmunización
Mensualmente se debe lograr vacunar al 8.3% de la meta anual. Si con primeras dosis no
logramos cumplir la meta mensual, más difícil será cumplir con terceras dosis.
Fuente: PAI / MSyD.
217
También se gráfica y se compara con anterior año.
Monitoreo de vacunación en menores de 1 año
100%
90%
Población
menor
80%
70%
1.000
60%
año 2019
50%
40%
1.180
30%
año 2020
20%
10%
MESES
2019
1RA.
DOSIS
2DA.
DOSIS
3RA.
DOSIS
1RA.
DOSIS
2020
Figura 20: Monitoreo de cobertura de vacunación - ejemplo
VACUNA PENTAVALENTE
2DA.
DOSIS
3RA.
DOSIS
En el mes
Acumulado
% Acumulado
En el mes
Acumulado
% Acumulado
En el mes
Acumulado
% Acumulado
En el mes
Acumulado
% Acumulado
En el mes
Acumulado
% Acumulado
En el mes
Acumulado
% Acumulado
ENE
73
73
7,3
40
40
4,0
25
25
2,5
70
70
5,9
40
40
3,4
25
25
2,1
FEB MAR ABR MAY JUN JUL AGO AEP OCT NOV DIC
69
74
74
77
65
63
67
69
56
63
62
142 216 290 367 432 495 562 631 687 750 812
14,2 21,6 29,0 36,7 43,2 49,5 56,2 63,1 68,7 75,0 81,2
35
38
34
33
29
30
20
21
22
23
21
75
113 147 180 209 239 259 280 302 325 346
7,5 11,3 14,7 18,0 20,9 23,9 25,9 28,0 30,2 32,5 34,6
30
45
35
29
28
27
25
24
26
23
20
55
100 135 164 192 219 244 268 294 317 337
5,5 10,0 13,5 16,4 19,2 21,9 24,4 26,8 29,4 31,7 33,7
72
74
74
73
69
63
67
69
56
63
62
142 216 290 363 432 495 562 631 687 750 812
12,0 18,3 24,6 30,8 36,6 41,9 47,6 53,5 58,2 63,6 68,8
35
38
34
33
29
30
20
21
22
23
21
75
113 147 180 209 239 259 280 302 325 346
6,4
9,6 12,5 15,3 17,7 20,3 21,9 23,7 25,6 27,5 29,3
30
45
35
29
28
27
25
24
26
23
20
55
100 135 164 192 219 244 268 294 317 337
4,7
8,5 11,4 13,9 16,3 18,6 20,7 22,7 24,9 26,9 28,6
Fuente: PAI / MSyD.
Figura 21: Mapa de monitoreo
de cobertura - ejemplo
Serie: Documentos Técnico Normativos
Y se puede utilizar mapas para reflejar la situación de acuerdo a la cobertura y las metas.
Fuente: PAI / MSyD.
218
6.8.2
Tasa de deserción
Con el análisis de este indicador se puede detectar problemas en los establecimientos de
salud con altas tasas de deserción, tales como: no se está brindando servicios de calidad
en general, ocurrencia de eventos adversos por mala técnica de administración de vacunas,
distribución de fichas, largas colas, rechazo, población migrante, etc.
Taza de deserción aceptada es del 5%.
Tabla N°18: sistematización de deserción
Establecimiento de salud /
Municipio / Red / SEDES
Total vacunados
con 1er dosis de
Pentavalente (b)
Total vacunados
con 3era dosis de
Pentavalente
(c)
Tasa de deserción
( b - c / b )*100
Total Establecimiento de
salud/municipio/red/SEDES
Fuente: PAI / MSyD.
6.8.3
Indicador de integralidad
Se podrá identificar problemas en la vacunación simultánea para dar soluciones oportunas
por cada uno de los niveles analizados. Por ejemplo, al sistematizar la información de una red
de salud podremos identificar en cual municipio no se vacuna integralmente e implementar
Manual Técnico del Programa Ampliado de Inmunización
Figura 22: Tasa de deserción de
pentavalente por SEDES, Bolivia 2020
Fuente: PAI / MSyD.
219
220
Figura 23: Vacunación integral a menores
de 1 año por SEDES Bolivia Gestión 2020
Serie: Documentos Técnico Normativos
Establecimiento
de salud/
municipio/red/
SEDES
Total Establecimiento
de salud/municipio/
red/SEDES
Fuente: PAI / MSyD.
Fuente: PAI / MSyD.
Penta & Rota
(b-d)/b x 100
Penta & Neumo
(b-c)/b x 100
Penta & Polio
(b-a)/b x 100
Total vacunados
con 1era dosis de
Antirotavirus (d)
Total vacunados
con 1era dosis de
Antineumococica (c)
Total vacunados
con 1era dosis de
pentavalente (b)
Total vacunados con
IPV 1 (a)
un plan de mejora específico, y proceder de la misma forma en otros niveles se admite hasta
un 5% de diferencia.
Tabla N°19: Sistematización de la integralidad
Tabla N°20: Esquema completo
5tas dosis de polio
y penta y una dosis
de anti influenza
4 años
Población objetivo
Nº de niños con
Antiamarílica, 2
dosis de SRP, 4tas
dosis de polio y
penta y una dosis
de anti influenza
Población objetivo
1 año
(12 a 23 meses)
Nº de niños con BCG,
con 3 dosis de polio,
penta y neumo,
con dos dosis de
antirota y anti
influenza
Establecimiento
de salud/
municipio/red/
SEDES
Población objetivo
Menor de 1 año
Total
Fuente: PAI / MSyD.
6.9
REPORTE DEL REGISTRO NOMINAL DE VACUNACIÓN ELECTRÓNICA
El PAI cuenta con cuatro tipos de reporte:
* Reporte diario.
* Reporte consolidado.
* Reporte de indicadores.
6.9.1
Reporte diario
Informe de datos de los registros diarios por día, tipo de vacuna, Nº de dosis, edad, sexo y
establecimiento de salud de vacunación.
6.9.2
Reporte consolidado
Informe de datos de los registros diarios por tipo de vacuna, período, Nº de dosis, edad, sexo
tipo de establecimiento de salud de vacunación, municipio, coordinación de red, SEDES y
nacional.
6.9.3
Reporte de indicadores
Acceso, coberturas, deserción o seguimiento, oportunidad, integralidad y esquema completo.
El reporte de estos indicadores debe ser de acuerdo a cohorte de nacimiento, oportunidad de
la vacunación, es decir de acuerdo al esquema (edad en meses por tipo de vacuna y número
de dosis), ámbito de responsabilidad, lugar de vacunación.
Manual Técnico del Programa Ampliado de Inmunización
* Reporte de listados.
221
También puede reportar por residencia de la persona vacunada y lugar de vacunación.
Indicador de oportunidad
Mide el cumplimiento de la vacunación de acuerdo al esquema, por ejemplo, vacuna BCG
aplicada en los 28 días de nacimiento, o terceras dosis de penta, polio y neumo, a los 6 meses
de edad.
Este indicador es de calidad y complementa el análisis de coberturas en el primer año de vida.
Tabla N°21 Indicador de oportunidad Establecimiento de salud /
municipio / red / SEDES
Población
objetivo
Niños <4 meses vacunados con 2
dosis de anti rotavírica
Porcentaje
(%)
Total de establecimiento de salud
/ municipio / red / SEDES
Fuente: PAI / MSyD.
6.9.4
Reporte de listados
Este listado puede ser por todas las variables del Registro Nominal de Vacunación electrónica,
las relevantes para el seguimiento del estado vacunal nominal son:
* Listado de inasistentes.
* Listado de quienes rechazan la vacunación.
* Lista de programados.
* Lista de próximas citas.
Serie: Documentos Técnico Normativos
Análisis
222
Comparar las vacunas administradas, con las metas mensuales, construir e interpretar
los indicadores de coberturas, acceso, tasas de deserción o seguimiento, de integralidad,
oportunidad y esquema completo; permite determinar las causas de no vacunación,
oportunidades perdidas, barreras institucionales, barreras comunitarias y las fortalezas y
debilidades.
Uso de los actos de vacunación
En base a las coberturas alcanzadas determinar un plan de mejora que permita lograr los
resultados esperados.
6.10
Establecer las normas del Registro Nominal de
Vacunación electrónica
El RNVe, es el registro individual de la persona vacunada por nombre, fecha de nacimiento,
fecha de administración de cada vacuna, tipo de vacuna, N° de lote, dosis, establecimiento
donde se aplica la vacuna y nombre del vacunador.
Los registros nominales de vacunación electrónicos (RNVe), son herramientas que facilitan
el seguimiento de los esquemas de vacunación de cada persona, el mantenimiento de su
historial de vacunación y que, por lo tanto, ayudan a mejorar el desempeño del PAI, tanto en
términos de su cobertura como de su eficiencia.
Existe evidencia de que los RNVe contribuyen al aumento de coberturas, a mejorar la
oportunidad de la vacunación, a disminuir la revacunación por falta de comprobación y a
proveer datos confiables para la toma de decisiones; como, por ejemplo, dónde ir a buscar a
las personas no vacunadas, para así garantizar el derecho a la vacunación equitativa.
El RNVe permite monitorear el proceso de vacunación, con el propósito de optimizar las
actividades relacionadas. Ofrece información precisa, oportuna, y así facilita la planificación
de los recursos y las actividades. Por otra parte, conocer la productividad de cada vacunador,
podría ayudar a distribuir mejor su carga de trabajo.
Esta herramienta permite detectar problemas de aplicación de normativas existentes, como la
aplicación de vacunas a población no objetivo, y ayuda a dirigir las actividades de capacitación
y supervisión. Por último, el RNVe ofrece información útil y fiable para la realización de estudios
de efectividad y seguridad vacunal, entre otros.
6.10.1
Beneficios del RNVe
* Contribuye a la simultaneidad de la vacunación.
* Reducción de errores de registro.
* Reponer carnet o la Libreta de Salud Infantil, en caso de pérdida.
* Monitorear causas de rechazo.
* Implementar acciones correctivas.
* Evaluar coberturas de vacunación por cohorte de nacimiento.
* Trazabilidad de lotes de vacunas.
* Vigilancia de ESAVI.
* Detección de bolsones de población no vacunados.
6.10.2
Ventajas del RNVe
* Permite el acceso a su historia vacunal y facilita la captación activa.
* Apoya la planificación mensual de quienes deben ser vacunados.
* Permite hacer seguimiento a los rezagados o inasistentes.
Manual Técnico del Programa Ampliado de Inmunización
* Automatizar recordatorios.
223
* Son registros computarizados y forman parte del sistema de información de inmunización,
el cual puede ser con conectividad (en línea), desconectado o una combinación de ambos.
6.10.3
Módulos del RNVe
* Administración (Gestión de Usuarios, roles, vacunas, lotes).
* Registro del Acto de Vacunación.
* Seguimiento Vacunal.
* Validación, Rectificación de Datos.
* Integración con el SOAPS.
* Interconectividad con el SEGIP para la generación del numero único de identificación.
* Interconectividad con el SERECI para la generación del certificado de nacimiento.
* Reportes.
* ESAVI.
A.
Administración (Gestión de Usuarios, roles, vacunas, lotes)
* En este módulo, se crea usuarios para el SEDES, PAI, el personal de salud ya sea
departamental, red y/o establecimiento para que pueda acceder al sistema del RNVe.
* Crea distintos roles para el acceso al sistema.
* El sistema permite registrar grupos etarios para las nuevas vacunas y esquemas.
* Se registran los nuevos lotes de vacunas para que el personal de salud pueda elegir al
momento de registrar en el acto de vacunación.
b.
Registro electrónico del acto de vacunación
* Para poder registrar el acto de vacunación de un paciente primeramente se realiza una
búsqueda de datos mediante servicios de SEGIP o SUS.
* Previo a la vacunación, revisar el estado vacunal en el sistema del RNVe para determinar
cuál o cuáles le corresponde recibir.
Serie: Documentos Técnico Normativos
* De acuerdo a la edad administrar y registrar en el RNVe las dosis y las vacunas aplicadas.
* Se registra el acto de vacunación de COVID-19 agregando las siguientes variables:
nacionalidad, residencia, tipo de paciente, antecedentes de salud, tipo de personal salud,
enfermedad de base y antecedentes de vacunas.
C.
Seguimiento del estado vacunal
El sistema RNVe nos permite obtener:
* Un historial vacunal de las personas.
* Fecha próxima de vacunación.
* Registro de ESAVI.
* Lugar de vacunación del paciente.
224
D.
Validación, rectificación de datos
Al momento de registrar el acto de vacunación el personal de salud de cada establecimiento,
debe realizar la validación de todas las vacunas registradas de una fecha determinada y eso
nos permite validar o corregir el dato.
El módulo de validación permite que el personal de salud pueda revisar las vacunas registradas
de una determinada fecha; si bien lo puede realizar, por semana o por mes, se recomienda
hacerlo el mismo día que se registró la vacunación.
El módulo de rectificación permite que el personal de salud, pueda modificar el dato de la
vacunación registrada; debe realizarla el encargado de Red, del PAI o el administrador del
sistema, pidiendo la siguiente información:
* Nombre del usuario que fue vacunado.
* Fecha de vacunación.
* Vacuna.
* Esquema.
* La rectificación de los datos se la puede realizar mensualmente, siguiendo los pasos
descritos en el Manual del Usuario.
E.
Integración con el SOAPS Después de validar las vacunas registradas en el sistema RNVe el personal de salud puede
integrar al sistema SOAP todos los datos registrados en el sistema RNVe y así el personal de
salud evitara registrar dos veces en los diferentes sistemas.
F.
INTERCONECTIVIDAD CON EL SEGIP PARA LA GENERACIÓN DEL NÚMERO ÚNICO DE IDENTIFICACIÓN
G.
INTERCONECTIVIDAD CON EL SERECI PARA LA GENERACIÓN DEL NÚMERO ÚNICO DE IDENTIFICACIÓN
Con relación a la interconectividad con el SERECI, la misma nos permitirá la vinculación con
su base de datos de hechos vitales.
H.
Reportes
El sistema RNVe presenta los siguientes informes:
* Listado de niños vacunados.
* Acceso, cobertura, deserción.
* Oportunidad vacunación.
* Integralidad.
* Esquema completo.
Manual Técnico del Programa Ampliado de Inmunización
Este módulo nos permite tener un dato real ya que el servicio del SEGIP proporcionará los
datos personales de una persona para la generación del número único de identificación.
225
* Niños a vacunar.
* Niños inasistentes.
* Kardex de vacuna por lote.
* Estadística.
* cuaderno de vacunas.
* Reporte SNIS.
* Consolidados.
Los reportes de indicadores de acceso, cobertura, oportunidad, deserción, integralidad y
esquema completo serán de acuerdo a lo ya descrito.
Los nuevos reportes son:
* Listado de personas vacunadas, se incorpora los datos registrados en el sistema de las
personas vacunadas.
* Listado de personas a vacunar, es la población meta u objeto a llegar, tanto por municipio,
departamento y nacional.
* Niños inasistentes, son la lista de niños que no recibieron o no acudieron a su vacunación.
* Kardex de vacuna por lote, es el registro detallado de la vacuna en el establecimiento de
salud, Red, SEDES y Nivel Nacional.
* Estadística, son lo gráficos y tablas resumidas de los indicadores, haciendo mención a
reportes que requiera el nivel solicitante.
* Cuaderno de vacunas, es el registro nominal de todas las personas vacunadas, tanto
físico y digital.
* Reporte SNIS, los datos del RNVe alimentaran al Sistema Nacional de Información online, al
servicio de producción que presenta de forma oficial el SNIS en la Web como Ministerio de Salud.
Serie: Documentos Técnico Normativos
* Consolidados, son los datos e información recopilada para su análisis de forma general
o desagregada por niveles.
226
* Pacientes eliminados, se busca mediante numero de identificación para obtener si la
dosis aplicada fue eliminada en el RNVE
* Reporte covid-19, se obtiene datos ya sea nacional. departamental, municipio
establecimiento desde una fecha inicial a una fecha final obteniendo los registros del
paciente si fueron validados o no validados
* Reportes covid-19 para seguridad social, se obtiene datos para una seguridad social ya
sea nacional. departamental, municipio establecimiento desde una fecha inicial a una
fecha final obteniendo los registros del paciente si fueron validados o no validados
* Reportes ESAVI covid-19, se obtiene datos ya sea nacional. departamental, municipio
establecimiento desde una fecha inicial a una fecha final obteniendo los registros de
ESAVI.
* Reportes ESAVI para seguridad social, se obtiene datos para seguridad social ya sea
nacional. departamental, municipio establecimiento desde una fecha inicial a una fecha
final obteniendo los registros del paciente si fueron validados o no validados
* Indicadores de covid-19 por grupo de edad, obtenemos datos por grupos de edad a nivel
nacional, departamento, municipio y/o establecimiento nacionalidad, obtenemos datos a
nivel nacional, departamento y municipio.
* Reportes de covid-19 por auto pertenencia, obtenemos datos
departamento y municipio.
6.11
a nivel nacional,
EL CONTROL DE LA CALIDAD DEL DATO El dato de los actos de vacunación generados a nivel de los establecimientos de salud, debería
mantenerse constante a lo largo de las instancias del flujo de la información, es decir, que
si el establecimiento, generador del dato, registra 10 vacunados, este mismo dato debería
reflejarse en el SNIS nacional, en el reporte a la Red de Salud, a nivel del SNIS departamental.
Sin embargo, esto no siempre sucede debido a muchas variables; en el mismo establecimiento
puede haber un mal registro que se expresa en una sub notificación, es decir, se reporta menos
vacunados o sobre notificación, se reporta un número mayor de niños/niñas vacunadas.
Para evitar esta situación, tanto el personal de los establecimientos, como las instancias
responsables de la información a lo largo del ciclo de la información, deben realizar controles
sobre la calidad del dato.
El primer control de calidad se realiza donde se genera la información se denomina control
interno, que consiste en verificar la calidad de los datos transcritos o registrados revisando
los instrumentos de captación: Carnet de Salud Infantil, Libretas de Salud y Desarrollo Integral
Infantil, y verificar si tienen registrados adecuadamente los datos acerca de la próxima cita,
etc.
De igual manera, en el momento de llenar el Formulario 301, se debe revisar el registro de cada
dato para evitar errores en la transcripción, comparando con los resultados de los Cuadernos.
Asimismo, cada tres meses se puede realizar un análisis de la calidad del dato mucho más
preciso; cuando se aplica la metodología del control de la calidad, comparando los resultados
de los cuadernos con los registrados en el Formulario 301, por ejemplo; en un primer momento
se establece si hay concordancia, es decir, si el dato de los Cuadernos está reflejado a nivel
del mencionado Formulario.
Si no hay concordancia, se puede establecer la diferencia absoluta y relativa; de esta manera
saber si hay sobreinformación, es decir, se informa más de lo que se produce o si hay
subinformación, es decir, se informa menos de lo que se produce.
Manual Técnico del Programa Ampliado de Inmunización
Posteriormente, se deberá revisar el Cuaderno de Vacunas, verificar si la sumatoria de las
columnas está bien, verificar si el número de niños/niñas vacunadas está reflejado en los
respectivos cuadernos. Es mejor revisar dos veces, por lo menos, la suma de los niños/niñas
registradas en los Cuadernos. Estos pasos se los debe realizar de manera habitual todos los
días.
227
También se debe realizar el control externo, por personal que no pertenece al establecimiento
o al nivel donde se genera la información; puede ser realizado por el Gerente de la Red, o del
PAI departamental.
El monitoreo y evaluación de calidad del dato tanto para el registro manual como para el
registro electrónico son muy importantes para la gestión del PAI, por cuanto precisa conocer
el acceso real a los servicios de vacunación y los resultados esperados en el control de las
enfermedades prevenibles por vacuna.
De esta manera, en el PAI, el proceso de control de la calidad del dato se aplica en tres
momentos: en la autoevaluación de la Calidad del Dato, en la supervisión y en las evaluaciones.
En resumen, en el PAI se realiza el control de la calidad del dato de esta manera:
* El autocontrol se hace diaria y mensualmente, en el momento en que se consolida el informe
mensual formulario 301a, se lo realiza por el personal responsable de la información.
* La supervisión trimestral por niveles, incluye el control de calidad de la información, por
las Coordinaciones de Red.
* La supervisión del nivel departamental se realiza cada seis meses a las Coordinaciones
de Red.
* La evaluación nacional de la calidad de la información se realiza cada dos años y la
internacional cada cinco.
6.12
MODELO DE RETROALIMENTACIÓN DEL ANÁLISIS DE LA INFORMACIÓN DE LA VACUNACIÓN
Mensualmente, en cada uno de los niveles de gestión del sistema de salud, se realizará un
análisis de la información del PAI que incluya los siguientes componentes:
* Coberturas de vacunación, cumplimiento de meta mensual, indicadores de coberturas,
acceso, tasas de deserción, de integralidad.
* Indicadores de desempeño de la vigilancia epidemiológica.
Serie: Documentos Técnico Normativos
* Indicadores de logística, utilización y saldos.
228
Participantes: personal de vacunación, de información y responsables del nivel de gestión.
Metodología
* Se levanta un acta de la reunión de análisis, con registro de los participantes, número y
porcentaje de meses con análisis conjunto.
* Análisis de indicadores de coberturas de vacunación, vigilancia y logística
* Se categoriza el desempeño del mes de acuerdo al grado de cumplimiento +95% bajo
riesgo, entre 80-95% riesgo medio y menos de 80% alto riesgo.
* Se elabora plan de mejora. Indicador 12 planes de mejora y meta 100% de cumplimiento.
• Siguiente reunión de análisis se inicia con seguimiento a recomendaciones de anterior
acta.
Figura 24: Retroalimentación de la información
• Se repite el proceso y se analiza comparativamente los resultados de ambos meses.
Manual Técnico del Programa Ampliado de Inmunización
Fuente: PAI / MSyD.
229
230
Serie: Documentos Técnico Normativos
CAPÍTULO 7
CADENA DE FRÍO
Índice
7.1
7.2
7.2.1
7.2.2
7.3
7.3.1
7.3.2
7.3.3
7.3.4
7.4
7.5
7.6
7.6.1
7.6.2
7.6.3
7.6.4
7.7
7.8
7.9
7.9.1
7.9.2
7.10
7.10.1
7.10.2
7.11
7.12
7.12.1
7.13
7.13.1
7.13.2
7.13.3
7.13.4
7.13.5
7.13.6
7.14
7.14.1
7.15
7.16
7.17
7.18
7.18.1
7.18.2
7.18.3
7.19
7.19.1
7.19.2
Introducción
La cadena de frío
Recursos para el funcionamiento de la cadena de frío
Niveles operativos de la cadena de frío
Sistema de transporte, traslado y distribución
Características operativas del Nivel Central
Características operativas del Nivel Departamental
Características operativas del Nivel de Coordinación de Red / Municipio
Características operativas del Nivel Local / Establecimiento de Salud
Conceptos fundamentales en cadena de frío
Importancia de la cadena de frío
Equipos de la cadena de frío
Cámaras frías
Vehículo frigorífico para el transporte de vacunas
Refrigeradores
Elementos complementarios de la cadena de frío
Temperatura requerida para la conservación de las vacunas
Monitoreo o control de temperatura de la cadena de frío
Presentación y dimensiones del empaque de las vacunas
Presentación de las vacunas
Empaques de las vacunas
Capacidad de almacenamiento
Cálculos de volúmenes y capacidades
Capacidad de almacenamiento para equipos de la cadena de frÍo
Organización de vacunas en equipos de la cadena de frÍo
Preparación para el transporte de vacunas
Termos porta vacunas
Cuidados esenciales y uso correcto de los equipos de la cadena de frÍo
Refrigeradores
Registro de control de la temperatura
Hoja de vida del equipo
Control de temperatura en termos porta vacunas
Paquetes fríos de agua
Termómetros
Cuidados del generador de energía eléctrica:
Cuidados de seguridad
Inventarios de equipos de la cadena de frío
Actividades de gestión en cadena de frío
Plan de emergencia
Algunos desperfectos más comunes y su solución
Refrigeradores eléctricos (compresión)
Refrigeradores a gas/glp (absorción)
Refrigeradores fotovoltaicos (energía solar)
Guía para manejo de vacuna Covid-19
Operaciones para la distribución
Despacho
226
226
227
227
229
229
229
230
230
230
232
232
232
233
233
235
239
242
243
243
244
244
245
246
253
256
256
258
258
261
262
263
264
265
265
266
269
271
272
273
273
273
274
275
276
276
7.19.3
Recepción en almacenes departamentales / Coordinaciones de Red /
municipios / Establecimientos de Salud
277
7.19.4
7.19.5
7.19.6
7.19.7
Para las vacunas a -70°C (Central y Departamental)
Para vacunas que se conservan a -18°C
Astrazeneca, Sinopharm y Janssen (+2 a +8C)
Moderna a -20°C
277
278
278
279
7.1
INTRODUCCIÓN
Por más de 40 años, el Programa Ampliado de Inmunización PAI, viene realizando la
vacunación para la prevención de las enfermedades inmunoprevenibles; garantizando el
almacenamiento, la conservación y el transporte de las vacunas en los diferentes eslabones
de sus componentes, asimismo, que las vacunas e insumos sean enviados de manera segura
y oportuna a su destino final.
Las vacunas que se encuentran en el esquema nacional de vacunación, son productos
sensibles a cualquier variación prolongada de temperatura y a otros factores internos y
externos; conservando y manteniendo en los rangos de temperatura establecidos entre +2°C
a +8°C, -18°C y -70°C. Si se exponen a temperaturas superiores o inferiores al rango permitido,
algunas de ellas disminuirán en su capacidad inmunológica y otras quedaran inutilizadas;
debido a que algunas vacunas son más sensibles a los cambios de temperatura que otras.
7.2
LA CADENA DE FRÍO
234
Figura N°25: Elementos importantes de la cadena de frío
Serie: Documentos Técnico Normativos
Es el proceso que asegura la correcta recepción, almacenamiento, conservación, manejo,
distribución y transporte de las vacunas, desde que salen del laboratorio que las produce, hasta
el momento de la vacunación, con la finalidad de asegurar que las vacunas sean conservadas
dentro de los rangos de temperatura recomendada, en todos los niveles, para que no pierdan
su potencia inmunológica.
Fuente: PAI / MSyD
7.2.1
Recursos para el funcionamiento de la cadena de frío
Es fundamental garantizar los recursos necesarios, suficientes y oportunos, para un adecuado
funcionamiento de la cadena de frío, que garanticen la conservación de las vacunas y que no
pierdan su potencia inmunológica. Estos recursos son:
* Recursos Humanos: Es el personal de salud que está capacitado para el manejo de la
cadena de frío de manera directa o indirecta.
* Recursos Materiales: Son equipos indispensables para almacenar, conservar, trasladar y
monitorear la temperatura de las vacunas.
Fuente: Programa Ampliado de Inmunización/Ministerio de Salud y Deportes, 2021
7.2.2
Niveles operativos de la cadena de frío
Los niveles de la cadena de frío corresponden a la organización técnico-administrativa
del Sistema Nacional de Salud, que brinda apoyo al almacenamiento y la distribución para
asegurar que las vacunas y otros insumos lleguen a los servicios de vacunación.
Manual Técnico del Programa Ampliado de Inmunización
Figura N°26: Recursos de la cadena de frío
* Recursos Financieros: Son los recursos económicos suficientes y necesarios para
asegurar el funcionamiento continuo e ininterrumpido de toda la cadena de frío; además de
garantizar la adquisición, conservación y dotación de vacunas, insumos, infraestructura,
equipamiento, recurso humano, tecnología y gastos operativos.
235
Estos niveles operativos están conectados entre sí, mediante una serie de eslabones que
permiten el almacenamiento y distribución de las vacunas de forma segura, evitando el
desabastecimiento en los puntos de servicios de vacunación, que es el objetivo primordial de
la cadena de suministros.
* Nivel Central: Su ámbito de actividad abarca a todo el territorio nacional, realiza la
gestión de adquisición de vacunas e insumos, los mismos que son distribuidos a los 9
departamentos de acuerdo a requerimientos trimestrales.
* Nivel Departamental: Está conformado por los 9 Servicios Departamentales de Salud,
quienes son responsables del almacenamiento, conservación y distribución de las
vacunas e insumos a las coordinaciones de red o municipios.
* Nivel de Coordinación de Red/Municipio: Localizado en las Coordinaciones de red de
servicios de salud de los municipios, ubicadas en las capitales de provincias, en el área
urbana y rural.
* Nivel Local/Establecimientos de Salud: Son los vacunatorios de los Establecimientos de
Salud.
Los niveles de la cadena de frío mencionados, se encuentran conectados entre sí a través de
un sistema de logística, que permite el traslado y distribución de vacunas hasta llegar a la
población objetivo; manteniendo la temperatura de forma permanente dentro de los rangos
establecidos.
En toda la red de cadena de frío, se deben seguir las recomendaciones generales para el
almacenamiento de vacunas, en cuanto a temperatura y periodos de tiempo.
Figura N°27: Organización del sistema de salud
Serie: Documentos Técnico Normativos
Actualmente, la cadena de distribución y operaciones de almacenamiento de vacunas se lleva
a cabo de la siguiente manera.
Fuente: PAI / MSyD.
236
Corresponde a los diferentes niveles técnico-administrativos del sistema de salud
almacenar y conservar, garantizando que las vacunas se mantengan a temperatura
definida por la normativa nacional vigente en ambientes y recipientes adecuados,
por tiempo y temperatura claramente definidas; así mismo, requiere contar con una
serie de condiciones de infraestructura física que permitan el cumplimiento de las
funciones correspondientes para el uso y mantenimiento de la cadena de frío.
7.3
SISTEMA DE TRANSPORTE, TRASLADO Y DISTRIBUCIÓN
Fuente: PAI / MSyD.
7.3.1
Características operativas del nivel central
En este nivel se garantiza la disponibilidad de un ambiente EXCLUSIVO de vacunas y diluyentes
del Programa Ampliado de Inmunización (PAI). Y cuenta con equipos de refrigeración como ser:
cámaras frigoríficas, refrigeradores, congeladores, ultracongeladoras, a generador eléctrico,
accesorios de control de temperatura, cajas térmicas, paquetes fríos, extintores y equipo de
manipulación de cargas para la distribución de vacunas.
7.3.2
Características operativas del nivel departamental
En este nivel se disponen de cámaras frías, refrigeradores, congeladores, ultracongeladores aire
acondicionado (donde la temperatura ambiente supera los +18°C), paquetes fríos, equipos de
Manual Técnico del Programa Ampliado de Inmunización
Figura N°28: Transporte de las vacunas
La conexión entre los diferentes niveles se basa en el sistema de transporte que permite el
traslado y distribución en condiciones adecuadas de acuerdo a norma hasta su destino final.
237
control de temperatura, generador eléctrico y extintores. Además, debe contar con espacios y
áreas suficientes para almacenar todos los insumos del Programa, como diluyentes, jeringas,
cajas de desecho seguro, material promocional y otros.
7.3.3
Características operativas del nivel de coordinación de
red/municipio
Estas instancias disponen de refrigeradores, congeladores para almacenar vacunas exclusivas
del programa, paquetes fríos, equipos de control de temperatura, cajas térmicas (cajas frías).
Además, debe contar con espacios y áreas suficientes para almacenar todos los insumos del
Programa, como diluyentes, jeringas, cajas de desecho seguro, material promocional y otros.
7.3.4
Características operativas del nivel local /
establecimientos de salud
Cuentan con un ambiente exclusivo para cadena de frío, con refrigeradores, paquetes fríos,
termómetros, termos porta vacunas, cajas térmicas (cajas frías), para mantener las vacunas
por tiempo limitado.
7.4
CONCEPTOS FUNDAMENTALES EN CADENA DE FRÍO
A.
Temperatura
El calor es una forma de energía y su intensidad no se puede medir directamente; sin embargo,
es posible medirla por medio de termómetros.
B.
Frío
Es la ausencia total o parcial de calor, siendo el resultado de la ausencia de una generación de
energía, en una superficie o espacio.
C.
Calor
Es una forma de energía, que puede transmitirse de un cuerpo a otro, en virtud de la diferencia
de temperaturas existentes entre ellos; se transmite de una sustancia de temperatura más
alta a otra más baja.
Serie: Documentos Técnico Normativos
D.
238
Refrigerante
Es cualquier cuerpo o substancia que actúa como agente de enfriamiento, absorbiendo calor
de otro cuerpo o substancia. Desde el punto de vista de la refrigeración mecánica, se produce
por evaporación de un líquido y la compresión de vapor. Se puede definir al refrigerante como
el medio para transportar calor desde donde lo absorbe.
E.
Vida fría de un componente térmico
Se define como vida fría de un componente térmico, al tiempo (en horas), que demora en subir
la temperatura de la vacuna, desde el momento en que se colocó en el mismo, hasta el rango
máximo de temperatura crítica (+8°C). El calor se transmite de una sustancia de temperatura
más alta a otra de temperatura más baja.
Los factores que intervienen y afectan la vida fría son:
* Temperatura ambiente que rodea al equipo o componente térmico.
* Calidad y espesor del aislamiento con que fue fabricado el equipo térmico.
* Cantidad y temperatura de los paquetes fríos que se ponen al interior de los equipos de
transporte.
* Funcionamiento o condición del equipo de conservación.
E.
Refrigeración
Proceso de reducir la temperatura de una sustancia o de un espacio determinado. El espacio
puede ser el interior de un refrigerador, una cámara fría o cualquier espacio cerrado, el cual
debe mantenerse a una temperatura más baja que la del ambiente que la rodea. Un equipo
de refrigeración, enfría su interior, bombeando energía térmica desde los compartimientos de
almacenamiento de las vacunas hacia el exterior más caliente.
F.
Congelación
Fuente: PAI / MSyD.
Manual Técnico del Programa Ampliado de Inmunización
Figura N°29: Proceso de refrigeración
La congelación es el cambio físico en el que la materia pasa del estado líquido al sólido, por
una baja en la temperatura. El nombre común de los cristales de agua es “hielo”, y este se
puede fundir o transformar en líquido nuevamente, si se somete a un calentamiento.
239
7.5
IMPORTANCIA DE LA CADENA DE FRÍO La cadena de frío es la unión de eslabones de tipo logístico, que intervienen en la manipulación
y el transporte de las vacunas. Esta área se constituye en el soporte básico del PAI y es
fundamental prestarle toda la atención que el caso amerita. En este sentido, la recepción,
almacenamiento, conservación, monitoreo de temperatura, distribución y transporte de las
vacunas, dentro de los rangos de temperatura establecidos según normativa, es fundamental
para garantizar la entrega de vacunas con calidad inmunológica a la población objeto.
Representa un aspecto vital para el éxito del programa.
El propósito de la cadena de frío en el PAI, es el de mantener la calidad de las vacunas, desde
el momento de la fabricación hasta su administración en la población objetivo; asegurando su
almacén y transporte en los rangos de temperatura de +2°C a +8°C, -18°C y -70°C; de acuerdo
a normas vigentes en el país, garantizando su poder de inmunogenicidad.
7.6
EQUIPOS DE LA CADENA DE FRÍO Es necesario contar con equipos frigoríficos, dispositivos de refrigeración y otros elementos
complementarios que se detallan a continuación:
7.6.1
Cámaras frías
Son equipos de refrigeración, utilizados para el almacenamiento y conservación de vacunas
en grandes volúmenes, encontrándose estos equipos en el almacén nacional y en los 9
almacenes departamentales del PAI.
Al interior de la cámara fría se debe contar con paquetes fríos apilados (llegando al menos a
un metro de altura) para estabilizar la temperatura, las mismas que deben ser ubicadas en las
esquinas de la parte inferior.
* Conservación en refrigeracion entre +2°C y +8°C
Serie: Documentos Técnico Normativos
* Conservación en congelación a -20°C
240
7.6.2
Vehículo frigorífico para el transporte de vacunas
Utilizados para el transporte de vacunas del aeropuerto al almacen central y de éste a los
9 departamentos. Estos vehículos poseen una unidad de refrigeración capaz de mantener
la temperatura de +2°C a +8°C, con autonomía propia de los generadores de energía para el
funcionamiento de la refrigeración.
7.6.3
Refrigeradores
Tabla N°22: Tipos de refrigeradores para almacenamiento de vacunas
Tipos de refrigeradores de vacunas
Descripción
Eléctrico (también conocido como
unidades de compresión)
Para garantizar la conservación de las
vacunas, se debe contar con refrigeradores
precalificados, cumpliendo recomendaciones
emanadas de la Evaluación Internacional de la
GEV (2016) y las normas técnicas del PAI Central.
En la actualidad, se utilizan refrigeradores
domésticos adaptados para la conservación
de las vacunas, los cuales deben ser
Manual Técnico del Programa Ampliado de Inmunización
Son indispensables para el almacenamiento y la conservación de todas las vacunas. Se
debe prestar la máxima atención, para que se encuentren funcionando de manera eficiente,
especialmente en los niveles operativos con deficiencias logísticas. Los refrigeradores
pueden funcionar con electricidad, con energía solar o gas (GLP), de acuerdo a la fuente de
alimentación energética disponible. Tomando en cuenta la programación de las vacunas y
paquetes de agua, se debe seleccionar el tipo de refrigerador necesario. Se recomienda que
la selección de refrigeradores para el almacenamiento de vacunas, se realice de acuerdo a las
características y condiciones operativas.
241
Serie: Documentos Técnico Normativos
cambiados por refrigeradores precalificados,
de manera paulatina en los próximos 5 años.
Para
consultar
las
especificaciones
técnicas ingresar al siguiente link: https://
apps.who.int/immunization_standards/
vaccine_quality/pqs_catalogue/)
242
A energía solar (también denominados
unidades fotovoltaicas)
Existen dos tipos: a) Con unidades de baterías
solares conectadas a un banco de baterías, las
cuales son cargadas por los paneles solares y
b) Con accionamiento solar directo, alimentadas
directamente por los paneles solares.
Para
consultar
las
especificaciones
técnicas ingresar al siguiente link: https://
apps.who.int/immunization_standards/
vaccine_quality/pqs_catalogue/)
A gas” GLP” (también conocidos como
unidades de absorción)
Las unidades de absorción necesitan
menos mantenimiento, siendo utilizados en
lugares donde no existe energía eléctrica.
Refrigeradores duales precalificados Son productos precalificados por la OMS
TCW 3000 AC
utilizados en los programas de inmunización
como equipos de cadena de frío.
Considerados duales por que tiene la
capacidad de conservar a temperaturas de:
Refrigeración
a
+
5ºC
Congelación
a
-20ºC
Para
consultar
las
especificaciones
técnicas
ingresar
al
siguiente
link:
https://apps.who.int/immunization_
standards/vaccine_quality/pqs_catalogue/
L i n k P D F. a s p x ? U n i q u e I D = e f 6 4 6 f 2 4 6bdd-4ba6-b884-23ba8bc7f0
fd&TipoDoc=DataSheet&ID=0
Ultra Congeladores UBT
Equipos de Ultra-Baja Temperatura (UBT)
Estos equipos tienen la capacidad de mantener
a una temperatura entre -20°C -70 °C
El verdadero reto es almacenar y distribuir
las vacunas que requieran una cadena de frío
a UBT (Ultra Bajas Temperaturas a -70°C).
Fuente: PAI / MSyD.
7.6.4
Elementos complementarios de la cadena de frío
Son equipos que sirven para el transporte y control de las vacunas en las actividades de
traslado y jornadas de vacunación Dentro de éstos se tienen los siguientes elementos:
A.
Caja fría y termo porta vacunas
Son contenedores fabricados con paredes aislantes de poliuretano o poliestireno. Se utilizan
para mantener a las vacunas y diluyentes, en el rango de temperatura requerido durante su
transporte a nivel operativo, para realizar las siguientes actividades:
* Almacenamiento de vacunas de manera temporal, como cuando el refrigerador del
Establecimiento de Salud no esté en funcionamiento o ante cualquier tipo de eventualidad
que ponga en riesgo la conservación de la cadena de frío.
Manual Técnico del Programa Ampliado de Inmunización
* Transportar vacunas y diluyentes en sesiones de vacunación fuera y dentro del servicio
de salud.
243
* Transportar suministros de vacunas de los almacenes departamentales, coordinaciones
de red o municipios a los Establecimientos de Salud.
B.
Paquetes fríos
Son pequeños recipientes de plástico planos, a prueba de fugas con tapa rosca reutilizables;
son utilizados para revestir el interior de la caja fría o el termo porta vacunas, teniendo como
finalidad el mantener las vacunas en el rango de temperatura requerida (de +2°C a +8°C) para
su transporte y almacenamiento temporal. Es importante usar el número y tamaño correcto
de paquetes y seguir las instrucciones impresas dentro de la tapa del recipiente.
Cada establecimiento de salud debe contar con el número suficiente de paquetes fríos que
sean necesarios, para asegurar el transporte adecuado de las vacunas. Se debe contar con
paquetes fríos adicionales para el reemplazo en caso de emergencia.
El líquido (agua) del paquete frío, no apto para consumo humano.
Serie: Documentos Técnico Normativos
No se recomienda utilizar paquetes fríos con gel (solución eutéctica), para evitar la exposición
a bajas temperaturas con alto riesgo de congelamiento de las vacunas.
244
Los orificios de los paquetes fríos NO deben ser utilizados para colocar las vacunas; estos
tienen la finalidad de evitar la expansión de los paquetes al congelarse y ser utilizados por el
operador en el momento de ser colocados en el termo o la caja fría.
Paquetes con soluciones eutécticas. Son sustancias de diferente composición química cuyo
punto de congelación es inferior a 0°C. Estos paquetes se presentan de diferentes formas y
colores, su contenido puede ser también un líquido incoloro, es habitual que se lo confunda
con agua.
C.
Dispositivos de control y registro de temperatura
Son instrumentos que registran la temperatura de las vacunas. Actualmente existen múltiples
dispositivos para el monitoreo de la temperatura de las vacunas, tanto para la exposición
al calor, como a la congelación; los monitores de viales de vacunas (VVMs) son algunos de
los dispositivos de monitoreo de temperatura y que acompañan de manera rutinaria a las
vacunas a lo largo de toda la cadena de frío o suministros. Además de éstos, existen varios
equipos electrónicos que tienen como fin el monitoreo continuo de la temperatura, que son
aplicados por los fabricantes para el traslado de vacuna.
Manual Técnico del Programa Ampliado de Inmunización
245
D.
Termómetros
Son instrumentos importantes para el monitoreo y control de la temperatura de los equipos
frigoríficos de la cadena de suministros que son utilizados a nivel operativo. El registro de la
temperatura se marca en escala de temperatura de grados Celsius (°C), también conocido
como grados centígrados.
Los termómetros usados más comúnmente son:
Termómetros de alcohol: Están construidos en un pequeño tubo de vidrio, en cuyo interior hay
una columna de alcohol coloreado (rojo, azul, verde, etc.), sobre una escala que permite leer la
temperatura marcada. Estos son aún utilizados en el país.
Termómetro digital: Es un dispositivo de medición continua de la temperatura, que permite
su lectura, sin abrir el refrigerador o los termos porta vacunas. Está compuesto por dos
sensores que deben ser instalados dentro del refrigerador (uno en la parte superior y otro en
la inferior), sin tocar las paredes del mismo y un lector que se coloca en un lugar visible, el
cual nos permitirá realizar la lectura de las temperaturas máxima y mínima, registradas a las
que ha llegado desde la última lectura. Recomendado para el control de la temperatura del
refrigerador y de los termos porta vacunas en todos los niveles.
Serie: Documentos Técnico Normativos
También existen termómetros digitales, integrados en refrigeradores, congeladores y en
algunos termos porta vacunas precalificados que vienen con estos dispositivos.
246
7.7 TEMPERATURA REQUERIDA PARA LA CONSERVACIÓN DE LAS VACUNAS
Las vacunas son productos altamente sensibles al cambio térmico, algunas de éstas son
sensibles a la congelación o al calor y otras a la luz. Las posibles variaciones térmicas
repercuten de manera directa, en la pérdida de la potencia de la vacuna y si ésta pierde la
potencia ya no se la puede recuperar. Para mantener la calidad de la vacuna, debe mantenerse
en los rangos establecidos, es decir entre +2°C a +8ºC. El siguiente cuadro muestra las
temperaturas recomendadas para las diferentes vacunas en cada nivel de la cadena de frío.
Es fundamental que todos los que manejan vacunas y diluyentes conozcan la sensibilidad
térmica y las temperaturas de almacenamiento, recomendadas para todas las vacunas y
diluyentes establecidos a nivel nacional.
Tabla N°23: Temperatura y tiempo de conservación de las vacunas, por niveles de
cadena de frío
Nivel
Departamental
(SEDES)
12 a 18 meses 6 meses
De -15°C
Central
Tiempo
bOPV anti
poliomielítica oral
BCG (Bacilo de
Coordinación
de Red
1 a 3 meses
Municipio/
Local
1 mes
a -25°C
Calmette-Gerín)
SRP (Sarampión,
y Rubeola)
Fiebre Amarilla
Pentavalente
Hepatitis B
dT
Neumococo
Rotavirus
VPH (Virus del
De +2°C a +8°C
¡NO CONGELAR!
Papiloma Humano)
Influenza Estacional,
pediátrica
Influenza Estacional,
adulto
IPV Polio inactivada
Diluyentes
Fuente: PAI / MSyD.
CONSERVAR A
CONSERVAR EN ALMACEN EN SECO A
TEMPERATURA
TEMPERATURA AMBIENTE ENTRE +15°C a +25°C
De +2°C a +8°C
¡NO DEBEN CONGELARSE!
¡NO DEBEN
CONGELARSE!
Manual Técnico del Programa Ampliado de Inmunización
VACUNAS
Rubeola y Parotiditis)
SR (Sarampión
247
Tabla N°24: Temperatura de conservación de las vacunas anti covid-19, por niveles
de cadena de frío
Departamental Coordinación
Municipio/Local
(SEDES)
de Red
Nivel
Central
Tiempo
Distribución inmediata
uso inmediato
ASTRAZENECA
SINOPHARM
de +2°C a +8°C
JANSSEN
SPUTNIK V
PFIZER
MODERNA
PARA LA ADMINISTRACION
CONSERVAR A TEMPERATURA
DE +2°C a +8°C (TIEMPO
MAXIMO 2 HORAS)
-18°C
-70°C
PARA LA ADMINISTRACION CONSERVAR
A TEMPERATURA DE +2°C a +8°C
(TIEMPO MAXIMO 30 DIAS)
-20°C
PARA LA ADMINISTRACION CONSERVAR
A TEMPERATURA DE +2°C a +8°C
(TIEMPO MAXIMO 30 DIAS)
Fuente: PAI / MSyD
Vacunas con sensibilidad al calor y a la congelación
Figura N°30: Sensibilidad de las
vacunas a la temperatura
Serie: Documentos Técnico Normativos
La pérdida de estabilidad se puede dar por factores externos; la temperatura por congelación
o por calor, por el tiempo de exposición; además de los factores intrínsecos de la vacuna.
De cualquier manera, se supone que la pérdida de la capacidad inmunizante es siempre
permanente, acumulativa e irreversible.
248
Figura N°31: Vacunas sensibles ala congelación
Figura N°32: Vacunas con sensibilidad al calor
* Factores extrínsecos, establecidos por la termoestabilidad y la fotoestabilidad.
Fuente: PAI / MSyD
Vacunas con sensibilidad a la luz
Existen vacunas que son muy sensibles a la luz y pueden perder su potencia inmunológica;
por eso, siempre deben protegerse contra la luz solar o cualquier luz artificial fuerte, debiendo
ser esta exposición minimizada siempre. Entre las principales vacunas que son sensibles a la
luz o al calentamiento, están la BCG, rotavirus, SRP, SR y vacunas anti COVID-19.
Manual Técnico del Programa Ampliado de Inmunización
* Factores intrínsecos, inducidos por la vacuna.
249
7.8
MONITOREO O CONTROL DE TEMPERATURA DE LA CADENA DE FRÍO (CRITERIO NO. 2 DE LA GESTIÓN EFECTIVA DE VACUNAS GEV)
Es prioritario realizar este control de temperatura de manera continua en toda la cadena de
suministros, por ser la única manera de garantizar que las vacunas se mantengan conservadas
en temperaturas idóneas.
El monitoreo de temperatura debe registrarse de manera diaria y en todos los niveles de cadena
de frío, incluido durante su transporte; los resultados deben ser analizados semanal, mensual
y anualmente; para verificar que las vacunas se almacenan y transportan a temperaturas
recomendadas. El registro se debe realizar en el formulario de registro manual de temperatura;
debiendo estar pegado el mismo en un lugar visible del refrigerador o equipo de cadena de
frío; utilizando para este control dos termómetros: uno puesto encima de las vacunas en la
rejilla superior y un segundo, encima de las vacunas, en la rejilla inferior. Se recomienda hacer
análisis periódicos de los controles y resguardar los registros de los 5 años anteriores.
Para el control y monitoreo continuo de temperatura, se deben utilizar equipos electrónicos
que registren la temperatura de las vacunas en los equipos de transporte durante todo el
recorrido; una vez se llegue al destino, éstos deben ser conectados en las computadoras
donde se realizara la extracción del reporte de la lectura de temperatura. Asi mismo , el
procedimiento del registro de temperatura, debe ser registrado de manera manual en la hoja
del despacho de vacunas.
¡IMPORTANTE!
Serie: Documentos Técnico Normativos
Los refrigeradores domésticos verticales tienden a perder temperatura rápidamente,
cada vez que se abre la puerta, debido a que, el aíre frío, al ser más pesado, sale
con facilidad por la parte inferior del gabinete. El aire caliente por ser más liviano
ingresa al compartimiento refrigerado, por la parte superior y ocupa el espacio que
dejo el aire frío.
250
Todas las cámaras y refrigeradores deben contar con un dispositivo de monitoreo continuo de
temperatura, con sistema de alarmas y alertas, cada uno deberá tener las especificaciones al
tipo de equipo de refrigeración.
Control de temperatura
* Durante el almacenamiento se debe realizar el control de temperatura 2 veces al día
durante los 7 días de la semana, inclusive los feriados y registrarse en la hoja de control
de temperatura. Los mismos deben ser analizados cada fin de mes.
* Durante el despacho y recepción de las vacunas, realizar el control de la temperatura
a cada uno de los termos, cajas frías, cajas frías, y porta vacunas; registrando en el
formulario respectivo.
* Durante el transporte, se debe realizar el control de temperatura, considerando la distancia,
el acceso geográfico, el clima, desastres naturales, movilizaciones sociales y otros que
interfieran en el transporte normal de las vacunas.
•
Del nivel central al departamental: Se realizará en vehículos frigoríficos con monitoreo
continuo de la temperatura.
•
Del nivel departamental a la coordinación de red o municipio: Cada Gobierno Autónomo
Departamental debe garantizar el transporte de la vacuna realizando estrictos
controles de la temperatura durante el trayecto.
•
De la Coordinación de Red/Municipio al Establecimiento de Salud: Cada Gobierno
Autónomo Municipal debe garantizar el transporte de la vacuna realizando estrictos
controles de la temperatura durante el trayecto.
•
En el Establecimiento de Salud:
◊
Dentro del servicio: Debe contar con un termo exclusivo para las actividades de
vacunación, realizando el monitoreo de la temperatura cada 3 horas durante la
jornada.
◊
Fuera de servicio: Debe contar con termos exclusivos para las actividades de
vacunación extramurales, realizando el control y registro de la temperatura
antes, durante y después de la actividad.
7.9
PRESENTACIÓN Y DIMENSIONES DEL EMPAQUE DE LAS VACUNAS
El personal de salud, responsable de la cadena de frío en todos los niveles, debe tener
conocimiento actualizado sobre la manipulación, presentación y tipo de empaque de las
vacunas.
Presentación de las vacunas
La presentación y dimensiones de las diferentes vacunas, influyen en los requisitos que deben
reunir los equipos de refrigeración para el almacenamiento en los diferentes niveles operativos
de la cadena de frío. Al elegir una vacuna, deberá tenerse en cuenta los siguientes puntos:
Viales Unidosis
* La presentación, en frasco unidosis (monodosis), tiene un volumen empacado mayor,
por tanto, se necesitará mayor espacio frío para su almacenaje en comparación con las
presentaciones multidosis. Sin embargo, el factor pérdida de las vacunas en frascos
monodosis es menor que las multidosis. Todos los responsables en los diferentes niveles
deben gestionar equipamiento suficiente y necesario para el espacio requerido, con el
propósito de reducir al mínimo los costos de operación y no comprometer la integridad
de las vacunas.
Manual Técnico del Programa Ampliado de Inmunización
7.9.1
251
Viales Multidosis
* La presentación, en frasco multidosis, tiene un volumen empacado menor por dosis, en
comparación con las presentaciones de dosis única. Sin embargo, el factor pérdida de las
vacunas en frascos de dosis múltiples es mayor que las unidosis. Todos los responsables
en los diferentes niveles deben gestionar equipamiento suficiente y necesario para el
espacio requerido, con el propósito de reducir al mínimo los costos de operación y no
comprometer la integridad de las vacunas.
* Se debe prever el volumen adicional de almacenamiento de las vacunas que tienen
diluyentes, que requieren en el nivel operativo almacenamiento en refrigeradores a
temperaturas de +2°C a +8°C.
* El fabricante determina el volumen empacado por dosis, para cada presentación de la
vacuna y el volumen máximo empacado por dosis, para la mayoría de las vacunas.
7.9.2
Empaques de las vacunas
Existen al menos tres tipos de empaques para las vacunas que se describen a continuación.
* En primera instancia se tiene la presentación de los frascos, ampollas, tubos, jeringas
prellenadas y cualquier otro dispositivo de administración de vacunas, listo para ser
usado, puede contener una o múltiples dosis.
* Luego se tiene al empaque primario es una caja que contiene varios envases frascos de la
vacuna o diluyente, si los hay. Por lo general, en los servicios de salud, las vacunas deben
ser almacenadas fuera del empaque primario; ordenado, de acuerdo a recomendaciones
de la normativa nacional.
* Finalmente, el empaque secundario, que es una caja que contiene varias cajas primarias,
utilizadas para el envío de las vacunas.
Serie: Documentos Técnico Normativos
Las dimensiones del empaque determinan el requerimiento, tanto del almacenamiento como
del transporte, para que se planifique la capacidad de los equipos de refrigeración en todos
los niveles de la cadena de frío.
252
7.10
CAPACIDAD DE ALMACENAMIENTO (CRITERIO N°3 DE LA GESTIÓN EFECTIVA DE VACUNAS GEV)
La capacidad de almacenamiento y transporte, debe ser suficiente para todas las vacunas e
insumos requeridos para el programa. La capacidad de almacenamiento radica en:
•
El empaque de algunas vacunas es más voluminoso que el de otras, por lo que se requiere
mayor capacidad de almacenamiento.
•
Las vacunas se deben almacenar correctamente para garantizar que se mantengan en los
rangos establecidos.
La suficiente capacidad de la cadena de frío es fundamental para el rendimiento óptimo del PAI.
Para este fin, se debe calcular el volumen de vacunas que deben almacenarse y transportarse
en la cadena de suministro en todos los niveles de gestión.
El volumen de vacunas, se relaciona de manera directa con las capacidades netas de
almacenamiento de los equipos existentes en la cadena de frío y esto permite identificar
dónde existen brechas de capacidad. Se identifica una brecha en la capacidad de la cadena de
frío, con el fin de dar soluciones de manera oportuna; así como también se deben implementar
métodos para estimar las necesidades de la capacidad de almacenamiento en seco de las
jeringas e insumos.
7.10.1 Cálculos de volúmenes y capacidades
Cálculo del volumen empacado de la vacuna. - Para realizar el ejercicio se deben seguir los
siguientes pasos:
* Identificar el empaque primario de la vacuna.
* Medir las dimensiones del empaque primario el largo, ancho y alto en centímetros.
* Calcular el volumen multiplicando largo x ancho x alto.
* Expresar el resultado en cm3 (porque se multiplicó los tres valores con la misma medida).
* Dividir el resultado por el número total de dosis de la vacuna contenidas en el empaque
primario.
Fuente: PAI/MSyD.
Ejemplo:
La coordinación de red Norte Central debe recibir 11.000 dosis de vacuna Pentavalente.
Requiere calcular la capacidad de almacenamiento, para esto se debe realizar los siguientes pasos.
* Multiplicar las dimensiones del empaque primario de la vacuna: Largo x Ancho x Alto = 13cm x
10cm x 5cm = 650 cm3
* Dividir el volumen total que ocupa la caja, por el número de dosis que contiene: 650 cm3 ÷ 50
dosis = 13 cm3 por dosis de la vacuna
Por lo tanto, se debe estimar el volumen a recibir realizando el siguiente ejercicio:
* 11.000 dosis × 13 cm3 = 143.000 cm3
* 143.000 cm3 ÷ 1.000 Litros = 143 litros
* 143 litros es el volumen que ocupará este envío
Manual Técnico del Programa Ampliado de Inmunización
Figura N°33: Vvolumen empacado
de la vacuna
* Obtener el volumen empacado por dosis expresado en cm3/dosis.
253
* Si el establecimiento de salud cuenta con 3 refrigeradores con capacidad neta de 120 litros cada
uno, pero solamente se toma en cuenta el 50% de esa capacidad el procedimiento se realizaría de
la siguiente manera:
143 litros ÷ 60 litros = 2.05 refrigeradores
* Tomando en cuenta este criterio técnico, para esta vacuna se necesitaría 3 refrigeradores.
Cálculo del volumen de diluyentes. - Para esto se debe realizar los siguientes pasos.
* Identifique el empaque primario del diluyente de acuerdo a la vacuna que corresponda.
* Mida las tres dimensiones del empaque del diluyente de la vacuna: largo, ancho y alto en
centímetros.
* Calcular el volumen multiplicando largo x ancho x alto.
* Expresar el resultado en cm3 (porque se multiplicó los tres valores con la misma medida
se expresa en centímetro cúbicos).
* Dividir el resultado por el número total de dosis del diluyente contenidas en el empaque
primario.
Serie: Documentos Técnico Normativos
* Obtener el volumen empacado por dosis expresado en cm3/dosis.
254
Ejemplo:
La coordinación de red Norte Central debe recibir 11.000 dosis de vacuna diluyente de SRP..
Requiere calcular la capacidad de almacenamiento, para esto se debe realizar los siguientes pasos.
* Multiplicar las dimensiones del empaque primario de la vacuna: Largo x Ancho x Alto = 13cm x
10cm x 5cm = 650 cm3.
* Dividir el volumen total que ocupa la caja, por el número de dosis que contiene: 650 cm3 ÷ 50
dosis = 13 cm3 por dosis de la vacuna
* Por lo tanto, se debe estimar el volumen a recibir realizando el siguiente ejercicio:
• 11.000 dosis × 13 cm3 = 143.000 cm3
• 143.000 cm3 ÷ 1.000 Litros = 143 litros
• 143 litros es el volumen que ocupará este envío
* Si el establecimiento de salud cuenta con 3 refrigeradores con capacidad neta de 120 litros cada
uno, pero solamente se toma en cuenta el 50% de esa capacidad el procedimiento se realizaría de
la siguiente manera:
* 143 litros ÷ 60 litros = 2.05 refrigeradores
* Tomando en cuenta este criterio técnico, para esta vacuna se necesitaría 3 refrigeradores.
7.10.2
Capacidad de almacenamiento para equipos de la cadena
de frío
A.
Capacidad en cámaras frías
Para realizar el ejercicio se deben seguir los siguientes pasos:
* Tomar las dimensiones internas del equipo con la ayuda de un instrumento de medición
(flexómetro o cinta métrica).
* Para el cálculo de la capacidad neta de almacenamiento en estos equipos se debe
considerar solamente el 50% de su capacidad.
* Medir las dimensiones internas de la cámara: largo, ancho y alto en centímetros.
* Calcular el volumen multiplicando: largo x ancho x alto.
Figura N°34: Capacidad
de las cámaras frías
* El resultado mostrara la capacidad neta de almacenamiento del equipo en cm3 (se
expresa en centímetros cúbicos porque se multiplicó los tres valores con la misma
medida) tomando en cuenta la mitad debido que únicamente es considerado el 50% de la
capacidad del equipo para el almacenamiento de las vacunas.
Fuente: PAI / MSyD
Manual Técnico del Programa Ampliado de Inmunización
Ejemplo:
Un PAI departamental necesita conocer la capacidad de almacenamiento de sus cámaras frías para la
recepción de vacunas de un trimestre, para lo cual se realiza los siguientes pasos.
* Tomar las dimensiones internas del equipo con la ayuda de un instrumento de medición (flexómetro
o cinta métrica)
* Multiplicar las dimensiones internas registradas de un equipo: Largo x Ancho x Alto = ¿? cm x ¿?
cm x ¿? cm = cm3
* Luego el resultado se lo divide por 1000 cm3 (equivalente a 1 litro): ¿? cm3 ÷ 1.000 cm3 dando
como resultado ¿? Litros
* Se debe considerar que en estos equipos se toma solo el 50% del total de la capacidad neta
obtenida como resultado, es decir que en el ejemplo se tiene únicamente ¿? Litros como capacidad
neta para el almacenamiento de vacunas.
* Estos pasos se deben repetir a todos los equipos que se tengan en el PAI departamental.
Recordar que este ejercicio se debe realizar de manera individual a cada cámara
fría de manera continua, para conocer la disponibilidad de la capacidad neta para el
almacenamiento de vacunas.
255
B.
Capacidad en refrigeradores verticales (domésticos)
Para realizar el ejercicio se deben seguir los siguientes pasos:
* Tomar las dimensiones internas del equipo con la ayuda de un instrumento de medición
(flexómetro o cinta métrica).
* Este equipo cuenta con dos compartimientos, el que se utiliza para conservar las vacunas
es el gabinete destinado a este fin.
* Para el cálculo de la capacidad neta de almacenamiento en el gabinete de conservación
de las vacunas, se debe considerar solamente el 50% de su capacidad.
* Medir las dimensiones internas del gabinete de conservación: Largo, Ancho y Alto en
centímetros.
* Calcular el volumen multiplicando: largo x ancho x alto.
* El resultado mostrara la capacidad neta de almacenamiento del equipo en cm3 (se
expresa en centímetros cúbicos porque se multiplicó los tres valores con la misma
medida), tomando en cuenta la mitad debido que únicamente es considerado el 50% de la
capacidad del equipo para el almacenamiento.
Mida en centímetros.
Serie: Documentos Técnico Normativos
Figura N°35: Capacidad de
refrigeradores verticales
Compartimento de congelación (solo para paquetes fríos).
256
Compartimento para almacenamiento de vacunas.
Volumen neto área congelación(lt)** = 67% x W x D x H
1000
Volumen neto área refrigeración (lt)** = 50% x W x D x H
1000
** La utilización de un factor de porcentaje es aproximado y pueden variar dependiendo de la configuración y
el uso.
Nota: Ignore el “área donde se almacenan los vegetales” en refrigeradores domésticos.
Fuente: PAI / MSyD.
Ejemplo:
Un Servicio de Salud necesita conocer la capacidad de almacenamiento de sus refrigeradores
domésticos o verticales para la recepción de vacunas correspondientes a un mes, para lo cual se
realiza los siguientes pasos.
* Tomar las dimensiones internas del equipo con la ayuda de un instrumento de medición (flexómetro
o cinta métrica)
* Multiplicar las dimensiones internas registradas de un equipo: Profundidad x Ancho x Alto = 45
cm x 50 cm x 120 cm = 270.000 cm3
* Luego el resultado se lo divide por 1000 ml (equivalente a 1 litro): 270.000 cm3 ÷ 1.000 cm3 dando
como resultado 270 Litros
* Se debe considerar que en estos equipos se toma solo el 50% del total de la capacidad neta
obtenida como resultado, es decir que en el ejemplo se tiene únicamente 135 Litros como
capacidad neta para el almacenamiento de vacunas.
* Estos pasos se deben repetir a todos los equipos que se tengan en el Servicio de Salud.
Recordar que este ejercicio se debe realizar de manera individual a cada refrigerador de
manera continua para conocer la disponibilidad de la capacidad para el almacenamiento
de vacunas.
C.
Capacidad en refrigeradores precalificados
Para realizar el ejercicio se deben seguir los siguientes pasos:
* Tomar las dimensiones internas del equipo con la ayuda de un instrumento de medición
(flexómetro o cinta métrica).
* Para el cálculo de la capacidad neta de almacenamiento en el gabinete de conservación
de las vacunas, se debe considerar solamente el 50% de su capacidad.
* Medir las dimensiones internas del gabinete de conservación: Largo, Ancho y Alto en
centímetros.
* Calcular el volumen multiplicando: largo x ancho x alto.
Fuente: PAI / MSyD
Ejemplo:
Un Servicio de Salud necesita conocer la capacidad de almacenamiento de sus refrigeradores
precalificados para la recepción de vacunas correspondientes a un mes, para lo cual se realiza los
siguientes pasos.
Manual Técnico del Programa Ampliado de Inmunización
Figura N°36: Capacidad de
refrigeradores precalificados
* El resultado mostrara la capacidad neta de almacenamiento del equipo en cm3 (se
expresa en centímetros cúbicos porque se multiplicó los tres valores con la misma
medida), tomando en cuenta la mitad debido que únicamente es considerado el 50% de la
capacidad del equipo para el almacenamiento.
257
* Tomar las dimensiones internas del equipo con la ayuda de un instrumento de medición (flexómetro
o cinta métrica)
* Multiplicar las dimensiones internas registradas de un equipo: Largo x Ancho x Alto = 65 cm x
38 cm x 70 cm = 172.900 cm3
* Luego el resultado se lo divide por 1000 ml (equivalente a 1 litro): 172.900 cm3 ÷ 1.000 cm3 dando
como resultado 173 Litros
* Se debe considerar que en estos equipos se toma solo el 50% del total de la capacidad neta
obtenida como resultado, es decir que en el ejemplo se tiene únicamente 86 Litros como capacidad
neta para el almacenamiento de vacunas.
* Estos pasos se deben repetir a todos los equipos que se tengan en el Servicio de Salud.
Recordar que este ejercicio se debe realizar de manera individual de cada refrigerador, de
manera continua para conocer la disponibilidad de la capacidad para el almacenamiento
de vacunas.
D.
Capacidad en recipientes térmicos de transporte
Para realizar el ejercicio se deben seguir los siguientes pasos:
* Identificar el recipiente térmico a ser utilizado.
* Medir las dimensiones internas del recipiente térmico: Largo, Ancho y Alto en centímetros.
* Calcular el volumen multiplicando: largo x ancho x alto.
Serie: Documentos Técnico Normativos
* El resultado mostrara la capacidad neta de transporte del equipo en cm3 (se expresa en
centímetros cúbicos porque se multiplicó los tres valores con la misma medida), tomando
en cuenta el 50% de la capacidad del equipo para el almacenamiento durante el transporte.
258
Ejemplo para una termo porta vacunas
Se requiere calcular la capacidad neta de almacenamiento de termos porta vacunas para el transporte
de vacunas en actividades extramurales de un Servicio de Salud, para lo cual se debe ejecutar los
siguientes pasos.
* Tomar las dimensiones internas del equipo con un instrumento de medición (flexómetro o cinta
métrica)
* Multiplicar las dimensiones internas registradas del equipo de termo: Largo x Ancho x Alto = 22,0
cm x 18,0 cm x 24,0 cm = 9.504 cm3
* Luego el resultado se lo divide por 1000 cm3 (equivalente a 1 litro): 9.504 cm3 ÷ 1.000 cm3 dando
como resultado 9,5 Litros
* Se debe considerar que en los termos se toma solo el 50 % del total de la capacidad neta para
almacenar las vacunas: es decir que en el ejemplo se tiene únicamente 2,6 Litros como capacidad
neta para el transporte de vacunas.
* Estos pasos se deben repetir en todos los termos que serán utilizados.
Ejemplo para una caja fría de la cadena de frío
Se requiere calcular la capacidad neta de almacenamiento de cajas frías para el transporte de vacunas
desde un PAI departamental a una Coordinación de red, para lo cual se debe ejecutar los siguientes
pasos.
* Tomar las dimensiones internas del equipo con un instrumento de medición (flexómetro o cinta
métrica)
* Multiplicar las dimensiones internas registradas del equipo de transporte: Largo x Ancho x Alto =
49,6 cm x 33,4 cm x 26,4 cm = 43.735 cm3
* Luego el resultado se lo divide por 1000 cm3 (equivalente a 1 litro): 43.735 cm3 ÷ 1.000 cm3
dando como resultado 44 Litros
* Se debe considerar que en estos equipos se toma solo el 50% del total de la capacidad neta para
almacenar las vacunas: es decir que en el ejemplo se tiene únicamente 22 Litros como capacidad
neta para el transporte de vacunas.
* Estos pasos se deben repetir en todos los equipos que se tengan para el transporte.
Recordar que este ejercicio se debe realizar de manera individual a cada termo de manera
continua para conocer la disponibilidad de almacenamiento de vacunas con el fin de
transportarlas de manera segura.
(Los equipos que se encuentran en el catálogo PQS de la OMS cuentan con información
relacionada a la capacidad neta de almacenamiento de cada equipo).
E.
Capacidad en vehículos frigoríficos para transporte de vacunas
Para realizar el ejercicio se deben seguir los siguientes pasos:
* Tomar las dimensiones internas del módulo de frío del vehículo con la ayuda de un
instrumento de medición (flexómetro o cinta métrica).
* Medir las dimensiones internas del módulo de frío del vehículo: largo, ancho y alto en
centímetros.
* Calcular el volumen multiplicando: largo x ancho x alto.
* El resultado mostrara la capacidad neta de almacenamiento del módulo frío en cm3
(se expresa en centímetros cúbicos porque se multiplicó los tres valores con la misma
medida) para esos equipos se toma en cuenta solo el 70% de la capacidad del equipo para
el almacenamiento de las vacunas.
Ejemplo para un camión frigorífico:
Manual Técnico del Programa Ampliado de Inmunización
Se incluyen a camiones, u otros que cuenten con un módulo aislante, con control
termostáticamente por una unidad de refrigeración que garantiza el mantenimiento constante
de la temperatura en rangos establecidos de +2°C a +8°C.
259
Se requiere calcular la capacidad neta de almacenamiento de módulos de fríos de vehículos para el
transporte de vacunas desde un PAI Central a un PAI departamental, para lo cual se debe ejecutar los
siguientes pasos.
* Tomar las dimensiones internas del equipo con un instrumento de medición (flexómetro o cinta
métrica)
* Multiplicar las dimensiones internas registradas del equipo de transporte: Largo x Ancho x Alto
= 5 m x 3,4 m x 2,6 m = 44,2 m3
* Luego el resultado se convierte el resultado en litros, multiplicando el resultado por 1000 litros
(1m3 =1000 litros): 44,2m3 ÷ 1.000 Litros dando como resultado 44.200 Litros
* Se debe considerar que en estos equipos se toma solo el 70% del total de la capacidad neta
para almacenar las vacunas: es decir que en el ejemplo se tiene únicamente 30.940 Litros como
capacidad efectiva para el transporte de vacunas.
* Estos pasos se deben repetir en todos los equipos que se tengan para el transporte.
*
Recordar que este ejercicio se debe realizar de manera individual a cada módulo frío de
cada vehículo, de manera continua para conocer la disponibilidad de almacenamiento de
vacunas con el fin de transportarlas de manera segura.
F.
Preparación y acondicionamiento de paquetes fríos de agua
Para realizar el ejercicio se deben seguir los siguientes pasos:
* Se debe verificar el tipo de equipo que será utilizado, para poder determinar la capacidad
de los paquetes fríos de agua ya sea de 0,4 o de 0,6 Litros dependiendo del termo a utilizar.
* Posteriormente se deben responder las siguientes preguntas:
• ¿Cuál es el volumen de vacuna que se transportará?
• ¿Cuántos equipos de transporte de vacuna serán necesarios?
• ¿Cuál es el número y el volumen de los paquetes fríos de agua para cada modelo de
contenedor térmico?
• ¿Se incluyen en el envío vacunas sensibles a la congelación o al calor?
Serie: Documentos Técnico Normativos
• ¿Cuánto es la duración del viaje o transporte?
260
• ¿Cuál es el clima y perfil de temperatura de las rutas de transporte?
* Los equipos de congelación están destinados únicamente a la producción de paquetes
fríos de agua.
* La capacidad neta de producción de paquetes fríos representa solo el 67% del equipo o
del módulo frío en los refrigeradores verticales o domésticos.
* Realizar el cambio de agua cada 3 meses a los paquetes fríos.
* Llenar el agua hasta la línea indicada en los paquetes de agua.
* Evitar que los paquetes se encuentren por debajo del límite del agua requerido.
Ejemplo capacidad de preparación de paquetes fríos de agua:
* Si se necesitan 10 cajas frías para el transporte de vacunas y cada caja fría necesita 12 paquetes
fríos de 0,6 Litros cada uno.
* Para esto se multiplica 10 cajas frías x 12 paquetes obteniendo el resultado de 120 paquetes de
agua a utilizar, estos 120 paquetes multiplicar x 0,6 Litros para conocer cuál es el peso de estos
120 paquetes, cuyo resultado aproximado es de 72 Litros o equivalentes a 72 Kilogramos por caja
fría que se requerirá para este transporte.
G.
Capacidad de almacén en seco para jeringas y cajas de desecho seguro
Para realizar el ejercicio se deben seguir los siguientes pasos:
* Para calcular la capacidad neta del almacén en seco, es importante considerar que estos
deben contar con estantería metálica de material antioxidante que se encuentren al
menos a 10 cm del piso y a 30 cm de las paredes.
* Obtener el largo, ancho y alto del ambiente
* Expresar el resultado en centímetros cúbicos
* Temperatura ambiente máximo de 22ºC (con aire acondicionado)
Ejemplo capacidad de almacén en seco para jeringas, diluyentes y cajas de desecho seguro
Si se recibirá 24 cajas de jeringas se debe realizar el siguiente procedimiento:
* Obtener las medidas de la caja Largo x Ancho x Alto (0,59 cm x 0,39 cm x 0,33 cm)
* El resultado del ejemplo seria 0,075 cm3 por caja
* Multiplicar 0,075 cm3 x 24 (cantidad de cajas), el resultado es 1,8 m3
* Siendo la capacidad requerida para la cantidad de cajas a recibir 1.8 m3
7.11
ORGANIZACIÓN DE VACUNAS EN EQUIPOS DE LA CADENA DE FRÍO
A.
Cámaras frías
La distribución de estantes de acero inoxidable dentro de las cámaras debe colocarse
separados de las paredes de los equipos.
* Las vacunas sensibles a la congelación como: pentavalente, dT, Hepatitis B, VPH, IPV,
Rotavirus, Influenza, neumococo, y las vacunas COVID-19 (Sinopharm, Astrazéneca y
Janssen) deben mantenerse en sus empaques secundarios.
• Almacenar en las divisiones de los estantes, dejando un espacio libre para la circulación
de aire frío entre las columnas de los empaques de vacunas. No deben estar pegados
a las paredes de la cámara.
• No almacenar en la parte superior del estante ni cerca del evaporador.
• El espacio entre caja y caja no debe ser menor 2cm.
Manual Técnico del Programa Ampliado de Inmunización
Las vacunas deben almacenarse de acuerdo a normativa establecida de almacenamiento, en
un rango de temperatura entre +2°C a +8°C, de acuerdo al tiempo y al nivel de la cadena de frío
ya expuesto cuadro de temperatura y tiempo de conservación de las vacunas.
261
* Las vacunas sensibles al calor como la SRP, FA, BCG, SR y bOPV deben cumplir las
siguientes recomendaciones:
• Almacenar en los estantes dejando un espacio libre para la circulación de aire frío, no
pegadas a las paredes de la cámara.
• El espacio entre caja y caja no debe ser menor 2cm
• Solo en el nivel central las vacunas bOPV pueden almacenarse a temperaturas hasta
-25°C.
B.
Refrigeradores
Serie: Documentos Técnico Normativos
* En los refrigeradores verticales de apertura frontal (Convencional), se deben realizar los
siguientes pasos:
262
* Colocar paquetes fríos con tapa de rosca, cubriendo el 67% de la capacidad neta en el
evaporador; deben estar ubicados de forma vertical con un espacio de 5 cm entre cada
paquete de agua; estos paquetes permitirán que se mantenga la temperatura en caso de
cortes de energía eléctrica.
* Nunca colocar vacunas o diluyentes en la puerta, puesto que se encuentran expuestas a
temperatura ambiente cada vez que ésta es abierta.
* Nunca colocar vacunas sensibles a la congelación, en contacto directo o cerca de la placa
del evaporador del refrigerador.
* En la primera división (Contando de arriba para abajo), ordenar en canastillos plásticos,
las vacunas sensibles al calor (BCG, bOPV, SRP, SR, FA), garantizando que exista flujo de
aire frío; y colocar el termómetro 1 sobre la vacuna.
* En la segunda división (Contando de arriba para abajo), ordenar en canastillos plásticos,
las vacunas sensibles a la congelación (Pentavalente, dT, Hepatitis B, Influenza, Rotavirus,
Neumococo, VPH, IPV), garantizando que exista flujo de aire frío; y colocar el termómetro
2 sobre la vacuna.
* En la tercera división (Contando de arriba para abajo), debe ordenarse los diluyentes, bien
identificados y de acuerdo a la vacuna que corresponda.
* Colocar 8 paquetes fríos de agua con tapa rosca en la parte inferior del refrigerador, con
el fin de estabilizar la temperatura cuando existan cortes de energía eléctrica y capturas
constantes de la puerta y deben estar ordenados de forma vertical con un espacio de 5
cm. uno del otro; en caso de existir un soporte de vidrio o bandejas en este espacio, deben
ser retirados para que no impidan la circulación del aire frío.
Recordatorio
El refrigerador es de uso exclusivo para la conservación de las vacunas y diluyentes
del Programa Ampliado de Inmunización.
Todas las vacunas deben ser almacenadas en canastillos fuera de las cajas
primarias.
La única vacuna que puede ser almacenada en su caja primaria es la Rotavirica por
su sensibilidad a la luz, además de que vienen en la presentación de jeringuillas
prellenadas.
Organización correcta de vacunas en refrigeradores verticales
Manual Técnico del Programa Ampliado de Inmunización
Para refrigeradores con apertura horizontal (Precalificados) se deben realizar los siguientes
pasos:
263
* Al contar con una pared de hielo, que viene de fábrica no se requieren incluir paquetes
fríos adicionales para la estabilización de la temperatura, en caso de cortes de energía
eléctrica.
* En la primera división (Contando de abajo para arriba), ordenar en canastillos plásticos
las vacunas sensibles al calor (BCG, bOPV, SRP, SR, FA), garantizando que exista flujo de
aire frío. Colocar el termómetro 1 sobre la vacuna.
* En la segunda división (Contando de abajo para arriba), ordenar en canastillos plásticos,
las vacunas sensibles a la congelación (Pentavalente, dT, Hepatitis B, Influenza, Rotavirus,
Neumococo, VPH, IPV garantizando que exista flujo de aire frío. Colocar el termómetro 2
sobre la vacuna.
* Se recomienda la utilización de termómetros digitales, para el uso exclusivo en estos
refrigeradores.
Recordatorio
Nunca colocar vacunas sensibles a la congelación en el fondo del refrigerador con
fuente de energía a gas (GLP) o al lado del compartimiento del congelador, debido
a que estas áreas tienen alto riesgo de congelar la vacuna.
Recordatorio
No es necesario incluir paquetes fríos de agua adicionales, en la parte inferior de
los refrigeradores horizontales (Precalificados)
Los paquetes fríos que vienen de fábrica, ubicados en las paredes de estos
refrigeradores, no deben ser retirados, por ningún motivo, por el personal de salud.
7.12
PREPARACIÓN PARA EL TRANSPORTE DE VACUNAS
7.12.1 Termos porta vacunas
Serie: Documentos Técnico Normativos
Según el tipo, calidad y manejo, los termos pueden mantener y conservar las vacunas por
lapsos de 4 a 24 horas, con el número de paquetes fríos de agua adecuados a cada termo.
264
El calor extremo influye en la temperatura interna en forma acumulativa, por lo que no se debe
poner el termo en contacto directo con los rayos solares; mantenerlos en lugar fresco, seco
y en sombra. Si amerita, se puede colocar una tela húmeda sobre el termo para mantenerlo
fresco, la misma debe ser humedecida y exprimida para que no se caliente.
Es importante la preparación del termo para garantizar el poder inmunológico de las vacunas,
para esto, se debe seguir los siguientes pasos.
Paso
1:
Sacar los paquetes fríos de agua del
congelador, colocar sobre una mesa y
esperar hasta que desaparezca el hielo de
la superficie; agitar los paquetes fríos hasta
escuchar que el agua se mueve levemente,
verificar que exista presencia de agua y
hielo en su interior, secarlos previamente y
ubicarlos en las cuatro paredes del termo.
Paso
2:
Colocar un pocillo o botella plástica cortada
en el termo y dentro de este el termómetro,
tapar el termo y esperar de 10 a 15 minutos
con el fin de estabilizar la temperatura.
Su finalidad es que los frascos de las vacunas
no entren en contacto directo con los paquetes
fríos y evitar que se remojen sus etiquetas.
Paso
3:
Recipientes térmicos de transporte del nivel departamental a las coordinaciones
de red o cabecera (s) de municipio
Sacar los paquetes fríos de agua del congelador, colocarlos sobre la mesa y esperar hasta que
desaparezca el hielo de la superficie; agitarlos hasta escuchar que el agua se mueve levemente
verifique que exista presencia de agua y hielo en su interior. Debe secarlos previamente y
ubicarlos en las cuatro paredes del equipo térmico.
Luego se debe verificar que la temperatura del paquete frío se encuentre en el rango de
+2°C.
El cumplimiento de esta preparación garantiza la conservación de las vacunas, por un lapso
aproximado de 24 horas, independientemente de la temperatura ambiente.
Manual Técnico del Programa Ampliado de Inmunización
Luego de verificar que la temperatura
se encuentre en el rango entre +2°C,
colocar las vacunas y el termómetro
en el pocillo, cerrar el termo y registrar
la temperatura en la hoja de monitoreo.
El termo debe ser únicamente abierto en
el momento de la vacunación, realizando
el control y registro estricto en la hoja de
temperatura (En servicio al inicio y final
de la jornada, en actividad extramural al
inicio, a la mitad y al finalizar la jornada).
Queda
estrictamente
PROHIBIDO
sentarse
sobre
los
termos
en
las
jornadas de vacunación o pisarlos, ni dentro ni fuera del servicio de salud.
265
Colocar las cajas secundarias, en el recipiente térmico de transporte, tapar el recipiente y
esperar de 10 a 15 minutos, con el fin de estabilizar la temperatura dentro del recipiente.
Verificar que la temperatura se encuentre en el rango de +2°C a +8°C, debiendo ser
registrado en la hoja de control de temperatura en el momento del envió y en la recepción.
Los almacenes departamentales y municipales, deben garantizar el transporte,
ininterrumpido, adecuado y oportuno, de acuerdo a normativa establecida para garantizar
la conservación de las vacunas y éstas no pierdan su potencia inmunológica.
Recuerde: se debe realizar monitoreo de la temperatura en el momento del envío y
de la recepción
CUIDADOS ESENCIALES Y USO CORRECTO DE LOS EQUIPOS 7.13
DE LA CADENA DE FRÍO Para preservar y garantizar la vida útil de los equipos de la cadena de frío y ahorrar el
consumo de energía eléctrica, se debe considerar los siguientes aspectos para una correcta
manipulación y prevenir posibles fallas:
7.13.1
Refrigeradores
A.
Ubicación
Los equipos de refrigeración deben ser instalados en ambientes frescos, libres de polvo y
de la tierra; bien ventilados, en sombra, alejados de toda fuente de calor, con el techo y las
paredes fáciles de lavar, con alto grado de limpieza, libre de roedores e insectos, con aire
acondicionado en climas tropicales o fríos, que superan los rangos entre +15°C a +25°C y
otros requerimientos de acuerdo con normativa nacional vigente.
Serie: Documentos Técnico Normativos
El refrigerador, debe estar a una distancia mínima de 15 cm de la pared y a más de 50 cm
del techo; sobre una tarima de madera resistente (si el equipo no cuenta con ruedas) tratada
266
con sustancias antitermitas y antihongos, que tenga una altura de 15 a 20 cm. para que
exista mayor circulación de aire y prevenir la oxidación. El servicio de salud, debe considerar
realizar mantenimientos periódicos del refrigerador y de las tarimas, principalmente en climas
húmedos; para evitar su deterioro prematuro.
El refrigerador debe estar bien nivelado, para que su funcionamiento sea el adecuado y así
evitar que el equipo se dañe. Una forma sencilla de comprobar si existe algún desnivel en la
posición del refrigerador, es colocar sobre éste, un vaso o botella con agua coloreada. Si el
agua presenta una superficie horizontal, es debido a que el refrigerador está en la posición
correcta, en caso contrario, se deberá nivelar.
B.
Estabilizadores de temperatura
No se debe abrir la puerta del refrigerador innecesariamente. Pruebas realizadas a una
temperatura ambiente de +30°C, con la puerta abierta durante 3 minutos, mostraron que
un refrigerador puede tardar en recuperar su temperatura interna en una hora. Al utilizar
estabilizadores de temperatura, este tiempo se reduce.
En los refrigeradores horizontales precalificados, no se requiere colocar los paquetes fríos, ya
que su diseño los incluye en sus paredes internas.
C.
Control de temperatura
El control de temperatura, debe realizarse dos veces al día al ingreso en la mañana y a la
salida por la tarde; al finalizar la jornada laboral los 7 días de la semana, los 365 días del año;
incluidos los fines de semana, días festivos y feriados, utilizando dos termómetros, uno en la
división superior y el otro en la inferior.
Cuando se registren temperaturas de riesgo, es decir fuera del rango +2°C a +8°C, se regulará
la perilla del termostato; los refrigeradores utilizan este instrumento para controlar la
temperatura en los compartimientos del refrigerador y congelador, utilizando una perilla con
una numeración de 0 al 9 marcado con rayas o líneas.
Manual Técnico del Programa Ampliado de Inmunización
Por ello en la parte inferior de los refrigeradores verticales u horizontales (no precalificados) se
debe colocar paquetes fríos de 0,4 o 0,6 litros de acuerdo a la capacidad del equipo, separados
a 5 cm el uno del otro en posición vertical (el agua debe ser cambiada cada 3 meses).
267
Para la regulación del termostato, se debe girar la perrilla suavemente a un número mayor,
esto hará que la temperatura pueda estabilizarse de manera paulatina. El control de este
procedimiento, se debe realizar con dos termómetros analógicos ubicados en la división
superior e inferior del equipo, con intervalos de 15 minutos durante 1 hora, hasta la verificación
de que se encuentra en el rango de +2°C a +8°C.
No realizar movimientos bruscos de la perilla, para evitar el deterioro del mecanismo del
termostato. Colocar cinta adhesiva sobre el termostato para evitar que este sea movido,
registrar la fecha de regulación del termostato en la hoja de vida del refrigerador y si fuera
necesario, comunicar al inmediato superior para que el refrigerador sea revisado por un
técnico.
Serie: Documentos Técnico Normativos
D.
268
Medidas cuando la temperatura del refrigerador está fuera de rango
Si la temperatura del refrigerador se encuentra por debajo de +2°C, se debe elaborar un
informe al inmediato superior, con carácter de alta prioridad; además de realizar las siguientes
acciones correctivas:
* Gire gradualmente la perilla del termostato, esto hará que el refrigerador suba su
temperatura, poco a poco, hasta estabilizarlo.
* Comprobar si la puerta del congelador se cierra correctamente; si la empaquetadura se
encontrara dañado o roto, se debe contactar inmediatamente al técnico, para hacer la
reparación o el cambio de la pieza.
* Si la temperatura ha descendido por debajo de 0°C, comprobar si las vacunas fueron
expuestas a la congelación, aplicando la prueba de agitación. Posteriormente se debe
colocar las vacunas en conservadores o en otro equipo de almacenamiento, que garantice
las temperaturas recomendadas.
Si la temperatura es superior a +8°C, se debe informar inmediatamente, a la autoridad superior
correspondiente, realizando un informe técnico con fotografías y medios de verificación. En
este caso, las acciones correctivas incluyen los siguientes pasos:
* Asegúrese que el refrigerador esté funcionando; si no funciona, verifique si la fuente de
alimentación (electricidad, gas o solar) se encuentra en condiciones adecuadas.
* Comprobar si la puerta del refrigerador o el compartimiento de congelación se cierren
correctamente. Si la empaquetadura de goma de la puerta del refrigerador está en mal
estado, la temperatura fluctuará, en ese caso, se deberá contactar con un técnico, para
que realice la reparación del mismo.
* Si existiera exceso de hielo en el compartimento de congelación, se debe descongelar y
limpiar el refrigerador, ya que esto evita que el aire frío circule al compartimento frigorífico.
* Si la temperatura no puede mantenerse en el rango de +2°C y +8°C, trasladar las vacunas
a otro equipo de cadena de frío que pueda mantener este rango de temperatura hasta que
el refrigerador esté reparado.
En los refrigeradores horizontales Icelined (Pared de hielo) no es posible regular
el termostato, este equipo es regulado por la fábrica. Si fuese necesario regular la
temperatura, debe ser realizado por un técnico calificado.
7.13.2
Registro de control de la temperatura
Registrar la temperatura de ambos termómetros (superior e inferior), al ingresar por la mañana,
y al finalizar la jornada laboral por la tarde durante los 365 días del año incluidos fines de
semana y feriados. Se debe utilizar la hoja de control de la temperatura.
Manual Técnico del Programa Ampliado de Inmunización
IMPORTANTE
269
Fuente: PAI / MSyD.
No olvide: El personal de salud del vacunatorio, conjuntamente con miembros del
nivel superior, cada fin de mes, deben realizar un análisis de los registros, para
identificar si se presentaron temperaturas de riesgo en el refrigerador. De ser así, se
deben identificar las posibles causas y la implementación de acciones correctivas
inmediatas. El llenado del registro de los equipos, debe ser correcto y completo, con
el visto bueno del inmediato superior, con la elaboración de un acta de respaldo.
Serie: Documentos Técnico Normativos
Estas hojas deben colocarse dentro de una funda plástica transparente, para
evitar su deterioro; debiendo ser, posteriormente, archivadas y conservadas por un
periodo de 5 años.
7.13.3
Hoja de vida del equipo
Es un instrumento técnico para registrar la frecuencia con la que se efectúa la limpieza y el
mantenimiento preventivo o correctivo; tiene la finalidad de registrar actividades que prolongan
la vida útil del equipo y velar por su funcionamiento en óptimas condiciones. De esta manera,
se garantiza la calidad de conservación de las vacunas y su potencia inmunológica. Esta hoja,
debe ser llenada por el personal a cargo, de manera completa y correcta, con letra legible sin
tachaduras ni borrones.
Para el cumplimiento de esta normativa, se deben realizar las siguientes actividades:
a. Limpieza interna del gabinete (LI).
b. Limpieza externa del equipo (LE).
270
c. Cuidados esenciales (CE).
d. Mantenimiento correctivo (MC).
Fuente: PAI / MSyD.
a.
Control de temperatura en termos porta vacunas
Monitoreo de temperatura en los termos porta vacunas, en actividades
dentro y fuera de servicio
Se debe realizar el monitoreo y registro de temperatura de los termos porta vacunas al inicio,
a la mitad y a la conclusión de la jornada (6 horas), en el formulario establecido (Ver anexo).
Estos registros de temperatura de cada termo deben ser archivados por el lapso de 1 año de
acuerdo a código asignado.
Manual Técnico del Programa Ampliado de Inmunización
7.13.4
271
Al finalizar las sesiones de vacunación, el personal de salud debe seguir la política de frascos
abiertos, que significa:
* Desechar los viales abiertos de vacunas que hayan sufrido algún tipo de contaminación o
daño por mala manipulación; realizando un informe al inmediato superior.
* Almacenar los viales no utilizados en el refrigerador, éstas deben ser las primeras en ser
utilizadas, en la próxima sesión de vacunación.
B.
Conservación de la temperatura correcta en cajas frías
Para mantener la temperatura correcta, en los equipos de transporte y conservación de
vacunas, se debe realizar lo siguiente:
* Colocar el número y tipo correctos de paquetes fríos de agua, adecuadamente
acondicionados en las cajas frías.
* Mantener la caja fría en la sombra y en lugar fresco.
* Se debe mantener la temperatura en un rango constante de +2°C a +8°C.
C.
Limpieza de los termos porta vacunas
Para la limpieza de los termos porta vacunas se debe considerar:
* Retirar las vacunas, diluyentes y paquetes fríos de agua, guardándolas en el refrigerador.
* Limpiar bien las partes internas y externas con agua jabonosa y con un paño suave.
Serie: Documentos Técnico Normativos
* Secar los termos por dentro y por fuera, con un paño seco suave absorbente.
272
* Los termos deben guardarse abiertos y colocados en posición horizontal con la tapa
encima, para facilitar el secado.
* Los termos deben ser almacenados sobre estantes, nunca en el piso.
* Limpiar los termos al finalizar cada jornada de trabajo.
7.13.5
Paquetes fríos de agua
Estos deben ser limpiados de acuerdo a las siguientes recomendaciones:
* Limpiar los paquetes fríos con agua, al término de cada jornada de trabajo o transporte.
* Limpiar de manera prolija, la parte externa de los paquetes, con agua jabonosa y un paño
suave.
* Secar con un paño absorbente la parte externa.
* Guardar los paquetes fríos de agua con tapa rosca, boca arriba y en posición vertical en
un estante. Nunca en el piso.
* El agua debe cambiarse cada 3 meses, y llenada hasta el límite indicado en cada envase,
para evitar que se dañe cuando se congelen.
7.13.6
Termómetros
Son instrumentos muy importantes y sensibles; útiles para el monitoreo y control de la
temperatura en los equipos de la cadena de frío, por lo que el personal de salud, debe tener un
especial cuidado.
El personal responsable de la supervisión capacitante, debe llevar a los establecimientos
dos termómetros debidamente calibrados, para compararlos con los termómetros que se
encuentran en los refrigeradores de los establecimientos.
Si existiese alguna diferencia en el registro, se debe informar al inmediato superior, para que
sean reemplazados a la brevedad posible.
En la columna de observaciones de la hoja de temperatura del equipo frigorífico, se debe
registrar el cambio del termómetro.
a. Lectura correcta del termómetro:
b. El termómetro de alcohol, nunca debe tomarse de la parte inferior donde se encuentra el
bulbo (sensor), porque modifica la temperatura registrada, por la transmisión de calor de
nuestro cuerpo al termómetro.
Limpieza de termómetros:
a. Se deben limpiar periódicamente con agua jabonosa al finalizar la jornada y cada semana.
b. Secar con un paño absorbente
Estas limpiezas se deben realizar cada semana y al finalizar las jornadas de trabajo extramural.
Se recomienda gestionar con los gobiernos departamentales, municipales y los
seguros a corto plazo, la compra de termómetros digitales para el monitoreo
continuo de la temperatura.
Manual Técnico del Programa Ampliado de Inmunización
c. Para observar la temperatura del termómetro, se debe tomar de la parte superior en forma
perpendicular a la visión del observador, por un lapso de 2 a 4 segundos.
273
7.14
Cuidados del generador de energía eléctrica
Para un buen funcionamiento y conservación del generador de energía eléctrica, se deberá
cumplir las siguientes medidas:
* Debe funcionar una vez a la semana, durante una hora.
* El combustible debe estar con un mínimo del 80% de su capacidad.
* Realizar el mantenimiento preventivo semanalmente (revisión de niveles y limpieza).
Serie: Documentos Técnico Normativos
7.14.1
274
Cuidados de seguridad
Instalación a tierra
Para evitar descargas eléctricas, todo establecimiento de
salud debe contar con un sistema de instalación a tierra,
para proteger a los refrigeradores de posibles descargas.
Contaminantes
En el ambiente donde se encuentra el refrigerador, no
deben existir objetos contaminantes, líquidos, orgánicos,
equipos en desuso y materiales inflamables como
gasolina, diesel, kerosene, garrafas de gas (GLP) y otros.
Estabilizador de voltaje
Para proteger el refrigerador de cambios de voltaje
de la red eléctrica, se debe utilizar un estabilizador
de voltaje de 1.000 a 1.500 watts como mínimo.
Interruptores térmicos
En las instalaciones eléctricas de los refrigeradores
de
conservación
de
vacunas,
se
recomienda
el uso de interruptores térmicos, para prevenir
daños a causa de corto circuitos o sobrecarga.
Toma corriente adecuados
No utilizar tomacorrientes múltiples para los refrigeradores.
La alimentación de energía eléctrica debe realizarse
por medio de tomacorrientes adecuados, para evitar
problemas de conexión o sobre calentamientos.
Transporte de los
refrigeradores
Se deben transportar en posición vertical para prevenir
daños. Una vez que llegue a su destino, es necesario
esperar 72 horas para ponerlo en funcionamiento.
Refrigeradores no
utilizados
Los refrigeradores que no se utilicen deben ser conectados y
puestos en funcionamiento, de 20 a 30 minutos una vez al mes.
De
esta
manera
se
evita
la
condensación
del
gas
y
la
obstrucción
del
condensador
Revisión de empaque de la
puerta
Revisar periódicamente la empaquetadura de la puerta,
colocando una tira de papel entre el marco y la puerta.
Una vez cerrada la puerta, jalar la tira de papel.
Si
esta
sale
fácilmente
o
se
cae,
indica
que
el
empaque
está
dañado.
En este caso, llamar al técnico que hará un ajuste,
de todo el marco de la puerta; especialmente en las
esquinas, para evitar la fuga de aire frío del refrigerador.
Manual Técnico del Programa Ampliado de Inmunización
275
Serie: Documentos Técnico Normativos
Descongelamiento del
refrigerador
276
2 dos tipos:
Refrigerador con escarcha.
Refrigerador con hielo seco.
En los refrigeradores que hacen escarcha, cuando el grosor
del hielo del congelador sobrepase los 5 mm (milímetros)
se debe realizar:
Descongelamiento, porque el hielo evita su buen
funcionamiento y esto hace que requiera más energía
eléctrica, acortando su vida útil y corriendo el riesgo de
que las vacunas no se encuentren dentro de los rangos de
temperatura establecidos.
Para descongelar el refrigerador se deben retirar las
vacunas a otro refrigerador o termo, posteriormente se debe
desenchufar el equipo durante 12 horas aproximadamente.
Se debe realizar la limpieza por dentro y fuera, con un paño
húmedo y luego secar con un paño seco (sin mover el
termostato). Enchufar el refrigerador eléctrico y, después de
una hora de funcionamiento, se debe verificar la temperatura
y que se encuentre en rangos de +2º a +8º C.
Finalmente, colocar las vacunas de acuerdo a normativa.
Los refrigeradores que no hacen escarcha, se deben
descongelar cada 3 meses, desconectándolos del
tomacorriente por un día.
OJO:
¡NUNCA
UTILIZAR
INSTRUMENTOS
CORTO
PUNZANTES
NI
AGUA
CALIENTE
PARA
DESCONGELAR
EL
EQUIPO!
Los refrigeradores a frío seco presentan problemas
con la acumulación de hielo en el evaporador mismo
que se encuentra en el ventilador. Por lo cual para la
descongelación debe tomarse 3 días como mínimo en
zonas altiplánicas y 1 día para zonas del trópico cada 6
meses y de esta manera asegura el buen funcionamiento.
Mantenimiento preventivo y El establecimiento de salud que cuente con equipo
correctivo
de refrigeración, debe programar la visita del
técnico por lo menos, dos veces al año para que
realice el mantenimiento preventivo del equipo.
El
mantenimiento
correctivo
debe
realizarse
de acuerdo a la falla que presente el equipo.
OJO: ¡DEBE SER REALIZADO POR UN TÉCNICO
ACREDITADO, NO POR EL PERSONAL DE SALUD!
Esta actividad debe estar insertada en el POA correspondiente.
No poner ningún objeto
sobre el refrigerador
Manual Técnico del Programa Ampliado de Inmunización
No colocar objetos sobre el refrigerador, porque
deterioran
las
empaquetaduras
y
obstaculizan
la
circulación
de
aire;
produciendo
el
mal
funcionamiento del refrigerador y el daño del equipo.
Contar con un extintor de
El establecimiento de salud, debe contar con un
incendio certificado
extintor de fuego, con su carga vigente (debe ser
recargado cada año, verificar fecha de expiración).
Debe
estar
ubicado
en
un
lugar
visible,
debidamente
señalizado
y
de
fácil
acceso.
El personal de salud debe conocer su uso correcto.
Se recomienda el uso de extintores de clase A, B y C.
La
adquisición,
reemplazo
y
recarga
debe
ser
inscrito
en
el
POA
correspondiente.
Contar con mangueras
Las mangueras y válvulas de conexión de las garrafas de los
adecuadas para conexión de equipos frigoríficos que funcionan a gas (GLP), deben ser
gas (GLP)
de goma convencional de alta resistencia con un regulador
de consumo de gas y una llave de paso en forma de L.
Las
mangueras
y
válvulas
de
conexión
de
gas, deben ser reemplazadas una vez al año.
La adquisición o reemplazo debe ser inscrito en el POA
del nivel correspondiente y en los seguros a corto plazo.
277
Cuidado de hoja de vida del
equipo
La hoja de vida del equipo, control de temperatura y plan
de contingencia, deben ser colocados en fundas plásticas
transparentes y pegadas en un lugar visible y de fácil acceso.
Deben ser archivadas por cinco años y el informe
técnico de análisis anual de funcionamiento del
equipo de por vida para efectos de control posterior.
Cambio de refrigeradores
Se recomienda que en el lapso de 5 a 8 años
los
refrigeradores
sean
renovados,
cumpliendo
especificaciones
técnicas
precalificadas.
Los refrigeradores que utilicen los gases refrigerantes 134a,
404a, 410a son los recomendados, por no ser contaminantes;
si algún establecimiento tiene refrigeradores que usen gases
diferentes a éstos deberán ser renovados a la brevedad
posible por su alto grado de contaminación medioambiental.
Los
recursos
para
este
fin
deben
ser
inscritos en el POA del nivel correspondiente.
7.15
Inventario de equipos de la cadena de frío
La gestión del inventario, incluye elaborar y actualizar los registros de todos los equipos,
herramientas y repuestos en uso, haciendo un inventario (Ver anexo). Un buen inventario de
equipos brinda información importante para programar el mantenimiento y reemplazo.
Los registros deben incluir:
Serie: Documentos Técnico Normativos
* Información técnica: marca, modelo, número de serie, año de producción, fecha de ingreso
al servicio de salud, fecha proyectada para su reemplazo y fecha de cambio final.
* Localización especifica.
* Condición actual: funcionando, en reparación y fuera de servicio.
Para facilitar la gestión y el inventario del equipo de la cadena de frío, los Servicios
Departamentales de Salud, los Gobiernos Autónomos Municipales y servicios de salud, deben
realizar y actualizar el inventario de cadena de frío de manera trimestral y realizar reportes a
nivel municipal/coordinación de red; de forma trimestral al nivel departamental y semestral
a nivel nacional (junio y diciembre); por conducto regular, en medio físico y electrónico
acompañado de fotografías y documentos de respaldo.
Que consisten en:
* Informe técnico
278
* Informe legal
* Resolución del nivel correspondiente de dependencia.
Aun con el mejor de los cuidados, todo equipo se deteriora o queda obsoleto con el tiempo.
Para evitar interrupciones en los servicios de vacunación, se requiere planificar el reemplazo
oportuno de los equipos.
Cuando el equipo sea dado de baja o sustituido se deben hacer las gestiones administrativas
necesarias para tener constancia. El mismo que debe ser detallado en el inventario de cadena
de frío.
En la actualidad, para consultar especificaciones técnicas de equipos y dispositivos que se
utilizan en la cadena de frío, se recomienda el uso del catálogo de Desempeño, Calidad y
Seguridad (PQS por sus siglas en inglés) de la OMS1 que precalifica estos, para que los estados
miembros y las agencias de compras de la Organización de Naciones Unidas (ONU2) estén
seguros de su idoneidad para su uso en programas de inmunización. El catálogo es elaborado
y revisado por el grupo de Calidad, Seguridad y Normas del departamento de Inmunización,
Vacunas y Productos Biológicos de la OMS en Ginebra-Suiza. Este catálogo reemplaza al
manual “PIS” de productos de la OMS/UNICEF siendo su última edición, en la gestión 2000.
Este documento y las hojas de datos individuales de los productos se encuentran disponibles
en Internet en el siguiente enlace:
https://apps.who.int/immunization_standards/vaccine_quality/pqs_catalogue/index.aspx
No existe una versión impresa y, lastimosamente, solo se dispone en idioma inglés. El
catálogo se renueva de manera periódica, para garantizar que la información que contiene
esté actualizada.
Tabla N°25: Equipos precalificados
CODIGO PQS
DESCRIPCIÓN EN INGLES
DESCRIPCIÓN EN ESPAÑOL (1)
1
La OMS es la autoridad directiva y coordinadora de la acción sanitaria en el sistema de las Naciones
Unidas. Es la organización responsable de desempeñar una función de liderazgo en los asuntos sanitarios
mundiales, configurar la agenda de las investigaciones en salud, establecer normas, articular opciones de
políticas basadas en la evidencia, prestar apoyo técnico a los países y vigilar las tendencias sanitarias mundiales.
https://www.un.org/youthenvoy/es/2013/09/oms-organizacion-mundial-de-la-salud/
2
Las Naciones Unidas nacieron oficialmente el 24 de octubre de 1945, después de que la mayoría de los
51 Estados Miembros signatarios del documento fundacional del Organización, la Carta de la ONU, la ratificaran.
En la actualidad, 193 Estados son miembros de las Naciones Unidas, que están representados en el órgano
deliberante, la Asamblea General. Siendo parte de este organismo internacional el Estado Plurinacional de
Bolivia. https://www.un.org/es/sections/about-un/overview/index.html
Manual Técnico del Programa Ampliado de Inmunización
El sitio web del PQS proporciona documentos, procedimientos y hojas de datos relevantes
para todos los productos precalificados, actualizados de manera periódica, contando con las
siguientes categorías de equipos:
279
1
E001
Cold rooms, freezer rooms,
and related equipment
Cámaras de frío, congeladores
y equipos relacionados.
E002
Refrigerated vehicles
Vehículos refrigerados
E003
Refrigerators and freezers
Refrigeradores y congeladores
E004
Cold boxes and vaccine carriers
Cajas frías y termos porta vacunas
E005
Coolant-packs
Paquetes fríos
E006
Temperature monitoring devices
Dispositivos de monitoreo
de temperatura
E007
Cold chain accessories
Accesorios de cadena de frío
E008
Injection devices for immunization
Dispositivos de inyección
para inmunización
E010
Waste management equipment
Equipos de gestión de residuos
E013
Injection devices for
therapeutic purposes
Dispositivos de inyección
para fines terapéuticos
Se realizó la traducción con el fin de brindar orientación.
7.16
Actividades de gestión en cadena de frío
* Se debe programar, de manera permanente en el POA local lo siguiente:
• Adquisición de equipamiento complementario para los equipos de la cadena de frío.
• Mantenimiento preventivo y correctivo de los equipos de refrigeración.
• Compra de equipos (precalificados) para el recambio de los que cumplieron su vida útil.
• Dotación de ropa de trabajo para el personal de salud del área.
• Capacitación continua a los recursos humanos.
Serie: Documentos Técnico Normativos
• Compra de estabilizadores, cada equipo de la cadena de frío debe contar con el mismo.
280
• Compra de equipo para facilitar la manipulación de carga (trans palet).
• Prever gastos logísticos de transporte de vacunas e insumos.
* Realizar el diagnóstico del estado de los equipos de cadena de frío para la toma de
decisiones.
* En los Comités de Análisis de Información (CAI) municipal, informar el estado del
funcionamiento y la capacidad de almacenamiento de los equipos de cadena de frio
* El Ministerio de Salud y Deportes y los Gobiernos Autónomos deben garantizar el traslado
de las vacunas, jeringas e insumos por los diferentes niveles, nacional, departamental,
coordinaciones de Red, municipio, y a los establecimientos de salud.
* Los Municipios deben garantizar ambientes exclusivos y adecuados para la cadena de
frío y el vacunatorio según norma del PAI.
* Realizar estudios locales en todos los niveles de mapeo de temperatura para fortalecer el
manejo de cadena de frio.
* Garantizar la capacidad de almacenamiento suficiente y necesario para vacunas jeringas
e insumos
* Implementar el uso de monitores de congelación para vacunas sensibles a la congelacion
y sensibles al calor para el transporte en zonas críticas donde se requiera.
* Coadyuvar en la gestión para la eliminación de desechos sanitarios correspondientes a la
vacunación a nivel municipal (Ver capitulo II disposicion final segura).
* Conocer la capacidadbruta y neta para garantizar el almacenamiento de las vacunas , en
todos los niveles
* Elaborar planes de reemplazo de equipos de la cadena de frío de manera progresiva en
todos los niveles.
* Elaborar planes de mantenimiento preventivo y correctivo para la infraestructura,
equipamiento de los almacenes y vacunatorios.
7.17
Plan de emergencia
Cada establecimiento debe elaborar un plan de emergencia, de acuerdo al equipo de cadena
de frío que disponga.
¡IMPORTANTE!
Cada Establecimiento de Salud, que cuente con un vacunatorio, debe tener un plan
de emergencia detallado, de acuerdo a su nivel de atención y cobertura de acción.
7.18
7.18.1
Algunos desperfectos más comunes y su solución
Refrigeradores eléctricos (Compresión)
Manual Técnico del Programa Ampliado de Inmunización
Este debe ser detallado, actualizado y visible, y deben estar registrados los datos de las
personas responsables, sus direcciones, números de teléfono y celulares, con el fin de
garantizar la cadena de frío. Este plan también debe contener el procedimiento para el traslado
de las vacunas en termos o recipientes térmicos al establecimiento de salud más cercano,
con carácter de alta prioridad.
281
Desperfecto
Qué hacer
Si la temperatura del
equipo frigorífico está
igual o mayor a +8ºC.
Si la temperatura del
equipo frigorífico está igual
o por debajo de +2ºC.
*
*
*
*
Serie: Documentos Técnico Normativos
7.18.2
282
Verificar la conexión del equipo al suministro eléctrico.
Verificar
la
regulación
del
termostato.
Realizar la prueba de verificación del termómetro
Monitorear
el
equipo
cada
hora,
hasta
estabilizar
la
temperatura.
* En caso de no poder estabilizar la temperatura,
preparar los termos de transporte con los
respectivos paquetes fríos de agua y trasladar las
vacunas al establecimiento de salud más próximo.
* Llamar
a
un
técnico
calificado.
* Sellar con cinta adhesiva la puerta del refrigerador, para
conservar la temperatura de las vacunas y registrar en la
hoja de temperatura la fecha y la hora de la falla del equipo.
Refrigeradores a gas/GLP (Absorción)
Desperfecto
Qué hacer
Fallas en el refrigerador
a gas/GLP.
* Verificar
el
estado
del
equipo
de
conexión
(manguera
y
válvula
de
paso).
* Verificar que la garrafa de reserva esté llena y conectada.
* Si no se pudiera contar con la garrafa de reserva, se debe
sellar con cinta adhesiva la puerta del refrigerador para
conservar la temperatura de las vacunas y registrar en la
hoja de temperatura la fecha y la hora de la falla del equipo.
* Si después de este periodo, continúa la falla del equipo, las
vacunas deben ser trasladadas en termos o recipientes
térmicos, al establecimiento de salud más próximo.
Otro tipo de fallas técnicas
* Verificar
la
temperatura
del
termómetro
dentro
del
equipo
de
cadena
de
frío.
* Revisar
si
aún
hay
gas.
* Verificar
el
visor
de
la
llama
para
cerciorarse
de
que
aún
esté
encendida.
* Cuando la llama es azul, el funcionamiento es normal,
si la llama es roja, se debe a la acumulación de hollín
que altera el correcto funcionamiento del equipo.
7.18.3
Refrigeradores fotovoltaicos (Energía Solar)
Como se mencionó anteriormente, estos equipos se utilizan en lugares con poca accesibilidad
y que no tienen energía eléctrica, ni posibilidades de utilizar gas/GLP.
Desperfecto
Qué hacer
Fallas en el sistema del
equipo fotovoltaico (solar).
* Sellar con cinta adhesiva la puerta del refrigerador, para
conservar la temperatura de las vacunas y registrar en la
hoja de temperatura la fecha y la hora de la falla del equipo.
* Tener en cuenta que las vacunas, en el refrigerador
cerrado, se mantienen por 24 horas en este equipo. Si
después de este periodo, el equipo sigue sin funcionar, las
vacunas deben ser trasladadas en termos o recipientes
térmicos al establecimiento de salud más próximo.
* Verificar el nivel de agua de la batería, si es
necesario
aumentar
agua
destilada
con
una
temporalidad de 3 meses o de acuerdo a necesidad.
* Se debe realizar limpieza semanal de los paneles solares.
Revisar el sistema:
¡¡¡ADVERTENCIA!!!
RECUERDE QUE ESTÁ PROHIBIDA LA CONEXION
DE OTROS EQUIPOS ELECTRICOS A LA BATERIA
DEL REFRIGERADOR SOLAR.
¡¡RECUERDE QUE EL REFRIGERADOR DEBE: !!!
1. Utilizarse exclusivamente para vacunas del PAI.
2. Estar el equipo separado del suelo aproximadamente con 10 centímetros.
3. Mantener nivelado el equipo a una distancia de 15 cm de la pared, y una distancia de 50
cm del techo.
4. Contar con estabilizador de energía de 1000 watts o superior.
5. Mantener el condensador limpio.
Manual Técnico del Programa Ampliado de Inmunización
* ver si la pantalla LCD o las luces indicadoras del regulador de
tension estan encendidos, lo que significa que hay energia.
* verificar si el indicador de la unidad electronica del compresor
esta encendido, si no esta encendido llamar al tecnico.
* en caso de que uno de los fusibles termicos este
quemqdo, reemplazarlo con otro del mismo amperaje.
* si uno de los termicos esta en posicion OFF/ apagado, ponerlo
en ON / encendido,. si el fusible vuelve a apagarse, significa
fallas en el equipo o en la bateria y debe llamarse al tecnico.
* Revisar la fecha de instalación de la batería del refrigerador,
ya que ésta debe reemplaza cada cinco años, como máximo.
* Verifique la condición ambiental del establecimiento,
si está nublado, esto reduce la generación de energía
lo que provoca el mal funcionamiento del equipo.
6. Verificar el cierre hermético de la puerta.
283
7. Mantener el compartimiento del evaporador sin escarcha.
8. Contar con la hoja de temperatura actualizada y en un lugar visible.
9. Contar con la hoja de vida del equipo y un plan de emergencia detallado.
10.Contar con dos termómetros en buenas condiciones.
11.Contar con paquetes fríos de agua de 0,4 o 0,6 litros separados 5 cm uno de otro, como
estabilizadores de temperatura de acuerdo a la capacidad del refrigerador.
12.Almacenar las vacunas de acuerdo a la capacidad neta.
13.Las vacunas, deben organizarse de acuerdo a su sensibilidad y en canastillos identificados
bajo el principio PEPS (primero en expirar primero en salir).
14.Cada refrigerador debe estar conectado a un estabilizador de voltaje.
15.Contar con un enchufe exclusivo para cada equipo y correctamente empotrados.
16.Se debe garantizar el suministro permanente de energía eléctrica, energía solar o gas
licuado (GLP).
17.El establecimiento de salud debe contar con un sistema de conexión a tierra.
18.Contar con el plan de emergencia y contingencia.
7.19
GUIA PARA MANEJO DE VACUNA COVID-19
Debido a la pandemia que atraviesa el país y el mundo entero, el PAI realiza la vacunación para
enfrentar al virus de la COVID-19 con vacunas de distintos productores. Mismas que tienen
características especiales en el manejo de la cadena de frío.
Serie: Documentos Técnico Normativos
Cabe destacar que el país realiza la recepción en grandes cantidades. Por ello, en todos los
niveles deben garantizar el almacenamiento y el cuidado de la cadena de frío hasta llegar al
beneficiario.
284
Para lo cual, desde el nivel central hasta los establecimientos de salud deben garantizar y
cumplir con la norma de cadena de frío de acuerdo a las características que requiere cada
vacuna, como ser:
*
Programación.
*
Análisis de capacidad de almacenamiento.
*
Requerimientos de acuerdo a la población meta a vacunar.
*
Recepción.
*
Almacenamiento.
*
Distribución.
*
Transporte de vacunas en vehículos frigoríficos.
Para la conservación de estas vacunas, cada nivel debe realizar las gestiones necesarias ante
las instancias correspondientes para contar con infraestructura adecuada y la adquisición
de equipos de cadena de frío (refrigeradores, congeladores y ultracongeladores) con el fin de
garantizar el almacenamiento de acuerdo a la capacidad necesaria.
7.19.1
Recepción de vacunas e insumos
* Cada nivel debe garantizar la disponibilidad del espacio para el almacenamiento y
asignación de un equipo de cadena de frío exclusivo y transporte para el traslado hasta
el almacén.
* Confirmar con la empresa o entidad de transporte la disponibilidad de recepción del envío
al nivel correspondiente.
* Realizar inmediatamente el desembalaje de las cajas de vacuna, verificando la temperatura
de la parte superior e inferior y registrar.
* Revisar cada uno de los contenedores y retirar los dispositivos de control de temperatura.
* Detener el dispositivo de registro de control de temperatura instalado por el laboratorio
productor presionando la tecla STOP de manera continua por el lapso de aproximadamente
5 segundos.
* Identificar por lotes, fecha de expiración, cantidad y organizarlas de acuerdo al principio
PEPS.
* Cumplir con el estricto control de temperatura en ambos turnos.
* Descargar y archivar la información de los dispositivos.
7.19.2
Despacho
* Contar con la distribución o requerimiento de las vacunas.
* Coordinar el despacho de acuerdo al cronograma de entrega.
Manual Técnico del Programa Ampliado de Inmunización
* Para la recepción de vacunas a -18°C o -70°C, los equipos de cadena de frío (cámaras,
congeladores y ultracongeladores), deben estar en funcionamiento mínimo 24 horas
antes para la estabilización de la temperatura.
285
* Garantizar y coordinar el transportar las vacunas e insumos a los diferentes puntos de
almacenamiento.
* Preparar los paquetes fríos (de agua o eutécticos) y las cajas térmicas necesarias.
* Introducir las vacunas en las cajas térmicas previamente estabilizadas a temperaturas
requeridas por tipo de vacunas (congelación o refrigeración).
* Identificar las cajas por número correlativo y registrar las temperaturas que se tomaron al
momento de sellar las cajas.
* Asegurar el envió de vacunas ya sea por vía aérea o terrestre.
Toda caja de vacuna debe ser identificada con letreros que indiquen que son productos
FRAGILES Y PERECEDEROS.
7.19.3
Recepción en almacenes departamentales/
coordinaciones de red/municipios/establecimientos de
salud
* Comprobar que las vacunas e insumos no tengan daños físicos y que no falten productos.
* Comprobar el detalle de las vacunas e insumos de acuerdo a la documentación de
despacho.
* Registrar en el formulario de recepción de vacunas y enviar al nivel que corresponda.
* Colocar los diluyentes en un almacén en seco de acuerdo al nivel correspondiente, control
de existencias y formularios de logistica.
* Registrar en el sistema de gestión de existencias y archivar la documentación.
Las vacunas de la COVID-19 deben utilizarse rápidamente una vez recibidas en los
almacenes, aplicando el principio PEPS
Evitar almacenar la vacuna durante periodos prolongados.
Serie: Documentos Técnico Normativos
7.19.4
286
Para vacunas que se conservan a -70°C
El equipo de cadena de frío de ultra-baja temperatura precisa lo siguiente:
* Contar con equipos congeladores de ultra-baja temperatura con suministro de energía
continua e ininterrumpida para la conservación de la vacuna.
* Cada equipo de ultra-baja temperatura debe contar con regulador de voltaje.
* Contar con suficientes paquetes ultra fríos o suministro de hielo seco.
* Contar con equipos de protección personal como ser: protector facial, guantes frisados,
mandil u overol y otros necesarios para crio-congelación.
* En el momento de la apertura del contenedor se debe abrir de manera paulatina esperando
5 segundos para evitar posibles accidentes laborales por crio congelación como
quemaduras y daños a la vista.
* La manipulación de las vacunas a esta temperatura se recomienda realizar dentro de los
5 minutos como máximo, para conservar la cadena de frío a -70°C.
* Si la manipulacion de la vacuna se excede por mas de 5 minutos iniciar el proceso
de descongelacion de los viales, estos pueden ser utilizados dentro los 30 días a una
temperatura entre +2° y 8°C.
* No volver a congelar
* Considerar que la vacuna una vez retira de -70°C, descongela a una temperatura ambiente
(+22°C) en 3 horas.
* Considerar que la vacuna una vez descongelada tiene 2 horas de vida útil.
* Control estricto de temperatura de acuerdo a norma establecida del PAI.
7.19.5
Para vacunas que se conservan a -18°C El equipo de cadena de frío (congelador) precisa lo siguiente:
* Contar con equipos congeladores con suministro de energía continua e ininterrumpida
para la conservación de la vacuna.
* Cada congelador debe contar con regulador de voltaje.
* Los paquetes fríos eutécticos deben estar 72 horas (3 dias como minimo ), en congelación
para alcanzar a una temperatura de -18°C para el preparado de las vacunas.
* Para la manipulación de las vacunas a esta temperatura, el manipuleo debe ser de forma
inmediata no excediendo los 5 minutos para garantizar la inmunogenicidad de la vacuna.
* Control estricto de temperatura de acuerdo a norma establecida del PAI.
* Considerar que la vacuna una vez descongelada tiene 30 dias de vida útil entre +2°C. a
+8C
* No volver a congelar
7.19.6
ASTRAZENECA, SINOPHARM Y JANSSEN (+2°C a +8°C)
La manipulación de estas vacunas es de acuerdo a normativa nacional vigente de las vacunas
del esquema regular manteniendo en este rango de temperatura en todos los niveles (Central,
departamental, coordinacion de red y establecimientos de salud).
Manual Técnico del Programa Ampliado de Inmunización
* Contar con equipos de protección personal como ser: protector facial, guantes frisados,
mandil u overol y otros necesarios para la manipulación.
287
7.19.7
moderna a -20°C El equipo de cadena de frío (congelador) precisa lo siguiente:
* Contar con equipos congeladores con suministro de energía continua e ininterrumpida
para la conservación de la vacuna.
* Cada congelador debe contar con regulador de voltaje.
* Los paquetes fríos eutécticos deben estar 72 horas (3 dias como minimo ), en congelación
para alcanzar a una temperatura de -20°C para el preparado de las vacunas.
* Contar con equipos de protección personal como ser: protector facial, guantes frisados,
mandil u overol y otros necesarios para la manipulación.
* Para la manipulación de las vacunas a esta temperatura, el manipuleo debe ser de forma
inmediata no excediendo los 5 minutos para garantizar la inmunogenicidad de la vacuna.
* Control estricto de temperatura de acuerdo a norma establecida del PAI.
* Considerar que la vacuna una vez descongelada tiene 30 dias de vida útil entre +2°C. a
+8C
Serie: Documentos Técnico Normativos
* No volver a congelar
288
CAPÍTULO 8
LOGÍSTICA
Índice
8.1
8.2
8.3
8.3.1
8.3.2
8.3.3
A.
B.
C.
D.
E.
F.
G.
H.
I.
J.
K.
L.
M.
N.
O.
8.3.4
8.3.5
8.3.6
8.4
8.4.1
8.4.2
8.4.3
8.5
8.6
Introducción
Logística
Proceso de gestión logística
Ciclo de la logística
Selección de la vacuna
Programación
Vacuna BCG
Vacuna Pentavalente
Vacuna Antipoliomielítica (bOPV)
Vacuna Antirotavírica
Vacuna Triple Viral Sarampión, Rubeola y Parotiditis (SRP)
Vacuna Antiamarílica (FA)
Vacuna contra Hepatitis B
Vacuna Antidiftérica y Antitetánica (dT)
Vacuna Antineumocócica
Vacuna Antipoliomielitica Inactivada (IPV)
Vacuna Antiinfluenza Pediátrica
Vacuna Antiinfluenza Adultos
Vacuna contra el Virus del Papiloma Humano (VPH)
Vacuna contra Sarampión y Rubeola (SR)
Programación de Cajas de Desecho Seguro
Adquisición
Almacenamiento
Distribución
Instrumentos del sistema de logística
Comprobante de requerimiento
Comprobante de despacho de vacunas, jeringas y
cajas de desecho seguro o factura del sistema
Kardex
Informe mensual de uso de vacunas y jeringas
Proceso para baja de vacunas
282
282
282
283
283
284
287
290
294
296
298
302
305
309
312
315
318
320
324
326
330
333
333
334
334
334
335
336
339
340
8.1
INTRODUCCIÓN
El sistema de logística fue implementado en el PAI el año 2004, en cumplimiento de
recomendaciones de la Contraloría General del Estado y Ley N° 1178 con la finalidad de
fortalecer los procesos de programación, solicitud, adquisición, distribución de vacunas,
jeringas e insumos y utilización de los mismos.
8.2
Logística
Es el proceso de operaciones que garantiza el ciclo de la cadena de suministros desde la
selección, programación, adquisición, transporte, almacenamiento, utilización, recolección de
información y procesos administrativos que correspondan al manejo de las mismas en la
vacunacion continúa en todo el territorio nacional.
El propósito es asegurar el abastecimiento de vacunas e insumos (jeringas y cajas de desecho
seguro) de manera oportuna en todos los Establecimientos de Salud publica y seguridad
socialcumpliendo con los siguientes objetivos:
* Garantizar los procesos sistemáticos de programación, adquisición y distribución de
vacunas, jeringas e insumos de vacunación en todos los niveles del Sistema de Salud.
* Contar y analizar la información para asegurar el uso eficiente de vacunas, jeringas e
insumos.
* Verificar la utilización eficiente de vacunas, jeringas y sus instrumentos correspondientes.
8.3
PROCESO DE GESTIÓN LOGÍSTICA
A través del PAI, cada año en Bolivia se aplican alrededor de 6.561.067 dosis a niñas(os)
menores de cinco años, poblacion en riesgo de acuerdo al esquema nacional de vacunacion.
Serie: Documentos Técnico Normativos
La Ley de Vacunas N° 3300 del 12 de diciembre de 2005, asegura los recursos económicos
nacionales a través del Ministerio de Economía y Finanzas Publicas para la compra de las
vacunas, jeringas, cajas de desecho seguro e insumos de acuerdo a la programación anual.
A su vez, los gobiernos departamentales y municipales deben programar y asignar recursos
provenientes del IDH y remanentes de la Ley del SUS y todos los instrumentos de registros
necesarios para la vacunación, como ser:
* Cuadernos actualizados de registro (dentro y fuera de servicio) donde no se tenga
implementado el SOAP)
* Reportes del SOAPS.
* Hoja de temperatura.
* Hoja de vida del equipo.
* Kardex de vacunas, diluyentes, jeringas y otros insumos.
* Comprobantes de requerimiento y despachos.
* Auto adhesivos de consejos útiles.
292
* Afiches informativos (material de promoción).
* Cuadro de monitoreo de cobertura.
* Formulario de informes mensuales de uso de vacunas e insumos.
* Carnets de vacunación.
* Libretas de Salud y Desarrollo Integral Infantil y otros.
Asimismo, se debe incluir a los equipos de cadena de frío y elementos complementarios:
termómetros laser y digital, refrigeradores, cajas frías, termos, equipo de aire acondicionado,
generadores eléctricos y otros.
8.3.1
Ciclo de la logística
Fuente: PAI / MSyD.
8.3.2
Selección de la vacuna
La selección de nuevas vacunas para el esquema nacional las recomienda el Comité Nacional
de Inmunización en base a estudios de:
* Carga de la enfermedad.
* Estudio de costo efectividad.
* Factibilidad económica, social y operativa.
El esquema actual cuenta con 14 vacunas que protegen 21 enfermedades.
Manual Técnico del Programa Ampliado de Inmunización
Figura N°37: Ciclo de la logística
Incluye los siguientes procesos administrativos:
293
8.3.3
Programación
La programación es un componente esencial para la implementación del PAI en todos los
niveles, para lo cual se requiere:
* Paso 1. Se precisa contar con la población objetivo de cada nivel y por grupo etario
(proporcionada cada año por el SNIS-VE/INE).
* Paso 2. Realizar la programación de vacunas, jeringas y cajas de desecho seguro en base
a la población objetivo calculado en el paso 1. Se debe considerar el stock de reserva
solo en el nivel central / departamental y en Coordinaciones de Red / Municipio, y no así
en los Establecimientos de Salud. Una vez concluida la programación, se debe enviar a
la instancia del nivel superior que corresponda (tomando como ejemplo, los ejercicios
desarrollados para cada vacuna en el presente capítulo).
Tabla N°27: Programación
Nivel
Programación
Central
PT x ND + FP + SR
Departamental
PT x ND + FP + SR
Coordinación de red/cabecera de municipio
PT x ND + FP + SR
Establecimiento de salud
PT x ND + FP
PT= Población total por grupo de edad objetivo y por vacuna
ND= Número de dosis
FP= Factor pérdida
SR= Stock de reserva
Fuente: PAI / MSyD.
* Paso 3. El requerimiento anual de vacunas, jeringas e insumos se debe realizar de la
siguiente manera.
• Central, una vez al año con la realización de 2 confirmaciones semestrales, de acuerdo
a solicitud del Fondo Rotatorio de OPS.
Serie: Documentos Técnico Normativos
• Departamental, cuatro requerimientos trimestrales al año remitidos al PAI Central.
294
• Coordinación de Red/Municipio, cuatro requerimientos trimestrales al año remitidos al
PAI Departamental.
• Establecimiento de Salud, de acuerdo a su capacidad de almacenaje (trimestral,
bimensual o mensual a la instancia que corresponde).
La programación de vacunas es anual en todos los niveles y se la debe realizar con la
población total asignada por el SNIS-VE y el INE con la finalidad de garantizar la protección
de la población objeto; en la Coordinación de Red, Municipios y Establecimientos de Salud
que cuenten con asignación de población subestimadas o sobrestimadas, deben presentar
un informe donde se respalde y/o justifique la población real; misma que será analizada por
el nivel superior para la dotación de las vacunas e insumos.
El PAI suministrará a los SEDES, el 100% de las dosis programadas, de acuerdo a la población
asignada por el SNIS-VE para cada gestión. Para la programación en los vacunatorios de la
Seguridad Social a corto plazo o de Convenio, que no cuentan con una población asignada, se
debe utilizar el histórico de los últimos 3 años con todas las vacunas.
Programar al 100% de su población asignada, para evitar el desabastecimiento.
Asimismo, se debe considerar el número de dosis que serán aplicadas de acuerdo al esquema
nacional de vacunación, presentación de la vacuna (multidosis o unidosis), factores de perdida,
stock de reserva y saldos en existencia para cada vacuna, jeringas y cajas de desecho que
serán utilizadas.
Stock de reserva: Es la cantidad adicional de vacunas y jeringas que se incluyen en la
programación anual para enfrentar situaciones de contingencia en control de brotes,
investigación de casos sospechosos y desabastecimiento de vacunas.
Tabla N° 28: Tiempo de Stock de reserva para vacunas e insumos por niveles
Nivel
Tiempo
Central
De 3 a 6 meses
Departamental
3 meses
Coordinación de Red / Municipio
1 mes
Establecimientos de Salud
No aplica
Fuente: Programa Ampliado de Inmunización, Ministerio de Salud y Deportes. 2021.
El Stock de seguridad tiene un carácter rotatorio y se debe utilizar de acuerdo al
principio PEPS (Primero en Expirar Primero en Salir).
* Para aprovechar las oportunidades de vacunación, se puede aperturar un frasco multidosis
por niño o niña.
* Cuando se debe llegar a población dispersa.
* Cuando se excede el tiempo del frasco abierto que una vez reconstituida, su duracion es
es de 6 horas.
* Los frascos multidosis.
* Manipulación de la vacuna y otros.
Manual Técnico del Programa Ampliado de Inmunización
Factor pérdida: Se denomina a las dosis no utilizadas que se incluyen en la programación de
vacunas, las mismas pueden ser consideradas:
295
Los tipos de factores de pérdida más frecuentes son:
* Vacunas
frasco abierto, frasco roto, factor manipuleo, frasco expirado y falla de fábrica.
* Diluyente
frasco roto, frasco expirado y falla de fábrica.
* Jeringas
falla de fábrica, factor manipuleo y expiración.
El siguiente cuadro detalla la presentación y norma el factor pérdida por vacuna.
Tabla N° 29: Factor pérdida por vacuna
Vacuna
Presentación
Factor pérdida
BCG
Multidosis (10 Dosis)
70%
Rotavirus
Unidosis
0.5%
IPV (Polio Inyectable)
Multidosis (5 Dosis)
10%
Neumococo
Unidosis
0.5%
Pentavalente
Unidosis
0.5%
OPVb (Polio Oral)
Multidosis (20 Dosis)
20%
Influenza Pediátrica
Multidosis (20 Dosis)
10%
SRP
Unidosis
0.5%
Fiebre Amarilla
Multidosis (10 Dosis)
70%
VPH
Unidosis
0.5%
dT
Multidosis (10 Dosis)
10%
SR
Unidosis
0.5%
Influenza Adulto
Unidosis (10 Dosis)
10%
Hepatitis B Adulto
Unidosis
0.5%
COVID-19
Unidosis
0.5%
COVID-19
Multidosis (5-6-10 dosis)
10%
Jeringas para aplicación de vacunas
Auto Desactivable
2%
Serie: Documentos Técnico Normativos
Fuente: PAI / MSyD
En base a la observación y supervisión en terreno, se norma la inclusión de un 2% de factor de
perdida para las jeringas utilizadas en la aplicación de vacunas.
La programación anual debe ser presentada por los Establecimientos de Salud, Municipios
y Coordinaciones de Red, a las instancias correspondientes hasta la segunda semana de
noviembre de cada año.
Los nueve SEDES deben presentar la programación al PAI Central la última semana de
noviembre de cada año; la misma que debe ser actualizada en el primer trimestre de la
siguiente gestión con las firmas de las autoridades correspondientes.
La programación de vacunas, jeringas y cajas de desechos seguros debe contemplar lo
siguiente:
* Ubicación geográfica y año programado.
296
* Población objeto (es la población por grupos de edad o riesgo a vacunar de acuerdo al
Esquema Nacional de Vacunación).
* Factor pérdida.
* Stock de reserva.
* Saldos en existencia.
Población de población de 2 años
Población de 4 años
Población 7 – 9 años
poblacion de 5 a 49 años
Población de niñas de 10 años
Población 10 – 49 años
Población de 60 años y mas
Población de embarazadas
241.860
242.679
731.711
1.620.011
124.120
7.967.357
1.099.785
275.631
Población de 12 a 23 meses (1 año)
242.152
Población menor de 1 año
242.848
11.633.371 Población Total
Tabla N° 30: Población nacional por grupos de edad objeto de vacunación
Fuente: SNIS-VE, Ministerio de Salud y Deportes. 2021
A.
Vacuna BCG
El factor pérdida de 70% a programar será de 2 dosis adicionales por niño, debido a múltiples
factores como: frasco multidosis, población dispersa (apertura de frasco por un niño para
evitar oportunidades perdidas), el tiempo de vida útil una vez reconstituida.
Jeringas para la vacuna BCG
Tabla N° 31: Requerimiento de jeringas
Uso
Tipo
CONSIDERACIÓN PARA PROGRAMACIÓN
Para aplicación
Jeringa Auto Destructible (AD)
de 0,1ml con aguja 27G x 3/8”.
La cantidad se obtiene del total
de la población menor de 1 año
más el 2% de factor pérdida.
Para dilución
Jeringa de 1 ml con
aguja 22G x 1½”.
Igual al número de frascos
de vacuna BCG.
Manual Técnico del Programa Ampliado de Inmunización
Para el cálculo de la programación anual, se considera la población total menor de un año
multiplicar por 10 porque el frasco es de 10 dosis. Del resultado obtenido calcular el 70% como
factor pérdida, posteriormente restar los resultados, para obtener el requerimiento anual.
297
Cálculo para nivel central y departamental
A
B
C
D
E
F
G
H
I
J
K
L
L
Stock de reserva de 3 meses
(jeringa dilución)
17.943
Total requerimiento anual
244.020 jeringa para aplicación de
0,1 ml 27gx3/8”
K
Stock de reserva de 3 meses
(jeringa aplicación)
jeringas aplicacion 2% de
factor de perdida
J
61.005
Requerimiento anual
239.235 jeringa para aplicación de
0,1 ml 27gx3/8”
I
Stock de reserva de 3 meses
(vacuna)
H
179.430
G
Total requerimiento anual
71.772 jeringa para dilución de 1
ml 22gx1 1/2”
F
4.785
E
717.720
D
717.705 Total requerimiento anual
1.674.645 factor de perdida 70%
C
multiplicar x 10 (un frasco
=10 dosis)
B
2.392.350
239.235 Población < 1 año
Bolivia
País / Departamento
A
total requerimiento anual
(redondeado)
Tabla N° 32: Programación anual de vacunas y jeringas para BCG (multidosis-10)
100% de la población menor de 1 año
A multiplicar por 10
Calcular el 70% de B
B-C
D (redondeado múltiplo de 10 por ser frasco multidosis)
A
2 % de F (factor pérdida)
F+G
E ÷ 10
E ÷ 4 (stock reserva de 3 meses - Vacuna)
H ÷ 4 (stock reserva de 3 meses - Jeringas Aplicación)
I ÷ 4 (Stock de reserva de 3 meses - Jeringas Dilución)
Requerimiento
anual*
Detalle
Departamento
País /
Serie: Documentos Técnico Normativos
Posteriormente, se procede a la programación por trimestres.
Vacuna BCG
897.150
(D + I)
Bolivia
Jeringa
aplicación
(G+J)
Jeringa
dilución
(H +K)
Trimestral vacunas
1er
2do
3er
4to
179.430
179.430
179.430
179.430
179.430
358.860
350.025
61.005
61.005
61.005
61.005
61.005
122.010
89.715
17.943
17.943
17.943
17.943
17.943
35.886
*El requerimiento anual es la suma de la programación anual + el stock de reserva.
298
Stock Total 4to
reserva Trimestre
A
B
C
D
E
F
G
H
I
J
K
L
D
E
F
G
H
I
J
K
L
total requerimiento anual
(redondeado)
Requerimiento anual jeringa para
aplicación de 0,1 ml 27gx3/8”
jeringas aplicacion 2% de factor
de perdida
Total requerimiento anual jeringa
para aplicación de 0,1 ml 27gx3/8”
Total requerimiento anual jeringa
para dilución de 1 ml 22gx1 1/2”
Stock de reserva de 1 mes (jeringa
dilución)
1.128
940 Stock de reserva de 1 mes (vacuna)
Stock de reserva de 1 mes (jeringa
aplicación)
3.829
319
94
75
3.754
11.280
C
11.262 Total requerimiento anual
B
26.278 factor de perdida 70%
multiplicar x 10 (un frasco =10
dosis)
A
37.540
3.754 Población < 1 año
País / Departamento
Cálculo para Nivel Coordinación de Red y Municipio
Tabla N° 33: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS PARA BCG (MULTIDOSIS-10)
Manual Técnico del Programa Ampliado de Inmunización
100% de la población menor de 1 año
A multiplicar por 10
Calcular el 70% de B
B-C
D (redondeado múltiplo de 10 por ser frasco multidosis)
A
2 % de F (factor pérdida)
F+G
E ÷ 10
E ÷ 4 (stock reserva de 1 mes - Vacuna)
H ÷ 4 (stock reserva de 1 mes - Jeringas Aplicación)
I ÷ 4 (Stock de reserva de 1 mes - Jeringas Dilución)
299
Requerimiento
anual*
Detalle
Coordinación de
Red/Municipio
Posteriormente, se procede a la programación por trimestres.
Central
Vacuna BCG
(D + I)
Trimestral vacunas
Stock reserva
1er
Total 1er
Trimestre
2do
3er
4to
12.220
2.820
940
3.760
2.820
2.820
2.820
Jeringa
aplicación
(G+J)
4.148
957
319
1.276
957
957
957
Jeringa dilución
(H +K)
1.222
282
94
282
282
282
282
* El requerimiento anual es la suma de la programación anual + el stock de reserva.
Cálculo para Establecimiento de Salud
300
A
B
C
D
E
F
G
H
I
H
I
Total requerimiento anual
3.829 jeringa para aplicación de 0,1
ml 27gx3/8”
Total requerimiento anual
1128 jeringa para dilución de 1 ml
22gx1 1/2”
G
jeringas aplicacion 2% de
factor de perdida
total requerimiento anual
(redondeado)
100% de la población menor de 1 año
A multiplicar por 10
Calcular el 70% de B
B-C
D (redondeado múltiplo de 10 por ser frasco multidosis)
A
2 % de F (factor pérdida)
F+G
E ÷ 10
F
75
E
Requerimiento anual jeringa
3.754 para aplicación de 0,1 ml
27gx3/8”
D
11.280
C
11.262 Total requerimiento anual
multiplicar x 10 (un frasco =10
dosis)
B
37.540
3.754 Población < 1 año
Asistencia
Establecimiento de salud
Pública
Serie: Documentos Técnico Normativos
A
26.778 factor de perdida 70%
Tabla N° 34: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS PARA BCG (MULTIDOSIS-10)
Posteriormente, se procede a la programación por trimestres.
Establecimiento
de salud
Requerimiento
anual*
Detalle
1er
2do
3er
4to
11.280
2.820
2.820
2.820
2.820
Jeringa
aplicación (G)
3.829
957
957
957
957
Jeringa dilución (H)
1.128
282
282
282
282
Vacuna BCG (D)
Asistencia Pública
B.
Trimestral vacunas
Vacuna Pentavalente
La población objetivo para esta vacuna son los niños y niñas menores de 1 año, de 12 a 23
meses y de 4 años.
Para hacer el cálculo de la programación anual de la vacuna pentavalente, se tomará la
población de:
* Menor de 1 año por 3 dosis.
* Población de 1 año para la cuarta dosis.
* Población de 4 años para la quinta dosis.
* Agregar el factor pérdida del 0.5%.
* Considerar el stock de reserva de 3 meses para el nivel Central/Departamental y 1 mes
para Coordinación de Red/Municipio.
Jeringas para la Vacuna Pentavalente
Tabla N° 35: Requerimiento de jeringas
Tipo
CONSIDERACIÓN PARA PROGRAMACIÓN
Para aplicación
Jeringa Auto
Destructible (AD)
de 0,5ml con
aguja 23G x 1”.
La cantidad se obtiene del total de la sumatoria de:
*
*
*
*
*
Población menor de 1 año por 3 dosis.
Población de 1 año para la cuarta dosis.
Población de 4 años para la quinta dosis.
2% de factor pérdida.
Stock de reserva de 3 meses (Central/Departamental).
1 mes (Coordinaciones de Red/Municipio).
Manual Técnico del Programa Ampliado de Inmunización
Uso
301
Cálculo para Nivel Central y Departamental
A
B
C
D
E
F
G
H
I
J
K
L
L
Stock de reserva de 3
meses (jeringa aplicación)
K
309.411
304.860
Stock de reserva de 3
meses (vacuna)
J
Total requerimiento anual
1.237.643 de jeringas de 0,5 ml 23 g
x 1”
I
24.268 Factor perdida 2%
H
SUB Total requerimiento
1.213.375 anual jeringa de 0,5 ml 23
g x 1”
G
Total requerimiento anual
de vacunas
F
1.219.442
E
6.067 Factor Pérdida 0,5%
Población menor de 1 año x
3 dosis
728.544
D
1.213.375 Sub total (B+C+D)
100% población menor de 1
año
C
242.679 100% población de 4 años
B
242.152 100% población de 1 año
A
242.848
Bolivia
País / Departamento
Tabla N° 36: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS PARA PENTAVALENTE (UNIDOSIS)
100% de la población menor de 1 año
A x 3 dosis
100% población de 1 año
100% población de 4 años
B+C+D
0.5 % de E (factor pérdida)
E+F
E
2 % de H (factor pérdida)
H+I
G ÷ 4 (stock de reserva para 3 mes - Vacuna)
J ÷ 4 (stock de reserva para 3 mes -Jeringa)
302
Detalle
Requerimiento
anual*
Serie: Documentos Técnico Normativos
Posteriormente, se procede a la programación por trimestres.
Trimestral vacunas
1er
2do
3er
4to
Stock reserva
Total 4to
Trimestre
Pentavalente (G+K)
1.524.302
304.861
304.861
304.860
304.860
304.860
609.720
Jeringa aplicación
(J+L)
1.547.053
309.411
309.411
309.410
309.410
309.411
618.821
* El requerimiento anual es la suma de la programación anual + el stock de reserva.
Cálculo para Nivel Coordinación de Red y Municipio
Tabla N° 37: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS PARA PENTAVALENTE (UNIDOSIS)
L
Stock de reserva de 1 mes
(jeringa de aplicación)
1.582
K
Stock de reserva de 1 mes
(vacuna)
Total requerimiento anual de
jeringa de 0,5 ml 23 gx1”
J
18.989
18.617
I
372 Factor perdida 2%
H
sub Total requerimiento anual
jeringa de 0,5 ml 23 gx1”
G
Total requerimiento anual de
vacunas
F
18.710
3.635 100% población de 4 años
E
93 Factor Perdida 0,5%
D
18.617 Sub total (B+C+D)
C
3.720 100% población de 1 año
11.262
Población menor de 1 año x 3
dosis
B
1.559
A
B
C
D
E
F
G
H
I
J
K
L
3.754 100% población menor de 1 año
Central Coordinación de Red / Municipio
A
2do
3er
4to
100 % de la población menor de 1 año
A x 3 dosis
100 % población de 1 año
100 % población de 4 años
B+C+D
0.5 % de E (factor pérdida)
E+F
E
2 % de H (factor pérdida)
H+I
G ÷ 12 (stock de reserva para 1 mes - Vacuna)
J ÷ 12 (stock de reserva para 1 mes - Jeringa)
Posteriormente, se procede a la programación por trimestres.
Trimestral vacunas
1er
Stock Total 1er
reserva Trimestre
Vacuna Pentavalente
(G+K)
20.269
4.678
1.559
6.237
4.678
4.678
4.678
Jeringa de
Aplicación (J+L)
20.572
4.747
1.582
6.329
4.747
4.747
4.747
* El requerimiento anual es la suma de la programación anual + el stock de reserva.
Manual Técnico del Programa Ampliado de Inmunización
Detalle
Requerimiento
anual*
303
cálculo para Establecimiento de Salud
Tabla N° 38: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS PARA PENTAVALENTE (UNIDOSIS)
A
B
C
D
E
F
G
H
I
J
Total requerimiento anual de
jeringa de 0,5 ml 23 gx1”
J
18.989
18.617
18.710
I
372 Factor perdida 2%
H
sub Total requerimiento anual
jeringa de 0,5 ml 23 gx1”
G
Total requerimiento anual de
vacuna
F
93 Factor Perdida 0,5%
E
18.617 Sub total (B+C+D)
D
3.635 100% población de 4 años
C
3.720 100% población de 1 año
11.262
Población menor de 1 año x 3
dosis
B
3.754 100% población menor de 1 año
Asistencia
Pública
Establecimiento de salud
A
100 % de la población menor de 1 año
A x 3 dosis
100 % población de 1 año
100 % población de 4 años
B+C+D
0.5 % de E (factor pérdida)
E+F
E
2 % de H (factor pérdida)
H+I
Serie: Documentos Técnico Normativos
Posteriormente, se procede a la programación por trimestres.
304
Servicio de
Salud
Asistencia
Pública
C.
Detalle
Requerimiento
anual*
Trimestral vacunas
1er
2do
3er
4to
Vacuna
Pentavalente (G)
18.710
4.678
4.678
4.678
4.678
Jeringa de
Aplicación (J)
18.989
4.747
4.747
4.747
4.747
Vacuna Antipoliomielítica (bOPV)
La población objetivo de esta vacuna son los niños y niñas menores de un año, de 1 año y de
4 años.
Para hacer el cálculo de la programación anual de la vacuna Antipoliomielítica (bOPV), se
tomará la población de:
* Menor de 1 año por 1 dosis.
* Población de 1 año para la cuarta dosis.
* Población de 4 años para la quinta dosis.
* Agregar el factor pérdida del 20%.
* Considerar el stock de reserva de 3 meses para el nivel Central/Departamental y 1 mes
para Coordinación de Red/Municipio.
Cálculo para Nivel Central y Departamental
Tabla N° 39: PROGRAMACIÓN ANUAL DE VACUNA antipoliomelítica (bOPV) (MULTIDOSIS-20)
873.215
Stock de reserva
de 3 meses
H
218.320
G
Total requerido
873.280 anual (redondeado
de 20 dosis)
F
Total Requerido
Anual
E
145.536 Factor Pedida 20%
D
727.679 Sub total (a+B+C)
Población de 4
años
242.679
Población menor
de 1 año
242.848
C
100 % de la población menor de 1 año
100 % población de 1 año
100 % población de 4 años
A+B+C
20 % de D (como factor pérdida)
D+E
F Redondear a múltiplo de 20 dosis
G ÷ 4 (Stock de reserva 3 meses)
Posteriormente, se procede a la programación por trimestres.
Requerimiento
País /
Departamento
Anual (1)*
Bolivia
Trimestral vacunas
1er
2do
3er
4to
1.091.600 218.320 218.320 218.320 218.320
Stock reserva
218.320
Total, 4to
trimestre
436.640
(1) El requerimiento anual se redondea a múltiplos de 20, porque la presentación de esta vacuna viene en frascos de 20 dosis.
* El requerimiento anual es la suma de la programación anual + el stock de reserva.
Manual Técnico del Programa Ampliado de Inmunización
A
B
C
D
E
F
G
H
B
242.152 Población de 1 año
País /
Departamento
Bolivia
A
305
Cálculo para Nivel Coordinación de Red / Municipio
A
B
C
D
E
F
G
H
G
Total requerido anual
(redondeado de 20 dosis)
H
1.120 Stock de reserva de 1 mes
F
13.360
E
13.331 Total Requerido Anual
D
2.222 Factor Pérdida 20%
C
11.109 Sub total (A+B+C)
B
3.635 Población de 4 años
3.754 Población Menor de 1 año
Central
Coordinación de Red /
Municipio
A
3.720 Población de 1 año
Tabla N° 40: PROGRAMACIÓN ANUAL DE VACUNAS PARA antipoliomelítica (bOPV) (MULTIDOSIS-20)
100 % de la población menor de 1 año
100 % población de 1 año
100 % población de 4 años
A+B+C
20 % de D (como factor pérdida)
D+E
F Redondear a múltiplo de 20 dosis
G ÷ 12 (Stock de reserva 1 mes)
Posteriormente, se procede a la programación por trimestres.
Coordinación de
Red / Municipio
Central
Requerimiento
Anual*
14.480
1er
3.340
Trimestral vacunas
Stock Total 1er
2do.
reserva Trimestre
1.120
4.460
3.340
Serie: Documentos Técnico Normativos
* El requerimiento anual es la suma de la programación anual + el stock de reserva.
306
3er.
4to.
3.340
3.340
Cálculo para Establecimiento de Salud
A
B
C
D
E
F
G
F
G
13.360 Total anual (de 20 dosis)
E
13.331 Total Requerido Anual
D
2.222 Factor Pérdida 20%
C
11.109 Sub total (A+B+C)
B
3.635 Población de 4 años
3.754 Población Menor de 1 año
Asistencia
Pública
Estableci-miento de salud
A
3.720 Población de 1 año
Tabla N° 41: PROGRAMACIÓN ANUAL DE VACUNAS PARA antipoliomelítica (bOPV)
(MULTIDOSIS-20)
100 % de la población menor de 1 año
100 % población de 1 año
100 % población de 4 años
A+B+C
20 % de D (factor pérdida)
D+E
F (redondear a múltiplo de 20 dosis por ser frascos multidosis)
Posteriormente, se procede a la programación por trimestres.
Asistencia Pública
D.
Requerimiento
Anual*
13.360
Trimestral vacunas
1er
3.340
2do
3.340
3er
3.340
4to
3.340
Vacuna Antirotavírica
La población objeto para esta vacuna son los niños y niñas menores de un año.
Para hacer el cálculo de la programación anual de la vacuna antirotavírica, se tomará a la
población menor de un año por dos dosis, más el factor perdida de 0.5% y el stock de reserva de
3 meses para el nivel Central/Departamental y 1 mes para Coordinaciones de red/Municipio.
Manual Técnico del Programa Ampliado de Inmunización
Establecimiento de
Salud
307
CÁLCULO para Nivel Central y Departamental
Stock de reserva
para 3 meses
122.032
Población menor de
1 año X 2 dosis
485.696
E
Total requerimiento
anual
Población menor de
1 año
242.848
D
488.125
País / departamento
A
B
C
D
E
C
Factor Perdida 0,5%
B
2.429
A
Bolivia
Tabla N° 42: PROGRAMACIÓN ANUAL DE VACUNAS ANTIROTAVíRICA (UNIDOSIS)
100% de la población menor de 1 año
A x 2 dosis
0.5 % de B (como factor pérdida)
B+C
D ÷ 4 (stock para 3 meses)
Posteriormente, se procede a la programación por trimestres.
País /
Requerimiento
Departamento
Anual*
Bolivia
610.157
Trimestral vacunas
1er
2do
122.031
122.031
3er
Stock Total 4to
reserva Trimestre
4to
122.031 122.032
122.032
244.064
* El requerimiento anual es la suma de la programación anual + el stock de reserva.
Cálculo para Nivel Coordinación de Red/Municipio
308
Central
A
C
Población
menor de 1 año
X 2 dosis
Factor Pérdida
0,5%
11.262
100% de la población menor de 1 año
22.524
113
D
E
Stock de
seguridad de 1
mes
B
Total
requerimiento
anual
A
Población
Menor De 1 año
Coordinación de
Red / Municipio
Serie: Documentos Técnico Normativos
Tabla N° 43: PROGRAMACIÓN ANUAL DE VACUNAS ANTIROTAVíRICA (UNIDOSIS)
22.637
1.886
B
C
D
E
A x 2 dosis
0.5 % de B (Factor pérdida)
B+C
D ÷ 12 (Stock reserva para 1 mes)
Posteriormente, se procede a la programación por trimestres.
Coordinación
de Red /
Municipio
Trimestral vacunas
Requerimiento
Anual
1er.
24.523
5.660
Central (D+E)
Stock Total 1er
reserva Trimestre
1.886
7.546
2do
3er
4to
5.659
5.659
5.659
Cálculo para Establecimiento de Salud
Tabla N° 44: PROGRAMACIÓN ANUAL DE VACUNAS ANTIROTAVIRICA (UNIDOSIS)
Asistencia Pública
A
B
C
D
C
3.754
D
7.508
Total requerimiento anual
Factor Pérdida
0,5%
Población menor
de 1 año X 2 dosis
B
Población menor
de 1 año
Estableci-miento
de salud
A
38
7.546
100% de la población menor de 1 año
A x 2 dosis
0.5 % de B (factor pérdida)
B+C
Establecimiento de
Salud
Requerimiento anual
Asistencia Pública
E.
7.546
Trimestral vacunas
1er
1.887
2do
1.887
3er
1.886
4to
1.886
Vacuna Triple Viral Sarampión, Rubeola y Parotiditis (SRP)
La población objeto de esta vacuna son las niñas y niños de un año, es decir de 12 a 23 meses.
Para hacer el cálculo de la programación anual de la vacuna SRP, se tomará:
* La población de un año (12 a 23 meses) por dos dosis.
* El factor pérdida de 0.5%.
* El stock de reserva de 3 meses para el nivel Central/Departamental y 1 mes para
Coordinaciones de red/Municipio.
Manual Técnico del Programa Ampliado de Inmunización
Posteriormente, se procede a la programación por trimestres.
309
Jeringas para SRP
Tabla N° 45: Jeringas para SRP
CONSIDERACIÓN PARA PROGRAMACIÓN
Uso
Tipo
Para aplicación
Jeringa Auto Destructible (AD) de 0.5 ml.
con aguja 25G x 5/8”
Para dilución
Jeringa de 1 ml. con aguja 25G x 1 1/2”
Es igual a la población objeto por
dos dosis más un 2% de factor
pérdida.
Cálculo para Nivel Central y Departamental
Serie: Documentos Técnico Normativos
310
A
B
C
D
E
F
G
H
I
J
K
G
H
I
J
K
Jeringa de dilución de 1 ml
25g x 1 1/2 anual
Stock de reserva de 3 meses
(vacuna)
Stock de reserva de 3 meses
(jeringa aplicación)
Stock de reserva de 3 meses
(jeringa de dilución)
484.304
121.681
123.498
121.076
Jeringa de aplicación de 0.5
ml 25g x 5/8
F
493.990 Total requerimiento anual
E
9.686 Factor perdida 2 %
D
484.304
484.304 Población de 1 año x 2 dosis
C
486.726 Total requerimiento anual
B
2.422 Factor perdida 0,5 %
A
242.152 Población de 1 año
Bolivia
País / Departamento
Tabla N° 46: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS PARA TRIPLE VIRAL SARAMPIÓN, RUBEOLA, PAROTIDITIS (SRP) – (UNIDOSIS)
100 % de la población de 1 año
Población de 1 año x 2 dosis
0.5 % de B (como factor pérdida)
B+C
B
2 % de E
E+F
B
D ÷ 4 (stock de reserva de 3 meses - Vacuna)
G ÷ 4 (stock de reserva de 3 meses - Jeringa de Aplicación)
H ÷ 4 (stock de reserva de 3 meses - Jeringa de Dilución)
Posteriormente, se procede a la programación por trimestres.
Coordinación de Red /
Municipio
A
B
C
D
E
F
G
H
D
E
Total requerimiento
anual
Jeringa aplicación de
0.5 ml 25gx5/8”
22.100
H
I
J
Jeringa dilución de 1 ml
25gx1 1/2”
Stock de reserva de 1
mes (vacuna)
Stock de reserva de 1
mes (jeringa aplicación)
22.100
1851
1.879
123.496
121.076
246.994
Requerimiento
anual*
121.680
243.362
121.682
121.682
121.682
121.682
608.408
Stock de
reserva
242.152
123.498
123.498
121.076
121.076
123.498
123.498
121.076
121.076
617.488
Detalle
País /
Departamento
4to
Stock de reserva de 1
1.842
mes (jeringa dilución)
G
Total requerimiento
anual
F
3er
Manual Técnico del Programa Ampliado de Inmunización
100 % de la población de 1 año.
Población de 1 año x 2 dosis .
0.5 % de B (factor pérdida)
B+C
B
2 % de E
E+F
B
2do
22.542
Jeringa
dilución (H+K)
605.380
Jeringa
aplicación
(G+J)
1er
442 Factor perdida 2 %
C
22.211
B
111 Factor perdida 0,5 %
Población de 1 año x 2
dosis
A
22.100
Bolivia
11.050 Población de 1 año
Central
Vacuna
SRP (D+I)
trimestral vacunas
Total 4to
Trimestre
* El requerimiento anual es la suma de la programación anual + el stock de reserva.
Cálculo para Nivel Coordinación de Red/Municipio
Tabla N° 47: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS PARA TRIPLE VIRAL SARAMPIÓN,
RUBEOLA, PAROTIDITIS (SRP) – (UNIDOSIS)
K
311
I
J
K
D ÷ 12 (stock de reserva de 1 mes - Vacuna)
G ÷ 12 (stock de reserva de 1 mes - Jeringa de Aplicación)
H ÷ 12 (stock de reserva de 1 mes - Jeringa de Dilución)
Posteriormente, se procede a la programación por trimestres.
coordinación de Red
/ Municipio
Central
Requerimiento anual*
Detalle
Vacuna SRP
(D+I)
Jeringa de
aplicación
(G+J)
Jeringa de
Dilución (H+K)
Trimestral vacunas
1er
Stock Total 1er
reserva trimestre
2do
3er
4to
24.062
5.553
1.851
7.404
5.553
5.553
5.553
24.421
5.635
1.879
7.514
5.636
5.636
5.635
23.942
5.525
1.842
7.367
5.525
5.525
5.525
* El requerimiento anual es la suma de la programación anual + el stock de reserva.
Cálculo para Establecimiento de Salud
312
A
B
C
D
E
F
Factor perdida 0,5 %
Total requerimiento anual
de vacunas
Jeringa aplicación de 0.5 ml
25gx5/8”
Factor pérdida 2 %
3.720
7.440
100% de la población de 1 año
Población de 1 año x 2 dosis
0.5 % de B (factor pérdida)
38
7.478
7.440
149
G
H
Jeringa dilución de 1 ml
25gx1 1/2”
C
Total requerimiento anual
B
Población de 1 año x 2 dosis
Asistencia
Pública
A
Población de 1 año
Establecimiento de Salud
Serie: Documentos Técnico Normativos
Tabla N° 48: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS PARA TRIPLE VIRAL SARAMPIÓN,
RUBEOLA, PAROTIDITIS (SRP) – (UNIDOSIS)
7.589
7.440
D
E
F
G
H
B+C
B
2 % de E
E+F
B
Posteriormente, se procede a la programación por trimestres.
Establecimiento
de salud
Asistencia
Pública
F.
Detalle
Requerimiento
anual
Trimestral vacunas
1er
2do
3er
4to
Vacuna
SRP (D)
7.478
1.870
1.870
1.869
1.869
Jeringa
aplicación (G)
7.589
1.897
1.897
1.897
1.898
Jeringa
dilución (H)
7.440
1.860
1.860
1.860
1.860
Vacuna antiamarílica (FA)
Para el cálculo de la programación, considerar la población total de un año (12 a 23 meses)
y el 15% de la población total de 2 años esta sumatoria multiplicarse por 10 porque el frasco
es de 10 dosis. Del resultado obtenido calcular el 70% como factor pérdida, posteriormente
restar los resultados, para obtener el requerimiento anual.
* Población de 1 año (12 a 23 meses) por una dosis.
* El 15% de la población susceptible de 2 años.
* Factor pérdida de 70%.
Jeringas para la vacuna contra Fiebre Amarilla (FA)
Tabla n°49: Jeringas para FA
Manual Técnico del Programa Ampliado de Inmunización
* Stock de reserva de 3 meses para el nivel Central/Departamental y 1 mes para
Coordinaciones de Red/Municipio.
313
Uso
Tipo
CONSIDERACIÓN PARA PROGRAMACIÓN
Para
aplicación
Jeringa Auto Destructible (AD)
de 0.5 ml con aguja 25G x 5/8”
Es igual a la población meta más
un 2% de factor pérdida.
Para dilución
Jeringa de 5 ml con
aguja 22G x 1 1/2”
La cantidad se calcula del total del
requerimiento anual de vacuna contra
la Fiebre Amarilla dividido por el 10%.
Cálculo Nivel Central y Departamental
Serie: Documentos Técnico Normativos
314
H
I
J
K
L
M
N
Ñ
Total requerimiento anual
(redondeado)
Jeringa aplicación de 0,5 ml
25 g x 5/8”
Factor de perdida 2%
jeringas de aplicacióN
Total requerimiento anual
jeringas de aplicación
Jeringa dilución 5 ml 22gx1
1/2”
Stock de reserva de 3 meses
(vacuna)
Stock de reserva de 3 mes
(jeringa aplicación)
Stock de reserva de 3 meses
(jeringa dilución)
273.284
278.749
81.988
204.970
69.687
20.497
5.466
G
819.880
F
1.912.987 Factor pérdida 70 %
MULTIPLICAR X 10 (UN FRASCO = 10 DOSIS)
E
2.732.838
D
273.284 Subtotal (A+C)
35.537 15% Población de 2 años
236.912 POBLACION DE 2 AÑOS
237.747 Población de 1 año
Bolivia
País / Departamento
A B C
819.851 TOTAL REQUERIMIENTO ANUAL
Tabla N° 50: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS PARA FIEBRE AMARILLA (FA)
(MULTIDOSIS-10)
A
B
C
D
E
F
G
H
I
J
K
L
M
100 % de la población de 1 año
Poblacion de 2 años.
15 % de la población de 2 años (B)
A+C
D multiplicar x 10 (un frasco = 10 dosis)
Calcular el 70 % de E (Factor pérdida)
E-F
G (redondeo a múltiplo de 10 por ser frasco multidosis)
D
2% de I (factor pérdida)
I+J
H ÷ 10
H ÷ 4 (stock de reserva de 3 meses - Vacuna)
N
Ñ
K ÷ 4 (stock de reserva de 3 meses - Jeringa de Aplicación)
L ÷ 4 (stock de reserva de 3 meses - Jeringa de Dilución)
Posteriormente, se procede a la programación por trimestres.
Requerimiento
anual*
Detalle
País /
Departamento
Vacuna
FA (E+J)
Trimestral vacunas
1er
2do
3er
4to
1.024.850 204.970 204.970 204.970 204.970
Jeringa
aplicación
Bolivia
(H+K)
Jeringa
dilución
(I+L)
Stock reserva
Total
del 4to
Trimestre
204.970
409.940
348.437
69.687
69.687
69.687
69.687
69.687
139.375
102.485
20.497
20.497
20.497
20.497
20.497
40.994
* El requerimiento anual es la suma de la programación anual + el stock de reserva.
Nivel Coordinación de Red/Municipio
F
G
H
I
J
K
L
M
N
Ñ
MULTIPLICAR X 10 (UN FRASCO = 10 DOSIS)
29.911 Factor pérdida 70 %
12.819 TOTAL REQUERIMIENTO ANUAL
Total requerimiento anual
(redondeado)
Jeringa aplicación de 0,5
ml 25 g x 5/8”
Factor de perdida 2%
jeringas de aplicacióN
Total requerimiento anual
jeringas de aplicación
Jeringa dilución 5 ml
22gx1 1/2”
Stock de reserva de 1 mes
(vacuna)
Stock de reserva de 1 mes
(jeringa aplicación)
Stock de reserva de 1 mes
(jeringa dilución)
12.840
4.273
4.359
1.284
1.70
3.63
107
85
E
42.731
D
4.273 Subtotal (A+C)
3.687 POBLACION DE 2 AÑOS
C
553 15% Población de 2 años
B
3.720 Población de 1 año
central
A
B
C
D
E
F
G
H
I
J
K
L
M
N
Ñ
A
100 % de la población de 1 año
Poblacion de 2 años.
15 % de la población de 2 años (B)
A+C
D multiplicar x 10 (un frasco = 10 dosis)
Calcular el 70 % de E (Factor pérdida)
E-F
G (redondeo a múltiplo de 10 por ser frasco multidosis)
D
2% de I (factor pérdida)
I+J
H ÷ 10
H ÷ 4 (stock de reserva de 1 mes - Vacuna)
K ÷ 4 (stock de reserva de 1 mes - Jeringa de Aplicación)
L ÷ 4 (stock de reserva de 1 mes - Jeringa de Dilución)
Manual Técnico del Programa Ampliado de Inmunización
coordinacion de red /
municipio
Tabla N° 51: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS PARA FIEBRE AMARILLA (FA)
(MULTIDOSIS-10)
315
Posteriormente, se procede a la programación por trimestres.
Coordinación
de Red /
Detalle
Municipio
Requerimiento
anual*
1er
Vacuna
FA (E+J)
Jeringa
aplicación
(H+K)
Jeringa
Dilución
(I+L)
Central
trimestral vacunas
Stock Total
reserva 1er
2do
3er
4to
13.910
3.210
1.070
4.280
3.210
3.210
3.210
4.722
1.090
363
1.453
1.090
1.090
1.090
1.391
321
107
328
321
321
321
* El requerimiento anual es la suma de la programación anual + el stock de reserva.
Cálculo Establecimiento de Salud
Serie: Documentos Técnico Normativos
316
I
MULTIPLICAR X 10 (UN FRASCO = 10 DOSIS)
29.911 Factor pérdida 70 %
TOTAL REQUERIMIENTO ANUAL
Total requerimiento
anual (redondeado)
Jeringa aplicación
de 0,5 ml 25 g x 5/8”
12.819
12.840
4.273
A
B
C
D
E
F
G
H
I
J
K
100 % de la población de 1 año
Poblacion de 2 años.
15 % de la población de 2 años (B)
A+C
D multiplicar x 10 (un frasco = 10 dosis)
Calcular el 70 % de E (Factor pérdida)
E-F
G (redondeo a múltiplo de 10 por ser frasco multidosis)
D
2% de I (factor pérdida)
I+J
L
H ÷ 10
Posteriormente, se procede a la programación por trimestres.
J
K
L
Jeringa dilución 5 ml
22gx1 1/2”
H
1.284
G
Total requerimiento
4.359 anual jeringas de
aplicación
F
Factor de perdida
85 2% jeringas de
aplicacióN
E
42.731
D
4.273 Subtotal (A+C)
3.687 POBLACION DE 2 AÑOS
C
15% Población de 2
años
B
553
A
3.720 Población de 1 año
Asistencia Establecimiento de
Pública Salud
Tabla N° 52: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS PARA FIEBRE AMARILLA (FA)
(MULTIDOSIS-10)
Establecimiento
de Salud
Detalle
Requerimiento
anual*
Trimestral vacunas
1er
2do
3er
4to
Vacuna FA (E)
12.840
3.210
3.210
3.210
3.210
Jeringa
Asistencia Pública aplicación (H)
4.359
1.090
1.090
1.090
1.090
1.284
321
321
321
321
Jeringa
dilución (I)
* El requerimiento anual es la suma de la programación anual redondeado.
G.
Vacuna contra Hepatitis B
La población objeto para la programación es:
* Personal de salud que representa aproximadamente el 0.2% de la población total del país
por tres dosis.
* Población en riesgo (trabajadoras sexuales, trabajadores de aseo, población de estudiantes
de último año de medicina y residentes, etc.).
* Población en riesgo que representa el 0.1% de la población total por tres dosis.
* Factor pérdida de 0.5%.
* Stock de reserva de 3 meses para el Nivel Central/Departamental y 1 mes para
Coordinaciones de Red/Municipio.
Jeringas para la vacuna contra la Hepatitis B
Tabla N°53: Jeringas para vacuna H.B.
Tipo
CONSIDERACIÓN PARA PROGRAMACIÓN
Para
aplicación
la cantidad necesaria se obtiene de la sumatoria del
Jeringa Auto Destructible (AD)
personal de salud y la población en riesgo por tres
de 1 ml con aguja 22G x 1 1/2”
dosis, más el factor pérdida del 2 %.
Manual Técnico del Programa Ampliado de Inmunización
Uso
317
Cálculo para Nivel Central y Departamental
Stock de reserva de 3
meses (jeringa aplicación)
Stock de reserva de 3
meses (vacuna)
337
L
342
K
Total requerimiento anual
jeringas aplicación
J
1.370
Total requerimiento anual
de vacunas
Factor perdida 2%
Factor perdida 0,5%
I
27
D x 3 dosis
1.343
H
Jeringa de aplicación de 1
ml 22 g x 1 1/2”
G
1.343
F
1.350
E
7
D
Sub total
0,1 % de la población total
Población en riesgo
C
149
0,2% de la población total
Personal de salud
298
149.214
Bolivia
A
B
C
D
E
F
G
H
I
J
K
L
B
Población total
País / Departamento
A
448
Tabla N° 54: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS PARA HEPATITIS B (UNIDOSIS)
Población total
0.2 % de la población total
0.1 % de la población total
B+C
D x 3 dosis
0.5 % de E (factor pérdida)
E+F
E
2 % de H
H+I
G ÷ 4 (stock de reserva de 3 meses - Vacuna)
J÷ 4 (stock de reserva de 3 meses - Jeringa de Aplicación)
318
Bolivia
Total 4to
Trimestre
Stock de
reserva
4to
3er
2do
Trimestral vacunas
1er
Requerimiento
anual*
Detalle
País /
Departamento
Serie: Documentos Técnico Normativos
Posteriormente, se procede a la programación por trimestres.
Vacuna HB
1.687
337
337
337
337
337
674
Jeringa
aplicación
1.685
342
342
342
342
342
685
* El requerimiento anual es la suma de la programación anual + el stock de reserva.
Cálculo para Nivel Coordinación de Red / Municipio
Tabla N° 55: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS PARA HEPATITIS B (UNIDOSIS)
118
Stock de reserva de 1 mes
(jeringa aplicación)
116
1.417
L
Stock de reserva de 1 mes
(vacuna)
K
Total requerimiento anual
jeringas de aplicación
J
28 Factor perdida 2%
I
Jeringas de aplicación de 1 ml
22 g x 1 1/2” anual
H
1.389
G
1.396 Total requerimiento anual HB
F
7 Factor perdida 0,5%
1.389 D x 3 dosis
E
463 Sub total
0,1 % de la población total
Población en riesgo
D
154
0,2% de la población total
Personal de salud
C
309
Central
A
B
C
D
E
F
G
H
I
J
K
L
B
154.355 Población total
Coordinación de Red /
Municipio
A
3er
4to
Población total
0.2 % de la población total
0.1 % de la población total
B+C
D x 3 dosis
0.5 % de E (factor pérdida)
E+F
E
2 % de H
H+I
G ÷ 12 (Stock de reserva de 1 mes - Vacuna)
J÷ 12 (Stock de reserva de 1 mes - Jeringa de Aplicación)
Coordinación
de Red /
Detalle
Municipio
Central
Trimestral vacunas
Requerimiento
Stock Total 1er
anual
1er
2do
reserva Trimestre
Vacuna
Hepatitis B
1.512
349
116
465
349
349
349
Jeringa
aplicación
1.535
354
118
472
354
354
354
Manual Técnico del Programa Ampliado de Inmunización
Posteriormente, se procede a la programación por trimestres.
319
cálculo para Establecimiento de Salud
A
B
C
D
E
F
G
H
I
J
Factor perdida 2%
Total requerimiento anual
de jeringas de aplicación
1.417
J
28
Total requerimiento anual
HB
I
Jeringas de aplicación de 1
ml 22 g x 1 1/2”
Factor perdida 0,5%
H
1.389
G
1.396
F
7
E
1.389
Sub total
D
463
0,1 % de la población total
Población en riesgo
154
0,2% de la población total
Personal de salud
C
309
Población total
B
154.355
Asistencia
Establecimiento de salud
Pública
A
D x 3 dosis
Tabla N° 56: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS PARA HEPATITIS B (UNIDOSIS)
Población total
0.2 % de la población total
0.1 % de la población total
B+C
D x 3 dosis
0.5 % de E (factor pérdida)
E+F
E
2 % de H
H+I
Posteriormente, se procede a la programación por trimestres.
Serie: Documentos Técnico Normativos
Establecimiento de
salud
Asistencia Pública
H.
Detalle
Requerimiento
anual
Vacuna Hepatitis B
Jeringa aplicación
1er
2do
3er
4to
1.396
349
349
349
349
1.417
354
354
354
354
Vacuna Antidiftérica y Antitetánica (dT)
La población objeto de esta vacuna es la población de 7 a 49 años.
Para hacer el cálculo de la programación anual de la vacuna dT se debe considerar:
* El 30% población de 7 a 9 años de edad por dos dosis.
* El 5% de la población de 10 a 49 años de edad por dos dosis.
* Factor pérdida de 10%.
320
Trimestral vacunas
* Stock de reserva de 3 meses para el Nivel Central / Departamental y 1 mes para
Coordinaciones de Red / Municipio.
Jeringas para la vacuna Antidiftérica y Antitetánica (dT)
Tabla N°57: Jeringas para la vacuna Antidiftérica y Antitetánica (dT)
Uso
Tipo
CONSIDERACIÓN PARA PROGRAMACIÓN
Para aplicación
Jeringa Auto Destructible (AD)
de 0.5 ml con aguja 22G x 1 ½”
Para el cálculo de jeringas se
multiplica el 100 % de la población
programada por dos dosis.
Cálculo para el Nivel Central y Departamental
P
Q
R
Total de jeringas DE APLICACION Jeringas de aplicación de 0,5 ml 23 g x 1”
Factor perdida 2%
Total de jeringas DE APLICACION Stock de reserva de 3 meses (vacuna)
Stock de reserva de 3 meses (jeringa) ADULTO
Stock de reserva de 3 meses (JERINGA )
PEDIATRICO
423.192
431.656
169.970
Poblacion de 10 a 49 años hombres y mujeres
5 % de la población de 10 a 49 años
B x 3 dosis
Poblacion de 7 a 9 años hombres y mujeres
30 % de la población de 7 a 9 años
E x 2 dosis
C+F
10% de G como factor de perdida
G+H
I (Redondeado a multiplo de 10 )
107.914
O
49.698
Ñ
198.792
j
8.464
N
Factor perdida 2%
I
3.898
Factor PERDIDA 10%
61.809
M
Jeringas de aplicación de 0,5 ml 22 g x 11/2”
sub Total de vacunas
618.087
L
194.895
E POR DOS DOSIS
423.192
K
TOTAL A SOLICITAR ANUAL
Total vacunas (redondeado)
5 %Población de 10 a 49 años
B POR 3 DOSIS
POBLACION DE 7 A 9 AÑOS hombres y mujeres
30% Población De 7 a 9 años
H
64.965
194.895
705.320
211.596
POBLACION DE 10 A 49 AÑOS HOMBRES Y MUJERES
1.299.297
Bolivia
A
B
C
D
E
F
G
H
I
J
G
Manual Técnico del Programa Ampliado de Inmunización
País / Departamento
A B C D E F
679.895
679.880
Tabla N° 58: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS PARA DIFTERIA Y TÉTANOS (dT)
(MULTIDOSIS-10)
321
K
L
M
N
Ñ
O
P
Q
R
C
el 2 % de K (Como factor de perdida)
K+L
F
2% de N
N+Ñ
J ÷ 4 (Stock de reserva de 3 meses) vacuna
M ÷ 4 (Stock de reserva de 3 meses) jeringa
O ÷ 4 (Stock de reserva de 3 meses) jeringa pediatrica
Serie: Documentos Técnico Normativos
248.491
49.698
49.698
49.698
49.698
49.698
99.396
Jeringa aplicación
pediatrica
107.914
107.914
107.914
107.914
107.914
215.828
339.940
Total 4to
Trimestre
Jeringa aplicación
Adulto
* El requerimiento anual es la suma de la programación anual + el stock de reserva.
322
Stock de
reserva
169.970
4to
169.970
3er
169.970
2do
169.970
1er
169.970
Requerimiento
anual*
Trimestral vacunas
539.570
Bolivia
Vacuna dT
849.850
Detalle
País
Posteriormente, se procede a la programación por trimestres.
A
B
C
D
E
F
G
H
I
J
K
L
M
N
Ñ
O
P
Q
R
M
N
Ñ
O
P
Q
R
Jeringas de aplicación de 0,5 ml 22 g x 11/2”
Factor perdida 2%
Total de jeringas DE APLICACION Jeringas de aplicación de 0,5 ml 23 g x 1”
Manual Técnico del Programa Ampliado de Inmunización
Poblacion de 10 a 49 años hombres y mujeres
5 % de la población de 10 a 49 años
B x 3 dosis
Poblacion de 7 a 9 años hombres y mujeres
30 % de la población de 7 a 9 años
E x 2 dosis
C+F
10% de G como factor de perdida
G+H
I (Redondeado a multiplo de 10 )
C
el 2 % de K (Como factor de perdida)
K+L
F
2% de N
N+Ñ
J ÷ 4 (Stock de reserva de 1mes) vacuna
M ÷ 4 (Stock de reserva de 1 mes) jeringa
O ÷ 4 (Stock de reserva de 1 mes) jeringa pediatrica
Factor perdida 2%
Total de jeringas DE APLICACION Stock de reserva de 1 mes (vacuna)
Stock de reserva de 1 mes (jeringa) ADULTO
Stock de reserva de 1 mes (JERINGA )
PEDIATRICO
2.116
1.540
1.246
176
41
2.075
j
14.956
I
293
L
14.663
Factor PERDIDA 10%
1.674
K
TOTAL A SOLICITAR ANUAL
Total vacunas (redondeado)
H
18.411
18.480
G
sub Total de vacunas
A B C D E F
16.737
E POR DOS DOSIS
5 %Población de 10 a 49 años
B POR 3 DOSIS
POBLACION DE 7 A 9 AÑOS hombres y mujeres
30% Población De 7 a 9 años
4.888
14.663
3.458
1.037
2.075
POBLACION DE 10 A 49 AÑOS HOMBRES Y MUJERES
coordinacion de red/ municipios
97.751
central
Cálculo para Nivel Coordinación de Red / Municipio
Tabla N° 59: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS PARA DIFTERIA Y TÉTANOS (dT)
(MULTIDOSIS-10)
Posteriormente, se procede a la programación por trimestres.
323
324
A
B
C
D
E
F
G
H
I
D
5 %Población de 10 a 49
años
B POR 3 DOSIS
POBLACION DE 7 A 9 AÑOS hombres y mujeres
E
Poblacion de 10 a 49 años hombres y mujeres
5 % de la población de 10 a 49 años
B x 3 dosis
Poblacion de 7 a 9 años hombres y mujeres
30 % de la población de 7 a 9 años
E x 2 dosis
C+F
10% de G como factor de perdida
G+H
Factor PERDIDA 10%
N
Ñ
O
Factor perdida 2%
Total de jeringas DE APLICACION 3.739
3.739
529
3.739
529
529
4.985
4.620
4.620
4.620
6.160
1.540
3er
2.116
M
Jeringas de aplicación de
0,5 ml 23 g x 1”
705
1.246
Requerimiento
anual*
2do
41
L
Total de jeringas DE APLICACION 176
4.620
20.020
Total
1er.
2.075
14.956
K
Factor perdida 2%
j
Jeringas de aplicación de
0,5 ml 22 g x 11/2”
3.739
16.202
Stock reserva
293
I
14.663
529
2.293
Detalle
Coordinación
de Red /
Municipio
1er
18.480
TOTAL A SOLICITAR ANUAL
Total vacunas
(redondeado)
H
18.411
G
1.674
F
sub Total de vacunas
Jeringa aplicación
pediatrica
16.737
Jeringa aplicación
Adulto
2.075
C
30% Población De 7 a 9
años
E POR DOS DOSIS
B
1.037
3.458
14.663
A
POBLACION DE 10 A 49 AÑOS HOMBRES Y MUJERES
coordinacion de red/
municipios
Central
4.888
97.751
central
Serie: Documentos Técnico Normativos
Vacuna dT
trimestral vacunas
4to
* El requerimiento anual es la suma de la programación anual + el stock de reserva.
Cálculo para Establecimiento de Salud
Tabla N° 60: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS PARA DIFTERIA Y TÉTANOS (dT)
(MULTIDOSIS-10)
J
K
L
M
N
Ñ
O
I (Redondeado a multiplo de 10 )
C
el 2 % de K (Como factor de perdida)
K+L
F
2% de N
N+Ñ
Posteriormente, se procede a la programación por trimestres.
Establecimiento
Detalle
de Salud
Asistencia
Pública
I.
Requerimiento
anual
Trimestral vacunas
1er.
2do.
3er.
4to.
Vacuna dT (G)
18.360
4.590 4.590
4.590
4.590
Jeringa
aplicación (J)
17.025
4.256 4.256
4.256
4.256
Vacuna AntiNeumocócica
La población objeto de esta vacuna son las niñas y niños menores de un año.
Para hacer el cálculo de la programación anual de la vacuna contra el Neumococo se debe
considerar:
* 100% de la población menor de un año por tres dosis.
* Factor pérdida de 0.5%
* Stock de reserva de 3 meses para el nivel Central/Departamental y 1 mes para
Coordinaciones de Red/Municipio.
Tabla N°61: Jeringas para la vacuna contra el Neumococo
Uso
Tipo
CONSIDERACIÓN PARA PROGRAMACIÓN
Para aplicación
Jeringa Auto Destructibles (AD) de
0.5 ml. Con aguja 23G x 1”
La cantidad se obtiene de la población
menor de un año por 3 dosis.
Manual Técnico del Programa Ampliado de Inmunización
Jeringas para la vacuna contra el Neumococo
325
Cálculo para Nivel Central y Departamental
H
Factor perdida
2%
Total jeringa De
aplicación
743.115
Stock de reserva
183.047 de 3 meses
(vacuna)
F
I
Stock de reserva
185.779 de 3 meses
(jeringa)
G
14.571
Población menor
728.544 de 1 año X 3
dosis
E
jeringa de
728.544 aplicación de 0,5
ml 23 gx1”
Población menor
Menor de 1 año
242.848
D
Total
732.187 requerimiento
anual vacuna
País /
Departamento
A
B
C
D
E
F
G
H
I
C
Factor Pérdida
0,5%
B
3.643
A
BOLIVIA
Tabla N°62: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS PARA NEUMOCOCO (UNIDOSIS)
100% de la población menor de 1 año
A x 3 dosis
0.5 % de B (factor pérdida)
B+C
B
2 % de E
E+F
D ÷ 4 (stock de reserva de 3 meses - Vacuna)
G ÷ 4 (stock de reserva de 3 meses - Jeringa)
326
Vacuna
Neumococo
(D+H)
183.047
183.046
183.047
366.093
Jeringa
aplicación (G+I)
185.778
185.779
371.557
Total 4to
Trimestre
185.779
Stock de
reserva
183.047
4to
185.779
3er
183.047
2do
185.778
Requerimiento
anual*
1er
915.234
Detalle
Trimestral vacunas
928.894
Serie: Documentos Técnico Normativos
Bolivia
Departamento
País /
Posteriormente, se procede a la programación por trimestres.
* El requerimiento anual es la suma de la programación anual + el stock de reserva.
cálculo para Nivel Coordinación de Red/Municipio
A
B
C
D
E
F
G
H
I
I
Stock de 1 mes
(vacuna)
Stock de 1 mes
(jeringa aplicación)
2.872
169 Factor Pérdida 0,5%
H
2.830
Población menor de
1 año X 3 dosis
33.786
F
G
Total, requerido
34.462 anual de jeringa 23
g x 1 -0.5 ml
Población menor de
1 año
11.262
E
676 Factor perdida de 2%
Coordinación de Red
/ Municipio
D
requerido
33.786 anual, jeringa.23
gx1 -0,5 ml
C
Total requerimiento
anual vacuna
B
33.955
A
Central
Tabla N° 63: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS PARA NEUMOCOCO (UNIDOSIS)
100% de la población menor de 1 año
A x 3 dosis
0.5 % de B (factor pérdida)
B+C
B
2 % de E
E+F
D ÷ 12 (stock de reserva de 1 mes - Vacuna)
G ÷ 12 (stock de reserva de 1 mes - Jeringa)
Detalle
Requerimiento
anual*
Central
Vacuna Neumococo
(D+H)
36.785
8.488
2.830
11.318
8.489
8.489
8.489
Jeringa aplicación
(G+I)
37.334
8.615
2.872
11.487
8.616
8.615
8.616
Trimestral vacunas
1er
Stock reserva
Total
1er
* El requerimiento anual es la suma de la programación anual + el stock de reserva.
2do
3er
4to
Manual Técnico del Programa Ampliado de Inmunización
Coordinación de
Red / municipio
Posteriormente, se procede a la programación por trimestres.
327
Cálculo para Establecimiento de Salud
Asistencia
Pública
A
B
C
D
E
F
G
Factor Pérdida 0,5%
11.262
57
E
F
11.319
11.262
G
Total requerimiento
anual de jeringa de
aplicación
Población menor de 1
año X 3 dosis
3.754
D
Factor perdida de 2%
C
jeringa de aplicación
de 0,5 ml 23 gx1”
B
Total, requerimiento
anual vacuna
A
Población menor de 1
año
Establecimiento de
Salud
Tabla N° 64: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS PARA NEUMOCOCO (UNIDOSIS)
226
11.488
100% de la población menor de 1 año
A x 3 dosis
0.5 % de B (factor pérdida)
B+C
B
2 % de E
E+F
Posteriormente, se procede a la programación por trimestres.
Establecimiento
de Salud
Asistencia Pública
J.
Detalle
Vacuna
Neumococo
Jeringa aplicación
Requerimiento
anual
Trimestral vacunas
1er.
2do.
3er.
4to.
11.319
2.830
2.830
2.830
2.829
11.488
2.872
2.872
2.872
2.872
Vacuna para Polio Inactivada (IPV)
Serie: Documentos Técnico Normativos
La población objeto para la aplicación de esta vacuna son las niñas y niños menores de un
año.
328
Para hacer el cálculo de la programación anual de la vacuna IPV Polio Inactivada se considera:
* 100 % población menor de un año por dos dosis.
* Factor pérdida de 10%.
* Stock de reserva de 3 meses para el nivel Central/Departamental y 1 mes para
Coordinaciones de Red/Municipio.
Jeringas para la vacuna para Antipoliomelítica Inactivada (IPV)
Tabla N°65: Jeringas para la vacuna para Polio Inactivada (IPV)
Uso
Tipo
CONSIDERACIÓN PARA PROGRAMACIÓN
Para aplicación
Se obtiene la cantidad de jeringas
Jeringa Auto Destructible (AD) de
multiplicando la población menor de 1 año
0.5 ml. con aguja 23G x 1”
por 2 dosis.
Cálculo para el Nivel Central y Departamental
J
Stock de reserva
123.852 3 meses (jeringa
aplicación)
Stock de reserva 3
meses (vacuna)
Factor perdida de
2%
9.714
I
133.570
jeringas 0.5 ml x
23 g x 1”
H
Total
495.410 requerimiento
jeringa aplicación
G
485.696
Población menor
de 1 año X 2 dosis
485.696
F
Total redondeado
múltiplo 5
Población menor
de 1 año
242.848
E
534.280
País /
Departamento
D
100% de la población menor de 1 año
A x 2 dosis.
10 % de B (factor pérdida)
B+C
D (redondear a múltiplo de 5 por ser multidosis)
B
2 % de F
F+G
E ÷ 4 (stock de reserva de 3 meses - Vacuna)
H ÷ 4 (stock de reserva de 3 meses - Jeringa)
Stock Total 4to.
reserva Trimestre
247.704 267.140
4to.
123.852 133.570
3er.
123.852 133.570
Requerimiento
anual*
2do
123.852 133.570
Jeringa
aplicación
(H+J)
1er
123.852 133.570
Bolivia
trimestral vacunas
123.852 133.570
Vacuna
IPV (E+I)
619.262 667.850
Detalle
País /
Departamento
Posteriormente, se procede a la programación por trimestres.
Manual Técnico del Programa Ampliado de Inmunización
A
B
C
D
E
F
G
H
I
J
C
Sub total
534.266 requerimiento
(B+C)
B
48.570 Factor Pérdida 10%
A
Bolivia
Tabla N° 66: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS PARA POLIO INACTIVADA (MULTIDOSIS-5)
* El requerimiento anual es la suma de la programación anual + el stock de reserva.
329
CÁLCULO PARA Nivel Coordinación de Red / Municipio
I
J
Total requerimiento de
jeringa de aplicación
Stock de reserva de 1 mes
(vacuna)
Stock de reserva de 1 mes
(jeringa aplicación)
319
75 Factor pérdida de 2%
H
3.829
G
jeringasde aplicación de
0.5 ml x 23 g x 1”
F
3.154
Total, requerimiento
4.140 anual redondeado
(múltiplo 5)
E
Sub total Requerimiento
(B+C)
D
4.129
C
750 Factor Pérdida 10%
Población menor de 1 año
X 2 DOSIS
7.508
B
345
A
B
C
D
E
F
G
H
I
J
A
3.754 Población menor de 1 año
Central
Coordinación de Red /
Municipio
Tabla N°67: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS PARA POLIO INACTIVADA (MULTIDOSIS-5)
2do
3er
4to
100% de la población menor de 1 año
A x 2 dosis.
10 % de B (factor pérdida)
B+C
D (redondear a múltiplo de 5 por ser frascos multidosis)
B
2 % de F
F+G
E ÷ 12 (stock de reserva de 1 mes - Vacuna)
H ÷ 12 (stock de reserva de 1 mes - Jeringa)
330
Central
Requerimiento
anual*
Detalle
Coordinación
de Red /
Municipio
Serie: Documentos Técnico Normativos
Posteriormente, se procede a la programación por trimestres.
Trimestral vacunas
1er
Stock Total 1er
reserva Trimestre
Vacuna IPV (E+I)
4.485
1.035
345
1.380
1.035
1.035
1.035
Jeringa
aplicación (H+J)
4.148
957
319
1.276
957
957
957
* El requerimiento anual es la suma de la programación anual + el stock de reserva.
Cálculo para establecimiento de Salud
Asistencia
Pública
A
B
C
D
E
F
G
H
B
C
D
E
F
G
Población menor de 1 año
x 2 dosis
Factor Pérdida 10%
Sub total Requerimiento
(A+B)
Total requerimiento
anual redondeado
(múltiplo 5)
jeringa de aplicación de
0.5 ml x 23 g x 1”
Factor perdida de 2%
3.754
7.508
750
4.129
4.140
3.154
H
Total requerimiento
anual jeringa de
aplicación
A
Población menor de 1 año
Establecimiento de Salud
Tabla N° 68: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS PARA POLIO INACTIVADA (MULTIDOSIS-5)
75
3.829
100% de la población menor de 1 año
A x 2 dosis
10 % de B (factor pérdida)
B+C
D (redondear a múltiplo de 5 por ser frasco multidosis)
B
2 % de F
F+G
Posteriormente, se procede a la programación por trimestres.
Establecimiento
de Salud
K.
Requerimiento
anual
Trimestral vacunas
1er.
2do.
3er.
4to.
Vacuna IPV (E)
41.140
1.035
1.035
1.035
1.035
Jeringa
aplicación (H)
3.829
958
957
957
957
Vacuna para Influenza Pediátrica
La población objeto para la aplicación de esta vacuna son los niños y niñas menores de un
año y de 12 a 23 meses.
Para hacer el cálculo de la programación anual de la vacuna contra la Influenza Pediátrica se
considera:
* El 50% de la población menor de un año por dos dosis.
* El 100% de la población de 12 a 23 meses por una dosis.
* Factor pérdida de 10%.
Manual Técnico del Programa Ampliado de Inmunización
Asistencia Pública
Detalle
331
Jeringas para la vacuna contra la Influenza Pediátrica
Tabla N° 69: Jeringas para la vacuna contra la Influenza Pediátrica
Uso
Tipo
CONSIDERACIÓN PARA PROGRAMACIÓN
Para aplicación
Jeringa de 1 ml. con
aguja 23G x 1”
* El 50% de la población menor de un año por dos dosis.
* El 100% de la población de 12 a 23 meses por una dosis.
* Factor pérdida de 2%.
Cálculo para Nivel Central y Departamental
A
B
C
D
E
F
G
H
I
Total
553.500 Redondeado
(múltiplos de 20)
Jeringas de
485.000 aplicación de 1
ml 23 g x 1
H
I
Total
requerimiento
494.700
de Jeringasde
aplicación
G
Factor pérdida
2%
F
9.700
E
533.500 Total Vacunas
100% de la
242.152 población de 12
De 23 meses
D
Factor Pérdida
10%
50% Población <
1 año X 2 dosis
C
48.500
B
485.000 Subtotal (A+B)
A
242.848
Bolivia
País /
Departamento
Tabla N°70: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS PARA INFLUENZA PEDIÁTRICA (MULTIDOSIS-20)
50 % de la población menor de 1 año x 2 dosis
100 % de la población de 1 año x 1 dosis
A+B
10 % de C (factor pérdida)
C+D
E (redondear múltiplos de 20)
C
2 % de G (factor pérdida)
G+H
Serie: Documentos Técnico Normativos
Posteriormente, se procede a la programación por trimestres.
332
País /
Departamento
Bolivia
Detalle
Requerimiento
anual
trimestral vacunas
1er.
2do.
3er.
4to.
Vacuna Influenza
pediátrica (F)
533.500
N/A
533.500
N/A
N/A
Jeringa aplicación (I)
494.700
N/A
494.700
N/A
N/A
N/A (No Aplica) por ser una vacuna estacional.
Cálculo para Nivel Coordinación de Red/Municipio
A
B
C
D
E
F
G
H
I
Total Requerimiento
Jeringas de aplicación
I
16.524
H
324 Factor Pérdida 2%
Total Redondeado
(múltiplos de 20)
17.820
G
Jeringas de aplicación
de 1 ml 23 g x 1
F
16.200
E
Total Requerimiento de
Vacunas
100% de la población de
12 a 23 meses X 1 dosis
8.000
D
17.820
50% Población < 1 año X 2 dosis
C
1.620 Factor Pérdida 10%
B
16.200 Subtotal (A+B)
A
8.200
Central
Coordinación de Red /
Municipio
Tabla N°71: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS PARA INFLUENZA PEDIÁTRICA (MULTIDOSIS-20)
50 % de la población menor de 1 año x 2 dosis.
100 % de la población de 12 a 23 meses x 1 dosis.
A+B
10 % de C (factor pérdida)
C+D
E (redondear múltiplos de 20)
C
2 % de G (factor pérdida)
G+H
Posteriormente, se procede a la programación por trimestres.
Central
Detalle
Requerimiento
anual
Trimestral vacunas
1er.
2do.
3er.
4to.
Vacuna Influenza
pediátrica (F)
17.820
N/A
17.820
N/A
N/A
Jeringa aplicación (I)
16.524
N/A
16.524
N/A
N/A
N/A (No Aplica) por ser una vacuna estacional.
Manual Técnico del Programa Ampliado de Inmunización
Coordinación
de Red /
Municipio
333
Cálculo para Establecimiento de Salud
I
G+H
Detalle
Requerimiento
anual
I
Total Requerido
Jeringas
H
7.038
G
Factor Pérdida 2%
F
138
Jeringas 1 ml. 23 g
x1
6.900
6.900
Total Redondeado
(múltiplos de 20)
Subtotal (A+B)
3.400
7.600
100% de la
población De 12 a 23
meses X 1 dosis
Total Requerimiento
de Vacunas
50% Población < 1
año X 2 dosis
50 % de la población menor de 1 año x 2 dosis
100 % de la población de 12 a 23 meses x 1 dosis
A+B
10 % de C (Factor pérdida)
C+D
E (Redondear múltiplos de 20)
C
2 % de G (Factor pérdida)
Vacuna
Influenza
Asistencia Pública pediátrica (F)
Jeringa
aplicación (I)
Serie: Documentos Técnico Normativos
E
A
B
C
D
E
F
G
H
Establecimiento
de Salud
334
D
7.590
C
Factor Pérdida 10%
B
690
A
3.500
Asistencia Establecimiento de
Pública Salud
Tabla N°72: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS PARA INFLUENZA PEDIÁTRICA (MULTIDOSIS-20), GESTIÓN 2021
trimestral vacunas
1er
2do
3er
4to
7.600
N/A
7.600
N/A
N/A
7.038
N/A
7.038
N/A
N/A
N/A (No Aplica) por ser una vacuna estacional.
L.
Vacuna para Influenza Adultos
La población objeto para la aplicación de esta vacuna es la población mayor de 60 años,
embarazadas, personal de salud y personas con enfermedad de base.
Para hacer el cálculo de la programación anual se considera:
* El 100% de la población mayor de 60 años.
* El 50% población de embarazadas.
* E 100% del personal de salud.
* El 3% de la población de 2 a 59 años (personas con enfermedad de base, excluyendo a
embarazada).
* El factor pérdida de 10%.
Jeringas para la vacuna contra la Influenza Adulto
Tabla N° 73: Jeringas para la vacuna contra la Influenza Adulto
Uso
Tipo
Para el cálculo de jeringas se toma
en cuenta al 100% de la población
programada para una dosis.
Jeringa Auto Destructible (AD) de
Para aplicación
0.5 ml con aguja 22G x 1 1/2”
Cálculo para el Nivel Central y Departamental
A
B
C
D
E
F
G
H
I
J
K
L
M
H
I
J
K
L
M
50% de embarazadas
Sub total
(C+D+E+F)
Factor pérdida 10 %
Total requerimiento
anual
Redondear para frascos
multidosis (10 dosis)
Jeringas 0,5 ml 22 g x 1
1/2
Factor perdida 2 %
Total requerimiento
anual
137.816
212.947
2.342.419
2.342.420
2.129.472
100 % de la población total
100 % de embarazadas
100 % de la población mayor a 60 años
100 % del personal de salud
3 % de la población total de 2 a 59 años (personas con enfermedad de base)
50% de B (meta en mujeres embarazadas)
C+D+E+F
10 % de G (factor pérdida)
G + H (requerimiento anual)
I (redondear múltiplos de 10 por ser frasco multidosis)
G (jeringas anual de aplicación)
2 % K (factor de pérdida)
K+L
2.172.062
G
42.590
F
2.129.472
E
Personas con enfermedad
de base de 2 a 59 años
D
334.451
C
557.420 personal de salud
Población total de
embarazadas
275.631
11.148.371 Población total
B
Manual Técnico del Programa Ampliado de Inmunización
Bolivia País / Departamento
A
1.099.785 Población > 60 años
Tabla N° 74: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS PARA INFLUENZA ADULTOS (MULTIDOSIS-10)
335
País /
Departamento
Requerimiento
anual
Detalle
Vacuna Influenza
adultos (J)
Bolivia
Trimestral vacunas
1er
2.342.420
Jeringa
aplicación (M)
2.172.062
2do
3er
4to
N/A
2.342.420
N/A
N/A
N/A
2.172.062
N/A
N/A
N/A (No Aplica) por ser una vacuna estacional.
Cálculo para el Nivel Coordinación de Red/Municipio
Serie: Documentos Técnico Normativos
336
A
B
C
D
E
F
G
H
I
J
K
L
M
D
E
F
G
H
I
J
K
L
M
Población > 60 años
personal de salud total
Personas con enfermedad de base
50% embarazadas Sub total (C+D+E+F)
Factor perdida 10 %
Total requerimiento anual
Total Redondeado (10 dosis)
Jeringa de aplicación de 0,5 ml. 22 g x 1 1/2”
Factor perdida 2 %
Total requerimiento anual
7.763
1.500
4.631
2.205
16.099
1.610
17.709
17.710
16.099
100 % de la población total
100 % de embarazadas
100 % de la población mayores de 60 años
100 % del personal de salud
3 % de la población total de 2 a 59 años (personas con enfermedades de base)
50% de B (meta en embarazadas)
C+D+E+F
10 % de G (Factor pérdida)
G + H (Requerimiento anual)
I (Redondear múltiplos de 10 por ser multidosis)
G (Jeringas anual de aplicación)
2 % K (Factor de pérdida)
K+L
16.420
C
322
B
Población total de embarazadas 154.355 Población total
Central
Coordinación de Red / Municipio
A
4.409
Tabla N° 75: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS PARA INFLUENZA ADULTOS (MULTIDOSIS-10)
Posteriormente, se procede a la programación por trimestres.
Coordinación de
Red / Municipio
Central
Requerimiento
anual
Detalle
Trimestral vacunas
2do.
3er.
1er.
4to.
Vacuna
Influenza
adultos (J)
17.710
N/A
17.710
N/A
N/A
Jeringa
aplicación (M)
16.421
N/A
16.421
N/A
N/A
N/A (No A Aplica) por ser una vacuna estacional.
Cálculo para Establecimiento de Salud
A
B
C
D
E
F
G
H
I
J
K
L
M
I
J
Población total
Población total de embarazadas Población > 60 años
Personal de salud
Personas con enfermedad de base
50% de embarazadas
Sub total (C+D+E+F)
Factor perdida 10 %
Total requerimiento anual
total Redondeado
505
763
165
452
253
1.633
163
1.796
1.800
100 % de la población total
100 % de embarazadas
100 % de la población mayor a 60 años
100 % del personal de salud
3 % de la población total de 2 a 59 años (personas con enfermedad de base)
50% de B (meta en mujeres embarazadas)
C+D+E+F
10 % de G (Factor pérdida)
G + H (Requerimiento anual)
I (Redondear múltiplos de 10 por ser frasco multidosis)
G (Jeringas de aplicación para periodo anual)
2 % K (Factor pérdida)
K+L
K
L
M
Total requerimiento anual
H
1.666
G
Factor perdida 2 %
F
33
E
22 g x 1 1/2”
D
Jeringa de aplicación de 0,5 ml.
C
1.633
B
15.355
A
Manual Técnico del Programa Ampliado de Inmunización
Asistencia
Pública
Establecimiento de salud
Tabla N° 76: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS PARA INFLUENZA ADULTOS (MULTIDOSIS-10)
Posteriormente, se procede a la programación por trimestres.
337
Establecimiento
de Salud
Asistencia Pública
Trimestral vacunas
Requerimiento
anual
Detalle
1er
2do
3er
4to
Vacuna Influenza
adultos (J)
1.800
N/A
1.800
N/A
N/A
Jeringa aplicación (M)
1.666
N/A
1.666
N/A
N/A
N/A (No Aplica) por ser una vacuna estacional.
M.
Vacuna contra el Virus del Papiloma Humano (VPH)
La población objeto para la aplicación de esta vacuna son las niñas de 10 años.
Para hacer el cálculo de la programación anual para vacuna contra el VPH se considera:
* El 100% de niñas de 10 años por dos dosis.
* Factor pérdida de 0.5%.
* Stock de reserva de seis meses para el Nivel Central/Departamental y un mes en
Coordinaciones de Red/Municipios.
Jeringas para la vacuna VPH
Tabla N° 77: Jeringas para la vacuna VPH
Uso
Tipo
CONSIDERACIÓN PARA PROGRAMACIÓN
Para aplicación
Jeringa Auto Destructible (AD)
de 1 ml con aguja 25G x 1”
100 % de la población de niñas
de 10 años por dos dosis.
Cálculo para Nivel Central y Departamental
338
A
B
C
D
H
I
Stock de reserva
126.603 de 3 meses (jeringa
aplicación)
Jeringa de
248.240 aplicación de 1 ml
25gx1”
G
Stock de reserva
124.741 de 3 meses
(vacuna)
Total
249.481 requerimiento
anual vacuna
100 % de la población de niñas de 10 años
A x 2 dosis
0.5 % de B (factor pérdida)
B+C
F
Total
253.205 requerimiento
anual jeringa
E
Factor pérdida 2%
D
4.965
C
1.241
total x 2 dosis
Población
Población de niñas
10 años
124.120
B
248.240
País /
Departamento
Bolivia
Serie: Documentos Técnico Normativos
A
Factor pérdida
0,5%
Tabla N° 78: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS CONTRA EL VIRUS DEL PAPILOMA HUMANO (VPH) (UNIDOSIS)
E
F
G
H
I
B
2 % de E (factor pérdida)
E+F
D ÷ 4 (stock de reserva para 3 meses - Vacuna)
G ÷ 4 (stock de reserva de 3 meses - Jeringa de Aplicación)
Posteriormente, se procede a la programación semestral.
País /
Departamento
Bolivia
Detalle
Requerimiento
anual*
1er
Semestral vacunas
Stock de Total 2do
2do
reserva semestre
Vacuna
VPH (D+H)
374.222
124.741
124.740
124.741
249.481
Jeringa
aplicación
(G+I)
379.808
126.602
126.603
126.603
253.206
* El requerimiento anual es la suma de la programación anual + el stock de reserva.
Cálculo para Nivel Coordinación de Red/Municipio
C
D
E
F
G
H
I
Coordinación de Red /
Municipio
Población mujeres 10
años
Población total x 2
dosis
Factor pérdida 0,5%
Total, requerimiento
anual vacuna
Jeringa de aplicación
de 1 ml 25gx1”
Factor pérdida 2%
Total requerimiento
anual jeringa
Stock de reserva de 1
mes (vacuna)
Stock de reserva
de 1 mes (jeringa
aplicación)
3.528
7.056
36
7.092
7.056
7.197
591
600
100 % de la población de niña de 10 años
A x 2 dosis
0.5 % de B (factor pérdida)
B+C
B
2 % de E (factor pérdida)
E+F
D ÷ 12 (stock de reserva para 6 meses) Vacuna
G ÷ 12 (stock de reserva de 6 meses) Jeringa de Aplicación
141
B
Manual Técnico del Programa Ampliado de Inmunización
A
B
C
D
E
F
G
H
I
A
Central
Tabla N° 79: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS CONTRA A EL VIRUS DEL PAPILOMA HUMANO (VPH) (UNIDOSIS)
339
Central
Semestral vacunas
Requerimiento
anual*
Detalle
Coordinación
de Red /
Municipio
Posteriormente, se procede a la programación semestral.
1ro
Stock Total 1er
reserva semestre
2do
Vacuna VPH (D+H)
7.683
3.546
591
4.137
3.546
Jeringa aplicación (G+I)
7.797
3.598
600
4.198
3.599
* El requerimiento anual es la suma de la programación anual + el stock de reserva.
cálculo para el Establecimiento de Salud
Serie: Documentos Técnico Normativos
A
B
C
D
E
F
G
Factor pérdida
0,5%
3.528
18
E
F
3.546
3.528
71
3.599
100 % de la población de niñas de 10 años
A x 2 dosis
0.5 % de B (factor pérdida)
B+C
B
2 % de E (factor pérdida)
E+F
Posteriormente, se procede a la programación por semestre.
Establecimiento de
salud
Asistencia Pública
n.
Detalle
Requerimiento
anual
Semestral vacunas
1ro.
2do.
Vacuna VPH (D)
3.546
1.773
1.773
Jeringa
aplicación (G)
3.599
1.800
1.799
Vacuna contra Sarampión y Rubeola (SR)
La población objeto de esta vacuna es la población de 5 a 49 años.
340
G
Total,
requerimiento
anual jeringa
Población total x
2 dosis
1.764
D
Factor perdida 2%
C
Jeringa de
aplicación de 1 ml
25gx1”
B
Total,
requerimiento
anual vacuna
Asistencia
Pública
A
Población Mujeres
10 años
Establecimiento de
Salud
Tabla N°80: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS PARA EL VIRUS DEL PAPILOMA HUMANO (VPH) (UNIDOSIS)
Para hacer el cálculo de la programación anual de la vacuna SR se considera:
* El 5% de la población de 5 a 49 años por una dosis.
* Factor pérdida de 0.5%.
* Stock de reserva para 3 meses para el Nivel Central/Departamental y 1 mes para
Coordinaciones de Red/Municipio.
Jeringas para la vacuna SR
Tabla N°81: Jeringas para SR
Uso
Tipo
CONSIDERACIÓN PARA PROGRAMACIÓN
Para aplicación
Jeringa Auto Destructible (AD)
de 0.5 ml con aguja 25G x ⅝”
Es igual a la población objeto más un 2%
de factor pérdida y el stock de reserva.
Para dilución
Jeringa de 1 ml con
aguja 25G x 1 1/2”
Cantidad similar al total de
requerimiento anual vacuna SR.
Cálculo para Nivel Central y Departamental
K
Stock de reserva de 3
meses (jeringa aplicación)
Stock de reserva de 3
meses (jeringa dilución)
99.592
J
101.584
1 ml. 25 g x 1 1/2
Jeringa dilución anual
I
Stock de reserva de 3
meses (vacuna)
406.335
Población de 5 a 49 años
5 % de A
0.5 % de B (factor pérdida)
B + C (requerimiento anual)
B
2 % de E
E+F
B
D ÷ 4 (stock de reserva para 3 meses - Vacuna)
G ÷ 4 (Stock de reserva para 3 meses -Jeringa de aplicación)
H ÷ 4 (Stock de reserva para 3 meses - Jeringa de dilución)
H
398.368
G
Total, requerimiento anual
jeringa aplicación
F
7.967 Factor pérdida 2%
Anual 0,5 ml. 25 g x 5/8
Jeringa aplicación
E
398.368
Total, requerimiento anual
vacuna
D
400.360
C
1.992 Factor pérdida 0.5%
5% de la población total,
de 5 a 49 años x 1 dosis
398.368
7.967.357 Población de 5 a 49 años
Bolivia
A
B
C
D
E
F
G
H
I
J
K
B
Manual Técnico del Programa Ampliado de Inmunización
País / Departamento
A
100.090
Tabla N°82: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS CONTRA SARAMPIÓN Y RUBEOLA (SR) (UNIDOSIS)
341
Bolivia
Requerimiento
anual
Detalle
País /
Departamento
Posteriormente, se procede a la programación por trimestres.
Trimestral vacunas
1er
2do
3er
4to
Stock de
reserva
Total 4to
Trimestre
Vacuna
SR (D+I)
500.450
100.090
100.090
100.090
100.090
100.090
200.180
Jeringa
aplicación
(G+J)
507.919
101.583
101.584
101.584
101.584
101.584
203.168
Jeringa
dilución
(H+K)
497.960
99.592
99.592
99.592
99.592
99.592
199.184
Cálculo para el Nivel Coordinación de Red/Municipio
342
A
B
C
D
E
F
G
H
I
J
K
I
J
K
Jeringa dilución de 1 ml.
25 g x 1 1/2”
Stock de reserva de 1
mes (vacuna)
Stock de reserva de 1
mes (jeringa aplicación)
Stock de reserva de 1
mes (jeringa dilución)
5.592
468
475
466
Jeringa aplicación anual
0,5 ml. 25 g x 5/8”
5.592
H
Total requerimiento
anual jeringa aplicación
Total requerimiento
anual vacuna
G
5.704
E
F
112 Factor pérdida 2%
D
5.620
5% de la población total
de 5 a 49 años x 1 dosis
C
28 Factor pérdida 0.5%
B
5.592
A
111.840 Población de 5 a 49 años
Central
Serie: Documentos Técnico Normativos
Coordinación de Red /
Municipio
Tabla N° 83: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS CONTRA SARAMPIÓN Y RUBEOLA (SR) (UNIDOSIS)
Población de 5 a 49 años
5 % de A
0.5 % de B (factor pérdida)
B + C (requerimiento anual)
B
2 % de E
E+F
B
D ÷ 12 (stock de reserva para 1 mes - Vacuna)
G ÷ 12 (stock de reserva para 1 mes - Jeringa de Aplicación)
H ÷ 12 (stock de reserva para 1 mes - Jeringa de Dilución)
Central
Requerimiento
anual
Detalle
Coordinación
de Red /
Municipio
Posteriormente, se procede a la programación por trimestres.
trimestral vacunas
1er
Stock reserva
Total
1er.
2do.
3er.
4to.
Vacuna SR (D+I)
6.088
1.405
468
1.873
1.405
1.405
1.405
Jeringa
aplicación (G+J)
6.179
1.426
475
1.901
1.426
1.426
1.426
Jeringa dilución
(H+K)
6.058
1.398
466
1.864
1.398
1.398
1.398
CÁLCULO PARA EL Establecimiento de Salud
C
D
E
F
G
H
Población de 5 a 49 años
5% de la población total,
de 5 a 49 años x 1 dosis
Factor pérdida 0.5%
Total, requerimiento
anual vacuna
Jeringa aplicación anual
0,5 ml. 25 g x 5/8
Factor pérdida 2%
Total requerimiento anual
jeringa aplicación
Jeringa dilución de 1 ml.
25 g x 1 1/2
1.864
10
1.874
18.64
1.902
1.864
Población de 5 a 49 años
5 % de A
0.5 % de B (factor pérdida)
B + C (requerimiento anual)
B
2 % de E
E+F
E
Posteriormente, se procede a la programación por trimestres.
38
B
37.280
Asistencia
Pública
A
B
C
D
E
F
G
H
A
Manual Técnico del Programa Ampliado de Inmunización
Establecimiento de Salud
Tabla N° 84: PROGRAMACIÓN ANUAL DE VACUNAS Y JERINGAS CONTRA SARAMPIÓN Y RUBEOLA (SR) (UNIDOSIS)
343
Establecimiento de
Detalle
Salud
Asistencia Pública
o.
Requerimiento
anual
trimestral vacunas
1er
2do
3er.
4to.
Vacuna SR (D)
1.874
468
469
468
469
Jeringa
aplicación (G)
1.902
475
476
475
476
Jeringa
dilución (H)
1.864
466
466
466
466
Programación de Cajas de Desecho Seguro
Para obtener la programación de estas cajas se debe sumar todas las jeringas (aplicación y
dilución) y el stock de reserva.
Cálculo:
9.064 (Total de jeringas para aplicación y diluir)
=76+10 (Factor pérdida) =86
120 (Jeringas por caja)
Resultado: 86 cajas de desecho seguro requeridas.
Tabla N° 85: PROGRAMACIÓN CAJAS DE DESECHO SEGURO NIVEL CENTRAL/Departamental
Serie: Documentos Técnico Normativos
País / Departamento: BOLIVIA
344
Vacuna
Jeringas para aplicar
Jeringas para dilución
BCG
309.631
91.069
Pentavalente
1.547.053
No aplica
Rotavirus
610.157
No aplica
SRP
617.488
605.380
F.A.
355.055
35.506
H.B.
133.888
No aplica
dT Adulto
1.529.740
No aplica
Neumococo
928.894
No aplica
IPV
619.262
No aplica
Influenza pediátrica
494.700
No aplica
Influenza adulto
2.172.062
No aplica
VPH
379.808
No aplica
SR
507.919
497.960
Total
10.205.656
1.229.914
Total jeringas
11.435.571
Cajas de Desecho Seguro (1)
95.296
Reserva 10 %
9.530
Total, cajas de Desecho Seguro a solicitar
104.826
(1) El cálculo se realiza por la capacidad de jeringas por caja (constante120 jeringas).
Posteriormente, se procede a la programación por trimestres.
Trimestral cajas
País /
Departamento
Requerimiento
anual*
Bolivia
104.826
1er
23.824
Stock Total
de
1er tri.
reserva
9.530
33.354
2do
3er.
23.824
23.824
4to.
23.824
* El requerimiento anual es la suma de cajas de desecho seguro y el 10% de reserva.
Tabla N° 86: PROGRAMACIÓN CAJAS DE DESECHO SEGURO NIVEL COORDINACIÓN DE RED/
MUNICIPIO
COORDINACIÓN DE RED/MUNICIPIO: Centro
Jeringas para aplicar
Jeringas para dilución
BCG
12.445
3.661
Pentavalente
61.818
No aplica
Rotavirus
22.637
No aplica
SRP
24.421
23.942
F.A.
14.042
1.404
H.B.
1.542
No aplica
dT Adulto
18.445
No aplica
Neumococo
37.334
No aplica
IPV
33.592
No aplica
Influenza pediátrica
116.524
No aplica
Influenza adulto
16.421
No aplica
VPH
7.797
No aplica
Manual Técnico del Programa Ampliado de Inmunización
Vacuna
345
SR
6.179
6.058
Total
273.196
35.065
Total jeringas
308.261
Cajas de Desecho Seguro (1)
2.569
Reserva 8.3 %
257
Total, cajas de Desecho Seguro a solicitar
2.826
(1) El cálculo se realiza por la capacidad de jeringas por caja (constante120 jeringas).
Coordinación de
Red / Municipio
Central
Trimestral cajas
Requerimiento
Anual
2.826
1er
Stock
Total
1er.
2do
3er
4to
642
257
899
642
642
642
Tabla N° 87: PROGRAMACIÓN CAJAS DE DESECHO SEGURO NIVEL ESTABLECIMIENTO DE
SALUD
Serie: Documentos Técnico Normativos
SERVICIO DE SALUD: ASISTENCIA PÚBLICA
346
Vacuna
Jeringas para aplicar
Jeringas para dilución
BCG
3.829
1.127
Pentavalente
18.990
No aplica
Rotavirus
7.546
No aplica
SRP
7.589
7.440
F.A.
4.359
436
H.B.
37
No aplica
dT Adulto
7.650
No aplica
Neumococo
11.488
No aplica
IPV
11.832
No aplica
Influenza pediátrica
7.038
No aplica
Influenza adulto
1.666
No aplica
VPH
3.599
No aplica
SR
1.902
1.864
Total
87.525
10.867
Total jeringas
98.392
Total cajas de Desecho Seguro a solicitar (1)
820
(1) El cálculo se realiza por la capacidad de jeringas por caja (constante120 jeringas).
Servicio de Salud
Requerimiento
Trimestral cajas
Anual
1er.
Asistencia Pública
8.3.4
820
205
2do
205
3er
205
4to
205
Adquisición
Las vacunas precalificadas por la OMS son adquiridas de acuerdo a lo establecido en la Ley
de vacunas N° 3300, a través del Fondo Rotatorio de la OPS; accediendo de manera continua
a vacunas que proceden indistintamente de diferentes laboratorios acreditados.
La cantidad adquirida está en base a la programación anual y trimestral realizada por el PAI
Central, la misma que es remitida con 6 meses de anticipación a la OPS para que una vez
consolidado el requerimiento de toda la región, se realice la compra a escala.
Las vacunas llegan al país trimestralmente bajo estrictas normas de conservación de cadena
de frío, son recepcionadas en aeropuerto por personal calificado y trasladadas hasta el
almacén central de vacunas.
8.3.5
Almacenamiento
Los diluyentes en el nivel central y departamental deben ser almacenados en un ambiente
exclusivo y alejado de toda fuente de calor.
En el nivel de coordinación de red, cabeceras de municipio y establecimientos de salud, deben
almacenarse dentro de los equipos de refrigeración al igual que las vacunas, en la tercera
bandeja (parte inferior del refrigerador).
Cuidado: NO congelar los diluyentes
Manual Técnico del Programa Ampliado de Inmunización
Las vacunas en el nivel central, departamental, coordinación de red, cabeceras de municipio
y establecimientos de salud, deben ser almacenadas en equipos de refrigeración (cámaras
frías, refrigeradores, congeladores), de acuerdo a la norma establecida de conservación y
almacenamiento de las vacunas. Asimismo, con la finalidad de garantizar el cumplimiento de
la normativa, se debe considerar el volumen de vacunas con relación a la carga poblacional,
requerimiento y programación anual.
347
Las jeringas y cajas de desecho seguro deben estar almacenadas en un ambiente exclusivo
y ocupar únicamente el 80% del ambiente a una temperatura máxima de 22°C. El ambiente
debe ser ventilado, las cajas deben estar separadas con una distancia que permitan la libre
circulación, libres del polvo, de humedad y evitar la exposición al sol.
Se recomienda que los estantes sean de aceroinoxidable, considerando 10 cm de distancia
con el piso y las cajas ordenadas de acuerdo a la fecha de expiración.
Cuidado: NO en el piso ni apiladas de manera desordenada.
8.3.6
Distribución
La distribución de vacunas, jeringas y cajas de desechos se realiza en base a los siguientes
criterios:
* Del nivel central a los SEDES es trimestral en base a la programación.
* Del SEDES a las Coordinaciones de Red es trimestral y/o de acuerdo a su capacidad de
almacenamiento.
* De las Coordinaciones de Red a los Establecimientos de Salud y de acuerdo a su capacidad
de almacenamiento, podrá ser programación trimestral, bimensual o mensual.
8.4
INSTRUMENTOS DEL SISTEMA DE LOGÍSTICA
El sistema de logística cuenta con instrumentos esenciales de verificación:
* Programación.
* Comprobante de Requerimiento.
* Comprobante de Despacho.
* Kardex de vacunas, diluyentes, jeringas y cajas de desecho seguro.
* Informe mensual de uso.
Serie: Documentos Técnico Normativos
* Software de logistica (VSSM)
IMPORTANTE: ¡¡¡La utilización de los formularios de logística es de uso obligatorio
en todos los niveles!!!
8.4.1
Comprobante de requerimiento
Este formulario debe ser utilizado por todos los establecimientos de salud, Coordinaciones de
Red y SEDES para solicitar trimestral o de forma mensual (según nivel) vacunas, diluyentes y
jeringas, además de las cajas de desecho seguro.
Para el llenado del formulario, tomar en cuenta lo siguiente:
a. Solicitante - Es la persona responsable que realiza el requerimiento.
348
b. Número de comprobante - Se debe colocar el número correlativo interno que corresponda
al requerimiento.
c. Fecha - De elaboración del requerimiento.
d. Cargo - De la persona solicitante.
e. Firma - De la persona que realiza el requerimiento.
f. SEDES - Nombre del SEDES correspondiente.
g. Coordinación de Red - Nombre de la Coordinación de la Red de Salud.
h. Municipio - Nombre del municipio al que corresponde el Establecimiento o la Red.
i. Establecimiento - Nombre del Establecimiento de Salud.
j. VºBº - Nombre, cargo y firma del inmediato superior.
k. Requerimiento trimestral o adicional - Se debe indicar si el requerimiento es trimestral o
adicional.
l. Tipo de vacuna o jeringa - La información del tipo de vacuna o jeringa viene registrada en
el formulario. En caso de no existir esta información, introducir el nombre del biológico o
tipo de jeringa en los espacios en blanco.
m. Programación trimestral - Anotar la cantidad trimestral programada en dosis. Este dato
se obtiene a partir de la programación anual.
n. Saldo actual - Se debe anotar la cantidad disponible de dosis de vacuna y/o piezas
de jeringas que existan al momento de la solicitud. Esta cantidad debe ser igual a la
registrada en el Kardex de existencias.
o. Número de lote - Registrar el número de lote de las vacunas y/o jeringas existentes.
q. Cantidad requerida - Registrar la cantidad que se requiere, teniendo en cuenta el saldo
con el cual se cuenta.
r. Cantidad aprobada para despacho - Está sujeta a la aprobación de los niveles superiores
correspondientes, previo análisis de uso, existencia y programación.
s. Observaciones - En este punto se deben describir las notas aclaratorias relacionadas al
requerimiento y que sean necesarias.
8.4.2
Comprobante de despacho
Este formulario es de uso y llenado obligatorio para el personal de salud de todos los niveles
que entregan vacunas y jeringas.
a.
Manual Técnico del Programa Ampliado de Inmunización
p. Fecha de expiración - Registrar la fecha de expiración de las vacunas y/o jeringas
existentes (en el caso de que solo se tenga el mes y año, considerar el ultimo dia del
mes)
A favor - Corresponde el nombre del solicitante.
349
Serie: Documentos Técnico Normativos
b.
Número de comprobante - Se coloca el número correlativo interno que corresponda al
despacho.
c.
Fecha - Se registra la fecha del despacho.
d.
Cargo - Cargo de la persona que hace la solicitud.
e.
Establecimiento - Nombre del Establecimiento de Salud.
f.
SEDES - Nombre del SEDES correspondiente.
g.
Coordinación de Red - Nombre de la Red de Salud.
h.
Municipio - Nombre del municipio al que corresponde el establecimiento o la Red.
i.
Tipo de vacuna y/o jeringa - La información del tipo de vacuna y/o jeringa ya viene
registrada en el formulario. En caso de no existir, introducir el nombre de la vacuna y/o
tipo de jeringa en los espacios en blanco.
j.
Número de lote - Registrar el número de lote de la vacuna y/o jeringa despachada.
k.
Fecha de expiración - Registrar la fecha de expiración de la vacuna y/o jeringa despachada.
l.
Cantidad despachada - Registrar la cantidad despachada de acuerdo a la cantidad
aprobada en el comprobante de requerimiento.
m
Valor unitario en bolivianos - Colocar el costo unitario por dosis que corresponde a la
vacuna o jeringa.
n.
Valor total en bolivianos - Multiplicar el precio unitario por la cantidad despachada.
ñ.
Despachado por - Registrar nombre y la firma del Encargado de Logística y el Encargado
de cadena de frío.
o.
Autorizado por - En el nivel central y departamental debe ir la firma del Administrador,
el responsable del Programa y el Director / Jefe de Epidemiologia. En los niveles de
coordinación de red, cabeceras de municipio, debe ir la firma de la encargada/ responsable
del PAI y el coordinador de Red.
p.
Acuse de recibo - El responsable de la recepción del insumo tiene que firmar, anotar
su nombre y número de carnet de identidad. Además, debe remitir el original firmado y
sellado por el personal y la institución correspondiente al lugar de origen.
q.
Observaciones - En este punto se deben describir las notas aclaratorias relacionadas al
despacho y que sean necesarias.
8.4.3
Kardex
Los kardex son una herramienta de gestión de inventarios cuyo propósito es registrar los
ingresos y egresos de vacunas e insumos.
* Kardex de existencia de vacunas
* Kardex de existencia de diluyentes
350
* Kardex de existencia de jeringas
* Kardex de cajas de desecho seguro
* Otros instrumentos del PAI
Los Kardex deben ser utilizado en todos los niveles: Establecimientos de Salud, Coordinaciones
de Red, SEDES y PAI Central.
El llenado debe ser diario o bien cuando se realize algún movimiento de ingreso o egreso, lo
que permitirá contar con registros actualizados.
Vacuna - Anotar el nombre de la vacuna.
b.
Laboratorio - Registrar el nombre del laboratorio que fabrica la vacuna.
c.
Unidosis/Multidosis -Marcar en el cuadro que corresponda, la forma de presentación del
biológico.
d.
Registrar según corresponda - SEDES, Coordinación de Red, Municipio y Establecimiento
de salud.
e.
Fecha - Se refiere a la fecha de ingreso o egreso de alguna vacuna o jeringa.
f.
Número de comprobante - Anotar el número interno de comprobante con que se recibió
o envío la vacuna.
g.
Número de lote - Registrar el número de lote de la vacuna mediante verificación física del
frasco.
h.
Fecha de expiración - Se debe registrar la fecha de expiración de la vacuna, después de
hacer la verificación correspondiente en los frascos (en el caso de que solo se tenga el
mes y año considerar el ultimo día del mes.)
i.
Costo unitario en bolivianos - Anotar el costo unitario de cada dosis en cada movimiento
(ingresos y egresos).
j.
Saldo anterior - Registrar el saldo por tipo, lote y fecha de expiración de la vacuna.
k.
Cantidad de ingreso - Se debe anotar la cantidad de dosis de la vacuna que ingresa.
l.
Cantidad disponible - Se refiere a la cantidad de dosis disponible en el momento dado.
Proviene de la suma del saldo anterior más el ingreso.
m. Cantidad del egreso - Es la cantidad de dosis de una vacuna que se despacha o es
utilizada.
n.
Origen/Destino - Lugar donde se envía/recibe la vacuna o jeringa y donde se la utiliza.
ñ.
Causas de pérdida - Existen cinco factores de pérdida:
Frasco abierto
* Se considera a las dosis de vacuna sobrantes que se encuentra en el frasco
por que las mismas no fueron utilizadas durante la jornada de vacunacion. Este
Manual Técnico del Programa Ampliado de Inmunización
a.
351
factor perdida solo aplica en los frascos multidosis como ser: vacuna BCG, bOPV,
dT, IPV, Influenza, Fiebre Amarilla y vacunas de la COVID-19.
Frasco roto
* Se refiere a las dosis que se pierden debido a la ruptura de un frasco de vacuna,
en cuyo caso, se debe desechar el frasco completo e informar dentro las 24
horas al nivel que corresponde
Factor de manipulación
* Denomina a las dosis que se pierden debido a un manejo deficiente e
incumplimiento de la normativa PAI o en términos de control adecuado de la
temperatura (calentamiento, congelamiento o contaminación u otras causales).
Frasco expirado
* Son aquellas vacunas que llegaron o sobre pasaron la fecha permitida de su uso
y deben ser dadas de baja de acuerdo a normativa de desecho seguro..
Falla de fábrica
* Son pequeños cambios en la apariencia del producto que pueden indicar defectos
y que terminan convirtiéndolo en producto inservible siendo esta falla de origen.
NO USAR VACUNA EXPIRADA
En caso de cualquier otro factor que ocasione pérdida se debe registrar en el Kardex,
como un egreso de vacuna con un informe de respaldo respectivo (incendio, robo,
accidente en el traslado, etc.).
¡¡¡IMPORTANTE!!!
Estos datos deben ser trasladados al reporte de pérdidas.
p.
Saldo - Es el resultado de la cantidad disponible menos egresos y factores de pérdida.
q.
Firmas - Se refiere a las firmas del responsable de la elaboración del Kardex y de su
inmediato superior.
Serie: Documentos Técnico Normativos
¡¡¡IMPORTANTE!!!
352
Por cada lote de vacuna se debe realizar un kardex
8.5
INFORME MENSUAL DE USO DE VACUNAS Y JERINGAS
Este formulario es implementado para informar acerca del uso de vacunas, jeringas y cajas
de desecho seguro en los Establecimientos de Salud y Coordinaciones de Redes. Deben
adjuntarse con carácter obligatorio a los formularios de requerimiento para fines de análisis
y aprobación del despacho.
SEDES - A cuál SEDES corresponde el Establecimiento de Salud o la Red.
b.
Red - A qué Coordinación de Red corresponde.
c.
Municipio - Municipio al cual pertenece el Establecimiento de salud o la Red que envía el
informe.
d- Establecimiento - Nombre del Establecimiento de Salud donde se elaboró el informe de
uso de vacunas y jeringas.
e.
Período - Tiempo comprendido entre el informe anterior y el actual. Tener en cuenta que
este informe es mensual.
f.
Vacuna y jeringa - Anotar específicamente a qué vacuna o jeringa corresponde el informe.
g.
Saldo anterior - Se debe anotar la cantidad de dosis que existen y cuyo número debe ser
igual al del Kardex.
h.
Cantidad de ingreso - Se anota la cantidad de vacunas y jeringas que se recibe en el
Establecimiento de Salud o Coordinación de Red.
i.
Total, disponible - Se anota la suma del saldo anterior más la cantidad recibida.
j.
Uso - En este punto se debe tener considerar lo siguiente:
Manual Técnico del Programa Ampliado de Inmunización
a.
353
Población objeto
* Población que se ha programado vacunar y que forma parte de los grupos etarios
priorizados según el Esquema Nacional de Vacunación.
Población no objeto
* Se refiere a las personas que han sido vacunadas, aunque no son parte de los
grupos etarios priorizados pero que, igualmente, deben ser registrados.
k.
Total uso - Es la suma de la población objeto y la población no objeto.
l.
Causas de pérdida - Se consideran cinco factores de pérdida:
Frasco abierto
* Se considera a las dosis de vacuna sobrantes que se encuentra en el frasco
por que las mismas no fueron utilizadas durante la jornada de vacunacion. Este
factor perdida solo aplica en los frascos multidosis como ser: vacuna BCG, bOPV,
dT, IPV, Influenza, Fiebre Amarilla y vacunas de la COVID-19.
Frasco roto
* Se refiere a las dosis que se pierden debido a la ruptura de un frasco de vacuna,
en cuyo caso, se debe desechar el frasco completo e informar dentro las 24
horas al nivel que corresponde
Factor de manipulación
* Denomina a las dosis que se pierden debido a un manejo deficiente e
incumplimiento de la normativa PAI o en términos de control adecuado de la
temperatura (calentamiento, congelamiento o contaminación u otras causales).
Frasco expirado
* Son aquellas vacunas que llegaron o sobre pasaron la fecha permitida de su uso
y deben ser dadas de baja de acuerdo a normativa de desecho seguro..
Serie: Documentos Técnico Normativos
Falla de fábrica
354
* Son pequeños cambios en la apariencia del producto que pueden indicar defectos
y que terminan convirtiéndolo en producto inservible siendo esta falla de origen.
m. Total pérdida - Se debe anotar la suma de las cinco columnas de los factores de pérdida.
n.
Total de uso, pérdida y despacho- Se debe anotar la suma de los totales del uso, pérdida
y despacho de las dosis de vacunas y unidades de jeringas.
ñ.
Saldo - Es el resultado del total disponible menos el total de uso y pérdida.
o.
Firmas - Las firmas deben ser de los responsables, de acuerdo a los niveles jerárquicos
correspondientes.
Figura N°38: Ciclo para baja de vacunas
8.6
PROCESO PARA BAJA DE VACUNAS Las vacunas tienen características especiales y diferentes con relación a otros medicamentos,
por lo cual se debe seguir un proceso continuo y riguroso para su recepción, conservación y
distribución para que lleguen en óptimas condiciones al usuario o usuaria, a fin de prevenir las
enfermedades inmunoprevenibles.
Con el objetivo de fortalecer las capacidades del personal de salud en torno al manejo
adecuado de vacunas e insumos, el PAI realiza capacitaciones, supervisiones e inventarios
continuosen la logística llegando hasta el nivel operativo, para así verificar el cumplimiento de
las normas establecidas de la cadena de frío.
Marco legal
* Ley No 1178
* Ley del Funcionario Público
* Ley del Medicamento
* Ley No.004
* Ley No.007
Manual Técnico del Programa Ampliado de Inmunización
Durante estas supervisiones se verifican el manejo adecuado de los registros de vacunación
y los respectivos instrumentos de logística, actividad que también debe ser realizada por el
personal de salud en forma mensual. Sin embargo, muchas veces se encuentran vacunas y
jeringas expiradas o con alguna alteración debido al incumplimiento de la Norma Nacional, se
debe proceder de acuerdo al marco normativo y legal vigente. En este caso y en otros en los
cuales no se ha cumplido estrictamente con la norma nacional y se han puesto en riesgo las
vacunas, se debe proceder de acuerdo a marco normativo y legal vigente.
* Otras normas relacionadas.
355
Alcance y responsabilidad
* Dirigida específicamente al Programa Ampliado de Inmunización.
Retiro y baja definitiva de vacunas y jeringas
BAJA DE VACUNAS Y JERINGAS
La baja de medicamentos e insumos médicos no es una modalidad de disposición; consiste
en la exclusión de las vacunas y jeringas en forma física y de los registros en los instrumentos
de control Logístico de la institución:
Las causales para la baja de vacunas y jeringas son:
a)
Disposición definitiva de medicamentos o insumos médicos
b)
Hurto, robo o pérdida fortuita
c)
Mermas
d)
Vencimiento, descomposiciones, alteraciones o deterioros
e)
Inutilización
f)
Obsolescencia
g)
Siniestro
Los siguientes puntos constituyen algunas características a ser consideradas para la baja de
las vacunas y otros insumos según el inciso d (por sus características y riesgo sanitario en
estos casos se procederá de acuerdo a lo señalado en el acápite siguiente; directamente con
la instrucción y verificación de la destrucción.)
a.
Vencimiento o expiración: productos cuyo tiempo de vida útil ha llegado al limite
b.
Descomposición, alteraciones o deterioro: también se denomina a si a la situación en
la que las vacunas y jeringas han sufrido alteraciones en su estructura física o química por
acciones de la luz, humedad, temperatura (por calentamiento o congelación), contaminación
por manipulación, hechos que impiden su utilización.
Serie: Documentos Técnico Normativos
Procedimiento para la baja:
356
a)
La baja por disposición definitiva de los medicamentos o insumos médicos procederá
concluido el proceso de disposición, de acuerdo a lo establecido en el acápite registro e
informes del presente reglamento.
b)
La baja por las causales de hurto, robo o pérdida fortuita, merma o siniestros procederá
en base al informe técnico, informe del fiscal y verificación de los responsables de los
medicamentos o insumos médicos consignando los datos señalados en el anexo en cuyo
caso deberá señalarse el valor de los medicamentos e insumos médicos.
c)
La baja por las causales de inutilización y obsolescencia podrán considerar la
recuperación de las partes, accesorios y componentes que sean útiles para la entidad y/o que
signifique un retorno económico.
d)
Cuando se produzca la baja por vencimientos, descomposiciones, alteraciones
o deterioro de medicamentos o insumos médicos por sus características especiales, el
responsable administrativo deberá instruir y verificar la destrucción y/o destrucción de los
mismos de acuerdo a normas vigentes.
e)
El procedimiento para la baja de medicamentos e insumos médicos se realizará
conforme al flujograma para la baja.
f)
Si la baja o remanencia de medicamentos e insumos médicos es atribuible al proveedor,
la instrucción exigirá a este de acuerdo a normas y contratos específicos a la restitución del
100% del producto o cambio por otro sobre el precio base establecido.
OTRAS CONSIDERACIONES.
Tanto para los casos de descomposición definitiva como para la baja de medicamentos e
insumos médicos deberá considerarse los flujogramas descritos debiendo contemplarse en
cada uno de las diferentes modalidades de disposición.
a.
deberá considerarse que de acuerdo a la modalidad a aplicarse deberá elaborarse
y suscribirse los contratos correspondientes con los mismos que a fin de asegurar su uso
adecuado deberán estar suscritos también por los profesionales farmacéuticos de las
diferentes entidades.
b.
Deberá considerarse que para llevar a cabo la disposición de medicamentos e insumos
se requerirá los certificados de control de calidad de los diferentes lotes por lo que los mismos
deberán archivarse de manera adecuada.
c.
A fin de facilitar la evaluación de los bienes a disponerse deberá utilizarse para la
recepción de medicamentos e insumos médicos el formulario de Remisión – Recepción, el
cual incluye tanto los números de lote como la vida útil de cada uno de los ítems.
Razones
* Existe la probabilidad de que el uso de la vacuna cause serias reacciones adversas en la
salud.
* Jeringas inutilizadas.
* Vacuna expuesta a temperaturas inapropiadas, confirmadas con la prueba de agitación
y refrendadas en un informe técnico por una comisión conformada por los inmediatos
superiores del personal de salud.
* La vacuna ha cumplido su fecha de vencimiento.
Flujo para la baja
Manual Técnico del Programa Ampliado de Inmunización
d.
Es importante considerar que la baja de medicamentos en conformidad a la ley del
Medicamento y la Ley del Medio Ambiente no podrá realizarse en lugares o por entidades o
empresas que no se hallen autorizadas para el efecto, quedando claramente establecido que
se halla prohibido la eliminación de medicamento o insumos a través de la basura.
357
Cuando se cumplen los pasos que se indica en el siguiente flujo.
Fuente: PAI / MSyD.
1. Realizar y remitir el informe de la causal de baja de acuerdo a la Ley de Medicamentos
a la Coordinación de Red
2. Revisar y verificar el informe técnico y remitir el informe de solicitud de baja al SEDES
3. Previa revisión de la documentación elaborar el informe técnico, para solicitar la
resolución administrativa de baja de vacunas o jeringas. Informar a la Contraloría y
remitir toda la documentación pertinente al PAI Central.
4. Recepción de la documentación.
5. Informar a la OPS y archivar la documentación.
6. La OPS de acuerdo a la causal toma conocimiento.
Una vez que se revise, analice e investigue el informe, se hará la determinación de
responsabilidades, proceso que está a cargo del equipo del PAI Departamental y un
representante del área jurídica.
La baja de vacunas y jeringas se da de acuerdo a las siguientes modalidades:
* Baja con reposición económica, este tipo de baja se aplicará cuando en el informe,
investigación y análisis se corrobore el incumplimiento de las normas establecidas en
el manejo de vacunas y jeringas. En estos casos la persona o personas responsables, en
cumplimiento de la Ley 1178, deberán pagar las pérdidas mediante depósitos bancarios
que no excedan el 20% del haber básico mensual.
Serie: Documentos Técnico Normativos
* Si se diera el caso de que grandes cantidades de vacunas hubieran sido expuestas a
temperaturas inadecuadas, el equipo del PAI debe analizar la posibilidad de hacer pruebas
de potencia inmunológica, pero sin perder de vista que a veces el costo de estos exámenes
supera el valor total de las vacunas posiblemente dañadas.
358
* Baja sin reposición, esta modalidad se aplica cuando se determine que las causas de baja
se deban por fuerza mayor o fortuita donde las vacunas o las jeringas hubieran sufrido
algún tipo de alteración o se hubiesen perdido por alguna causa justificada, como ser:
accidente durante el traslado, incendio, robo u otras situaciones inevitables de origen
interno o externo o bien, cuando se dan ingresos de vacunas y jeringas cuyas fechas de
caducidad tengan un plazo igual o menor a un mes.
Figura N°39: Flujograma para baja de vacunas y jeringas institucional
Manual Técnico del Programa Ampliado de Inmunización
Fuente: PAI / MSyD
359
360
Serie: Documentos Técnico Normativos
CAPÍTULO 9
CAPACITACIÓN,
SUPERVISIÓN,
MONITOREO Y
EVALUACIÓN
Índice
9.1
Introducción
348
9.2
Capacitación en el PAI
348
9.2.1
Capacitación autodidacta
349
9.2.2
Capacitación de autoformación en línea
349
9.2.3
Talleres de capacitación
350
9.2.4
Capacitación en servicio a través de la supervisión
352
9.3
Supervisión
352
9.3.1
Metodología para la supervisión
353
9.3.2
Modalidades de supervisión
355
9.3.3
Fases de la supervisión
357
9.4
Monitoreo
360
9.4.1
Indicadores
360
9.4.2
Modalidades para monitorear coberturas
360
9.4.3
Control de calidad del dato
363
9.4.4
Interpretación de la supervisión
364
9.5
Evaluación
364
9.5.1
Evaluación de desempeño
364
9.5.2
Evaluaciones al PAI
366
9.1
INTRODUCCIÓN
El surgimiento de nuevos desafíos en el campo de la salud y la rotación constante del personal
en los diferentes niveles del sistema de salud, sobre todo a nivel operativo, obligan a una
permanente actualización de los conocimientos del recurso humano. Por estas razones, el
presente capítulo, está destinado a exponer los procesos de capacitación, en las diversas
formas que promueve el programa; mostrando la concepción eminentemente formadora y
educadora del PAI, con miras a empoderar los niveles gerencial y técnico operativo, con las
fortalezas que proporciona el conocimiento.
“Un sistema sanitario basado en la atención primaria de salud, orienta sus
estructuras y funciones hacia los valores de la equidad y la solidaridad social, y el
derecho de todo ser humano a gozar del grado máximo de salud que se pueda lograr,
sin distinción de raza, religión, ideología política, o condición económica o social.
Los principios que se requieren para mantener un sistema de esta naturaleza, son la
capacidad para responder equitativa y eficientemente a las necesidades sanitarias
de los ciudadanos, incluida la capacidad de vigilar el avance para el mejoramiento
y la renovación continua; la responsabilidad y obligación de los gobiernos de
rendir cuentas; la sostenibilidad; la participación; la orientación hacia las normas
más elevadas de calidad y seguridad; y la puesta en práctica de intervenciones
intersectoriales”.
Organización Panamericana de la Salud
El PAI, ha formulado un programa de educación continua, para contar con un personal de
salud con conocimientos, destrezas, habilidades y compromiso personal, para formar un perfil
humano y profesional con virtudes como valoración del trabajo y la responsabilidad, disciplina
capacidad de análisis, proactividad y enfoque en procedimientos seguros y de calidad, tratando
de minimizar y mitigar los errores programáticos y lograr un nivel de excelencia técnica en
todos los procedimientos. El capítulo de capacitación tiene como finalidad la formación de
agentes de cambio, que sean capaces de fortalecer y mantener los resultados alcanzados por
el PAI.
Serie: Documentos Técnico Normativos
9.2
364
CAPACITACIÓN EN EL PAI
El proceso de educación continua del PAI busca complementar y fortalecer la información
básica y genérica que hubiera podido recibir el personal de salud, (médicos, licenciadas en
enfermería, auxiliares de enfermería, brigadas especiales de acción rápida y personal de
apoyo), en su formación profesional o técnica.
El PAI coordina con las universidades e institutos acreditados en el área de la salud la
planificación de los rotes de los estudiantes, tanto en el programa como en los establecimientos
de salud; esto con la finalidad de profundizar el manejo de todos sus componentes en el nivel
operativo, como política establecida en el sistema de salud, que incluye conocimientos teóricos,
técnicos y prácticos, que contribuyen a un mejor desempeño de todos los componentes del
PAI, en todas las instancias del sistema de salud y con el nivel de excelencia técnica-operativa
requerida.
Ha diseñado un programa de capacitación continua que apoya desde la inducción del
personal nuevo, hasta el reforzamiento de conocimientos del personal en ejercicio, empleando
herramientas de autoformación y supervisión; esta última, está dirigida al personal de salud
tanto del sistema público, privado, y seguros a corto plazo.
Los procesos de capacitación en el PAI tienen diferentes modalidades que abarcan desde la
autodidacta, autoformación en línea, taller de capacitación hasta la capacitación en servicio
a través de la supervisión.
9.2.1
Capacitación autodidacta
El personal de salud vinculado a las actividades de vigilancia-control epidemiológico de
EPV y vacunación, sea operativo o de gerencia, debe revisar periódicamente todo el material
técnico-normativo del PAI; realizando sesiones de formación continua con todo su equipo
humano, para intercambiar opiniones y fortalecer las capacidades del personal de salud que
operativiza la implementación del PAI en el nivel correspondiente.
Una buena práctica es la lectura colectiva de la norma, motivada por el responsable/
director de cada establecimiento de salud con presentación de temas o casos
especiales por parte de los miembros del equipo.
9.2.2
Capacitación de autoformación en línea
El PAI pone a disposición de todo el personal de salud, a nivel nacional, material didáctico y los
módulos de autoformación; esta iniciativa de educación continua busca que el beneficiario
pueda dosificar sus tiempos de estudio, los mismos que están destinados a la revisión del
material didáctico y su correspondiente evaluación en línea, hasta completar los 10 módulos
formativos ofertados. El alumno adapta los tiempos y el ritmo del estudio a sus necesidades
y posibilidades.
Los cursos de autoformación en línea permiten:
a. Acceder libremente a todos los cursos y a la revisión del material didáctico, cuantas veces
se desee.
b. Adquirir conocimientos de forma autónoma, sin las limitaciones de un programa formal
en cuanto a horarios, plazos y desplazamientos.
c. Certificar las competencias obtenidas por esta vía, a través de la realización de exámenes.
Manual Técnico del Programa Ampliado de Inmunización
Todo el personal de salud que implemente actividades del PAI, debe cumplir con la formación
en línea, que el PAI ofrece a través de la plataforma del Ministerio de Salud y Deportes,
sobre los diferentes componentes del Programa, aprovechando las nuevas tecnologías de la
información y comunicación, acceso a internet desde su celular, tablet o computadora. Esta
formación en línea es de carácter obligatorio, y el personal debe presentar la certificación
obtenida a su inmediato superior.
365
El acceso a los cursos se realiza a través del aula virtual del PAI que se encuentra en la página
del Ministerio de Salud y Deportes en el siguiente enlace: https://pai.minsalud.gob.bo , en la
opción Autoformación, eligiendo el curso de acuerdo a su perfil ocupacional y al área de su
interés. Los cursos disponibles son:
* Conociendo al PAI.
* Conociendo las vacunas.
* Las vacunas del PAI.
* Estrategias de vacunación.
* Vigilancia epidemiológica en el PAI.
* Sistema de información del PAI.
* Cadena de frío.
* Logística.
* Capacitación, supervisión, monitoreo y evaluación.
* Comunicación social del PAI.
9.2.3
Talleres de capacitación
Figura 40: Estructura del taller de capacitación
Serie: Documentos Técnico Normativos
Los talleres de capacitación tienen tres etapas: preparación, ejecución y evaluación.
Fuente: PAI / MSyD.
366
A.
Preparación
Diseño: En la supervisión, los responsables de cada nivel, deben realizar un diagnóstico
de necesidades de capacitación, para luego planificar y priorizar el fortalecimiento de las
competencias gerenciales, técnicas y operativas requeridas por recurso humano en salud,
tomando en cuenta la función que desempeña.
Planificación: La planificación debe incluir los objetivos, a quiénes está dirigido, el contenido
temático, la metodología, los recursos y medios de apoyo, el número de participantes, el
responsable de la coordinación, el lugar y el cronograma.
Elaboración: Organizar la convocatoria de los participantes, incluyendo el recordatorio acerca
de la información que deben llevar consigo al taller y apoyando con la otorgación del permiso
para el personal de salud, si así lo ameritara.
Se debe elaborar el presupuesto que contemple el material impreso y electrónico a
proporcionarse a los participantes, como ser, material de escritorio, refrigerio, alquiler
o fletes si se requiriesen ambientes y equipos tecnológicos como proyectora, pantalla
ecran, computadora, sistema de sonido y otros que sean necesarios (Coordinar con el área
administrativa local para poder utilizar las partidas de gasto inscritas en el POA local).
B.
Ejecución
Inicial: La actividad de capacitación se inicia con un pre test (evaluación inicial), que incluye
los temas a tratar en las clases.
Central: Posteriormente, se realizan las exposiciones dialogadas a cargo del facilitador, las
cuales deberán incluir ejercicios individuales y trabajos grupales.
Final: Luego se promueven plenarias, espacios donde se puedan absolver todas las
inquietudes, dudas o interrogantes que hubiesen surgido; además de promover el intercambio
de conocimientos y de experiencias, reforzándose las ideas centrales de la capacitación.
C.
Evaluación de los talleres
Inmediata: se realiza al finalizar cada taller, se aplica un post test (evaluación final) para medir
el desempeño de los facilitadores y participantes. Esto permite formular planes de mejora
continua.
Mediata: se refiere a la evaluación de desempeño, la cual se refleja en la obtención de
resultados en el PAI, en servicio: grado de cumplimiento de los indicadores de desempeño de
la vacunación y de la vigilancia epidemiológica de las EPV.
El personal de salud que logre las mejores calificaciones en cada taller y en su evaluación del
desempeño, deberá ser recomendado para su permanencia en su cargo o para su promoción
a un cargo superior.
Manual Técnico del Programa Ampliado de Inmunización
Existe el 90% de probabilidades de recordar lo aprendido, cuando se escucha, se
escribe, se observa, se discute y se hace.
367
9.2.4
Capacitación en servicio a través de la supervisión
La supervisión es un componente gerencial importante del PAI, pues permite observar el
desempeño operativo del personal de salud, cuando desarrolla actividades de vacunación
o vigilancia epidemiológica de las enfermedades prevenibles por vacuna, dentro y fuera de
servicio.
El enfoque de la supervisión en el PAI, es de enseñanza aprendizaje, donde el supervisor
fortalece in situ las debilidades encontradas y, a su vez, aprende de las iniciativas locales para
su réplica en otros lugares; es parte de un proceso continuo de capacitación, de enseñanza y
control de tareas asignadas.
9.3
SUPERVISIÓN
La supervisión es un componente del PAI gerencial, que permite observar el desempeño del
personal de salud que desarrolla actividades de vigilancia, vacunación y gestión, en cada
uno de los niveles. Como se ha mencionado, tiene un enfoque de enseñanza - aprendizaje,
el supervisor fortalece las capacidades donde haya encontrado debilidades; es parte de un
proceso continuo que contribuye al mejoramiento de los procedimientos, a la organización, y
al cumplimiento de normas e indicadores del programa.
Figura 41: Proceso de supervisión
Serie: Documentos Técnico Normativos
Esta actividad debe ser realizada por el recurso humano en salud que conoce y maneja bien
el PAI; con el fin de mejorar el desempeño.
Fuente: PAI / MSyD.
368
El propósito de la supervisión es fortalecer la capacidad técnica y las destrezas del personal
de salud, para la vacunación de calidad y una eficiente vigilancia epidemiológica de las
enfermedades inmunoprevenibles. Además, permite a los supervisados participar, de manera
activa, del proceso y también de las decisiones que serán tomadas. En la implementación de
las medidas correctivas que se dejan al finalizar la supervisión; generalmente, las personas
supervisadas rinden al máximo cuando conocen sus debilidades.
La supervisión cuenta con tres tareas esenciales:
* Identificar fortalezas y debilidades del personal de salud capacitado y/o supervisado en los
procesos de gestión, vacunación, gestión efectiva de vacunas y vigilancia epidemiológica
de EPV.
* Proporcionar apoyo técnico y soluciones oportunas a nivel operativo in situ, para mejorar
la calidad de las actividades de vacunación, vigilancia epidemiológica, gestión efectiva de
vacunas y de abogacía e incidencia multisectorial.
* Realizar seguimiento al cumplimiento de recomendaciones de anteriores supervisiones.
9.3.1
Metodología para la supervisión
A.
Selección del supervisor
El supervisor(a) debe cumplir con los siguientes requisitos:
* Experiencia acreditada en manejo integral de todos los componentes del PAI y/o en alguna
de sus áreas específicas.
* Conocer las normas técnicas del PAI.
* Poseer amplia experiencia en el tema de supervisión.
* Conocer las guías e instructivos de supervisión.
* Debe ser respetuoso, tolerante y coherente.
* Tener conocimiento y capacidad para la toma de decisiones y orientar acciones correctivas
de acuerdo al nivel de responsabilidad.
* Demostrar capacidad de resolver las interrogantes del supervisado y destacar los
aspectos positivos encontrados.
B.
Capacitación de supervisores/as
La capacitación de supervisores debe contener como mínimo:
* Amplio conocimiento de la normativa del PAI, los instrumentos de supervisión y su manejo.
* Información necesaria y suficiente de las áreas o zonas a ser supervisadas de manera
objetiva.
* Metodologías didácticas de enseñanza-aprendizaje.
Manual Técnico del Programa Ampliado de Inmunización
* Debe disponer de alta capacidad para escuchar, observar, analizar la situación, reflejar
interés por los temas y la solución de problemas.
Nota: El número de supervisores no debe superar el número de supervisados.
369
C.
Selección de áreas, municipio o departamento
La selección debe ser realizada a través del análisis de la situación de salud del área de
intervención de los establecimientos de salud, municipio, red o departamento; priorizando la
problemática, como ser:
* Coberturas de vacunación. (por ejemplo extremos: mayor o menor cobertura).
* Notificación de enfermedades prevenibles por vacunas. (silenciosos o de otros
subsectores: seguros, privados; urbanos, periurbanos y rurales).
* Cumplimiento de metas utilizando indicadores de cobertura, de vigilancia, de logística y
de gestión. (bajas coberturas crónicas, tipos de centros de salud estratégicos, falta de
apoyo de GAM).
* Problemas en alguno de los componentes del Programa por ejemplo la cadena de frío.
* Resultados deficientes de supervisiones previas o evaluaciones.
* Falta de información, dudas en la confiabilidad de la misma.
* Criterios socioeconómicos, ámbitos de influencia que incluyen turismo, la presencia de
migrantes, comunidades indígenas o fronteras.
D.
Plan de supervisión
Cada responsable en su nivel debe elaborar un plan de supervisión, coordinado con los
diferentes niveles según corresponda, para que no interfieran con otras actividades.
El plan debe contemplar al total de servicios de salud de las áreas seleccionadas y su contenido
mínimo es:
* Objetivos e indicadores sobre proceso o actividades del PAI.
* Guía de supervisión estandarizada.
* Cronograma.
* Presupuesto.
* Plan de monitoreo de coberturas.
Serie: Documentos Técnico Normativos
* Plan de búsqueda activa institucional y comunitaria.
* Informes anteriores de supervisiones.
* Información de apoyo (normas, descripción de funciones, informes previos, estadísticas
y otros pertinentes).
* Plan de acción quinquenal y anual a nivel nacional, departamental, municipal y local.
* Otros.
E.
Instrumentos de supervisión
Para cumplir con la supervisión se dispone de los siguientes instrumentos estandarizados:
* Formulario Nº1 Supervisión gerencial (Nivel PAI SEDES, Coordinación red, Municipio).
* Formulario Nº2 Supervisión operativa (Establecimientos de Salud con vacunatorios).
370
* Formulario Nº3 Calidad del dato.
* Formulario Nº4 Búsqueda activa institucional.
* Formulario Nº5 Búsqueda activa comunitaria.
* Formulario Nº6 Monitoreo Rápido de Coberturas (MRC).
* Formulario Nº7: Inventario de vacunas, jeringas, cajas de desecho seguro.
9.3.2
Modalidades de supervisión
Con el desarrollo de los procesos administrativos y de organización, los procesos de
supervisión se han desarrollado hasta convertirse en un arte que permite obtener diversos
resultados, sobre todo, ha dejado de estar dirigido solamente a los niveles operativos y en la
actualidad alcanza a todos los niveles ejecutivos.
El PAI cuenta con tres modelos de supervisión:
A.
Supervisión sistemática por niveles
Supervisión gerencial
La supervisión gerencial se halla orientada a la verificación del cumplimiento de los indicadores
de gestión, por lo tanto, está dirigida a los responsables de los PAI nacional y departamentales,
coordinadores de red y dirección municipal.
Esta supervisión permite verificar si los logros alcanzados corresponden a lo planificado
permite detectar conjuntamente con el personal supervisado, los aspectos o variables que
han influido positiva o negativamente.
Si el resultado no fuese el esperado, la actitud del supervisor no será el castigo o la represalia,
por el contrario, debe ser identificar junto al supervisado las causas y buscar que las
soluciones emerjan del equipo supervisado; de esta manera, se garantizará que se cumplan
efectivamente las medidas correctivas necesarias.
Una supervisión en la que se destaca el respeto al personal supervisado, generará que este
modelo se replique cuando le toque a éste realizarla a los niveles operativos; formándose una
cadena positiva, proactiva y de respeto.
Un aspecto que debe ser entendido por este nivel, es que la supervisión gerencial proporciona
insumos técnicos valiosos para corregir las fallas, si las hubiese, o brinda insumos que
permiten que la creatividad de los niveles operativos, sean asumidos y se traduzcan en nuevas
estrategias para el fortalecimiento del PAI.
Componentes a supervisar:
* Planificación, programación y organización.
* Cadena de frío.
Manual Técnico del Programa Ampliado de Inmunización
La supervisión siempre tiene un carácter capacitante y también de mejora continua del
Programa, pues ambos, el supervisor y el supervisado, actúan al unísono con el mismo
objetivo de identificar las limitaciones u obstáculos, y buscar soluciones.
371
* Monitoreo de coberturas.
* Vigilancia epidemiológica
* Técnicas y procedimientos de vacunación segura (conservación adecuada de vacunas,
inyecciones seguras, vigilancia de ESAVI).
* Logística.
Esta supervisión se la debe realizar al menos dos veces al año.
Supervisión operativa
Tiene el fin de medir el cumplimiento de la normativa del PAI a nivel del desempeño del personal
operativo de salud.
El nivel nacional y los niveles departamentales, deben definir la muestra de los niveles
operativos a supervisar, de acuerdo a los siguientes criterios técnicos:
* Coberturas con 3ra. dosis de la vacuna pentavalente, menores a 80% y mayores a 100%.
* Bajo desempeño en indicadores de vigilancia epidemiológica de las EPV.
* Carga poblacional.
* Establecimientos con silencio epidemiológico, sin reporte de casos sospechosos en los
últimos dos años.
* Problemas con el denominador.
* Poblaciones migrantes.
* Fronteras.
* Turismo
* Sin supervisión en los últimos dos años.
Serie: Documentos Técnico Normativos
Tabla N° 88: Supervisión gerencial y operativa
372
De nivel
A nivel
Frecuencia Tipo de supervisión Instrumentos
PAI Nacional
PAI SEDES
2 veces
Coordinaciones de red y al año
Establecimientos de
salud seleccionados
Gerencial
Anexo 1, 3,
4, 5, 6, 7.
PAI SEDES
Coordinaciones
de Red y
Establecimientos de
Salud seleccionados
Gerencial
Anexo 1, 3,
4, 5, 6, 7.
3 veces
al año
Coordinaciones Establecimientos
de Redes
de Salud
urbanas
4 veces
al año
Coordinaciones Cabeceras de
de Redes
Municipios
rurales
Anexo 2, 3,
4, 5, 6, 7.
Operativo
Anexo 1, 2,
3, 4, 5, 6, 7.
Cabeceras de
Municipios
Establecimientos
de Salud
4 veces
al año
Operativo
Anexo 2, 3,
4, 5, 6, 7.
Internacional
PAI Nacional y
todos los niveles
1 vez cada
5 años
Gerencial
Anexo 1
Fuente: PAI / MSyD.
B.
Autosupervisión
El equipo de un establecimiento de salud o de los niveles gerenciales, se auto supervisa para
verificar su propio desempeño; para esto utiliza el formato del instrumento de supervisión
correspondiente y procede a la conformación de un equipo técnico. Esta actividad se la debe
realizar mensualmente a fin de encontrar soluciones inmediatas; también es una forma
permanente de revisar las normas técnicas.
C.
Supervisión cruzada
Es una supervisión entre pares, es decir, equipos de SEDES, de coordinaciones de red, o de
establecimientos de salud se intercambian para la supervisión. Es una oportunidad para
el intercambio de experiencias, conocer iniciativas novedosas cuya aplicación puede ser
extensiva a más lugares. Es aconsejable realizarla el primer semestre del año o de acuerdo a
necesidad, con el fin de poder aplicar las recomendaciones en la gestión y definir estrategias
complementarias para alcanzar los objetivos y metas del PAI.
Figura 41: Fases de la supervisión
Fases de la supervisión
Manual Técnico del Programa Ampliado de Inmunización
9.3.3
Fuente: PAI / MSyD.
373
A. Preparatoria
El proceso de supervisión debe ser preparado con anticipación y en detalle; esta primera fase
es la de planificación y comprende los siguientes pasos:
* Elección de los niveles a ser supervisados:
• Las coordinaciones /Gerencias de Red.
• Los Municipios.
• Los Establecimientos de Salud.
* Conformación del equipo supervisor.
* Consenso del cronograma en coordinación con los niveles correspondientes.
* Definir el tipo de supervisión, gerencial u operativa.
* Preparar los instrumentos de supervisión requeridos - Monitoreo Rápido de Coberturas
(MRC), de Búsqueda Activa Institucional (BAI), Búsqueda Activa Comunitaria (BAC),
control de calidad del dato, comprobantes de logística.
* Informes de anteriores supervisiones.
* Presupuesto.
B.
Coordinación
Se debe coordinar con el nivel a ser supervisado, priorizando la comunicación oficial al director
técnico del SEDES para que autorice y esté receptivo a las conclusiones de la supervisión;
otros aspectos de esta fase son:
* Coordinar las fechas.
* Los alcances de la supervisión.
* Informar cuáles serán los indicadores y actividades que se supervisarán y por qué.
* Compartir los instrumentos de supervisión de manera oportuna.
Serie: Documentos Técnico Normativos
* En todo este proceso deberá participar la instancia departamental del PAI respectivo.
374
Recordar que la actitud del equipo supervisor no es punitiva ni de castigo, sino
de apoyo técnico basado en la confianza, se debe garantizar que no existan
inconsistencias en la metodología de supervisión.
C.
Supervisión en terreno
Se organiza de la siguiente manera:
* Visita a la autoridad del Municipio o Establecimiento de Salud.
* Reiterar el objetivo de la supervisión.
* Reunión con el equipo supervisado.
* Ajuste del cronograma.
* Desplazamiento a las instancias a ser supervisadas.
* Aplicar los formularios de acuerdo al nivel supervisado, por componentes y variables,
utilizando y combinando las técnicas de observación, revisión y verificación de registros
primarios y consolidados; entrevistas al personal de salud que interviene en la vacunación,
en la vigilancia epidemiológica de las EPV y en la logística.
* Entregar al nivel supervisado el plan de mejoramiento y si fuese pertinente, felicitarlo.
La relación debe ser cordial, puesto que la supervisión es de apoyo, ayuda técnica, y análisis
de los resultados alcanzados.
Se debe dialogar con los participantes, indagando las causas de los resultados, respetando sus
criterios; para luego llevar la discusión al terreno técnico y mostrando cómo podría mejorarse.
Es muy importante demostrar que no solamente hay una forma de actuar. Se debe ser receptivo
a las explicaciones y comprensivo con las limitaciones logísticas del contexto, teniendo
cuidado de no caer en justificaciones que no llevan a un plan de mejora y mostrar que a pesar
de las limitaciones es posible avanzar.
D.
Análisis de resultados
Analizar y comparar los resultados obtenidos con resultados de supervisiones anteriores,
para observar si hubo mejora, si se mantienen los logros o si surgieron nuevos problemas; en
base a las conclusiones se debe establecer un plan de mejora.
Si se trata de una supervisión de seguimiento, se debe utilizar el mismo formulario de
supervisión poniendo énfasis en debilidades encontradas.
La evaluación de resultados de las supervisiones permitirá determinar:
* La calidad de los servicios de vacunación.
* El desempeño de la vigilancia epidemiológica.
* Calidad de la información producida.
* Oportunidad en la toma de decisiones.
* Dificultades de almacenamiento, provisión oportuna, de vacunas e insumos, que
garanticen la realización de las actividades normales.
* Porcentaje de cumplimiento de recomendaciones de anteriores supervisiones.
* Reconocer e incentivar al personal que cumple con sus compromisos y es innovador en
la implementación del PAI.
* Realizar ajustes en las programaciones de acuerdo a los resultados obtenidos.
* Definir la periodicidad de las visitas
* El supervisor o equipo de supervisores debe realizar un informe de los resultados a las
autoridades correspondientes y planificar la próxima supervisión de seguimiento a la
implementación del plan de mejora.
Manual Técnico del Programa Ampliado de Inmunización
* Porcentaje de indicadores de monitoreo cumplidos.
375
Incentivo: Aun cuando los resultados de la supervisión no hayan llenado las
expectativas de los equipos, se debe destacar los aspectos positivos del equipo
supervisado; esto generará un mayor compromiso, el cual se verificará en la
próxima supervisión.
9.4
MONITOREO El monitoreo es una herramienta clave que contribuye a la ejecución efectiva y eficiente de las
acciones, pues sirve para verificar periódicamente, que la ejecución del PAI se desarrolla de
acuerdo a lo planificado, identificando las causas de incumplimiento de las metas; y adoptando
las medidas pertinentes de manera inmediata y oportuna para su corrección.
El propósito principal del monitoreo es poder analizar el grado de avance del programa con
respecto a las metas propuestas, y recopilar la información sobre el progreso de los indicadores
de coberturas de vigilancia y de gestión.
Cuenta con tres tareas principales:
* Discutir y definir las áreas de alto riesgo para el programa.
* Analizar el progreso del sistema de vigilancia epidemiológica y detectar las necesidades
para cumplir el plan de acción.
* Discutir el estado de la ejecución de las actividades programadas.
9.4.1
Indicadores
Para el monitoreo de las actividades programadas en el Plan Operativo Anual, ejecución del
presupuesto y resultados de abogacía, como asignación de fondos.
Los indicadores que utiliza el PAI son:
Serie: Documentos Técnico Normativos
* Indicadores de prevención: Relativas a la vacunación: acceso, cobertura por vacuna, tasa
de deserción por vacunas, integralidad, monitoreo rápido de cobertura, acumulación de
susceptibles por enfermedad.
376
* Mide la proporción de niños que han recibido vacunas, de acuerdo a esquema de
vacunación, por edad, tipo de vacuna y por período monitoreado. Se espera un resultado
de 8.3% mensual con todas las vacunas.
* Indicadores de control: porcentaje de vacunación en barridos/bloqueos.
* Indicadores de erradicación o eliminación: indicadores de desempeño de vigilancia por
enfermedad y descritos en capítulo de vigilancia epidemiológica.
9.4.2
Modalidades para monitorear coberturas
Existen dos modalidades empleadas actualmente por el PAI: el monitoreo mensual
administrativo y el monitoreo rápido de coberturas.
A.
Monitoreo mensual administrativo
El monitoreo mensual administrativo debe realizar lo siguiente:
* Se debe monitorear cada uno de los tipos de vacunas y número de dosis administradas.
* Se lo realiza mensualmente en todos los niveles del sistema, por lo que se puede hacer de
manera desagregada (comunidad/barrio) o consolidada (municipio, red, sedes y nacional).
Esto permite programar metas mensuales y analizar las coberturas del mes, comparar con el
mes anterior y con el año anterior.
Con los resultados del monitoreo mensual se pueden corregir oportunamente las bajas
coberturas y determinar la recuperación de los no vacunados en el siguiente mes.
La cobertura es graficada para el monitoreo de los indicadores del PAI, es la herramienta
visual para mostrar la tendencia de las coberturas de vacunación.
Monitoreo de vacunación en menores de 1 año
100%
90%
Población
menor
80%
70%
1.000
60%
año 2019
50%
40%
1.180
30%
año 2020
20%
10%
MESES
2019
1RA.
DOSIS
2DA.
DOSIS
3RA.
DOSIS
2020
1RA.
DOSIS
2DA.
DOSIS
3RA.
DOSIS
En el mes
Acumulado
% Acumulado
En el mes
Acumulado
% Acumulado
En el mes
Acumulado
% Acumulado
En el mes
Acumulado
% Acumulado
En el mes
Acumulado
% Acumulado
En el mes
Acumulado
% Acumulado
ENE
73
73
7,3
40
40
4,0
25
25
2,5
70
70
5,9
40
40
3,4
25
25
2,1
FEB MAR ABR MAY JUN JUL AGO AEP OCT NOV DIC
69
74
74
77
65
63
67
69
56
63
62
142 216 290 367 432 495 562 631 687 750 812
14,2 21,6 29,0 36,7 43,2 49,5 56,2 63,1 68,7 75,0 81,2
35
38
34
33
29
30
20
21
22
23
21
75
113 147 180 209 239 259 280 302 325 346
7,5 11,3 14,7 18,0 20,9 23,9 25,9 28,0 30,2 32,5 34,6
30
45
35
29
28
27
25
24
26
23
20
55
100 135 164 192 219 244 268 294 317 337
5,5 10,0 13,5 16,4 19,2 21,9 24,4 26,8 29,4 31,7 33,7
72
74
74
73
69
63
67
69
56
63
62
142 216 290 363 432 495 562 631 687 750 812
12,0 18,3 24,6 30,8 36,6 41,9 47,6 53,5 58,2 63,6 68,8
35
38
34
33
29
30
20
21
22
23
21
75
113 147 180 209 239 259 280 302 325 346
6,4
9,6 12,5 15,3 17,7 20,3 21,9 23,7 25,6 27,5 29,3
30
45
35
29
28
27
25
24
26
23
20
55
100 135 164 192 219 244 268 294 317 337
4,7
8,5 11,4 13,9 16,3 18,6 20,7 22,7 24,9 26,9 28,6
Fuente: PAI / MSyD.
De acuerdo a criterios estadísticos, se espera vacunar mensualmente al 8.3% de la población
asignada y llegar, a fin de año al 100% de la población. Se considera una cobertura de
vacunación exitosa, cuando, al finalizar la gestión con todos los biológicos, se obtiene un
mínimo de 95%.
Manual Técnico del Programa Ampliado de Inmunización
Figura 42: Vacuna pentavalente cobertura en niñas y niños menores de 1 año
VACUNA PENTAVALENTE
377
Para alcanzar este porcentaje se debe observar lo alcanzado cada mes; cuando se vela por el
cumplimiento de la meta mensual, es posible implementar inmediatamente las acciones de
vacunación necesarias.
Instructivo de llenado
A inicio de año, se debe preparar el afiche o la pizarra llenando todos los espacios asignados
a la población del año en curso. Allí se debe colocar la cantidad total (100%) de niñas y niños
menores de 1 año, de 1año y de 4 años según corresponda.
Se debe dividir la población objetivo en 12 meses; que como mínimo se debe alcanzar al 8.3%
de la población cada mes.
Para el llenado en la fila correspondiente a meses, se debe registrar el número de niños
vacunados o dosis aplicadas en el mes. Por ejemplo, en enero, 400; en febrero 500; en marzo
600, así sucesivamente hasta diciembre.
Para el acumulado del primer mes se repite el mismo número del mes; con el ejemplo anterior,
a partir del siguiente mes, febrero, se toma en cuenta el acumulado del mes anterior, enero
(400) y se suma el de febrero (500). En este ejemplo, el acumulado para febrero sería 900 y así
sucesivamente.
El porcentaje de vacunación alcanzado en enero, se obtiene de la división del número de
vacunados del mes dividido entre la población total y multiplicado por 100.
400 x100 dando un resultado de 6.6%. Este resultado se lo debe graficar.
6.000
A partir de febrero se dividirá el acumulado entre la población total por 100.
900 x100 dando como resultado 15%.
6.000
De acuerdo a este ejemplo, podemos observar que, ya en el primer mes hay un desfase de
1,7 puntos de la meta mensual; este déficit, debería ser recuperado en el mes de febrero y así
sucesivamente.
Serie: Documentos Técnico Normativos
B.
378
Monitoreo Rápido de Coberturas - MRC
El MRC es un instrumento que sirve para verificar en terreno, las coberturas de vacunación;
también es útil para supervisar brigadas en una campaña, en control de brotes y en la
investigación de casos sospechosos de polio, sarampión y fiebre amarilla.
En la supervisión el objetivo del MRC es ayudar al supervisor a determinar si un municipio,
área o comunidad se encuentra debidamente vacunada y, en base a los resultados tomar la
decisión de acciones complementarias.
El MRC no es una encuesta de cobertura y sus resultados no pueden ser generalizados al
resto del municipio, área o comunidad.
Metodología
A continuación, se describe el MRC relativo a supervisión:
* Definir el objetivo del MRC, estableciendo qué vacunas se monitorearán (trazadoras:
Penta3, OPV3, en menores de un año; SRP2, en un año; Penta 5, en niños de 4 años).
* Debe ser realizado por personal de salud del nivel superior correspondiente, por los BEAR
o por pares acompañados del personal supervisado.
* Seleccionar el área, zona o comunidad mediante sorteo, al azar o de acuerdo a criterios
de riesgo.
* En los manzanos elegidos se debe visitar todas las casas, moviéndose en dirección a las
manecillas del reloj.
* Todos los niños menores de cinco años sin vacunas, son registrados como no vacunados,
pero deben ser vacunados en el momento.
* El MRC en área urbana termina cuando se ha completado la siguiente cantidad:
• 5 niños menores de 1 año, 5 niños de 1 año y 5 niños de 4 años.
• En el área rural termina cuando se ha recorrido toda la comunidad.
Se debe insistir en conocer las causas de la no vacunación de los casos que se encuentren.
Las fórmulas para obtener el porcentaje de cobertura son:
% Cobertura= (Número de niños vacunados menores de 1 año) x 100
(Total de niños menores de 1 año encontrados)
% Cobertura=
(Número de niños vacunados de 1 año)
x 100
(Total de niños de 1 año encontrados)
% Cobertura=
(Número de niños vacunados de 4 años) x 100
(Total de niños de 4 años encontrados)
El obtener un porcentaje de vacunados menor a 100% es evidencia que la población objetivo
no está cubierta y se debe proceder a la programación de vacunación inmediata.
Control de calidad del dato
El dato de vacunación de un establecimiento de salud, debería ser el mismo en todos los
niveles del Sistema Nacional de Información- SNIS -VE establecido en el Ministerio de Salud
y Deportes; es decir, que si en un centro de salud se ha vacunado a 10 niños con BCG y
se encuentra de esa manera registrado en el cuaderno del establecimiento de salud, este
mismo número debe encontrarse en la base de datos generada por el reporte del SNIS-VE del
Establecimiento, o en la información reportada por la Coordinación de Red al SEDES respectivo
o en el dato final del SNIS-VE nacional.
Sin embargo, muchas veces observamos que el dato registrado a nivel del cuaderno de
vacunación, no coincide con el dato registrado en el formato 301ª del SNIS de algún o de todos
los niveles; esta situación provoca desconfianza en cuanto a la calidad del dato; por esta
razón es necesario realizar las correcciones necesarias para superar estas discordancias.
En este sentido, los niveles operativos del PAI deben realizar la verificación de la calidad del
dato de manera periódica, mediante la aplicación de una metodología que les permite a partir
Manual Técnico del Programa Ampliado de Inmunización
9.4.3
379
de la verificación de la concordancia entre datos de dos instrumentos de registro del dato,
poder establecer si hay alteraciones en algún nivel del SNIS.
Esta verificación permite determinar si el dato de un establecimiento de salud, se refleja con
exactitud y concordancia con el reporte del SNIS-VE nacional; en algún caso puede existir,
por ejemplo, sobre información (informa más de lo que produce) o sub-información (informa
menos de lo que produce).
9.4.4
Interpretación de la supervisión
Una vez concluida la supervisión, se debe sumar por componente y el puntaje obtenido
calificarlo de la siguiente manera.
Tabla N° 89: Ponderación del puntaje por categorías
Puntaje
Categoría
90 a 94%
Suficiente
95 a 99%
Óptimo
100%
Excelente
Fuente: PAI / MSyD.
Los puntajes superiores al 95%, recibirán un reconocimiento por parte de sus niveles superiores.
9.5
EVALUACIÓN
Es un juicio de valor, resultado de la aplicación de un conjunto de procedimientos que se basa
en métodos cualitativos y cuantitativos para determinar si se alcanzaron los resultados. Sirve
para analizar el desarrollo del programa y para obtener información sobre el cumplimiento de
sus objetivos, actividades, costos, resultados e impacto. Los resultados de la evaluación se
utilizan para mantener, corregir o modificar las diferentes acciones del programa.
Los resultados obtenidos de las supervisiones permitirán:
Serie: Documentos Técnico Normativos
* Determinar el grado de cumplimiento de las metas planteadas
380
* Identificar las debilidades, amenazas, fortalezas, oportunidades y lecciones aprendidas,
para mantener, corregir o cambiar estrategias en los diferentes componentes.
* Determinar la eficiencia y efectividad de las acciones implementadas
* Realizar control de la calidad del dato
* Incrementar la coordinación y la retroalimentación entre los diferentes niveles de gestión
del Programa.
9.5.1
Evaluación de desempeño
Toda evaluación busca determinar con la mayor precisión posible la pertinencia, eficacia
e impacto de determinadas actividades; se constituye en un instrumento básicamente de
aprendizaje que se orienta a tomar acciones que mejoren no solo las actividades actuales sino
la planificación y la programación que llevará a una modificación en la toma de decisiones.
Las evaluaciones de procesos, de resultados y de impacto están dirigidas a analizar la gestión
del PAI en todos los niveles; es decir la planificación, ejecución, financiamiento, capacitación,
supervisión, logística y otros. Y se describen los siguientes tipos:
A.
Evaluación de procesos
Relacionada a la gestión del PAI, a la planificación, ejecución, logística y financiamiento de las
actividades programadas.
Indicadores de gestión
Se utilizan para verificar el cumplimiento de las actividades programadas y cumplidas:
IG1=
(Número de actividades ejecutadas)
x 100
(Número de actividades programadas)
Monto ejecutado por el PAI
IG2= (Nacional | Gobernación|Departamental | municipios)
Monto asignado al PAI
(Nacional | Gobernación|Departamental | municipios)
x 100
Indicador de equidad
Este indicador permite medir los esfuerzos que se hacen para lograr la homogeneización de
coberturas necesarias para mantener la erradicación o eliminación de enfermedades:
Número de municipios (establecimientos y comunidades)
con cobertura de<95% con OPV4 y SRP2
Total de municipios
Evaluación de resultados
Es la verificación del cumplimiento de objetivos y metas, a través de las diferentes acciones
establecidas en cada uno de los componentes del PAI; los indicadores que se utilizan son
relativos a la vacunación y a la vigilancia epidemiológica.
Tabla N° 90: Indicadores de evaluación
Vacunación*
Vigilancia epidemiológica**
Acceso
Cobertura
Seguimiento
Integralidad
Oportunidad
Esquema completo
% de Notificación Semanal
Tasas de captación de enfermedad.
% de casos investigados <48 hrs
% de casos con muestra adecuada
*Vacunación: Descritos en el capítulo de información.
** Vigilancia epidemiológica: Descritos en el capítulo de vigilancia epidemiológica.
Fuente: PAI / MSyD.
Manual Técnico del Programa Ampliado de Inmunización
B.
x 100
381
C.
Evaluación de impacto
A través de esta metodología se evalúa el cambio que se ha producido en la salud de la
población; para ello se utilizan indicadores trazadores de morbilidad y mortalidad por
enfermedades inmunoprevenibles.
El impacto del PAI se puede medir a través de la inexistencia de casos de sarampión y de polio,
que son resultado directo de las acciones del PAI.
De igual manera, a través de la disminución de casos de diarrea por rotavirus, neumonías y
meningitis bacterianas en población menor de 5 años.
Indicadores
* % de casos confirmados de sarampión.
* % de casos confirmados de Poliomielitis.
* % de casos de diarreas graves con aislamiento de rotavirus.
* % de casos de neumonías con aislamiento de estreptococo neumonías.
9.5.2
Evaluaciones al PAI
A.
Evaluaciones internacionales
El PAI recibe evaluaciones internacionales cada 5 años para fortalecer la gestión integral
del programa; de los mismos emanan recomendaciones que deben ser implementadas en
el período quinquenal. También se reciben evaluaciones específicas de la calidad del dato y
sobre la gestión efectiva de vacunas, entre otras.
B.
Evaluaciones nacionales
Del mismo modo, el PAI realiza evaluaciones semestrales y anuales, analizando todos los
componentes del programa, Adicionalmente las ENDSA y las ENCOVA proporciona información
de las coberturas del PAI, a través de visitas a los hogares, verificación de la existencia de los
carnets infantiles de vacunación, así como verificación de las coberturas de vacunación.
Serie: Documentos Técnico Normativos
Estas evaluaciones, tanto internacionales como nacionales, sirven para fortalecer al Programa,
pues constatan que las coberturas oficiales del PAI reflejan o no la realidad a nivel operativo.
382
Tabla N° 91: Evaluaciones nacionales
Nombre de la
evaluación
Nivel
Temporalidad Objetivo
Indicadores
que mide
Evaluación
Internacional
del PAI
Nacional
Cada 5 años
De desempeño
De resultado
De impacto
Analizar la situación
del Programa en el
contexto del sistema
de salud y su entorno.
Calidad del
dato (DQS)
Cada 4 años
Determinar la
precisión del número
de inmunizaciones
informadas y la calidad
del sistema de control
de las mismas.
De cobertura
De calidad
Gestión efectiva Nacional
de vacunas
Cada 4 años
Evalúa la cadena de frío,
suministros, logística y
la gestión de vacunas
en todos los niveles
en base a 9 criterios.
De gestión
De manejo
De uso
De residuos
ENDSA
Nacional
Cada 5 años
Brinda información
actualizada basada
en la población;
sobre indicadores
demográficos.
De cobertura
Demográficos
De Salud y
Nutrición
.
ENCOVA
Nacional
4 años
Determinar las
coberturas de
vacunación basada
en encuestas de
base poblacional.
De cobertura
De gestión
De calidad
De barreras
Demanda
y oferta de
servicios.
Oportunidades
Perdidas de
Vacunación
Nacional
4 años
Estimar la proporción
de oportunidades
pérdidas y sus causas.
Barreras y
viabilizadores
en la demanda
y oferta de
servicios de
vacunación.
Fuente: PAI / MSyD.
Manual Técnico del Programa Ampliado de Inmunización
Nacional
383
384
Serie: Documentos Técnico Normativos
CAPÍTULO 10
COMUNICACIÓN SOCIAL
DEL PAI
Índice
10.1
Introducción
372
10.2
Estrategias, conceptos y definiciones en busca de
una comunicación integrada y de calidad
373
10.2.1
Comunicación para el Desarrollo (C4D)
374
10.2.2
Comunicación en Salud
374
10.2.3
Abogacía por la salud
374
10.2.4
Movilización comunitaria para la salud
375
10.2.5
Comunicación Interpersonal
375
10.2.6
Comunicación de riesgo
376
10.3
Comunicación integrada y multimedia en apoyo
a la vacunación e inmunización
376
10.4
Identificación de audiencias y segmentación
de destinatarios de mensajes
377
10.5
Objetivos y premisas de la comunicación integrada en
apoyo a las actividades de vacunación según públicos
386
10.5.1
Objetivos específicos para el público primario
386
10.5.2
Objetivos específicos para el público secundario
386
10.5.3
Objetivos específicos en respuesta a eventos inesperados,
brotes o ESAVI
387
10.6
Planificación de la comunicación
388
10.6.1
Vacunación en servicio
388
10.6.2
Actividades extramurales: Vacunación por
concentración y/o micro concentración
388
10.6.3
Actividades extramurales: Vacunación casa por
casa (barrido, búsqueda activa, bloqueo)
389
10.6.4
Vacunación para el control de brote
389
10.7
Planificación de la comunicación: pasos y recomendaciones
390
10.7.1
El Proceso P
391
10.8
Errores frecuentes y lecciones aprendidas en la planeación
y ejecución de las actividades de comunicación
398
10.9
Situaciones de crisis en vacunación e inmunización
y comunicación de riesgos
399
10.9.1
Naturaleza y caracterización de las situaciones complejas y crisis
399
10.1 Introducción
“La inmunización es un componente esencial del derecho humano a la salud además
de responsabilidad de individuos, comunidades y gobiernos (Organización Mundial de
la Salud OMS, 2013)”.
Bolivia, en concordancia con los países de la Región de las Américas, sitúa a la vacunación
en el núcleo de sus estrategias de prevención y es un componente primordial de la atención
primaria de salud. El acceso universal, oportuno y sostenible a vacunas seguras y de calidad,
así como los constantes esfuerzos nacionales por otorgar las mejores condiciones posibles
de funcionamiento al programa nacional y a los nueve programas departamentales se ven
reflejados en los logros sin precedentes alcanzados en la prevención, control y eliminación de
enfermedades inmunoprevenibles.
La vacunación es considerada por la ciudadanía como un bien social1 y un derecho adquirido;
sus beneficios alcanzan a todas las personas y grupos sociales de manera equitativa y
solidaria.
El camino para merecer este sitial privilegiado en la valoración pública no fue sencillo; por
más de 40 años los esfuerzos técnicos y programáticos, la capacitación continua del talento
humano, el compromiso social y vocación de servicio, la voluntad política de instituciones
nacionales e internacionales y, finalmente, la generosa participación de la comunidad y sus
organizaciones han producido un impacto positivo y duradero en la salud pública nacional.
Gracias a la confianza en la vacunación, generación tras generación de padres y cuidadores
de niños y niñas asisten cotidianamente a los establecimientos de salud en busca de las
vacunas que ofrece el sistema público. Igualmente, a partir de la introducción de nuevas
vacunas, adolescentes, adultos y adultos mayores participan de las actividades que convoca
el Ministerio de Salud y Deportes
Serie: Documentos Técnico Normativos
Construir y consolidar un lazo de confianza no es un acto fortuito o espontáneo. Es un largo,
complejo y, en ocasiones errático, proceso social y de comunicación entre personas que
interactúan en un ecosistema multiétnico y multicultural.
Para ser eficaz, la comunicación entre los actores del proceso de vacunación debe sustentarse
en la voluntad de las partes para establecer un diálogo democrático. En un intercambio
positivo y continuo de información, haceres y sentires en busca de establecer las condiciones
propicias para - a través de la persuasión y el modelaje del comportamiento - promover
actitudes favorables y motivar prácticas orientadas a la vacunación de los niños, de las
familias y de las comunidades.
De acuerdo a Aarva, Haes y Visser (1997) la salud y la comunicación pueden estar
interrelacionadas desde diferentes niveles: entre individuos, grupos o sistemas. Diversos
estudios han demostrado que la comunicación en todos los niveles -masiva, comunitaria e
interpersonal- juega un papel importante en la difusión de conocimiento, práctica de conductas,
1
2010.
388
Ministerio de Salud y Deportes/Organización Panamericana de la Salud. Informe de la Evaluación Internacional del PAI Bolivia,
valores y normas sociales y en el estímulo a procesos de cambio social que contribuyen al
mejoramiento de la calidad de vida de un sujeto y al desarrollo de los pueblos2.
Como se puede deducir, la abogacía, la información, la comunicación y la movilización social
en apoyo a la vacunación son tareas primordiales para alcanzar efectivamente los objetivos y
metas de inmunización y mantener los logros hasta ahora conseguidos.
Las intervenciones en este componente, considerado un eje estratégico y transversal de la
inmunización, requiere de una acción cotidiana, continua y sistemática en cada uno de los
niveles del sistema de salud y de la voluntad de los tomadores de decisión.
El abordaje de la comunicación entre los usuarios y personal de salud debe ser integral,
intersectorial, participativo, inclusivo, intracultural e intercultural y, sobre todo, sensible a la
realidad local y a las necesidades de la población.
La planificación para la comunicación es un elemento esencial para implementar estrategias,
planes y actividades de vacunación exitosas.
Las buenas prácticas en comunicación tienen como requisito ineludible que el personal
de salud sea empático, creativo y proactivo, desarrollando habilidades comunicativas que
propicien un feedback constante a partir de la escucha activa y la observación continua de la
población.
El objetivo es que el personal de salud, especialmente quienes estén a cargo de la vacunación,
esté suficientemente capacitado y tenga la motivación necesaria para emplear las técnicas
de comunicación correctas, en los momentos oportunos para transmitir mensajes eficaces y
culturalmente apropiados dirigidos a audiencias correctamente segmentadas, utilizando de
medios y canales idóneos.
El triunfo del proceso se producirá cuando cada funcionario de salud se apropie de los recursos
técnicos y conceptuales y los emplee cotidianamente en su labor. De ser así, este conjunto de
destrezas y capacidades le permitirá constituirse en un líder, un promotor de la vacunación,
un dinamizador social y en legítimo agente de cambio en su comunidad.
10.2
Estrategias, conceptos y definiciones en busca de
una comunicación integrada y de calidad
“La información sobre la salud es un bien público, no una mercancía para transacciones
privadas ni algo accesible sólo a minorías. Todo ciudadano boliviano tiene, por tanto,
derecho a recibir y utilizar la información beneficiosa para su salud por todos los medios
de comunicación a su alcance y sin ninguna restricción” (Beltrán L.R et al, 1994).
2
Manual Técnico del Programa Ampliado de Inmunización
En síntesis, la aspiración es que la comunicación en pro de la vacunación se constituya en
una herramienta práctica – con reglas claras y técnicas específicas-, eficiente, adaptable a
las distintas realidades locales y escalable en todos los niveles del sistema de salud.
Comunicación en Salud: Conceptos y Modelos Teóricos. Iván Ríos Hernández (pp. 123-140) Perspectivas de la Comunicación Vol
4 Nro 1, 2011.
389
La promoción de la salud es el resultado de la suma de acciones de la población, los servicios
de salud, las autoridades sanitarias y otros actores sociales y productivos, encaminados al
desarrollo de mejores condiciones de salud individual y colectiva… y sentencia que: La salud
está en manos de la sociedad en su conjunto. (Beltrán Luis Ramiro, 2001:52).
A fin de disponer de un marco referencial que facilite la comprensión y alcance de las premisas
generales que se utilizarán repetidamente a largo de este texto, a continuación, se expondrán
las definiciones clave de los componentes mayores que sustentan e inspiran la comunicación
integrada en apoyo a la vacunación y la inmunización.
10.2.1
Comunicación para el Desarrollo (C4D)
La comunicación para el desarrollo (C4D) es un concepto centrado en la persona para encontrar
soluciones a los problemas de desarrollo. Algo inherente a la C4D es el deseo de entender
el conocimiento, las actitudes, y las prácticas de las personas con respecto a determinado
problema. Con este entendido, será entonces posible seleccionar una combinación de
mensajes de comunicación, herramientas y estrategias adaptados para abordar vacíos de
conocimiento y conducta en el público meta. En última instancia, la C4D ofrece un manual
estratégico para usar comunicación para impulsar el cambio social y conductual, así como
los resultados en el apoyo. Su enfoque en métodos participativos ayuda a facilitar el cambio
sostenible y duradero3.
10.2.2
Comunicación en Salud
La comunicación para la salud se define como: “la modificación del comportamiento humano
y los factores ambientales relacionados con ese comportamiento que directa o indirectamente
promueven la salud, previenen enfermedades o protegen a los individuos del daño”, o como
“un proceso de presentar y evaluar información educativa persuasiva, interesante y atractiva
que dé por resultado comportamientos individuales y sociales sanos”. Los elementos claves
de un programa de comunicación para la salud son el uso de la teoría de la persuasión, la
investigación y segmentación de la audiencia, y un proceso sistemático de desarrollo de
programas4.
Serie: Documentos Técnico Normativos
10.2.3
Abogacía por la salud
Es una combinación de acciones individuales y sociales destinadas a conseguir compromisos
políticos, apoyo para las políticas de salud, aceptación social y apoyo de los sistemas para un
determinado objetivo o programa de salud.
Dicha acción puede ser adoptada por los propios individuos y grupos, y/o en su nombre, con
el fin de crear condiciones de vida que conduzcan a la salud y a la adquisición de estilos de
vida sanos. La abogacía por la salud puede adoptar muchas formas incluido el uso de los
medios informativos y los multimedia, la presión directa a los políticos y la movilización de
la comunidad, por ejemplo, a través de grupos de presión, sobre cuestiones concretas. Los
3
Organización Internacional para las Migraciones. Manual de C4D de la OIM X, 2018.
4
Organización Panamericana de la Salud, Comunicación y Salud: documento técnico elaborado para la
29ava sesión del Subcomité de Planificación y Programación del Comité Ejecutivo, 1 y 2 de diciembre de 1997.
390
profesionales sanitarios tienen un importante papel como defensores de la salud en todos los
niveles de la sociedad5.
10.2.4
Movilización comunitaria para la salud
Es la participación (autónoma o estimulada externamente) sostenida y protagónica de los
individuos, grupos y organizaciones naturales de la comunidad en el planeamiento, ejecución
y evaluación de acciones para resolver problemas de salud definidos en consenso por todos
los actores.6
Los abordajes de la movilización social (Mc Kee:1992) son: (i) Movilización Política: dirigida
a las autoridades con poder de decisión (ii) Movilización gubernamental: en busca de
cooperación y apoyo -directo o indirecto- de otras carteras de Estado, proyecto o servicios del
gobierno nacional y de los gobiernos sub-nacionales (iii) Movilización comunitaria: informa y
obtiene compromisos de los líderes locales políticos, religiosos, sociales y tradicionales, así
como de las instituciones locales, ONGs, grupos de mujeres y cooperativas. (iv) Movilización
corporativa: en busca de la implicación de la empresa privada para promover objetivos
apropiados (v) Movilización de los beneficiarios: dirigida a la sensibilización, información y
motivación de los beneficiarios directos para involucrarlos en los objetivos del programa de
salud.
10.2.5
Comunicación Interpersonal
Es el intercambio de información que suele darse entre personas que comparten un espacio
físico, es decir, que cohabitan y por ende se ven en la necesidad de emitir y recibir mensajes
para normar u organizar la convivencia7.
En el ámbito de la salud pública, “La comunicación interpersonal es el intercambio, verbal o
no verbal, cara a cara de información o sentimientos entre dos o más personas y tiene lugar
en todas las áreas de los servicios de salud.”
Las habilidades interpersonales que utiliza el personal de salud con los usuarios son una
medida importante para determinar la calidad de atención. La calidad de la atención es
entendida como la característica que proporciona el máximo bienestar a quien demanda
5
Organización Mundial de la Salud. Promoción de la Salud: Glosario, 1998. Disponible en: https://apps.
who.int/iris/bitstream/handle/10665/67246/WHO_HPR_HEP_98.1_spa.pdf;sequence=1
6
Alfaro Rosa María; Díaz Bordenave Juan; Montaño Virreira Sonia; Prieto Castillo Daniel; Tognoni Gianni;
Torres-Goitia T. Javier. Movilización comunitaria para la salud, Diálogo Multidisciplinario. Universidad Johns
Hopkins/Save the Children, 1998.
7
Raffino Ma Estela. Comunicación interpersonal, 2020. Disponible en:
Manual Técnico del Programa Ampliado de Inmunización
La comunicación interpersonal que se desarrolla entre el personal de salud y usuarios/as
del servicio es de vital importancia, puesto que en este proceso el personal de salud tiene
la oportunidad de informar a el/la paciente y familiares, animarles a adoptar un nuevo
comportamiento para el cuidado de su salud, ofrecer a el/la paciente información y ayudar a
que tome sus propias decisiones mediante el incremento del conocimiento de algún tema de
salud. (Espinoza M: 2003).
https://concepto.de/comunicacion-
interpersonal/#ixzz6OSWzxnMn
391
un servicio de salud, sus dos aspectos fundamentales son: el manejo de las relaciones
interpersonales y la atención científico-técnica8.
10.2.6
Comunicación de riesgo
La comunicación de riesgo, se refiere al intercambio en tiempo real, de información,
recomendaciones y opiniones, entre expertos y/o funcionarios y personas que se enfrentan
a una amenaza (riesgo) para su sobrevivencia, su salud o su bienestar económico o social.
El objetivo final de la comunicación de riesgos es que toda persona expuesta a un riesgo sea
capaz de tomar decisiones informadas para mitigar los efectos de la amenaza (riesgo), como
el brote de una enfermedad, y tomar las medidas y acciones de protección y prevención.
La comunicación de riesgos utiliza variadas técnicas de comunicación que van desde
los medios de comunicación social a medios de comunicación masiva, grupos de interés
y motivación comunitaria. La comunicación de riesgos requiere de la comprensión de las
percepciones de las partes interesadas, de las preocupaciones y creencias, así como de sus
conocimientos y prácticas. Una comunicación de riesgos efectiva debe ser capaz de identificar
y poder manejar desde un inicio, los rumores, así como la desinformación y otros desafíos de
la comunicación9.
10.3
Comunicación integrada y multimedia en apoyo a la
vacunación e inmunización
La evolución continua del Programa Nacional de Inmunización plantea desafíos (nuevos o
recurrentes) que deben ser abordados con sentido de urgencia con apoyo de la comunicación
integral, estos son:
* Alcanzar niveles constantes y homogéneos de cobertura de vacunación, por departamento
y por municipio, consistentes con las metas nacionales y los compromisos internacionales;
* Disminuir aceleradamente las áreas de riesgo y los bolsones de no vacunados para evitar
brotes epidémicos o emergencias sanitarias;
* Realizar acciones preventivas y de control para disminuir las tasas de deserción o
abandono del esquema completo de vacunación.
Serie: Documentos Técnico Normativos
* Incrementar los niveles de satisfacción de los usuarios de los servicios de vacunación.
* Reducir los niveles de pérdida de oportunidades de vacunación.
* Promover vacunación segura en espacios seguros, en el contexto de la pandemia de
COVID-19;
* Aclarar, corregir o neutralizar la desinformación y rumores originados de grupos
antivacunas.
8
Espinoza Mauricio. La comunicación interpersonal en los servicios de salud. Artículo publicado en
Punto Cero v.8 n.7, 2003. Disponible en: http://www.scielo.org.bo/scielo.php?script=sci_arttext&pid=S1815-02762003000200005
9
Organización Panamericana de la Salud. Disponible en :
https://www.paho.org/hq/index.php?option=com_
content&view=article&id=11400:la-comunicacion-de-riesgo-preguntas-frecuentes&Itemid=41610&lang=es
392
Como se puede apreciar, el abordaje de los desafíos actuales y necesidades de mejora
continua en la gestión y operación del proceso de vacunación a escala nacional, requieren
de una intervención multidisciplinaria, sistemática y basada en innovaciones y debe incluir
mejoras en el desempeño del personal de salud.
Las intervenciones integrales en información, abogacía, comunicación, interpersonal,
movilización social y/o comunicación de riesgos, son instrumentos clave que ofrecen recursos
y herramientas eficientes para su utilización en todos los niveles del sistema.
El proceso integrado de comunicación, debe planificarse en base a un calendario anual y
acondicionarse de acuerdo al tipo de estrategia y táctica de vacunación que se pretende
accionar, a los recursos materiales disponibles en cada nivel de gestión, a las aptitudes del
personal para comunicar y movilizar, y considerar las variables geográficas, culturales y de
organización social predominantes.
Por ejemplo, la comunicación en apoyo a la vacunación en servicio tendrá especificidades
y variaciones respecto a aquellos recursos empleados para promover la vacunación en
momentos de intensificación, o la vacunación por concentración será, a su vez, levemente
diferente de aquellos recursos a emplear durante un barrido casa por casa.
Para finalizar esta parte teórica conceptual, la Guía Práctica de Campo propuesta por la
Organización Mundial de la Salud (OMS) y el Fondo de las Naciones Unidas para la Infancia
(UNICEF)10, señala que las actividades de comunicación en apoyo a la inmunización abarcan
los siguientes tipos:
* La Comunicación Social para la inmunización que estimula a las poblaciones para
actuar en apoyo directo al mejoramiento de las coberturas de vacunación y a brindar
información, motivación y asesoría para que el personal de salud trate a los padres con
respeto, brinden información de calidad con claridad y los estimulen a traer a sus niños y
niñas para vacunarlos cuando les corresponde.
* La Abogacía para la inmunización que es una actividad que tiene como objetivo ganar y
mantener el apoyo de líderes políticos, líderes de opinión y otras personas responsables
de tomar decisiones.
10.4
Identificación de audiencias y segmentación de
destinatarios de mensajes
Una práctica básica en la planificación y operación de la comunicación, es definir claramente
quiénes son los destinatarios de los mensajes y de las acciones. Es claro que los mensajes
no pueden ser elaborados, ni llegar por igual a todas las personas.
Manual Técnico del Programa Ampliado de Inmunización
* La Movilización Social para la inmunización que tiene como propósito ganar y mantener
la participación de un amplio rango de grupos y sectores para discutir y organizarse para
apoyar y participar en las actividades de inmunización.
10
OMS – UNICEF - USAID. Acciones Esenciales en Inmunización. Una Guía Práctica de Campo:
Comunicación social y modificación de conductas. p. 178. 2000
393
Las personas son diferentes entre sí, pero frecuentemente los materiales informativos,
educativos o de sensibilización las tratan como si fueran idénticas. Los planificadores de
la comunicación deben, para un uso óptimo de los medios y canales, “segmentar” a su
audiencia, es decir dividirla en subcomponentes homogéneos de la población mayor (a la que
habitualmente llamamos “población en general”).
La primera división consiste en definir las audiencias primarias y secundarias. Habitualmente,
las audiencias primarias son aquellas personas que se espera adopten los comportamientos
recomendados o prescritos.
Las audiencias secundarias son aquellas personas que influyen en la audiencia primaria y
pueden colaborar para enseñar o reforzar los comportamientos prescritos por el plan integrado
de comunicación.
En síntesis, la segmentación ayuda a identificar con precisión: a quién debe dirigirse un
mensaje en busca de que ésta persona o grupo se informe y analice por qué y para qué se
recomienda cierta práctica; evalúe si tiene las competencias para realizarla; se inicie en la
práctica; ejercite y mejore sus destrezas; esté motivado a continuar realizando la práctica; la
automatice y la incorpore en su rutina y, finalmente, aliente a otros a adoptarla.
Para el caso de la comunicación de la vacunación y la inmunización, los productos y actividades
de comunicación están orientados a las siguientes audiencias:
Serie: Documentos Técnico Normativos
Tabla N° 92: Audiencia primaria
394
QUIÉN
CONOCIMIENTOS Y/O COMPORTAMIENTOS DESEADOS
Embarazadas
Durante las consultas prenatales, reciben información sobre la importancia
de la vacunación y los beneficios para el recién nacido y para sí misma.
Igualmente, están informadas sobre los beneficios de la lactancia materna,
en especial del calostro.
Están sensibilizadas para llevar a sus hijos a vacunar hasta que ellos
concluyan el esquema de vacunación recomendado por el Ministerio de
Salud y Deportes
Completan su esquema de vacunación con la vacuna dT antes del parto.
Demandan la vacuna de la influenza estacional para evitar riesgos y
complicaciones causadas por el virus del AH1N1.
Demandan la vacuna contra la COVID-19.
Madres y
padres con
niños recién
nacidos.
Solicitan la BCG para su niño antes recibir el alta médica posterior al parto.
Consultan al personal de salud si efectivamente su niño recibió la vacuna
BCG.
Consultan al personal de salud la fecha en que debe ser administrada la
siguiente vacuna.
Solicitan el carné de vacunación del recién nacido.
Están sensibilizadas y motivadas para que sus hijos completan el esquema
de vacunación en el momento oportuno, recomendado por el Ministerio de
Salud y Deportes.
Conocen las ventajas y beneficios generales de la vacunación.
Recuerdan cuándo (fecha) es la próxima visita y cuántas veces deben llevar
a sus hijos a los establecimientos de salud para que reciban las vacunas
que correspondan a su edad hasta completar el esquema de vacunación.
Clarifican dudas y temores sobre la aplicación de múltiples inyectables.
Visitan el centro de vacunación aún si el niño(a) tiene alguno de los
siguientes síntomas: fiebre leve, diarrea, resfrío leve.
En el periodo de pandemia de COVID-19, colaboran con el personal de salud
cumpliendo las medidas de protección al momento de visitar un vacunatorio
(uso de barbijo, lavado de manos antes y después, distanciamiento físico
de, al menos un metro y medio).
Recuerdan las indicaciones básicas respecto a: qué hacer en caso de que
el niño manifieste un leve malestar o fiebre después de la vacunación.
Recuerdan que las molestias que los niños puedan presentar después de
la vacunación son leves y pasajeras.
Valoran a la vacunación como la mejor forma de evitar enfermedades
graves que, en algunos casos, pueden causar discapacidad o la muerte.
Recuerdan que no deben masajear ni colocar objetos, yerbas o
medicamentos en los sitios de aplicación de las vacunas.
Conservan en carné de vacunación de los niños y lo llevan al centro de
salud.
Verifican en el carné cuándo es la fecha de la próxima visita.
Recuerdan que los niños deben continuar la vacunación hasta completar
todas las dosis del esquema.
Padres y
cuidadores
de niños
mayores
de un año
Conocen la importancia y beneficios de la vacunación.
Recuerdan a qué edad los niños mayores de un año deben recibir las
siguientes dosis:
4ta dosis de pentavalente, 4ta dosis de antipolio y 2da de SRP entre los 18
y 23 meses de edad.
5ta dosis de pentavalente y 5ta dosis de antipolio a los 4 años.
Una dosis de refuerzo de la vacuna contra la influenza estacional entre los
12 y los 23 meses.
Dosis única de vacuna antiamarílica entre los 12 y 23
En el periodo de pandemia de COVID-19, colaboran con el personal de
salud cumpliendo las medidas de protección al momento de visitar un
vacunatorio.
Conservan el carné de vacunación o certificados de vacunación que son
entregados durante las actividades de intensificación, control de brotes,
introducción de nuevas vacunas u otras impulsadas por las autoridades
sanitarias.
En caso de tener dudas sobre la seguridad de la vacuna, consultan con su
médico pediatra o se informan de fuentes oficiales.
Manual Técnico del Programa Ampliado de Inmunización
Padres y
cuidadores
de niños
menores
de un año
395
Serie: Documentos Técnico Normativos
396
Niñas de 10
años de edad
Conocen la importancia y beneficios de la vacunación, en especial de las
vacunas VPH.
En el periodo de pandemia de COVID-19: demandan la vacuna VPH en
los establecimientos de salud próximos a su vivienda y colaboran con
el personal de salud, cumpliendo las medidas de protección personal al
momento de visitar un vacunatorio.
Conocen que la primera dosis debe ser aplicada a los 10 años de edad y la
segunda 6 meses después.
Conservan el carné de vacunación o certificados de vacunación que son
entregados durante las actividades de intensificación, control de brotes,
introducción de nuevas vacunas u otras impulsadas por las autoridades
sanitarias.
Padres o
cuidadores
de niñas
que deben
recibir la
vacuna VPH
Tienen información sobre por qué y para qué se recomienda la vacunación
contra el VPH de las niñas de 10 años.
En caso de tener dudas sobre la seguridad de la vacuna, consultan con su
médico pediatra o se informan de fuentes oficiales.
Colaboran con la vacunación de sus hijas. En caso de que el establecimiento
educativo lo solicite, dan su autorización por escrito o verbal para que sus
hijas sean vacunadas.
En el periodo de pandemia de COVID-19: acompañan a sus hijas a que
demanden la vacuna VPH en los establecimientos de salud próximos a su
vivienda y colaboran con el personal de salud, cumpliendo las medidas de
protección al momento de visitar un vacunatorio.
Adultos
que viajan
a países
endémicos
o con
transmisión
activa de
fiebre amarilla Los viajeros se informan, anticipadamente, si en su lugar de destino existe
transmisión activa, brotes o epidemias de fiebre amarilla o sarampión.
Están informados de que la vacuna contra la fiebre amarilla debe ser
administrada 14 días antes de su viaje. En el caso de la vacuna SR
(sarampión y rubéola) debe ser administrada 3 días antes de su viaje.
Están informados y sensibilizados de la importancia de hacerse vacunar
antes de viajar, no importando el tiempo de permanencia en su destino o el
tipo de actividad que realizará.
o sarampión
En el caso de la vacuna FA están informados que ésta vacuna no debe
ser aplicada a personas que tengan alergia al huevo o a alguno de los
componentes de la vacuna.
En el periodo de pandemia de COVID-19: demandan la vacuna FA, SR
o ambas en los establecimientos de salud próximos a su vivienda y
colaboran con el personal de salud, cumpliendo las medidas de protección
al momento de visitar un vacunatorio.
Conservan el carné de vacunación (certificado internacional o nacional de
vacunación)
Conocen la importancia y beneficios de la vacunación, en especial de la
vacuna contra la influenza estacional y la vacuna contra la COVID-19.
Están prevenidos de que luego de la vacunación podrían tener molestias
como dolor leve en el lugar de aplicación o síntomas similares a un resfrío.
Sin embargo, son informados que las molestias son leves y pasajeras y
que pasaran luego de algunas horas o pocos días.
Valoran favorablemente que la vacunación les protege de las formas graves
o incluso mortales de la influenza.
Valoran que la vacuna contra la COVID-19 evita las formas graves de
la enfermedad y disminuye notablemente la posibilidad de requerir
hospitalización o terapia intensiva, en caso de enfermedad.
En el periodo de pandemia demandan la vacuna contra la influenza
estacional en los establecimientos de salud próximos a su vivienda y
colaboran con el personal de salud, cumpliendo las medidas de protección
al momento de visitar un vacunatorio.
En caso de dudas o de requerir información sobre la seguridad de las
vacunas consultan a las autoridades de salud, a médicos especialistas en
inmunología/ infectología, o se informan a través de fuentes oficiales.
Conservan el carné de vacunación o certificados de vacunación.
Personal
de salud
Están informados, suficientemente sensibilizados sobre las ventajas y
solicitan las siguientes vacunas:
* Influenza estacional (anual).
* Anti COVID (de acuerdo a las recomendaciones actualizadas).
* Sarampión /rubéola (una sola vez).
* FA (una sola vez).
* Anti hepatitis B (tres dosis).
* dT (5 dosis).
Reconocen que a través de la vacunación contribuyen a disminuir el riesgo
de transmitir enfermedades infecciosas a sus colegas, familiares y a los
pacientes.
En caso de dudas o de requerir información técnico científica sobre la
seguridad de una vacuna o sobre sus componentes toman contacto
con las autoridades del Programa Ampliado de Inmunización o solicitan
información técnico-científica a fuentes oficiales.
Manual Técnico del Programa Ampliado de Inmunización
Adultos
mayores,
personal
esencial,
personas con
enfermedades
crónicas
397
Serie: Documentos Técnico Normativos
Tabla N° 93: Audiencia secundaria
398
QUIÉN
CONOCIMIENTOS Y COMPORTAMIENTOS DESEADOS
Autoridades
municipales,
seccionales y
cantonales
Las autoridades municipales están involucradas en la promoción,
difusión e información de acciones de salud, principalmente en la
vacunación.
Solicitan informes periódicos de la situación de la vacunación en sus
territorios, los analizan con las autoridades locales de salud y toman
acción en caso de que existan brechas de cobertura o poblaciones
desatendidas.
Colaboran, en la medida de sus posibilidades, con el fortalecimiento de
los centros de vacunación y con el desplazamiento de las brigadas de
vacunación.
Colaboran en las actividades de control de brotes, en caso necesario.
Colaboran en la diseminación de mensajes o información relacionada
con la vacunación, utilizando los medios de comunicación masiva, redes
sociales, reuniones grupales u otras que dispongan sus instituciones.
Dirigentes de
organizaciones
de la comunidad
y líderes locales
Progresivamente incorporan en sus agendas políticas administrativas
el tema de la salud infantil, con énfasis en vacunación.
Se informan sobre la situación de cobertura en sus áreas de jurisdicción
y promueven la vacunación de los niños, las escolares, las mujeres, los
jóvenes, los adultos mayores, en el marco del esquema nacional de
vacunación establecido por el Estado.
Conocen el calendario anual de actividades de vacunación e informan a
las comunidades.
Toman acción en caso de que existan poblaciones desatendidas,
insuficientemente vacunadas.
Intervienen para establecer puentes de diálogo y negociación en
aquellos lugares donde exista renuencia o rechazo a la vacunación por
parte de la población.
En caso de dudas o de requerir información técnico científica sobre la
seguridad de una vacuna o sobre sus componentes toman contacto
con las autoridades del Programa Ampliado de Inmunización o solicitan
información técnico-científica de fuentes oficiales.
Maestros,
educadores,
líderes religiosos
Están sensibilizados sobre los riesgos inherentes a la no vacunación
de los niños y se constituyen en promotores activos de las acciones de
vacunación en su territorio.
Colaboran en la planificación y organización de actividades de
vacunación de la población escolar.
Verifican que el personal docente, administrativo y de apoyo hayan
recibido las dosis recomendadas de la vacuna contra la COVID-19.
Facilitan el trabajo de las brigadas y la vacunación de las estudiantes.
Continúan solicitando el carné de vacunación como requisito para la
inscripción de alumnos en los establecimientos escolares.
Se constituyen en facilitadores en la comunicación entre el personal de
salud y los padres de familia.
Los líderes religiosos colaboran con las actividades de vacunación
ayudando en la difusión de la convocatoria a la vacunación (fechas,
horarios y lugares) y, en caso de ser necesario, colaboran con las
brigadas instalando puestos de vacunación en los espacios apropiados.
Los líderes religiosos recuerdan a la población que la vacunación es un
gesto de amor y de solidaridad.
Son aliados en la promoción de la salud en general y de la vacuna en
particular.
Se constituyen en facilitadores en la comunicación entre el personal de
salud, los líderes y autoridades locales y los padres de familia.
Directores
Técnicos
de SEDES,
responsables
departamentales
de vacunación,
Gerentes de red,
directores de
establecimientos
de salud
Realizan continuamente actividades de abogacía a fin de lograr respaldo
a las actividades de vacunación.
Organizan actividades de información y rendición de cuentas sobre la
situación de la inmunización en su departamento / municipio dirigido a
autoridades locales, y socios de la vacunación.
Lideran las actividades de movilización social y comunitaria en apoyo a
la vacunación.
Informan a la autoridad correspondiente en caso de brotes, ESAVI u
otras situaciones complejas relacionadas con la vacunación.
Los directores técnicos de SEDES o las personas que ellos designen, se
constituyen en voceros únicos dentro de su departamento en caso de
ocurrencia de brotes, ESAVI o situaciones de crisis relacionadas con la
vacunación.
Los directores técnicos de SEDES, lideran e impulsan la coordinación
interinstitucional con las autoridades nacionales, departamentales y
locales respecto de las actividades de vacunación.
Cuentan con un mapa, actualizado cada año, de actores sociales
departamentales (instituciones, organizaciones, ONGs, colegios y
asociaciones médicas, medios de comunicación, programas o espacios
dedicados a la promoción de la salud).
Visibilizan las experiencias exitosas, buenas prácticas y otras
actividades de promoción e información de la vacunación a través de
las redes sociales.
Comunicadores
institucionales
de los Sedes y
profesionales
de promoción
de la salud
Impulsan la ejecución de las actividades integradas de comunicación.
Coordinan al interior del SEDES y con las gerencias de red.
Se relacionan con los medios de comunicación e interceden para generar
espacios de información relacionados con la vacunación.
Cooperan en la visibilización de las experiencias exitosas, buenas
prácticas y otras actividades de promoción e información de la
vacunación a través de las redes sociales.
Capacitan al personal en comunicación interpersonal y manejo de redes
sociales.
Realizan monitoreos y evaluaciones de cumplimiento.
Manual Técnico del Programa Ampliado de Inmunización
Defensorías
de la niñez y
adolescencia.
399
Serie: Documentos Técnico Normativos
Miembros
del equipo de
salud (médicos,
enfermeras,
auxiliares de
enfermería,
personal
administrativo)
400
En el periodo pandémico aplica rigurosamente los lineamientos de
bioseguridad y las recomendaciones para realizar una vacunación
segura en un espacio seguro.
Conoce en detalle el esquema nacional de vacunación (vacuna,
enfermedad que previene, edad recomendada para la aplicación, vía de
aplicación y dosis).
Inicia el proceso de sensibilización pro vacunación durante las consultas
prenatales. Aclara dudas, mitos o información falsa sobre la vacunación.
El personal está persuadido de la importancia de disminuir al mínimo
las oportunidades perdidas de vacunación y colabora diligentemente
con este propósito.
Recuerda que la fiebre leve, el resfrío o la diarrea no son contraindicaciones
a la vacunación.
Se capacita en habilidades y técnicas de comunicación interpersonal
durante la prestación del servicio de vacunación. Practica y evalúa
continuamente su desempeño.
Incluye la comunicación interpersonal entre las variables a considerar
al momento de evaluar la calidad de prestación del servicio.
Incluye las actividades de comunicación, recursos necesarios,
equipamiento y los materiales requeridos al momento de realizar la
programación anual operativa y la microprogramación de las actividades
extramurales.
En caso de programar actividades de vacunación casa por casa, microconcentraciones, o vacunación en instituciones se asegura que la
población (vecinos, autoridades locales, padres, etc.) estén informados
con anticipación del cronograma de desplazamientos a fin de favorecer
el desempeño y la productividad de los equipos de vacunación.
Cuenta con material informativo, y recursos de apoyo para dar mensajes
claros a los padres o responsables del cuidado de los niños.
Realiza sondeos, encuestas, entrevistas u otras para conocer el grado
de satisfacción del usuario y realizar mejoras continuas.
Periódicamente, organiza actividades de sensibilización e información
mediante charlas didácticas, actividades lúdicas u otras que sean
atractivas y novedosas para los padres y la comunidad.
Actúan con ética y cautela para no ser agentes diseminadores de
información falsa o errónea relacionada con la vacunación y la
inmunización.
En caso de dudas o de requerir información técnico científica sobre la
seguridad de una vacuna o sobre sus componentes toman contacto
con las autoridades del Programa Ampliado de Inmunización o solicitan
información técnico-científica a fuentes oficiales.
Sociedades y
asociaciones
médicas:
Infectología,
medicina interna
Pediatría,
Ginecología,
Patología,
Salubristas,
epidemiólogos,
alergólogos,
inmunólogos,
biólogos
Realizan continuamente actividades de abogacía a fin de lograr respaldo
a las actividades de vacunación.
Fuerzas
Armadas y
Policía Boliviana
Están informados, suficientemente sensibilizados y solicitan las
siguientes vacunas para su contingente:
* Influenza estacional (anual).
* Anti COVID (de acuerdo a las actualizaciones y recomendaciones)
* Sarampión /rubéola (una sola vez)
Saben que, al ser responsables de la seguridad interna y externa del
país, sus miembros deben estar completamente protegidos y así evitar
bajas por enfermedades inmunoprevenibles.
Colaborar con la organización de las actividades de vacunación dentro
de las instalaciones policiales y militares.
Reconocen los beneficios de la vacunación para disminuir el riesgo de
transmitir enfermedades infecciosas a sus camaradas y familias.
En caso de dudas o de requerir información técnico científica sobre la
seguridad de una vacuna o sobre sus componentes toman contacto
con las autoridades del Programa Ampliado de Inmunización o solicitan
información técnico-científica a fuentes oficiales.
Periodistas y
comunicadores
Son sensibles a la situación de vulnerabilidad en la que un niño(a),
adolescente, adulto o adulto mayor podría encontrarse si no accede a
la vacunación.
Comprenden que la labor informativa de los periodistas no se limita a la
difusión de información estadística y/o estrictamente referida al suceso
noticioso, sino debe ampliarse y complementarse con información
u orientaciones pro-educativas, capaces de ayudar a los individuos
a reflexionar respecto a qué pueden hacer ellos, por sí mismos, para
evitar riesgos, prevenir las enfermedades inmunoprevenibles y cuidar
su salud.
Se involucren, en el marco del servicio por el bien común, en la promoción
de las acciones de vacunación.
Identifiquen fuentes idóneas capaces de exponer información basada
en evidencia científica de probada validez.
Organizan actividades de información y socialización sobre la situación
de la inmunización en su departamento / municipio dirigidas a sus
colega y miembros de sus asociaciones.
Lideran las actividades de movilización institucional, social y comunitaria
en apoyo a la vacunación.
Informan a la autoridad correspondiente en caso de brotes, ESAVI u
otras situaciones complejas relacionadas con la vacunación.
Manual Técnico del Programa Ampliado de Inmunización
401
Conozcan las guías para periodistas sobre cómo actuar en caso de
producirse un brote o situación compleja relacionada con enfermedades
prevenibles por vacunación, incluida la COVID-19.
Los medios masivos de comunicación (estatales, privados, confesionales,
sindicales o comunitarios) sean aliados estratégicos y solidarios para
la difusión de mensajes de sensibilización pública sobre las acciones de
vacunación y la socialización de una cultura de prevención.
10.5
Objetivos y premisas de la comunicación integrada
en apoyo a las actividades de vacunación según
públicos
En el sentido amplio la comunicación integrada que se propone en apoyo al PAI es “la mediación
estimulativa y de apoyo a la gente para que se comunique más y mejor entre sí y con los
funcionarios de salud - valiéndose principalmente de medios autóctonos y tradicionales de
tipo interpersonal y complementariamente de medios masivos modernos adaptativamente
empleados - bajo un encuadre igualitario de diálogo y participación, para contribuir colectiva,
autónoma y consensualmente al mejoramiento de la salud (...)¨. 11
Sobre la base de esta premisa general, el objetivo mayor de la comunicación es:
Promover cambios de comportamiento de los usuarios, operadores y socios del sector salud
con el propósito de estimular la demanda de vacunas y fortalecer la prestación de los servicios
de vacunación a fin de apuntalar el logro de las metas nacionales y cobertura de vacunación
y, en consecuencia, contribuir a la reducción del riesgo de enfermar y/o morir por causa de
enfermedades inmunoprevenibles.
10.5.1
objetivos específicos para el público primario
* Mantener la confianza pública en la vacunación y la inmunización.
Serie: Documentos Técnico Normativos
* Incrementar el conocimiento de madres, padres de familia y otras personas a cargo de
cuidado de niños y niñas respecto de la importancia y beneficios de las vacunas y el uso
y conservación del carnet de vacunación.
402
* Alentar a las mujeres en edad reproductiva, jóvenes adultos mayores, personal de salud
y personal de servicios esenciales a que reconozcan la importancia y oferta de valor de
las vacunas dT, anti influenza, anti COVID-19 y otras recomendadas por el Ministerio de
Salud y Deportes y que acepten y demanden la vacunación en los momentos oportunos.
10.5.2
objetivos específicos para el público secundario
* Estimular continuamente la participación de la comunidad y de sus líderes y organizaciones
en la promoción de la vacunación.
* Reducir la resistencia o renuencia a la vacunación de familiares o líderes de opinión u
otros que puedan influir negativamente por temor a posibles efectos secundarios, falsas
contraindicaciones o dogmas.
* Revertir las percepciones de maltrato y baja calidad de atención en los servicios de salud
a través de la circulación de mensajes dirigidos a sensibilizar, motivar y promover la
correcta aplicación, por parte del personal, de las normas básicas de atención al usuario
basadas en los principios de efectividad, afectividad, productividad y adecuación cultural
(calidad y calidez).
* A través de la comunicación instrumental reducir significativamente los porcentajes de
pérdida de oportunidades de vacunación.
* Promover en la comunidad educativa la realización de actividades de promoción de la
vacunación.
* Crear mecanismos y espacios (físicos o virtuales) de intercambio de información con
periodistas y comunicadores.
10.5.3
objetivos específicos en respuesta a eventos
inesperados, brotes o ESAVI
* Comprender la percepción del riesgo y el comportamiento de las audiencias frente al
fenómeno.
* Comprender y responder prontamente a las necesidades de información de la población.
* Desarrollar e Implementar el plan de comunicación de riesgos y a la gestión de la
información durante una situación de crisis.
* Posicionar a las autoridades de salud, como la principal fuente de información, durante
crisis o situaciones complejas.
* Asesorar y reforzar las capacidades del vocero o voceros.
* Asegurar uniformidad en la información y en el lenguaje utilizado por todos los voceros y
asociados, evitar difundir información incorrecta o no verificada, y reaccionar frente a los
rumores rápidamente.
* Ofrecer a las personas cosas sencillas para hacer con el objetivo de reducir su exposición
al virus y para proteger la salud de sus queridos.
* Promover, facilitar o producir recursos comunicativos.
* Organizar las relaciones con los medios de comunicación y la divulgación de mensajes
clave.
* Realizar la vigilancia de medios y monitorear las corrientes de opinión.
* Garantizar la participación y el compromiso con las comunidades pertinentes para
fortalecer la respuesta local y contribuir a superar las barreras para su implementación.
10.6
PLANIFICACIÓN DE LA COMUNICACIÓN
Manual Técnico del Programa Ampliado de Inmunización
* Durante un brote, procurar que las personas tengan la información esencial necesaria
para protegerse a sí mismas y a otros.
403
Recursos básicos de comunicación que deben ser considerados y utilizados al momento de
planificar e implementar una estrategia de vacunación:
10.6.1
Vacunación en servicio
El establecimiento de salud donde se ofrezca la vacunación, para reforzar la comunicación
interpersonal y visual con los usuarios, debe disponer de:
* Un letrero o valla exterior de identificación colocado en un lugar visible (Por ejemplo: Aquí
se vacuna gratis todos los días)
* Un cartel en el ingreso en el cuál se informe al usuario: los horarios de funcionamiento del
vacunatorio y dónde está ubicado, si fuera necesario.
* Letreros (señalética), desde la entrada hasta el sitio dónde está ubicado el vacunatorio.
* Banner, afiche o rotafolio u otro que describa gráficamente el esquema nacional de
vacunación y que sirva de ayuda memoria para el personal de Salud y una referencia para
los usuarios.
* Cartel, banner o afiche recordando las medidas de protección individual recomendadas
durante la pandemia y resaltando la idea “Vacuna segura en espacio seguro”.
* Cartel, banner o afiche recordando las habilidades de comunicación interpersonal que
el usuario debe practicar al momento de interactuar con los padres o beneficiarios de la
vacunación.
* Material informativo (beneficios de la vacunación, esquema y recomendaciones generales)
destinado a padres y cuidadores que visitan por primera vez el vacunatorio.
10.6.2
Actividades extramurales: Vacunación por
concentración y/o micro concentración
Serie: Documentos Técnico Normativos
Las herramientas básicas con las que debe contar son:
404
* Una carta u otra comunicación escrita dirigida a las autoridades y líderes locales
(municipales, sindicales, vecinales, clubes de madres, escuelas u otras representativas)
señalando el objetivo de la actividad de vacunación extramural, describiendo sus
características (periodo de duración, lugar, horario) y solicitando con precisión cómo
puede colaborar a los equipos de vacunación.
* Un modelo de comunicación a padres de familia, en caso de que se requiera, para informar
que hay una actividad de vacunación en curso y que se realizará -por ejemplo- en la
unidad educativa.
* Anuncio anticipado a través de los medios de comunicación local y en las reuniones
de la comunidad y adicionalmente una comunicación vía redes sociales o sistema de
comunicación instantánea (WhatsApp, Messenger, zoom, otros disponibles).
* Identificaciones y/o ropa de trabajo, a fin de que la población reconozca con facilidad al
personal de salud y no sienta desconfianza o susceptibilidad por la llegada de personas
desconocidas a su casa o comunidad.
* Megáfono fijo o móvil para anunciar la presencia de los vacunadores, informar y motivar
a la población a participar de la vacunación.
* Afiches, volantes, trípticos en caso de que estén disponibles.
10.6.3
Actividades extramurales: Vacunación casa por casa
(barrido, búsqueda activa, bloqueo)
* Una reunión informativa, realizada con anticipación a la llegada de las brigadas, con las
autoridades locales y/o líderes de la comunidad para informar de los objetivos, actividades
y de cómo ellos pueden colaborar con las actividades de vacunación casa por casa.
* Coordinación con las autoridades de la comunidad o responsables de los barrios o zonas
para que ellos comuniquen a los vecinos el arribo y despliegue de las brigadas.
* Un megáfono que acompañe a la brigada, anticipe su llegada a una comunidad, localidad
o barrio y anuncie cuál es el propósito de la actividad y a quién está dirigida.
* Identificaciones y/o ropa de trabajo, a fin de que la población no sienta desconfianza o
susceptibilidad por la llegada de personas desconocidas.
* Carnets de vacunación suficientes
* Material informativo promocional, si estuviera disponible.
10.6.4
Vacunación para el control de brote
* Coordinación con las autoridades de la comunidad o responsables de los barrios o zonas
para que ellos comuniquen a los vecinos el arribo y despliegue de las brigadas.
* Un megáfono que acompañe a la brigada, anticipe su llegada a una comunidad, localidad
o barrio y anuncie cuál es el propósito de la actividad y a quién está dirigida.
* Identificaciones y/o ropa de trabajo, a fin de que la población no sienta desconfianza o
susceptibilidad por la llegada de personas desconocidas.
* Reuniones diarias informativas, coordinación y evaluación con las autoridades locales.
* Una lista de mensajes clave relacionados con la actividad a ser difundidos por los medios
locales, reuniones con la comunidad, redes sociales o mensajería instantánea.
* Un listado con los números de teléfono de las autoridades locales, a fin de mantenerlos
informados y, si es el caso, solicitarles apoyo para movilizar a la comunidad.
10.7
PLANIFICACIÓN DE LA COMUNICACIÓN: PASOS Y RECOMENDACIONES
Manual Técnico del Programa Ampliado de Inmunización
* Una hoja ilustrada o pequeño afiche con fotografías ilustrativas de la enfermedad
que se pretende controlar a través de las actividades de bloqueo a fin de explicar las
características de la enfermedad, los síntomas y las posibles consecuencias sobre la
salud. Ese mismo instrumento servirá de apoyo para las actividades de vigilancia
epidemiológica comunitaria.
405
Una vez propuestos los objetivos de comunicación, según cada uno de los segmentos
priorizados y de acuerdo a los comportamientos esperados, en esta sección se presentarán
recomendaciones prácticas para planificar una intervención de comunicación.
El proceso de planificación debe ser comprendido como un paso fundamental e ineludible,
sólo a partir de ella es que se optimizará el uso del tiempo, los recursos y el esfuerzo. Las
acciones de comunicación en apoyo a la vacunación no deben ser fruto de la improvisación.
Las recomendaciones y sugerencias que se expondrán deben ser proyectadas con base en
la realidad local, al tipo de estrategia de vacunación o actividad de promoción que se quiera
reforzar y en la disponibilidad de medios de comunicación (masivos, grupales o interpersonales)
que se necesiten emplear. No todas las estrategias, ni planes sirven para el mismo propósito
ni para todas las situaciones relacionadas con la vacunación.
Por otra parte, las actividades a incluirse en el plan deben considerar todos los desafíos de la
operación, los responsables, los costos, la factibilidad de ejecutarlo en un tiempo prudencial
y, fundamentalmente, asegurar el impacto en las audiencias elegidas.
Para obtener un impacto real en el comportamiento buscado, la comunicación debe ser
planificada, ejecutada y evaluada en el marco de una metodología basada en una constante
consulta e interacción con la población objetivo.
Existen distintos métodos de planificación de la comunicación, todos válidos y con similitudes
entre sí. Para citar algunos:
* El “Proceso P.” Cinco pasos para la comunicación estratégica. Baltimore: Centro para
Programas de Comunicación de la Facultad de Salud Pública Bloomberg de la Universidad
Johns Hopkins.
* Pasos para diseñar la estrategia de comunicación. Basado en “Cómo diseñar una
Estrategia de comunicación educativa” de José Ignacio Mata.
* Diseño y ejecución de Programas de Comunicación Social de The University of Texas
School of Public Health. (adaptación de Luis. F. Velez).
Serie: Documentos Técnico Normativos
* “Herramientas para desarrollar destrezas en comunicación para la salud” HEALTHCOM
Proyecto de comunicación y mercadeo para la supervivencia infantil. Desarrollado por
The Academy for Educational Development de USAID.
406
* Estrategia COMBI (Comunicaciones con impacto en el comportamiento). Práctica y
vigilancia de la movilización y comunicación social, para lograr y mantener resultados
conductuales específicos relacionados con la prevención y el control de las enfermedades
transmisibles. Unicef, FAO, OMS.
Para ilustrar esta sección, se propone al lector utilizar como referencia (que no invalida la
utilización de los otros modelos señalados) al modelo de planificación estratégica de la
comunicación denominado “Proceso P “.
10.7.1
El Proceso P
El Proceso P es un marco de referencia que define, paso a paso la manera de desarrollar un
programa estratégico de comunicación para la salud.
Fue concebido para guiar el desarrollo de actividades de comunicación estratégica.
¿Cuáles son las etapas del Proceso P?
Consta de cinco etapas interdependientes para desarrollar las actividades, estas son:
1. Análisis.
2. Diseño estratégico.
3. Desarrollo: pre testeo y producción de materiales.
4. Aplicación: gerencia, ejecución y monitoreo.
5. Monitoreo y evaluación del impacto.
Paso 1: Análisis12
El producto esperado de este primer paso es: el equipo de salud interactúe con la comunidad,
investigue, organice y analice lo siguiente:
Comprensión del contexto y posibles públicos meta. Es un marco que ayuda a identificar y
entender los niveles de conocimiento, actitud y práctica de las personas, comunidades y de
los socios de la vacunación. Proveerá información útil para una mejor comprensión de la
situación, no solo desafíos, sino también oportunidades.
Análisis. Identifica la diversidad de públicos potenciales, incluido el público meta cuyo
comportamiento pretende cambiarse, modificarse o reforzarse con las actividades de
comunicación integrada.
Mediante la investigación de campo, las consultas a la población a través de un diálogo franco
y respetuoso con la comunidad y sus referentes será posible entender el problema de salud,
identificar a las organizaciones líderes y evaluar la capacidad de comunicación.
Análisis del comportamiento. Se prioriza y jerarquiza los comportamientos deseados. Por
ejemplo: enmendar bajas coberturas por causa del abandono del esquema, reforzar la
importancia de la vacunación con 4tas y 5tas dosis en el niño menor de 5 años, mejorar las
habilidades de comunicación interpersonal del personal de salud o, disminuir las oportunidades
perdidas de vacunación, etc.
El análisis se desarrolla en el siguiente orden:
* Se analiza qué comportamiento es factible de cambiar, modificar o reforzar.
* Se visualiza cuáles son los beneficios que la comunidad o el personal de salud puedan
percibir con el cambio de comportamiento propuesto.
Manual Técnico del Programa Ampliado de Inmunización
Cuánto más específica sea la información que se obtenga sobre las percepciones,
comportamientos y prácticas del público meta, más sencillo será desarrollar mensajes y
actividades focalizadas y correctamente orientadas.
407
* Se evalúa si las audiencias tienen las capacidades y/o habilidades para desplegar el
comportamiento deseado.
* Se valora si las personas tienen una motivación o motivaciones para poner en práctica el
comportamiento recomendado.
Análisis de comunicación. Consiste en comprender cómo accede a la información el público
meta y cuáles son sus plataformas mediáticas preferidas. Sean estas masivas (radio, televisión,
redes sociales, impresos, etc.) o comunitarias (reuniones, asambleas, radios comunitarias,
charlas educativas, etc.).
Ejemplo ilustrativo:
A pesar de sus esfuerzos, el personal del servicio de vacunación de la Red de salud “Pampa Alta”
no puede alcanzar la meta de cobertura con tercera dosis de pentavalente, la deserción es alta, las
vacunas se están perdiendo y el personal no entiende el porqué de la situación. El equipo de salud
decidió implementar un plan de comunicación integrado para motivar la vacunación con terceras
dosis. Entonces: ¿Qué hacer? ¿Por dónde comenzar?
Comprender el contexto requiere ver más allá de nuestra propia razón o percepción. Es necesario
escuchar a las personas de la comunidad y saber, desde su perspectiva, cuáles son las causas (el
problema) que están produciendo las deserciones.
Una actividad de inicio es reunir al equipo de salud, hacer un análisis introspectivo y autocrítico e
indagar cuáles podrían ser los motivos, internos o externos, que están produciendo que un grupo
importante de madres no regresen al establecimiento.
La segunda actividad será organizar uno o varios grupos de 6 u 8 madres de niños entre 4 y 6 meses
de edad (segmento específico de la población objetivo) e invitarlas a dialogar sobre la vacunación. La
conversación debe ser orientada por una guía de preguntas previamente estructuradas (siguiendo
una técnica de investigación cualitativa) y se desarrollará en un tiempo no mayor a 90 minutos. La
actividad debe ser altamente participativa, cordial y respetuosa de las opiniones.
Serie: Documentos Técnico Normativos
La intención es que, a partir del diálogo con las madres y escuchando atentamente su punto de
vista, sus experiencias, percepciones, necesidades de información o lo que oyeron de otras madres,
familiares o de los líderes de la comunidad, el equipo de salud comprenda: Las causas y las
motivaciones por las cuales las madres adoptaron una conducta de riesgo.
Entonces, con base en las respuestas provenientes de la comunidad, y desde la propia autocritica
del personal de salud se comienza a concebir: qué, cómo, cuándo, dónde y en quién apoyarse para
revertir la situación. Es decir, se reúnen los elementos para darle forma al diseño estratégico.
PASO 2: DISEÑO ESTRATÉGICO
Las actividades clave dentro de este paso, son: Desarrollar objetivos MADRE (SMART por
su acrónimo en inglés); utilizar tácticas para posicionar el plan de tal manera que ofrezca
beneficios claros e inmediatos; determinar cuál será el modelo a seguir y seleccionar los
medios y actividades principales.
Entre las tareas está elaborar un documento breve y muy claro que:
* explique el plan de ejecución y el presupuesto,
408
* esté consensuado dentro del equipo de salud y socializado con los actores internos y
externos que estarán implicados en su implementación.
* incluya el proceso de monitoreo y evaluación.
Fijar objetivos MADRE. Un objetivo define los cambios deseados a partir de la identificación
del problema de salud (por ejemplo: el abandono del esquema), los comportamientos o los
conocimientos que se desea la población adopte.
Conozcamos a qué se refieren los autores con los objetivos MADRE:
Medible: Los cambios se verifican objetivamente.
Alcanzable: Las metas son realistas.
Dirigido: Especifica claramente los destinatarios y el cambio de comportamiento deseado por
cada uno de ellos.
Razonable: El objetivo propuesto responde a las capacidades y recursos disponibles y reales,
al compromiso de cumplimiento por parte del equipo e implicados y considera los desafíos
que deben superarse para lograrlo.
Específico en el tiempo: El cambio de comportamiento deseado se produce en un tiempo
predeterminado por el plan.
Definir las estrategias de difusión y medios y canales. Se determinan cuáles serán los medios
y canales que se utilizarán para difundir los mensajes. La elección debe ser consistente con
la información obtenida en la etapa de diagnóstico.
Si el presupuesto es limitado, el equipo de salud debe identificar creativamente cuáles medios
y canales pueden ser utilizados con poco presupuesto, pero asegurándose de maximizar el
resultado. También es necesario considerar quiénes son los aliados estratégicos y cómo ellos
pueden contribuir con sus recursos o capacidades instaladas y así colaborar con la difusión.
1. el conocimiento de la innovación/conducta;
2. la formación de una actitud favorable hacia la innovación/conducta en cuestión;
3. la intención o decisión de adopción;
4. la práctica o adopción de la innovación;
5. la abogacía/confirmación de tal práctica.
Desarrollar la propuesta creativa. Es importante desarrollar una propuesta creativa que
establezca el público meta, los objetivos de comunicación, los mensajes y el contenido clave,
las llamadas a la acción, las pautas, el tono, el género y otras consideraciones creativas. Un
resumen creativo pretende ser informativo, atractivo, relevante, participativo y persuasivo.
Manual Técnico del Programa Ampliado de Inmunización
Diseñar de la estrategia de comunicación. Al planificar la estrategia de comunicación, se
identifica dónde se encuentra el público objetivo a lo largo del trayecto del comportamiento.
El camino por el cual un individuo transita para adoptar nuevos comportamientos es:
409
Ejemplo ilustrativo:
Frente al problema: La cobertura de vacunación con terceras dosis en la comunidad “Pampa Alta”
está por debajo del 30% debido a las altas tasas de deserción.
Un objetivo de comunicación “débil” sería: “Informar a la comunidad “Pampa Alta” sobre los
beneficios del programa de vacunación”.
Los objetivos de comunicación “fuertes”, bajo el enfoque madre MADRE, debería ser:
Al menos 80% de los niños de 6 meses de edad de la comunidad “Pampa Alta” reciben oportunamente
la tercera dosis de pentavalente, antineumocócica y antipolio luego de la implementación de un
proceso integral e intensivo de abogacía, comunicación interpersonal, comunicación social y
movilización comunitaria.
A través de personal de salud capacitado en comunicación interpersonal eficaz, el 100% de las
madres/padres de niños de 2 y 4 meses de edad se informan y recuerdan tres beneficios de la
vacunación, valoran positivamente la seguridad e inocuidad de las vacunas y recuerdan cuáles son
los riesgos de no hacer vacunar a sus hijos o de abandonar el esquema.
Y las actividades para alcanzar estos objetivos serian:
El personal de salud realiza charlas educativas semanales en las salas de espera del establecimiento,
compone una canción sobre la vacunación y aplica técnicas de motivación grupal durante las
reuniones mensuales del club de madres para estimular a que las madres/padres de niños entre 2
y 4 meses de edad continúen con la vacunación hasta finalizar el esquema.
El personal de salud felicita y agradece a las madres que completaron el esquema de vacunación y
organiza un cuadro de honor con las fotografías de las madres y niños que están 100% vacunados.
Durante 8 meses, la radio comunitaria difunde mensajes sobre los beneficios de la vacunación, la
seguridad e inocuidad de las vacunas y refuerza continuamente a qué edad los padres deben llevar
a los niños a los centros de vacunación, dónde están ubicados y en qué horarios prestan el servicio
de vacunación.
Serie: Documentos Técnico Normativos
Los líderes de la comunidad están informados de la situación de la vacunación con terceras dosis
en la comunidad “Pampa Alta”, tienen un registro de los niños en edad de vacunar y resuelven
organizar una reunión de toda la comunidad para que el personal de salud explique la situación,
informe cuáles son los problemas que podrían presentarse en la comunidad debido al abandono del
esquema y propongan a la comunidad soluciones frente al problema.
410
El equipo de salud conoce que las vacunas pueden aplicarse de forma simultánea y que tienen
la misma eficacia e inocuidad si se coloca una sola o simultáneamente con las otras vacunas
establecidas en el calendario. Comunican a los padres que la aplicación de múltiples vacunas
inyectables en una misma visita es una práctica habitual, segura y eficaz, y no aumenta o agrava
los malestares posteriores a la vacunación, que por lo general son leves y pasajeros y no conllevan
ningún riesgo para los niños.
PASO 3: DESARROLLO Y PRUEBA
Dentro de esta fase, se desarrollan, se prueban, se revisan y se vuelven a probar los conceptos,
materiales y mensajes antes de la producción final.
Este ejercicio de verificaciones constantes antes de lanzar el producto sirve para garantizar
que una actividad no sólo sea entendida y relevante a su público, sino que también evoque
emociones que puedan motivar cambios positivos de comportamiento y/o acciones sociales
en favor de la vacunación.
1. Desarrollo de contenidos. ¡Los materiales y mensajes deber ser creativos! El arte está
en crear materiales que evoquen emociones, motiven al público y se ajusten al plan de
comunicación.
2. Desarrollo de mensajes de cambio de comportamientos eficaces. Hay múltiples opciones
para presentar un mensaje sobre vacunación.
Por ejemplo, un eslogan genérico (mensaje típico) puede ser útil para conseguir apoyo del
público, pero sobre la base de las lecciones aprendidas en comunicación de la inmunización,
los mensajes de acción tienen un mayor impacto porque les dicen a las personas lo que
pueden hacer y cómo pueden ser partícipes.
También se pueden usar mensajes negativos (como información sobre riesgos o
consecuencias), pero se recomienda equilibrar con aspectos positivos. Las campañas
excesivamente negativas erosionarán la confianza de su público meta y pueden hacer que
se sientan alienados o desanimados, en lugar de motivados.
Los mensajes positivos pueden contribuir a:
* Apoyar al público meta para que se convenzan que pueden marcar la diferencia y que es
posible hacer algo por el bienestar de su familia y comunidad.
* Motivar al público meta a modelar y reforzar comportamientos positivos/seguros.
* Facilitar la apropiación de la comunidad del cambio positivo que se promueve.
Para recordar:
Tres por tres: ¡Polio, neumo y penta de una vez!
Por ti, por mí, por ellos. ¡Vacúnate!
Cuídalos, quiérelos, vacúnalos.
¡Disfruta de la vida, vacúnate!
¡Que la gripe no te acompañe…Vacúnate!
Los conceptos y mensajes son el eje central del plan, ellos reflejan con creatividad los objetivos
propuestos.
Todos los medios, materiales e intervenciones de comunicación deben transmitir los mismos
mensajes principales y secundarios.
Manual Técnico del Programa Ampliado de Inmunización
3. Prueba preliminar y validación de los mensajes. Testear un mensaje y un material es muy
importante. La validación se debe realizar a través de consultas, discusiones y otros. Las
pruebas preliminares se hacen para garantizar que los materiales de comunicación logren
sus objetivos, por ello es importante recordar que los mensajes de la vacunación deben
ser: fáciles de entender; atractivos; culturalmente aceptables; participativos; persuasivos.
Para construir mensajes clave es necesario conocer su anatomía:
411
1. Atractivo del mensaje: El mensaje para que llame la atención, sea fácil de recordar y de
asociar puede utilizar múltiples formas o combinaciones.
Pudiera ser emocional/racional, educativo/emocional “agresivo” / ”diplomático”, unilateral/
bilateral, científico/sabiduría tradicional, u otra clase de atractivo culturalmente apropiado
2. Tono del mensaje: Hace referencia a cómo se apelará al destinatario del mensaje, para
que este preste atención, se interese y lo asocie positivamente con un tema de su interés.
Los mensajes pueden tener un tono humorístico o uno serio. Puede ser formal o coloquial.
Puede centrarse en lo informativo o más en lo emocional, etc.
3. Etapas del mensaje: No todos los mensajes pueden transmitirse a la vez. Ellos deben ser
bien dosificados y difundidos de acuerdo a las prioridades establecidas, a las etapas del
plan.
4. Integración del mensaje: Es la forma en que varios mensajes (principales y secundarios)
se relacionan entre sí en la mente de la audiencia para reflejar un todo conceptual único.
5. Imagen: Es la definición de ¿Qué “imagen” se utilizará en la gráfica o piezas visuales o
audiovisuales? Por ejemplo, imágenes que reflejen lo rural/urbano, lo moderno/tradicional,
muestren adultos/jóvenes, muestren equilibrio de género, etc.
Fuente de información: Es la presentación al público de una persona real o de un personaje
ficticio que podría ser utilizado como “la fuente de la información”. Es una imagen constante
que se utiliza en todos los materiales y productos que se quiere transmitir, por ejemplo, una
enfermera, un médico, un líder legítimo de la comunidad, un deportista, etc. La selección de
una persona o la creación de un personaje, dependerá de las validaciones realizadas con la
población, siempre que esta lo identifique como creíble y confiable.
Serie: Documentos Técnico Normativos
PASO 4: IMPLEMENTACIÓN
412
Esta fase incluye la coordinación y la movilización de todos los socios clave que participaron
en el desarrollo del plan de comunicación y que fueron previamente identificados y clasificados
en un mapa de actores sociales. Estos socios clave o actores sociales, también deben ser
parte de la difusión de los mensajes a través de sus propios canales y redes. Un enfoque
altamente consultivo y participativo al desarrollar el plan y los materiales, crea a su vez,
mayores oportunidades para la difusión.
Piense en una combinación de canales de comunicación. Por ejemplo: una campaña de
medios impresos seguida de talleres específicos con materiales audiovisuales y un facilitador
que dirija las discusiones sobre estos materiales. Este tipo de enfoque le dará al público mayor
exposición a los mensajes clave.
El público tiene tiempo para pensar en los mensajes a través de la comunicación interpersonal
y los materiales impresos actúan como refuerzos del mensaje.
Para recordar:
Los líderes de la comunidad, las autoridades locales, los medios de comunicación, entre otros
influyen sobre la percepción que la opinión pública tiene sobre la vacunación, y esa influencia
puede ser positiva o negativa. Es fundamental crear alianzas de colaboración con estos
actores desde un primer momento, a fin de garantizar su apoyo a la difusión de los mensajes.
Contar con un mapa de actores sociales es muy importante ya que facilita la tarea de abogacía,
coordinación y movilización social e institucional.
¿Qué es un mapa de actores sociales?
Es una técnica que permite identificar a las personas y organizaciones que pueden ser
importante en el planeamiento, diseño, implementación, evaluación o sistematización del
plan de comunicación integral; permite conocer a priori con quienes se cuenta para apoyar la
iniciativa que se está promoviendo.
Con la información incluida en el mapa es posible definir las estrategias específicas por cada
socio o grupo de socios a fin de que estos faciliten y contribuyan al logro de los objetivos
previstos en el plan de comunicación.
El mapa de actores sociales debe señalar a las personas, grupos y organizaciones que puedan
contribuir o afectar el desarrollo del plan. Debe también clasificarlas y jerarquizarlas de
acuerdo a sus características; sus capacidades, recursos, experiencia; su poder de influencia
en otros actores sociales o en la comunidad; y, finalmente, su interés en el tema.
PASO 5: MONITOREO Y EVALUACIÓN
El Monitoreo y Evaluación buscan de medir los resultados, sean de proceso o de impacto. El
Monitoreo hace un seguimiento de los productos y resultados para poder hacer ajustes a la
actividad durante la implementación.
En síntesis, el Monitoreo tiene como propósito: corregir, reorientar o rediseñar. Su intención es
reajustar las actividades y los mensajes de comunicación, si fuera necesario.
La evaluación, tiene como propósito: Demostrar el impacto de las actividades de comunicación.
Su finalidad es determinar el nivel de cambio, adopción o suspensión del comportamiento
deseado y si la puesta en marcha del Plan contribuyó al logro de los objetivos y al marco de
resultados.
10.8
ERRORES FRECUENTES Y LECCIONES APRENDIDAS EN LA PLANEACIÓN Y EJECUCIÓN DE LAS ACTIVIDADES DE COMUNICACIÓN13
Manual Técnico del Programa Ampliado de Inmunización
La Evaluación mide qué tan bien logra sus resultados un plan. Es importante evaluar el
resultado de las actividades en el nivel del comportamiento. Es muy importante dar tiempo y
presupuesto para la investigación y el monitoreo de la implementación.
13
Adaptado de: Organización Panamericana de la Salud, Iniciativa para la erradicación global de la polio
(IMG/GPEI). Paquete de recursos sobre medios de comunicación, preparación para la introducción de la IPV.
413
¿Qué no se debe hacer al proyectar o ejecutar un plan de comunicación en apoyo a la
vacunación?
Error 1. Diseñar un plan de comunicación sin una investigación apropiada, sin escuchar la
opinión de la población y sin analizar el contexto social, político o cultural.
Error 2. Tomar decisiones improvisadas, por intuición o sobre la base de las viejas prácticas
que ya no sorprenden ni llaman la atención del público.
Error 3. Realizar actividades de comunicación dispersas, sin base en una programación y en
un calendario anualizado.
Error 4. Elaborar materiales de comunicación en el último momento. El proceso creativo,
el diseño, la validación, la reproducción y la distribución de materiales relacionados con la
comunicación y la movilización social demandan tiempo, recursos y procedimientos técnicos
y administrativos. El proceso de diseño y producción debe iniciarse tempranamente y
concluirse a tiempo.
Error 5. Utilizar imágenes poco felices o inadecuadas de la vacunación. No habrá un efecto
favorable, ni la adhesión espontánea de la comunidad, si los materiales de comunicación
muestran imágenes de personas “sufriendo” o “asustadas”. El miedo a las inyecciones es muy
frecuente y difundido en la sociedad, el temor altera a los niños y a los padres por igual.
Error 6. Presentar al público mensajes y materiales que no están suficientemente validados y
elaborados. Los materiales poco atractivos, difíciles de leer, interpretar o de mala calidad no
generan impacto.
Error 7. Comenzar tardíamente las campañas de comunicación.
Error 8. Desaprovechar o ignorar la capacidad e influencia de las redes sociales y sus distintos
recursos.
Error 9. Comparecer ante los medios sin preparación suficiente y/o utilizar voceros inadecuados
o improvisados.
Serie: Documentos Técnico Normativos
Error 10. Permitir que los rumores o informaciones erróneas circulen sin control.
Error 11. Mentir u ocultar la verdad en una situación de crisis o de un ESAVI. La falta de
transparencia provocará tarde o temprano la indignación pública y la desconfianza en la
seguridad e inocuidad de las vacunas.
Error 12. Obviar la sensibilización del personal de salud, su capacitación en técnicas de
comunicación y habilidades de comunicación interpersonal.
Error 13. Lanzar información o mensajes difíciles de comprender (lenguaje extremadamente
técnico), contradictorios o técnicamente incorrectos.
Error 14. Difundir materiales impresos, audiovisuales u otros que no tienen una línea
discursiva o gráfica común (mismo slogan, gráfica, colores, etc.). Las personas se confunden
2014
414
y no pueden reconocer con facilidad la campaña de comunicación en curso ni recordar sus
mensajes principales.
Error 15. Desperdiciar el presupuesto y recursos existentes en medios, productos y actividades
ineficientes e ineficaces.
Error 16. Pretender establecer relaciones con los periodistas y productores de programa
solamente en periodos de campañas y distanciarse de ellos el resto del año.
Error 17. Organizar eventos solamente para cumplir el protocolo y las formalidades. Un evento
sin impacto público o mediático es solamente un desperdicio de recursos y tiempo.
10.9
SITUACIONES DE CRISIS EN VACUNACIÓN E INMUNIZACIÓN Y COMUNICACIÓN DE RIESGOS
No obstante, de los importantes avances en el control de enfermedades, la inmunización no
está libre de controversias, en 2019, La Organización Mundial de la Salud (OMS), emitió una
comunicación revelando las diez cuestiones de alto interés para la Organización y los países
miembros, se denominaron: “Las 10 principales amenazas a la salud”. Una de estas amenazas
globales a la salud pública internacional es la “Renuencia a la vacunación”.
En su exposición de motivos, la OMS14 señala:
“La renuencia a vacunarse, esto es, la reticencia o la negativa a vacunarse a pesar de la
disponibilidad de vacunas, amenaza con revertir los progresos realizados en la lucha contra
las enfermedades prevenibles mediante vacunación.
10.9.1
Naturaleza y caracterización de las situaciones
complejas y crisis
A medida que las enfermedades inmunoprevenibles se tornan menos visibles, gracias a la
ejecución de programas eficaces de vacunación, la población y los medios de comunicación
prestan mayor atención a los eventos atribuibles al uso de las vacunas o sus posibles riesgos.
Asimismo, las necesidades de información de los padres y cuidadores de niños del siglo 21
son crecientes y cada vez más específicas; muchas de ellas motivadas por las corrientes de
opinión que se generan en las redes sociales, por la disponibilidad de información en revistas
o publicaciones científicas, por causa de las afirmaciones de artículos pseudo científicos o
publicaciones engañosas que están disponibles en internet y, en otros casos, por la ola de
desinformación y temor provocado por grupos de presión.
14
Manual Técnico del Programa Ampliado de Inmunización
Las razones por las que las personas deciden no vacunarse son complejas; un grupo asesor
de la OMS sobre vacunas identificó la complacencia, los inconvenientes para acceder a las
vacunas y la falta de confianza como razones clave. Los trabajadores sanitarios, especialmente
los de las comunidades, siguen siendo los asesores e influyentes más confiables en las
decisiones relativas a la vacunación, y la OMS los apoya para que proporcionen información
fidedigna y creíble sobre las vacunas…”
Disponible en: https://www.who.int/es/news-room/feature-stories/ten-threats-to-global-health-in-2019
415
Como se dijo, en simetría a que cada año se reduce la incidencia de las enfermedades
prevenibles por la vacunación, los padres pueden percibir que el riesgo de vacunar a sus hijos
es mayor que el riesgo de contraer la enfermedad15 y ante la duda, algunos de ellos, optan por
evadir la vacunación de sus hijos.
En general, las situaciones o eventos que producen crisis de confianza se originan en:
* Errores provocados por las deficiencias de operación del Programa de Vacunación (errores
humanos).
* Proliferación de noticias falsas, rumores, mitos, y/o información errónea difundida
intencionalmente por grupos antivacunas (infodemia).
* Eventos supuestamente atribuidos a la vacunación y la inmunización (ESAVI).
* Demanda descontrolada y situaciones excepcionales (generalmente temporales)
por causa de limitaciones en la disponibilidad de una vacuna específica durante una
emergencia sanitaria.
¿Qué es una crisis?
En el contexto de la vacunación una “crisis” es una situación donde se produce una pérdida real
o potencial de la confianza pública en las vacunas o en el servicio de vacunación, precipitada
por la difusión a gran escala de un hecho verídico o supuesto. Habitualmente, cuando suceden,
las crisis surgen por motivos que están fuera del control directo del Programa de Vacunación.
Sin embargo, infundadas o no, esas crisis pueden trastornar las actividades de inmunización
y consiguientemente afectar la salud pública.
Las crisis, pueden también nacer o acrecentarse por un deficiente manejo de las relaciones
con los medios de comunicación y con la comunidad. Igualmente, se pueden exacerbar
debido a la decisión de minimizar la situación o demorar excesivamente en la activación de
un plan de respuesta frente a una situación en desarrollo.
Elaborar planes de comunicación nacional, departamentales y de Gerencia de Red sobre la
seguridad de las vacunas debe adoptar un enfoque integral a partir de los siguientes ejes:
* Promover la sensibilización respecto de los riesgos y beneficios de las vacunas.
Serie: Documentos Técnico Normativos
* Comprender las percepciones de riesgos.
416
* Preparar la gestión rápida de eventos adversos y otras preocupaciones concernientes a
la seguridad e inocuidad de las vacunas.
En general, la respuesta frente a una situación inusitada debe considerar lo siguiente:
* Verificar los hechos. Investigar y constatar que la información/rumor/denuncia/alerta
tenga relación con la vacunación. Si es así, deben seguirse los protocolos recomendados
de investigación epidemiológica o social. Inmediatamente debe iniciarse la cadena de
comunicaciones, utilizando los medios más eficaces posibles para que la comunicación
sea instantánea, hasta llegar a la autoridad departamental y de ella a la nacional.
Es muy importante que la información sea precisa (tiempo, lugar, persona), colectada de
fuente primaria y que esté claramente descrita.
* Disponer de un plan. Crear un grupo de trabajo, si es apropiado se debe involucrar a las
autoridades locales; diseñar el plan general (objetivos, actividades y subactividades,
marco de resultados, recursos necesarios), asignar responsabilidades (individuales o de
grupo); socializar la cadena de comunicaciones y establecer reglas y conducta a seguir
para evitar especulaciones y fugas de
* información; organizar y clasificar la información disponible (actualizar la sala de situación
e incluir el mapa de actores sociales); establecer las acciones de salud y de comunicación
que serán necesarias implementar; determinar y organizar las medidas de apoyo a los
afectados (incluye al personal de salud); iniciar el plan de comunicación: con los afectados,
con la población y establecer las relaciones con los medios de comunicación; activar las
tareas de escucha a la población, monitoreo de medios y rumores.
* Seguimiento y evaluación diaria. Realizar un monitoreo continuo de la evolución de
la situación y del cumplimiento de las actividades. El monitoreo debe servir como un
elemento de retroalimentación y de mejora del plan. En situaciones de crisis el plan debe
adaptarse a la evolución y el contexto y los miembros del equipo de salud deben ser
flexibles e introducir las modificaciones que se requieran.
Manual Técnico del Programa Ampliado de Inmunización
417
418
Serie: Documentos Técnico Normativos
COMITÉ EDITORIAL DEL MANUAL TÉCNICO DEL PAI
ACTUALIZACIÓN 2021:
Responsable PAI La Paz
Técnico de cadena de frío
Gestora de calidad del PAI
Técnico cadena de frío
Responsable de vigilancia PAI
Comunicadora
Gestora de calidad PAI
Responsable PAI Santa Cruz
Responsable PAI de Potosí
Gestora de calidad del PAI
Responsable de vacunación segura
Responsable nacional de logística
Responsable nacional PAI
Responsable PAI Pando
Responsable de cadena de frío
SNIS-VE
Responsable PAI Beni
Responsable PAI Tarija
Gestora de calidad PAI
Consultora PAI OPS
Responsable PAI Cochabamba
Consultor Unicef
Responsable PAI Chuquisaca
PAI Potosí
PAI Chuquisaca
Vicepresidente CNI
Comunicadora PAI
Responsable PAI Oruro
Presidente CNI
EDICIÓN:
Lic. Rosmery Azurduy
Lic. Teresa Bonifaz
Dra. Pamela Callisaya
Lic. Claudia Carrizales
Dra. Wendy Cepeda
Dr. Max Enríquez
Tec. Juaquín Gironda
Responsable PAI La Paz
Gestora de Calidad del PAI
Responsable de vigilancia PAI
Gestora Calidad del PAI
Gestora de calidad del PAI
Responsable PAI
Responsable nacional de logística
Manual Técnico del Programa Ampliado de Inmunización
Lic. Rosmery Azurduy
Sr. Enrique Borda
Lic. Teresa Bonifaz
Sr. Luis Chávez
Dra. Pamela Callisaya
Lic. Teresa Calderón
Lic. Claudia Carrizales
Dr. Boris Chang
Dr. David Choqueticlla
Dra. Wendy Cepeda
Dr. Carlos Echazú
Tec. Juaquín Gironda
Dr. Max Enríquez
Lic. Roxana Lima
Ing. Efraín Loza
Dr. Jhemys Molina
Lic. Mery Parada
Lic. Virginia Pérez
Lic. Mary Quintanilla
Dra. Rosario Quiroga
Lic. Gaby Quiroga
Lic. Eduardo Rivero
Lic. Wilma Rodríguez
Lic. Faviola Ticona
Lic. Eulalia Vedia
Dr. Victor Hugo Velasco
Lic. Paula Vera
Dra. Juana Vera
Dr. Adalid Zamora
411
Ing. Efraín Loza
Lic. Mary Quintanilla
Dra. Rosario Quiroga
Lic. Paula Vera
Dr. Adalid Zamora
Responsable de cadena de frío
Gestora de calidad del PAI
Consultora PAI OPS
Comunicadora PAI
Presidente CNI
COMITÉ NACIONAL DE INMUNIZACION:
Dra. Volga Iñiguez
Dr. Adalid Zamora
Dr. Jean Floru
Dra. María Eugenia Tejada
Dr. Víctor Hugo Velasco
Comité de Identidad Institucional y Publicaciones:
Dr. Álvaro Terrazas Peláez
Dra. Sdenka Maury Fernández
Dr. Juan Marcos Rodríguez Morales
Dra. Tania Huanca Uluri
Dra. Diana Noya Pérez
Lic. Rodrigo Omar Chipana Cortez
Dr. Dante David Ergueta Jiménez
Lic. Mariel Silvana Churruarrin Orozco
Dra. Miriam Nogales Rodríguez
Sr. Marcelo Martínez Quisbert
Dra. María del Carmen Del Carpio
Serie: Documentos Técnico Normativos
ACTUALIZACIÓN MAYO-JUNIO 2020:
412
Sr. Enrique Borda
Sr. Luis Chávez
Dra. Pamela Callisaya
Lic. Claudia Carrizales
Dr. Max Enríquez
Ing. Efraín Loza
Dr. Armando Mariaca
Lic. Mary Quintanilla
Dra. Rosario Quiroga
Lic. Eduardo Rivero
Dra. Susana Solano
Dr. Victor Hugo Velasco
Técnico de cadena de frío
Técnico cadena de frío
Responsable de vigilancia PAI
Supervisora nacional PAI
Coordinador del SNIS-VE
Responsable de cadena de frío
Consultor GAVI
Supervisora nacional PAI
Consultora PAI OPS
comunicador PAI
Responsable PAI
Vicepresidente CNI
VALIDACIÓN DE LOS MANUALES TÉCNICOS DEL PAI, REALIZADO EN LA CIUDAD DE LA PAZ, 3 Y 4 DE OCTUBRE 2013, POR:
Dr. Adolfo Zarate C.
Dra. Maritza Patzi Ch.
Dra. Elvira Chahua O.
Lic. Claudia Jhovana Carrizales
Resp. PAI Nacional
Resp. Vigilancia Centinela PAI Nacional
Supervisora PAI Nacional
Supervisora PAI Nacional
Resp. Logística PAI Nacional
Estadístico PAI Nacional
Técnico de Cadena de Frio PAI Nacional
Resp. Cadena de Frio
Responsable PAI Potosí
Supervisora PAI Potosí
Responsable PAI Chuquisaca
Supervisora PAI Chuquisaca
Resp. Logística PAI Chuquisaca
Responsable. PAI Tarija
Supervisora PAI Tarija
Responsable. PAI Pando
Responsable Logística PAI Pando
Responsable. PAI Oruro
Supervisora PAI Oruro
Ex responsable. PAI Cochabamba
Responsable Cadena de Frio PAI Cochabamba
Responsable. PAI Santa Cruz
Supervisora PAI Santa Cruz
Ex responsable. PAI Beni
Supervisor PAI Beni
Responsable PAI La Paz
Responsable PAI El Alto
Responsable de Vigilancia Epidemiológica PAI La Paz
Jefe de Unidad de Bioseguridad INLASA
Jefe de Unidad de Epidemiologia Caja Nacional de
Salud
Dr. Fernando Jurado
Jefe Nacional departamento medicina familiar y
Comunitaria - Caja Nacional de Salud
Dra. Rosario Quiroga
Dra. Desirée Pastor
Dr. Antonio Plaza
Dr. Erick Machicao
Lic. Dora López
Dra. Erika Franco
Dr. Percy Halkyer
Oficial de Salud UNICEF Bolivia
Consultora internacional PAI OPS Bolivia
Consultor PAI OPS Tarija
Consultor PAI-OPS La Paz
Profesional OPS
Profesional OPS
Consultor Nacional PAI OPS Bolivia
REVISIÓN REALIZADA EN LA CIUDAD DE SANTA CRUZ DEL 9 AL 12 DE OCTUBRE 2012 POR:
Dr. René Lenis
Dra. Pamela Guzmán
Dra. Maritza Patzi
Dra. Elvira Chahua
Manual Técnico del Programa Ampliado de Inmunización
Ing. Efraín Loza
Tec. Hernán Águila A
Tec. Luis Chávez G.
Tec. Enrique Borda T.
Dr. David Choqueticlla R.
Lic. Ema Fabiola Ticona T.
Lic. Wilma Rodríguez
Lic. Eulalia Vedia
Tec. Ramiro Valda
Lic. Martha Martínez
Lic. Ana Miranda
Lic. Roxana Lima
Tec. Osiel Zabala Tuesta
Dra. Juana Vera
Lic. Irene Choque
Lic. Gaby Quiroga Claros
Tec. Humberto Cadima
Dr. Fernando Gil Mendia
Lic. Patricia Menacho
Dra. Nirza Vargas Rodas
Lic. Anibal Gilagachi
Dra. María Eugenia Velasco
Lic. Vilda Pérez López
Tec. Juan Carlos Tapia
Dra. Shirley Aramayo
Dr. Kadir Ocaña
413
Lic. Dora López
Tec. Miguel Ángel Siles
Lic. Eulalia Vedia
Lic. Ana Miranda
Ing. Edgardo Pabón
Dra. Rosario Quiroga
Tec. Hernán Águila
Dra. Desireé Pastor
Tec. Luis Chávez
Lic. Nacira Vargas
Tec. Enrique Borda
Dr. Antonio Plaza
Lic. Wilma Rodríguez
Dra. Patricia Rosales
Dr. David Choqueticlla
Dra. Juana Vera
Lic. Fabiola Ticona
Lic. Roxana Lima
Dr. Fernando Gil Mendia
Lic. Anibal Gilacachi
Lic. Gaby Quiroga
Lic. Rosario Saucedo
Lic. Patricia Menacho
Tec. Osiel Zabala
Dra. María Eugenia Velasco
Lic. Irene Choque
Lic. Claudia Carrizales
Tec. Eliana Quintanilla
Tec. Ramiro Valda
Dra. Yelin Roca
Dra. Nirza Vargas Rodas
Dr. Kadir Ocaña
Tec. Juan Carlos Tapia
Dr. Erick Machicao
Tec. Humberto Cadima
Dr. Percy Halkyer
Lic. Vilda Pérez
Dr. Fernando Jurado
Dra. Shirley Aramayo
ELABORADO (PRIMERA EDICIÓN) POR:
Dr. David Choqueticlla Rodríguez
Dr. Fernando Gil Mendia
Serie: Documentos Técnico Normativos
Dr. Percy Halkyer Belaunde
414
Dr. Arturo Quiñones López
Dr. Erick Machicao Ballivián
Dra. Rosario Quiroga Morales
Bibliografía
1.
Abbas AK, Lichtman AH, Pillai S. Inmunologia Celular y Molecular + Student Consult. 7a ed.
Elsevier; 2014
2.
Ajjan N. La Vaccination: Manuel Pratique de Tous Les Vaccins. Barcelona, Spain: Elsevier
Masson; 2011.
3.
Barclay E. Is climate change affecting dengue in the Americas? Lancet [Internet].
2008;371(9617):973–4. Disponible en: http://dx.doi.org/10.1016/s0140-6736(08)60435-3
4.
Bartos A. Inmunizaciones. In: Aranda E, Diaz M, Tamayo L, Sandoval O, ed. by. Texto de la
Catedra de Pediatria. 3rd ed. La Paz: 2007; 2021. p. 173-176.
5.
Bellanti J, Escobar A, Mendez J. Immunology II. Philadelphia: W.B. Saunders; 1978.
6.
Benavente J, Madden C, Mendez J. Como mejorar la supervisión: un enfoque de equipo.
2021.
7.
Canadian Immunization Guide. 5a ed. Environment; 1998.
8.
Castiel LD, Vasconcellos Silva PR. Precariedades del Exceso - Informacion y Comunicacion
En Salud Colectiva. Lugar Editorial; 2005.
9.
Centers for Disease Control and Prevention. Epidemiology and Prevention of Vaccines
Preventable. Atlanta: CDC; 2018.
10. Chokshi D, Kesselheim A. Rethinking Global Access to Vaccines. BMJ; 2008.
11. Comite de Medicamentos de la Asociación Española de Pediatría. Pediamecum. Madrid:
2015; 2021.
13. COVID-19 resources and guidance [Internet]. Healthcluster.who.int. 2021. Available from:
https://healthcluster.who.int/resources/covid-19-resources-and-guidance
14. Di Tella T, Chumbita H, Gajardo P, Gamba S. Diccionario de ciencias sociales y políticas.
Buenos Aires: Ariel; 2004.
15. Ezeanolue E, Harriman K, Hunter P, Kroger A, Pellegrini C. General Best Practice Guidelines
for Immunization. Atlanta: ACIP; 2019.
16. General recommendations on immunization. Atlanta, Ga.: U.S. Dept. of Health and Human
Services, Public Health Service, Centers for Disease Control; 1986.
17. Gómez-Dantés H, Willoquet JR. Dengue in the Americas: challenges for prevention and
control. Cad Saude Publica [Internet]. 2009;25(suppl 1):S19–31. Disponible en: http://
dx.doi.org/10.1590/s0102-311x2009001300003
Manual Técnico del Programa Ampliado de Inmunización
12. Corretger R. vacunaciones en los niños con Síndrome de Down. [Internet]. Vacunasaep.
org. 2021. Available from: https://vacunasaep.org/profesionales/noticias/vacunacionessindrome-down
415
18. Guillain Barre Syndrome [Internet]. Dynamed.com. 2021 [cited 30 November 2018]. Available
from: https://www.dynamed.com/condition/guillain-barre-syndrome
19. Health A. The Australian immunisation handbook. Canberra: Dept. of Health and Ageing;
2018.
20. Heymann D. El control de las enfermedades transmisibles. Washington DC: OPS APHA;
2013.
21. Hii Y, Rocklöv J, Ng N, Tang C, Pang F, Sauerborn R. Climate variability and increase in intensity
and magnitude of dengue incidence in Singapore. Global Health Action. 2009;2(1):2036.
22. Ibañez J. El regreso del sujeto: la investigacion social del segundo orden. Madrid: Siglo XXI
de España editores; 1994.
23. Immunization in special clinical circumstances. En: Red Book (2021). American Academy of
Pediatrics; 2021. p. 67–105.
24. Instituto Nacional de Seguridad e Higiene del Trabajo. Directrices para la evaluacion de
riesgos y protección de la maternidad en el trabajo. Madrid: INSHT; 2011.
25. Instituto Nacional de Seguridad e Higiene del Trabajo. Directrices para la evaluacion de
riesgos y protección de la maternidad en el trabajo. Madrid: INSHT; 2011
26. Instituto Nacional de Seguridad e Higiene del Trabajo. Guia técnica para la evaluacion
y prevención de los riesgos relacionados con la exposición de los trabajadores al ruido.
Madrid: INSHT; 2018.
27. Instituto Nacional de Seguridad e Higiene del Trabajo. Guia técnica para la evaluación y
prevención de los riesgos relacionados con las vibraciones mecánicas. Madrid: INSHT;
2018.
28. Instituto Nacional deSeguridad e Higiene del Trabajo. Guia técnica para la evaluacion de la
exposición a amianto durante el trabajo. Madrid: INSHT; 2011.
Serie: Documentos Técnico Normativos
29. Kimberly D, Brady M, Jackson M, Long S. Active And Passive immunizationi. Red Book. 30th
ed. Grove Village: Report of the committe of the infectious Diseases; 2015.
416
30. MANUAL DE VACUNAS EN LÍNEA DE LA AEP | Comité Asesor de Vacunas de la AEP
[Internet]. Vacunasaep.org. 2021 [cited 26 Februry ]. Available from: https://vacunasaep.
org/documentos/manual/manual-de-vacunas
31. MANUAL DE VACUNAS EN LÍNEA DE LA AEP | Comité Asesor de Vacunas de la AEP
[Internet]. Vacunasaep.org. 2021 [cited 16 May 2020]. Available from: https://vacunasaep.
org/documentos/manual/manual-de-vacunas
32. Maturana H, Behncke C R. El árbol del conocimiento. Chile: Editorial Universitaria; 2006.
33. McMahon R, Barton E, Piot M. Administracion de la Atencion Primaria de Salud. Mexico:
Pax; 1989.
34. Ministerio de Salud de la Nación. Vacunación en Huéspedes Especiales. Buenos Aires:
2018; 2018.
35. Ministerio de Salud y Prevision Social. Programa Ampliado de Inmunizaciones Manual
Tecnico. La Paz: 2001; .
36. Ministerio de salud. Presidencia de la Nacion Republica Argentina. Vacunacion segura:
Cadena de Frío “manual de almacenamiento de las vacunas para el nivel operativo”. Buenos
Aires; .
37. Ministerio de Salud. supervision, monitoreo y Evaluación. Programa de fortalecimiento de
los servicios de salud. 2015.
38. Ministry of Health. Immunization Handbook. New Zeland: Ministry of Health; 2017.
39. Moraes I. Informações em saúde: da prática framentada ao exercício da cidadania. Sao
Paulo: Hucitec/ Rio de Janeiro; 1994.
40. Mota E, Carvalho D. Sistemas de informação em saúde. 6th ed. Rio de Janeiro: MEDSI; 2003.
41. OPS/OMS. Herramientas para la autoevaluación de la calidad de datos de inmunización..
World Health Organization.
42. OPS/OMS. Herramientas para la autoevaluación de la calidad de datos de inmunización..
World Health Organization.
43. OPS/OMS. Resolucion CD25.R27.Consejo Directivo. World Health Organization. 1977
44. Organizacion Panamericana de la Salud, 2012. Metodología para la evaluación internacional
del Programa Ampliado de Inmunización. Washington, D.C: OMS.
45. Organización Panamericana de la Salud. (2021). Guía para elaborar un plan nacional de
despliegue y vacunación para las vacunas contra la COVID-19. Orientación provisional. 1
de junio del 2021.Washington, D.C.
46. Organización Panamericana de la Salud. Guía Práctica: Introducción de la vacuna inactivada
contra la poliomielitis (IPV). Washington, DC : OPS, 2014.
48. Organización Panamericana de la Salud. Lessons Learned From The Introduction Of The
Pneumococcal Conjugate Vaccine (Pcv) In Latin America And The Caribbean. Buenos Aires:
OPS; 2021.
49. Programa Ampliado de Inmunizacion. Como aprovechar todas las opotunidades de
vacunación. La paz: Ministerio De Salud Y Prevision Social; 1993.
50. Programa Ampliado de Inmunizacion. Guia Tecnica Para La Vigilancia Epidemiologica Del
Sarampión. La paz: Ministerio De Salud Y Prevision Social; 1993.
51. Programa Ampliado de Inmunizacion. Manual del PAI para trabajadores de salud. La paz:
Ministerio De Salud Y Prevision Social; 1993.
52. Programa Ampliado de Inmunizacion. Modulo de Cadena de frio. Manual Técnico. 6th ed.
La Paz: Ministerio de Salud y Deportes; 2004. p. 180-231.
Manual Técnico del Programa Ampliado de Inmunización
47. Organización Panamericana de la Salud. Herramienta de evaluación de la preparación para
los países con vacuna contra la COVID-19 (VIRAT).
417
53. Programa Ampliado de Inmunizacion. Recomendaciónes para la vacunacion de pacientes
con necesidades especiales por patologias o situaciones de riesgos. Santiago de Chile:
Ministerio De Salud de Chile; 2018.
54. Programa Ampliado de Inmunizacion. Vigilancia Epidemiologica en el PAI. La paz: Ministerio
De Salud Y Prevision Social; 1993.
55. Public Health England. The green book Immunization against Infectious Disease. London:
Public Health England; 2019.
56. Public Health England. The green book Immunization against Infectious Disease
Immunizations of individuals with underlying medical condition. London: Public Health
England; 2019.
57. Rosanvallon P. La nueva cuestion social. Buenos Aires: Ediciones Manantial; 1995.
58. Smith G. Devolpment of Rapid Epidemiologic Assessment methods to evaluate health
Status and Delivery Health Services. London; 2011.
59. Sole Gomez D. Embarazo, lactancia y trabajo: promoción de la salud. Notas tecnicas de
Previsión.
60. Tacker s. Principles of Public Health Surveillance: Historical Development. Epidemiology
Rev. 1988;10:164-190.
61. The Australian immunisation handbook. Canberra: Dept. of Health and Ageing; 2013.
62. The longest mile in the COVID-19 vaccine cold chain [Internet]. SciDev.Net. 2021. Available
from: https://www.scidev.net/global/features/the-longest-mile-in-the-covid-19-vaccinecold-chain/
63. Von Bertalanffy L. Teoria General de Los Sistemas: Fundamentos, Desarrollo, Aplicaciones.
Fondo de Cultura Economica; 2006.
Serie: Documentos Técnico Normativos
64. Vriesendorp F. Guillain-Barré syndrome in adults: Treatment and prognosis [Internet].
Uptodate.com. 2021 [cited 16 December 2021]. Available from: https://www.uptodate.
com/contents/guillain-barre-syndrome-in-adults-treatment-and-prognosis?_escaped_
fragment_=
418
65. Wolff JA, Miller J. Estrategias Gerenciales Para Mejorar Los Servicios de Planificacion
Familiar: Un Compendio de Actualidad Gerencial En Planificacion Familiar. Wulf D, editor.
Management Sciences for Health; 1997.
66. World Health Organization, UNAIDS. Vacunas E Inmunizacion: Situacion Mundial. 2009. 3a
ed. World Health Organization; 2010.
67. World Health Organization. 2 the Vaccine Cold Chain. W. H. Organization, Inmunization in
Practice A Practical guide for health staff. Ginebra: WHO Library Cataloguing-in-Publication
Data. XII 2015.
68. World Health Organization. Estadisticas Sanitarias Mundiales 2012. World Health
Organization; 2014.
69. World Health Organization. Evaluation of National Diarrheal Diseases Control Programmes.
Genova.1984.
70. World Health Organization. Vaccination Coverage Cluster Surveys: Reference Manual.
Genova: WHO; 2018.
71. Wormser GP, Faix RG. Red book: 2006 report of the committee on infectious diseases, 27th
edition edited by Larry K. pickering, carol F. baker, Sarah S. long, and Julia A. mcmillan Elk
Grove Village, IL: American academy of pediatrics, 2006. 992 pp. $124.95 (cloth). Clin Infect
Dis [Internet]. 2007;44(6):892–892. Disponible en: http://dx.doi.org/10.1093/cid/44.6.892
72. Wu P, Lay J, Guo H, Lin C, Lung S, Su H. Higher temperature and urbanization affect the
spatial patterns of dengue fever transmission in subtropical Taiwan. Science of The Total
Environment. 2009;407(7):2224-2233.
Manual Técnico del Programa Ampliado de Inmunización
419