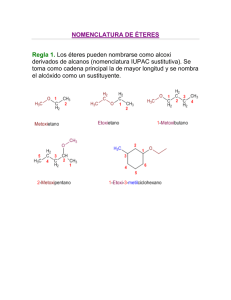
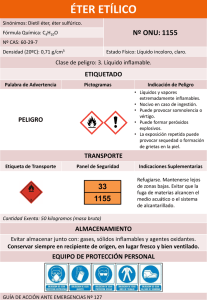
Eteres. Química orgánica Actividad 7. R–O–R Ruptura acida R – X + R – OH Exceso de acidos R–X A) Ruptura acida • • • • • Los éteres son muy inertes, es decir, no reaccionan con facilidad. Se utilizan acidos provenientes de halógenos quedando la reactividad de la siguiente manera. HI HBr HCl Los éteres alquilicos primarios y secundarios reaccionan por una ruta Sn2 en el cual el ion yoduro o bromuro ataca al éter protonado en el sitio menos sustituido. Los éteres terciarios, bencilico y alílicos tienden a romperse a través de un mecanismo Sn1 o E1, por la facilidad de formar carbocationes estables. Al agregar un exceso de estos ácidos se obtienen derivados halogenados exclusivamente. Ejercicios. 1. ¿Cuáles son los productos esperados al reaccionar los siguientes éteres con HI, sin agregar un exceso de este? a) éter secbutil metilico b) éter butilpentilico c) éter etil fenilico d) éter etil isopropilico e) éter etil ciclohexilico f) Anisol g) 1 – metil tetrahidrofurano 2. ¿Cuáles serian los productos esperados si a los anteriores éteres se hacen reaccionar con un exceso de HBr? 3. Se dejo reaccionar una serie de éteres con HBr en exceso y se obtuvieron los siguientes resultados, identifique el éter en cada caso. a) Un éter produjo una mezcla de bromociclopentano y 1 – bromobutano. Eteres. Química orgánica b) Otro éter solo produjo bromuro de bencilo c) Un tercer éter produjo un mol de 1, 5 – dibromopentano por mol de éter. d) El ultimo éter produjo iodometano y 2 - iodosecbutano