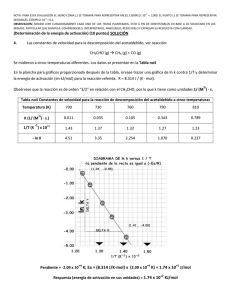
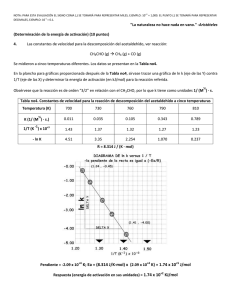
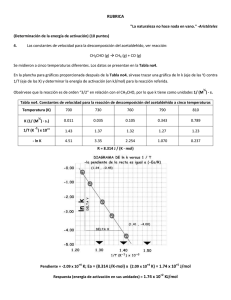
Carrera de Biología Fisicoquímica II Tercera Unidad 1. Diferencia entre molecularidad y orden de reacción. 2. Expresión de la velocidad de la reacción y de la ley de velocidad de reacción. 3. Constante de velocidad de una reacción química, unidades dependiendo del orden de reacción 4. Obtención del orden de reacción de acuerdo a los siguientes métodos: leyes de velocidad integrada, tiempo de vida media y velocidades iniciales. 5. Ecuación de Arrhenius y cómo calcular sus parámetros. 6. Factores que afectan la velocidad de reacción. 7. Efecto de la temperatura sobre la constante de velocidad. I. Resuelve los siguientes ejercicios. 1. En un estudio de la reacción de la piridina con el yoduro de etilo C5H5N + C2H5I = C7H10N+ + I─ las concentraciones iniciales de ambos reactivos eran 0.10 mol dm-3. Siguiendo la cinética de reacción se obtuvieron los siguientes valores. Tiempo/s [C5H5N]/mol dm-3 0 230 465 720 1040 1440 1920 2370 0.100 0.085 0.074 0.065 0.056 0.048 0.041 0.036 Determine el orden de reacción y la constante de velocidad. 2. Cierto investigador determinó la ley de velocidad: V=Kv[A]2 para una reacción química simple. Si la ley fue de 2.44 x 10 -4 M/s cuando [A] era de 0.167 M, ¿Cuál sería la [A] cuando la velocidad de la reacción corresponda a 1.55 X 10-6 M/s? 3. A 25 °C el período de vida media para la descomposición de N 2O5 es de 5.7 horas (primer orden), calcular el tiempo necesario para que se consuma el 90%. 4. Demostrar gráficamente que la descomposición del peróxido de hidrógeno en solución acuosa de ioduro de potasio es una reacción de primer orden tiempo (min) X (vol. de gas producido) 0 5 10 25 45 infinito 0 7.50 14.0 28.80 41.20 57.90 5. El ciclobutano se descompone a etileno, de acuerdo con la reacción C4H8(g) ----------> 2C2H4(g) 1 Determine el orden de reacción y la constante de velocidad basándose en las siguientes presiones que se registraron cuando se realizó la reacción a 430 °C en un recipiente de volumen constante. tiempo (min) P (mmHg) 0 2000 4000 6000 8000 10000 400 316 248 196 155 122 6. Uno de los riesgos de las explosiones nucleares es la generación de 90Sr y su posterior incorporación en los huesos reemplazando al calcio. Este núcleo tiene una vida media de 28.1 años. Suponiendo que un recién nacido absorbe 1 μg, qué cantidad permanecerá después de: a) 18 años; b) 70 años, si no se pierde nada metabólicamente del compuesto 7. Se midieron a diferentes temperaturas las constantes de velocidad de la descomposición de primer orden de un compuesto orgánico en solución. Kv (s-1) T (°C) 4.92 x 103 5.0 0.0216 0.0950 0.326 1.15 15 25 35 45 Determine gráficamente el factor pre-exponencial y la energía de activación de la reacción. 8. Para la reacción A -------> B, se obtuvieron los siguientes datos cuando se estudio su cinética llevada a diferentes temperaturas. t (min) 0 15 30 45 60 75 90 25 °C 0.750 0.648 0.562 0.514 0.460 0.414 0.385 30 °C 0.750 0.622 0.530 0.467 0.410 0.378 0.336 35 °C 0.750 0.590 0.490 0.410 0.365 0.315 0.290 40 °C 0.750 0.556 0.440 0.365 0.315 0.275 0.243 45 °C 0.750 0.520 0.400 0.324 0.270 0.235 0.205 a) Utilizando un set de datos determinar de manera gráfica el orden de la reacción. b) Después de determinar la correcta ley de velocidad, obtener la constante de velocidad a cada temperatura. c) Una vez determinadas las constantes a diferentes temperaturas, determinar la energía de activación y el factor pre-exponencial (factor de frecuencia). 9. La constante de velocidad de una reacción de primer orden es de 4.60 x 10 -4s-1 a 350 °C. Si la energía de activación es de 104 KJ/mol, calcule la temperatura a la que la constante será de 8.80 x 10-4s-1. 10. Para la descomposición térmica del etano se obtuvieron las siguientes constantes de velocidad Kv. 2 Kv 105 s-1 TK 2.5 4.7 8.2 12.3 23.1 35.3 57.6 92.4 141.5 823 833 843 853 863 873 883 893 903 A partir de estos valores determínese la energía de activación y el factor preexponencial para esa descomposición. 11. Con los siguientes datos de la descomposición del peróxido de hidrógeno, calcula la velocidad de la reacción y la constante de velocidad. Tiempo 0 2 5 10 20 (min) [H2O2] M 2.50 2.12 1.82 1.48 1.00 12. A partir de los siguientes datos, determinar la ley de velocidad, así como la constante para la reacción del monóxido de nitrógeno y el cloro. [NO] [Cl2] Velocidad inicial (mol/L min) 0.50 0.5 1.90 X10-2 1.00 0.50 7.60 X 10-2 1.00 1.00 15.2 X 10-2 13. Utiliza los siguientes datos para determinar la ley de velocidad y las constantes de velocidad. [ClO2] [OH-] Velocidad inicial (mol/L min) 0.0500 0.200 6.9 0.100 0.200 27.6 0.100 0.100 13.8 14. La vida media de la descomposición radiactiva del 14C es de 5730 años. Una muestra arqueológica contiene madera que sólo tiene el 72% del 14C encontrado en los árboles vivos. ¿Cuál es la edad aproximada de la muestra? 15. En un experimento se determino que la concentración N 2O5 en bromo líquido variaba con el tiempo según: t/s 0 200 400 600 1000 [N2O5]/mol-1 0.110 0.073 0.048 0.032 0.014 Determine el orden de la reacción, así como la constante de velocidad y la concentración cuan se han alcanzado los 500 s. 16. Los valores de absorbancia (D.O.) obtenidos en la isomerización del cloruro de bisetilendiaminodiclorocobalto a 540 nm fueron: Abs 0.119 0.108 0.096 0.081 0.071 t/min 0 20 47 80 107 Determinar el orden de la reacción y el tiempo de vida media. 0.060 140 0.005 ∞ 17. Para la reacción de A → P, se obtuvieron los siguientes datos. 3 tiempo/h [A]/M 0 1.24 1 0.960 2 0.775 3 0.655 4 0.560 5 0.502 a) Realizar las gráficas correspondientes para determinar el orden de la ley de velocidad. b) Determinar la constante de velocidad para la reacción. c) Utilizando la ley de velocidad que acaba de determinar, calcule el tiempo de vida media para la reacción. d) ¿En qué tiempo la concentración de A será 0.380 M? 4