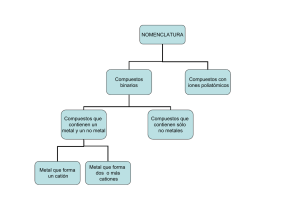
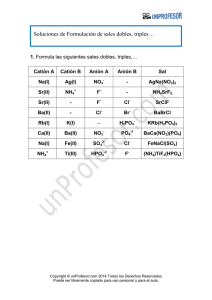
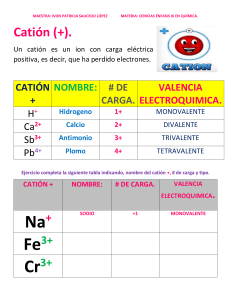
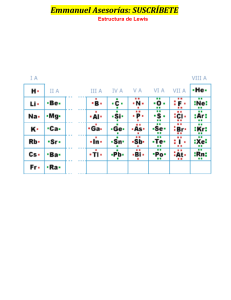
Consulta Regla de Fanjas Las reglas de Fajans se pueden resumir en tres puntos: • Regla 1: cuánto más polarizarle es el catión, mayor carácter covalente tendrá el enlace. El carácter polarizante de un catión aumenta al aumentar su relación carga/radio, q/r. • Regla 2: cuánto más polarizarle es el anión, mayor carácter covalente tendrá el enlace. La polarizabilidad del anión aumenta al aumentar el radio y la carga. En el caso de los halógenos la polarizabilidad crece en el siguiente orden: F < Cl < Br < I. • Regla 3: la polarización del enlace y por lo tanto su carácter covalente, aumenta cuando la configuración electrónica del catión no es la de un gas noble. Esto se da en los metales de transición y en las tierras raras (lantánidos y actínidos) debido a que sus orbitales d y f se extienden lejos del núcleo y por ello son fáciles de polarizar al ser menos atraídos por el núcleo. Por ejemplo el cloruro sódico tiene un catión (Na+) con carga de (+1) y un tamaño relativamente grande de en torno a 1 Å y un anión (Cl-) relativamente pequeño (para ser anión) de 2 Å y por lo tanto el enlace es iónico. Contrariamente el ioduro de aluminio (AlI3) tiene un catión trivalente (+3) muy polarizante y un anión muy grande (y por lo tanto polarizable) por lo que su enlace tiene carácter covalente. Bibliografías • Fajans, K. Teoría cuanticular del enlace químico. Rev. Soc. Química México, 7(1): 6-28, 1963. • Holmen, R.E. y W.B. Lake. Kasimir Fajans (1887-1975). «The man and his work». Bull. Hist. Chem. 6, 1990