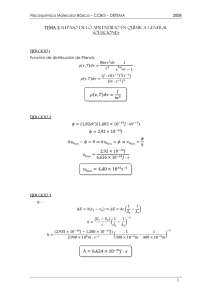
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE INGENIERÍA QUÍMICA CARRERA DE INGENIERÍA QUÍMICA LABORATORIO DE FISICOQUÍMICA TEMA: GASES REALES PROFESORA: Ing. Ivonne Carrillo AYUDANTE DE CÁTEDRA: Mayté Torres ESTUDIANTES: Chicaiza Cynthia Caza Liseth Morillo Henry Quishpe Marlon Sarango Katia Tapia Milena Quito – Ecuador UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE INGENIERÍA QUÍMICA LABORATORIO DE FISICOQUÍMICA Practica N° 4 GASES REALES 1. OBJETIVOS 1.1.Reconocer la funcionalidad de cada ecuación y su aplicación. 1.2.Determinar el factor de compresibilidad de un gas por medio de las distintas variables de estado del sistema empleado para encontrar su valor 2. PROCEDIMIENTO 2.1.Realizar los siguientes ejercicios en ESS (Adjuntar la resolución en ees mediante capturas de pantalla) 2.1.1. Mediante la ecuación de Van der Wals calcule el volumen que ocupa 5 moles de Nitrogeno a una presión de 2 atm y una temperatura de 300 K. UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE INGENIERÍA QUÍMICA LABORATORIO DE FISICOQUÍMICA 2.1.2. Determinar por el método de Redlich-Kwong, el valor del volumen de un gas propano que se encuentra a una temperatura de 300 K y 5atm , para 6.5 moles del gas. UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE INGENIERÍA QUÍMICA LABORATORIO DE FISICOQUÍMICA 2.1.3. Por el metodo de peng-Robinson determinar el valor de las moles para un gas metano a T=600 K , presión de 60 atm , volumen de 450 ml. UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE INGENIERÍA QUÍMICA LABORATORIO DE FISICOQUÍMICA 3. RESULTADOS Tabla 1. Ejercicio 1. Método de Vander Walls α 1,348 [ 𝑎𝑡𝑛 ∗ 𝐿 ] 𝑚𝑜𝑙 2 PC 3396[𝑘𝑃𝑎] TC 126.2[𝑘 ] b 0.03859 [ 𝐿 ] 𝑚𝑜𝑙 PT 33.51[𝑎𝑡𝑚] V 61.42[𝐿] Vm 12.28 [ 𝐿 ] 𝑚𝑜𝑙 Fuente: Grupo 5 Tabla 2. Ejercicio 2. Método de Redlich-Kwong a1 b1 [𝑱𝟐 /𝒎𝒐𝒍𝟐 𝑷𝒂] [𝑱/𝒎𝒐𝒍 𝑷𝒂] 18,3 0,00006277 n [mol] Z 6,5 PC [Pa] 4,247 ∗ 1006 A B 0,08604 V 0,01275 0,9156 0,02941 TC R [K] [J/mol K] 369,8 8,314 Fuente: Grupo 5 P [Pa] 506625 Vm [𝑱/𝒎𝒐𝒍 𝑷𝒂] 0,004525 T [K] 300 UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE INGENIERÍA QUÍMICA LABORATORIO DE FISICOQUÍMICA Tabla 3. Ejercicio 3. Peng-Robinson Tr ω m α ΩPR 𝒌𝑱𝟐 [ ] 𝒌𝒎𝒐𝒍𝟐 ∗ 𝑷𝒂 3.149 0.001141 0.392 0.485 0.2496 b1 𝒌𝑱 [ ] 𝒌𝒎𝒐𝒍 ∗ 𝑷𝒂 at A B Vm 𝒌𝑱 [ ] 𝒌𝒎𝒐𝒍 ∗ 𝑷𝒂 0.0000268 0.121 0.02957 0.02957 0.0008254 n [𝒎𝒐𝒍] Z PC [𝑩𝒂𝒓] TC [𝑲] P1 [𝑷𝒂] 0.5452 1.012 4.599*106 190.6 6.08*106 Fuente: Grupo 5 4. CUESTIOARIO 4.1. Utilizando la ecuacion de Beatlie Briggenman determinar el valor de la presión para el gas etano que se encuentra a una temperatura de 550K, si el volumen es de 2.3 litros/mol. UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE INGENIERÍA QUÍMICA LABORATORIO DE FISICOQUÍMICA Escriba los siguientes valores: A=-1,48*10^6 B=-0,6887 C=900000 P=2,812*10^11 4.2. Calcule lo siguientes considerando gases reales: A) El volumen ocupado por 18 kg de etileno a 55 °C y 35 bar R= el volumen que ocupa es de 0,4483 m ^3 B) La masa del etileno contenida en un cilindro de 0.25 m^3 a 50 °C y 115 bar UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE INGENIERÍA QUÍMICA LABORATORIO DE FISICOQUÍMICA R= la masa contenida es de 60,9 kg 5. CONCLUSIONES 5.1.Se puede concluir de acuerdo a la práctica realizada, que la determinación de el factor de compresibilidad de un gas no es una constante ya que por medio de las distintas variables de estado del sistema empleado para encontrar su valor los mismo que varían con los cambios en la composición del gas, la presión y la temperatura. 5.2.Se determinó en la practica el valor de las moles de metano a través de los cálculos realizados en el programa EES, utilizando las variables propuestas en el ejercicio, así como otros valores obtenidos en el programa. 5.3. Se determinó en la practica el valor de las moles de Nitrógeno a través de los cálculos realizados en el programa EES que igual manera nos ayuda a sacar UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE INGENIERÍA QUÍMICA LABORATORIO DE FISICOQUÍMICA valores más acertados, se podría confirmar que no hay errores sistemáticos, utilizando los valores y los requisitos que pide el ejercicio en su enunciado, así como otros valores obtenidos en el programa. 5.4. Se obtuvo que para cada fluido existe un punto crítico característico, así como condiciones de presión y temperatura en la que los gases se comportan como fluidos supercríticos, además de coeficientes que hablan sobre las interacciones moleculares que existen entre las moléculas de un determinado fluido. 6. BIBLIOGRAFÍA Laboratorio de fisicoquímica, 2021. Grupo 9. EES, 2021. UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE INGENIERÍA QUÍMICA LABORATORIO DE FISICOQUÍMICA 7. ANEXOS 7.1.Ejercicio en clase 1 RESULTADOS UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE INGENIERÍA QUÍMICA LABORATORIO DE FISICOQUÍMICA 7.2. Ejercicio en clase 2 RESULTADOS UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE INGENIERÍA QUÍMICA LABORATORIO DE FISICOQUÍMICA 7.3. Ejercicio en clase 3 RESULTADOS