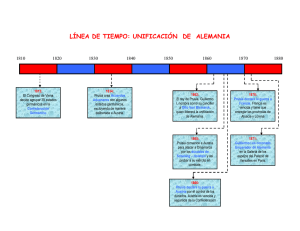
Laboratorio de Química del Estado Sólido SÍNTESIS DEL AZUL DE PRUSIA OBJETIVO Sintetizar el azul de Prusia, un complejo con propiedades magnéticas y aplicaciones tecnológicas potenciales. INTRODUCCIÓN Históricamente, los “azules de hierro” se conocen como azul de Prusia “soluble” (ferrocianuro férrico) y azul de Turnbull “insoluble” (ferricianuro ferroso); sin embargo, todos los estudios recientes concluyen que ambos son idénticos. La formación de este pigmento se puede escribir como 4 Feac3+ + 3 Fe(CN)64- Æ Azul de Prusia, Fe4[Fe(CN)6]3.xH2O (x = 14-16) Su muy baja solubilidad evidencia la naturaleza polimérica del producto sólido. La difracción de rayos-X indica que forma una red cúbica. Debido al cociente 4:3 de Fe(III) y Fe(II), 25% de los sitios de Fe(II) están vacantes. La ocurrencia de más de un estado de oxidación del mismo elemento en un compuesto particular se define como mezcla de valencia. Debido a la deslocalización parcial de los electrones de valencia el azul de Prusia es un semiconductor. La interacción entre los iones Fe(II) y Fe(III) se refleja en sus propiedades magnéticas. Debajo de 5.5 K el azul de Prusia se vuelve un ferromagneto. Dependiendo de las propiedades deseadas en el producto, se conocen muchas rutas de preparación. La preparación de una muestra cristalina puede tardar aproximadamente 10 semanas. Una ruta mucho más expedita conduce a la obtención de una suspensión coloidal. El azul de Prusia tiene muchas aplicaciones prácticas, siendo la más importante su uso como pigmento de bajo costo. En los años 1960’s en EE.UU. se producían ca. de 5,000 toneladas al año. Debido a la naturaleza porosa de su estructura tiene un carácter zeolítico que le permite almacenar moléculas pequeñas en sus cavidades, por ejemplo, puede atrapar cationes tóxicos como el talio(I) (hexacoordinado) que tiene un radio de 164 pm, y puede penetrar la Síntesis del Azul de Prusia Laboratorio de Química del Estado Sólido red del azul de Prusia de ca. de 152 pm de radio y quedar atrapado y posteriormente excretado por el organismo en caso de haber sido ingerido. El azul de Prusia no es tóxico, ni reactivo y no tiene sabor, por lo que puede ser ingerido en cantidades de gramos sin efectos dañinos. Desde que ocurrió el accidente nuclear en Chernobyl en 1986 que emitió una nube de Cs137 radioactivo se ha usado el azul de Prusia proporcionándoselo al ganado vacuno y ovino. La FDA (Agencia Federal de Drogas) de EE.UU. aprobó el año pasado el uso del azul de Prusia como un antídoto seguro contra la contaminación en humanos causado por Cs137. PROCEDIMIENTO EXPERIMENTAL Se mezclan con agitación 0.05 moles de K4Fe(CN)6 con 0.0125 moles de FeCl3 anhidro hasta que la mezcla sea homogénea. Se vacía lentamente la mezcla en un recipiente con 400 mL de agua agitada vigorosamente. El azul de Prusia soluble se forma de inmediato. La solución arriba del sol se decanta con una pipeta y el sol se centrifuga. El azul de Prusia centrifugado se lava repetidamente con etanol al 50% centrifugando en cada caso, el decantado cambia de color con cada lavado de amarillo a amarillo-verdoso a verde a azulverdoso a azul turbio. Estos cambios de color representan la remoción de las impurezas de iones ferrocianuro y férrico. Se supone que la aparición de un color azul turbio indica que los lavados se han completado. La muestra se lava con etanol absoluto, se seca con aire, se muele hasta un polvo fino y secado al vacío durante 24 hrs. La muestra puede ser caracterizada vía su espectro IR (400-4,000 cm-1), IR lejano (200-400 cm-1), por medición de la susceptibilidad magnética, por el patrón de difracción de rayos-X en polvo y análisis elemental. REFERENCIAS 1. A. Ludi, J. Chem. Ed., 58(12):1013 (1981). 2. Chem. & Eng. News, Mayo 2, p.32 (2005). 3. M. Ware, J. Chem. Ed., 85(5):612 (2008). Síntesis del Azul de Prusia