pdf-analisis-de-la-primera-y-segunda-ley-de-la-termodinamica-en-sistemas-reactivospdf compress
Anuncio

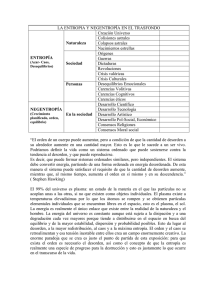
Análisis de la primera ley de la termodinámica en sistemas reactivos. En el estudio del proceso de combustión, determinar la concentración de las especies en la medida que el proceso se desarrolla, permite evaluar en una forma más precisa la evolución de las propiedades termodinámicas del fluido de trabajo. El empleo de la Primera Ley de la Termodinámica en sistemas donde las reacciones químicas son importantes permite calcular la cantidad de energía que se libera en el proceso. A partir de estos resultados se puede determinar las variables más importantes que caracterizan los procesos de combustión que ocurren en los motores de vehículos; por ejemplo, se puede calcular: la potencia producida, la cantidad de calor desprendido conocidas las temperaturas de inicio y fin del proceso, el poder calorífico desprendido por una mezcla combustible-aire, la máxima temperatura que se puede obtener en el ciclo de trabajo bajo condiciones dadas de presión, temperatura y relación combustible-aire, el efecto de la dilución con gases residuales sobre la máxima temperatura del proceso, etc. La aplicación de la Primera Ley de la Termodinámica en un determinado proceso de combustión solo requiere tener un modelo que permita determinar la composición de las especies en función de la temperatura y riqueza de la mezcla; sin embargo, la composición no permite obtener información detallada sobre las características de desarrollo del fenómeno de combustión, tales como: velocidad de propagación de la llama, efectos de turbulencia, formación de compuestos intermedios. Los procesos de combustión en la práctica son muy complicados; por esta razón las características de las reacciones químicas involucradas son solo conocidas para casos de combustibles simples. Para combustibles con estructuras más complejas el camino real a través del cual tienen lugar las transformaciones químicas no está completamente determinado. Sin embargo, para relacionar los estados inicial y final de las mezclas que participan en el proceso de combustión se puede emplear la Primera Ley de la Termodinámica en vista de que su aplicación no requiere que los detalles de los procesos sean conocidos. La Primera Ley de la Termodinámica relaciona los cambios de energía interna o entalpía con el calor y el trabajo transferido. Para un sistema con masa, m, como el mostrado en la figura, donde se considera que están ocurriendo cambios en la composición de los reactantes a productos, la aplicación de la Primera Ley entre los estados inicial y final queda indicada por la siguiente ecuación: Por convención se considera que el calor transferido al sistema y el trabajo realizado por el mismo son positivos. En forma general se pueden analizar dos tipos de procesos de combustión: a volumen constante y a presión constante. Análisis de la segunda ley de sistemas reactivos. La segunda ley establece que en el curso de las conversiones energéticas, la energía de un sistema en el estado final siempre será menor que la del mismo sistema en el estado inicial. La energía que se libera como calor en una conversión (reacción química, por ejemplo), no se ha destruido como tal, se ha transformado, pero, para ese sistema particular, la energía que cedió al Universo, deja de estar disponible para realizar trabajo. Para entender esta Ley hay que ubicarse en el sistema que transforma energía. Considere cada sistema que transforma energía como si fuese una cajita chiquita (con tapa perforada) dentro de la gran caja hermética (en cuanto a la energía) que sería el Universo. Lo que escapa de las cajitas, se pierde para ellas, pero queda en la gran caja. Sobre esto versa la segunda Ley, que dice que, en todos los intercambios y conversiones de energía, si no entra ni sale energía del sistema que se estudia, la energía potencial del estado final (la que hay en los productos) es siempre menor a la que había en el estado inicial (en los reactivos). Este enunciado no contradice la primera Ley. Vamos a enunciar la segunda Ley de otra manera Todos los procesos tienden a desarrollarse en una dirección tal que el desorden o el estado aleatorio del sistema aumenta. Detengámonos en un ejemplo. Si tenemos un montón de naranjas y las volcamos en un cajón de madera, no van a quedar en fila, prolijamente dispuestas, tendremos un “revoltijo” de naranjas. Esto ocurre espontáneamente. Si querernos ordenarlas tendremos que gastar energía de alguna manera, y disponerlas de modo tal que una sostenga a otra y el orden se mantenga. Tendremos que hacer un esfuerzo para establecer un orden. La tendencia natural es al desorden. Hay una forma de denominar a ese desorden. A la “medida” del desorden (es necesario abstraerse una vez más) se la llama entropía. Todo sistema cerrado, que no intercambie materia y energía con el entorno, tiende hacia un estado de máximo desorden. Para mantener la organización de la cual depende la vida (sistemas abiertos), los sistemas vivos deben tener un suministro constante de energía que les permita superar la tendencia hacia el desorden creciente. El Sol es la fuente original de esta energía. Pensemos en nosotros mismos, mantenemos nuestra organización gracias al alimento que ingerimos. Ingerir alimento significa “desorgani “desorganizar” zar” las estructu estructuras ras materiales que constituyen, por ejemplo, una manzana para que podamos aprovechar la materia y la energía que ésta nos proporciona. El orden que nos caracteriza como seres vivos tiene como costo el desorden del entorno. Las transformaciones energéticas en las células vivas implican el movimiento de electrones de un nivel energético a otro y, frecuentemente, de un átomo o molécula a otro. Entropía Todo se destruye, todo se enfría, todo se desordena. Ésta es la dirección en la que, espontáneamente, todo transcurre en el Universo. Sin embargo, sabemos que es posible construir un edificio, calentar un café, incluso ordenar una habitación. Pero, para hacerlo, debe consumirse energía, a fin de poder ir en contra de aquella tendencia natural hacia el desorden y la uniformidad, la cual es conocida como aumento de la entropía del Universo. Los seres vivos son las estructuras más exquisitamente exquisitamente complejas de todas las que existen en el Universo. ¿Cómo logran mantener ese orden tan sofisticado, esa compleja organización?, ¿cómo puede desarrollarse todo un individuo a partir de una única célula? ¿Cómo todo esto es posible si la tendencia natural es al desorden, al caos? Veamos. Esta analogía nos será muy útil. Un acondicionador de aire impide el calentamiento espontáneo espontáneo de las habitaciones debido al intenso calor externo, se opone al aumento de la entropía. Lo logra porque consume energía eléctrica. Pero, con el uso continuo, sus mecanismos se van deteriorando y, cuando alguno falla, ya no puede ir en contra de la entropía y la habitación se calentará, alcanzando el equilibrio térmico. Finalmente, la entropía aumentó. Un ser vivo, también se opone al aumento de la entropía, al menos por un determinado tiempo. Desde el momento de la concepción, un ser vivo se va construyendo a partir de nuevas estructuras, adquiriendo una organización funcional cada vez más compleja. También, como el acondicionador de aire, ocurrirá que alguna vez algo fallará, y entonces la destrucción de toda esa sofisticada organización se alcanzará inexorablemente. Para poder ir en contra de la entropía, el ser vivo requirió, evidentemente, de energía, que obtuvo de los enlaces químicos de las sustancias orgánicas. Esto implica que la sustancia debe ser degradada para que libere energía de sus enlaces. Esa energía debe utilizarse lo más eficientemente posible para funcionar, para construir moléculas propias; incluso, el sobrante debe almacenarse por si llegara a hacer falta. Todo esto requiere de un sofisticado conjunto de reacciones físico- químicas interconectadas unas con otras, denominado metabolismo. El metabolismo tiene por finalidad permitir que los organismos vivos luchen en contra del aumento de entropía, desarrollándose, creciendo y reproduciéndose. En la comprensión del funcionamiento del programa genético, se halla una de las claves para entender cómo es posible el orden que caracteriza a los seres vivos. El programa genético contenido en el ADN, es una cuña contra el desorden.