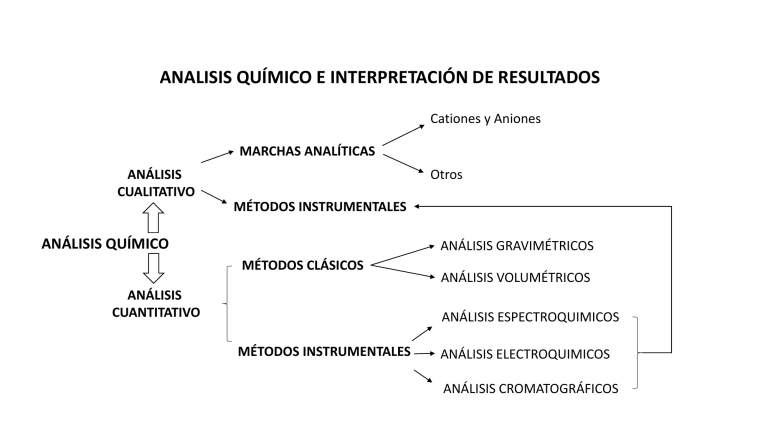
ANALISIS QUÍMICO E INTERPRETACIÓN DE RESULTADOS
Cationes y Aniones
MARCHAS ANALÍTICAS
ANÁLISIS
CUALITATIVO
Otros
MÉTODOS INSTRUMENTALES
ANÁLISIS QUÍMICO
ANÁLISIS GRAVIMÉTRICOS
MÉTODOS CLÁSICOS
ANÁLISIS
CUANTITATIVO
ANÁLISIS VOLUMÉTRICOS
ANÁLISIS ESPECTROQUIMICOS
MÉTODOS INSTRUMENTALES
ANÁLISIS ELECTROQUIMICOS
ANÁLISIS CROMATOGRÁFICOS
ANÁLISIS CUALITATIVOS
ANÁLISIS CUANTITATIVOS
MÉTODO GRAVIMÉTRICO
1. Una muestra de 0.6025 g de una sal de cloro se disolvió en agua y
el cloruro se precipitó adicionando un exceso de nitrato de plata.
El precipitado de cloruro de plata AgCl(s) se filtró, se lavó, se secó
y se pesó, obteniéndose 0.7134 g. Calcule el porcentaje de cloro Cl
en la muestra.
2. El calcio de una muestra de 0.7554 g de piedra caliza, previamente
disuelta, fue precipitado como oxalato y, posteriormente calentado
hasta su transformación en carbonato cálcico. El peso de este
compuesto fue de 0.3015 g. Calcular el porcentaje de Ca y CaO en
la muestra de caliza.
MÉTODO VOLUMÉTRICO
Concentraciones en Unidades Químicas
Molaridad (M) =
N° de mol del soluto
Litros de solución
N° de mol del soluto
Molalidad (m) =
kilogramos de solvente
masa del soluto
N° equivalentes del soluto =
P.E. soluto
N° equivalentes del soluto
Normalidad (N) =
Litros de solución
Masa molar del soluto
P.E. soluto =
θ
N° de mol del soluto
Fracción molar soluto (X) =
N° mol de solución
Fracción molar solvente (X) =
N° de mol del soluto
N° mol de solución
Donde θ
- N° de hidrogeniones si es un ácido
- N° de oxidrilos si es una base
- Valor absoluto de la carga total del anión o catión si es sa
- Electrones ganados o perdidos si implica redox
3. Una muestra de 0,3147 g de Na2C2O4 grado patrón primario se disolvió en H2SO4 diluido y se
tituló con 31,67 mL de KMnO4 diluido:
(MnO4)- + (C2O4)2- + H+
Mn2+ + CO2 + H2O
Calcular la molaridad de la solución de KMnO4.
4. Con carbonato de sodio puro y seco se determina la normalidad de una solución de ácido
clorhídrico, obteniéndose los siguientes datos:
Peso de carbonato de sodio empleado: 0,2343g
Volumen de HCl gastados: 39mL
5. Calcule el volumen de AgNO3 0,120 M ,más un 10% en exceso
necesarios para precipitar todo elión cloruro presente en 120 mL de una solución de MgCl2
0,015 M.
ANÁLISIS ESPECTROMÉTRICOS
ESPECTROSCOPIA
La espectroscopia es una ciencia que estudia las interacciones que suceden
entre la radiación y la materia.
Se clasifican de acuerdo con la región del espectro electromagnético que se
utiliza para hacer la medición. Estas regiones incluyen los rayos ϒ, X,
ultravioleta (UV), visible, infrarrojo (IR), las microondas y las radiofrecuencias
(RF).
Absorción de Luz
T=
P
Po
Donde: T = Transmitancia
A = Absorvancia
Po
A = log
= − log T
P
Ley de Beer
La absorbancia está relacionada linealmente con la concentración (c) de las especies absorbentes
y con la longitud de la trayectoria de la radiación (b) en el medio absorbente, se expresa
mediante la siguiente ecuación:
Po
A = log
= abc
P
Donde a = constante llamada absortividad, si la concentración está en mol/L la constante se
denomina absortividad molar y se simboliza como ϵ.
La ley de Beer también se aplica también se aplica a soluciones que contienen mas de un
tipo de un tipo de sustancia absorbente.
Atotal = A1 + A2 + …….+ An = ϵ1bc1 + ϵ2bc2 + ……. + ϵnbcn
ANÁLISIS ELECTROQUÍMICOS
1. Una solución contiene 4,48 ppm de KMnO4 tiene una transmitancia de 0,309 en una celda de 1
cm a 520 nm. Calcular la absortividad molar del KMnO4.
2. De una muestra de agua de volumen 1122 mL, se sacó una alícuota de 1,00 mL y se trató con
reactivos para determinar la presencia de hierro y se diluyó a 50,00 mL. Se preparó una curva
de calibración con alícuotas de 1,00 mL de soluciones patrón de hierro tratadas de la misma
manera que la muestra de agua.
Solución
Absorvancia a 650 nm
1,00 ppm Fe
0,230
2,00 ppm Fe
0,436
3,00 ppm Fe
0,638
4,00 ppm Fe
0,848
Muestra de Agua
0,518
a. Construir el gráfico y encontrar la ecuación de la recta.
b. ¿Cuántos g Fe/L de muestra hay en la muestra de agua?.
3. Los datos siguientes se determinaron previamente con una celda de 1 cm.
Elemento
Absorbancia a 365 nm
Absorbancia a 470 nm
Concentración
Pb
0,150
0,642
1,00x10-4 M
Hg
0,684
0,088
2,00x10-4 M
Muestra de Agua
0,721
0,604
?
Calcular la concentración de Pb y Hg en la muestra.
Determinación de Alcalinidad
Una muestra de 100 mL de agua requiere 7,2 mL de H2SO4 0,025 N para alcanzar el punto de vire de
la fenolftaleína y 3,9 mL adicionales para alcanzar el punto de vire del anaranjado de metilo.
Determinar la alcalinidad total y el valor de cada una de las causas de la alcalinidad.
Dureza de un Agua
La dureza es causada por cationes metálicos multivalentes, de los cuales los principales, en
orden de abundancia en el agua, son calcio, magnesio, estroncio, hierro divalente y manganeso
divalente. También el hierro trivalente y el aluminio pueden causar dureza, pero debido a su
solubilidad su contribución es generalmente despreciable.
Se consideran dos clases de dureza: la porción químicamente equivalente a la alcalinidad,
llamada Dureza carbonácea, y la porción restante asociada a otros aniones como sulfatos,
cloruros, nitratos, silicatos, etc. Correspondiente a la dureza no carbonácea.
Dureza total ≥ alcalinidad
Dureza carbonácea = alcalinidad
Dureza no carbonácea = dureza total – dureza carbonácea
Dureza total < alcalinidad
Dureza carbonácea = dureza total
Dureza no carbonácea = 0
4. Una muestra de agua presenta el siguiente análisis: Ca2+ = 92 mg/L, Mg2+ =
43 mg/L, Na+ = 31 mg/L, K+ = 15mg/L, (HCO3)-= 142 mg/L, (SO4)2- = 150
mg/L y Cl- = 173 mg/L. Determinar la dureza total, dureza carbonácea y la
dureza no carbonácea del agua.
MATERIA ORGÁNICA
La materia orgánica en el agua se encuentra en cantidades tan pequeñas que
es imposible identificarlas y valorarlas en forma aislada, se expresa como la
cantidad de oxígeno que necesita para la oxidación.
El procedimiento se basa en que una solución ácida de KMnO4 cede oxígeno
cuando se pone en contacto con sustancias oxidables. El exceso se valora con
H2C2O4 , el cual se oxida a CO2 y el KMnO4 pasa a Mn2+.
Índices de Estabilidad
Permiten evaluar la corrosividad de un agua y se
calculan a partir del pH medido del agua y el pH
de saturación (pHs), mediante las expresiones
siguientes:
- Índice de saturación de Langelier (ISL)
- Índice de Ryznar (IR)
- Índice de Agresividad (IA)
-
Índice de saturación de Langelier (ISL)
ISL = pH - pHs
-
Índice de Ryznar (IR)
IR = 2 pHs - pH
-
Índice de Agresividad (IA)
IA = pH + log {(Alc)(Ca)}
pH de saturación (pHs)
pHs = A + B – log (Ca) – log (Alc)
Donde:
(Alc) = Alcalinidad Total, mg CaCO3/L
(Ca) = Dureza por Calcio, mg CaCO3/L
A = Constante que depende de la temperatura
B = Constante que depende de los STD
Valores de A en función de la temperatura
Temperatura
A
(°C)
0
2,30
Temperatura
A
(°C)
18
2,04
Temperatura
A
(°C)
50
1,56
4
2,24
20
2,01
55
1,49
8
2,18
25
1,93
60
1,41
10
2,16
30
1,86
65
1,33
12
2,13
35
1,78
70
1,25
14
2,10
40
1,71
75
1,18
16
2,07
45
1,64
80
1,10
Valores de B en función de los sólidos totales disueltos
STD (ppm)
0
100
200
400
800
1000
B
9.70
9.77
9.83
9.86
9.89
9.90
Una comparación entre los tres índices y su significado se
presenta a continuación:
ISL
IR
IA
SIGNIFICADO
> 0,0
-2,0 a 0,0
< -2,0
< 6,5
6,5 a 10,0
> 10,0
> 12,0
10,0 a 12,0
< 10,0
No agresiva
Moderadamente agresiva
Muy agresiva
Ejemplo:
5. resultados del análisis de un agua fueron: alcalinidad
total = 98 mg CaCO3/L, Dureza cálcica = 62 mg CaCO3/L,
temperatura = 12 °C, STD = 160 ppm y pH = 6,5.
Determinar que tipo de agresividad tiene el agua.