MODELOS ATÓMICOS
Anuncio

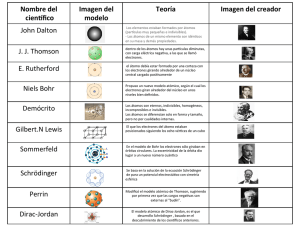
MODELOS ATÓMICOS Se le denomina radiactividad al hecho de que los núcleos de los átomos sin intervención alguna modifiquen su constitución Fue descubierto por Becquerel en 1896. En 1898 los Esposos Curie confirmaron el fenomeno al obtener de una tonelada de pechblenda un mineral radiactivo al que le llamaron. La radiactividad es una propiedad de un núcleo, y normalmente ocurre en los nucleos pesados, con un número atómico mayora 83. Fue el primer modelo atómico con bases científicas, fue formulado en 1808 por John Dalton. Este primer modelo atómico postulaba: La materia está formada por partículas muy pequeñas llamadas átomos, que son indivisibles y no se pueden destruir. Los átomos de un mismo elemento son iguales entre sí, tienen su propio peso y cualidades propias. Los átomos de los diferentes elementos tienen pesos diferentes. Los átomos permanecen sin división, aún cuando se combinen en las reacciones químicas. Los átomos, al combinarse para formar compuestos guardan relaciones simples. Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto. Los compuestos químicos se forman al unirse átomos de dos o más elementos distintos. Este modelo fue propuesto en 1899, por el físico Ingles J.J Thomson. Thomson propuso un modelo estático que con solo movimientos de vibración o por frotación podía ganar o perder energía. El átomo era una masa fluida de carga positiva que tenia en su interior los electrones incrustados distribuidos de manera simétrica. Lo Pero que se esperaba resulto ser: era: Este modelo fue propuesto en 1911, por el físico británico Ernest Rutherford E Rutherford propuso que dichos electrones (descubiertos por Thomson) van alrededor de un núcleo describiendo órbitas similares a las del Sistema Solar, aunque no muy bien definidas E E N E E Intuye la existencia de partículas sin ninguna carga en el núcleo del átomo, a las que llamo neutrones. E La ciencia que estudia los espectros en la Física y la Química, es la espectroscopia. Los espectros son una serie de colores -violeta, azul, verde, amarillo, anaranjado y rojo por orden- que se producen al dividir una luz blanca en sus colores constituyentes. Los aparatos empleados para analizar los espectros son: espectroscopios, espectrógrafos y espectrofotómetros. En el siglo XIX, los científicos descubrieron que mas allá de los extremos violeta y rojo del espectro había unas radiaciones que se denominaron ultravioleta e infrarroja. Desde entonces se han abierto los límites del espectro En el modelo de Rutherford, los electrones giran alrededor del núcleo atómico y su traslación genera una pérdida de energía. Sin embargo, Bohr propone que dicha pérdida no es continua sino que se da de manera escalonada, en proporciones regulares llamadas cuantos. Reitera, de esta forma lo ya intuido por Max Planck. Si el átomo funciona de esta manera, ello se debe reflejar la longitud de onda lumínica que emite. Las observaciones al respecto, llevadas a cabo en 1913, le dan la razón. En el modelo de Schrödinger se abandona la concepción de los electrones como esferas diminutas con carga que giran en torno al núcleo, que es una extrapolación de la experiencia a nivel macroscópico hacia las diminutas dimensiones del átomo. En vez de esto, Schrödinger describe a los electrones por medio de una función de onda, el cuadrado de la cual representa la probabilidad de presencia en una región delimitada del espacio. Esta zona de probabilidad se conoce como orbital. A lo largo del siglo XX han sido necesarias nuevas EN CONCLUSION: mejoras del modelo para explicar otros fenómenos espectrales. MODELOS ATÓMICOS EL EQUIPO ESTA CONFORMADO POR: BRAVO ARTEAGA SANDRA DIAZ ANICETO ANDREA MARQUEZ ROMERO BRENDA RODRIGUEZ PEREZ DANIEL ROJAS SILVA AURORA