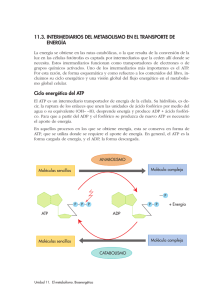
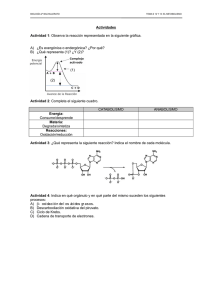
![Cartilla BIOQUIMICA [Tomo II]](http://s2.studylib.es/store/data/008971367_1-f4d38cfc04304d7feea3580ce058f717-768x994.png)
Tema XII: Vías metabólicas y de transferencia de energía Catabolismo y anabolismo. Vías catabólicas, anabólicas y anfibólicas. Ciclo de la energía en las células. Distribución intercelular de las enzimas y sistemas enzimáticos. El metabolismo Es definido brevemente, como la suma total de las reacciones enzimáticas que tienen lugar en la célula. Cuatro son las funciones específicas del metabolismo: Obtener energía química del entorno de los elementos orgánicos nutritivos o de la luz solar Convertir los elementos nutritivos exógenos en los precursores de los componentes moleculares de las células. Reunir los precursores para formar proteínas, ácidos nucleicos, lípidos y otros componentes celulares. Formar y degradar aquellas biomoléculas necesarias para las funciones celulares especializadas. Las secuencias reacciónales del metabolismo son semejantes en todas las formas de vida especialmente las que se conocen como rutas metabólicas centrales. Catabolismo y anabolismo El metabolismo se divide en catabolismo y anabolismo: El catabolismo: Es lo degradación enzimática, mediante reacciones de oxidación, de moléculas nutritivas relativamente grandes (carbohidratos, lípidos y proteínas) procedentes del entorno de la célula o de sus propios depósitos de reservas nutritivas, hasta transformarlas en moléculas simples y menores, por ejemplo, ácido láctico, ácido acético, CO 2 , amoníaco o urea. El catabolismo va acompañado de liberación de energía libre, la cual se conserva en el ATP. El anabolismo: Es la síntesis enzimática de componentes celulares relativamente grandes de la célula, ejemplo: polisacáridos, ácidos nucleicos, proteínas, lípidos a partir de moléculas precursoras sencillas. Puesto que los procesos sintéticos provocan un aumento en el tamaño y la complejidad de las estructuras, se necesita la energía proporcionada por el enlace fosfato del ATP. Tanto el catabolismo como el anabolismo son dos procesos simultáneos e interdependientes, que pueden analizarse por separado. Cada uno de los procesos abarca la secuencia de reacciones enzimáticas mediante las cuales se degrada o se sintetiza el esqueleto covalente de una determinada biomolécula. Los intermediarios químicos de este proceso se denominan metabolitos, y este proceso metabólico: metabolismo intermedio. Acompañando a cada una de las reacciones químicas del metabolismo intermediario; tiene efecto un cambio de energía característico. En algunas de las etapas de las secuencias catabólicas puede conservarse la energía química, habitualmente en forma de energía del enlace fosfato y en ciertas etapas de las 1 secuencias anabólicas puede utilizarse esa energía del enlace fosfato. Esta fase del metabolismo se denomina acoplamiento energético. El metabolismo intermedio y el acoplamiento de energía están obligatoriamente interconectados y son interdependientes. Por ello, cuando examinamos los esquemas metabólicos deberemos analizar: 1. Las etapas de reacción por las que la estructura covalente del precursor se altera para formar el producto. 2. Los cambios de energía química que acompañan a esta conversión. Transformaciones catabólicas, anabólicas y anfibólicas La degradación enzimática de cada uno de los principales elementos nutritivos (hidratos de carbono, lípidos y proteínas) tiene lugar a través de cierto número de reacciones enzimáticas consecutivas que se desarrollan en tres fases: Fase I: En esta fase las grandes moléculas de los elementos nutritivos se degradan hasta los principales componentes. Los polisacáridos son degradados a pentosas o hexosas, los lípidos a ácidos grasos, glicerina y otros componentes, y las proteínas a sus veinte aminoácidos constitutivos. Fase II: Los numerosos productos distintos de la Fase I son recogidos y convertidos en un número pequeño de moléculas más sencillas. Así, las hexosas, las pentosas y la glicerina se degradan en el azúcar fosforilado de tres átomos de carbono, el gliceraldehído-3-fosfato y después hasta un compuesto sencillo de dos átomos de carbono, la acetil-coenzima A. Los aminoácidos diferentes son también degradados a: acetil-coenzima A, alfacetoglutarato, succinato, fumarato y oxalacetato. Fase III: Los productos formados en la fase II pasan a la fase III que es el camino común final en el cual se oxidan a CO2. El anabolismo tiene lugar también en tres fases, comenzando por las pequeñas moléculas originadas en la tercera fase del catabolismo. Por ejemplo, la síntesis proteica comienza en La Fase III, a partir de los alfa-cetoácidos que son los precursores de los aminoácidos. En la Fase II los alfa-cetoácidos son aminados por donadores de grupos aminos y se forman los alfa-aminoácidos y en la Fase I se reúnen los aminoácidos para producir cadenas peptídicas. Aunque los caminos del catabolismo y el anabolismo no son idénticos la Fase III constituye un camino central accesible a ambos. Esta senda central, que recibe el nombre de anfibólica, desempeña una doble función (amphi: ambos). La ruta anfibólica puede utilizarse catabólicamente para lograr la degradación completa de pequeñas moléculas producidas en la Fase II del catabolismo o puede utilizarse anabólicamente como precursora de moléculas para la Fase II del anabolismo. 2 Lípidos Polisacáridos Ácidos grasos glicerina Hexosas Pentosas Proteínas Fase I Aminoácidos Gliceraldehído 3-fosfato Fase II Fosfoenol piruvato Piruvato Acetil - C o A citrato oxalacetato Fase III isocitrato malato Alfa - cetoglutarato Fumarato Ciclo de los ácidos tricarboxilos succinato CO 2 LA ENERGÍA EN LA CÉLULA Las moléculas orgánicas complejas, tales como la glucosa contienen mucha energía potencial a causa de su elevado grado de ordenación estructural; poseen una entropía relativamente pequeña. Cuando la molécula de glucosa se oxida y forma seis moléculas de CO 2 y seis de H2 O , sus átomos experimentan un aumento en el desorden. Como resultado de esta transformación, la molécula de glucosa experimenta una pérdida de energía libre que es energía útil y capaz de realizar trabajo. La energía libre se conserva, como energía química, específicamente como ATP. Dado que el ATP formado puede difundirse hacia aquellos lugares en la célula en que se necesite su energía, constituye una forma de transportar la energía. La energía química del ATP se libera después, durante la transferencia de su grupo o grupos fosfatos terminales, a determinadas moléculas de un aceptor específico, que adquiere un nivel superior de energía y puede realizar trabajo. Un segundo camino para transportar la energía química de las reacciones de óxido-reducción del catabolismo a las reacciones anabólicas, que necesita de energía, es en forma de electrones. En las síntesis de algunas biomoléculas ricas en hidrógeno, tales como los ácidos grasos y el colesterol, se requieren electrones e hidrógeno para la reducción de los enlaces dobles a simples. En La célula los 3 electrones son transportados enzimáticamente desde las oxidaciones productoras de electrones tales como los dobles enlaces carbono-carbono o carbono-oxígeno, mediante coenzimas transportadoras de electrones, la más importante es la nicotinamida-adenindinucleótido fosfato (NADP). El NADP desempeña de este modo, el panel de transportador de electrones ricos en energía desde las reacciones catabólicas hasta las reacciones anabólicas que los necesitan. Distribución intracelular de las enzimas y de los sistemas enzimáticos Las diferentes enzimas y sistemas enzimáticos se hallan localizados característicamente, en una u otra organela o estructura intracelular de las células. El sistema enzimático glicolítico está localizado en el citoplasma mientras que las enzimas implicadas en la oxidación del piruvato, de los ácidos grasos y de algunos aminoácidos están en la mitocondria donde también se hallan las enzimas de la cadena respiratoria y de la fosforilación del ADP. La ventaja de la compartimentación la constituye el hecho de que separa reacciones químicamente incompatibles. Por ejemplo, una célula puede realizar, a un mismo tiempo, la oxidación de los ácidos grasos de cadena larga hasta el estado de ácido acético y el proceso inverso de reducción del ácido acético para formar ácidos grasos de cadena larga. Estos procesos químicamente incompatibles se producen en diferentes partes de la célula; la oxidación en las mitocondrias y la reducción en el citoplasma extramitocondrial. Regulación celular de las sendas metabólicas La velocidad del catabolismo de una célula no es controlada por la concentración de los elementos nutritivos del entorno, sino más bien por sus necesidades energéticas en forma de ATP. La regulación de una ruta metabólica puede llevarse a cabo a varios niveles. El tipo de regulación más sencilla implica los parámetros que afectan a las velocidades de las reacciones enzimáticas (pH, concentración de enzima, concentración de cada intermediario, concentración de iones metálicos y coenzimas esenciales, etc.). El segundo mecanismo de regulación consiste en la acción de enzimas reguladoras que se hallan localizadas, habitualmente, en el comienzo o en proximidades de una secuencia multienzimática. El tercer nivel en que se ejerce la regulación metabólica es a través del control genético de la velocidad de la síntesis enzimática. En organismos multicelulares superiores el control se ejerce a través de sistemas endocrinos. Las hormonas elaboradas por una glándula endocrina son mensajeros químicos que estimulan o inhiben actividades metabólicas específicas en otros tejidos u órganos. 4 TEMA XIII: PRINCIPIOS DE BIOENERGETICA Y CICLO DEL ATP Localización y propiedades del ATP y del ADP. Variación de energía libre estándar de las reacciones químicas. Energía libre estándar de la hidrólisis del ATP. Compuesto con enlace fosfato de bajo y alto nivel energético. Vías enzimáticas de la transferencia de fosfato. Principio del intermediario común. Otros ribonucleótidos que participan en la transferencia de energía en la célula 5' difosfato y 5' trifosfato. Papel del AMP y del pirofosfato. El sistema ATP - ADP actúa como transportador de energía química, ya que el ADP es capaz de aceptar un grupo fosfato en las reacciones acopladas productoras de energía del catabolismo, y el ATP así formado puede ceder su grupo fosfato terminal, en otras reacciones acopladas que requieren energía. En este capítulo examinaremos los principios químicos y termodinámicos en que se basa el funcionamiento del sistema ATP - ADP. LOCALIZACION Y PROPIEDADES DEL ATP Y EL ADP El ATP fue aislado por primera vez, en 1.929 por Fiske y Subbarow, de los extractos ácidos de músculo. Su estructura se dedujo algunos años después, mediante experimentos de degradación y fue definitivamente confirmada por síntesis química total realizada por Todd y sus colegas en 1948. Desde los inicios del descubrimiento, se sospechó que el ATP desempeñaba un papel en la transferencia de energía celular pero recién en 1939-1941 Lipmann propuso que actuaba como medio principal de transferencia de la energía química en la célula. El ATP, el ADP y el AMP no son sustancias que existen solo en trazas; la suma de sus concentraciones en la fase acuosa de los diversos tipos de células intactas oscila entre 2 y 15 mM. La concentración de ATP es por lo común, muy superior a la suma de las otras dos concentraciones del AMP, habitualmente es la menor de las tres. Estos nucleótidos están presentes no sólo en el citoplasma, sino también en organelas tales como mitocondrias y núcleo. La compartimentación intracelular del sistema ATP constituye una característica importante en la regulación celular del metabolismo. A pH 7,0 tanto ATP como ADP son aniones muy cargados, el ATP posee cuatro protones ionizables en su grupo de ácido trifosfórico. Tres de los protones poseen valores de pK (K = constante de disociación) bajo entre 2 y3; por lo tanto a pH 7,0 están completamente disociados; el cuarto protón tiene un pK' de 6,5; por consiguiente a pH 7,0 se halla disociado en un 75%. 5 NH2 N N O HO P O O OH P OH ATP O P N N O OH 2 C O OH H H H H : hidrógenos que cede en su disociación OH OH El ADP posee tres protones ionizables, dos de ellos están completamente disociados a pH 7,0 y el tercero que posee un pK' de 7,2 a pH 7,0 se halla disociado alrededor del 39%. La elevada concentración de cargas negativas en torno al grupo trifosfato del ATP constituye un factor importante en su naturaleza de compuesto de alto contenido energético. En la célula intacta existen muy pocas cantidades de ATP y de ADP en forma de aniones libres, se hallan presentes en su mayor parte en forma de complejos Mg ATP y Mg ADP a causa de la gran afinidad de los grupos pirofosfato para enlazar cationes divalentes y de la elevada concentración de ión Mg en el fluido intracelular. La afinidad del ATP por el Mg es unas diez veces mayor que la del ADP. mg O Adenina Ribosa O - P O O O P O O O P O - mg-ATP O mg O Adenina Ribosa O P O O O P O - mg-ADP O En muchas de las reacciones enzimáticas en que participa el ATP como dador de fosfato, su forma activa es la del complejo mg-ATP. El ADP y el ATP pueden separarse y medirse con facilidad mediante electroforesis o por cromatografía en capa fina. PRINCIPIOS DE TERMODINAMICA QUIMICA Una descripción de las bases físico-químicas de la función del ATP en el ciclo energético de la célula, requiere un breve repaso de algunos principios de la termodinámica. El análisis termodinámico de los intercambios energéticos se inicia por las siguientes definiciones: a. Sistema: Es el conjunto de materia que es objeto de nuestro estudio. 6 b. Entorno: Toda materia del universo, aparte del sistema que se considera. En el transcurso del proceso en estudio la energía puede pasar del sistema al entorno, o viceversa. c. Estado inicial: Es el contenido de energía del sistema y del entorno, al iniciar el proceso que se analiza. d. Estado final: Contenido de energía de sistema y entorno una vez que se ha alcanzado el equilibrio. El contenido de energía de cada estado es una función de diversas magnitudes medibles (temperatura, presión, volumen, masa, etc.) que se formulan mediante una ecuación de estado. A partir de las medidas de los cambios de contenido de energía del sistema y el entorno, a medida que el sistema evoluciona desde su estado inicial hasta su estado final, puede realizarse un balance de energía. (Bloques de cobre) caliente frio Estado inicial Estado de equilibrio La primera ley de termodinámica es el principio de conservación de la energía. La energía no se crea ni se destruye, sino que se transforma en una u otra forma (ej. calorífica, química, mecánica, etc.). La segunda ley establece algunas limitaciones en los tipos de transformaciones energéticas que ocurren en los procesos físicos-químicos, y predice la dirección en que es probable que ocurra un proceso determinado. Establece que todos los procesos tienden a evolucionar en una dirección tal que la entropía del sistema más la del entorno, aumenta hasta alcanzar un estado de equilibrio. Entropía: Se define como el grado de desorden. Equilibrio: Se define como aquel estado en que no ocurre ningún cambio físico o químico ulterior, y en el que la temperatura, la presión y la concentración son uniformes en todo el sistema. UN SISTEMA DE EQUILIBRIO 1. Ha agotado su capacidad de realizar trabajo sobre su entorno, 2. El proceso no puede invertirse de modo espontáneo y volver a su estado inicial, lo cual requerirá una disminución de entropía. Un sistema desordenado al azar no se reordena por si mismo espontáneamente. Los procesos que se realizan con aumento de entropía se denominan irreversibles. Los procesos que tienen lugar sin cambio de entropía son reversibles. Ejemplo: si tenemos bloques de piedra dispuestos al azar y queremos disponerlos de tal modo que formen un arco la entropía o sea el grado de organización disminuye y es reversible porque espontáneamente sin cambio de entropía puede pasar del orden al 7 desorden (arco a bloques al azar). entropía ( S) elevada (desorden) ( S) disminuye irreversible espontáneo exotérmico reversible endotérmico S disminuye (orden) S aumenta En reacciones químicas los cambios de entropía ( ΔS ) no siempre pueden medirse o calcularse con facilidad. Sin embargo, el cambio de entropía durante un proceso está relacionado cuantitativamente con los cambios de la energía total del sistema por una tercera función, llamada energía libre, mediante una ecuación que combina la primera y la segunda ley de termodinámica. Puesto que los cambios de la energía libre de las reacciones químicas pueden medirse con relativa facilidad, esta ecuación resulta muy útil para predecir la dirección y el equilibrio de las reacciones químicas. El cambio de energía libre ( ΔG ) cuando la temperatura y presión son constantes se define del siguiente modo: G H - T. S (1) En la que ΔH es la variación de entalpía, T la temperatura absoluta y ΔS variación de entropía. La variación de entalpía ( ΔH) que también se denomina cambio calorífico, se define mediante la ecuación: H E PV (2) ΔE = variación de le energía total del sistema. P = presión V = volumen En los sistemas biológicos las reacciones químicas tienen lugar en disoluciones acuosas diluidas, en las que la temperatura, presión y volumen permanecen constantes. En estas condiciones, ΔPV es cero, por lo tanto: H E Si sustituimos en la ecuación (1) G E - T. S E G T. S reordenamos la ecuación: 8 Con esta ecuación vemos que a temperatura y presión constantes la variación de energía total del sistema ( ΔE ) (que es equivalente al cambio calórico ΔH) es la suma de T.Δ. S más la variación de la energía libre. La variación de energía libre puede definirse como aquella fracción del cambio de energía total del sistema disponible para realizar trabajo a medida que el sistema evoluciona hacia su estado de equilibrio, a T y P constantes. Mientras el sistema se aproxima al equilibrio, la energía libre disminuye hasta un valor mínimo. VARIACION DE LA ENERGIA LIBRE ESTANDAR EN LAS REACCIONES QUIIMICAS El cambio de energía libre que tiene lugar durante las reacciones químicas se calcula empleando una ecuación que puede derivarse de la ley de equilibrio químico. Para una reacción general del tipo: aA + bB cC + dD (3) en la que a, b, c y d son el número de moléculas de A, B, C, y D que participan en la reacción. El cambio de energía libre ( ΔG ) está dado por la ecuación: ΔG ΔG º RT ln C .D c d a b A .B (4) en la que los términos A, B, C y D son las concentraciones molares de A, B, C, y D y a, b, c y d son ahora los exponentes de sus concentraciones. R es la constante de los gases (1.987 cal mol-1 grado-1); T la temperatura absoluta y ΔGº la variación de energía libre estándar. Cuando la reacción (3) se halla en equilibrio, independientemente de las concentraciones iniciales de A, B, C y D prevalece la condición que la energía libre es mínima y no es posible ningún cambio ulterior; por tanto ΔG 0 . Entonces: 0 ΔGº RT ln C .D c d a b A .B (5) De donde: ΔG º RT ln C .D c d a b A .B (6) Puesto que la constante de equilibrio K'eq para la ecuación (3) es: K' eq C .D c d a b A .B (7 ) Podemos sustituir K'eq en la ecuación (6) y obtener la ecuación general: 9 ΔGº RT ln (K' eq) O bien: ΔGº 2.303 RT log10 (K' eq) (8) Esta ecuación nos muestra que ΔGº , la variación de energía libre estándar de una reacción química, puede calcularse a partir de su constante de equilibrio. La ΔGº constituye, por lo tanto, una constante termodinámica para una reacción química dada. Puede definirse de otro modo, que indica claramente su verdadero significado. La variación de energía libre estándar de una reacción constituye, en realidad, la diferencia existente entre la energía libre estándar de los reactivos y la energía libre estándar de los productos, hallándose cada término ajustado a la estequiometría de la ecuación de reacción: ΔGº Gº productos Gº reaccionantes Para la reacción (3) será: ΔGº (c Gº C d Gº D ) (a Gº A b Gº B ) La energía libre estándar de un compuesto constituye la medida de la cantidad total de energía libre que puede proporcionar por descomposición completa. Es importante comprender la diferencia que hay entre ΔGº , que es la variación de energía libre estándar, y ΔG que es la variación de energía libre medida o real. Esta diferencia puede explicarse mejor utilizando una analogía. ΔGº es un valor constante para una determinada reacción a una temperatura también determinada. Por otra parte, ΔG varía con las concentraciones de los reaccionantes y de los productos. El valor de ΔGº únicamente es igual al de ΔG cuando todos los reactivos y todos los productos están presentes a concentración 1,0M. El valor de ΔG es el que determina si una reacción química ocurrirá en la dirección escrita, partiendo de unas concentraciones de reaccionantes determinadas. Recuérdese que una reacción química solamente ocurrirá si ΔG es negativo, es decir, si la energía libre del sistema disminuye. Las reacciones químicas con un ΔGº negativo reciben el nombre de exergónicas; se realizan espontáneamente en la dirección en que están escritas. Si recordamos el ejemplo de los bloques: ordenado ΔG º disminuye, es negativo exergónica o exotérmica espontánea irreversible desordenado 10 Las reacciones con un cambio de energía libre estándar positivo reciben el nombre de endergónicas o endotérmicas, no se realizan de modo espontáneo en la dirección en que se escriben. Volviendo al ejemplo: desordenado ΔG º aumenta, es postivo endergónica o endotérmica no es espontánea reversible ordenado Ahora podemos exponer un ejemplo de la ΔGº a partir de la siguiente reacción: glucosa_1_fosfato glucosa_6_fosfato ΔGº R T ln(K' eq) ΔGº 1.987 x 298 x 2.303 log19 1745 cal 1.745 Kcal Puesto que ΔGº es negativo, la conversión de glucosa-1-fosfato en glucosa-6-fosfato es exergónico. El análisis químico muestra que parte de una concentración 0,020 M de glucosa-1-fosfato con un exceso de enzima y permitimos que la reacción ocurra en sentido directo, o si partimos de la concentración 0,020 M de glucosa-6-fosfato y la reacción transcurre en sentido inverso, las concentraciones de la mezcla final en equilibrio son, en ambos casos, 0.001 M de glucosa-1-fosfato y 0,019 de glucosa -6fosfato a 25º C y pH 7,0. Hay dos tipos de reacciones que tienen lugar con disminuciones especialmente grandes de ΔGº , son la hidrólisis de los anhídridos y las reacciones de oxidación. ΔGº de la hidrólisis del ATP El camino más sencillo para determinar ΔGº para la reacción: ATP + H2O ADP + fosfato (10) Es determinar la constante de equilibrio y calcular ΔGº empleando la relación dada por la ecuación (8): ΔGº -2.303 R T log10 (K' eq) La medida directa de la constante de equilibrio de la hidrólisis del ATP no es práctico. Una de las razones, y la más importante, es que los métodos analíticos que se disponen no son lo suficientemente precisos o sensibles para determinar con exactitud las concentraciones de equilibrio de ATP, ADP y el ión fosfato, porque en el estado de equilibrio el ATP se encuentra casi completamente hidrolizado en ADP y en ión fosfato. En realidad, esto constituye un problema serio para muchas reacciones que poseen 11 grandes valores negativos de ΔGº . Para poder medir el ΔGº de la hidrólisis del ATP, se descompone en cierto número de etapas menores, las cuales pueden medirse más fácilmente. Veremos un ejemplo: en primer lugar, se deja reaccionar al ATP con la glucosa, en presencia de hexoquinasa para formar ADP y glucosa-6-fosfato. Se mide la constante de equilibrio, y a partir de ella se calcula ΔGº . hexoquinasa ATP + glucosa ADP + glucosa_6_fosfato K'eq = 661 Gº = - 4.00 kcal (11) Se continúa después con la medida de la K'eq y la ΔGº de la reacción de hidrólisis de la glucosa-6- fosfato catalizada por una fosfatasa. fosfatasa glucosa_6_fosfato + H2O glucosa + fosfato Pi K'eq = 171 Gº = - 3.30 kcal (12) La suma de las reacciones (11) y (12) es la ecuación de hidrólisis del ATP. hexoquinasa ATP + glucosa ADP + glucosa_6_fosfato + H2O glucosa + fosfato Pi + H2O ADP + fosfato fosfatasa glucosa_6_fosfato ATP Puesto que los valores de ΔGº de las dos reacciones son aditivas, la ΔGº de la hidrólisis del ATP puede calcularse a partir de ellos: ΔGº ΔGº ΔGº - 4.00 (-3.30) - 7.30 kcal Es importante hacer notar que este valor está basado en que pH = 7,0; T = 37º C, en presencia de exceso de ion Mg y concentraciones 1,0 M de los reaccionantes y de los productos. El grupo fosfato terminal del ADP también posee una ΔGº de hidrólisis relativamente grande. Es igual a -7,30 kcal. ADP + H2O AMP + Pi ΔGº -7.3 kcal Sin embargo el único grupo fosfato del AMP tiene un valor mucho menor: 12 AMP + H2O adenosina + ΔGº -3.40 kcal Pi Lo que sucede es que los enlaces entre grupos fosfatos adyacentes son enlaces del tipo de anhídrido, mientras que el enlace entre el fosfato y la ribosa en el AMP es un enlace éster. COMPUESTOS CON ENLACES FOSFATO DE ALTO Y DE BAJO NIVEL ENERGÉTICO En la escala termodinámica de ΔGº , el ATP es el único que posee un valor de ΔGº , intermedio. Daremos el ΔGº de algunos compuestos fosforilados. ΔGº (kcal) Fosfoenol piruvato ………………………. 1-3 difosfoglicerato ……………………... Fosfocreatina …………………………….. Acetil-fosfato …………………………….. Fosfoarginina …………………………….. -14.80 - 11.80 - 10.30 -10,10 - 7.70 ………………………………. - 7.30 ATP Glucosa-1- fosfato ……………………... - 5.00 Fructosa-6-fosfato Glucosa-6-fosfato Gliceril-1-fosfato ……………………... ……………………... ………………………… - 3.80 - 3.30 - 2.20 ΔGº ATP ΔG º ATP O sea que la función del sistema ATP-ADP, consiste en servir como transportador obligatorio intermedio de grupos fosfato desde los compuestos con enlaces fosfato de elevado nivel energético, situados por encima del ATP en la escala termodinámica, hasta las moléculas aceptoras que forman compuestos con enlaces fosfato de bajo nivel energético situados en la escala por debajo del ATP. COMPUESTOS FOSFATO DE ALTO NIVEL ENERGETICO Hay dos clases de compuestos fosforilados que poseen una ΔGº de hidrólisis más negativa que la del ATP: 1. Los compuestos fosfato que se forman durante la ruptura enzimática de moléculas combustibles. 2. Los compuestos fosfato utilizados como almacenadores de la energía del enlace 13 fosfato. Los dos miembros más importantes de la primera clase son el 1-3 difosfoglicerato y el fosfoenol piruvato, los cuales se forman durante la fermentación anaerobia de la glucosa (glucólisis). 1-3 difosfoglicerato + ADP 3 fosfoglicerato ATP + H 2O ADP + + ΔG º -4.5 kcal ATP ΔG º -7.3 kcal Pi Total -11.80 kcal Los compuestos fosfato de elevado nivel energético, que actúan como reservorio de la energía de enlaces fosfato, reciben con frecuencia el nombre de fosfágenos. Los dos fosfágenos principales son la fosfocreatina hallada en muchos vertebrados, y la fosfoarginina, presente en muchos invertebrados. Ambos se forman a partir de la creatina y de la arginina por transferencia de grupos fosfato desde el ATP en reacciones catalizadas por la creatin-fosfoquinasa y la arginin-fosfoquinasa, respectivamente. Ambas reacciones son reversibles pero el equilibrio se halla desplazado hacia la formación de ATP. fosfocreatina + ADP creatina + ATP COMPUESTOS FOSFATO DE BAJO NIVEL ENERGETICO La mayoría de los compuestos fosfato pobres en energía son ésteres fosfóricos de alcoholes. Se conocen muchas enzimas que catalizan la transferencia de grupos fosfato desde el ATP a aceptores de fosfato específicos, para formar compuestos fosfato pobres en energía; entre las enzimas mencionadas se hallan la glicero quinasa y la hexoquinasa, que catalizan la transferencia de fosfato desde el ATP a la glicerina y desde el ATP a la D-glucosa, respectivamente. ATP + glicerina ADP + glicerol_3_fosfato ΔGº -4.5 kcal ATP + D-glucosa ADP + D.glucosa_6_fosfato ΔGº -7.3 kcal RUTAS ENZIMATICAS DE LA TRANSFERENCIA DE FOSFATO Fosfoenol piruvato Dadores de P de alta energía P Reservorio de fosfocreatina 1-3 difosfoglicerato P P ATP Aceptores de P de baja energía P P Glucosa_6_fosfato Glicerol_3_fosfato 14 La figura es un esquema de las reacciones enzimáticas de transferencia de fosfato en la célula. Constituye un rasgo importante que el sistema ATP-ADP sea el nexo de unión obligado entre los compuestos fosfato de elevado y de bajo nivel energético. Los grupos fosfato se transfieren, en primer lugar, mediante la acción de fosfotransferasas específicas, desde compuestos de alto nivel energético al ADP, como en el ejemplo: fosfoenol piruvato + ADP piruvato - piruvato + ATP quinasa El ATP así formado se transforma entonces en el dador de fosfato específico de una segunda reacción enzimática, para formar compuestos fosfato de baja energía. hexoquinasa ATP + D-glucosa ADP + D-glucosa_6_fosfato La reacción global es la siguiente: fosfoenol piruvato + D-glucosa piruvato + D-glucosa_6_fosfato El resultado final es la transferencia de un grupo fosfato desde un donador de energía elevado a un aceptor de bajo nivel energético, a través del sistema ATP-ADP, que actúa como intermediario. El contenido de energía de la D-glucosa se ha elevado al fosforilarse, la glucosa-6-fosfato puede considerarse una forma de glucosa que ha recibido energía. En el flujo principal de reacciones transferidoras de energía de la célula, la transferencia del fosfato nunca se produce directamente desde un compuesto de elevado nivel energético como el 1-3 difosfoglicerato a un aceptor de fosfato de bajo nivel energético, como por ejemplo, la glicerina, no se han encontrado enzimas capaces de catalizar tales transferencias directas de fosfato. Esencialmente, todas las reacciones de transferencia de fosfato en la célula tienen que efectuarse a través del sistema ATPADP. La figura también muestra el papel de reservorio desempeñado por la fosfocreatina, que se forma por transferencia enzimática directa de un grupo fosfato desde el ATP a la creatina; no existe ningún otro camino para su formación. Además, la única ruta principal conocida para su desfoforilación es la inversa de la reacción por la que se forma. El sistema reservorio de la fosfocreatina es muy importante en el músculo esqueletal. También se encuentra en el músculo liso y en las células nerviosas, y en pequeñas cantidades en el hígado, riñón y otros tejidos de mamíferos. PRINCIPIO DEL INTERMEDIARIO COMUN En dos reacciones consecutivas en que un producto de la primera es un sustrato de la segunda, como ocurre en las siguientes reacciones: A + B C + D D + E F + G 15 ambas reacciones están ligadas por un intermediario común, en este caso el componente D. El único camino mediante el cual la energía química puede ser transferida desde una reacción a otra en condiciones isotérmicas es el de que ambas reacciones posean un intermediario de reacción común. Casi todas las reacciones metabólicas de la célula se realizan mediante secuencias de esta clase. En las reacciones consecutivas, responsables de la transferencia de energía a través del ATP, la energía química se transfiere desde un dador fosfato de elevada energía hasta el ADP, y se conserva en forma de ATP como producto de reacción. En la reacción subsiguiente, el ATP se comporta como un sustrato, y cuando pierde su grupo fosfato terminal, que cede a la molécula del aceptor, ésta última aumenta su contenido energético. Por lo tanto, el ATP es el intermediario común. En realidad, la transferencia de intermediarios comunes constituye un atributo general de las reacciones químicas consecutivas y no necesita por fuerza, ni grupos fosfatos, ni ATP. En efecto, veremos que muchos grupos funcionales distintos del fosfato, por ejemplo, átomos de hidrógeno, grupos acetilo, se transfieren enzimáticamente mediante reacciones consecutivas que poseen intermediarios comunes, tales reacciones pueden analizarse termodinámicamente por los mismos métodos que se han desarrollado para el caso especial de las transferencias del grupo fosfato. CANALIZACION DE GRUPOS FOSFATO POR LA VIA DE OTROS NUCLEOSIDOS 5' TRIFOSFATO Aunque el sistema ATP-ADP constituye el transportador obligado de fosfato en el flujo principal de transferencia de energía en la célula, también participan en dichas transferencias los 5' di y trifosfatos de otros ribonucleósidos y los 2 desoxirribonucleósidos. Los 5' di y trifosfatos de diversos ribonucleósidos no solamente actúan como precursores en la síntesis de ARN, sino también canalizan los grupos fosfato de alto contenido en energía hacia reacciones biosintéticas específicas. P ATP P UTP ATP P GTP ATP P CTP ATP P CTP P GTP P UTP Polisacáridos Proteínas Lípidos ARN ATP P d ATP P d GTP P d TTP P d CTP ADN 16 Todas estas canalizaciones conectan con el ATP mediante la enzima nucleósidos difosfoquinasa presente en las mitocondrias y en el citoplasma de la célula, cataliza las reacciones del tipo mostrado en el esquema. Cada tipo de nucleósido trifosfato posee una función especializada. Por ejemplo: el UTP es el dador de fosfato inmediato, y por lo tanto el donador de energía de reacciones que conducen a la síntesis de polisacáridos. PAPEL DEL AMP Y DEL PIROFOSFATO Aunque el ADP constituye el producto de muchas reacciones celulares que emplean el ATP, y el ADP es el aceptor directo del fosfato en las reacciones productoras de energía de la glicólisis y de la fosforilación oxidativa de la mitocondria; en muchas de las reacciones que utilizan el ATP en la célula los dos grupos fosfato terminales de éste se separan conjuntamente en forma de pirofosfato y se libera AMP como producto. AMP ATP + PPi El pirofosfato inorgánico es un compuesto fosfato de nivel energético elevado que posee un ΔGº de hidrólisis comparable al fosfato terminal del ATP. Para regenerar el ATP a partir de PPi y AMP intervienen dos enzimas auxiliares: la pirofosfatasa inorgánica y la adenilato-quinasa. La primera cataliza la hidrólisis del pirofosfato inorgánico (PP i). PPi + H2O 2 Pi Esta hidrólisis secundaria del pirofosfato constituye una etapa valiosa de liberación de energía, la cual se utiliza para asegurar que ciertas reacciones biosintéticas se realicen por completo. El Pi formado se utiliza para la regeneración del ATP a partir de ADP. La adenilatoquinasa cataliza la refosforilación del AMP a ADP. ATP + AMP ADP + ADP El ATP, el ADP y el AMP de la célula existen en concentraciones constantes. 17 TEMA XIV: GLUCOLISIS Vamos a considerar los mecanismos por los que las moléculas combustibles se degradan y su energía se conserva en forma de energía de enlace fosfato ATP. Se estudiarán los procesos conocidos como fermentación, mediante el cual muchos organismos extraen energía química de la glucosa y otros combustibles en ausencia de oxígeno molecular. Nos referimos primeramente el proceso de fermentación para luego poder hablar de respiración. FERMENTACION Y RESPIRACION Los organismos inferiores que viven en condiciones anaerobias (ciertas bacterias, invertebrados inferiores) obtienen su energía de la fermentación de la glucosa. Los organismos que viven en condiciones aerobias (hongos, bacterias, mayoría de los animales y plantas superiores) degradan sus combustibles por la ruta anaerobia pero después oxidan los productos de la fermentación utilizando el oxígeno molecular. En esta fermentación el oxidante final o aceptor final es una molécula orgánica producida en el proceso fermentativo. En los organismos superiores la ruta anaerobia es una primera etapa de la fase aerobia de la respiración. Utilización de la glucosa por los organismos inferiores superiores: La ruta de la fermentación es común tanto en la utilización anaerobia de la glucosa como en la aerobia. Anaerobios Aerobios glucosa sin O2 glucosa fermentación productos de la fermentación fermentación sin O2 productos de la fermentación con CO 2 CO2 + H2O Entre las clases de fermentación nombraremos la fermentación homoláctica y la alcohólica. La fermentación homoláctica: La molécula de glucosa de 6 átomos de carbono se degrada a dos moléculas de ácido láctico de tres átomos de carbono. Este 18 proceso se denomina glucólisis que significa lisis de la glucosa. La fermentación alcohólica: La molécula de glucosa de 6 átomos de carbono se degrada a dos moléculas de etanol de 2 átomos de carbono y 2 de CO 2 . 1. Glucosa C C C C 2. Glucosa C C C C C triosas C C C C C C C triosas C C ácido láctico ácido láctico CH3 CH3 CH OH CH OH COOH COOH C C C C C C etanol etanol CH3 CH3 CH2 OH CH2 OH + + CO 2 CO 2 En estas reacciones tenemos que hablar de las reacciones de óxido reducción que se producen en todo organismo donde el agente oxidante recibe los electrones y el agente reductor entrega electrones. En este caso de la fermentación alcohólica el etanol es una molécula relativamente reducida rica en H 2 , pobre en O 2 . La molécula de CO 2 es relativamente oxidada, pobre en H 2 . En el caso de la fermentación homoláctica el grupo metilo se halla más reducido que el grupo carbonilo. Veamos la reacción completa: Ácido láctico 1. Glucosa O C H CH3 HC OH HO C H + 2 Pi + 2 ADP CH OH 2 HC OH + 2 ATP + 2 H2O COOH HC OH CH2 OH 2. Glucosa + 2 Pi + 2 ADP 2 CH3 + 2 CO2 + 2 ATP + 2 H2O CH2 OH Etanol 19 ANALIZAREMOS LA REACCION ENERGETICA DE LA GLUCOLISIS 1) La conversión de glucosa en lactato es exergónica y 2) la formación de ATP a partir de ADP y de Pi es endergónica. Se deduce de estos datos que la transformación de glucosa en lactato proporciona energía para producir la fosforilación de 2 moléculas de ADP a ATP. Esta reacción es irreversible. Lo demuestra el ΔGº negativo. ETAPA DE LA GLUCOLISIS: La glucólisis es catalizada por la acción de un grupo de 11 enzimas. Se cree que están localizadas en la porción soluble del citoplasma. Se pueden considerar dos etapas o fases. En la primera fase la glucosa se fosforila y se escinde pare formar gliceraldehído 3 P; y en la segunda fase éste se convierte en ácido láctico. LA FASE I: Constituye un proceso preparativo o de congregación en el que cierto número de hexosas penetran en el esquema, después de fosforilarse a expensas del ATP, y dan un producto común, el gliceraldehído 3 P. LA FASE II: Es la ruta común para todos los azúcares, se produce la fosforilación del ADP y se llevan a cabo las reacciones de óxido reducción, obteniéndose el lactato. En este proceso hay tres tipos de transformaciones interconectadas. 1º.La ruta de los átomos de carbono: o sea degradación de la glucosa para formar ácido láctico. 2º.La ruta del fosfato: o sea que el Pi (fósforo inorgánico) se transforma en P del ATP. 3º.- La ruta de los electrones: o sea las reacciones del óxido-reducción. 20 almidón glucogeno glucosa ATP Pi glucosa-1-P FASE I Congregación de azúcares sencillos y su conversión en fosfato ADP galactosa manosa pentosa glucosa-6-P de gliceraldehído; entrada de ATP fructosa-6-P ATP ADP fructosa-1-6-di P glicealdehído-3-P (2) 2 NAD+ Pi 1,3 difosfoglicerato (2) FASE II 2 NADH 2 ADP 2 ATP 3 difosfoglicerato (2) Oxidación - reducción y formación acoplada de ATP; salida de lactato 2 difosfoglicerato (2) fosfoenolpiruvato (2) 2 ADP 2 ATP piruvato (2) 2 NAD+ 2 lactato 21 1. Fosforilación de glucosa por el ATP: catalizada por dos enzimas: la hexoquinasa y glucoquinasa. ATP + glucosa Mg++ ADP + Gº glucosa-6-P 4 kcal Es una reacción irreversible. La hexoquinasa es de mayor afinidad que la glucoquinasa por la glucosa. La glucoquinasa solo actúa cuando hay alta concentración de glucosa en sangre; las dos enzimas necesitan del catión Mg ó Mn para formar el verdadero sustrato que es Mg Mn ATP . La hexoquinasa actúa también fosforilando otras hexosas. La reacción es irreversible. CH2 CH2 OH OPO 3= O O H H H + OH ATP ADP OH OH H OH OH OH H OH glucosa OH glucosa-6-fosfato 2. Conversión de glucosa-6-P fosfoglucoisomerasa. CH2 ΔG º -4 kcal + H H H H H OPO 3= a CH2 O H fructosa-6-P: H OH CH2 H OH OH H la OH H glucosa-6-P OH ΔGº H OH OH por OPO 3= O H OH Catalizada 0.4 kcal (reacción reversible) OH fructosa-6-P 3. Fosforilación de la fructosa-6-fosfato a fructosa 1-6 difosfato. Interviene una segunda molécula de ATP. Esta reacción es catalizada por la fosfofructoquinasa. CH2 OPO 3= O CH2 CH2 + OH OH H OH ATP CH2 ADP OH OPO 3= ΔG º -3.4 kcal + H OH OPO 3= O OH H OH OH H (reacción irreversible) OH 22 4. Escisión de la fructosa 1 - 6 difosfato por una aldosa (la fructosa-1-6-difosfato gliceraldehído 3-liasa) dando fosfato de dihidroxiacetona + gliceraldehído-3fosfato. 1. CH2 2. C OPO 3= H O 1. CH2 OPO 3= 4. C 3. HO CH 2. C O ΔGº O + 5.73 kcal 5. H COH 4. H COH 3. CH2 6. OH CH2 OPO 3= 5. H COH 6. CH2 OPO 3= fructosa 1-6-di P (cadena abierta) gliceraldehído 3-P fosfato de dihidroxiacetona INTERCONVERSION DE LOS FOSFATOS DE TRIOSA Solamente uno de los dos fosfatos de triosa, el gliceraldehído 3-fosfato, puede ser directamente degradado en las reacciones posteriores de la glucólisis. El otro, el fosfato de dihidroxiacetona, se convierte reversiblemente en gliceraldehído-3-fosfato por acción de la enzima triosa fosfato isomerasa. O CH2 OPO 3= C H ΔGº 1.83 kcal C O CH2 OH H C OH CH2 OPO 3= Así en la primera fase una molécula de glucosa da dos moléculas de gliceraldehído 3 P. SEGUNDA FASE 1. Oxidación del gliceraldehído 3 P a 1-3 difosfoglicerato. La enzima que actúa es G_3_fosfato deshidrogenasa, o gliceraldehído 3 fosfato deshidrogenasa. 2 gliceraldehído-3-P + 2 NAD+ + 2 Pi (2) 1,3 di-fosfoglicerato + 2 NADH + 2 H+ 23 O C O PO 3= H C HC O + NAD+ + Pi 2 H COH 2 CH2 OH + PO 3= + NADH + H O ΔG º 1.5 kcal CH2 OPO 3= El NAD+ y el NADH transportan los electrones. 2. Transferencia de fosfato desde el 1-3 difosfoglicerato al ADP. El 1-3 difosfoglicerato + ADP da 3-fosfoglicerato + 2 ATP; es catalizada la reacción por la enzima fosfogliceratoquinasa. O 1. C 3. O 2. H COH PO 3= + ADP CH2 OPO 3= 2. H COH ΔGº + ATP 4.50 kcal (reacción irreversible) 3. CH2 1. OPO 3= COO - 3. Conversión del 3-fosfoglicerato dando 2-fosfoglicerato. Actúa la fosfogliceratomutasa. CH2 OPO 3= H COPO 3= H COH COO CH2 OH - 3-fosfoglicerato COO ΔG º 1.06 kcal - 2-fosfoglicerato 4. El 2-fosfoglicerato da fosfoenolpiruvato + H20 por medio de una enzima, la enolasa, en un proceso de deshidratación. 24 CH2 OH CH2 enolasa H COPO 3= COO - C COO 2-fosfoglicerato O PO 3= + H2O ΔG º 0.44 kcal - fosfoenolpiruvato 5. Transferencia de fosfato desde el fosfoenolpiruvato al ADP. El fosfoenolpiruvato da piruvato por una enzima piruvato quinasa en presencia de ADP y Mg . CH3 CH2 ΔG º C O COO PO 3= + ADP - ATP + C O COO fosfoenolpiruvato 7.5 kcal (reacción irreversible) - piruvato 6. Reducción de piruvato a lactato. Piruvato da lactato por medio de lactato deshidrogenasa. CH3 C CH3 O COO - piruvato + NADH + H+ + H COH + NAD COO ΔGº 6.0 kcal - lactato En condiciones anaerobias el lactato es producto final de la glucólisis el cual difunde a través de la membrana plasmática de la célula hacia el entorno como producto de desecho. Cuando las células musculares de los animales superiores actúan de manera anaerobia durante cortos esfuerzos de actividad vigorosa (excepcionalmente) el lactato escapa desde las células musculares a la sangre y es transformado nuevamente en glucosa en el hígado. 25 BALANCE GLOBAL 2 ADP glucosa + 2 ATP + 2 NAD+ + 2 Pi + 4 ADP + 2 NADH+ + 2 H+ 2 lactato + 2 ADP + + 2 ATP + 2 NADH + 4 ATP + 2 H2O + 2 H+ + 2NAD+ glucosa + 2 Pi + 2 ADP 2 lactato + 2 ATP + 2 H2O ENTRADA DE LOS OTROS HIDRATOS DE CARBONO Los polisacáridos de reserva el glucógeno, almidón, azúcares sencillos distintos de la glucosa penetran en la primera fase de la glucólisis. El glucógeno y el almidón penetran por la acción de dos enzimas que actúan sobre los extremos terminales no reductores de la molécula, escindiendo los enlaces alfa (1-4). Otra enzima actúa sobre las ramificaciones alfa (1-6) dando glucosa-1-fosfato para luego dar glucosa-6-fosfato. Los azúcares sencillos una vez fosforilados, por ej. : manosa-6-P, fructosa-6-P recién penetran al ciclo. manosa + ATP manosa-6-P + ADP fructosa + ATP fructosa-6-P + ADP 26 TEMA XV: CICLO DE LOS ACIDOS TRICARBOXILICOS Y VIA DEL FOSFOGLUCONATO Energética de la fermentación y respiración. Plan de organización de la respiración. Oxidación del piruvato a acetil CoA. Ciclo de Krebs. Vías del fosfogluconato. Las células aerobias obtienen la mayor parte de su energía de la respiración, esto es, gracias a una transferencia de electrones desde les moléculas orgánicas combustibles hasta el oxigeno molecular. La respiración es mucho más compleja que la glicólisis. En este tema se esboza el plan general de le respiración y después se considera con detenimiento el ciclo del ácido tricarboxílico de Krebs, que es la ruta catabólica común por la que finalmente se degradan todas las moléculas combustibles de la célula (carbohidratos, ácidos grasos y aminoácidos). También se describe la ruta del fosfogluconato de oxidación de la glucosa, mecanismo que genera potencial de reducción para las reacciones biosintéticas. ENERGETICA DE LA FERMENTACION Y LA RESPIRACION En la glicólisis se libera solamente una fracción muy pequeña de la energía química potencialmente asequible en la estructura de la molécula de glucosa. Se libera más energía cuando ésta se oxida completamente a CO 2 y H2 O como se pone de manifiesto al comparar las variaciones de energía libre estándar de la conversión anaerobia de la glucosa en lactato y de su oxidación a CO 2 y H2 O . glucosa glucosa + 6 O2 2 lactato ΔG º 6 CO2 + 6 H2O 47 kcal ΔG º 686 kcal Cuando las células fermentan a la glucosa anaerobiamente, los productos que ya no son susceptibles de ulterior empleo, y por ello abandonan la célula, todavía contienen la mayor parte de la energía de la molécula de glucosa original. Por esta razón, las células que viven anaerobiamente, para obtener una misma cantidad de energía utilizable tienen que consumir mucho más glucosa que cuando viven en condiciones aerobias. ¿Por qué rinde la respiración mucho más energía que la glicólisis? En primer lugar, el producto de la glicólisis, el ácido láctico, es una molécula casi tan compleja como la de glucosa y sus átomos de carbono todavía se hallan en un mismo estado de oxidación. El CO 2 , producto de la respiración, es una molécula mucho más sencilla y pequeña que la glucosa, y su átomo de carbono está completamente oxidado. En segundo lugar, la cantidad de energía que se libera en la transferencia de un par de electrones desde una molécula combustible determinada a un aceptor electrónico, varía con la naturaleza del aceptor. Puede liberarse mucha más energía cuando el aceptor electrónico el oxígeno molecular, como ocurre en la respiración, que cuando es el piruvato el que actúa como aceptor, que es el caso de la glicólisis. 27 ORGANIGRAMA RESPIRATORIO En la figura se muestra un diagrama de la respiración. lkk Los grupos acetilo procedentes de los carbohidratos, de los lípidos y de los aminoácidos en la fase II del catabolismo, en la siguiente fase III se incorporan al ciclo de Krebs, que en las aerobias constituye la ruta común final del catabolismo oxidativo de todas las moléculas combustibles. En este ciclo los grupos acetilo se desintegran para formar CO 2 y átomos de hidrógeno. Estos últimos (o sus electrones equivalentes) posteriormente se incorporan a la cadena respiratoria constituída por una serie de transportadores electrónicos. El proceso subsiguiente de transporte de electrones hasta el oxígeno molecular se realiza con un descenso muy grande de energía libre, gran parte de la cual se conserve en forma de ATP, gracias a la fosforilación oxidativa acoplada del ATP. La reacción global catalizada por el ciclo de Krebs es la siguiente: CH3COOH + 2 H2O 2 CO2 + 8 H + Como puede verse en la ecuación, no participan en el ciclo ni el oxígeno molecular, ni el fosfato inorgánico, ni el ATP. Su función primaria consiste en la deshidrogenación del ácido acético para formar, en último término, dos moléculas de CO 2 y cuatro pares de átomos de hidrógeno. Este proceso es catalizado en una serie cíclica de reacciones consecutivas, en contraste con la secuencia glicolítica, que es lineal. En cada vuelta del ciclo de Krebs se incorpora una molécula de ácido acético (dos átomos de carbono) por condensación con una molécula del compuesto de cuatro carbonos, el ácido oxal acético, para formar el ácido cítrico de seis átomos de carbono. Posteriormente, el ácido cítrico se degrada con producción de dos moléculas de CO2 y ácido succínico, compuesto de cuatro átomos de carbono. Finalmente, este último se oxida a ácido oxalacético, con lo que puede iniciarse de nuevo una vuelta del ciclo. En cada una de las vueltas se incorpora una molécula de ácido acético y se eliminan dos moléculas de CO 2 , en cada giro completo se emplea también una molécula de oxal acetato para formar citrato, pero aquel se regenera al final del ciclo. Por tanto, cuando el ciclo funciona no hay pérdida neta de oxalacetato, basta con una molécula para llevar a cabo la oxidación de un número infinito de moléculas de acetato. Las reacciones enzimáticas del ciclo de Krebs tienen lugar en el compartimiento interno de la mitocondria (a diferencia de la glucolisis que tiene lugar en el citoplasma celular). 28 Carbohidrato Aminoacidos Movilización del Ácidos grasos Piruvato acetil CoA 2H CO2 Acetil-CoA oxalacetato citrato cis-aconitato malato Ciclo del ácido tricarboxilo CO2 -oxoglutarato CO2 succinato fumarato 2H isocitrato 2H 2H ATP NAD ADP + Pi 2H flavoproteina coenzima Q Transporte electrónico y fosforilación oxidativa citocromo b ADP + Pi 2H + ATP citocromo c citocromo a + a3 + ADP A Pi 2 H+ + 1/2 O2 ATP H2O 29 Oxidación del Piruvato a acetil CoA O Piruvato NAD+ CH3 NADH2 COOH O CO2 HS-CoA C CH3 C S CoA + CO 2 Acetil-CoA La ecuación global es: Piruvato + NAD + + HSCoA acetil-S-CoA+ NADH2 + CO 2 Gº 8.0 kcal La oxidación de piruvato a acetil-SCoA, catalizada por el sistema piruvatodeshidrogenasa, en realidad constituye un proceso muy complejo. A causa del gran descenso de energía libre estándar, la reacción es esencialmente irreversible. Aunque en si misma no forma parte del ciclo del ácido tricarboxílico, constituye una etapa obligatoria, mediante le cual los hidratos de carbono se incorporan al ciclo. En este proceso participan dos coenzimas importantes: CoA y ácido lipoico. CoA: Actúa como transportador de grupos acilo, efectuando una función análoga a la que desempeña el ATP como transportador de grupos fosfato. La forma acetilada de la coenzima A (acetil CoA) es un tioéster del ácido acético. El tioéster es un enlace de elevado contenido energético, es decir, posee un Gº fuertemente negativo. acetil-S-CoA + H2O acetato + CoA - SH Gº 7.52 kcal Ácido lipoico: es un factor de crecimiento para algunos microorganismos, un ácido graso saturado de 8 átomos de carbono, en el que los carbonos 6 y 8 están unidos por un grupo disulfuro formando un anillo de cinco términos. CH2 S CH2 S CH (CH 2)4 30 COOH La decarboxilación oxidante del piruvato a acetil CoA CO2 necesita tres enzimas diferentes y 5 coenzimas que constituyen el: enzimas Piruvato-deshidrogenasa dihidrolipoil-transacetilasa dihidrolipoil-deshidrogenasa coenzimas Coenzima A ácido lipoico Pirofosfato de tiamina (TPP) NAD FAD Sistema de la piruvato-deshidrogenasa REACCIONES INDIVIDUALES DEL CICLO DEL ACIDO TRICARBOXILICO La acetil-CoA formada como producto final de la piruvato-deshidrogenasa se encuentra ahora dispuesta para incorporarse al ciclo de Krebs. 1. Se produce la condensación de la acetil-CoA con el oxalacetato, para formar citrato. La reacción es catalizada por la citrato-sintetasa. O Acetil - CoA CH3 C S CoA CoA SH COOH COOH C oxalacetato CH2 O HO C citrato COOH CH2 CH2 COOH COOH En esta reacción el grupo metilo (CH3 ) de la acetil CoA se condensa con el átomo de carbono carbonílico del oxalacetato con la hidrólisis del enlace tioéster y formación de la CoA SH libre. O C 2. Actúa una enzima, la aconitasa que cataliza la formación de isocitrato con formación de un compuesto intermedio el cis-aconitato. En esta reacción se produce pérdida, y posterior adición de agua. H2O OH COOH CH2 C CH2 COOH citrato COOH COOH CH2 C CH COOH COOH cis-aconitato 31 H2O COOH CH2 CH CH COOH OH COOH isocitrato 3. Se produce una oxidación del isocitrato y pérdida de CO 2 . La reacción es catalizada por la isocitrato-deshidrogenasa ligada al NAD , que requiere Mg ó Mn para su actividad. CO2 COOH CH2 CH CH COOH OH O COOH NAD+ isocitrato COOH CH2 NADH2 La reacción transcurre con gran descenso de exergónica. CH2 C COOH alfa-cetoglutarato Gº es una reacción altamente 4. La oxidación de alfa-cetoglutarato a succinato se produce en dos etapas. a. En la primera el alfa-cetoglutarato experimenta una decarboxilacíón oxidativa para formar succinil-S-CoA y CO 2 . Esta reacción es comparable a la de la oxidación del piruvato a CoA y se produce por el mismo mecanismo con intervención de: + NAD + pirofosfato de tiamina ácido lipoico FAD que participan como cofactores necesarios ligados a la enzima succinil-CoAsintetasa. b. El producto final de la reacción la succinil-CoA que es un tioéster de elevado contenido energético, experimenta pérdida de su grupo CoA, pero no por una simple reacción de hidrólisis sino por una reacción con el GDP y fosfato en el que se conserva la energía. succinil-CoA + Pi + GDP succinato + CoA SH + GTP A continuación el GTP formado en esta reacción cede terminal al ADP para formar ATP. GTP + ADP GDP + ATP La reacción es catalizada por la nucleósido-difosfoquinasa. Este tipo de fosforilación se designa como fosforilación a nivel de sustrato, para distinguirla de las fosforilaciones ligadas a la cadena respiratoria. 5. El succinato es oxidado a fumarato en una reacción catalizada por la succinatodeshidrogenasa que contiene FAD como coenzima que actúa como aceptor de 32 hidrógeno. COOH CH2 CH2 COOH + FAD COOH CH succinato CH COOH + FADH2 fumarato 6. Se produce una hidratación del fumarato dando malato, actuando coma catalizador la fumarasa. OH COOH CH CH COOH + H2O COOH Fumarato C CH2 H Malato COOH 7. En la última reacción del ciclo la malato-deshidrogenasa dependiente del NAD cataliza la oxidación del malato a oxalacetato. OH COOH C O CH2 + COOH + NAD COOH C CH2 COOH + NADH2 H Malato Oxalacetato Podemos ahora resumir los productos producidos en una vuelta del ciclo del ácido tricarboxílico. Dos átomos de carbono aparecen en forma de CO 2 equivalentes, aunque no idénticos, a los dos átomos de carbono del grupo acetilo que ingresa en el ciclo. Por deshidrogenación enzimática se producen cuatro pares de átomos de hidrógeno, tres pares se utilizan para reducir el NAD y uno para reducir el FAD. En último término, estos cuatro pares de átomos de hidrógeno y electrones se combinan con el oxígeno, una vez realizado su transporte a lo largo de la cadena respiratoria. RUTA DEL FOSFOGLUCONATO O VIA DE LAS PENTOSAS Muchas células disponen, además del ciclo del ácido tricarboxílico, de otra ruta de degradación de la glucosa cuya primera reacción es la oxidación de la glucosa-6fosfato a 6-fosfato gluconato. La ruta del fosfogluconato, conocida como ruta de los fosfatos de pentosa o desviación del monofosfato de hexosa, no es una ruta principal de oxidación de la glucosa. Su objetivo primordial, en la mayor parte de las células, es obtener NADP reducido en el citoplasma extramitocondrial. Una segunda función es la producción de pentosas en especial D-ribosa, que se emplea en la síntesis de ácidos nucleicos. Otra función importante consiste en participar en la formación de glucosa, a partir del CO 2 , en las reacciones de fotosíntesis. Las diversas etapas de la ruta del fosfogluconato tienen lugar en la porción soluble del citoplasma extramitocondrial de la célula. 33 1. La primera reacción de la ruta del fosfogluconato es la deshidrogenación enzimática de la glucosa-6-fosfato por la glucosa-6-fosfato deshidrogenasa para formar 6-fosfogluconato. H C OH H C OH H C O COOH C OH O + NADP+ HO C H H C OH H C O +NADPH HO C H H C OH H C CH 2OPO 3= 2 CH 2OPO 3= glucosa-6-fosfato H C OH HO C H HC OH HC OH CH2 O PO 3= 6-fosfogluconato-lactona 6 Fosfogluconato La enzima es específica para el NADP como aceptor electrónico. Realiza la deshidrogenación del átomo de carbono 1 de la forma piranosa de la glucosa-6-fosfato y rinde la 6-fosfogluconato lactona. Esta última es inestable y experimenta hidrólisis espontánea a ácido libre en presencia de una lactonasa. 2. En la etapa siguiente el 6-fosfogluconato experimenta una decarboxilación oxidativa por acción de la 6-fosfogluconato-deshidrogenasa y se forma una pentosa la D-ribulosa-5-fosfato, reacción que produce una segunda molécula de NDAHP2 . CH2 OH COOH H C C O OH H COH H HO C C OH + NADP+ H COH + NADPH2 + CO2 H CH 2OPO 3= H C OH CH 2OPO 3= 6-fosfogluconato ribulosa-5-fosfato 3. Por acción de la fosfo-pentosaepimerasa la ribulosa-5-fosfato se transforma reversiblemente en xilulosa-5-fosfato, su epímero en el átomo de carbono 3. Por acción de la fosfo-pentosa-isomerasa, la ribulosa-5-fosfato, puede convertirse, también reversiblemente, en su isómero aldo, la ribosa-5-fosfato que puede emplearse en la síntesis de los nucleótidos que contienen pentosa y el ARN. 34 CH2 OH C O xilulosa-5-fosfato HO C H CH2 OH HC C O H C OH H C OH m epi sa era OH CH 2OPO 3= CHO CH 2OPO 3= iso me ras a ribulosa-5-fosfato HC OH H C OH H C OH ribosa-5-fosfato CH 2OPO 3= En ciertas circunstancias, la ruta del fosfogluconato finaliza en este punto, y entonces su ecuación global se escribe así: glucosa-6-fosfato + 2NADP+ + H2O ribosa-5-fosfato + CO2 + 2NADPH2 El resultado neto es la producción del NADPH necesario para las reacciones biosintéticas de reducción en el citoplasma extramitocondrial, y la formación de ribosa como precursor para la síntesis de nucleótidos. En otras circunstancias, sin embargo, la ruta del fosfogluconato continúa más allá, ya que las pentosas-5-fosfato pueden experimentar otras transformaciones que son posibles gracias a dos enzimas adicionales: la transcetolasa y la transaldolasa. *La transcetolasa que contiene pirofosfato de tiamina íntimamente unido como coenzima y Mg , realiza la transferencia de un grupo glicoaldehído desde la xilulosa-5-fosfato a la ribosa 5 fosfato. En este proceso el grupo glicolaldehído ( CH2 OH CO ) se transfiere en primer lugar al pirofosfato de tiamina unido a la enzima, que actúa como transportador intermediario del grupo glicolaldehído, que a continuación es transferido a la molécula del aceptor, la ribosa-5-fosfato. El resultado neto consiste en la formación de un ceto-azúcar de 7 átomos de carbono, la sedo heptulosa-7-fosfato, y un azúcar de 3 átomos de carbono, el glicer aldehído-3fosfato. CH2 OH C O HO C H H C OH CHO CH2 OH HCOH + CH 2OPO 3= C O C H H C OH H C OH HC OH CH 2OPO 3= HC OH HC OH HO + CHO HC OH CH2 O PO 3= CH2 O PO 3= Debe observarse que uno de los productos de la acción de la transcetolasa es el xilulosa-5-P ribosa-5-P sedoheptulosa-7-P gliceraldehído-3-P 35 gliceraldehído-3-P que es un intermediario de la secuencia glicolítica. Su formación constituye un lazo de conexión entre la vía glicolítica y la del fosfogluconato. *La segunda enzima que participa en transformaciones ulteriores de la vía del fosfogluconato es la transaldolasa, que actúa sobre los productos de la reacción catalizada por la transcetolasa Cataliza la transferencia del grupo dihidroxiacetona correspondiente a los átomos de carbono 1-2-3 de la sedoheptulosa para formar un azúcar de 6 átomos de carbono, la fructosa-6-fosfato, y otro azúcar de 4 átomos de carbono, la eritrosa-4-fosfato. CH2 OH CH2 OH C O C O HO C H HO C H H C OH H C OH H C OH H C OH H C OH CH2 O CHO + H C OH CH2 O PO 3= CHO + HC OH HC OH CH2 O CH2 O PO 3= PO 3= PO 3= La fructosa-6-fosfato, es también un intermediario de la glicólisis y por lo tanto, el segundo punto de conexión entra las dos rutas: glicolítica y fosfogluconato. Otra reacción destacada que cataliza la transcetolasa es: xilulosa-5-P + eritrosa-4-P fructosa-6-P + gliceraldehído-3-P En la que dos intermediarios de la vía del fosfogluconato pueden convertirse en intermediarios de la vía glicolítica. Una consecuencia importante de la acción de las dos enzimas, consiste en que hacen posible, junto con las enzimas de la secuencia glicolítica la interconversión de los azúcares. La última parte de la vía del fosfogluconato no es bien definida, no conduce a un único producto final, sino a una ruta ramificada, capaz de gran flexibilidad metabólica. Es probable que la ruta del fosfogluconato normalmente se reúna con el ciclo glicolítico por interconversión en intermediarios de la glicólisis. 36 TEMA XVI: TRANSPORTE DE ELECTRONES Y FOSFORILACION OXIDATIVA Reacciones de óxido reducción. Enzimas de óxido-reducción. Vía de transporte de electrones: la cadena respiratoria. Energética del transporte de electrones. Fosforilación oxidativa. Acoplamiento de la fosforilación oxidativa al transporte de electrones. Veremos en este capítulo que los pares de electrones derivados de los intermediarios del ciclo del ácido tricarboxílico fluyen a lo largo de una cadena de varios eslabones, constituidos por enzimas de transporte electrónico, con niveles de energía sucesivamente inferiores hasta reducir al oxígeno molecular, que es el último aceptor electrónico, en la respiración. Durante este proceso se conserva gran parte de la energía libre de estos electrones en forma de energía del enlace fosfato del ATP; el proceso se denomina fosforilación oxidativa. El transporte electrónico y la fosforilación oxidativa suceden en casi todas las células aerobias, las enzimas que catalizan estas reacciones se hallan localizadas en la membrana interna de las mitocondrias. Reacciones de oxidación-reducción Antes de referirnos a oxidaciones biológicas, veremos que se entiende por oxidación y reducción. a. Si el hierro (Fe) reacciona con el oxígeno 4Fe + 3O2 2Fe2 O3 Este proceso de ganancia de oxigeno se denomina oxidación y lo inverso o sea la pérdida de oxígeno, reducción. b. Si se combina un elemento con otro distinto al oxígeno. Znº + Cu++ SO4= Zn++ SO4= + Cu Lo que ocurrió es lo siguiente: el Zn es neutro, de él se desprenden una pareja de electrones y se convierte en ión Zn. Zn carga 0 Zn++ carga 2 Se produce una oxidación del Zn porque de carga 0 pasa a carga 2. A su vez el ión Cu capta los electrones. Cu++ + 2ecarga 2 Cu metalico carga 0 El cobre se reduce de carga 2 pasa a 0. 37 Resumiendo: 1. La pérdida de electrones se denomina oxidación. 2. La ganancia de electrones se denomina reducción. c. En compuestos orgánicos el proceso de oxidación se acompaña de pérdida de hidrógeno o ganancia de oxígeno. H H C H H2O H -2H H C H OH H H metano metanol -2H H C H H2O O -2H H C O ácido metanoico metanal -2H CO 2 anhídrido carbónico El carbono llega a su grado máximo de oxidación. O sea que la pérdida de átomos de hidrógeno o deshidrogenación equivale también a una oxidación y el proceso inverso a una reducción. oxidación ganancía de oxígeno pérdida de electrones pérdida de hidrógeno reducción pérdida de oxígeno ganancia de electrones ganancia de hidrógeno Las reacciones de oxidación-reducción son aquellas en que tiene lugar una transferencia de electrones, desde un dador electrónico (el reductor) hasta un aceptor electrónico (el agente oxidante u oxidante). Es decir que siempre que hay pérdida de electrones por un átomo se produce una transferencia de electrones a otro átomo. O sea que la oxidación y la reducción son simultáneas. Ared. + Boxid. Aoxid. + Bred. Al equilibrio entre la forma reducida y oxidada se llama sistema de óxido reducción o sistema redox. La tendencia de un agente reductor a perder electrones se puede expresar mediante el potencial de reducción estándar. Es decir colocando la especie oxidante y reductora a concentración 1.0 M, pH = 7, y a 25º C. Para medir el potencial se establece como patrón de referencia el potencial de reducción del H 2 en la siguiente reacción. H2 2H+ + +2e- El cual por convención se ha establecido que es igual a 0,0 voltios, cuando la 38 presión de H 2 gaseoso es de 1,0 atmósfera, la concentración 1,0 M, el pH 0,0 y temperatura 25º C. Cuando se corrige este valor a pH 7,0 el potencial estándar del sistema hidrógeno-ión hidrógeno es de -0,42 voltios. Potenciales de reducción estándar de algunos pares redox Reductor Oxidante E’ voltios Acetaldehído Acetato - 0.60 H2 2H - 0.42 α cetoglutarato + Isocitrato - 0.38 CO 2 NAD + H NAD - 0.32 Lactato NADH – deshidrogenasa (reducida) Citocromo b Piruvato - 0.19 Oxidada - 0.11 Fe (II) Fe (III) 0.00 Fe (II) Fe (III) + 0.26 H2 O ½ O2 + 0.82 Citocromo c Los sistemas que poseen un potencial estándar de reducción más negativo que el + del par H2 2H muestran mayor tendencia a perder electrones que el hidrógeno. Los que poseen potencial más positivo tienen menor tendencia a perder electrones. Obsérvese la pareja agua-oxígeno: posee un potencial estándar de reducción fuertemente positivo. 1/2 O2 H2O + 2 H+ + +2e- Por dicha razón el agua muestra muy poca tendencia a perder electrones y a formar oxígeno molecular. Dicho de otro modo, el oxígeno molecular tiene gran afinidad por los electrones, superior que la de aceptores biológicos de electrones tales como el NAD , las flavoproteínas y los citocromos. Cadena respiratoria: Sustrato reducido Sustrato oxidado NAD+ FADH2 FAD+ NADH2 CoQ CoQH2 Fe++ Fe+++ Fe++ cit. b c a+ a3 Fe+++ Fe++ ATP ATP H + Fe+++ 2H ATP 39 2H+ + 1/2 O2 H2O En el proceso un sustrato que se va a oxidar entrega sus electrones H al primer constituyente de la cadena que es el NAD y se reduce. El NADH H entrega sus hidrógenos y respectivos electrones a una flavoproteína y ésta a la coenzima Q, que desempeña el papel de transportador electrónico entre las deshidrogenases ligadas al NAD y FAD y los citocromos. De aquí en adelante lo que se transfieren ya son electrones y los H irán al medio. Los electrones son captados por el citocromo b, c y a + a3. Este último es autooxidable y entrega los electrones al 1/ 2 O 2 que con los H formará H2 O . Enzimas de óxido-reducción: Tres son las clases principales de enzimas que participan de la corriente del transporte electrónico desde los sustratos orgánicos hasta el oxígeno molecular. De acuerdo al orden en que participan son los siguientes: 1. Deshidrogenasas ligadas a la piridina que requieren NAD o NADP como coenzima. Participan en la primera parte del eslabón: Sustrato reducido NAD+ Sustrato oxidado NADH + H+ 2. Deshidrogenasas ligadas a la flavina que tienen como grupo prostético al FAD o al FMN. Participan en la segunda parte del eslabón FADH + H CoQ CoQH + H + FAD 3. Los citocromos que contienen un sistema nuclear ferroporfirínico. Participan en la última parte del eslabón Fe++ Fe+++ Fe++ cit. b c a+ a3 Fe+++ Fe++ Fe+++ 2H+ + 1/2 O2 H2O Analizamos cada una de las enzimas con sus respectivas coenzimas: 40 Deshidrogenasa ligada a la piridina: Se conocen alrededor de 150 y catalizan la siguiente reacción: Sustrato reducido + NAD+ Sustrato oxidado + NADH + H+ Las deshidrogenases ligadas a la piridina transfieren reversiblemente dos equivalentes de reducción desde el sustrato a la forma oxidada del nucleótido piridínico; uno de ellos aparece en el nucleótido reducido como un átomo de hidrógeno. El otro átomo de hidrógeno separado del sustrato aparece en forma de H libre en el medio. Veamos la estructura del NAD: O HO + P O O H2C O adenina H H OH OH CONH 2 HO + P O O + O H2C N H H OH OH La parte activa de los nucleótidos piridínicos es la nicotinamida, ya que ésta es la porción de la molécula que va a recibir el hidrógeno del sustrato. Es importante destacar que la nicotinamida es una vitamina del complejo B. O sea que por su participación en los mecanismos de óxido-reducción cumplen un papel fundamental en la célula. El mecanismo de óxido-reducción se realiza según el siguiente esquema: H H CONH CONH 2 + H+ + 2H + 2 N N R R 41 Deshidrogenases ligadas a la flavina: Esta clase de enzimas contienen flavín-adenín-dinucleótido (FAD) o bien flavínmononucleótido (FMN) como grupos prostéticos. En la mayor parte de las flavíndeshidrogenasas el nucleótido flavínico se halla firmemente unido y no se separa de la enzima durante el ciclo catalítico. Veamos la estructura del FMN: 6-7 dimetil-iso-aloxacina CH2 CH2 CH2 riboflavina (vitamina B2) CH2 CH2 O HO P FDN OH + O O P O OCH2 O adenina H H OH OH H FDN: resulta de la unión pirofosfórica entre el FMN y el AMP. La parte activa del FAD y del FMN es el anillo de isoaloxacina. H O H N CH3 O H N CH3 N N CH3 CH3 N N R O N N R H O En cuanto a la coenzima Q o ubiquinona existen controversias. Importantes experimentos recientes permiten creer que la CoQ es realmente uno de los transportadores de la cadena respiratoria, y que funciona, posiblemente, como una molécula liposoluble que actúa a modo de nexo de unión entre las flavoproteínas y el sistema de los citocromos. Citocromos: Los citocromos son un grupo de ferroproteínas transferidoras de 42 electrones en las células aerobias, que actúan secuencialmente transfiriendo electrones desde las flavoproteínas al oxígeno molecular .Todas ellas contienen grupos prostéticos ferroporfirínicos; en este aspecto se parecen a la hemoglobina y a la mioglobina. Los citocromos experimentan cambios de valencia reversibles, Fe (II) Fe (III), durante el ciclo catalítico. El citocromo terminal de la cadena, que puede reaccionar con el oxígeno, es la citocromo-oxidasa. Las formas reducidas de los demás citocromos no pueden reoxidarse directamente por el oxígeno molecular. Estructura: Los citocromos tienen grupos prostéticos hierro porfirínicos. El anillo porfirínico deriva del compuesto tetrapirrólico llamado porfina que se designa según sus cadenas laterales sustituyentes. HC CH N N Fe Fe ++ +++ HN N HC CH Forman quelatos (literalmente, cuatro dientes) con iones metálicos como el hierro, por ejemplo. En los citocromos, el átomo de Fe experimenta cambios reversibles entre las formas Fe (II) y Fe (III); su función real es la de desempeñar el papel de transportadores electrónicos. Potencial estándar de óxido-reducción en la cadena respiratoria Los potenciales de reducción de los diferentes transportadores electrónicos, se hacen más positivos a medida que los electrones pasan desde el sustrato el oxígeno. Es decir, que el transportador electrónico más próximo el extremo inicial de la cadena, o sea el NAD es el término más reducido, mientras que los transportadores situados en el extremo del oxígeno (citocromo a + a3) están casi por completo en la forma oxidada. Los transportadores intermedios en estados sucesivamente más oxidados, según una escala que va desde el sustrato hasta el oxígeno. Energética del transporte electrónico-Fosforilación oxidativa Hemos visto que el Gº que se produce en el transcurso de cualquier reacción química es función de su constante de equilibrio. Gº RT Ink eq 43 Puede utilizarse una forma modificada de esta expresión para calcular la Gº que se produce cuando reaccionan entre sí dos pares de óxido-reducción cuyos potenciales de reducción estándar son conocidos. Gº nFT E '0 Gº = variación de energía libre estándar expresada en calorías; n = número de electrones transferidos; F = equivalente calorífico de Faraday; E' 0 = la diferencia entre los potenciales de reducción estándar del aceptor del dador electrónico. Se supone que todos los componentes se hallan a concentraciones 1, 0 M, a 25º C y pH = 7,0 Mediante esta relación, podemos calcular la Gº cuando se transfiere un par equivalentes electrónicos desde el NADH al oxigeno molecular, es decir a lo largo de toda la cadena respiratoria. Gº 2 23062 0.82 0.32 52.700 kcal 52.7 kcal Se produce, por tanto, una variación de energía libre muy grande durante el proceso de transporte electrónico desde el NADH hasta el oxígeno molecular, a través de la cadena respiratoria. Este valor puede compararse con la energía libre estándar de formación de ATP a partir del ADP y el fosfato. ADP + FOSFATO ATP + H2O Gº 7.3 kcal Puede verse que la transferencia de un par de electrones, desde el NADH al oxígeno va acompañada de una disminución de energía libre lo suficientemente grande para que resulte posible la síntesis de varias moléculas de ATP, a partir de ADP y de fosfato, en las condiciones estándar, siempre que se disponga de un mecanismo de acoplamiento. Mediante cálculos semejantes se obtienen las Gº que tienen lugar en cada una de las etapas principales de transferencia electrónica en la cadena respiratoria, cuyos potenciales de reducción estándar son conocidos. Tres de los pasos de la cadena respiratoria muestran Gº relativamente grandes; ellos son: 1. Entre NAD y FAD 2. Entre citocromo b y c 3. Entre citocromo a y el oxígeno En cada uno de ellos se produce una disminución de energía libre suficientemente grande para que se origine la formación acoplada del ATP a partir de ADP y de fosfato. Las Gº en otros puntos de la cadena son pequeñas y, por ello resultan insuficientes para provocar la formación de una molécula de ATP. 44 Acoplamiento de la fosforilación oxidativa al transporte electrónico La fosforilación del ADP acoplado a la respiración representa un mecanismo de recuperación aerobia de energía y recibe el nombre de fosforilación oxidativa. La ecuación global para las fosforilaciones de la cadena respiratoria puede escribirse como sigue: NADH + H+ + 3 ADP + 3 Pi + +1/2 O2 NAD+ + 4 H2O + 3 ATP que podemos analizar desde el punto de vista de su componente exergónico. NADH + H+ + 1/2 O2 NAD+ + H2O Gº 52.7 kcal y de su componente endergónico: 3 ADP + 3 Pi 3 ATP + 3 H2O Gº 3 7.3 21.9 kcal La fosforilación oxidativa acoplada de tres moléculas de ATP conserva por lo tanto 21,9/52,7 x 100, es decir, alrededor del 40% del descenso total de energía libre. Sólo se formarán 3 moléculas de ATP si el sustrato se oxida a nivel del NAD. Puede ocurrir que el sustrato entregue sus electrones a la flavoproteina (por ej. succinato) en este caso se producen 2 moléculas de ATP; y si entrega sus electrones al citocromo a, (por ej. ácido ascórbico) se forma solamente una molécula de ATP. Balance energético de un proceso de respiración Es decir, el Gº , cuando la glucosa se oxida completamente hasta CO2 H2 O por la secuencia glicocolítica y el ciclo del ácido tricarboxílico. 1. glucosa a 2 piruvato glucosa + 2 Pi + 2 ADP + 2 NAD+ 2 piruvato + 2 NADH + H+ + 2 ATP + 2 H2O 2. 2 piruvato 2 acetil CoA 2 (piruvato + NAD+ + HS - CoA) 2 acetil CoA + 2NADH + 2H+ + 2CoA2 NADH H se reoxida en la cadena respiratoria y se producen 3 ATP; como son 2 moleculas de NADH + H+ 3 ATP x 2 = 6 ATP 3. Ciclo de Krebs se producen 24 ATP a. 2 isocitrato 2 alfa-cetoglutarato hay deshidrogenación, los H 2 son captados por el NAD que se reoxida en la cadena respiratoria y se 45 producen 6 ATP. H2O b. 2 alfa-cetoglutarato también se producen 6 ATP. c. 2 malato H2 2 succinato, ocurre lo mismo, o sea que 2 oxalacetato 6 ATP. H2 d. 2 succinato 2 fumarato. En este caso los hidrógenos son captados por el FAD. Se producen 4 ATP. e. 2 succinato CoA 2 succinato, hay una fosforilación a nivel de sustrato de producen 2 ATP. Resumiendo: a ………….. 6 ATP b ………….. 6 ATP c ………….. d ………….. e ………….. 6 ATP 4 ATP 2 ATP 24 TP 4. El NAD H que se produce en la glicólisis en el pasaje de gliceraldehído 3 P 3 P glicerato , cuando el proceso es anaerobio se reoxida en el pasaje de piruvato lactato . Cuando el proceso es aerobio el NADH H se reoxida en la cadena respiratoria, por lo tanto se producen 2 ATP x 2 (porque son dos moléculas de NADH H ) = 4 ATP. O sea que el balance global será: 1. ………….. 2 ATP 2. .………….. 6 ATP 24 3. ………….. ATP 4. ………….. 4 ATP 36 ATP glucosa + 6 O2 + 36 Pi + 36 ADP 6 CO2 + 36 ATP + 42 H2O Si analizamos el componente exergónico glucosa + 6 O2 6 CO2 + 6 H2O Gº 680 kcal componente endergónico 36 Pi + 36 ADP 36 ATP + 36 H2O Gº 263 kcal La eficacia global de la recuperación de energía resulta ser: 46 263 100 680 39% ¿Cómo entra el NADH producido en la glicólisis a la cadena respiratoria? El NADH 2 citoplasmático producido en la glicólisis es impermeable a la membrana mitocondrial, por lo tanto si no penetra en la mitocondria no se puede reoxidar a nivel de la cadena respiratoria. Aunque el NADH no puede penetrar, sus electrones pueden hacerlo por medios indirectos denominados lanzaderas. La mejor conocida es la lanzadera del glicerolfosfato. El NADH citoplasmático reacciona con la dihidroxiacetona citoplasmática para formar glicerol-3-fosfato en una reacción catalizada por la glicerofosfato-deshidrogenasa citoplasmática. dihidroxiacetona fosfato + NADH + H+ glicerol-3-fosfato + NAD+ El glicerol-3-fosfato atraviesa fácilmente la membrana mitocondrial. En el interior de la mitocondria otra glicero-3-fosfato-deshidrogenasa reoxida el glicerol-3-fosfato a dihidroxiacetona fosfato. dihidroxiacetona fosfato + FADH2 glicerol-3-fosfato + FAD La flavoproteína reducida cede sus equivalentes de reducción a la cadena respiratoria a nivel de CoQ y finalmente pasan al oxígeno. La dihidroxiacetona fosfato formada en esta reacción difunde fuera de la mitocondria el citoplasma en donde puede aceptar electrones de otra molécula de NADH extramitocondrial. NADH + H+ NAD+ DIHIDROXICETONA-P GLICEROL-FOSFATO NAD FAD ATP ATP MITOCONDRIA O2 47 TEMA XVIII: Oxidación de los ácidos grasos Hidrólisis intracelular de los lípidos. Ciclo de oxidación de los ácidos grasos: activación y entrada de los ácidos grasos a la mitocondria. Primera deshidrogenación. Hidratación. Segunda deshidrogenación. Clivaje tiólico. Oxidación de los ácidos grasos insaturados. Cuerpos cetónicos y su oxidación. Oxidación de los ácidos grasos de carbono impar. Aunque los hidratos de carbono, a causa de su abundancia constituyen el combustible principal para la mayor parte de los organismos, los ácidos grasos desempeñan también un papel muy destacado como fuente energética. La oxidación de los ácidos grasos es importante en los animales superiores y en las plantas, que pueden almacenar cantidades grandes de grasa neutra como combustible de reserva. La grasa neutra posee un valor calorífico elevado (9 Kcal) y puede almacenarse en forma casi anhidra en las gotitas de grasa intracelulares, mientras que el glucógeno o el almidón (valor calórico = 4 Kcal) se hallan demasiado hidratados para poder almacenarse en forma tan concentrada. Hidrólisis intracelular de los lípidos Los ácidos grasos que experimentan oxidación en los tejidos de los animales superiores provienen del fluido extracelular o bien de los lípidos intracelulares endógenos. La sangre de los vertebrados contiene cantidades considerables de triacilgliceroles y de fosfoglicéridos, así como cantidades muy pequeñas de ácidos grasos libres unidos a la proteína seroalbúmina, que actúa transportando los ácidos grasos. Estos últimos son oxidados en tejidos tales como el corazón y el músculo. La fuente endógena principal de ácidos grasos combustibles es grasa de depósito, en foma de gotitas de grasa del citoplasma, constituido, en su mayor parte por triacilgliceroles. Resumiendo lo expuesto: a. fluido extracelular Ácidos grasos a oxidarse provienen de la sangre que contiene triacilgliceroles, fosfoglicéridos, ácidos grasos 1. grasa de depósito constituida por triacilgliceroles. b. fuente endógena 2. fosfoglicéridos de las membranas A. Hidrólisis intracelular Los ácidos grasos deben hallarse en forma libre, es decir, no esterificados para que puedan experimentar el proceso de activación y oxidación. Para ello, deben en primer lugar, hidrolizarse por la acción de lipasas intracelulares para rendir ácidos grasos libres y glicerina. Se sabe relativamente poco acerca de la secuencia y 48 detalles de la hidrólisis intracelular de los lípidos. Sin embargo, en general, no tiene lugar acumulación significativa de ácidos grasos o de otros productos de hidrólisis que serían tóxicos para la estructura de la membrana. Evidentemente, la velocidad y la ruta de hidrólisis de los lípidos intracelulares está ajustada a la velocidad de utilización de los ácidos grasos. B. Ciclo de los ácidos grasos Activación y penetración de los ácidos grasos en el interior de la mitocondria Existen 3 fases en la entrada de los ácidos grasos procedentes del citoplasma extramitocondrial, en el interior de la mitocondria. 1. Esterificación enzimática del ácido graso libre con la CoA extramitocondrial, a expensas del ATP, que tiene lugar en la membrana exterior. 2. Transferencia del grupo acilo graso desde la CoA a la molécula transportadora carnitina, la cual lo conduce a través de la membrana interior. 3. Transferencia del grupo acilo graso desde la carnitina a la CoA intramitocondrial. Activación de los ácidos grasos Tres enzimas diferentes catalizan la formación de ésteres acil-CoA graso; cada una de ellas se específica para un determinado intervalo de longitud de cadena de ácido graso. Acetato-tioquinasa Activa los ácidos acético, propiónico y acrílico Tioquinasa de ácido graso de cadena media Activa los ácidos grasos desde cuatro hasta doce átomos de carbono Tioquinasa de ácido graso de cadena larga Activa los ácidos grasos de 12 a 22 o más; átomos de carbono Las últimas dos tioquinasas activan tanto los ácidos grasos saturados como los no saturados. Las tres se encuentran en la membrana exterior de la mitocondria. Las propiedades y mecanismos de las tres tioquinasas, son más o menos idénticos. La reacción global catalizada por las tioquinasas ligadas al ATP es la siguiente: O R COOH + ATP + CoA SH R CH SCoA + AMP + PPi A medida que el enlace tioéster se forma entre el grupo carboxilo del ácido graso y el grupo tiol de la CoA, el ATP experimenta ruptura pirofosfórica y rinde AMP PPi . A su vez el PPi formado resulta hidrolizado por la pirofosfatasa inorgánica. 49 PPi + H2O 2 Pi El efecto neto de esta hidrólisis es la utilización de dos enlaces fosfato de elevada energía para impulsar el equilibrio global de la etapa de activación a la formación de acil CoA graso. Transferencia de carnitina Los ácidos grasos superiores poseen una capacidad limitada para atravesar la membrana interior de la mitocondria en forma de ésteres de CoA; pero su entrada es estimulada por la carnitina. En el proceso actúa una enzima la acil-CoA graso: carnitin transferasa de ácido graso, que cataliza la transferencia del grupo acilo graso desde su enlace tioéster con la CoA, a un enlace éster con la carnitina que es un enlace de elevada energía. CH3 CH3 + N O CH2 CH CH3 CH2 COOH + R C S CoA OH CH3 CH3 + N CH3 CH2 CH CH2 COOH + CoA SH O C O R El compuesto carnitín-O-acilo graso, así formado, atraviesa con facilidad la membrana interna de la mitocondria; no se sabe si el paso se realiza por simple difusión o con intervención de algún mecanismo transportador de la membrana mitocondrial. Transferencia de la CoA intramitocondrial En la última etapa del proceso de penetración, el grupo acilo graso es transferido desde la carnitina a la CoA intramitocondrial por acción de la carnitín-transferasa de ácido graso intramitocondrial. acil-graso-carnitina + CoA SH acil-graso-CoA + carnitina Este mecanismo de entrada ejerce el efecto de mantener separada la CoA extramitocondrial de la intramitocondrial. El acil-graso-CoA se emplea entonces 50 como sustrato para el ciclo de oxidación del ácido graso, que tiene lugar en el compartimiento interno de la matriz. Las mitocondrias contienen otro tipo de aciltioquinasas que participan en la activación del ácido graso. Esta enzima necesita GTP en lugar de ATP y produce GDP Pi . O R GTP + RCOOH + CoASH C SCoA + GDP + Pi Puesto que la carnitina no es necesaria para su acción, probablemente está implicada en la activación de los ácidos grasos libres formados en el interior de las mitocondrias. C. Primera etapa de deshidrogenación A continuación de la etapa de activación, las reacciones de oxidación del ácido graso tienen lugar en el compartimiento interior de la mitocondria. El éster formado experimenta la deshidrogenación enzimática en los átomos de carbono alfa y beta, es decir, en los átomos de carbono 2 y 3, para formar un acil-graso-CoA no saturado. La posición del doble enlace se designa mediante el símbolo 2,3 . Existen cuatro clases diferentes de deshidrogenasas de acil CoA graso que contienen FAD, cada una de las cuales es específico para un determinado intervalo de longitud de cadena del ácido graso. O 2 R CH2 3 CH2 C SCoA acil-graso CoA + E R C FAD oxi. H O C C SCoA 2,3 trans-enoil CoA + E FAD red. H El enlace no saturado 2,3 formado en esta reacción es el isómero geométrico trans. Los electrones del FAD red. son cedidos a la cadena respiratoria. D. Etapa de hidratación La hidratación reversible del doble enlace de los ésteres 2,3 enoílicos del CoA para formar beta-hidroxiacil-CoA es catalizada por la enzima enoil-hidratasa. 51 R CH2 C H O C C S CoA 2,3 trans-enoil CoA H OH R CH2 O C CH2 C hidroxi-acil-CoA SCoA H E. Segunda etapa de deshidrogenación El compuesto obtenido se deshidrogena para formar un 3-oxoacil-graso-CoA, con intervención de la -hidroxiacil-graso-CoA-deshidrogenasa siendo el NAD el aceptor electrónico específico. OH R CH2 C O CH2 SCoA + NAD+ C H O R CH2 C O CH2 + SCoA + NADH + H C El NADH cede sus electrones a la NADH deshidrogenasa de la cadena respiratoria. Etapa de ruptura tiólica En la última etapa de la secuencia de la oxidación del ácido graso, que es catalizada por la tiolasa, el 3 oxoacil-graso-CoA experimenta una escisión por interacción con una molécula de CoA libre para producir un fragmento de dos carbonos que contiene el carboxilo terminal en forma de acetil-CoA libre, y el éster del CoA de un ácido graso cuya cadena se ha acortado en dos átomos de carbono. O R CH2 C O CH2 C SCoA + CoA O O R CH2 C SH SCoA + CH3 C SCoA La reacción es muy exergónica, y el equilibrio favorece por tanto la ruptura. Balance de la oxidación Con la reacción de tiólisis se ha completado una vuelta de la secuencia de oxidación del ácido graso, en la que una molécula de acetil-CoA, y dos pares de átomos de hidrógeno resultan eliminados de un acil-CoA graso de cadena larga. La ecuación 52 global de una vuelta de la secuencia de oxidación del ácido graso actuando sobre el palmitoil-CoA es la siguiente: palmitoil + CoA + FAD + NAD+ + H2O CoA miristoil CoA + acetil CoA + FADH2 + NADH + H+ Ahora podemos escribir la ecuación para las siete vueltas del espiral necesarias a fin de convertir una molécula de palmitoil-CoA en 8 moléculas de acetil CoA (el ácido palmítico tiene 16 átomos de carbono). Cada molécula de FADH 2 cede un par de equivalentes electrónicos a la cadena respiratoria a nivel de la CoA y se generan 2 moléculas de ATP. De modo análogo, la oxidación de cada molécula de NADH da por resultado la formación de 3 moléculas de ATP. Por lo tanto, se forman un total de 5 moléculas de ATP por molécula de acetil-CoA escindido. Podemos escribir ahora la ecuación que también comprende las fosforilaciones: pamitoíl (1) CoA + 7 CoA + 7 O2 + 35 Pi + 35 ADP 8 acetil CoA + 35 ATP + 42 H2O Las 8 moléculas de acetil CoA formadas en el ciclo del ácido graso pueden incorporarse ahora al ciclo de Krebs (2) 8 acetil CoA + 16 O2 + 96 Pi + 96 ADP 8 CoA + 96 ATP + 104 H2O + 16 CO2 Combinando la ecuación (1) y (2) obtenemos la ecuación global: pamitoíl CoA + 23 O2 + 131 Pi + 131 ADP CoA + 16 CO2 + 131 ATP + 146 H2O Puesto que se necesita una molécula de ATP ( o de GTP) para activar el ácido palmítico libre al comenzar, podemos suponer que el rendimiento neto de ATP es de 130 moléculas. Oxidación de los acidos grasos no saturados Los ácidos grasos no saturados, son oxidados por las mismas rutas generales que los ácidos saturados; pero se plantean dos problemas: 1. Los dobles enlaces de los ácidos grasos no saturados existentes en la naturaleza se hallan en la configuración geométrica cis, mientras que los ésteres 2,3 insaturados del acil CoA que actúan como intermediarios en la oxidación de los ácidos grasos saturados, son trans. 2. Los dobles enlaces de la mayor parte de los ácidos grasos no saturados aparecen en posiciones tales que la eliminación sucesiva de fragmentos de dos átomos de carbono rinde un acil-CoA graso 3,4 en lugar de 2,3 . 53 Se ha resuelto este problema con el descubrimiento de una enzima auxiliar, la 3,4 cis- 2,3 -trans-enoil CoA-isomerasa que cataliza el desplazamiento del doble enlace desde la configuración 3,4 -cis a la 2,3 -trans que es el sustrato normal de la siguiente enzima de la secuencia de oxidación del ácido-graso. Cuerpos cetónicos y su oxidación En muchos vertebrados el hígado posee la capacidad enzimática adecuada para desviar algo de acetil-CoA, hacia la formación de acetoacetato y -hidroxibutirato, los cuales son transportados por la sangre a los tejidos periféricos, en donde pueden ser oxidados por el ciclo del ácido tricarboxilico. Estos compuestos reciben el nombre de cuerpos cetónicos. El acetoacetato proviene de la condensación de dos moléculas de acetil-CoA catalizado por la tiolasa. acetil CoA + acetil CoA acetoacetil CoA + HSCoA La acetoacetil CoA experimenta la pérdida de la CoA para transformarse en acetoacetato, proceso conocido como desacilación. La principal ruta para la desacilación es la formación y escisión enzimática del hidroxi- -metil glutaril CoA. CH3 HOOC CH2 C O CH2 C SCoA OH acetoacetil CoA + acetil CoA -hidroxi -metil glutaril CoA + CoA El acetoacetato libre así producido se reduce enzimáticamente hidroxibutirato, por la Beta-hidroxibutirato deshidrogenasa ligada al NAD. acetoacetato + NADH + H+ a Beta- Beta-hidroxibutirato + NAD+ La mezcla de acetoacetato y Beta hidroxibutirato resultante de esta reacción pueden difundir después, fuera de la célula hepática, a la corriente sanguínea y llegar a los tejidos periféricos. Normalmente la concentración de cuerpos cetónicos en la sangre es muy baja, pero a causa del ayuno o por la diabetes puede alcanzar niveles elevados. Esto es debido, a que al no existir glucosa utilizable por la célula, ésta se vale de las grasas, las cuales al degradarse dan como producto acetil CoA en cantidades elevadas. Oxidación de ácidos grasos de número impar de carbonos Estos ácidos grasos raramente se encuentran en la naturaleza. Son oxidados por el ciclo de oxidación del ácido graso. Se separan sucesivamente restos de acetil CoA hasta que se llega a un resto terminal de tres átomos de carbono: propionil-CoA. El propionil CoA experimenta una carboxilación enzimática que lo transforma en metil-malonil CoA que es isomerizado a succinil CoA, que pierde la CoA para rendir succinato que se incorpora al ciclo del ácido tricarboxílico. 54 TEMA XIX: Degradación oxidativa de los aminoácidos Esquema de la oxidación de los aminoácidos. Transaminación y función del piridoxal fosfato. Desaminación oxidativa. Vías de la acetil CoA y del alfacetoglutorato, del succinato, del oxalacetato. Formación de los productos de excreción nitrogenada. Ciclo de la urea. Excreción de amoníaco. Formación de ácido úrico. Aunque la función primordial de los A.A. es la de ser precursores de las proteínas y de otras biomoléculas, se emplean con frecuencia como fuente energética. Los animales superiores oxidan activamente los aminoácidos tanto exógenos como endógenos. Aún cuando no se haya ingerido cantidad alguna de proteínas, los seres humanos pueden excretar hasta 5 grs. de N 2 cada día, que corresponden a la oxidación neta de casi 30 grs. de proteína endógena. El ciclo de los ácidos tricarboxílicos es la ruta definitiva para la oxidación de los esqueletos carbonados de los aminoácidos. En este capítulo describiremos la degradación oxidativa de los aminoácidos normalmente presentes como unidades estructurales de las proteínas, lo que constituye la corriente principal del catabolismo de los aminoácidos. Aunque las reacciones enzimáticas básicas implicadas en el catabolismo aminoácido son en su mayor parte semejantes en todos los organismos, el ritmo real de utilización y la proporción de los diferentes aminoácidos empleados en un organismo determinado dependen de muchos factores que incluyen: La capacidad genética para metabolizar aminoácidos; La asequibilidad de aminoácidos del entorno; La dependencia nutritiva del organismo respecto de los aminoácidos esenciales; La disponibilidad de otros combustibles caloríficos; Las necesidades de aminoácidos del organismo para la síntesis proteica; La necesidad de aminoácidos específicos como precursores de ciertas biomoléculas importantes, tales como purinas, pirimidinas, componentes de la pared celular, hormonas y otras moléculas especializadas. PROTEOLISIS Antes que las proteínas puedan incorporarse a las rutas catabólicas deben experimentar hidrólisis completa hasta transformarse en aminoácidos ya que las moléculas proteicas intactas y la mayoría de los péptidos no pueden atravesar la membrana celular, mientras que los aminoácidos libres son absorbidos fácilmente. Los péptidos extracelulares y las proteínas con frecuencia son hidrolizados por acción de enzimas segregadas al entorno, por ejemplo muchos microorganismos forman y segregan peptidasas y enzimas proteolíticas. Sin embargo, la proteólisis extracelular ha sido estudiada con máximo detalle en el tracto digestivo de los vertebrados (ver proceso en página 460 de Lehninger). Por acción combinada de las enzimas proteolíticas segregadas por el estómago, el páncreas y el intestino delgado, las proteínas ingeridas se hidrolizan por completo hasta aminoácidos, los cuales son absorbidos por las células epiteliales del intestino delgado, mediante un transporte activo que requiere energía. Los aminoácidos son enviados luego a los 55 tejidos por medio de la sangre. Al entrar en las células individuales también por transporte activo, se incorporan a los canales metabólicos. Se sabe muy poco de la proteólisis intracelular, que en algunos tejidos como el hígado, tiene lugar a un ritmo elevado. ESQUEMA DE LA OXIDACION DE LOS AMINOACIDOS Para la oxidación de los 20 aminoácidos diferentes existen 20 secuencias multienzimáticas distintas. En último término todas convergen en unas pocas rutas terminales que conducen al ciclo de los ácidos tricarboxílicos. Los esqueletos hidrocarbonados de 10 de los A.A. son convertidos finalmente en acetil-CoA, ya sea por la vía del piruvato o por la del acetoacil-CoA, cinco se convierten en cetoglutarato, tres en succinil-CoA y dos en oxalacetato. La fenilalanina y la tirosina se degradan de modo que una porción del esqueleto hidrocarbonado se incorpora como acetil-CoA y lo otra como fumarato. Sin embargo no todos los átomos de C de los 20 A.A. se incorporan al ciclo del ácido tricarboxílico ya que algunos se pierden por el camino de la descarboxilación. Las rutas del catabolismo no son necesariamente idénticas a las de la biosíntesis, pero hay algunas etapas que son comunes. Alanina Cisteína Glicocola Serina Treonina Glutamato Piruvato Arginina Histidina Glutamina Prolina Oxoglutarato Isocitrato Isoleucina Leucina Triptófano Succinil-CoA Citrato Isoleucina Metionina Valina Succinato Acetil-CoA Oxalacetato Tirosina Fumarato Acetoacetil-CoA Fenilalamina Malato Fenilalanina Tirosina Leucina Lisina Triptófano Aspartato Asparagina Los grupos -amino de los aminoácidos comparten un destino común, al menos en los vertebrados, los cuales excretan el N 2 amínico en forma de Urea, Amoníaco o de Ácido Úrico, según la especie. Los mecanismos por los cuales los grupos NH2 son eliminados de los A.A. y luego convertidos en cualquiera de los tres productos de excreción, son completamente semejantes. Puesto que la eliminación de los grupos 56 NH2 constituye la primera etapa en la degradación de los A.A., examinaremos ahora los dos procesos principales implicados en esta reacción, ellos son la Transaminación y la Desaminación Oxidativa. TRANSAMINACION Por este proceso el grupo amino de por lo menos 11 aminoácidos es separado enzimáticamente por transaminación y transferido al carbono de uno o tres oxoácidos (piruvato; cetoglutarato o al oxalacetato). Por lo tanto el aminoácido al perder su grupo NH2 se transforma en el oxoácido correspondiente y el -oxoácido que acepta el grupo NH2 se transforma en el aminoácido correspondiente. Dos transaminasas importantes son: la ALANIN-TRANSAMINASA; que cataliza la reacción: oxoácido alanina a minoácido ácido pirúvico y la GLUTANATO-TRANSAMINASA, que cataliza la reacción: a minoácido ácido oxoácido ácido glutámico oxoglutárico Ejemplo de transaminación: O R' H C NH2 R2 + O C COOH R1 C NH2 COOH COOH + R2 C COOH H Cualquiera sea la ruta de transaminación, el -cetoglutarato es el aceptor final de los grupos NH2 de la mayor parte de los A.A. y luego transporta esos grupos NH2 hasta una secuencia final de reacciones mediante las cuales se forman los productos nitrogenados finales o de excreción. Por ejemplo en la reacción anterior la alanin-transaminasa cataliza la formación de alanina a partir de un aminoácido más ácido pirúvico, luego esa alanina le transfiere el grupo NH2 al cetoglutarato por acción de la alanin-glutamato-transaminasa. Alanina ácido ácido pirúvico oxoglutári co ácido glutámico (aceptor final) Las transaminasas se encuentran tanto en el citoplasma como en la mitocondria de las células eucarióticas; las formas mitocondriales y las extramitocondriales difieren en sus propiedades físico-químicas. Todas las transaminasas emplean una misma coenzima y comparten un mecanismo de reacción común. La coenzima es el fosfato de piridoxal, un derivado de la vitamina B 6 , necesario como factor de crecimiento y esencial en la dieta de muchos microorganismos y animales. H C HO H3C CH2 C C C C CH N O O O P OH Fosfato de piridoxal OH El fosfato de piridoxal es también el grupo prostético de cierto número de otras enzimas que catalizan 57 reacciones en las que intervienen -aminoácidos. En principio el fosfato de piridoxal actúa como un transportador de grupos O, en algunos casos de aminoácidos. La clave de acción es su grupo aldehído que puede formar una base de Shiff o cetimina, con amoníaco o con diversas aminas. Durante su ciclo catalítico en las transaminasas, la coenzima experimenta reacciones reversibles entre la forma de aldehído libre (fosfato de piridoxal) y su forma aminada (el fosfato de piridoxamina). Se produce el ciclo en dos etapas: El complejo enzima-fosfato de piridoxal, acepta un grupo amino del dador de grupos NH2 con formación de un complejo enzima-fosfato de piridoxamina; ello ocurre mediante dos bases de Shiff intermedias. El complejo enzima-fosfato de piridoxamina forma una base de Shiff con el aceptor entrante del grupo NH2 , el -oxoácido, al que se cede a continuación el grupo NH2 . NH2 R1 CH H O COOH + E C H2O + H R1 Dador de NH2 H C N C E COOH Base de Shiff I O R1 C N CH2 R1 E COOH C COOH + E CH2 NH2 enzima-fosfato de piridoxamina oxoácido Base de Shiff II O E CH2 NH2 + R2 C R2 COOH oxoácido aceptor de NH2 C N CH2 E COOH Base de Shiff III H R2 C N C NH2 O H E COOH E C H + R2 enzima-fosfato de piridoxal CH COOH aminoácido Base de Shiff IV DESAMINACION OXIDATIVA Este proceso ocurre en la mitocondria y los grupos NH2 recogidos de los diferentes aminoácidos por la acción de las transaminasas, aparecen en el último término en forma de grupos -aminos del L-glutamato. En algunas células, particularmente en las bacterias, el glutamato experimenta una 58 desaminación oxidativa rápida, catalizada por la glutamato-deshidrogenasa ligada a la piridina. oxoglutarato + NH+4 + NADH + H+ L-glutamato + NAD+ Descarga así en forma de iones NH 4 , los grupos aminos recogidos de los demás aminoácidos. La L-glutamato deshidrogenasa puede usar también el NADP como aceptor de electrones, el NADPH así formado, actúa como reductor en las reacciones biosintéticas. La mayor parte de los organismos tienden a reutilizar el NH 4 formado en el catabolismo de los A.A. recuperándolo. cetoglutar ato NH4 NADH H glutamato NAD Glutamato deshidrogenasa RUTAS QUE CONDUCEN AL ACETIL-CoA Treonina Cistina Cisteina Glicocola Serina Alanina Ácido Pirúvico Acetil-CoA El esquema muestra los portales de entrada por los que penetran en el ciclo de los ácidos carboxílicos, los esqueletos carbonados de los diferentes aminoácidos. Las rutas de los 20 A.A. dependen del punto de entrada. El punto principal de entrada en el ciclo es por la vía del acetil-CoA, diez aminoácidos penetran por esta ruta, cinco de ellos se degradan al acetil-CoA por la vía del piruvato y los restantes por la del acetoacetil-CoA. 59 NH2 CH3 CH CH COOH OH Treonina Glicocola H2N CH CH2 O CH3 COOH C H Serinhidroximetil tranferasa OH acetaldehído NAD+ NH 2 ATP Serina CH2 CH OH COOH CoA Serina deshidrasa O Ácido Pirúvico CH3 C NADH + H+ COOH AMP; Pi Piruvato deshidrogenasa O CH3 C S CoA Acetil CoA VIA DEL PIRUVATO Los cinco aminoácidos que penetran por la vía del piruvato son la alanina, la cisteína, la glicocola, la serina y la treonina (ejemplo anterior). La alanina rinde directamente piruvato por transaminación con el -cetoglutarato. En el ejemplo puede verse como se degradan hasta piruvato, la treonina, la glicocola y serina. RUTA DEL -OXOGLUTARATO Los esqueletos carbonados de cinco aminoácidos (arginina, histidina, ácido glutámico, glutamina y prolina) entran en el ciclo de los ácidos tricarboxílicos por la vía de -cetoglutarato, cuyo precursor inmediato es el ácido glutámico. Arginina Prolina Semialdehído glutámico Histidina Glutamina Ácido Glutámico cetoglutar ato 60 El esquema muestra las rutas que conducen hasta el distintos A.A. para poder entrar al ciclo de Krebs. -cetoglutarato de los RUTA DEL SUCCINATO Los esqueletos carbonados de la metionina, la isoleucina y la valina, se degradan definitivamente, por la vía del propionil-CoA y del metilmalonil-CoA, a succinil-CoA que experimenta una desacilación para dar succinato, intermediario del ciclo de Krebs. METIONINA Ácido oxobutírico Isoileucina Propionil-CoA Valina Metilmalonil-CoA Succil-CoA RUTA DEL OXALACETATO La asparagina y ácido aspártico se incorporan finalmente al ciclo de Krebs en forma de oxalacetato. La asparagina en primer lugar se hidroliza a ácido aspártico y amoníaco por la acción de la asparaginasa. Asparagina + H2O ácido-aspartico + NH3 El aspartato así formado, experimenta transaminación con el ácido para formar ácido oxalacético. Ácido aspartico + ácido oxoglutarato -cetoglutarato ácido oxalacético + ácido glutámico De esta manera los cuatro átomos de carbono de estos aminoácidos pueden incorporarse al ciclo de Krebs. En las plantas y en algunos microorganismos el ácido aspártico experimenta una eliminación directa de NH3 para dar fumarato, catalizada por la enzima aspartasa, que no se encuentra presente en los tejidos animales. Ácido aspartico Ácido fumárico + NH3 61 FORMACION DE PRODUCTOS DE EXCRECION NITROGENADOS La mayoría de los vertebrados excretan definitivamente cierta fracción del amoníaco formado en una de estas tres formas: urea, amoníaco, o ácido úrico. El N 2 amínico es excretado por la mayor parte de los vertebrados terrestres en forma de urea. Son organismos designados como ureotélicos. Muchos animales acuáticos, tales como los peces teleósteos, excretan nitrógeno amínico en forma de NH3 y se les denomina amonotélicos. Los pájaros y los reptiles terrestres, cuyo consumo de agua es limitado, excretan el N 2 amínico en forma de ácido úrico (en forma semisólida) y a estos organismos se los llama uricotélicos. Los anfibios ocupan una posición intermedia. El renacuajo, cuyos hábitos son acuáticos, excreta amoníaco, después de la metamorfosis, durante la cual el hígado adquiere las enzimas necesarias, la rana adulta excreta urea. CICLO DE LA UREA La formación de urea tiene lugar casi por completo en el hígado de los organismos ureotélicos, es catalizada por un mecanismo cíclico denominado ciclo de la urea. Penetran en este ciclo dos grupos aminos que proceden inicialmente de los aminoácidos por desaminación, junto con una molécula de CO 2 y forman arginina a partir de la ornitina, diaminoácido homólogo de la lisina. Esta parte del ciclo de la urea tiene lugar en casi todos los organismos capaces de realizar la biosíntesis de la arginina pero solamente los animales ureotélicos poseen grandes cantidades de enzima arginasa, que cataliza la hidrólisis irreversible de la arginina para formar urea regenerando ornitina. La urea molécula neutra soluble en H2 O se excreta con la orina. - NH2 Grupos -amino oxoglutarato ácido aspártico ácido glutámico - NH2 arginina - NH2 arginasa H2N citrulina carbamilfosfato C NH2 C O ornitina O El primer grupo NH2 que entra al ciclo surge en forma de NH3 libre como consecuencia de la desaminación oxidativa ligada al NAD del glutamato en las mitocondrias. Ácido glutámico + NAD+ ácido oxoglutárico + NH3 + NADH + H+ Entonces el NH3 libre es utilizado junto con el CO 2 para formar fosfato de carbamilo en una reacción compleja, catalizada por la carbamil-fosfato sintetasa. 62 NH2 - O CO2 + NH3 + 2 ATP + H2O H2N C O O P - + ADP + Pi O O Fosfato de carbamilo Se necesitan dos moléculas de ATP para formar cada molécula de fosfato de carbamilo que interviene en esta reacción, la cual es irreversible. El fosfato de carbamilo es un compuesto rico en energía. El fosfato de carbamilo originado en esta reacción, cede a continuación, su grupo carbamilo a la ornitina para formar citrulina y fosfato; la reacción es catalizada por la ornitin-transcarbamilasa. El segundo grupo NH2 penetra después en el ciclo de la urea, al que llega en forma de aspartato que a su vez lo adquirió del glutamato por acción de la aspartatoglutamato-transaminasa. Ácido glutámico + ácido oxalacético Ácido oxoglutárico + ácido aspártico A continuación el grupo NH2 del aspartato se condensa con el átomo de carbono carbonílico de la citrulina en presencia de ATP para formar argininosuccinato, reacción catalizada por la arginosuccinato sintetasa. El arginosuccinato es escindido en forma irreversible por acción de la argininsuccinasa, con formación de arginina y fumarato libre. Hasta este punto la secuencia de la reacción es empleada por la mayoría de las células en la biosíntesis de la arginasa. Los animales ureotélicos sin embargo poseen arginasa, la cual desdobla, la arginina en urea y ornitina que vuelve al ciclo. La ecuación global del ciclo de la urea es: 2 NH3 + CO2 + 2 ATP + H2O Urea + 2 ADP + 2 Pi + AMP + PPi EXCRECION DE AMONIACO Se cree que en los organismos amonotélicos los grupos NH2 derivados a diversos -aminoácidos, se transaminan para formar glutamato, que experimenta después una desaminación oxidativa mediante la glutamato-deshidrogenasa. El NH3 así formado se convierte después en N 2 amídico de la glutamina, que es la forma de transporte del NH3 en la mayor parte de organismos. La glutamina se forma por acción de la glutamina-sintetasa, a partir de ácido glutámico. NH2 HOOC CH2 CH2 CH Acido Glutámico O Mg++ COOH + NH3 + ATP H2N C NH2 CH2 CH2 CH COOH + ADP + Pi Glutamina 63 La glutamina rinde NH3 libre en los túbulos renales de la mayoría de los vertebrados, pero esta reacción predomina en los organismos amonotélicos. La reacción es: Glutamato + NH4+ Glutamina + H2O El NH 4 así formado pasa directamente a la orina. Dado que la glutamina no es tóxica constituye un medio de transporte eficaz del NH3 . FORMACION DE ACIDO ÚRICO En los organismos uricotélicos, el ácido úrico es la forma principal de excreción de los grupos NH2 de los -aminoácidos. Es también el producto principal de excreción del metabolismo purínico en los primates, los pájaros y los reptiles terrestres. La ruta de formación de ácido úrico es compleja, puesto que en primer lugar debe formarse el anillo purínico a partir de precursores sencillos. OH C Amino ácidos NH2 N N C C C N N O2 C C C C N C N H HO C N N H Xantin oxidasa H Anillo de Purina Xantina O H C H N N C C C O O C N N H H Acido Urico (forma oxo) 64 TEMA XX: BIOSINTESIS DE CARBOHIDRATOS Principales vías de la síntesis de carbohidratos. Formación de fosfoenol-piruvato a partir de piruvato. Conversión de fosfoenol-piruvato a glucosa. Gluconeogénesis a partir de los intermediarios del ciclo de Krebs, de la acetil CoA y de los aminoácidos. Hemos visto que la transformación de la glucosa en piruvato es la senda principal del metabolismo de los carbohidratos en la mayoría de las células, tanto en condiciones aerobias como anaerobias. El proceso inverso, la conversión del piruvato en glucosa es el camino más importante. Convergen sobre esta senda central biosintética otras dos sendas las cuales provienen de dos precursores diferentes que no son carbohidratos. Una de ellas está dada por productos intermedios del ciclo de Krebs, que se transforman en piruvato. Este proceso se denomina gluconeogénesis. El otro camino está dado por las reacciones que provocan la reducción del CO 2 para formar glucosa (es en las células fotosintéticas). 1.- Formación de fosfoenol-piruvato La conversión del piruvato en fosfoenol-piruvato no puede realizarse en presencia de la piruvato-quinasa ya que el Gº 75 kcal . La fosforilación del piruvato se consigue tanto en el citoplasma como en la mitocondria mediante una secuencia reaccional de rodeo que necesita de la intervención de varias enzimas. La primera reacción es la catalizada por la piruvato-carboxilasa (de la mitocondria). H2O piruvato + CO2 + ATP Acetil CoA + oxalacetato + ADP + Pi Gº 0.5 kcal La enzima piruvato carboxilasa que se encuentra en la mitocondria necesita de le acción de la acetil CoA para actuar. 2.- El oxalacetato es reducido a malato por el NADH 2 NADH2 + oxalacetato NAD+ + malato Gº 6.7 kcal 3.- El malato formado difunde al citoplasma donde es reoxidado por la forma citoplasmática de la malato-deshidrogenasa ligada al NAD para formar oxalacetato extramitocondrial. malato + NAD+ oxalacetato + NADH2 Gº 6.7 kcal Esta reacción es muy endergónica, se desplaza hacia la derecha porque los productos finales se eliminan rápidamente. 4.- El oxalacetato se transforma en fosfoenol-piruvato por la acción de los fosfoenolpiruvato-carboxiquinasa. En esta reacción el donador de fósforo es el GTP (o el ITP). 65 Mg++ fosfoenol-piruvato + CO2 + GDP oxalacetato + GTP Gº 0.7 kcal Sumando todas las reacciones, escribimos la ecuación global, teniendo en cuenta la suma algebraica de los Gº . fosfoenol-piruvato + ADP + GDP + Pi piruvato + ATP + GTP Gº 0.2 kcal Esta reacción global es reversible, puesto que su variación de energía libre estándar es muy pequeña. Tenderá a desplazarse a la derecha siempre que el cociente (ATP) / (ADP) tenga un valor elevado y que haya presente un exceso de piruvato. Para fosforilar una molécula de piruvato se consumen dos enlaces de alto valor energético. Practicando le dirección energética de la ecuación, se observa que el proceso endergónico que requiere energía es: piruvato + GTP Gº fosfoenol-piruvato + GDP 7.5 kcal Mientras que el proceso que cede energía es: ATP + H2O ADP + Pi Gº 7.3 kcal Conversión en glucosa del fosfoenol-piruvato El fosfoenol-piruvato se convierte fácilmente en fructuosa 1 - 6 difosfato por inversión de las reacciones de la glicólisis que comienzan con la enolasa y terminan en la aldolasa. enolasa fosfoenol-piruvato + H2O 2-fosfoglicerato (1) 2-fosfoglicerato 3-fosfoglicerato (2) ATP + 3-fosfoglicerato ADP + 1,3-difosfoglicerato (3) 1-3 difosfo-glicerato + NADH2 gliceraldehído-3-P gliceraldehido-3-fosfato + NAD+ + Pi (4) dihidroxiacetona-P gliceraldehído-3-P + dihidroxiacetona-P (5) fructosa-1-6-di P (1) fosfoglicerometasa - (2) - fosfoglicerato-quinasa - (3) - gliceraldehído-3 Pdeshidrogenasa - (4) - triosa-fosfato-isomerasa (5) - aldolasa 66 La reacción siguiente no se realiza en dirección a le síntesis catalizada por la fosfofructoquinasa. Esta reacción es catalizada por la fructosadifosfatasa. fructosa-1-6-difosfato + H2O fructosa-6-P + Pi Gº 0.4 kcal En la etapa siguiente en camino hacia la glucosa la fructosa 6 P se convierte de modo reversible en glucosa 6P por la acción de la fosfohexoisomerasa o fosfoglucoisomerasa. fructosa 6-P glucosa 6-P En la mayoría de las células la glucosa-6-P formada durante la gluconeogénesis se emplea como precursor en la producción de polímeros de reservas como glucógeno, almidón, de otros monosacáridos de la glucosa, de disacáridos y polímeros estructurales. Sin embargo en determinadas células como en el hígado, riñón, epitelio intestinal de los vertebrados, la glucosa-6-P puede desfosforilarse y libera glucosa. El hígado constituye la fuente más importante de la glucosa sanguínea. La escisión de la glucosa-6-P; no puede tener efecto por inversión de la reacción de la hexoquinasa, a causa del gran cambio de energía libre estándar positiva que hay en la dirección de formación de la glucosa libre. glucosa-6-P + ADP glucosa + ATP Gº 4.0 kcal Sin embargo la producción de glucosa libre es inducida por la glucosa -6-fosfatasa, que cataliza la siguiente reacción exergónica de hidrólisis. glucosa-6-P + H2O glucosa + Pi Gº 3.3 kcal Esta enzima se encuentra de modo característico en el hígado y riñón de los vertebrados. Su actividad es dependiente de los lípidos y de la estructura de la membrana. La glucosa-6- fosfatasa no se encuentra en los músculos, ni en el cerebro, por lo que estos órganos no poseen la capacidad de donar glucosa libre. Resumiendo: 2 piruvato + 4 ATP + 2 GTP + 2 NADH2 + 6 H2O glucosa + 2 NAD+ + 4 ADP + 2 GDP + 6 Pi Por cada molécula de glucosa que se forma se consumen seis enlaces fosfato de alto valor energético y se requiere dos moléculas de NADH2 como reductor. 67 La reacción global es exergónica. glucógeno UDP-glucosa UTP glucosa-1-P glucosa libre glucosa-6-P disacáridos fructosa-6-P Pi monosacáridos ATP Pi fructosa-1-6 P gliceraldehído-3-P 3-P-glicerato 2-P-glicerato fosfoenolpiruvato GTP CO2 oxalacetato malato malato oxalacetato piruvato piruvato 68 Gluconeogénesis a partir de los intermediarios del ciclo de los ácidos tricarboxílicos Dijimos anteriormente que la síntesis de glucosa podría tener varios precursores. Entre ellos los principales son los productos intermedios del ciclo de los ácidos tricarboxílicos que pueden experimentar oxidación a malato. Entonces el malato puede abandonar las mitocondrias y experimentar su oxidación a oxalacetato en el citoplasma extramitocondrial; donde tiene lugar la formación de fosfoenol-piruvato por la acción de la fosfoenolpiruvato-carboxiquinasa del citoplasma. Tres átomos de carbono de los distintos intermediarios del ciclo de los ácidos tricarboxílicos se convierten, finalmente en tres átomos de carbono del fosfoenol-piruvato. Estos carbonos proceden de los átomos alfa-carboxílicos (alfa-carboxílicos) y beta del oxalacetato. Acido oxalacético. COOH CH2 C O COOH Gluconeogénesis a partir de acetil CoA En los tejidos de los animales superiores no hay formación neta de nueva glucosa a partir de los dos átomos de carbono del grupo acetilo del acetil CoA. Lo que sí sucede es que la condensación de la acetil CoA con el oxalacetato de citrato que al oxidarse para dar fosfoenol-piruvato pierde 3 átomos de C en forma de CO 2 . Se deduce que no puede formar más glucosa que el oxalacetato. En los tejidos animales la acetil CoA no puede convertirse directamente en piruvato o en succinato. En los animales superiores no existe senda metabólica alguna por lo que los átomos de carbono de los ácidos grasos puedan ser utilizados para producir nueva glucosa. Gluconeogénesis a partir de los aminoácidos Como se ha visto, algunos o todos los átomos de carbono de los distintos aminoácidos derivados de proteínas son finalmente convertibles en acetil CoA o en intermediarios del ciclo de Krebs. Aquellos aminoácidos que pueden servir de precursores del fosfoenol-piruvato y por consiguiente de la glucosa son aminoácidos glucogénicos. Ej: alanina, arginina, glicina, histidina, valina, prolina, etc. Los aminoácidos que por degradación son capaces de formar acetoacetato se los denomina cetógenos. Ej.: leucina. La fenilalanina y la tirosina constituyen ejemplos de aminoácidos que a la vez son glucogénicos y cetogénicos puesto que por degradación se escinden para formar ácido fumárico (glucogénico) y acetil CoA (cetogénico). 69 TEMA XXI: BIOSÍNTESIS DE LÍPIDOS Biosíntesis de ácidos grasos saturados. Formación de malonil CoA. Pasos en la síntesis de ácidos grasos. Prolongación de los ácidos grasos saturados en la mitocondria y los microsomas. Biosíntesis de triacil-gliceroles. Biosíntesis de colesterol. La ruta biosintética que conduce desde la glucosa a los ácidos grasos es importante en la mayoría de los organismos. Puesto que la capacidad de los animales superiores para almacenar polisacáridos es bastantes limitada la glucosa ingerida en exceso, respecto a las necesidades calóricas inmediatas y a la capacidad de almacenaje, se convierte en ácidos grasos, y éstos a su vez, en triacilgliceroles que pueden almacenarse en grandes cantidades en el tejido adiposo. Constituye otro proceso importante la biosíntesis de fosfoglicéridos de las membranas, puesto que la mayoría de las células experimentan un recambio relativamente veloz. También se verá la biosíntesis de colesterol. Aunque desde el punto de vista cuantitativo se trata de una vía secundaria, el gran número de esteroles, biológicamente activos, que derivan del colesterol le confiere considerable importancia. BIOSINTESIS DE LOS ÁCIDOS GRASOS SATURADOS La síntesis completa de ácidos grasos saturados de largas cadenas tiene efecto, solamente en la fracción soluble del citoplasma. Esta catalizada por un complejo de siete enzimas que se denomina complejo sintetasa de ácidos grasos. Los acilderivados intermediarios del proceso no son los tioésteres de la CoA, como en el caso de la oxidación de los ácidos grasos, sino tioésteres de una proteína de bajo peso molecular denominado proteína transportadora de ácil os (o ACP). Esta proteína puede formar complejos con las enzimas sintetasas a manera de un racimo. Malonil transferasa Acil transferasa Palmitil transferasa Enzima condensante ( citonil sintetasa) Deshidrogenasa (2º reducción) SH (resto fosfopantotenil con grupo SH terminal que enlaza los intermediarios acílicos) Deshidrogenasa (1º reducción) Deshidratasa SH (resto SH perteneciente a la proteína transportadora de grupos acilos) 70 La malonil CoA es el precursor inmediato de 14 de los 16 átomos de carbono del ácido palmítico; se forma a partir de la acetil-CoA citoplasmática (que deriva de la acetil-CoA mitocondrial) y del CO 2 por la acción de la acetil-CoA-carboxilasa. O CH3 C O biotina SCoA + CO2 + ATP HOOC ++ CH2 C S CoA Mn El CO2 se convierte en el carbono carboxílico libre distal de la malonil CoA. Los grupos acilos de la acetil-CoA y de la malonil CoA son transferidos al grupo tiol de la ACP por acción de dos enzimas acil-transferasa y malonil-transferasa. O O SH + CH3 C SCoA acil SH C CH3 + HSCoA SH O O S SH S transferasa C CH3 + COOH CH2 C SCoA O malonil S C CH3 + HSCoA transferasa S C O CH2 COO H Acetil-S-ACP y malonil-S-ACP reaccionan entre sí de manera que el grupo acetilo del primero pasa a formar los carbonos 3 y 4 del grupos acetoacetilo, con desplazamiento del CO 2 . 71 SH + CO2 condensante S C O CH2 C O CH3 La acetoacetil-S-ACP se reduce por acción del NADPH. SH SH NADPH+ + H+ S C O NADPH+ + H+ NADP deshidratasa S deshidrogenasa C CH2 C SH O S C H2O CH2 O H C CH3 OH CH CH3 crotonil-S-ACP Hidroxibutiril - S- ACP SH C O CH CH3 S C acil transferasa S NADP CH2 CH2 O CH2 O SH CH3 CH2 CH3 butiril-S-ACP 72 La formación de butiril-S-ACP completa el primer ciclo, el cual se repite seis veces más en el cual una molécula de malonil-S-CoA se incorpora a la ACP para dar malonil-S-ACP la cual experimenta pérdida de CO 2 y condensación con el acilo graso que se encuentra en el otro brazo. De ésta manera el producto es el ácido palmítico de 16 átomos de carbono. Al final del ciclo se libera la ACP por la acción de una desacilasa hidrolítica. SH + CH3 (CH 2)14 COOH ácido palmitico SH Las reacciones enzimáticas de la síntesis de ácidos grasos difieren de la oxidación en: Su localización dentro de la célula. En el portador de grupos acilos. En la forma en que las unidades de dos átomos de carbono se adicionan o eliminan. El NADPH necesario en la reducción proviene de la vía del fosfogluconato. PROLONGACION DE LOS ACIDOS GRASOS SATURADOS EN LAS MITOCONDRIAS Y LOS MICROSOMAS El ácido palmítico que es el producto final normal del sistema de la sintetasa de los ácidos grasos del citoplasma, puede prolongarse mediante dos tipos diferentes de sistema enzimáticos: el de las mitocondrias y del retículo endoplasmático. En las mitocondrias los ácidos grasos saturados de 12 a 16 átomos de carbono, en forma de ésteres de la CoA, se alargan por adiciones sucesivas de acetil-CoA. La ruta mitocondrial se realiza por inversión de las mismas etapas implicadas en la oxidación, con excepción de la reducción del doble enlace α β que conduce al ácido graso saturado, que se verifica a expensas del NADHP como reductor, y no de la flavoproteína. El sistema mitocondrial es capaz de alargar también los ácidos grasos no saturados. En los microsomas tanto los ésteres de ácidos grasos saturados, como los de los no saturados pueden prolongarse, pero en este caso es la malonil-CoA la fuente de grupos acetilos. FORMACION DE ACIDOS MONOENOICOS (con doble enlace) Los precursores de los ácidos grasos monoenoicos son el: 73 Acido palmítico (C16) Acido palmitoleico ( Acido Esteárico (C18) ) Acido oleico ( ) Aunque la mayoría de los organismos tienen capacidad para formar ácido palmitoleico y ácido oleico, la ruta y el mecanismo utilizado dependen si el organismo es anaerobio o aerobio. En los organismos aerobios los dobles enlaces son introducidos por una oxigenasa específica localizada en la fracción microsómica, especialmente del hígado y del tejido adiposo. No se conocen detalles completos del mecanismo enzimático, pero se sabe que se utiliza la molécula de oxígeno como aceptor de dos pares de electrones, uno de los cuales procede del sustrato acil-CoA y el otro del NADPH, que se requiere en la reacción. palmitoíl-CoA + NADPH + H+ + O2 1 par palmitoleíl-CoA + NADP+ + 2 H2O 1 par FORMACION DE ACIDOS POLIENOICOS Todos los ácidos polienoicos se forman a partir de cuatro precursores: 1.- Acido palmitoleico 2.- Acido oleico 3.- Acido linoleico 4.- Acido linolénico Los cuales sufren ulterior alargamiento y/o desaturización. Los ácidos linoleicos y linolénicos no pueden ser sintetizados por los mamíferos quienes tienen que tomarlos de fuentes vegetales por esta razón se denominan ácidos grasos esenciales. BIOSINTESIS DE TRIACIL GLICEROLES (TAG) Los TAG, que actúan como lípidos de depósito o de almacenamiento, son activamente sintetizados por las células hepáticas y adiposas de los mamíferos. Para la síntesis se requieren dos precursores principales: 1.- Glicerol 3-fosfato 2.- Acil CoA graso El glicerol 3-fosfato procede de dos fuentes: 1.- Dihidroxiacetona-fosfato que se produce en la glicólisis. Dihidroxiacetona-fosfato + NADH + H+ glicerol-3-fosfato + NAD+ 74 2.- También puede formarse por la acción de la gliceril-quinasa ATP + glicerina glicerol-3-fosfato + ADP ETAPAS DE LA BIOSINTESIS - Primera etapa: Acilación de los grupos oxidrilos libres del glicerol-3-fosfato por dos moléculas de acil-CoA graso, produciendo un ácido fosfatídico. O CH2 OH CH2 O C R O CH C O + CH OH CH2 O R 2 C S CoA O CH2 O PO 3H2 R' + 2 HSCoA PO 3H2 - Segunda etapa: El ácido fosfatídico experimenta una hidrólisis por acción de una fosfatasa específica formando diacilglicérido. O CH2 O C O R CH2 O O CH O C CH2 O C R O + H2O R' CH PO 3H2 O C R' + Pi CH2 OH - Tercera etapa: El diacilglicérido reacciona con una molécula de acil-graso CoA dando triacilglicerol. O CH2 O C O R CH2 O O O CH O C R' + R'' C C R' O S CoA CH O C R'' + HSCoA O CH2 OH CH2 O C R''' BIOSINTESIS DE FOSFOGLICERIDOS Los principales fosfoglicéridos que sirven como componentes de las membranas y las lipoproteínas de transporte se forman por ramificaciones de la ruta biosintética a partir del ácido fosfatídico. Además intervienen los nucleótidos citidínicos. Todas estas reacciones tienen lugar en el retículo endoplásmico. 1) El ácido fosfatídico con el CTP se convierte en citidín-difosfato-diacilglicérido que es el precursor común de todos los fosfoglicéridos formados por ésta ruta. Acido fosfatídico + CTP citidín-difosfato-diacilglicérido + PPi 75 Su porción CMP puede considerarse la portadora del ácido fosfatídico. En las reacciones subsiguientes, cada una de las cuales es catalizada por una enzima específica la porción CMP es desplazada por los alcoholes: serina, inositol, fosfato de glicerilo. O CH2 O C R O CH O C R' CH2 O HO P O O HO P O O CH2 citosina O H H OH OH H 1). CDP - diacilglicérido + serina fosfatidil-serina + CMP 2). CDP - diacilglicérido + inositol fosfatidil inositol + CMP 3). CDP - diacilglicérido + glicerol-fosfato CMP fosfatidil-glicerol-fosfato + La descarboxilación enzimática del resto de la serina de la fosfatidilserina conduce a la formación de la fosfatidil-etanolamina. La fosfatidil-etanolamina es precursora de la fosfatidil-colina, la cual se forma por transferencia de tres grupos metilos. El fosfatidil-gliceril-fosfato es precursor de dos lípidos. Por desfosforilación rinde fosfatidil-glicerina que es uno de los componentes de la membrana celular de muchas bacterias. El fosfatidil-gliceril-fosfato con una segunda molécula de CDP diacilglicérido rinde cardiolipina. 76 Acido fosfatídico CTP Fos fato de glice rilo CDP - diacilglicérido ina Ser Inositol Fosfatidil-serina Fosfatidil-inositol Fosfatidil-glicerol-fosfato CO2 Pi Fosfatidil-etanolamina Fosfatidil-glicerina + CDP-diacilglicérido 3 CH3Cardiolipina Fosfatidil-colina BIOSINTESIS DE COLESTEROL Comprende tres etapas: 1.- Conversión de acetato en ácido mevalónico 2.- Conversión de ácido mevalónico en escualeno 3.- Conversión de escualeno en colesterol. 1). Conversión de acetato en ácido mevalónico: El ácido mevalónico tiene seis átomos de carbono por lo que se forma por condensación de tres moléculas de acetil-CoA. Acetil CoA + acetoacetil CoA hidroxi - hidroxi - metil - glutaril CoA NADPH2 metil - glutaril CoA + CoA ácido mevalónico + NADP + HSCoA 2). Conversión de ácido mevalónico en escualeno: El ácido mevalónico es fosforilado por el ATP y se convierte en ácido-3-fosfo-5pirofosfomevalónico. CH3 COO H CH2 C OH CH2 CH2 O P O OH O P OH O O HO P OH O 77 El compuesto es muy inestable pierde H3PO 4 y se descarboxila dando isopentenil-pirofosfato que se isomeriza y dá el 3-3'-dimetil-alil-pirofosfato. CH2 OH C CH2 CH2 O CH3 CH3 C CH CH2 O CH3 P OH O P O O OH OH P O O P OH OH O Estos dos compuestos se condensan con pérdida de PPi dando geranil-pirofosfato. geranil-pirofosfato + isopentenil pirofosfato - PPi farnesil pirofosfato El cual experimenta condensaciones reductoras y conducen al escualeno. 3). Conversión de escualeno en colesterol El escualeno sufre un ataque del oxígeno formando el 2-3 epóxido, el cual sufre una ciclización a lanosterol en el cual se producen desplazamientos electrónicos con el cierre de los cuatro anillos y formación de colesterol.- 78 TEMA XXII: BIOSÍNTESIS DE LOS AMINOACIDOS La biosíntesis de los aminoácidos a partir de precursores sencillos, es vital para todas las formas de vida, puesto que los aminoácidos son los precursores de las proteínas. Sin embargo los organismos vivos difieren considerablemente en lo que se refiere a las formas de N 2 que son capaces de utilizar con dicha finalidad. Los animales superiores pueden utilizar NH3 como fuente de N 2 para la síntesis de aminoácidos no indispensables, pero son incapaces de utilizar, nitritos y nitratos o N 2 . Los rumiantes pueden utilizar los nitritos y nitratos pero solo después que las bacterias de su panza los reducen a NH3 . Las plantas superiores pueden producir todos los aminoácidos requeridos para la síntesis de proteínas, a partir tanto de NH3 como de nitratos, como fuentes de N 2 . Pueden utilizar el NH3 como tal o después de su oxidación a nitrato por acción de las bacterias del suelo. Las leguminosas son capaces de fijar N 2 atmosférico como NH3 por acción de las bacterias que se encuentran en sus nódulos radicícolas. Los microorganismos difieren ampliamente en cuanto a su capacidad de efectuar síntesis de aminoácidos. Algunos no pueden crecer si no se le suministran algunos aminoácidos ya formados. Otros como E.Coli pueden obtener todos sus aminoácidos a partir de NH3 . Los veinte aminoácidos se sintetizan gracias a unas secuencias polienzimáticas, algunas de las cuales son extremadamente complejas como es el caso en las mayoría de las vías biosintéticas, las sendas de las síntesis aminoácidas son, en su mayor parte, diferentes a las seguidas en sus degradaciones. Por una parte los aminoácidos sirven no sólo como bloques de montajes en la síntesis de proteínas sino también como precursores de muchas biomoléculas que poseen gran variedad de funciones especializadas. Es frecuente que las rutas de síntesis y degradaciones aminoácidas incluyan ciertas ramificaciones o extensiones conducentes a la formación de tales productos especializados. Ya hemos visto que las formas biológicas de N 2 disponibles son relativamente escasas en los ambientes inanimados, porque el proceso de fijación de N 2 atmosférico está circunscrito a unos pocos organismos Además las propias síntesis de las enzimas que catalizan la formación de los aminoácidos se hallan también bajo control, tales síntesis pueden resultar reprimidas, si la célula dispone de un suministro exógeno de aminoácido. Ambas formas de regulación constituyen el reflejo de una intrínseca economía celular que prevalece en la síntesis y en la utilización de los aminoácidos. BIOSINTESIS DE LOS AMINOACIDOS NO ESENCIALES: Se definen a éstos como aquellos aminoácidos que pueden ser sintetizados por la rata albina. Conviene considerar en primer lugar este grupo de aminoácidos, porque la mayoría de los organismos pueden realizar su síntesis. Además este grupo se distingue porque sus rutas biosintéticas son más bien cortas y muestran variaciones relativamente pequeñas de unas especies a otras. 79 BIOSINTESIS DE ACIDO GLUTAMICO, GLUTAMINA Y PROLINA: Las rutas biosintéticas de estos aminoácidos que están íntimamente relacionados son idénticas en todas las formas de vida. Los tres se degradan por sendas que conducen al cetoglutarato, y los mismos caminos que se emplean para su síntesis. El ácido glutámico se forma desde luego a partir de NH3 y de ácido cetoglutárico por acción de la L-glutamato ~ deshidrogenasa. NH3 + ácido oxoglutárico + NADPH + H+ ácido L-glutámico + NADP+ Esta reacción es de importancia fundamental en la biosíntesis de cualquier aminoácido en todas las especies, pues se trata de la ruta primaria sino la única de formación directa de grupos amino a partir de NH3 . La transaminación de los ácidos -ceto con el ácido glutámico como donador de grupos NH2 , constituye la senda principal de introducción de grupos -amino en la biosíntesis de la mayoría de los aminoácidos. La Glutamina se forma a partir del ácido glutámico por la acción de la glutamina ~ sintetasa. NH3 + ácido glutámico + ATP Glutamina + ADP + Pi Esta reacción es bastante compleja e implica dos o más etapas intermedias. Se ha observado que el ~glutamil fosfato actúa como intermediario de alta energía ligado a la enzima. O OH C O CH2 OH O CH2 H P ácido C glutamil-fosfórico NH2 COOH ATP + Acido glutámico glutamil~fosfato + NH3 ADP + glutamil~fosfato glutamina + Pi La prolina se sintetiza a partir de ácido glutámico por inversión de la ruta metabólica, antes descrita para la oxidación de la prolina. Los restos de hidroxiprolina que se encuentran en el colágeno y en otras proteínas fibrosas, se forman a partir de determinados restos de prolina de esas proteínas por acción de la prolin-hidroxilasa. Esta oxigenasa de función mixta utiliza el cetoglutarato como correductor y el oxígeno corno aceptor electrónico. En la 80 reacción se requieren Fe y ácido ascórbico como cofactores. Sin embargo la prolin-hidroxilasa no transforma la prolina libre en hidroxiprolina. NH 2 OH-C-CH 2-CH 2-CH-COOH O Acido Glutámico NADH 2 NH2 H C CH2 CH2 CH semialdehído glutámico COOH inhibición O H2C CH2 H HC Acido 1~pirrolín 5 carboxílico C N COOH NADH 2 H2C CH2 H2C C H N COOH H Prolina BIOSINTESIS DE ALANINA: ACIDOS ASPARTICO Y ASPARAGINA: En muchos organismos la alanina y el ácido aspártico se forman por transaminación de ácido pirúvico y del ácido oxalacético respectivamente. ALANINA O CH3 C NH2 COOH + HOOC CH2 CH2 C COOH NH2 CH3 C H Acido pirúvico O COOH + HOOC H Acido glutámico CH2 CH2 C COOH α cetoglutarato Alanina ACIDO ASPARTICO O HOOC CH2 C NH2 COOH + Acido glutámico Acido oxalacético HOOC CH2 C COOH + Acido -oxoglutámico H Acido Aspártico En algunas plantas estos dos compuestos se producen por Aminación reductora. El 81 ácido Aspártico es el precursor directo de la asparagina. En muchos organismos ésta se forma por una reacción similar a la catalizada por la glutamin-sintetasa. NH2 HOOC CH2 C NH2 NH2 COOH + NH3 + ATP H C CH2 O Acido Aspártico C COOH + ADP + Pi H Asparagina TIROSINA Aunque la Tirosina es un aminoácido no indispensable, su síntesis requiere el aminoácido esencial feniIalanina, como precursor. La tirosina se forma a partir de la fenilalanina por una reacción de hidroxilación catalizada por la fenil-alaninhidroxilasa. La cual como hemos visto participa de la degradación de la fenilalanina. Fenilalanina + NADPH + H+ + O2 Tirosina + NADP+ + H2O BIOSINTESIS DE AMINOACIDOS ESENCIALES Las sendas de la síntesis de los aminoácidos esenciales se han deducido en gran parte, de estudios bioquímicos y genéticos practicados con bacterias. En general los caminos son idénticos en la mayoría de las especies bacterianas y plantas superiores. Sin embargo en algunos casos se observan diferencias de especie en algunas etapas individuales. Las sendas que llevan a la biosíntesis de los aminoácidos esenciales son más largas que las que llevan a la síntesis de los no esenciales. También son más complejas posiblemente porque varios intermediarios sirven también como precursores de muchas otras clases de biomoléculas. BIOSINTESIS DE METIONINA Y TREONINA Estos dos aminoácidos esenciales tienen un denominador común: sus esqueletos carbonados proceden de la homoserina. Análogo de la serina con cuatro átomos de carbono. A su vez la cadena de carbonos de la homoserina deriva del esqueleto del ácido aspártico, luego de una serie de reacciones que no tienen lugar en los mamíferos. El camino metabólico de la reducción del grupo -carboxílo de ácido aspártico al correspondiente aldehído se parece a la reducción de 1-3 difosfoglicerato al 3 gliceraldehído-fosfato de la ruta de la glicólisis. La homoserina formada en la primera etapa se fosforila a fosfato de homoserina mediante una reacción que requiere ATP. El fosfato de homoserina se convierte en Treonina por acción de la Treonínsintetasa, enzima que requiere fosfato de Piridoxal. En esta reacción se elimina ácido fosfórico de los carbonos 3 y 4, se obtiene así un 82 doble enlace 3,4 que se isomeriza a la posición formar Treonina. 2,3 y después se hidrata para SINTESIS DE TREONINA O COOH CH2 H C ATP OH C ADP O CH2 apartil NH2 quinasa H C COOH Acido aspártico P OH NADH CH2 O CH2 C P H NH2 N CH CH2 C H NH2 ENZ. C NH2 COOH COOH Semialdehído aspártico Homoserina CH2 OH O CH2 OH NAD+ NADH O CH2 COOH aspartil fosfato ADP C O OH ATP H NAD+ H+ CH - Pi Complejo enzimático -homoserin-fosfato C N CH ENZ. COOH COOH CH3 + H CH3 H2O CH C N COOH CH ENZ. CH3 H C OH H C N COOH H2O CH ENZ. H C OH + O H C NH2 CH ENZ. COOH Treonina Se cree que la secuencia completa tiene lugar con el grupo NH2 del sustrato unido al grupo aldehído del fosfato de piridoxal de la enzima como una base de Schiff, en éste complejo el átomo de H2 es lábil. El producto final de la secuencia, la treonina, es un inhibidor modulador de la primera enzima del sistema que es la enzima regulador aspartil-quinasa. METIONINA La conversión de la homoserina en metionina comienza con la formación enzimática de la O~succinil homoserina por transferencia de un grupo succinilo del succinil-CoA. En la reacción siguiente se forma cistationina a partir de la O succinil-homoserina y de la Cisteína la cual, a su vez escinde, para dar homocisteína ácido pirúvico y NH3 . La Cisitationina puede experimentar dos tipos de escisión, uno a cada uno de los lados del átomo de azufre, así puede servir como intermediario de la conversión de Metionina en Cisteína en los mamíferos y de la transformación de Cisteína en Metionina en las plantas y bacterias. 83 O CH2 OH Succinil CoA CH2 H C NH2 H COOH CH2 O C CH2 CH2 C S CH2 NH2 CH2 COOH Homoserina CH2 Cisteína H COOH C CH H NH2 C NH2 COOH COOH O succinil - homoserina Cistationina CH3 SH S CH2 Piruvato CH2 + NH2 H C CH2 DA ~ Cobalanina CH2 5 NH2 N ~ Metil tetrahidroflorato COOH Homocisteina H C NH2 COOH Metionina La metilación de la Homocisteína a Metionina en E. Coli tiene lugar por transferencia del grupo Metilo de N5 metil tetrahidrofolato. N5 metil tetrahidrofolato + homocisteína D. A. ~ Cobalamina tetrahidrofolato + metionina En esta reacción se requiere Desoxiadenosilcobalamina, coenzima que contiene vitamina B12 , su acción como portador de grupo metilo ( CH3 ) del N5 metiltetrahidrofolato el cual puede provenir originalmente de varios donadores de grupos ( CH3 ) metilo, tales como la colina o la 5-adenosil-metionina. A su vez, la homocisteína es uno de los posibles aceptores de grupos ( CH3 ) metilo. Funciones Precursoras de los Aminoácidos: Biosíntesis de Porfirinas Los aminoácidos son precursores de muchas biomoléculas (aparte las proteínas) que ejercen importantes funciones biológicas, tales como hormonas, vitaminas, coenzimas, alcaloides, porfirinas, antibióticos, pigmentos y sustancias neurotransmisoras. Es digno de mención especialmente, el hecho de que los aminoácidos cromáticos, sean los principales precursores de buen número de alcaloides entre ellos la morfina, la codeína, y la papaverina, así como de muchas otras sustancias con intensa actividad biológica, tales como la hormona tiroxina, la hormona de crecimiento vegetal: ácido indolacético, el poderoso vasocontrictor neurohumoral: serotonina y las hormonas catecolamínicas: epinefrina y norepinefrina. Los aminoácidos son precursores de pequeños péptidos, como el glutatión y de las hormonas péptidas, como la bradiquinina, oxitocina y la vasopresina. El péptido glutation se sintetiza según las siguientes reacciones: 84 Acido glutámico + Cisteína + ATP Mg++ Glutamilcisteína + ADP +P Glutamilcisteína + Glicina + ATP i Glutatión + ADP + Pi La biosíntesis de las Porfirinas cuyo principal precursor es la Glicina requiere especial atención por la importancia central del núcleo porfirínico en la función de la hemoglobina, de los citocromos y de la clorofila. Los tetrapirroles se construyen a partir de cuatro moléculas del derivado monopirrólico Porfobilinógeno, que a su vez se sintetiza según las siguientes etapas: COOH COOH CH2 HSCoA CH2 NH2 COOH COOH CH2 CH2 + CH2 C COOH S CoA Glicina O H Succinil~CoA CH2 CH2 C O C O C CH2 NH2 COO H NH2 Acido amino levulínico Acido amino oxoadípico En la primera reacción la glicina reacciona con el succinil-CoA para dar ácido amino oxoadípico quien luego se descarboxila para dar ácido amino-levulínico reacción que es catalizada por la amino~levulínico~sintetasa; enzima que requiere fosfato de piridoxal y se encuentra en el retículo endoplásmico de las células hepáticas. Luego dos moléculas de amino-levulínico se condensan para formar porfobilinógeno bajo la acción de la aminolevulínico deshidrasa. COOH COOH HOOC CH2 CH2 CH2 CH2 C C CH2 C C 2 H2O H C C CH2 NH2 H CH2 + O C H C CH2 COOH O H N H NH2 N H H Porfobilinógeno H 85 Como precursores de la Protoporfirina actúan cuatro moléculas de porfobilinógeno, a través de una serie compleja de reacciones, la primera de las cuales la cataliza la porfobilinógeno~desaminasa. Algunas de las etapas de la serie permanecen aún oscuras. El hierro no se incorpora hasta que se ha completado la molécula de la protoporfirina. Esta incorporación requiere una enzima, la hemo-sintetasa o Ferroquelatasa que está localizada en las mitocondrias. HOOC CH2 COOH CH2 CH2 C C CH2 C C CH NH2 H Porfobilinógeno CH C C C CH2 C CH H CH3 C C N N CH3 H H C C CH3 C C CH N H CH2 CH2 COOH C C CH2 H HC C C C C CH2 CH3 CH CH2 COOH Protoporfirina IX La degradación de la protoporfirina IX, conduce a la bilirrubina y a biliverdina, que son pigmentos segregados en la bilis. 86 TEMA XXIII: BIOSINTESIS DE LOS MONONUCLEOTIDOS Biosíntesis de los nucleótidos de purina. Vías del ácido inosínico hacia los ácidos adenílico y guanílico. Biosíntesis de los nucleótidos de pirimidina. La biosíntesis de ribonucleótidos y desoxiribonucleótidos es un proceso vital ya que estos compuestos son precursores directos del ADN y del ARN así como de las coenzimas nucleotídicas. Las rutas metabólicas de formación de sus bases (púricas y pirimidínicas) tienen una importancia central. Biosíntesis de nucleótidos purínicos: Origen biosintético de los átomos del anillo purínico. Proviene de los experimentos realizados por Bucherer quién administró a animales precursores marcados y luego determinó los sitios del núcleo purínico a los que se habían incorporado los átomos marcados. Esta experiencia se realizó en aves, que excretan el N 2 en forma de ácido úrico que es un derivado de las purinas. Ácido úrico: CO 2 Glicina 7 C N 6 Aspartato N 1 5 C C Formiato C 8 Formiato C 2 4 N 3 N 9 amida de la glutamina Construcción del núcleo púrico: N9 NH2 de la glutamina glicina aminotransferasa PP ADP + P ácido glutámico P O CH2 H H NH 2 R P fosforibosilamina O P ATP OH H H OH OH fosforibosilpirofosfato (FRPP) 87 C4 y C5 N7 C8 NH2 NH "CHO" CH CH2 glutamina CHO CoF C ácido glutamínico C NH NH O O R P R glicinamida ribótido P formil - glicinamida ribótido N3 C6 O N1 N C CO2 CH NH2 N "CHO" CH CH CH Acido aspártico C NH2 N R P C N R 5 aminoimidazol ribótido O CoF NH2 P 5 aminoimidazol 4 carboxamida ribótido C2 N NH CH CH N N R P Inosina 5' - fosfato Acido Inosínico IMP 88 Vías del ácido inosínico hacia los ácidos adenílico y guanílico O H N N N IMP (H+ inosínico) N R P NAD aspartato [O] NADH2 GTP GDP + Pi O H HOOC H N N CH2 C COOH NH O N N H R H N N P N H+ glutámico H+ Xántico glutamina ATP aspartato AMP N R AMP + PP P fumarato O NH2 H N N H NH2 N N N N N R N P R GMP (H+ guanílico) P AMP (H+ adenílico) 89 Vías de la biosíntesis de nucleótidos purínicos: ATP base púrica AMP Ribosa 5 P 5 P Ribosil PP Nucleótido Pi Ribosa 1 P base púrica Nucleósido ATP AMP Nucleótido Pi Biosíntesis de GDP, GTP y ADP, ATP: GMP + ATP GDP + ADP GDP + ATP GTP + ADP AMP + GTP ADP + GDP ADP + GTP ATP + GDP Regulación de la síntesis de Nucleótidos Purínicos: E PRPP AMP ADP ATP GMP GDP GTP H+ inosínico 5 fosforibosilamina En este caso el exceso de ATP, ADP o AMP o de GTP, GDP o GMP producen una inhibición a nivel de la enzima que cataliza la reacción entre el fosforibosilpirofosfato y la 5 fosforibosilamina, por lo tanto se frena la secuencia metabólica y se inhibe la biosíntesis. Es un caso de retroalimentación negativa. Biosíntesis de Nucleótidos de Pirimidina Es una ruta similar a la de los nucleótidos purínicos, pues las bases libres no son productos intermedios. Esta ruta es más simple y se diferencia en que la D-Ribosa se acopla después que se ha formado el anillo pirimidínico. El precursor es el ácido Orótico. O C H O N C H C C COOH N 90 ácido orótico H2O carbamil PO4 Acido Aspártico Acido Carbamil Aspártico Dihidrotasa PO4 PRPP NAD Acido Dihidrótico PP Acido Orotidílico OMP Acido Orótico fosforibosil-tr ansferasa NADH2 CO2 Acido Uridílico OMP descarboxilasa UMP (uridin monofosfato) UMP + ATP UDP + ADP UDP + ATP UTP + ADP Biosíntesis de CTP (citidin trifosfato) O NH2 C H C N C H C C H ATP + O P P P triofosfato de uridina (UTP) C H C C H NH3 O N R ADP + Pi N N R P P P triofosfato de citidina (CTP) En Escherichia Coli (bacteria) el que dona el grupo NH2 es el NH3 libre. En los mamíferos es el grupo amino de la glutamina. Regulación de la biosíntesis de nucleótidos de pirimidina Cuando hay un exceso de UTP y de CTP este exceso determina la inhibición de la aspartato carbamil transferasa, enzima que inicia la ruta de biosíntesis, por lo tanto se produce el fenómeno de retroalimentación negativa o feed-back. 91 Acido Aspártico aspartato carbamil transferasa Acido carbamil Aspártico UMP UTP CTP Biosíntesis de desoxi-TMP (timidín-monofosfato) O O C H N C O C CH H CH H N5; N10.Metilen Tetrahidrofolato FH2 Dihidrofolato H N C O N desoxi R P (dUMP) C CH3 C H N desoxi R P (d-TUMP) Reacciones fosfotransferásicas: ATP + d ADP ADP + d ATP ATP + d CDP ADP + d CTP ATP + d TDP ADP + d TTP ATP + d GDP ADP + d GTP Los precursores del ADN (ácido desoxiribonucléico) son desoxi-ribonucleótidos. Los precursores del ARN (ácido ribonucléico) son ribonucléotidos. 92 TEMA XXIV: NATURALEZA, ESTRUCTURA Y REPLICACION DEL MATERIAL GENETICO Evidencias de que el ADN es el material genético. Estructura del ADN: Ley de Chargaff, estudios de difracción con rayos X. Modelo de Watson y Crick. El dogma central de la Biología Molecular. Replicación del ADN: replicación semiconservativa. La genética estudia la transmisión hereditaria y la variabilidad de los caracteres de los organismos. En este capítulo veremos las bases bioquímicas de algunas cuestiones centrales, que plantea la continuidad genética y la evolución de los organismos vivos. ¿Cuál es la naturaleza molecular del material genético y de sus unidades fundamentales, los cromosomas, los genes, los símbolos de código? ¿Cómo se replica la información genética para pasar de una generación a otra? ¿Cómo se transcribe la información en la célula? ¿Cómo se traslada la información genética a la secuencia de aminoácidos de las moléculas proteicas? Los extraordinarios avances en el conocimiento de la base molecular de la genética han provocado una revolución intelectual en biología, que se considera comparable a la que comenzó con la teoría de Darwin sobre el origen de las especies. Todos los campos de la biología han resultado profundamente influídas por tales avances, de tal modo que en la actualidad no se puede estudiar problema bioquímico alguno prescindiendo de su fondo genético. El conocimiento actual de la base molecular de la genética deriva de los avances realizadas en tres campos científicos diferentes: la genética, la bioquímica y la física molecular. A. En el campo de la genética, ¿qué progresos hubieron? Al principio el único medio de llevar a cabo análisis genéticos consistía en realizar experiencias con apareamientos debidamente orientados, es decir ya teniendo un conocimiento de los resultados de la reproducción sexual. Experiencias de esta clase presenta grandes limitaciones en cuanto al tiempo de generación que es relativamente grande y el número de descendientes que es relativamente pequeño. Supongamos por ejemplo, que se investigan fenómenos genéticos utilizando cobayos como animales de experimentación. Se eligen progenitores apropiados y se identifican por anticipado los caracteres de la descendencia. El período de gestación es de 10 semanas y el número de descendientes es de 2 a 4. Con este número de descendientes se revela una pequeña parte de los rasgos potenciales capaces de ser transmitidos por los padres y para estudiar la reproducción de los descendientes hay que esperar que los cobayos alcancen la madurez sexual. El desarrollo de la genética microbiana ha aportado un gran avance. Los microorganismos y particularmente las bacterias se multiplican rápidamente (algunos a intervalos de 15'). Otro progreso experimental que es el uso de rayos X y otros agentes mutagénicos, que incrementan la velocidad de mutaciones espontáneas. MUTACION: alteración de un gen que puede ser espontánea o inducida (rayos X, radiación U.V., etc. 93 Como las propiedades de la célula están controladas por genes los caracteres pueden cambiar por mutación. De esta manera se pudo conocer la secuencia de los genes en los cromosomas y saber que los genes poseen un gran número de locus que pueden experimentar mutación; y que químicamente están constituidos por ácido desoxiribonucléico. Pero el desarrollo más importante en el campo de le genética fue: La enunciación de la hipótesis de "un gen - una enzima", por Beadle y Tatum que dice que los genes se expresan a través de proteínas, por lo tanto, las mutaciones darán origen a proteínas alteradas. El descubrimiento de Avery y Col, que demostraron que el ADN contiene la información genética. B. En el campo de la bioquímica, muchos avances experimentales importantes se hicieron posibles gracias a la mejora de métodos cromatográficos, que hicieron posible el análisis cuantitativo de la composición aminoácida y de la secuencia de las proteínas y mostraron que le secuencia varía según función de la proteína. También se llegó a establecer la composición y estructura covalente de los ácidos nucleicos.Uno de los desarrollos más significativos consistió en el descubrimiento de la equivalencia de ciertas bases del ADN que se convirtió en un elemento importante para deducir su estructura tridimensional. C. En el campo de la física molecular la aplicación de difracción de rayos X a la conformación de moléculas de proteínas fibrosas y globulares llevó al concepto de que cada tipo de molécula proteica posee una conformación específica, que determina su función biológica. Pero el hecho fundamental fue la aplicación de los rayos X al análisis de la estructura tridimensional del ADN. En 1953 Watson y Crick postularon una estructura de doble hélice para el ADN que sugirió un mecanismo sencillo por medio del cual la información genética puede transferirse de la célula progenitora a la célula hija. La hipótesis de Watson y Crick fue pronto ampliada y extendida hasta llegar a lo que Crick denominó el dogma central de la genética molecular, el cual establece que la información genética fluye del ADN al ARN y de éste a las proteínas; relación frecuentemente simbolizada así: ADN ARN proteínas El dogma central definió tres procesos principales de la preservación y transmisión de la información genética. 1. Réplica, es decir, la copia del ADN con formación de moléculas hijas idénticas. 2. Transcripción, por el cual el mensaje genético del ADN es transcripto en forma de ARN para ser llevado a los ribosomas. 3. Traducción, por la cual el mensaje genético es descifrado y convertido en el alfabeto de 20 letras de la estructura proteica. Evidencias de que el ADN es el material genético Aunque el ADN se descubrió en los núcleos celulares en 1.869, no se identificó como portador directo de la información genética hasta 1.943. Avery y Col hallaron que una cepa no virulenta de la bacteria Pneumococcus puede transformarse de modo hereditario, en una cepa virulenta por simple adición de un 94 ADN extraído de un neumococo virulento. Lo que sucede es que el ADN se incorpora covalentemente al ADN de la célula receptora donde se replica con la célula huésped. De especial significación son los experimentos de Hershey y Chase. Marcaron el ADN de las partículas vírales e incubaron con la célula huésped mientras que la proteína viral no. En 1955 Pauling mostró que en la anemia falciforme los glóbulos rojos se presentan en forma de hoz debido a una alteración de la molécula de hemoglobina. Lo que ocurría es que en la hemoglobina normal su cadena tiene un ácido glutámico en posición G, mientras que en la anemia falciforme tiene valina. Este hallazgo deja en claro algo fundamental: una mutación puntual en el ADN puede determinar el cambio de un aminoácido de la secuencia polipeptídica de una proteína. ESTRUCTURA DEL ADN Se hicieron numerosos estudios tendientes a conocer la Estructura del ADN. En 1.938 Astbury observó que sometiendo al ADN al análisis de difracción de rayos X presentaba reflexiones que corresponden a un espaciado regular de 3,4 Å a lo largo del eje de la fibras. Si bien el significado de ésta observación no estaba bien clara, porque se sabía que el ADN utilizado era impuro. Sin embargo, más tarde Franklin y Wilkins obtuvieron datos más precisos operando con fibras de ADN altamente purificadas y encontraron dos periodicidades de 3,4 Å y de 34 Å. En el periodo 1.949 – 1.953 Chargaff y Col explicaron métodos cromatográficos cuantitativos para la determinación analítica de las 4 bases del ADN. De dichos estudios se obtuvieron las siguientes conclusiones: Las muestras de ADN aisladas de diferentes tejidos de una misma especie poseen igual composición de bases. La composición de bases del ADN varía de una especie a otra. La composición de bases del ADN de una determinada especie no cambia con la edad, con el estado de nutrición, ni con los cambios ambientales. En todos los ADN examinados el número de restos de adenina es igual al de restos de timina (es decir: A = T); el número de restos guanínicos es igual al de los citosínicos (G = C ). La equivalencia de bases observadas en el ADN plantearon la posibilidad de que existe un nivel de organización estructural de las moléculas del ADN que sea compatible con ciertas equivalencias de bases, pero incompatibles con otras. Además ya se pensó en una conformación tridimensional para el ADN. De esta manera el escenario ya estaba dispuesto para proponer la conformación tridimensional del ADN. Es decir se contaba con tres elementos. 1. Tamaño de las bases; 2. Periodicidades observadas; 3. Equivalencia de ciertas bases. El interés en el problema se acrecentó ante la difícil interrogación de como podía replicarse el ADN con tanta fidelidad. En 1.953 Watson y Crick postularon un modelo tridimensional preciso para la estructura del ADN, basado en los datos de rayos X de Franklin y Wilkins y en las 95 equivalencias de bases observadas por Chargaff. Este modelo no solo explicaba las propiedades físicas y químicas del ADN, sino que sugería un mecanismo por medio del cual la información genética podía replicarse con exactitud. El modelo estructural del ADN de Watson y Crick consiste en dos cadenas polinucleotídicas dextrohelicoidales, arrolladas a un mismo eje y constituyendo una doble hélice. Las bases púricas y pirimídicas de cada hebra se encuentran en el interior de la doble hélice. El aparejamiento de las bases apartadas por ambas hebras es tal que solamente ciertas bases encajan en el interior de la estructura de manera que puedan unirse unas a otras por puentes hidrógeno. Las bases son: A-T y G-C Que son las parejas que muestran exacta equivalencia: núcleo de AyG N núcleo de TyC N N N N Si el par sería A - G serían demasiado grandes para poder encajar dentro de la doble hélice de estas dimensiones. Si la pareja fuera G - T las bases se encontrarían muy distanciadas para poder formar enlaces hidrógeno estables. A A G T T C A T T A C A G G T C Además los enlaces hidrógeno entre A – G y C – T son más débiles que A – T y G – C, o sea que la doble hélice implica aquellas parejas que poseen el máximo de estabilidad. ¿Por qué las dos periodicidades observadas con los rayos X?. Se postuló que la periodicidad de 3,4 Å se debe a que las bases están apretadamente apiladas al eje y mantienen una distancia de 3,4 Å de centro a centro. En cada espira de la hélice hay 10 nucleótidos y de una espira a otra hay 34 Å. Las bases hidrófobas están en el interior de la hélice, los restos carbohidratos y los fosfatos que poseen carga eléctrica están expuestas al H2 O . Así resulta que la doble hélice está estabilizada no sólo por los puentes hidrógeno entre les bases complementarias sino también por interacciones hidrofóbicas entre dichas bases apiladas. Las dos cadenas polinucleótidas de la doble hélice no son idénticas ni en la composición ni en la secuencia de bases. Ambas cadenas son complementarias una de la otra. Esta estructura conduce a un mecanismo por medio del cual la información genética puede replicarse con precisión. Dado que las dos hebras son complementarias una de la otra, y contienen información genética complementaria, se postuló que durante la división celular la réplica del ADN podría ocurrir por separación de las dos hebras, con lo que cada una haría de patrón especificador de la secuencia de bases de una nueva hebra complementaria sintetizada. EI resultado 96 final de este proceso consistiría en la formación de dos moléculas hijas de un ADN de doble hélice, cada una de las cuales contendría una de las hebras del progenitor. REPLICACION DEL ADN De acuerdo al dogma central de la genética molecular, quedó establecido que: ADN ARN proteínas O sea que éste dogma definió tres procesos fundamentales de los cuales el primero es el de REPLICA, es decir la "copia" del ADN con formación de moléculas hijas. Veremos como sucede éste proceso a nivel molecular. La característica más sorprendente de la hipótesis de Watson y Crick, desde el punto de vista genético, en su postulado de que las dos hebras del ADN duplohelicoidales son complementarias. La réplica de cada una de ellas conduce a dos moléculas hijas de ADN; cada una contiene una hebra del ADN progenitor. Este proceso se denomina réplica semiconservadora. Pero ¿Cómo pueden replicarse simultáneamente las dos hebras del ADN de modo que se formen al mismo tiempo. Éste mecanismo requiere tres enzimas: ADN - polimerasa dependiente del ADN ADN - ligasa Endodesoxiribonucleasa ADN – polimerasa Cataliza la síntesis de enlaces internucleótidos. Posee los siguientes requerimientos: 1). Presencia da ADN preformado 2). Presencia de los cuatro desoxiribonucleótidos trifosforados, los mono y difosforados son inactivos. 3). Mg++ ¿Qué papel desempeña el ADN preformado? Se han propuesto dos alternativas: 1. Que actúa como cebador, es decir, que al proporcionar un extremo o puntos de crecimiento, se pueden adicionar nuevos mononucleótidos. 97 hebra patrón hebra cebadora 2. O bien podría ser utilizado como patrón sobre el cual la enzima podría construir una hebra complementaria al ADN preformado. nd ATP d nd GTP ADN preformado nd CTP Mg++ d nd TTP d d ADN | AMP | GMP | CMP | TMP + 4 PPi Teniendo en cuenta estos requerimientos la reacción global sería así. Mecanismo de acción de la ADN – Polimerasa Si partimos de una hebra cebadora de ADN o sea de un ADN preformado: OH HO P H2C O O H Base H H O H P O O HO H O Base H H OH H O H O H P OH O P O OH P OH O P O PPi H2C OH PPi O O H + H2C OH H Base P OH H Base H H OH H OH H2C O H Base H H OH H OH 98 Hay un ataque al átomo de fósforo alfa del nucleótido trifosforado entrante y provoca el desplazamiento de su grupo pirofosfato, con formación de enlace internucleótido. El PPi formado es rápidamente hidrolizado por una pirofosfatasa por lo cual la reacción es muy exergónica. La dirección de la síntesis es por lo tanto 5’ --- 3'. ADN ligasa 1. Enlaza extremos de moléculas de ADN produciendo formas circulares. Ej.: bacterias. 2. Cataliza la reparación de roturas de una cadena de ADN. Requerimientos de la ADN ligasa 1. Presencia de NAD que actúa como fuente de grupos adenilo. 2. Una hebra intacta de ADN. Mecanismo de acción de la ADN ligasa O Base CH2 O P NMN OH NAD AMP 5' Dinucleótido constituído NMN y AMP OH H OH 3' H Base O 1. Enzima + NAD --------------- En - AMP + NMN. Se forma un complejo entre En y AMP y se forma NMN como producto secundario. 2. El grupo adenilo es transferido por la Enzima al extremo 5’ fosfato. 3. El extremo 3' OH desplaza al grupo adenilo y forma el enlace fosfodiéster. 99 OH O Base O CH2 O P O O OH P H2C ó Base O Adenina OH CH 2 O HO P O O OH Base O Base O Mecanismo de replicación Antes de hablar de la replicación es importante acotar que la cadena de ADN recién sintetizada se prolonga en dirección opuesta a la cadena de ADN patrón, es decir, tiene una polaridad opuesta o antiparalela. P 3' T T A 5' 3' cebadora P P 3' 5' 3' 5' 5' 3' A T T 3' P P Kornberg: postuló que la réplica comienza con la producción de una mella o una rotura en una hebra por acción de una endonucleasa. Unidades de MN adicionadas por la ADN polimerasa: 5' 5' 3' 3' 5' 3' La ADN polimerasa se fija a dicha rotura y comienza a prolongar el extremo 3' unidades de mononucléotidos. El extremo 5' se desplaza de la estructura duplex. Se sugiere que el extremo 5' 100 puede estar sujeto por adherencia a la membrana celular. La réplica continua durante cierto trecho mientras que el extremo 5' se va "pelando". La ADN polimerasa se desplaza de lugar, o salta, desde la hebra patrón intacta a la hebra mellada en el sitio donde se separan ambas hebras y comienza a adicionar unidades de mononucleótidos utilizando como patrón la fibra mellada. La replicación continúa hasta que el extremo se ha replicado por completo y entonces la enzima se retira. La endonucleasa rompe en la horquilla la hebra formada y el proceso vuelve a repetirse con la ADN polimerasa, que adiciona nuevas unidades de mononucleótidos. Los dos nuevos segmentos formados sobre la hebra patrón son unidos por la ADN ligasa y comienza un nuevo ciclo. 3' endonucleasa 5' 3' ADN polimerasa 5' 3' 5' ADN ligasa 101 TEMA XXV: LA TRASCRIPCION DE LA INFORMACION GENÉTICA ARN mensajero: teoría y propiedades del mensajero. La polimerasa del ARN dependiente del ADN. Mecanismo de acción: unión, iniciación, elongación y terminación de la trascripción. La réplica del ARN. Evidencias de que el ARN transporta la información genética: El ARN m es un buen candidato para transportar la información por una serie de evidencias: 1. El ARN tiene una estructura semejante a las cadenas del ADN y sus bases nucleotídicas pueden formar puentes hidrogeno con las bases del ADN siguiendo las reglas de complementariedad de Watson y Crick. 2. El ARN puede contener y transmitir información genética; ésto lo demuestra el hecho de que algunos virus no contienen ADN y su ARN puede actuar como agente infeccioso. Ej., el virus del mosaico del tabaco que causa infecciones virales en las hojas de las plantas. 3. El ARN se sintetiza en el núcleo, pero los ribosomas que están en el citoplasma, donde se realiza la síntesis proteica, contienen más del 70% del ARN celular. PROPIEDADES DEL ARN MENSAJERO 1. Recambio. En bacterias el ARN m tiene un activo metabolismo, se sintetiza y degrada rápidamente. Esta propiedad fue la clave de su aislamiento e identificación. Sin embargo existen ARN muy estables Ej.: el ARN m de los reticulocitos. 2. Relación entre la secuencia de bases del ADN y el ARN celular. El ARN m se sintetiza sobre una matriz de ADN o sea que el ARN m es el portador de la información. La enzima que cataliza esta síntesis es la ARN polimerasa dependiente del ADN. Mecanismo de acción de la ARN polimerasa Para obtener esta enzima en forma pura, Richard Burgen realizaron una electroforesis en gel de poliacrilamida. Así se pudo detectar 4 bandas por tinción de los polipéptidos. Lo que interesaba saber era si los 4 polipéptidos intervenían en la actividad de la enzima. Para ello eliminaron uno de los polipéptidos que denominaron factor (sigma). La eliminación de este factor cambió las propiedades de la enzima ya que perdió su capacidad de usar como matriz al ADN. La adición de factor restauraba la propiedad de la enzima de usar ADN como matriz. 102 Mecanismo de acción de la ARN polimerasa A. Unión de la ARN polimerasa al ADN: unión reversible unión estable: reconoce al promotor las hebras del ADN se separan La ARN polimerasa se une reversiblemente al ADN en varios sitios de éste. Sin embargo cuando esta unión se hace en una región específica que es el gen promotor el factor reconoce la secuencia nucleotídica y estabiliza el complejo ADN-ARN polimerasa. Esta estabilización permite que la enzima inicie la separación de las hebras de la doble hélice del ADN permitiendo la iniciación de la trascripción. B. Iniciación de la trascripción A T T A C T G A G G A C T A T G A T A T C T G A G G A A C T G A T A C T C G C T G A C 3' P P P OH P P P OH OH 5' P P P 103 A T T A C T G A G G A C T G A T Se forma el primer enlace internucleótido A P P C T G A P P C OH + P P 5' Una vez unida la enzima a un promotor en el ADN, se inicia la transcripción por unión de dos nucleótidos trifosforados a la enzima. En general todos los ARN comienzan a sintetizarse por ATP y GTP. Al tomar posición los dos primeros sustratos, el OH 3' del nucleótido trifosforado iniciador ataca el enlace fosfodiéster entre los fosfatos alfa y beta del segundo nucleótido y se forma el primer enlace internucléotido. Elongación de las cadenas nucleotídicas: A T T A C T G A G A G C T G A T A La enzima se desplaza por la hebra del ADN P P P C T C G A G P P A P OH 104 Cuando el producto de la elongación llega a un tamaño crítico el factor se libera. Las cadenas nucleotídicas crecen por adición secuencial de ribonucleótidos al extremo 3' del dinucleótido iniciador. La entrada de los diferentes sustratos depende de la complementariedad con las bases de la hebra del ADN que sirve de matriz. Terminación de la transcripción: 1. secuencia terminadora reconocida por la enzima 2. factor de terminación Ro ADN ARN enzima Ocurre por medio de dos mecanismos: Terminación codificada por una secuencia de ADN que es reconocido por la enzima. Por medio de un factor proteico adicional el cual tiene la propiedad de causar la terminación de la trascripción en sitios donde no funciona el primer mecanismo. Conclusión: la célula resuelve el "problema geográfico" transcribiendo la información genética contenida en el ADN del núcleo en un ARN que actúa como mensajero, pues lleva la información a los ribosomas citoplasmáticos donde se realiza la síntesis proteica. 105 TEMA XXVI: EL CODIGO GENETICO El codón: unidad de información, primeras ideas sobre la clave genética. Universalidad de la clave genética. Vamos a considerar dos cuestiones: 1. ¿Cómo se traslada el lenguaje de cuatro letras de los ácidos nucleicos al de veinte letras de las proteínas? 2. ¿Cuál es la correspondencia entre la secuencia nucleotídica y la secuencia de aminoácidos? Mediante consideraciones matemáticas, parecía probable que cada aminoácido fuera codificado por un número pequeño de nucleótidos consecutivos de la cadena ADN. Puesto que el ADN contiene sólo cuatro bases y las proteínas contienen veinte aminoácidos, es obvio que se requiere más de un nucleótido para codificar cada aminoácido. Si se disponen los nucleótidos en grupos de dos, rinden 4 2 16 combinaciones. Las 4 bases en combinaciones de 3, pueden codificar 4 3 64 aminoácidos distintos. O sea que un código de tripletes es utilizado para codificar aminoácidos. Composición de los Tripletes Los experimentos que se realizaron para conocer la composición de los tripletes fueron utilizando polirribonucleótidos sintéticos como mensajeros de ribosomas aislados de E. Coli. Incubaron ácido uridílico (poli - U) en una serie de tubos que contenían ribosomas de E. Coli privados de mensajero, además de todo lo necesario para la síntesis proteica, incluyendo todos los aminoácidos. Este estudio demostró que la cadena polipeptídica recién formada contenía solamente fenilalanina. En consecuencia, sugirieron que el vocablo del código para la fenilalanina era el triplete UUU. Por experimentos similares hallaron que el poli C codifica prolina, el poli A lisina, etc. Posteriormente prepararon polímeros de nucleótidos variando la relación cuantitativa de los distintos mononucleótidos que permitió identificar la composición de 50 vocablos del código para los distintos aminoácidos. Estos experimentos no sólo permitieron establecer como se "deletrea" el vocablo del código de cada aminoácido, sino que permitieron comprobar que algunos aminoácidos eran codificados por más de un triplete. Por ejemplo: fenilalanina es cofificada por UUU UUC serina es cofificada por UCU UCC UCA UCG El triplete de bases nucleotídicas que se encuentran en el ARN m y que codifica un aminoácido de denomina “codón”. 106 Características generales del código El código aminoácido es un código degenerado, es decir que hay más de un vocablo de codificación para la mayoría de los aminoácidos. Otra característica del código genético consiste en que no requiere señal indicadora del final de un codón y comienzo del siguiente. 3 de los 64 tripletes no codifican ninguno de los aminoácidos y son: UAG UAA - UGA. Estos tripletes constituyen una señal de terminación de las cadenas polipeptídicas. Universalidad del código Los vocablos del código aminoácido son idénticos en el hombre, en virus y en bacterias, es decir, es universal. A esta conclusión se llegó luego de una serie de ensayos. Se comparó 50 aminoacil - ARNt diferentes procedentes de especies muy distantes, y observaron sus respectivas capacidades para ser reconocidos por los codones aminoácidos previamente establecidos de E. Coli. Para ello se ensayó la capacidad de tales aminoacil - ARN t para unirse a ribosomas de E. Coli empleando sintéticos y se halló que en todos los casos los aminoacil - ARN t respondían perfectamente a los codones de E. Coli unidos a los ribosomas de este microorganismo. Considerando conjuntamente este hallazgo sugieren que el lenguaje genético es idéntico en todas las especies. 107 TEMA XXVII: LA TRADUCCION DE LA INFORMACION GENETICA Necesidad de una molécula adaptadora: el ARN de transferencia. El anticodón. Función de los ribosomas. El mecanismo de traducción: iniciación, elongación, translocación y terminación. Vamos a considerar ahora la tercera gran cuestión que plantea la continuidad genética de los organismos vivos. ¿Cómo se traslada la información genética contenida en la secuencia nucleótida del ARN m , de tal suerte que los aminoácidos se engarcen formando una cadena polipeptídica con una secuencia aminoácida específica? Trataremos los mecanismos enzimáticos por medio de los cuales se constituye la cadena polipeptídica, es decir, como se realiza la síntesis proteica. Además veremos el funcionamiento de los ribosomas asegurando la adecuada transferencia de la información del ARN m , y el papel adaptador del ARN t . Estructura ribosómica Los ribosomas sometidos a condiciones especiales se disocian en dos subunidades 50 S y 30 S cada uno de los cuales contiene ARN y varias proteínas. contiene dos componentes 50 S 30 S ARN y 30 proteinas diferentes contiene una molécula de ARN ribosomático y 20 proteínas diferentes Estructura del ARN de transferencia ( ARN t) El ARN t , posee una conformación tridimensional similar a una hoja de trébol de manera que presentan sus cadenas el máximo de aparejamiento intracatenario. G A | C | C Locus de enlace aminoácido 108 Anticodón (unión al ARNm) Todas las moléculas de ARN t tienen en un extremo la misma secuencia terminal C C A . El último resto, el ácido adenílico, es el locus que se esterifica al resto aminoácido. Además existe un triplete de bases que es distinto en todos los ARN t y representa el anticodón es decir, el triplete nucleótido especifico complementario de los tripletes del codón del ARN m . La molécula de ARN t contiene otro locus de unión para la enzima activadora. Una característica de la estructura es la presencia de bases secundarias además de las normales A – U – G y C. La mayoría son formas metiladas de las bases principales. El ARN t es solamente un "adaptador" de manera que puede ser adaptado al lenguaje de tripletes nucleótidos del código genético. Estadíos de la síntesis proteica Primer estadio: activación Los 20 AA se eterifican al ARN t correspondiente. Las enzimas que participan son: aminoacil- ARN t -sintetasas que tienen: a. tres locus de unión: o para el AA o para el ARN t o para el ATP b. son específicos: o para cada AA o para el correspondiente ARN t La reacción tiene lugar en el citoplasma. Primera fase de activación Se forma un producto intermedio unido a la enzima: Mg++ ácido amino acil adenílico + PPi ATP + AA O H O C C P R O P O P O OH + CH2 O OH Adenina NH2 R H O C C NH2 O O P OH O CH2 O + Adenina PPi 109 Segunda fase de activación Consiste en la transferencia del grupo aminoacilo del AMP al ARN t : ácido-aminoacil.adenílico + ARNt aminoacil - ARNt + ácido adenílico O sea que la reacción global sería AA + ARNt + ATP aminoacil - ARNt + AMP + PPi Tenemos entonces cada AA con su correspondiente ARN t . Segundo estadío: ribosomal En ribosomas. Los ribosomas tienen que captar al ARN m y al ARN t AA . 30 S LP LA 50 S Los ribosomas tienen dos locus de unión. 1. El locus peptidílico: (LP) para el ARNm que tiene unido el AA iniciador de la síntesis que es la metionina, la cual tiene su grupo amino bloqueado por un grupo formilo con el objeto de: a. que el grupo amino no forme enlace peptídico. b. que el locus peptidílico sólo acepte alARN t que tiene metionina. 2. El locus aminoacílico: que permite la entrada secuencial de los ARN t AA . El ribosoma para que puedan unirse el ARN m y el ARN t AA debe disociarse en sus dos subunidades. Participan en este proceso factores proteicos F1 F2 F3 (llamados también disociasaribosomal) y GTP. Estos factores permiten la disociación de los ribosomas y además la unión del ARN m en el lugar donde se inicia el mensaje. 110 30 S 30 S 30 S 50 S AA AA 50 S Tercer Estadío: Elongación La prolongación de una cadena tiene efecto en tres fases principales: 1.- Los ribosomas con su ARN m , tienen unido en el LP el ARN t AA iniciador de la síntesis (metionina). En el estadío de elongación, al locus aminoácido se une por su anticodón el ARN t AA de acuerdo al triplete de bases del codón. Este proceso requiere GTP y un factor T que es una proteína que cataliza este proceso de elongación. LP LA (metionina) AA AA 2.- En la segunda fase se forma el enlace peptídico por reacción entre el grupo amino del nuevo aminoacil - ARN t captado con el grupo carboxilo del AA ya existente en el LP. 111 NH NH R CH C O R CH O C HO LP O LP descargado NH NH2 R R CH C O C H C LA O O LA O ARNm Para la formación del nuevo enlace peptídico es necesario una enzima denominada peptidil-transferasa. El ARN t "descargado" que ya no lleva su AA, continúa unido al LP. El peptidil ARN t recién alargado está unido al LA. 3.- En la tercera fase del ciclo de alargamiento el peptidil - ARN t se desplaza físicamente desde el LA al LP y desaloja de este último al sitio del ARN t “descargado”. Esta compleja reacción de translocación se cree que es resultado de un cambio de conformación en el ribosoma, que tiene lugar a costa de la hidrólisis del GTP. Para esta fase se requiere una proteína especifica denominada factor G. Simultáneamente con la translocación del peptidil - ARN t tiene lugar la del ARN m que desplaza un codón a lo largo del ribosoma. O CH NH R C H C O LP O LA El proceso se repite, es decir entrando ARN t codifica la terminación. AA al LA hasta que el ARN m 112 Cuarto Estadío: Terminación de la cadena polipeptídica La terminación de una cadena polipeptídica completa y su despegue del ribosoma está señalada en el ARN m por tres codones especiales de terminación. La liberación del polipeptidil- ARN t del ribosoma, es inducido por un factor de liberación protéico que está unido al ribosoma y provoca la hidrólisis del enlace éster entre el polipéptido y el ARN t . El ribosoma 70 S se aparta del ARN m y queda libre. Cuando experimenta disociación en sus subunidades 50 S y 30 S puede recomenzar un nuevo ciclo.- 113 TEMA XXVIII: REGULACION DE LA SÍNTESIS PROTEICA Teoría de Jacob y Monod: Regulación transcripcional. Inducción. Represión. Las células vivas disponen de mecanismos que regulan la cantidad de proteínas que se sintetizan. Estos mecanismos de regulación fueron estudiados en células bacterianas y se observó que la cantidad de enzimas que se acumula en el medio depende de la naturaleza de los nutrientes. En base a todos estos estudios se distinguió dos tipos de respuestas: De inducción enzimática De represión enzimática INDUCCION Si estamos en presencia de una inducción a la enzima que se induce a que se sintetice se denomina enzima inducible. Esta enzima inducible se encuentra en pequeña cantidad en el medio, pero cuando se agrega un sustrato sobre el cual debe actuar su concentración aumenta para transformar a ese sustrato en un metabolito que puede ser utilizado por la célula. Ej.: un tipo de E. coli usa como fuente de carbono a la glucosa. Si en el medio en lugar de colocar glucosa colocamos lactosa, la célula inmediatamente comienza a sintetizar β -galactosidasa que desdobla la lactosa en galactosa y glucosa. Si volvemos a colocar glucosa, la enzima β -galactosidasa deja de sintetizarse y alcanza un nivel bajo. La mayoría de las enzimas inducibles catalizan las reacciones del catabolismo. Estas enzimas inducibles son diferentes a las enzimas constitutivas que se forman a velocidades constantes independientemente de la presencia del sustrato (por ej. las enzimas de la glicólisis). REPRESIÓN ENZIMATICA La célula tiene enzimas requeridas para la síntesis de los 20 aminoácidos. Si agregamos al medio un aminoácido, por ej. histidina, la enzima que le sintetizaba es reprimida y desaparece de la célula. Todas las enzimas inducibles están codificadas por genes. En los genes hay locus que determinan la formación de las enzimas. Un locus se denomina gen estructural, que es el que determina la secuencia de aminoácidos de la enzima. El otro locus, llamado gen regulador, es interruptor, es decir, que está determinando si el gen estructural se transcribe o no. O sea que el gen estructural codifica una enzima que se sintetiza normalmente siempre que el gen regulador no reprima su síntesis. Regulador Estructural 114 ¿Cómo funciona el gen regulador tanto en la represión como en la inducción? Jacob y Monod formularon una hipótesis general respecto a la función de los genes estructural y regulador) en los 2 procesos. Inducción El gen regulador transcribe un ARN mensajero que codifica una proteína denominada represor. ARNm regulador operador estructural represor Este represor tiene un locus de unión específico próximo al gen estructural. Este locus se denomina operador. ¿Qué sucede en una inducción, es decir, cuando se agrega al medio un sustrato que debe degradarse? El sustrato, que sería el inductor, se combina con el represor formando un complejo inductor-represor inactivo, que no puede unirse al operador. represor inductor El gen estructural queda libre y comienza a transcribirse y por lo tanto se sintetiza la enzima. La unión represor-inductor es reversible, o sea que cuando se elimina el inductor la síntesis de la enzima que lo degrada es reprimida. Represión Si agregamos al medio un aminoácido por ej. histidina, la célula no necesita utilizar las enzimas que lo sintetizan. regulador ARNm operador estructural represor 115 En este caso, la histidina se une al represor y forma un complejo represorcorrepresor que se combina al operador; el gen estructural no se transcribe y por lo tanto no se sintetiza histidina. Regulación coordinada También existe un mecanismo de regulación coordinada por el cual un grupo de enzimas puede ser reprimida o inducida por un sólo represor o por un sólo inductor. Por ejemplo, para sintetizar histidina se necesita un grupo de enzimas. Todas se encuentran codificadas en los genes ocupando locus vecinos. operador z x a b codifican las síntesis de histidina Este grupo de genes relacionados constituyen un operón; o sea que el operón se encuentra codificando todas las enzimas que participan en la biosíntesis de histidina. ¿Cómo se reprime un operón completo actuando un represor? Cuando el represor se une al operador no se sintetiza ninguna de las enzimas del operón. Si se elimina el represar se sintetizan todas las enzimas que codifica el operón. 116 BIBLIOGRAFIA 1. Blanco, A., (2008) Química Biológica. 8 Ed. Buenos Aires. 2. Griffihs, A. Miller, J., Suzuki, D., Lewontin, R., y Gelbart, W., (1995) Genética. 5°Ed. Editorial Interamericana. México. 3. Murray, R., Darylk, Granner, Meyer, P, & Rotewell, V., (1994) Bioquímica de Harper 22° Ed. Editorial El Manual Moderno. México. 4. Kuchel, P., & Ralston, G., (1994) Bioquímica General. Editorial Mac Graw Hill Interamericana. México. 5. Lehninger, A., (1981) “Bioquímica” Ediciones Omega. Barcelona. 6. MC Keen, T., 2003. Bioquímica. La base molecular de la vida. Mac Graw Hill Interamericana. 7. Smith, C., & Wood, E., (1998) Biosíntesis. Tercera Edición. Editorial Addison. Wesley Ibero 8. americana. USA. 9. Strayer, L., (1990) Bioquímica. Tomo I y II. Tercera Edición. Editorial Reverté. Buenos Aires. 10. Strayer, L.,(1995) Biochemistry. Quinta Edición. Freedman and company. USA. 11. Torres, H., Carminatti, H & Cardini, C., (1983) Bioquímica. Editorial El Ateneo. Buenos Aires. 12. Watson, J., (1978) Biología molecular del gen. Fondo Educativo Interamericano. España. 117