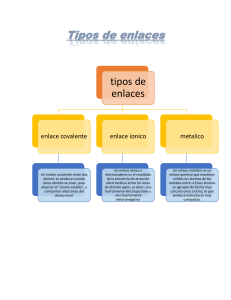
Fundamentos de Química Ing. Othoniel Hernández Ovando Fórmulas Químicas Una fórmula química expresa la composición de las moléculas y los compuestos iónicos, por medio de símbolos químicos. Composición significa no solamente los elementos presentes, sino la posición en la cual se combinan los átomos. La fórmula química es la representación de los elementos que forman un compuesto y la proporción en que se encuentran, o del número de átomos que forman una molécula. También brinda información adicional como la manera en la que se unen dichos átomos mediante enlaces químicos e incluso su distribución en el espacio. La fórmula química es la representación de los elementos que forman un compuesto y la proporción en que se encuentran, o del número de átomos que forman una molécula. También brinda información adicional como la manera en la que se unen dichos átomos mediante enlaces químicos e incluso su distribución en el espacio. La fórmula empírica indica cuales elementos están presentes y la relación mínima, en número entero, entre sus átomos; pero no necesariamente indica el número real de átomos en una molécula determinada. --Es la fórmula más sencilla para un compuesto-- En una fórmula empírica los subíndices se reducen a la razón de números enteros más sencilla. Ejemplo: Fórmula Molecular H2O2 Peróxido de Hidrogeno Relación entre los átomos de H y los de O es: 2:2 o 1:1 La fórmula empírica del Peróxido de Hidrogeno es: HO Ejemplo: Fórmula Molecular N2H4 Hidrazina Relación entre los átomos de N y los de H es: 1:2 La fórmula empírica del compuesto Hidrazina es: NH2 Ejemplo: CH2O es la fórmula empírica de los siguientes compuestos: C2H4O2 Acido Acético Todos tienen la misma fórmula CH2O Formaldehido empírica: CH O C6H12O6 Glucosa 2 Generalmente las fórmulas empíricas no nos dan mucha información sobre un compuesto. La fórmula molecular indica el número exacto de átomos de cada elemento que están presentes en la unidad más pequeña de una sustancia. --La fórmula molecular son las fórmulas verdaderas de las moléculas-- Sólo tiene sentido hablar de fórmula molecular en compuestos covalentes. Ejemplo Ejemplo H2 Hidrogeno O2 Oxigeno O3 Ozono H2O Agua C2H4O2 Acido Acético CH2O Formaldehido C6H12O6 Glucosa CCl4 Tetracloruro de Carbono H2O2 Peróxido de Hidrogeno CH4 Metano CO2 Dióxido de Carbono NH3 Amoniaco HNO3 Acido Nítrico Para muchas moléculas la fórmula empírica es igual a la fórmula molecular. Molécula Fórmula Empírica Fórmula Molecular Amoniaco NH3 NH3 Dióxido de Carbono CO2 CO2 Metano CH4 CH4 Agua H2O H2O HNO3 HNO3 Acido Nítrico Las fórmulas moleculares y empíricas nos indican la razón de combinación de los átomos en el compuesto pero no nos dicen nada sobre cómo están unidos los átomos entre sí. La fórmula estructural muestra el orden en el que se unen los átomos en una molécula y los tipos de enlace. Los enlaces se representan sobre un plano cartesiano. Etanol (Alcohol Etílico) Ejemplos: Hidrazina Acido Acético Folrmaldehido Metano Acido Nítrico Proyección de Fischer Proyección de Newman Estructura lineal Estructura ciclada http://recursostic.educacion.es/ciencias/biosfera/web/alumno/2bachillerato/biomol/contenidos6.htm Las moléculas tienen forma tridimensional. Las fórmulas empíricas o moleculares, no proporcionan ninguna información sobre la disposición espacial de los átomos. Las fórmulas estructurales a veces pueden mostrar esto, pero normalmente la única forma satisfactoria de representar las estructuras tridimensionales de las moléculas es construyendo modelos. En un modelo de barras y esferas, los centros de los átomos enlazados se representan por pequeñas esferas y los enlaces entre átomos por barras. El modelo de bolas y barras es fácil de interpretar, pero los átomos en una molécula están en contacto y no se encuentran separados como se indica en este modelo. Los modelos de barras y esferas muestran con claridad la distribución tridimensional de los átomos y son relativamente fáciles de construir. Sin embargo, el tamaño de las esferas no es proporcional al tamaño de los átomos. Como consecuencia, las barras por lo general exageran la distancia entre los átomos de una molécula. En un modelo espacial (de espacio lleno) los átomos están representados por esferas truncadas que se mantienen unidas a presión de tal manera que los enlaces no se ven. Na Acido Nítrico HNO3 C Cl Cloruro de Sodio NaCl O Monóxido de Carbono CO El tamaño de las esferas es proporcional al tamaño del átomo. Los modelos son más exactos porque muestran la diferencia del tamaño de los átomos. El inconveniente es que su construcción requiere más tiempo y no muestra bien la posición tridimensional de los átomos.