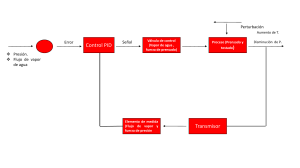
Ejercicio 1 T2 = 450℃ 𝑝2 = 20 𝑏𝑎𝑟 𝑎𝑏𝑠𝑜𝑙𝑢𝑡𝑜 𝑝1 = 0,1 𝑏𝑎𝑟 𝑎𝑏𝑠𝑜𝑙𝑢𝑡𝑜 a) Ciclo Rankine. Transformaciones y características Las transformaciones que caracterizan a este ciclo son: 1-2: Calentamiento isobárico. Se realiza en la caldera y el sobrecalentador. Se puede descomponer a su vez en los siguientes procesos: • Calentamiento isobárico, no isotérmico hasta la temperatura de saturación correspondiente a la isobara de salida de la bomba, que es también la isobara correspondiente a la presión que reina en la caldera. • Evaporación isobárico-isotérmica. • Recalentamiento isobárico. Se realiza en el sobrecalentador. 2-3: Expansión adiabático-isoentrópica. Se realiza en la turbina de vapor. El punto 2 es el comienzo de la expansión, el vapor a la entrada de la turbina puede ser húmedo, si el punto cae debajo de la curva de saturación, saturado, si el punto se encuentra en la curva de saturación, o sobrecalentado cuando esta mas allá de la curva de saturación, (punto 2). El punto 3 indica el final de la expansión y pueden presentarse también los tres casos definidos para el punto 2; el vapor puede ser húmedo, saturado y sobrecalentado. 3-4: Condensación isobárica. Se realiza en el condensador. Si el vapor a la entrada es recalentado, se enfría isobáricamente hasta convertirse en vapor saturado seco para luego condensarse isobárica-isotérmicamente. La condensación es completa hasta el estado de líquido saturado (x = 0); principal diferencia con el ciclo de Carnot. 4-1: Compresión adiabático-isoentrópica. Se realiza en la bomba en fase líquida. Los valores de interés son: • • • Presión p Volumen específico v Entalpía h • • Entropía s Título del vapor x b) Calor recibido y cedido por el ciclo 𝑄𝑟 = ℎ2 − ℎ1 El calor recibido por el ciclo se expresa como De las tablas de vapor se obtienen los siguientes valores de entalpía: ℎ2 = 3357 𝑘𝐽⁄𝑘𝑔 ℎ4 = 251,5 𝑘𝐽⁄𝑘𝑔 (450℃ 𝑦 20 𝑏𝑎𝑟) 𝑣𝑎𝑝𝑜𝑟 𝑠𝑜𝑏𝑟𝑒𝑐𝑎𝑙𝑒𝑛𝑡𝑎𝑑𝑜 (0,2 𝑏𝑎𝑟) 𝑒𝑠𝑡𝑎𝑑𝑜 𝑙𝑖𝑞𝑢𝑖𝑑𝑜 El trabajo realizado por la bomba es 𝑊𝐵 = ℎ1 − ℎ4 = 𝑣4 ∗ ∆𝑝 𝑊𝐵 = 1,017 Entonces 𝑑𝑚3 𝑘𝑔 𝑚3 𝑁 ∗ (20 − 0,2)𝑏𝑎𝑟 = 0,001017 𝑘𝑔 ∗ 1980000𝑚2 = 2,013 𝑘𝐽 𝑘𝐽 ℎ1 = 𝑊𝐵 + ℎ4 = 2,013𝑘𝑔 + 251,5𝑘𝑔 = 253,53 𝑘𝐽 𝑘𝐽 𝑄𝑟 = ℎ2 − ℎ1 = 3357𝑘𝑔 − 253,53𝑘𝑔 = 3103,47 El calor cedido por el ciclo se expresa como 𝑄𝑐 = −(ℎ3 − ℎ4 ) 𝑘𝐽 𝑘𝑔 𝑘𝐽 𝑘𝑔 𝑘𝐽 𝑘𝑔 No se conoce la entalpía del vapor a la entrada del condensador (punto 3), pero al tener la misma entropía que el punto 2, y obteniendo de la tabla de vapor la entropía del punto 3’ ubicado sobre la curva de saturación, se obtiene el título del vapor a la salida de la turbina: 𝑥= 𝑠3 − 𝑠4 (7,283 − 0,832) 𝑘𝐽⁄𝑘𝑔°𝐾 = = 0,91 𝑠3′ − 𝑠4 (7,907 − 0,832) 𝑘𝐽⁄𝑘𝑔°𝐾 Donde 𝑠3 = 𝑠2 = 7,283 𝑘𝐽⁄𝑘𝑔°𝐾 ; 𝑠3′ = 7,907 𝑘𝐽⁄𝑘𝑔°𝐾 𝑦 𝑠4 = 0,832 𝑘𝐽⁄𝑘𝑔°𝐾 fueron obtenidos de las tablas de vapor a la presión y estados correspondientes. Entonces 𝑘𝐽 Entonces c) 𝑘𝐽 𝑘𝐽 ℎ3 = ℎ4 + 𝑟𝑥 = 251,5 𝑘𝑔 + 2357,7𝑘𝑔 ∗ 0,91 = 2397𝑘𝑔 𝑘𝐽 𝑘𝐽 𝑘𝐽 � = −2145,5𝑘𝑔 𝑄𝑐 = −(ℎ3 − ℎ4 ) = − �2397𝑘𝑔 − 251,5𝑘𝑔 Trabajo cedido y absorbido por el ciclo Trabajo cedido por el ciclo: Tiene lugar en la turbina de vapor 𝑘𝐽 𝑘𝐽 𝑊𝑐 = 𝑊𝑇 = −(ℎ3 − ℎ2 ) = −(2397 − 3357)𝑘𝑔 = −960𝑘𝑔 Trabajo absorbido por el ciclo: tiene lugar en la bomba de alimentación de la caldera 𝑘𝐽 𝑊𝐵 = 2,013 𝑘𝑔 d) (Calculado en el inciso b) Rendimiento térmico teórico 𝜂= 𝑊𝑛 𝑊𝑇 − 𝑊𝐵 (960 − 2,013) 𝑘𝐽⁄𝑘𝑔 = = = 0,308 ≅ 30,87% 3103,47 𝑘𝐽⁄𝑘𝑔 𝑄𝑟 𝑄𝑟 e) Caudal de vapor para generar 1MW de potencia 𝑃𝑇 = 𝑚̇ ∗ 𝑊𝑇 ∗ 𝜂 𝑇 → 𝑚̇ = 𝑃𝑇 1𝑀𝑊 𝑘𝑔 𝑘𝑔 = = 1,3 = 4687,3 𝑘𝐽 𝑠 𝑊𝑇 ∗ 𝜂 𝑇 960𝑘𝑔 ∗ 0,8 ℎ Ejercicio 2 𝑚̇ = 5 𝑇𝑛⁄ℎ 𝑝 = 50 𝑘𝑔⁄𝑐𝑚2 𝑇 = 500℃ 𝑝𝑖 = 10 𝑘𝑔⁄𝑐𝑚2 𝑝𝑐 = 0,075 𝑘𝑔⁄𝑐𝑚2 a) Rendimiento térmico del ciclo De tabla se obtienen los siguientes valores: 𝑘𝐽 ℎ1 = 168,8𝑘𝑔 𝑘𝐽 ℎ2 = 763,1𝑘𝑔 𝑘𝐽 ℎ3 = 1154,5𝑘𝑔 𝑘𝐽 ℎ4 = 3433,77𝑘𝑔 𝑘𝐽 El valor ℎ5 puede hallarse teniendo en cuenta que 𝑠5 = 𝑠4 = 𝑠6 = 6,98𝑘𝑔 (obtenido de tabla) y conociendo 𝑘𝐽 la presión de extracción intermedia 𝑝𝑖 , del Diagrama de Mollier se obtiene que ℎ5 = 3000𝑘𝑔 El valor ℎ6 puede calcularse de la misma forma que ℎ5 , o por procedimiento analítico: el título del vapor a la salida de la turbina se calcula por medio de las entropías obtenidas de tabla 𝑥6 = 𝑠6 − 𝑠1 (6,98 − 0,576) 𝑘𝐽⁄𝑘𝑔 = = 0,834 𝑠6′ − 𝑠1 (8,25 − 0,576) 𝑘𝐽⁄𝑘𝑔 𝑘𝐽 𝑘𝐽 𝑘𝐽 ℎ6 = ℎ1 + 𝑟𝑥6 = 168,8𝑘𝑔 + 2405,5𝑘𝑔 ∗ 0,834 = 2174,98𝑘𝑔 Entonces de vaporización a la presión del condensador 𝑝𝑐 La cantidad específica de vapor extraído es: ℎ5 ∗ 𝑚 + ℎ1 = ℎ2 (1 + 𝑚), despejando 𝑚 se obtiene 𝑚= ℎ2 −ℎ1 ℎ5 −ℎ2 = (763,1−168,8)𝑘𝐽 ⁄𝑘𝑔 (3000−763,1)𝑘𝐽 ⁄𝑘𝑔 = 0,265 𝑘𝑔𝑣𝑎𝑝𝑜𝑟 𝑒𝑥𝑡𝑟𝑎𝑖𝑑𝑜 𝑘𝑔𝑣𝑎𝑝𝑜𝑟 donde 𝑟 es el calor latente Con estos datos es posible calcular el rendimiento térmico del ciclo 𝑘𝐽 𝑘𝐽 𝑊𝑇 (ℎ4 − ℎ5 )(1 + 𝑚) + (ℎ5 − ℎ6 ) (3433,77 − 3000)𝑘𝑔(1 + 0,265) + (3000 − 2174,98)𝑘𝑔 = = 𝜂= 𝑘𝐽 (ℎ4 − ℎ2 )(1 + 𝑚) 𝑄𝑟 (3433,77 − 763,1)𝑘𝑔 (1 + 0,265) b) 𝜂 = 0,4 Mejora del rendimiento respecto del ciclo sencillo de Rankine El rendimiento del ciclo sin la extracción intermedia sería: 𝜂´ = ℎ4 − ℎ6 (3433,77 − 2174,98) 𝑘𝐽⁄𝑘𝑔 = = 0,38 (3433,77 − 168,8) 𝑘𝐽⁄𝑘𝑔 ℎ4 − ℎ1 El rendimiento, como es de esperarse, es menor al del ciclo con extracción intermedia, que mejora el rendimiento en un 2%. c) Potencia que podría ceder el ciclo La potencia que podría ceder el ciclo es 𝑁𝑐𝑖𝑐𝑙𝑜 = 𝑁𝑇 − (𝑁𝐵1 + 𝑁𝐵2 ) ; pero la potencia de las bombas es despreciable comparada a la obtenida en el eje de la turbina, por lo que puede considerarse que 𝑁𝑐𝑖𝑐𝑙𝑜 ≈ 𝑁𝑇 𝑚̇𝑒 = 𝑚̇ ∗ 𝑚 = 5000𝑘𝑔 ∗ 0,265 = 1325 ℎ La cantidad de vapor extraído es La potencia de la turbina de vapor es 𝑘𝑔 𝑁𝑇 = 𝑚̇(ℎ4 − ℎ5 ) + (𝑚̇ − 𝑚̇𝑒 )(ℎ5 − ℎ6 ) 𝑘𝐽 𝑘𝑔 𝑘𝑔𝑣𝑎𝑝𝑜𝑟 𝑒𝑥𝑡𝑟𝑎𝑖𝑑𝑜 𝑘𝐽 ℎ 𝑁𝑇 = 5000 ℎ (3433,77 − 3000)𝑘𝑔 + (5000 − 1325) ℎ (3000 − 2174,98)𝑘𝑔 = 52000798,5 d) 𝑁𝑇 = 14444,67 𝑘𝑊 ≈ 14,45𝑀𝑊 𝑘𝐽 ℎ Consumo específico de vapor El consumo específico de vapor es la cantidad de vapor necesaria para generar una potencia de 1 MW en el eje de la turbina 𝑚̇𝑒𝑠𝑝 = 𝑚̇ 5000 𝑘𝑔⁄ℎ 𝑘𝑔 = = 346 𝑁𝑇 14,45 𝑀𝑊 ℎ ∗ 𝑀𝑊 Se necesitan 346 kg de vapor por hora para producir 1 MW de potencia en la turbina Ejercicio 3 𝑚̇ = 2 𝑇𝑛⁄ℎ 𝑝 = 5 𝑘𝑔⁄𝑐𝑚2 (Manométrica) 𝑝𝑐 = 9 𝑘𝑔⁄𝑐𝑚2 (Manométrica) 𝐻 = 2 𝑘𝑔⁄𝑐𝑚2 a) Proceso térmico del agua y del vapor La válvula reductora de presión, reduce la presión del vapor producido en la caldera de 10 a 6 kilos de presión absoluta, el proceso mantiene constante la entalpía del vapor, por lo que el estado del vapor a la entrada del proceso es el de vapor sobrecalentado a 6 kilos de presión absoluta b) Energía cedida en el proceso Los valores de entalpía se obtienen de tabla 𝑘𝑔 𝑘𝐽 𝑄𝑐 = 𝑚̇(ℎ1 − ℎ2 ) = 2000 ℎ (2778 − 670,4)𝑘𝑔 𝑄𝑐 = 4215200 c) 𝑘𝐽 ℎ Revaporizado perdido en el tanque de agua de alimentación Después del proceso, el líquido condensado se descarga al tanque que se encuentra abierto a la atmósfera, por lo que los valores de entalpía a utilizar en el cálculo son los correspondientes al estado líquido a 6 y 1 kilos de presión absoluta respectivamente. Ejercicio 4 %𝑟𝑒𝑣𝑎𝑝𝑜𝑟𝑖𝑧𝑎𝑑𝑜 = 𝑝1 = 0,98 𝑘𝑔⁄𝑐𝑚2 ℎ2 − ℎ𝑎𝑡𝑚 (670,4 − 417,5) 𝑘𝐽⁄𝑘𝑔 = = 0,11 = 11% 2257,7 𝑘𝐽⁄𝑘𝑔 𝑟𝑎𝑡𝑚 𝜂𝑖 = 0,78 𝑇1 = 27℃ 𝑘 = 1,4 (Aire frío) 𝑘𝐽 𝑄𝑎 = 1500𝑘𝑔 = 358.2𝐾𝑐𝑎𝑙 𝑘𝑔 𝜂𝑣 = 0,95 𝑉𝑡 = 2,2 𝑙𝑡𝑠 = 0,0022 𝑚3 𝜆 = 8: 1 (Relación de compresión) 𝑛 = 1200 𝑟𝑝𝑚 𝜂𝑚 = 0,85 𝑘 = 1,3 (Aire caliente) a) Estado del gas en puntos característicos y trabajo específico Punto 1 𝑣1 = 𝑅∗𝑇1 = 𝑝1 𝐽 286,9𝑘𝑔°𝐾 ∗300,15°𝐾 0,98𝑘𝑔⁄𝑐𝑚2 𝑝1 = 0,98 𝑘𝑔⁄𝑐𝑚2 = 0,878 𝑚3 𝑘𝑔 𝑇1 = 27℃ = 300,15°𝐾 Punto 2 𝑇1 𝑇2 𝑣 = � 2� 𝑣2 = 𝑣1 𝑣1 𝜆 𝑘−1 = 1 𝑘−1 =� � 0,878𝑚3 ⁄𝑘𝑔 𝑝1 𝑣1𝑘 = 𝑝2 𝑣2𝑘 Punto 3 8 𝑣 Punto 4 𝑝2 → → 𝑘𝑔 300,15°𝐾 1 1,4−1 8 � � = 689,56°𝐾 𝑘𝑔 𝑘 𝑇3 = 𝑇3 𝑝 𝑇2 2 = 𝑄1 𝑐𝑣 + 𝑇2 = 2779,94°𝐾 689,56°𝐾 358,5𝐾𝑐𝑎𝑙 ⁄𝑘𝑔 0,1715𝐾𝑐𝑎𝑙 ⁄𝑘𝑔°𝐾 𝑘𝑔 18,01𝑐𝑚 2 = 72,6 𝑘𝑔 𝑐𝑚2 + 689,56°𝐾 = 2779,94°𝐾 𝑘𝑔 𝑐𝑚2 𝑚3 𝑘𝑔 𝑇4 𝑣1𝑘−1 = 𝑇3 𝑣2𝑘−1 → 𝑝4 𝑣1𝑘 = 𝑝3 𝑣2𝑘 = 𝐾𝑐𝑎𝑙 𝑘𝐽 𝑐𝑣 = 0,1715𝑘𝑔°𝐾 = 0,717𝑘𝑔°𝐾 𝑚3 𝑝3 = 𝑣4 = 𝑣1 = 0,878 𝑚3 𝑣2 𝑣3 = 𝑣2 = 0,1097 𝑝3 = 0,1097 𝑇1 1 𝑘−1 � � 𝜆 𝑘𝑔 1,4 𝑝2 = 𝑝1 � 1 � = 𝑝1 𝜆𝑘 = 0,98𝑐𝑚 = 18,01 2 ∗8 → 𝑄𝑎 = 𝑐𝑣 (𝑇3 − 𝑇2 ) 𝑇3 = 𝑇2 → 𝑇2 = 𝜆 → 1 𝑘−1 𝑇4 = 𝑇3 � � 𝑝4 = 𝑝3 𝜆𝑘 = 𝜆 1 1,3−1 = 2779,94°𝐾 � � 72,6𝑘𝑔⁄𝑐𝑚2 81,3 Los valores hallados se resumen en la Tabla 1 = 4,86 𝑘𝑔 8 = 1489,73°𝐾 𝑐𝑚2 Tabla 1. Estados del gas en los puntos característicos del ciclo Otto Punto 1 Punto 2 Punto 3 Punto 4 Presión [kg/cm2] 0,98 18,01 72,6 4,86 Volumen específico [m3/kg] 0,878 0,1097 0,1097 0,878 Trabajo específico: es el producto del trabajo neto por el rendimiento efectivo 𝜂𝑡 = 1 − 𝑄𝑐 𝑄𝑎 =1− 𝑐𝑣 (𝑇4 −𝑇1 ) 𝑄𝑎 =1− 𝑘𝐽 (1489,73−300,15)°𝐾 0,717𝑘𝑔°𝐾 1500𝑘𝐽⁄𝑘𝑔 = 0,431 𝑘𝐽 𝑘𝐽 (1489,73 − 300,15)°𝐾 = 852,93𝑘𝑔 Donde 𝑄𝑐 = 𝑐𝑣 (𝑇4 − 𝑇1 ) = 0,717𝑘𝑔°𝐾 Temperatura [°K] 300,15 689,56 2779,94 1489,73 𝑊𝑛 = 𝑄𝑎 − 𝑄𝑐 = (1500 − 852,93) 𝑘𝐽 𝑘𝑔 El rendimiento efectivo se define como 𝑘𝐽 = 647,07 𝑘𝑔 𝜂𝑒 = 𝜂𝑡 ∗ 𝜂𝑖 ∗ 𝜂𝑚 = 0,431 ∗ 0,78 ∗ 0,85 = 0,286 El trabajo específico es 𝑊𝑒𝑠𝑝 = 𝑊𝑛 ∗ 𝜂𝑒 = 647,07 b) 𝑘𝐽 𝑘𝑔 ∗ 0,286 = 185,06 Masa real de aire admitido y trabajo realizado 𝑘𝐽 𝑘𝑔 𝑘𝑔 3 𝑚𝑡 = 𝜌𝑎𝑖𝑟𝑒 ∗ 𝑉𝑡 ∗ 𝑛𝑐 = 1,164𝑚 3 ∗ 0,0022𝑚 ∗ 6 = 0,0154𝑘𝑔 Donde 𝜌𝑎𝑖𝑟𝑒 se obtiene de tabla a 20°C y 1 atm de presión y 𝑛𝑐 es el número de cilindros. Entonces: 𝜂𝑣 = c) 𝑚𝑎 𝑚𝑡 → 𝑚𝑎 = 𝜂𝑣 ∗ 𝑚𝑡 = 0,95 ∗ 0,0154𝑘𝑔 = 0,0146𝑘𝑔𝑎𝑖𝑟𝑒 𝑎𝑑𝑚𝑖𝑡𝑖𝑑𝑜 𝑊 = 𝑚𝑎 ∗ 𝑊𝑒𝑠𝑝 = 0,0146𝑘𝑔 ∗ 185,06 Presión media indicada y Presión media efectiva 𝑘𝐽 = 2,7𝑘𝐽 𝑘𝑔 Presión media indicada: es la presión teórica constante que, si actúa sobre el pistón durante la carrera de trabajo, produce la misma potencia que la desarrollada dentro del motor por la combustión. 𝑝𝑚𝑖 = 𝑊𝑛 𝑉𝑐𝑖𝑙𝑖𝑛𝑑𝑟𝑎𝑑𝑎 = 𝑊𝑛 647,07 𝑘𝐽⁄𝑘𝑔 𝑘𝐽 𝑘𝑔 = = 842,21 3 = 8,59 2 3 𝑚 𝑣1 − 𝑣2 (0,878 − 0,1097) 𝑚 ⁄𝑘𝑔 𝑐𝑚 Presión media efectiva: es la presión teórica constante que, si actúa sobre el pistón durante la carrera de trabajo, produce la misma potencia que la obtenida en el eje del motor d) 𝜂𝑚 = 𝑝𝑚𝑒 𝑝𝑚𝑖 → Potencia en el eje Caudal teórico de aire 𝐺𝑡 = 𝑚𝑡 ∗𝑛 60∗2 𝑝𝑚𝑒 = 𝑝𝑚𝑖 ∗ 𝜂𝑚 = 8,59 = 0,0154𝑘𝑔∗1200𝑟𝑝𝑚 120 𝐺𝑟 = 𝐺𝑡 ∗ 𝜂𝑣 = 0,154 Caudal real de aire 𝑘𝑔 𝑠 𝑁𝑒 = 𝐺𝑟 ∗ 𝑊𝑒 = 0,146 Potencia en el eje 𝑘𝑔 𝑠 = 0,154𝑘𝑔 𝑠 ∗ 0,95 = 0,146 𝑊𝑒 = 𝜂𝑒 ∗ 𝑄𝑎 = 0,286 ∗ 1500 Trabajo en el eje 𝑘𝑔 𝑘𝑔 ∗ 0,85 = 7,3 2 2 𝑐𝑚 𝑐𝑚 𝑘𝐽 𝑘𝑔 = 429 𝑘𝑔 𝑠 𝑘𝐽 𝑘𝑔 𝑘𝐽 ∗ 429𝑘𝑔 = 62,63𝑘𝑊 = 84𝐶𝑉 El motor no puede entregar 110 CV en el eje en estas condiciones de funcionamiento debido a su bajo rendimiento y a que está funcionando a bajas vueltas (1200 rpm). e) Cupla motora 𝑁𝑒 = 𝑀𝑡 ∗ 𝑛 716,2 → 𝑀𝑡 = 716,2𝑁𝑒 716,2 ∗ 84𝐶𝑉 = = 50,18𝑁𝑚 1200𝑟𝑝𝑚 𝑛 Ejercicio 5 𝑝1 = 1 𝑏𝑎𝑟 𝑇1 = 300°𝐾 𝜏 = 20 (Relación de compresión) 𝜌 = 2 (Relación de expansión en la inyección) a) Presión, Volumen y temperatura en cada punto del ciclo Punto 1 𝑝1 = 1 𝑏𝑎𝑟 𝑇1 = 300°𝐾 Punto 2 𝑣2 = 𝑣1 = 𝜏 0,86𝑚3 ⁄𝑘𝑔 𝑣 𝑘 20 = 0,043 𝑣1 = 𝑅∗𝑇1 𝑝1 = 286,9𝐽⁄𝑘𝑔°𝐾 ∗300°𝐾 1 𝑏𝑎𝑟 = 0,86 𝑚3 𝑘𝑔 𝑝2 = 𝑝1 � 1 � = 𝑝1 𝜏 𝑘 = 1𝑏𝑎𝑟 ∗ 201,4 = 66,29 𝑏𝑎𝑟𝑒𝑠 𝑇2 = 𝑣2 𝑝2 ∗𝑣2 𝑅 Punto 3 = 66,29 𝑏𝑎𝑟∗0,043𝑚3 ⁄𝑘𝑔 286,9𝐽⁄𝑘𝑔°𝐾 𝑝3 = 𝑝2 = 66,29 𝑏𝑎𝑟𝑒𝑠 3 = 994,35°𝐾 𝑣3 = 𝜌 ∗ 𝑣2 = 2 ∗ 0,043𝑚 = 0,086 𝑘𝑔 𝑇3 𝑇2 = 𝑣3 𝑣2 =𝜌 → Punto 4 𝑚3 𝑘𝑔 𝑇3 = 𝜌 ∗ 𝑇2 = 2 ∗ 994,35°𝐾 = 1988,7°𝐾 3 𝑣4 = 𝑣1 = 0,86𝑚 𝑘𝑔 𝑣 𝑘 𝑝4 = 𝑝3 � 3 � = 66,29 𝑏𝑎𝑟𝑒𝑠 � 𝑇4 = 𝑣4 𝑝4 ∗𝑣4 𝑅 = 2,64 𝑏𝑎𝑟∗0,86𝑚3 ⁄𝑘𝑔 286,9𝐽⁄𝑘𝑔°𝐾 0,086 1,4 𝑚3 � 𝑘𝑔 0,86 = 791,7°𝐾 = 2,64𝑏𝑎𝑟𝑒𝑠 Los valores hallados se resumen en la Tabla 2 Tabla 2. Estados del gas en los puntos característicos del ciclo Diesel Punto 1 Punto 2 Punto 3 Punto 4 Presión [bar] 1 66,29 66,29 2,64 Volumen [m3/kg] 0,86 0,043 0,086 0,86 Temperatura [°K] 300 994,35 1988,7 791,7 𝑚3 𝑘𝑔 b) Calores aportados y rechazados por el ciclo Calor aportado 𝑘𝐽 (1988,7 − 994,35)°𝐾 = 998,23 𝑄𝑎 = 𝑐𝑝 (𝑇3 − 𝑇2 ) = 1,0039𝑘𝑔°𝐾 Calor rechazado 𝑘𝐽 (791,7 − 300)°𝐾 = 352,55 𝑄𝑐 = 𝑐𝑣 (𝑇4 − 𝑇1 ) = 0,717𝑘𝑔°𝐾 c) Trabajo y rendimiento térmico del ciclo 𝑊𝑛 = 𝑄𝑎 − 𝑄𝑐 = (998,23 − 352,55) 𝜂𝑡 = 1 − 1 𝜏𝑘−1 Ejercicio 6 � 𝜌𝑘 −1 𝑘(𝜌−1) �=1− 1 201,4−1 � 𝑘𝐽 𝑘𝑔 = 645,66 21,4 −1 1,4(2−1) 𝑘𝐽 𝑘𝑔 𝑘𝐽 𝑘𝑔 𝑘𝐽 𝑘𝑔 � = 0,65 𝑇3 = 1300°𝐾 (Entrada de la turbina) 𝑇1 = 300°𝐾 (Entrada del compresor) 𝑟𝑝 = 𝑝2 𝑝1 =8 𝑚̇ = 45,5 𝑘𝑔⁄𝑠 𝛾𝑎𝑖𝑟𝑒 = 1,4 a) Temperatura del gas a la salida del compresor y de la turbina Temperatura a la salida del compresor 𝑇1 𝑇2 = 𝑇4 𝑇3 𝑝1 =� � 𝑝2 𝛾−1 𝛾 1 𝛾−1 𝛾 =� � 𝑟𝑝 → Temperatura a la salida de la turbina 1 𝑇4 = 𝑇3 � � b) 𝑟𝑝 𝛾−1 𝛾 1 = 1300°𝐾 � � Eficiencia del ciclo 8 1,4−1 1,4 𝜂𝑡 = 1 − 𝑇2 = 𝑇1 𝛾−1 𝛾 1 � � 𝑟𝑝 = 300°𝐾 1,4−1 1 � � 1,4 8 = 543,43°𝐾 = 717,66°𝐾 𝑇4 𝑇1 717,66°𝐾 =1− =1− = 0,448 ≈ 44,89% 1300°𝐾 𝑇3 𝑇2 c) Potencia requerida para impulsar el compresor 𝑘𝐽 𝑘𝐽 𝑊𝐶 = ℎ2 − ℎ1 = 𝑐𝑝 (𝑇2 − 𝑇1 ) = 1,005𝑘𝑔°𝐾(543,43 − 300)°𝐾 = 244,65𝑘𝑔 𝑘𝑔 d) 𝑘𝐽 𝑁𝐶 = 𝑚̇ ∗ 𝑊𝐶 = 45,4 𝑠 ∗ 244,65𝑘𝑔 = 11106,98𝑘𝑊 ≈ 11𝑀𝑊 Potencia útil que el ciclo podría desarrollar El trabajo neto es 𝑊𝑛 = 𝑊𝑇 − 𝑊𝐶 donde el trabajo de la turbina vale 𝑘𝐽 𝑘𝐽 𝑊𝑇 = ℎ3 − ℎ4 = 𝑐𝑝 (𝑇3 − 𝑇4 ) = 1,005𝑘𝑔°𝐾(1300 − 717,66)°𝐾 = 585,25𝑘𝑔 Y la potencia útil del ciclo es 𝑘𝑔 Ejercicio 7 𝑘𝐽 𝑁𝑢 = 𝑚̇ ∗ 𝑊𝑛 = 45,4 𝑠 ∗ (585,25 − 244,65)𝑘𝑔 = 15463,32𝑘𝑊 ≈ 15,46𝑀𝑊 𝑝1 = 15 𝑏𝑎𝑟𝑒𝑠 𝑇1 = 197,4℃ 𝑝2 = 1𝑎𝑡𝑚 ≈ 1𝑏𝑎𝑟 𝑇2 = 120℃ Generalmente, la presión y la temperatura no son datos suficientes para conocer el estado del vapor mediante alguno de los Diagramas de Vapor de Mollier o de Izart, o de las tablas de vapor. Pero en este caso, considerando que 1𝑏𝑎𝑟 ≈ 1 𝑘𝑔⁄𝑐𝑚2 , de las tablas de vapor se puede ver que la temperatura de saturación TS para la presión p1 es igual a T1. El proceso de estrangulación del vapor se realiza a entalpía constante, o sea, ℎ1 = ℎ2 𝑦 𝑑𝑄 = 0, entonces, para 15 bares-197,4°C y 1bar-120°C; ℎ𝑣𝑠 = 649 𝑘𝑐𝑎𝑙 ⁄𝑘𝑔 (vapor sobrecalentado a 1bar-120°C); y ℎ𝑙 = 200,7 𝑘𝑐𝑎𝑙 ⁄𝑘𝑔 (líquido saturado a 15 bares y temperatura de saturación 𝑇𝑠 = 𝑇1 = 197,4℃ ) y 𝑟 = 465,9 𝑘𝑐𝑎𝑙 ⁄𝑘𝑔 (calor de vaporización a 15 bares-197,4°C). Por lo tanto ℎ2 = ℎ1 = ℎ𝑣𝑠 = ℎ𝑙 + 𝑟𝑥 Gráficamente: → 𝑥= ℎ𝑣𝑠 − ℎ𝑙 (649 − 200,7) 𝑘𝑐𝑎𝑙 ⁄𝑘𝑔 = = 0,962 465,9 𝑘𝑐𝑎𝑙 ⁄𝑘𝑔 𝑟 Ejercicio 8 𝑝1 = 70 𝑘𝑔⁄𝑐𝑚2 𝑝2 = 10 𝑘𝑔⁄𝑐𝑚2 𝑇 = 27℃ 𝑝 = 1𝑎𝑡𝑚 De tabla se obtiene: ℎ1 = 1267,4 𝑘𝐽⁄𝑘𝑔 (A 70 kg/cm2) 𝑟 = 2014,9 𝑘𝐽⁄𝑘𝑔 (A 10 kg/cm2) ℎ𝐿 = 763,1 𝑘𝐽⁄𝑘𝑔 (A 10 kg/cm2) ℎ1 = ℎ2 = ℎ𝐿 + 𝑟𝑥 Despejando 𝑥 resulta Ejercicio 9 𝑥= 𝑘𝑔𝑣𝑎𝑝𝑜𝑟 ℎ1 − ℎ𝐿 (1267,4 − 763,1) 𝑘𝐽⁄𝑘𝑔 = = 0,25 ⁄ 2014,9 𝑘𝐽 𝑘𝑔 𝑟 𝑘𝑔𝑙𝑖𝑞𝑢𝑖𝑑𝑜 𝑚̇ = 1 𝑡𝑛⁄ℎ = 0,277𝑘𝑔/𝑠 𝑝 = 4 𝑏𝑎𝑟𝑒𝑠 (Relativos) 𝑥 = 90% 𝐻 = 5𝑚 𝑝𝑡 = 0,5 𝑏𝑎𝑟 (Relativos) 𝑑𝑡 = 2´´ = 50,8𝑚𝑚 Del diagrama de Mollier se obtiene 𝑣𝑒 = 0,3 𝑚3 ⁄𝑘𝑔 (A 5 bares absolutos y 𝑥 = 0,9) a) Velocidad del vapor en la tubería de bajada 3 b) ∗ 0,3𝑚 0,277𝑘𝑔 𝑄 𝑚̇ ∗ 𝑣𝑒 𝑚 𝑘𝑔 𝑠 𝑣= = = = 41,11 2 2 𝐴 𝜋𝑑 ⁄4 𝜋(0,0508𝑚𝑚) /4 𝑠 Energía total transferida en el proceso El proceso ocurre a presión constante ℎ1 − ℎ2 = 𝑟 = 504,2 𝑘𝑐𝑎𝑙 ⁄𝑘𝑔 (A 5 bares absolutos) 𝑘𝑐𝑎𝑙 𝑘𝑔 𝑄𝑐 = 𝑟 ∗ 𝑚̇ = 504,2 𝑘𝑔 ∗ 1000 ℎ = 504200 𝑘𝑐𝑎𝑙 ℎ c) Revaporizado perdido por el venteo El revaporizado formado por la descarga de condensado dentro del tanque presurizado a 1,5 bares, escapa directamente a la atmósfera a través del venteo. ℎ𝑙5𝑏𝑎𝑟 − ℎ𝑙1,5𝑏𝑎𝑟 (152,1 − 110,99) %𝑟𝑒𝑣 = = 𝑟1,5𝑏𝑎𝑟 532,1𝑘𝑐𝑎𝑙 𝑘𝑔 d) 𝑚̇𝑟𝑒𝑣 = %𝑟𝑒𝑣 ∗ 𝑚̇ = 0,0772 ∗ 1000 Cantidad de agua fría de reposición 𝑘𝑐𝑎𝑙 𝑘𝑔 = 0,0772 = 7,72% 𝑘𝑔 𝑘𝑔 = 77,26 ℎ ℎ 𝑇 = 95℃ (Tanque de alimentación) 𝑇𝑎𝑟 = 20℃ (Agua de reposición) 𝑣𝑒 = 0,001052 𝑚3 𝑘𝑔 (Volumen específico del agua a 1,5 bares absolutos) Considerando que el nivel del tanque de alimentación se debe mantener constante, la cantidad de agua de reposición que debe bombearse al tanque es la misma masa que se pierde en revaporizado, o sea, 77,26 kg/h, por lo tanto: 𝑚3 Ejercicio 10 𝑘𝑔 𝑣̇ 𝐻2 𝑂 = 𝑣𝑒 ∗ 𝑚̇𝑟𝑒𝑣 = 0,001052 𝑘𝑔 ∗ 77,26 ℎ = 0,081 𝑣̇ 𝑎𝑖𝑟𝑒 = 20000 𝑚3 ⁄ℎ 𝑚3 𝑙𝑡𝑠 ≈ 81,28 ℎ ℎ 𝑘𝐽 𝑐𝑝 𝑎𝑖𝑟𝑒 = 0,24𝑘𝑐𝑎𝑙 = 1,005𝑘𝑔°𝐾 𝑘𝑔℃ 𝜌 = 1,15 𝑘𝑔⁄𝑚3 𝑇𝑒 = 25℃ 𝑇𝑠 = 130℃ 𝑝 = 7 𝑏𝑎𝑟𝑒𝑠 𝑚𝑎𝑛𝑜𝑚𝑒𝑡𝑟𝑖𝑐𝑜𝑠 a) Cantidad de vapor requerido El flujo másico de aire es 𝑚̇𝑎 = 𝜌𝑣̇ 𝑎𝑖𝑟𝑒 = 1,15 𝑘𝑔⁄𝑚3 ∗ 20000 𝑚3 ⁄ℎ = 23000 𝑘𝑔⁄ℎ El calor que transfiere en el proceso vale 𝑘𝑔 𝑘𝑐𝑎𝑙 𝑄 = 𝑚̇𝑎 ∗ 𝑐𝑝 𝑎𝑖𝑟𝑒 ∗ ∆𝑇 = 23000 ℎ ∗ 0,24𝑘𝑔℃ ∗ (130 − 25)℃ = 579600 𝑘𝑐𝑎𝑙 ℎ Sabiendo que 𝑄 = 𝑟 ∗ 𝑚̇𝑣 donde 𝑟 = ℎ𝑣 − ℎ𝑙 = 489,8 𝑘𝑐𝑎𝑙 ⁄𝑘𝑔 (a 8 bares absolutos), es el calor latente de vaporización, ya que el proceso se lleva a cabo a presión constante. Entonces 𝑚̇𝑣 = 𝑄 579600 𝑘𝑐𝑎𝑙 ⁄ℎ 𝑘𝑔𝑣 = = 1184,34 𝑟 489,8 𝑘𝑐𝑎𝑙 ⁄𝑘𝑔 ℎ b) c) Cantidad de Revaporizado formado en el tanque de trasvase ℎ𝑙8𝑏𝑎𝑟 − ℎ𝑙1𝑏𝑎𝑟 (171,4 − 99,19) %𝑟𝑒𝑣 = = 𝑟1𝑏𝑎𝑟 539,6𝑘𝑐𝑎𝑙 𝑘𝑔 Diferencia de temperatura media logarítmica 𝑘𝑐𝑎𝑙 𝑘𝑔 = 0,139 = 13,9% 𝑇𝑠𝑎𝑡 = 169,6℃ (Temperatura de saturación del vapor a 8 bares absolutos) La expresión de la diferencia de temperatura media logarítmica, que relaciona las diferencias de temperatura a la entrada y a la salida del proceso de transferencia de calor es ∆𝑇𝑚𝑙 = ∆𝑇𝑠 − ∆𝑇𝑒 ∆𝑇 ln � 𝑠 � ∆𝑇𝑒 Donde ∆𝑇𝑒 = 𝑇𝑠𝑎𝑡 − 𝑇𝑒 = 169,9℃ − 25℃ = 144,6℃, diferencia de temperaturas a la entrada del intercambiador de calor. De la misma manera ∆𝑇𝑠 = 𝑇𝑠𝑎𝑡 − 𝑇𝑠 = 169,6℃ − 130℃ = 39,6℃, es la diferencia de temperaturas a la salida del intercambiador de calor. Entonces ∆𝑇𝑚𝑙 = 39,6℃ − 144,6℃ = 81,07℃ 39,6℃ � ln � 144,6℃ Bibliografía • Apuntes de la cátedra Máquinas e Instalaciones Térmicas 1, de la Facultad de Ingeniería de la UNaM • Curso de Termodinámica – Facorro-Ruiz • Termodinámica técnica y Máquinas térmicas – Mataix, Claudio • Motores de combustión interna. Análisis y aplicaciones – Obert, Edward