
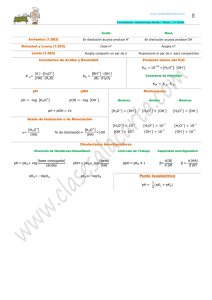
Química 2º Bachillerato. IES La Magdalena. Avilés. Asturias Son ácidos fuertes aquellos que se considera que están completamente ionizados: Ácidos y bases fuertes y débiles. Resumen Son ácidos débiles aquellos que no están completamente ionizados, estableciéndose un equilibrio entre la parte disociada (iones) y la parte molecular no disociada: HCl (ac) H2 O(l) Cl (ac) H3 O (ac) c c CH3 COOH (ac) H2O CH3 COO (ac) H3 O (ac) c CH3 COOH (ac) H2O CH3 COO (ac) H3O (ac) Especies presentes en disolución Cálculo del pH de un ácido fuerte: Especies presentes en disolución pH log (H3O ) log (c) Cl Existe una pequeña cantidad de iones OH- procedentes de la autoprotólisis del agua y debe de cumplirse: OH H2 O CH3 COO H3 O OH K w OH H3 O 10 14 Serán bases fuertes aquellas que se considera que están completamente ionizadas: NaOH(s) Na (ac) OH (ac) c c H2 O Especies presentes en disolución H3 O OH H2 O Cálculo del pH de una base fuerte: Existe una pequeña cantidad de iones H3O+procedentes de la autoprotólisis del agua y debe de cumplirse: K w OH H3O 10 14 2 2 c Ka Cálculo del pH de un ácido débil pH log (H3O ) log (x) Existe una pequeña cantidad de iones OH- procedentes de la autoprotólisis del agua y debe de cumplirse: K w OH H3O 10 14 NH3 (ac) H2O NH 4 (ac) OH (ac) c pOH log (OH ) log (c) pH 14 pOH x CH3COO H3O x x Ka ; x (c x) c CH3COOH Son bases débiles aquellas que no están completamente ionizadas, estableciéndose un equilibrio entre la parte disociada (iones) y la parte molecular no disociada: Especies presentes en disolución x CH3 COOH H3 O Na (c x) NH4 (ac) OH (ac) NH3 (ac) H2O (c x) x NH4 OH Kb NH3 NH3 NH4 OH H3 O H2 O x x2 x2 ;x (c x) c c Kb Cálculo del pH de una base débil pOH log (OH ) log (x) pH 14 pOH Existe una pequeña cantidad de iones H3O+ procedentes de la autoprotólisis del agua y debe de cumplirse: K w OH H3O 10 14






![[editar]Definición](http://s2.studylib.es/store/data/008533524_1-f53108428f2c43501e4a8807a3697a86-300x300.png)

