Inmunodeficiencia común variable
Anuncio
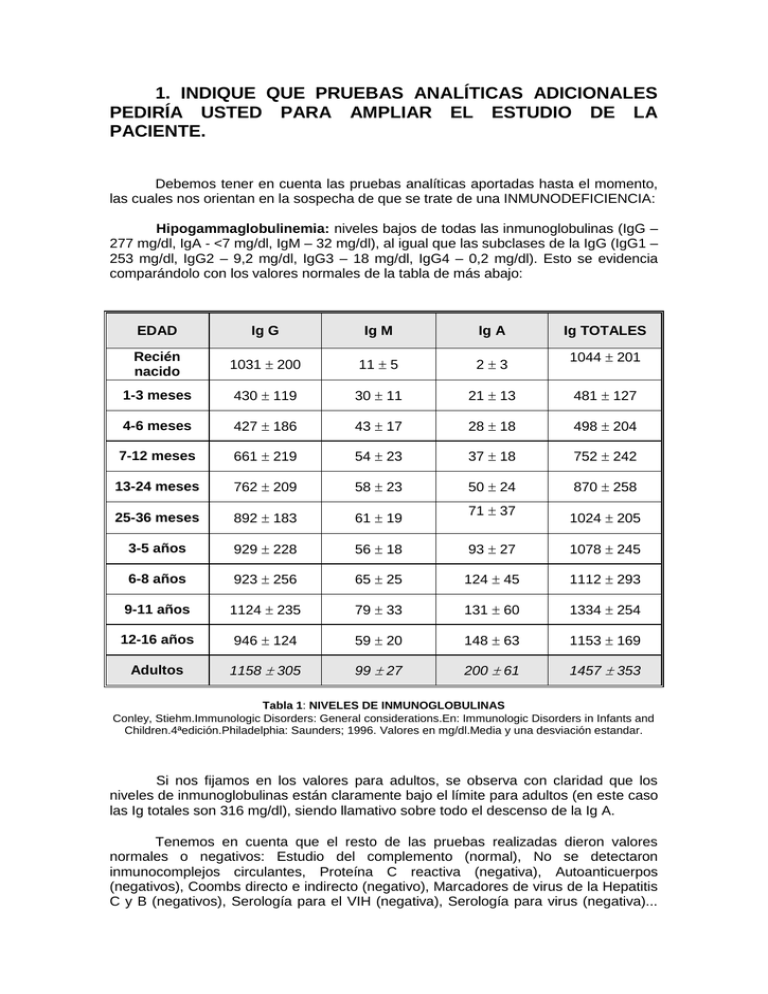
1. INDIQUE QUE PRUEBAS ANALÍTICAS ADICIONALES PEDIRÍA USTED PARA AMPLIAR EL ESTUDIO DE LA PACIENTE. Debemos tener en cuenta las pruebas analíticas aportadas hasta el momento, las cuales nos orientan en la sospecha de que se trate de una INMUNODEFICIENCIA: Hipogammaglobulinemia: niveles bajos de todas las inmunoglobulinas (IgG – 277 mg/dl, IgA - <7 mg/dl, IgM – 32 mg/dl), al igual que las subclases de la IgG (IgG1 – 253 mg/dl, IgG2 – 9,2 mg/dl, IgG3 – 18 mg/dl, IgG4 – 0,2 mg/dl). Esto se evidencia comparándolo con los valores normales de la tabla de más abajo: EDAD Ig G Ig M Ig A Recién nacido 1031 200 11 5 23 1-3 meses 430 119 30 11 21 13 481 127 4-6 meses 427 186 43 17 28 18 498 204 7-12 meses 661 219 54 23 37 18 752 242 13-24 meses 762 209 58 23 50 24 870 258 25-36 meses 892 183 61 19 3-5 años 929 228 56 18 93 27 1078 245 6-8 años 923 256 65 25 124 45 1112 293 9-11 años 1124 235 79 33 131 60 1334 254 12-16 años 946 124 59 20 148 63 1153 169 Adultos 1158 305 99 27 200 61 1457 353 71 37 Ig TOTALES 1044 201 1024 205 Tabla 1: NIVELES DE INMUNOGLOBULINAS Conley, Stiehm.Immunologic Disorders: General considerations.En: Immunologic Disorders in Infants and Children.4ªedición.Philadelphia: Saunders; 1996. Valores en mg/dl.Media y una desviación estandar. Si nos fijamos en los valores para adultos, se observa con claridad que los niveles de inmunoglobulinas están claramente bajo el límite para adultos (en este caso las Ig totales son 316 mg/dl), siendo llamativo sobre todo el descenso de la Ig A. Tenemos en cuenta que el resto de las pruebas realizadas dieron valores normales o negativos: Estudio del complemento (normal), No se detectaron inmunocomplejos circulantes, Proteína C reactiva (negativa), Autoanticuerpos (negativos), Coombs directo e indirecto (negativo), Marcadores de virus de la Hepatitis C y B (negativos), Serología para el VIH (negativa), Serología para virus (negativa)... en cambio si se detectaron niveles altos de Colesterol (255 mg/dl) y de fosfatasa alcalina (334 mg/dl). Estos resultados, acompañados de la clínica (enfermedades infecciosas de repetición, generalmente de tracto respiratorio y de origen bacteriano, no vírico ni micótico) nos orientan en la posibilidad de una INMUNODEFICIENCIA PREDOMINANTEMENTE HUMORAL, con déficit de inmunoglobulinas fundamentalmente (ya que los estudios del Complemento nos ofrecen valores normales), pero como no contamos con pruebas referentes a los componentes celulares (número, actividad, respuesta, etc.) no podemos saber si en su lugar se trata de una inmunodeficiencia mixta (con afectación humoral y celular), lo cual nos obliga a pedir una serie de pruebas que confirmen esta sospecha. Las habituales en el diagnóstico de cualquier inmunodeficiencia serían (las que constan como “ Pendiente de realizar” son las pruebas adicionales que debemos pedir para completar el estudio de la paciente en nuestro caso): - Respuesta humoral: al tratarse de una posible inmunodeficiencia predominantemente humoral habría que realizar esta batería de pruebas completa, ya que nos confirmará la sospecha de una inmunodeficiencia predominantemente humoral. - Cuantificación de inmunoglobulinas séricas ya realizada y evidenciando la existencia de una hipogammaglobulinemia. Titulación de anticuerpos naturales: isohemaglutininas contra grupos sanguíneos Pendiente de realizar. Titulación de anticuerpos universalmente presentes: antiestreptolisinas Pendiente de realizar. Titulación de anticuerpos posvacunación: antitétanos, antineumococo Pendiente de realizar. Recuento porcentual y absoluto de linfocitos B: CD19, CD20, inmunoglobulinas de membrana Pendiente de realizar. Respuesta proliferativa de linfocitos B a mitógenos y producción de inmunoglobulinas in vitro Pendiente de realizar. Respuesta celular: esta es la batería de pruebas que nos orientará sobre cual es el estado de las células del sistema inmune, para confirmar o descartar la sospecha de una posible inmunodeficiencia mixta. En el caso de una inmunodeficiencia predominantemente celular, serían estas pruebas las que presentarían las mayores alteraciones, mientras que las humorales permanecerían prácticamente inalteradas. Recuento porcentual y absoluto de linfocitos T: CD2, CD3, CD7, CD4, CD8 Pendiente de realizar. Se pueden confirmar con la tabla 2, de valores normales en las subpoblaciones linfocitarias. Respuesta proliferativa in vitro de linfocitos T a mitógenos: PHA*, PWM**, ConA; Respuesta a antígenos: toxoide tetánico; Respuesta a anticuerpos antiCD3, CD2, CD28 y CD34 Pendiente de realizar. Pruebas cutáneas de hipersensibilidad retardada: estreptocinasaestreptodornasa, PPD, candidina Pendiente de realizar. * PHA: fitohemaglutinina; ** PWM: mitógeno pokeweed (o mitógeno de la Phitolacca americana). Subpoblaciones CORDÓN UMBILICAL 2-3 MESES 4-11 MESES 1-2 AÑOS 2-5 AÑOS 7-17 AÑOS ADULTOS Linf.totales (cels/) % 5400 4200-6900 41(60-87) 5680 2920-8840 66(55-78) 5990 3610-8840 64(45-79) 5160 2180-8270 59(44-72) 4060 2400-5810 50(38-64) 2400 2000-2700 40(36-43) 2100 1600-2400 32(28-39) Cels T CD 3 (cels/) % 3100 2400-3700 55(49-62) 4030 2070-6540 72(60-87) 4270 2280-6450 71(57-84) 3330 1460-5440 66(53-81) 3040 1610-4230 72(62-80) 1800 1400-2000 70(66-76) 1600 960-2600 73(61-84) Cels T CD 4 (cels/) % 1900 1500-2400 35(28-42) 2070 1020-3600 43(31-54) 1800 900-2860 43(35-51) 800 700-1100 37(33-41) 940 540-1660 46(32-60) Cels T CD 8 (cels/) % 1500 1200-2000 29(26-33) Cociente CD:4/CD:8 Cels B (CD19 o CD20) % 2830 1460-5110 52(41-64) 2950 1690-4600 49(36-61) 1410 650-2450 25(16-35) 1450 720-2490 24(16-34) 1320 570-2230 25(16-38) 1180 630-1910 30(22-38) 800 600-900 30(27-35) 520 270-930 27(13-40) 1.2 0.8-1.8 2.18 1.32-3.47 2.09 1.20-3.48 1.55 0.95-2.95 1.44 1.05-2.07 1.3 1.1-1.4 1.7 0.9-4.5 100 200-1500 20(14-23) 900 500-1500 23(19-31) 900 500-1500 23(19-31) 900 500-1500 23(19-31) 900 700-1300 24(21-28) 400 300-500 16(12-22) 246 122-632 13(10-31) Tabla 2: SUBPOBLACIONES LINFOCITARIAS Conley, Stiehm.Immunologic Disorders: General considerations. En: Immunologic Disorders in Infants and Childrens.4ªedición.Philadelphia: WB Saunders; 1996JAMA, 267; 1484-1488 Mediana; Los intervalos de confianza corresponden a los percentiles 5 y 95 excepto donde aparece un .El % de linfocitos corresponde al total de leucocitos.El % de los CD3, CD4, CD8 y células B corresponden al total de linfocitos. - Sistema monocnuclear-fagocítico: - Prueba de nitroazul de tetrazolio Pendiente de realizar. Quimiotaxis. Fagocitosis Pendiente de realizar. Presencia de moléculas de adhesión CD11/CD18 Pendiente de realizar. Sistema del complemento: estas pruebas ya han sido realizadas y se encuentran dentro de la normalidad en el caso que nos ocupa. CH50 (actividad hemolítica de la vía clásica) AP50 (actividad hemolítica de la vía alternativa) - Hemograma completo: Recuento, fórmula y morfología leucocitaria Pendiente de realizar. Probablemente si se haya realizado porque es una de las pruebas habituales y básicas en cualquier estudio inmunológico, pero no consta entre los datos facilitados en nuestro caso y debería realizarse. Con todas estas pruebas analíticas, siempre sumadas a la clínica y antecedentes personales del paciente, tendremos información suficiente para establecer si se trata de una INMUNDEFICIENCIA PREDOMINANTEMENTE HUMORAL (como es la sospecha en este cuadro clínico) o bien MIXTA (lo que se vería confirmado por alteraciones significativas en las pruebas referentes al componente celular). 2. HAGA UN DIAGNÓSTICO DIFERENCIAL DE LA PATOLOGÍA QUE PRESENTA LA PACIENTE SOBRE LA BASE DE ANTECEDENTES Y DATOS CLÍNICOS QUE SE APORTAN. El diagnóstico diferencial de esta entidad se debe establecer con otras inmunodeficiencias primarias como son el déficit selectivo de IgA, en donde se encuentra una disminución de la IgA 1 y 2, pero los linfocitos B son normales; el síndrome de Hiper-IgM, en donde se encuentra un aumento de esta inmunoglobulina, con Ig D aumentada o normal y disminución de los otros isotipos; las deficiencias selectivas de subclases de Ig G, en las cuales hay disminución en una o más subclases de Ig G; la deleción de las cadenas pesadas de las inmunoglobulinas que se presenta con ausencia de Ig G 1, 2 ó 4, y en algunas ocasiones se asocia a la ausencia de IgA o Ig E, además tiene un patrón de herencia autosómico. La inmunodeficiencia común variable, se va a caracterizar por una reducción vaiable en múltiples isotipos de inmunoglobulinas, con los linfocitos B normales o ligeramente disminuidos. Para establecer un diagnóstico de inmunodeficiencia común variable es necesario que reuna los siguientes criterios: .- Paciente hombre o mujer con disminución maracada (menos de dos veces la derivación estándar de la media para la edad) de Ig G e Ig A. .- Comienzo después de los 2 años de vida. .- Ausencia de isohemaglutininas y / o respuesta inadecuada a las inmunizaciones. .- Exclusión de otras causas definidas de hipogammaglobulinemia. Las inmunodeficiencias secundarias son más frecuentes que las primaria y aparecen en un individuo previamente dotado de un sistema inmunitario normal como consecuencia de efectos nocivos ambientales (yatrogénos, infecciosos, malnutrición). Las funciones inmunitarias que se alteran son variables y se normalizan si se consigue eliminar la causa que las produce. Las principales causas de inmunodeficiencias secundarias en los países industrializados son las yatrógenas y la infección por el virus de la inmunodeficiencia humana que causa el denominado síndrome de inmunodeficiencia adquirida (SIDA). Si bien los pacientes pueden presentar un síndrome de infecciones de repetición, en general las pruebas inmunológicas, con excepción del sida, no suelen aportar datos de interés para el diagnóstico o el tratamiento. La esplenectomía es una de las causas más frecuentes de inmunodeficiencia secundaria. Otra de las causas más corrientes de inmunodeficiencias secundarias lo constituyen los fármacos denominados inmunosupresores. Entre estos se incluyen los glucocorticoides y la mayoría de los productos empleados como antineoplásicos. Las sales de oro, el levamisol, la azatioprina, la penicilamina y la sulfasalazina pueden producir hipogammaglobulinemia, que en ocasiones afecta selectivamente a la Ig A, dato que es importante tener en cuenta antes de realizar el diagnóstico de estas inmunodeficiencias de anticuerpos y catalogarlas como primarias. Las pérdidas de proteinas y las hepatopatías crónicas, se deben de tener en cuenta en el momento de adoptar las medidas terapéuticas precisas. CAUSAS DE INMUNODEFICIENCIAS INDUCIDAD POR DROGAS: .- Captopril .- Carbamazepina .- Glucocorticoides .- Penicilaminas .- Fenitoina .- Sulfasalazina CAUSAS INDUCIDAS POR ENFERMEDADES GENÉTICAS: .- Ataxia-telangiectasia .- Inmunodeficiencia combinada severa autosómica (SCID) .- Síndrome de hiper Ig M .- Deficiencia de transcobalamina 2 .- Agamaglobulinemia ligada al cromosoma X .- Síndrome linfoproliferativo ligado al cromosoma X (asociado al EBV) .- SCID ligado al cromosoma X .- Anormalidades cromosómicas como son: Síndrome del cromosoma 18q, monosomía 22, trisomía 8, trisomía 21. CAUSA INDUCIDAS POR ENFERMEDADES INFECCIOSAS: .- HIV .- Toxoplasmosis .- Rubéola .- Virus de Ebstein Barr (monocucleosis infecciosa) .- Enfermedad bacteriana aguda CAUSAS INDUCIDAS POR ENFERMEDADES MALIGNAS: .- Leucemia linfocítica crónica .- Inmunodeficiencia con timoma .- Linfoma Hodgkin .- Leucemia linfoma B CAUSAS INDUCIDAS POR ENFERMEDADES SISTÉMICAS: .- Uremia .- Diabetes mellitas .- Enteropatías pierde proteinas .- Síndrome nefrótico .- Hepatitis crónica activa CAUSAS POR ENFERMEDADES HEMATOLÓGICAS INFILTRATIVAS: .- Histiocitosis .- Sarcoidosis .- Agranulocitosis y anemia aplásica CAUSAS POR PÉRDIDA DE INMUNOGLOBULINAS: .- Nefrosis .- Quemados extensos .- Diarrea severa .- Linfangiectasia 3.- SEÑALE CUÁL ES EL DIAGNÓSTICO MÁS PROBABLE DE ESTE CASO; EXPLIQUE POR QUÉ. Teniendo en cuenta los datos clínicos y analíticos presentados en el caso de esta paciente, es probable que el diagnóstico más acertado se trate de una inmunodeficiencia variable común. Se denomina común porque es una forma relativamente frecuente de inmunodeficiencia; y variable porque su expresión clínica difiere mucho de unos pacientes a otros. Esta enfermedad se encuadra en el contexto de las inmunodeficiencias primarias y se caracteriza principalmente por la disminución de los niveles séricos de los principales tipos de inmunoglobulinas (Ig G, Ig A, Ig M). Dado que el diagnóstico de esta patología es relativamente tardío (en este caso se demora hasta la sexta década de la vida) se han utilizado otros nombres para este trastorno como agammagloblulinemia de aparición adulta, hipogammaglobulinemia de aparición tardía o inmunmodeficiencia adquirida; esta última nomenclatura se utiliza ahora para referirse a un síndrome causado por el virus VIH y por lo tanto no debe aplicarse a la inmunodeficiencia variable común. Se estima que hasta la tercera parte de las inmunodeficiencias primarias pueden deberse a inmunodeficiencia variable común. Afecta por igual a hombres y mujeres -como en esta ocasión se trata de una mujer podemos descartar en principio otras inmunodeficiencias propias de varones- y entre sus manifestaciones clínicas principales se encuentran las infecciones respiratorias de repetición, trastornos gastrointestinales, patologías autoinmunes y neoplasias malignas. Las características de la inmunodeficiencia variable común están ligadas a defectos tanto de los linfocitos T como de la diferenciación de las células productoras de inmunoglobulinas. Aunque no se conoce con certeza la etiología de esta entidad, estos errores de la respuesta inmune están asociados con defectos genéticos del sistema mayor de histocompatibilidad en el cromosoma seis (alrededor del 50% de los pacientes tienen el haplotipo HLA-1.B8.DR3, comparado con el 5% de la población general). Es todavía incierto si es un solo gen o una combinación de genes con este haplotipo lo que predispone a la inmunodeficiencia variable común, sin embargo es probable que estos factores estén directamente relacionados con la activación de las células T y con las complicaciones inflamatorias que determinarán la severidad de las manifestaciones de la enfermedad. Los linfocitos B de los pacientes con este tipo de inmunodeficiencia pueden reconocer a los antígenos y pueden tener una respuesta proliferativa normal, pero fracasan al diferenciarse en células plasmáticas productoras de inmunoglobulinas. Varios defectos en la diferenciación han sido identificados. Primero, una anormalidad intrínseca de los linfocitos B puede impedir su diferenciación, aún cuando los factores de diferenciación de células T normales estén presentes. Segundo, en algunos pacientes las células T o sus productos, pueden activamente suprimirla diferenciación terminal de linfocitos B normales. Tercero, el defecto de respuesta de los linfocitos B puede reflejar una deficiencia en la función de las células T cooperadoras, la cual puede estar a su vez asociada con un aumento de las células T supresoras. En general, parece ser que existe una insuficiente estimulación de las señales y factores decrecimiento para promover la formación y diferenciación de los linfocitos B en el tejido linfoide. El diagnóstico debe de considerarse en pacientes adultos con infecciones respiratorias crónicas, enfermedad intestinal, giardiasis crónica o síndrome de malabsorción; algunos pacientes pueden presentar síntomas de enfermedad linfática maligna. Este caso manifiesta las características clínicas descritas en sujetos con alteración en la inmunidad humoral: los cuadros repetitivos infecciosos de senos paranasales y las alteraciones de laboratorio con las principales inmunoglobulinas por debajo de los niveles de referencia. Estos datos hacen sospechar que esta paciente es portadora de una inmunodeficiencia primaria, del tipo de la variable común. Las características iniciales en la mayoría de estos pacientes, incluido el caso de la paciente en estudio, son infecciones recurrentes que involucran oídos, nariz, senos paranasales, bronquios y pulmones. Cuando las infecciones en pulmón son graves y ocurren repetidamente pueden ocasionar daño permanente en los bronquios con ensanchamiento de estas estructuras (bronquiectasias). Algunos pacientes pueden desarrollar a largo plazo una inflamación dolorosa de las articulaciones, en este caso de las metacarpofalángicas y las rodillas. Esta afectación se conoce como poliartritis y afecta pricipalmente a grandes articulaciones. Usualmente desaparece con la terapia de gammaglobulina que siguen los pacientes diagnosticados de inmunodeficiencia variable común. Paradójicamente en esta patología hay un riesgo incrementado de desarrollar trastornos autoinmunes (anemia, trombopenia, lupus, enfermedad tiroidea,...), a pesar de los bajos niveles de anticuerpos que la caracterizan; en el caso de esta paciente este mecanismo podría verse involucrado en la etiopatogenia de la anemia crónica que padece, aunque sería poco probable puesto que los test de Coombs directo e indirecto realizados resultaron negativos, y existen otros factores en su historia clínica que también podrían relacionarse con la anemia, como la gastrectomía a la que fue sometida que podría ocasionarle anemia por déficit de factor intrínseco. Otro dato de la historia que podría relacionarse con las complicaciones propias de la patología de esta paciente es el desarrollo de pólipos intestinales y un probable cáncer gástrico (la paciente está gastrectomizada), puesto que la inmunodeficiencia variable común predispone a la aparición de neoplasias, especialmente de los tejidos linfático, gastrointestinal y cutáneo. También es propia de esta enfermedad la mayor predisposición a padecer infecciones por virus de la hepatitis: la paciente del caso presenta anticuerpos antiHBc. Igualmente son frecuentes los casos de colelitiasis, que justificarían los cólicos biliares de repetición en este caso. En general, la aproximación al diagnóstico de esta enfermedad se hace por la clínica, como se ha ido detallando a lo largo de la exposición, y su establecimiento por exclusión de otras inmunodeficiencias de características similares que cursan también con hipogammaglobulinemia, tanto por características clínicas como por exámenes complementarios. 4.-QUÉ COMPLICACIONES HA ASOCIADO RELACIONADAS CON SU PATOLOGÍA DE BASE. La inmunodeficiencia común variable afecta por igual a hombres y mujeres. Suele aparecer en los primeros años de vida, sin embargo, el diagnóstico de certeza, con frecuencia no se realiza hasta la 3ª o 4ª década de la vida. Nuestra paciente posee historia de catarros y sinusitis desde edades tempranas, sin embargo su proceso ha llegado a la edad adulta sin diagnosticar. En ocasiones, aparecen síntomas inespecíficos en la infancia, y se frena el proceso hasta la edad adulta, donde reaparecen. No es nuestro caso, donde parece existir una clínica continúa desde el inicio de la infancia. En general la existencia de hipogammaglobulinemia y la incapacidad para producir anticuerpos tras la estimulación antigénica, hace muy frecuentes las infecciones bacterias piógenas y la asociación de enfermedades autoinmunes. La ausencia de Ig, favorece la invasión por bacterias encapsuladas, y la alteración de las células T, favorece la aparición de infecciones oportunistas (virus y microorganismos intracelulares). Generalmente, es el padecimiento de estas enfermedades y las infecciones de repetición, las que nos orientan a pensar en una etiología autoinmune. A veces estas enfermedades aparecen años antes de que se desarrolle la hipogammaglobulinemia característica de la IDCV. En cuanto a las complicaciones y manifestaciones clínicas de esta enfermedad podemos exponer: 1.- INFECCIONES DE REPETICIÓN La paciente presenta sinusitis crónica, catarros de repetición y se encuentra también afectación de vías respiratorias bajas. Las infecciones más frecuentes en relación a la IDCV son las sinopulmonares. En general, pueden darse: otitis media, sinusitis, bronquitis y neumonía. Suelen ser la presentación inicial de este cuadro, y generalmente aparece en edades tempranas, como en nuestra paciente, donde los episodios de sinusitis se remiten a la edad infantil. Es importante también señalar que son procesos que cronifican con mucha facilidad, a pesar de someterse a un tratamiento adecuado. Los microorganismos más frecuentemente asociados son: S.pneumoniae, Haemophilus influenzae y S.aureus. Las infecciones recurrentes, unidas al proceso evolutivo natural de la patología, conllevan la aparición de alteraciones a nivel pulmonar. Las más frecuentes son: Bronquiectasias, como en nuestra paciente. Es importante la terapia física y el drenaje postural para evitar que las secreciones acumuladas, provoquen aún más infecciones. Enfermedad intersticial pulmonar crónica, por neumonía linfoide intersticial. Insuficiencia pulmonar. Cuando las infecciones en pulmón son graves y ocurren de forma reiterada, pueden ocasionar daño permanente en bronquios, desarrollándose una afectación crónica de los mismos, ocasionando el ensanchamiento y cicatrización de estas estructuras, es decir, desarrollándose las bronquiectasias. Nuestra paciente tiene edad avanzada, bronquiectasias ya establecidas, y una posible afectación intersticial pulmonar, debido al largo proceso de evolución y a las múltiples infecciones, lo cual empeora el pronóstico a corto-medio plazo. La insuficiencia pulmonar evoluciona en las IDCV aunque exista un adecuado tratamiento con Ig G humana, tratamiento estándar hoy en día. De hecho, es este proceso, junto con los tumores, el principal causante de mortalidad en estos pacientes (por ello es tan importante el diagnóstico precoz). En algunos pacientes sólo es descubierta cuando tienen una importante afectación crónica pulmonar y bronquiectasias. Aparecen también con relativa frecuencia, las meningoencefalitis crónicas por enterovirus. Nuestra paciente, aparentemente, no presenta clínica neurológica. 2.-MANIFESTACIONES GASTROINTESTINALES 1. Sin duda la manifestación más frecuente, son los procesos diarreicos más o menos crónicos. Se pueden producir por la infiltración linfática de la pared intestinal, pero sobre todo, por sobrecrecimiento bacteriano y por infección de gérmenes como puede ser el Campilobacter jejuni y, como germen más frecuente, la Giardia lamblia. 2. Síntomas inespecíficos, como malestar general, perdida de peso, síntomas de indigestión, náuseas, vómitos, hipoalbuminemia o déficits de vitaminas. En principio, en nuestro caso no tenemos datos sugerentes de clínica digestiva. 3. Malabsorción por sobrecrecimiento bacteriano o por giardiasis. 4. Enteropatía pierde proteínas. 5. Atrofia vellosidades intestinales. 6. Infiltración linfoide difusa. 7. Hiperplasia nodular linfoide, en ocasiones conlleva el desarrollo de un auténtico linfoma. No se correlaciona directamente con la diarrea ni con la malabsorción. No desaparece aunque tratemos la giardiasis. 8. Carcinoma gástrico. 9. Intolerancia a la lactosa. 10. Enfermedad inflamatoria intestinal, como Colitis Ulcerosa o Enfermedad de Crohn. 11. Gastritis atrófica, que puede dar lugar a una anemia perniciosa. Todos estos procesos, justifican la existencia de la poliposis y la historia de gastrectomía, posiblemente por un cáncer gástrico asociado a su proceso inmune. La mayor tendencia de estos pacientes a sufrir infecciones de repetición y a la cronificación de las mismas, les hace más sensibles al padecimiento de la hepatitis y a la cronificación de la misma. A veces el proceso autoinmune debuta como una hepatitis crónica. Nuestra paciente presenta una serología negativa para el virus de la hepatitis C y en la serología para virus hepatitis B, obtenemos un único parámetro positivo, los anticuerpos antiHBc. Esta detección aislada, en principio, no tiene gran significación clínica, ya que en ocasiones presenta una reacción inmunológica cruzada o falsamente positiva. En principio, esta detección, sólo implica un padecimiento lejano de una hepatitis B, pero inactividad de la enfermedad en el momento actual. Un 5-12% de las personas que curan después de un proceso de hepatitis B, no forman anticuerpos antiHBs, que es el otro parámetro que aparece como positivo en los individuos tras el padecimiento de este proceso infeccioso, lo cual puede justificar la serología de nuestro caso. Existe ocasiones de infección aguda donde antiHBc es positivo. Este anticuerpo sería de tipo Ig M y todos los demás parámetros serológicos podrían resultar negativos, por un bajo nivel de viremia, donde el antígeno Hbs, se encuentra por debajo del umbral de detección, o en el período ventana entre los antígenos HBs y la formación de los anticuerpos antiHBs. Otro hallazgo frecuente en estos pacientes, es la presencia de colelitiasis . Justifica por tanto, los cólicos de repetición aparecidos en nuestra paciente. 3.- AFECTACIÓN DEL TEJIDO LINFOIDE En general los pacientes con IDCV poseen una hiperplasia linfoide, con aumento de los tejidos de estas características, como adenopatías, generalmente en cuello, tórax o abdomen, amígdalas hipertróficas o esplenomegalia. En un 20-60% existe hiperplasia nodular linfoide que afecta a intestino delgado ( en las placas de Peyer) y ocasionalmente a estómago y colon. Ninguno de estos datos, a pesar de su alta frecuencia en la IDCV, es comentado en relación a nuestro caso. La hiperplasia nodular linfoide y la esplenomegalia, pueden explicarse por el proceso etiopatogénico básico de la enfermedad. Esto es, el defecto que tiene las células B para diferenciarse y madurar, pero sí son capaces de reconocer los antígenos y proliferar en respuesta a ellos. Es por tanto este estímulo antigénico prolongado, el responsable de la hiperplasia del tejido linfoide. 4.-ALTERACIONES HEMATOLÓGICAS Los procesos gastrointestinales, pueden justificar, en parte, la existencia de anemia que padece nuestra paciente. Y ésta puede responder a: - Anemia megaloblástica por déficit de factor intrínseco, ya que la mujer se encuentra gastrectomizada, lo cual impide que la vitamina B12 pueda ser absorbida en el tubo digestivo. - Anemia hemolítica autoinmune, es otro de los proceso frecuentes en los pacientes con IDCV, sin embargo, por ahora, en nuestro caso el test de Coombs directo e indirecto, resultó negativo. - Anemias carenciales, los defectos en la mucosa intestinal asociados a la malabsorción, pueden dificultar la absorción, tanto de vitamina B12, como de ácido fólico o de hierro. - Anemia de trastornos crónicos, por las infecciones de repetición y demás características clínicas asociadas a la patología de base, y la IDCV en sí misma. Otras alteraciones hematológicas frecuentes son las citopenias, principalmente las trombocitopenias y las neutropenias. Este último factor, puede favorecer aún más, las infecciones de repetición. 5.-DESARROLLO DE TUMORES Los enfermos con IDCV, tienen mayor incidencia de desarrollo de tumores malignos, especialmente cáncer del sistema linfático, de la piel y del tracto gastrointestinal. Entre ellos los más frecuentes son, el Linfoma no Hodking y el carcinoma gástrico. Son una causa frecuente de mortalidad. En ocasiones existe asociación con timoma, denominándose entonces, síndrome de Good. Con referencia a nuestra paciente en este punto, lo único que suponemos, es la existencia de un carcinoma gástrico, razón por la cual, fue operada hace 25 años. La poliposis intestinal también fue extirpada, para evitar la malignización posterior. 6.- MANIFESTACIONES ARTICULARES Las manifestaciones articulares más frecuentes en estos pacientes, son artralgias y artritis inespecíficas. Generalmente poliartritis, y puede ser un signo de insuficiente tratamiento de la enfermedad. El diagnóstico diferencial debe hacerse con artritis sépticas, mediante punción y cultivo del líquido articular. Una de la patologías autoinmunes que pueden desarrollarse en el seno de una IDCV, es la Artritis Reumatoide. Sin embargo es raro que se presente como una AR clásica ya que generalmente no cumple todos los criterios clínicos característicos de dicha enfermedad. No suelen tener nódulos subcutáneos, ni erosiones articulares. Para descartar o admitir la presencia de este proceso, ante las manifestaciones inespecíficas que presenta la paciente, podría ser de utilidad la detección de Factor Reumatoide que, aunque no es patognomónico, orienta mucho hacía el diagnóstico si resulta positivo. Por tanto, las manifestaciones articulares son frecuentes en los pacientes con IDCV, como en nuestra paciente, que tiene artralgias en manos y rodilla, sin aparentes signos de inflamación, y bastante inespecíficas. 7.-OTRAS ENFERMEDADES AUTOINMUNES A pesar de que los pacientes con IDCV tienen respuesta disminuida de anticuerpos, y bajos niveles de inmunoglobulinas, algunos de los anticuerpos producidos, pueden atacar a sus propios tejidos, desarrollando procesos autoinmunes como: 1. Alteraciones tiroideas, tanto hipotiroidismo, como enfermedad de Graves. No hay datos para justificar su existencia en nuestro caso, aunque podrían justificar los trastornos del ánimo. 2. Citopenias, principalmente, anemia hemolítica y trombocitopenia. También puede desarrollarse púrpura trombocitopénica. 3. LES, no parece tampoco estar en relación con nuestro caso, ya que los anticuerpos antinucleares son negativos. 4. El desarrollo de alergias es más frecuente que en la población general. Esto explica las alergias que presenta esta paciente a los antibióticos y la consecuente reacción urticarizante. 5. Alteraciones dermatológicas como alopecia areata. _____________________________________________________________ 5. CUAL SERÍA LA ACTITUD TERAPÉUTICA A SEGUIR EN ESTE PACIENTE. Por lo general, se requieren concentrados de gammaglobulina parenteral y administración continua de antibióticos. Se aplica gammaglobulina intravenosa a dosis de 100 a 200mg/kg una vez al mes. Si no se controlan los síntomas, la dosis puede aumentarse a 400mg/kg por semana para restaurar el nivel normal de anticuerpos. Los pacientes con sinusitis crónica o bronquiectasias necesitan tratamientos prolongados con antibióticos de amplio espectro así como kinesiterapia y drenaje postural de las secreciones provenientes del pulmón. Si se sospechan infecciones de micoplasma o clamydia, se indicará antibióticos específicos para estos organismos. Se deberá hacer seguimiento de los pacientes a intervalos regulares con radiografías de tórax y pruebas de función pulmonar, para determinar lo adecuado de la terapéutica. La fisioterapia pulmonar es una parte esencial del tratamiento en individuos con enfermedad pulmonar crónica. Quizá se requiera tratamiento específico para problemas de malabsorción. Algunos sujetos responden a la terapéutica con gammaglobulina. En otros casos, la malabsorción puede relacionarse con deficiencias enzimáticas secundarias. Si la malabsorción se vincula con infección por Giardia lamblia, se deberá utilizar tratamiento con metronidazol. Hay que tener cuidado en cuanto al uso de corticosteroides e inmunosupresores en pacientes con inmunodeficiencia, pues puede ocasionar un incremento marcado de la susceptibilidad a la infección. El propósito del tratamiento es mantener al paciente libre de infecciones y prevenir la manifestación de enfermedad pulmonar crónica. La perspectiva para los pacientes con Inmunodeficiencia Común Variable depende en gran parte de cuánto daño ha ocurrido en los pulmones u otros órganos antes de ser diagnosticados y tratados con terapia de globulina gamma y con qué éxito se podrán prevenir las infecciones en un futuro usando terapias con globulina gamma y antibióticos. 6. QUÉ TIPO DE SEGUIMIENTO CLÍNICO HARÍA EN ESTE CASO. Las características iniciales de la mayoría de los pacientes con Inmunodeficiencia Común Variable son infecciones recurrentes que involucran los oídos, los senos paranasales, la nariz, y tracto respiratorio. Cuando las infecciones en pulmón son graves y ocurren repetidamente, esta afección se conoce como bronquiectasias. En estos casos se debe prevenir su reaparición (debido al carácter recidivante que tiene en estos pacientes) y el daño crónico en tejido pulmonar que las acompaña. En las revisiones clínicas periódicas se prestará atención a posibles adenopatías. La causa específica es desconocida, pero los nódulos linfáticos agrandados pueden ser provocados por una infección, falta de regulación inmune, o ambos. Además de la exploración física, se realizarán estudios serológicos seriados, hemograma, radiografía de tórax, y seguimiento de la función pulmonar. Algunos pacientes con Inmunodeficiencia Común Variable que pueden no estar recibiendo terapia óptima de globulina gamma también podrían manifestar una inflamación dolorosa de una o más articulaciones (poliartritis). La artritis típica asociada con Inmunodeficiencia Común Variable puede involucrar articulaciones mayores tales como rodillas, tobillos, codos y muñecas; en otras ocasiones puede desarrollarse una artritis reumatoide atípica sin cumplir todos los criterios diagnósticos de la misma, por lo que convendría hacer estudios periódicos de factor reumatoide, porque aunque su positivización no específica podría evidenciarnos la existencia de este cuadro. A veces estas artritis pueden ser infecciosas y debemos vigilar en ellas la presencia de micoplasma mediante la realización de punciones articulares y cultivo posterior. En pacientes con problemas digestivos, siendo las diarreas el trastorno más frecuente, causadas en su mayoría por el parásito Giardia lamblia, identificable en las biopsias y muestras fecales, la erradicación de éstos puede eliminar los síntomas gastrointestinales. Entre los objetivos de nuestro seguimiento se incluyen el vigilar el tratamiento y mantener al paciente libre de infecciones, al mismo tiempo que prevenir la manifestación de enfermedad pulmonar crónica. La perspectiva para los pacientes con Inmunodeficiencia Común Variable depende en gran parte del daño ocasionado en los pulmones u otros órganos antes de comenzar el tratamiento. A pesar de la baja incidencia de afectación familiar, en algunos casos se han identificado en más de un miembro un déficit en una o varias de las clases de inmunoglobulinas. Por ejemplo, no es inusual que algún miembro de la familia tenga una Inmunodeficiencia Común Variable mientras que otro puede tener una deficiencia selectiva de Ig A. Por tanto prestaremos atención a signos de inmunodeficiencia en los familiares de la paciente de este caso. 7. QUE AVANCES PARA EL DIAGNOSTICO Y TRATAMIENTO DE LA PATOLOGÍA DE BASE DEL PACIENTE EXISTEN EN LA ACTUALIDAD. Hoy en día el tratamiento de la inmunodeficiencia variable común se basa en inmunoglobulina intravenosa y antibióticos. La inmunoglobulina disminuye la incidencia de infecciones sistémicas severas, pero en muchos pacientes permanece la susceptibilidad a infecciones respiratorias que progresan hacia disfunción pulmonar, debido a la incapacidad de la inmunoglobulina para reemplazar a la Ig A secretora de las mucosas. Además el tratamiento con inmunoglobulina puede provocar reacciones anafilácticas y anfilactoides, y transmitir vectores infecciosos (por ser un hemoderivado humano). En un intento de disminuir la dependencia de la inmunoglobulina en los pacientes con un inmunodeficiencia variable común e incrementar su inmunidad humoral se ha probado en estos enfermos el tratamiento con agentes inmunomoduladores como la IL-2, que parece incrementar la respuesta linfocitaria a agentes coestimuladores así como la producción de Ig G e Ig M, pero ha fallado en su objetivo de disminuir los requerimientos de inmunoglobina intravenosa. IL-2 recombinante en tratamientos a largo plazo parece que aumenta la respuesta de linfocitos T a mitógenos y antígenos infecciosos así como la producción de inmunoglobulinas tras administración de vacunas, la producción de citoquinas estimuladoras del crecimiento celular y la expresión de Bcl-2 (proteína intracitoplasmática que protege a las células de la apoptosis). Por otra parte disminuye la duración de los episodios de bronquitis, diarrea y dolor articular, aunque no de forma estadísticamente significativa. Estos datos indican que IL-2 puede utilizarse como terapia adyuvante en algunos casos de inmunodeficiencia común variable; aunque no está del todo claro qué pacientes se beneficiarían más de este tratamiento, parece que sería especialmente efectivo en aquellos con una función T helper alterada. Otra posible vía de modulación inmunitaria que se ha probado en ciertos pacientes es el bloqueo de receptores de histamina H2 para inhibir la actividad de los linfocitos T CD8+ supresores, que podría estar alterada como base patogénica del trastorno inmunitario en estos casos. Recientes estudios parecen poner de manifiesto que los linfocitos B de pacientes con inmunodeficiencia común variable responden a la proteína BLyS (estimulador de linfocitos B) in vitro. BLyS es un miembro de la familia de citoquinas relacionadas con el TNF que induce proliferación de linfocitos B y secreción de inmunoglobulinas tanto in vitro como in vivo, actuando también como coestimulador de linfocitos T in vitro. Estas cualidades sugieren que podría ser útil como arma terapéutica en aquellas inmunodeficiencias caracterizadas por un déficit de inmunoglobulinas, como la inmunodeficiencia variable común. A pesar de que la Terapia Génica es ya una realidad en algunas inmunodeficiencias primarias o congénitas, aún no se aplica esta patología puesto que aún no se conoce el gen responsable. A este respecto ha habido varias líneas de investigación, como el polimorfismo del gen SWAP 70, pero desafortunadamente ninguna de ellas ha mostrado una relación clara entre un gen la Inmunodeficiencia Común Variable enfermedad. Se reconoce que la inmunodeficiencia común variable no es heredada como un defecto genético único, sino que se debe a la combinación de desórdenes genéticos aún por descubrir y de factores ambientales. Otra de las líneas de investigación se basa en la función y estructura de la molécula ICOS, molécula coestimuladora que pertenece a la familia de la CD28/CTLA4, y que es expresada por las células T activadas (TH2). Esta molécula aumenta la secreción de linfocinas y la expresión de CD40-L en los linfocitos T. Sin coestimulación por ICOS se favorece la secreción de IFN-gamma y disminuye la de linfocinas promotoras de diferenciación TH2. De esta manera ICOS es necesaria para el incremento de citoquinas (IL1O) por las células T, que supone el estímulo final para la diferenciación de las células B en células plasmáticas, y la posterior síntesis y secreción de Ig’s. Por tanto ICOS interviene tanto en la respuesta de linfocitos T activados como en la cooperación de éstos con las células B. Su acción en la respuesta inmunitaria ha de ser analizado con más precisión en el futuro. Otra vía de investigación abierta en este campo es la relacionada con las células madre de sangre de cordón umbilical y su aplicación en la terapia génica. El trasplante de células madre hematopoyéticas (CMHs) se ha venido usando en estas tres últimas décadas para reconstituir la hematopoyesis tras tratamientos mielo-ablativos. El trasplante de CMHs se utiliza para tratar una extensa variedad de enfermedades hematológicas y no hematológicas, habiéndose establecido como terapia para muchas patologías congénitas o adquiridas del sistema hematopoyético y para las enfermedades quimio o radio-sensibles. La fuente de CMHs se ha ido ampliando en estos últimos años, obteniéndose de médula ósea (MO), sangre periférica movilizada, y más recientemente de sangre de cordón umbilical (SCU). Las principales ventajas de utilizar la SCU como una fuente alternativa de CMHs son, la facilidad de su obtención, ausencia de riesgo para el donante, un riesgo reducido de transmisión de infecciones, pronta disponibilidad de muestras criopreservadas, bajo riesgo de transmisión viral y baja incidencia de enfermedad de injerto contra huésped (EICH), debido a la inmadurez del sistema inmune del recién nacido. Uno de los principales problemas que plantean los trasplantes de SCU, es la baja celularidad de una unidad de SCU y el retraso del prendimiento mieloide y plaquetar, en comparación con los trasplantes de MO, por lo que la expansión ex vivo se vislumbra prometedora, no solo porque aportaría al paciente un número suficiente de PHs que acortarían el período de aplasia, sino porque permitiría su uso en adultos. Desde hace dos décadas se ha propuesto que la transferencia génica en las CMHs puede ser una herramienta para el tratamiento de las enfermedades genéticas y para enfermedades neurodegenerativas, autoinmunes, cáncer y más tarde inmunodeficiencias como el SIDA, y para corregir o modular el sistema inmunitario. Todos los vectores utilizados para el desarrollo de modelos de terapia génica se han generado con vectores virales, predominantemente onco-retrovirus. Estos vectores requieren para su integración en el genoma de la célula huésped, que ésta se replique y las CMHs se encuentran en un estado quiescente, por lo que estas estrategias requieren del uso de protocolos de expansión, con las dificultades que ello conlleva, como antes se ha mencionado. El descubrimiento y desarrollo de nuevos vectores derivados del HIV posiblemente aceleren el progreso en este campo. Esta familia de lentivirus puede transducir células tanto en estado de división celular como de quiescencia. Sin embargo, por razones de seguridad, se trata de un patógeno humano, no se ha aprobado ningún ensayo clínico. Otras estrategias como las denominadas "transcriptional targetting", consistentes en la inserción de: secuencias reguladoras en los vectores que controlen la transcripción y confinen la expresión del transgen a una estirpe celular específica después de la diferenciación celular, parecen más prometedoras. Este sistema sugiere futuras aplicaciones terapéuticas para la inmunodeficiencia común variable, pudiendo aplicar una terapia génica a partir de células madre extraídas de sangre de cordón umbilical. Para ello previamente será necesario conocer cuales son las secuencias génicas que pueden verse alteradas en esta patología.

