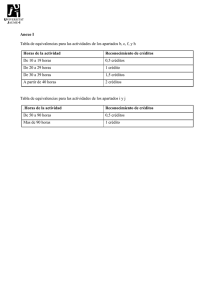
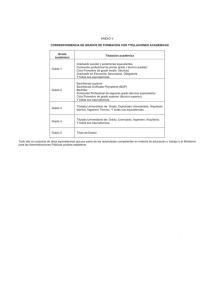
Marco regulatorio para el desarrollo de dispositivos médicos 07 de noviembre de 2017 OCF-SGC-P-01-POI-01-L-01-F-07 Rev. 00 1. 2. 3. 4. 5. 6. 7. 8. Registro Sanitario Clasificación de Dispositivos Médicos Vía Ordinaria Vía Acuerdo de Equivalencias Vía Terceros Autorizados Vía Acuerdo de Insumos de Bajo Riesgo Retos y Avances Referencias 2 1. 2. 3. 4. 5. 6. 7. 8. Registro Sanitario Clasificación de Dispositivos Médicos Vía Ordinaria Vía Acuerdo de Equivalencias Vía Terceros Autorizados Vía Acuerdo de Insumos de Bajo Riesgo Retos y Avances Referencias 3 1. Registro Sanitario ¿Que necesito para obtener el Registro Sanitario para un Dispositivo Médico? Determinar el tipo de dispositivo que quiero registrar, con base en su uso propuesto, riesgo y naturaleza del producto Determinar su categoría y clasificación Aplicar los requisitos que avalen la seguridad y eficacia del mismo. 2. Clasificación de Dispositivos Médicos Categorías definidas en la Ley General de Salud Art. 262 I. II. III. IV. V. VI. Equipo médico Prótesis, órtesis y ayudas funcionales Agentes de diagnóstico Insumos de uso odontológico Materiales quirúrgicos y de curación Productos higiénicos Clasificación con base a Riesgo Art. 83 RIS • Clase I • Clase II • Clase III PROCESO DE EMISIÓN DE RESOLUCIONES. 6 OCF-SGC-P-01-POI-01-L-01 F-07 3. Vía Ordinaria Origen del insumo • Fabricación Nacional (México) • Fabricantes Extranjeros. • Varios Maquiladores 3. Vía Ordinaria Tiempos de Atención Solicitud de registro sanitario Periodo de atención (días hábiles) Clase I 30 Clase II 35 Clase III 60 4. Vía Acuerdo de Equivalencias o Homologación de criterios internacionales Acuerdos de equivalencias con otras Agencias Reguladoras Japón Canadá México Tiempo de Atención: 30 días Estados Unidos de América 4. Vía Acuerdo de Equivalencias o Homologación de criterios internacionales Acuerdos de equivalencias con otras Agencias Reguladoras Estados Unidos de América -510 (k) Premarket notification -PMA Premarket approval. -Reporte de Inspección. - Cartas de Representación. México Tiempo de Atención: 30 días 4. Vía Acuerdo de Equivalencias o Homologación de criterios internacionales Acuerdos de equivalencias con otras Agencias Reguladoras Health Canada / Canadá -Health Canada Licensing -Norma CAN/CSAISO 13485:03 - Cartas de Representación. México Tiempo de Atención: 30 días 4. Vía Acuerdo de Equivalencias o Homologación de criterios internacionales Acuerdos de equivalencias con otras Agencias Reguladoras México Tiempo de Atención: 30 días Japón - Resumen de Documentos Técnicos , STED - CLV, con vigencia de 12 meses - Notificación de Exportación -Cartas de Representación - Carta de aprobación del ministerio de salud de Japón 5. Vía Terceros Autorizados o Apoyo al predictamen y revisión Terceros Autorizados Terceros Autorizados (Ampliación de cobertura COFEPRIS) Tiempo de Atención 15 días Atención de Clase I, II y III (2011 – Actual) 5. Terceros Autorizados En la COFEPRIS contamos con 33 dictaminadores especializados en Dispositivos médicos Convocatoria 2016 + 52 33-Dictaminadores 85 Previamente autorizados Dictaminadores de Terceros Autorizados Total COFEPRIS + Terceros Autorizados 170 dictaminadores 5. Terceros Autorizados 2016 2012 1.29% 4 años 27.76% 98.71% 72.24% Se espera que para 2017 se alcance un ingreso del 30% vía Terceros Autorizados. 6. Vía Acuerdo de Insumos de Bajo Riesgo Registro Insumos Considerados de Bajo Riesgo Disminución de requisitos administrativos. Insumos de Bajo Riesgo No considerados Dispositivos Médicos Tiempo de Atención: 30 días NO requiere de Registro 7. Retos y Alcances • Desarrollo de nuevos mecanismos para agilizar los tiempos de respuesta • Fortalecer la retroalimentación con los Terceros Autorizados. • Implementación y desarrollo de sistemas de información robustos entre la autoridad regulatoria y los aplicantes. • Robustez de los sistemas de gestión de la calidad en los procesos que permitan disminuir la carga regulatoria. 8. Referencias Ley General de Salud, Reforma 27 de enero de 2017 http://www.diputados.gob.mx/LeyesBiblio/pdf/142_270117.pdf Reglamento de Insumos para la Salud, http://www.salud.gob.mx/unidades/cdi/nom/compi/ris.html ACUERDO por el que se da a conocer el listado de insumos para la salud considerados como de bajo riesgo para efectos de obtención del Registro Sanitario, y de aquellos productos que por su naturaleza, características propias y uso no se consideran como insumos para la salud y por ende no requieren Registro Sanitario. http://dof.gob.mx/nota_detalle.php?codigo=5227732&fecha=31/12/2011 http://www.dof.gob.mx/nota_detalle.php?codigo=5376857&fecha=22/12/2014 COFEPRIS: https://www.gob.mx/cofepris/ https://www.gob.mx/cofepris/documentos/relacion-de-terceros-autorizados ¡GRACIAS! Q.A. Katia Lilian Ruiz Noria Gerente de Material de Curación, Equipo Médico, Prótesis y Productos Higiénicos [email protected]