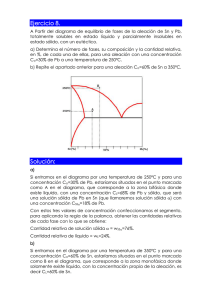
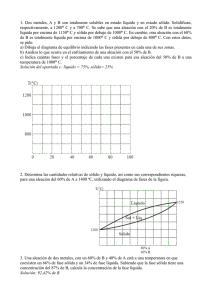
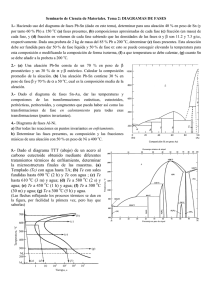
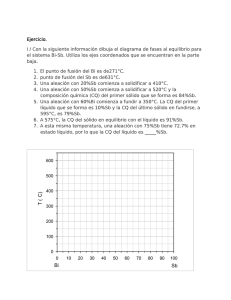
UNIDAD 3 DIAGRAMAS DE FASE LOGRO Al término de la unidad, el alumno comprende cómo solidifica un material y cuál es el efecto de los elementos aleantes en una aleación. Además, explica los diagramas de equilibrio binarios. Prof. Waldo Balarezo Fernández Diagramas de Equilibrio de las Fases Un diagrama de equilibrio o más comúnmente llamado diagrama de fases es un diagrama Temperatura vs. Composición el cual muestra las fases presentes en condiciones de equilibrio. Diagramas de Equilibrio de las Fases •Equilibrio:Es la condición del sistema en el que no se manifiesta ninguna tendencia al cambio. •Fase: Porción física homogénea, con la misma composición e iguales propiedades físicas químicas. •Microconstituyente: Fase o mezcla de fases en una aleación que tiene una apariencia distintiva. Normalmente una microestructura se describe en términos de los microconstituyentes y no de las fases reales. •Componentes: Son los elementos químicos que forman la aleación. Una aleación binaria está formada por dos componentes •Para describir completamente una aleación es necesario conocer: Fases presentes Fracción en peso de cada fase (Wt %) o % atómico (At %) Composición de cada fase Sistemas binarios característicos Solubles en estado líquido y en estado sólido Solubles en estado líquido e insolubles en estado sólido Solubles en estado líquido y parcialmente solubles en estado sólido Sistemas que forman compuestos intermetálicos SISTEMAS DE ALEACIONES BINARIAS ISOMÓRFICAS Son completamente solubles entre sí, tanto en sus estados líquidos como sólidos. Como sólo existe un tipo de estructura cristalina para todas las composiciones de los componentes, se denominan sistemas isomórficos. Considérese una aleación de 53 por ciento en peso de Ni-47 % en peso de Cu a 1300°C: Las composiciones de las fases líquidas y sólidas se definen trazando una línea de enlace horizontal a 1 300°C desde la línea de liquidus hasta la línea de solidus, y líneas verticales hacia el eje horizontal de la composición. La composición de la fase líquida (wl) a 1 300°C contiene 45 por ciento en peso de Ni y la de la fase sólida (ws) es 58 por ciento en peso de Ni, como lo indica la intersección de las líneas verticales punteadas con el eje de la composición. SISTEMAS DE ALEACIONES BINARIAS ISOMÓRFICAS Los diagramas de fases binarios de equilibrio para los componentes que son completamente solubles entre sí en el estado sólido, pueden construirse a partir de una serie de curvas de enfriamiento de líquido-sólido, como lo muestra el sistema Cu-Ni de la siguiente figura: REGLA DE LA PALANCA El porcentaje en peso del líquido y el porcentaje del sólido para una determinada temperatura, se pueden calcular para cualquier aleación de composición media en la región de dos fases líquida y sólida en el diagrama de fase. Fracción en peso de la fase sólida: 𝑿𝒔 = 𝒘𝟎 − 𝒘𝒍 𝒘𝒔 − 𝒘𝒍 Fracción en peso de la fase líquida: 𝑿𝒍 = 𝒘𝒔 −𝒘𝟎 𝒘𝒔 −𝒘𝒍 Ejercicio Una aleación de cobre-níquel contiene 47% en peso de Cu y 53% en peso de Ni y está a 1300°C. a) ¿Cuál es el porcentaje en peso de cobre en las fases sólida y líquida a esta temperatura? b) ¿Qué porcentaje en peso de la aleación es líquida y qué porcentaje es sólida? Solución: a) De la figura, a 1 300°C, la intersección de la línea de enlace con el liquidus da 55% en peso de Cu en la fase líquida y su intersección con el solidus ofrece42% en peso de la fase sólida. Solucion b) De la figura y utilizando la regla de la palanca a 1 300°C sobre la línea de enlace, 𝑤0 = 53%Ni 𝑤𝑙 = 45%Ni 𝑤𝑠 = 58%Ni Fracción en peso de la fase líquida = 𝑿𝒍 = 𝒘𝒔 −𝒘𝟎 𝒘𝒔 −𝒘𝒍 = 𝟓𝟖 −𝟓𝟑 𝟓𝟖 −𝟒𝟓 = 𝟓 𝟏𝟑 = 0.38 % en peso de la fase líquida = (0.38)(100%) = 38% Fracción en peso de la fase sólida = 𝑿𝒔 = 𝒘𝟎 − 𝒘𝒍 𝒘𝒔 − 𝒘𝒍 = 𝟓𝟑 −𝟒𝟓 𝟓𝟖 −𝟒𝟓 = Porcentaje en peso de la fase sólida = (0.62)(100%) = 62% 8 13 = 0.62 Ejercicio Considerar una aleación del 70% en peso de Ni y 30% en peso de Cu. a) Realizar un análisis de fases a 1.500 °C y a 1350°C, suponiendo condiciones de equilibrio. En el análisis de fases debe incluirse las siguientes cuestiones: (i)Fases presentes. (ii) Composición química de cada fase (iii) Cantidades presentes de cada fase. b) Esquematizar la microestructura de la aleación a cada una de las temperaturas anteriores utilizando campos microscópicos circulares. El punto "a" del diagrama de fases representa una aleación Cu-70% en peso de Ni a 1500°C, A 1500 °C, el 100% en peso de la aleación es líquida (70% de Ni) El punto "b" del diagrama de fases representa una aleación Cu-70% en peso de Ni a 1350°C, Solución: El punto "a" del diagrama de fases representa una aleación Cu-70% en peso de Ni a 1500°C, A 1500 °C, el 100% en peso de la aleación es líquida (70% de Ni) El punto "b" del diagrama de fases representa una aleación Cu-70% en peso de Ni a 1350°C, A 1350 °C un 27,3% de la aleación está en fase líquida (62% de Ni) y un 72,7% en fase alfa (73% de Ni). Microestructura de la aleación SISTEMAS DE ALEACIONES BINARIAS EUTÉCTICAS Las regiones de solubilidad sólida restringida en cada extremo del diagrama Pb-Sn se designan como fases alfa y beta, y se denominan soluciones sólidas terminales, ya que aparecen al final del diagrama. La fase alfa es una solución sólida rica en plomo y puede disolver en solución sólida un máximo de 19.2% en peso de Sn a 183°C. La fase beta es una solución sólida rica en estaño y puede disolver un máximo de 2.5% en peso de Pb a 183°C . A medida que la temperatura disminuye por debajo de 183°C, la solubilidad sólida máxima de los elementos solutos disminuye siguiendo las líneas de solvus del diagrama de fases Pb-Sn. SISTEMAS DE ALEACIONES BINARIAS EUTÉCTICAS -Ilustración esquemática de varias estructuras eutécticas: a) lamelar, b) varilla, c) globular, d) acicular. Ejercicio Considerar el diagrama de fases eutéctico binario cobre-plata de la figura 2.7 a) Realizar un análisis de fases de una aleación del 75% en peso de Cu-25% en peso de Ag a las temperaturas de 1.000 °C, 800oC, 780°C+∆T y a 780°C-∆T, suponiendo condiciones de equilibrio. En el análisis de fases debe incluirse las siguientes cuestiones: (i)Fases presentes. (ii) Composición química de cada fase (iii) Cantidades presentes de cada fase. b) Esquematizar la microestructura de la aleación a cada una de las temperaturas anteriores utilizando campos microscópicos circulares. Solución: El punto "a" del diagrama de fases representa una aleación Cu-25% en peso de Ag a 1000°C, A 1000 °C, el 100% en peso de la aleación es líquida (25% de Ag). Aproximadamente a 950°C empieza la solidificación de la aleación. El punto "b" del diagrama de fases representa una aleación Cu-25% en peso de Ag a 800°C, A 800 °C un 30% de la aleación está en fase líquida (65% de Ag) y un 70% ha solidificado en fase alfa (7,9% de Ag). El punto "c" del diagrama de fases representa una aleación Cu-25% en peso de Ag justo por encima de la temperatura eutectoide (780°C+∆T), A 780°C+∆T un 27% de la aleación está en fase líquida (71,9% de Ag) y un 73% en fase alfa (7,9% de Ag). Solución: El punto "d" del diagrama de fases representa una aleación Cu-25% en peso de Ag justo por debajo de la temperatura eutéctica (780°C-∆T), en este punto el 27% de la aleación que aún se encontraba en fase líquida en el punto c ya ha solidificado. A 780°C-∆T un 79% de la aleación está en fase α (7,9% de Ag) y un 21% en fase β (91,2% de Ag). Del 79% de la fase α, sólo un 6% es alfa eutéctico, el 73% restante es alfa proeutéctico formado antes de la reacción eutéctica. SISTEMAS DE ALEACIONES BINARIAS PERITÉCTICAS La reacción peritéctica se presenta comúnmente como parte de los diagramas de equilibrio más complicados, particularmente si los puntos de fusión de los dos componentes son completamente diferentes. En la reacción peritéctica, una fase líquida reacciona con una fase sólida para formar una fase sólida nueva y diferente. SISTEMAS BINARIOS MONOTÉCTICOS Otra reacción invariante de tres fases que se presenta en algunos diagramas de fase binarios es la reacción monotéctica, en la cual una fase líquida se transforma en una fase sólida y en otra líquida como enfriamiento cooling. En un determinado margen de composiciones, los dos líquidos son inmiscibles como ocurre con el aceite en el agua y, por tanto, constituyen fases individuales. Esta reacción de este tipo ocurre en un sistema de cobre-plomo a 955°C y 36 por ciento Pb, como se muestra en la figura.. Sistemas Binarios con Reacciones de tres Fases Aleación Binaria Componentes.solubles en estado sól. Completamente miscibles en estado liq. Aleación Binaria Componentes parcalm. solubles en estado sól. Completamente miscibles en estado liq. Aleación Binaria Componentes parcialm. solubles en estado sól. Parcialmente miscibles en estado liq. Aleación Binaria Componentes solubles en estado sólido. Completamente miscibles en estado líquido. Aleación Binaria Componentes insolubles en estado sól. Completamente miscibles en estado liq. Sistemas con Compuestos Intermedios • Compuesto químico: Combinaciones de elementos con valencia positiva y negativa. Se combinan en una proporción definida, Ejemplos: agua (H2O) y la sal de mesa (NaCl). • En aleaciones, los estequiométricos o no. compuestos químicos pueden ser • Compuestos estequiométricos: Tienen una fórmula química definida. Aparecen como una sola línea vertical en un diagrama de fases • Compuestos no estequiométricos: Ocurre un grado determinado de sustitución atómica que da lugar a desviaciones con respecto a la estequiometría. Aparecen como un intervalo de composición en un diagrama de fases Sistemas con Compuestos Intermedios • Los compuestos más comunes que se encuentran en las aleaciones son: • Compuestos intermetálicos: Se forman por metales no similares químicamente y se combinan siguiendo las reglas de valencia química. Tienen enlace fuerte (iónico o covalente) con propiedades esencialmente no metálicas. No son dúctiles y tienen baja conductividad eléctrica. Estructuras cristalinas complejas: CaSe, Mg2Pb, Mg2Sn y Cu2Se. • Compuestos intersticiales: Unión entre elementos de transición (Ti, Ta, W, Fe) con elementos intersticiales (C, H, O, N, B). Estos átomos pequeños forman soluciones sólidas intersticiales con cada uno de estos elementos de transición. • Pueden tener intervalos de composición muy reducidos, altos puntos de fusión y son extremadamente duros. Ejemplos de ellos son: TiC, TaC, Fe3N, Fe3C, W2C, CrN, TiH. Sistemas con Compuestos Intermedios • Los compuestos intermetálicos no estequimétricos tienen un intervalo de composiciones. El sistema Al-Cu presenta varios de estos compuestos. Uno de ellos es el aluminiuro de cobre (CuAl2), que se denomina θ Sistemas con Compuestos Intermedios • El sistema Mg-Pb presenta el compuesto intermetálico Mg2Pb. Es estequiométrico. • Tiene una composición de 19%wt de Mg y 81%wt de Pb. Se lo representa como una línea vertical en el diagrama, dado que este compuesto sólo existe a esta composición química definida. • Puede pensarse este diagrama de fases como dos diagramas eutécticos simples adyacentes, uno para el sistema Mg-Mg2Pb, y el otro para Mg2Pb-Pb. En ambos casos, el compuesto Mg2Pb se considera realmente como un componente, o mejor, llamado “compuesto”. El sistema Mg-Pb presenta el compuesto intermetálico Mg2Pb. es estequiométrico. Sistemas con Compuestos Intermedios Sistema Al – Ti Sistemas con Compuestos Intermedios • El carburo de hierro, cementita (Fe3C), es un “compuesto intersticial”, en los aceros muy frecuentemente llamado “compuesto intermetálico”, a pesar de que el carbono es un intersticial y además no metálico. • El término “compuesto intermetálico”, hace referencia a todos los tipos de compuestos encontrados en aleaciones. • Se define un compuesto intermetálico como un compuesto formado por dos metales (o un metal y un no metal) que tiene una fórmula química definida, composición, estructura cristalina, y propiedades específicas. • En el diagrama de fases aparece como una fase intermedia que existe en un intervalo de composiciones muy estrecho (casi una línea vertical). LA REGLA DE LA PALANCA • La regla de la palanca permite conocer la composición química de las fases y las cantidades relativas de cada una de ellas. EJERCICIO 1 • Dos metales A y B, son totalmente solubles en estado líquido y en estado sólido. Solidifican a 1200 y 700 ºC, respectivamente. Se sabe que una aleación con el 80% de A es totalmente líquida por encima de 1150 ºC y sólida por debajo de 1000ºC. Así mismo, otra aleación con el 40% de A es totalmente líquida por encima de 1000 ºC y sólida por debajo de 800 ºC. Se pide: • a) Dibujar el diagrama de equilibrio indicando las fases presentes en cada una de sus zonas. • b) Analiza lo que ocurre en el enfriamiento de una aleación del 50% de A desde 1200 ºC hasta la temperatura ambiente. • c) Para la aleación anterior y la temperatura de 1000ºC, ¿Existe más de una fase? • Si la respuesta es afirmativa, ¿Qué porcentaje hay de cada una? SOLUCION 1a • a) Representando gráficamente los valores dados se obtiene el siguiente diagrama de fases: SOLUCION 1b • b) Una aleación con el 50% de A se encuentra en estado líquido a 1200 ºC. Al enfriar sigue en estado líquido hasta que llega a 1038 ºC en que comienza a solidificar. Al enfriarse aumenta la cantidad de sólido hasta que al llegar a 850 ºC se encuentra solidicado al 100 %. Después continúa enfriándose en estado sólido. • c) A 1000ºC y con un 50% de A nos encontramos en el punto k. En dicho punto encontramos fase sólida y fase líquida. El contenido de cada una de ellas se obtiene mediante la regla de la palanca: 𝟓𝟎 − 𝟒𝟎 %Solido = x100 = 25 % 𝟖𝟎 −𝟒𝟎 𝟖𝟎 −𝟓𝟎 %Liquido = x 100 = 75 % 𝟖𝟎 −𝟒𝟎 EJERCICIO 2 1-Con el diagrama de equilibrio Cu - Ni. Determinar para una aleación con el 40 % de Ni: a)Curva de enfriamiento, intervalo de solidificación, fases presentes en cada una de las regiones que atraviesa. b)Relación de fases y pesos de las mismas a 1250° C para una aleación de 600 kg. Solución • • • • a) Por encima de 1280°C toda la aleación está en estado líquido (1 fase). Entre 1280° y 1200°C (intervalo de solidificación) coexisten las fases líquida y solución sólida (2 fases). Por debajo de 1200°C toda la aleación ha solidificado en forma de solución sólida (1 fase). La curva de enfriamiento aparece representada junto al diagrama. • b) Aplicando la regla de la palanca: • • luego : mL + mS = 600 mL = 300 Kg mS = 300 Kg