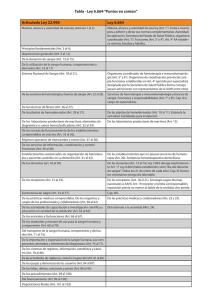
REQUISITOS PARA LA OBTENCION DE LA AUTORIZACIÓN SANITARIA DE FUNCIONAMIENTO DE LOS CENTROS DE HEMOTERAPIA Y BANCOS DE SANGRE EN EL PERU” II.- INDICE Introducción................................................................................. 2 Finalidad...................................................................................... 2 Objetivos...................................................................................... 2 Contenido..................................................................................... 3 - Requisitos para los Centros de Hemoterapia y Bancos De Sangre Tipo I.................................................................... - 3 Requisitos para los Centros de Hemoterapia y Bancos De Sangre Tipo II................................................................... 7 Anexos......................................................................................... 12 Bibliografía.................................................................................... 21 1 INTRODUCCIÓN Oficialmente la hemoterapia en el Perú se inicia en diciembre de 1943 cuando la Cruz Roja Peruana funda el primer banco de sangre en el Hospital Dos de Mayo. Con la promulgación de la Ley No 26454, el 23 de Mayo de 1995, que declara de “Orden Público y de Interés Nacional la Obtención, Donación, Conservación y Transfusión de Sangre Humana”, se establece el marco legal para el manejo de la sangre en el país, dando origen a la creación del Programa Nacional de Hemoterapia y Bancos de Sangre - PRONAHEBAS. Con el inicio de las actividades del PRONAHEBAS el Estado Peruano y, particularmente el Ministerio de Salud, se dedicó a la ardua tarea de identificar e inscribir a todos los establecimientos de salud, públicos y privados, que contaban con servicios transfusionales a nivel nacional. Esta tarea de inscripción incluyó asignar no sólo un código de identificación (código de inscripción) a los servicios transfusionales, sino también, a categorizarlos en Centros de Hemoterapia y Bancos de Sangre Tipo I o Centros de Hemoterapia y Bancos de Sangre Tipo II, según su complejidad y capacidad resolutiva. La modificación del Texto Único de Procedimientos Administrativos (TUPA) del Ministerio de Salud en el año 2005 ha generado el marco administrativo ideal para proseguir el camino en el proceso de la formalización de los servicios de sangre en el Perú; permitiendo la adecuación de los servicios transfusionales a los requisitos técnicos de infraestructura, equipamiento y perfil profesional exigidos por las Normas Técnicas del Sistema de Gestión de la Calidad del PRONAHEBAS y otras normativas legales. En este contexto, el presente Documento Técnico se constituye en el documento que establece los requisitos mínimos para el funcionamiento de los Centros de Hemoterapia y Bancos de Sangre en el Perú. V.- OBJETIVO Establecer, normar y regular los requisitos con los que deberán contar los establecimientos de salud para la obtención de la “Autorización Sanitaria de Funcionamiento de los Centros de Hemoterapia y Bancos de Sangre Tipo I y Tipo II” del Sector Salud, a nivel nacional. 2 VI.- BASE LEGAL 1. Ley del Ministerio de Salud N° 27657, Art. 2°; Art. 3°, literales h, n, r, s, j; Art. 5° numerales 6, 8 y 11. 2. Ley General de Salud N° 26842, Art. 2° párrafo 2; Art. 8 párrafo 1; Art. 14; Art. 18, 19, 37; Art. 40° párrafo 2; Art. 46 y 48. 3. Ley N° 26454. Declaran de orden público e interés nacional la obtención, donación, conservación, transfusión y suministro de sangre humana. 4. Decreto Supremo N° 03-95 SA. Aprueban Reglamento de la Ley N° 26454. 5. Resolución Ministerial N° 283-9 SA/DM. Establecen Normas de Procedimientos para el control, medidas de seguridad y sanciones en relación con la obtención, donación, conservación, transmisión y suministro de sangre humana. 6. Resolución Ministerial N° 725 – 2003 SA/ DM. Plan Nacional de Promoción de la Donación Voluntaria de Sangre 2003 – 2005. 7. Resolución Ministerial N° 540-99 SA/DM. Requisitos que deben cumplir los Bancos de Sangre y Plantas de Hemoderivados para obtener autorización sanitaria de funcionamiento 8. Resolución Ministerial N° 307-99 SA/DM Normas técnicas para proyectos de arquitectura y equipamiento de Centros Hemodadores 9. Resolución Ministerial N° 614 – 2004 / MINSA. Sistema de Gestión de la Calidad del Programa Nacional de Hemoterapia y Bancos de Sangre. VII.- ÁMBITO DE APLICACIÓN El presente documento técnico es de aplicación obligatoria en todos los establecimientos del Sector Salud (Sector Público, EsSalud, Fuerzas Armadas, Fuerzas Policiales y Sector Privado) del nivel nacional. VIII.- CONTENIDO REQUISITOS MINIMOS PARA OBTENCION DE AUTORIZACION SANITARIA DE FUNCIONAMIENTO DE CENTROS DE HEMOTERAPIA Y BANCOS DE SANGRE TIPO I – 2006 Requisitos concordados con: Resolución Ministerial N° 307-99 SA/DM. Normas técnicas para proyectos de arquitectura y equipamiento de Centros Hemodadores RM 540-99 SA/DM. 3 Resolución Ministerial N° 540-99 SA/DM. Requisitos que deben cumplir los Bancos de Sangre y Plantas de Hemoderivados para obtener autorización sanitaria de funcionamiento. Resolución Ministerial N° 614-2004/MINSA. Gestión de la Calidad del PRONAHEBAS. Normas Técnicas del Sistema de GENERALIDADES Relación del personal con experiencia y/o certificación en Bancos de Sangre, emitida por entidad acreditada por el Instituto de Desarrollo de Recursos Humanos y con el auspicio del PRONAHEBAS Presentación de declaración jurada otorgada por el PRONAHEBAS. (Anexo 1) Croquis de la distribución de los ambientes del Centro de Hemoterapia y Banco de Sangre, donde se consigne áreas y metraje (sólo de estructura física construida, no consignar futuras ampliaciones). Copia simple del Convenio vigente con Centro de Hemoterapia y Banco de Sangre Tipo II (que cuente con Autorización Sanitaria de Funcionamiento vigente), que asegure el aporte de unidades de sangre tamizadas. Certificación del control de calidad de los reactivos empleados, con fecha de vencimiento mínimo de 06 a 12 meses, expedido por el Instituto Nacional de Salud. ORGANIZACIÓN – Gestión Manual de organización y funciones del Centro de Hemoterapia y Banco de Sangre o incluida dentro del Manual de organización y funciones del servicio de Laboratorio o de Patología Clínica. Manual de normas y procedimientos técnicos del Centro de Hemoterapia y Banco de Sangre. Manual de Bioseguridad. Programa de capacitación continua para personal del Centro de Hemoterapia y Banco de Sangre. Estudio de costos de las pruebas de compatibilidad de las unidades de sangre y/o hemocomponentes Programa de control de calidad interno. Programa de mantenimiento preventivo y recuperativo de equipos. Plan de Promoción de la Donación Voluntaria de Sangre Institucional, concordante con el Plan Nacional de Promoción de la Donación Voluntaria de Sangre del PRONAHEBAS Registro de transfusiones de sangre. Registro de casos e informes de reacciones transfusionales. 4 Informe estadístico PRONAHEBAS). mensual actualizado (Según formato estadístico del Compromiso para el uso obligatorio del sello nacional de calidad de sangre en todas las unidades transfundidas (Anexo 2) INFRAESTRUCTURA Área de recepción y atención de solicitudes transfusionales. Área de Inmunohematología y Control de calidad Recepción de muestras y unidades de sangre Laboratorio de inmunohematología Control de calidad Almacén Área de almacenamiento y distribución de componentes a temperatura ambiental de + 20 a + 24 °C Área para congeladora de -20 °C ó menos con registro de temperatura Área para conservadora de sangre de +2 a +6°C con registro de temperatura Área de distribución Área administrativa Área medicina transfusional (Opcional) Área de lavado, autoclavado y decontaminación. Cálculo del área mínima = 0.05 m2 x total de unidades de sangre transfundidas al año. EQUIPOS MÍNIMOS Baño María Centrífuga de inmunohematología Conservadora de sangre de +2 a +6° C, con registro de temperatura y/o alarma audiovisual. Congeladora de -20°C o menos con registro de temperatura y/o alarma audiovisual. Microscopio óptico Pipetas automáticas Cronómetro Termómetros de laboratorio con rangos: -10 a +100°C; -40 a +10°C; -80 a 5 +10°C Autoclaves (compartida). Esfingomanómetros. Estetoscopio (adultos y niños). Termómetro clínico. Cooler para transporte de unidades Rotador de plaquetas ** EQUIPOS INDISPENSABLES Equipo de cómputo. Grupo electrógeno o alimentación de emergencia (propio o compartido). Teléfono Equipo de aire acondicionado o calefacción** Equipo de Radiotelefonía para quienes no cuenten con servicio telefónico ** INSTALACIONES Sistema eléctrico con punto a tierra Agua y desagüe Telefonía fija Punto de internet Sistema de aire acondicionado o calefacción ** Radiotelefonía ** PERSONAL Medico Patólogo Clínico con entrenamiento en Banco de Sangre – Jefatura. Tecnólogo Médico con mención en laboratorio clínico y entrenamiento en Banco de Sangre Técnico de Laboratorio con entrenamiento en Banco de Sangre Enfermera (si va a tener área de medicina transfusional) Los ambientes pueden estar compartidos con el servicio de laboratorio, a EXCEPCION DEL ÁREA DE ALMACENAMIENTO y la UNIDAD DE MEDICINA TRANSFUSIONAL. La atención en el servicio debe estar GARANTIZADA durante las 24 horas del día, de lunes a domingo, con profesionales de la salud con experiencia en Centros de Hemoterapia y Bancos de Sangre. 6 REQUISITOS MINIMOS PARA OBTENCION DE AUTORIZACION SANITARIA DE FUNCIONAMIENTO DE CENTROS DE HEMOTERAPIA Y BANCOS DE SANGRE TIPO II – 2006 Requisitos concordados con: Resolución Ministerial N° 307-99 SA/DM. Normas técnicas para proyectos de arquitectura y equipamiento de Centros Hemodadores RM 540-99 SA/DM. Resolución Ministerial N° 540-99 SA/DM. Requisitos que deben cumplir los Bancos de Sangre y Plantas de Hemoderivados para obtener autorización sanitaria de funcionamiento. Resolución Ministerial N° 614-2004/MINSA. Gestión de la Calidad del PRONAHEBAS. Normas Técnicas del Sistema de GENERALIDADES Relación del personal con experiencia y/o certificación en Bancos de Sangre, emitida por entidad acreditada por el Instituto de Desarrollo de Recursos Humanos y con el auspicio del PRONAHEBAS ( No necesario para el personal de Enfermería). Presentación de declaración jurada otorgada por el PRONAHEBAS. (Según Modelo) Croquis de la distribución de los ambientes del Centro de Hemoterapia y Banco de Sangre, donde se consigne áreas y metraje (sólo de estructura física construida; no consignar futuras ampliaciones. Certificación del control de calidad de los reactivos empleados, con fecha de vencimiento mínimo de 06 a 12 meses, expedido por el Instituto Nacional de Salud. ORGANIZACIÓN – Gestión Manual de organización y funciones del Centro de Hemoterapia y Banco de Sangre o incluida dentro del Manual de organización y funciones del servicio de Laboratorio de Patología Clínica. Manual de normas y procedimientos técnicos del Centro de Hemoterapia y Banco de Sangre. Manual de Bioseguridad Programa de capacitación continua para personal del Centro de Hemoterapia y Banco de Sangre. 7 Estudio de costos de las unidades de sangre y/o hemocomponentes. Programa de control de calidad interno y externo. Programa de mantenimiento preventivo y recuperativo de equipos. Plan de Promoción de la Donación Voluntaria de Sangre Institucional, concordante con el Plan Nacional de Promoción de la Donación Voluntaria de Sangre del PRONAHEBAS. Registro de donación y transfusión de sangre. Registro de casos e informes de reacciones transfusionales. Registro de donantes voluntarios. Registro de transfusiones autólogas. Informe estadístico mensual actualizado. (Anexo 4). Archivos de los convenios con los Centros de Hemoterapia y Banco de Sangre Tipo I que cuenten con Autorización Sanitaria de Funcionamiento del Ministerio de Salud y a quienes provee de unidades de sangre. Compromiso para el uso obligatorio del sello nacional de calidad de sangre en todas las unidades procesadas. INFRAESTRUCTURA Área de recepción y atención de solicitudes transfusionales y entrega de resultados. Sala de espera y recepción de donantes Servicios higiénicos Área de reconocimiento de donantes y extracción de sangre (área de captación de donantes; área de Consultorio - reconocimiento selección de donantes) médico Extracción de sangre y de reposo Sala de aféresis (opcional) Área de análisis de sangre (inmunoserología e inmunohematología) Recepción de muestras y unidades de sangre Análisis de muestras de los donantes. 8 Inmunoserología Inmunohematología Recepción de muestras y unidades de sangre Área de producción de componentes sanguíneos Área de custodia de unidades de sangre Área de fraccionamiento Área de material e instrumental estéril Seroteca (intra o extra institucional). Área de Control de calidad Área de almacenamiento y distribución de componentes a temperatura ambiental de + 20 a + 24 °C Área para congeladora de -20 °C ó menos con registro de temperatura Área para conservadora de sangre de +2 a +6°C con registro de temperatura Área de distribución Área administrativa Área de medicina transfusional Área de Lavado, autoclavado y decontaminación Cálculo del área mínima total = 0.05 m2 x total de unidades de sangre procesadas-año EQUIPOS MÍNIMOS Balanza digital o de 2 brazos hasta 3 Kg. Balanza con tallímetro (si va a realizar aféresis). Baño María Centrífuga de inmunohematología Centrifuga de microhematocrito Centrifuga refrigerada 9 Conservadora de sangre de +2 a +6° C, con registro de temperatura y/o alarma audiovisual Congeladora de -20° C o menos con registro de temperatura y/o alarma audiovisual Congeladora de -70° C con registro de temperatura y/o alarma audiovisual Equipo automatizado o semiautomatizado (lector, lavador, incubadora e impresora) para enzimoinmuno ensayo (ELISA). Microscopio óptico Agitador de bolsas de sangre con báscula calibrada Rotador de plaquetas Separador de plasma Pipetas automáticas Cronómetro Incubadora de 37 °C (si equipo de ELISA es semiautomatizado) Termómetros con rangos a : -10 a 100; -40 a +10; -80 a + 10 Descongelador de Plasma (opcional) Autoclave (Compartida) Esfingomanómetro Estetoscopio (adultos y niños) Termómetro clínico Cooler para transporte de unidades Selladores de tubuladura Equipo automatizado para inmunohematología (opcional) Sillones para hemodonación Equipo de reanimación cardiopulmonar básico Camillas con baranda y soporte, rodantes Equipo de aféresis (Opcional) 10 EQUIPOS INDISPENSABLES Equipo de cómputo. Grupo electrógeno o alimentación de emergencia (propio o compartido). Teléfono Equipo de aire acondicionado o calefacción** Equipo de radiotelefonía para quienes no cuenten con servicio telefónico ** INSTALACIONES Sistema eléctrico con punto a tierra Agua y desagüe Telefonía fija Punto de internet Sistema de aire acondicionado o calefacción ** Radiotelefonía ** PERSONAL Medico Patólogo Clínico con entrenamiento en Banco de Sangre - Jefatura Medico Patólogo Clínico con entrenamiento en Banco de Sangre - Médico Asistente Tecnólogo Médico con mención en laboratorio clínico y entrenamiento en Banco de Sangre Técnico de Laboratorio con entrenamiento en Banco de Sangre Enfermera Secretaria Digitador * No indispensable ** Si amerita 11 Los ambientes pueden estar compartidos con el servicio de laboratorio, a EXCEPCION DEL ÁREA DE ALMACENAMIENTO y la UNIDAD DE MEDICINA TRANSFUSIONAL. La atención en el servicio debe estar GARANTIZADA durante las 24 horas del día, de lunes a domingo, con profesionales de la salud con experiencia en Centros de Hemoterapia y Bancos de Sangre. 12 ANEXO N° 1 MODELO DE SOLICITUD DIRIGIDA A LA DIRECCIÓN GENERAL SALUD DE LAS PERSONAS DEL MINISTERIO DE SALUD REQUIRIENDO AUTORIZACIÓN SANITARIA DE FUNCIONAMIENTO PARA CENTRO DE HEMOTERAPIA Y BANCOS DE SANGRE. SUMILLA: “Solicita Autorización Sanitaria de Funcionamiento de Centro de Hemoterapia y Banco de Sangre” SEÑOR DIRECTOR GENERAL DE LA DIRECCIÓN GENERAL DE SALUD DE LAS PERSONAS DEL MINISTERIO DE SALUD. S.D.: Yo,................................................................................... ...............................................Director/a General del Hospital.............. (Nombre del Hospital, Instituto, Clínica, Policlínico, etc.)......................................................del.................(Ministerio de Salud, Fuerzas Armadas, Fuerzas Policiales, EsSalud, Sector Público),............................................identificado/a con DNI N°................................................................, señalando domicilio legal en el/a ......................................................................., del Distrito de...................................................., de la Provincia de....................................................y del Departamento de ......................................................., ante usted con el debido respeto me presento y digo: Que el establecimiento bajo mi dirección cuenta con un Centro de Hemoterapia y Banco de Sangre, el mismo que reúne los requisitos mínimos de infraestructura, equipamiento, personal profesional y estándares, exigidos por el Programa Nacional de Hemoterapia y Bancos de Sangre – PRONAHEBAS, por lo que solicito a usted ordene a quien corresponda se me otorgue la AUTORIZACIÓN SANITARIA DE FUNCIONAMIENTO PARA CENTROS DE HEMOTERAPIA Y BANCOS DE SANGRE DEL PERÚ. Es gracia que espero alcanzar por ser de justicia. .........................................de,..................................del 2006. Firma y Sello del Director General 13 Del Establecimiento de Salud 14 ANEXO N° 2 MODELO DE LA DECLARACIÓN JURADA DE CUMPLIMIENTO DE LOS REQUISITOS DE INFRAESTRUCTURA, EQUIPAMIENTO Y COMPONENTES Y ESTÁNDARES MÍNIMOS PARA LOS CENTROS DE HEMOTERAPIA Y BANCOS DE SANGRE Conste por el presente documento que yo, señor/a....................................................................................................identificado/a con DNI N° ...............................................Director/a General del Hospital.............. (Nombre del Hospital, Instituto, Clínica, Policlínico, etc.)......................................................del.................(Ministerio de Salud, Fuerzas Armadas, Fuerzas Policiales, EsSalud, Sector Público), con Registro Único de Contribuyente N° ................................................................., con domicilio legal en el/a ......................................................................., del Distrito de ...................................................., de la Provincia de....................................................y del Departamento de ......................................................., designado/a mediante ....................................(Resolución Ministerial, Acuerdo de Consejo, etc.) N°......................................., DECLARÓ que el establecimiento bajo mi dirección cuenta con un Centro de Hemoterapia y Banco de Sangre, el mismo que reúne los requisitos mínimos de infraestructura, equipamiento, personal profesional y estándares, exigidos por el Programa Nacional de Hemoterapia y Bancos de Sangre – PRONAHEBAS. En tal sentido, autorizo a los representantes de la Dirección de Servicios de Salud y al Coordinador del PRONAHEBAS de la DISA / DIRESA bajo su Dirección para que puedan efectivizar las visitas de verificación necesarias que permitan corroborar lo expresado. .........................................de,..................................del 2006. Firma y Sello del Director General Del Establecimiento de Salud 15 ANEXO N° 3 MODELO DEL COMPROMISO DE UTILIZACION DEL SELLO NACIONAL DE CALIDAD DE SANGRE DEL PRONAHEBAS EN TODAS LAS UNIDADES DE SANGRE Y HEMOCOMPONENTES Conste por el presente documento, que los suscritos............................................................, con DNI N°.................................., Director General y..................................................................., con DNI N°.................................., Jefe del Centro de Hemoterapia y Banco de Sangre Tipo II del.................................................. (Nombre del Hospital, Instituto, Clínica, Policlínico, etc.)......................................................del.................(Ministerio de Salud, Fuerzas Armadas, Fuerzas Policiales, EsSalud, Sector Público), DECLARAMOS CONOCER, el artículo 7° de la Ley N° 26454 que a la letra dice: “Los Bancos de Sangre deben realizar obligatoriamente las pruebas correspondientes para la sangre y sus componentes, según las normas internacionales de la Organización Mundial de la Salud vigentes, así como también las pruebas pre transfusionales de compatibilidad. Ningún producto podrá ser entregado o transfundido sin el respectivo Sello Nacional de Calidad de Sangre................”. En tal sentido NOS COMPROMETEMOS a ceñirnos a la normatividad vigente y por tanto, a disponer EL USO OBLIGATORIO del Sello Nacional de Calidad de Sangre del Programa Nacional de Hemoterapia y Bancos de Sangre en todas las unidades de sangre y/o hemocomponentes procesadas en nuestro Centro de Hemoterapia y Banco de Sangre, como constancia de que le han sido realizadas todas las pruebas inmunoserológicas que las normas nacionales e internacionales disponen, bajo responsabilidad. .........................................de,..................................del 2006. Firma y Sello del Director General del Hospital Firma y Sello del Jefe del Centro de Hemoterapia y Banco de Sangre 16 ANEXO N° 4 MODELO DEL CONVENIO ESPECÍFICO DE COLABORACIÓN MUTUA ENTRE EL HOSPITAL....................................................Y EL........... (Nombre del Hospital, Instituto, Clínica, Policlínico, etc.)................... PARA EL TRABAJO COORDINADO DE LOS CENTROS DE HEMOTERAPIA Y BANCOS DE SANGRE Conste por el presente documento el Convenio Específico de Colaboración Mutua para el trabajo coordinado de los Centros de Hemoterapia y Bancos de Sangre, que celebran de una parte, el Hospital.............. (Nombre del Hospital, Instituto, Clínica, Policlínico, etc.)......................................................del.................(Ministerio de Salud, Fuerzas Armadas, Fuerzas Policiales, EsSalud, Sector Público), con Registro Único de Contribuyente N° ................................................................., con domicilio legal en el/a ......................................................................., del Distrito de ...................................................., de la Provincia de....................................................y del Departamento de ......................................................., debidamente representado/a por su Director/a General, señor/a...........................................................identificado/a con DNI N° ............................................... y, designado/a con.....................................(Resolución Ministerial, Acuerdo de Consejo, etc.) N°......................................., a quien en adelante se le denominará “CENTRO DE HEMOTERAPIA Y BANCO DE SANGRE TIPO II” y, de otra parte, el.............. (Nombre del Hospital, Instituto, Clínica, Policlínico, etc.)......................................................del.................(Ministerio de Salud, Fuerzas Armadas, Fuerzas Policiales, EsSalud, Sector Público).................., con Registro Único de Contribuyente N° ................................................................., con domicilio legal en el/a ......................................................................., del Distrito de ...................................................., de la Provincia de....................................................y del Departamento de ......................................................., debidamente representado/a por su Director/a General.....................................................señor/a................................................................ ........... .................................................................identificado/a con DNI N° ............................................... y, designado/a con.....................................(Resolución Ministerial, Acuerdo de Consejo, etc.) N°......................................., a quien en adelante se le denominará “CENTRO DE HEMOTERIA Y BANCO DE SANGRE TIPO I”, en los términos y condiciones que se especifican en las cláusulas siguientes: 17 CLAUSULA PRIMERA: DE LAS PARTES EL HOSPITAL............ (Nombre del Hospital)...................................., es un establecimiento de salud, que cuenta con un CENTRO DE HEMOTERAPIA Y BANCO DE SANGRE TIPO II, el mismo que reúne los requisitos mínimos exigidos por las Normas Técnicas del Sistema de Gestión de la Calidad del PRONAHEBAS y, posee además, Autorización Sanitaria de Funcionamiento N°........................, otorgado por la Dirección General de Salud de las Personas del Ministerio de Salud. Realiza actividades de captación, extracción, fraccionamiento tamizaje, control, conservación, transfusión y/o distribución de sangre y/o hemocomponentes. EL....................................................................................... (Nombre del Hospital, Instituto, Clínica, Policlínico, etc.)......................................................del.................(Ministerio de Salud, Fuerzas Armadas, Fuerzas Policiales, EsSalud, Sector Público), es un establecimiento de salud, que cuenta con un CENTRO DE HEMOTERAPIA Y BANCO DE SANGRE TIPO I, el mismo que reúne los requisitos mínimos exigidos por las Normas Técnicas del Sistema de Gestión de la Calidad del PRONAHEBAS y que requiere del abastecimiento de unidades sangre total y/o hemocomponentes sanguíneos de calidad, oportunos y seguros para la atención de la demanda institucional. Realiza actividades de control, conservación y, transfusión de sangre y/o hemocomponentes. CLAUSULA SEGUNDA: DEL MARCO DEL CONVENIO El presente Convenio Específico de Colaboración Mutua para el trabajo coordinado de los Centros de Hemoterapia y Bancos de Sangre, se suscribe al amparo de lo establecido por la Resolución Ministerial N° 1954-2002-SA/DM. CLAUSULA TERCERA: DEL OBJETO DEL CONVENIO Por el presente Convenio Específico, las partes acuerdan establecer los criterios básicos que regularán el desarrollo del trabajo coordinado y sostenido en el campo del abastecimiento de unidades de sangre y/o hemocomponentes, de calidad, oportuna y segura. Asi como otras actividades concernientes a la promoción, captación y fidelización de donantes voluntarios de sangre. CLAUSULA CUARTA: LOS REPRESENTANTES Las partes designarán autónomamente a una persona como representante de su institución con la finalidad de coordinar y viabilizar el desarrollo y ejecución del presente convenio asi como, facilitar el desarrollo de las actividades que de éste devengan. CLAUSULA QUINTA: DE LAS OBLIGACIONES Por el presente, el CENTRO DE HEMOTERAPIA Y BANCO DE SANGRE TIPO II se obliga a: 1. Abastecer oportunamente al CENTRO DE HEMOTERAPIA TIPO I con unidades de sangre y/o hemocomponentes de calidad y seguras, según la demanda de éste. 2. Contar y mantener vigente la Autorización Sanitaria de Funcionamiento otorgada por el Ministerio de Salud. 18 3. Asumir completamente las responsabilidades en la selección de los postulantes, aplicando el cuestionario del postulante consignado en las Normas Técnicas del Sistema de Gestión de la Calidad y asegurando la identificación plena del mismo. 4. Mantener personal profesional y técnico, en cantidad suficiente y según los perfiles descritos en la Norma del Sistema de Gestión de la Calidad del PRONAHEBAS, capacitado y actualizado, para el desarrollo de los procesos de selección, extracción, fraccionamiento, tamizaje, pruebas de control interno y externo, almacenamiento, transfusión y distribución de las unidades de sangre. 5. Adscribirse al Programa de Evaluación Externa del Desempeño en Inmunoserlogía (PEVED) del PRONAHEBAS. 6. Asegurar infraestructura, equipamiento, insumos y reactivos mínimos exigidos por el PRONAHEBAS para el desarrollo de los procesos. 7. Garantizar la Bioseguridad durante los procesos de extracción y colección de sangre. 8. Entregar los resultados de las pruebas de tamizaje realizadas a las personas a quienes se les extrajo sangre, bajo cualquier modalidad de donación, en forma quincenal y, guardando la confidencialidad del caso. 9. Implementar y mantener un registro de donantes voluntarios de sangre. 10. A garantizar la atención del donante, por evento ocurrido durante y después del proceso de la donación voluntaria. 11. Garantizar la firma del consentimiento informado del DONANTE. 12. Garantizar la firma del consentimiento informado del RECEPTOR. 13. Transferir unidades sanguíneas y/o hemocomponentes, según lo establecido en las Normas Técnicas del Sistema de gestión de la Calidad del PRONAHEBAS. 14. Al uso de Sello Nacional de Calidad del PRONAHEBAS en todas las unidades sanguíneas transferidas, como constancia de que le han sido realizadas todos los procesos mínimos y obligatorios, que certifiquen calidad e inocuidad de los mismos y, de acuerdo a la normatividad vigente. 15. Participar activamente en las actividades conjuntas (institucional, interinstitucionales, intersectoriales u otras) que se desarrollen en lo referente a la promoción de la donación voluntaria de sangre. 16. Disponer de la logística necesaria y adecuada para el desarrollo de actividades de promoción de la donación voluntaria de sangre (campañas, actividades educativas o de difusión), con la movilización individual de sus recursos o de forma compartida con otras instituciones. 17. Fomentar la cultura de la donación voluntaria de sangre en la población en general a través de sus diferentes espacios de intervención. 18. Realizar campañas de sensibilización en lo referente a la promoción de la donación voluntaria de sangre con los medios de comunicación de acuerdo al plan concertado con el Ministerio de Salud. 19. Mantener actualizado el stock de sangre. 19 20. Mantener un stock de unidades de sangre igual o mayor al 20%, proveniente de donantes voluntarios. 21. Mantener un archivo de las Autorizaciones Sanitarias de Funcionamiento de los establecimientos a los que abastece de unidades de sangre y/o hemocomponentes. 22. No comercializar la sangre y/o hemocomponente por ningún tipo de modalidad. 23. No abastecer de sangre a Centros de Hemoterapia y Bancos de Sangre que no cuenten con Autorización Sanitaria de funcionamiento. 24. A rotular todas las unidades de sangre total y/o hemocomponentes con los siguientes datos: identificación de la institución recolectora, identificación numérica, tipo, volumen, grupo ABO, factor Rh, fecha de extracción, fecha de expiración y resultados de las pruebas de tamizaje realizadas. 25. Eliminar adecuadamente las unidades de sangre, sean por reactividad o vencimiento de las mismas, sean institucionales o, provenientes de los Centros de Hemoterapia y Bancos de Sangre Tipo I que sean devueltas con este fin, con el acta de eliminación respectiva. 26. Realizar ante la DISA/DIRESA, la notificación de reacciones adversas transfusionales mensuales, incluyendo la notificación negativa. 27. Fomentar el uso racional y adecuado de sangre entre los profesionales de la salud. 28. Realizar el estudio de costos del tamizaje de las unidades de sangre procesadas, dejando claramente establecido el costo unitario de la unidad de sangre y/o hemocomponente. 29. Mantener actualizado e informar mensualmente, a la DISA / DIRESA las estadísticas del servicio, según los formatos establecidos por el PRONAHEBAS. EL CENTRO DE HEMOTERAPIA Y BANCO DE SANGRE TIPO I se obliga a: 1. Remitir en un plazo no mayor de 15 días al Centro de Hemoterapia y Banco de Sangre Tipo II, copia simple de la Autorización Sanitaria de Funcionamiento otorgada por el Ministerio de Salud, momento en el cual se iniciará el abastecimiento efectivo de unidades de sangre y/o hemocomponentes, materia del presente convenio. 2. Mantener personal profesional y técnico, en cantidad suficiente y según los perfiles descritos en la Norma del Sistema de Gestión de la Calidad del PRONAHEBAS, capacitado y actualizado, para el desarrollo de los procesos de control, almacenamiento y, transfusión de unidades de sangre. 3. Asegurar infraestructura, equipamiento e insumos mínimos exigidos por el PRONAHEBAS para el desarrollo de los procesos. 4. Realizar un estudio de la demanda de sangre institucional, en casos de normalidad y de situación de catástrofe. 5. Solicitar adecuada y oportunamente, bajo los criterios descritos en el Sistema de Gestión de la Calidad del PRONAHEBAS, las unidades de sangre al CENTRO DE HEMOTERAPIA Y BANCO DE SANGRE TIPO II, que se requieran para atender la demanda institucional y ante una situación de catástrofe. 20 6. Garantizar la esterilidad e inocuidad de insumos utilizados en los procesos de almacenamiento, distribución y transfusión de las unidades de sangre y/o hemocomponentes. 7. Garantizar la firma del consentimiento informado del receptor. 8. Asegurar la atención del receptor, por evento ocurrido durante y después del proceso de transfusión sanguínea. 9. Realizar ante la DISA/DIRESA, la notificación de reacciones adversas transfusionales mensuales, incluyendo la notificación negativa. 10. Asegurar una cantidad suficiente de donantes voluntarios, repetitivos y fidelizados al Centro de Hemoterapia y Banco de Sangre tipo II, con la finalidad de poder mantener en su stock un 20% o más de unidades provenientes de donantes voluntarios Y, DE ACUERDO AL PLAN OPERATIVO ANUAL INSTITUCIONAL Y DELPRONAHEBAS. 11. Exigir el Sello Nacional de Calidad del PRONAHEBAS en todas las unidades sanguíneas recibidas, como constancia de que le han sido realizado todos los procesos mínimos y obligatorios, que certifiquen calidad e inocuidad de los mismos y, de acuerdo a la normatividad vigente. 12. Responsabilizarse por el recojo, traslado y, pruebas de compatibilidad pertinentes de las unidades sanguíneas y/o hemocomponentes transferidas por el Centro de Hemoterapia y Banco de Sangre Tipo II, según lo establecido en las Normas Técnicas del Sistema de gestión de la Calidad del PRONAHEBAS; cumpliendo para ello con todos los requisitos de bioseguridad que permitan a éstas mantener su calidad y, ser utilizados sin ningún riesgo alguno para el receptor. 13. Participar activamente en las actividades conjuntas (institucional, interinstitucionales, intersectoriales u otras) que se desarrollen en lo referente a la promoción de la donación voluntaria de sangre. 14. Disponer de la logística necesaria y adecuada para el desarrollo de actividades de promoción de la donación voluntaria de sangre (campañas, actividades educativas o de difusión), con la movilización individual de sus recursos o de forma compartida con otras instituciones. 15. Participar activamente en actividades concernientes a la Promoción de la Donación Voluntaria de Sangre institucional. 16. Fomentar la cultura de la donación voluntaria de sangre en la población en general a través de sus diferentes espacios de intervención. 17. Realizar campañas de sensibilización en lo referente a la promoción de la donación voluntaria de sangre con los medios de comunicación de acuerdo al plan concertado con el Ministerio de Salud. 18. Exigir la entrega de los resultados de parte del Centro de Hemoterapia y Bancos de Sangre Tipo II, de las pruebas de tamizaje realizadas a las personas a quienes los remitió para que se les extrajera sangre, bajo cualquier modalidad de donación, en forma quincenal y, guardando la confidencialidad del caso. 21 19. Verificar las condiciones en las cuales son recepcionadas las unidades de sangre y/o hemocomponentes, lo cual debe constar por escrito, con cargo para la institución de procedencia. 20. En caso que la sangre u hemocomponente no sea utilizado en los plazos determinados, éstos deberán ser devueltos ANTES DE LOS 15 DIAS DE VENCIMIENTO, con un acta de eliminación al Centro de Hemoterapia y Bancos de Sangre Tipo II para el debido proceso 21. Fomentar el uso racional y adecuado de sangre. 22. Asumir el pago de los costos que generó el tamizaje y procesamiento de las unidades de sangre recibidas por otras modalidades de donantes que no sean voluntarios. El costo de los mismos son los establecidos en el estudio que para este ítem desarrolló el Centro de Hemoterapia y Banco de Sangre Tipo II; el pago se realizará en forma mensual en la Caja Central del Hospital.......... (en el que se ubica el Centro de Hemoterapia y Banco de Sangre Tipo II)......................, previa liquidación del Servicio en que se encuentre orgánicamente adscrito el Centro de Hemoterapia y Banco de Sangre Tipo II. 23. No cobrar al receptor (paciente), una cantidad mayor al precio establecido en el estudio de costos para el tamizaje de las unidades de sangre y/o hemocomponentes transfundidas. 24. Mantener actualizado e informar mensualmente, a la DISA / DIRESA las estadísticas del servicio, según los formatos establecidos por el PRONAHEBAS. CLAUSULA SEXTA: DEL ABASTECIMIENTO DE LOS CENTROS DE HEMOTERAPIAS Y BANCOS DE SANGRE DEL SECTOR PRIVADO Para cuestiones de abastecimiento de unidades de sangre y/o hemocomponentes de los Centros de Hemoterapia y Bancos de Sangre del Sector Privado, éstas sólo podrán provenir OBLIGATORIAMENTE, de los donantes voluntarios y/o de reposición que éstas envíen al Centro de Hemoterapia y Banco de Sangre Tipo II para ser procesadas. CLAUSULA SEPTIMA: DE LAS SUPERVISIONES Y COMPROMISOS. Con la finalidad de efectuar un seguimiento y control permanente del Convenio, los representantes de ambas Instituciones, realizarán una evaluación de la marcha del presente Convenio cada 6 meses, desde la fecha del abastecimiento efectivo de unidades de sangre y/o hemocomponentes, emitiendo un informe conjunto al nivel central de ambas instituciones y a la Coordinación Nacional del PRONAHEBAS. CLAUSULA OCTAVA: DE LAS MODIFICACIONES DEL CONVENIO Si en el desarrollo de las actividades concernientes a la ejecución del presente Convenio Específico, se detectaran vacíos en cualquiera de las etapas o interrelaciones del mismo; o si fuera necesario redefinir criterios o mecanismos para su mejor ejecución, los representantes de las partes suscribirán acuerdos que recibirán el nombre de Addendas que suplirán estas deficiencias y, que para su aplicación, deberán ser refrendadas por los funcionarios centrales de ambas Instituciones y tener el visto bueno del PRONAHEBAS. CLAUSULA NOVENA: DE LA RESOLUCIÓN DEL CONVENIO 22 En caso de incumplimiento de las obligaciones y responsabilidades establecidas en el presente Convenio, la parte afectada requerirá a su contraparte el cumplimiento de la obligación en un plazo máximo de 30 días, bajo apercibimiento de que, en caso contrario, el convenio quedará resuelto. La Resolución del presente Convenio requerirá obligatoriamente la declaración de la causa que motiva ésta, la misma que deberá ser notificada en forma inmediata al Centro de Hemoterapia afectado, al nivel central de ambas instituciones y a la Dirección General de Salud de las Personas del Ministerio de Salud, para la adopción las sanciones y/o denuncias correspondientes, si el caso lo amerita. De tratarse de un Centro de Hemoterapia y Banco de Sangre Tipo I, recibida la comunicación escrita, éste tendrá 30 días calendario (treinta) para que en ese lapso de tiempo, tramite y consiga un nuevo convenio con un Centro de Hemoterapia y Banco de Sangre Tipo II. De tratarse de un Centro de Hemoterapia y Banco de Sangre Tipo II, recibida la comunicación escrita, éste tendrá 07 días calendario (siete) para que en ese lapso de tiempo corrija el o las observaciones que desencadenaron en esta situación. La resolución del convenio, no exime del pago y de la provisión de unidades de sangre y/o hemocomponentes hasta el último día de la finalización del mismo, de parte de uno u otro de los obligados. CLAUSULA DECIMA: MOTIVOS DEL RETIRO DE LA AUTORIZACIÓN SANITARIA DE FUNCIONAMIENTO 1. Incumplimiento de cualquiera de las obligaciones y responsabilidades establecidas en el presente Convenio. 2. Incumplimiento en el pago de las unidades transferidas. 3. Solicitar unidades de reposición en la modalidad de 2 x 1. 4. Pago por tamizaje de sangre diferente al monto que figura en el estudio de costos. 5. Enviar donantes remunerados. 6. Enviar donantes sin documentos de identidad. 7. Traslado del lugar físico diferente al original para el cual se emitió la Autorización Sanitaria de Funcionamiento. En ningún caso, el Centro de Hemoterapia y Banco de Sangre Tipo I podrá desarrollar actividades concernientes al manejo y transfusión de unidades de sangre y/o hemocomponentes sin un Convenio Específico. CLAUSULA DECIMA PRIMERA: DE LA VIGENCIA La vigencia del Convenio Específico es de un tres años (03) a partir de la fecha de su suscripción, pudiendo renovarse por un periodo igual de tiempo en forma automática, salvo comunicación escrita en contrario efectuada por alguna de las partes, la cual debe ser remitida como mínimo con 60 (sesenta) días de anticipación a la finalización de su vigencia. 23 La renovación del Convenio Específico requiere de la firma de un nuevo documento actualizado. CLAUSULA DECIMA SEGUNDA: SOLUCIÓN DE CONFLICTOS Toda controversia o discrepancia que se derive de la interpretación o cumplimiento del Convenio Específico será solucionada mediante el trato directo entre las partes De conformidad con todas y cada una de las cláusulas estipuladas en el presente Convenio, las partes firman por duplicado, con igual valor, en la Ciudad de Lima a los.......días del mes de.............del año 2006. Director General del Hospital Director General del Hospital CS y BS Tipo II CS y BS Tipo I V° B° Director de la DISA /DIRESA Pronahebas de V° B° Coordinador del la DISA / DIRESA BIBLIOGRAFIA 1. Ministerio de Salud – Perú. Dirección General de Salud de las Personas – Programa Nacional de Hemoterapia y Bancos de Sangre. Sistema de Gestión de calidad del PRONAHEBAS. NT N° 011 - MINSA/DGSP-V.01. Lima – 2004. 2. Ministerio de Salud – Perú. Dirección General de Salud de las Personas – Programa Nacional de Hemoterapia y Bancos de Sangre. Sistema de Gestión de calidad del PRONAHEBAS. NT N° 012 - MINSA/DGSP-V.01. Lima – 2004. 3. Ministerio de Salud – Perú. Dirección General de Salud de las Personas – Programa Nacional de Hemoterapia y Bancos de Sangre. Sistema de Gestión de calidad del PRONAHEBAS. NT N° 013 - MINSA/DGSP-V.01. Lima – 2004. 4. Ministerio de Salud – Perú. Dirección General de Salud de las Personas – Programa Nacional de Hemoterapia y Bancos de Sangre. Sistema de Gestión de calidad del PRONAHEBAS. NT N° 014 - MINSA/DGSP-V.01. Lima – 2004. 5. Ministerio de Salud – Perú. Dirección General de Salud de las Personas – Programa Nacional de Hemoterapia y Bancos de Sangre. Sistema de Gestión de calidad del PRONAHEBAS. NT N° 015 - MINSA/DGSP-V.01. Lima – 2004. 6. Ministerio de Salud – Perú. Dirección General de Salud de las Personas – Programa Nacional de Hemoterapia y Bancos de Sangre. Sistema de Gestión de calidad del PRONAHEBAS. NT N° 016 – MINSA/DGSP-V.01. Lima – 2004. 24 7. Ministerio de Salud – Perú. Dirección Ejecutiva de Normas Técnicas para infraestructura en Salud. Normas Técnicas para proyectos de ar1quiatectura y equipamiento de centros Hemodadores.. Lima – 1999. 8. Ministerio de Salud. Resolución Ministerial N° 540-99-SA/DM. Aprueban requisitos que deben cumplir los Bancos de Sangre y Plantas de Hemoderivados para obtener autorización sanitaria de funcionamiento. Lima – 1999. 25