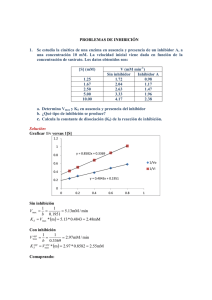
1. Las velocidades iniciales, a varias concentraciones de sustrato, para una reacción catalizada por una enzima hipotética son: [S] (mM) V0 (µM/min) 2.5 x 10-6 28 4.0 x 10-6 40 1.0 x 10-5 70 2.0 x 10-5 95 4.0 x 10-5 112 1.0 x 10-4 128 2.0 x 10-3 139 1.0 x 10-2 140 Estime los valores de Km y Vmax 2. The following experimental data were collected during a study of the catalytic activity of an intestinal peptidase with the substrate glycylglycine: Glycylglycine + H2O 2 glycine [S] (mM) V0 (µM/min) 1.5 0.21 2.0 0.24 3.0 0.28 4.0 0.33 8.0 0.40 16.0 0.45 Use the graphical analysis (Lineweaver-Burk) to determine the Km and Vmax 3. En una reacción química catalizada por una enzima, se tomaron los siguientes datos para distintas concentraciones de sustrato: Concentración del Sustrato mM 10.00 5.00 2.50 1.25 Velocidad mM/seg 5.40 4.30 3.08 1.96 Estime los valores de Km y Vmax 4. Prostaglandins are a class of eicosanoids, fatty acid derivatives with a variety of extremely potent actions on vertebrate tissues. They are responsible for producing fever and inflammation and its associated pain. Prostaglandins are derived from the 20-carbon fatty acid arachidonic acid in a reaction catalyzed by the enzyme prostaglandin endoperoxide synthase. This enzyme, a cyclooxygenase, uses oxygen to convert arachidonic acid to PGG2, the immediate precursor of many different prostaglandins. The kinetic data given below are for the reaction catalyzed by prostaglandin endoperoxide synthase. Focusing here on the first two columns, determine the Vmax and Km of the enzyme. 5. [Arachidonic acid] (mM) 0.5 1.0 1.5 2.5 3.5 Rate of formation of PGG2 (mM/min) Rate of formation of PGG2 with 10 mg/mL of ibuprofen (mM/min) 23.50 32.20 36.90 41.80 44.00 16.67 25.25 30.49 37.04 38.90 Ibuprofen is an inhibitor of prostaglandin endoperoxide synthase. By inhibiting the synthesis of prostaglandins, ibuprofen reduces inflammation and pain. Using the data in the first and third columns of the table, determine the type of inhibition that ibuprofen exerts on prostaglandin endoperoxide synthase and calculate K i or Ki’. 6. Se lleva a cabo un proceso enzimático en un reactor. Si se tienen valores de Vmáx=7.18 mM/min y Km=3.33 mM y teniendo en cuenta la reacción estequiométrica S P, calcule la cantidad de producto, en gramos (PMP: 60 g/L), que se forma al cabo de 25 minutos, partiendo de una concentración de sustrato de 200 mM. 7. Un proceso enzimático presenta una Vmax=5 mM/min y Km=10 mM. a. Si se tiene una [S]o de 10 µM ¿Cuál será la concentración al cabo de 10 minutos? b. Si se tiene una [S]o de 10 M ¿Cuál será la concentración al cabo de 10 minutos? c. Se agrega un inhibidor a la reacción y se obtuvieron valores de Vmax=50 mM/min y Km=20 mM. En otro erlenmeyer, a la misma reacción, se agrega otro inhibidor y se obtuvieron valores de Vmax=25 mM/min y Km=20 Mm ¿La inhibición es competitiva y/o no competitiva? Halle las respectivas Ki y/o K’i en cada caso. d. En un tercer erlenmeyer con una reacción similar, se agregan los dos inhibidores del punto c a la vez y se obtuvieron valores de Vmax=50 mM/min y Km=5 mM ¿Qué ocurrió? 8. Se lleva a cabo una reacción enzimática de degradación de un compuesto S. La concentración del S se puede contabilizar a partir de un método espectrofotométrico, el cual se rige por la expresión Abs=0.4*[S], con un rango de medición de [S] entre 0 mM y 1 mM. Si sobrepasa ese rango, se requiere dilución. Se llevó a cabo el método de las velocidades iniciales, donde se hace un montaje de 5 experimentos con diferentes concentraciones de S y un tiempo de reacción de 2 minutos, obteniéndose los siguientes resultados: Ensayo 1 2 3 4 5 [S]o FD Abs 20 0.40 80 0.20 96 0.25 128 0.25 200 0.20 [S]t=2 min FD Abs 5 0.40 20 0.40 60 0.25 64 0.35 100 0.30 a. Calcule la concentración y velocidad iniciales para cada ensayo. b. Calcule los valores de Vmax y Km de la cinética enzimática de degradación de S. c. En unos ensayos aparte, se llevaron a cabo experimentos similares con un inhibidor, a una concentración de 0.2 mM, utilizando las mismas concentraciones iniciales de S de la tabla y el mismo tiempo de reacción. Se obtuvieron valores de Vmax y Km iguales a 7.5 mM/min y 40 mM respectivamente Calcular los valores de Ki y/o K’i, según sea el caso. 9. A partir de los datos experimentales, definir el tipo de modelo enzimático más adecuado y las respectivas constantes cinéticas (ver archivo anexo de Excel). Nota: para todos los casos, considerar un tiempo de reacción igual a 150 segundos. Dar la velocidad en mM/min y la concentración de sustrato en mM. 10. Para cada uno de los ejercicios del numeral 9, calcule la concentración, al cabo de 10 minutos, si So = 200 mM. Posibles modelos para numeral 9 y 10: 𝐌𝐢𝐜𝐡𝐚𝐞𝐥𝐢𝐬 − 𝐌𝐞𝐧𝐭𝐞𝐧: V = Vmax ∙ S Km + S 𝐈𝐧𝐡𝐢𝐛𝐢𝐜𝐢ó𝐧 𝐚𝐜𝐨𝐦𝐩𝐞𝐭𝐢𝐭𝐢𝐯𝐚 𝐩𝐨𝐫 𝐬𝐮𝐬𝐭𝐫𝐚𝐭𝐨: V = Vmax ∙ S S2 Km + S + K s Vmax ∙ S 𝐈𝐧𝐡𝐢𝐛𝐢𝐜𝐢ó𝐧 𝐜𝐨𝐦𝐩𝐞𝐭𝐢𝐭𝐢𝐯𝐚 𝐩𝐨𝐫 𝐬𝐮𝐬𝐭𝐫𝐚𝐭𝐨: V = S S2 K m (1 + K ) + S + K s s 𝐄𝐜𝐮𝐚𝐜𝐢ó𝐧 𝐝𝐞 𝐇𝐢𝐥𝐥𝐬 (𝐄𝐧𝐳𝐢𝐦𝐚𝐬 𝐚𝐥𝐨𝐬𝐭é𝐫𝐢𝐜𝐚𝐬): V = V=− Vmax ∙ S n K′s + S n dS dt Nota: recordar que para el método de las velocidades iniciales (cálculo de las constantes cinéticas) S y V pasan a ser So y Vo, respectivamente, donde Vo = (So – St)/t. Para estos ejercicios, el R2, del mejor ajuste de modelo, es muy cercano a 1.