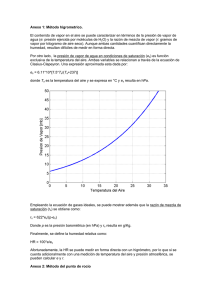
Aire Atmosférico: El aire atmosférico es una mezcla de una serie de gases, cada uno de los cuales tiene propiedades físicas y químicas propias. Los componentes principales del aire atmosférico puro son oxígeno y nitrógeno, existiendo además porcentajes pequeños de gases raros (argón, neón y helio) así como un porcentaje variable de dióxido de carbono. La composición del aire puro seco es: % en volumen % en masa Nitrógeno 78.09 75.53 Oxígeno 20.95 23.14 Dióxido de Carbono 0.03 0.046 Argón, helio, neón, etc. 0.93 1.284 Para efectos prácticos, puede considerarse la composición de 1 m3 se aire como sigue: Nitrógeno 78% Oxígeno 21% C02 + otros gases 1% La densidad del aire a nivel del mar y a 21 ºC es de 1.2 Kg / m3 En atmósferas normales, el aire seco no existe ya que normalmente contiene un porcentaje variable de vapor de agua (entre 0.1 y 4% de su masa). Se considera que este vapor de agua forma parte dela aire, aunque en realidad constituye una impureza como podría serlo el polvo o las bacterias. Lo correcto sería decir que un espacio contiene una cierta masa de aire y una cierta masa de vapor de agua, es decir, un volumen de un metro cúbico contendría un metro cúbico de aire y un metro cúbico de vapor de agua. El vapor de agua podrá constituir hasta el 4% de la masa total de la mezcla. Aire + vapor Los gases tienden a ocupar el máximo volumen. ( 1 m3) La masa de un gas determinado, presente en un volumen de 1 m3 dependerá de su temperatura y de la presión ejercida sobre el mismo. La presión ejercida en un gas estará constituida por la presión atmosférica y las presiones adicionales generadas por medio mecánicos tales como ventiladores o compresores. Para cálculos se emplea el aire normalizado o estándar (se encuentra a condiciones atmosféricas 1 atm. ó 760 mm Hg) ; 15 ºC y humedad relativa de 60% = 1.2 Kg / m3 . Los vapores pueden ser condensados mediante variación de presión; para los gases requiere primero bajar la temperatura y después cambiar la presión. El volumen de vapor varía en base a las condiciones atmosféricas. Leyes del comportamiento de los gases “ Ley de Boyle” ( PV = cte) Pero en realidad el aire se encuentra con vapor de agua gases reales ( aire + H2O). P LEY DE BOYLE Temp. critica T LIQUIDO T INTERMEDIO VAPOR V Línea saturado liquido Línea saturado seco La temperatura crítica para el vapor de agua es de 374 ºC. “Ley de Charles o Gay – Lussac” ( V / T = cte ) Ley General de los Gases PV / T = cte ; establece que PV = mRT , donde: P = presión del gas (N / m2 ó Pa) V = volumen que ocupa el gas (m3) M = masa del gas (Kg) T = temperatura del gas (ºK) R = constante de proporcionalidad Hipótesis de Avogadro Establece que en condiciones de igual presión y temperatura, el número de moléculas de gas contenido en un volumen dado es el mismo, independientemente del gas que esté ocupando dicho volumen. Asumiendo que la unidad de masa sea 1 Kmol se tendrá: P x Vm = Ro x T donde: Vm = volumen de gas que ocupa 1 Kmol de gas (m3). Ro = constante universal de los gases. A presión y temperatura constante, Vm será el mismo para todos los gases. Experimentalmente se ha determinado que para P = 101325 Pa al nivel del mar y T = 273.15 ºK : Vm = 22.41 m3 / Kmol Esto hace que : Ro = 101325 x 22.41 = 8314.66 Nm / Kmol ºK 273.15 es decir, la constante universal de los gases es: Ro = 8314.66 Nm / Kmol ºK. La constante para 1 Kg de gas cualquiera será: R = Ro / M , donde M es la masa molecular del gas, por lo tanto para el aire seco R aire seco Ra = 287 J / Kg ºK Similarmente para el vapor de agua: Rv = 461 J / Kg ºK “Ley de Dalton” Una mezcla de gases que ocupa un volumen determinado a una temperatura dada, ejerce una presión total igual a la suma de las presiones parciales de cada uno de los gases presentes en la mezcla. En estos casos se cumple que: a) la presión ejercida por cada gas es independiente de la presencia de los otros gases. b) La presión total es igual a la suma de las presiones parciales. Psicrometría Denominada también Higrometría. Se ocupa del estudio de las mezclas de aire y vapor de agua bajo distintas condiciones de temperatura, presión y humedad relativa. Humedad Relativa: Es la relación (expresada en porcentaje) entre la presión de vapor de agua en una mezcla dada y la presión de vapor de agua para esa mezcla en condiciones de saturación, a la misma temperatura. H.R. = Pv aire húmedo x 100 Pv aire saturado Contenido de humedad (w): Es la relación existente entre la masa de vapor de agua y la masa de aire seco en una mezcla de aire dada. Se expresa en gr/kg ó kg/kg. w = mv ma Pv w = 0.622 x (kg/kg) Pat – Pv La expresión de w en (gr/kg) es: w =622 x Pv Pat – Pv Nota: A fin de conocer la cantidad de vapor de agua que contiene el aire, se hace uso del Psicrómetro, aparato que consta de dos termómetros: uno de bulbo seco y el otro de bulbo húmedo, mediante los cuales se puede determinar dos temperaturas del aire, las denominadas bulbo seco y bulbo húmedo. Conocidas las temperaturas del bulbo seco (ts) y del bulbo húmedo (th), se podrá determinar la denominada depresión del bulbo húmedo (ts – th) la que combinada con la temperatura del bulbo seco, permite determinar la humedad relativa del aire. Volumen Específico (V): Es el volumen de aire seco contenido en 1 kg de aire atmosférico (aire seco + vapor de agua). Se expresa en m3 / kg. Entalpía: La primera ley de la termodinámica establece que la energía no se crea ni se destruye, sólo se transforma. En el proceso de transferencia de calor (hacia o desde) un gas, ocurre una transformación de la energía interna del gas. Energía Interna: Es la capacidad que posee un gas para realizar trabajo y que se encuentra almacenada en su estructura molecular. Su valor depende de la presión y temperatura a la que se encuentra el gas. Se puede suministrar calor (energía externa) a un gas, ya sea a presión o a temperatura constante. La contracción o expansión de un gas (variación de volumen) exige la aplicación (o generación) de energía externa, es decir, es necesario efectuar trabajo. El trabajo realizado por ( o sobre) el gas estará definido por: w= ∫ P x dv De donde se deduce que: 1. Si se suministra calor a un gas y se mantiene su volumen constante, se producirá un almacenamiento de energía que servirá para incrementar la energía interna del gas (U) y éste no realizará trabajo alguno sobre el medio que lo rodea. 2. Si el mismo proceso se produjera a presión constante, el gas realizará trabajo externo a medida que su volumen aumenta. La entalpía del gas se define como: H = U + PV Donde P y V pueden ser cuantificados, mientras que resulta imposible asignar un valor numérico a la energía interna U. Por esta razón, cuando se hace referencia a la entalpía de un gas, en realidad se está hablando del cambio de entalpía ( o entalpía relativa) del gas con respecto a un nivel de referencia, el cual si es susceptible de ser cuantificado. En Psicrometría, se define a la entalpía del aire atmosférico como: h = ha + w hg ; en KJ / kg donde: ha = entalpía del aire seco hg = entalpía del vapor de agua w = contenido de humedad (kg / kg) Considerando los 0º C como nivel de referencia, se sabe que entre 0 y 60ºC: ha = 1.007 t – 0.026 hg = 2501 + 1.84 t h = (1.007 t – 0.026) + w (2501 + 1.84 t) Aplicación: Si se tiene dos corrientes de aire de diferentes características que confluyan en un punto determinado, el concepto de entalpía nos permitirá conocer las características del aire resultante. w2, h2, ma2 w1, h1, ma1 w3, h3, ma3 Por el principio de conservación de la masa: w1 - w3 = ma2 w3 - w2 ma1 Por el principio de conservación de la energía: h1 - h3 = ma2 h3 - h2 ma1 CAPACIDAD TERMICA (Cp) Se define la capacidad térmica de una sustancia, como la cantidad de calor que es necesario agregar (o extraer) de ella para incrementar (o reducir) la temperatura en 1 ºC. Q = ma x Cp x t Cp (KJ / kg ºC) P = cte V = cte Aire seco 1.005 0.712 Vapor de agua 1.884 1.382 Agua 4.187 Hielo 2.094 Madera 1.758 Carbón 1.005 Cuarcita 0.837 Vidrio 0.753 Hierro 0.461 Cobre 0.377 Plomo 0.126 Oro 0.126 Los términos entalpía y cantidad de calor, se refieren al mismo cambio de energía entre dos niveles de temperatura. Nota: Calor Latente (KJ / Kg): Es Q requerido para cambiar el estado de una sustancia, sin cambiar su temperatura. P V Calor Sensible (KJ / Kg ºC): Es Q que si cambia la temperatura de la sustancia: Temperatura de Rocío: Es la temperatura de aire saturado que tiene la misma presión de vapor que el aire que se está considerando. PRESION ATMOSFERICA: Representa la presión ejercida por una columna de aire sobre un punto cualquiera de la superficie terrestre. La variación de la presión atmosférica con la altitud está controlada por las variaciones de densidad y temperatura de la columna de aire. PH , H , TH P + dp dh H ,T p h Po , o , To nivel del mar La presión ejercida por una columna de aire de altura h es: P= xgxh Si: T = 0 y = P RT Si T <> 0 y T = To – th Donde t = 0.0065 oK/m Ras = 287 J / Kg ºK ( t en ºK / m). TABLAS PSICROMETRICAS Está basado en cuatro expresiones sencillas. - Para la presión de vapor del aire saturado: Pvs = 0.6105 x e 17.27 t /( t + 237.3) Kpa ; T = ºC Para el aire atmosférico: PV = PVSBH – 0.000644 x P (tBS – tBH) - Contenido de humedad: C.H. = 622 x PV (gr /Kg) P – PV H.R. = PV x 100 PVS - Para la densidad: = P – 0.378 PV 0.287 x (tBS + 273.15) (Kg / m3) Kpa Diagrama bioclimático de Olgyay Los hermanos Olgyay (EEUU) fueron los primeros que representaron en una carta los parámetros de comodidad térmica, basándose en datos de fisiólogos en 1925, que permite establecer una una “zona de comodidad” en relación con la temperatura y humedad relativa del aire. Este método se basa en unas condiciones muy concretas, para una persona con una actividad ligera (paseando), vestida con ropa de entretiempo (1 Clo), sin viento y a la sombra. En la primera figura se muestra en gris la zona de confort, delimitada por la temperatura del aire entre los 21ºC y 27ºC, y la humedad relativa entre 20ª y 75%, con una zona de exclusión para el aire demasiado cálido y húmedo (sudor). Este gráfico además muestra: Las sensaciones fisiológicas de las zonas periféricas. Los límites de la actividad o el riesgo en función de las condiciones de calor y humedad. La tolerancia a bajas temperaturas cuando se aumenta el arropamiento (unidades Clo). En la segunda figura se muestra el desplazamiento de la zona de confort cuando se aplican medidas correctoras del ambiente: Aumento de la radiación incidente o soleamiento (W absorbidos) contra el frío. Aumento de la velocidad del viento (m/s) contra el exceso de calor y humedad. Evaporación adiabática (g agua/Kg aire) contra el exceso de calor y sequedad. Es interesante para el estudio del ambiente exterior o clima, ya que se le puede incorporar los datos de temperatura y humedad del clima de una localidad, en diferentes meses y horas del día. También es un indicativo de las medidas de modificación microclimáticas para corregir situaciones de incomodidad térmica al exterior. Sin embargo, este método ha recibido críticas cuando se ha querido aplicar para evaluar condiciones ambientales interiores, ya que no permite evaluar en detalle el “nivel de comodidad” ni la influencia de parámetros personales como la actividad, el arropamiento o la temperatura radiante media de los cerramientos, tal como se describen en otros métodos mas modernos.