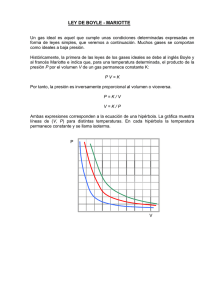
FISICOQUÍMICA Dra. Guadalupe Canosa FISICOQUÍMICA: Definición PROBLEMÁTICAS P/ QUÍMICOS EXPERIENCIAS DE LABORATORIO Métodos matemáticos POSTULAR LEYES FISICOQUÍMICA: Definición La FISICOQUÍMICA es la ciencia en donde la física y la matemática se aplican a la resolución de los problemas fundamentales de la química INGENIEROS Usar estas leyes y conceptos para la resolución de PROBLEMAS INDUSTRIALES Sensibilidad del V a P y T Espacio disponible Superficies de contorno Gases Líquidos Sólidos Alta Casi nula Llenan completamente Llenan parcialmente No llenan No poseen Límite a través de una Al menos una Casi nula LEY DE BOYLE Y MARIOTTE (1660-1670) LEY DE BOYLE Y MARIOTTE A temperatura constante, el volumen de una masa dada de un gas es inversamente proporcional a su presión P x V = cte P1 x V1 = P2 x V2 LEY DE BOYLE Y MARIOTTE (Teoría cinética) LEY DE BOYLE Y MARIOTTE (Teoría cinética) T LEY DE GAY-LUSSAC (1800) LEY DE GAY-LUSSAC A volumen constante, la temperatura absoluta de una masa dada de un gas es directamente proporcional a su presión P = cte x T Por Boyle V = cte x T LEY DE GAY-LUSSAC LEY DE GAY-LUSSAC Otra forma expresa que el volumen de una masa dada de cualquier gas aumenta en la misma cantidad relativa por cada grado centígrado de aumento de la temperatura Vt V0 v *V0 * t v coeficiente de dilatación de los gases t Vt V0 1 v * t V0 1 273 , 15 Si V1 y V2 son los volúmenes de una masa dada de un gas a las temperaturas t1 y t2 t1 V1 V0 1 273 , 15 V1 t 273,15 1 V2 t2 273,15 t2 V2 V0 1 273 , 15 V1 V0 (1 t1 / 273,15) V2 V0 (1 t2 / 273,15) Si definimos una nueva escala de temperaturas Ti ti 273,15 V1 T1 V2 T2 ECUACIÓN DE ESTADO DE LOS GASES IDEALES Combinando los resultados de las leyes de Boyle y Gay-Lussac P1 V1 P2 V1' A temperatura cons tan te P1 V1 V P2 ' 1 V1' V2 T1 T2 V1' A presión cons tan te T1 V2 T2 P1 V1 P2 V2 T1 T2 PV cte T ECUACIÓN DE ESTADO DE LOS GASES IDEALES El valor de la constante de los gases surge de considerar la LEY DE AVOGADRO R = 0,082 l atm/K mol R = 2 cal/K mol R = 8,31 J/K mol LEY DE GRAHAM DE DIFUSIÓN Estudió la difusión de diferentes gases a través de medios porosos: D1 D2 2 1 Como PM D1 D2 PM 2 PM1 Además D 1 / t t2 t1 2 1 PM 2 PM1 LEY DE DALTON La presión total de una mezcla de gases es igual a la suma de las presiones parciales de los gases que componen la mezcla: P p1 p2 ... pn Otra forma puede obtenerse si suponemos que cada gas en la mezcla se comporta como GI: piV ni RT pV n RT PV (n1 n2 ... nn ) RT nRT pi n i x P n i PV i nRT pi xi P CÁLCULO DE CV (T. CINÉTICA) Supongamos que tenemos un GI a volumen constante, sus moléculas pueden: TRASLADARSE ROTAR VIBRAR CÁLCULO DE CV (COMPONENTE DE TRASLACIÓN) Según el principio de equipartición cada forma de energía manifestada por una molécula contribuye con ½ R la capacidad calorífica de un gas. Así, la capacidad calorífica de cualquier molécula sería 3/2 R, por las tres componentes de traslación: Por definición de CV: 3 3 3 Cv traslación R(T 1) RT R 2 2 2 CÁLCULO DE CV (COMPONENTE DE ROTACIÓN) Esta se debe a la rotación de la molécula entera alrededor de los tres ejes coordenados. Debido, también, al principio de equipartición, la rotación podría contribuir con un máximo de 3/2 R a la capacidad calorífica del gas: Cv rotación 0 * Cv rotación 2 * 1 R0 2 1 RR 2 1 3 Cv rotación 3 * R R 2 2 MOLÉCULAS MONOATÓMICAS MOLÉCULAS DIATÓMICAS O POLIATÓMICAS LINEALES MOLÉCULAS POLIATÓMICAS NO LINEALES CÁLCULO DE CV (COMPONENTE DE VIBRACIÓN) La vibración aporta como máximo 2 x 1/2R a la capacidad calorífica a volumen constante de un gas por cada modo de vibración; esta se calcula usando la siguiente expresión: Cv vibración 3n x R n=número de átomos que forman la molécula x=número de movimientos de rotación más traslación CÁLCULO DE CV Cv máximo Cv traslación Cv rotación Cv vibración 3 3 Cv máximo R R (3n x) R 2 2 CÁLCULO DE CP Al aumentar la temperatura pero en este caso permitiendo que el gas se dilate, el sistema debe hacer un trabajo extra al que realiza para aumentar la Ecin para “vencer” la presión externa: P h A CÁLCULO DE CP P h 1 2 A En el estado 1 el gas ejerce sobre el émbolo una presión P=F/A. Para pasar al estado 2 debe realizar un trabajo Wexp=F.d=P.(A.h)=P.ΔV CÁLCULO DE CP Wexp=P.ΔV Para un mol de GI: P.V=R.T Si elevamos su temperatura 1K(a P cte): P(V+ΔV)=R(T+1) Restando estas: P(V+ΔV)-P.V=R(T+1)-R.T P.V+P.ΔV-P.V=R.T+R-R.T P.ΔV=R Wexp=R Cp Cv W exp Cv R 3 3 C p máximo R R (3n x) R R 2 2 GASES REALES Un gas real se comporta como ideal a: PRESIÓN TEMPERATURA GASES REALES Las leyes de los gases ideales pueden deducirse de la teoría cinética de los gases y esta postula: No hay fuerzas El volumen de las moléculas es despreciable Los choques son perfectamente elásticos GASES REALES Volumen de las moléculas del sólido? Cómo pueden liguarse los gases? ECUACIÓN DE VAN DER WAALS (GASES REALES) Para la primera corrección considera que hay fuerzas de atracción entre las moléculas y teniendo en cuenta lo que le ocurre a una molécula cercana a la pared del recipiente y a otra en el interior (y de datos experimentales con gases reales): Pideal Preal a 2 V ECUACIÓN DE VAN DER WAALS (GASES REALES) Además como las moléculas tienen volumen, el espacio que disponen para moverse es menor que el real del recipiente: Videal Vreal b Donde b es denominado covolumen ECUACIÓN DE VAN DER WAALS (GASES REALES) a P 2 V * V b R * T a n2 P * V n b n R * T 2 V