Trabajo en extenso - Facultad de Ingeniería
Anuncio

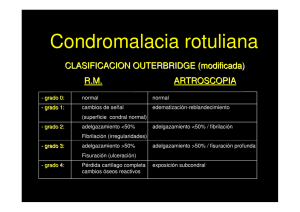
1 Propuesta de un nuevo diseño de biorreactor para crecimiento de tejido cartilaginoso Andrea C. Cura, Diego M. Campana y José Di Paolo Grupo Biomecánica Computacional, Facultad de Ingeniería, Universidad Nacional de Entre Ríos [email protected] Resumen— Una solución prometedora y a largo plazo para el problema de la degradación del cartílago articular, es la implantación de cartílago fabricado mediante ingeniería de tejido que pueda reparar el defecto completamente. Para esto se usan biorreactores que mantienen un ambiente biológicamente activo para la proliferación celular, pudiendo programarse para modular y preservar el crecimiento del cartílago, especialmente cuando se aplican estímulos mecánicos como esfuerzos de corte, perfusión y compresión. Debido a la importancia de los biorreactores en la ingeniería de tejidos, el objetivo del presente estudio es la propuesta de un nuevo diseño de biorreactor que estimule la proliferación de tejido cartilaginoso. Para ello, se investigó sobre los modelos de biorreactores existentes y se seleccionaron ciertas características de aquellos con mejores resultados experimentales. Se estudiaron las variables físicas y químicas que influyen en la proliferación celular. El diseño del biorreactor propuesto se basa en un cilindro fijo con orificios donde se fijan los constructos, rodeado de un cilindro exterior concéntrico giratorio para inducir un flujo viscoso que accione sobre los scaffolds (material de soporte para el conjunto celular) con tensiones cortantes controladas. El fluido está presurizado respecto al ambiente interior al cilindro fijo, para promover su pasaje por perfusión a través de los scaffolds. Además, se propone la forma de aumentar la superficie de intercambio de oxígeno para poder incrementar la cantidad de células en el cultivo, dado que el oxígeno generalmente es el nutriente limitante del cultivo en un biorreactor. El diseño propuesto permitiría la colocación de scaffolds sobre la superficie del cilindro fijo sin restricción alguna, aumentando la densidad de células por ml de medio de cultivo. Además, proporcionaría esfuerzos cortantes tanto en la superficie como en el interior del scaffold, estimulando la proliferación celular y aumentando así el suministro de nutrientes y la remoción de desechos. Palabras clave— biorreactores, cartílago, esfuerzo de corte y perfusión. I. INTRODUCCIÓN L os cartílagos articulares se encuentran recubriendo las extremidades de los huesos en contacto en las articulaciones que soportan peso. Su misión es reducir la fricción, soportando y distribuyendo cargas de modo de aliviar cualquier presión que pueda dañar a los huesos. El líquido sinovial que llena las cavidades entre los cartílagos lubrica la articulación, reduciendo la fricción y el desgaste [1], [2]. El tejido cartilaginoso está compuesto por condrocitos rodeados por una matriz extracelular formada mayoritariamente por proteoglicanos y colágeno tipo II. Organizado en una estructura tridimensional compleja, el cartílago está altamente adaptado a su ambiente mecánico donde los proteoglicanos y las fibras colágenas interactúan para proveer resistencia a las fuerzas de compresión y de corte. Debido a su estructura sin vascularización, el cartílago depende de los esfuerzos mecánicos, de los esfuerzos inducidos por el fluido, de la perfusión del fluido a través del cartílago y de la compresión durante el movimiento de la articulación para el mantenimiento de la función y estructura del tejido. La escasez de vasos sanguíneos (que proveen oxígeno y nutrientes), contribuye a la limitada capacidad del cartílago articular de regenerarse in vivo [3]. El cartílago sano es el resultado de un balance entre los procesos de síntesis y degradación. Los daños y enfermedades que sufre el cartílago comienzan cuando la vía catabólica sobrepasa la síntesis. Las enfermedades más comúnmente conocidas son artritis, osteoartritis, artritis reumatoide y artritis traumática. Los daños traumáticos como las fracturas también pueden provocar degradación del cartílago. Esto lleva a una necrosis en la región de la herida, y la incapacidad del cartílago de repararse convenientemente puede resultar en una funcionalidad disminuida y eventualmente evolucionar a osteoartritis. En el año 2005 aproximadamente 46,4 millones de norteamericanos fueron diagnosticados con algún desorden articular, el más común de los cuales fue osteoartritis (National Center for Health Statistics 2007). Ésta enfermedad se caracteriza por una lenta degradación del cartílago articular en las articulaciones que soportan peso, como por ejemplo la cadera y la rodilla. Los procesos naturales de reparación son limitados por la naturaleza sin vascularización del cartílago, lo que resulta en la formación de fibrocartílago que posee funciones mecánicas más pobres y carece de estabilidad a largo plazo [3]. Las opciones actuales de tratamientos incluyen drogas antiinflamatorias, terapia de reemplazo hormonal, regeneración de células mesenquimales, rellenos autólogos, y reemplazo total de cadera o rodilla, cada uno con sus ventajas y limitaciones [4]. Una solución prometedora y a largo plazo para la degradación del cartílago articular, es la implantación de cartílago fabricado mediante ingeniería de tejido que pueda reparar el defecto completamente. El desafío es encontrar la apropiada fuente de células, material de soporte para el conjunto celular (scaffold), medio de cultivo, y condiciones de almacenamiento para producir y mantener al cartílago vivo y en condiciones de utilización. En ingeniería de tejidos se utilizan células diferenciadas como los condrocitos (para cartílago) o células madres multipotentes. Los scaffolds poliméricos biodegradables y biocompatibles definen la geometría del tejido y proveen el soporte inicial para el establecimiento y crecimiento celular [5]. El 2 conjunto de scaffolds, condrocitos o células madres, medios y condiciones de cultivo, conforman lo que se denomina un biorreactor. Un biorreactor es un recipiente o sistema que mantiene un ambiente biológicamente activo para la proliferación celular, es decir, el medioambiente apropiado para crear tejidos en 3 dimensiones utilizando scaffolds adecuados. El medioambiente del biorreactor puede programarse para modular y preservar el crecimiento del cartílago, especialmente cuando se aplican estímulos mecánicos como esfuerzos de corte, perfusión y compresión. Debido a la importancia de los biorreactores en la ingeniería de tejidos, el objetivo del presente estudio es la propuesta de un nuevo diseño de biorreactor que estimule la proliferación de tejido cartilaginoso. II. MATERIALES, DISEÑO Y CARACTERIZACIÓN DE LOS BIORREACTORES EXISTENTES Para lograr el nuevo diseño de biorreactor se realizó un análisis de biorreactores existentes y se seleccionaron ciertas características de aquellos dispositivos con mejores resultados experimentales. Además se estudiaron las variables físicas y químicas que influyen en la proliferación celular. La premisa de que los estímulos mecánicos y químicos que modulan el comportamiento del condrocito in vivo, también influyen en su comportamiento in vitro [6], [7] ha llevado a numerosos estudios demostrando que los scaffolds cultivados con células están influenciados por su medio circundante, estimulando la condrogénesis y síntesis de matriz [6]. Así, en los biorreactores, se efectúan cambios en el medio de cultivo para afectar la cinética y propiedades del crecimiento tisular en un régimen de flujo bien definido, para dar con los caminos adecuados para la mecanotransducción y la óptima relación entre las causas mecánicas y la cinética del crecimiento celular. Schultz et al. [7] reporta que con algunas pocas excepciones, los biorreactores que se usan para cultivar cartílago, tratan de mimetizar la carga mecánica experimentada por el cartílago in vivo que resulta del movimiento y las tensiones en las articulaciones. También hay otros sistemas en los que se aplican otras formas de estimulación a los cultivos incluyendo: campos eléctricos, ultrasonido, o fuerzas centrífugas. crecimiento de cartílago, en general producían flujos turbulentos o no uniformes que volvían errático el crecimiento del tejido. En el 2007, Bilgen y Barabino [10], concluyeron que el esfuerzo de corte producido por el flujo experimentado por los constructos de tejido dentro de un biorreactor de pared ondulada eran significativamente menores que los observados dentro de un tanque de agitación (ver Fig. 2). Williams et al. [9] hicieron uso de modelos de DFC (Dinámica de Fluidos Computacional) para calcular los campos de flujo, los esfuerzos de corte y perfiles de oxígeno alrededor de constructos no porosos que simulaban el cartílago en desarrollo en un biorreactor concéntrico cilíndrico. Ellos hallaron que su biorreactor proveía un medioambiente hidrodinámico relativamente homogéneo, con un transporte de oxígeno hacia el constructo uniforme. Posteriormente, Farooque [11], desarrolló un trabajo experimental basado en dos modelos de biorreactores con cilíndricos concéntricos. Uno de los modelos (CC, concentric cylinder) solo provee un flujo que genera tensiones de corte sobre la superficie de los constructos. En estudios previos y utilizando un biorreactor similar a este, se observó que la carga hidrodinámica, la baja tensión de oxígeno y los factores de crecimiento contribuyen a la condrogénesis [6], [12]. El otro modelo (ver Fig. 3), además de los esfuerzos de corte sobre la superficie, proporciona un flujo de perfusión a través del volumen de los scaffolds (modelo PCC, perfusión concentric cylinder). Los resultados experimentales mostraron que, ambos modelos favorecen el crecimiento de tejido de cartílago, con la diferencia de que en el PCC hay un crecimiento de células que casi duplica la tasa de crecimiento del modelo CC, y el contenido de glicosamino-glicanos y colágeno en el constructo es significativamente menor en el modelo PCC. En el estudio de Farooque, mediante la utilización de DFC, se realizó un modelo 2D del flujo en la zona anular (entre los cilindros) del biorreactor PCC, incluyendo los scaffolds. Mediante este modelo se encontró que los perfiles de velocidades sobre la superficie del constructo no eran homogéneos y se observó recirculación de flujo en los bordes del mismo. a) Fig. 1: Las imágenes en la segunda columna magnifican el perfil del fluido. A) Tanque de agitación; B) De pared rotatoria. Tomado de [11]. Entre los primeros modelos de biorreactores (ver Fig. 1) se encuentran los de tanque de agitación [8]; y los de pared rotatoria. A pesar que estos biorreactores indujeron el b) c) Fig. 2: Esfuerzo de corte para: a) Tanque de agitación (SF, Spinner Flask), b) y c) Biorreactor de pared ondulada (WWB, Wavy-Walled Bioreactor) con los scaffolds en ubicación central y lobular respectivamente. Tomado de [10]. 3 Fig. 5: Vista frontal del biorreactor propuesto Fig. 3: Biorreactor PCC presentado por Farooque. Tomado de [11]. Cinbiz et al. [13] simularon un biorreactor de perfusión de paredes rotatorias RWPV (rotating wall perfusion vessel), el cual consiste en dos cilindros concéntricos. El medio de cultivo y los constructos se encuentran entre los cilindros, los cuales rotan a la misma velocidad angular para lograr condiciones microgravitatorias y la rotación de cuerpo rígido de los constructos de tejido y el medio de cultivo, sincrónicamente con el recipiente. Las fuerzas que actúan en los constructos están balanceadas, y éstos se mantienen en una posición relativamente estable dentro del recipiente durante el periodo de cultivo (ver Fig. 4). Los patrones de flujo laminar dinámico en el RPWV proveen grandes tasas de transferencia de masa con bajos valores de esfuerzos de corte. Por lo tanto, el medioambiente hidrodinámico de los biorreactores giratorios mantiene la formación de constructos de cartílago de gran tamaño, superiores bioquímica y mecánicamente al compararlos con otros sistemas de cultivo [13]. Fig. 4: Esquema de la posición de los scaffolds dentro del biorreactor de perfusión de paredes rotatorias. Tomado de [13]. III. RESULTADOS Basados en los estudios mencionados en la sección anterior, y principalmente en el diseño presentado por Farooque [11], se propone una posible configuración de un nuevo diseño de biorreactor (ver Fig. 5). Éste está constituido por un cilindro fijo con orificios donde se fijan los constructos, rodeado de un cilindro exterior concéntrico giratorio que impulsa el flujo del fluido de cultivo en el espacio anular entre ambos cilindros. El fluido esta presurizado respecto al ambiente interior al cilindro fijo para promover la perfusión a través de los constructos. Además, cuenta en su extremo inferior con una región de configuración cono-plato para minimizar los efectos en la extremidad. El ángulo del cono se elige de forma de asegurar que durante la rotación constante de la pared externa, el esfuerzo de corte promedio en esta región sea igual al presente en la región concéntrica cilíndrica en la superficie del constructo. Por otra parte, una bomba extrae el fluido del cilindro interior y lo vuelca hacia el espacio anular. Además, el diseño propuesto cuenta con un tanque de burbujeo por el que circularía el medio de cultivo, para aumentar de esta manera la transferencia de oxígeno al medio, asegurando la satisfacción de los requerimientos metabólicos celulares. IV. DISCUSIÓN Para optimizar la producción de cartílago para implantación e identificar los factores que estimulan el crecimiento del constructo, es necesario desarrollar protocolos que expongan a los constructos a condiciones uniformes en tiempo y espacio. Por ello, para el presente estudio se eligió un biorreactor concéntrico cilíndrico que opera en un régimen de bajo esfuerzo de corte para minimizar el daño celular, posee un gran área de crecimiento para aumentar la producción de constructos por unidad de volumen, y es de geometría sencilla permitiendo el cálculo del transporte de nutrientes y de la carga hidrodinámica en los constructos. Este diseño provee un medioambiente cuantificable, uniforme e hidrodinámico, que promueve la adhesión celular y crecimiento de matriz bajo condiciones bien definidas y controlables [6]. La rotación del cilindro exterior (en contraposición a la rotación del cilindro interior) asegura el mantenimiento de un flujo estable aún a velocidades de rotación mayores a las necesarias para inducir el esfuerzo de corte en el cultivo celular [14]. La relación entre el radio del cilindro interno (Ri) y externo (Re) cercana a la unidad (Ri/Re= 0.91), asegura un flujo estable y un esfuerzo de corte constante a través del espacio anular. Además, se incluye la perfusión del fluido a través del constructo ya que mediante la perfusión se proporciona un adecuado suministro de nutrientes, remoción de desechos y un intercambio gaseoso suficiente, promoviendo así el crecimiento y la proliferación celular en el scaffold [15]. 4 Al comparar el nuevo diseño de biorreactor con el PCC reportado en la literatura, se observa que el PCC, dada su configuración, presenta una cavidad abierta próxima a los constructos que indica una limitación debido a que produce un flujo multidireccional y esfuerzos de corte heterogéneos en la superficie de los constructos. Esto, no ocurriría en el nuevo diseño propuesto ya que la perfusión se realiza a través de un gradiente de presión, y no utilizando tubos por los cuales perfunda el fluido. Además, dado el diseño propuesto, se visualiza una disminución del espacio muerto en relación al PCC, aumentando así la densidad del cultivo. El oxígeno es escasamente soluble en medios acuosos, y una de las preocupaciones relativa a los cultivos de tejido de alta densidad es la depleción del oxígeno y la formación de regiones metabólicamente inactivas o necróticas dentro del constructo. El oxígeno es el nutriente limitante en un cultivo celular ya que la concentración de otros nutrientes y factores de crecimiento puede aumentarse mediante un más frecuente cambio del medio de cultivo para lograr abastecer la mayor demanda metabólica que ocurre por la adición de constructos en un biorreactor [16]. Por ello, el diseño propuesto posee un tanque de burbujeo para aumentar la transferencia de oxígeno, y disponer de la cantidad adecuada del gas en el cultivo celular, posibilitando la colocación de scaffolds sobre la superficie del cilindro fijo sin restricción alguna en relación a la disponibilidad de oxígeno. [5] [6] [7] [8] [9] [10] [11] [12] [13] [14] V. CONCLUSIONES La carga hidrodinámica de los tejidos en los biorreactores es importante para regular el crecimiento y la maduración de los tejidos. Un diseño como el propuesto, permitiría la colocación de scaffolds sobre la superficie del cilindro fijo sin restricción alguna, disminuiría el espacio muerto, reduciendo la cantidad de medio de cultivo utilizado, y aumentando así la densidad de células por ml de medio de cultivo. VI. TRABAJOS FUTUROS Sería de invalorable utilidad el uso de DFC para la caracterización del flujo permitiendo predecir y posiblemente optimizar el diseño propuesto. A través del uso de paquetes de software para la simulación de la operación del nuevo biorreactor, se obtendrán los resultados en el contexto de la geometría y dimensiones del dispositivo a analizar, que optimicen el flujo de cultivo, y el impacto de éste sobre el crecimiento celular. REFERENCIAS [1] [2] [3] [4] J. Di Paolo y M.E. Berli. “Numerical Analysis of the Effects of Material Parameters on the Lubrication Mechanism for Knee Prosthesis”. Computer Methods in Biomechanics and Biomedical Engineering, Taylor and Francis. vol 2, pp. 79 – 89, 2006. M. Berli, D. Campana , S. Ubal y J. Di Paolo. “Lubrication model of a knee prosthesis, with non newtonian fluid and porous rough material”. Latin American App. Res. vol 39, pp. 105-11, 2009. D. Eyre. "Collagen of Articular Cartilage." Arthritis Research. vol 4(1), pp. 30-5, 2002. S. Kurtz. “Total knee and hip replacement surgery projections show meteoric rise by 2030. Orthopaedic procedures set to continue gaining widespread acceptance as means to restore quality of life.” 2006. http://www.prnewswire.com/news-releases/total-knee-andhip-replacement-surgery-projections-show-meteoric-rise-by-203055519727.html [15] [16] B.P. Chan y K.W. Leong. "Scaffolding in tissue engineering: general approaches and tissue-specific considerations." Eur Spine J. vol 17(Suppl 4), pp. 467-79, 2008 S. Saini y T.M. Wick. "Concentric Cylinder Biorreactor for Production of Tissue Engineered Cartilage: Effect of Seeding Density and Hydrodynamic Loading on Construct Development". Biotechnology Progress. vol 19, pp. 510-21, 2003. R.M. Schulz y A. Bader. "Cartilage tissue engineering and biorreactor systems for the cultivation and stimulation of chondrocytes." Eur Biophys J. vol 36(4-5), pp. 539-68, 2007. L.E. Freed, G. Vunjak-Novakovic, et al. "Kinetics of Chondrocyte Growth in Cell-Polymer Implants." Biotechnol. Bioeng. vol 43, pp. 597-604, 1993. K.A. Williams, S. Saini, y T.M. Wick. “Computational Fluid Dynamics Modeling of Steady-State Momentum and Mass Transport in a Biorreactor for Cartilage Tissue Engineering”. Biotechnol. Prog. 2002, vol 18, pp. 951−963, 2008. B. Bilgen, G.A. Barabino. “Location of Scaffolds in Biorreactors Modulates the Hydrodynamic Environment Experienced by Engineered Tissues”. Biotechnol. Bioeng. vol 98, pp. 282–294, 2007. T. Farooque. “Biochemical and Mechanical Stimuli for Improved Material Properties and Preservation of Tissue-Engineered Cartilage. School of Chemical and Biomolecular Engineering”. Atlanta, GA, Georgia Institute of Technology. PhD, 2008. P. Rangamani. “Bioprocessing Conditions for Improving Material Properties of Tissue Engineered Cartilage.” Chemical and Biomolecular Engineering. Atlanta, Georgia Institute of Technology, 2005. M.N. Cinbiz, R. SedaTıglı, I. Gercek Beskardesb, M. Gümüsderelioglu, Ü. Colak. “Computational fluid dynamics modeling of momentum transport in rotating wall perfused biorreactor for cartilage tissue engineering”. J Biotechnol. vol 150(3), pp. 389-95, 2010. G.I. Taylor. “Stability of a Viscous Liquid Contained Between Two Rotating Cylinders”. Philos. Trans., vol A223, pp. 289-343, 1923 X. Yan, X.B. Chen, D.J. Bergstrom. “Modeling of the Flow within Scaffolds in Perfusion Biorreactors”. American Journal of Biomedical Engineering; vol 1(2), pp. 72-77, 2011 T.M. Wick y T. Farooque. “Biorreactor development for cartilage tissue engineering: Computational modelling and experimental results”. Seventh International Conference on CFD in the Minerals and Process Industries, 2009.