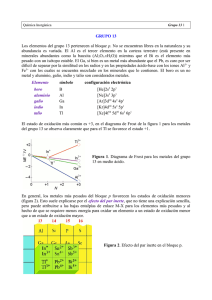
Potenciales de reducción estándar en el grupo del boro Diagrama
Anuncio

Los Elementos Representativos
(Segunda parte)
Potenciales de reducción estándar
en el grupo del boro
E° (M3+/M) / V
E° (M+/M) / V
B
-0,87
Al
-1,66
Ga
-0,56
-0,79
In
-0,34
-0,15
Tl
0,72
-0,33
1
Diagrama de Frost en solución
acuosa ácida
Número de oxidación, N
2
Potenciales de reducción estándar
en el grupo 17: los halógenos
como oxidantes
E° (½ X2/X-) / V
F2
2,87
Cl2
1,36
Br2
1,04
I2
0,54
At2
0,2
3
Química Inorgánica - 2007
1
Los Elementos Representativos
(Segunda parte)
Ciclo termodinámico
ΔionH° (H)
+ AE (Cl)
X(g) + H(g)
X–(g) + H+(g)
ΔatH° (X)
+ ½ EE (H-H)
ΔhidH° (X–)
+ ΔhidH° (H+)
½ X2(ee) + ½ H2(g)
ΔredH°
X–(ac) + H+(ac)
4
Tabla de valores
F
Cl
Br
I
ΔatH° (X)
80
122
96
76
AE (Cl)
-328
-349
-325
-295
ΔhidH° (X–)
-513
-370
-339
-274
Σ (H)
410
410
410
410
ΔredH°
-351
-187
-158
-83
5
Algunas reacciones de los
elementos con el hidrógeno
Na + ½ H2
Δ
NaH
Todos los alcalinos, calcio, estroncio y bario,
reaccionan directamente con el hidrógeno
para dar hidruros iónicos
Li + Al + 2 H2
250 atm, 120-150 °C
éter
LiAlH4
6
Química Inorgánica - 2007
2
Los Elementos Representativos
(Segunda parte)
Algunas reacciones de los
elementos con el hidrógeno (II)
N2 + 3 H2
Δ, P
Fe
O2 + 2 H2
Cl2 + H2
2 NH3
2 H2 O
luz
2 HCl
7
Clasificación de hidruros
H
He
Li Be
B
C
N
O
F Ne
Na Mg
Al Si
P
S
Cl Ar
K Ca
Ga Ge As Se Br Kr
Rb Sr
In Sn Sb Te
Cs Ba
Tl Pb Bi Po At Rn
I
Xe
Fr Ra
8
Propiedades de los hidruros
iónicos
Presentan estructuras tridimensionales infinitas
El LiH fundido conuce la electricidad y se libera H2 en el
ánodo. También se desprende hidrógeno en el ánodo
por electrólisis de sus soluciones en haluros alcalinos
fundidos
Reaccionan fácilmente con el agua y con agentes
oxidantes
NaOH + H2
NaH + H2O
Xδ-—Hδ+ + H-
Química Inorgánica - 2007
X- + H2
9
3
Los Elementos Representativos
(Segunda parte)
Hidruros con enlaces
multicéntricos
H
z
Be
BeH2: cadena 1D
z
AlH3: red 3D
Be
H
H
B2H6: molécula dinuclear
Be
H
H
z
H
H
H
H
B
H
B
H
H
Todos son muy reactivos con el agua
z
B2H6 + 6 H2O
2 H3BO3 + 3 H2
10
Algunos hidruros no tan sencillos
Hidruros de los elementos del grupo 14
z
z
z
z
z
Hidrocarburos: CnH2n+2, CnH2n, CnH2n-2, ...
Silanos
Germanos
Estannanos
Plumbanos
Boranos
z
z
BnHn+4
BnHn+6
11
Algunas reacciones de los
elementos con el agua
Todos los metales alcalinos, más Ca, Sr y Ba
reaccionan con el agua liberando hidrógeno
z
z
K + H2O
Ca + 2 H2O
KOH + ½ H2
Ca(OH)2 + H2
El Mg sólo reacciona con agua caliente
z
z
Mg + 2 H2O
Mg +H2O
Mg(OH)2 + H2
MgO + H2
El Be no reacciona
12
Química Inorgánica - 2007
4
Los Elementos Representativos
(Segunda parte)
Algunas reacciones de los
elementos con el agua (II)
El Al no reacciona con agua pura (pasivación)
z
Al + 3H2SO4
z
2 Al + 2 NaOH + H2O
Al2(SO4)3 + 3 H2
2 Na[Al(OH)4] + 3 H2
13
Reacciones con el agua: los
halógenos como oxidantes
F2(g) + e- → F- (ac)
Cl2(g) + e- → Cl- (ac)
z ½ Br2(l) + e- → Br- (ac)
z ½ I2(s) + e- → I- (ac)
z½
z½
z ½O2(g)
E ° = 2,85 V
E ° = 1,36 V
E ° = 1,06 V
E ° = 0,53 V
+ 2H+(ac) + 2e- → H2O(ac)
E ° = 1,23 V
(en medio neutro: E °’ = 0,82 V)
X2(elem) + H2O(ac) → X-(ac) + 2H+(ac) + ½O2(g)
14
Reacciones con el agua:
desproporcionación
+ H+ (ac) + e- → H2O (ac) + ½ Cl2(g)
E ° = 1,63 V
z HBrO(ac) + H+ (ac) + e- → H2O (ac) + ½ Br2(l)
E ° = 1,59 V
z HIO (ac) + H+ (ac) + e- → H2O(ac) + ½ I2(s)
E ° = 1,45 V
z HClO(ac)
X2(elem) + H2O(ac) → X-(ac) + H+(ac) + HXO(ac)
X2(elem) + 2 OH-(ac) → X-(ac) + XO-(ac) + H2O(l)
15
Química Inorgánica - 2007
5
Los Elementos Representativos
(Segunda parte)
Compuestos oxigenados de los
metales alcalinos y su reacción
con el agua
4 Li + O2
2 Na + O2
K + O2
2 Li2O
Na2O2
KO2
M2O + H2O
M2O2 + 2 H2O
2 MO2 + 2 H2O
2 MOH
2 MOH + H2O2
2 MOH + H2O2 + O2
16
Todos los óxidos, peróxidos y superóxidos son
bases fuertes
O2- + H2O
OH- + OH2-
O
H
O
H
La basicidad de los óxidos aumenta de Li2O a
Cs2O
17
Los peróxidos se descomponen a óxidos al
calentarlos
Li2O2(s)
Li2O(s) + ½ O2(g)
Los carbonatos se descomponen a óxidos al
calentarlos
Li2CO3(s)
Li2O(s) + CO2(g)
18
Química Inorgánica - 2007
6
Los Elementos Representativos
(Segunda parte)
Para los metales alcalino-térreos
2 M + O2
2 MO
CaO(s) + H2O(l)
Ca(OH)2(s)
Ca(OH)2(s) + CO2(g)
CaCO3(s)
> 900 °C
CaCO3(s) + H2O(l)
CaO(s) + CO2(g)
19
Óxido e hidróxido de berilio:
propiedades ácido-base
Be(OH)2 + 2 OH-
[Be(OH)4]2-
OH
HO
2-
Be OH
OH
Be(OH)2 + H2SO4
BeSO4 + H2O
20
Compuestos oxigenados de los
elementos del grupo 13
En condiciones normales, el B y el Al no reaccionan con
el oxígeno del aire
El carácter básico de los óxidos crece al bajar en el
grupo:
z B2O3 es ácido
z Al2O3 y Ga2O3 son anfóteros
z In2O3 y Tl2O3 son básicos
Tl2O + H2O
2 TlOH
21
Química Inorgánica - 2007
7
Los Elementos Representativos
(Segunda parte)
Boratos
OH
HO
B2O3 + 3 H2O
B
OH
2 B(OH)3
Algunos ejemplos:
HO
O
HO
B
O
O
B
O
HO
B
[B3O3(OH)6]
O
B-
B
O
O
O
O
B
B
OH
B
OH
OH
OH
[B5O6(OH)4]-
Unidades estructurales: [BO3] y [BO4]
22
Compuestos oxigenados de los
elementos del grupo 14
Carácter ácido-base de los óxidos:
z
z
z
z
z
z
z
CO2 + H2O
CO2 + OH-
O
H2CO3
[HCO3]-
C
O
H
CO + OHno hay reacción
SiO2 + OHmuy lenta
GeO, GeO2, SnO y SnO2 son anfóteros
PbO es anfótero
PbO2 es ácido
O
H
23
Óxidos y oxoaniones
CO2 : moléculas aisladas
SiO2, GeO2, SnO2 y PbO2 : redes 3D
z [CO3]2-
O
C
O
z silicatos:
tetraedros unidos por los vértices
4-
O
O
O
Si
O
24
Química Inorgánica - 2007
8
Los Elementos Representativos
(Segunda parte)
Oxidos de nitrógeno
N
N
O
O
O
N
N
O
N
N
O
O
O
O
O
O
N
O
O
O
N
N
O
O
[NO2][NO3]
N
O
25
Oxidos de fósforo
26
Algunos oxoaniones de
nitrógeno y fósforo
N
nitrito
O
fosfato
O
H
-
H
H
P
fosfito
O
P
O
2-
P
O
O
O
O
dipolifosfato
O
P
4-
O
O
O
O
hipofosfito
3-
O
O
O
P
O
O
27
Química Inorgánica - 2007
9
Los Elementos Representativos
(Segunda parte)
Comportamiento redox en
solución acuosa
28
Oxidos de azufre
29
Algunos oxoaniones de azufre
y selenio
O
S
2-
O
2O
O
O
S
O
O
O
O
sulfato
sulfito
2-
Se O
O
selenato
2-
S
O
S
peroxodisulfato
O
O
tiosulfato
O
S
2-
O
O
O
O
O
S
O
O
30
Química Inorgánica - 2007
10
Los Elementos Representativos
(Segunda parte)
Propiedades redox
31
Oxidos de los halógenos
2 F2 + 2 OH-
OF2 + 2 F- + H2O
2 Cl2 + 2 HgO
HgCl2·HgO + Cl2O
2 ClO3- + SO2
2 ClO2 + SO42-
2 ClO2 + 2 O3
Cl2O6 + 2 O2
2 HClO4
Cl2O7
32
Oxoácidos y oxoaniones
F2 + H2O
3 OX-
HOF + HF (T = - 40°C)
2 X- + XO3- (v aumenta al aumentar T)
2 ClO2 + 2 OH4 ClO3-
ClO2- + ClO3- + H2O
3 ClO4- + Cl- (muy lenta)
IO3- + 6 OH- + Cl2
IO65- + 3 H2O + 2 Cl33
Química Inorgánica - 2007
11
Los Elementos Representativos
(Segunda parte)
34
Propiedades redox en solución
acuosa
35
Metales, semimetales, no
metales (III)
H
He
Li Be
B
C
N
O
F Ne
Na Mg
Al Si
P
S
Cl Ar
K Ca
Ga Ge As Se Br Kr
Rb Sr
In Sn Sb Te
Cs Ba
Tl Pb Bi Po At Rn
I
Xe
Fr Ra
36
Química Inorgánica - 2007
12
Los Elementos Representativos
(Segunda parte)
Reacciones de los elementos con
los halógenos
Todos los metales de los grupos 1, 2 y 13
reaccionan en forma directa con los
halógenos
z
2 M + n X2
Δ
2 MXn
Boro
z
2 B + 3 F2
2 BF3
37
Haluros binarios
H
He
Li Be
B
C
N
O
F Ne
Na Mg
Al Si
P
S
Cl Ar
K Ca
Ga Ge As Se Br Kr
Rb Sr
In Sn Sb Te
Cs Ba
Tl Pb Bi Po At Rn
I
Xe
Fr Ra
38
Haluros intermedios
39
Química Inorgánica - 2007
13
Los Elementos Representativos
(Segunda parte)
Características de los haluros
covalentes
Fórmula general: AXn
Diferencia de electronegatividades entre A y X,
generalmente entre 0 y 1
En general, tienen como base estructural
moléculas discretas, con enlaces covalentes,
de geometría predecible por RPENV
40
Reacciones de los elementos con
los halógenos (II)
2 P + n X2
2 PXn
n = 3: todos los halógenos
n = 5: sólo F, Cl y Br
S + n X2
SX2n
n = 2: sólo Cl y F
n = 3: sólo F
41
Más haluros covalentes
14
CX4
SiX4
GeX2
GeX4
SnX2
SnX4
15
NF3
NCl3
PX3
PF5, PCl5
PBr5
AsX3
AsF5
SbX3
SbF5, SbCl5
OF2
SF2, SCl2
SF4, SCl4
SF6
SeCl2
SeBr2
SeCl4
SeBr4, SeF6
TeCl2
TeBr2
TeX4
TeF6
16
42
Química Inorgánica - 2007
14
Los Elementos Representativos
(Segunda parte)
Interhalógenos
XY
ClF
BrF
*
IF *
XY3
XY5
ClF3
ClF5
BrF3
BrF5
(IF3)n
IF5
XY7
IF7
BrCl *
ICl
I2Cl6
IBr
43
Reacción de los hidruros
covalentes con el agua
BCl3 + 3H2O
SiCl4 + 2H2O
PCl5 + 4H2O
BrCl + H2O
SF6 + 3H2O
PF3 + 3H2O
NCl3 + 3H2O
H3BO3 + 3HCl
SiO2 + 4HCl
H3PO4 + 5HCl
HBrO + HCl
SO2 + 6HF + ½O2
H2PO3 + 3HF + ½H2
NH3 + 3HClO
44
Haluros de los gases nobles
Xe(g) + F2(g)
Xe(g) + 2 F2(g)
Xe(g) + 3 F2(g)
400°C, 1 atm
600°C, 6 atm
300°C, 60 atm
XeF2(g)
Xe en exceso
XeF4(g)
Xe:F2 = 1:5
XeF6(g)
Xe:F2 = 1:20
45
Química Inorgánica - 2007
15
Los Elementos Representativos
(Segunda parte)
Reacciones de los fluoruros de
xenón (I)
2 XeF2(g) + 2 H2O(l)
2 Xe(g) + 4 HF(g) + O2(g)
XeF4(g) + Pt(s)
Xe(g) + PtF4(s)
XeF2 + SbF5
[XeF]+[SbF6]-
XeF4 + [N(CH3)4]F
[N(CH3)4]+[XeF5]46
Reacciones de los fluoruros de
xenón (II)
XeF6 + 3 H2O
XeO3 + 6 HF
2 XeF6 + 3 SiO2
2 XeO3 + 3 SiF4
XeO3
OH-(ac)
HXeVIO4-(ac)
Xe0 + [XeVIIIO6]4-(ac)
47
Aspectos de
estructura y enlace
48
Química Inorgánica - 2007
16
Los Elementos Representativos
(Segunda parte)
Formas de las moléculas
F
XeF2: lineal
Xe
F
F
XeF4: plana cuadrada
4-
F
F
Xe
F
O
O
O
Xe
O
O
XeO64-: octaédrica
Modelo de RPENV
O
49
Formas de las moléculas (II)
F
ClF3 : forma de “T”
Cl
F
F
F
F
F
Br
F
F
BrF5 : pirámide de base cuadrada
F
F
IF7 : bipirámide pentagonal
F
F
I
F
F
F
50
Formas de las moléculas (III)
51
Química Inorgánica - 2007
17
Los Elementos Representativos
(Segunda parte)
Hibridación
z
z
z
z
z
z
z
sp
sp2
sp3
sp3d (dz2)
sp3d (dx2_y2)
sp3d2
sp2d
lineal
triangular plana
tetraédrica
bipiramidal trigonal
piramidal de base cuadrada
octaédrica
plano-cuadrada
La hibridación de los orbitales de valencia s y
p es más efectiva cuando n = 2
La participación de los orbitales d en enlaces
σ localizados es tema de debate
52
Energías de enlace al variar el
número de coordinación
F
SF2
SF4
SF6
F
S
sp3
367
339
329
Valores en kJ/mol
sp3d
F
S
F
F
F
F
F
sp3d2
F
S
F
F
F
53
¿Hay casos en que no se cumple
la regla del octeto?
F
F
F
S
F
F
F
F
F
F
S
2+
F
F
_
F
F
F
F
S
F
2+
F
Química Inorgánica - 2007
_
_
F
_
54
18
Los Elementos Representativos
(Segunda parte)
¿Hay casos en que no se cumple
la regla del octeto?
F
hibridación: sp3d
Xe
(parcipan orbitales d)
F
F
F
_
F
.. +
: Xe :
+
: Xe :
..
F
F
Xe
hibridación: sp2
_
(no participan orbitales d)
F
55
Enlace tricéntrico con cuatro
electrones: XeF2
2F
F-Xe-F
Xe
3σ
+
+
+
+
p
2σ
p
1σ
+
+
No se requieren orbitales d para describir el enlace
56
Moléculas deficientes en
electrones: enlace tricéntrico con
dos electrones
2B
B-H-B
H
σ∗
sp3
s
σ
Puentes de hidrógeno
Química Inorgánica - 2007
57
19
Los Elementos Representativos
(Segunda parte)
Concatenación
Carbono: alcanos, alquenos, alquinos, anillos
aromáticos
Silanos, germanos y estannanos: EnH2n+2
(n= 10 → E = Si, Ge; n=2 → E=Sn)
Organocompuestos: cadenas En(CH3)2n+2 ,
anillos (ER2)n
58
Carbono y silicio
An-1H2n(g) + A(s) + H2(g) → AnH2n+2(g)
C-C
356
C=C
602
C-H
416
C-Cl
338
Si-Si
226
Si=Si
310
Si-H
326
Si-Cl
391
H-H
435
Cl-Cl
242
Valores en kJ/mol
59
Carbono y silicio (II)
Crecimiento de la cadena
z
Enlaces que se rompen
z
Enlaces que se forman
z2
z1
z
(A-A) + 1 (H-H)
(A-A) + 2 (A-H)
Balance
z Para
z Para
A = Carbono: - 41 kJ/mol
A = Silicio: +6 kJ/mol
60
Química Inorgánica - 2007
20
Los Elementos Representativos
(Segunda parte)
Carbono y silicio (III)
Combustión
z
AnH2n+2 + (3n+1)/2 O2 → n AO2 + (n+1) H2O
Hidrólisis
z
AnH2n+2 + 2n H2O → n AO2 + (3n+1) H2
Cloruros
z
An-1Cl2n(g) + A(s) + Cl2(g) → AnCl2n+2(g)
61
Energías de enlace
simple y múltiples
14
15
16
C-C
356
N-N
167
O-O
144
C=C
602
N≡N
945
O=O
513
Si-Si
226
P-P
209
S-S
226
Si=Si 310
P≡P
493
S=S
431
Valores en kJ/mol
62
Los enlaces múltiples
Elementos del segundo período: buen
solapamiento pπ – pπ
Elementos de los períodos siguientes:
solapamiento pπ – pπ deficiente
63
Química Inorgánica - 2007
21
Los Elementos Representativos
(Segunda parte)
Algunas consecuencias
P
P
P
S
S
P
P
6 x EE(P-P) = 1254 kJ/mol
2 x EE(P≡P) = 986 kJ/mol
S
S
S
2 x
en lugar de
P
S
S
S
4 x
en lugar de
S
S
64
Más consecuencias
Estructuras de los dióxidos de carbono y silicio
z
Elección entre formar más enlaces simples A-O
ó enlaces dobles A=O
Compuestos de Si, Ge o Pb análogos a
alquenos y alquinos
z
z
Si2H4 o Si2H2 nunca se han aislado
Enlaces múltiples se estabilizan por grupos
orgánicos voluminosos
65
Ejemplos
R
R
Si
R
X
Si
Si
Si
Si
Si
R
E
X
+
R
R
R
Si
Si
E
+
R
66
Química Inorgánica - 2007
22
Los Elementos Representativos
(Segunda parte)
Moléculas R2X=XR2 no planas
67
La participación de orbitales d en
enlaces múltiples
pπ –dπ
dπ –dπ
Estructuras de la trimetilamina y trisililamina:
z Piramidal
vs. triangular
H
Si
H
N
H3C
CH3
CH3
N
SiH3
SiH3
H
68
Relaciones isoelectrónicas:
similitudes entre C-C y B-N
{BN}x presenta
estructura tipo
grafito
69
Química Inorgánica - 2007
23
Los Elementos Representativos
(Segunda parte)
Relaciones isoelectrónicas:
similitudes entre C-C y B-N
Boracina B3N3H6
70
Anomalías en el segundo período
Li y Be respecto de los restantes metales del
bloque s
Alótropos de elementos del bloque p con
enlaces múltiples
Regla del octeto
Mayor estabilidad cinética de haluros del
bloque p frente a la sustitución nucleofílica
71
El primer elemento del grupo
Tamaño pequeño
Mayor electronegatividad
Enlaces π fuertes, usando orbitales p
Tendencia a formar aniones y estados de
oxidación negativos
No hay orbitales d de baja energía, número
máximo de coordinación 4
72
Química Inorgánica - 2007
24
Los Elementos Representativos
(Segunda parte)
Los elementos restantes
Gran discontinuidad en las propiedades
respecto del primer elemento (C, N, O)
El elemento más pesado del grupo difiere del
resto en:
z
z
z
Estabilidad de estados de oxidación menores
(positivos)
Oxidos más básicos
Enlaces más débiles con H
Los elementos más pesados pueden presentar
mayores números de coordinación
73
Relaciones diagonales
Li y Mg
Be y Al
B y Si
74
Química Inorgánica - 2007
25