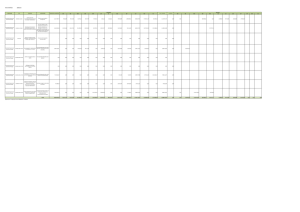
Volumen II
Anuncio

0 AUTORIDAD BINACIONAL AUTONOMA DEL SISTEMA HIDRICO T.D.P.S. PROYECTO PER 98/G32 CONSERVACIÓN DE LA BIODIVERSIDAD EN LA CUENCA DEL LAGO TITICACA - DESAGUADERO - POOPO - SALAR DE COIPASA GERENCIA NACIONAL PERUANA Instituto de Investigación, Producción, Servicios y Capacitación “Qollasuyo” Centro de Investigación y Producción Pesquera Chucuito UNA – Puno ESPECIES ÍCTICAS NATIVAS Equipo Profesional Asoc. IIP Qollasuyo - CIPP Chucuito UNA Puno PUNO – PERÚ 0 EQUIPO PROFESIONAL IIP QOLLASUYO - CIPP CHUCUITO UNA PUNO Ing. Francisco Paca Pantigoso Co Director IIP Qollasuyo Ph. D. Sabino Antencio Limachi Co Director CIPP Chucuito UNAP Ing. M. Sc. Romeo F. Paca Pantigoso Especialista: Estadística e Informática Blgo. René Alfaro Tapia Especialista: Pesca Artesanal Ing. Pesq. Maria del Rosario Roncal Gutiérrez Especialista: Transformación Blgo. Brígida Paca Pantigoso Residente de CP. Chucuito – Pomata Blgo. René Chura Cruz Residente de CP. Arapa Ing. Raul Quispe Mamani Especialista en formulación de alimentos para peces Prod. José Carlos Paca Vallejo Productor de medios CPC. Guadalupe Vásquez Pareja Administración Ing. Rubén Chambilla Huarahuara Informática Sistemas INVESTIGADORES - Blgo. José Luis Vilca Ticona Blgo. Yuver Paul Castillo Apaza Bach. Yanet Carmen Coila Rojas Blgo. Lourdes Jara Zuñiga ASISTENTES DE CAMPO - Sr. Saturnino Pongo Tarqui Sr. Hipólito Álvarez Condori APOYO LOGISTICO - CP. Myriam Chávez Barbery 1 INDICE 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Sinopsis Biológica de Trichomycterus dispar “mauri”. Equipo Profesional de la Asoc. IIP Qollasuyo – CIPP Chucuito UNA – PUNO; Noviembre 2000. Publicación Nº 01 Sinopsis Biológica de Orestias luteus “carachi amarillo”. Equipo Profesional de la Asoc. IIP Qollasuyo – CIPP Chucuito UNA – PUNO. Noviembre 2000. Publicación Nº 02 Sinopsis Biológica de Orestias ispi “ispi”. Equipo Profesional de la Asoc. IIP Qollasuyo – CIPP Chucuito UNA – PUNO. Noviembre 2000. Publicación Nº 03 Refrigeración Casera de Orestias luteus “carachi amarillo”. Lic. Blgía. René Chura Cruz, Ing. Romeo Paca Pantigoso. Asoc. IIP Qollasuyo – CIPP Chucuito UNA – PUNO. Noviembre 2000. Publicación Nº 04 Sinopsis Biológica Orestias pentlandii “boga”; Lic. Blgía. René Chura Cruz. Asoc. IIP Qollasuyo – CIPP Chucuito UNA – PUNO; Diciembre 2000. Publicación Nº 05 Sinopsis Biológica Trichomycterus rivulatus “suche”. Ph. D. Sabino Atencio Limachi, Blgo. Rene Alfaro Tapia. Asoc. IIP Qollasuyo – CIPP Chucuito UNA – PUNO. Diciembre 2000 Puno. Publicación Nº 06 Adaptación de Trichomycteridos en Ambientes Controlados Trichomycterus rivulatus “suche” y Trichomycterus dispar “mauri”. Ph. D. Sabino Atencio Limachi. Asoc. IIP Qollasuyo – CIPP Chucuito UNA – PUNO. Diciembre 2000. Publicación Nº 07 Construcción y Adecuación de Estanques para Trichomycterus rivulatus “suche” y Trichomycterus dispar “mauri”. Ph. D. Sabino Atencio Limachi. Asoc. IIP Qollasuyo – CIPP Chucuito UNA – PUNO; Diciembre 2000. Publicación Nº 8 Diseño de Ahumador Artesanal para Especies Ícticas Nativas del Lago Titicaca. Ing. Pesq. Maria del Rosario Roncal Gutiérrez, Ph. D. Sabino Atencio Limachi, Blgo René Alfaro Tapia. Asoc. IIP Qollasuyo – CIPP Chucuito UNA – PUNO; Enero 2001. Publicación Nº 10 Procesos para Reproducción Artificial de Orestias luteus “carachi amarillo”, Orestias agassii”carachi negro”, Orestias ispi “ispi”. Lic. Blgía. Brígida Paca Pantigoso y Lic. Blgía. Rene Chura Cruz. Asoc. IIP Qollasuyo – CIPP Chucuito UNA – PUNO; Enero 2001. Publicación Nº 11 Elaboración de Conservas de: Orestias agassii “carachi negro” y Orestias luteus “carachi amarillo” “Salsa de Tomate, Grated en aceite. Lic. Blgía. Brígida Paca Pantigoso y Lic. Blgía. Rene Chura Cruz. Asoc. IIP Qollasuyo – CIPP Chucuito UNA PUNO; Febrero 2001. Publicación Nº 12 Elaboración de Seco Salado de Orestias ispi “ispi”. Equipo Profesional de la Asoc. IIP Qollasuyo – CIPP Chucuito UNA PUNO; Febrero 2001. Publicación Nº 13 Elaboración de Ahumado de Orestias ispi “ispi”. Equipo Profesional de la Asoc. IIP Qollasuyo – CIPP Chucuito UNA PUNO; Febrero 2001. Publicación Nº 14 Incubadores Artesanales. Lic. Blgía. René Chura Cruz. Asoc. IIP Qollasuyo – CIPP Chucuito UNA PUNO; Marzo 2001. Publicación Nº 15 2 15 Alimentación inicial de alevinos de Orestias. Ph. D. Sabino Atencio Limachi. Asoc. IIP Qollasuyo – 16 17 18 19 CIPP Chucuito UNA PUNO; Abril 2001. Publicación Nº 16 Taxonomía de la Ictiofauna Nativa del Lago Titicaca. Ph. D. Sabino Atencio Limachi. Asoc. IIP Qollasuyo – CIPP Chucuito UNA PUNO;; Julio 2001. Publicación Nº 17 Formulación de Alimento Balanceado para Especies Ícticas Nativas del Lago Titicaca. Ing. Raúl Quispe Mamani. Asoc. IIP Qollasuyo – CIPP Chucuito UNA PUNO; Noviembre 2001. Publicación Nº 18 Reproducción Artificial de Trichomycterus rivulatus “suche” y Trichomycterus dispar “mauri”. Lic. Blgía. Brígida Paca Pantigoso y Lic. Blgía. René Chura Cruz. Asoc. IIP Qollasuyo – CIPP Chucuito UNA PUNO; Julio 2001. Publicación Nº 19 Elaboración de Alimento Balanceado para Especies Ícticas Nativas. Ing. Raúl Quispe Mamani. Asoc. IIP Qollasuyo – CIPP Chucuito UNA PUNO; Julio 2001. Publicación Nº 20 3 Instituto de Investigación, Producción, Servicios y Capacitación “Qollasuyo” Centro de Investigación y Producción Pesquera Chucuito UNA – Puno SINOPSIS BIOLÓGICA DE Trichomycterus dispar “mauri” Equipo Profesional Asoc. IIP Qollasuyo - CIPP Chucuito UNA Puno PUBLICACIONES QOLLA Nº 01 Noviembre AÑO 2000 PUNO – 2000 – PERÚ 0 I.- ASPECTOS GENERALES.- 1.1. Taxonomía de Trichomycterus dispar “mauri” El primer investigador en describir el género Trichomycterus, fue HUMBOLDT (1811), identificando equivocadamente como el género Eremophilus, nombre que fue descartado. VALENCIENNES (1833), dio una descripción más clara de este género. MEYEN (1834), WIEGMANN (1890), describen varias especies como pertenecientes al género Pygidium; pero el Dr. T. TCHERNAVIN (1943), ratifica la denominación de Trichomycterus designada por VALENCIENNES (1833). El nombre específico originalmente fue dado por TSCHUDI (1845). Según TCHERNAVIN (1943) la posición taxonómica actual es la siguiente, citados por Samaniego et al. 1987: PHYLLUM Chordata SUB PHYLLUM Vertebrata CLASE Osteichthyes SUB CLASE Actinopterygii ORDEN Siluriformes SUB ORDEN Siluroidei FAMILIA Trichomycteridae GENERO Trichomycterus ESPECIE Trichomycterus dispar NOMBRE COMUN "mauri" “mari” “huita” II.- MORFOLOGÍA STORER, F. (1961), manifiesta que el Sub Orden Siluroidei posee boca protáctil (en caso del género Trichomycterus “suche” y “mauri” no presenta este tipo de boca), con dientes generalmente con barbillas sensitivas, cuerpo desnudo (sin escamas) o con placas óseas, las especies americanas desnudas y con aletas adiposas. MIPE (Documento) indica que el “suche” y “mauri”, son peces bentónicos por lo cual su cuerpo y algunos órganos están adaptados funcionalmente. Cuerpo.- Soporta altas presiones producidas por el gran volumen de agua, por lo cual presenta un cuerpo aplanado, dorso ventralmente en los dos tercios anteriores y lateralmente en el tercio posterior; el vientre es aplanado. Órganos principales Ojos.- Los ojos son pequeños y hundidos por su adaptación a escasa cantidad de luz. Barbos.- Están premunidos de seis barbos filamentosos en la base de la mandíbula superior, siendo órganos complementarios. Vejiga natatoria.- El "mauri" y "suche" carecen de vejiga natatoria o está sumamente atrofiada. Estómago.- El estómago es de tipo tubular, es frecuente en los peces carnívoros y se complementa con un intestino relativamente corto y simple, se presenta a manera de una bolsa tubular bastante distensible, de tal modo que cuando el animal se encuentra en ayunas o exento de contenido estomacal, este se mantiene como un conducto tubular más o menos replegado. En cambio, cuando este se halla repleto de alimentos se ensancha ostensiblemente por distensión de su tejido y membranas que conforman sus paredes. 1 2.1. Estructura del tracto digestivo LAGLER (1980) indica que la estructura básica del tracto digestivo de los vertebrados es: a) Boca bordeada por mandíbula dentada y rodeada internamente por válvulas orales. b) Cavidad oral con dientes vomerianos y palatinos en el techo y lengua con dientecillos linguales en su superficie. c) Faringe con dientes faringeos en cojinetes hacia los lados de los arcos branquiales que protegen las aberturas branquiales internas. d) Esófago. e) Estómago. f) Píloro. g) Intestino corto. h) Intestino largo. i) Ano. 2.2. Longitud La longitud del Trichomycterus dispar “mauri” en la zonas de Chucuito y Uros fue de 15.74 cm y se observa que en promedio las hembras miden 15.61 cm, son más pequeñas que los machos que tienen una longitud de 15.95 cm. CUADRO Nº 01 LONGITUDES DE Trichomycterus dispar “MAURI” EN LA ZONA DE CHUCUITO – UROS (LAGO TITICACA) 1994 – 1995 INTERVALO DE CLASE cm MARCA DE CLASE 12 – 14 13 14 – 16 15 16 – 18 17 18 – 20 19 20 – 22 21 TOTAL DESVIACIÓN ESTANDAR PROMEDIO COEFICIENTE DE VARIABILIDAD HEMBRAS Ni 17 17 18 04 03 59 % 28.82 28.82 30.50 6.78 5.08 100.00 2.24 15.61 14.33 MACHOS Ni 05 15 13 05 00 38 % 13.16 39.47 34.21 13.16 0.00 100.00 1.79 15.95 11.19 TOTAL Ni 22 32 31 09 03 97 % 26.68 32.68 31.68 9.28 3.09 100 2.07 15.74 13.14 FUENTE: Angles, 1996. La longitud de Trichomycterus dispar “mauri” en Uros Chulluni es de 15.74 cm y se observa que en promedio las hembras miden 15.61 cm, son más pequeñas que los machos que tienen una longitud de 15.95 cm; 2 CUADRO Nº 02 LONGITUDES DE Trichomycterus dispar “MAURI” EN LA ZONA DE LOS UROS (LAGO TITICACA) 1994 – 1995. INTERVALO DE HEMBRAS MACHOS TOTAL MARCA DE CLASE cm CLASE Ni % Ni % Ni % 12 14 16 18 – – – – 14 16 18 20 13 15 17 19 TO TAL DESVIACIÓN ESTANDAR PROMEDIO COEFICIENTE DE VARIABILIDAD 17 12 3 5 45.9 32.4 8.1 13.5 5 10 0 1 31.3 62.5 0.0 6.3 22 22 3 6 41.5 41.5 5.7 11.3 37 100.0 2.10 14.78 14.18 16 100.0 1.50 14.63 10.26 53 100.0 1.92 14.74 3.05 FUENTE: Angles, 1996. CUADRO Nº 03 LONGITUDES DE Trichomycterus dispar “MAURI” EN LA ZONA DE CHUCUITO (LAGO TITICACA) 1994 – 1995. INTERVALO DE CLASE cm MARCA DE CLASE 14 –16 16 – 18 18 – 20 20 – 22 TOTAL 15 17 19 21 DESVIACIÓN ESTANDAR PROMEDIO COEFICIENTE DE VARIABILIDAD HEMBRAS Ni 5 15 2 3 25 % 20 60 8 12 100 17.24 1.76 10.22 MACHOS Ni 5 13 4 0 22 % 22.7 59.1 18.2 0.0 100.0 16.91 1.71 10.09 TOTAL Ni 10 28 6 3 47 % 21.3 59.6 12.8 6.4 100.0 17.00 1.56 9.12 FUENTE: Angles, 1996. III.- FISIOLOGÍA 3.1 Tracto digestivo LAGLER (1980), menciona que: en los cetáceos y peces óseos, el tracto digestivo consiste en un conducto interrumpido que se inicia en la boca y termina en el ano o cloaca, según el pez que se trate. Pero existe gran variabilidad en lo referente a forma, característica y estructura del tracto digestivo entre las diferentes clases de peces, de acuerdo a su filiación taxonómica, mecanismo ingestivo, hábitos alimentarios etc., esto conlleva a diferencias en la fisiología del tracto digestivo. Todo alimento inicia su proceso digestivo, siendo ingerido mediante cualquiera de los mecanismos de ingestión que existen en los peces, de la cavidad bucofaríngea, que recepciona los alimentos, pasan estos al esófago, aunque los peces presentan una lengua en la cavidad bucal, esta es rígida, dura y no cumple ninguna función deglutora. 3 Los alimentos acumulados en el sector bucofaríngeo provocan la distensión de las paredes esofágicas y por los movimientos musculares del tubo digestivo pasan lubricados por el mucus hacia el estómago, venciendo previamente la estrechez que ejerce el esfínter cardial, que se refleja o movimientos reflejos. Una vez que los alimentos ingresan al estómago se da inicio al proceso digestivo propiamente dicho, los movimientos peristálticos provocados por la acción muscular en las paredes del estómago al ataque químico de los jugos gástricos (HCI) y la acción bioquímica de enzimas o diastasas se encarga de completar la acción digestiva que tiene lugar en el estómago del pez. IV.- HABITOS ALIMENTICIOS LAGLER (1980), manifiesta que un factor importante en la alimentación es la hora del día. Algunos peces como los bagres que encuentran su alimento mediante el olfato y el gusto, son predominantemente comedores nocturnos. MONTOYA (1989), menciona que el Trichomycterus sp. “mauri” es una especie altamente selectiva en su alimentación ya que el 91.79% en número y el 97.34% en volumen esta representado por el anfípodo Hyalella spp.; el anélido Helobdella spp. y ovas de peces, variando el porcentaje de acuerdo al tamaño del pez. 4.1. Contenido estomacal 4.1.1. Número y porcentajes del contenido estomacal por longitudes La composición de organismos que se hallan en el contenido estomacal se aprecia en detalle en el cuadro Nº 01, respectivamente; en el rango de longitudes comprendidas entre 13 y 14 cm. Se registró 96.03% de Hyalella, 2.84% larvas de chirómidos, 1.13% Ovas de peces. Para el rango de longitud de 14 a 16 cm, estuvo conformado por un 68.43% por el contenido estomacal de un 68.43% de Hyalella, 3.92% larvas de chironómidos, 6.71% Helobdella, 2.79% ninfas de odonatos, pupas de chironómidos y 15.36% ovas de peces. En el rango de longitud de 16 a 17.9 cm, el contenido estomacal es 59.94% de Hyalella, 33.42% larvas de chironómidos, 2.63% Helobdella, 1.17% ninfas de odonatos, 0.88% pupa de chironómidos y 1.46% de peces, en estos rangos existe una variedad de preferencias en cuanto a los tipos de alimentación. Para el rango de longitud de 18 a 19.9 cm., el contenido estomacal esta constituido por un 71.22% de Hyalella, 23.38% larvas de chironómidos y 5.4% de ovas de peces. Para el rango de longitud de 20 a 21.9 cm, el análisis del contenido estomacal estuvo conformado por un 73.32% de Hyalella, 28.98% larvas de chironómidos y el resto estuvo formado por otros organismos. 4 CUADRO Nº 04 NUMERO Y PORCENTAJE DE ORGANISMOS EN EL CONTENIDO ESTOMACAL DEL Trichomycterus dispar “MAURI” EN RELACION A LAS LONGITUDES EN LAS ZONAS DE UROS – CHUCUITO (LAGO TITICACA) 1994 – 1995 CLASE Cm N° % 13-14 338 96.0 14-16 245 68.4 16-18 410 59.9 18-20 396 71.2 20-22 86 62.3 TOTAL 1475 70.6 Fuente: Angles, 1996 N° % N° % N° % N° % N° % 10 14 232 130 40 426 2.8 3.9 33.9 23.4 29.0 20.4 0 24 18 0 0 42 0.0 6.7 2.6 0.0 0.0 2.0 0 10 8 0 10 28 0.0 2.8 1.2 0.0 7.2 1.3 0 10 6 0 0 16 0.0 2.8 0.9 0.0 0.0 0.8 4 55 10 30 2 101 1.14 15.4 1.46 5.4 1.45 4.84 TOTAL 352 358 684 556 138 2088 4.1.2. Contenido estomacal por épocas En el Altiplano peruano no se manifiestan con toda claridad las estaciones de primavera, verano, otoño e invierno, por lo que normalmente solo se consideran dos épocas, la de intermedio que comprende los meses de abril hasta agosto y la época de lluvias de setiembre a marzo. a. Época intermedia Se analizó 47 ejemplares, tal como se puede ver en el cuadro Nº 05, donde se observa, que el principal alimento de esta especie está conformada por 64.98% de Hyalella, 30.58% de chironómidos, 0.86% de Helobdella, 2.18% ninfas de odonatos y 0.47% pupa de chironómidos y 0.93% ovas de peces. b. Época de lluvia Se contó 50 ejemplares, representado en el cuadro Nº 05 cuyo análisis estomacal estuvo constituido por 82.63% Hyalella, 1.67% larvas de chironómidos, 3.99% de Helobdella, 0.26% pupa de chironómidos y un 11.45% de ovas de peces. Haciendo comparaciones en estas dos épocas, indudablemente el organismo principal de alimentación de los “mauris” es la Hyalella, para la época de lluvia este organismo toma mayor frecuencia que en la intermedia. 5 14-15.9 16-17.9 18.19.9 20-21.9 12-13.9 LLUVIA 14-15.9 + 16-17.9 50 18-19.9 FUENTE: Angles, 1996. INTERMEDIA + 47 4.2. 75.70 61.46 67.34 62.32 96.02 66.66 64.52 80.50 9.72 34.55 32.66 28.98 2.84 0 4.84 0 7.64 0 0 0 1.4 6.37 29.03 0 6.94 1.33 0 7.25 0 0 0 0 0 0 1 1.66 0 0 0 1.45 0 0 0 26.97 1.61 0 0.62 19.48 TOTAL ovas (peces) chironomido (pupa) odonato (ninfa) Helobdella chironomido (larvas) O RGANIS M OS Hyalella sp. RANGO DE LONGITUD cm. EPOCAS CUADRO Nº 05 PORCENTAJE DE NÚMERO DE ORGANISMOS DEL CONTENIDO DE Trichomyterus dispar “MAURI”, EN EPOCAS INTERMEDIAS DE LLUVIAS DEL (TITICACA) 1994 – 1995. 100.00 100.00 100.00 100.00 100.00 100.00 100.00 100.00 Determinación cualitativa de los componentes alimenticios en el contenido estomacal de Trichomycterus dispar “ mauri” En la determinación cualitativa se considera el grado de llenura, grado de digestión y organismos que conforman su dieta. Con respecto al grado de llenura se obtuvo un promedio de 2 (grado de llenura), esto nos demuestra que el tracto digestivo se hallaba con escaso contenido, encontrándose 14 ejemplares con el estómago vacío. En el grado de digestión se obtuvo un promedio de 3 lo cuál nos indica que el momento de análisis los alimentos estuvieron digeridos. Referente a los componentes alimenticios en el “mauri” encontramos organismos bentónicos Hyalella (anfípodos), pupas y larvas de chironómidos (insectos), ninfa de odonatos (insectos), Helobdella (anélido) y ovas de peces. 4.3. Determinación cuantitativa de la alimentación de Trichomycterus dispar “mauri” 4.3.1. Índice de Replección Total (IRT) Al realizar los análisis estadísticos de los IRT para el total de la población obtuvimos los siguientes resultados. IRT (Mínimo) = 58.8 IRT (Máximo) = 365.8 IRT (Promedio) = 141.4 4.3.2. Índice de Replección Total por clase Los IRT por clase difieren en cuanto a promedios así como en desviación estándar como se aprecia en el cuadro N° 06. 6 CUADRO Nº 06 ÍNDICE DE REPLECCIÓN TOTAL DE Trichomycterus dispar “MAURI” EN EL LAGO TITICACA 1995. Rango de Longitud en cm 12.0 – 13.9 14.0 – 15.9 16.0 – 17.9 18.0 – 19.9 20.0 – 21.9 ∑ ц D.S IRT Mínimo IRTµ IRT Máximo 81.6 29.9 41.1 25.4 60.5 246.4 49.3 22.03 566.0 348.6 333.0 332.8 269.3 1848.7 369.7 101.9 323.6 189.2 197.0 179.1 168.4 1047.5 209.5 57.6 FUENTE: Angles, 1996 4.3.3. Índice de Significación Relativa (ISR) Se hace uso de este índice con el fin de apreciar el grado de preferencia en su alimentación por el pez en estudio obteniendo lo que se aprecia en el cuadro N° 07. CUADRO Nº 07 ÍNDICE DE SIGNIFICANCIA RELATIVA (ISR) COMPONENTE ALIMENTICIO Hyalella chironomidos (larvas) Helobdella odonatos (ninfa) chironomidos (pupa) ovas T O T A L NPA F NCP P %P 83 100 1,475-17.9 6,104.90 73.54 14 17 405-4.9 1220-36 14.70 5 6 42-0.5 160-7 1.93 5 6 28-0.3 42-6 1.10 3 4 8-0.1 60-9 0.72 5 6 101-1.2 665-44 8.01 100% Fx % P 7354 249.9 11.58 6.6 2.88 48.06 7,673.02 I. S. R. 95.84 3.26 0.15 0.08 0.04 0.63 100% FUENTE: Angles, 1996 ISR = Índice de significación relativa. N P A = Número de peces con determinado alimento F = Frecuencia N C P = Número de componentes alimentarios por pez. %P = Suma de porcentaje por peso de cada componente alimenticio. Fx % P = Porcentaje por peso de cada componente 4.4. Número de organismos de contenido estomacal respecto al rango de longitudes para la época intermedia Para el número de organismos del contenido estomacal respecto al rango de longitudes para la época intermedia se estructuró el cuadro N° 08 donde se muestra que el rango de longitud 12.6 – 13.9 cm., en dicha época no se encontró ningún ejemplar. Para las tallas 14.0 – 15.9 cm. encontró el siguiente número de organismos: 109 individuos de Hyalella, 14 larvas de chironómidos, 11 individuos de Helobdella, 10 ninfas de odonatos en total 144 organismos. Para las tallas 16.0 – 17.9 se puede ver que hay una variedad de alimentos o Items donde se encontró: 370 individuos de Hyalella, 208 larvas de chironómidos, 08 ninfas de odonatos, 6 pupa de chironómidos y 10 ovas de peces teniendo un total de 602 organismos. En este rango se nota que hay más consumo de organismos. 7 Para las tallas de 18.0 – 19.9 se hallaron 268 individuos de Hyalella y 130 larvas de chironómidos, haciendo un total de 398 organismos y por último para las tallas de 20.0 – 21.9 de 86 individuos de Hyalella, 40 larvas de chironómidos, 10 ninfas de odonatos y 2 ovas obteniendo un total de 136 organismos. Los promedios finales para la época intermedia son los siguientes: 64.97% de Hyalella, 30.58% larvas de chironómidos, 0.86% de Helobdella, 2.18% ninfas de odonatos, 0.47% pupas de chironómidos y un 0.94% ovas de peces. CUADRO Nº 08 NUMERO DE ORGANISMOS DE CONTENIDO ESTOMACAL RESPECTO AL RANGO DE LONGITUDES PARA LA EPOCA INTERMEDIA DE Trichomycterus dispar “MAURI” 1994 – 1995 TOTAL 2 X % - - - 14 208 130 40 11 0 0 0 10 8 0 10 0 6 0 0 833 392 228001.0 6111960.0 64.97 30.58 11 121.0 0.8 28 264.0 2.18 6 36 0.47 0 10 0 2 TOTAL - ovas (peces) 109 370 268 86 chironomido (pupa) Helobdella - odonato (ninfa) chironomido (larvas) 12-13.9 14-15.9 16-17.9 18-19.9 20-21.9 Hyalella RANGO DE LONGITUD cm. O RG ANIS M OS 1444 602 398 138 12 1,282 104.0 2220486.0 0.94 100.0 FUENTE: Angles, 1996 4.5. Número de organismos del contenido estomacal respecto al rango de longitudes para la época de lluvia. Para el número de organismos del contenido estomacal respecto al rango de longitud para la época de lluvia se estructuró el cuadro N° 09 Para el rango de longitud 12.0 – 13.9 se hallaron 338 organismos de Hyalella, 10 larvas de chironómidos, 4 ovas; haciendo un total de 352 componentes. Para el rango 14.0 – 15.9, se encontraron 136 organismos de Hyalella, 13 organismos de Helobdella y 55 ovas con un total de 204 componentes. Para el rango de 16.0 – 17.9 se encontraron 40 individuos de Hyalella, 3 larvas de chironómidos y una pupa de chironómidos, y 18 individuos de Helobdella, con un total de 62 organismos. Para el rango de 18.0 – 19.9, se contaron 128 organismos de Hyalella, 01 pupas de chironómidos y 30 ovas de peces teniendo un total de 159 organismos, finalmente para el rango de 20.0 – 21.9, no fueron registrados en la época de estudio. 8 Para esta época se obtuvieron los siguientes promedios finales: 82.62 % de Hyalella, 1.67% larvas de chironómidos 3.99% Helobdella, 0.27% pupas de chironómidos y 11.45% ovas de peces. Haciendo comparaciones de estas épocas, podemos observar claramente que en la época lluviosa el 82.62% del contenido estomacal esta compuesto de la Hyalella, y el 64% del mismo organismo en la época intermedia. Pudiendo afirmar en la época de lluvia este anfípodo es muy importante en su alimentación; con relación a larvas de chironómidos ocurre lo contrario el 30.58% que corresponde a la época intermedia y el 1.67% la época de lluvia, seguido de ovas de peces para la época de lluvia con 11.45% con relación intermedia que solo se cuenta con 0,94% con relación a los demás organismos, se puede decir que como son organismos esporádicos no son tan importantes para su dieta, como es la Hyalella. En el presente trabajo también se pudo verificar en cuanto a la Hyalella que el consumo es mayor en la época intermedia con relación a la época de lluvia, lo cuál Montoya menciona que en segundo lugar de consumo están las ovas de peces, con relación a este trabajo el segundo organismo que en importancia alimentaría son las larvas de chironómidos. CUADRO Nº 09 NUMERO DE ORGANISMOS DEL CONTENIDO ESTOMACAL RESPECTO AL RANGO DE LONGITUDES PARA LA ÉPOCA DE LLUVIA DE Trichomycterus dispar “MAURI” 1994 – 1995 TOTAL ovas (peces) chironomido (pupa) odonato (ninfa) Helobdella chironomido (larvas) Hyalella RANGO DE LONGITUD cm. O R G A N I S M O S 12-13.9 14-15.9 16-17.9 18-19.9 20-21.9 338 136 40 128 - 10 0 3 0 - 0 13 18 0 - 0 0 0 0 - 0 0 1 1 - 4 55 0 30 - 352 264 62 159 - TOTAL 2 X % 642 150724 82.62 13 109 1.67 31 492 3.99 0 0 0 2 4 0.27 89 3941 11.45 777.00 155331.00 100.00 FUENTE: Angles, 1996 El número de organismos presentes en el contenido estomacal en los diferentes rangos de longitud para Trichomycterus dispar “mauri” son diferentes para cada una de las tallas durante la época de lluvia. 9 4.6. Relación de época, talla y volumen de los organismos del contenido estomacal Se conoce que no existe diferencia en el contenido estomacal en las épocas de lluvia y seca, en cambio si existe diferencia en la preferencia de alimentación de las diferentes tallas y el volumen de organismos. 4.7. Contribución para el conocimiento de la comunidad ecológica para establecer sus cadenas tróficas El conocimiento del tipo de alimentación que se registra para las diferentes tallas de “mauri”, permitirá afirmar en que nivel trófico se halla dentro de las especies ícticas nativas en el lago Titicaca. Si hacemos un recuento de la alimentación de las “truchas” (Bustamante 1974), indica que estos peces son carnívoros de tercer orden consumen los peces “ispi” mientras que el “pejerrey” tiene una alimentación más heterogénea (Choquehuanca 1980), en lo referente a las especies ícticas nativas estas tienen mayor especialización ya que el “ispi” es aún zooplanctófago y los “carachis” combinan su alimentación con anfípodos y moluscos (Azabache 1984) Para el Trichomycterus dispar “mauri” las longitudes de 12.0 – 13.9 cm., su alimentación principal es de Hyalella con un 96.03% larvas de chironómidos 2.84% , y ovas de peces en 1.13% . Para las longitudes de 14.0 - 15.9 cm, en este rango su dieta es variada pero como siempre su principal alimento es Hyalella en un 68.43% , ovas de peces 15.36% , Helobdella 6.61% larvas de chironómidos 3.92% ninfas de odonatos, y pupas de chironómidos en un 22.79%. Para las longitudes de 16.00 – 17.9 cm, presenta una dieta variada, Hyalella en un 59.54%, seguido de larvas de chironómidos 33.42%, Helobdella 2.63% ovas de peces 1.46%, ninfas de odonatos 1.17% y 0.88% de pupas chironomidos. Para las longitudes de 18.0 – 19.9 cm, su dieta en cuanto a preferencias aumenta, 71.22% de Hyalella, larvas de chironómidos 23.38% y ovas de peces 5.4%. Entre las longitudes 20.0 – 21.9 cm, su alimentación está conformada por 70.64% ninfas de odonatos y 1.45% ovas de peces. V .- HABITAT AYALA (1982), manifiesta que el Trichomycterus dispar “mauri” tiene hábitos bentónicos en profundidades de 0 a 20 m, con fondos cenagosos o terrosos con abundante vegetación acuática sumergida, prefiriendo fondos arenosos, formados en su mayoría por cantos rodados; además elige habitar aguas tranquilas, sin mucha corriente buscando albergarse entre plantas acuáticas o algún otro obstáculo como medio de defensa contra los predadores y en casos muy especiales realizan el fenómeno del mimetismo. 10 VI.- DISTRIBUCIÓN GEOGRÁFICA CANALES (1982), manifiesta que la distribución normal del "mauri" esta circunscrita a ciertos grupos de agua del Altiplano Peruano Boliviano, pues no se tiene conocimiento de su existencia fuera de estos países, se podría decir que tiene una distribución estenocora; requiriendo por tal razón un tratamiento especial para asegurar la propagación y supervivencia de la especie. Es indudable que los hábitos de reproducción son determinantes lo que pueda ocasionar un consiguiente período de extinción. AYALA (1983), dice que la pesquería de Trichomycterus sp "mauri" es amplia en su distribución, comprendiendo lagunas de Arapa, Saracocha, Lagunillas y el lago Titicaca, siendo en esta última la de mayor disponibilidad en la zona Norte, Sur y bahía de Puno. Dentro de la pesquería del Altiplano Peruano representa el 30% del volumen, la distribución territorial, abarca especialmente la península de Chucuito, islas de los Uros, y siendo la época de mayor extracción las de lluvia, cuando salen a buscar zonas de desove. 11 Instituto de Investigación, Producción, Servicios y Capacitación “Qollasuyo” Centro de Investigación y Producción Pesquera Chucuito UNA – PUNO SINOPSIS BIOLÓGICA DE Orestias luteus “carachi amarillo” Equipo Profesional de la Asoc. IIP Qollasuyo – CIPP Chucuito PUBLICACIONES QOLLA Nº 02 Noviembre AÑO 2000 PUNO – 2000 - PERÚ 0 I. ASPECTOS GENERALES 1.1. Taxonomia de Orestias luteus “carachi amarillo” Los estudios y revisiones más importantes que se han realizado sobre el Género son: CUVIER et VALENCIENNES, 1846; GARMAN, 1895; EIGEMANN et ALLEN (1942); TCHERNAVIN (1944); LAUZANNE (1982) y PARENTI (1984). CUADRO Nº 01 Orestias luteus “CARACHI AMARILLO” TAXONOMÍA DE ORDEN FAMILIA GÉNERO ESPECIE NOMBRE COMUN Cyprinodontiformes Ciprinodontidae Orestias O. luteus carachi amarillo, punkuru awicha, punku, punkuku k’ara wasa, khenu, punkunti Fuente: Sarmiento et. al., 1987 La primera colección de Orestias, fue realizada por PENTLAND en los años 30 del siglo XIX, fue descrito por VALENCIENNES quien estableció un Género Orestias con diez especies, en 1839. Según TCHERNAVIN (1944) las Orestias luteus “carachi amarillo” lo clasifica en el grupo 2 y para LAUZANNE (1982) lo clasifica en el grupo 1 según el cuadro siguiente: CUADRO Nº 02 COMPARACIÓN TAXONÓMICA DE Orestias Luteus “CARACHI AMARILO” POR INVESTIGADORES TCHERNAVIN LAUZANNE Grupo Especies Grupo Especie 2 Orestias luteus 1 Orestias luteus Fuente: Sarmiento et. al., 1987 1.2. Clasificación de Lauzanne, 1982 LAUZANNE (1982), clasifica a las Orestias en grupos. Siendo para el “carachi amarillo, el grupo 01 que comprende a: Orestias luteus, Orestias albus y Orestias jussiei, sin embargo PARENTI (1984) clasifica a las Orestias en 04 complejos, siendo para el “carachi amarillo” el complejo agassii. El holotipo (MNHN A. 9608), una hembra adulta, de 126 mm LS., colectada por M. PENTLAND, aproximadamente en (1833), del lago Titicaca. 1 1.3. Clave para “carachi amarillo”, según Lauzanne, 1982 citado por Sarmiento et al., 1987. TCHERNAVIN (1944) y LAUZANNE (1982) han propuesto clasificar taxonomicamente a Orestias luteus “carachi amarillo”, tal como sigue: 1.4. 1. I/H I/A 48% 11% ---------------------------------------------------- 9 9 Hueso faringeo cordiforme dientes faringeos, fuertes y cilíndricos ---------------- 10 10 B/A: 31 - 36% N/A: 25 – 34% Encima de la cabeza muy granulosas Vientre amarillo vivo ------------------ Orestias luteus I/A: Altura del pedúnculo cuadal en relación a la longitud estándar I/H: Altura del pedúnculo cuadal en relación a su longitud total B/A: Largo de la cabeza en relación a la longitud estándar N/A: Ancho de la cabeza en relación a la longitud estándar Posición taxonómica Según, TCHENAVIN (1944) citado por BRAVO (1991): PHYLLUM : Chordata. SUB PHYLLUM : Vertebrata. SUPERCLASE : Pisces. CLASE : Osteichthyes. SUB CLASE : Actinopterygii. SUPER ORDEN :Teleostei. ORDEN : Ciprinodontiformes. FAMILIA : Ciprinodontidae. SUBFAMILIA :Cyprinodontinae. GÉNERO : Orestias. ESPECIE : Orestias luteus. N. VULGAR : “carachi amarillo” “punku” II.- MORFOLOGÍA Y ANATOMÍA 2.1. Descripción morfológica de Orestias luteus “carachi amarillo” THERNAVIN (1944) describe a Orestias luteus “carachi amarillo”, que es de color amarillo, de cuerpo alargado protegido por escamas, de radios circulares (ctenoidea); pedúnculo caudal que termina en lóbulos iguales (homocerca), con puntuaciones negras y redondeadas. La forma de la cabeza es triangular de color negruzco, posee dos ojos, presentando además, boca protráctil con mandíbula. Tiene dos aletas pectorales, una dorsal posterior, una anal y una caudal, la aleta anal y dorsal se encuentran a la misma altura. Internamente el aparato digestivo se inicia en la boca con pre maxilares y maxilar protráctil, provisto de dientes cortos y 2 pequeños de un número escaso, posee una laringe pequeña y lisa a los lados de la cavidad buco – faringeo donde se encuentran las branquias. A partir del esófago existe un estómago, así como, el hígado voluminoso y de color rojizo, además, aquí se encuentra la vesícula biliar casi esférica de color verde amarillento y el corazón pequeñísimo se halla situado cerca de la cavidad opercular. El macho presenta un testículo de forma alargada y se comunica con el orificio genital por medio de un conducto de igual manera en la hembra que presente un solo ovario. Las Orestias luteus “carachi amarillo” presentan tallas superiores al rango de 148 – 163 mm. Existe una ausencia total de machos, posiblemente se deba a que éstos no alcanzan dichas tallas o sean muy escasas, ya que en las tallas comprendidas entre 123 – 133 mm. existen proporciones casi iguales de machos respecto a hembras. CRUZ (1984) manifiesta que la longitud promedio de 86 mm el 50% de la población, alcanzan su primer desove a los 112 mm el 100% de los individuos han desovado por primera vez. 2.2. CARACTERÍSTICAS BIOMORFOLÓGICAS ♦ Presenta el cuerpo comprimido lateralmente. ♦ Dientes de arcos branquiales simples. ♦ Ojos pequeños cuyas órbitas no sobresalen de la corona, siendo este casi convexo. ♦ Cabeza ligeramente redondeada. ♦ Boca protráctil, la comisura desciende hacia un nivel por debajo de la órbita. ♦ Dientes romos. ♦ Escamas de la parte anterior con granulaciones, grandes y notorias al tacto. ♦ Presenta las siguientes aletas, una dorsal, una anal, aletas pectorales, aletas ventrales o pelvianas ausentes, aleta anal presente, aleta caudal típicamente homocerca con el borde convexo. ♦ Otras características merísticas importantes en el número de radios en las aletas así tenemos: Ateta pectoral Aleta dorsal Aleta anal Aleta caudal • • P ................ 21 D ................ 14 A ................ 16 C ................ 28 Internamente el aparato digestivo se inicia en la boca protráctil con premaxilares y maxilares, previstas de dientes de arcos branquiales simples. En la cavidad buco faringea se encuentra la lengua pequeña y lisa, a los lados de esta se encuentra las branquias. No se encuentra un estómago propiamente dicho, sino que mas bien le sigue una región mas dilatada del intestino que termina en un ciego pilórico con una curvatura poco distinguible, que se continúa con el intestino, de mayor longitud que la cavidad celómica y que se repliega en el interior. 3 • • • • • 2.3. Esto es posible que la parte final del intestino se halla provista de una válvula intestinal que se presume tendría una doble función la de retornar alimentos, para prolongar la digestión y para eliminar los restos de la alimentación. El Hígado voluminoso y de color rojizo se halla situado en la parte anterior de la cavidad celómica, en el hígado se encuentra la vesícula biliar casi esférica y de color amarillento. El corazón pequeño se halla situado cerca de la cavidad y por ende cerca a las branquias. Las gónadas se hallan situadas en la cavidad abdominal cerca de la abertura anal. La coloración del cuerpo es gris amarillenta por la parte dorsal algunos oscuros y la abdominal amarillo cremoso o amarillo canario. Descripción histológica en ciclos de madurez sexual CANCCAPA y CAZORLA (1990) indican que la madurez sexual para Orestias luteus”carachi amarillo” es como sigue: Para hembras - Estadio I.- Predominan los oogonios y los oocitos de primer orden. La pared de ovario aunque es delgada, en su mayor parte presenta zonas en las que se observa ligeramente engrasadas. Se aprecian espacios entre los lóbulos de tejido conectivo entre los lobulillos más o menos abundantes. - Estadio II.- Se aprecian oocitos II, así como algunos óvulos maduros, aunque se puede observar en los lobulillos oogonios y oocitos I en buen porcentaje. En este estadio se puede observar algunos folículos post – ovulatorios y folículos atrésicos, lo que indicaría que el espécimen ha desovado anteriormente y está en proceso de recuperación. - Estadio III.- Hay predominancia de óvulos maduros y oocitos II, El tejido conectivo se redujo, desplazado por los óvulos. En menor porcentaje se encuentran los oogonios y oocitos I. Se pueden encontrar algunos folículos atrésicos. - Estadio IV.- Predominan los óvulos maduros, pero se observan oocitos en todos los estadios, la pared del ovario se encuentra bastante adelgazada y el tejido conectivo parece desaparecer entre los óvulos maduros. - Estadio V.- Predominancia de los folículos post – ovulatorios y los folículos atrésicos, pero se pueden observar oocitos en todos los estadios de madurez. Para machos - Estadio I.- Podría denominarse como estadío de las células germinales por la predominancia de las mismas en los testes, al corte testículo presenta 4 ya una forma ligeramente de presa casi triangular; existe bastante tejido conectivo. - Estadio II.- Las células germinales dan origen a los espermatogonios, éstas se ubican en la base de los lóbulos, y por división dan origen a los espermatocitos I y II, éstas se ubican en la luz del lóbulo. Los espermatogonios y espermatocitos primarios se aprecian en cistos de la base de los lóbulos. También se pueden encontrar células germinales. - Estadio III.- Los espermatocitos secundarios dan lugar a los espermatocitos que se ubican en el centro de los lóbulos encontrándose espermatocitos II en cistos en la base de los lóbulos. Asimismo pueden encontrarse espermatocitos I y enpermatogonias e incluso células germinales primarias. - Estadio IV.- Se forman los espermatozoides a partir de los espermátides, los espermatozoides se ubican a la luz de cada lóbulo, por donde van a trasladarse hasta llegar por intermedio de los conductos al exterior. - Estadio V.- Presencia de lóbulos seminíferos vacíos en predominancia, observándose también espermatocitos en todos los órdenes. 2.4. ESTUDIO MICROSCÓPICO 2.4.1. Estructura y características microscópicas del testículo GALVEZ (1984) indica que la estructura y características microscópicas del testículo, son como siguen. En la observación microscópica (4X), de las láminas histológicas, se aprecian dos zonas notorias: 2.4.1.1. Zona periférica o corteza Donde se observan abundantes túbulos seminíferos con numerosas células germinales, que representan el parénquima testicular, que están separados por escasa cantidad de tejido conectivo. Los túbulos seminíferos se originan de la porción superficial a manera de sacos ciegos, teniendo disposición radial, dirigiéndose hacia el interior del órgano y uniéndose unos con otros en la zona central. 2.4.1.2. Zona central o médula Tiene apariencia clara y está formada por tabiques de tejido conectivo denso, que circunscribe a los conductos vasculares y conductos seminíferos, proyectándose hasta la cápsula de manera laxa. A) Estroma La cápsula y tabiques constituyen el estroma, que es un armazón de soporte formado por tejido conectivo, observándose de color verde con la coloración de tricrómica de Masson, de rosado con Van Giesson, y rojo con Hematoxilina Eosina. 5 B) Cápsula La cápsula en el testículo del “carachi amarillo”, es una capa que rodea en toda su extensión al testículo. Observado en cortes transversales y longitudinales, la cápsula esta formada por una membrana serosa y tejido conectivo que la envuelve en toda su amplitud proyectándose al interior de las cisuras, para formar pequeños lobulillos superficiales. C) Capa mesotelial La capa mesotelial está formada por una membrana serosa, delgada, constituida por células mesoteliales aplanadas cuyos núcleos son alargados, aplanados algo oscuros y adistanciados, que corresponden al peritoneo visceral del abdomen. D) Capa conjuntiva Se encuentra por debajo del epitelio de revestimiento visceral, fina y delgada formada por tejido conectivo laxo, que contiene capilares sanguíneos. Con la técnica de tricrómica de Masson, se observa de color verde. E) Tabiques Los tabiques se proyectan desde la porción profunda de la cápsula, hacia el interior del órgano, en forma de pequeños haces laxos de tejido conectivo que separan a los túbulos seminíferos. A medida que se proyectan al interior del órgano se van haciendo paulatinamente más densos, constituyendo tabiques que separan y envuelven conductos correspondientes a vasos sanguíneos y seminales. El tejido conjuntivo se condensa hacia el interior del testículo, similar a la anchoveta, como una masa de estroma que recorre el interior, estos tabiques se adosan a la cápsula por su pared interna formando multitud de septos, donde se acumulan y maduran los espermatocitos que canalizan hacia conductos testiculares, similar a lo descrito en el presente trabajo. El tejido conectivo laxo que se observa hacia la superficie testicular, estaría relacionado a la capilarización de los vasos sanguíneos para irrigar con mayor eficiencia y brindar el aporte nutritivo a los túbulos seminíferos; mientras que el tejido conectivo denso estaría localizado en la zona central del testículo, formando trabéculas con el objeto de constituir el sistema de sostén de la parte parenquimatosa. F) Parénquima Se llama parénquima, a las células conformantes del túbulo seminífero que tienen como función primordial la de generar los espermatozoides. 6 G) Túbulos seminíferos Los túbulos seminíferos presentan tres zonas bien definidas, por la presencia de células germinales en su lumen, con características morfológicas y tintoreales propias. 2.4.1.3. Zona superficial En esta zona los túbulos se originan de sacos ciegos de forma esférica y apariencia folicular, cuya luz ligeramente amplia repleta de células grandes dispuestas a manera de cordones. 2.4.1.4. Zona intermedia Es la continuación de la anterior; es una zona estrecha en cuyo lumen se encuentran células de menor tamaño que las anteriores pero con características similares. 2.4.1.5. Zona profunda Es una zona estrecha, en cuyas paredes se incrementa las células de Sértoli. El lumen contiene células intensamente coloreadas de forma arriñonada, que vienen a ser los espermatozoides, su pared es delgada y formada por tejido conectivo intertubular se amplia y se hace más laxo y contiene grupos de células de núcleos esféricos oscuros y citoplasma de aspecto granuloso y basófilo que corresponden a las células intersticiales de Leydig. Existiendo en el límite de este túbulo un cambio a epitelio simple que es el inicio de los conductos intratesticulares. 2.4.1.6. Estructura de los túbulos seminíferos En las diversas zonas, presentan las siguientes estructuras de afuera hacia dentro. A) Túnica propia Constituida de tejido conjuntivo laxo, con pocas células conjuntivas. B) Membrana basal Fina capa acelular , apenas notorio con la técnica de PAS. C) Capa interna Revestida por dos tipos de células: germinativas y de sostén. Las primeras conformadas por los espermatogonios que son células madres, están adosados a la membrana basal, presentan un núcleo esférico grande con cromatina condensada, exceso citoplasma acidófilo que lo rodea a manera de un halo, todas con las mismas características estructurales y tintoreales 7 Los espermatocitos I y II, están localizados en el centro del túbulo de la porción superficial, donde se aprecian los procesos de mitosis, tienen características tintoreales, diferenciándose por el tamaño del núcleo con las espermatogonias. Las espermátides se encuentran en una porción más profunda del túbulo, son células más pequeñas que las anteriores, núcleos esféricos coloreados un tanto mayor que los espermatocitos I y II. Los espermatozoides, se encuentran en la porción mucho más profunda del túbulo, con células intensamente coloreadas cuyos núcleos tiene forma de herraje , sus flagelos son difícilmente observables con las técnicas usadas. Las células de Sertoli o de sostén se presentan en escasa cantidad, uno a tres en cada túbulo caracterizados por un núcleo basilar vesiculoso claro y de cromatina laxa, algo pálidos, núcleo grande y abundante citoplasma, desplazados un tanto a la periferia. 2.4.1.7. Tejido intersticial Está formado por el tejido conectivo intertubular, es sumamente escaso en la superficie en donde se presentan a manera de tabiques entre los túbulos seminíferos, a medida que se proyectan hacia el interior aumentan de cantidad y se unen unos con otros para contener conductillo seminíferos mayores; hacia el centro se hacen bien manifiestos y forman una red alrededor de un conducto central, en este tejido conectivo se encuentran vasos sanguíneos, siendo las células intersticiales de Leydig más notorios en el centro que en la periferia. Células intersticiales Denominadas células de Leydig, son escasos a nivel de la zona externa del testículo, se encuentran formando grupos de células sumamente vascularizadas entre los espacios conectivos intertubulares, tiene forma poliédrica irregular, con núcleo esférico oscuro y citoplasma de aspecto granuloso y basófilo que contiene cromatina condensada periféricamente. Conductos intertesticulares En el testículo del “carachi amarillo” se presentan dos tipos de conductos intertesticulares. Conductos periféricos Son numerosos y se disponen formando una red intensa alrededor del conjunto central, tienen distribución radial. Estructuralmente están constituidos por un revestimiento interno de células planas que están envueltas a un manojo de haces de fibras colágenas y musculares lisas. Están acompañadas de vasos sanguíneos de pequeño calibre, que hacia la zona central corresponden al tipo de arteriolas y hacia la zona 8 superficial se capilarizan, en su luz contienen abundante cantidad de espermatozoides. Conducto central Es un conducto de luz amplia algo irregular que se proyecta a lo largo del testículo, en su trayecto va recogiendo tributarios de conductos periféricos; estructuralmente está constituido por las siguientes capas. Un epitelio, de revestimiento constituido de células aplanadas. Una parte notoria de tejido conectivo denso entremezclada con haces de fibras musculares lisas, en cuya porción periférica llegan tabiques de tejido conjuntivo entremezclados con fibras musculares. Este conducto se continua con el conducto extratesticular que llevan los espermatozoides hacia el interior. El lumen se amplía notoriamente en la zona central, lo que permite el almacenamiento y la conducción de espermatozoides, también encontramos un ligero incremento de músculo liso, que posiblemente favorecerá La expulsión de los espermatozoides por la contracción que este tejido realiza. 3. 3.1. ANATOMÍA Anatomía del tubo digestivo 3.1.1. La boca La boca es un ensanchamiento anterior del tubo digestivo con ciertas estructuras, sus paredes están reforzadas por un cierto número de piezas óseas aplanadas, constituyendo sectores o regiones tales como la bóveda del paladar, la vomeriana y la faríngea. Por sus adaptaciones y modalidad de captura de las presas dependen del ancho de boca, la profundidad de la boca se relaciona con el tamaño de la presa. La boca y los labios son ricos en terminaciones nerviosas sensitivas, variando enormemente según la implantación de los dientes, su morfología y número. La cavidad bucal está tapizada por un epitelio y enlazada a los huesos ó a los músculos por una dermis. Los dientes de los peces óseos se implantan sobre los huesos premaxilares (mandíbula superior) y dentarios (mandíbula inferior). En la boca encontramos la lengua, que es un órgano de forma diversa, prácticamente inmóvil. Unas veces de superficie lisa, otras veces de superficie granulosa o rugosa y a veces posee dientes. Su rol sería el de servir de piso a la cavidad bucal y contribuir a aplastar ligeramente el alimento voluminoso y algunas veces para colaborar en el proceso de englutirlo. La boca constituye, el comienzo del aparato digestivo. Está situada al extremo del hocico. 9 3.1.2. Las branquiespinas Son formaciones diversas en tamaño y forma, nacen en los arcos branquiales inmediatamente antes de la faringe. Ellas pueden presentar formas de tubérculos espinosos de conos delgados, de largas espinas e incluso de agujas o filamentos muy finos y ocupan en algunos casos, buena parte de la cavidad bucal. El rol de estos pequeños órganos tiene una importante relación con los procesos de alimentación: filtración en unos casos, masticación o presión de alimentos en otros. El rol de los branquiespinas en peces que se alimentan de zooplancton, especialmente pequeños crustáceos, el camino seguido por el alimento ingerido en los diferentes compartimientos digestivos. Hay una primera comprensión del alimento al nivel de almohadillas faríngeasbranquioespinas, luego deglutición hasta el estómago, enseguida una regurgitación u “ruminación” al mismo nivel faringe-branquio espinas y, finalmente, regresa al estómago y continuación normal del proceso digestivo. 3.1.3. La faringe La faringe es por lo general un sector anatómico poco diferenciado, que en realidad corresponde a la parte posterior de la boca, y menos dilatada en ella. Muchas veces se le reconoce por la presencia de los dientes faríngeos (almohadillas faringeas o placas masticatrices), que se presentan en la parte posterior de este vestíbulo. Las áreas de implantación de los dientes faríngeos inferiores son por lo general algo mas reducidas y aplanadas que las superiores. Por lo general estos dientes son algo curvos, móviles, generalmente caniniformes, de aspecto quitinoso y tamaño reducido. Su distribución dentro del área de implantaciones es bastante irregular 3.1.4. Esófago El esófago casi siempre es corto, recto y muy musculoso. Se inicia en la boca y termina en el cardias del estómago. - Es un sector más o menos tubular que une la faringe con el estómago. El esófago pone en comunicación la cavidad bucal con el estómago; es corto, recto y con paredes muy musculosas que permiten la dilatación en alto grado. Es raro encontrar que el esófago tenga otra función además de transporte de alimento. El esófago es tan dilatable que puede acomodar en su interior cualquier cosa que el pez haya tomado con la boca. El esófago es un tubo generalmente corto, con paredes gruesas y difícil de reconocer externamente. Cuando es menos dilatado que el estómago y, sobre todo, cuando se observa los pliegues internos, normalmente muy evidentes y paralelos en dirección longitudinal, puede haber certeza de haberlo localizado. En todo caso, no hay mayores variaciones de especie a especie. 10 3.1.5. Intestino Entre el estómago y el intestino suele existir un píloro; es un estrechamiento generalmente de tipo muscular a la entrada del intestino. El intestino se le subdivide en intestino medio e intestino posterior, pero esta delimitación es a menudo incierta o no existe en teleósteos. El límite entre los dos segmentos viene marcado por una o varias digitaciones, los ciegos; pero éstos no designan quizá siempre la misma línea de demarcación. El paso del intestino medio al intestino posterior puede estar también indicado por un espesamiento de la capa muscular, una válvula. Cuando se manifiesta la diferencia de diámetro, el intestino anterior puede oponerse como intestino delgado al intestino posterior o intestino grueso. El intestino posterior (grueso) de los peces es corto, rectilíneo y más estrecho que el intestino medio (delgado). El intestino de los peces, presenta una gran variabilidad en forma, longitud y estructura, dependiendo estas diferencias principalmente de la especie y del régimen alimentario del pez. En peces netamente carnívoros tienen por lo general un intestino simple, más o menos derecho y corto; en cambio el intestino de los herbívoros se presentan más bien algo replegados con curvas y es de gran longitud. El intestino de los peces es más o menos largo, según el tipo de régimen alimenticio, se presenta como un simple tubo sin dilatación posterior para formar después el colon. Este puede ser recto, signoide o espiral, todo ello en función de la forma de la cavidad abdominal (20). El intestino de los peces que se alimentan de vegetales alcanza una longitud que sobrepasa con mucho la del propio cuerpo. La mucosa del intestino delgado muestra pliegues longitudinales. Los conductos pancreáticos y colédoco hepático, para aquellos peces que carecen de vesícula biliar, desembocan en el primer tramo del intestino. También se encuentran en los apéndices pilóricos glandulares, pequeños sacos ciegos. Su número varía mucho de una especie a otra. En el interior del intestino puede haber pliegues diversos de orientación longitudinal u oblicua, a veces trasversal, otras en zig-zag o semejando pequeñas papilas. El intestino es rara vez rectilinio, pues en general tiene circunvoluciones más o menos numerosas, más o menos largas, dependiendo del espacio disponible en la cavidad abdominal. 3.1.6. Recto La abertura anal tiene su asiento en el tercio terminal del cuerpo, pero a veces puede situarse en posición muy adelantada, bien distante de la región caudal. 11 3.2. Glándulas anexas al tubo digestivo A) Hígado - Es grueso, voluminoso y rico en grasa. De la unión de los conductos hepáticos y císticos parte el conducto biliar que desemboca en el intestino. En caso de Orestias agassii “carachi negro”, el hígado es prominente, alargado y aplanado; localizado lateralmente hacia el lado izquierdo. El hígado de los teleósteos tiene considerable volumen en relación al cuerpo. Es de color marrón rojizo en las especies libres carnívoras y marrón claro en las especies herbívoras. La morfología comparada del hígado casi no merece comentario, puede ser simple como en muchos teleósteos. 3.3 Histología del tubo digestivo y órganos anexos 3.3.1 Cavidad bucal De los peces el epitelio es multiestratificada semejante a la epidermis. También es mencionado para “ispi” con un epitelio estratificado plano no queratinizado. Además se menciona también de un epitelio relativamente bajo, que contiene células mucosas ciliadas. Por debajo del epitelio se encuentra una sub mucosa de tejido conectivo laxo y una capa muscular formada por fibras estriadas longitudinales. En la casi totalidad de los peces el epitelio no contiene más que células sobretodo mucosas y serosas. 3.3.2 Esófago Se pueden encontrar invaginaciones denominadas papilas que aumentan la superficie interna, estos amplios pliegues longitudinales facilitan la ingestión de las partículas alimenticias y en algunas especies tropicales existen divertículos, ciegos, sacos esofágicos o dientes esofágicos. Estos repliegues son bastante limitados y que se presentan en el esfinter cardial. En el “ispi” en su tercio medio del esófago el lumen es amplio donde los pliegues se proyectan. A. Mucosa.- Su epitelio formada por un pluri estratificado ciliado para ciclóstomos y ciertos teleósteos, en otras especies con presencia de células mucosas y en forma general, presentan células cúbicas a veces ligeramente alargadas y formando rara vez un tejido pseudo estratificado pero en el caso del “ispi” presenta una transición de estratificado plano a estratificado cilíndrico. B. Sub mucosa.- Para diferentes especies de aspecto claro y bien desarrollado con sus regiones de tejido laxo y denso la existencia de haces de fibras musculares longitudinales reunidos en pequeños grupos son considerados como una muscularis mucosa. C. Túnica muscular .- Está formada solo por fibras estriadas circulares. D. Serosa.- Es una capa muy delgada limitada externamente por un mesotelio está formada por un tejido conjuntivo laxo en algunos vasos sanguíneos y a veces se puede encontrar nódulos linfáticos. 12 3.3.3 Estómago Para algunas especies el estómago es de tamaño reducido pero sus paredes son gruesas y musculosas, el tejido interior también está reforzado con tejido conectivo y la luz o lumen está muy reducido. Además se ha encontrado una estructura histológica casi idéntica en la región cardial y fúndica . A. La mucosa.- Está formada por una sucesión de pliegues que sobresalen en la luz del órgano y que alternan con invaginaciones profundas que constituyen las criptas estomacales. El límite esófago y estómago está marcado típicamente por el brusco reemplazamiento del epitelio pluri estratificado por un epitelio simple, mucoso cilíndrico o prismático y por la aparición de células ó de glándulas gástricas. Las células cilíndricas están dispuestas en la región apical de los pliegues, los otros tipos de elementos de esta región como son las células caliciformes están dispuestas al nivel del cuello de las criptas. Estudios citológicos de los peces afirman que en el estómago las glándulas gástricas tienen un tipo celular único que llegan hasta la muscularis mucosae, que se hallan en la base de los pliegues. En el “ispi” no presenta contricciones correspondientes al cardias y al píloro, la mucosa revestida por un epitelio estratificado cilíndrico ciliado con células calisiformes escasas, células cilíndricas secretoras, no secretoras y células basales. Peces y anfibios no tienen más que un tipo de células gástricas con glándulas acidófilas secretoras a la vez de ácido clorhídrico y de enzimas ó de sus precursores. B. La muscular.- La túnica muscular está exclusivamente formada por fibras lisas. 3.3.4 El intestino Histológicamente en un corte transversal del intestino se observa un número de diferentes vellosidades. A. Mucosa.- En la mucosa intestinal dentro de su epitelio se puede descubrir dos tipos de células: unas, constituidas por un epitelio columnar ó cilíndrico que tapiza todas las vellocidades y otras son células caliciformes, dispersas entre las células del epitelio columnar. En otros se menciona que el epitelio esta formado por un estratificado mucoso. B. La sub mucosa.- Esta penetra en las vellosidades para separar las capas epiteliales y forma una lámina propia observándose en estas fibras conjuntivas fibrocitos capiliares sanguíneas y a veces nódulos linfáticos además se menciona de un tejido conectivo elástico muy vascularizado, cargada de células eosinófilas limitada por una capa densa que es denominada muscularis mucosae. Pero los teleósteos carecen de muscularis mucosae típica poseen a menudo un estrato muscular liso subepitelial. Asimismo para peces pequeños como el “ispi” no presenta muscularis mucosae. 13 C. La túnica muscular.- La constituyen fibras musculares lisas donde la capa externa es longitudinal y la interna circular. Entre las dos capas musculares se encuentra el plexo mioentérico ó Avervach, denominado simplemente plexos nerviosos. La túnica serosa no presenta características particulares salvo que son menos importantes en el espesor de estas. 3.3.5 Recto El recto tiene una pared muscular más gruesa que la del intestino, con una túnica interna muy rica en glándulas mucosas y una enorme capacidad de distensión. 3.3.6 Glándulas anexas A. Hígado.- La histología del hígado de los peces difiere a la de los mamíferos en que los hepatocitos tienen mucho menor tendencia de dispersarse en cordones o lóbulos. Histológicamente en los peces se puede notar una capa mesotelial que recubre el órgano y un parénquima con pequeños canales, vénulas y arteriolas de diverso tamaño y forma, también es estudiado bajo dos estructuras básicas que es el estroma y parénquima, donde la primera está constituida por la cápsula y el tejido conectivo intersticial además el parénquima hepático representado por las células hepáticas presenta un corte más ó menos poligonal, para el caso del “ispi” los cordones son desordenados de células hepáticas de forma poliédrica. Los hepatocitos tienen base ancha y ápice angosto que mira hacia el canalículo biliar a menudo rodeado de 4-5 células Asimismo para otras especies son núcleos pequeños y redondeados. Los sinusoides se encuentran en menor número e irregularmente distribuido dentro de los hepatocitos y están revestidos por células epiteliales con núcleos muy prominentes. En algunas especies se encuentra tejido pancreático mezclado con el hepático pero guardando su independencia funcional. B. Páncreas.- El tejido pancreático tiene una localización mucho más variable que otras viseras abdominales se encuentra diseminado y los lugares preferentes de su emplazamiento incluyen los islotes secretores dispersos, entre las células adiposas de los sesos pilóricos del mesenterio, el revestimiento capsular del baso la capa externa que rodea la vena porta hepática. IV. HISTOLOGÍA DEL APARATO REPRODUCTIVO EN Orestias luteus “CARACHI AMARILLO” 4.1. En hembras Los ovarios al igual que los testículos son órganos impares internos ambos entre sí, encontrándose suspendida a ambos lados de la cavidad del cuerpo, por un par de mesenterios denominados mesovarios. Estos se encuentran típicamente situados por debajo de los riñones y la vejiga natatoria. 14 El tamaño y extensión que ocupa en la cavidad del cuerpo varía con el estado de madurez de la hembra, cuando maduros los ovarios pueden ocupar el 70% de la cavidad del cuerpo. El color varía del rosado pálido, en los juveniles, el amarillo cuando están madurando y hasta anaranjado cuando están desarrolladas. La textura y aspecto varía desde flocular en los inmaduros, finalmente granular, en los que están madurando, hasta el fuertemente granular cuanto son plenamente desarrollados. La parte del ovario está constituida con una capa externa de tejido conectivo, una capa pigmentada y una capa muscular. Estas capas no están distintamente separadas una de la otra. 4.2. En machos El testículo de Orestias luteus “ carachi amarillo” son órganos impares internos alargados, ligeramente aplanadas y suspendidos en la cavidad celómica por mesenterios de la pared dorsal del abdomen, llamados mesorquios. El testículo es de color blanco cremoso y de consistencia fiable, presentan una cara ventral y una dorsal, la cara dorsal de forma cóncava orientados hacia arriba, estando muy estrecho contacto con la vejiga natatoria, y la cara ventral ligeramente convexa, extremo, agudo de la parte anterior y posterior, separado por un surco longitudinal y pliegue peritonial dorsal poco profesional dorsal poco profundo. Presenta tres caras: dorsal, ventro lateral derecho y ventro lateral izquierdo. V. FECUNDIDAD EN Orestias luteus “CARACHI AMARILLO” 1. El Orestias luteus “carachi amarillo”, es de alta potencialidad reproductiva, cuya moda más pronunciada es de 152 mm correspondiente al sexo hembra, para el sexo macho la moda más acentuada es de 132 mm de marca clase. 2. La fecundidad regresionada (número de óvulos) es dependiente del peso gonadal, peso del pez, finalmente de la longitud total del pez, cuyas ecuaciones son: Valores correspondientes a los meses de febrero y marzo. Peso gonadal – fecundidad : Y = 6.2 – 809.3x Peso total – fecundidad : Y = 48.8 – 809.8x Longitud total – fecundidad : Y = 32.2 – 808.3x Valores correspondientes al mes de agosto. Peso gonadal – fecundidad : Y = 12.9 – 1252.3x Peso total – fecundidad : Y = 82.9 – 1241.7x Longitud total – fecundidad : Y = 138.7 - 1251.7x 3. Las tallas más frecuentes fluctúan entre 97 – 152 mm. de longitud total en ambos sexos. 4. La proporción sexual es de 1:1 en los meses estudiados en enero, febrero, marzo, julio, agosto. 15 5. El peso promedio para la población muestreada es de 43.6 gr para la hembra es de 46.3 gr, y para el macho es de 37.4 gr correspondiente a los meses de enero – marzo y para los meses de julio – agosto la población muestreada es de 45.0 gr para el sexo hembra es de 48.8 gr por tanto para el sexo macho es de 34.7 gr se estudiaron 250 especímenes de los cuales 104 fueron hembras, y 146 machos, los cuales motivaron no dar conclusiones definitivas. VI.- ALIMENTACIÓN SARMIENTO et al., (1987) menciona para la Orestias luteus “carachi amarillo” que su dieta esta conformada principalmente por organismos bentónicos en tres épocas de estudio, haciendo un promedio en número 96.32% y en volumen de 97.54% (ver cuadro Nº 03). Dentro de este grupo el constituyente mas importante son los anfípodos, las tres épocas de estudio con un promedio número de 75% y en volumen 93.9%; seguido de larvas de chironómidos es consumido, en la época de invierno seco con un porcentaje número de 8.15% y en volumen 2.05% y en época con un porcentaje frecuencial 24.57% y un 1.09%; ostrácoda solo es importante en la época de lluvia con un porcentaje en número 19.44% y en volumen 2.27%, tiene una preferencia por moluscos (pelecípoda, planorbis y littoridina) siendo el mas importante esta última, que se hace presente con mayor frecuencia en la época transitoria con un porcentaje número del 10.97%, representando en volumen traza alimenticia; los huevos de pez solo han sido consumidos en la época invierno seco con un porcentaje en número de 6.27% que se ha presentado en volumen trazas alimenticias. El zooplancton y grupo terrestre no son importantes; el grupo nectónico se hace presente solo en la época transitoria y con único representante corixidae representa en número un porcentaje de 2.37% y en volumen de 4.85%. En conclusión Orestias luteus “carachi amarillo” es una especie de hábitos alimenticios bentónicos carnívoros y con una dieta no muy diversificada (estenofaga), el 94% de su alimento está constituido por anfípoda y muy poco por pelecípoda, planorbis y littoridina que solo hacen presentes en las épocas de invierno seco y transitoria. Sin embargo, RAMÍREZ (1977) encuentra que el constituyente más importante en la dieta de esta especie está dado por moluscos (littoridina, tropicorbis, taphius) y la clase pelecípoda representa en total un porcentaje en número de 44.1% y en volumen de 49.2%, seguida por anphípoda que representa el 31% tanto en números como en volumen. Esta diferencia de preferencia en alimento se podría deber a que en la zona donde se realizó el trabajo ha existido escaso número de moluscos lo que no significa que Orestias luteus “carachi amarillo” no tenga preferencia por este grupo, ya que presenta dientes faringeos robustos que le permite la trituración de sus conchas LAUZANNE (1982). En cuanto al zooplancton no juega ningún papel importante en la alimentación de esta especie pudiendo haber sido chirodus ingerida por casualidad con otros alimentos. RAMÍREZ (1977) encuentra como constituyente alimenticio a algas filamentosas, indicando también que podrían haber sido ingeridos por casualidad junto con los huevos que se encuentran adheridos a la vegetación sumergidos; también encontró en el contenido estomacal de esta especie un “ispi” hecho que no se ha verificado. 16 CUADRO Nº 03 CONTENIDO ESTOMACAL DE Orestias luteus “CARACHI AMARILLO” POR ÉPOCAS OJERANI, BAHIA DE PUNO - LAGO TITICACA 1984-1985 Promedio Inv. Seco Transitorias Lluvias Organismos anual %F %D %F %D %F %D %F %D I.- BENTÓNICOS Amphípoda Larva Chiromidae Ostracoda Pelecípoda Littoridina Planorbis ovas de pez ninfa de Odonata pupa Díptero II.- ZOOPLANCTON Chidorus III.- TERRESTRES Chironomidae A Díptero A IV.- NECTÓNICO 97.69 76.21 8.15 2.37 0.81 0.81 2.66 6.28 --0.40 0.66 0.66 1.65 1.65 ----- 98.84 91.97 2.05 0.27 3.56 0.42 0.07 0.40 --0.10 ----1.13 1.13 ----- 96.82 74.13 4.57 1.15 2.60 10.97 2.27 --1.13 ------0.76 --0.76 2.37 93.95 92.37 1.09 0.06 0.02 0.03 0.01 --0.37 ------1.18 --1.18 4.85 94.45 75.01 --19.44 ------------5.55 5.55 --------- 99.83 97.56 --2.27 ------------0.17 0.17 --------- 96.32 ------------------2.07 2.07 0.84 ----0.79 97.54 ------------------0.05 0.05 0.77 ----1.61 FUENTE: SARMIENTO et al., 1987 VII.- DISTRIBUCIÓN GEOGRÁFICA El rango de conocido de Orestias se extiende desde la provincia de Ancash, al norte del Perú, hasta Antofagasta, en Chile (09º a 22º Latitud Sur). Es endémico de los lagos y corrientes de los Andes peruanos, bolivianos y chilenos, más de la mitad de las 43 especies conocidas son endémicas de la cuenca cerrada del Titicaca y de aquellas 23 existen solo en el lago Titicaca. De las 3 subdivisiones que comprende el lago, la mayoría de especies pertenecen solo a las 2 secciones más pequeñas (lago menor y bahía de Puno), desconociéndose aún si éstas representan la verdadera distribución de Orestias en el lago o meramente la facilidad de su colección. Las mayores densidades relativas de su población, en orden de importancia, se encuentran en los lagos: Titicaca (Perú Bolivia), Junín (Perú) y Poopo (Bolivia), lagunas y ríos aledaños. En los tramos superiores de los ríos, su distribución altitudinal llega hasta los 4299 m.s.n.m., pudiendo vivir en riachuelos y charcos de muy escasa profundidad y mínimo contenido de oxígeno. En 1979 se descubrió Orestias en 3 pequeños lagos al Noreste de Lima, lo que reveló no sólo la presencia de 2 nuevas especies sino también la posibilidad de que puedan encontrarse Orestias en los numerosos lagos pequeños que caracterizan el sur de los Andes ecuatorianos PARENTI (1984) citado por SARMIENTO et al. (1987). 17 Instituto de Investigación, Producción, Servicios y Capacitación “Qollasuyo” Centro de Investigación y Producción Pesquera Chucuito UNA – Puno SINOPSIS BIOLÓGICA DE Orestias ispi “ispi” Equipo Profesional de la Asoc. IIP Qollasuyo – CIPP Chucuito PUBLICACIONES QOLLA Nº 03 Noviembre AÑO 2000 PUNO – 2000 – PERÚ 0 I . SISTEMATICA Esta especie es conocida en todas las zonas que habita con el nombre de “ispi”. La especie esta situada dentro de la siguiente posición taxonómica: LAUZANNE (1981) y STORER (1961): PHYLLUM ............................ Chordata SUB-PHYLLUM ................... Vertebrata SUPER-CLASE ................... Pisces CLASE ................................. Osteichthyes SUB-CLASE .......................... Actinopteygii SUPER-ORDEN .................... Teleostei ORDEN ................................. Cyprinodontiformes FAMILIA ................................ Cyprinodontidae SUB-FAMILIA .......................... Orestiinae GENERO ....................................Orestias ESPECIE ....................................Orestias ispi Lauzanne, 1981 NOMBRE COMÚN ................... “ispi”. El holotipo (MNHN 1981; 605) un ejemplar macho adulto, 62 mm LS., colectado el 15/10/79, en el estrecho de Tiquina, lago Titicaca. Orestias ispi ”ispi”, es uno de los mas alargados de Orestiinae (F/A: 18-24%). El cuerpo es muy comprimido (G/A: 10-15%) y la cabeza es pequeño (B/A: 2226%) y estrecho (N/B: 41-53%), la mandíbula forma con la línea inferior de la cabeza un ángulo generalmente algo superior a 90 ºC, excepto en los especímenes mas grandes, en los que el ángulo puede ser inferior a 90 ºC. CLAVE PARA RECONOCIMIENTO DEL “ISPI” (LAUZANNE, 1982) 1.- I/H 48% ----------------------------------------------------- 2 2.- número de escamas 29 - 53 número de vértebras 30 - 34 branquiespinas no ramificados Q/B 24% -------------------------------------------------- 3 3.- Presencia de escamas sobre el vientre B1 : 18 - 21 -------------------------------------------- 4 4.- I/A: 08 – 11% G/A : 10 – 14% N/A : 09 - 12% F/A : 18 – 24% Mentón muy anguloso Color plateado ----------------------------------------------- O. ispi Los símbolos usados en la clave significan: I/A : Altura del pedúnculo caudal en relación a la longitud estándar. I/H : Altura del pedúnculo caudal en relación a su longitud. B/A : Largo de cabeza en relación a la longitud estándar. F/A : Altura del cuerpo en relación a la longitud estándar. G/A : Ancho del cuerpo en relación a la longitud estándar. C/A : Extremo del hocico – base de la dorsal en relación a la longitud estándar. N/A : Ancho de la cabeza en relación a la longitud estándar. N/B : Ancho de la cabeza en relación a su longitud. Q/B : Diámetro del ojo en relación a la longitud estándar. B1 : Nº de branquiespinas sobre la parte externa del primer arco branquial. H/A : Longitud del pedúnculo caudal en relación a la longitud estándar. 1 II. MORFOLOGÍA Y ANATOMÍA 2.1. Descripción de Orestias ispi “ispi” Presenta cuerpo alargado, protegido por escamas ctenoidea, pedúnculo caudal con puntos negros y redondeados. La coloración del cuerpo es dorado negrusco; con predominancia de puntos de color marrón y negro, hasta la línea lateral, la parte ventral es de color blanco y los flancos de color plateado con escasas puntuaciones, entre las líneas lateral y ventral. La forma de la cabeza es triangular de color marrón oscuro, boca protráctil con la mandíbula inferior ligeramente sobresaliente. Posee dos aletas pectorales, una dorsal posterior, una anal y otra caudal; cabe señalar que tanto la aleta anal como la dorsal se encuentran a la misma altura. Otra característica merística importante es el numero de radios en las aletas: Pectoral ..................... 16 a 17 Anal ........................... 15 a 16 Dorsal......................... 12 a 13 Las escamas son muy finas y presentan estrías coricéntricas, ubicadas en la parte media ventral y regularmente dispuestas incluso en la parte anterior su número (42 – 53) en línea longitudinal. El número de branquiespinas es 17 a 19. El aparato digestivo inicia en la boca con premaxilar y maxilar protráctil provisto de dientes pequeños; posee una lengua pequeña y lisa, a los lados de la cavidad buco-faringea se encuentran las branquias. A partir del esófago no existe un estomago propiamente dicho, sino que mas bien, le sigue una región mas dilatada del intestino que termina en un ciego pilórico con una curvatura poco distinguible, se continua con el intestino de mayor longitud que la cavidad celómica y que se repliega en el interior. El hígado voluminoso es de color rojizo, además aquí se encuentra la vesícula biliar casi esférica y de color verde amarillento. El corazón pequeñísimo se halla situado cerca de la cavidad opercular. 2.2. Longitud En el cuadro Nº 01, se tiene la distribución de frecuencia de longitudes de Orestias sp “ispi” por sexo, en número y porcentaje en las distintas clases de tamaños agrupados cada 5 mm de longitud total; donde se puede observar que el mayor porcentaje de ejemplares capturados se encuentra entre 80 y 99 mm en hembras (79.69%), en cambio en machos el mayor porcentaje esta comprendido entre 55 y 84 mm. lo que demuestra que las hembras tienen una mayor talla que los machos (82.96%); por lo que podemos concluir que, existe diformismo sexual en cuanto a talla, puesto que los machos son mas 2 pequeños que las hembras. La talla promedio de la especie es de 86 mm. concentrándose en el mayor porcentaje (43.17%) entre 85 y 94 mm. La distribución por tamaños para sexo, se aprecia que las longitudes extremas fluctúan entre 55 y 114 mm de longitud total. CUADRO Nº 01 PORCENTAJES DE LAS FRECUENCIAS DE LONGITUDES DE Orestias ispi “ISPI” 1984 Long. Total HEMBRAS MACHOS TOTAL en mm. N % N % N % 55 – 59 60 – 64 65 – 69 70 – 74 75 – 79 80 – 84 85 – 89 90 – 94 95 – 99 100 – 104 105 – 109 110 – 114 TOTALES 6 1.17 16 3.13 10 1.95 34 6.64 73 14.26 123 24.02 130 25.39 82 16.02 28 5.47 9 1.76 1 0.19 512 100.00 Moda : 92 mm Promedio : 89 mm 8 15 20 11 10 9 4 2 2 4 2 1 88 9.09 8 1.33 17.05 21 3.50 22.73 36 6.00 12.50 21 3.50 11.36 44 7.33 10.23 82 13.67 4.55 127 21.17 2.27 132 22.00 2.27 84 14.00 4.55 32 5.33 2.27 11 1.83 1.14 2 0.33 100.00 600 100.00 Moda : 67 mm Moda : 92 mm Promedio : 74 mm Promedio : 86 mm Fuente: Cruz, 1984. Medidas de longitudes de Orestias ispi “ispi” a/b = Longitud total a/d = Longitud estándar a/c = Longitud a aleta pectoral 3 2.3. Peso En el cuadro Nº 02, para un total de 600 individuos se muestra el peso promedio por sexo y total; siendo para los machos el peso de 6.8 gr y para hembras 7.6 gr. CUADRO Nº 02 RELACIÓN LONGITUD-PESO DE Orestias ispi “ISPI” (1984) Longitud Total mm. MACHOS Peso Promedio N gr. 55 – 59 60 – 64 65 - 69 70 - 74 75 - 79 80 - 84 85 - 89 90 - 94 95 - 99 100 - 104 105 - 109 110 - 114 PROMEDIOS 2.0 2.3 2.9 3.6 3.9 6.0 6.2 6.6 8.2 10.8 12.3 16.6 6.8 HEMBRAS Peso Promedio N gr. 8 15 20 11 10 9 4 2 2 4 2 1 3.1 3.9 4.1 5.8 6.3 6.8 7.9 8.9 10.8 11.7 12.7 7.6 TOTAL Peso Promedio N gr. 6 16 10 34 73 123 130 82 28 9 1 2 2.5 3.5 3.8 4.9 6.2 6.6 7.5 8.8 10.8 11.9 14.7 6.9 8 21 36 21 44 82 127 132 84 32 11 2 Fuente: Cruz, 1984. 2.4. Relación longitud – peso Para la relación longitud-peso el coeficiente de correlación para machos es r = 0.9892, para hembras r = 0.9941 y el total tiene una correlación de r = 0.9968; lo que indica que existe una correlación alta entre longitud y peso, es decir a mayor longitud mayor peso. La ecuación de regresión para peso en función de longitud es: P = 0.00002l L2.84; con una R 2 = 99.35% De acuerdo a esta ecuación podemos afirmar que no se cumple la ley del cubo en esta especie, se podría deber al desarrollo irregular del cuerpo, cuyo índice de incremento total es x = 2.84, arrojando diferentes valores por sexo. La ecuación de regresión para machos es: P = 0.0000082 L3.04; con una R2 = 97.89% y para hembras es: P = 0.000162 L2.39; con una R 2 = 98.82% 4 III .- REPRODUCCIÓN 3.1. Madurez sexual El macho presenta un testículo de forma alargada y la hembra presenta un ovario. El testículo y ovario se conectan con el orificio genital de ambos órganos sexuales. La progresión de los estadios de maduración sexual de Orestias ispi “ispi” para hembras en función del tiempo se presenta en el cuadro Nº 03, observándose que la madurez sexual del estadío I se presenta entre febrero a junio, decreciendo de marzo a mayo para luego ausentarse. Para el estadío II se mostró índices altos entre los meses de marzo a julio. CUADRO Nº 03 PROGRESIÓN DE LOS ESTADIOS DE MADUREZ SEXUAL Orestias ispi “ISPI” PARA HEMBRAS (1984) MESES FEBRERO MARZO ABRIL MAYO JUNIO JULIO TOTALES I % 7.86 1.22 2.22 1.26 4.94 2.93 II % 10.11 19.51 12.22 6.33 6.17 21.97 12.89 III % 12.36 13.41 5.55 7.59 13.58 13.19 10.94 IV % ESTADIOS V % 14.61 14.63 15.56 22.78 19.75 20.88 17.97 17.98 15.85 27.78 26.58 22.22 28.57 23.24 VI % VII % 21.35 7.32 10.00 16.45 14.81 9.89 13.28 15.73 28.05 26.67 18.99 18.52 5.49 18.75 TOTALES % 100.00 100.00 100.00 99.98 99.99 99.99 100.00 Fuente: Cruz, 1984. 3.2. Longitud a la primera madurez En el cuadro Nº 04, se presentan los resultados y curvas de los porcentajes del estadío II con respecto a la suma de los estadíos I y II, los mismos que han sido agrupados cada 5 mm de longitud total. En el gráfico Nº 01, se observa que la longitud promedio a la cual el 50% de la población para machos alcanza su madurez a los 64.5 mm de longitud, pudiendo presentarse individuos sexualmente inmaduros hasta los 92 mm y en las hembras el 50% de la población alcanza su primera madurez a los 74.0 mm de longitud, pudiendo presentarse individuos hasta los 107 mm como casos aislados. 5 Gráfico Nº 01 Longitud a la primera madurez para Orestias ispi "ispi" Porcentaje acumulado 100 90 80 Machos Hembras Total 70 60 50 40 30 20 10 0 57 62 67 72 77 82 87 92 97 10 Longitud del Pez (mm) Fuente: Cruz, 1984 CUADRO Nº 04 LONGITUD A LA PRIMERA MADUREZ DE Orestias ispi “ISPI” (1984) Longitud Total en mm I II I + II 60-64 65-69 70-74 2 - 1 2 3 2 75-79 80-84 85-89 90-94 95-99 100-104 - 1 1 1 - 105-109 - - MACHOS POBLACIÓN MUESTRAL HEMBRAS % II I II I + II %II I II I + II 37.5 37.5 62.5 3 4 1 1 7 2 1 1 1 - 75.0 75.0 87.5 100.00 - 3 3 1 1 - - - - % II 4 11 3 5.0 18.5 22.2 5 4 1 2 7 4 7 11 5 7.9 20.2 25.8 12 17 18 2 6 15 20 19 2 6 40.7 65.4 88.9 88.9 91.3 98.8 3 3 1 - 13 17 19 1 2 6 16 20 20 1 2 6 1 1 100.0 - 1 1 43.8 66.2 88.8 89.9 92.1 98.9 100.0 0 Fuente: Cruz, 1984 3.3. Longitud al primer desove En el gráfico Nº 02, se puede observar que el 50% de la población de machos alcanzan su primer desove a los 69.5 mm de longitud y el 50% de las hembras alcanzan su primer desove a los 89 mm de longitud. En el cuadro Nº 05 y gráfico Nº 02, para machos y hembras se observa que la longitud promedio para el 50% de la población que alcanza el primer desove es a los 86 mm de longitud, a partir de esta talla se va incrementando el número de ejemplares y es cuando a los 112 mm el 100% de los individuos han desovado por lo menos una vez. 6 CUADRO Nº 05 LONGITUD AL PRIMER DESOVE EN Orestias ispi “ISPI” (1984) Marca Long mm de Por clase Clase (mm) 55-59 60-64 65-69 70-74 75-79 80-84 85-89 90-94 95-99 100-104 105-109 110-114 TOTALES MACHOS 57 62 67 72 77 82 87 92 97 102 107 112 % Acum. F % 1 7 4 5 5 4 1 1 1 29 3.45 24.14 13.79 17.24 17.24 13.79 3.45 3.45 3.45 POBLACIÓN MUESTRAL HEMBRAS 3.45 27.59 41.38 58.62 75.86 89.65 93.10 93.10 93.10 96.55 96.55 100.00 F % % Acum. 1 1 5 18 20 19 3 1 68 1.47 1.47 7.35 26.47 29.41 27.94 4.41 1.47 - 1.47 1.47 2.94 10.29 36.76 66.17 94.11 98.52 100.00 - F 1 7 5 5 6 9 19 20 19 4 1 1 97 % 1.03 7.22 5.15 5.15 6.19 9.28 19.59 20.62 19.59 4.12 1.03 1.03 % Acum. 1.03 8.25 13.40 18.55 24.74 34.02 53.61 74.23 93.82 97.94 98.97 100.00 Fuente: Cruz, 1984 100 80 60 Machos Hembras Total 40 20 112 107 102 97 92 87 82 77 72 67 62 0 57 Porcentaje acumulado Gráfico Nº 02 Longitud al Primer Desove en Orestias ispi "ispi" Longitud del Pez (mm) Fuente: Cruz, 1984 3.4. Fecundidad En el cuadro Nº 06, se ofrece los modelo de regresión lineal de la fecundidad en función de la longitud del ovario, peso del pez, longitud del pez y peso del ovario; así como sus correspondientes correlaciones y coeficientes de correlación. Los coeficientes de correlación nos indican que existe un alto porcentaje de correlación entre la fecundidad y la longitud del ovario (r= 0.98861), y del mismo modo existe una alta correlación entre fecundidad y longitud del pez (r=0.98179) la correlación entre fecundidad y longitud del pez es de (r=0.97500) y la correlación entre la fecundidad y el peso del ovario es de (r=0.95727); estas dos últimas correlaciones son menores a las primeras, sin embargo existe una buena relación entre variables. 7 Las ecuaciones de regresión que se consideran en el cuadro Nº 06 pueden ser usadas indistintamente para calcular la fecundidad, esto si se considera los coeficientes de determinación que se expresan en el mismo cuadro. CUADRO Nº 06 REGRESIÓN Y CORRELACION PARA FECUNDIDAD EN Orestias ispi (1984) VARIABLE a b r R2 INDEPENDIENTE Longitud del ovario -293.15410 30.14262 0.98861 97.73% Peso del pez 8.92158 38.02738 0.98179 96.39% Longitud del pez -474.49000 8.93667 0.97500 95.06% Peso del ovario -4.03409 269.59091 0.95727 91.64% Fuente: Cruz, 1984 3.4.1. Relación de longitud del pez-fecundidad Esta relación fue determinada en base a 68 ovarios del estadio VI el mismo que está representado en el gráfico Nº 03. Nº de óvulos GRÁFICO Nº 03 RELACION LONGITUD DE PEZ Y FECUNDIDAD 500 450 400 350 300 250 200 150 100 50 0 62 67 72 77 82 87 92 97 102 107 112 Longitud en mm Fuente: Cruz, 1984 En el cuadro Nº 07, se puede apreciar que existen variaciones no tan alejadas en lo referente a la fecundidad real y teórica. Podríamos atribuir esto al método utilizado para los cálculos, para este parámetro se calculó el coeficiente de correlación, que es: r = 0.97500 y el coeficiente de determinación es : R 2 = 95.06%; Estos valores nos indican que existen una alta correlación entre la longitud del pez y el número de óvulos producidos. La ecuación de regresión de fecundidad en función de la longitud del pez está dado por la siguiente ecuación: F = - 474.49 + 8.93667(L) Donde: F= Nº de óvulos L= Longitud del pez. 8 CUADRO Nº 07 RELACION ENTRE EL NUMERO DE ÓVULOS OBSERVADOS Y CALCULADOS EN Orestias ispi “ISPI” (1984) Longitud Del pez mm. 65-69 70-74 75-79 80-84 85-89 90-94 95-99 100-104 105-109 Fecundidad Real Teórica 102 174 245 256 332 332 337 445 504 124 169 213 258 303 345 392 437 481 Peso del Pez gr Fecundidad 3.0 4.5 6.0 7.1 7.2 7.9 9.1 11.4 13.4 Real Teórica 102 174 245 256 332 332 337 445 504 123 180 237 279 284 309 355 442 518 Long del ovario (mm) Fecundidad Real 13 15 18 19 20 21 22 24 26 Teórica 91 174 246 277 308 338 369 431 493 99 159 249 280 310 339 370 430 491 Peso del Fecundidad ovario gr Real Teóric a 0.6 0.65 0.7 1.0 1.1 1.3 1.4 1.7 1.8 157 174 184 265 292 346 373 454 482 158 171 185 266 293 346 373 454 481 Fuente: Cruz, 1984 3.4.2. Relación entre peso del pez y la fecundidad El ajuste con una regresión lineal dan valores teóricos muy ajustados a los reales, con una correlación de r = 0.98179 y R2 = 96.39% y una ecuación de: F = 8.92158 + 38.02738(x) 3.4.3. Relación longitud del ovario- fecundidad En el cuadro Nº 07 y gráfico Nº 04, se observa la relación longitud del ovariofecundidad, que corresponde a los 68 especímenes, no se observa variaciones tan significativas entre la fecundidad real y teórica determinándose a continuación el valor de r = 0.98861 y R 2 = 97.73%. La ecuación de regresión es: F = - 293.15410 + 30.14262(x) G r á fic o Nº 0 4 R E L AC IÓN L ON GIT U D D E L OV AR IOFE C U N D ID AD Fecundidad en cientos de óvulos 50 0 45 0 40 0 35 0 30 0 25 0 20 0 15 0 10 0 50 0 13 15 17 19 21 23 25 27 L o ng itu d d el p ez en mm. Fuente: Tes is Lic . en B iología UNA-P uno 1984. Julio C ruz 9 3.4.4. Relación peso ovario-fecundidad El cuadro Nº 07 y gráfico Nº 05, podemos apreciar que la variación existente para pesos reales con los teóricos no es tan distante el uno del otro; calculando el coeficiente de correlación dio un valor de r = 0.95727 y R2 = 91.64%, quiere decir que el 91.64% es explicable por la variación del peso gonadal. La ecuación de regresión a partir de la cual se puede calcular la fecundidad en función del peso del ovario es: F = - 4.03409 + 269.59091(x) Gráfico Nº 05 Fecundidad en cientos de óvulos RELACIÓN PESO DEL OVARIO-FECUNDIDAD 500 400 F=2.41+1.13x 300 200 100 0 1 2 Peso en gramos Fuente: Tesis Lic. en Biología UNA-Puno 1984. Julio Cruz Realizando el análisis de varianza, para las relaciones peso del ovariofecundidad, longitud del Pez-Fecundidad, en la se observa valores altamente significativos, tal como se puede observar en los cuadros 08 y 09 respectivamente. CUADRO Nº 08 ANALISIS DE LA VARIANZA PARA LA RELACIÓN LONGITUD DEL OVARIO-FECUNDIDAD DE Orestias ispi “ISPI” (1984) F. DE V. Regresión Error TOTAL G.L . 1 6 7 SC 0.31007 0.00743 0.31750 CM 0.31007 0.00124 FC 250 ** Ft 0.05 5.99 Fuente: Cruz, 1984 ** Altamente significativo CUADRO Nº 09 ANALISIS DE VARIANZA PARA LA RELACION PESO DEL PEZFECUNDIDAD DE Orestias ispi “ISPI” (1984) F. DE V. G.L. SC CM FC Ft 0.05 Regresión Error TOTAL 1 6 7 0.30620 0.01130 0.31750 0.30620 0.00188 16.29 ** 5.99 Fuente: Cruz, 1984 ** Altamente significativo 10 IV.- HABITAT El género Orestias abarca la zona andina desde 9º a 22º Latitud Sur, por lo que se considera que son peces endémicos del lago Titicaca. El hábitat de Orestias ispi “ispi” es la zona pelágica, realizando migraciones por épocas o zonas de litoral (época de desove) y mas profunda en busca de alimento. Es una especie que prefiere el zooplancton; desplazamiento en cardúmenes, extendiendo en mayor número las hembras con respecto a los machos. V .- DISTRIBUCIÓN GEOGRÁFICA Esta especie se halla distribuida por lo general en la zona Norte del lago Titicaca, particularmente en las siguientes zonas: Yapura, Llachon-Capachica, Isla Amantani, Vilquechico, Huarisani, Quellahuyo, Jacantaya, Muelle Cariquita, Moho, Conima y Villa Tilali (Inf. DIREPE XI-PUNO). Son insistentemente Limnéticos, teniendo una migración diurna; por las noches encima de la termoclina y de día por debajo de esta. La captura se realiza por lo general en zona litoral ya que existe una migración por reproducción y los ejemplares capturados están generalmente en estadíos V – VI. 11 Instituto de Investigación, Producción, Servicios y Capacitación “Qollasuyo” Centro de Investigación y Producción Pesquera Chucuito UNA – Puno REFRIGERACIÓN CASERA DE Orestias luteus “CARACHI AMARILLO” Ing. M.Sc. Romeo Paca Pantigoso Blgo. René Chura Cruz PUBLICACIONES QOLLA Nº 04 Noviembre AÑO 2000 PUNO – 2000 – PERÚ 0 I.- INTRODUCCIÓN La presencia de Orestias luteus “carachi amarillo”, en la cuenca del Titicaca es frecuente, por ser una de las especies que más se ha desarrollado y al mismo tiempo a resistido a la depredación humana y a las especies introducidas, convirtiéndose en la base de la alimentación de la población ribereña y además por que esta especie es comercializada en las ciudades de Arequipa, Moquegua, Ilo y Tacna. El transporte para la comercialización del “carachi amarillo” se realiza en condiciones antihigiénicas e inadecuadas, por lo cual es necesario generar alternativas tecnológicas que permitan una buena preservación y transporte de las especies ícticas nativas, para su comercialización en condiciones adecuadas. El proceso de refrigeración consiste en la preservación del recurso hidrobiológico, por un período de tiempo relativamente largo, sin alterar su grado de salubridad y frescura para el consumo humano. Para el proceso de enfriamiento, que debe llegar a 1 ó 1.5º C, el procedimiento más simple consiste en adicionar hielo en la parte superior y el fondo. 1 II.- OBJETIVOS 1. Objetivo general Preservar Orestias luteus “carachi amarillo” en base a refrigeración para el proceso de transporte y comercialización. 2. Objetivos específicos 2.1. 2.2. 2.3. Realizar la biometría de peso y talla en el Orestias luteus. Determinar el proceso de refrigeración para la especie Orestias luteus, utilizando la Tabla de Burges (1973). Establecer una Tabla con los tiempos de enfriamiento para Orestias luteus. III. MATERIALES 3.1 Material experimental Se utilizó 105 peces de la especie Orestias luteus “carachi amarillo”, que tienen un peso total de 4 kg siendo el peso promedio por animal de 35.7 gr y una talla promedio de 99.1 mm. 3.2 Material de trabajo Se utilizaron los siguientes materiales y equipos: • Una cámara isotérmica (caja teknopor) de las siguientes dimensiones exteriores: Largo: 36 cm Ancho: 24 cm Altura: 23 cm Volumen: 0.02 m3 Capacidad: 4 kg. de pescado Espesor del teknopor: 2.5 cm • Termómetro, con escala de –10 a 100º C • Hielo, tipo escama • Ictiómetro de 0 a 300 mm • Balanza de triple barra O’Hauss • Balanza reloj, con una capacidad de 10 Kg. • Guantes impermeables IV. METODOLOGÍA 4.1. Se compró el pescado de las vendedoras de la avenida Simón Bolívar, que a partir de las 11 de la mañana, comercializan pescado de la zona de Llachón, en bolsas de polietileno 4.2. En el laboratorio del IIP Qollasuyo, se procedió a tomar la biometría de los 105 carachis amarillos. La talla se registra en el ictiómetro y el peso en la balanza O’Hauss. 4.3. Tabla de Burges G. 1973, que determina la cantidad de hielo requerida para enfriar a 0º C un volumen de 7 kg. de pescado fresco, donde: A = Temperatura inicial de pescado en grados centígrados ºC B = Peso mínimo del hielo requerido en Kg. 2 CUADRO Nº 01 TABLA DE BURGES DE TEMPERATURA INICIAL DEL PESCADO Y EL PESO MINIMO DE HIELO REQUERIDO A (ºC) B (Kg.) A (ºC) B (Kg.) 18.3 15.5 12.7 1.5 1.3 1.0 10.0 7.2 4.4 1.6 0.8 0.6 0.3 0.1 Fuente: Burges, 1973 4.4. Cálculo de hielo requerido para el enfriamiento de pescado a ºC Para el cálculo se utilizó como base los datos de la tabla de Burges y una regla de tres compuesta, de las siguientes características: CUADRO Nº 02 RELACION DE PESO DE PESCADO, TEMPERATURA INICIAL Y HIELO REQUERIDO Temperatura inicial del Peso pescado en Kg. Hielo requerido pescado en ºC 7 4 15.5 16.0 1.3 X Fuente: IIP Qollasuyo – CIPP Chucuito, 2000 – 2002 x= 4 x16 x1.3 = 0.77 Kg. 7 x15.5 x = 770 gr. Debido a que en el momento de preparar la capa de hielo inferior con un espesor de 2 cm nos quedó muy poco hielo, se vio por conveniente agregarle un volumen adicional de 30% más del volumen calculado inicialmente, haciendo un volumen total de 1000 gr que fue utilizado en el trabajo de observación preliminar que estamos reportando. 4.5. Acondicionamiento del pescado en la caja térmica. • La primera medida que se tomó fue el pesaje del pescado en una balanza reloj, obteniéndose el peso de 4 kg. • Con este peso se calculó la cantidad de hielo requerida, que para nuestro caso fue de 1001 grs • Luego se registró la temperatura del pescado que fue de 16º C con un termómetro de digital de marca BOECO de escala de –10º C a 100º C. • Con esta información se puso una primera capa de hielo de 2 cm en la caja isotérmica. • Luego se estibó el pescado en 4 capas, colocándose el pescado con la parte dorsal hacia abajo, entrecruzando cabeza con cola, se hizo una capa de pescado de 9 cm. • A continuación se acondicionó una capa superior de hielo de un espesor de 1.5 cm • En la parte central se colocó el termómetro, haciendo que la parte inferior se ubique entre la parte media del estibaje de los pescados. • Finalmente se tapó la caja en forma hermética 3 Figura Nº 01 ACONDICIONAMIENTO DEL PESCADO EN LA CAJA ISOTERMICA 1.5 cm de hielo 9.0 cm. de pescado (Orestias luteus) 2.0 cm de hielo Fuente: IIP Qollasuyo – CIPP Chucuito, 2000 – 2002 V. RESULTADOS Y DISCUSIÓN 5.1. Biometría de peso y talla en Orestias luteus “carachi amarillo” Los datos obtenidos de talla y peso fueron ingresados en el programa Excel del entorno Windows de una computadora Pentium III, donde se calcularon directamente los parámetros en estudio con los siguientes resultados: CUADRO Nº 04 PARÁMETROS DE PESO Y TALLA EN Orestias luteus “CARACHI AMARILLO” PARÁMETRO PESO en gr. TALLA en mm. PROMEDIO DESVIACIÓN ESTANDAR VALORES MÁXIMOS VALORES MINIMOS C. V. % 37.5 7.07 68.9 21.8 18.8 99.1 8.65 130.0 80.0 08.7 Fuente: IIP Qollasuyo – CIPP Chucuito, 2000 – 2002 5.2. Proceso específico de refrigeración para la especie Orestias luteus, “carachi amarillo” utilizando la tabla de Burges (1973) para el proceso de enfriamiento En el proceso que se realizó siguiendo la tabla de Burges, se encontró que esta tabla no se adapta a las condiciones de la especie y nuestro medio ambiente por las siguientes observaciones: • • • • El volumen de hielo no fue suficiente, se tuvo que agregar el 30% más de hielo del peso señalado por la tabla de Burges. La temperatura mínima que se alcanzó fue de 1.5º C en 3 horas con 43 minutos. A partir de esta temperatura, comenzó el deshielo por el incremento de temperatura, lo que nos obligó a botar el líquido denominado “sanguaza” e incrementar hielo en 1001 gr. adicionales en la parte superior. A partir de este incremento la temperatura descendió nuevamente hasta los 3º C. 4 5.3. Tabla con los tiempos de enfriamiento, para la especie Orestias luteus “carachi amarillo” Con los datos obtenidos no es posible aún proponer una tabla de enfriamiento para la especie Orestias luteus “carachi amarillo”, sin embargo a continuación ofrecemos nuestros resultados: CUADRO Nº 05 OBSERVACIONES DE TEMPERATURA Y TIEMPO EN EL ENFRIAMIENTO A 0ºC EN Orestias luteus “CARACHI AMARILLO” OB SERVACIÓN Nº T EMPERAT URA º C T IE MP O 1 2 3 4 5 6 7 8 9 10 16.0 7.0 4.0 3.0 3.0 3.0 1.5 2.0 4.0 5.0 0 Hr. 00 minutos 1 Hr. 08 minutos 2 Hr. 05 minutos 2 Hr. 20 minutos 2 Hr. 30 minutos 3 Hr. 17 minutos 3 Hr. 43 minutos 4 Hr. 30 minutos 9 Hr. 30 minutos 11 Hr. 30 minutos Fuente: IIP Qollasuyo – CIPP Chucuito, 2000 – 2002 Temperatura ºC GRAFICO Nº 01 ENFRIAMIENTO PARA Orestias luteus “CARACHI AMARILLO” 17 16 15 14 13 12 11 10 9 8 7 6 5 4 3 2 1 0 0.00 1.13 11.50 2.08 9.50 2.33 2.50 3.28 3.72 0.00 1.13 2.08 2.33 2.50 3.28 3.72 4.50 4.50 9.50 11.50 Tiempo en horas Fuente: IIP Qollasuyo – CIPP Chucuito, 2000 – 2002 VI. RECOMENDACIONES 6.1 Es necesario realizar trabajos de investigación que consideren como variables de estudio: • Espesor de la capa de hielo inferior y superior • Espesor de las capas de pescado • Tiempo de enfriamiento hasta alcanzar 1º C • Tiempo en el cual la temperatura se mantiene constante en 1º C 6.2. Es necesario probar simultáneamente con diferentes tipos de cajas isotérmicas, variando en sus dimensiones. 5 Instituto de Investigación, Producción, Servicios y Capacitación “Qollasuyo” Centro de Investigación y Producción Pesquera Chucuito UNA – Puno SINOPSIS BIOLÓGICA DE Orestias pentlandii “boga” Autor: Blgo. René Chura Cruz PUBLICACIONES QOLLA Nº 05 Noviembre AÑO 2000 PUNO – 2000 – PERÚ 0 1. TAXONOMIA La taxonomía de Orestias pentlandii “boga”, fue descrita y revisada por CUVIER y VALENCIENNES (1846); GARMAN (1895); EIGENMANN y ALLEN (1942); TCHERNAVIN (1944); LAUZANNE (1982) y PARENTI (1984). La primera colección de Orestias pentlandii “boga”, fue realizada por M. PENTLAND en la década del 30 del siglo XIX y descrita por VALENCIENNES (1839); quien estableció el género Orestias con diez especies. TCHERNAVIN (1944), LAUZANNE (1982) y PARENTI (1984), clasifican en diferentes grupos y complejos como menciona SARMIENTO et al., 1987. TCHERNAVIN GRUP. ESPECIE Orestias 01 pentlandii LAUZANNE GRUP. ESPECIE Orestias VI pentlandii PARENTI COMPLEJO Complejo cuvieri Orestias pentlandii Fuente: Sarmiento et al., 1987 El SYNTIPO (MNHN A: 9594) corresponde a Orestias pentlandii “boga” dos adultos, 163 – 168 mm longitud estándar, colectada por M. PENTLAND, CA. 1839 del lago Titicaca. 1.1. Clasificación taxonómica La taxonomía para la Orestias pentlandii “boga”, según TCHERNAVIN (1942); LAUZANNE (1982) y PARENTI (1984); es la siguiente: REYNO Animal PHYLLUM Chordata SUB PHYLLUM Vertebrata GRUPO Gnathostomata SUPER CLASE Pisces CLASE Osteichthyes SUB CLASE Actinopterygi DIVISIÓN Teleostei SUPER ORDEN Cyprinodontimorpha ORDEN Cyprinodontiformes SUB ORDEN Cyprinodontoidei FAMILIA Ciprinodontidae SUB FAMILIA Ciprinodontinae GENERO Orestias (Valenciennes) 1839 ESPECIE Orestias pentlandii Val., 1839 NOMBRE VULGAR "boga" “bolla” “kessi” Clasificación realizada por Sarmiento et al., 1987. 1.2. Nombre científico válido Orestias pentlandii (VALENCIENNES, 1839) p. 118 1.3. Sinonimias o nombres anteriores Orestias pentlandii VALENCIENNES (1839) Orestias pentlandii GÜNTHER (1866) Orestias pentlandii GARMAN (1876); PELLEGRIN (1906) Orestias pentlandii EIGENMANN 1894; STEINDACHNER (1902); STARKS, (1906) y FOWLER (1916). Orestias bairdii COPE (1876); FOW LER (1916). Orestias bairdi EIGENMANN (1893). 1 1.4. Nombres comunes Boga, boguilla (CUVIER y VALENCIENNES, 1846); Bova (GARMAN, 1876) en TCHERNAVIN, 1943. 1.5. Clave para la identificación de Orestias pentlandii “boga” Según LAUZANNE, 1982: 1.5.1. I/H 48% I/A 11% ............................................... 2. I/H 48% I/A 11% ............................................... 9. 1.5.2. Número de escamas: 49 – 61 Número de vértebras: 34 – 38 Branquiespinas ramificadas Q/B 21% ......................................... Orestias pentlandii I/A: Altura de pedúnculo caudal en relación a longitud estándar I/H: Altura de pedúnculo caudal en relación a su longitud Q/B: Diámetro del ojo en relación a la longitud estándar GRÁFICO (LAUZANNE, 1982) c a m n s´ s o Longitud Estandar Distancia Predorsal Distancia Postdorsal Distancia Pre anal Distancia Post anal Longitud del pedúnculo caudal en mm en mm en mm en mm en mm en mm (ac) (am) (cn) (ao) (sc) (s´c) 2. DISTRIBUCIÓN Para la determinación de la distribución en el ecosistema lacustre existen tres factores que pueden ser considerados en las distribuciones de las poblaciones ícticas: la profundidad del lago, la distribución de las macrofitas y la distancia de la costa en función de la cual puede producirse variabilidad en la distribución de las poblaciones pelágicas (SARMIENTO et al., 1987). Para Orestias pentlandii “boga” VALENCIENNES (1839), especie que prefiere habitar áreas acuáticas con profundidades, desde los 6 a 50 m, según se ha podido observar en las pescas exploratorias y por la tendencia y experiencia de los pescadores de calar sus redes dentro de este rango (NAVARRO,1981). Por las características anteriores Orestias pentlandii “boga” es una especie de zona béntica y estaría asociada con Orestias forgeti, Orestias tchernavini y Orestias mulleri (SARMIENTO et al., 1987). 2 En años anteriores, la “boga” se encontraba distribuida en el lago Titicaca, en las penínsulas de Capachica, Pomata y Yunguyo; según los muestreos de CUVIER y VALENCIENNES (1846) y EIGENMANN y ALLEN (1942). Así como en la bahía de Puno, lago Arapa y Huarina - Huatajata (lago Menor) (VILLWOCK ,1963). En los años ochenta existía esta especie en el lago Arapa (DIREPE/ORDE PUNO, 1981). Distribución de las principales especies de Orestias 1.- Valle de Urubama (Cerca del Cusco. 2.- Valle de Urubamba (cerca de Urubamba) 3.- Laguna Langui. 4.- Hacienda Checayani 5.- Lago Arapa. 6.- Vilque Chico Haancané 7.- Lagunillas. 8.- Lago Umayo. 9.- Peninsula de Capachica 10.- Bahia de Puno 11.- Moho. 12/13.- Lago Menor. (Huarina Huatajata) 14.-La Paz 15.- Huaqui 16.- Rio Mauri Orestias agassii Orestias cuvieri y Orestias pentlandii Orestias mulleri et. Orestias luteus Fuente: VILLWOCK ,1963 3 3. DESCRIPCIÓN DE Orestias pentlandii “BOGA” Val., 1839 La Orestias pentlandii “boga” Val., 1839 , es posiblemente la Orestia que alcanza las mayores tallas. La longitud estándar del lote estudiado por LAUZANNE, 1982 varía entre 126 a 169 mm. Es una especie muy alargada de acuerdo a las medidas plásticas que se indica (F/A: 19 – 25%) con pedúnculo caudal muy fino (I/A: 7 – 10%). La cabeza es relativamente grande (B/A: 23 – 28%) y ancha (N/B: 59 – 71%). El cuerpo es cilíndrico. Las escamas de la parte anterior del cuerpo y la cabeza son fuertes y cubiertas de gránulos, y las otras presentan estrías concéntricas. No presentan escamas sobre la línea media del vientre. En algunos individuos, puede existir un par de espacios vacíos trás de la cabeza y a cada costado de la línea media del dorso. El número de escamas en línea longitudinal es muy elevada (49 – 61), lo mismo que el número de vértebras (34 – 38). El número de branquiespinas es particularmente elevado, se cuentan 20 a 25 sobre la parte externa del primer arco branquial y 17 a 21 sobre uno de los costados de la faringe inferior. El total de branquiespinas en un lado del aparato branquiespinal está comprendido entre 195 a 226. Las branquiespinas, sobre todo las del primer arco son furcadas e incluso ramificadas alargados. El hueso faríngeo tiene vértices numerosos y alargados, dientes relativamente finos con una curvatura pronunciada. Las escamas son tipo ctenoidea y las aletas presentes en macho y hembra son: dos aletas pectorales, una aleta dorsal, una anal y una caudal. El número de radios varia entre unos y otros: dorsal 13, pectoral 14 – 18, anal 13 – 16 y caudal 22 - 24 (DIREPE, 1987). Los individuos vivos tienen coloración marrón verdoso, flancos amarillo verdosos y vientre blanco. Los juveniles de Orestias pentlandii “boga”, pueden confundirse con Orestias ispi “ispi”, pero los adultos de Orestias pentlandii “boga”, no se asemejan a ninguna otra especie de Orestias. Las medidas que indica SARMIENTO Et al. (1987) son cuerpo cilíndrico, ojo (Q/B 15 – 20) indicando que Orestias pentlandii “boga”, no presenta escamas en la línea lateral. 4. REPRODUCCIÓN 4.1. Sexualidad La “boga” para la diferenciación de sexo no presenta caracteres externos que permitan deducir a simple vista, sin embargo se ha podido demostrar que las hembras presentan un mayor tamaño y la predominancia de la parte abdominal, y presencia de color rojizo y prominente del poro genital (TITO Y VELÁSQUEZ, 1991). En el caso de los machos se les reconoce con la manipulación directa que a una ligera presión en la zona ventral facilita la fluidez del líquido seminal. La otra técnica para la identificación del sexo se verifica mediante el examen macroscópico o bajo la lupa de la gónada impar situada en la porción caudal de la cavidad general del cuerpo (SARMIENTO et al., 1987) 4 4.2. Madurez sexual La talla a la primera madurez sexual es mayor a 125 mm (BUSTAMANTE Y TREVIÑO, 1977). 4.3. Fertilización Es externa. 4.4. Fecundidad TITO y VELÁSQUEZ (1991), indican que el número de ovas extraídos en promedio oscilan entre 800 a 1500; sin embargo el PELT (1995) indica que en promedio tiene 2400 ovas. 4.5. Desove 4.5.1. Período de desove. Según TITO y VELÁSQUEZ (1991) indican que la época de desove es más frecuente entre los meses de octubre, noviembre y parte de diciembre; sin embargo el PELT en 1995 menciona que la época de desove son los meses de agosto a noviembre. 4.5.2. Número de desoves por año. Las Orestias son consideradas reproductoras parciales por que desovan dos veces al año, por consiguiente la “boga” es un reproductor parcial con un desove fraccionado. 4.5.3. Horas de desove. La “boga” migra por las noches, especialmente desde las zonas pelágicas o litorales profundas hacia los lugares de bastante vegetación sumergida, con la finalidad de realizar el desove en horas nocturnas. 4.5.4. Áreas de desove. Según reportes de la DIREPE (1987) la existencia de las zonas o áreas de desove es relativamente grande y territorial abarcando las zonas ubicadas frente a Chejjachi, Pesquería, Arapa, Trapiche y alrededor de la Isla Arapa; que geográficamente corresponde a la zona costera de la parte nor oeste de la lago Arapa donde las profundidades varían de 15 a 20 metros. El área de desove se calcula de 10 a 11 Km2. 5. MIGRACIÓN La “boga” presenta una migración horizontal de las zonas pelágicas, hacia las zonas litorales (DIREPE, 1987). 5 6. BIBLIOGRAFIA 1. BUSTAMANTE, E y H. TREVIÑO, 1977. Descripción de la 1976-1977 pesqueria en el Lago Titicaca DOC. inédito IMARPE PUNO - PERU. 15 p. 2. DIREPE/PUNO 1987. Proyecto: Producción de Especies iscícolas Nativas Puno – Perú 3. DIREPE/ORDE PUNO 1981. Estudio Bioecológico de las especies nativas de la laguna Arapa 133 pag. Puno. 4. EIGENMANN, C; Y W . ALLEN 1942. Fishes of western South America. University of Kentucky.USA 494 Pag. 5. LAUZANNE, L 1982. Description de trois orestias noveaux du lac titicaca O ispi sp, O. forgueti n. sp. y O. tchernavini n sp. (Pisces. Cyprinodontinadae) Cybium, 3e, 5(3): 71-91. 6. PROYECTO ESPECIAL LAGO TITICACA 1995. Producción de especies icticas nativas de la cuenca del lago Titicaca por medio artificial en laboratorio. Revista Técnica 13 pag. 7. SARMIENTO J. Et al.,1987. Sinopsis Biológica de las Principales especies ícticas del Lago Titicaca. Proyecto de los recursos del Lago Titicaca.173 pag. 8. TCHERNAVIN, V 1943. A revisión of the subfamily orestiinae. Proc.Zool. Soc London, 114:140-233. 9. TITO M.,A. y F. VELASQUEZ CH. 1991. Producción Artificial de alevinos de Orestias pentlandii “boga” Tesis FCCBB-UNA-P Puno Perú 71 pag. 10. VILLW OCK W . 1963.Die Guttong Orestias (Pisces, Microciprini) und dieFrage der infra-lakustrishea speziation im titicaca seegebiet. Verh.DC. zool. 26: 610-24 6 7 Instituto de Investigación, Producción, Servicios y Capacitación “Qollasuyo” Centro de Investigación y Producción Pesquera Chucuito UNA – Puno SINOPSIS BIOLÓGICA DE Trichomycterus rivulatus “suche” Ph. D. Sabino Atencio Limachi Blgo. René Alfaro Tapia PUBLICACIONES QOLLA Nº 06 Diciembre AÑO 2000 PUNO – 2000 – PERÚ 0 TROCHOMYCTERIDOS DEL LAGO TITICACA POSICIÓN TAXONÓMICA REINO ......................... Animal PHYLLUM ................. Chordata SUB PHYLLUM……….... Vertebrata GRUPO ...................... Gnathostomata SUPER CLASE.................... Pisces CLASE ............................ Osteichthyes SUB CLASE .................... Actinopterygii DIVISIÓN ................................. Teleostei SUPER ORDEN........................ Silurimorpha ORDEN ............................. Siluriformes CUVIER, 1817 SUB ORDEN............................ Siluroidei FAMILIA ............................. Trichomycteridae GILL, 1872 GÉNERO .............................. Trichomycterus HUMBOLDT, 1811 ESPECIE ........................... T. rivulatus “suche” VAL,1846 T. dispar “mauri” CARACTERÍSTICAS GENERALES DE LA FAMILIA Trichomycteridae - tienen cuerpo moderadamente alargado y desnudo, cuerpo desnudo (carecen de escamas), cuerpo deprimido, dorsoventralmente, particularmente en la zona cefálica, alcanzan tallas hasta de 202 mm (mauri) y hasta 400 mm (suche), tiene una sola aleta dorsal, no presentav aleta adiposa, en la aleta pectoral, los “suches” tienen más de 7 radios blandos ramificados y los “mauris” menos de 7 radios, en sus aletas no tienen radios duros o espinas, los radios de sus aletas son blandas y ramificados, en la parte superior de la cabeza tiene un par de barbillas, en las comisuras de la boca, en cada lado, tienen dos barbillas siendo la superior más grande que la inferior, la coloración de sus cuerpos varían de grisaceo, verdusco y amarillento, con mañchas negras de formas iirregulares, tienen boca terminal y de posición ventral, sus ojos son pequeños tienen la bóveda craneana con un hueso unitario, el perieto occipital procedente de la difusión de los parietales y el supraoccipital, tienen una vejiga natatoria atrofiada. CARACTERÍSTICAS GENERALES DEL Trichomycterus rivulatus “SUCHE” A.- CARACTERÍSTICAS MORFOLÓGICAS Y ANATÓMICAS - La forma de su cuerpo es deprimido, dorsoventralmente, en los dos tercios anteriores. Piel sin escamas Alcanzan talla hasta 324 mm y peso hasta 419 gr. 1 - A diferencia del T. dispar “mauri”, en la aleta pectoral tienen de siete a mas radios blandos ramificados. Tienen un par de ojos pequeños. Son peces ostarioficios (con aparato de transmisión de weber). Bobeda craneana con un hueso unitario, el parieto-occipital, procedente de la fisión de los apriétales y el supraoccipital. Vejiga natatoria atrofiada. B.- HÁBITAT Y DISTRIBUCIÓN - Son peces bentónicos que viven en profundidades hasta de 30 m sobre substratos arenosos o blandos. Vive en lechos que le sirven de refugio o escondites, que generalmente son rocas, pequeños socavones, asociada a algunas plantas acuáticas sumergidas. - Habitan, mayormente en medios lénticos (lagos y lagunas) existiendo también en medios lóticos (ríos). - Su distribución es por toda la cuenca del lago Titicaca. Algunos autores indican una distribución desde el lago Junin (Perú), hasta el lago Poopo (Bolivia) C.- ALIMENTACIÓN NATURAL. La alimentación del “suche” es de tipo eurífago, es decir su espectro alimenticio está constituido de diversos componentes. Su primera alimentación exógena constituyen algas unicelulares y estadios iniciales de zooplancton como: cladóceros, ostracodos, copépodos y anfípodos. En edades juveniles y adultos, la base de su alimentación le constituye la Hyalella sp “camaroncillo del lago”, ovas de peces, larvas de insectos, larvas y alevinos de peces; complementando por cladóceros, copépodos y escasamente macrófitos acuáticos y algas. D.- REPRODUCCIÓN NATURAL. - En el “suche” existe dimorfismo sexual reflejado en la talla de los reproductores, siendo los machos de menor tamaño que las hembras. - Los machos se caracterizan por tener un poro genital mas pequeño que el de las hembras en forma de “tetilla”, que al presionar el vientre se forma una prominencia en forma de apéndice. - Realizan migraciones de reproducción, saliendo de las zonas profundas que es su hábitat normal, hacia zonas litorales. - El tipo ecológico de su desove es psamofílico, es decir que depositan sus ovas en substratos de arena. - Las hembras construyen nidos en la arena, en forma de hoyos de aproximadamente 50 – 70 cm de diámetro y 10 cm de profundidad aproximadamente. - Los reproductores, poseen una sola gónada. - La proporción de sexo es de 1 macho por 1 hembra. - Su tipo de desove es porcional, tienen ovas libres. - Mantienen una conducta de protección de sus ovas y descendiente. - Las épocas de desove se da entre los meses de enero a abril. 2 BIBLIOGRAFÍA 1.- BARDACH, R.M.,(1982). Acuacultura. A.G.T. Editores S.A. México 2.- BARREDA, M., (1978). Ictiología General. Edit. U.Villarreal Lima-Perú 3.- CHERFAS, B.I., (1956). Piscicultura en Acuatorios Naturales Industria alimentaria (ID. RUSO) Moscú Editorial 4.- HUET. M., (1983 ). Tratado de Piscicultura. Ediciones Mundi Prensa, MadridEspaña. 5.- NIKOLSKY, G.V., (1971). Ictiología Especial. Editorial Escuela Superior (ID RUSO)- Moscú 6.- NIKOLSKY, G.V., (1973 ). Ecología de los peces. Editorial Escuela Superior (ID RUSO)- Moscú 3 Instituto de Investigación, Producción, Servicios y Capacitación “Qollasuyo” Centro de Investigación y Producción Pesquera Chucuito UNA – Puno ADAPTACIÓN DE TRICHOMYCTERIDOS EN AMBIENTES CONTROLADOS Trichomycterus rivulatus “suche”, Trichomycterus dispar “mauri” Ph. D. Sabino Atencio Limachi PUBLICACIONES QOLLA Nº 07 Diciembre AÑO 2000 PUNO – 2000 – PERÚ 0 PRESENTACIÓN Los trichomycteridos del lago Titicaca como el “suche” y el “mauri”, se encuentran en proceso de extinción; razón por la cual muchos especialistas e instituciones se han abocado a buscar alternativas que coadyuven a la solución de esta problemática. En las últimas décadas, se han realizado algunos trabajos sobre la bioecología y la reproducción de “suche” y “mauri”, sin embargo no existe publicación sobre las diferentes etapas que son necesarias para llegar a la reproducción artificial, por ejemplo la obtención y mantenimiento de reproductores, el proceso de transporte y mantenimiento de especimenes vivos, el proceso de adaptación en cautiverio, etc. El IIP Qollasuyo y el CIPP Chucuito UNA- Puno, con el financiamiento del PNUD a través de la Autoridad Autónoma de lago Titicaca (ALT), y del Proyecto PER/98/G-32 Conservación de la Biodiversidad en la Cuenca del Sistema TDPS, esta realizando la sistematización de la bibliografía existente y publicando guías prácticas sobre especies nativas. La presente guía fue preparada por el Dr. Sabino Atencio Limachi, como resultado de más de 3 meses de observación directa del proceso de adaptación del “suche” y el “mauri”, en los Laboratorios de la UNA- PUNO. Esta dirigido a especialistas y público en general que este interesado en el conocimiento de los peces nativos del lago Titicaca, particularmente en su piscicultura. Ofrecemos el presente aporte, esperando sus sugerencias y alcances que nos serviran para seguir renovando esfuerzos. IIP Qollasuyo – CIPP Chucuito UNA-PUNO 1 CONTENIDO I.II.III.IV.V.VI.VII.VIII.IX.X.XI.XII.XIII.XIV.- PRESENTACIÓN PREPARACIÓN DEL HÁBITAT ARTIFICIAL ACONDICIONAMIENTO DEL HÁBITAT ARTIFICIAL. OBTENCIÓN Y ACOPIO DE ESPECIMENES VIVOS REAVIVAMIENTO DE LOS ESPECIMENES ACOPIADOS TRANSPORTE DE ESPECIMENES VIVOS. SIEMBRA DE ESPECIMENES SEXADO. ALIMENTACIÓN REPRODUCCIÓN SANIDAD CONDUCTA CARACTERÍSTICAS FÍSICO - QUÍMICAS DEL AGUA RECOMENDACIONES REFERENCIAS BIBLIOGRÁFICAS 2 I.- PREPARACIÓN DEL HÁBITAT ARTIFICIAL La preparación del hábitat artificial, se hace en base a los conocimientos previos sobre la bioecología de la especie y los recursos disponibles. Como en todo proceso de investigación, las primeras observaciones se realizan en condiciones de laboratorio, para lo cual se ha tenido en cuenta la disponibilidad de recurso agua, infraestructura, materiales y equipos. - - El agua disponible, debe ser sin ningún tratamiento con productos químicos como el cloro. El agua que utilizamos fue proveniente de un pozo artesiano. Sabiendo del carácter bentónico de los trichomycteridos se puede preparar su hábitat artificial, utilizando diferentes medios como recipiente; que pueden ser de plástico, fibra de vidrio, madera, etc. El material mas accesible constituye las tinas circulares de plástico con un diámetro de 50 cm. a más, según la densidad de la población de peces a colocarse. No es recomendable utilizar acuarios de vidrio por su transparencia que les incomoda y les produce stress. Es necesario contar con algunos materiales como baldes pequeños, calcales, coladores, etc. Se debe contar con algunos equipos mínimos como: balanza tipo Ohaus, termómetro, oxímetro, equipo de análisis de agua, ictiómetro y otros. II.- ACONDICIONAMIENTO DEL HÁBITAT - El nivel del agua en el recipiente, es suficiente de 25 a 30 cm de altura. El fondo, tapizado con arena fina y lavada. En el fondo se colocan unos cobertizos o escondites, hechos con piedras planas y largas, sostenido sobre otras piedras de menor tamaño para formar pequeños túneles. En la superficie del agua se colocan macrófitos acuáticos como: Elodea potamogeton y Myriophyllum quitense lo cual se va cambiando semanalmente. Es indispensable contar con aireadores eléctricos de acuario. III.- OBTENCIÓN Y ACOPIO DE ESPECIMENES VIVOS La obtención y acopio de especimenes vivos, es posible en los mismo lugares de pesca y en puntos de comercialización. El acopio de especímenes en puntos de comercialización, es posible por cuanto el tiempo de resistencia de estos peces fuera del agua, es de 4 a 5 Hrs después de su captura, aún en condiciones no apropiadas de su manipuleo y transporte (atados y latas). Al acopiar especímenes vivos, es necesario llevar consigo recipientes con agua limpia del lago, río o de pozo, no tratadas con productos químicos. Al recipiente con agua, se agrega un poco de macrófitos acuáticos. IV.- REAVIVAMIENTO DE ESPECÍMENES Este proceso es necesario en casos cuando la obtención de especímenes vivos se hace en los puntos de comercialización (mercados, k’atos, etc.). Por la forma de su captura, con redes agalleras, por el manipuleo y por la forma 3 inadecuada de su transporte; los “suches y mauris” llegan a los centros de comercialización como muy debilitados. Por estas razones, aún de haberlo recepcionado en recipientes con agua, es necesario hacer las siguientes operaciones: El proceso de reavivamiento o recuperación vital, se refiere a que una vez obtenido los especímenes vivos, es necesario: - Trasladarlos a un recipiente amplio que puede ser una tina de plástico u otro material. - Hacer la homogenización y cambio total del agua. - En el fondo, adecuar refugios de piedra - En la superficie del agua colocar un poco de macrófitos. - Colocar en el recipiente la mayor cantidad de aireadores posibles (3 – 4). - Colocar a los peces para que se reaviven o recuperen por un tiempo de 2 a 3 Hrs. antes de su transporte hacia su destino final. En caso de no contar con ambiente disponible y no contar con oxigenadores: - El proceso de reavivamiento se realiza llevando el recipiente con peces a un río, riachuelo u otra fuente de agua limpia y corriente. De estar cerca de un río, el recipiente acondicionado contenedor de peces, se coloca al río en un lugar con corriente moderada y que el agua cubra unos 2 a 3 cm sobre el recipiente. Tener cuidado que no escapen los peces que generalmente se quedan en el fondo y debajo de sus escondites. Mantener a los peces de 2 a 3 Hrs antes de su transporte hacia su destino final. V.- TRASPORTE DE ESPECÍMENES VIVOS Luego de cumplir con el proceso de reavivamiento o recuperación vital, los peces se encuentran en mejores condiciones para ser transportados hacia su destino final. En caso de nuestras experiencias, los lugares de acopio fueron los distritos de Pomata, Juli e Ilave que distan en 90 km. de la ciudad de Puno (destino). - Para el trasporte propiamente, el recipiente contenido de agua, macrófitos y peces, se cubre y amarra con una tela limpia, para que no se salga todo el agua y no se escapen los peces. Estando en ruta, en el lugar mas cercano donde se encuentre agua limpia, es necesario agregar agua al recipiente y oxigenar, haciendo caer el agua desde cierta altura. En nuestro caso, luego de llegar al punto mas cercano al Lago Titicaca (sector Ojerani) a mas o menos 80 km. de viaje desde el centro de acopio, se agregó y oxigenó el recipiente de trasporte de peces, con agua del lago. De esta manera llegaron todos los peces vivos hasta su destino final, la ciudad de Puno. VI.- SIEMBRA DE ESPECÍMENES EN EL HABITAT DE RECEPCIÓN - Una vez llegado al destino final, los especimenes vivos son colocados (sembrados) en el hábitat debidamente acondicionado para la recepción y mantenimiento. - Antes de colocar los peces a su nuevo hábitat, previamente en forma gradual, se mezcla el agua del recipiente de transporte, con agua nueva de la fuente en 4 la cual se mantendrá a los especímenes. - Luego de ser transportados y sembrados (colocados) en su nuevo hábitat artificial, se sienten “mejor”, sin embargo, el primer día y noche se les deja en quietud absoluta y sin suministrarles alimentos. - La densidad de siembra de especímenes con una talla promedio de 18 cm, es de 10 ejemplares por m2. . Esta densidad se mantiene siempre y cuando se tenga el recambio de agua cada 24 Hrs, cuando el oxígeno disuelto se mantenga de 5 a 6 mg/l, el pH de 7 a 8, y la temperatura de 10 a 15 º C - Una vez sembrado los peces en su nuevo hábitat, (tinas de plástico) es recomendable taparlos con tapa oscura. VII.- SEXADO Al momento de sembrarlos, es necesario previamente pesarlos, medirlos (longitud total y longitud estándar) y sexarlos, para así saber la composición de la población en observación y su correspondiente seguimiento. - En los trichomycteridos del lago Titicaca, existe dimorfismo sexual. - Las hembras son de tallas mas grandes que los machos. - Las hembras cuando están grávidas tienen su vientre abultado. - El sexado propiamente se hace por rasgos morfológicos. - El poro genital de los machos es más prominente que en el de las hembras. - Al presionar su vientre – cerca del poro genital – forma como una tetilla lo cual no ocurre en las hembras. VIII.- ALIMENTACIÓN - - A 24 horas de mantenimiento en cautiverio, se le suministra alimento natural vivo, consistente en Hyalella sp. “camaroncillo del lago” y Lumbricus terrestris “lombrices”, los cuales son rechazadas inicialmente, hasta por 2 a 3 días. Algunos ejemplares, se someten a un ayuno forzado, hasta 5 – 6 días, lo cual es posible gracias a que estos peces son grasos y durante su ayuno, utilizan sus reservas energéticas. Después de 6 – 7 días de cautiverio, se nota que gradualmente y de manera limitada empiezan a consumir el alimento natural que se le suministra. Los alimentos solo son aceptados de organismos vivos, y en caso de las lombrices a los más pequeños. El consumo de alimento lo realizan en horas de la noche o en momentos de completa quietud. IX.- REPRODUCCIÓN Los aspectos reproductivos de los especímenes, durante su proceso de adaptación, se muestran en los siguientes aspectos: - La madurez sexual, se observa en base a una escala de seis grados. Se determina el índice gónado somático IGS. La composición de sexos, en los peces en adaptación son de 8 hembras por 2 machos, en caso de nuestras observaciones. Durante el proceso de adaptación en cautiverio, las hembras aptas, llegan a desovar. 5 X.- SANIDAD - - En los aspectos profiláticos o preventivos, se realiza el cambio de agua cada 24 Hrs, limpieza general del hábitat artificial cada 7 días. Separación de lombrices muertas que fácilmente son atacadas por hongos. En el aspecto terapéutico, después de 10 - 15 días de mantenerse en cautiverio, los peces más dañados en el opérculo y la aleta pectoral, como consecuencia de su captura con redes agalleras, son atacadas por los hongos; lo cual se trata con una solución de verde de malaquita al 2 ppm. y en otros casos, con pinceladas de mertiolatie. Algunos especímenes que pronto llegan a morir, al ser diseccionados muestran traumatismos y hemorragias internas. XI.- CONDUCTAS - - - Los primeros días en su nuevo hábitat, los peces se sienten incómodos y débiles; su debilidad se manifiesta cuando al manipularlos no ofrecen mayor resistencia, sus movimientos en el agua son lentos. Pasado más de 10 días, se nota un cambio en la conducta de los peces, al parecer se van habituando. Sus movimientos son más rápidos, durante su manipuleo ofrecen resistencia hasta que algunos tratan de saltar fuera del agua. El “suche” y el “mauri” son tímidos y huraños, estando en cautiverio prefieren mantenerse en sus refugios, preparado con piedras. Durante el día, tienen muy poco movimiento. Durante la noche, sus movimientos son más activos. Los alimentos naturales que se le suministra “camaroncillos” y “lombrices” lo consumen de noche. Son muy sensibles a los cambios bruscos del agua, que le producen un shock; que en algunos ejemplares se observa una reacción con requiebros corporales como si estuvieran acalambrados, volviendo a su normalidad luego de homogenizarse el agua y estabilizarse las condiciones de su ambiente artificial. Cuando la concentración de las soluciones antimicóticos (hongos) son fuertes también les produce un shock. Los peces muestran exigencia permanente a la concentración del oxígeno disuelto en el agua. Cuando no se hace recambio de agua oportuno o en casos extremos se quiten los oxigenadores, los peces se inquietan de inmediato. Al disminuir la concentración del oxigeno disuelto y variar otros parámetros físico químicos del agua como el pH, ºT, etc., los primeros que reaccionan e inclusive empiezan a morir son los “camaroncillos”, seguidamente los peces que al final tratan de ponerse en posición vertical tomar el oxigeno del aire. El límite de tolerancia a la concentración del oxígeno disuelto para el “suche y mauri” en proceso de adaptación es de 2 mg/l; frente a la cual reaccionan con conductas arriba señaladas y finalmente mueren. Algunos ejemplares que definitivamente se resisten a alimentarse mueren por inanición, lo cual se muestra al ser diseccionados y tener el grado 0 (cero) de replección gástrica y grado 0 (cero) en grasa. 6 XII.- CARACTERÍSTICAS FÍSICO QUÍMICAS DEL AGUA - - El agua que se utilizó en el proceso de adaptación del “suche y mauri”, consideramos que no es lo más óptimo ya que no fue elegido de manera especial para estos peces, sino que se utilizó en base a los criterios de ser agua de poza no tratada con productos químicos y por su disponibilidad en la UNAPuno. Las características generales del agua utilizada se muestran en la tabla Nº 01, mientras que los valores promedios de algunas características específicas de nuestras observaciones se muestran en la tabla Nº 02. TABLA Nº 01 CARACTERÍSTICAS FÏSICO-QUÍMICAS DEL AGUA QUE SE UTILIZÓ PARA EL PROCESO DE ADAPTACIÓN DE LOS TRICHOMYCTERIDOS DEL LAGO TITICACA MESES PARAMETROS Setiembre Octubre Noviembre Diciembre Temperatura (ºC) Oxígeno (O2) pH 13.4 5.5 7.5 13.8 5.8 7.4 14.0 6.2 7.6 14.5 6.3 7.7 Fuente: Autor TABLA Nº 02 VALORES PROMEDIO DE LAS CARACTERÍSTICAS FISICO – QUÍMICAS DEL AGUA DURANTE EL PROCESO DE ADAPTACIÓN DE LOS TRICHOMYCTERIDOS DEL LAGO TITICACA MUE ST RA DAT OS GENERAL ES Procedencia UNA – PUNO Muestreo 24-10-2000 Análisis 25-10-2000 CARACT ERÍST ICAS ORGANOL ÉPT ICAS Aspecto Líquido transparente Color Incoloro Olor Inodoro Sabor Insípido CARACT ERÍST IC AS F ÍSICAS pH 7.6 CARACT ERÍST ICAS QUÍMICAS Dureza total como Ca CO3 440.36 mg/l Alcalinidad total como Ca CO3 118.92 mg/l Cloruros como Cl 101.69 mg/l Sulfatos como SO4 89.00 mg/l Nitratos como NO3 Positivo Calcio como Ca++ 150.29 mg/l Magnesio como Mg++ 15.71 mg/l Sólidos totales 542.05 mg/l Fuente: Laboratorio de Quimica UNA – Puno, 2001. 7 XIII.- RECOMENDACIONES 1. Obtener reproductores por capturas directas, utilizando aparejos activos de pesca, chinchoros. 2. Profundizar estudios sobre la Bioecología de los trichomyctéridos del lago Titicaca. 3. Diseñar medios especiales para el acopio y transporte de los especímenes vivos. 4. Diseñar infraestructura especial para el proceso de adaptación. 5. Preveer y garantizar los alimentos vivos para el proceso de adaptación. 6. Preveer y garantizar los medicamentos correspondientes. 7. Contar con materiales y equipos mínimos para el control y seguimiento respectivo. 8. Contar con una movilidad propia para el transporte de peces vivos. XIV.- REFERENCIAS BIBLIOGRÁFICAS. - BARDACH, R.M. 1982. “Acuacultura”; Cap 06. cultivo de bagres en EE.UU, Pag. 129 –167; Cap 07: Cultivo de Bagres Nativos de Asia, Autralia y Europa. Pág. 168 – 177. - CHERFAS, B.I. 1956. “Piscicultura en Acuatorios Naturales”; Cap V. Reproducción Artificial de Peces Comerciales. Pág. 90 – 280. - DOROJOV, C.M. et al 1975. “Piscicultura en estanques”; Cap. 15; Procesos Principales de la Piscicultura en Estanques. Pág. 181- 205. - MARTISHEV, F.G. 1973. “Piscicultura en Estanques” 426 Pág. - MIPE, 1984. Dirección Nacional de Acuicultura; “Cultivo de Peces Amazónicos”; Boletín de Información Técnica. Doc. Nº 06 Lima, Perú. 43 Pág. - NIKOLSKY, G. V., 1971. “Ictiología Especial”. Sub orden Siluroidei Pág. 264-272 - NIKOLSKI, G. V. 1973. “Ecología de Peces”; 366 Pág. 8 9 Instituto de Investigación, Producción, Servicios y Capacitación “Qollasuyo” Centro de Investigación y Producción Pesquera Chucuito UNA – Puno CONSTRUCCIÓN Y ADECUACIÓN DE ESTANQUES PARA Trichomycterus rivulatus “suche” y Trichomycterus dispar “mauri” Ph. D. Sabino Atencio Limachi PUBLICACIONES QOLLA Nº 08 Diciembre AÑO 2000 PUNO – 2000 – PERÚ 0 PRESENTACIÓN L os estanques constituyen la infraestructura básica en la piscicultura; las que tienen que responder a las características bioecológicas de la especie a cultivarse. El IIP Qollasuyo y el CIPP Chucuito-UNA-Puno dentro del marco del Proyecto PER/98/G-32 “Conservación de la Biodiversidad en la cuenca del TDPS”, propone una alternativa tecnológica para la construcción de estanques, destinado al mantenimiento y cultivo de especies ícticas nativas del lago Titicaca. Es necesario que los pescadores y todos los pobladores de la cuenca del lago Titicaca, consideren a la piscicultura de especies ícticas nativas, como una perspectiva potencial de la actividad socio-económica en el Altiplano, la que implique la preservación de las especies en peligro de extinción y una posibilidad de diversificar la actividad productiva en la cuenca del lago Titicaca. En este contexto, ofrecemos la presente “Guia Práctica” sobre la construcción y adecuación de estanques para los trichomycteridos “suche” y “mauri”. Los costos, pueden ser minimizados por cuanto en muchos lugares existe a disposición materiales de construcción como piedras, hormigón y arena; asi mismo la mano de obra podrá ser aporte del interesado. 1 I. DISEÑO DE UN ESTANQUE El diseño de una infraestructura, corresponde a las caraterísticas bioecológicas de la especie íctica, así como a la disponibilidad y caracteristica del recurso suelo-agua. a) Forma del estanque: - Rectangular - Circular - Poligonal b) Tipo de Estanque.- Se refiere a la forma de su construcción y pueden ser: - Por excavación (caso de la presente propuesta) - Por edificación c) Para determinar las dimensiones debe considerarse: - Cantidad de peces a mantenerse o cultivar. - La edad y talla de los peces (categoría de estanques) En nuestro caso se considera: Forma : Rectangular Tipo : Por excavación. Largo : 10.60m (exterior) Ancho : 03.00m (exterior) Altura : 0.90 m. (Estanque con fines de investigación y producción) II.- CONSTRUCCIÓN DE UN ESTANQUE Comprende los siguientes aspectos: a) Ubicación Los estanques deben estas ubicados en: Cerca de una fuente de agua El agua debe ser disponible en cantidad y calidad necesaria. El terreno debe tener una pendiente moderada, para la circulación del agua y su correspondiente oxigenación (menores a 10º) El estanque debe estar ubicado en un terreno semi permeable, para evitar o controlar la filtración. Los estanques deben ubicarse en terrenos que no compitan con la agricultura y ganadería, salvo que ofrezcan una alta y sostenible rentabilidad. b) Levantamiento de los taludes Constituyen las paredes del estanque, que pueden ser: vaciado con cemento o emboquillado con piedras y cemento. Para darle mejor funcionalidad, los taludes tienen una inclinación aproximada de 3% y su superficie debe quedar uniforme o lisa. 2 c) Dimensiones interiores del estanque Una vez concluido los taludes, el estanque queda con las siguientes dimensiones: - Largo 10.00 m. - Ancho superior 2.70 m. - Ancho inferior 2.50 m. - Altura en la entrada de agua 0.80 m. - Altura en la parte media 0.90 m. - Altura en la parte de la salida de agua 0.90 m. - Pendiente del estanque 3% d) Materiales a utilizar - Piedras Arena Hormigón Cemento 16 m3 01 m3 03 m3 16 bolsas Otros materiales complentarios como: madera, clavos alambre, tubos de PVC, pegamento, etc. e) Fondo del estanque Considerando que el estanque propuesto tiene caracter experimental y de producción, se diseña con tres secciones, la primera en la parte de la entrada del agua, como zona para el mantenimiento de alevinos y juveniles de trichomycteridos; la segunda zona para la producción del alimento natural (fito y zooplancton); la tercera zona diseñada para cobertizos y escondites de adultos y reproductores. III. ADECUACIÓN DEL ESTANQUE Antes de colocar a los peces, el estanque debe estar adecuado y preparado para la recepción de los especímenes. La adecuación incluye los siguientes aspectos: a) Sanidad Consiste en tomar las medidas profilácticas que incluyen: • Remoción del piso y limpieza de las raices y restos de vegetales, piedras y elementos extraños. • Secado del piso, por lo menos 2 días. • Desinfección de los taludes y el fondo del estanque con cal viva. b) Hábitat Consiste en preparar el fondo de acuerdo a la bioecología de la especie y la producción de alimento natural. Esta abarca los siguientes aspectos: 3 1.- Preparación del fondo; comprende: Preparación del sustrato para el desarrollo de fitoplancton, zooplancton y macrófitos. El sustrato debe tener 4 capas cada uno de 3 a 5 cm de espesor, las que den tener las siguientes características: Primero: tierra arcillosa, segundo: tierra negra, tercero: abono orgánico (estiercol de cerdo o ave) y cuarto: tierra negra. 2.- Preparación del filtro natural.- Debe estar constituido por tres capas de arena de diferente espesor entre 3 a 5 cm. Empezando del fondo las capas son: primero arena fina lavada, segundo cascajo grueso de 3 - 6 mm de diámetro y tercero una capa superficial de cascajo (tipo hormigón) de piedras planas de 10 a 20 mm de diámetro. 3.- Plantación de macrófitos.- De acuerdo al hábitat de la especie se realiza la plantación de macrófitos: Elodea potamogeton “llachu” y Myriophyllum elatinoides “hinojo”, Schoenoplectus tatora “Totora”, Chara sp, etc. 4.- Preparación de cobertizos.- considerando que los trichomycteridos son huraños y de hábitat bentónico, requiere de refugios; por lo que es necesario preparar una zona de penumbra y cobertizos, con piedras largas y planas. 5.- Siembra de alimento natural.- Antes de sembrar peces en el estanque, es necesario tener organismos que constituyan el alimento natural de los trichomycteridos; en este caso zooplancton: Hyalella sp “camaroncillo del lago”, Daphnia sp “pulga de agua”, fitoplancton y otros. 6.- Siembra de peces.- finalizada la adecuación del estanque, luego de 2 - 3 días, se procede a sembrar los peces y a partir de ese momento se hace el seguimiento del proceso de su adaptación en cautiverio. IV.- COSTO DE CONSTRUCCIÓN DE T ALLE 1. Materiales Piedra Cemento Hormigón Arena Madera Tubo PVC Alambre Nº 16 Clavos 2 ½ “ Unidad de Med ida Costo Unitar io S/. Pr ecio T otal S/. Cantidad 687.40 m3 Bolsas m3 3 m Unidad Unidad Kg. Kg. 16.90 17.30 30.00 30.00 3.00 10.00 2.20 2.00 16 16 3 1 2 1 1 1 Viaje 20.00 6 120.00 2. Transporte Trans. materiales 120.00 315.00 3. Mano de obra Maestro de obra Peón 270..40 276.80 90.00 30.00 6.00 10.00 2.20 2.00 Jornal TOTAL 15.00 21 315.00 S/. 1122.40 Fuente: IIP Qollasuyo – CIPP Chucuito, 2000 – 2002 4 5 Instituto de Investigación, Producción, Servicios y Capacitación “Qollasuyo” Centro de Investigación y Producción Pesquera Chucuito UNA – Puno DISEÑO DE AHUMADOR ARTESANAL PARA ESPECIES ÍCTICAS NATIVAS DEL LAGO TITICACA Ing. Pesq. Maria del Rosario Roncal Gutiérrez Ph. D. Sabino Atencio Limachi Blgo. René Alfaro Tapia PUBLICACIONES QOLLA Nº 09 Diciembre AÑO 2000 PUNO – 2000 - PERU 0 INTRODUCCIÓN Una de las actividades del Subcontrato 21.24 “Desarrollar la Capacidad de Programas de Pesca Artesanal en el Ámbito Peruano” del Proyecto PER/98/G-32 “Conservación de la Biodiversidad en la Cuenca del Lago Titicaca – Desaguadero – Poopo – Salar de Coipasa (TDPS)”, es el de desarrollar una tecnología al alcance y uso de los pescadores artesanales, para darle mayor valor agregado al producto pesquero que capturan en el lago Titicaca. Una de las formas de preservación de los productos hidrobiológicos es el AHUMADO, forma que se usó por las culturas chinas y egipcias, las mismas que podrían tener un uso masificado en el ámbito de la población ribereña del lago Titicaca. Asoc. IIP Qollasuyo - CIPP Chucuito UNAP 1 I. PLANTEAMIENTO DEL PROBLEMA Las capturas de peces en el altiplano peruano – boliviano son de gran volumen, pero los pescadores artesanales tienen la desventaja de desconocer algunos métodos que en muchos lugares son de uso frecuente. La preservación de los productos pesqueros tiene la finalidad de tener un tiempo más prolongado, para poder realizar su comercialización y darle un mayor valor agregado, lo que permitirá elevar la condición de vida del pescador artesanal, por lo que se plantea desarrollar alternativas de aspectos tecnológicos como el caso del ahumado del pescado. II. OBJETIVOS • • Inhibir el crecimiento bacteriano mediante el ahumado del pescado Dar mayor valor agregado al producto pesquero. III. ALCANCES Con el diseño y construcción de un ahumador artesanal se propone alcanzar los siguientes beneficios: Preservar el producto pesquero. Manejo y transporte adecuado de los productos pesqueros. Dar mayor valor agregado al producto. Ampliar el mercado de los productos hidrobiológicos. - IV. MATERIALES - Cilindro de latón. Varillas de fierro (10 metros). Tubería de latón de 4 pulgadas de diámetro. V. DISEÑO - VII El diseño del ahumador artesanal se alcanza en plano que se adjunta. El manipuleo del ahumador es de uso y operatividad no complicado, lo que garantizará una adecuada forma de preservación. CALCULOS Ahumado en Frío - Los tiempos de ahumado en promedio son mayores a 6 horas. La pérdida de peso está en rangos de 10 a 20%. Temperatura de 25 a 30 oC. Ahumado en Caliente - Los tiempos de ahumado en promedio son menores a 6 horas. La pérdida de peso está en rangos de 10 a 20%. Temperatura de 60 a 80 oC. 2 Ventana 10 cm. 20 cm. Ventana 65 cm 10 cm. 20cm. 20 cm. Topes de bastidores 20 cm. 5cm 40 cm. 10 cm. 8 cm 20 cm. HOGAR 40 cm. Visagra 10 cm. Visagra 38 cm. 10 cm. 58 cm. 20 cm. BASTIDOR 24 cm. HORNO 10 cm. Ventana con tapa Tapa del Ahumadero Anillo de Bastidor Asoc. IIP QOLLASUYO - CIPP CHUCUITO UNA-PUNO Dim ensión Fecha: en c entímetros Puno, enero del 2001 3 Instituto de Investigación, Producción, Servicios y Capacitación “Qollasuyo” Centro de Investigación y Producción Pesquera Chucuito UNA – Puno PROCESOS PARA: REPRODUCCIÓN ARTIFICIAL DE Orestias luteus, Orestias agassii y Orestias ispi Lic. Blgo. Brígida Paca Pantigoso Lic. Blgo. René Chura Cruz PUBLICACIONES QOLLA Nº 10 Diciembre AÑO 2000 PUNO – 2000 – PERU 0 INTRODUCCIÓN Para garantizar la conservacion y aprovechamiento sostenible de las especies ícticas nativas del lago Titicaca es necesario comprometer a las Instituciones del Sector y la población ribereña. La Asociación IIP Qollasuyo - CIPP Chucuito UNA - Puno, esta comprometida en estudiar y validar el proceso de reproducción de las Orestias. En esta oportunidad ofrecemos la Guía de Capacitación “Reproducción Artificial de carachi amarillo, carachi negro e ispi” con los resultados de los trabajos de investigación que se ha realizado. La transferencia de conocimientos a los pescadores debe ser sencilla, por lo cual el lenguaje que utilizamos esta en función a este objetivo. Asoc. IIP Qollasuyo - CIPP Chucuito UNAP 1 PROCESOS PARA LA REPRODUCCIÓN ARTIFICIAL DE Orestias luteus, Orestias agassii y Orestias ispi 1. OBTENCIÓN DE REPRODUCTORES En la actualidad no se cuenta con un plantel de reproductores en ninguna Institución o Centro de Investigación, por lo que la obtención de reproductores de Orestias, motivo de nuestro trabajo se hizo adquiriendo especímenes vivos de los pescadores. Por la práctica de pesca, las Orestias son capturadas con redes agalleras de 1 ¾ y 2¼” para “carachi amarillo” y “carachi negro”; y 5/8” - 1 pulgadas para “ispi”, las que son caladas en horas de la tarde y cobradas al día siguiente en la mañana, con una permanencia promedio de captura de las redes de 13 horas. Los reproductores para nuestro trabajo fueron acopiados en el Muelle Barco de la localidad de Chucuito y península de Chucuito. Otro punto de acopio fue la comunidad de Vilca Maquera del distrito de Pilcuyo, provincia de El Collao. 2. TRANSPORTE DE PECES VIVOS Una vez cobradas las redes, se procedió a extraer los reproductores tratando de no dañarlos y se colocó en recipientes con agua del lago y macrófitas; luego se cubrieron los recipientes con una tela oscura. El recipiente se adecuó en la movilidad para transportarlo al centro de reproducción artificial, oxigenando el agua durante el traslado, para evitar la muerte de los peces por anoxia. En los casos de Orestias ispi “ispi” y Orestias pentlandii “boga”, son especies que requieren altas concentraciones de oxígeno disuelto. 3. SELECCIÓN DE REPRODUCTORES PARA EL DESOVE Se realiza la selección para la reproducción artificial, considerando los siguientes aspectos: - Selección por sexos, Selección de los ejemplares de mayor talla y peso, Selección de peces en V estadio de madurez sexual (aptos), Aspecto morfológico normal, Productos sexuales sin rasgos de sangre, heces u otras impurezas. 4. MATERIALES Y EQUIPOS PARA LA INCUBACIÓN Y FECUNDACIÓN Para el proceso de reprodución artificial se utilizó los siguientes materiales, equipos y reactivos: - Recipientes para reproductores seleccionados, - Baldes medianos, - Fuentes aporcelanadas y placas petri para la recepción de ovas, semen y la fecundación artificial, - Plumas de ave y pinceles pequeños de pelo natural fino, - Probetas de 50 y 100 ml, - Agua destilada, - Mortero pequeño (almirez y mango), - Coladores pequeños de malla fina, - Estuche de disección, - Franela y servilleta limpia, 2 - Vasos de incubación de flujo vertical tipo Chasse, Bombillas de jebe con tubo de vidrio, Solución de verde de malaquita, Vernier, Aireadores, Soporte para los vasos de incubación. 5. CARACTERÍSTICAS DE LOS PRODUCTOS SEXUALES Los productos sexuales de las diferentes especies del género Orestias, deben presentar las características que se especifican en el cuadro Nº 01. CUADRO Nº 01 CARACTERÍSTICAS DE LOS PRODUCTOS SEXUALES DE ORESTIAS SEXO GRADO MADUREZ SEXUAL DIÁMETRO OVA ( mm) COLOR OVAS COLOR SEMEN Orestias luteus “carachi amarillo” MACHOS HEMBRAS V V MACHOS HEMBRAS V V MACHOS HEMBRAS V V MACHOS HEMBRAS V V Blanco lechoso 1.5 – 2.0 Amarillo Orestias agassii “carachi negro” Blanco lechoso 1.5 – 1.8 Amarillo transparente Orestias ispi “ispi” Blanco lechoso 1.0 – 1.2 Amarillo transparente Orestias pentlandii “boga” Blanco lechoso 1.5 – 1.8 Amarillo transparente Fuente: Asociación IIP Qollasuyo - CIPP Chucuito UNA Puno, 2000 – 2002. El diámetro de ovas es diferente para cada especie en función a la talla y madurez sexual. El color de las ovas en Orestias va entre amarillo y amarillo transparente; mientras que el semen es de color blanco lechoso para el V estadío y blanco pálido en el VI estadio. 6. PROCESO DE DESOVE Y FECUNDACIÓN El desove se realiza por el método de la trascolación, que consiste en friccionar suavemente el vientre de los reproductores, empezando en la parte pectoral, para avanzar hacia la parte del poro genital. En la fecundación se utiliza el método seco, que consiste en recepcionar las ovas aptas en un recipiente seco, al cual se agrega el semen del macho que es distribuido y mezclado sobre las ovas con ayuda de una pluma de ave, con movimientos circulares hasta que se logre fecundar el mayor porcentaje posible; enseguida se agrega agua y se lava repetidas veces, para luego ser colocadas en la incubadora. 3 6.1. Desaglutinación de las ovas fecundadas Las ovas de las Orestias son adherentes, cuentan con filamentos en forma de cilios y racimos. Luego de la fecundación, y a fin de desaglutinar se agrega agua, formándose grumos o racimos, que son separados o desaglutinados en forma mecánica. Las ovas separadas se lavan con agua hasta que queden limpias, luego se deja en reposo durante 15 a 20 minutos para completar el proceso de hidratación. Finalmente las ovas fecundadas son contadas por cualquiera de los métodos: gravimetrico, volumétrico o conteo directo. 6.2. Incubación y desarrollo embrionario La incubación es el proceso biológico que comprende la fecundación, el desarrollo embrionario y termina con la eclosión (nacimiento). Este proceso dura de 30 a 40 días, dependiendo de la temperatura del agua. En el caso de las Orestias ispi “ ispi”, estas etapas tienen una duración de 30 a 46 días, dependiendo básicamente de la temperatura del agua. En el caso de Orestias luteus y Orestias agassii este período de incubación es de 20 a 43 días La incubación en las ovas fecundadas de Orestias, se hizo en incubadoras de flujo vertical “vasos tipo Chasse”, al cual se colocaron en promedio de 2000 a 3000 ovas fecundadas. GRAFICO Nº 01 VASO DE INCUBACION TIPO CHASSE Durante el desarrollo embrionario de Orestias ispi “ispi”se distinguen las siguientes etapas: 4 6.2.1. Ova fecundada FOT O N° 01. Vista frontal de la formación del blastodisco y el espacio vitelino, en esta foto se observa la disposición de blastodisco en la ova , que es de forma esférica y con apariencia de una gota de aceite, esta se forma a los 2 días de fecundación del oocito tiene un color amarillo transparente. 6.2.2. Formación del eje embrionario y los órganos rudimentarios FOT O N° 02. De 7 a 8 días se observó la formación del eje embrionario, los órganos rudimentarios, la formación del saco vitelino y esbozos de notocordio que rodea el embrión, este con presencia de pigmentos no muy oscuros. 5 6.2.3. Segmentación de la sección anterior del cuerpo FOT O N° 03. A los 9 y 10 días se percibió la segmentación de la sección anterior del cuerpo, formación de la vesícula cefálica, las vesículas oculares, la pigmentación aumenta de forma irregular del pigmento que se distribuye a lo largo del dorso del notocordio y el vitelo se dispone alrededor del embrión. 6.2.4. Rompimiento de la tapa del vitelo FOT O N° 04 . De 15 a 16 días aparecen los ojos, el rompimiento de la tapa del vitelo y separación de la rudimentaria sección caudal se realizó con movimientos lentos y esporádicos a medida que se desprendió el embrión del vitelo. 6 6.2.5. Pigmentación de los ojos e incio de la pulsación del corazón FOT O N° 05 . Durante 20 a 25 días se observó la pigmentación de los ojos e inicio de la pulsación del corazón, desarrollo del sistema vitelino – intestinal, apertura de la cavidad bucal, aparición de opérculos y formación rudimentaria de las aletas. 6.2.6. Eclosión FOT O N° 06. Eclosión (nacimiento) de 30 a 40 días, la larva en el momento de la eclosión mide aproximadamente de 3 a 3.5 mm. El peso del saco vitelino le impide la flotación por lo que permanece en el fondo de la incubadora. La reabsorción del saco vitelino duró de 7 a 10 días, donde las larvas pasan a ser alevinos. 7 7. LARVAJE Se denominan larvas a los embriones libres (eclosionados) que aun no se parecen a un pez adulto, se caracterizan por tener un saco vitelino en forma de una bolsa en el vientre, la misma que contiene sustancias nutritivas procedentes de la ova fecundada y que constituye la única fuente de energía y alimentación del pez durante los primeros días de su vida, en que su aparato digestivo aún no reune condiciones para asimilar alimentos exógenos. La eclosión se produce cuando se completa el desarrollo embrionario y el embrión se vuelve activo, rompiendo el tejido de la ova (corion). No todos los embriones eclosionan en un solo día, demoran hasta 6 días, dependiendo de la temperatura del agua. Al embrión eclosionado se le conoce como larva y se caracteriza por tener un saco vitelino que le sirve como fuente de alimentación endógena. La reabsorción del saco vitelino se inicia inmediatamente después de la eclosión de la larva, esta, depende de la temperatura del agua y del tamaño de la ova. En cuanto a su conducta, las larvas de las Orestias se caracterizan por que durante los primeros días después a su eclosión, permanecen en la superficie del fondo formando aglomeraciones que poco a poco se hacen mas sueltos hasta que empiecen a nadar paulatinamente, lo cual ocurre cuando el tamaño de su saco vitelino se ha reducido en casi la mitad. Longitud total Longitud estandar Ojo Melamositos Aleta caudal Zona opercular Cavidad viceral Boca Aletas pectorales Longitud de la Cabeza Ancho del cuerpo 8. ALEVINAJE La reabsorción del saco vitelino para las cuatro especies es entre 5 a 8 días, a una temperatura de 13º C, llegando hasta 10 días para temperaturas bajas El alevino, inicialmente, es un pez pequeño que morfológicamente, aún no se asemeja totalmente a un pez adulto, su coloración no es tan característico en cada especie. Los alevinos a partir de esta etapa necesitan de una alimentación exógena. 8 9 Instituto de Investigación, Producción, Servicios y Capacitación “Qollasuyo” Centro de Investigación y Producción Pesquera Chucuito UNA – Puno ELABORACIÓN DE CONSERVAS DE Orestias agassii “carachi negro” y Orestias luteus “carachi amarillo” - Salsa de tomate - Grated en aceite Lic. Blgía. René Chura Cruz Lic. Blgía. Brígida Paca Pantigoso PUBLICACIONES QOLLA Nº 11 Febrero AÑO 2001 PUNO – 2001 – PERÚ 0 INTRODUCCIÓN Dentro de los objetivos a cumplir por el Subcontrato 21.24 “Desarrollar Programas de Pesca Artesanal en el Ambito Peruano del Sistema TDPS”, es el de realizar la transformación de especies ícticas nativas. Una presentación del pescado es la conserva; que es una forma para mantener por más tiempo; adecuado para transportar este alimento a lugares más lejanos y con mejores precios para nuestros “carachis”, “ispis” y “mauris”. Las conservas se realizan desde 1795 y en nuestra región esta actividad tiene 40 años de práctica. No obstante los resultados positivos de estos ensayos de conservas de Especies Icticas Nativas, consideramos que no es recomendable su implementación en forma comercial; porque ello significaría la depredación definitiva de nuestras especies nativas, tal como ocurrió con la “trucha”, cuando se instalaron conserveras en la década del 60. Asoc. IIP Qollasuyo - CIPP Chucuito UNA - Puno 1 I. CONSERVAS DE Orestias agassii y Orestias luteus Se realizó en forma experimental conservas de las especies Orestias agassii “carachi negro” y Orestias luteus “carachi amarillo” en salsa de tomate y grated en aceite. La materia prima estuvo compuesta por peces pertenecientes a las especies de Orestias agassii “carachi negro” y Orestias luteus “carachi amarillo”, para sacar 250 latas de conserva se necesita 70 kilos de pescado. Las latas utilizadas fueron de hojalata. II. SALSA DE TOMATE 2.1. Diagrama de flujo El diagrama de flujo para Orestias agassii “carachi negro” y Orestias luteus “carachi amarillo” en salsa de tomate es: Materia Prima Recepción y pesado Lavado Eviscerado Lavado Lavado Lavado Escurrido Lavado de latas Envasado Pre cocción Limpieza y escurrido Adición de líquido de gobierno Sellado Lavado de latas Esterilizado Enfriado Secado Etiquetado y empacado Almacenado 2 2.2. Materia prima Las especies que se utilizaron como materia prima para la transformación en conserva, fueron las que comúnmente se les conoce como “carachi negro” y “carachi amarillo” en buenas condiciones. 2.3. Recepción y pesado En la planta conservera se recepcionó la materia prima en cajas de plástico, para inmediatamente realizar el pesado, obteniéndose un peso total de 70 kilos. 2.4. Lavado El pescado entero es lavado con el objeto de retirar cuerpos extraños. 2.5. Eviscerado Se hace un corte en la parte abdominal de los peces, para retirarles las vísceras; previamente se eliminan las escamas, la cabeza y las aletas, dejando el pescado para el proceso de transformación propiamente dicho, (los productos eliminados pueden ser utilizados para el ensilado). 2.6. Lavado Se lava el pescado para quitar residuos de sangre, mucus y otros. 2.7. Escurrido El pescado es escurrido por 30 minutos antes de ser envasado. 2.8. Lavado de latas Las latas extraños. vacías se lavan en agua tibia, para quitarles el polvo y cuerpos 2.9. Envasado Se llenan estos envases acomodando los trozos de pescado tratando de no dejar espacios libres; se pesa cada una de ellas hasta obtener un peso de 170 gramos. Se toma las precauciones de limpieza para evitar la contaminación del producto. 2.10. Pre cocción Se cocinan los trozos de pescado, a fin de disminuir los líquidos de la carne y mejorar la textura del músculo. 2.11. Limpieza y escurrido Se eliminan algunos elementos de la carne cocida para mejorar la presentación de la conserva; y se escurre el líquido. 2.12. Adición del líquido de gobierno Se adicionó salsa de tomate en una cantidad de 50 ml por lata aproximadamente. Para la elaboración de la salsa de tomate se hace un puré de tomate (sin cáscara y semillas) con agua, aceite, pimienta, clavo de olor, hojas de laurel y sal. 3 2.13. Sellado El sellado se realiza con un sellador manual de latas, el que debe ser controlado para garantizar un sellado que evite el paso de material que contamine el producto. 2.14. Lavado de latas Se procede al lavado de latas para eliminar la grasa que hubiera sido derramada por efecto del sellado; esta actividad se realiza con agua caliente y detergente, para luego enjuagar con agua varias veces. 2.15. Esterilizado Se colocan las latas en canastillas, para ser introducidas en una marma por 75 minutos. 2.16. Enfriado Se usa agua para reducir la temperatura de las latas . 2.17. Secado Se secan los envases, especialmente los bordes del sellado para evitar que se oxiden. 2.18. Etiquetado y empacado Los envases son etiquetados y encajonadas, en cajas de cartón de una capacidad de 48 latas. 2.19. Almacenamiento Las cajas con el producto son almacenados por espacio de 40 días, para ver si se inchan las latas. 4 III.- EN GRATED 3.1. Diagrama de flujo de la elaboración de conservas de Orestias agassii y Orestias luteus en grated Materia Prima Recepción pesado Lavado Eviscerado Lavado Escurrido Lavado de latas Cocción Molido Envasado Adición de líquido de gobierno Sellado Lavado de latas Esterilizado Enfriado Secado Etiquetado y empacado Almacenado El proceso de elaboración de grated, es similar al de la elaboración de conservas en salsa de tomate, hasta el lavado de latas, con la diferencia que en este proceso se utiliza la cocción, molido, envasado y el líquido de gobierno que se adiciona es aceite. 5 3.1. Cocción Los trozos de pescado tienen un cocimiento en la marma por un tiempo de 75 minutos. 3.2. Molido Se saca el producto y se deja enfriar, en este paso se revisa esto para eliminar escamas y otros cuerpos extraños que podrían observarse, luego de realizar esta observación se procede al molido del músculo. 3.3. Envasado La carne de pescado molida se coloca en los envases. Se pesan las latas con el contenido hasta llegar a 160 gr por lata. 3.4. Líquido de gobierno A los envases con el producto se les adiciona aceite en una cantidad de 30 ml y 3 gr de sal. 6 7 Instituto de Investigación, Producción, Servicios y Capacitación “Qollasuyo” Centro de Investigación y Producción Pesquera Chucuito UNA – Puno ELABORACIÓN DE SECO SALADO DE Orestias ispi “ispi” Equipo Profesional IIP Qollasuyo – CIPP Chucuito UNA Puno PUBLICACIONES QOLLA Nº 12 Febrero AÑO 2001 PUNO – 2001 – PERU 0 INTRODUCCIÓN El Seco Salado es una forma de preservar el pescado por más tiempo. Esta forma de conservación se realiza desde nuestros antepasados; pero el presente manual tiene algunas modificaciones que pueden ser utilizadas para mejorar nuestro conocimiento de seco salado y preservarlo por más tiempo y darle al producto mejores precios por la calidad del pescado. Este aporte de tecnología modificada se debe al cumplimiento de los objetivos del subcontrato 21.24 “Desarrollar Programas de Pesca Artesanal en el Ámbito Peruano del Sistema TDPS” Asoc. IIP Qollasuyo - CIPP Chucuito UNA - Puno 1 SECO SALADO DE Orestias ispi “ISPI” Una de las formas de conservar a los pescados es el seco salado, logrando que el producto tenga una mayor duración y así pueda ser transportado a otros lugares o almacenados para su comercialización. El principio del seco salado es el curado en sal en el que se elimina el agua y se sustituye en gran parte con la sal. 1. Materiales - Sal Ácido ascórbico Lavadores Bolsas de polietileno Balanza Rejillas de secado Selladora al vacío DIAGRAMA DE FLUJO DEL SECO SALADO EN Orestias ispi “ISPI” Materia Prima Lavado Escurrido Pre Tratamiento Pila Húmeda PRE TRATAMIENTO A PRE TRATAMIENTO B Segundo Salado Oreado Oreado Desecado Desecado Emvasado y sellado Embasado y sellado Almacenado P Almacenado 2 2. Materia prima Se realizó este experimento con “ispi” entero, el peso de inicio fue de 16.8 kilogramos, el que estuvo en buenas condiciones. 3. Lavado Se procedió al lavado del pescado con el fin de quitarle cualquier materia extraña que estuviera adherida a los peces. 4. Escurrido Una vez lavada la materia prima se escurre por 10 a 15 minutos para proseguir con el proceso. 5. Pre tratamiento Se realiza un pre tratamiento de agua con sal y ácido ascórbico para evitar la oxidación del pescado, para esto se utiliza. - Sal Ácido ascórbico Agua 0.750 Kg. 0.015 Kg. 5 lt. Estos productos se disolvieron en agua, disponiendo el pescado en esta solución por espacio de 10 minutos para ambos tratamientos. 6. Salmuera en pila húmeda Este proceso tiene dos tratamientos, para lo cual la materia prima se divide en partes iguales cada una con un peso de 8.2 Kg. El pescado fue ordenado en una caja de fibra de vidrio colocando sal en el fondo, una capa de pescado y una capa de sal sucesivamente, en forma ordenada. Las concentraciones utilizadas fueron. Materiales Pescado Sal Tratamiento A 8.20 Kg. 2.52 Kg. Tratamiento B 8.40 Kg. 3.36 Kg. En el tratamiento A la cantidad de sal que se utilizó es del 30%, en referencia al peso del pescado. En el tratamiento B se usó el 40% de sal en referencia al peso del pescado. El tiempo de duración del apilamiento fue de tres días, en ambos casos, luego de lo cual se observó el estado del pescado y se escurre la salmuera. 7. Segundo pre tratamiento Se realiza un segundo pre tratamiento de agua con sal y ácido ascórbico para evitar la oxidación del producto, se utilizó las mismas concentraciones de sal y ácido ascórbico que en primer pre tratamiento. 8. Segundo salado En el tratamiento A se utiliza la pila seca con 20% de sal en relación a su peso por 24 horas, en cambio en el tratamiento B se pasa directamente al oreado. 3 9. Oreado Ambos tratamientos se dejan oreando por 15 minutos y luego se colocan en las parrillas para hacerlos secar 10. Desecado Los peces se colocaron en las parrillas en forma ordenada y se llevaron al medio ambiente: - Tratamiento A, se seca el producto por espacio de 9 días; obteniéndose un promedio del 30% de seco salado en relación a la materia prima inicial. - Tratamiento B , el producto se deja por 12 días; obteniendo un promedio del 36% de seco saldo en relación a la materia prima inicial. 11. Envasado y sellado Para tratamientos se envasó el producto en bolsas de plástico, las que luego fueron selladas 12. Almacenamiento El almacenamiento se hace al ambiente. 4 5 Instituto de Investigación, Producción, Servicios y Capacitación “Qollasuyo” Centro de Investigación y Producción Pesquera Chucuito UNA – Puno ELABORACIÓN DE AHUMADO DE Orestias ispi “ispi” Equipo Profesional IIP Qollasuyo – CIPP Chucuito UNA Puno PUBLICACIONES QOLLA Nº 13 Febrero AÑO 2001 PUNO – 2000 – PERU 0 INTRODUCCIÓN D entro de los objetivos a cumplir por el subcontrato 21.24 “Desarrollar Programas de Pesca Artesanal en el Ámbito Peruano del Sistema TDPS”, hemos considerado la transformación de las especies ícticas nativas del lago Titicaca, para lograr un mayor tiempo de conservación de pescado para su comecialización, así como para dar un mayor valor agregado al producto. En esta ocasión presentamos una de las formas de transformación del pescado que es el ahumado, para lo cual hemos diseñado un ahumadero artesanal que puede estar al alcance del pescador artesanal de nuestro medio, con un costo sumamente ecocómico. El ahumado se realiza en frío y en caliente, pero en esta oportunidad les explicamos en un lenguaje muy sencillo, el ahumado en caliente, que fue experimentado previamente por el equipo profesional de la Asoc. IIP Qollasuyo CIPP Chucuito UNA Puno. Asoc. IIP Qollasuyo – CIPP Chucuito UNA Puno 1 AHUMADO De Orestias ispi “ISPI” Actualmente las especies ícticas del lago Titicaca se puede transformar en pescado ahumado, esto para darle un sabor agradable y además puede ser conservado por más tiempo, esta forma de presentación facilita el transporte a otros mercados. La conservación del ahumado se debe a los efectos combinados de la desecación, la acción de sustancias químicas y bactericidas presentes en el humo. Se utilizan dos tipos de procesos de ahumado: el ahumado en frío y caliente. En el experimento se utilizó el ahumado en caliente, para tener un producto cocido (las temperaturas oscilaron entre 60 y 80 o C) y al mismo tiempo se hace el ahumado del producto. 1. Materiales Los materiales ha utilizar son: - Orestias ispi con un peso eviscerado de dos kilogramos. Sal Ácido ascórbico Azúcar rubia Coronta de maíz Viruta de madera Termómetro de –10 a 100o C Balanza Lavadores Cajas escurrideras Ahumadero Bolsas de polietileno Selladora al vacío. 2 2. Diagrama de flujo del ahumado en Orestias ispi “ispi” Materia Prima Pesado Lavado Eviscerado Lavado y escurrido Pesado Pre Tratamiento Salado en Salmuera TRATAMIENTO 1 TRATAMIENTO 2 Escurrido Ahumado y cocinado Enfriado Empacado y sellado Almacenado 2.1. Materia prima Se utiliza 2 kilogramos de pescado de la especie Orestias ispi “ispi” 2.2. Lavado Se lavan los pescados para quitarles la tierra o residuos orgánicos a estos, por el transporte de puerto hacia la planta de tratamiento. 2.3. Eviscerado Se separan las vísceras para que el pescado quede limpio; se abre el pez en forma de filete, tratando con mucho cuidado para no lacerar o desgarrar el músculo del pez. 3 2.4. Lavado y escurrido Se lavan los peces procesados, quitando todo residuo de vísceras, luego se procede al escurrido del agua por un espacio de diez minutos. 2.5. Pesado El peso inicial de la materia prima al comenzar el proceso de ahumado es de 2 kilogramos. 2.6. Pre tratamiento Se sumerge el pescado en salmuera a una concentración del 3%: - Agua Sal Acido ascórbico 5 lt. 150 gr. 15 gr. Estos materiales se mezclan, para luego colocar los peces en esta solución por espacio de cinco minutos. 2.7. Salado en salmuera Este proceso puede realizarse de dos maneras, de acuerdo al tipo de solución que se utiliza: Primero Para un kilo de pescado que se coloca en salmuera, se utiliza la siguiente solución: - Sal Azúcar Agua Tiempo 1.0 Kg. 0.175 Kg. 5 lt. 8 minutos Esta cantidad de sal y azúcar representan el 20% y el 3.5% de concentración, en referencia al peso total eviscerado del pescado. Segundo Para un kilo de pescado que se coloca en salmuera, se utiliza la siguiente solución: - Sal Azúcar Agua Tiempo 0.750 Kg. 0.175 Kg. 5 lt. 15 minutos Esta cantidad de sal y azúcar representan el 15% y 3.5% de concentración, en referencia al peso eviscerado total del pescado. 2.8. Escurrido Luego del salado en salmuera se lleva a un recipiente para escurrirlos por un lapso aproximado de 20 minutos. 2.9. Ahumado y cocinado Se colocan los peces en la parrilla en forma ordenada; luego se lleva al ahumadero el cual debe estar encendido. Este proceso dura cuatro horas; se debe realizar observaciones cada cierto tiempo para verificar el cocimiento y la textura del producto. El producto obtenido en promedio es el 36% del producto inicial. 4 2.10.Enfriado Se sacan las parrillas del ahumadero y se deja enfriar el producto por espacio de 4 a 5 horas. 2.11.Empaquetado y sellado El ahumado se coloca en bolsas especiales de plástico, en forma ordenada, luego se realiza el sellado al vacío con una presión de –0.6 bar, por un tiempo de 20 segundos por bolsa. 2.12.Almacenamiento El pescado ahumado y embolsado, para su mejor conservación, se almacena en un ambiente frío. 5 Instituto de Investigación, Producción, Servicios y Capacitación “Qollasuyo” Centro de Investigación y Producción Pesquera Chucuito UNA – Puno PREPARACIÓN DE INCUBADORES ARTESANALES PARA ESPECIES ÍCTICAS NATIVAS Blgo. René Chura Cruz PUBLICACIONES QOLLA Nº 14 Marzo AÑO 2001 PUNO – 2001 – PERU 0 INTRODUCCIÓN El proceso de reproducción de las especies ícticas nativas del lago Titicaca implica la perpetuación de especies. Este proceso hoy en día con la intervención del hombre, se ha logrado la reproducción artificial en ambientes controlados. La reproducción artificial implica el desove, fecundación y el desarrollo del proceso embrionario en incubadores de diferentes tipos. Existe una variedad de incubadores modernos y sofisticados, pero que no están al alcance de los pescadores. El equipo de la Asociación IIP QOLLASUYO - CIPP CHUCUITO ha diseñado un modelo de incubadora artesanal, que se puede usar y construir para el proceso de incubación in situ, por los propios pescadores. Asoc. IIP Qollasuyo - CIPP Chucuito UNAP 1 MATERIALES: - 01 botella descartable de 2 lts. de capacidad, transparente y con tapa 01 frasquito de terokal 1/8 Gln. de cola sintética 01 pedazo de corcho y/o boya 01 soporte ó trípode 01 pedazo de celocilla de color verde de 1 mm de cocada 01 tijera 01 cuchillo 01 regla milimetrada 01 plumón indeleble. PROCEDIMIENTO - La botella debe ser desinfectada con una a dos gotas de cloro disueltas en 500 ml de agua, para luego enjuagarlos repetidas veces; para la eliminación de agentes patógenos. - Realizar el marcaje de la periferie de la base de la botella, como se observa en la Figura Nº 01. - Cortar con la ayuda de la tijera sobre la marca. FIGURA 01 Recorte en esta zona - Marcar en la parte inferior vaso un rectángulo de 3 x 5 cm y cortar únicamente en los laterales y doblar en forma perpendicular como observa la Figura Nº 02. 2 FIGURA 02 3 cm 5 cm - En otra botella cortar una lámina de 11 x 8 en la cual se hace el trazo y corte de un trapecio con una altura de 8 cm. y la base inferior de 7 cm. tal como se indica en la Figura Nº 03 FIGURA Nº 03 3.0 11.0 cm 5.0 3.0 Cortar Doblar 80 cm 1. 0 1. 0 - Doblar los extremos del trapecio tal como se observa Figura Nº 04. FIGURA 04 - Pegar la canaleta en el vaso aplicando terokal a la superficie sombreada FIGURA 05 Aplicar Terokal 3 - El vaso con la canaleta debe quedar de siguiente manera FIGURA 06 - Cortar y pegar una malla rectangular de 4 x 6 cm. (tul); como se observa en la figura siguiente FIGURA 07 - Taponar la boca de la botella con un corcho de 1 pulg. de diámetro y 1 pulg. de altura, fijando el corcho con terokal. FIGURA 08 Adecuado de Corcho de 1 & x 2.5 cm altura 2.5 cm 4 - La superficie de la parte superior debe quedar liza y totalmente sellado tal como se observa en la figura FIGURA 09 Corcho Pegamento DISEÑO FINAL DE VASO DE INCUBACIÓN SOBRE UN TRIPODE 5 Instituto de Investigación, Producción, Servicios y Capacitación “Qollasuyo” Centro de Investigación y Producción Pesquera Chucuito UNA – Puno ALIMENTACION INICIAL DE ALEVINOS DE ORESTIAS Ph. D. Sabino Atencio Limachi PUBLICACIONES QOLLA Nº 15 Abril AÑO 2001 PUNO – 2001 – PERU 0 INTRODUCCIÓN C ontinuando con los trabajos del proceso de la reproducción artificial de especies ícticas nativas de la Cuenca del Sistema TDPS; en el presente número ponemos a disposición los resultados de los trabajos realizados en Alimentación inicial de alevinos de Orestias. Las experiencias logradas, deseamos compartir con los pescadores artesanales de la Cuenca del Sistema TDPS, a quienes ofrecemos el presente Boletín que fue preparado con los aportes del equipo técnico de la Asoc. IIP Qollasuyo - CIPP Chucuito UNA - Puno Asoc. IIP Qollasuyo - CIPP Chucuito UNAP 1 ALIMENTO INICIAL DE ALEVINOS DE Orestias Según los estudios de la alimentación natural de las Orestias, en sus primeros estadíos; se conoce que estas especies se alimentan de especimenes vivos como microorganismos y estados larvarios de zooplancton. En base a estos conocimientos, en la alimentación de los alevinos obtenidos artificialmente, estamos empleando como alimento: - - Larvas y estadios juveniles de zooplancton, específicamente: Daphnia, Cyclops, Rotíferos, etc. Estos especÍmenes son capturados en el lago Titicaca. Por la imposibilidad de conseguir regularmente los especimenes señalados, se cuenta con alimento vivo cultivado, entre ellos tenemos: Anguilillas silusiae ( Panagrellus silusiae) “microgusanos” Protozoarios : Los infusorios. 1. ALIMENTOS VIVOS CULTIVADOS 1.1. Anguilillas silusiae ( Panagrellus silusiae) “microgusanos” Pertenecen al género de las Anguilulas; son pequeños gusanos de color blanco, de mas o menos un milímetro de largo y muy delgados. Constituyen un buen alimento, especialmente para los peces recién nacidos (alevinos de primera fase), tienen un alto contenido de proteinas (62%) (G. Sanz Málaga, 1996). 1.2. Infusorios Son protozoarios, animales unicelulares, microscópicos, más evolucionados. Dotados de prolongaciones denominados cilios o pestañas vibrátiles, mediante las cuales se desplazan en el agua. Su reproducción es asexual, por división celular o asexual, por conjugación. De todos los infusorios, el más grande (250 micrones) es de interes como alimento para los peces. Se recomienda como alimento para las crías recien nacidas, por lo menos en sus primeros días de vida (alevinos de primera fase). 1.3. Forma de suministro del alimento - Los “microgusanos” nadan hasta descender al fondo, donde pueden vivir aproximadamente dos día. La forma como se le suministra, es que de los recipientes de cultivo (tapers) los “microgusanos” cosechados, con ayuda de una espátula o una pluma de ave, luego traspasados a un pequeño recipiente de vidrio o plástico (vaso) con agua para ser dispersado; luego de ello el aguas con “microgusanos” se le agrega al acuario contenedor de alevinos. Esta operación se realiza de 3 a 5 veces al día. - Los infusorios, del medio de cultivo son cosechados, con un cucharón, de lo cual se toma 1 a 2 cucharillas de café para echarlos a cada acuario por 3 a 5 veces al día. 2 2. ALIMENTOS NO VIVOS Para combinar y complementar la dieta de los alimentos para los alevinos de las Orestias, venimos utilizando. 2.1. Sera micrón Es un alimento de cría microfino para todos los peces de las especies ovíparas que pueden comer inmediatamente después de comenzar a nadar. Este producto fue adquirido en el comercio; es un polvillo verdoso. Para suministrarlo a los alevinos, se coge una pequeña cantidad (pisca) de micrón sobre un pedazo de vidrio y se disuelve en agua de acuario para formar una masa en forma de papilla lo cual se suministra a los alevinos, con ayuda de una espátula o pluma de ave, removiéndolo en el agua del acuario. 2.2. Yema de huevo duro Se suministra a los alevinos, como alimento alternativo, intercalando con los alimentos vivos. La yema de huevo duro, se suministró de manera similar al “micrón”; es decir preparando una pequeña cantidad de “papilla” y luego se suministra a los alevinos, disolviéndo en el acuario con ayuda de una espátula o pluma de ave. Tanto el micrón como el huevo duro, se suministró de 3 a 5 veces al día. 3 Instituto de Investigación, Producción, Servicios y Capacitación “Qollasuyo” Centro de Investigación y Producción Pesquera Chucuito UNA – Puno TAXONOMÍA DE LA ICTIOFAUNA NATIVA DEL LAGO TITICACA Ph.D. Sabino Atencio Limachi PUBLICACIONES QOLLA Nº 16 Julio AÑO 2001 PUNO – 2001 - PERU 0 INTRODUCCIÓN La identificación de las características taxonómicas de la ictiofauna nativa del Lago Titicaca datan de dos siglos anteriores; estas expediciones han descrito los diferentes aspectos con los que hacen resaltar la diferencia de cada uno las especies. El Equipo Profesional de la Asociación IIP Qollasuyo - CIPP Chucuito UNA Puno, estan comprometidos en estudiar, recopilar y validar estas Características Taxonómicas . En esta oportunidad ofrecemos una Guía de Técnica “Taxonomía de la ictiofauna nativa del lago Titicaca” con lo que alcanzamos una recopilación desde el aporte de los primeros investigadores a la fecha. Asoc. IIP Qollasuyo - CIPP Chucuito UNAP 1 APORTES A LA REVISIÓN TAXONOMICA DE LA ICTIOFAUNA NATIVA DEL LAGO TITICACA Los trabajos científicos sobre la taxonomía de la ictiofauna nativa del lago Titicaca, datan cerca de dos siglos; entre los primeros investigadores se tienen a: Pentland, 1830; Valenciennes, 1839; Tschudi, 1845; Cuvier y Valenciennes, 1846; Castelnau, 1855; Gunther, 1866; Garman, 1876-1895; Cope, 1876, 1877. Posteriormente continuaron: Pellegrini, 1902; Bouanger, 1902; Starks, 1906; Everman y Radclife, 1909,1917; Meyers, 1931; Rendahl, 1937; Eigenmann y Allen, 1942. El estudio más extenso de la taxonomía de peces nativos del Lago Titicaca fueron las recolecciones hechas por la expedición de Percy Sladen, en 1937 (W ilson, 1939) y los análisis emprendidos por Tchernavin, de las colecciones del Museo Británico (Tchernavin, 1944A; Tchernavin, 1944B;). Entre los últimos trabajos referentes a la ictiofauna del Lago Titicaca, se tienen los trabajos de: Lauzanne, 1981; Villwock W., 1983; Parenti L.R. , 1984; Ortega y Vari, 1986. 1. ORDEN Cyprinodontiformes Berg, 1940 Del Orden Cyprinodontiformes, se conocen ejemplares fósiles desde el periodo del oligoceno. Está representado por 2 Sub Ordenes: Cyprinodontoidei (el poro genital se encuentra delante de la aleta anal) y Anablyopsoidei (el poro genital se encuentra en el cuello o zona yugular). Las relaciones filogenéticas del Orden Cyprinodontiformes, aún no están suficientemente claras. La mayoría de los actuales ictiólogos, a este Orden , lo relacionan con los Esociformes (Starks, 1904). Por otro lado, consideran que los Cyprinodontiformes tienen su origen, directamente en el Orden Clupeiformes (Gregory, 1933). Los Cyprinodontiformes, son peces óseos que tienen una longitud que oscila de 2 hasta 30 cm. Exteriormente, son similares con los Cypriniformes; con 4-8 radios en la membrana branquial, vejiga natatoria cerrada (fisóstomo). Aletas sin radios duros o espinas. Una sola aleta dorsal. Escamas cicloideas. No tienen línea lateral y si tienen, es muy poco notoria. En las mandíbulas, tienen dientes menudos. En la cintura escapular no tienen el mezacoracoideo. Son generalmente peces de aguas dulces y salobres, muy raramente marinos. Habitantes de regiones tropicales y sub tropicales de todos los continentes, a excepción de Australia. Algunas especies como los peces ciegos viven en aguas de las cavernas cársicas de América del Norte. Los Cyprinodontiformes, abarcan 9 familias: Cyprinodontidae, Horaichthidae, Oryziatidae, Ambliopsidae, Poecilidae, Tetraphtalmonidae, Tomeiuridae, Jeninsiidae, Goodeidae. Entre todas las familias abarcan mas de 400 especies. Representantes de 4 familias como: Poecilidae y Tetraphtalmonidae, son vivíparos. Algunas especies como por ejemplo Cyprinodon macularis , viven en aguas termales, ante temperaturas hasta de 50 ºC. Muchos representantes de los Cyprinodontiformes, son peces de acuario, por ejemplo: Gambusia affinis “gambusia” Amblioosis spelaea “peces ciegos del norte” Anableps tetraphtalmus “cuatro ojos” 2 Más de 25 especies de los Cyprinodontiformes, están considerados en el Libro Rojo de la Organización Mundial para la Protección de la Naturaleza, que se refieren a peces en peligro de extinción y extinguidos. 1.1. SUB ORDEN Cyprinodontoidei Jordan, 1923 Se caracterizan por tener el poro anal, delante de la aleta anal, el desarrollo de sus ojos es normal. En la era terciaria tuvieron una distribución más amplia que en la era actual; específicamente habitaron en aguas de la latitudes templadas de América del Norte y Europa. Por la influencia del Periodo Glaciar, el espacio de su propagación en el periodo cuaternario, se redujo. El Sub Orden Cyprinodontoidei, abarca dos Súper Familias: Poeciloidae y Cyprinodontoidae. 1.1.1. SUPER FAMILIA Poeciloidae Son generalmente vivíparas. Son peces pequeños, ampliamente distribuidos en aguas dulces y rara vez en aguas marinas de Norte América y en la zona Norte de Sudamerica. Abarca cinco familias: Anablepidae, Poecilidae, Tomeuridae, Jeninsiidae y Goodeidae. 1.1.1.1. Familia Anablepidae Abarca un solo género: Anableps, cuyo representante es el Anableps tetraphthalmus L. que habita en pequeñas lagunas. La vista de estos peces está adaptada para ver en el medio aéreo y en el medio acuático. La alimentación de los Anableps lo constituyen pequeños invertebrados y en mayor proporción insectos terrestres. Como la mayoría de los representantes de la Súper Familia Poeciloidae, los Anableps son vivíparos. 1.1.1.2. Familia Tomeuridae Abarca una sola especie, a diferencia de los otros Poeciloidae, son ovíparos. Tienen un gonopodio con una estructura compleja. Su reproducción es durante todo el año. 1.1.1.3. Familia Poecilidae Esta familia es la más numerosa en especies, sus representantes habitan en las aguas dulces del sur de los Estados Unidos de Norteamérica y en el zona norte de Sudamérica. En las últimas décadas, a consecuencia de que algunas especies sobre todo la “gambusia”, que fueron ( y son ) utilizadas en la lucha contra la malaria; fueron muy difundidas en la regiones tropicales y subtropicales del hemisferio oriental. A esta familia pertenecen muchas especies de acuario como: Xiphophorus, Platypoecilus, Levistes “gupis”, Girardinus y muchos otros. Son peces pequeños; las hembras, generalmente son más grandes que los machos. En muchas especies, los machos son de colores más claros y brillosos. En los machos de los Xiphophorus y Levistes el margen inferior de la aleta anal es un tanto alargado. Son especies muy precoces, generalmente, el mismo verano de su nacimiento alcanzan su madurez sexual. Su fecundación es externa: el esperma se coloca en el poro genital de la hembra con ayuda del gonopodio. Durante el año, la hembra desova 3 varias veces de tal manera, la fecundidad de estas especies es muy significativa; ante condiciones muy favorables de manera extraordinaria y rápidamente pueden poblar totalmente el acuatorio donde se encuentran. En condiciones artificiales los peces vivíparos de la Super Familia Poeciloidae, fácilmente forman híbridos. En algunos representantes de la familia Poecilidae forman híbridos en condiciones naturales. Ante la hibridación, frecuentemente se presenta el fenómeno biológico denominado matroclinia, en el cual el esperma del macho solo da un estímulo para su desarrollo. Ante esta situación los descendientes tienen un parecido total con el organismo materno y todos resultan hembras. Es interesante que en la especie Molinisia formosa (Agassiz), no hay machos y su reproducción se realiza a través de la hibridación con machos de otras especies y los descendientes resultan hembras (Hubbs et Hubbs, 1932). La alimentación de la familia Polecilidae está en base a invertebrados acuáticos. Los adultos se alimentan preferentemente con larvas de insectos y crustáceos pelágicos. Estos peces en sus primeros estadios consumen infusorios; los alevinos y estadios posteriores, consumen rotíferos. Los Polecilidae no se encuentran en latitudes templadas. 1.1.2. SUPER FAMILIA Cyprinodontoidae Son peces ovíparos; según sus formas de vida, son muy variados. Por ejemplo, representantes del género Cyprinodon habitan en acuatorios de los desiertos de la parte sur de los Estados Unidos de Norte América y Asia menor. Algunas especies se adaptan en acuatorios salobres, por ejemplo el Cyprinodon macularius Baird et Gir.; otros viven en aguas termales que a veces alcanzan temperaturas mayores a los 50 ºC. El pez africano Aplocheiliththys pelaigicus, que habita en los grandes lagos de la Africa Oriental, se adaptó a vivir en zonas pelágicas muy alejado de las orillas. Representantes del género Fundulus, viven en aguas continentales así como en las aguas marinas costeras del sur de los Estados Unidos y Africa. El Fundulus heteroticus (L.) es una especie muy preferida para investigaciones experimentales. Todos los Ciprinodontidos ovíparos depositan una pequeña cantidad de ovas demersales relativamente de tamaño grande, generalmente con una abundante cubierta filamentosa (Jones, 1937), con ayuda de los cuales las ovas se adhieren a las plantas acuáticas sumergidas. La ovoposición generalmente ocurre a fines de la primavera e inicios de verano (noviembre, diciembre y enero). En el Fundulus gularis Blgr., que habita en el río Niger, la hembra durante el periodo de desove, enrolla su aleta anal y forma un tubo con la cual excava hoyos, donde deposita de 1 a 3 ovas que luego son fecundados por los machos. Relacionado con esta particularidad en las hembras, el número de radios no ramificados en la aleta anal es mayor que los ramificados, en comparación con el de los machos (Slastnikov, 1935). Muchos representantes de la Sub Familia Rivulinae que vienen en acuatorios temporales de Sudamérica y África, depositan sus ovas en el lodo. Después del periodo de reproducción, como consecuencia del secado de los acuatorios temporales, todos los reproductores mueren, mientras que las ovas se conservan en el suelo hasta la venida del siguiente periodo de lluvias. Ante esta situación, ocurre la diapausa durante cuyo tiempo el desarrollo se amortigua (ovas latentes) y la membrana exterior de la ova lo protege de los factores 4 externos (Peters, 1963; Gulidov, 1968). La alimentación de casi todos los Cyprinodontoidae constituyen pequeños invertebrados, principalmente crustáceos, larvas de insectos y rara vez pequeños moluscos. El valor económico de los Cyprinodontoidae, es insignificante. Por sus tamaños pequeños, no son utilizados como alimento humano. En algunos lugares, ciertas especies son utilizadas como controladores biológicos, para la lucha contra los zancudos de la malaria. A la Súper Familia Cyprinodontoidae , corresponden las Familias: Horaichthyidae y Cyprinodontidae 1.1.2.1. Familia Horaichthyidae Habitan aguas salobres de la India, son ovíparos; los machos; antes de la aleta anal tiene un gonopodio complejo cuya función en los Horaichthys es suspender (colgar) los espermatóforos hacia el poro genital de la hembra. Los Horaichthys son peces pequeños y transparentes, alcanzan su madurez sexual a una talla de 20 mm. Las hembras tienen solo una sola aleta ventral, la izquierda. El poro genital se encuentra en la base de la aleta anal y el poro anal se encuentra un tanto delante de la aleta ventral. En los machos el esperma se encuentra encerrado en especiales espermatóforos, cuyo número en distintos estadíos de desarrollo en los machos adultos es aproximandamente 250 – 280 espermatóforos. Los espermatóforos en sus finos terminales tienen una especial adaptación para pegarse al poro genital de la hembra. La medida de los espermatóforos es de 0.61 mm. durante la fecundación el terminal del espermatóforo se inflama para abrirse y los espermas salen al exterior. La fecundación transcurre en el interior del organismo materno, a propósito como en los vivíparos Cyprinodontoidei el esperma se mantiene durante considerable tiempo en el cuerpo de la madre, de tal manera que unas cuantas puestas de ovas se realizan sin la fecundación sucesiva. Sus ovas son demersales, con un diámetro aproximado de un milímetro (1 mm), tienen largos filamentos con ayuda de las cuales se pegan a las plantas acuaticas. Las ovas se colocan en puestas de 20 a 30 ovas. Su periodo de incubación dura de 8 a 10 días (Kulkarni, 1940). Su reproducción es durante todo el año. La alimentación de estos peces esta constituido principalmente por crustáceos menores y sus larvas, así como las diatomeas. 1.1.2.2. Familia Cyprinodontidae.Se caracterizan básicamente porque no tienen gonopodio. Abarca las siguientes subfamilias: Rivulinae, Cyprinodontinae, Fundalinae, Orestiatinae, Aphaniinae, Pracatopodinae, Oryziatinae. 1.1.2.2.1. GENERO Orestias Valenciennes, 1839 Los principales caracteres del género Orestias, según W illwock, 1983 son: - Ausencia de aletas ventrales en todas las especies conocidas. La escamación es irregular y es reducida en la mayor parte de la especies, especialmente en el pecho, vientre y cuellos que son desnudos, totalmente o en parte. 5 - - - - - La linea lateral es siempre clara y algo uniforme, y consiste de una hilera mas o menos regular de escamas perforadas y ranuradas a lo largo del canal sensorial. Los dientes de las mandíbulas son cónicos, formando mayormente más de una hilera irregular. Marcado dimorfismo sexual; por ejemplo, las espinas y los ganchos que se encuentran en las escamas y los radios de las aletas de los machos maduros, existen en menor número y en menor grado en las hembras maduras. Las hembras tienen un solo ovario y los machos un solo testículo; en ambos casos con una línea divisoria central. La forma de la cabeza es triangular presentando además, boca terminal superior y protráctil. Tiene dos aletas pectorales, una dorsal posterior, una anal y una caudal. Sus aletas presentan radios blandos ramificados. Cabe señalar que la aleta anal y dorsal se encuentran a la misma altura. La aleta pectoral se inicia al final del opérculo. Internamente el aparato digestivo se inicia en la boca con pre maxilares y maxilar protráctil, provisto de dientes cortos y pequeños de un número escaso, posee una laringe pequeña, lisa a los lados de la cavidad buco – faringea donde se encuentran las branquias El hígado es voluminoso y de color rojizo, la vesícula biliar es casi esférica de color verde amarillento y el corazón es pequeño y esta situado cerca de la cavidad opercular 1.1.2.2.2. GENERO Orestias Valenciennes, 1839 del lago Titicaca El género Orestias Valenciennes, 1839 del lago Titicaca fue descrita por el autor que se indica; mientras que las Orestias de la cuenca del Lago Titicaca, taxonómicamente como fue revisada por Tchernavin, 1944A, quien reconoció 20 especies, de los cuales 16 corresponden al Lago Titicaca, las 20 especies los organizó en los siguientes 04 grupos: GRUPO I GRUPO III Orestias cuvieri “umanto” Orestias pentlandii “boga” Orestias uruni Orestias minutus Orestias minimus Orestias gilsoni Orestias tutini Orestias taquiri GRUPO II GRUPO IV Orestias agassii Orestias uyunius Orestias jussiei Orestias polonorum Orestias langui Orestias olivaceous Orestias luteus Orestias albus Orestias mulleri Orestias incae Orestias crawfordi Orestias mooni 6 Según Tchernavin, 1944A; los cuatro grupos pueden representar Géneros distintos o posiblemente Subgéneros. Según el mismo autor estas especies se pueden clasificar en tres grupos ecológicos principales: formas depredadoras tal como Orestias cuvieri “umanto”; formas planctivoras como Orestias mooni (colectivamente llamado “ispi”) y formas bentófagas como la O. agassii (en conjunto llamado “carachi”). Estudios recientes por Lauzanne, 1981,1982 han confirmado la existencia de tres adicionales Orestias del grupo IV: Orestias tchernavini, Orestias ispi y Orestias forgeti. Villwock, 1963 , 1966, 1972 y 1983; plantea la teoría de la especiación intralacustre como un proceso evolutivo y ecológico. Según esta teoría, el número de especies establecidas por los anteriores se reduciría, a 5 especies válidas de Orestias : Orestias agassii “carachi negro” (altamente variable y la más común) Orestias luteus “carachi amarillo” (tipo ciprínido que se supone se alimenta principalmente en el fondo, con preferencia de bivalvos). Orestias pentlandii “boga” (tipo coregonus, especie pelágica que se alimenta preferentemente de zooplancton y de larvas de insectos). Orestias cuvieri “umanto” (tipo “pike”, predatora). Orestias mulleri “gringuito” (que representa un tipo de aguas profundas). Según Villwock, 1983, todas las especies deben cuando mucho interpretarse, como infra especies de alguna de las 5 especies antes mencionadas. Por su parte Parenti, 1984 en su obra “A taxonomic Revisión of the Andean Killifish Genus Orestias” considera hasta 43 especies, cuya área de expansión abarca desde el departamento de Ancash en el Norte del Perú, hasta el Departamento de Antofagasta en el Norte de Chile. Señala también que mas de la mitad de las 43 especies de Orestias son endémicos de la cuenca del Lago Titicaca y que 23 especies son conocidas solamente en el lago Titicaca. Por otra parte Ortega y Vari, 1986 en su trabajo “Annotated Checklist of the freshwater Fishes of Perú” considera 32 especies de Orestias para el lago Titicaca. De los estudios mencionados podemos decir que la mejor sistematización de Orestias fue conseguida en los trabajos de Tchernavin, 1944 y Lauzanne, 1982, más particularmente en el segundo de ellos. Tomando las referencia de Ortega y Vari, 1986 las especies de Orestias que se consideran para el Lago Titicaca son en número de 32: Orestias agassii Orestias albus Valenciennes, 1846; Parenti, 1984. Valenciennes, 1846; Parenti, 1984. 7 Orestias crawfordi Orestias ctenolepis Orestias cuvieri Orestias farfani Orestias forgeti Orestias frontosus Orestias gilsoni Orestias gracilis Orestias imarpe Oresitas incae Orestias ispi Orestias luteus Orestias minimus Orestias minutus Orestias mooni Orestias multiporis Orestias mulleri Orestias olivaceus Orestias pentlandii Orestias puni Orestias richersoni Orestias robustus Orestias rotundipinnis Orestias sillustani Orestias taquiri Orestias tchernavini Orestias tomcooni Orestias tschudii Orestias tutini Orestias uruni Tchernavin, 1944; Parenti, 1984. Parenti, 1984. Valenciennes, 1839; Parenti, 1984. Parenti, 1984. Lauzanne, 1981; Parenti, 1984. Cope, 1876; Parenti, 1984. Tchernavin, 1944; Parenti 1984. Parenti, 1984. Parenti 1984. Garman, 1895; Parenti, 1984. Lauzanne 1981; Parenti, 1984. Valenciennes, 1839; Parenti, 1984. Tchernavin, 1944; Parenti, 1984. Tchernavin, 1944; Parenti, 1984. Tchernavin, 1944; Parenti, 1984. Parenti, 1984. Valenciennes, 1846. Garman, 1895; Parenti, 1984. Valenciennes, 1839; Parenti, 1984. Tchernavin, 1944; Parenti; 1984. Parenti, 1984. Parenti, 1984. Parenti, 1984. Allen, 1942; Paranti, 1984 Tchernavin, 1944; Parenti, 1984. Lauzane, 1981; Parenti, 1984. Parenti, 1984. Castelnau, 1855; Parenti, 1984. Tchernavin, 1944; Parenti, 1984. Tchernavin, 1944; Parenti, 1984. En base a la revisión de la bibliografía especializada y a los investigaciones propias, se propone el siguiente orden taxonómico para las Orestias del lago Titicaca. 8 TAXONOMIA DE LOS CYPRINODONTIDOS DEL LAGO TITICACA REINO Animal PHYLLUM Chordata SUB PHYLLUM Vertebrata Gnathostomata GRUPO SUPER CLASE Pisces CLASE Osteichthyes SUB CLASE Actinopterygii DIVISIÓN Teleostei SUPER ORDEN Cyprinodontimorpha ORDEN Cyprinodontiformes Berg, 1940 SUB ORDEN Cyprinodontoidei Jordan, 1923 SUPER FAMILIA Cyprinodontoidae FAMILIA Cyprinodontidae Agassiz, 1834 Cyprinodontinae (Günther S. 1968) SUB FAMILIA GENERO Orestias Valenciennes, 1839 ESPECIES Orestias cuvieri Valenciennes, 1839 “umanto” Orestias pentlandii Valenciennes, 1839 “boga” Orestias agassii Valenciennes, 1846“carachi negro” Orestias luteus Valenciennes, 1839 “carachi amarillo” Orestias mulleri Valenciennes, 1846 “gringuito” Orestias ispi Lauzanne, 1981 “ispi” ... 9 Instituto de Investigación, Producción, Servicios y Capacitación “Qollasuyo” Centro de Investigación y Producción Pesquera Chucuito UNA – Puno FORMULACIÓN DE ALIMENTO BALANCEADO PARA ESPECIES ÍCTICAS NATIVAS DEL LAGO TITICACA Ing. Raúl Quispe Mamani PUBLICACIONES QOLLA Nº 17 Noviembre AÑO 2001 PUNO – 2001 - PERU 0 RESUMEN El IIP "QOLLASUYO" que viene ha ser parte de un mecanismo integrado para fomentar las acciones de preservación, investigación e innovación tecnológica de alimentos compuestos para la alimentación de las especies pesqueras nativas, que estas especies pesqueras son muy apreciadas por los consumidores que aún falto para la investigación en el potencial para su reproducción en cautividad. No obstante, las necesidades nutritivas de las mismas son desconocidas, por lo que el objetivo de las presentes formulaciones llevan al desarrollo de los piensos compuestos para la alimentación de las especies. El balanceo de ración o dieta, fue efectuado empleando el método de Programación lineal o de mínimo coste, que consistió en minimizar (mediante un programa informático denominado AEZO, F.D. 3.0 para W indows versión 95/98) para cada etapa de desarrollo en "carachi amarillo", "boga", "suche", "mauri". En función de costos, la inclusión de materias primas en mayor o menor proporción, considerando la naturaleza de su alimentación, disponibilidad, requerimiento de energía, requerimientos de proteínas y nutrientes, composición de los ingredientes, digestibilidad para peces, dando resultados de programación referente a una solución factible(composición de la dieta), el aporte real de la combinación, el aporte de nutrientes por ingredientes y su respectivo costo por Kg. de la composición de la dieta. 1 INTRODUCCION Durante los últimos años, según volumen consolidado de extracción de especies nativas (MIPE/DRP/DAT-UE, 2000) se observa una disminución de la extracción, lo que está provocando una sobre explotación de las especies nativas; desde algunos sectores se intenta potenciar el desarrollo en la conservación de tal manera se podría diversificar su uso ordenado. Las especies nativas pesqueras, con buenas expectativas para su reproducción en cautividad, aunque con algunos problemas de supervivencia larvaria, no obstante las necesidades nutritivas no son conocidas exactamente, para lo cual se planteó el estudio en la formulación de dietas, con niveles de proteína, lípidos, carbohidratos, minerales, energía metabolizable establecidas dentro de los rangos citados para peces en general por los antecedentes bibliográficos. Actualmente, la mayor pare de los piensos utilizados en la alimentación de peces son los alimentos tipo extrusionados, por lo que el objetivo del presente estudio es la formulación de dietas, utilizando ingredientes alternativos. Asoc. IIP Qollasuyo - CIPP Chucuito UNAP 2 MATERIALES Y METODOS MATERIALES - Paquete computacional AEZO F.D. 3.0 para W indows, versión 95/98 para cálculo de raciones a mínimo costo. Computadora SYNCMASTER 450Nb. Datos sobre composición nutritiva de los ingredientes (adoptado de diferentes fuentes) Reporte teórico sobre requerimiento nutritivo para peces. METODOLOGÍA La alimentación animal representa entre 60-80% (cañas, 1995) de los costos variables de los sistemas de producción animal, de ahí la importancia de utilizar raciones que además que cumplen el requerimiento nutricional de la especie, sean el mínimo costo, consecuentemente se busca diseñar una formulación de máxima utilidad técnica - económica, y se emplea para tal efecto una herramienta de apoyo. Para la toma de decisiones que es la programación lineal (AEZO, F.D. 3.0); aunque es posible balancear una ración por el método de prueba y error, donde éstos métodos son de mayor utilización de tiempo y de poca precisión, en especial consideración cuando se incluyen muchas variables (nutrientes, ingredientes). El análisis de problemas en donde se busca encontrar el máximo o mínimo de una función lineal de varias variables, sujeta a restricciones; expresado en forma matemática se tiene: X1, X2,... Xn Ingredientes disponibles para minimizar una función objetivo (Z). Z = C1X1 + C 2X2 +...+ C nXn (C i = Precio del ingrediente Xi) Z = Costo de la ración, la que se desea minimizar RESTRICCIONES a11x1 + a12x2 + ... a1nxn = b1 . . . . . . . . . . . . an2x1 + an2x2 + ... annxn = bn con x 1, x2, ... xn >= 0 En el procedimiento de formulación de dietas se consideró: - REQUERIMIENTOS DE ENERGIA METABOLIZABLE La energía metabolizable, con referencia a la carpa común y pez gato Europeo; 2.700 - 3.100 Mcal/Kg (New, 1987; en peces 2.500 a 4.700 Mcal/kg (Dominique and Cho, 2000) 3 - REQUERIMIENTOS DE PROTEÍNAS Para la mayoría de los peces requieren de 35 - 45 % de proteína en el alimento (Hepher, 1993) 35 - 45 % proteína digestible, 40 - 50 % de proteína cruda (Cho and Kaushik, |990). - REQUERIMIENTOS DE NUTRIENTES • • • Calcio, 0.5% (New, 1987) Fósforo (disponible) 0.7% (New, 1987) Aminoácidos esenciales, para tal efecto se consideró los siguientes aminoácidos, con referencia a la carpa y el pez gato, necesidades fijas (en % del contenido protéico). Amino ácido Car pa Pez gato Lisina 5.7 5.1 Met + Cist 3.1 2.3 Triptófano 0.8 0.5 Treonina 3.9 2.3 Fibra; < 10% (UPGL, 2000) Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. - RESTRICCIONES Los inhibidores de las proteasas digestivas, estando presente en muchas materias primas vegetales (harina de soya, trigo) (Martinez Y. Alarcon; 2001) (Sintayehu, A., et al, 1996) Inclusión fija de complementación o aditivos - COMPOSICIÓN DE INGREDIENTES Se tomó la información de varios autores sobre la composición química proximal de los ingredientes a emplear en el balanceo (CUADRO 1). Referente a la Bromatología de los organismos alimenticios acuáticos y vegetación acuática fue tomado de (Hepher, 1993) donde recopila de otros autores conformados por la vegetación acuática, Oligoquetos, Copépodos, Ostrácodos, Quironómidos, Moluscos. - COSTO DE LOS INGREDIENTES ADICION DE COMPLEMENTARIOS Y ADITIVOS RESULTADOS. La formulación de las dietas representan el cálculo de nutrientes (%) y energía metabolizable (Mcal/kg) en la mezcla balanceada de diferentes ingredientes alimenticias para especies pesqueras nativas, donde el método de un programa informático, que consistió en minimizar una función de costos, la inclusión o no de un ingrediente básicamente decidido por su precio relativo, no obstante habitualmente para formular la dieta se tuvo en consideración la concentración energética y el 4 aporte de proteína bruta, lisina, metionina + cistina, triptófano y treonina, como también minerales imprescindibles par los peces calcio y fósforo, que se puede observar en los cuadros de "Dietas mínimo costo - solución" de cada especie nativa (composición de la dieta, en % de Tm, aporte de nutrientes de los ingredientes parcial y total). Se efectuó la inclusión fija de aditivos tales como el antioxidante (BHT); Bentonita, en proporciones de 0,1% El costo por kilogramo de alimento compuesto para especies ícticas nativas. Se tiene entre 0.90 - 1.10 nuevos soles valores inferiores al costo por kilogramo para especies carnívoro como es la trucha arco iris que es del margen de entre 2.0- 2.4 nuevos soles. NOTA: para este caso de los alimentos para especies ícticas nativas no está considerado los costos indirectos de producción como otros rubros, los cuales sólo afectarán en un costo total aproximado final de entre 1.10 - 1.30 kg./alimento como también están sujetos a variabilidad de acuerdo a la formulación y el costo de los ingredientes CUADRO N° 01 COMPOSICIÓN DE LOS ALIMENTOS Valor nutritivo de los Ingredientes Nombre del Alimento ENERG. Proteína MET. C. (Mcal) % Fibra cruda % Calcio % Fósforo % HARINA PESCADO ORGANISMOS ALIMENTICIOS ACUÁTICOS ACEITE PESCADO REMOLACHA MELAZA 3.4500 5.1460 0.0000 2.3000 66.0000 45.6500 0.0000 6.0000 1.0000 0.0000 0.0000 0.0000 4.0000 0.0000 0.0000 0.1000 2.0000 0.0000 0.0000 0.0300 SOYA AFRECHO TRIGO GRANO VEGETACIÓN ACUÁTICA 2.7000 3.3000 3.9000 48.0000 13.0000 14.6 4.0000 3.0000 0.0000 0.2600 0.0500 0.0000 0.2400 0.1300 0.0000 Nombre del Alimento LISINA (%) METION + TRIPTOF TREONINA ACEITE CIST (%) (%) PESCADO (%) HARINA PESCADO 5.2000 2.8000 0.8000 2.6000 0.0000 ORGANISMOS ALIMENTICIOS ACUÁTICOS 6.2000 3.2000 1.2000 3.9000 0.0000 ACEITE PESCADO 0.0000 0.0000 0.0000 0.0000 1.0000 REMOLACHA MELAZA 0.0000 0.0000 0.0000 0.0000 0.0000 SOYA AFRECHO 2.9000 1.3200 0.6000 1.7000 0.0000 TRIGO GRANO 0.4000 0.3900 0.1000 0.3600 0.0000 VEGETACIÓN ACUÁTICA 5.4000 1.0000 0.0000 5.1000 0.0000 Nombre del Alimento MELAZA DE CAÑA TRIGO GRANO SOYA AFRECHO HARINA PESCADO 0.0000 0.0000 0.0000 ORGANISMOS ALIMENTICIOS ACUÁTICOS ACEITE PESCADO 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 REMOLACHA MELAZA SOYA AFRECHO TRIGO GRANO VEGETACIÓN ACUATICA 1.0000 0.0000 0.0000 0.0000 0.0000 0.0000 1.0000 0.0000 0.0000 1.0000 0.0000 0.0000 FUENTE: Recopilado de varios autores. 5 CUADRO N° 02 DIETAS DE MÍNIMO COSTO, PARA ALEVINOS DE “CARACHI AMARILLO” (INICIO) Dieta Calculada Nombre del Alimento Composición de la dieta Porcentaje Kg./Ton. Precio S/. Kg. Costo Total HARINA PESCADO 22.46 224.60 2.10 0.47 ORGANISMOS ALIMENTICIOS ACUÁTICOS 38.00 380.00 0.30 0.11 0.02 REMOLACHA MELAZA 3.00 30.00 0.70 26.55 265.54 1.10 0.29 VEGETACIÓN ACUÁTICAA 1.89 18.87 0.30 0.01 TRIGO GRANO ACEITE PESCADO 5.00 3.00 50.00 30.00 0.80 3.00 0.04 0.09 SOYA AFRECHO TOTALES 99.90 999.00 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) 1.03 CUADRO N° 03 DIETAS DE MÍNIMO COSTO, PARA ALEVINOS DE “CARACHI AMARILLO” (INICIO) Aporte de nutrientes por ingrediente Nombre del Alimento HARINA PESCADO Proteína C. Fibra cruda Calcio % % % 14.8234 0.2246 0.8984 ENERG. MET. (Mcal) 0.7749 ORGANISMOS ALIMENTICIOS ACUÁTICOS REMOLACHA MELAZA SOYA AFRECHO VEGETACIÓN ACUÁTICA TRIGO GRANO 1.9555 17.3470 0.0690 0.1800 0.7170 12.7458 0.0736 0.2754 0.1650 0.6500 ACEITE PESCADO 0.0000 0.0000 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) Nombre del Alimento LISINA (%) 0.0000 0.0000 1.0622 0.0000 0.1500 0.0000 0.0000 0.0030 0.0690 0.0000 0.0025 0.0000 Fósforo % 0.6289 0.0000 0.0009 0.0637 0.0000 0.0065 0.0000 METION + TRIPTOF TREONINA REMOLACHA CIST (%) (%) (%) MELAZA HARINA PESCADO 1.1679 0.6289 0.1797 0.5840 0.0000 ORGANISMOS ALIMENTICIOS ACUÁTICOS REMOLACHA MELAZA SOYA AFRECHO VEGETACIÓN ACUÁTICA TRIGO GRANO 2.3560 0.0000 0.7701 0.1019 0.0200 1.2160 0.0000 0.3505 0.0302 0.0195 0.4560 0.0000 0.1593 0.0000 0.0050 1.4820 0.0000 0.4514 0.0952 0.0180 0.0000 0.0300 0.0000 0.0000 0.0000 ACEITE PESCADO 0.0000 0.0000 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) 0.0000 0.0000 0.0000 Nombre del Alimento SOYA AFRECHO TRIGO GRANO HARINA PESCADO 0.0000 0.0000 ORGANISMOS ALIMENTICIOS ACUÁTICOS 0.0000 0.0000 REMOLACHA MELAZA 0.0000 0.0000 SOYA AFRECHO 0.2655 0.0000 VEGETACIÓN ACUATICA 0.0000 0.0000 TRIGO GRANO 0.0000 0.0500 ACEITE PESCADO 0.0000 0.0000 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) ACEITE PESCADO ORGANISMOS ALIMENTICIOS ACUÁTICOS 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 0.0300 0.0000 0.3800 0.0000 0.0000 0.0000 0.0000 0.0000 6 CUADRO N° 04 DIETAS DE MÍNIMO COSTO, PARA JUVENILES DE “CARACHI AMARILLO” (CRECIM) Dieta C alc ulada Composición de la dieta Nombre del Alimento HARINA PESCADO VEGETACIÓN ACUÁTICA SOYA AFRECHO REMOLACHA MELAZA TRIGO GRANO ORGANISMOS ALIMENTICIOS ACUÁTICOS ACEITE PESCADO TOTALES Porcentaje 23.07 20.26 20.00 3.00 4.00 26.57 3.00 99.90 Kg./Ton. 230.68 202.58 200.00 30.00 4000 265.74 30.00 999.00 Precio S/. Kg. Costo Total 2.10 0.30 1.10 0.70 0.80 0.30 3.00 0.48 0.06 0.22 0.02 0.03 0.08 0.09 0.99 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) CUADRO N° 05 DIETAS DE MÍNIMO COSTO, PARA JUVENILES DE “CARACHI AMARILLO” (CRECI) Aporte de nutrientes por ingrediente ENERG. Proteína MET. C. (Mcal) % Fibra cruda % Calcio % Fósforo % 15.2248 2.9577 0.2307 0.0000 0.9227 0.0000 0.6459 0.0000 0.5400 9.6000 0.0690 0.1800 0.1320 0.5200 1.3675 12.1311 ACEITE PESCADO 0.0000 0.0000 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) 0.8000 0.0000 0.1200 0.0000 0.0000 0.0520 0.0030 0.0020 0.0000 0.0000 0.480 0.0009 0.0052 0.0000 0.0000 Nombre del Alimento HARINA PESCADO VEGETACIÓN ACUÁTICA SOYA AFRECHO 0.7958 0.7901 REMOLACHA MELAZA TRIGO GRANO ORGANISMOS ALIMENTICIOS ACUÁTICOS Nombre del Alimento HARINA PESCADO VEGETACIÓN ACUÁTICA SOYA AFRECHO LISINA (%) 0.6459 0.3241 0.2640 0.0000 0.0156 0.8504 0.1845 0.0000 0.1200 0.0000 0.0040 0.3189 0.5998 1.0332 0.3400 0.0000 0.0144 1.0364 0.0000 0.0000 0.2000 0.0000 0.0000 0.0000 ACEITE PESCADO 0.0000 0.0000 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) 0.0000 0.0000 0.0000 REMOLACHA MELAZA TRIGO GRANO ORGANISMOS ALIMENTICIOS ACUÁTICOS Nombre del Alimento HARINA PESCADO VEGETACIÓN ACUÁTICA SOYA AFRECHO REMOLACHA MELAZA TRIGO GRANO ORGANISMOS ALIMENTICIOS ACUÁTICOS ACEITE PESCADO 1.1995 1.0939 0.5800 0.0000 0.0160 1.6479 METION TRIPTOF TREONINA SOYA + CIST (%) (%) AFRECHO (%) SOYA AFRECHO TRIGO GRANO ACEITE PESCADO VEGETACIÓ N ACUÁTICA 0.0000 0.0000 0.0000 0.0000 0.0400 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 0.0300 0.0000 0.0000 0.2026 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 0.0300 0.0000 0.0000 0.0000 0.0000 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) 7 CUADRO N° 06 DIETAS DE MÍNIMO COSTO, PARA ADULTOS DE “CARACHI AMARILLO” (ACABADO) Dieta C alc ulada Nombre del Alimento Composición de la dieta Porcentaje Kg./Ton. Precio S/. Kg. Costo Total HARINA PESCADO 23.09 230.93 2.10 0.48 ORGANISMOS ALIMENTICIOS ACUÁTICOS 24.35 243.55 0.30 0.07 ACEITE PESCADO 3.00 30.00 3.00 0.09 REMOLACHA MELAZA 5.00 50.00 0.70 0.04 SOYA AFRECHO 20.00 200.00 1.10 0.22 VEGETACIÓN ACUÁTICA 21.45 214.52 0.30 0.06 3.00 30.00 0.80 TRIGO GRANO 0.02 TOTALES 99.90 999.00 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) 0.99 CUADRO N° 07 DIETAS DE MÍNIMO COSTO, PARA ADULTOS DE “CARACHI AMARILLO” (ACABADO) Aporte de nutrientes por ingrediente Fibra cruda % 0.2309 Calcio % 0.9237 Fósforo % 0.6466 11.1179 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 REMOLACHA MELAZA 0.1150 0.3000 SOYA AFRECHO 0.5400 9.6000 VEGETACIÓN ACUÁTICA 0.8366 3.1320 TRIGO GRANO 0.0990 0.3900 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) 0.0000 0.8000 0.0000 0.0900 0.0050 0.0520 0.0000 0.0015 0.0015 0.0480 0.0000 0.0039 Nombre del Alimento HARINA PESCADO ORGANISMOS ALIMENTICIOS ACUÁTICOS ACEITE PESCADO Nombre del Alimento HARINA PESCADO ORGANISMOS ALIMENTICIOS ACUÁTICOS ACEITE PESCADO ENERG. Proteína MET. C. (Mcal) % 0.7967 15.2413 1.2533 0.0000 LISINA (%) METION + TRIPTOF TREONINA ACEITE CIST (%) (%) (%) PESCADO 1.2000 1.5100 0.0000 0.0000 0.5900 0.6466 0.7794 0.0000 0.0000 0.2640 REMOLACHA MELAZA SOYA AFRECHO VEGETACIÓN ACUÁTICA 1.1574 0.3432 TRIGO GRANO 0.0120 0.0117 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) Nombre del Alimento 0.1847 0.2923 0.0000 0.0000 0.1200 0.6004 0.9498 0.0000 0.0000 0.3400 0.0000 0.0000 0.0300 0.0000 0.0000 0.0000 0.0030 1.0941 0.0108 0.0000 0.0000 REMOLACHA MELAZA SOYA AFRECHO TRIGO GRANO HARINA PESCADO ORGANISMOS ALIMENTICIOS ACUÁTICOS ACEITE PESCADO 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 REMOLACHA MELAZA SOYA AFRECHO VEGETACIÓN ACUÁTICA TRIGO GRANO 0.0500 0.0000 0.0000 0.0000 0.0000 0.2000 0.0000 0.0000 0.0000 0.0000 0.0000 0.0300 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) 8 CUADRO N° 08 DIETAS DE MÍNIMO COSTO, PARA ALEVINOS DE “BOGA” (INICIO) Dieta Calculada Nombre del Alimento Composición de la dieta Porcentaje Kg./Ton. Precio S/. Kg. Costo Total 2.10 0.48 HARINA PESCADO 22.95 229.54 ORGANISMOS ALIMENTICIOS ACUÁTICOS 42.67 426.72 0.30 0.13 ACEITE PESCADO 3.00 30.00 3.00 0.09 REMOLACHA MELAZA 5300 50.00 0.70 0.04 SOYA AFRECHO 20.00 200.00 1.10 0.22 TRIGO GRANO VEGETACIÓN ACUÁTICA 6.00 0.27 60.00 2.74 0.80 0.30 0.05 0.00 TOTALES 99.90 999.00 1.00 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) CUADRO N° 09 DIETAS DE MÍNIMO COSTO PARA ALEVINOS DE “BOGA” (INICIO) Aporte de nutrientes por ingrediente Nombre del Alimento HARINA PESCADO ORGANISMOS ALIMENTICIOS ACUÁTICOS ACEITE PESCADO ENERG. Proteína MET. C. (Mcal) % 0.7919 2.1959 0.0000 0.1150 0.5400 15.1494 19.4799 0.0000 0.3000 9.6000 REMOLACHA MELAZA SOYA AFRECHO TRIGO GRANO 0.1980 0.7800 VEGETACIÓN ACUÁTICA 0.0107 0.0400 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) Nombre del Alimento HARINA PESCADO REMOLACHA MELAZA SOYA AFRECHO TRIGO GRANO Fósforo % 0.2295 0.0000 0.0000 0.0000 0.8000 0.9181 0.0000 0.0000 0.0050 0.0520 0.6427 0.0000 0.0000 0.0015 0.0480 0.1800 0.0000 0.0030 0.0000 0.0078 0.0000 METION + CIST (%) TRIPTOF (%) 1.1936 0.6427 0.1836 0.5968 0.0000 0.5121 0.0000 0.0000 0.1200 0.0060 0.0000 1.6642 0.0000 0.0000 0.3400 0.0216 0.0140 0.0000 0.0300 0.0000 0.0000 0.0000 0.0000 2.6957 1.3655 0.0000 0.0000 REMOLACHA MELAZA 0.0000 0.0000 SOYA AFRECHO 0.5800 0.2640 TRIGO GRANO 0.0240 0.0234 VEGETACIÓN ACUÁTICA 0.0148 0.0044 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) HARINA PESCADO ORGANISMOS ALIMENTICIOS ACUÁTICOS ACEITE PESCADO Calcio % LISINA (%) ORGANISMOS ALIMENTICIOS ACUÁTICOS ACEITE PESCADO Nombre del Alimento Fibra cruda % TREONINA ACEITE (%) PESCADO REMOLACHA MELAZA SOYA AFRECHO TRIGO GRANO 0.0000 0.0000 0.0000 0.0500 0.0000 0.0000 0.0000 0.0000 0.0000 0.2000 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 0.0600 0.0000 0.0000 0.0000 VEGETACIÓN ACUÁTICA 0.0000 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) 9 CUADRO N° 10 DIETAS DE MÍNIMO COSTO, PARA JUVENILES DE “BOGA” (CRECIM) Dieta Calculada Composición de la dieta Porcentaje Kg./Ton. HARINA PESCADO 23.42 234.18 ORGANISMOS ALIMENTICIOS ACUÁTICOS 23.84 238.38 ACEITE PESCADO 3.00 30.00 REMOLACHA MELAZA 6.00 60.00 TRIGO GRANO 5.00 50.00 SOYA AFRECHO 15.00 150.00 VEGETACIÓN ACUÁTICA 23.64 236.44 TOTALES 99.90 999.00 Nombre del Alimento Precio S/. Kg. Costo Total 2.10 0.30 3.00 0.70 0.80 1.10 0.30 0.49 0.07 0.09 0.04 0.04 0.16 0.07 0.97 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, 1999 CUADRO N° 11 DIETAS DE MÍNIMO COSTO, PARA JUVENILES DE “BOGA” (CRECI) Aporte de nutrientes por ingrediente Fibra cruda % Calcio % Fósforo % 15.4558 10.8822 0.0000 0.3600 0.6500 7.2000 0.2342 0.0000 0.0000 0.0000 0.1500 0.6000 0.9367 0.0000 0.0000 0.0060 0.0025 0.0390 0.6557 0.0000 0.0000 0.0018 0.0065 0.0360 VEGETACIÓN ACUÁTICA 0.9221 3.4520 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) 0.0000 0.0000 0.0000 Nombre del Alimento HARINA PESCADO ORGANISMOS ALIMENTICIOS ACUÁTICOS ACEITE PESCADO REMOLACHA MELAZA TRIGO GRANO SOYA AFRECHO Nombre del Alimento ENERG. Proteína MET. C. (Mcal) % 0.8079 1.2267 0.0000 0.1380 0.1650 0.4050 LISINA (%) METION + TRIPTOF CIST (%) (%) TREONINA ACEITE (%) PESCADO HARINA PESCADO 1.2177 0.6557 0.1873 0.6089 0.0000 ORGANISMOS ALIMENTICIOS ACUÁTICOS ACEITE PESCADO 1.4780 0.0000 0.7628 0.0000 0.2861 0.0000 0.9297 0.0000 0.0000 0.0300 0.0000 0.0050 0.0900 0.0000 0.0000 0.0180 0.2550 1.2058 0.0000 0.0000 0.0000 0.0000 REMOLACHA MELAZA 0.0000 0.0000 TRIGO GRANO 0.0200 0.0195 SOYA AFRECHO 0.4350 0.1980 VEGETACIÓN ACUÁTICA 1.2768 0.3783 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) Nombre del Alimento REMOLACHA TRIGO GRANO MELAZA HARINA PESCADO 0.0000 0.0000 ORGANISMOS ALIMENTICIOS ACUÁTICOS 0.0000 0.0000 ACEITE PESCADO 0.0000 0.0000 REMOLACHA MELAZA 0.0600 0.0000 TRIGO GRANO 0.0000 0.0500 SOYA AFRECHO 0.0000 0.0000 VEGETACIÓN ACUÁTICA 0.0000 0.0000 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) SOYA AFRECHO 0.0000 0.0000 0.0000 0.0000 0.0000 0.1500 0.0000 10 CUADRO N° 12 DIETAS DE MÍNIMO COSTO, PARA ADULTOS DE “BOGA” (ACABADO) Dieta Calculada Nombre del Alimento Composición de la dieta Porcentaje Kg./Ton. Precio S/. Kg. Costo Total 0.48 HARINA PESCADO 22.95 229.54 2.10 VEGETACIÓN ACUÁTICA 2.27 22.74 0.30 0.01 TRIGO GRANO 6.00 60.00 0.80 0.05 SOYA AFRECHO 20.00 200.00 1.10 0.22 ACEITE PESCADO 2.00 20.00 3.00 0.06 REMOLACHA MELAZA 5.00 50.00 0.70 0.04 ORGANISMOS ALIMENTICIOS ACUÁTICOS 41.67 416.72 0.30 0.13 TOTALES 99.90 999.00 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) 0.98 CUADRO N° 13 DIETAS DE MÍNIMO COSTO, PARA ADULTOS DE “BOGA” (ACABADO) Aporte de nutrientes por ingrediente Fibra cruda % Calcio % Fósforo % 15.1494 0.3320 0.7800 9.6000 0.0000 0.2295 0.0000 0.1800 0.8000 0.0000 0.9181 0.0000 0.0030 0.520 0.0000 0.6427 0.0000 0.0078 0.0480 0.0000 REMOLACHA MELAZA 0.1150 0.3000 ORGANISMOS ALIMENTICIOS ACUÁTICOS 2.1445 19.0234 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) 0.0000 0.0000 0.0050 0.0000 0.0015 0.0000 Nombre del Alimento HARINA PESCADO VEGETACIÓN ACUÁTICA TRIGO GRANO SOYA AFRECHO ACEITE PESCADO Nombre del Alimento HARINA PESCADO VEGETACIÓN ACUÁTICA TRIGO GRANO ENERG. Proteína MET. C. (Mcal) % 0.7919 0.0887 0.1980 0.5400 0.0000 LISINA (%) METION + TRIPTOF TREONINA ACEITE CIST (%) (%) (%) PESCADO 0.6427 0.0364 0.0234 0.1836 0.0000 0.0060 0.5960 0.1160 0.0216 0.0000 0.0000 0.0600 SOYA AFRECHO 0.5800 0.2640 ACEITE PESCADO 0.0000 0.0000 REMOLACHA MELAZA 0.0000 0.0000 ORGANISMOS ALIMENTICIOS ACUÁTICOS 2.5837 1.3335 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) 0.1200 0.0000 0.0000 0.5001 0.3400 0.0000 0.0000 1.6252 0.0000 0.0000 0.0000 0.0000 Nombre del Alimento 1.1936 0.1228 0.0240 REMOLACHA MELAZA SOYA AFRECHO 0.0000 0.0000 0.0000 VEGETACIÓN ACUÁTICA 0.0000 0.0000 TRIGO GRANO 0.0000 0.0000 SOYA AFRECHO 0.0200 0.0000 ACEITE PESCADO 0.0000 0.0200 REMOLACHA MELAZA 0.0000 0.0000 ORGANISMOS ALIMENTICIOS ACUÁTICOS 0.0000 0.0000 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) 0.0000 0.0000 0.0000 0.0000 0.0500 0.0000 HARINA PESCADO TRIGO GRANO 11 CUADRO N° 14 DIETAS DE MÍNIMO COSTO, PARA ALEVINOS DE “SUCHE” (INICIO) Dieta Calculada Nombre del Alimento HARINA PESCADO ORGANISMOS ALIMENTICIOS ACUÁTICOS ACEITE PESCADO SOYA AFRECHO TRIGO GRANO REMOLACHA MELAZA TOTALES Composición de la dieta Porcentaje Kg./Ton. 23.22 232.18 46.60 3.00 18.00 4.00 5.00 99.90 Precio S/. Kg. Costo Total 2.10 0.49 0.30 3.00 1.10 0.80 0.70 0.14 0.09 0.20 0.03 0.04 0.98 466.82 30.00 180.00 40.00 50.00 999.00 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) CUADRO N°15 DIETAS DE MÍNIMO COSTO, PARA ALEVINOS DE “SUCHE” (INICIO) Aporte de nutrientes por ingrediente Nombre del Alimento HARINA PESCADO ORGANISMOS ALIMENTICIOS ACUÁTICOS ENERG. MET. (Mcal) Proteína Fibra cruda C. % % Calcio % Fósforo % 0.8010 15.3238 0.2322 0.9287 0.6501 2.4023 21.3104 0.0000 0.0000 0.0000 0.0000 0.7200 0.1200 0.0000 0.0000 0.0000 0.0468 0.0020 0.0000 0.0050 0.000 0.0432 0.0052 0.0000 0.0015 TRIPTOF (%) TREONINA (%) ACEITE PESCADO 0.1057 0.6037 0.0000 0.5602 0.0000 0.1080 0.0040 0.0000 0.0000 1.8206 0.0000 0.3060 0.0144 0.0000 0.0000 0.0000 0.0300 0.0000 0.0000 0.0000 0.0000 ACEITE PESCADO 0.0000 0.0000 SOYA AFRECHO 0.4860 8.6400 TRIGO GRANO 0.1320 0.5200 VEGETACIÓN ACUÁTICA 0.0000 0.0000 REMOLACHA MELAZA 0.1150 0.3000 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) Nombre del Alimento LISINA (%) METION + CIST (%) HARINA PESCADO 1.2073 0.6501 ORGANISMOS ALIMENTICIOS ACUÁTICOS 2.8943 1.4938 ACEITE PESCADO 0.0000 0.0000 SOYA AFRECHO 0.5220 0.2376 TRIGO GRANO 0.0160 0.0156 VEGETACIÓN ACUÁTICA 0.0000 0.0000 REMOLACHA MELAZA 0.0000 0.0000 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) Nombre del Alimento REMOLACHA MELAZA SOYA AFRECHO TRIGO GRANO HARINA PESCADO ORGANISMOS ALIMENTICIOS ACUÁTICOS ACEITE PESCADO SOYA AFRECHO TRIGO GRANO VEGETACIÓN ACUÁTICA 0.0000 0.0000 0.0000 0.0000 0.0000 0.1800 0.0000 0.0000 0.0000 0.0000 0.0000 0.0400 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 REMOLACHA MELAZA 0.0000 0.0000 0.0500 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) 12 CUADRO N° 16 DIETAS DE MÍNIMO COSTO, PARA JUVENILES DE “SUCHE” (CRECIM) Dieta Calculada Nombre del Alimento Composición de la dieta Porcentaje Kg./Ton. Precio S/. Kg. Costo Total 2.10 0.48 HARINA PESCADO ORGANISMOS ALIMENTICIOS ACUÁTICOS 23.03 230.29 29.94 299.41 0.30 0.09 ACEITE PESCADO 2.00 20.00 3.00 0.06 0.04 REMOLACHA MELAZA 6.00 60.00 0.70 SOYA AFRECHO 19.00 190.00 1.10 0.21 VEGETACIÓN ACUÁTICA 13.93 139.30 0.30 0.04 TRIGO GRANO 6.00 60.00 0.80 0.05 TOTALES 99.90 999.00 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) 0.97 CUADRO N° 17 DIETAS DE MÍNIMO COSTO, PARA ALEVINOS DE “SUCHE” (CRECIM) Aporte de nutrientes por ingrediente ENERG. Nombre del MET. Alimento (Mcal) Proteína C. Fibra cruda % % HARINA PESCADO 0.7945 15.1989 0.2303 ORGANISMOS ALIMENTICIOS ACUÁTICOS 1.5408 13.6681 0.0000 ACEITE PESCADO 0.0000 0.0000 0.0000 REMOLACHA MELAZA 0.1380 0.3600 0.0000 SOYA AFRECHO 0.5130 9.1200 0.7600 VEGETACIÓN ACUÁTICA 0.5433 2.0338 0.0000 TRIGO GRANO 0.1980 0.7800 0.1800 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) Nombre del Alimento HARINA PESCADO ORGANISMOS ALIMENTICIOS ACUÁTICOS ACEITE PESCADO REMOLACHA MELAZA SOYA AFRECHO LISINA (%) 1.1975 1.8563 0.0000 0.0000 0.5510 Calcio % Fósforo % 0.9211 0.6448 0.0000 0.0000 0.0060 0.0494 0.0000 0.0030 0.0000 0.0000 0.0018 0.0456 0.0000 0.0078 METION TRIPTOF TREONINA + CIST (%) (%) (%) 0.6448 0.1842 0.5987 0.9581 0.03593 1.1677 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 0.2508 0.1140 0.3230 VEGETACIÓN ACUÁTICA 0.7522 0.2229 TRIGO GRANO 0.0240 0.0234 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) 0.0000 0.0060 0.7104 0.216 Nombre del REMOLACHA Alimento MELAZA HARINA PESCADO 0.0000 ORGANISMOS ALIMENTICIOS ACUÁTICOS 0.0000 ACEITE PESCADO 0.0000 REMOLACHA MELAZA 0.0600 SOYA AFRECHO 0.0000 VEGETACIÓN ACUÁTICA 0.0000 TRIGO GRANO 0.0000 SOYA AFRECHO 0.0000 0.0000 0.0000 0.0000 0.1900 0.0000 0.0000 ACEITE PESCADO 0.0000 0.0000 0.0200 0.0000 0.0000 0.0000 0.0000 TRIGO GRANO 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 0.0600 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) 13 CUADRO N° 18 DIETAS DE MÍNIMO COSTO, PARA ADULTOS DE “SUCHE” (ACABA) Dieta Calculada Nombre Ingredientes HARINA PESCADO ORGANISMOS ALIMENTICIOS ACUÁTICOS ACEITE PESCADO Composición de la dieta Porcentaje Kg./Ton. 22.67 37.22 4.00 Precio S/. Kg. Costo Total 2.10 0.30 3.00 0.48 0.11 0.12 0.70 1.10 0.80 0.05 0.25 0.05 1.03 226 372.25 40.00 REMOLACHA MELAZA 7.00 70.00 SOYA AFRECHO 23.00 230.00 TRIGO GRANO 6.00 60.00 TOTALES 99.90 999.00 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) CUADRO N° 19 DIETAS DE MÍNIMO COSTO, PARA ADULTOS DE “SUCHE” (ACABADO) Aporte de Nutrientes por ingredientes Nombre del Alimento HARINA PESCADO ORGANISMOS ALIMENTICIOS ACUÁTICOS ACEITE PESCADO ENERG. Proteína MET. C. (Mcal) % 0.7823 1.9156 0.0000 0.1610 0.6210 14.9655 16.9932 0.0000 0.4200 11.0400 REMOLACHA MELAZA SOYA AFRECHO TRIGO GRANO 0.1980 0.7800 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) Nombre del Alimento HARINA PESCADO ORGANISMOS ALIMENTICIOS ACUÁTICOS ACEITE PESCADO REMOLACHA MELAZA LISINA (%) 1.1791 2.3079 0.0000 0.0000 Fibra cruda % Calcio % Fósforo % 0.2267 0.0000 0.0000 0.0000 0.9200 0.9070 0.0000 0.0000 0.0070 0.0598 0.6349 0.0000 0.0000 0.0021 0.552 0.1800 0.0030 0.0078 METION TRIPTOF TREONINA + CIST (%) (%) (%) 0.6349 0.1814 0.5895 1.1912 0.4467 1.4518 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 SOYA AFRECHO 0.6670 0.3036 TRIGO GRANO 0.0240 0.0234 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) 0.1380 0.0060 0.3910 0.0216 ACEITE PESCADO 0.0000 0.0000 0.0400 0.0000 0.0000 0.0000 MELAZA DE CAÑA TRIGO GRANO 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 REMOLACHA MELAZA 0.0700 0.0000 SOYA AFRECHO 0.0000 0.0000 TRIGO GRANO 0.0000 0.0600 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) 0.0000 0.0000 0.0000 0.2300 0.0000 Nombre del Alimento HARINA PESCADO ORGANISMOS ALIMENTICIOS ACUÁTICOS ACEITE PESCADO SOYA AFRECHO 14 CUADRO N° 20 DIETAS DE MÍNIMO COSTO, PARA ALEVINOS DE “MAURI” (INICIO) Dieta Calculada Nombre Ingredientes HARINA PESCADO TRIGO GRANO REMOLACHA MELAZA SOYA AFRECHO Composición de la dieta Porcentaje Kg./Ton. 2258 5.00 4.00 25.00 Precio S/. Kg. Costo Total 2.10 0.80 0.70 1.10 0.47 0.04 0.03 0.27 0.30 3.00 0.30 0.00 0.06 0.12 1.00 225.82 50.00 40.00 250.00 VEGETACIÓN ACUÁTICA 0.25 2.48 ACEITE PESCADO 2.00 20.00 ORGANISMOS ALIMENTICIOS ACUÁTICOS 41.07 410.70 TOTALES 99.90 999.00 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) CUADRO N° 21 DIETAS DE MÍNIMO COSTO, PARA ALEVINOS DE “MAURI” (INICIO) Aporte de Nutrientes por ingredientes Fibra cruda % Calcio % Fósforo % 14.9042 0.6500 0.2400 12.0000 0.2258 0.1500 0.0000 1.0000 0.9033 0.0025 0.0040 0.0650 0.6323 0.0065 0.0012 0.0600 0.0097 0.0362 0.0000 0.0000 ORGANISMOS ALIMENTICIOS ACUÁTICOS 2.1134 18.7483 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 Nombre del Alimento HARINA PESCADO TRIGO GRANO REMOLACHA MELAZA SOYA AFRECHO ENERG. Proteína MET. C. (Mcal) % 0.7791 0.1650 0.0920 0.6750 VEGETACIÓN ACUATICA ACEITE PESCADO Nombre del Alimento HARINA PESCADO TRIGO GRANO REMOLACHA MELAZA LISINA (%) 1.1743 0.0200 METION + CIST (%) 0.6323 0.0195 TRIPTOF TREONINA (%) (%) 0.0000 0.0000 0.7250 0.3300 0.0134 0.0040 0.0000 0.0000 ORGANISMOS ALIMENTICIOS ACUÁTICOS 2.5463 1.3142 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) SOYA AFRECHO VEGETACIÓN ACUÁTICA ACEITE PESCADO Nombre del Alimento HARINA PESCADO TRIGO GRANO REMOLACHA MELAZA TRIGO GRANO 0.1807 0.0050 0.5871 0.0180 0.0000 0.0500 0.0000 0.1500 0.0000 0.0000 0.4928 0.0000 0.4250 0.0127 0.0000 1.6017 0.0000 0.0000 0.0000 0.0000 0.0000 MELAZA DE TRIGO GRANO CAÑA SOYA AFRECHO SOYA AFRECHO 0.0000 0.0000 0.0400 0.0000 0.0000 0.0000 0.0000 0.2500 0.0000 0.0000 0.0000 0.0000 VEGETACIÓN ACUÁTICA ACEITE PESCADO 0.0000 0.0000 0.0000 0.0000 0.0200 0.0000 ORGANISMOS ALIMENTICIOS ACUÁTICOS Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) 15 CUADRO N° 22 DIETAS DE MÍNIMO COSTO, PARA JUVENILES DE “MAURI” (CRECIM) Dieta Calculada Composición de la dieta Porcentaje Kg./Ton. HARINA PESCADO 22.99 229.89 ORGANISMOS ALIMENTICIOS ACUÁTICOS 41.91 419.11 PESCAD ACEITE 4.00 40.00 SOYA AFRECHO 20.00 200.00 TRIGO GRANO 5.00 50.00 REMOLACHA MELAZA 6.00 60.00 TOTALES 99.90 999.00 Nombre del Alimento Precio S/. Kg. Costo Total 2.10 0.30 3.00 1.10 0.80 0.70 0.48 0.13 0.12 0.22 0.04 0.04 1.03 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) CUADRO N° 23 DIETAS DE MÍNIMO COSTO, PARA JUVENILES DE “MAURI” (CRECIM) Aporte de nutrientes por ingrediente Fibra cruda % Calcio % Fósforo % 15.1729 191322 0.0000 0.2299 0.0000 0.0000 0.9196 0.0000 0.0000 0.6437 0.0000 0.0000 0.5400 9.6000 0.1650 0.6500 0.0000 0.0000 REMOLACHA MELAZA 0.1380 0.3600 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) 0.8000 0.1500 0.0000 0.0000 0.0520 0.0025 0.0000 0.0060 0.0480 0.0065 0.0000 0.0018 Nombre del Alimento HARINA PESCADO ORGANISMOS ALIMENTICIOS ACUÁTICOS ACEITE PESCADO ENERG. Proteína C. MET. % (Mcal) 0.7931 2.1567 0.0000 SOYA AFRECHO TRIGO GRANO VEGETACIÓN ACUÁTICA Nombre del Alimento LISINA (%) METION + TRIPTOF TREONINA CIST (%) (%) (%) HARINA PESCADO ORGANISMOS ALIMENTICIOS ACUÁTICOS ACEITE PESCADO 1.1954 0.6437 2.5985 1.3411 0.0000 0.0000 SOYA AFRECHO 0.5800 0.2640 TRIGO GRANO 0.0200 0.0195 VEGETACIÓN ACUÁTICA 0.0000 0.0000 REMOLACHA MELAZA 0.0000 0.0000 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) Nombre del Alimento HARINA PESCADO ORGANISMOS ALIMENTICIOS ACUÁTICOS ACEITE PESCADO SOYA AFRECHO TRIGO GRANO VEGETACIÓN ACUÁTICA REMOLACHA MELAZA 0.1839 0.5029 0.0000 0.1200 0.0050 0.0000 0.0000 0.5977 1.6345 0.0000 0.3400 0.0180 0.0000 0.0000 SOYA AFRECHO TRIGO GRANO 0.0000 0.0000 0.0000 0.2000 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 0.0500 0.0000 SOYA AFRECHO 0.0000 0.0000 0.0400 0.0000 0.0000 0.0000 0.0000 REMOLACHA MELAZA 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 0.0600 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) 16 CUADRO N° 24 DIETAS DE MÍNIMO COSTO, PARA ADULTOS DE “MAURI” (ACABADO) Dieta Calculada Nombre del Alimento HARINA PESCADO ORGANISMOS ALIMENTICIOS ACUÁTICOS REMOLACHA MELAZA Composición de la dieta Porcentaje Kg./Ton. 22.46 30.00 2.25 Precio S/. Kg. Costo Total 2.10 0.30 0.70 0.47 0.09 0.02 1.10 0.80 0.30 3.00 0.22 0.14 0.02 0.09 1.04 224.64 300.00 22.53 SOYA AFRECHO 20.00 200.00 TRIGO GRANO 17.18 171.83 VEGETACIÓN ACUÁTICA 5.00 50.00 ACEITE PESCADO 3.00 30.00 TOTALES 99.90 999.00 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) CUADRO N° 25 DIETAS DE MÍNIMO COSTO, PARA ADULTOS DE “MAURI” (ACABADO) Aporte de Nutrientes por ingredientes Nombre del Alimento HARINA PESCADO ORGANISMOS ALIMENTICIOS ACUÁTICOS REMOLACHA MELAZA ENERG. MET. (Mcal) Proteína Fibra cruda C. % % Fósforo % 14.8261 13.6950 0.1352 9.6000 2.2338 0.7500 0.2245 0.0000 0.0000 0.8000 0.5155 0.0000 0.8985 0.0000 0.0023 0.0520 0.0086 0.0000 0.6290 0.0000 0.0007 0.0480 0.0223 0.0000 ACEITE PESCADO 0.0000 0.0000 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) 0.0000 0.0000 0.0000 SOYA AFRECHO TRIGO GRANO VEGETACIÓN ACUÁTICA Nombre del Alimento HARINA PESCADO ORGANISMOS ALIMENTICIOS ACUÁTICOS REMOLACHA MELAZA 0.7750 1.5438 0.0518 0.5400 0.5670 0.1950 Calcio % LISINA (%) METION + TRIPTOF TREONINA TRIGO CIST (%) (%) (%) GRANO 1.1681 1.8600 0.6290 0.9600 0.1797 0.3600 0.5841 1.17000 0.0000 0.3000 0.0000 0.0000 0.5800 0.2640 0.0687 0.0670 0.2700 0.0800 ACEITE PESCADO 0.0000 0.0000 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) 0.0000 0.1200 0.072 0.0000 0.0000 0.0000 0.3400 0.0619 0.2550 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 SOYA AFRECHO TRIGO GRANO VEGETACIÓN ACUÁTICA Nombre del Alimento HARINA PESCADO ORGANISMOS ALIMENTICIOS ACUÁTICOS REMOLACHA MELAZA SOYA AFRECHO TRIGO GRANO 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 SOYA AFRECHO 0.2000 0.0000 TRIGO GRANO 0.0000 0.1778 VEGETACIÓN ACUÁTICA 0.0000 0.0000 ACEITE PESCADO 0.0000 0.0000 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) ACEITE VEGETACIO PESCADO N ACUÁTICA 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 0.0000 0.0200 0.0000 0.0300 0.0000 0.0000 0.0500 0.0000 17 DISCUSIÓN Los resultados obtenidos en el cálculo de solución factible, referente al aporte de nutrientes es similar y/o se encuentran de acuerdo a los requerimientos de los peces en general en los intervalos citados por (New, 1987; Hepher, 1993; Cho and Kaushik, 1990; UPGL, 2000) Los límites de inclusión de ingredientes, bien por motivos tecnológicos (demasiado grasa que dificulta la granulación) o bien por motivos fisiológico, digestivo y metabólico fue efectuada mas que todo a la torta de soya como cita (Alarcón F.J, 1997) La formulación de una fórmula ideal y las consideraciones prácticas que sea nutritivamente equilibrado tanto para el mantenimiento, crecimiento, la reproducción y la salud de las especies tal como también lo considera (Dominique, P. And Cho, J, 2000) CONCLUSIONES Del presente trabajo se extraen las siguientes conclusiones. Según la solución factible el aporte de nutrientes de los ingredientes se encuentran dentro de los valores recomendados para peces de proteína entre 35-50% y energía metabolizable entre 2.50 - 4.70 Mcal/kg; para este efecto para las especies nativas se tiene las siguientes conclusiones en cuanto al contenido mínimo en el alimento (contenido teórico) de energía metabolizable (Mcal/Kg) y proteína cruda (%) se presentan en el cuadro 25. CUADRO 25 APORTE REAL DE NUTRIENTES EN LAS DIETAS FORMULADAS EXPERIMENTALMENTE ESPECIE Y/O ETAPA CARACHI – aLEVÍN CARACHI - JUVENIL CARACHI – ADULTO BOGA – ALEVÍN BOGA – JUVENIL BOGA – ADULTO SUCHE – ALEVINO SUCHE - JUVENIL SUCHE - ADULTO MAURI – ALEVÍN MAURI - JUVENIL MAURI - ADULTO ENERGÍA METABOLIZABLE (Mcal/Kg) (Mínimo) PROTEÍNA CRUDA % (mínimo) 3.75 3.69 3.64 3.85 3.66 3.88 3.94 3.73 3.68 3.83 3.79 3.67 46.02 40.61 39.78 45.35 38.00 45.18 46.09 41.16 44.20 46.58 44.92 41.22 Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. Según AEZO/Agrosis, (1999) - Previa etapa de formulación por método lineal se puede restringir el nivel de inclusión de los factores nutritivos que puedan tener algunos ingredientes de origen vegetal. 18 - La validación de la formulación según requerimientos nutricionales de las especies pesqueras nativas nos permitirá determinar las formulaciones en proporciones exactas de los ingredientes mas convenientes para cada especie. RECOMENDACIONES. - Determinar los requerimientos nutricionales en ensayos "In vivo" ó "in vitro" de las especies pesqueras nativas de lago Titicaca. Realizar nuevas formulaciones de dietas en función a los requerimientos establecidos. Ejecutar trabajos de alimentación de especies ícticas nativas, empleando los alimentos formulados y elaborados en el presente trabajo. BIBLIOGRAFÍA. 1. ALARCÓN F. J (1997). Procesos Digestivos en Peces Marinos. Caracterización y aplicaciones Prácticas. Tesis doctoral Universidad de Almería. Almería. 2. CAÑAS, R (1995). Alimentación y Nutrición Animal. DPC. Grapos S.A. impreso en Chile. 3. CHO, C, Y., and Kau Shik, D.J (1990) la energía y utilización de la proteína en (Salmo Gairdneri) Revista Mundial NUTRICIÓN - LA DIETA, 61. Pág. 132-172. 4. DOMINIQUE P, and CHO, Y (2000) And introduction to the Nutrition and feeding of fish. Fish Nutrition Investigation Laboratory Dept. Of Animal and Poultry Science, University of Guelp, Ontario - Canada. 5. HEPHER, B (1993) Nutrición de Peces Comerciales en Estanques. Edit. Limusa S.A. de CV grupo Noriega Editors - México. 6. MIPE/DRP/OAT-UE, (2000). Estadísticas sobre volumen consolidado de extracción de productos hidrobiológicos nativas. 7. MARTINEZ. D y ALARCÓN, L (2001). Efecto de los inhibidores presentes en materias primas vegetales sobre las proteasas alcalinas de los peces. Universidad de la Almería, 04120 - Almería. 8. NEW M. B. (1987). Feed and Feeding of Shrimp and fish. Aquac. Develop. And Coord. Prog. UNEP - FAO, ADCP/REP/87/26. FAO, Rome: p 274. 9. SINTAYEHU, A.; MATHIES, E.; MEYER – BURGDORFF, H.; ROSENOW , H. And GUNHER, k. D (1996) Apparent digestibilities and growth experiments With tilapia areochromis niloticus fed soybean harina, cottonseed harina and sun flower seed harina. J APPL. 10. UNIVERSIDAD DE LAS PALMAS DE GRAN CANARIA (UPGC) (2000) Fac. de Veterinaria, Dpto. de Producción Animal "Nutrición Animal" - Gran Canarias. 19 Instituto de Investigación, Producción, Servicios y Capacitación “Qollasuyo” Centro de Investigación y Producción Pesquera Chucuito UNA – Puno REPRODUCCIÓN ARTIFICIAL DE Trichomycterus rivulatus “suche” y Trichomycterus dispar “mauri” Lic. Blgo. Brígida Paca Pantigoso Lic. Blgo. René Chura Cruz PUBLICACIONES QOLLA Nº 18 Julio AÑO 2001 PUNO – 2001 – PERU 0 INTRODUCCIÓN Entre las especies ícticas nativas del lago Titicaca en peligro de extinción se encuentran los trichomycteridos es decir el “mauri” y el “suche”. Principalmente el “suche” que sufre la mayor amenaza. El peligro de extinción obedece a varios factores como la introducción e intromisión de especies ícticas foráneas como: la “trucha “ y el “pejerrey”, el proceso de eutroficación, contaminación, el crecimiento poblacional, la pobreza, etc. Frente a esta situación una de las alternativas de preservar y conservar las especies ícticas nativas, particularmente el “suche” es su acuicultura intensiva, es decir su reproducción artificial para lograr su repoblamiento. En este contexto se les ofrece la presenta guía, que esta dirigida a los pescadores artesanales y todas las personas afines al campo pesquero en el lago Titicaca. Asoc. IIP Qollasuyo - CIPP Chucuito UNAP 1 1. OBTENCIÓN DE REPRODUCTORES Se cuenta con un plantel de reproductores en los estanques del Centro Piloto de Pomata (Challacollo). Estos reproductores fueron capturados en el sector Villa Santiago (Pomata) del Lago Titicaca con redes agalleras de una malla de 1 ½”, 1 ¼” y 1 7/8” para “mauri” y 2”, 21/8” y 21/4” para “suche”; las que son caladas en horas de la tarde (antes de las 4 de la tarde) y cobradas al día siguiente en las primeras horas de la mañana (5 de la mañana). En ocasiones se realiza el acopio de reproductores en forma directa de los pescadores. 2. TRANSPORTE DE LOS REPRODUCTORES los reproductores aptos se transporta en tinas, baldes y otros recipientes adecuados para este fin, de una capacidad de 5 a 10 litros con agua del lago y cubiertos con plantas acuáticas. llegado al laboratorio se le añade con agua fresca en forma gradual evitando ocasionar un shock térmico. 3. SELECCIÓN La selección de los reproductores de trichomycteridos se hace tomando en cuenta las siguientes características: a. Selección por sexo b. Que estén aptos ( estadio V) c. Selección por tallas 112 mm como mínimo para “mauri” y 200 mm como mínimo para “suche” d. Aspecto morfológicos (que no tengan mal formaciones) 2 4. MATERIALES Y EQUIPOS PARA LA FECUNDACIÓN E INCUBACIÓN - Baldes de 5 a 10 litros de capacidad. Franela de algodón. Placas petri. Coladores pequeños. Vaso de incubación. Lupa Fuentes aporcelanadas. Bombillas de jebe. Plumas de ave. Cámara fotográfica. 5. DESOVE Y FECUNDACIÓN Para el proceso de fecundación artificial se debe tener en cuenta la proporción sexual de 2 machos por 1 hembra en “mauri” y en de 1 a 1 para “suche”. La fecundación se realiza por el método seco (Braskii), que consiste en extraer la totalidad de las ovas aptas de la hembra, sobre una bandeja completamente seca y en un lugar donde no haya incidencia directa de los rayos solares; friccionando el vientre con la mano. Se sigue un proceso similar para los machos esparciendo el líquido seminal sobre la ovas, luego se mezcla los dos productos sexuales con la ayuda de una pluma de ave, para que se produzca la fecundación de las ovas y dar origen al huevo o cigoto. Los productos sexuales se dejan reposar una hora para una mejor fecundación. Posteriormente se lavan las ovas fecundadas con agua fresca hasta que queden translucidas. Las ovas son libres por lo que no es necesario la separación. Se cuantifica directamente el numero de ovas y luego se mide el diámetro para ambas especies es de aproximadamente de 1.7 a 1.9 mm, depositándolas en los vasos de incubación. Después de 24 horas las ovas fecundadas se hidratan aumentando en su diámetro de 2.4 a 4 mm. Los periodos de incubación varían en función de la temperatura del agua, a mayores temperatura, menor período de incubación. 3 6. ECLOSION Y LARVAJE - La incubación tiene un período de 6 a 15 días para “mauri” y “suche” - El periodo de eclosión dura 3 a 5 días, dependiendo de la temperatura del agua. - Las larvas se caracterizan por presentar un saco vitelino previsto de reserva vitelina. - La reabsorción del saco vitelino en la población de larvas dura de 7 a 12 días dependiendo de la temperatura del agua. - Las larvas tienen tallas aproximadas de 6 a 7 mm. - La alimentación de las larvas es endógena, utilizando el vitelo. 7. ALEVINAJE - Las larvas pasan a ser alevinos, con la reabsorción del saco vitelino. - La alimentación de los alevinos es exclusivamente exógena, con base a fitoplancton, zooplancton, larvas de insectos acuáticos y en algunas oportunidades con alimento balanceado. - Los alevinos son diferentes morfológicamente a los adultos en los primeros días de vida, pero con el transcurso de los días los vestigios morfológicos de las aletas van tomando la forma definitiva del adulto. 4 5 Instituto de Investigación, Producción, Servicios y Capacitación “Qollasuyo” Centro de Investigación y Producción Pesquera Chucuito UNA – Puno ELABORACIÓN DE ALIMENTO BALANCEADO PARA ESPECIES ÍCTICAS NATIVAS DEL LAGO TITICACA Ing. Raúl Quispe Mamani PUBLICACIONES QOLLA Nº 19 Julio AÑO 2001 Puno 2001 – PERU 0 INTRODUCCIÓN Las raciones de alimento balanceado para especies ícticas nativas se elabora con materia prima, concentrados, ingredientes complementarios y aditivos. Lo que se pretende en el presente trabajo es introducir la utilización de alimentos de la zona, en la elaboración de dietas para la alimentación de las especies ícticas nativas del lago Titicaca, teniendo una composición equivalente a la de los nutrientes de los alimentos naturales (Energía Metabolizable, Proteína, Aminoácidos esenciales, Lípidos, Minerales, Carbohidratos); ajustando el precio. Actualmente se tiene dos tipos de Alimentos Compuestos en el proceso de Elaboración: el extruido y el alimento Compuesto - Pelletizado es bastante diferente, donde el pelletizado se realiza básicamente en seco, frío o caliente con baja presión, mientras que en el extruído se añaden grandes cantidades de aceite a los ingredientes secos y la mezcla húmeda se extruye a altas temperaturas y presión. En la formulación y elaboración de alimentos compuestos para especies pesqueras nativas no se tiene antecedentes por lo que el objetivo del presente trabajo es la elaboración de las dietas experimentales de acuerdo a la formulación planteada, los resultados serán directamente aplicables a evaluación en el proceso productivo para tener un grado adecuado de viabilidad técnica de los productos de alimentos compuestos para las especies ícticas nativas. Asoc. IIP Qollasuyo - CIPP Chucuito UNAP 1 1.- MATERIALES Y MÉTODOS El presente trabajo de Diseño y Elaboración de Alimentos Balanceados experimentales se llevó a cabo en la planta de Alimentos Balaceados del Proyecto Especial Truchas Titicaca (PETT), donde fueron fabricados mediante pelletizado. 1.1. MATERIALES 1.1.1. Materia prima, complementarios y aditivos utilizados en la fabricación de las dietas balaceadas. - Harina de Pescado Torta de soya Organismos alimenticios (Hyallella, etc.) Harina de trigo Vegetación Acuática Aceite vegetal Melaza de caña Antioxidante Conservantes (0.2%) Agentes ligantes y/o aglomerantes (0.2%) 1.1.2. Materiales y/o equipos - Balanza de plataforma, marca exacta, cap. 500kg. Balanza de precisión marca OHAUS, cap. 3210 gr. Jarras graduadas Tinas Bastidores Sacos de polipropileno Envases Pouch Envases de papel 1.1.3. Equipos para fabricación de Alimentos Balaceados - Molino desintegrador de martillos, Cap. 150 Kg./h. Accionamiento 380 V. (motor eléctrico de 20 HP) Molino pulverizador de martillos, Cap. 240 Kg./h. Accionamiento 380 V. (motor eléctrico de 15 HP) Mezclador vertical, Cap. 1000 – 1200 Kg./h. Acc. 380 V. (motor eléctrico de 5 HP) Pelletizadora y dosificador/mezclador, Cap. 300 – 600 Kg./h. Accionamiento 380 V. (motores eléctricos de 25 y ¼ HP) Generador de vapor (Beckett) Cap. 100 lb./pulg2 Accionamiento 220 V. (motor de 1/8 HP) Secador de pellets (Máquinas – INNOVA), Cap. 125 – 1200 Kg./h. Accionamiento 380 V. (motores eléctricos de ½ y ¼ HP) Tamizador (OCRIM) Cap. 500 – 1000 Kg./h. Accionamiento de 380 V. (motor eléctrico de ¼ HP) Cosedora de sacos (Kingex) Cap. 5 sacos/min. Accionamiento de 220 V. (motor de 1/8 HP) 2 1.2. METODOLOGÍA DE EXPERIMENTALES PROCESAMIENTO DE LAS DIETAS Figura 01 FLUJO DE PROCESAMIENTO DEL ALIMENTO BALANCEADO DENSO COMPRIMIDO. - Trigo entero - Torta de soya MATERIA PRIMA ACONDICIONAMIENTO BALANCEO de RACIÓN AEZO F. D. 3.0 Versión Windows 95/98. PESADO - Harina de pescado - Harina de torta de soya - Organismos Acuáticos - Harina de trigo - Vegetación Acuática - Conservante - BHT (antioxidante) MEZCLADO EN BASE SECA MEZCLADO EN BASE HÚMEDA - Melaza de caña - Aceite vegetal PELLETIZADO EN CALIENTE -Vapor saturado SECADO Y/O ENFRIADO TAMIZADO ENSACADO / PESADO Y COSIDO ALMACENAMIENTO Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno. 1.2.1. MATERIA PRIMA Se consideraron materias primas a partir de productos alimenticios enteros o granulados (tortas o granos) los que garantizan la calidad del alimento compuesto 1.2.2. ACONDICIONAMIENTO DE LAS MATERIAS PRIMAS Los ingredientes como; el trigo, la torta de soya a granel se recepcionaron en planta, a la vez se ha efectuado la separación de partículas indeseables, no 3 comestibles, a fin de garantizar la pureza del ingrediente, como evitar daños a las máquinas. Los insumos en granos y tortas, se sometieron a una proceso de molienda, efectuada en un molino de martillos móviles donde, el principio de funcionamiento es por (estallido o percusión), obteniendo partículas menores de 300 micras, con tamiz fino teniendo un diámetro de perforación de 0,9 mm. 1.2.3. FORMULACIÓN DE RACIONES Las raciones experimentales fueron formuladas, empleando un programa computacional denominado AEZO. FD para WINDOW S 95/98 considerando aspectos que se mencionan en la metodología de formulación de ración. 1.2.4. PESADO De acuerdo a la composición porcentual de las dietas, se realizó el pesado de cada uno de los insumos, complementarios y aditivos. 1.2.5. MEZCLADO BASE SECA Para el producto mezclado de base seca, se incluyen todos los ingredientes en seco, como (harina de pescado, harina torta de soya, harina de maíz híbrido, harina de trigo, antioxidante Butilhidroxitolueno-BHT), para efectuar el mezclado y homogenizado en un tiempo de 8 minutos. 1.2.6. MEZCLADO BASE HÚMEDA Se prepara una cantidad de 3 Kg por tina, cuya capacidad es de 90 litros, donde se incluyen los ingredientes como la melaza de caña, aceite vegetal, a estos insumos de les da un mezclado manual, hasta homogenizarlos, obteniéndose ésta en un tiempo de 2-8 minutos por cada 3 Kg 1.2.7. PELLETIZADO EN CALIENTE La operación de moldeado se llevó a cabo en la pelletizadora, la que está provista de dos rodillos con superficies perforadas de acero endurecido con un determinado diámetro; la que tiene una matriz con orificio de salida para el producto, y concluye con una cuchilla fija para cortar los pellets; está máquina gira en sentido horario. El pelletizado en caliente, consistió en dar forma, a la masa ó mezcla de ingredientes en una prensa de expulsión con matriz fija plana; acondicionada la mezcla con vapor saturado de agua a 99 a 110 oC, en el trayecto del dosificador – transportador que dosifica la mezcla humedecida en cantidades 4 continuas y necesarias para que los rodillos compriman a través de los agujeros de la matriz fija la que tiene 4 mm. de diámetro, para luego ser expulsados en cantidad continua, y obtener gránulos o pellets. 1.2.8. ENFRIADO – SECADO El producto pelletizado al salir de la máquina pelletizadora tuvo una temperatura de 89-98 ºC y con una humedad promedio de 35 %. El producto fue alimentado a una secadora horizontal de pellets, la máquina emplea aire frío del ambiente para secar el producto. Para obtener resultados satisfactorios, se procedió a un oreado del producto a temperatura del medio ambiente. 1.2.9. TAMIZADO El producto una vez sometido al secado, se tamizó para obtener un producto seleccionado de diferentes tamaños y separar las partículas finas. Este proceso se lleva a cabo empleando una máquina seleccionadora, la que tiene o tamizador la que tiene una producción de 300-450 Kg/h. 1.2.10. ENSACADO – COSIDO El ensacado del producto pelletizado seco, se hizo en bolsas de papel, en presentaciones de 3 Kg. 1.2.11. ALMACENAMIENTO Las dietas elaboradas fueron almacenadas a la sombra en “parihuelas” de madera a una temperatura de 13 oC. 2. RESULTADOS Y DISCUSIÓN. En los cuadros siguientes se presenta las cantidades de Ingredientes empleados en la elaboración de las Dietas experimentales. CUADRO Nº 01 CANTIDAD DE INSUMOS E INGREDIENTES PARA LA ELABORACIÓN DE ALIMENTO B PARA ESPECIES ÍCTICAS NATIVAS INGREDIENT E S Harina de pescado Organismos alimenticios Melaza Vegetación acuática Harina de trigo Aceite de pescado Harina de soya COMPOSICIÓN PARA DIETA DE 3 KG/CU (CARACHI AMARILLO) ALEVINOS JUVENILES ADULTOS Cant. (kg) Cant. (kg) Cant. (kg) 0.6738 1.14 0.09 0.056 0.150 0.09 0.796 0.692 0.797 0.090 0.007 0.120 0.090 0.600 0.692 0.730 0.150 0.643 0.090 0.090 0.600 5 RESULTADOS Peso inicial : 3000gr. Peso inicial: 3000gr Peso final : 2500gr. Peso final: 2 978 gr Rendimiento: 83.3% Rendimiento: 99.1% Fuente: IIP-Qollasuyo CP-Arapa (2001) Peso inicial: 3000gr Peso final: 3150 gr Rendimiento: 105% CUADRO Nº 02 INGREDIENTES Harina de pescado Organismos alimenticios Aceite de pescado Melaza Torta de soya Harina de trigo Vegetación acuático RESULTADOS COMPOSICIÓN PARA DIETA DE 3 KG/CU (BOGA) ALEVINOS JUVENILES ADULTOS Cant. (kg) Cant. (kg) Cant. (kg) 0.6885 1.2801 0.090 0.150 0.600 0.180 0.0081 Peso inicial: 3000gr Peso final: 3090 gr Rendimiento: 103% Fuente: IIP-Qollasuyo CP-Arapa (2001) 0.7026 0.7152 0.090 0.180 0.450 0.150 0.7092 Peso inicial: 3000gr Peso final: 3009 gr. Rendimiento: 100% 0.6885 1.2501 0.050 0.150 0.600 0.180 0.068 Peso inicial: 3000gr Peso final: 3014 gr Rendimiento: 100% 6 CUADRO Nº 03 CANTIDAD DE INSUMOS E INGREDIENTES PARA LA ELABORCIÓN DE ALIMENTO B PARA ESPECIES ÍCTICAS NATIVAS COMPOSICIÓN PARA DIETA DE 3 KG/CU SUCHE INGREDIENTES ALEVINOS JUVENILES ADULTOS Cant.(kg) Cant.(kg) Cant.(kg) 0.6966 1.3980 0.090 0.54 0.120 0.150 -Pi=3000gr Pf=3013 R=100% Harina de pescado Organismos alimenticios Aceite de pescado Harina de soya Harina de trigo Melaza de caña Vegetación acuática RESULT AD OS 0.6909 0.8982 0.060 0.570 0.180 0.180 0.4179 Pi = 3000gr Pf = 3002 R = 100% 0.6801 1.1166 0.120 0.69 0.180 0.210 -Pi = 3000gr Pf = 1977 R = 99% Fuente: IIP-Qollasuyo CP-Arapa (2001) CUADRO Nº 04 INGREDIENTES Harina de pescado Organismos alimenticios Aceite de pescado Harina de soya Harina de trigo Melaza de caña Vegetación acuática RESULT AD OS COMPOSICIÓN PARA DIETA DE 3 KG/CU MAURI ALEVINOS JUVENILES ADULTOS Cant.(kg) Cant.(kg) Cant.(kg) 0.6774 1.2321 0.06 0.750 0.150 0.120 0.0075 Pi = 3000gr Pf = 3065gr R=102% 0.6897 0.2573 0.120 0.600 0.150 0.180 -Pi = 3000gr Pf = 3100gr R = 103% 0.6738 0.900 0.09 0.600 0.515 0.067 0.150 Pi = 3000gr Pf = 3043gr R = 101% Fuente: IIP-Qollasuyo CP-Arapa (2001) En los cuadros anteriores se observa que en el proceso de elaboración de las dietas experimentales se obtuvo rendimientos que fluctúan entre 83.3% a 105% resultados acorde o muy cercanos a las referencias bibliográficas, sin embargo dentro del rendimiento se tiene en cada dieta un porcentaje promedio de 8% de finos, aunque teóricamente debería ser el 3% de finos; en las dietas que exceden en rendimientos mayores al 100% se puede atribuir que estos resultados se obtienen debido a la inclusión de aceite vegetal y melaza de caña como ingredientes líquidos. Según el crecimiento de los característicos merísticas de Orestias luteus, Orestias pentlandii y Trichomycterus dispar . Referente a longitud de boca en (mm) se presenta en el cuadro Nº 05. 7 CUADRO Nº 05: CRECIMIENTO DE LAS CARACTERÍSTICAS MERISTICAS DE LAS ESPECIES ÍCTICAS NATIVAS Características mirística (mm) 1 día 8 días Orestias luteus Longitud de boca (mm) 0.3 0.3 Fuente: IIP-Qollasuyo CP-Arapa (2001) 17 días 0.3 Características merística (mm) Ores tias pe ntlan dii Longitud de boca (mm) Fuente: IIP – Qollasuyo CP - Arapa (2001) Características merística (mm) T richo my cterus d is par Longitud de boca (mm) Fuente: IIP-Qollasuyo CP-Arapa (2002) 44 días 0.6 58 días 0.7 70 días 0.8 82 días 0.9 115 días 1 33 días 43 días 0.6 0.7 178 días 1.2 1 días 14 días 20 días 61 días 0.7 0.8 1.0 1.2 De acuerdo a lo reportado se puede recomendar los siguientes tamaños de alimentos para diferentes especies y tamaños de especies. ETAPA DE DESARROLLO “CARACHI AMARILLO” (Tamaño de alimento mm) “BOGA” (tamaño de alimento mm) Alevinos (0.1-0.4) (0.1-0.4) Juveniles (0.6-1.0) (0.6-1.2) Adultos (1.1-2.5) (1.2-2.8) Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno (2002) “SUCHE” (tamaño de alimento mm) “MAURI” (tamaño del alimento mm) (0.2-0.4) (0.5-1.2) (1.2-2.5) (0.3-0.4) (0.5-1.2) (1.2-3.0) Las partículas de Alimento ingerido están en relación al diámetro de la boca; Aleev, 1963; citado por (Hepher 1993), demostró que los especies que se alimentan de Plancton, materia vegetal o pequeños organismos bentónicos, por lo general tienen el tamaño de la boca más pequeño que los carnívoros depredadores; (Dominique and. Cho, 2001)manifiestan que los tamaños correctos del alimento deben ser aceptables para los diferentes tamaños de peces. Las post larvas de los peces nativas son pequeñas (2-3mm y 0.12 g de peso promedio) y por tanto se concluye que se necesita un alimento tan pequeño y los métodos para obtenerlo están en una etapa inicial y experimental. El pellet o gránulo debe ser de correcta textura, flotabilidad donde parece que ha de ser formulado y diseñado específicamente para alimento desmoronado ya que en la industria de Alimentos Balanceados no se tiene en desarrollo de este tipo de productos porque las especies ícticas el tamaño del alimento son menores a los alimentos para otras especies ya existentes. 8 A continuación en el cuadro 7 se muestra las características organolépticas de las dietas experimentales. CUADRO Nº 07 CARACTERÍSTICAS ORGANOLÉPTICAS DE LAS DIETAS DIETA sabor CARACTERÍSTICAS ORGANOLÉPTICAS olor color apariencia Dieta, “carachi amarillo” Harina de Pescado fresco pescado y carne olor a melaza Harina de Dieta para la “boga” Pescado fresco pescado Harina de Pescado fresco Dieta para “suche” pescado olor a melaza Sabor a carne Dieta para “mauri” Pescado fresco harina de pescado Fuente: IIP Qollasuyo - CIPP Chucuito UNA Puno (2002) Oscuro pronunciado Ligeramente oscuro Oscuro pronunciado Oscuro pronunciado Buena dureza Correcto pulido Dureza adecuada Buen pulido Dureza adecuada Buen pulido Dureza adecuada Buen pulido Las características organolépticas presentan una ligera variación donde éstas están en función de las propiedades físicas de los ingredientes, cantidad de cada ingrediente en la mezcla, tamaño de la partícula de los ingredientes, la temperatura utilizada para el pelletizado, el nivel de grasa incluida, la utilización de insumos complementarios y/o aditivos. 3. CONCLUSIONES - El alimento seco formulado en pellet’s se debe desmenuzar para que ésta tenga un tamaño de alimento correcto, donde presentaron características físicas y texturales deseables. - El tamaño correcto del alimento provee una suave transición entre los diferentes rangos de tamaño de los peces en los alimentos. - El pellet o gránulo debe ser formulado y diseñado específicamente para alimento desmenuzado. - En una formulación de alimento desmenuzado se puede utilizar agentes aglutinadores naturales como es el almidón de papa, harina de trigo en niveles considerados y así se asegurará la calidad, estabilidad en el agua, flotabilidad de la partícula. 9 4. RECOMENDACIONES - Efectuar determinaciones de tamaño de boca de las especies ícticas nativas de cada una de las etapas de desarrollo de los peces. - Establecer normas de tamaño de alimento para diferentes especies y tamaños de especies. - Elaborar las dietas alimenticias para especies ícticas nativas en método de procesamiento de alimento por extrusión. - Realizar nuevas pruebas de formulación y elaboración de los alimentos compuestos. Iniciar trabajos de prueba y cultivo de peces empleando alimentos formulados y elaborados por la Asociación IIP “Qollasuyo” y CIPP Chucuito de la UNA Puno. Validar las dietas para diferentes edades de Orestias y Trichomycterus diseñadas y elaboradas por el IIP “Qollasuyo”. - Realizar análisis bromatológico de los alimentos naturales (Zooplancton y otros) preferidas por las especies ícticas nativas y partir de estos resultados elaborar alimento balanceado. - Iniciar con la formulación de otro tipo de alimentos y metodologías para la elaboración del alimento balaceado para las especies ícticas nativas. - Continuar con los trabajos de alimentación artificial en especies ícticas nativas desde los primeros estadios de crecimiento, para lo que podría servir las formulaciones presentes en este capitulo. - Iniciar las investigaciones para la producción de alimento vivo (fitoplancton y zooplancton) a fin de romper la dependencia de alimento natural silvestre. 5. BIBLIOGRAFÍA - DOMINIQUE, P. The Desk, Azebedo, P.A. and. CHO, C. (2000)the combinations of ingredients of the protein animals dice as major sources of the protein in the diet of trout of the rainbow fish laboratory of investigation of nutrition, the dept. of animal and poultry sci., university of guelp, Ontario Canada. - HEPHER, B. (1993) Nutrición de Peces Comerciales en estanques, Edit. Limusa S.A. de C.V., Grupo Noriga Editores- México. 10