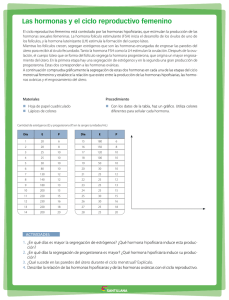
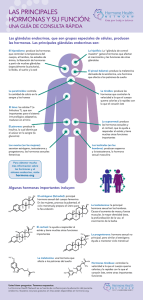
antología - BIOQUÍMICA CLÍNICA ESPECIALIZADA
Anuncio

ANTOLOGÍA BIOQUÍMICA CLÍNICA ESPECIALIZADA Para la siguiente antología se recopiló información de los temas vistos durante el semestre, entre los cuales se encuentran: agua y electrolitos, equilibrio ácido base, exudados y trasudados, análisis de cálculos (renales y biliares), líquido cefalorraquídeo, líquido amniótico, líquido seminal y perfil hormonal (sistema endócrino) AGUA La molécula de agua es un tetraedro irregular con oxígeno al centro y dos enlaces con hidrogeno que se dirigen hacia los dos vértices del tetraedro. Los enlaces de los átomos del agua son covalentes y se unen a otras moléculas mediante puentes de hidrógeno. Las características físico-químicas del agua son: acción disolvente, elevada fuerza de cohesión (incomprensible), elevada fuerza de adhesión (capilaridad), gran calor específico, elevado calor de vaporización (aumento de su temperatura por la ruptura de puentes de hidrógeno) y tensión superficial. Funciones: Todas las reacciones químicas se llevan a cabo en presencia de agua. Actúa como solvente para los productos de la digestión Regulador de la temperatura corporal. Sirve para eliminar por la orina los elementos de desecho orgánicos. Estados físicos del agua Líquido: los átomos carecen de posición fija por lo que están en constante movimiento. La temperatura del agua en este estado es de 36.5° Sólido: cuando la temperatura baja, los átomos se agrupan quedando muy juntos y casi inmóviles. Gaseoso: cuando la temperatura aumenta, los átomos se alejan entre sí y viajan de manera libre. Tipos de soluciones Soluciones isotónicas: igual concentración de solutos en los espacios intra y extracelular Solución hipotónica: menor concentración de solutos en el medio extracelular que en el intracelular. (citólisis) Solución hipertónica: mayor concentración de solutos en el medio extracelular que en el intracelular (crenación) Movimiento de los líquidos La ósmosis es el movimiento del agua de un medio de menor concentración a otro de mayor concentración, a través de membranas celulares semipermeables. Cuando se ejerce presión en el lado de mayor concentración, se puede hacer que el agua pase al lado de menor concentración, y a esto se le llama ósmosis inversa. La osmolaridad, es la medida solución. usada para la expresar la concentración de una Presión osmótica, es la cantidad de fuerza requerida para detener o prevenir la ósmosis. Regulación del Medio Interno (Homeostasis) La homeostasis es una condición en la que el ambiente interno del cuerpo permanece dentro de un margen de ciertos límites fisiológicos. Regulación del volumen de líquidos ajustando los egresos e ingresos RESTAURACION DE LA HOMEOSTASIA 6 Aumento del volumen total de líquidos corporales ESTIMULO 1 Deshidratación 2 Disminución del flujo de saliva Sequedad de boca y garganta Aumento en la presión osmótica sanguínea 3 Estimula al hipotálamo RESPUESTA 5 Aumento en la ingestión de líquidos 4 Sed Pérdidas de agua en la enfermedad Pérdidas gastrointestinales (vómitos, diarrea, ileostomía) Secuestro de Líquidos (quemadura, obstrucción intestinal, peritonitis) Pérdida de líquidos por trastornos renales (diabetes Insípida, Diuresis osmótica.) Distribución del agua corporal Hay dos tipos principales de líquido en el cuerpo: el extracelular y el intracelular. El agua corporal en el varón promedio que pesa 70kg es de 40 litros, de los cuales 25 litros corresponden al compartimento intracelular y 15 litros al compartimento extracelular. El líquido intersticial es la parte del líquido extracelular, situado fuera de los capilares y entre las células. En él se incluyen líquidos especiales como son: LCR, líquido pleural, líquido de los ojos, sinovial, peritoneal, Pericárdico y linfa. Estos líquidos viscosos y lubricantes se acumulan en algunos espacios del cuerpo llamados “potenciales” o “virtuales” que por lo regular están vacíos, y permiten a las superficies que los contienen deslizarse con facilidad. Los iones que hay en el espacio intracelular son: K1, Mg2, H2PO4-1, y HPO4-2, mientras que en el espacio extracelular están: Na1, Ca2, Cl-1 y HCO3-1. El catión más abundante en el espacio intracelular es el potasio y los aniones más importantes son los fosfatos y proteínas; mientras que el catión más abundante en el espacio extracelular es el sodio, y el anión más abundante el cloro. Déficit y exceso de agua Hipovolemia: Es el déficit de líquidos en el organismo como resultado de pérdidas anormales a través de piel intestino, riñón, disminución de ingesta de líquidos ó sangrado. Los signos más frecuentes son: Hipotensión Pérdida de peso. Sequedad de mucosas. Oliguria. Hipervolemia: es el exceso en volumen de líquido extracelular. Sus signos son: Edema periférico Ganancia de peso. Ascitis. Dilatación de venas periféricas ELECTROLITOS Ion es un átomo o conjunto de átomos con carga eléctrica por ganancia o pérdida de electrones. Al disolverse se separan en forma de iones; estas soluciones son capaces de conducir la corriente eléctrica, por lo que se denominan soluciones electrolíticas y a sus componentes, electrólitos. Importancia biológica Regulan equilibrio ácido base pH sanguíneo Controlan presión osmótica y coloidosmótica – oncótica Participan en transmisión de impulsos nerviosos y neuro-musculares Constituye estructuras formes (esqueleto y dientes) Necesarios como activadores enzimáticos Regulación de electrolitos sanguíneos Ingresos Por el aporte alimenticio (dieta) Egresos Eliminación - Vía Renal - Vía digestiva - Vía pulmo-cutánea Regulación hormonal - Mineralocorticoides: aldosterona, H. Paratiroidea - Otros glucocorticoides: cortisona y desoxicortisona Alteraciones en la concentración de los electrolitos más importantes SODIO Los valores normales de sodio en plasma son: 136 – 142 mmol/L. Cuando su contenido es más bajo se llama hiponatremia y los síntomas empiezan cuando: • Existe un desplazamiento intracelular del agua para igualar la presión osmótica de los compartimientos. • El agua penetra a las células cerebrales y las dilata. Síntomas de la hiponatremia: Na+ CONCENTRACIÓN PLASMÁTICA < 125 mmol/L 11O - 120 mmol/L < 110 mmol/L NÁUSEA DOLOR DE CABEZA SÍNTOMAS GRAVES MALESTAR GENERAL LETARGO CONVULSIONES OFUSCACIÓN COMA Cuando los niveles de sodio están elevados se llama Hipernatremia, y hay un aumento en la concentración del sodio extracelular lo que produce deshidratación celular. Ya sea por pérdida de líquido hipotónico por vía renal o extrarrenal. Sus principales síntomas son: Letargia, Reflejos hiperactivos, Temblor muscular, Convulsiones y coma. Está asociada con: • enfermedad neurológica asociada a hipodipsia. • Afecta más comúnmente a pacientes comatosos, con trastornos primarios de la sed o a niños. POTASIO Es el principal catión intracelular del organismo, un 98% de K+ del cuerpo está dentro de las células y sólo el 2% en el líquido extracelular. La concentración intracelular de K+ es 150 mmol/L. y su concentración plasmática es 3.5 – 5.0 mmol/L y Si se ve alterada produce arritmias cardiacas y parálisis muscular. Cumple 2 funciones fisiológicas: • Regula los procesos metabólicos celulares. • Es indispensable en la excitación neuromuscular. Cuando sus niveles son más bajos se considera hipopotasemia y puede deberse a pérdidas renales, gastrointestinales o incremento del consumo celular de K CALCIO En bioquímica se estudia al calcio ionizado (forma activa del calcio) y es el electrolito más abundante en el organismo, estando un 99% en el músculo esquelético. Los valores normales del calcio ionizado en suero son 1 – 1.2 mmol/L Sus funciones son: actividad neuromuscular, coagulación sanguínea, metabolismo óseo, conservación de las membranas celulares y participa además como segundo mensajero intracelular. • Hipocalcemia: Se valora junto con la albúmina y el edo. Ácido-básico, como reflejo de la fracción ionizada. Entre sus síntomas están: Tetania, extremidades inferiores afectadas, espasmos dolorosos, epilepsia, depresión, mala memoria, confusión. • Hipercalcemia: se presenta cuando el nivel total de calcio en suero es >10.5 mg/100 ml y el 90% se debe a hipoparatiroidismo primario. Entre sus síntomas están: Falta de concentración, confusión mental, letargo, poliuria, nefrolitiasis, dolor en huesos, quistes, fracturas. MAGNESIO Sus valores normales son: 1.5 meq/L a 2.5 meq/L • Hipomagnesemia: es causada por la desnutrición, venoclisis carentes de Mg, síndrome de mala absorción, diarrea, alcoholismo, uso excesivo de diuréticos. Sus síntomas son depresión mental, confusión, debilidad muscular, convulsiones, ateroesclerosis, arritmias cardiacas graves, IAM. • Hipermagnesemia: puede ser causada por insuficiencia renal, intoxicación, ingesta de antiácidos o leche de magnesia. Entre sus síntomas están la somnolencia, paro cardiaco y más gravemente el coma. FOSFATO Los valores normales van de 2,4 a 4,1 mg/dl. Varían ligeramente entre diferentes laboratorios. Las causas de hipofosfatemia pueden deberse a una excesiva excreción renal, hiperparatiroidismo primario, cetoacidosis diabética, malabsorción, etc. Y sus síntomas pueden ser irritabilidad, malestar general, convulsiones, dolor muscular y en huesos, raquitismo y osteomalacia. El pH de los medios biológicos es una constante fundamental para el mantenimiento de los procesos vitales. La acción enzimática y las transformaciones químicas de las células se realizan dentro de unos estrictos márgenes de pH. En los humanos, los valores extremos compatibles con la vida y con el mantenimiento de las funciones vitales oscilan entre 6, 8 y 7.8, siendo el estrecho margen de 7.35 a 7.45 el de normalidad. También en el laboratorio es imprescindible el mantenimiento de un pH para la realización de muchas reacciones químico-biológicas. (Sistemas in vitro) Los sistemas encargados de evitar grandes variaciones del valor de pH, son denominados “amortiguadores, buffer o tampón”, y resisten tanto a la adición de ácidos como de bases. En ocasiones, el cuerpo humano produce su propio sistema buffer, para equilibrar el pH de algunas reacciones que se producen en él. (Sistemas in vivo) Cuando en una reacción aumenta el número de protones, al pH baja (ácido); y cuando el número de protones baja el pH sube (alcalino). Cuando esto sucede, la sustancia amortiguadora se disocia en su para amortiguador y regula la cantidad de protones. La fórmula para valorar el pH de una solución con un amortiguador es: pH= pK + log _sal_ Ácido Una reacción que ayuda a regular el pH en el cuerpo humano es la de HenderssonHasselbach, donde los principales amortiguadores son el ión carbonato y el ácido carbónico. Ésta reacción busca que la relación entre los amortiguadores sea20:1 para que el pH se mantenga en 7.4 Cuando el ión carbonato aumenta o disminuye, se dice que hay un cambio metabólico; y cuando el ácido carbónico aumenta o disminuye se dice que el cambio es respiratorio. La sangre, el riñón y el pulmón ayudan a controlar la fórmula de HenderssonHasselbach. Cuando el ácido carbónico se disocia, cede un protón H+ que se une a la Hb para formar HHB ayudando al transporte de O2 en la sangre y así realizar el intercambio gaseoso (donde el ácido carbónico se elimina por los pulmones). El mecanismo consiste en que la Hb recoge el O2 en el pulmón y lo lleva a los tejidos en forma de HbO2, una vez en el tejido, la HbO2 suelta el O2 en la célula y capta un protón H+ y se convierte en HHb. Ésta pasa a la sangre y ya desoxigenada regresa al pulmón para volver a comenzar el ciclo. Cuando el ión bicarbonato se disocia, cede un protón H+ que se une al NH3 para formar amonio (NH4) y así se eliminan el bicarbonato y el amonio en la orina, así como otros fosfatos ácidos monosódicos. La hemoglobina de la sangre es un tampón fisiológico que juega un papel muy importante en el mecanismo de regulación ácido-base. Es muy eficiente debido tanto al cambio de pK que experimenta al pasar de la forma oxidada a la reducida, como a la gran abundancia de esta proteína en la sangre. La HbO2 es un ácido más fuerte que la desoxihemoglobina, y por lo tanto los valores de pK son tales que en la disociación siguiente determinan que el pH sea aproximadamente 0,7. Ésta propiedad de la Hb de cambiar su valor de pK demuestra el efecto tampón, lo que permite el transporte de una determinada cantidad de CO 2 liberada en los tejidos. Los líquidos extravasculares son aquellos que se localizan fuera de los vasos sanguíneos. Los dividimos en dos grandes grupos, que son: 1. Líquidos serosos: Incluyen al Líquido Pleural, Pericárdico y Peritoneal. Como su propio nombre indica, derivan del suero. Los líquidos serosos son ultrafiltrados del plasma, provenientes de los vasos de las serosas. Su formación está influida por la presión osmótica (retiene líquido gracias a las proteínas), por la presión hidrostática (saca líquido de los capilares) y la permeabilidad capilar. En condiciones normales están en muy poca cantidad y no tienen interés clínico. En condiciones patológicas se distinguen dos tipos de líquidos serosos: “Derrames Exudados” y “Derrames Trasudados”. 2. Derrames: son aumentos de líquidos serosos de origen patológico. Las causas de que se produzcan derrames son las siguientes: Disminución de la presión osmótica (por descenso de las proteínas plasmáticas) Enfermedad hepática (Cirrosis) Síndrome Nefrótico Aumento de la permeabilidad capilar: Enfermedades inflamatorias Infecciones Tumores Aumento de la presión hidrostática Insuficiencia cardiaca congestiva Hipertensión portal (derrame en el peritoneo) Disminución del drenaje linfático Obstrucción linfática Ruptura de los conductos linfáticos Los derrames se denominan Exudados o Trasudados dependiendo de su composición. El Trasudado es un derrame no inflamatorio provocado por factores mecánicos que alterarían la presión hidrostática o factores que alteran la presión osmótica. El Exudado es un derrame inflamatorio originado por un aumento de la permeabilidad capilar que ocurre en enfermedades que afectan directamente a las cavidades orgánicas (Ej. Tuberculosis, infecciones bacterianas, tumores,...) Los criterios de diferenciación entre Exudado y Trasudado son los siguientes: ASPECTO FIBRINÓGENO PROTEÍNAS GLUCOSA TRASUDADO CLARO NO COAGULA < 20 g / L + ó - igual que en el plasma EXUDADO TURBIO COAGULA > 20 g / L Menor que en el plasma Características de los Líquidos Extravasculares Nombre Líquido cefalorra -quídeo Líquido sinovial Líquido pleural Cantidad Adulto: 90150ml y Neonatos:1060ml Depende tamaño de articulación. Ejem: la rodilla tiene de 0.1- 3.5 ml 15ml espacio pleural por Características macroscópicas Rojizo: hematíes Verdoso: liberación de mieloperoxidasa Amarillo: liberación de bilirrubina Incoloro o ligeramente amarillo y transparente Rojizo: traumatismos articulares Amarillo intenso: proceso inflamatorio Aspecto lechoso: presencia de uratos Amarillo verdoso: en ictericias Rosado: derrames hemorrágicos Blanquecinos: derrames Características microscópicas Linfocitos: 60-70 % Monocitos: 3050% Neutrófilos: 13% Leucocitos: 200/mm3 Monocitos: 48% Linfocitos: 25% Células sinoviales: menos de 10% Células polinucleares o plasmáticas Leucocitos:1000 /ml Linfocitos: mes del 50% Eosinófilos: 10% Células Mesoteliales: Composición Iones Gluc osa Proteí nas Triglicéri dos Urea y Ac. úrico Na, K, Ca, Cl Fosfat X os X X X X X X Líquido peritone al 75 a 100 ml Líquido Pericárdi co 15 a 50 ml quilosos y quiliformes(colest erol) Es de aspecto claro y color amarillo claro 5% Eritrocitos: 100 000/mm3 Neutrófilos: 25% Linfocitos: 70 % Eritrocitos y células mesoteliales Color amarillo Turbidez: indica pálido, claro, presencia de escaso. leucocitos Aspecto lechoso: derrames quilosos X X X X X X X Los cálculos son masas sólidas patológicas constituidas por cristales y material orgánico (mucoproteínas, células exfoliadas, leucocitos digeridos, bacterias, coágulos, etc.), habitualmente localizados en sitios de mayor tránsito de secreciones. El análisis cualitativo de cálculos se basa en identificar sus constituyentes químicos que es la clave para conocer la alteración que indujo su formación, además de servir como apoyo al tratamiento clínico y prevención de nuevas formaciones de cálculos en los pacientes. Se han obtenido cálculos de riñón, intestino, conductos biliares, conductos pancreáticos, glándulas salivares, canal prostático, entre otros, pero los que con más frecuencia causan alteraciones son de origen biliar y renal. Cálculos Biliares La litiasis biliar es una patología del aparato digestivo bastante frecuente, caracterizada por la formación de cálculos en la vesícula biliar. Los cálculos biliares pueden ser pigmentarios o de colesterol, siendo estos últimos los más frecuentes (75%) Los cálculos biliares de colesterol se forman por alteración en el metabolismo de los ácidos biliares y del colesterol, mientras que los pigmentarios por anomalía del metabolismo de la bilirrubina. Existen una serie de factores claramente asociados a un mayor riesgo de producción de cálculos biliares, como son: Cálculos de colesterol: son más frecuentes en personas mayores de 40 años, en las mujeres, en las que aumenta el riesgo al aumentar el número de embarazos, personas obesas o que padecen algunas enfermedades del tubo digestivo, como cirrosis, infección de vías biliares, enfermedad de Crohn, o diabetes. También se asocia a determinados tratamientos médicos, como son los tratamientos con anticonceptivos orales o los tratamientos hormonales. Cálculos pigmentarios: generalmente asociados a enfermedades hemolíticas (en las que los glóbulos rojos de la sangre se destruyen con mayor velocidad de lo normal), cirrosis e infecciones biliares, o infección por parásitos de las vías biliares. SÍNTOMAS En aproximadamente el 40% de los casos no se producen síntomas. Los síntomas más característicos son: Cólico en la parte superior derecha del abdomen o entre los omóplatos. Intolerancia a los alimentos grasos (indigestión, dolores, hinchazón y eructos). Náuseas y vómitos. Hinchazón y eructos. Ictericia Hipo o acolia (coloración blanquecina o francamente blanca de las heces; éstas también presentan un aspecto untuoso o graso). Coluria, coloración obscura de la orina. FACTORES DE RIESGO Historial familiar de cálculos biliares. Factores genéticos. Algunos grupos étnicos son más susceptibles. Obesidad. Consumo alcohólico excesivo. Anticonceptivos orales. Dieta alta en grasas y baja en fibra. Pérdida de peso brusca. Mujeres multíparas La mejor manera de evitar la formación de este tipo de cuerpos extraños dentro de nuestra vesícula biliar es: Mantenga el peso ideal Evite comidas abundantes o muy grasosas Evite que las comidas le produzcan indigestión Reduzca el consumo de colesterol Las mujeres que tienen cálculos debe evitar el tratamiento a base de estrógenos DIAGNÓSTICO La presencia de cálculos biliares, sin síntomas, no suele manifestarse en los análisis de sangre. La ecografía abdominal es la prueba no invasiva de elección ante la sospecha de colelitiasis. La colangiopancreatografia retrógrada puede ser necesaria si se sospecha la presencia de los cálculos en el conducto colédoco (conducto que va desde la vesícula biliar al tubo digestivo). El estudio de vías biliares solo es necesario ante la sospecha de colecistitis aguda, cuando la clínica y la ecografía no han sido definitivas para el diagnóstico. La posibilidad de realizar la extirpación de la vesícula biliar con los cálculos, mediante laparoscopia, hace que sea muy frecuente la realización de ecografía laparoscópica, y en caso de confirmarse el diagnóstico realizar la colecistectomía (extirpación de la vesícula) en la misma intervención. ¿CÓMO EVOLUCIONA? Las colelitiasis suelen manifestarse como colecistitis aguda, que con frecuencia evoluciona con complicaciones, más frecuentes en los pacientes ancianos mayores de 65 años, como la infección de las vías biliares, la perforación de la vesícula, la formación de abscesos y fístulas de la vesícula y el árbol biliar entre otras. Otra complicación es la coledocolitiasis: Ocurre cuando los cálculos emigran desde la vesícula al conducto colédoco, pudiendo manifestarse como un cuadro de colestasis extrahepática (falta de drenaje de la bilis), o bien, si el conducto biliar común se contamina con microorganismos, como un episodio de colangitis aguda. La pancreatitis aguda puede ocurrir hasta en el 5% de todos los pacientes con litiasis biliar. Se produce por emigración de los cálculos que pasan del conducto biliar común al pancreático, o bien por reflujo de fluidos duodenales o biliares hacia este conducto del páncreas. La existencia de complicaciones suele exigir la extirpación de la vesícula mediante intervención quirúrgica abierta. TRATAMIENTO El tratamiento de elección de la colelitiasis sintomática (cólico biliar, colecistitis, etc.) es la colecistectomía (extirpación de la vesícula biliar), además del tratamiento médico del dolor y de la inflamación. Es preferible intervenir con cirugía laparoscópica en los primeros días de la fase aguda del cólico o de la colecistitis. El tratamiento no quirúrgico, con tratamiento médico de ácidos biliares orales que facilitan la disolución de los cálculos puede ser una alternativa en pacientes en los que el riesgo de una intervención quirúrgica no recomienda su realización. La litotricia, recomendada en algunos casos de pacientes con litiasis única no calcificada de menos de 20 mm y vesícula con funcionamiento normal. No puede realizarse en pacientes con antecedentes de pancreatitis, con quistes o aneurismas hepáticos, entre otros. Cálculos Renales La litiasis del sistema urinario es una patología que afecta aproximadamente al 1% de la población total. Más o menos el 15-20% de los pacientes con cálculos son hospitalizados debido al dolor, la obstrucción, o al desarrollo de infección. La formación de cálculos renales se debe a diversas alteraciones metabólicas, a la disminución del volumen urinario, o al aumento en la excreción urinaria de ciertos componentes químicos, tal como sucede en la hipercalciuria, hiperoxaluria, hiperuricosuria o cistinuria. La disminución en la solubilidad puede deberse a la alteración del pH urinario: un pH ácido predispone a la formación de cálculos de ácido úrico, mientras que un pH alcalino facilita la formación de litos que contengan fosfatos. Excepto algunos casos en los que hay factores estructurales, morfológicos u otras condiciones médicas claramente predisponentes, la mayor parte de los pacientes tienen algún trastorno en la absorción, metabolismo o excreción de los componentes de los cálculos (calcio, ácido oxálico, ácido úrico, fosfato, etc.), de las sustancias inhibidoras de la formación de los mismos (ácido cítrico y magnesio) o de la acidez (pH) de la orina. En algunas ocasiones, no es posible saber si dichos trastornos son congénitos o adquiridos y la formación de cálculos puede ser secundaria a más de un trastorno metabólico. En las últimas décadas, se han realizado sustanciales progresos en el conocimiento de los mecanismos fisiopatológicos responsables de la enfermedad litiásica, con lo que se han podido desarrollar programas eficaces y racionales, tanto para su tratamiento como para la prevención de la recurrencia. Con los conocimientos actuales, se puede alterar la cadena de acontecimientos que acaba en la formación de cálculos, cambiando algunos factores ambientales, como la dieta (hábitos alimentarios) de los pacientes, a quienes se pueden indicar normas comprensivas para cada tipo específico de trastorno litiásico. TIPOS DE CÁLCULOS RENALES El tipo de piedra más común contiene calcio. El calcio es un mineral que forma parte de nuestra dieta normal. El calcio que no se necesita para los huesos y los músculos pasa a los riñones. En la mayoría de las personas, los riñones eliminan ese calcio que sobra junto con el resto de la orina. Las personas que forman piedras de calcio retienen ese calcio en los riñones. El calcio que no se elimina se une a otros desperdicios para formar una piedra. Una piedra tipo estruvita también conocida como triple fosfato, puede formarse después de una infección del sistema urinario o por presencia de cuerpos extraños en este sistema. Estas piedras contienen el mineral magnesio y el producto de desperdicio, amoníaco además de fosfato. Una piedra de ácido úrico se puede formar cuando hay demasiado ácido en la orina, debido a un exceso de ácido úrico en sangre. Las piedras de cistina son poco comunes. La cistina es una de las sustancias que forman los músculos, nervios y otras partes del cuerpo. La cistina se puede acumular en la orina hasta formar una piedra. La enfermedad que causa la formación de piedras de cistina es hereditaria. Otros cálculos menos frecuentes que se pueden presentar son: de xantinas, iatrogénicos, de silicato (inducido por fármacos como efedrina, o indinavir) y los espurios o falsos. Los cálculos renales pueden ser tan diminutos como un granito de arena o tan grandes como una perla. Incluso algunas piedras pueden tener el tamaño de una pelota de golf. La superficie de la piedra puede ser lisa o con picos. Por lo general son de color amarillo o marrón. Es posible que tomando algunas pastillas como L-carnitina o populares preparados vitamínicos con calcio o magnesio ayudamos a la aparición de las piedras. Algunos cálculos renales ocupan el espacio que se conforma por la pelvis renal dando a lugar a cálculos renales con forma de coral o Litiasis coraliforme. SÍNTOMAS La litiasis renal puede comportarse de forma asintomática o manifestarse por dolor que puede ser el típico cólico renoureteral, dolor sordo lumbar o dolor acompañando a la micción. El cólico renal comienza de forma súbita y se va intensificando hasta alcanzar un nivel insoportable, acompañado de náuseas, vómitos y variaciones en su intensidad. El dolor comienza en la fosa lumbar, se irradia al flanco y sigue por el abdomen hasta la zona genital, ingle y cara interna del muslo. La polaquiuria, la disuria y, a veces, la hematuria acompañan a las manifestaciones ya mencionadas. Cuando el cálculo pasa a la vejiga, lo que suele producirse si su tamaño es menor de 5 mm, o se mueve y permite la descompresión del uréter, el dolor se atenúa o desaparece; los cálculos de tamaño superior a 7 mm son de casi imposible expulsión. El episodio cólico renal debe diferenciarse de otros procesos, como dolores de origen intestinal, apendicitis aguda, cólico biliar, torsión de un quiste ovárico, ruptura de un embarazo extrauterino, tuberculosis genitourinaria, pielonefritis aguda y otras alteraciones parenquimatosas renales. Otras formas de manifestarse la litiasis renal son piuria estéril, escasa proteinuria, disuria, aumento de la frecuencia miccional, estranguria y, eventualmente, expulsión indolora de arenillas o pequeños cálculos. Las complicaciones litiásicas, como hematuria indolora, infección urinaria, e insuficiencia renal aguda por obstrucción, son también modos de manifestarse. El diagnóstico de sospecha de la litiasis renal se basa en la clínica antes mencionada. El problema de la litogénesis se complica al ser la orina una solución muy compleja, en la que existen sustancias que tienen influencia en los fenómenos de nucleación, crecimiento, agregación y anclaje cristalinos, pues no todos los sujetos con orinas sobresaturadas desarrollan litiasis renal. Tales compuestos se pueden clasificar como promotores, inhibidores y complejadores. Los promotores son aquellos compuestos químicos que, actuando en la superficie de los cristales, facilitan su crecimiento y, por ende, la formación de cálculos. Suelen encontrarse en la matriz orgánica de los cálculos y son macromoléculas del tipo de las mucoproteínas como la proteína de Tamm-Horsfall, que puede agregarse y precipitar en los túbulos constituyendo un núcleo litogénico, al hacerse insoluble por desialización; la llamada sustancia A, el uromucoide y, finalmente, algunas proteínas ácidas que contienen residuos de aspártico y glutámico. El LCR o líquido cerebro-espinal es un líquido transparente que cubre al cerebro y a la médula espinal; circula por los ventrículos cerebrales y el canal medular y se almacena en las cisternas cerebrales. Su función es proteger, alimentar, lubricar, ayudar en la función eléctrica al sistema nervioso central, entre otras. O sea proporciona el medio más adecuado para la supervivencia y función del principal sistema de coordinación y comunicación del cuerpo humano. El sistema nervioso central es un sistema semi-cerrado, guardado por el maravilloso mecanismo de la barrera hematoencefálica, un tejido muy especializado que también gracias a su permeabilidad especifica aísla eficazmente la circulación del líquido cefalorraquídeo de los demás líquidos del cuerpo, como la sangre venosa, la arterial, de la linfa y del liquido extracelular, al mismo tiempo que permite una comunicación esencial y selectiva con ellos. Este líquido cefalorraquídeo se fabrica en la cabeza, a través del plasma sanguíneo y es segregado en un 95% por los plexos coroideos del tercer ventrículo y los ventrículos laterales. Parte del fluido se difunde en el cerebro por el espacio subaracnoideo, mientras el resto pasa a través del agujero de Munro al cuarto ventrículo, donde se produce más fluido. De ahí pasa a través de la cisterna magna hacia el espacio subaracnoideo inferior del cerebro y baja por la meninge espinal, por toda la columna vertebral, el sacro y al final circula por todo el organismo. El líquido cefalorraquídeo circula por todo el sistema nervioso central de modo ordenado y por un canal de una sola dirección, y siendo eventualmente reabsorbido por las vellosidades aracnoideas del seno sagital y devuelto al sistema venoso. El espacio subaracnoideo en el cráneo vacía a la circulación sanguínea a través de los vellos aracnoideos en el seno sagital superior, aunque primero el LCR debe atravesar la pequeña apertura tentarais que rodea el mesencéfalo. O sea que el LCR está en constante cambio, entra nuevo líquido y se elimina el viejo al riego sanguíneo a través de las vellosidades aracnoideas. Diariamente el LCR es reabsorbido hacia: Sangre Granulaciones aracnoideas Venas del conducto raquídeo Sistema linfático Plexos coroideos CARACTERÍSTICAS FÍSICO-QUÍMICAS El LCR tiene un color claro y transparente como agua de roca. Con densidad de 1.008, presión de 50-80 mmHg y un pH de 7.35. Debe tener una coagulación negativa y no precipitar. Otros datos importantes de su producción: • • • • • • Volumen craneal total: 1900 ml Volumen total: 150 ml Volumen intra ventricular: 20-30ml Índice de producción: 500 cc/24 horas Lugar de producción: plexos coroideos: 80-90% Zonas extracoroideas (parenquima-epéndimo): 10-20% Aunque para su producción se utiliza la materia bruta del plasma sanguíneo, su composición difiere de su origen en la composición de electrolitos y en el hecho de que esta relativamente exento de proteínas. Su producción está clasificada como secreción más que como un simple filtrado. También existen componentes no celulares y algunas macromoléculas. La composición del LCR es principalmente agua con algunos elementos disueltos como: Proteínas: 15-45 mg/100ml Glucosa: 50-80 mg/100ml Leucocitos: 0-5/campo Eritrocitos: ninguno Vitaminas: especialmente del grupo B ALTERACIONES DEL LÍQUIDO CEFALORRAQUÍDEO ALTERACIONES Turbio opalescente Aumento de células polimorfonucleares Meningitis bacteriana Color Rojo hemorragico Xantocromico amarillo Traumático Oxihemoglobina Hemorragia ventricular Ictericia Post neuroquirurgico Aumento proteínas El líquido amniótico es un fluido líquido que rodea y amortigua al embrión y luego al feto en desarrollo en el interior del saco amniótico. Permite al feto caminar y saltar dentro de la pared del útero sin que las paredes de éste se ajusten demasiado a su cuerpo. También le proporciona sustentación hidráulica. El líquido amniótico es producido principalmente por la madre hasta las 17 semanas de gestación. El saco amniótico crece y comienza a llenarse, principalmente con agua dos semanas después de la fertilización. Tras 10 semanas después el líquido contiene proteínas, carbohidratos, lípidos y fosfolípidos, urea y electrolitos, todos los cuales ayudan al desarrollo del feto FUNCIONES DEL LÍQUIDO AMNIOTICO Un medio en el que el feto se mueve libremente. Es protección fetal para las agresiones externas. Mantiene una temperatura fetal uniforme. Protección fetal a las agresiones por contracciones Constituye un ambiente óptimo para el crecimiento y desarrollo fetal. Es un medio útil para valorar la salud y la madurez fetal. Es un medio útil para administrar medicación al feto. Es un elemento favorecedor de la dilatación cervical. COMPOSICION Y CARACTERÍSTICAS FÍSICAS Al término de la gestación, la composición y los caracteres físicos del LA, se resumen de la siguiente manera: Agua: 98 a 99 %. Solutos: 1 a 2 %, por partes iguales orgánicos e inorgánicos. Turbidez: aumenta con el tiempo de gestación. Peso Específico: en promedio 1,0078. Valor Crioscópico: de alrededor de 0,504 grados C. Presión Osmótica: de alrededor de 6,072 atmósferas a 0 grado C. Gases: pO 2 = 4-43 mm Hg y pCO 2 = 38-50 mm Hg. pH: desciende, de 7.13 antes de las 32 semanas, a 7.08 desde esa etapa en delante. Componentes Inorgánicos: no varían el Zn, Cu St, Mn, Fe. Componentes Orgánicos: - - - - - - Proteínas: tienen concentración 20 a 25 veces menor que en plasma materno, por electroforesis pueden identificarse la celuloplasmina, transferrina, IgG, IgA, e IgM, siendo las dos primeras, de origen materno, y la última aparece por infecciones intraútero. Aminoácidos: su concentración en el Líquido Amniótico es un 50 a75 % menor que en plasma materno; disminuyen con la EG. Algunos de ellos, permitirían detectar tempranamente, algunas anomalías del desarrollo fetal. Componentes Nitrogenados No Proteicos: urea, ácido úrico, creatinina; aumentan con la EG, especialmente por el aporte urinario fetal. Lípidos: su concentración en LA varía con la EG. Los lípidos totales al término del embarazo, oscilan alrededor de 13,61 mg %; los lípidos polares, representan un 69,50 % de ese total; los fosfolípidos aumentan su concentración con la EG, siendo su origen principalmente pulmonar (surfactante). Carbohidratos: están presentes, en diferentes concentraciones, glucosa, sacarosa, arabinosa, fructuosa, lactosa. La concentración de glucosa verdadera es menor que en plasma materno, alcanzando al término, 20 mg %. Vitaminas: las concentraciones de B-1 y C, son semejantes a las del plasma materno. Enzimas: de significación y aplicación clínica no aclarada, entre las que se encuentran la oxitocinasa no placentaria (cistino-aminopeptidasa), acetilcolinesterasa, fosfatasa alcalina que en forma patológica en las pacientes preeclámpticas, y la amilasa, Hormonas: los corticoides, andrógenos, progesterona y sus metabolitos, gonadotrofina coriónica, lactógeno placentario, renina, prostaglandinas, oxitocina. Las hormonas proteicas, no pasan la placenta ni el amnios. Los esteroides puede ser eliminados por la orina fetal. Citología: las células del LA proceden del amnios, mucosas y piel fetal. A las 14 semanas gestacionales, el LA es prácticamente acelular. Entre las 14 y 32 semanas, se observa una escasa celularidad del LA, la que aumenta bruscamente a partir de las 37 semanas. Existen células nucleadas y anucleadas; con citoplasma basófilo o acidófilo. La mayoría de las células aparecen en la segunda mitad gestacional, provenientes de la piel fetal, células superficiales, intermedias y profundas. Con sulfato azul de NILO al 1 %, agregando gota a gota al LA, se pondrá en evidencia el material lipídico de las células, con una coloración naranja, y con la misma coloración, los lípidos libres. ASPECTO En cuanto al aspecto físico del LA obtenido, puede ser: cristalino (inmadurez fetal), con vérmix y lanugo (madurez fetal), amarillo (bilirrubina aumentada), meconial (hipoxia fetal) o sanguinolento (muerte fetal). ESTUDIOS EN LIQUIDO AMNIOTICO El LA puede aportar datos sobre la madurez y la condición (salud) fetal. Tales valoraciones pueden realizarse por amniocentesis, amnioscopía o ecografía. 1) Amniocentesis: punción de la cavidad amniótica para obtención de LA. No está exenta de riesgos. Debe ser realizada con técnica quirúrgica. De preferencia, realizarla bajo control ecográfico. Para decidir el "sitio de punción", conocer previamente la localización placentaria. Los sitios de punción pueden ser: Mitad de línea umbílico-púbica: especial para embarazos menores de 28 semanas gestacionales. Pequeñas partes fetales: lago amniótico entre abdomen y miembros, especial para embarazos mayores de 28 semanas. Nuca fetal: cuando la presentación está fija o insinuada, especial para embarazos mayores de 35 semanas gestacionales. Suprapúbica: con presentaciones móviles y vejiga vacía. Transvaginal: en casos de piodermitis, embarazos menores de 20 semanas gestacionales. Entre las indicaciones de amniocentesis se encuentran: riesgos de cromosomopatías fetales, riesgos de trastornos metabólicos hereditarios, alfa-feto-proteína materna elevada, evaluaciones de la salud fetal y de su madurez. Complicaciones de la amniocentesis: a) Complicaciones maternas: como punción vesical; hematomas de la pared abdominal y /o uterina; infecciones de la pared abdominal y /o cavidad amniótica; irritabilidad uterina (hiperdinamia); parto prematuro. b) Complicaciones Ovulares: hematomas de la placenta y /o del cordón umbilical; desprendimiento prematuro de la placenta; microtransfusiones; RPM. c) Complicaciones fetales: hematomas, zonas de necrosis; neumotórax lesiones en cuello o axila, óbito fetal (muy raro). Entre los inconvenientes de la amniocentesis, se pueden mencionar: a) Punción negativa: ocurre en menos del 5 % de las punciones. En estas situaciones, hacer rotar la aguja 90 a 180 Grados continuando la aspiración. b) Contaminación: del material obtenido, con sangre o meconio. 2) Amnioscopía: es la observación del LA a través del polo ovular inferior intacto, contrastando con el polo cefálico. Es útil en las últimas semanas gestacionales. Es de técnica sencilla, indolora, de bajo riesgo, repetible y de forma ambulatoria. En cuanto a la técnica, deberá identificarse previamente las características del cuello uterino, el que es permeable en el 80 % de los embarazos al término. La presentación no debe estar muy alta. Se observa la característica del LA; su cantidad (la ausencia de LA es compatible con embarazo prolongado). Entre las indicaciones, luego de las 36 semanas gestacionales, se mencionan: embarazo postérmino, diabetes, RCIU, HTA, colestasis intrahepática, RPM. Como contraindicaciones, figuran: metrorrágicas del 3er. trimestre; amenaza de parto prematuro; presentaciones no cefálicas; condiciones inadecuadas del cuello uterino, lo que ocurre en un 15 % de las primigestas. Entre las complicaciones, aunque poco frecuentes se mencionan: parto prematuro, RPM, infecciones ovulares, metrorragias. 3) Ecografía: para valorar el volumen de LA. Una forma es medir un bolsillo de LA en uno o dos diámetros. La otra forma, es medir los diámetros verticales de un bolsillo en cada uno de los cuatro cuadrantes uterinos, y sumarlos, obteniendo así el índice de LA. Si la sumatoria se encuentra entre 10 y 20 cm, se estaría ante un volumen normal de LA. Valores entre 5 y 10 cm, estaría a favor de un oligohidramnios moderado. Con valores inferiores a los 5 cm, se estaría ante un oligohidramnios severo. Valores entre 20 y 25 cm, estarían a favor de un polihidramnios moderado y con valores de 25 cm o más, se considera polihidramnios. La imagen ecográfica puede semejarse a un nevisca, en los bolsillo de LA, lo que estaría a favor de madurez fetal, incluso de feto a término o postérmino. Esta misma imagen puede corresponder a LA meconial en grumos espesos (estructuras de mayor refringencia ultrasónica). Una brusca y severa disminución del volumen de LA, apoyaría la sospecha de amniorrexis. PATOLOGÍAS El líquido amniótico alcanza su volumen máximo aproximadamente a las 34 semanas del embarazo, cuando llega a un promedio de 800 ml. La deficiencia de líquido amniótico (oligohidramnios) o el exceso (polihidramnios) puede ser la causa o el indicador de problemas para la madre y el feto. Los fetos que se han desarrollado en ambientes con poco líquido amniótico pueden desarrollar contracturas de las extremidades, zopedad (torcimiento) de pies y manos y también el desarrollo de una afección peligrosa para la vida llamada hipoplasia pulmonar. Si este es el caso en un recién nacido, es decir, que sus pulmones son hipoplásicos, lo que significa que estos órganos están infradesarrollados y son pequeños, la situación es potencialmente mortal y el neonato puede fallecer poco después del parto. El oligohidramnios se puede producir por infección, disfunción renal o malformaciones; también por intervenciones como la toma de muestras de vellosidades coriónicas y un patrón de ruptura prematura de membrana. Se puede tratar en ocasiones con reposo en cama, rehidratación oral e intravenosa, antibióticos, esteroides y amnioinfusión. El polihidramnios es un factor de riesgo que predispone al prolapso de cordón umbilical y en ocasiones es un efecto secundario del embarazo macrosómico. El polihidramnios se asocia con la atresia de esófago. El patrón de ruptura prematura de membranas es un estado en el que el saco amniótico tiene fugas de líquido antes de la 38 semana de gestación. Esto puede estar provocado por una infección bacteriana o por un defecto en la estructura del saco amniótico, el útero o el cérvix. En algunos casos la fuga puede cicatrizar espontáneamente, pero en la mayor parte de los casos el parto comienza en 48 horas de la ruptura de membranas. Cuando esto sucede es necesario que la madre reciba tratamiento para evitar la posible infección del neonato. La embolia de líquido amniótico es una complicación obstétrica frecuentemente mortal que produce coagulación intravascular diseminada. El líquido seminal es una sustancia secretada por el aparato reproductor masculino. Esta sustancia contiene a los espermatozoides o gametos masculinos que tienen como objetivo fecundar el óvulo de la mujer. Este es expulsado por el hombre durante la eyaculación y se compone de un 10% de células reproductoras (espermatozoides) fabricados por los testículos, y el 90% es el líquido seminal que viene de las glándulas anexas, próstata y vesícula seminal. El volumen del eyaculado es diferente para cada hombre y depende de la frecuencia de las eyaculaciones. Después de la eyaculación el esperma tiene un olor característico en relación con la espermina componente volátil odorante. El color del esperma es lechoso, amarillenta; coagula en pocos minutos y se vuelve en un líquido viscoso y que pega. El esperma contiene, además de los espermatozoides, tres componentes principales que le dan su color y su gusto: la carnitina, el zinc y la fructosa. Hay unos 20 millones de espermatozoides por mililitro de esperma. Es de notar que lo importante no es la cantidad de esperma sino la cualidad. El termino cualidad se refiere a la movilidad y a la morfología de los espermatozoides. CARACTERISTICAS FISICO-QUIMICAS El volumen medio de semen de una eyaculación es de 3,5 mililitros y depende mucho de la abstinencia sexual previa. El pH del semen es de 7,5. Menos del 10% del volumen del semen de una eyaculación corresponde a los espermatozoides. Más del 90% del volumen del semen de una eyaculación corresponde al líquido seminal. La densidad de los espermas en el semen varía de 50 a 150 millones por mililitro, por lo que cada eyaculado contiene entre 200 y 300 millones de espermatozoides. Para que se produzca la fecundación del óvulo el semen debe contener más de 20 millones de espermas por mililitro. Por debajo de esta cifra se habla de esterilidad o infertilidad masculina. Otras células: Desprendidas del epitelio de los conductos excretores y de la uretra. Se compone básicamente de nitrógeno, ácido úrico, fructosa (el azúcar de las frutas, que le da un sabor y un olor característico), fosforociclina, glucosa, sodio, cloro, amoniaco y ácido ascórbico (presente también en los cítricos). Puede presentar elementos como: calcio, dióxido de carbono, colesterol y cretina. Esta composición del semen puede variar en cada persona. FORMACIÓN DEL SEMEN Túbulos seminíferos del testículo: Aquí se forman los espermatozoides durante un proceso que se llama espermatogénesis, influido por una hormona llamada testosterona y por la FSH. Al principio los espermas carecen de movilidad y conforme avanzan gracias a los movimientos peristálticos de estos túbulos, se van diferenciando y adquieren movilidad. Epidídimo: Aquí los espermatozoides son retenidos durante mucho tiempo, incluso semanas, recorriendo su trayecto largo y tortuoso lentamente e impulsados por las contracciones peristálticas del músculo liso de la pared de este conducto. En el epidídimo los espermatozoides aumentan su capacidad fertilizante y es el lugar principal de almacenamiento de los gametos masculinos. Conductos deferentes: Estos conductos apenas contienen espermatozoides. Su función, con su gruesa capa muscular, es la de transportar rápidamente el semen durante el coito, hacia la uretra. Vesículas seminales: Producen una densa secreción que contribuye de manera muy importante al volumen del eyaculado, que oscila entre el 46% al 80%, siendo la última parte del semen en salir en una eyaculación. Esta secreción es rica en fructosa, que es el azúcar principal del semen y proporciona los hidratos de carbono utilizados como fuente de energía de los espermatozoides móviles. También contiene pequeñas cantidades de un pigmento amarillo, flavinas en su mayor parte, que aportan al semen una fuerte fluorescencia a la luz ultravioleta, que tiene mucho interés en medicina legal para la detección de manchas de semen en una violación. Próstata: Aporta la segunda parte del contenido del semen en una cantidad abundante que oscila entre el 13% y el 33% del volumen total del eyaculado. El líquido prostático es rico en enzimas fosfatasas y en ácido cítrico. La próstata produce el fosfato de espermina, un compuesto poliamínico presente en cantidad abundante en el semen humano. Esta sustancia forma los cristales de Böttcher que se forman cuando el semen se enfría y comienza a secarse. Uretra bulbar: Contiene las glándulas de Cowper y Littré que también secretan un líquido lubricante al semen, poco abundante pero rico en mucoproteínas, siendo la primera parte del eyaculado. Facilitan la lubricación de la uretra que recorre el pene para el paso del semen a gran velocidad hacia el exterior, gracias a la contracción de los músculos bulbouretrales. Cuando se realiza una prostatectomía radical en caso de un cáncer de próstata, se extirpa la próstata, las vesículas seminales y se ligan los conductos deferentes. El semen producido en las gónadas masculinas, se acumula en el epidídimo y conductos deferentes, reabsorbiéndose allí mismo. En estos casos, en caso de coito, no existe eyaculación, lo que se llama orgasmo seco. RECORRIDO DEL SEMEN Son los testículos el sitio del escroto donde se produce el semen. El epidídimo es una estructura enrollada que corona los testículos y recibe espermatozoides inmaduros de los testículos y los almacena por varios días. Cuando se produce la eyaculación, el semen es expulsado desde una extremidad del epidídimo hacia el conducto deferente. Posteriormente, el semen se desplaza a través del conducto deferente hacia el cordón espermático en la cavidad pélvica más allá del uréter y detrás de la vejiga. Allí, el vaso deferente se une con la vesícula seminal para formar el conducto eyaculatorio, el cual atraviesa la próstata y se vacía en la uretra. Cuando se produce la eyaculación, los movimientos musculares rítmicos impulsan el esperma hacia adelante. RECUENTO DEL SEMEN La Organización Mundial de la Salud (OMS, 1999) proporciona una definición de recuento de esperma "normal", si bien se ha modificado con el paso de los años hasta la actualidad: La concentración de espermatozoides debe ser al menos de 20 millones por ml. El volumen total de semen debe ser al menos de 2 ml. El número total de espermatozoides en la eyaculación debe ser al menos de 40 millones. Al menos el 75% de los espermatozoides deben estar vivos (es normal que hasta el 25% estén muertos). Al menos el 30% de los espermatozoides deben tener una forma y contorno normales. Al menos el 25% de los espermatozoides deben nadar con un movimiento rápido hacia delante. Al menos el 50% de los espermatozoides deben nadar hacia delante, incluso aunque sea con lentitud. Un órgano endócrino es todo aquel órgano que secreta una hormona (ENDO: Dentro, KRINEIN: Secretar) Hormona: Compuesto químico producido por una célula endocrina que actúa sobre una célula blanco produciendo un efecto biológico FUNCIONES • Maduración del SNC • Mantiene la homeostasis • Crecimiento y desarrollo • Reproducción 1. HIPOTÁLAMO Es un órgano integrador del Sistema Nervioso y del Sistema Endócrino. Regula la homeostasis y necesidades como sed, hambre, temperatura corporal, balance hídrico y la presión sanguínea. En respuesta a su estimulación, regula las actividades de las glándulas tiroides, suprarrenales y las gónadas; funciones de crecimiento y el metabolismo. HORMONAS HIPOTALAMICAS ESTIMULADORAS Glándula Hipotálamo (vía hipófisis posterior) Hormona Acción principal Mecanismo que controla su secreción Tipo de molécula Oxitocina Estimula las contracciones uterinas y la salida de la leche Sistema nervioso Péptido (9 aminoácidos) Controla la excreción de agua Concentración osmótica de la sangre; volumen sanguíneo, sistema nervioso Péptido (9 aminoácidos) Hormona antidiurética (ADH, vasopresina) 2. HIPÓFISIS También llamada Glándula Pituitaria. Es una glándula compleja que se aloja en el espacio óseo llamado silla turca situada en la base d cráneo. HORMONAS HIPOFISIARIAS Glándula Hormona Acción principal Mecanismo que controla su secreción Tipo de molécula Hormona de crecimiento (somatotropina) Estimula el crecimiento del hueso, inhibe la Hormona (s) oxidación de la hipotalámica (s) glucosa, promueve la degradación de ácidos grasos Proteína Prolactina Estimula la producción de leche Hormona (s) hipotalámica (s) Proteína Hormona estimuladora de tiroides (TSH) Estimula la glándula tiroides Tiroxina en sangre; hormona (s) hipotalámica (s) Glucoproteína Cortisona en la sangre; hormona (s) hipotalámica (s) Polipéptido (39 aminoácidos) Glucoproteína Hipófisis, lóbulo Hormona anterior Estimula la corteza adrenocorticotrófica suprarrenal (ACTH) Hormona foliculoestimulante (FSH)* Estimula al folículo ovárico, espermatogénesis Estrógeno en la sangre; hormona (s) hipotalámica (s) Hormona luteinizante (LH) Estimula la ovulación y la formación del cuerpo lúteo en las hembras y las células intersticiales en el macho Progesterona o testosterona en la Glucoproteína sangre; hormona(s) hipotalámica (s) 3. GLÁNDULA TIROIDES Está situada en la parte anterior del cuello, por delante del cartílago cricoides. Consta de dos lóbulos unidos por un istmo. Tiene un peso al nacimiento de 1-3 gr. Y en el Adulto de 15-20 gr. Puede identificarse a los 16 -17 días de gestación Funciones: Regulan consumo de O2 Mantenimiento del peso y temperatura Contracción del corazón Síntesis proteica Metabolismo de colesterol y triglicéridos Crecimiento somático Diferenciación y maduración SNC Regulación del metabolismo de calcio HORMONAS TIROIDEAS Son producidas por la glándula tiroides. Se encargan de aumentar el metabolismo basal, del correcto desarrollo fetal y del Funcionamiento adecuado de los sistemas: Cardiovascular, musculo-esquelético y hematopoyético. Las principales hormonas producidas por la tiroides son la Tiroxina (T4) y la Triyodotironina (T3), cuya producción está regulada por una hormona producida por la hipófisis, la TSH (hormona estimulante de la tiroides). El yodo es un componente esencial tanto para T3 como para T4. La tiroides también sintetiza la hormona calcitonina que juega un papel importante en la homeostasis del calcio. TRIYODOTIRONINA (C15H12I3NO4) También conocida como T3, es una hormona tiroidea cuya función es estimular el metabolismo de los hidratos de carbono y grasas, activando el consumo de oxígeno, así como la degradación de proteínas dentro de la célula. La T3 incrementa el metabolismo basal y, así, incrementa el uso de oxígeno y energía por el cuerpo. T3 actúa en la mayoría de los tejidos dentro del cuerpo, con algunas excepciones incluyendo el bazo y los testículos. El rango para los valores normales es de 100 a 200 ng/dL (nanogramos por decilitro). Los niveles por encima de lo normal pueden indicar: Niveles altos de una proteína que transporta T3 en la sangre (puede ocurrir con el embarazo, el uso de píldoras anticonceptivas o estrógenos, enfermedad hepática, o como parte de una afección hereditaria) Hipertiroidismo (por ejemplo, enfermedad de Graves) Tirotoxicosis por T3 (poco común) Cáncer tiroideo (poco común) Los niveles por debajo de lo normal pueden deberse a: Enfermedad prolongada Hipotiroidismo (por ejemplo, enfermedad de Hashimoto) Inanición TETRAYODOTIRONINA O TIROXINA Es una importante hormona tiroidea compuesta por la unión de aminoácidos yodados. Su función es estimular el metabolismo de los hidratos de carbono y grasas, activando el consumo de oxígeno, así como la degradación de proteínas dentro de la célula. Formación: La tiroides sintetiza esta hormona combinando yodo con el aminoácido tirosina, siendo regulada por la TSH. Es transportada en sangre formando un complejo con las proteínas del plasma, y se desactiva en el hígado. La tiroxina se convierte en el hígado y otros órganos en una forma metabólicamente activa, la triyodotironina (T3) En la actualidad se utiliza tiroxina sintética para tratar enfermedades causadas por deficiencias del tiroides, como el cretinismo (hipotiroidismo congénito) y el bocio. Los Valores normales para T4 son: 5 a 13,5 microgramos / dl. Los niveles elevados de T4 pueden darse en: • El embarazo • Enfermedad hepática • Uso de anticonceptivos • Por hiperactividad de la tiroides (enfermedad de Hashimoto, enfermedad de Graves o tumores de las células germinativas) Los niveles de T4 inferiores a lo normal pueden indicar: • Hipotiroidismo • Desnutrición o ayuno • Uso de ciertos medicamentos HIPOTIROIDISMO Es la disminución de los niveles de hormonas tiroideas en el plasma sanguíneo y consecuentemente en tejidos. HIPOTIROIDISMO CONGÉNITO Es aquel de origen genético que aparece en el momento del nacimiento del bebé. Los niños pueden no presentar signo aparente tras el nacimiento. Si no se trata adecuadamente de forma precoz puede provocar discapacidad física y mental HIPOTIROIDISMO SIN BOCIO También se llama hipotiroidismo tiroprivo. Se debe a una pérdida del tejido tiroideo con síntesis inadecuada de hormona tiroidea a pesar de la estimulación máxima con hormona tirotropa (TSH). Este puede ser congénito (por una disgenesia tiroidea) o adquirido (iatrogénico, idiopático o transitorio) HIPERTIROIDISMO Es cuando se produce una cantidad excesiva de hormonas tiroideas circulantes, generalmente debido a una glándula tiroides que funciona más de lo debido. El hipertiroidismo suele deberse a un funcionamiento excesivo de la glándula tiroides, en cuyo caso el nivel de TSH en sangre está muy bajo. En casos menos frecuentes, el hipertiroidismo se debe a un exceso de producción de TSH por la glándula hipófisis. BOCIO Es el padecimiento más común de la glándula tiroides y consiste en el aumento del tamaño de la glándula tiroides por la deficiencia de T3 y T4, ya que la glándula se agranda para poder aumentar su capacidad para extraer y procesar el yodo. Este problema es más frecuente en mujeres que en hombres y tiene una mayor incidencia a mayor edad, sin embargo en algunos casos puede presentarse durante la infancia o adolescencia, cuando se da el periodo de crecimiento acelerado y cambios metabólicos, el aumento de tamaño del cuello en estos casos, es proporcional al del resto de su cuerpo, por lo que se le conoce como “bocio de la adolescencia”. 4. GLÁNDULAS PARATIROIDES Son Glándulas endocrinas situadas en el cuello, generalmente localizadas en los polos de la glándula tiroides, que producen la hormona paratiroidea o paratohormona (PTH) Hay cuatro glándulas paratiroides, dos superiores y dos inferiores, pero de forma ocasional puede haber cinco o más. La hormona paratiroidea es la hormona reguladora más importante de los niveles de calcio y fósforo en el cuerpo y es controlada por el nivel de calcio en la sangre Cuando los Niveles de calcio en la sangre son bajos provocan un aumento en la liberación de esta hormona, y cuando los niveles de calcio son altos inhiben su liberación. ALTERACIONES • El déficit de esta hormona produce hipocalcemia, que conduce a la tetania (contracciones dolorosas de los músculos de las extremidades) • El Aumento de la secreción provoca hipercalcemia 5. GLÁNDULAS SUPRARRENALES Las glándulas suprarrenales, o glándulas adrenales son las estructuras con forma de triángulo que están situadas encima de los riñones. Su función es la de regular las respuestas al estrés, a través de la síntesis de corticosteroides (principalmente cortisol) y catecolaminas (sobre todo adrenalina). ANATOMÍA Anatómicamente las glándulas suprarrenales están situadas en el retroperitoneo, en la cara anterosuperior de los riñones y están irrigadas por las arterias suprarrenales superior, media e inferior. Están formadas por dos estructuras diferentes que son la médula suprarrenal y la corteza suprarrenal, ambas inervadas por el sistema nervioso autónomo. Como su nombre sugiere, la médula suprarrenal está situada dentro de la glándula, rodeada por la corteza suprarrenal que forma la superficie. A. MÉDULA SUPRARRENAL: SECRECIÓN HORMONAL La glándula suprarrenal posee dos glándulas, una interna (médula) y otra externa (corteza). La médula suprarrenal produce catecolaminas, más o menos el 90% es adrenalina y el 10% noradrenalina; éstas son las hormonas que colaboran en la estimulación del Sistema Nervioso Parasimpático. Tienen una estructura amina y se almacenan en gránulos. Producen los efectos citados en el Sistema Nervioso Parasimpático (aumenta la vigilia). En ocasiones, las células de la médula suprarrenal sufren un crecimiento tumoral benigno, denominado feocromocitoma, en el cual se produce un aumento de la producción de catecolaminas a la sangre y como consecuencia el aumento de la tensión arterial. Estudiando los metabolitos presentes en la orina, se observará un aumento del ácido vanilmandélico, procedente de la degradación de catecolaminas. B. CORTEZA SUPRARRENAL: SECRECIÓN HORMONAL La hormona de la corteza suprarrenal es esteroidea, por lo tanto no tendremos que fijar en las características de dichas hormonas. Existen varias capas: Capa externa: capa glomerulosa, productora de mineral-corticoides (aldosterona) Capa media: capa fasciculada, la cual produce glucocoticoides (cortisol) Capa interna o capa reticular: produce andrógenos (hormonas masculinas), llamado dihidroepiandroterona y androstendinosa, posee un efecto menos potente que la testosterona. Los andrógenos tienen poco efecto reproductor, efecto en cuanto al aumento del metabolismo proteico y del crecimiento, responsables del bello axilar y púbico en la mujer. Si apareciera una tumoración en esta capa, se producirían cantidades elevados de estos andrógenos, en la mujer provocaría efectos virilizantes, a esta patología se la conoce como síndrome adrenogenital La ACTH es imprescindible para mantener la corteza suprarrenal, si ésta desapareciera se atrofiaría la corteza. Glucocorticoides El 95% de la actividad glucocorticoide se debe al cortisol denominado también hidrocortisona, y en menor proporción a hormonas como la cortisona y corticosterona. Una vez que el cortisol es liberado hacia la circulación se combina con una alfaglobulina denominada transcortina o globulina fijadora de cortisol (GFC), o en un grado menor con la albúmina. Alrededor del 94% de la hormona se transporta en forma fija y el 6% libre. El 1% de la secreción es excretada en forma no alterada por la orina. En un tiempo aproximado de una a dos horas, se produce la fijación del cortisol en los tejidos blanco en donde promueve: aumento de la gluconeogénesis hepática a expensas de la movilización de aminoácidos desde otros tejidos disminución del ingreso de glucosa al interior celular. disminución de la utilización de glucosa por la célula aumento de la glucemia con la posibilidad de provocar diabetes suprarrenal que es moderadamente sensible a la presencia de insulina. disminución de las reservas proteicas en tejidos extrahepáticos debido al aumento en el catabolismo de las proteínas aumento de aminoácidos en sangre disminución de la formación de ARN aumento del transporte de aminoácidos hacia el hígado y disminución del transporte a tejidos extra hepáticos. aumento de la formación de proteínas a nivel hepático aumento de la movilización de ácidos grasos desde el tejido adiposo, ya que el cortisol es activador de la LPL-hs (lipoprotein lipasa hormono sensible) presente en la membrana de los adipositos aumento de la concentración de ácidos grasos en el plasma actúa como antiinflamatorio actúa como antialérgico aumenta la producción de eritrocitos El ritmo de secreción de factor liberador de ACTH por el hipotálamo, ACTH por la hipófisis anterior y cortisol de las corteza suprarrenal, se encuentran incrementados durante la mañana (fig. 2), por lo que presentan regularmente un ritmo cíclico de secreción durante las 24 horas. Si una persona cambia su ritmo diario de sueño, ésta modificación también se ve acompañada por un cambio en el ciclo de secreción de los glucocorticoides. Mineralocorticoides El 95% de la actividad mineralcorticoide se encuentra bajo la acción de una hormona denominada aldosterona. El cortisol posee también actividad mineralocorticoide, la cual es de menor magnitud que la de la aldosterona. El nombre de mineralocorticoide deviene de la acción de éstas hormonas reflejadas sobre los electrolitos como el sodio, potasio, cloruro. Existen diferentes factores que actúan como reguladores de la secreción de aldosterona: aumento de concentración del ion potasio en el líquido extracelular. disminución de la concentración de sodio. alteraciones en la volemia. alteraciones en la presión arterial. sistema renina angiotensina. presencia de la hormona ACTH. Frente a estos estímulos que generan incrementos en la secreción de aldosterona, ésta promueve los siguientes efectos: aumento del transporte de sodio y potasio a nivel de los túbulos renales. aumento de la reabsorción de sodio a nivel de los túbulos renales acompañado por la reabsorción de agua debido al efecto osmótico del sodio sobre ésta. aumento de la concentración de sodio extracelular. aumento de la excreción de potasio por orina. aumento del volumen del líquido extracelular debido al efecto osmótico ejercido por el sodio sobre el agua en los túbulos renales. aumento en la secreción de hidrógeno hacia los túbulos renales generando alcalosis leve. aumento en la reabsorción de sodio a nivel de las glándulas sudoríparas y salivales para conservar los niveles de sodio. aumento en la absorción de sodio a nivel intestinal evitando la pérdida por las heces. ANDRÓGENOS SUPRARRENALES El término andrógenos hace referencia a cualquier hormona que sea de origen esteroide y que promueva efectos masculinizantes. La corteza suprarrenal secreta al menos 5 tipos de andrógenos diferentes. El más importante de estos andrógenos es la dehidroepiandrosterona (DHEA). Durante la infancia los andrógenos promueven el desarrollo inicial de los órganos sexuales tanto en hombre como en mujer (durante toda la vida) pero durante la pubertad éstos solo tienen efectos insignificantes en relación a la actividad de los andrógenos secretados por el testículo. Aparentemente los andrógenos suprarrenales ayudarían al crecimiento del vello axilar como pubiano. HORMONAS DE MÉDULA SUPRARRENAL La adrenalina (epinefrina) y noradrenalina (norepinefrina) son hormonas producidas en las células cromafines de la médula suprarrenal derivadas de lo aminoácidos tirosina y fenilalanina. Ambas hormonas suelen denominarse catecolaminas, sólo se distingue una de la otra por la presencia de un grupo metílico en adrenalina y que esta actúa sobre el metabolismo entre unas 5 a 10 veces más intensamente que la noradrenalina. Adrenalina y noradrenalina no sólo actúan como hormonas sino también como neurotransmisores del sistema nervioso simpático. Ya que la secreción simpática del sistema nervioso y la médula de las glándulas suprarrenales están unidas funcionalmente, se definen bajo el concepto de "sistema simpático adrenal". La mayoría de las células cromafines de la médula suprarrenal sintetizan adrenalina, sólo en el 10% del total de las células la vía termina formando noradrenalina. Una vez secretadas, las catecolaminas se unen a receptores de membranas alfa y beta. Los receptores alfa se dividen en alfa 1: que se ubican en la musculatura lisa arterial y alfa 2 en los vasos sanguíneos, terminales nerviosas y plaquetas. La unión de las hormonas a receptores alfa produce: vasoconstricción aumento de la presión arterial contracción de esfínteres en estómago y vejiga. Los receptores beta se dividen en beta 1 ubicados preferentemente en corazón y beta 2 ubicados en el músculo liso de bronquios, arterias y útero. La unión de las hormonas a receptores beta produce: aumento de la frecuencia y contractilidad cardíaca aumento de la velocidad de propagación del estímulo por el corazón relajación de la musculatura lisa en los vasos sanguíneos, bronquiolos y tracto gastrointestinal y genitourinario. La respuesta de los receptores beta es más intensa frente la a la presencia de adrenalina, mientras que la respuesta de los receptores alfa es más intensa frente a la noradrenalina. 6. HORMONAS REPRODUCTORAS MASCULINAS TESTOSTERONA La testosterona es una hormona androgénica producida por los testículos. En realidad es una prohormona, ya que para realizar su acción fisiológica o farmacológica debe reducirse en posición 5-alfa-dihidrotestosterona, que es la hormona activa. Es una hormona propia del género masculino, que permite desarrollar los músculos del hombre con mayor facilidad que la mujer. Las mujeres producen una cantidad mucho menor, que cumple también importantes funciones en la regulación de aspectos como su humor, apetito sexual y sensación de bienestar. ESTRUCTURA QUÍMICA La testosterona es un andrógeno, esteroide derivado del ciclopentanoperhidrofenantreno, que tiene 19 átomos de carbono, un doble enlace entre C4 y C5, un átomo de oxígeno en C3 y un radical hidroxilo (OH) en C12. Su fórmula es C19H28O2. Esta estructura es necesaria para el mantenimiento de la actividad androgénica. La testosterona puede ser aromatizada en varios tejidos para formar estradiol, de tal manera que en el hombre es normal una producción diaria de 50 microgramos. El papel del estradiol en el hombre aún no está aclarado, pero su exceso absoluto o relativo puede provocar feminización. La testosterona del testículo es producida por las células de Leydig, pero también es sintetizada en otros tejidos a partir de los andrógenos circulantes (DHEA,DHEA-S), provenientes de la corteza suprarrenal (zona reticular). La testosterona tiene diferentes funciones a lo largo de la vida: - Para el feto (antes del nacimiento): la testosterona es responsable del desarrollo de las glándulas sexuales masculinas (los testes) y los genitales externos masculinos. - Durante la pubertad: es la hormona responsable de los caracteres sexuales secundarios masculinos como: el tono de la voz, el crecimiento de la barba, desarrollo del vello corporal y púbico y la producción y maduración de espermatozoides entre otras funciones. En el hombre adulto: la testosterona controla todas las funciones sexuales como la libido, la potencia y la fertilidad y conserva la apariencia típica masculina que se desarrolla en la pubertad. La salud masculina general y el desempeño sexual se mantienen con niveles óptimos de testosterona. La poca testosterona que circula libre en el organismo se conoce como testosterona biodisponible. Pero con la edad, todos los hombres, en unos más que en otros, se produce una disminución en los niveles de testosterona biodisponible. Esta disminución impacta la calidad de vida y puede ser un factor de riesgo a largo plazo vinculado con determinados problemas de salud y sexualidad por los bajos niveles de testosterona. La testosterona es importante porque: Es una hormona que tiene un efecto único en el cuerpo masculino. Es producida en los testículos y las glándulas adrenales. Es para los hombres lo que el estrógeno es para las mujeres. Es esencial para el comportamiento sexual normal y para la producción de erecciones. Interviene en muchas funciones metabólicas como la producción de células sanguíneas en la médula ósea, la formación de huesos, el metabolismo lípido, el metabolismo de carbohidratos, la función del hígado y el crecimiento de la glándula prostática. SÍNTESIS Y SECRESIÓN IMAGEN: Eje hipotálamo-hipofisario-testicular. Las células de Leydig del testículo son el lugar de síntesis principal de la testosterona a partir del colesterol. También se puede sintetizar en la zona rugosa de la corteza suprarrenal, en las células tecalis del ovario y en la placenta. La gonadotropina hipofisaria LH, hormona luteinizante, es la hormona reguladora específica de la producción de la testosterona. La acción de la LH, está mediada por la activación de la adenilciclasa y proteínas específicas reguladoras de nucleótidos de guanina (proteínas G), para la producción intracelular de AMPc. Además la acción de la LH, también puede precipitar la activación de fosfolipasa C e incremento de la producción de los segundos mensajeros, diacilglicerol (DAG) e inositol trifosfato (IP3) a partir de fosfoinositoles de la membrana. Otras hormonas que influyen en grados variables la síntesis de la testosterona, son la prolactina, el cortisol, la insulina, factor de crecimiento insulínico (insulin-like growth factor), estradiol, e inhibina. El AMPc activa la captación de acetato procedente de la glucosa o del metabolismo lipídico y la síntesis del colesterol en el retículo endoplásmico liso. El colesterol es transformado por enzimas mitocondriales en pregnenolona, que es el precursor de la testosterona, vía 17-alfa-pregnenolona, dihidroepiandrosterona, androstendiona y finalmente testosterona. Las células testiculares de Sértoli, tienen como función principal el control de la espermatogénesis y su función biológica es regulada por la gonadotropina FSH u hormona folículo estimulante. Las células de Sértoli también producen una proteína transportadora de andrógenos, ABP, (androgen binding protein), que sirve para fijar la testosterona en el testículo y es la proteína específica en el transporte de testosterona por la circulación sanguínea. Las células de Sértoli también producen testosterona en cantidades limitadas. Estas células están localizadas en los túbulos seminíferos y la testosterona producida parece tener una acción local de especial importancia en la espermatogénesis. La testosterona producida por las células de Leydig, es la que pasa a la circulación sanguínea. La concentración plasmática de testosterona en el adulto normal es de 300 a 1000 nanogramos/dl. Antes de la pubertad la concentración es menor a 20 ng/dl. El contenido de testosterona en el testículo humano es de aproximadamente 300 ng/g de tejido. En el hombre adulto el testículo produce entre 2,5 y 11 mg/día de testosterona. En la mujer los ovarios producen aproximadamente 0.25 mg/día de testosterona. La LH y la FSH tienen también efectos tróficos al estimular el crecimiento testicular, en el que también interviene la hormona del crecimiento. La testosterona a través de un mecanismo de retroalimentación negativa inhibe la secreción de gonadotropinas aunque este mecanismo no ha sido completamente aclarado. De todos modos es evidente que disminuye la liberación del factor de liberación gonadotrópico. Las células de Sertoli secretan una serie de proteínas, algunas de las cuales entran en la luz del túbulo seminífero y son importantes para la espermatogénesis, mientras que otras son segregadas hacia la capa basal de las células y entran en la circulación sistémica. Así las células de Sértoli segregan la mencionada ABP, transferrina y un agente de tipo hormonal llamado inhibina. La administración parenteral de testosterona y de andrógenos anabólicos, sobre todo si estos últimos son usados indiscriminadamente o durante períodos prolongados de tiempo, producen la supresión por retroalimentación negativa de la secreción de LH. También en dosis altas suprimen la secreción de FSH, lo que conduce a medio o largo plazo a la atrofia o hipotrofia del tejido intersticial y la anulación o marcada disminución de la producción endocrina de testosterona. NIVELES ALTERADOS DE TESTOSTERONA EN LA SANGRE Los niveles más altos de testosterona se encuentran después de la adolescencia, entre 800 y 1200 nanogramos por decilitro (ng/dl) de sangre. Estos niveles se mantienen durante aproximadamente diez o veinte años, después de los cuales comienzan a disminuir alrededor del 1 por ciento por año. Los niveles aumentados de testosterona en sangre pueden ocurrir en: 1. 2. 3. 4. 5. 6. Pubertad precoz. Resistencia a los andrógenos. Cáncer de ovario. Hiperplasia suprarrenal congénita. Enfermedad ovárica poliquística. Cáncer testicular. Los niveles disminuidos de testosterona pueden ocurrir en: 1. 2. 3. 4. 5. Hipopituitarismo. Insuficiencia testicular. Retraso en la pubertad. Enfermedad crónica. Prolactinoma. 7. HORMONAS REPRODUCTORAS FEMENINAS Las hormonas sexuales femeninas que produce el ovario son los estrógenos y la progesterona. La función principal de las hormonas sexuales femeninas consiste en la preparación del aparato reproductor para recibir la esperma masculina y mantener las condiciones adecuadas para la implantación del óvulo fecundado. Estas hormonas se segregan de manera cíclica cada 28 días durante la edad fértil de la mujer, dando lugar a lo que llamamos “ciclo menstrual”. Luego, alrededor de los 50 años, la función ovárica se reduce poco a poco hasta detenerse por completo, cesa la producción hormonal y es entonces cuando la mujer entra a la etapa de su vida conocida como “menopausia”. El deseo sexual femenino también se asocia a la segregación de hormonas durante el ciclo menstrual. Los días previos y durante a la ovulación la libido suele ser muy alta, por los picos de estrógeno que produce la mujer mientras que durante los días previos a la menstruación, es decir, durante el SPM, el deseo sexual suele ser muy bajo debido también por las molestias propias del SPM. También verás a las hormonas femeninas trabajando cuando: Las chicas experimentan cambios al entrar a la pubertad. Se estimula el crecimiento de la vagina, los ovarios y trompas de Falopio. Se desarrollan las mamas. Hay un cambio en la apariencia física al entrar a la adolescencia por la nueva distribución de la grasa corporal. Crecimiento rápido de estatura en la pubertad. Cuando menstruas. Al lubricar durante el sexo Los estrógenos se forman en el ovario, la placenta, los testículos y también en ciertas plantas. Los estrógenos son las hormonas responsables de las características sexuales femeninas tales como desarrollo de las mamas y el ciclo menstrual. Para las mujeres jóvenes, la pubertad empieza cuando la producción del estrógeno aumenta en los óvulos. El nivel del estrógeno sigue siendo relativamente igual durante 25 años, después de lo cual disminuirá constantemente. El cuerpo intenta luchar este problema produciendo dos otras hormonas por la hipófisis: la hormona que estimula del óvulo (FSH) y la Hormona de Luteinizante (LH). Sin embargo, los niveles disminuidos del estrógeno y la producción creciente de FSH y de la LH crean síntomas tales como calores o sudores de la noche. Hay tres formas principales de estrógeno encontradas en el cuerpo humano: el estrone, el estradiol y el estriol. El Estradiol es el tipo más comúnmente posible medido de estrógeno para las mujeres no embarazadas. La cantidad de estradiol en la sangre varía a través de su ciclo menstrual. Después de la menopausia, la producción del estradiol cae a un nivel muy bajo pero constante. En los hombres, la FSH y la LH son necesarios para la formación del esperma y el estímulo de la síntesis de la testosterona. Entonces no sorprende que los hombres demuestren a veces los mismos síntomas que las mujeres. Influyen en el metabolismo de las grasas y el colesterol de la sangre. Gracias a la acción de los estrógenos los niveles de colesterol se mantienen bajos e inducen la producción del "colesterol bueno". Ayuda a la distribución de la grasa corporal, formando la silueta femenina con más acumulación de la grasa en caderas y senos. Contrarrestan la acción de otras hormonas como la paratifoidea (PTH), que promueven la reabsorción ósea, haciendo que el hueso se haga frágil y poroso. Actúa sobre el metabolismo del hueso, impidiendo la perdida de calcio del hueso y manteniendo la consistencia del esqueleto. El descenso de estrógenos afecta al comportamiento emocional de la mujer provocando cambios de humor, irritabilidad, depresión. Estimula la libido, lo que facilita a la mujer tener una vida sexual satisfactoria. Tienen un papel importante en la formación del colágeno, uno de los principales componentes del tejido conectivo. Estimulan la pigmentación de la piel sobre todo en zonas como pezones, areolas y genitales. METABOLISMO DEL ESTRÓGENO En el hígado, el estradiol circulante se convierte con rapidez en estrona mediante la 17-hidroxiesteroide deshidrogenasa. Un poco de la estrona reingresa a la circulación; sin embargo, la mayor parte de ella se metaboliza en 16-hidroxiestrona (que entonces se convierte en estriol) o 2 o 4-hidroxiestrona (estrógeno catecol). Los estrógenos catecol con actividad biológica se convierten en los compuestos 2metoxi y 4-metoxi mediante la catecol-0-metiltransferasa. Mucha de la estrona remanente se conjuga para formar sulfato de estrona. El estriol se convierte principalmente en estriol 3-sulfato-16-glucurónido antes de su excreción por el riñón. El hígado también conjuga los estrógenos para formar glucurónidos y sulfatos; aproximadamente la quinta parte de estos productos conjugados es eliminada con la bilis, y cantidades menores pasan a la orina. El hígado también combina los estrógenos en forma lábil para formar la denominada estroproteína; es principalmente en esta forma como circulan los estrógenos en los líquidos extracelulares. Así pues, el hígado desempeña papel clave en el metabolismo de los estrógenos; como es, la transformación de estrógenos como el potente estradiol y estrona en un estrógeno casi totalmente inactivo, el estriol, y en consecuencia secreta cantidades moderadas hacia el intestino, la disminución de las funciones hepáticas en realidad aumentan actividad de los estrógenos en el cuerpo, ocasionando a veces hiperestrinismo. PROGESTERONA La progesterona es una hormona esteroide implicada en el sexo femenino en el ciclo menstrual, el embarazo (apoya la gestación) y la embriogénesis de los seres humanos y otras especies. La progesterona pertenece a una clase de hormonas llamadas prostágenos, y su principal origen natural es humano. La progesterona no debe confundirse con progestágenos, que son producidos sintéticamente. La progesterona se produce en las glándulas suprarrenales, las gónadas(específicamente después de la ovulación en el cuerpo lúteo), el cerebro y, durante el embarazo, en la placenta. En los seres humanos, el aumento de las cantidades de progesterona se produce durante el embarazo: Inicialmente, la fuente es el cuerpo lúteo que ha sido "rescatado" por la presencia de gonadotropina coriónica humana(hCG) desde la concepción. Sin embargo, después de la 8ª semana la producción de progesterona cambia sobre la placenta. La placenta materna utiliza el colesterol como el sustrato inicial, y la mayor parte de la progesterona producida entra en la circulación materna, pero parte de esta es captada por la circulación fetal y se utiliza como sustrato para los corticoides fetales. Al término del embarazo la placenta produce alrededor de 250 mg de progesterona por día. Una fuente adicional de la progesterona son los productos lácteos. Contienen mucho porque en las explotaciones lecheras las vacas son ordeñadas durante el embarazo, cuando el contenido de progesterona de la leche es alta. Tras el consumo de productos lácteos el nivel de biodisponibilidad de progesterona aumentada. Esta observación ha dado lugar a la preocupación de que una dieta alta en productos lácteos de origen animales podría producir enfermedades. Sistema nervioso La progesterona, al igual que Pregnenolona y dehidroepiandrosterona, pertenece al grupo de neuroesteroides que se encuentran en concentraciones elevadas en algunas zonas en el cerebro y se sintetizan en ese lugar. Los Neuroesteroides afectan el funcionamiento sináptica, son neuroprotectores, y afectan la mielinización. Ellos son investigados por su potencial para mejorar la memoria y capacidad cognitiva. La progesterona como neuroprotector afecta la regulación de la apoptosis de los genes. Su efecto como Neuroesteroide trabaja predominantemente a través de la GSK-3 beta vía, como un inhibidor(otras GSK-3 beta inhibidores incluyen bipolar estabilizadores del humor, litio y ácido valproico.) 8. PRUEBAS DE FERTILIDAD Infertilidad es la incapacidad de un hombre de fecundar con éxito el óvulo de una mujer. Puede ser causa de una serie de factores que incluyen una baja motilidad de los espermatozoides, forma anormal de espermatozoides, varicocele y oligospermia (recuento bajo de espermatozoides) ELEMENTOS DE FERTILIDAD Producción en calidad y cantidad adecuada de espermatozoides ESPERMATOBIOSCOPIA DIRECTA Consiste en la toma de una muestra de semen, obtenida en el laboratorio por medio de masturbación. Se estudian diferentes factores del líquido seminal y su contenido: Características Generales Valores de Referencia Cantidad Mayor a 2.0 ml Ph /grado de acidez y 7.2 a 7.8 alcalinidad Aglutinación Menor a 10% Viscosidad Normal Licuefacción Normal Espermatozoides por ml. Mayor a 20 mill./ml Movilidad Valores de Referencia Móviles Mayor a 50% Grado 0-4 (donde 4= Muy buena, 3 Buena, 2 Moderada, 1 a 0 Mala) Morfología Valores de Referencia Normales Mayor de 50% Macrocéfalos Menor a 0.5% Microcéfalos Menor a 1.5% Cabezas dobles Menor a 1.5% Cabezas ausentes Menor a 5% Amorfos Menor a 40% PERFIL HORMONAL MASCULINO El estudio hormonal en el varón, está orientado a establecer la causa de una disfunción eréctil o una baja calidad seminal. Dentro de los Servicios de CeFeGen, está la determinación de estas hormonas: LH FSH TESTOSTERONA DIHIDROTESTOSTERONA PROLACTINA ESPERMATOBIOSCOPIA INDIRECTA. La pareja deberá: 1. Abstenerse de tener relaciones sexuales tres días antes del estudio. 2. El estudio parte de un coito genital que la pareja realiza en su domicilio en la época ovulatoria del ciclo, preferentemente los días 13, 14 o 15 (contar a partir del 1er. día de la menstruación) 3. La paciente debe permanecer acostada (reposo pos- coital) y mantener la pelvis un poco levantada por medio de dos almohadas o cojines superpuestos que su pareja le coloca debajo de la pelvis al terminar el coito. 4. En este momento se anota la hora, a partir de la cual se empiezan a contar 15 minutos de reposo de la paciente, durante los cuales se pide a la pareja que esté pendiente de si presenta escurrimiento seminal-vulvar. 5. En caso afirmativo, deberá colocar debajo de la vulva el frasco (que se suministra previamente en el laboratorio) para que en él recoja el escurrimiento, a fin de evitar de esta manera que se pierda volumen. 6. Transcurridos los 15 minutos, la paciente se baja de la cama poniéndose en cuclillas sobre el frasco, deja que siga escurriendo o empiece a escurrir el semen presente en la vagina. 7. La paciente deberá presentarse en el laboratorio en un plazo no mayor de dos horas después de la relación sexual, trayendo consigo el recipiente con la recolección del líquido. 8. Es importante señalar que la paciente no puede tomar un baño, ni hacerse ningún aseo vulvar después del coito. 9. Tampoco deberá ponerse después del coito una toalla sanitaria, algodón, o algún otro material absorbente, únicamente se pondrá su ropa íntima. 10. Es importante observar estrictamente la fecha, el horario, y las indicaciones para un buen resultado ESPERMATOBIOSCOPÍA CERVICAL) INDIRECTA (M. Transporte a trompas de Falopio Técnicas para valorar permeabilidad tubárica. Insuflación tubárica con CO2 Histerosalpingografia Endoscopia PERFIL HORMONAL FEMENINO Crecimiento y desarrollo de folículo normal Hormonas LH, FSH, Progesterona ,Prolactina Ovulación Temperatura basal Biopsia endometrial hormonas LH, FSH, Progesterona Prolactina Transporte adecuado o nulo Fertilización Fracción β-HGC Transporte del huevo al útero Concentraciones adecuadas de hormonas para asegurar nidación y desarrollo del embrión CUÁNDO REALIZAR PRUEBAS DE FERTILIDAD Por lo menos un año de relaciones sexuales sin anticonceptivos, parejas jóvenes La mujer > 35 años hasta 6 meses de relaciones sexuales sin éxito Con dx. de endometriosis, quistes de ovario El varón con insuficiencia seminal