UNIDAD IV. COMPUESTOS ORGÁNICOS QUE
Anuncio

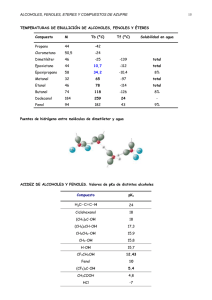
Química Orgánica UNIDAD IV. COMPUESTOS ORGÁNICOS QUE CONTIENEN OXÍGENO Objetivo de la unidad: El alumno determinará las propiedades de los hidrocarburos que contienen oxígeno, a partir de sus fórmulas estructurales y técnicas de laboratorio, para su utilización en los procesos. En una época, la fuente principal de metanol era como subproducto en la producción de carbón vegetal a partir de la madera; de ahí el nombre de alcohol de madera. Ahora, la mayor parte de los más de 10 mil millones de libras de metanol usadas anualmente en Estados Unidos es sintética, preparada por reducción de monóxido de carbono con hidrógeno. El monóxido de carbono se obtiene por lo general del metano. Tema 1. Alcoholes 4.1. Objetivo de aprendizaje: SABER: Identificar los alcoholes primarios, secundarios y terciarios. Explicar las principales propiedades físicas y químicas de los alcoholes. Explicar las reglas de nomenclatura de la para alcoholes. Describir la estructura de los Isómeros de los alcoholes. Enlistar las aplicaciones de los principales alcoholes en la industria. SABER HACER: Formular los alcoholes Demostrar las propiedades físicas y químicas de los alcoholes en laboratorio. Introducción. Este y otros de los temas siguientes tratan de la química de algunos grupos funcionales que contienen oxígeno. La interacción de estas clases de compuestos importantes: Alcoholes, éteres, aldehídos, cetonas, ácidos carboxílicos y derivados de los ácidos carboxílicos, es fundamental para la química orgánica y la bioquímica. Los alcoholes son grupos de compuestos que tienen el radical –OH. Elaboró: Ing. Marcel Ruiz Martínez El metanol se usa principalmente en la preparación de formaldehído y éter ter-butil metílico (conocido comercialmente como MTBE). El formaldehído es una materia prima para varias resinas y plásticos, incluyendo el primer plástico sintético por completo, baquelita. El MTBE es un aditivo para gasolina efectivo, pero las fugas de los tanques de depósito subterráneos que contaminan los mantos acuíferos lo hacen inapropiado para su uso continuo. Cantidades menores de metanol se usan como disolvente y combustible líquido de encendido limpio. Esta última propiedad lo hace un combustible adecuado para automóviles; el metanol ya se usa como combustible de automóviles de carreras clase Indianápolis. El metanol es un líquido incoloro, que hierve a 65°C y se mezcla con agua en todas proporciones. Es tóxico; beber apenas 30 ml ha sido fatal. Cantidades menores pueden producir ceguera. Cuando la materia vegetal se fermenta, sus carbohidratos se convierten en etanoly dióxido de carbono por las enzimas presentes en la levadura. La fermentación de la cebada produce cerveza; la de las uvas, vino. El contenido máximo de etanol es del orden de 15%, debido a que concentraciones mayores inactivan las enzimas, deteniendo la fermentación. Como el etanol hierve a 78°C y el agua a 100°C, la destilación del caldo de fermentación produce “licores de destilación” con mayor contenido de etanol. El whisky es el destilado añejado de granos fermentados y contiene poco menos que 50% de etanol. El brandy y coñac se hacen añejando los licores destilados de uvas Basado en: Carey, Francis. Química Orgánica, 6a Edición. McGraw-Hill Interamericana 1 Química Orgánica fermentadas y otras frutas. Los sabores, olores y colores característicos de las diversas bebidas alcohólicas dependen tanto de su origen como de la forma en que son añejadas. El etanol sintético se deriva del petróleo por hidratación de etileno. En Estados Unidos se producen al año, aproximadamente, 700 millones de libras de etanol sintético. Es relativamente barato y útil para aplicaciones industriales. Para evitar su uso como bebida alcohólica, y los impuestos elevados que la mayoría de los gobiernos imponen sobre el etanol usado en bebidas, se desnaturaliza agregándole cualquier cantidad de materiales nocivos. Nuestro cuerpo está razonablemente bien preparado para metabolizar etanol, lo que lo hace menos peligroso que el metanol. El abuso del alcohol y el alcoholismo, sin embargo, han sido y son problemas persistentes. A continuación se muestran algunos alcoholes presentes en la naturaleza: Elaboró: Ing. Marcel Ruiz Martínez Basado en: Carey, Francis. Química Orgánica, 6a Edición. McGraw-Hill Interamericana 2 Química Orgánica Tal como vimos los alcoholes se caracterizan por tener un grupo OH(hidroxilo) en su estructura. Por lo cual su forma general es R-OH. A continuación se muestra un ejemplo: Existen tres grupos de alcoholes: Alcoholes primarios: El grupo OH se encuentra unido a un carbono primario: 2.- Numerar la cadena principal de forma tal que se obtenga la numeración más corta que soporte al grupo hidroxilo. Alcoholes secundarios: El grupo OH se encuentra unido a un carbono secundario. Alcoholes terciarios: El grupo OH se encuentra unido a un carbono terciario. Si al numerar la cadena principal se obtiene el mismo valor numérico que contiene al grupo OH entonces se toma en cuenta la numeración más pequeña posible para los radicales alquilo. Reglas IUPAC para MONOFUNCIONALES. la nomenclatura de alcoholes 1.- Identifica la cadena de carbonos más larga de átomos de carbono que contenga al grupo hidroxilo (-OH) el nombre de dicha cadena será el nombre base del compuesto que se deba agregar con la terminación “-ano” del alcano correspondiente al número total de átomos de carbono de la cadena principal; además de una “l” al final de forma tal que se tenga la terminación “-ol”. Siempre que haya dos o más posibilidades de cadenas de igual longitud, debe elegirse la opción que proporcione los radicales más sencillos. Elaboró: Ing. Marcel Ruiz Martínez Basado en: Carey, Francis. Química Orgánica, 6a Edición. McGraw-Hill Interamericana 3 Química Orgánica 3.- Cadena principal. Por ultimo escribe la cadena principal considera el nombre del alcano correspondiente pero con la terminación “-ol” al final antepon dicho nombre con el número de carbono donde se encuentre el –OH. Actividad en clase: Determine el nombre de los siguientes compuestos: Actividad en clase: Nombra el siguiente compuesto. Actividad 4.1. Nomenclatura de los alcoholes. Para los siguientes compuestos indica cuál es su nombre según las reglas de la nomenclatura de la IUPAC. Las rubricas de PRÁCTICA DE EJERCICIOS se puede consultar en la siguiente liga: http://marcelrzm.comxa.com/Rubricas/Rubricas.htm Enviar el trabajo a los siguientes correos: [email protected]; [email protected]; [email protected]; [email protected] También enviar copia del correo a sus compañeros de equipo y a usted mismo. Colocar en ASUNTO: “4.1 Nomenclatura de los alcoholes” Elaboró: Ing. Marcel Ruiz Martínez Basado en: Carey, Francis. Química Orgánica, 6a Edición. McGraw-Hill Interamericana 4 Química Orgánica Fuerzas de atracción intermoleculares Las fuerzas de atracción de van der Waals entre moléculas neutras son de tres tipos. 1. Fuerzas dipolo inducido-dipolo dispersión; fuerzas de London) inducido (fuerzas de 2. Fuerzas dipolo-dipolo inducido 3. Fuerzas dipolo-dipolo Las fuerzas dipolo inducido-dipolo inducido son las únicas fuerzas de atracción intermoleculares disponibles entre moléculas no polares como los alcanos, y son importantes también en las moléculas polares. Las fuerzas de atracción dipolo-dipolo son fáciles de visualizar y se ilustran en la figura siguiente: Dos moléculas de una sustancia polar experimentan una atracción mutua entre la región polarizada en forma positiva de una molécula y la región polarizada en forma negativa de la otra. Elaboró: Ing. Marcel Ruiz Martínez Basado en: Carey, Francis. Química Orgánica, 6a Edición. McGraw-Hill Interamericana 5 Química Orgánica PROPIEDADES FÍSICAS DE LOS ALCOHOLES Y DE LOS HALOGENUROS DE ALQUILO: FUERZAS INTERMOLECULARES Punto de ebullición. Al igual que los hidrocarburos alifáticos (alcanos, alquenos y alquinos) el punto de ebullición aumenta con el peso molecular Consideremos los siguientes ejemplos de compuestos orgánicos: Solubilidad en agua. Los halogenuros de alquilo (R-X; donde R es una cadena de carbonos e hidrógenos y X es cualquier halógeno: Yodo, Cloro, Fluor, Bromo) así como otros compuestos orgánicos no son solubles en agua; pero los alcoholes como de peso molecular bajo (metílico, etílico, n-propílico e isopropílico) son solubles en agua en todas proporciones. Su capacidad para participar en puentes de hidrógeno intermoleculares no sólo afecta a los puntos de ebullición de los alcoholes, sino también aumenta su solubilidad en agua. Nótese que aun cuando la cantidad de carbonos es muy parecida en los tres compuestos, el punto de ebullición es muy diferente. Esto se debe a un tipo de atracción especialmente fuerte llamada puente de hidrógeno (atracción dipolo – dipolo); lo anterior se muestra en la siguiente figura: Elaboró: Ing. Marcel Ruiz Martínez Al aumentar el peso molecular de los alcoholes, poco a poco la proporción de la molécula de dichos compuestos es más no polar y se vuelven más parecidos a los hidrocarburos y menos al agua, por lo tanto dejan de ser solubles en la misma. Los alcoholes de carbonos de C1 al C4 son solubles en agua en todas sus proporciones pero a partir de 4 carbonos dicha solubilidad es menor; el pentanol y hexanol son ligeramente solubles en agua y el heptanol y octanol (asi como el resto de alcoholes con mayor cantidad de carbonos) son prácticamente insolubles en agua. Basado en: Carey, Francis. Química Orgánica, 6a Edición. McGraw-Hill Interamericana 6 Química Orgánica Estado de agregación y densidad. En cuanto al estado de agregación de los alcoholes no existen gases; del C1 al C12 son líquidos y del C13 en adelante son sólidos. La densidad de los alcoholes (alrededor de 0.8g/mL) es menor que el agua. Por ejemplo, la densidad del etanol es de 0.810 g/mL, la del npropanol es de 0.8016 g/mL, n-butanol 0.810 g/mL, etcétera. Bien, después de ver y estudiar esta información espero disfrutes la siguiente actividad. Actividad 4.2. Usos y efectos de los alcoholes. Con su equipo de trabajo elabore un RESUMEN que contenga lo siguiente sobre los alcoholes: 1.- Usos industriales y comerciales. 2.- Efectos del metanol y etanol en el cuerpo humano. 3.- Estructura en tres dimensiones del etanol (foto, puede ser descargada de internet o de una maqueta que realice con su equipo de trabajo). Las rubricas del RESUMEN se puede consultar en la siguiente liga: http://marcelrzm.comxa.com/Rubricas/Rubricas.htm Enviar el trabajo a los siguientes correos: [email protected]; [email protected]; [email protected]; [email protected] También enviar copia del correo a sus compañeros de equipo y a usted mismo. Colocar en ASUNTO: “Actividad 4.2. Usos y efectos de los alcoholes” Elaboró: Ing. Marcel Ruiz Martínez Basado en: Carey, Francis. Química Orgánica, 6a Edición. McGraw-Hill Interamericana 7