quimica organica ii - Benemérita Universidad Autónoma de Puebla
Anuncio

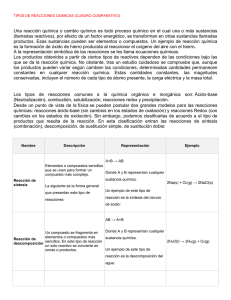
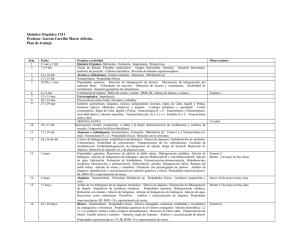
BENEMÉRITA UNIVERSIDAD AUTÓNOMA DE PUEBLA FACULTAD DE CIENCIAS QUÍMICAS LICENCIATURA: FARMACIA ÁREA ESPECÍFICA DE: QUÍMICA ORGÁNICA NOMBRE DE LA ASIGNATURA: QUÍMICA ORGÁNICA II CÓDIGO: CCQ 200 FECHA DE ELABORACIÓN: MARZO 2001 NIVEL EN EL MAPA CURRICULAR: BÁSICO TIPO DE ASIGNATURA: BÁSICA PROFESORES QUE PARTICIPARON EN SU ELABORACIÓN: Blanca Martha Cabrera Vivas Gerardo Durán Espinosa Carmen Ma. González Álvarez Lucio Gutiérrez García René Gutiérrez Pérez Guadalupe Hernández Téllez Macario Martínez Barragán Ruth Meléndrez Luévano Socorro Meza Reyes Aarón Pérez Benítez Leticia Quintero Cortés Jesús Sandoval Ramírez José Luis Vega Báez HORAS DE TEORIA: 4 HORAS PRÁCTICA: 3 TOTAL DE CRÉDITOS: 11 PRE-REQUISITOS: Química Orgánica I RECOMENDACIONES: Conocimientos previos de Química General I y II, Física y Fisicoquímica. 1 PRESENTACION GENERAL DEL PROGRAMA La Química Orgánica es un a ciencia con un gran desarrollo, los historiadores consideran sus inicios a mediados del siglo XIX y actualmente en la literatura se encuentran descritos más de 15’000,000 de compuestos, y esta cantidad crece 600,000 por año, para entender esta vasta cantidad de información, el estudio de la Química Orgánica se organiza en tres aspectos fundamentales: a). Estructura b). Reacciones c). Aplicaciones El estudio de la estructura, se estudia en forma detallada en el primer curso de Química Orgánica. Las reacciones son la parte dinámica de la química orgánica. Para su comprensión se requiere, aparte de conocer la estructura de las moléculas reaccionantes, considerar los parámetros termodinámicos, que nos van a indicar si una reacción se puede llevar a cabo, y la cinética, que nos indica a que velocidad se puede efectuar una reacción bajo determinadas condiciones. El segundo curso de química orgánica se encuentra en el nivel básico del currículo de la licenciatura en química, es este se estudia las propiedades físicas y la parte dinámica de los compuestos orgánicos que contienen en su estructura enlaces sencillos CarbonOxígeno (alcoholes, éteres y epóxidos), Carbono-Azufre (tioalcoholes, tioéteres y tioepóxidos), enlaces múltiples Carbono-Carbono (alquenos, dienos, polienos, alquinos), así como los compuestos aromáticos. El estudio de las transformaciones químicas es uno de los temas centrales del presente curso y se organiza para su comprensión en Funciones Orgánicas, y las reacciones características de éstos, se clasifican en diferentes Tipos, los que a su vez proceden por un determinado Mecanismo. OBJETIVOS GENERALES DEL CURSO ¾ Tomando como punto de partida la estructura de las moléculas orgánicas, el alumno entenderá los principios en que se organiza tanto la parte estática como la parte dinámica de la química orgánica, de tal forma que se capacite para entender tanto a nivel teórico como experimental: las propiedades físicas y transformaciones químicas de los grupos funcionales que se analizan en el presente curso. ¾ En el curso se desarrollarán las siguientes actitudes habilidades y conocimientos: constancia, puntualidad, análisis, síntesis, reflexión. 2 CONTENIDO Y ESQUEMA DEL CURSO UNIDAD I. ALCOHOLES, ÉTERES Y EPÓXIDOS TEMAS: I.1 Introducción, estructura, clasificación, nomenclatura y propiedades físicas I.2 Susceptibilidad al cambio y reactividad de alcoholes I.2.1 Propiedades ácido-base I.2.2 Reacción de Sustitución y Eliminación a) Reacciones de alcoholes con halogenuros de hidrógeno, Reactivo de Lucas, PX3, POX3, SOCl2. Mecanismos SN1 y SN2. b) Síntesis de Willianson. Mecanismo SN2 c) Reacción de Deshidratación. i). Formación de alquenos. Mecanismos E1 y E2 ii). Formación de éteres. Mecanismos SN1 y SN2 iii). Transposición pinacólica I.2.3 Formación de ésteres. Reacción de alcoholes con; RCO2H, RCOCl, H2SO4, pCH3C6H5SO2Cl; CH3SO2Cl, H3PO4, PCl3, POCl3, I.2.4 Reacciones de Oxidación. a) Reglas para determinar el estado de oxidación de un compuesto orgánico. b) Oxidación con Cu. c) Reacción con derivados de Cr (VI); Na2Cr2O7/H2SO4, H2O, CrO3.2Py, Reactivo de Jones, d) Reacción con derivados de Mn (VII); KMnO4/KOH, H2O; MnO2. e) Reacción de glicoles con HIO4, (CH3CO2)4Pb. I.3 Susceptibilidad al cambio y reactividad de Éteres y Epóxidos 1.3.1 Ruptura de éteres con HBr y HI. Mecanismos SN1, SN2. 1.3.2 Auto oxidación de éteres 1.3.3 Reacciones de apertura de epóxidos en medio ácido o medio básico. Mecanismos SN1, SN2. OBJETIVOS DE LA UNIDAD: • • • Entender la importancia que tienen las fuerzas intermoleculares y en especial los puentes de hidrógeno en las propiedades físicas de alcoholes, éteres y epóxidos. El empleo de éstos compuestos como disolventes de compuestos polares y no polares. La forma en que los puentes de hidrógeno permiten que compuestos con actividad biológica puedan atravesar membranas celulares que les permiten tener una distribución amplia en un organismo vivo. Entender, comprender y aplicar los tipos de reacción: Ácido-Base, Sustitución Nucleofílica, Eliminación y Oxidación; así como los mecanismos: SN1, SN2, E1, E2 y Oxidación. Aplicar las reglas de nomenclatura tanto común como sistemática de alcoholes, éteres y epóxidos. 3 UNIDAD II. TIOLES, TIOETERES Y TIOEPÓXIDOS . TEMAS: II.1 Introducción, estructura, nomenclatura y propiedades físicas II.2 Susceptibilidad al cambio II.3 Propiedades ácido-base II.4 Métodos de obtención II.5 Reactividad II.5.1 Reacciones de oxidación a). Formación de disulfuros b). Formación de ácidos sulfónicos y sulfotas OBJETIVOS DE LA UNIDAD: • Entender las diferencias y semejanzas de los compuestos orgánicos que presentan enlaces carbono–oxígeno y carbono-azufre, desde un punto de vista: estructural, de sus propiedades físicas, comportamiento químico y campo de aplicación. • Entender, comprender y aplicar los tipos de reacción: Ácido-Base, Sustitución Nucleofílica,, y Oxidación, así como los mecanismos:, SN2 y Oxidación UNIDAD III. ENLACE DOBLE (C=C) TEMAS: III.1 Estructura, clasificación, isomería geométrica, nomenclatura y propiedades físicas de alquenos III.2 Susceptibilidad al cambio y reactividad de alquenos III.2.1 Reacciones de adición III.2.1.1 Hidrogenación a). Calores de hidrogenación y estabilidad de alquenos III.2.1.2 Reacciones tipo Markovnikov: adición de halogenuros de hidrógeno, adición de agua,(hidratación), adición de ácido sulfúrico, dimerización y alquilación, oximercuriación-desmercuriación III.2.1.3 Reacciones tipo Antimarkovnikov: hidroboración-oxidación III.2.1.4 Reacciones de adición anti: adición de bromo, halogenación mixta, formación de halohidrínas III.2.1.5 Adición de radicales libres: adición de bromuro de hidrógeno en presencia de peróxidos, adición de carbenos, polimerización y adición de tetracloruro de carbono y bromotriclorometano . III.2.1.6 Reacciones de oxidación a) Formación de epóxidos. b) Formación de glicoles cis a partir de alquenos . III.2.2 Reacciones de ruptura oxidativa a) Ozonólisis. 4 b) Reacción con KMnO4/KOH III.2.3 Sustitución alílica: halogenación . III.3 Estructura y clasificación de dienos III.4 Susceptibilidad al cambio y reactividad de dienos conjugados III.4.1 Reacciones de adición 1,2 y adición 1,4 III.4.2 Reacción de Diels-Alder OBJETIVOS DE LA UNIDAD: • • • Conocer la estructura del doble enlace carbono-carbono, para entender las propiedades físicas, la isomería geométrica y la reactividad del grupo funcional alqueno. Entender, comprender y aplicar los tipos de reacción generales: adición, sustitución y ruptura; así como los mecanismos: hidrogenación, adición vía carbocationes, adición vía radicales libres, adición concertada, .oxidación con: RCOOOH, KmnO4, OsO4, y O3, sustitución vía radicales libres. Aplicar las reglas de nomenclatura tanto común como sistemática de alquenos, alcadienos, polienos. UNIDAD IV. ENLACE TRIPLE (C≡C) TEMAS: IV.1 Estructura, clasificación, nomenclatura y propiedades físicas de alquinos. IV.2 Susceptibilidad al cambio y reactividad. IV.2.1 Propiedades ácido-base. a) Formación de acetiluros y derivados b) Acetiluros y derivados como nucleófilos IV.2.2 Reacciones de adición. a) Halogenación b) Hidrogenación: Total, parcial (syn y anti) IV.2.3 Reacción de hidratación IV.2.4 Reacciones de oxidación OBJETIVOS DE LA UNIDAD: • • • Conocer la estructura del triple enlace carbono-carbono, para entender las propiedades físicas y la reactividad del grupo funcional alquino Entender, comprender y aplicar los tipos de reacción generales: ácido-base, adición, sustitución y ruptura; así como los mecanismos: reducción, hidratación y SN2. Aplicar las reglas de nomenclatura tanto común como sistemática de alquinos. 5 UNIDAD V: BENCENO Y COMPUESTOS AROMÁTICOS TEMAS: V.1 Introducción, estructura, nomenclatura y propiedades físicas. V.2 Aromaticidad V.2.1 Calores de hidrogenación y energía de resonancia. V.2.2 Criterios de aromaticidad V.3 Susceptibilidad al cambio reactividad. V.3.1 Reacciones de Sustitución electrofílica aromática. a) Monosustitución: nitración, sulfonación, halogenación, alquilación y acilación. b) Segunda sustitución: Grupos activadores, desactivadores, orientadores orto- para y orientadores meta V.3.2 Reacciones de sustitución nucleofilíca aromática V.3.3 Reacciones en la cadena lateral: halogenación y oxidación. V.4 Compuestos aromáticos heterocíclicos V.4.1 Estructura y nomenclatura V.5 Fenoles V.5.1 Susceptibilidad al cambio y reactividad V.5.1.1 Propiedades ácido-base V.5.1.2 Reacción de Kolbe V.5.1.3 Reacción de Riemer-Tieman OBJETIVOS DE LA UNIDAD: • • • Conocer la estructura, distribución electrónica, energía de resonancia del benceno. Entender y aplicar los criterios de aromaticidad Analizar y comprender las propiedades físicas en base a la estructura y las fuerzas intermoleculares de los compuestos aromáticos. Entender, comprender y aplicar los tipos de reacción generales: sustitución electrofílica, sustitución nucleofílica; así como los mecanismos correspondientes Aplicar las reglas de nomenclatura tanto común como sistemática de los compuestos aromáticos. METODOLOGÍA: Conferencias Lecturas adicionales y dirigidas Seminarios Resolución de ejercicios individuales y grupales Dinámica de grupo 6 INSTRUMENTACIÓN DIDÁCTICA A UTILIZAR: Pizarrón Acetatos Diapositivas Modelos moleculares CRITERIOS DE EVALUACIÓN: Para evaluar el aprendizaje del curso se tendrá en cuenta: Asistencia Participación en clase Resolución de problemas en clase Asistencia a seminarios Exámenes parciales Examen ordinario y extraordinario Para acreditar el curso se requiere: Asistencia a clases del 80% Cursar y aprobar el laboratorio el cual tendrá un valor del 20% de la calificación final de la materia BIBLIOGRAFÍA BÁSICA: 1. R. J. Ouellette, INTRODUCCIÓN A LA QUÍMICA ORGÁNICA; México : Harper and Row, tr. Eva Estrada Meza 2. Fessenden y J. S. Fessenden; QUÍMICA ORGÁNICA; Ed. Grupo Ed. Iberoamericana. 3. Streitwieser Jr., C. H. Heathcock; QUÍMICA ORGÁNICA; Ed. Mc. Graw Hill. 4. N. L. Allinger y M. P. Cava; QUÍMICA ORGÁNICA; Ed. Reverté 5. T. W. G. Solomons; QUÍMICA ORGÁNICA; Ed. Limusa. 6. McMurry; QUÍMICA ORGÁNÍCA; Ed. Grupo Editorial Iberoamericano. 7. R. T. Morrison y R. N. Boyd; Química Orgánica; Ed. Fondo Educativo Interamericano. 8. S. Wingrove y R. L. Caret; QUÍMICA ORGÁNICA; Editorial Harla. 9. L. Ternay Jr.; CONTEMPORARY ORGANIC CHEMISTRY; Ed. W. B. Saunders Company. 10. M. A. Fox & J. K. Whitesell; QUÍMICA ORGÁNICA; Ed. Addison Wesley. BIBLIOGRAFIA COMPLEMENTARIA: 1. F. A. Carey; QUIMICA ORGANICA; Ed. Mc. Graw Hill. 2. P. Sykes; MECANISMOS DE REACCION EN QUÍMICA ORGÁNICA; Ed. Martínez Roca. 3. W. R. Peterson; FORMULACION Y NOMENCLATURA EN QUÍMICA ORGÁNICA; Eunibar (Editorial Universitaria de Barcelona). 7