propuesta didacta - orientacioneneducacionsuperior
Anuncio
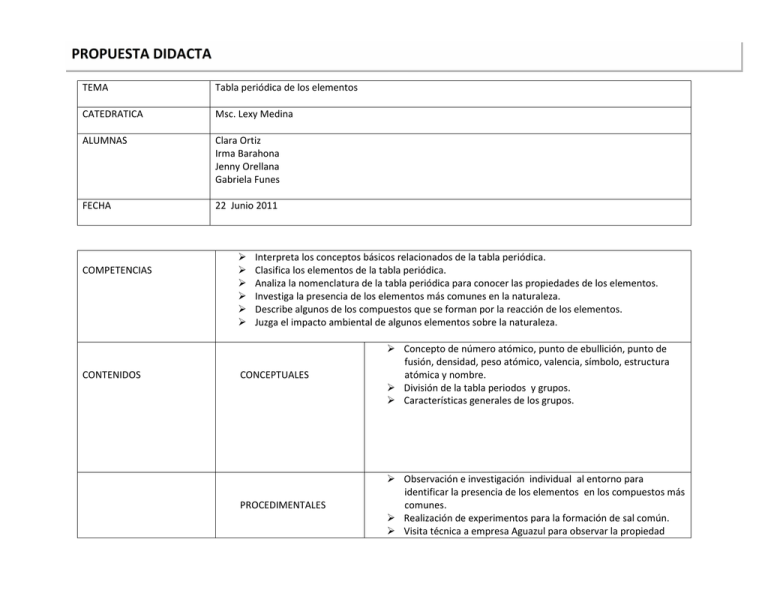
PROPUESTA DIDACTA PROPUESTA DIDACTICA TEMA Tabla periódica de los elementos CATEDRATICA Msc. Lexy Medina ALUMNAS Clara Ortiz Irma Barahona Jenny Orellana Gabriela Funes FECHA 22 Junio 2011 COMPETENCIAS CONTENIDOS Interpreta los conceptos básicos relacionados de la tabla periódica. Clasifica los elementos de la tabla periódica. Analiza la nomenclatura de la tabla periódica para conocer las propiedades de los elementos. Investiga la presencia de los elementos más comunes en la naturaleza. Describe algunos de los compuestos que se forman por la reacción de los elementos. Juzga el impacto ambiental de algunos elementos sobre la naturaleza. CONCEPTUALES Concepto de número atómico, punto de ebullición, punto de fusión, densidad, peso atómico, valencia, símbolo, estructura atómica y nombre. División de la tabla periodos y grupos. Características generales de los grupos. PROCEDIMENTALES Observación e investigación individual al entorno para identificar la presencia de los elementos en los compuestos más comunes. Realización de experimentos para la formación de sal común. Visita técnica a empresa Aguazul para observar la propiedad ACTITUDINALES TEMAS TRANSVERSALES TRATAMIENTO DIDÁCTICO bactericida del Ozono. Elaboración de un mapa mental de la tabla periódica. Observación de video sobre la contaminación de la industria minera. (youtube, 2009) Reflexión sobre la contaminación ambiental. Uso de equipo de seguridad personal al momento de manipular reactivos químicos. Responsabilidad ética y moral al realizar experimentos para crear nuevos compuestos. Historia sobre el descubrimiento de los elementos. Análisis y control de calidad Responsabilidad social empresarial. Impacto económico de la industria en el país. Clases magistrales (Mapa mental, Participación interactiva de los alumnos) Elabora un diagrama de los sentidos con los datos obtenidos de la observación del entorno. Utilizando el diagrama de persuasión describe lo observado en la visita técnica a Aguazul. Observa video sobre industria minera y su impacto ambiental y elabora un ensayo del mismo. Formando equipos de trabajo efectúa práctica experimental en el laboratorio para formar sal común (NaCl). Evaluación inicial o diagnostica, lo que se, lo que quiero saber, lo que aprendí. EVALUACIÓN INDICADOR DE LOGRO PUNTOS Diagrama de persuación Diagrama de los sentidos Ensayo del video Practica de laboratorio Mapa mental TOTAL 5% 5% 5% 10% 5% 30% Whitten, K. W., & Davis, R. E. (1998). QUIMICA GENERAL. Espana : McGraw Hill. BIBLIOGRAFIA Willians Daub & Seese Willians. (2005). QUIMICA. Mexico: Pearson Education . wspGuancora. (17 de Diciembre de 2009). youtube. Recuperado el 25 de Junio de 2011, de http://www.youtube.com/watch?v=H8FV1kxe_7M Deming, H. G. (1948). Practicas de laboratorio. Mexico: Hispano Americana. TRATAMIENTO TEORICO SOLUCION DE EJERCICIOS Clasificación periódica de los elementos 1.0 1.1 1.2 1.3 Introducción Conceptos Distribución de la tabla periódica en periodos y grupos Características generales de los grupos Diagrama de persuasión Diagrama de los sentidos Mapa mental Procedimiento experimental Ensayo (MarcadorDePosición1) TRATAMIENTO TEORICO CLASIFICACION PERIODICA DE LOS ELEMENTOS. 1. Introducción “En el año 1869 Mendeleev anuncio por primera vez su descubrimiento de la ley periódica de los elementos, esta ley permite acomodar los elementos en orden de sus números atómicos crecientes y los que tienen propiedades químicas similares se encuentran en intervalos definidos”. (Whitten & Davis, QUIMICA GENERAL, 1998) Para comprender mejor la tabla periódica y sus elementos es necesario conocer algunos conceptos relacionados a esta: 1.1 Conceptos relacionados con la tabla periódica (Willians Daub & Seese Willians, 2005): Figura 1.1.1 (Whitten & Davis, QUIMICA GENERAL, 1998) Tabla periódica (Willians Daub & Seese Willians, 2005) “Tabla especial que comprende todos los elementos conocidos de acuerdo a sus números atómicos y los ordena de manera que los elementos de una columna determinada tengan propiedades químicas similares”. (sección 3.7) Elemento (Whitten & Davis, QUIMICA GENERAL, 1998) “Es una sustancia pura que no puede descomponerse en sustancias más simples utilizando los métodos químicos ordinarios. Todos sus átomos tienen su mismo número atómico”.( sección 3.2 y 4.4) Átomo (Willians Daub & Seese Willians, 2005)”Es la partícula mas pequeña de un elemento, que puede existir y presentar todavía las propiedades de ese elemento incluyendo la capacidad de relacionarse con otros átomos.”(sección 3.20) Número atómico (Willians Daub & Seese Willians, 2005) “Es la cantidad de protones que se encuentran en el núcleo del átomo de un elemento”. (sección 4.4) Peso atómico (Whitten & Davis, QUIMICA GENERAL, 1998) “Es la masa molar del elemento se define como la masa de un mol de átomos de un elemento puro en gramos es numéricamente igual al peso atómico de ese elemento en una sus unidades son gramos/mol”. (sección 2.5) Valencia (Whitten & Davis, QUIMICA GENERAL, 1998) “Es la capa electrónica más externa de un átomo, estos electrones son los implicados en el enlace para la formación de moléculas”.(sección 8.1) Estructura electrónica (Whitten & Davis, QUIMICA GENERAL, 1998) “Es la manera en que los electrones están ordenados en un átomo, esto es en niveles de energía llamados orbitales atómicos, en la tabla periódica los elementos están distribuidos de acuerdo al número de orbitales atómicos que están siendo ocupados.” (sección 5.18) Punto de ebullición (Willians Daub & Seese Willians, 2005) “Temperatura a la cual la presión de vapor de un líquido es igual a la presión externa que actúa sobre la superficie del líquido”. (sección 12.4) Punto de fusión (Willians Daub & Seese Willians, 2005) “Es la temperatura a la cual la energía cinética de algunas partículas en un sólido coincide con las fuerzas de atracción presentes en el sólido de manera que este comienza a licuarse”. (sección 12.9) Densidad (Willians Daub & Seese Willians, 2005) “Masa de una sustancia que ocupa una unidad de volumen; se expresa como masa dividida entre volumen (m/V)”. (sección 2.1) Compuesto (Willians Daub & Seese Willians, 2005) “Es una sustancia pura formada paro la combinación de dos o más elementos diferentes por medio de diversas reacciones químicas”. (seccion3.2) Sustancia Pura (Willians Daub & Seese Willians, 2005)” Es una sustancia caracterizada por su composición definida y constante y por tener propiedades definidas y constantes bajo una serie de condiciones determinadas”. (sección 3.2) Símbolo de un elemento (Whitten & Davis, QUIMICA GENERAL, 1998) “Es una letra o grupo de letras que representan o identifica un elemento”. 1.2 Distribución de la tabla periódica en periodos y grupos Según William Daub & Seese Willians, 2005, si observamos una tabla periódica completa como la que se muestra en la figura 1.2.2, podremos observar que esta ordenada en 7 renglones llamados periodos y 18 columnas verticales llamadas grupos (familias). Esta tabla periódica fue propuesta por primera vez en 1985 por Julius Thomsen. En esta figura se muestra la clasificación periódica de los elementos en forma abreviada con base a sus números atómicos. Figura 1.2.2 El número del periodo determina el número del último nivel de energía principal que los electrones comienzan a llenar. Como se muestra en la figura 1.2.3, mientras que los elementos que se encuentran en un determinado grupo son semejantes por que tienen propiedades químicas similares. Figura 1.2.3 Como los grupos tienen propiedades químicas semejantes, también tienen nombres especiales. Los elementos del IA (con excepción del hidrogeno) se les llama metales alcalinos. El hidrogeno aunque se presente en el grupo IA no está considerado entre los metales alcalinos por que no todas sus propiedades se parecen a las de estos; litio, sodio, potasio, rubidio, cesio y francio. El grupo IIA se llaman metales alcalinotérreos: berilio, magnesio, calcio, estroncio, barjo y radio. Los del grupo VIA se llaman Calcogenos: oxigeno, azufre, selenio, telurio y polonio. Los elementos del grupo VIIA se conocen como halógenos: fluor, cloro, bromo, yodo y astatino. Los del grupo VIIIA se conocen como gases nobles: helio, neón, argón, kripton, xenón, radón, Oberón. Cuando hacemos referencia a un grupo (columna vertical), utilizamos el número romano y a continuación el número de columna. En un determinado periodo, los elementos varían gradualmente de izquierda a derecha, comenzando por la izquierda con aquellos que tienen propiedades mas metálicas como es el caso del sodio ( Na), hasta los que tienen propiedades no metálicas por ejemplo el cloro (Cl). Al término de cada periodo se encuentran los elementos del VIIIA llamados los gases nobles. Considerando a detalle cada uno de los 7 periodos (renglones horizontales) tenemos: Periodo I: contiene solo dos elementos: el hidrogeno (H) y el Helio (He). En este periodo se llena el primer nivel de energía principal (subnivel IS de electrones). Periodo 2: contiene ocho elementos que van desde el litio (Li) hasta el neón (Ne), hasta un segundo nivel de energía completamente lleno hasta el neón. Periodo 3: también contiene ocho elementos, desde el sodio (Na) hasta el argón (Ar). Con el 3er nivel de energía principal lleno, el argón último elemento del periodo, tiene ocho electrones en su tercer nivel de energía principal. Al los periodos 2 y 3 se les llaman periodos cortos ya que solo tienen ocho elementos cada uno. Periodo 4: contiene 18 elementos, desde el potasio (K) hasta el kripton (Kr) en este periodo se llenan los subniveles 4s, 4p y 3d. El nivel 3d se llena a partir del escandio (Sc), hasta el (Zn). Periodo 5: contiene 18 elementos desde el rubidio (Rb) hasta el Xenón (Xe). En este periodo se llenan los subniveles 5s, 5p y 4d. el 4d se comienza a llenar desde el itrio (Y) y cadmio (Cd) Periodo 6: contiene 32 elementos, desde el cesio (Cs) hasta el radón (Rn). En este periodo se llenan los subniveles 6f, 6p, 5d y 4f. A los elementos del 58 al 71 del cerio (Ce) al lutecio (Lu) se les llama serie de los lantánidos y anteriormente se les denomino tierras raras. Estos elementos corresponden al llenado del subnivel 4f y están colocados al pie de la tabla por conveniencia porque si los colocamos en la tabla, esta sería demasiado ancha y difícil de manejar. 1.3 Características Generales de los Grupos. Uno de los principios fundamentales en química es el uso de la tabla periódica para correlacionar las características generales de los elementos. A continuación veremos cuáles son las cinco características generales de los grupos. 1.3.1 La tabla periódica separa los metales de los no metales por medio de una línea escalonada de color. A la derecha de esta línea se encuentran los no metales y a la izquierda los metales: en el extremo izquierdo se encuentran los elementos más metálicos. Como podrá observar en la figura 1.3.1 a la mayoría de los elementos se les considera metales. Los elementos que están adyacentes a la línea escalonada de color se llaman metaloides (semimetales), con excepción del aluminio (Al), que no es un metaloide sino un metal ya que la mayoría de sus propiedades son metálicas. Como ejemplos tenemos los siguientes: Boro, Silicio, Germanio, Arsénico, Antimonio, Telurio, Polonio y astatino. Figura 1.3.1 1.3.2 En los elementos del grupo A (elementos representativos), la cantidad de electrones de valencia está dada por el numero del grupo o por el digito de las unidades en el numero de cada columna. Por ejemplo el sodio (Na) esta en el grupo IA por lo tanto tiene un electrón de valencia (1s 2,2s2,2p6,3s1).El aluminio que está en el grupo IIIA tiene 3 electrones de valencia (1s2,2s2,2p6,3s2,3p1) y así sucesivamente, el Helio (He) que también está en el grupo VIIIA es la excepción a la regla, ya que tiene solo 2 electrones de valencia (1s 2). Esta característica general no la tienen los elementos de transición los elementos del grupo B y los elementos del grupo VIII. 1.3.3 Los elementos que pertenecen al mismo grupo tienen propiedades químicas y configuraciones electrónicas similares. Por ejemplo, todos los metales alcalinos (grupo IA) reaccionan rápidamente con el cloruro metálico. Todos los miembros de los metales alcalinos tienen la misma configuración electrónica en el nivel de energía de valencia (s1), con la diferencia en la cantidad de electrones del centro. 1.3.4 En los elementos del grupo A las propiedades metálicas aumentan conforme se incrementan los números atómicos y al mismo tiempo las propiedades no metálicas disminuye. En el grupo VA el primer elemento del grupo es el nitrógeno, que se considera un no metal; el segundo es el fosforo, también un no metal, el tercero es el arsénico, un metaloide y el último elemento del grupo es el bismuto, un metal. Como la mayoría de los elementos mas metálicos se encuentran en el extremo inferior izquierdo de la tabla, y las propiedades metálicas van en aumento al incrementarse el numero atómico en determinado grupo A, el elemento estable (no radiactivo) mas metálico lo encontraremos en la esquina inferior izquierda y es el cesio (Cs). 1.3.5 Existe un cambio gradual en muchas de las propiedades físicas y químicas dentro de los elementos de un mismo grupo, según va aumentando su número atómico. En el grupo VIIA –los Halógenos – los puntos de fusión y de ebullición, las densidades, y los radios atómicos de los elementos aumentan a medida que se incrementa el número atómico. SOLUCION DE EJERCICIOS 1.0 SOLUCION DE EJERCICIOS Practicas EXPERIMENTAL PARA FORMACION DE COMPUESTO CLORURO DE SODIO (NaCl) (Deming, 1948) Instrumentos • • • • • • Capsula de porcelana (1) Beaker 250 ML (2) Papel tornasol Horno eléctrico Agitador Probeta 150 ML Materiales • • Hidróxido de sodio diluido NaOH Acido clorhídrico diluido HCL Procedimientos 1. 2. 3. 4. 5. 6. 7. En la capsula de porcelana colocamos un trozo de papel tornasol. Agregamos 150 ML de NaOH diluido medido con la probeta. Agregamos a la capsula que contiene el papel tornasol. Medir 150 ML de HCL diluido usando probeta. Agregamos el HCL lentamente bajo agitación al NaOH contenido en la capsula hasta que el papel se torne entre rojo y azul. Evaporar la solución obtenida utilizando el horno a 110 grados centígrados el residuo será Sal común. Pesar la cantidad de sal obtenida utilizando una balanza analítica. Reacción involucrada HCL + NaOH =NaCL +H2O TABLA DE CINCO SENTIDOS 2.0 Observación e investigación individual al entorno. Compuesto Común Identificación de la presencia de los elementos en los compuestos más comunes. AGUA (H2O): Compuesto formado por dos átomos de hidrogeno y uno de oxígeno.Cubre el 71% de la superficie de la corteza terrestre Incolora. Ruido al salir del grifo, o al fluir. Líquido. Humedad. Insípida. Inodora. SAL (NaCl): cloruro Cristales blancos. No genera sonidos. Granulada. Salobre. Inodora. AIRE:mezcla de gases Transparente. Sonido etéreo. Suave, sutil. Fresco. Insípido. Inodoro. sódico (o cloruro de sodio). Compuesto formado por 1 átomo de sodio y 1 de cloro. Es la única roca mineralcomestible por el hombre. que constituye la atmósfera terrestre; nitrógeno (78%), oxígeno (21%), vapor de agua (variable entre 07%), ozono, dióxido de carbono, hidrógeno y algunos gases nobles como el criptón o el argón, es decir, 1% de otras sustancias. TABLA DE PERSUACION 3.0 purificación del agua a través de la propiedad bactericida del ozono (O3) 4.0 ENSAYO Instrucciones 1. Redacte un ensayo reflexivo sobre el video observado de la minería en el Valle de Siria. 2. No menor a una página ni mayor de tres. 3. Enumere cuales son los daños causados al ser humano y al medio ambiente. 4. Qué medidas aplicaría usted para reducir el impacto. 5.0 MAPA MENTAL







