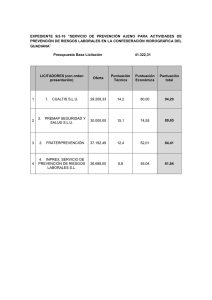
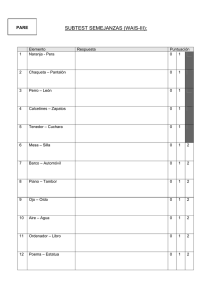
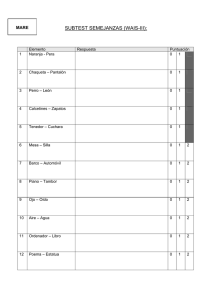
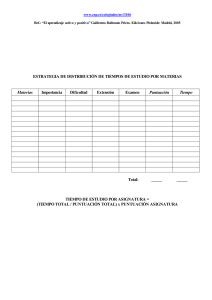
coppadis-2015 - Fundación Curemos el Parkinson
Anuncio

COPPADIS-2015 COhort of Patients with PArkinson´s DIsease in Spain, 2015 PROMOTOR/INVESTIGADOR PRINCIPAL: Dr. Diego Santos García, MD, PhD Facultativo Especialista de Área Sección de Neurología, Hospital Arquitecto Marcide Complejo Hospitalario Universitario de Ferrol (CHUF), Ferrol, A Coruña 646-173341; [email protected]; [email protected] CÓDIGO PROMOTOR: COH-PAK-2014-01 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 ÍNDICE LISTADO DE ABREVIATURAS ............................................................................................................... 4 RESUMEN ................................................................................................................................................... 5 INFORMACIÓN GENERAL .................................................................................................................... 13 INTRODUCCIÓN...................................................................................................................................... 14 JUSTIFICACIÓN DEL ESTUDIO ............................................................................................................ 15 OBJETIVOS DEL ESTUDIO .................................................................................................................... 19 TIPO DE ESTUDIO Y DISEÑO ............................................................................................................... 21 MATERIAL Y MÉTODOS ...................................................................................................................... 23 1. 2. 3. Selección y reclutamiento de los sujetos participantes .................................................................. 23 1.1 Pacientes con enfermedad de Parkinson ............................................................................... 23 1.2 Cuidadores (cuidador principal del paciente) ....................................................................... 24 1.3 Controles............................................................................................................................... 24 Evaluación basal de los sujetos participantes ................................................................................ 24 2.1 Pacientes con enfermedad de Parkinson ............................................................................... 25 2.2 Cuidadores (cuidador principal del paciente) ....................................................................... 32 2.3 Controles............................................................................................................................... 32 Evaluación del seguimiento prospectivo de los sujetos participantes ........................................... 33 3.1 Pacientes con enfermedad de Parkinson ............................................................................... 33 3.2 Cuidadores (cuidador principal del paciente) ....................................................................... 34 3.3 Controles............................................................................................................................... 35 4. Recursos necesarios de los centros participantes........................................................................... 35 5. Recogida de datos.......................................................................................................................... 36 6. Final del estudio ............................................................................................................................ 37 7. Justificación del tamaño muestral ................................................................................................. 37 8. Análisis estadístico ........................................................................................................................ 38 CONSIDERACIONES ÉTICO-LEGALES DEL ESTUDIO .................................................................... 42 CONSIDERACIONES PRÁCTICAS DEL ESTUDIO ............................................................................. 47 1. Plan de trabajo ............................................................................................................................... 47 2 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 2. Procedimientos de comunicación de reacciones adversas ............................................................. 47 3. Registro de datos y conservación de documentos ......................................................................... 48 4. Informe final .................................................................................................................................. 48 5. Difusión de los resultados ............................................................................................................. 48 CALENDARIO DEL ESTUDIO ............................................................................................................... 49 REFERENCIAS BIBLIOGRÁFICAS ....................................................................................................... 50 PIE DE FIGURAS ...................................................................................................................................... 58 ANEXO I. CENTROS E INVESTIGADORES QUE HAN CONFIRMADO SU PARTICIPACIÓN. .... 59 ANEXO II. CÁLCULO DE LA DOSIS EQUIVALENTE DIARIA DE LEVODOPA. ........................... 61 ANEXO III. DEFINICIÓN DEL FENOTIPO PARKINSONIANO ATENDIENDO A LA UPDRS. ...... 62 ANEXO IV. PROTOCOLO DE LA PRUEBA DE RESOLUCIÓN DEL PUZZLE. ................................ 63 ANEXO V. PROTOCOLO DE LA DETERMINACIÓN DE MARCADORES MOLECULARES EN SANGRE. ................................................................................................................................................... 64 ANEXO VI. ESTUDIO GENÉTICO: OBJETIVOS Y TIPO DE ANÁLISIS. .......................................... 67 ANEXO VII. PROTOCOLO DE REALIZACIÓN DE LA RM CRANEAL. ........................................... 72 ANEXO VIII. ESTUDIOS DE VOLUMETRÍA CEREBRAL MEDIANTE RM CRANEAL. ................ 74 ANEXO IX. CRITERIOS DE DETERIORO COGNITIVO LIGERO ASOCIADO A LA ENFERMEDAD DE PARKINSON (PD-MCI). ........................................................................................ 75 ANEXO X. CRITERIOS DE DEMENCIA-PARKINSON (PD-D). ......................................................... 77 ANEXO XI. LISTADO DE PACIENTES “CONSECUTIVOS” EVALUADOS EN CADA CENTRO. . 78 ANEXO XII. CRD, Cuaderno de Recogida de Datos: variables estimadas que se van a recoger. ............. 79 ANEXO XIII. TABLA RESUMEN DEL PLAN DE TRABAJO ............................................................ 100 ANEXO XIV. DEFINICIÓN DEL HEMICUERPO PREDOMINANTE. .............................................. 101 ANEXO XV. CLASIFICACIÓN DEL ESTADO EMOCIONAL ATENDIENDO AL BDI. ................. 102 3 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 LISTADO DE ABREVIATURAS ADLS, Schwab & England Activities of Daily Living Scale AEMPS, Agencia Española del Medicamento y Productos Sanitarios BDI, Beck Depression Inventory CEIC, Comité Ético de Investigación Clínica CRD, Cuaderno de Recogida de Datos CSI, Caregiver Strain Index EP, enfermedad de Parkinson FEP, Federación Española de Parkinson FOGQ, Freezing of Gait Questionnaire HY, Hoenh and Yahr IMAO-B, inhibidor de la mono-amino-oxidasa tipo B NMSS, Non-Motor Symptoms Scale NPI, Neuropsychiatric Inventory PCR, proteina C reactiva PD-CRS, Parkinson´s Disease Cognitive Rating Scale PD-D, Demencia-Parkinson PD-MCI, deterioro cognitivo ligero asociado a la enfermedad de Parkinson PDQ-39SI, Parkinson´s disease Quality of Life Questionnaire Summary Index QUIP-RS, Questionnaire for Impulsive-Compulsive Disorders in Parkinson's Disease-Rating Scale PDSS, Parkinson´s Disease Sleep Scale RM, resonancia magnética UPDRS, Unified Parkinson´s Disease Rating Scale VAFS, Visual Analog Fatigue Scale VAS-Pain, Visual Analog Scale-Pain ZCBI, Zarit Caregiver Burden Inventory 4 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 RESUMEN 1. Título: COhort of Patients with PArkinson´s DIsease in Spain, 2015. 2. Código del promotor: COH-PAK-2014-01. 3. Promotor/investigador principal Promotor del estudio: Diego Santos García. Investigador principal y coordinador del estudio: Diego Santos García. Dirección: Sección de Neurología, Complejo Hospitalario Universitario de Ferrol (CHUF); Hospital Arquitecto Marcide, ctra. de San Pedro de Leixa, s/n; CP 15405; Ferrol (A Coruña), España. 4. Justificación del estudio La enfermedad de Parkinson es un trastorno frecuente (segunda enfermedad neurodegenerativa más frecuente después de la enfermedad de Alzheimer) y complejo (con afectación de múltiples áreas cerebrales y vías de conexión y desarrollo de múltiples síntomas además de los motores como deterioro cognitivo, trastorno de conducta, depresión, dolor, etc.) para el que no existe un tratamiento curativo en el momento actual. No se conoce bien la etiopatogenia de la enfermedad y es necesario identificar un marcador diagnóstico y de progresión que nos ayude a detectar de forma precoz la misma y utilizar de forma correcta las terapias sintomáticas de las que disponemos. Mejorar la calidad de vida de los pacientes y conocer aquellos factores que ocasionan una sobrecarga del cuidador son también aspectos muy importantes en el manejo de la enfermedad. El presente proyecto se fundamenta e integra de forma global cuatro conceptos muy importantes: (1) Concepto global de enfermedad (síntomas motores, no motores, cognitivos, etc.); 2) Calidad de vida del paciente y estado del cuidador; 3) Biomarcador (valor diagnóstico y pronóstico); 4) Progresión de la enfermedad. Necesitamos avanzar en el conocimiento en cada uno de estos puntos y el proyecto COPPADIS-2015 representa un estudio muy completo que contempla múltiples objetivos (ver objetivos, hasta 17 propuestos inicialmente y con la posibilidad de formular otras cuestiones bajo hipótesis plausibles) que pretende dar respuesta a algunas cuestiones no resueltas sobre el conocimiento de la enfermedad. El esfuerzo individual de cada centro participante (tiempo y personal) resultará productivo para conseguir el objetivo del proyecto. Disponer de una cohorte de pacientes como la estimada tendrá un valor muy importante en su seguimiento prospectivo. Las posibilidades de investigaciones futuras sobre dicha cohorte y las expectativas de producción científica justifican el proyecto y el compromiso individual de cada centro participante. En el momento actual no hay ningún grupo poblacional en estudio como el propuesto en nuestro país. 5. Diseño del estudio Estudio epidemiológico, descriptivo, observacional no intervencionista, longitudinalprospectivo, abierto con grupo control, multicéntrico, nacional (EPA-SP). 5 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 6. Objetivo (1) Definir de forma detallada y rigurosa una población de pacientes con enfermedad de Parkinson idiopática (variables clínicas, marcadores de imagen, genéticos y moleculares séricos) representativa de diferentes áreas de nuestro país a la que llamaremos COPPADIS-2015 (COhort of Patients´s with PArkinson´s DIsease in Spain, 2015), (2) compararla frente a un grupo control y (3) hacer un seguimiento de la misma durante un periodo de 5 años. Objetivos específicos: 1. Estudiar qué variables (síntomas no motores, cognición, síntomas neuropsiquiátricos, caídas, discapacidad, etc.) repercuten de forma negativa en la calidad de vida global y relacionada con el estado de salud de los pacientes con enfermedad de Parkinson. 2. Estudiar qué variables contribuyen a una peor calidad de vida, estado de ánimo y sobrecarga del cuidador principal del paciente con enfermedad de Parkinson así como si estas últimas repercuten en el estado de ánimo y calidad de vida del propio paciente. 3. Estudiar la prevalencia de trastorno de control de impulsos y sus tipos en la población analizada así como qué variables se asocian a los mismos y comparar frente a un grupo control. 4. Estudiar la prevalencia de diferentes síntomas no motores en la población analizada y comparar frente a un grupo control. 5. Estudiar la prevalencia del dolor (y sus tipos) en los pacientes con enfermedad de Parkinson, su relación con la enfermedad y diferentes variables y comparar frente a un grupo control. 6. Estudiar la prevalencia de diferentes tipos de trastorno del ánimo (depresión mayor, depresión menor, depresión subclínica) en los pacientes con enfermedad de Parkinson, su relación con otras variables de la enfermedad y comparar frente a un grupo control. 7. Estudiar los diferentes tipos de fenotipo parkinsoniano y su relación con otras variables (clínicas, moleculares y de neuroimagen). 8. Estudiar la relación entre diferentes variables (clínicas, moleculares y de neuroimagen) y el patrón de asimetría del parkinsonismo. 9. Estudiar la relación entre los niveles séricos de proteína S-100b, TNF-alfa, IL-1, IL-2, IL-6, vitamina B12, ácido metilmalónico, homocisteína, ácido úrico, proteína C reactiva (PCR), ferritina y hierro y otras variables de la enfermedad en pacientes con enfermedad de Parkinson y comparar frente a un grupo control. 10. Realizar estudios genéticos sobre ADN y ARN extraídos de los linfocitos de muestras de sangre periférica. 11. Estudiar el posible valor de un marcador de imagen propuesto recientemente (MTAi, Medial Temporal Atrophy Index) para detectar alteraciones cognitivas 6 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 12. 13. 14. 15. 16. 17. en pacientes con enfermedad de Parkinson y comparar frente a un grupo control. Realizar estudios de volumetría en busca de correlaciones, bajo hipótesis plausibles, entre los parámetros de la neuroimagen y las variables clínicas, neuropsiquiátricas y/o de otro tipo que se recogen en este estudio. Estudiar la incidencia de hospitalización aguda a lo largo de los 12 meses posteriores a la evaluación basal (para cada paciente), sus causas, y factores predictores de la misma en los pacientes con enfermedad de Parkinson y comparar frente a un grupo control. Estudiar qué porcentaje de pacientes con enfermedad de Parkinson desarrollan complicaciones motoras (en el subgrupo de aquellos que no las presenten en la evaluación basal) a lo largo de los 48 meses posteriores a la evaluación basal (para cada paciente) y analizar factores predictores de las mismas. Estudiar qué porcentaje de pacientes con enfermedad de Parkinson desarrollan demencia a lo largo de los 24, 48 y 60 meses posteriores a la evaluación basal (para cada paciente), comparar frente a un grupo control y analizar posibles marcadores predictores de la misma (clínicos, moleculares y/o genéticos, de imagen). Estudiar la morbimortalidad de los pacientes con enfermedad de Parkinson a lo largo de los 24 y 60 meses posteriores a la evaluación basal (para cada paciente), comparar frente a un grupo control y analizar posibles marcadores predictores de la misma (clínicos, moleculares y/o genéticos, de imagen). Comparar al final del seguimiento la evolución de las diferentes variables clínicas y paraclínicas (marcadores moleculares y de neuroimagen). 7. Enfermedad o trastorno en estudio: enfermedad de Parkinson. 8. Población del estudio 1) En torno a 800 pacientes con enfermedad de Parkinson. Criterios de inclusión: 1) Paciente con enfermedad de Parkinson idiopática según criterios del United Kingdom Parkinson´s Disease Society Brain Bank. 2) No criterios de demencia (MMSE ≥ 26). 3) Edad comprendida entre 30 y 75 años. 4) Deseo de participar voluntariamente. 5) Firma voluntaria de un consentimiento informado. Criterios de exclusión: 1) Incapacidad para contestar de forma adecuada a los cuestionarios (se excluirán sujetos analfabetos). 2) Otra enfermedad neurológica concomitante discapacitante (ictus, traumatismo craneal grave, enfermedad neurodegenerativa, etc.). 7 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 3) Otra enfermedad no neurológica concomitante discapacitante (oncológica, autoinmune, etc.). 4) Anemia crónica y/o hiperuricemia conocidas. 5) Tratamiento activo con infusión continua de levodopa y/o apomorfina y/o con estimulación cerebral profunda. 6) Expectativas de imposibilidad de seguimiento a largo plazo. 7) Paciente que esté participando en un ensayo clínico y/u otro tipo de estudio que no permita su participación concomitante en otro. 2) En torno a 600 cuidadores (cuidador principal del paciente). 3) En torno a 400 controles. 9. Periodo del estudio 1) Fase de reclutamiento: del 1 de mayo de 2015 al 31 de agosto de 2016 (evaluación basal de cada sujeto participante). 2) Fase de seguimiento (cohorte de pacientes, cuidadores y controles): durante los 5 años posteriores a su evaluación basal (evaluaciones anuales y/o bianuales). 3) Fecha de cierre del estudio (seguimiento clínico): 30 de noviembre de 2021. 10. Evaluaciones del estudio 1) Evaluación basal (Figura 1). a. Pacientes con enfermedad de Parkinson: 1. Evaluación motora (UPDRS-III; UPDRS-IV; Hoehn&Yahr). 2. Evaluación no motora (PD-CRS; MMSE; resolución de un puzzle; NMSS; BDI-II; QUIP-RS; PDSS; NPI; VAS-Pain; VAFS; FOGQ; ADLS; PDQ-39SI; PQ-10; EUROHIS-QOL8 item index). 3. Estudios complementarios (n=300): 1) Biomarcadores moleculares séricos (proteína S-100b, TNF-alfa, IL-1, IL-2, IL-6, vitamina B12, ácido metilmalónico, homocisteína, ácido úrico, proteína C reactiva, ferritina y hierro); 2) Estudios genéticos (SNCA, LRRK2, FBXO7, PINK1, PRKN, DJ1, HTRA2, UCHL1, ATP13A2, VPS35, PLA2G6, GIGYF2, EIF4G, GBA); 3) Estudio de RM craneal (volumetría y MTAi [Medial Temporal Atrophy Index]). b. Cuidadores: ZCBI; CSI; BDI-II; PQ-10; EUROHIS-QOL8 item index. c. Controles: 1. Evaluación no motora (MMSE; PD-CRS; resolución de un puzzle; NMSS; BDI-II; QUIP-RS; PDSS; NPI; VAS-Pain; VAFS; FOGQ; ADLS; PDQ-39SI; PQ-10; EUROHIS-QOL8 item index). 2. Estudios complementarios (n=100): 1) Biomarcadores moleculares séricos (proteína S-100b, TNF-alfa, IL-1, IL-2, IL-6, vitamina B12, ácido metilmalónico, homocisteína, ácido úrico, proteína C reactiva, ferritina y hierro); 2) Estudios genéticos (SNCA, LRRK2, FBXO7, PINK1, PRKN, DJ1, HTRA2, UCHL1, ATP13A2, VPS35, PLA2G6, GIGYF2, EIF4G, GBA); 3) Estudio 8 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 de RM craneal (volumetría y MTAi [Medial Temporal Atrophy Index]). 2) Fase de seguimiento (Figura 2). a. Pacientes con enfermedad de Parkinson: 1. 12 meses: Hoehn&Yahr; UPDRS-III; UPDRS-IV; NMSS; ADLS. 2. 24 meses: Hoehn&Yahr; UPDRS-III; UPDRS-IV; MMSE; PD-CRS; resolución de un puzzle; NMSS; BDI-II; QUIP-RS; PDSS; NPI; VAS-Pain; VAFS; FOGQ; ADLS; PDQ-39SI; PQ-10; EUROHISQOL8 item index. 3. 36 meses: Hoehn&Yahr; UPDRS-III; UPDRS-IV; NMSS; ADLS. 4. 48 meses: Hoehn&Yahr; UPDRS-III; UPDRS-IV; MMSE; PDCRS; resolución de un puzzle; NMSS; BDI-II; QUIP-RS; PDSS; NPI; VAS-Pain; VAFS; FOGQ; ADLS; PDQ-39SI; PQ-10; EUROHIS-QOL8 item index. 5. 60 meses: Hoehn&Yahr; UPDRS-III; UPDRS-IV; MMSE; PDCRS; resolución de un puzzle; NMSS; BDI-II; QUIP-RS; PDSS; NPI; VAS-Pain; VAFS; FOGQ; ADLS; PDQ-39SI; PQ-10; EUROHIS-QOL8 item index; estudios complementarios (biomarcadores moleculares séricos y RM craneal en el subgrupo que los hizo inicialmente, n=300). b. Cuidadores: 1. 24 meses: ZCBI; CSI; BDI-II, PQ-10; EUROHIS-QOL8 item index. 2. 48 meses: ZCBI; CSI; BDI-II; PQ-10; EUROHIS-QOL8 item index. 3. 60 meses: ZCBI; CSI; BDI-II; PQ-10; EUROHIS-QOL8 item index. c. Controles: 6. 24 meses: MMSE; PD-CRS; resolución de un puzzle; NMSS; BDIII; QUIP-RS; PDSS; NPI; VAS-Pain; VAFS; FOGQ; ADLS; PDQ39SI; PQ-10; EUROHIS-QOL8 item index. 7. 48 meses: MMSE; PD-CRS; resolución de un puzzle; NMSS; BDIII; QUIP-RS; PDSS; NPI; VAS-Pain; VAFS; FOGQ; ADLS; PDQ39SI; PQ-10; EUROHIS-QOL8 item index. 8. 60 meses: MMSE; PD-CRS; resolución de un puzzle; NMSS; BDIII; QUIP-RS; PDSS; NPI; VAS-Pain; VAFS; FOGQ; ADLS; PDQ39SI; PQ-10; EUROHIS-QOL8 item index; estudios complementarios (biomarcadores moleculares séricos y RM craneal en el subgrupo que los hizo inicialmente, n=100). 11. Variable principal de valoración Dado que es un proyecto con múltiples objetivos no hay una única variable principal. Las principales variables contempladas (según cada objetivo) son: Puntuación total en el cuestionario PQQ-39SI (39-item Parkinson’s disease Quality of Life Questionnaire Summary Index). Puntuación total en el cuestionario EUROHIS-QOL 8 item index. Puntuación total en el cuestionario ZCBI (Zarit Caregiver Burden Inventory). Puntuación total en el cuestionario CSI (Caregiver Strain Index). 9 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 Puntuación total en el cuestionario QUIP-RS (Questionnaire for ImpulsiveCompulsive Disorders in Parkinson's Disease-Rating Scale). Puntuación total en el cuestionario NMSS (Non-Motor Symptoms Scale). Tipo de trastorno del estado de ánimo (depresión mayor vs depresión menor vs depresión subclínica vs sin trastorno). Fenotipo parkinsoniano (tremórico vs trastorno con afectación predominantemente postural y de la marcha vs indeterminado). Asimetría del parkinsonismo (asimétrico derecho o izquierdo leve a moderado vs marcado vs simérico). Valor (las unidades dependerán del marcador en concreto) de diferentes marcadores moleculares en sangre (proteína S-100b, TNF-alfa, IL-1, IL-2, IL-6, vitamina B12, ácido metilmalónico, homocisteína, ácido úrico, proteína C reactiva, ferritina y hierro). Valor del marcador de neuroimagen MTAi (Medial Temporal Atrophy Index). Hospitalización aguda no programada durante el año posterior a la evaluación basal (si vs no). Desarrollo de complicaciones motoras (en el subgrupo inicial sin ellas) a lo largo de los 48 meses posteriores a la evaluación basal (si vs no). Desarrollo de demencia (según criterios de la Movement Disorder Society) a lo largo de los 24, 48 y 60 meses posteriores a la evaluación basal (si vs no). Cambio en la puntuación total de algunas de las variables descritas a lo largo del seguimiento (5 años). 12. Centros en los que se prevé realizar el estudio Se llevará a cabo en diferentes centros hospitalarios del territorio nacional (España). El requisito imprescindible será que el investigador principal participante en cada centro tenga experiencia y competencias en el diagnóstico y manejo habitual en la práctica clínica diaria de los pacientes con enfermedad de Parkinson. El centro participante, de esta forma, puede ir desde una Unidad de Trastorno del Movimiento muy especializada de un hospital de tercer nivel asistencial hasta un neurólogo general de un hospital comarcal con las competencias correspondientes mencionadas. A fecha 15 de enero de 2015, 47 centros han confirmado su participación en el estudio (ver ANEXO I). 13. CEIC que lo evalúa: Comité Autonómico de Ética de Investigación (CAEI) de Galicia. 14. Recogida de datos y análisis estadístico Se cubrirá un CRD-e y se trasferirán los datos a un paquete estadístico para su posterior análisis. En función del tipo de objetivo se realizará el análisis pertinente (estudios descriptivos, estudios univariados, regresión logística binaria, regresión lineal múltiple, etc.). El análisis principal e independiente de los datos será llevado a cabo por un evaluador ciego. 10 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 15. Consideraciones éticas El desarrollo del proyecto se realizará respetando las Normas de Buena Práctica Clínica, los principios éticos fundamentales establecidos en la Declaración de Helsinki y el Convenio de Oviedo, así como los requisitos establecidos en la legislación española en el ámbito de la investigación. Se respetará la Ley de Protección de Datos de Carácter Personal (Ley Orgánica 15/1999, de 13 de diciembre), la Ley 41/2002, de 14 de noviembre (básica reguladora de la autonomía del paciente y de derechos y obligaciones en materia de información y documentación clínica), así como la Ley 3/2001, de 28 de mayo (reguladora del consentimiento informado y de la historia clínica de los pacientes), la Ley 3/2005, de 7 de marzo, de modificación de la Ley 3/2001 y el Decreto 29/2009 de 5 de febrero, por el que se regula el acceso a la historia clínica electrónica. En relación con las muestra biológicas y de neuroimagen, toda la información referente a la identidad de los pacientes será considerada confidencial a todos los efectos y se tratará conforme establece la Ley Orgánica 15/1999 de 13 de diciembre (de “Protección de Datos de Carácter Personal”) y en el marco de la Ley 14/2007, de 7 de julio (“de Investigación Biomédica”). 16. Calendario del estudio 1. Trámites previos a la puesta en marcha i. Envío del proyecto para evaluación al CAEI de Galicia: octubre de 2014. ii. Aprobación estimada por el CAEI de Galicia: último trimestre de 2014. iii. Envío del proyecto para evaluación por la Agencia Española del Medicamento y Productos Sanitarios (AEMPS): último trimestre de 2014. iv. Registro por la AEMPS: último trimestre de 2014. v. Tramitación y puesta en marcha en todos los centros: primer trimestre del 2015. vi. Inicio del reclutamiento de pacientes: 1 de mayo de 2015. 2. Primera evaluación (evaluación transversal): 1 de mayo de 2015 a 31 de agosto de 2016. 3. Revisión de base de datos: septiembre-octubre de 2016. 4. Análisis estadístico (objetivos propuestos): último trimestre de 2016. 5. Comunicación y publicación de trabajos (objetivos 1 a 12 de la evaluación transversal –excepto el 10– y otros sub-análisis): años 2017 a 2019. 6. Objetivos del seguimiento prospectivo de la cohorte: a partir del 2018. 17. Fuentes de financiación: privadas (www.coppadis.com). 18. Abreviaturas: ADLS, Schwab & England Activities of Daily Living Scale; BDI, Beck Depression Inventory; CSI, Caregiver Strain Index; FOGQ, Freezing of Gait Questionnaire; HY, Hoenh and Yahr; NMSS, Non-Motor Symptoms Scale; NPI, Neuropsychiatric Inventory; PD-CRS, Parkinson´s Disease Cognitive Rating Scale; PDQ-39SI, Parkinson´s disease Quality of Life Questionnaire Summary Index; QUIP11 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 RS, Questionnaire for Impulsive-Compulsive Disorders in Parkinson's Disease-Rating Scale; PDSS, Parkinson´s Disease Sleep Scale; UPDRS, Unified Parkinson´s Disease Rating Scale; VAFS, Visual Analog Fatigue Scale; VAS-Pain, Visual Analog ScalePain; ZCBI, Zarit Caregiver Burden Inventory. 12 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 INFORMACIÓN GENERAL 1. Título: COhort of Patients with PArkinson´s DIsease in Spain, 2015. 2. Código del protocolo: COH-PAK-2014-01. 3. Promotor/investigador principal: Promotor del estudio: Diego Santos García. Investigador principal y coordinador del estudio: Diego Santos García. Dirección: Sección de Neurología, Complejo Hospitalario Universitario de Ferrol (CHUF); Hospital Arquitecto Marcide, ctra. de San Pedro de Leixa, s/n; CP 15405; Ferrol (A Coruña), España. 4. Ámbito del estudio: Ciencias de la Salud. 5. Centros en los que se prevé realizar el estudio. Se llevará a cabo en diferentes centros hospitalarios del territorio nacional (España). El requisito imprescindible será que el investigador principal participante en cada centro tenga experiencia y competencias en el diagnóstico y manejo habitual en la práctica clínica diaria de los pacientes con enfermedad de Parkinson. El centro participante, de esta forma, puede ir desde una Unidad de Trastorno del Movimiento muy especializada hasta un neurólogo general de un hospital comarcal con las competencias correspondientes mencionadas. El ANEXO I muestra el listado de centros que a fecha 15 de enero de 2015 han confirmado su participación. Es posible que pueda hasta que se ponga en marcha el proyecto haber un incremento de los centros participantes, siempre con el correspondiente cumplimiento de la normativa y criterios para su posible participación. 6. Duración del estudio: se estima el cierre del estudio en el último trimestre del año 2021. 13 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 INTRODUCCIÓN El concepto de enfermedad de Parkinson ha cambiado en los últimos años y actualmente se entiende la misma como una enfermedad neurodegenerativa con afectación de diferentes vías y neurotransmisores que explicaría, en parte, la gran variedad de síntomas que los pacientes pueden presentar [1]. Diversos síntomas no motores y problemas cognitivos pueden estar presentes ya en estadios iniciales [2]. Aunque disponer de un marcador diagnóstico y de progresión de la enfermedad (preferiblemente, no invasivo, poco costoso y accesible) es prioritario, conceptos como el de calidad de vida se antojan muy importantes en enfermedades (como la enfermedad de Parkinson) sobre las que sólo podemos actuar de forma sintomática. Por otra parte, disponer de una población con un número elevado de pacientes evaluados de forma completa y rigurosa y sin sesgos de selección resulta muy útil para estudiar diferentes aspectos propuestos inicialmente (evaluación transversal) así como otros posteriores en su seguimiento (seguimiento prospectivo). Esto es especialmente relevante para estudiar poblaciones afectas por una enfermedad neurodegenerativa dado que los pacientes irán desarrollando diferentes complicaciones que podremos identificar y analizar. 14 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 JUSTIFICACIÓN DEL ESTUDIO La enfermedad de Parkinson es un trastorno frecuente (segunda enfermedad neurodegenerativa más frecuente después de la enfermedad de Alzheimer) y complejo (con afectación de múltiples áreas cerebrales y vías de conexión y desarrollo de múltiples síntomas además de los motores como deterioro cognitivo, trastorno de conducta, depresión, dolor, etc.) para el que no existe un tratamiento curativo en el momento actual. No se conoce bien la etiopatogenia de la enfermedad y es necesario identificar un marcador diagnóstico y de progresión que nos ayude a detectar de forma precoz la misma y utilizar de forma correcta las terapias sintomáticas de las que disponemos. Mejorar la calidad de vida de los pacientes y conocer aquellos factores que ocasionan una sobrecarga del cuidador son también aspectos muy importantes en el manejo de la enfermedad. Durante años, el manejo de la enfermedad de Parkinson se centró en los síntomas motores, como el temblor, rigidez, bradicinesia, trastornos de la marcha y alteraciones posturales. De hecho, el diagnóstico que se realiza en vida actualmente es utilizando criterios clínicos exclusivamente motores [3]. Sin embargo, en los últimos años ha cobrado importancia la sintomatología no motora, que también forma parte de la enfermedad. El origen de los síntomas no motores es diverso y no siempre claramente comprendido, pero parece que en parte dicha sintomatología se debería a la degeneración de otras vías dopaminérgicas diferentes de la nigro-estriada y no dopaminérgicas, con participación de otros neurotransmisores como la serotonina, noradranalina o acetilcolina [4]. Esto podría explicar la aparición de síntomas como problemas cognitivos, depresión o apatía y ha ayudado a intentar comprender mejor la fisiopatología de la enfermedad. No obstante, algunos síntomas no motores pueden aparecer en relación con sintomatología o complicaciones motoras, como por ejemplo la ansiedad durante los episodios off. En otras ocasiones, los síntomas podrían estar originados por patología concomitante que el paciente presenta (comorbilidad) o debido a efectos secundarios de fármacos y no directamente relacionados con la enfermedad. La sintomatología no motora puede ser muy variada: síntomas cardiovasculares, urinarios, gastrointestinales, trastornos del sueño, trastornos del estado de ánimo, conducta, problemas cognitivos, disfunción sexual o síntomas sensoriales incluyendo dolor entre otros. Los síntomas no motores tienen importancia por diferentes motivos: son frecuentes, pueden preceder a la sintomatología motora (hiposmia, estreñimiento, depresión o trastorno del sueño REM) y en el futuro podrían ser utilizados para realizar un diagnóstico pre-motor más precoz, pueden ser de difícil manejo (hipotensión ortostática, trastornos de conducta, etc.) y en ocasiones hay que recurrir al uso de fármacos con efectos secundarios perjudiciales, generan un coste económico elevado (demencia, psicosis, etc.), no siempre son suficientemente reconocidos por el clínico y repercuten de forma negativa en la calidad de vida del paciente [5]. Varios estudios han demostrado que el impacto negativo que los síntomas no motores generan sobre la calidad de vida del paciente es independiente del efecto de otras variables [6,7] y que mejorando los mismos ayudamos a mejorar su calidad de vida [8]. Por todo ello, su identificación precoz (actualmente se utilizan diferentes escalas y/o cuestionarios validados que objetivan el problema y son útiles probablemente no sólo en investigación sino también en la práctica clínica diaria; por ejemplo, escalas cognitivas, de 15 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 síntomas no motores, sueño, apatía, depresión, trastornos de control de impulsos, etc.) y correcto manejo [9] debería ser actualmente una prioridad en la práctica clínica diaria y por múltiples motivos no siempre es así. Igualmente, hay muchos aspectos no bien conocidos sobre su origen y evolución en el tiempo, siendo imprescindible profundizar en ello. Otro aspecto importante de la enfermedad es conocer qué factores influyen en la calidad de vida del paciente y el estado del cuidador. Esto es especialmente importante en una enfermedad como la enfermedad de Parkinson, para la cual no disponemos de una cura en el momento actual. Nuestro objetivo será utilizar de forma racional la medicación sintomática y/o otras terapias disponibles para mejorar los síntomas del paciente y que esto permita mejorar su estado de salud, grado de autonomía y calidad de vida. La clave es conocer qué factores afectan a la calidad de vida, dado que la intervención se realizará en función de los mismos. Por ejemplo, recientemente se ha observado que la presencia de deterioro cognitivo leve en pacientes con Parkinson podría repercutir de forma negativa en la calidad de vida de los pacientes independientemente del efecto de otros factores [10]. Por lo tanto, el intervencionismo irá dirigido hacia la mejora del deterioro cognitivo, para lo cual será necesario conocer su origen y patogenia (por ejemplo, si es ocasionado por un déficit de dopamina en vías meso-corticales o meso-límbicas o debido a un déficit colinérgico, a ambos u otro origen diferente). Debido a que la enfermedad de Parkinson es un trastorno neurodegenerativo y que los síntomas irán progresando y el paciente se irá volviendo cada vez más dependiente, la figura del cuidador principal del paciente es también muy importante. Será necesario conocer qué factores provocan sobrecarga y estrés en el mismo con intención de poder realizar un intervencionismo precoz, ya que la sobrecarga del cuidador genera un mal cuidado y a largo plazo riesgo de institucionalización del paciente [11]. En este sentido, se ha observado que la calidad de vida del paciente se correlaciona con el estado del cuidador (a peor calidad de vida del paciente mayor grado de sobrecarga del cuidador) y se han sugerido intervencionismos dirigidos a mejorar la sobrecarga del cuidador para mejorar también la calidad de vida del paciente [12]. Otros dos aspectos clave (relacionados entre sí) de la enfermedad son el de disponer de un biomarcador (diagnóstico y pronóstico) y conocer cómo es la progresión natural de la misma. Los criterios clínicos utilizados actualmente no permiten asegurar el diagnóstico con un grado de certeza muy alto en vida, sobre todo en pacientes con síntomas muy leves (estadios iniciales) [13] y esto tiene repercusiones en la práctica clínica (a la hora de emitir un diagnóstico y tratar acorde con el mismo) y especialmente (no hay cura) en investigación (ya que pacientes que reclutamos diagnosticados de enfermedad de Parkinson podrían no tener la enfermedad) de forma grave (puede hacernos asumir cierto lo que no es). Idealmente, este biomarcador diagnóstico debería permitir diagnosticar la enfermedad más precozmente, cuando el proceso neurodegenerativo y la pérdida de neuronas dopaminérgicas se inicia. Igualmente, tampoco disponemos de un biomarcador actualmente que nos permita saber cómo va a progresar la enfermedad del paciente y emitir un pronóstico con cierto grado de certeza. Una revisión reciente de estudios realizados entre 1950 y 2010 (183 estudios) cuyo objetivo primario fuese testar un biomarcador de progresión de enfermedad concluyó que existe falta de evidencia para recomendar el uso de un biomarcador y que a ésta han contribuido problemas metodológicos 16 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 (demasiados estudios transversales sin seguimiento, tamaño muestral insuficiente, estudios prospectivos con seguimiento insuficiente, excesivos criterios de in/exclusión o análisis estadísticos simplistas) [14]. Un biomarcador de progresión de enfermedad ideal debería presentar las siguientes características [15,16]: 1) Cambiar con la neurodegeneración; 2) Mostrar una asociación con el fenotipo; 3) Mostrar una asociación directa e independiente de otras variables con la progresión de la enfermedad; 4) Que esa asociación (con la progresión) sea lineal y robusta; 5) No influenciable por el tratamiento sintomático (sólo por el proceso neurodegenerativo); 6) Predecir cambios importantes en la progresión a partir de cambios pequeños del mismo; 7) Útil para pacientes con diferentes características (edad, sexo, raza, etc.); 8) Ser continuamente cambiante (idealmente de forma lineal); 9) Ser sensible, mostrando cambios ante pequeños cambios en el proceso neurodegenerativo; 10) Ser rápido de obtener y barato; 11) Estar disponible en la mayoría de centros para beneficio de todos los pacientes; 12) Realizable de forma repetida varias veces a lo largo de la evolución del paciente si fuera preciso; 13) Ser seguro y bien tolerado por el paciente. Por lo tanto, metodológicamente, es necesario realizar estudios longitudinales prospectivos bien diseñados para identificar un biomarcador de progresión ideal y también para conocer cuál es la progresión natural de la enfermedad de Parkinson. Actualmente todavía desconocemos como es la relación entre la progresión de los síntomas motores y otros síntomas no motores a largo plazo. Diferentes estudios longitudinales con seguimiento prospectivo de pacientes han aportado conocimiento sobre el desarrollo de complicaciones motoras y su relación con el tipo de terapia sintomática inicialmente utilizada [17-19], deterioro cognitivo y/o demencia [20-23], la evolución posterior a un intervencionismo determinado (por ejemplo, estimulación cerebral profundas) [24,25] u otros datos evolutivos de la enfermedad [26-35]. También hay estudios en marcha prometedores cuyo objetivo fundamental es identificar un biomarcador de progresión de enfermedad [36]. Sin embargo, muchos de los estudios presentan limitaciones importantes como un tamaño muestral o tiempo de seguimiento insuficientes, pérdida significativa de casos a lo largo del seguimiento, limitaciones en el reclutamiento u origen de la muestra y realización de análisis no contemplados específicamente en el diseño. Igual que se ha considerado en otras enfermedades neurodegenerativas como la enfermedad de Huntington [37], el modelo de estudio más beneficioso para conseguir avances relevantes en el conocimiento de la enfermedad de Parkinson podría ir orientado hacia aquel estudio completo (preferiblemente multicéntrico internacional) que incluya una evaluación transversal basal de los pacientes (con grupo control) con análisis de múltiples variables (clínicas y de pruebas complementarias; por ejemplo, marcadores moleculares séricos, otras muestras biológicas como líquido cefalorraquídeo, saliva o piel, neuroimagen estructural, neuroimagen funcional, estudios oftalmológicos, pruebas neurofisiológicas, etc.) seguida de un posterior seguimiento prospectivo (idealmente durante un tiempo de seguimiento largo y sin pérdida de casos) de la población estudiada con múltiples análisis periódicos que permitan comparar la evolución de las diferentes variables analizadas. El presente proyecto se fundamenta e integra de forma global cuatro conceptos muy importantes (comentados previamente): (1) Concepto global de enfermedad (síntomas motores, 17 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 no motores, cognitivos, etc.); 2) Calidad de vida del paciente y estado del cuidador; 3) Biomarcador (valor diagnóstico y pronóstico); 4) Progresión de la enfermedad. Necesitamos avanzar en el conocimiento en cada uno de estos puntos y el proyecto COPPADIS-2015 representa un estudio muy completo que contempla múltiples objetivos (ver objetivos, hasta 17 propuestos inicialmente y con la posibilidad de formular otras cuestiones bajo hipótesis plausibles) que pretende dar respuesta a algunas cuestiones no resueltas sobre el conocimiento de la enfermedad. El esfuerzo individual de cada centro participante (tiempo y personal) resultará productivo para conseguir el objetivo del proyecto. Disponer de una cohorte de pacientes como la estimada tendrá un valor muy importante en su seguimiento prospectivo. Las posibilidades de investigaciones futuras sobre dicha cohorte y las expectativas de producción científica justifican el proyecto y el compromiso individual de cada centro participante. En el momento actual no hay ningún grupo poblacional en estudio como el propuesto en nuestro país. 18 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 OBJETIVOS DEL ESTUDIO 1. Objetivo general (1) Definir de forma detallada y rigurosa una población de pacientes con enfermedad de Parkinson idiopática [38] (variables clínicas, marcadores de imagen, genéticos y moleculares séricos) representativa de diferentes áreas de nuestro país a la que llamaremos COPPADIS-2015 (COhort of Patients´s with PArkinson´s DIsease in Spain, 2015), (2) compararla frente a un grupo control y (3) hacer un seguimiento de la misma durante un periodo de 5 años. 2. Objetivos específicos El estudio incluye una evaluación basal y un seguimiento posterior con nuevas evaluaciones. Los objetivos propuestos, inicialmente, de la evaluación basal (transversal) son: 1) Estudiar qué variables (síntomas no motores, cognición, síntomas neuropsiquiátricos, caídas, discapacidad, etc.) repercuten de forma negativa en la calidad de vida global y relacionada con el estado de salud de los pacientes con enfermedad de Parkinson. 2) Estudiar qué variables contribuyen a una peor calidad de vida, estado de ánimo y sobrecarga del cuidador principal del paciente con enfermedad de Parkinson así como si estas últimas repercuten en el estado de ánimo y calidad de vida del propio paciente. 3) Estudiar la prevalencia de trastorno de control de impulsos y sus tipos en la población analizada así como qué variables se asocian a los mismos y comparar frente a un grupo control. 4) Estudiar la prevalencia de diferentes síntomas no motores en la población analizada y comparar frente a un grupo control. 5) Estudiar la prevalencia del dolor (y sus tipos) en los pacientes con enfermedad de Parkinson, su relación con la enfermedad y diferentes variables y comparar frente a un grupo control. 6) Estudiar la prevalencia de diferentes tipos de trastorno del ánimo (depresión mayor, depresión menor, depresión subclínica) en los pacientes con enfermedad de Parkinson, su relación con otras variables de la enfermedad y comparar frente a un grupo control. 7) Estudiar los diferentes tipos de fenotipo parkinsoniano y su relación con otras variables (clínicas, moleculares y de neuroimagen). 8) Estudiar la relación entre diferentes variables (clínicas, moleculares y de neuroimagen) y el patrón de asimetría del parkinsonismo. 9) Estudiar la relación entre los niveles séricos de proteína S-100b, TNF-alfa, IL-1, IL-2, IL-6, vitamina B12, ácido metilmalónico, homocisteína, ácido úrico, proteína C reactiva (PCR), ferritina y hierro [39-49] y otras variables de la enfermedad en pacientes con enfermedad de Parkinson y comparar frente a un grupo control. 19 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 10) Realizar estudios genéticos sobre ADN y ARN extraídos de los linfocitos de muestras de sangre periférica.* 11) Estudiar el posible valor de un marcador de imagen propuesto recientemente (MTAi, Medial Temporal Atrophy Index) [50] para detectar alteraciones cognitivas en pacientes con enfermedad de Parkinson [51,52] y comparar frente a un grupo control. 12) Realizar estudios de volumetría en busca de correlaciones, bajo hipótesis plausibles, entre los parámetros de la neuroimagen y las variables clínicas, neuropsiquiátricas y/o de otro tipo [53,54] que se recogen en este estudio. *NOTA: la memoria económica contempla el coste derivado de la extracción y envío de las muestras para su almacenamiento. La obtención futura de financiación determinará el momento de realización de los estudios genéticos. Los objetivos propuestos, inicialmente, del seguimiento prospectivo de la cohorte previamente definida COPPADIS-2015 son: 13) Estudiar la incidencia de hospitalización aguda a lo largo de los 12 meses posteriores a la evaluación basal (para cada paciente), sus causas, y factores predictores de la misma en los pacientes con enfermedad de Parkinson y comparar frente a un grupo control. 14) Estudiar qué porcentaje de pacientes con enfermedad de Parkinson desarrollan complicaciones motoras (en el subgrupo de aquellos que no las presenten en la evaluación basal) a lo largo de los 48 meses posteriores a la evaluación basal (para cada paciente) y analizar factores predictores de las mismas. 15) Estudiar qué porcentaje de pacientes con enfermedad de Parkinson desarrollan demencia [55] a lo largo de los 24, 48 y 60 meses posteriores a la evaluación basal (para cada paciente), comparar frente a un grupo control y analizar posibles marcadores predictores de la misma (clínicos, séricos y/ o géneticos, de imagen). 16) Estudiar la morbimortalidad de los pacientes con enfermedad de Parkinson a lo largo de los 24 y 60 meses posteriores a la evaluación basal (para cada paciente), comparar frente a un grupo control y analizar posibles marcadores predictores de la misma (clínicos, moleculares y/o genéticos, de imagen). Finalmente, el objetivo principal (17) de realizar una nueva evaluación completa al final del seguimiento (5 años) como la basal será comparar la progresión de las diferentes variables analizadas en los pacientes (síntomas motores, no motores, cognición, marcadores de imagen y moleculares séricos) y algunas de ellas también frente a un grupo control. 20 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 TIPO DE ESTUDIO Y DISEÑO 1. Tipo de estudio Estudio epidemiológico, descriptivo, observacional no intervencionista, longitudinalprospectivo, abierto con grupo control, multicéntrico, nacional (EPA-SP). Los pacientes no serán sometidos a ningún tipo de intervención terapeútica salvo la que considere el propio facultativo en relación con su práctica clínica habitual. Si de la información obtenida por el facultativo de la evaluación de los pacientes éste considerase iniciar algún tipo de tratamiento (por ejemplo, tratamiento con un inhibidor de la acetilcolinesterasa en un paciente evaluado en el que observa deterioro cognitivo), se entenderá su decisión igualmente como derivada de una evaluación que podría considerarse habitual y/o recomendable en la práctica clínica diaria. Por otra parte, a un subgrupo de pacientes (y controles) se les realizará prueba de neuroimagen (RM craneal) y extracción de sangre (30 mL). Dichas pruebas (neuroimagen y análisis de sangre) forman parte del conjunto de estudios complementarios que de forma habitual se realizan a los pacientes con enfermedad de Parkinson o sospecha de la misma entre otros motivos para descartar otras causas que pudiesen ocasionar el cuadro clínico (diagnóstico diferencial). Los criterios clínicos vigentes incluyen en el paso 2 [38] descartar causas como un tumor o hidrocefalia normotensiva (lo cual requiere realizar neuroimagen) y es recomendable análisis para descartar otras causas (hipotiroidismo, degeneración hepato-lenticular, etc). 2. Población del estudio Se evaluarán pacientes con enfermedad de Parkinson idiopática [38], cuidadores (cuidador principal del paciente en caso de haberlo) [56] y controles. Estimamos incluir: 1) En torno a 800 pacientes con enfermedad de Parkinson. 2) En torno a 600 cuidadores (cuidador principal del paciente). 3) En torno a 400 controles. El ANEXO I muestra el listado de centros participantes con el nombre del investigador principal en cada caso así como el número aproximado de pacientes que se ha comprometido personalmente a reclutar. Con estos datos de participación y compromiso (a fecha 15 de enero de 2015), las expectativas del reclutamiento estimado son viables. 3. Diseño del estudio El estudio se llevará a cabo en dos fases: 1) Evaluación transversal (reclutamiento de pacientes con una evaluación basal a lo largo de un periodo de 16 meses, desde el 1 de mayo de 2015 al 31 de agosto de 2016). Se contempla la posibilidad, si fuera necesario, de ampliar el periodo de reclutamiento hasta un máximo de 24 meses (1 de mayo de 2017) con el fin de alcanzar el objetivo propuesto de tamaño muestral. 2) Seguimiento prospectivo de la cohorte definida de pacientes con enfermedad de Parkinson COPPADIS-2015 durante 5 años (evaluaciones anuales). 21 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 4. Evaluación de los participantes Ver material y métodos. A los pacientes se les realizará una evaluación clínica motora y no motora y a un subgrupo (n=300) estudios complementarios (estudios genéticos, marcadores moleculares y RM craneal). A los controles se les realizará la misma evaluación clínica no motora que a los pacientes y a un subgrupo (n=100) los mismos estudios complementarios que a los pacientes. A los cuidadores se les realizará una evaluación clínica no motora sencilla (cuestionarios). 22 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 MATERIAL Y MÉTODOS 1. Selección y reclutamiento de los sujetos participantes El número mínimo necesario de centros participantes en España es de 20. No habrá número máximo de centros participantes. A fecha 15 de enero de 2015, 47 centros han confirmado su participación. Es posible que se puedan sumar más centros en los meses previos al inicio del estudio. Habrá un investigador principal en cada centro participante. Cada investigador principal incluirá en el estudio (1) pacientes con enfermedad de Parkinson idiopática, (2) cuidador principal de cada paciente y (3) controles sanos sin enfermedad de Parkinson. En todos los casos la participación será voluntaria. El número de sujetos mínimo a reclutar por centro será de 15 pacientes (con/sin cuidador principal) y 10 controles. No habrá un número máximo de sujetos a reclutar. En total estimamos una inclusión aproximada de 800 pacientes, 600 cuidadores y 400 controles. En el ANEXO I figura el compromiso de pacientes a reclutar por cada investigador que ha confirmado su participación (a fecha 15 de enero de 2015). Con estos datos (ANEXO I), el número (abierta la posibilidad de conseguir una mayor participación antes del inicio del estudio) estimado de sujetos que se reclutarán es de 1.030 pacientes con enfermedad de Parkinson y 490 controles. Para este número de pacientes estimamos reclutar más de 500 cuidadores (considerando que al menos un 75% de los pacientes pueda tener un cuidador principal). El tiempo de reclutamiento de sujetos participantes será de 16 meses, del 1 de mayo de 2015 al 31 de agosto de 2016. Se contempla la posibilidad, si fuera necesario, de ampliar el periodo de reclutamiento hasta un máximo de 24 meses (1 de mayo de 2017) con el fin de alcanzar el objetivo propuesto de tamaño muestral. 1.1 Pacientes con enfermedad de Parkinson Se incluirán en el estudio pacientes “consecutivos” del listado de citados en cada centro para ser evaluados dentro de la actividad asistencial programada habitual que cumplan con los criterios de inclusión y exclusión a partir de la fecha de puesta en marcha de la fase de reclutamiento del estudio (1 de mayo de 2015). Aunque el reclutamiento es consecutivo, los pacientes se programarán (fecha y hora) para la evaluación según conveniencia y/o disponibilidad de ambas partes (paciente y/o familiar e investigador) y de acuerdo con el protocolo establecido. Los pacientes serán incluidos de acuerdo con la aplicación de los criterios de inclusión/exclusión por parte del investigador principal de cada centro, no habiendo posibilidad de excluir pacientes de forma arbitraria por su parte. Igualmente, los pacientes no serán seleccionados de antemano por parte del investigador. Criterios de inclusión: 1) Paciente con enfermedad de Parkinson idiopática según criterios del United Kingdom Parkinson´s Disease Society Brain Bank [38]. El 23 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 2) 3) 4) 5) criterio de más de un pariente con Parkinson en la familia del paso 2 (exclusión) [38] no será tenido en cuenta (todos los demás sí). No criterios de demencia (MMSE ≥ 26) [55]. Edad comprendida entre 30 y 75 años. Deseo de participar voluntariamente. Firma voluntaria de un consentimiento informado. Criterios de exclusión: 2) Incapacidad para contestar de forma adecuada a los cuestionarios (se excluirán sujetos analfabetos). 3) Otra enfermedad neurológica concomitante discapacitante (ictus, traumatismo craneal grave, enfermedad neurodegenerativa, etc.). 4) Otra enfermedad no neurológica concomitante discapacitante (oncológica, autoinmune, etc.). 5) Anemia crónica y/o hiperuricemia conocidas. 6) Tratamiento activo con infusión continua de levodopa y/o apomorfina y/o con estimulación cerebral profunda. 7) Expectativas de imposibilidad de seguimiento a largo plazo. 8) Paciente que esté participando en un ensayo clínico y/u otro tipo de estudio que no permita su participación concomitante en otro. 1.2 Cuidadores (cuidador principal del paciente) Se incluirá como cuidador principal a aquella persona que sin ser profesional y/o recibir dinero por ello convive con el paciente y es el responsable del cuidado del mismo [56]. Deberá aceptar participar de forma voluntaria y firmar un consentimiento informado. 1.3 Controles Se incluirán como controles 10 sujetos por centro que acepten participar voluntariamente en una proporción por sexo varón/mujer de 6/4 y una edad comprendida entre 60 y 70 años. El sujeto control podría ser un familiar (no cuidador del paciente) o amigo del paciente que quisiera participar de forma voluntaria. Se aplicarán los mismos criterios de inclusión (excepto el criterio 1 y 3, ver criterios) y exclusión que a los pacientes. Será clave por parte del investigador recordar al sujeto control de la importancia de su participación hasta el final del seguimiento en el estudio. 2. Evaluación basal de los sujetos participantes La evaluación de los pacientes con enfermedad de Parkinson incluirá una recogida de datos sobre su enfermedad y tratamiento, una exploración clínica motora y una exploración 24 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 clínica no motora (uso de escalas validadas). A un subgrupo de pacientes (n=300, participación voluntaria previo consentimiento informado firmado y sin contraindicación) se les llevará a cabo extracción de sangre para estudios genéticos y determinación de marcadores moleculares así como un estudio de RM craneal T1 3D mediante protocolos estandarizados que incluya cortes frontales y/o coronales en secuencia T1 a 1.5 T o superior sin contraste intravenoso. Todas las evaluaciones contempladas (motora, no motora, neuroimagen y análisis de sangre) se pueden considerar como evaluaciones habituales en los pacientes con enfermedad de Parkinson y que se realizan en la práctica clínica diaria. El cuidador principal de cada paciente (en caso de haberlo) que quiera participar voluntariamente (será necesario obtener un consentimiento informado firmado) será evaluado con cuestionarios y/o escalas sencillas. Los controles (será necesario obtener un consentimiento informado firmado) serán sometidos a la misma evaluación clínica no motora que se realizará a los pacientes. A un subgrupo de controles (n=100, participación voluntaria previo consentimiento informado firmado y sin contraindicación) se les realizará las mismas pruebas complementarias que se realizarán al subgrupo de pacientes (extracción de sangre para estudios genéticos y determinación de marcadores moleculares así como un estudio de RM craneal T1 3D mediante protocolos estandarizados que incluya cortes frontales y/o coronales en secuencia T1 a 1.5 T o superior sin contraste intravenoso). La figura 1 muestra la evaluación de los pacientes (1 y 2A), cuidadores (2B) y controles (2C). La primera evaluación (decisión sobre la inclusión/exclusión y evaluación motora) será llevada a cabo por un neurólogo o facultativo con experiencia en la enfermedad de Parkinson (figura 1, 1). La parte de los cuestionarios (calidad de vida, síntomas no motores, cognición) de los pacientes (figura 1, 2A), cuidador (2B) y controles (2C) será llevada a cabo por el mismo evaluador o bien por una enfermera y/o psicólogo y/u otro facultativo con formación apropiada. No es preciso que sea realizada el mismo día y podría llevarse a cabo en horario de tarde pero deberá ser en estado ON medicación. 2.1 Pacientes con enfermedad de Parkinson a. Decisión sobre la inclusión y exclusión El investigador principal será quien decida sobre la inclusión del paciente. Será necesario: 1) Cumplimiento de los criterios de inclusión (y que no haya criterios de exclusión); 2) No presencia de demencia, con una puntuación en el Mini-Mental State Examination (MMSE; cuestionario básico para detectar deterioro cognitivo que incluye 11 preguntas sobre orientación espacial y temporal, atención y memoria, cálculo, lenguaje, función visuoespacial y capacidad para seguir instrucciones básicas) [57] ≥ 26 [55]; 3) Participación voluntaria; 4) Firma del consentimiento informado. b. Evaluación motora 25 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 Todo paciente será evaluado desde el punto de vista motor en estado ON medicación (de una a dos horas después de haber recibido su medicación habitual) entre las 8:00 y 12:00 horas cuando no presente fluctuaciones motoras ni sea un paciente al cual se le realicen pruebas complementarias (estudios genéticos, marcadores moleculares y RM craneal). En el caso de ser un paciente que presenta fluctuaciones motoras o corresponda al subgrupo de pacientes a los que se les realice pruebas complementarias (estudios genéticos, marcadores moleculares y RM craneal) independientemente de presentar o no fluctuaciones motoras, será evaluado en estado OFF y ON medicación. Se define paciente con fluctuaciones motoras cuando las presenta de acuerdo con la parte IV de la Unified Parkinson´s Disease Rating Scale (UPDRS-IV) [58] (ítems 36 a 39, al menos 2 respuestas positivas con mínimo 1 punto derivado de los ítems 36 a 38 y al menos otro del ítem 39 –tiempo off) utilizada (entrevista) por el investigador principal. Estos pacientes (todos los fluctuantes y los no fluctuantes que realicen pruebas complementarias) se evaluarán en estado OFF medicación entre las 8 y 10 horas de la mañana, no habiendo recibido ningún tratamiento antiparkinsoniano en las 12 horas previas a la evaluación (por ejemplo, si es a las 9 horas, desde las 21 horas del día anterior). Cuando el paciente esté a tratamiento con levodopa, recibirá un 150% de la dosis equivalente de levodopa habitual de su toma de la mañana independientemente de que finalmente el paciente participe o no en el estudio por el motivo que sea y será evaluado en su “mejor ON” [59]. Se utilizará la medicación habitual del paciente con las dosis requeridas para alcanzar este objetivo de dosis equivalente; por ejemplo, si el paciente toma rasagilina 1 mg + pramipexol 0.7 mg + levodopa/carbidopa 100/25 mg a la mañana (dosis equivalente de levodopa de 270 mg), recibirá rasagilina 1 mg + pramipexol 0.7 mg + levodopa/carbidopa 200/50 (2 pastillas) (dosis equivalente de 370 mg [60]). Cuando el paciente no reciba levodopa (esté en monoterapia con un IMAO-B, agonista dopaminérgico o combinación de IMAO-B + agonista) recibirá su medicación habitual y será evaluado a partir de al menos 1 hora después cuando el paciente manifieste su “mejor ON”. El ANEXO II muestra la forma de calcular la dosis equivalente diaria de levodopa [60]. La evaluación motora incluirá: 1) Hoehn&Yahr [61] en estado OFF medicación (HY-OFF) sólo a los pacientes con fluctuaciones motoras y a todos aquellos sin/con fluctuaciones pero que realicen pruebas complementarias (estudios genéticos, marcadores moleculares y RM craneal; 2) Hoehn&Yahr [61] en estado ON medicación (HY-ON) a todos los pacientes; 3) UPDRS-III [58] en estado OFF medicación (UPDRS-III-OFF) sólo a los pacientes con fluctuaciones motoras y a todos aquellos sin/con fluctuaciones pero que realicen pruebas complementarias (estudios genéticos, marcadores moleculares y RM craneal); 4) UPDRS-III [58] en estado ON medicación (UPDRS-III-ON) a todos los pacientes; 5) UPDRS-IV [58] a todos los pacientes. Será necesario además recoger en todos los pacientes los ítems 26 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 13, 14, 15 y 16 de la UPDRS-II [58] para poder calcular el fenotipo del paciente [62,63]. El ANEXO III muestra la forma de calcular el fenotipo [62,63]. c. Evaluación no motora La evaluación no motora de los pacientes incluirá aspectos cognitivos, relacionados con estado de ánimo, conducta, sueño, otros síntomas no motores, trastornos de la marcha, grado de autonomía para el desempeño de las actividades de la vida diaria y calidad de vida. Se utilizará para ello diferentes escalas y/o cuestionarios validados y/o alguna prueba de evaluación sencilla: 1) Parkinson´s Disease Cognitive Rating Scale (PD-CRS) [64]. Escala validada para evaluar el estado cognitivo de los pacientes con enfermedad de Parkinson. La puntuación total es la suma de la puntuación fronto-subcortical (ítem 1, memoria verbal inmediata; ítem 3, atención mantenida; ítem 4, memoria de trabajo; ítem 5, dibujo espontáneo de un reloj; ítem 7, memoria verbal diferida; ítem 8, fluencia verbal alternante; ítem 9, fluencia verbal de acción) y la puntuación cortical posterior (ítem 2, denominación por confrontación; ítem 6, copia de un reloj). 2) Resolución de un puzzle sencillo de 16 piezas (4 horizontales y 4 verticales; 4 x 4 = 16). El deterioro cognitivo típico de la enfermedad de Parkinson es visuoespacial y disejecutivo y se sabe que los pacientes presentan limitación para realizar tareas en las que se precisan de estas funciones como la resolución de un puzzle [65]. Evaluaremos el número de piezas correctamente colocadas cada minuto hasta un máximo de 5 minutos así como el tiempo total en resolver el mismo (si se resuelve). El ANEXO IV muestra el protocolo de la prueba de resolución del puzzle. 3) Non-Motor Symptoms Scale (NMSS) [66]. Incluye 30 ítems, siendo cada ítem un síntoma no motor diferente. Los síntomas son referidos a las 4 semanas previas a la evaluación. La puntuación total de cada ítem es el resultado de multiplicar la frecuencia (0, nunca; 1, raramente; 2, a menudo; 3, frecuente; 4, muy frecuente) x severidad (1, leve; 2, moderado; 3, grave) y variará de 0 a 12 puntos. La puntuación de la escala va de 0 a 360 puntos. Los ítems se agrupan en 9 dominios diferentes: 1) Cardiovascular (ítems 1 y 2; puntuación, 0 a 24); 2) Sueño/fatiga (ítems 3, 4, 5 y 6; puntuación, 0 a 48); 3) Depresión/apatía (ítems 7, 8, 9, 10, 11 y 12; puntuación, 0 a 72); 4) Alteraciones de la percepción (ítems 13, 14 y 15; puntuación, 0 a 36); 5) Atención/memoria (ítems 16, 17 y 18; puntuación, 0 a 36); 6) Síntomas gastrointestinales (ítems 19, 20 y 21; puntuación, 0 a 36); 7) Síntomas urinarios (ítems 22, 23 y 24; puntuación, 0 a 36); 8) 27 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 Disfunción sexual (ítems 25 y 26; puntuación, 0 a 24); 9) Miscelánea (ítems 27, 28, 29 y 30; puntuación, 0 a 48). La puntuación por dominios se puede expresar como un porcentaje para poder comparar el grado de afectación entre ellos. 4) Beck Depression Inventory II (BDI-II) [67]. Es un instrumento de auto-aplicación de 21 ítems. Ha sido diseñado para evaluar la gravedad de la sintomatología depresiva en adultos y adolescentes con una edad mínima de 13 años. El sujeto evaluado tiene que elegir en cada uno de los ítems entre cuatro alternativas (ordenadas de menor a mayor gravedad) aquella que mejor describa su estado durante las dos semanas previas. La puntuación va de 0 (mínima) a 63 (máximo). Puntuaciones más altas reflejarán a priori un peor estado de ánimo. 5) Questionnaire for Impulsive-Compulsive Disorders in Parkinson's Disease-Rating Scale (QUIP-RS) [68]. Se trata de un cuestionario que permite evaluar la presencia y severidad de trastorno de control de impulsos relacionado con juego, compras, comida, sexo así como conductas relacionadas (abuso de medicación, punding y hobbismo). Los síntomas son referidos a las 4 semanas previas a la evaluación. La puntuación total de cada ítem es el resultado de multiplicar la frecuencia (0, nunca; 1, raramente; 2, a menudo; 3, frecuente; 4, muy frecuente) x severidad (1, leve; 2, moderado; 3, grave; 4, muy grave) y variará de 0 a 16 puntos. La puntuación total va de 0 a 112 (máximo, 7 x 16). Se puede expresar además la puntuación total de los 4 trastornos de control de impulsos, que va de 0 a 64 puntos (máximo, 4 x 16). Los ítems relacionados con el punding y hobbismo se expresan como un único trastorno que va de 0 a 32 puntos. 6) Parkinson´s Disease Sleep Scale (PDSS) [69]. Escala para evaluar el sueño de los pacientes con Parkinson. Los síntomas son referidos a la semana previa a la evaluación. Son 15 ítems y para cada uno la puntuación va de 0 a 10. La puntuación total va de 0 a 150 (máximo, 15 x 10). Puntuaciones más altas reflejarán a priori una mejor calidad del sueño. 7) Neuropsychiatric Inventory (NPI) [70]. Incluye 10 trastornos neuropsiquiátricos: 1) Delirios; 2) Alucinaciones; 3) Agitación; 4) Depresión/disforia; 5) Ansiedad; 6) Euforia/júbilo; 7) Apatía/indeferencia; 8) Desinhibición; 9) Irritabilidad/labilidad emocional; 10) Conducta motora sin finalidad. Los síntomas son referidos a las 4 semanas previas a la evaluación. La puntuación total de cada ítem es el resultado de multiplicar la frecuencia (0, nunca; 1, raramente; 2, a menudo; 3, frecuente; 4, muy frecuente) x severidad 28 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 (1, leve; 2, moderado; 3, grave) y variará de 0 a 12 puntos. La puntuación total va de 0 a 120 (máximo, 10 x 12). Una mayor puntuación indicará a priori un trastorno neuropsiquiátrico más grave. 8) Visual Analog Scale-Pain (VAS-Pain) [71]. Se trata de una escala visual analógica para determinar la presencia de dolor. El paciente marcará una cruz a lo largo de una línea donde lo estime oportuno. En un extremo figurará “no dolor” y en el otro “el peor dolor posible”. Se le deberá explicar con detalle en qué consiste la evaluación para asegurarnos de que lo ha comprendido y la respuesta es coherente. 9) Visual Analog Fatigue Scale (VAFS) [72]. Se trata de una escala visual analógica para determinar la presencia de fatiga. El paciente marcará una cruz a lo largo de una línea donde lo estime oportuno. En un extremo figurará “no fatiga” y en el otro “la peor fatiga posible”. Se le deberá explicar con detalle en qué consiste la evaluación para asegurarnos de que lo ha comprendido y la respuesta es coherente. 10) Freezing of Gait Questionnaire (FOGQ) [73]. Es un cuestionario utilizado para evaluar los trastornos de la marcha. Los síntomas son referidos a la semana previa a la evaluación. Incluye 6 ítems; el ítem 1 se refiere al grado de autonomía para caminar, el 2 al impacto que los trastornos de la marcha ocasionan en el desempeño de las actividades diarias y los ítems 3 a 6 al fenómeno de congelación. Si es preciso, el evaluador debe explicar al paciente en qué consiste el fenómeno de congelación de la marcha. Para cada ítem la puntuación va de 0 a 4. La puntuación total va de 0 a 24 puntos. Una mayor puntuación indicará a priori un trastorno de la marcha más grave. 11) Schwab & England Activities of Daily Living Scale(ADLS) [74]. El paciente debe indicar en una escala que va de 0 (encamado, no mantiene adecuadamente funciones vegetativas como la deglución, función vesical o intestinal) a 100 (totalmente independiente, esencialmente normal) el grado de autonomía para el desempeño de las actividades de la vida diaria. Una puntuación ≥ 80 indica que el paciente es totalmente independiente. 12) 39-item Parkinson’s disease Quality of Life Questionnaire Summary Index (PDQ-39SI) [75]. Cuestionario que evalúa la calidad de vida del paciente relacionada con su estado de salud. Son 39 ítems agrupados en 8 dominios: (1) Movilidad (ítems 1 a 10); (2) Actividades de la vida diaria (ítems 11 a 16); (3) Bienestar emocional (ítems 17 a 22); (4) Estigmatización (ítems 23 a 26); (5) Apoyo social (ítems 27 a 29); (6) Cognición (ítems 30 a 33); (7) Comunicación 29 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 (ítems 34 a 36); (8) Dolor y discomfort (ítems 37 a 39). Para cada ítem la puntuación podrá ir de 0 (nunca) a 4 (siempre). Los síntomas son referidos a las 4 semanas previas a la evaluación. La puntuación total va de 0 a 156 (máximo, 39 x 4) pero se suele expresar como un porcentaje. Cada dominio se puede igualmente expresar como un porcentaje para poder establecer comparaciones. 13) PQ-10 [76]. Es una escala verbal que va de 0 (la peor posible) a 10 (la mejor posible) en la cual el sujeto responde sobre cuál es su calidad de vida global referente a las 4 semanas previas. 14) EUROHIS-QOL8 item index [77]. Es un cuestionario de calidad de vida de 8 ítems (calidad de vida, estado de salud, energía, autonomía para actividades de la vida diaria, autoestima, relaciones sociales, capacidad económica y hábitat) derivado del WHOQOL-100 y WHOQOL-BREF. Para cada ítem la puntuación va de 0 (no del todo) a 5 (completamente). La puntuación total se expresa como la media de las puntuaciones individuales. Una mayor puntuación indicará a priori una mayor calidad de vida. El orden de evaluación de los cuestionarios aplicado será el mismo para todos los pacientes: 1) PD-CRS; 2) Prueba del puzzle; 3) NMSS; 4) BDI-II; 5) QUIP-RS; 6) PDSS; 7) NPI; 8) VAS-Pain; 9) VAFS; 10) FOGQ; 11) ADLS; 12) PDQ-39SI; 13) PQ-10; 14) EUROHIS-QOL8 item index. En caso de precisar, se puede hacer un descanso en la evaluación del paciente con intención de facilitar la respuesta a los cuestionarios. Lo recomendable será hacer la evaluación de forma continua y de una vez aunque en aquellos casos que el investigador lo crea oportuno (fatiga o por ejemplo, paciente fluctuante que desarrolla un estado OFF durante la misma) la podrá fraccionar en dos pero siempre respetando el orden de las pruebas. El paciente deberá estar obligatoriamente en estado ON medicación al inicio de la evaluación. d. Pruebas complementarias (genética, marcadores moleculares y neuroimagen) En un subgrupo de 300 pacientes se llevarán a cabo las siguientes pruebas complementarias: 1) Extracción de sangre para determinación de marcadores moleculares; 2) Extracción de sangre para estudios genéticos; 3) Estudio de neuroimagen (RM craneal T1 3D mediante protocolos estandarizados que incluya cortes frontales y/o coronales en secuencia T1 a 1.5 T o superior sin contraste intravenoso). La selección de los sujetos para realizar las pruebas complementarias dependerá de varios aspectos: 1) Posibilidad del centro de poder llevar a cabo las mismas; 2) Participación voluntaria; 3) Firma de un consentimiento específico para esta parte; 4) Ausencia de contraindicación (por ejemplo, marcapasos cardiaco que contraindique la realización del estudio de RM craneal). Se ofrecerá (investigador principal) por parte de los centros que puedan implicarse en esta parte la 30 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 participación a pacientes y controles “consecutivos” no seleccionados. Será necesario la realización de las tres pruebas en cada sujeto que participe en esta parte del estudio. El ANEXO I muestra la distribución estimada de realización de las pruebas a fecha 15 de enero de 2015 (se detalla en el listado los centros que han confirmado su participación en esta parte del protocolo). Las pruebas complementarias son: 1) Extracción de muestras de sangre para la determinación de diferentes marcadores moleculares: proteína S-100b, TNF-alfa, IL-1, IL-2, IL6, vitamina B12, ácido metilmalónico, homocisteína, ácido úrico, proteína C reactiva, ferritina y hierro. El análisis será llevado a cabo en un laboratorio común para todos los centros: REFERENCE LABORATORY (www.reference-laboratory.es). La extracción de la muestra se llevará a cabo en un tiempo no superior a los 3 meses con respecto a la evaluación clínica. Además se recogerán muestras de sangre (4 tubos por paciente) para almacenar junto con las muestras para estudios genéticos que podrán ser utilizadas en el futuro (por ejemplo, identificar un nuevo marcador molecular). En el ANEXO V figura el listado de marcadores y el protocolo de extracción. En el apartado de memoria económica se comenta lo relativo al coste de las pruebas. 2) Extracción de muestras de sangre para estudios genéticos sobre ADN y ARN de linfocitos con 4 objetivos fundamentales: (1) Estudios de perfil de expresión; (2) Secuenciación del exoma; (3) Análisis exhaustivo de determinados genes; (4) Estudios de asociación en genes candidatos con el fin de determinar si las variaciones patológicas se presentan con mayor frecuencia en los sujetos con enfermedad de Parkinson (con respecto al grupo control). En el ANEXO VI se describe con detalle los objetivos y el tipo de análisis que se llevará a cabo en las muestras. 3) Estudio de neuroimagen: RM craneal T1 3D mediante protocolos estandarizados que incluya cortes frontales y/o coronales en secuencia T1 a 1.5 T o superior sin contraste intravenoso. Será llevado a cabo en la Unidad de Radiología de referencia para cada centro participante preferiblemente en un tiempo no superior a los 6 meses con respecto a la evaluación clínica. El MTAi (ANEXO VII) será calculado por un evaluador ciego (Manuel Menéndez González, MMG; [email protected]) al cual se remitirán las imágenes de RM ([email protected]). Se realizará un análisis (subgrupo) de variabilidad intra-observador e interobservador. El estudio volumétrico (ANEXO VIII) será llevado a cabo por el equipo del Dr. Pablo Mir del Hospital Universitario 31 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 Virgen del Rocío e Instituto de Biomedicina de Sevilla (las imágenes se enviarán por correo electrónico). e. Otros datos recogidos Se recogerán diferentes variables clínicas y epidemiológicas mediante entrevista y uso de la historia clínica del paciente. 2.2 Cuidadores (cuidador principal del paciente) Se recogerán diferentes variables clínicas y epidemiológicas mediante entrevista. La evaluación incluirá: 1) Zarit Caregiver Burden Inventoy (ZCBI) [78]. Escala validada para 2) 3) 4) 5) evaluar el grado de sobrecarga que presenta el cuidador. Consta de 22 ítems y para cada uno la respuesta va de 0 (nunca) a 4 (casi siempre). La puntuación total varía de 0 a 88 (máximo, 22 x 4). Puntuaciones más altas reflejarán a priori una mayor sobrecarga del cuidador principal. Por categorías, se puede considerar el grado de sobrecarga como [79]: 1) Mínimo o no sobrecarga (0-20); 2) Leve a moderado (21-40); 3) Moderado a severo (41-60); 4) Severo (61 a 88). Caregiver Strain Index (CSI) [80]. Cuestionario muy sencillo que plantea 13 cuestiones donde el cuidador debe responder una de las dos opciones: (1) si ó (2) no. Se cuentan las respuestas afirmativas. Un mayor número de respuestas afirmativas indicará a priori un mayor estrés por parte del cuidador principal. Si el número de respuestas afirmativas es igual o mayor a 7 consideramos que el cuidador presenta un alto grado de estrés. BDI-II [67]. PQ-10 [76]. EUROHIS-QOL8 item index [77]. El orden de evaluación de los cuestionarios aplicado será el mismo para todos los cuidadores: 1) ZCBI; 2) CSI; 3) BDI-II; 4) PQ-10; 5) EUROHIS-QOL8 item index. 2.3 Controles Se recogerán diferentes variables clínicas y epidemiológicas mediante entrevista. La evaluación incluirá (por este orden): 1) MMSE; 2) PD-CRS; 3) Prueba del puzzle; 4) NMSS; 5) BDI-II; 6) QUIP-RS; 7) PDSS; 8) NPI; 9) VAS-Pain; 10) VAFS; 11) FOGQ; 12) ADLS; 13) PDQ-39SI; 14) PQ-10; 15) EUROHIS-QOL8 item index. 32 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 En un subgrupo de controles (n=100; en la páginas 30 y 31 se detallan los criterios para pacientes y controles) se realizarán las mismas pruebas complementarias que al subgrupo de pacientes: 1) Extracción de muestras de sangre para la determinación de diferentes marcadores moleculares: proteína S-100b, TNF-alfa, IL-1, IL-2, IL6, vitamina B12, ácido metilmalónico, homocisteína, ácido úrico, proteína C reactiva, ferritina y hierro. Además se recogerán muestras de sangre (4 tubos por control) para almacenar junto con las muestras para estudio genético que podrán ser utilizadas en el futuro (por ejemplo, identificar un nuevo marcador molecular). 2) Extracción de muestras de sangre para estudios genéticos sobre ADN y ARN de linfocitos. 3) Estudio de neuroimagen: RM craneal T1 3D mediante protocolos estandarizados que incluya cortes frontales y/o coronales en secuencia T1 a 1.5 T o superior sin contraste intravenoso. 3. Evaluación del seguimiento prospectivo de los sujetos participantes En relación con el seguimiento, la figura 2 muestra las evaluaciones que se llevarán a cabo en diferentes momentos. Los datos recogidos en las evaluaciones se han definido de acuerdo con los objetivos propuestos del seguimiento. El tiempo de seguimiento de la cohorte definido es de 5 años. El sujeto participante (paciente, cuidador o control) deberá de ser informado completamente del seguimiento del estudio al inicio. Si en algún momento de forma voluntaria desea abandonar el seguimiento podrá hacerlo sin que esta decisión suponga ningún cambio en el trato asistencial. 3.1 Pacientes con enfermedad de Parkinson Se realizarán las siguientes evaluaciones (el orden de aplicación será el mostrado a continuación para todos los pacientes): 1) 12 meses (± 1 mes): UPDRS-IV, Hoehn&Yahr-OFF (sólo si se realizó basalmente o ha desarrollado fluctuaciones motoras), Hoehn&Yahr-ON, UPDRS-III-OFF (sólo si se realizó basalmente o ha desarrollado fluctuaciones motoras), UPDRS-III-ON, NMSS y ADLS. 2) 24 meses (± 1 mes): UPDRS-IV, Hoehn&Yahr-OFF (sólo si se realizó basalmente o ha desarrollado fluctuaciones motoras), Hoehn&Yahr-ON, UPDRS-III-OFF (sólo si se realizó basalmente o ha desarrollado fluctuaciones motoras), UPDRS-III-ON, MMSE, PD-CRS, prueba del puzzle, NMSS, BDI-II, QUIP-RS, PDSS, NPI, VAS-Pain, VAFS, FOGQ, ADLS, PDQ-39SI, PQ-10 y EUROHIS-QOL8 item index. 33 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 3) 36 meses (± 2 meses): UPDRS-IV, Hoehn&Yahr-OFF (sólo si se realizó basalmente o ha desarrollado fluctuaciones motoras), Hoehn&Yahr-ON, UPDRS-III-OFF (sólo si se realizó basalmente o ha desarrollado fluctuaciones motoras), UPDRS-III-ON, NMSS y ADLS. 4) 48 meses (± 2 meses): UPDRS-IV, Hoehn&Yahr-OFF (sólo si se realizó basalmente o ha desarrollado fluctuaciones motoras), Hoehn&Yahr-ON, UPDRS-III-OFF (sólo si se realizó basalmente o ha desarrollado fluctuaciones motoras), UPDRS-III-ON, MMSE, PD-CRS, prueba del puzzle, NMSS, BDI-II, QUIP-RS, PDSS, NPI, VAS-Pain, VAFS, FOGQ, ADLS, PDQ-39SI, PQ-10 y EUROHIS-QOL8 item index. 5) 60 meses (± 3 meses): UPDRS-IV, Hoehn&Yahr-OFF (sólo si se realizó basalmente o ha desarrollado fluctuaciones motoras), Hoehn&Yahr-ON, UPDRS-III-OFF (sólo si se realizó basalmente o ha desarrollado fluctuaciones motoras), UPDRS-III-ON, MMSE, PD-CRS, prueba del puzzle, NMSS, BDI-II, QUIP-RS, PDSS, NPI, VAS-Pain, VAFS, FOGQ, ADLS, PDQ-39SI, PQ-10 y EUROHIS-QOL8 item index. Los pacientes (n=300) que realizaron las pruebas complementarias basalmente repetirán los estudios de RM craneal (preferiblemente mismo centro y misma máquina) y determinación de marcadores moleculares (proteína S-100b, TNF-alfa, IL-1, IL-2, IL-6, vitamina B12, ácido metilmalónico, homocisteína, ácido úrico, proteína C reactiva, ferritina y hierro; mismo laboratorio, REFERENCE LABORATORY).* Se utilizarán los criterios de la Movement Disorders Society propuestos para establecer el diagnóstico de deterioro cognitivo ligero asociado a la enfermedad de Parkinson (PD-MCI) [81] y de demencia-Parkinson (PD-D) [55]. Los ANEXOS IX y X muestran los criterios para PD-MCI y PD-D (respectivamente). Se utilizará la UPDRS-IV (entrevista por el investigador principal) para definir el desarrollo de complicaciones motoras (fluctuaciones motoras y/o discinesias). *NOTA: la memoria económica actual no contempla el coste derivado de la repetición de los estudios complementarios. Será preciso obtener financiación para llevar a cabo los mismos. Con el fin de obtener dichos recursos se planteará la posibilidad de presentar el proyecto a diferentes convocatorias de proyectos de investigación. 3.2 Cuidadores (cuidador principal del paciente) Se realizarán las siguientes evaluaciones (por el orden mostrado): 1) 24 meses (± 1 mes): ZCBI, CSI, BDI-II, PQ-10 y EUROHIS-QOL8 item index. 2) 48 meses (± 2 meses): ZCBI, CSI, BDI-II, PQ-10 y EUROHIS-QOL8 item index. 34 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 3) 60 meses (± 3 meses): ZCBI, CSI, BDI-II, PQ-10 y EUROHIS-QOL8 item index. 3.3 Controles Se realizarán las siguientes evaluaciones (por el orden mostrado): 1) 24 meses (± 1 mes): MMSE, PD-CRS, prueba del puzzle, NMSS, BDI-II, QUIP-RS, PDSS, NPI, VAS-Pain, VAFS, FOGQ, ADLS, PDQ-39SI, PQ10 y EUROHIS-QOL8 item index. 2) 48 meses (± 2 meses): MMSE, PD-CRS, prueba del puzzle, NMSS, BDI-II, QUIP-RS, PDSS, NPI, VAS-Pain, VAFS, FOGQ, ADLS, PDQ-39SI, PQ10 y EUROHIS-QOL8 item index. 3) 60 meses (± 3 meses): MMSE, PD-CRS, prueba del puzzle, NMSS, BDI-II, QUIP-RS, PDSS, NPI, VAS-Pain, VAFS, FOGQ, ADLS, PDQ-39SI, PQ10 y EUROHIS-QOL8 item index. Los controles (n=100) que realizaron las pruebas complementarias basalmente repetirán los estudios de RM craneal (preferiblemente mismo centro y misma máquina) y determinación de marcadores moleculares (proteína S-100b, TNF-alfa, IL-1, IL-2, IL-6, vitamina B12, ácido metilmalónico, homocisteína, ácido úrico, proteína C reactiva, ferritina y hierro; mismo laboratorio, REFERENCE LABORATORY).* *NOTA: la memoria económica actual no contempla el coste derivado de la repetición de los estudios complementarios. Será preciso obtener financiación para llevar a cabo los mismos. Con el fin de obtener dichos recursos se planteará la posibilidad de presentar el proyecto a diferentes convocatorias de proyectos de investigación. 4. Recursos necesarios de los centros participantes Personal para realizar las evaluaciones (ver punto 2 de material y métodos y figura 1). El tiempo de la primera evaluación (inclusión y evaluación motora) estimado es de 30 minutos a 1 hora (sin contar el tiempo que puede transcurrir entre el OFF y el mejor ON en aquellos pacientes que precisen la evaluación en los dos estados según el protocolo; este tiempo puede ser utilizado para cubrir los datos del cuaderno de recogida de datos, CRD). Estimamos en torno a 2 horas y media la segunda evaluación del paciente (figura 1, 2A) y 30 minutos la del cuidador principal (figura 1, 2B). El tiempo de evaluación del control (figura 1, 2C) (10 por centro) estimado es de unas 2 horas y cuarto. Aquellos centros que participen en la realización de pruebas complementarias deben disponer de la posibilidad de realizar extracciones de sangre para determinación de diferentes marcadores moleculares (proteína S-100b, TNF-alfa, IL-1, IL-2, IL-6, vitamina B12, ácido metilmalónico, homocisteína, ácido úrico, PCR, ferritina y hierro). Las muestras extraídas se enviarán a REFERENCE LABORATORY. En el ANEXO V figura el listado de marcadores y 35 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 el protocolo de extracción. En el apartado de memoria económica se comenta lo relativo al coste de las pruebas. Aquellos centros que participen en la realización de pruebas complementarias deben disponer de la posibilidad de realizar extracciones de sangre para estudios genéticos. Dichas muestras serán enviadas para su conservación y posterior trabajo al laboratorio 104-Trastornos del Movimiento-Instituto de Biomedicina de Sevilla-Hospital Universitario Virgen del Rocío. En el ANEXO VI se describen con detalle los objetivos y el tipo de análisis que se llevará a cabo de las muestras. Aquellos centros que participen en la realización de pruebas complementarias deben disponer de la posibilidad de realizar estudios de RM craneal sin contraste intravenoso (T1 3D mediante protocolos estandarizados que incluya cortes frontales y/o coronales en secuencia T1 a 1.5 T o superior). El estudio de neuroimagen se utilizará para calcular el MTAi (ANEXO VII) y realizar análisis de volumetría (ANEXO VIII). Si un centro no tiene disponibilidad y/o recursos para la realización de pruebas complementarias podrá participar en la evaluación estrictamente clínica de los sujetos (pacientes, cuidadores y controles). 5. Recogida de datos En cada centro participante, se cubrirá una hoja con los datos de los pacientes enumerados (los pacientes que cumpliendo con los criterios de inclusión/exclusión son valorados para el estudio) y el motivo de exclusión de alguno si fuera el caso. Habrá otra hoja con los datos de los controles enumerados y el motivo de exclusión de alguno si fuera el caso. El ANEXO XI muestra un ejemplo del listado (pacientes). Los datos quedarán recogidos en un CRD (Cuaderno de Recogida de Datos, ver ANEXO XII). En cada centro participante quedará archivada (archivo físico) la documentación y/o información de cada sujeto participante (un archivador individual por cada paciente con/sin cuidador y por cada sujeto control): 1) CRD; 2) Cuestionarios y/o escalas; 3) Copia en papel de la determinación de marcadores moleculares; 4) Prueba de imagen (RM craneal); 5) Consentimiento/s informado/s debidamente cumplimentado/s y firmado/s. El ANEXO XII muestra quién debe llevar a cabo la recogida de datos y cumplimiento del CRD (no en todos los datos es imprescindible que lo haga el investigador principal). Cada investigador accederá a una plataforma on-line (con clave) para cubrir el CRD (eCRD). Los datos del e-CRD serán transferidos a una base de datos de un paquete estadístico para poder hacer el análisis. Las imágenes de RM para el cálculo del MTAi serán enviadas por correo electrónico ([email protected]) (en el momento que esté realizada la prueba) al evaluador ciego (MMG), que remitirá los resultados de las variables en cada caso, siendo el investigador de cada centro quien incluya el valor de las variables de imagen en el e-CRD. Las imágenes de RM para estudio volumétrico serán enviadas por correo electrónico al equipo del Dr. Pablo Mir del Hospital Universitario Virgen del Rocío e Instituto de Biomedicina de Sevilla. 36 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 6. Final del estudio La fecha prevista del final de la primera fase (evaluación basal del paciente; periodo de reclutamiento de participantes) es el 31 de agosto de 2016 (16 meses después de la fecha de inicio; fecha estimada de inicio, 1 de mayo de 2015). El periodo de seguimiento de cada sujeto participante (paciente, cuidador o control) es de 60 meses (± 3 meses). El final del seguimiento será por lo tanto no posterior a 63 meses después de la fecha final del periodo de reclutamiento basal. Si se cumplen los plazos previstos, la fecha de fin del estudio (seguimiento) será el 30 de noviembre del año 2021. Estimamos que en el último trimestre del año 2021 se complete el cierre definitivo del estudio (base de datos, etc.). Se contempla no obstante la posibilidad de ampliar la fase de reclutamiento hasta un máximo de 24 meses (sólo en caso exclusivamente necesario y con la finalidad de alcanzar el tamaño muestral necesario). En este supuesto, la fecha final de reclutamiento sería el 1 de mayo de 2017 mientras que la fecha final del seguimiento a 5 años sería el 31 de agosto de 2022. Se contemplaría el cierre definitivo del estudio en el último cuatrimestre del año 2022. 7. Justificación del tamaño muestral Para calcular el tamaño de la muestra hemos tenido en cuenta las siguientes consideraciones: (1) la pérdida de seguimiento de pacientes máxima estimada teniendo en cuenta el tipo de patología, edad, comorbilidades médicas y otros factores es de un 10% al año [82]; estimamos, por lo tanto, una pérdida máxima del 50% de los pacientes al final del seguimiento (5 años); (2) muestras menores a 30 sujetos se consideran pequeñas desde el punto de vista estadístico; (3) se estima que entre un 15 a 20% de los centros involucrados en un estudio multicéntrico pueden abandonar el mismo por diferentes motivos. De esta forma, si reclutamos 800 pacientes con enfermedad de Parkinson, esperaríamos que al final de los 5 años hubiera un mínimo de 400 pacientes a los que se les hubiese realizado de forma completa y correcta el seguimiento. Si abandonan su participación en el estudio un 15% de los centros y estimando una media de 20 pacientes reclutados por centro, se perderían 120 pacientes. Esto supondría un mínimo de 280 pacientes al final del seguimiento. Esta muestra final sería suficiente para incluir hasta 27 variables predictoras en los análisis de regresión múltiple con un poder de 0.8 y una confiabilidad del 95% [83]. Con el número de pacientes que se estiman reclutar a fecha 15 de enero de 2015 (47 centros confirmados, 1.030 pacientes), una muestra final de 280 pacientes supondría una pérdida del 72% de los pacientes al final de los 5 años. Este porcentaje es elevado y entendemos que el estudio podría ser viable con una muestra de más de 600 pacientes. La gran mayoría de los estudios publicados de seguimiento de una cohorte de pacientes con Parkinson presentan un tamaño muestral inferior (ver justificación del estudio). Será prioritario y así se le recalcará al investigador principal, evitar perder pacientes y/o controles que realicen los estudios complementarios. 37 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 8. Análisis estadístico 8.1 Consideraciones generales Los análisis se realizarán en base a los datos disponibles, sin emplear técnicas de sustitución de valores ausentes y describiendo el número de datos que faltan en cada análisis. En todas las pruebas estadísticas realizadas se utilizará un nivel de significación de α = 0,05. Los análisis serán llevados a cabo por un evaluador ciego: Raúl de la Fuente Fernández ([email protected]). En caso de falta de disponibilidad de dicho evaluador, el análisis independiente de los datos será llevado a cabo por otro evaluador ciego. Para determinados análisis puede haber otro/s estadistas que contrasten resultados. 8.2 Análisis descriptivo Se realizará un análisis descriptivo de los datos recogidos en el CRD. Algunos objetivos (por ejemplo, objetivo 4 de la evaluación basal, conocer la prevalencia de los diferentes síntomas no motores en la población de pacientes con Parkinson) requerirán fundamentalmente un análisis descriptivo de los datos. Para las variables continuas se presentarán los datos descriptivos de tendencia central y dispersión: media, desviación estándar, mediana, percentiles 25% y 75% y rango (mínimo-máximo). Para las variables categóricas se presentarán las frecuencias y los porcentajes. 8.3 Análisis bivariante Cuando sea necesario y/o de interés para dar respuesta a los objetivos del estudio u otros contemplados con posterioridad y siempre planteados bajo hipótesis plausibles se evaluará la relación entre variables. Para dos variables categóricas se presentarán tablas de contingencia con la frecuencia en cada categoría y el porcentaje por columnas. Para evaluar la posible asociación se realizarán pruebas de Chi cuadrado o test exacto de Fisher y se presentará el valor de la p resultante. Para variables numéricas definidas como categóricas se presentarán los estadísticos descriptivos por grupos. Para evaluar la posible asociación se realizarán pruebas T-Test, ANOVA o las pruebas no paramétricas de Wilconxon o Kruskal-Wallis y se presentará el valor de la p resultante. Para valorar la relación entre dos variables numéricas continuas se presentará la correlación de Pearson o Spearman así como el valor de la p resultante. 38 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 8.4 Análisis multivariante Cuando sea necesario y/o de interés para dar respuesta a los objetivos del estudio u otros contemplados con posterioridad y siempre planteados bajo hipótesis plausibles se realizarán análisis multivariantes (modelo de regresión logística binaria, regresión lineal múltiple, etc.). Las variables que constituyan cada modelo y la definición del mismo se llevará a cabo antes del análisis correspondiente (modelo constituido “a priori”, con un razonamiento y justificación científica adecuada) como contempla los métodos de buena práctica médica [84]. 8.5 Otros análisis Se realizarán otro tipo de estudios estadísticos en función del requerimiento a criterio del evaluador ciego que realizará el análisis independiente de los datos (por ejemplo, estudio de la variabilidad interobservador e intraobservador del marcador de neuroimagen MTAi). 8.6 Análisis de los objetivos específicos Se llevarán a cabo de acuerdo con lo comentado en los puntos anteriores. La variable principal y tipo de análisis en cada caso será: 1) Objetivos de la evaluación transversal (1 a 12, páginas 20 y 21): i. Objetivo 1: puntuación total en los cuestionarios PDQ39SI (39-item Parkinson’s disease Quality of Life Questionnaire Summary Index), PQ-10 y EUROHISQOL8 item index (variables dependientes; modelos de regresión lineal múltiple). ii. Objetivo 2: puntuación total en los cuestionarios ZCBI (Zarit Caregiver Burden Inventory) y CSI (Caregiver Strain Index) (variables dependientes; modelos de regresión lineal múltiple). Ambas variables de pueden definir como numéricas categóricas (página 32) y ser consideradas como la variable dependiente en un modelo de regresión logística binaria (por ejemplo, factores asociados a un elevado grado de estrés [si vs no]). iii. Objetivo 3: se considerará lapuntuación total en el cuestionario QUIP-RS (Questionnaire for ImpulsiveCompulsive Disorders in Parkinson's Disease-Rating Scale) como la variable dependiente en un modelo de regresión lineal múltiple y en relación con las respuestas al cuestionario consideraremos pacientes con trastorno de control de impulsos (variable dependiente) frente a los 39 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 iv. v. vi. vii. viii. ix. que no (modelo de regresión logística binaria); se podrá realizar el mismo tipo de análisis para cada uno de los diferentes tipos de trastorno de control de impulsos. Objetivo 4: análisis fundamentalmente descriptivo y de asociación comparativo frente al grupo control en el que la variable principal es la puntuación total en el cuestionario NMSS (Non-Motor Symptoms Scale). Se realizará un análisis por dominios e ítems. Objetivo 5: análisis descriptivo (tipos de dolor, ver CRD) y de asociación comparativo entre pacientes con enfermedad de Parkinson y dolor frente a aquellos sin dolor; se comparará frente al grupo control y se analizará los factores asociados a presencia de dolor (relacionado con la enfermedad) en un modelo de regresión logística binario (dolor relacionado con la enfermedad como variable dependiente). Objetivo 6: tipo de trastorno del estado de ánimo (depresión mayor vs depresión menor vs depresión subclínica vs sin trastorno) como variable principal (análisis descriptivo, estudios de asociación y modelo de regresión). Objetivo 7: fenotipo parkinsoniano (tremórico vs trastorno con afectación predominantemente postural y de la marcha vs indeterminado) como variable principal (análisis descriptivo, estudios de asociación y modelo de regresión). Objetivo 8: asimetría del parkinsonismo (asimétrico derecho o izquierdo leve a moderado vs marcado vs simérico) como variable principal. Se realizarán análisis bivariantes y multivariantes para conocer la asociación con otras variables (clínicas, moleculares y de neuroimagen) bajo hipótesis plausibles. Objetivo 9: valor (las unidades dependerán del marcador en concreto) de diferentes marcadores moleculares en sangre (proteína S-100b, TNF-alfa, IL-1, IL-2, IL-6, vitamina B12, ácido metilmalónico, homocisteína, ácido úrico, proteína C reactiva, ferritina y hierro). Se realizarán análisis bivariantes y multivariantes para conocer la asociación con otras variables (clínicas y de neuroimagen) bajo hipótesis plausibles. 40 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 x. xi. Objetivo 11: valor del marcador de neuroimagen MTAi (Medial Temporal Atrophy Index). Se realizarán análisis de correlación con otras variables bajo hipótesis plausibles (por ejemplo, con la puntuación total en el cuestionario PD-CRS y algunos de sus dominios como memoria verbal diferida). Objetivo 12: se definirán las variables a estudio y se realizarán los análisis pertinentes bajo hipótesis plausibles. 2) Objetivos del seguimiento prospectivo (13 a 16, página 20): i. Objetivo 13: hospitalización aguda (no programada) durante el año posterior a la evaluación basal (si vs no; variable dependiente; modelo de regresión logística binaria). ii. Objetivo 14: desarrollo de complicaciones motoras (en el subgrupo inicial sin ellas) a los 48 meses posteriores a la evaluación basal (si vs no; variable dependiente; modelo de regresión logística binaria). iii. Objetivo 15: desarrollo de demencia (según criterios de la Movement Disorder Society) a los 24, 48 y 60 meses posteriores a la evaluación basal (si vs no; variables dependientes; modelo de regresión logística binaria). iv. Objetivo 16: éxitus a los 24 y 60 meses posteriores a la evaluación basal (si vs no; variable dependiente; modelo de regresión logística binaria). 3) Objetivos de una evaluación final a los 60 meses (incluyendo estudios complementarios): se realizarán los estudios estadísticos pertinentes para comparar la evolución de las diferentes variables analizadas. 41 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 CONSIDERACIONES ÉTICO-LEGALES DEL ESTUDIO La participación de todo paciente, cuidador y control será voluntaria. Deberá obtenerse el consentimiento informado firmado de todos los participantes. El desarrollo del proyecto se realizará respetando las Normas de Buena Práctica Clínica, los principios éticos fundamentales establecidos en la Declaración de Helsinki y el Convenio de Oviedo, así como los requisitos establecidos en la legislación española en el ámbito de la investigación. De acuerdo con los principios éticos para las investigaciones médicas en seres humanos de la “Declaración de Helsinki de la Asociación Médica Mundial”, todos los participantes tendrán derecho al final de la investigación de ser informados sobre sus resultados y compartir cualquier beneficio y/o perjuicio. Igualmente, el médico deberá informar al paciente de los aspectos de la atención que tienen relación con la investigación. En relación con las muestra biológicas y de neuroimagen, toda la información referente a la identidad de los pacientes será considerada confidencial a todos los efectos y se tratará conforme establece la Ley Orgánica 15/1999 de 13 de diciembre (de “Protección de Datos de Carácter Personal”) y en el marco de la Ley 14/2007, de 7 de julio (“de Investigación Biomédica”). Evaluación beneficio-riesgo para los sujetos de investigación Los sujetos incluidos en el estudio no serán sometidos a ningún procedimiento experimental. Por ello, la participación no entraña ningún riesgo adicional. Los principales riesgos son los derivados de la obtención y gestión de datos personales, la obtención de muestras de sangre, impacto de los resultados genéticos, hallazgos genéticos de significado incierto o no buscados y los derivados de la realización de un estudio de RM craneal (prácticamente nulos). Se contempla un seguro de responsabilidad civil para aquellos sujetos que realicen estudios complementarios. Consentimiento informado y hoja de información a los participantes Entendemos que al obtener el consentimiento informado, el médico debe poner especial cuidado cuando el sujeto esté vinculado a él por una relación médico-paciente previa y así se especifica en la Declaración de Helsinki. El sujeto del estudio será informado por su neurólogo de la posibilidad de participar en este estudio, pero deberá otorgar su consentimiento después de haber entendido, mediante una entrevista, los objetivos del estudio, sus riesgos e inconvenientes, así como las condiciones en las que se llevará a cabo, y después de haber sido informado de su derecho a retirarse del estudio en cualquier momento sin que ello le ocasione perjuicio alguno. Asimismo, se hará constar explícitamente en la documentación facilitada al sujeto participante que podrá revocar su consentimiento en cualquier momento, sin expresión de causa y sin que por ello se derive para el sujeto participante responsabilidad ni perjuicio alguno. El 42 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 consentimiento se documentará mediante una hoja de información para el sujeto y el documento de consentimiento. Estos documentos contendrán únicamente información relevante, expresada en términos claros y comprensibles para los sujetos, y estarán redactados en la lengua propia del sujeto (RD 223/2004). Ver documento adjunto con el documento de consentimiento informado y la hoja de información para el sujeto. Confidencialidad de datos La confidencialidad de datos de cada paciente será respetada en todo momento. Los datos originales serán conservados en los centros participantes y sólo tendrán acceso los investigadores del estudio o personal determinado en caso de inspección por parte de las Autoridades Sanitarias Españolas. Los investigadores participantes en este estudio se comprometen a que todo dato clínico recogido de los sujetos a estudio sea separado de sus datos de identificación personal, asegurando el anonimato de dichos pacientes, respetando la Ley de Protección de Datos de Carácter Personal (Ley Orgánica 15/1999, de 13 de diciembre), la Ley 41/2002, de 14 de noviembre (básica reguladora de la autonomía del paciente y de derechos y obligaciones en materia de información y documentación clínica), así como la Ley 3/2001, de 28 de mayo (reguladora del consentimiento informado y de la historia clínica de los pacientes), la Ley 3/2005, de 7 de marzo, de modificación de la Ley 3/2001 y el Decreto 29/2009 de 5 de febrero, por el que se regula el acceso a la historia clínica electrónica. El investigador será la única persona que puede y debe conocer el origen de los datos recogidos y asociarlos al paciente. Los datos personales de los investigadores (nombre completo, dirección, centro de trabajo, NIF) serán recogidos en un fichero informatizado con la única finalidad de facilitar aquellos aspectos logísticos y de organización necesarios para el desarrollo del estudio. El fichero de datos estará sometido a tratamiento confidencial al amparo de lo que establece la normativa aplicable (L.O. 15/1999) y los investigadores podrán ejercitar los derechos de acceso, rectificación, cancelación y oposición respecto de los datos personales que les hubieren sido recabados. Interferencia con los hábitos de prescripción del médico Ninguna. Debe quedar claro que se trata de un estudio observacional donde el investigador no llevará a cambio ningún tipo de intervención terapeútica sobre el paciente salvo la que considere oportuna en relación con la práctica clínica habitual. En este sentido, es importante resaltar que el investigador principal es el médico evaluador habitual del paciente. Si de la información obtenida por el facultativo de la evaluación de los pacientes éste considerase iniciar algún tipo de tratamiento (por ejemplo, tratamiento con un inhibidor de la acetilcolinesterasa en un paciente evaluado en el que observa deterioro cognitivo), se entenderá su decisión igualmente como derivada de una 43 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 evaluación que podría considerarse habitual y/o recomendable en la práctica clínica diaria. Responsabilidades de los participantes en el estudio 1) Investigador: 1. Comprometerse a llevar a cabo el estudio de acuerdo con lo recogido en el protocolo del mismo. 2. Informar a los sujetos de la investigación y obtener su consentimiento. 3. Recoger, registrar y notificar los datos de forma correcta respondiendo de su actualización y calidad ante las auditorías oportunas. 4. Facilitar la inspección de las autoridades sanitarias, por lo cual se mantendrá la documentación del estudio un mínimo de 5 años después de la presentación del informe final. 5. Saber responder de los objetivos, metodología básica y significado de los resultados del estudio ante la comunidad científica y profesional. 6. Se responsabilizará de que la información registrada en el CRD sea exacta, veraz y de que se haya obtenido de la forma indicada en el protocolo. 7. El investigador será la única persona que puede y debe conocer el origen de los datos recogidos y asociarlos al paciente, siendo responsable de que no figure en el CRD información extra (no reclamada) que pueda identificar al paciente (nombre, DNI/NIF, NASS, CIP, dirección postal, teléfono, etc.). 8. El investigador deberá velar en todo momento por el mejor cuidado posible del paciente, anteponiendo siempre el bienestar y seguridad de los pacientes y de las personas que los atienden. 2) Investigador coordinador: 1. El investigador coordinador deberá cumplir todas las obligaciones (punto previo) como investigador del estudio. 2. Deberá firmar el protocolo y cualquier modificación del mismo junto con el promotor. 3. Será co-responsable junto con el promotor en la elaboración de los informes de seguimiento e informes finales. 4. Contribuirá a difundir los resultados del estudio en colaboración con el promotor. 5. Se comprometerá a no firmar ningún contrato que contenga cláusulas de secreto sobre eventuales resultados del estudio ni compromiso a no difundir los hallazgos de la investigación, evitando en todo caso poner en riesgo la integridad del estudio. 44 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 3) Promotor: 1. Será responsable de velar por el cumplimiento de las normas legales pertinentes. 2. Firmará con el investigador coordinador el protocolo y cualquier modificación del mismo. 3. Suministrará a los investigadores el protocolo del estudio. 4. Remitirá el protocolo al CEIC. 5. Presentará el protocolo del estudio y los informes de seguimiento y final, en los plazos establecidos y comunicará, en su caso, la interrupción y las razones de la misma. 6. Entregará copia del protocolo y de los documentos que acrediten el seguimiento de los procedimientos establecidos a los responsables de las entidades proveedoras de servicios de atención a la salud donde se vaya a realizar el estudio. 7. Identificará las fuentes de financiación del estudio. Pólizas de seguro Para los pacientes que no sean sometidos a la realización de pruebas complementarias (extracción de sangre para determinación de marcadores moleculares, extracción de sangre para estudios genéticos y estudio de RM craneal sin contraste) no se concertará seguro u otra garantía financiera que cubra los daños y perjuicios que como consecuencia del estudio puedan resultar para la persona en que hubiera de realizarse porque se considera que las intervenciones a las que serán sometidos los sujetos por su participación en el estudio suponen un riesgo equivalente al que correspondería a su atención en la práctica clínica habitual. Si se concertará un seguro para aquellos pacientes que sean sometidos a la realización de pruebas complementarias (extracción de sangre para determinación de marcadores moleculares, extracción de sangre para estudios genéticos y estudio de RM craneal sin contraste) que cubra los daños y perjuicios que potencialmente aunque muy poco probables puedan acontecer derivados de las mismas. Comité Ético de Investigación Clínica (CEIC) / Comité Ético Independiente (CEI) El protocolo, el formulario de consentimiento informado y el resto de información para los pacientes, serán revisados por un Comité Ético de Investigación Clínica (CEIC) / Comité Ético Independiente (CEI). En este caso, será evaluado inicialmente por el Comité Autonómico de Ética de Investigación (CAEI) de Galicia y en el caso de aprobación será pertinente la misma posteriormente en el CEIC correspondiente a cada centro participante. Cualquier modificación del protocolo, que no sean cambios administrativos, necesitará de una enmienda al protocolo que ha de ser aprobada por el CAEI de Galicia. Los cambios de dirección del estudio sin enmiendas serán consideradas violaciones del 45 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 protocolo. Las violaciones pueden conducir a la descalificación de un centro para continuar participando en el estudio. 46 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 CONSIDERACIONES PRÁCTICAS DEL ESTUDIO 1. Plan de trabajo 1) Reclutamiento de investigadores El promotor seleccionará a los investigadores en función de su capacidad para cumplimentar satisfactoriamente con el protocolo del estudio. La página 13 detalla los centros que podrán participar. Con el propósito de (1) conseguir seleccionar una muestra de pacientes lo más representativa posible del ámbito nacional, (2) alcanzar un mayor tamaño muestral y (3) ser justo a la hora de ofrecer la posibilidad de participar (en un proyecto de envergadura no realizado en España con anterioridad) a aquellos neurólogos con competencia e interés en el proyecto, se envió (11/07/14) una invitación personal por correo electrónico a todos los neurólogos que forman parte del Grupo de Trastornos del Movimiento de la Sociedad Española de Neurología (SEN), con el correspondiente aval y apoyo del Comité Científico de la SEN. A fecha 15 de enero de 2015, 47 centros han confirmado su participación (ver ANEXO I). El proyecto fue presentado en la LXVI Reunión Anual de la Sociedad Española de Neurología que tuvo lugar en Valencia los días 18 al 22 de noviembre de 2014. Es posible que nuevos centros se puedan incorporar al listado de participantes. 2) Reclutamiento de participantes (pacientes, cuidadores y controles) Para evitar sesgos de selección, cada investigador participante incluirá todos aquellos pacientes con diagnóstico de enfermedad de Parkinson, cuidadores y controles que cumplan con los criterios de in/exclusión (páginas 23 y 24) evaluados consecutivamente en las consultas de la práctica clínica diaria programada para cada investigador en su centro a partir de la fecha de inicio del reclutamiento (1/05/2015). Aunque el reclutamiento es consecutivo, los pacientes se programarán (fecha y hora) para la evaluación según conveniencia y/o disponibilidad de ambas partes (paciente y/o familiar e investigador) y de acuerdo con el protocolo establecido. El número mínimo de sujetos a reclutar será de 15 pacientes y 10 controles por centro. No habrá número máximo. Tras obtener el consentimiento informado del sujeto participante se procederá a registrar todos los datos necesarios en el CRD. 3) Plan de visitas El ANEXO XIII muestra una tabla resumen sobre la evaluación a realizar en cada visita: 1) Basal; 2) 12 meses; 3) 24 meses; 4) 36 meses; 5) 48 meses; 6) 60 meses. 2. Procedimientos de comunicación de reacciones adversas De acuerdo con la legislación vigente, el médico investigador evaluador de cada paciente será el responsable de comunicar las posibles reacciones adversas graves o inesperadas 47 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 que se puedan producir durante el estudio al correspondiente Centro Regional de Farmacovigilancia, utilizando para ello la Tarjeta Amarilla del Sistema Español de Farmacovigilancia del mismo modo que suele hacerse en la práctica habitual. 3. Registro de datos y conservación de documentos El investigador deberá completar todos los datos reclamados en el CRD siguiendo las pautas descritas para su correcta cumplimentación y transmitir los datos según los procedimientos indicados por el promotor al inicio del estudio. Los datos de los pacientes recogidos en el CRD durante el estudio deberán documentarse de manera anónima (el paciente sólo será identificado por un número asignado). Cada investigador guardará durante un periodo mínimo de 5 años los documentos fuente originales indispensables para las inspecciones de las autoridades sanitarias. 4. Informe final Al finalizar el estudio se realizará un informe final de resultados que será enviado al CEIC que haya evaluado el estudio y a la AEMPS. Durante el mismo, si fuera preciso por ser reclamado se enviaría un informe/s de seguimiento al CEIC y la AEMPS. 5. Difusión de los resultados Todos los investigadores participantes figurarán en las publicaciones y/o comunicaciones a congresos. Todo participante y autor de una comunicación o publicación recibirá el documento para poder revisarlo y sugerir cambios antes del envío oficial a un congreso o editor de una revista. En caso de ser preciso por haber un número de autores elevado, se crearía un consorcio con todos los participantes. Figurarán como primeros autores los responsables de la elaboración de cada artículo y aquellos investigadores que hayan incluido más pacientes. El proceso de publicación se realizará como sigue: Se nombra un responsable y/o responsables de la elaboración de cada artículo. Se nombra un comité que revisará cada artículo. Se envía esa revisión a todos los participantes en el estudio para que sugieran los cambios que crean oportunos. Publicación. Se redactará y firmará un Memorandum of Understunding (MOA). 48 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 CALENDARIO DEL ESTUDIO 1. Trámites previos a la puesta en marcha i. Envío del proyecto para evaluación al Comité Autonómico de Ética de Investigación (CAEI) de Galicia: octubre de 2014. ii. Aprobación estimada por el CAEI de Galicia: último trimestre de 2014. iii. Envío del proyecto para evaluación por la Agencia Española del Medicamento y Productos Sanitarios (AEMPS): último trimestre de 2014. iv. Registro por la AEMPS: último trimestre de 2014. v. Tramitación y puesta en marcha en todos los centros: primer trimestre del 2015. vi. Inicio del reclutamiento de pacientes: 1 de mayo de 2015. 2. Primera evaluación (evaluación transversal): 1 de mayo de 2015 a 31 de agosto de 2016. 3. Revisión de base de datos: septiembre-octubre de 2016. 4. Análisis estadístico (objetivos propuestos): último trimestre de 2016. 5. Comunicación y publicación de trabajos (objetivos 1 a 12 de la evaluación transversal –excepto el 10– y otros sub-análisis): años 2017 a 2019. 6. Objetivos del seguimiento prospectivo de la cohorte: a partir del 2018. NOTA: Se contempla no obstante la posibilidad de ampliar la fase de reclutamiento hasta un máximo de 24 meses (sólo en caso exclusivamente necesario y con la finalidad de alcanzar el tamaño muestral necesario). En este supuesto, la fecha final de reclutamiento sería el 1 de mayo de 2017 mientras que la fecha final del seguimiento a 5 años sería el 31 de agosto de 2022. Se contemplaría el cierre definitivo del estudio en el último cuatrimestre del año 2022. El calendario previsto de la producción científica se vería modificado en relación con dichos cambios. Finalmente, se contempla la posibilidad de que la fecha de inicio de reclutamiento se retrase con respecto a la prevista debido a demora en los trámites burocrátricos y/o de otro tipo justificables, produciéndose en el presente caso cambios en las fechas posteriores en relación con la fecha de inicio final. 49 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 REFERENCIAS BIBLIOGRÁFICAS 1. Olanow CW, Obeso JA. The significance of defining preclinical or prodromal Parkinson´s disease. Mov Disord 2012;27:666-9. 2. Tolosa E, Gaig C, Santamaría J, Compta Y. Diagnosis and the premotor phase of Parkinson´s disease. Neurology 2009;72 (Suppl 7):S12-20. 3. Jankovic J. Parkinson's disease: clinical features and diagnosis. J Neurol Neurosurg Psychiatry 2008;79:368-76. 4. Goldman JG, Postuma R. Premotor and non motor features of Parkinson´s disease. Curr Opin Neurol 2014;27:431-44. 5. Chaudhuri KR, Rizos A, Sethi KD. Motor and nonmotor complications in Parkinson's disease: an argument for continuous drug delivery? J Neural Transm 2013;120:1305-20. 6. Martinez-Martin P, Rodriguez-Blazquez C, Kurtis MM, Chaudhuri KR; NMSS Validation Group. The impact of non-motor symptoms on health-related quality of life of patients with Parkinson's disease. Mov Disord 2011;26:399-406. 7. Li H, Zhang M, Chen L, et al. Nonmotor symptoms are independently associated with impaired health-related quality of life in Chinese patients with Parkinson's disease. Mov Disord 2010;25:2740-6. 8. Honig H, Antonini A, Martinez-Martin P, et al. Intrajejunal levodopa infusion in Parkinson's disease: a pilot multicenter study of effects on nonmotor symptoms and 9. 10. 11. 12. 13. 14. 15. quality of life. Mov Disord 2009;24:1468-74. Seppi K, Weintraub D, Coelho M, et al. The Movement Disorder Society EvidenceBased Medicine Review Update: Treatments for the non-motorsymptoms of Parkinson's disease. Mov Disord 2011;26 (Suppl 3):S42-80. Lawson RA, Yarnall AJ, Duncan GW, et al. Severity of mild cognitive impairment in early Parkinson's disease contributes to poorer quality of life.Parkinsonism Relat Disord 2014 (epub ahead of print). Oguh O, Kwasny M, Carter J, Stell B, Simuni T. Caregiver strain in Parkinson's disease: National Parkinson Foundation Quality Initiative Study. Parkinsonism Relat Disord 2013;19:975-9. Tan SB, Williams AF, Kelly D. Effectiveness of multidisciplinary interventions to improve the quality of life for people with Parkinson's disease: a systematic review. Int J Nurs Stud 2014;51:166-74. Adler CH, Beach TG, Hentz JG, et al. Lowclinicaldiagnosticaccuracy of earlyvs advanced Parkinson disease: Clinicopathologic study. Neurology 2014;83:406-12. McGhee DJ, Royle PL, Thompson PA, Wright DE, Zajicek JP, Counsell CE. A systematic review of biomarkers for disease progression in Parkinson's disease. BMC Neurol 2013;13:35. doi: 10.1186/1471-2377-13-35. Biomarkers Definitions Working Group. Biomarkers and surrogate endpoints: preferred definitions and conceptual framework. Clin Pharmacol Ther 2001;13:89-95. 50 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 16. Brooks DJ, Frey KA, Marek KL, et al. Assessment of neuroimaging techniques as biomarkers of the progression of Parkinson's disease. Exp Neurol 2003;184 (Suppl 1):S68-79. 17. Katzenschlager R, Head J, Schrag A, Ben-Shlomo Y, Evans A, Lees AJ; Parkinson's Disease Research Group of the United Kingdom. Fourteen-year final report of the randomized PDRG-UK trial comparing three initial treatments in PD. Neurology 2008;71:474-80. 18. Hely MA, Morris JGL, Reid WGJ, Trafficante R. Sydney Multicentre Study of Parkinson´s disease: non-levodopa responsive problems dominate at 15 years. Mov Disord 2005;20:190-9. 19. PD MED Collaborative Group. Long-term effectiveness of dopamine agonists and monoamine oxidase B inhibitors compared with levodopa as initial treatment for Parkinson's disease (PD MED): a large, open-label, pragmatic randomised trial. Lancet 2014 (epub ahead of print). 20. Zhu K, van Hilten JJ, Marinus J. Predictors of dementia in Parkinson's disease; findings from a 5-year prospective study using the SCOPA-COG. Parkinsonism Relat Disord 2014 (epub ahead of print). 21. Stewart T, Liu C, Ginghina C, et al; Parkinson Study Group DATATOP Investigators. Cerebrospinal fluid α-synuclein predicts cognitive decline in Parkinson disease progression in the DATATOP cohort. Am J Pathol 2014;184:966-75. 22. Balzer-Geldsetzer M, Costa AS, Kronenbürger M, et al. Parkinson's disease and dementia: a longitudinal study (DEMPARK). Neuroepidemiology 2011;37:168-76. 23. Tsai ST, Hung HY, Hsieh TC, Lin SH, Lin SZ, Chen SY. Long-term outcome of young onset Parkinson's disease after subthalamic stimulation--a cross-sectional study. Clin Neurol Neurosurg 2013;115:2082-7. 24. Merola A, Zibetti M, Angrisano S, et al. Parkinson's disease progression at 30 years: a study of subthalamic deep brain-stimulated patients. Brain 2011;134:2074-84. 25. Pedersen KF, Larsen JP, Tysnes OB, Alves G. Prognosis of mild cognitive impairment in early Parkinson disease: the Norwegian ParkWest study. JAMA Neurol 2013;70:5806. 26. Hiorth YH, Larsen JP, Lode K, Pedersen KF. Natural history of falls in a populationbased cohort of patients with Parkinson's disease: An 8-year prospective study. Parkinsonism Relat Disord 2014 (epub ahead of print). 27. Bugalho P, Viana-Baptista M. REM sleep behavior disorder and motor dysfunction in Parkinson's disease--a longitudinal study. Parkinsonism Relat Disord 2013;19:1084-7. 28. Williams-Gray CH, Mason SL, Evans JR, et al. The CamPaIGN study of Parkinson's disease: 10-year outlook in an incident population-based cohort. J Neurol Neurosurg Psychiatry 2013;84:1258-64. 29. Zhu K, van Hilten JJ, Putter H, Marinus J. Risk factors for hallucinations in Parkinson's disease: results from a large prospective cohort study. Mov Disord 2013;28:755-62. 51 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 30. Clark AJ, Ritz B, Prescott E, Rod NH. Psychosocial risk factors, pre-motor symptoms and first-time hospitalization with Parkinson's disease: a prospective cohort study. Eur J Neurol 2013;20:1113-20. 31. Winder-Rhodes SE, Evans JR, Ban M, et al. Glucocerebrosidase mutations influence the natural history of Parkinson's disease in a community-based incident cohort. Brain 2013;136:392-9. 32. Kasten M, Hagenah J, Graf J, et al. Cohort Profile: a population-based cohort to study non-motor symptoms in parkinsonism (EPIPARK). Int J Epidemiol 2013;42:128-128k. 33. Auyeung M, Tsoi TH, Mok V, et al. Ten year survival and outcomes in a prospective cohort of new onset Chinese Parkinson's disease patients. J Neurol Neurosurg Psychiatry. 2012;83:607-11. 34. Chen YY, Cheng PY, Wu SL, Lai CH. Parkinson's disease and risk of hip fracture: an 8-year follow-up study in Taiwan. Parkinsonism Relat Disord 2012;18:506-9. 35. Velseboer DC, Broeders M, Post B, et al; CARPA Study Group. Prognostic factors of motor impairment, disability, and quality of life in newly diagnosed PD. Neurology 2013;80:627-33. 36. Parkinson Progression Marker Initiative. The Parkinson Progression Marker Initiative (PPMI). Prog Neurobiol 2011;95:629-35. 37. Paulsen JS, Long JD, Johnson HJ, et al. Clinical and Biomarker Changes in Premanifest Huntington Disease Show Trial Feasibility: A Decade of the PREDICT-HD Study. Front Aging Neurosci 2014;6:78. doi: 10.3389/fnagi.2014.00078. 38. Daniel SE, Lees AJ. Parkinson's Disease Society Brain Bank, London: overview and research. J Neural Transm Suppl 1993;39:165-72. 39. Sathe K, Maetzler W, Lang JD, et al. S100B is increased in Parkinson's disease and ablation protects against MPTP-induced toxicity through the RAGE and TNF-α pathway. Brain 2012;135(Pt 11):3336-47. 40. Schaf DV, Tort AB, Fricke D, et al. S100B and NSE serum levels in patients with Parkinson's disease. Parkinsonism Relat Disord 2005;11:39-43. 41. Lindqvist D, Kaufman E, Brundin L, Hall S, Surova Y, Hansson O. Non-motor symptoms in patients with Parkinson's disease - correlations with inflammatory cytokines in serum. PLoS One 2012;7:e47387. 42. Reale M, Iarlori C, Thomas A, et al. Peripheral cytokines profile in Parkinson’s disease. Brain Behav Immun 2009;23:55–63. 43. Zhang L, Yan J, Xu Y, et al. The combination of homocysteine and C-reactive protein predicts the outcomes of Chinese patients with Parkinson's disease and vascular parkinsonism.PLoS One 2011;6:e19333. 44. Zoccolella S, dell'Aquila C, Abruzzese G, et al.Hyperhomocysteinemia in levodopatreated patients with Parkinson's disease dementia. Mov Disord 2009;24:1028-33. 45. Madenci G, Bilen S, Arli B, Saka M, Ak F. Serum iron, vitamin B12 and folic acid levels in Parkinson´s disease. Neurochem Res 2012;37:1436-41. 52 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 46. Dufek M, Hamanová M, Lokaj J, et al. Serum inflammatory biomarkers in Parkinson's disease.Parkinsonism Relat Disord 2009;15:318-20. 47. Jesus S, Pérez I, Cáceres-Redondo MT, et al. Low serum uric acid concentration in Parkinson's disease in southern Spain. Eur J Neurol 2013;20:208-10. 48. Association of serum uric acid levels with the progression of Parkinson's disease in Chinese patients. Chin Med J (Engl) 2012;125:583-7. 49. Farhoudi M, Taheraghdam A, Farid GA, et al. Serum iron and ferritin level in idiopathic Parkinson´s disease. Park J Biol Sci 2012;15:1094-7. 50. Menéndez-González M, López-Muñiz A, Vega J, Arias-Carrión O. MTA index: a simple 2D-method for assessing atrophy of the medial temporal lobe using clinically available neuroimaging. Front Aging Neurosci 2014;6:23. 51. Menéndez-González M, Martínez-Rivera M, Álvarez-Avellón T, López-Muñiz A, Vega JA. The Medial Temporal Atrophy Index (MTAI) correlates with memory in Parkinson´s disease without dementia. Poster Presentation, XX WFN World Congress on Parkinson´s Disease and Related Disorders, 8-11 de Diciembre de 2013, Ginebra, Suiza. 52. Brück A, Kurki T, Kaasinen V, Vahlberg T, Rinne JO. Hippocampal and prefrontal atrophy in patients with early non-demented Parkinson’s disease is related to cognitive impairment. J Neurol Neurosurg Psychiatry 2004;75:1467–9. 53. Ibarretxe-Bilbao N, Junque C, Marti MJ, Tolosa E. Brain structural MRI correlates of cognitive dysfunctions in Parkinson’s disease. J Neurol Sci 2011;310:70–4. 54. Lee JE, Cho KH, Song SK, et al. Exploratory analysis of neuropsychological and neuroanatomical correlates of progressive mild cognitive impairment in Parkinson’s disease. J Neurol Neurosurg Psychiatry 2014;85:7–16. 55. Dubois B, Burn D, Goetz C, et al. Diagnostic procedures for Parkinson's disease dementia: recommendations from the movement disorder society task force. Mov Disord 2007;22:2314-24. 56. Martinez Martin P, Arroyo S, Rojo-Abuin JM, Rodrigues-Blazquez C, Frades B, de Pedro Cuesta J, the Longitudinal Parkinson’s disease Patients Study Group. Burden, perceived health status, and mood among caregivers of Parkinson’s disease patients. Mov Disord 2008;23:1673-80. 57. Folstein MF, Folstein SE, McHugh PR. "Mini-mental state". A practical method for grading the cognitive state of patients for the clinician. J Psychiatr Res 1975;12:189-98. 58. Fanhn S, Elton RL, Members of the UPDRS Development Committee. Unified Parkinson´s Disease Rating Scale. In: Fahn S, Marsden CD, Calne DB, Goldstein M, editors. Recent developments in Parkinson´s disease, Vol 2. Florham Park, NJ: Macmillan Health Care Information;1987.p-153-64. 59. Langston JW, Widner H, Goetz CG, Brooks D, Fahn S, Freeman T, Watts R. Core assessment program for intracerebral transplantations (CAPIT). Mov Disord 1992;7:213. 53 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 60. Tomlinson CL, Stowe R, Patel S, Rick C, Gray R, Clarke CE. Systematic review of levodopa dose equivalency reporting in Parkinson's disease. Mov Disord 2010;25:264953. 61. Hoehn MM, Yahr MD. Parkinsonism: onset, progression and mortality. Neurology 1967;17:427-42. 62. Jankovic J, McDermott M, Carter J, et al. Variable expression of Parkinson's disease: a base-line analysis of the DATATOP cohort. The Parkinson Study Group. Neurology 1990;40:1529-34. 63. Stebbins GT, Goetz CG, Burn DJ, Jankovic J, Khoo TK, Tilley BC. How to identify tremor dominant and postural instability/gait difficulty groups with the movement disorder society unified Parkinson's disease rating scale: comparison with the unified Parkinson's disease rating scale. Mov Disord 2013;28:668-70. 64. Pagonabarraga J, Kulisevsky J, Llebaria G, García-Sánchez C, Pascual-Sedano B, Gironell A. Parkinson's disease-cognitive rating scale: a new cognitive scale specific for Parkinson's disease. Mov Disord 2008;23:998-1005. 65. Richarson JTE, Vecchi T. A jigsaw-puzzle imagery tasl for assessing active visuoespacial processes in old and young people. Behav Res Methods Instruments Comput 2002;34:69-82. 66. Chaudhuri KR, Martinez-Martin P, Brown RG et al. The metric properties of a novel non-motor symptoms scale for Parkinson's disease: Results from an international pilot study. Mov Disord 2007;22:1901-11. 67. Beck AT, Steer RA, Brown GK, Beck Depression Inventory-second edition. Manual, 1996; San Antonio: The Psychological Corporation. 68. Weintraub D, Hoops S, Shea JA, et al. Validation of the questionnaire for impulsivecompulsive disorders in Parkinson's disease. Mov Disord 2009;24:1461-7. 69. Chaudhuri KR, Pal S, DiMarco A, et al. The Parkinson's disease sleep scale: a new instrument for assessing sleep and nocturnal disability in Parkinson's disease. J Neurol Neurosurg Psychiatry 2002;73:629-35. 70. Cummings JL, Mega M, Gray K, Rosenberg-Thompson S, Carusi DA, Gornbein J. The Neuropsychiatric Inventory: comprehensive assessment of psychopathology in dementia. Neurology 1994;44:2308-14. 71. Burckhardt CS, Jones KD. Adult measures of pain: The McGill Pain Questionnaire (MPQ), Rheumatoid Arthritis Pain Scale (RAPS), Short Form McGill Pain Questionnaire (SF-MPQ), Verbal Descriptive Scale (VDS), Visual Analog Scale (VAS), and West Haven-Yale Multidisciplinary Pain Inventory (WHYMPI). Arthritis Rheum 2003;49:S96-104. 72. Tseng BY, Gajewski BJ, Kluding PM. Reliability, responsiveness, and validity of the visual analog fatigue scale to measure exertion fatigue in people with chronic stroke: a preliminary study. Stroke Res Treat 2010. Pii:412964. 54 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 73. Giladi N, Shabtai H, Simon ES, Biran S, Tal J, Korczyn AD. Construction of freezing of gait questionnaire for patients with Parkinsonism. Parkinsonism Relat Disord 2000;6:165-170. 74. Schwab RS, England AC. In Third Symposium on Parkinson´s disease. E. And S. Livingstone: Edinburgh 1969;152-7. 75. Jenkinson C, Fitzpatrick R, Peto V, Greenhall R, Hyman N. The Parkinson´s Disease Questionnaire (PDQ-39): development and validation of a Parkinson´s disease summary index score. Age Ageing 1997;26:353-7. 76. Santos García D, de la Fuente-Fernández R. Impact of non-motor symptoms on healthrelated and perceived quality of life in Parkinson's disease. J Neurol Sci 2013;332:13640. 77. Da Rocha NS, Power MJ, Bushnell DM, Fleck MP. The EUROHIS-QOL 8-item index: comparative psychometric properties to its parent WHOQOL-BREF. Value Health 2012;15:449-57. 78. Novak M, Guest C. Application of a multidimensional caregiver burden inventory. Gerontol 1989;29:798-803. 79. Santos-García D, Añón MJ, Fuster-Sanjurjo L, de la Fuente-Fernández R. Duodenal levodopa/carbidopa infusion therapy in patients with advanced Parkinson's disease leads to improvement in caregivers' stress and burden. Eur J Neurol 2012;19:1261-5. 80. Robinson BC. Validation of a Caregiver Strain Index. J Gerontol 1983;38:344-8. 81. Litvan I, Goldman JG, Tröster AI, et al. Diagnosticcriteria for mild cognitive impairment in Parkinson'sdisease: Movement Disorder Society Task Force guidelines. Mov Disord 2012;27:349-56. 82. Cervantes-Arriaga A, Rodríguez-Violante M, Zúñiga-Ramírez C, et al. Protocolo de estudio de una cohorte multicéntrica de pacientes mexicanos con enfermedad de Parkinson para evaluar los determinantes motores, no motores y genéticos sobre la progresión. Arch Neurocien Mex 2012;17:159-64. 83. Tabachnick BG, Fidell LS: Multiple regression New York; Harper Collins College Publications. 1996. 84. Cohen J, Cohen P. Applied multiple regression/correlation analysis for the behavioral sciences. Second edition. Hillsdale, New Jersey: Lawrence Erlbaum, 1983. 85. Rothermundt M, Peters M, Prehn JH, Arolt V. S100B in brain damage and neurodegeneration. Microsc Res Tech 2003;60:614-32. 86. Wu DC, Jackson-Lewis V, Vila M, et al. Blockade of microgial activation is neuroprotective in the 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine mouse model of Parkinson´s disease. J Neurosci 2002;22:1763-71. 87. Basta G, Lazzerini C, Massaro M, et al. Advanced glycation end products activate endothelium thought signal-transduction receptor RAGE: a mechanism for amplification of inflammatory responses. Circulation 2002;105:816-22. 88. Nagatsu T, Mogi M, Ichinose H, Togari A. Changes in cytokines and neurotrophins in Parkinson´s disease. J Neural Transm Suppl 2000;60:277-90. 55 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 89. Sawada H, Oeda T, Umemura A, et al. Subclinical elevation of plasma C-reactive protein and illusions/hallucinations in subjects with Parkinson´s disease: case-control study. PLoS One 2014;9:e85886. 90. Zoccolella S, dell´Aquilla C, Abruzzese G, et al. Hyperhomocysteinemia in levodopatreated patients with Parkinson´s disease dementia. Mov Disord 2009;24:1028-33. 91. Rogers JD, Sánchez-Saffon A, Frol AB, Díaz-Arrastia R. Elevated plasma homocysteine levels in patients treated with levodopa: association with vascular disease. Arch Neurol 2003;60:59-64. 92. Toth C, Breithaupt K, Ge S, et al. Levodopa, methylmalonic acid, and neuropathy in idiopathic Parkinson´s disease. Ann Neurol 2010;68:28-36. 93. Schwarzschild MA, Schwid SR, Marek K, et al. Serum urate as a predictor of clinical and radiographic progression in Parkinson disease. Arch Neurol 2008;65:716-23. 94. Sian-Hülsmann J, Mandel S, Youdim MB, Riederer P. The relevance of iron in the pathogenesis of Parkinson's disease. J Neurochem 2011;118:939-57. 95. Madenci G, Bilen S, Arli B, Saka M, Ak F. Serum iron, vitamin B12 and folic acid levels in Parkinson's disease. Neurochem Res 2012;37:1436-41. 96. Menéndez-González M, Martínez Rivera M, López-Muñiz A, Vega JA. MTL index: a simple new method for measuring atrophy of the medial temporal lobe using clinically available neuroimaging. AAIC Conference, Vancouver 2012. Published in Alzheimer's and Dementia. 97. Menéndez-González M, Martínez-Rivera M, Álvarez-Avellón T, López-Muñiz A, Vega JA. The Medial Temporal Atrophy index (MTAi) is a simple and reliable method for predicting conversion from Mild Cognitive Impairment to Alzheimer’s disease. AAIC Conference, Boston 2013. 98. Snijders AH, Leunissen I, Bakker M, et al. Gait-related cerebral alterations in patients with Parkinson’s disease with freezing of gait. Brain 2011;134:59–72. 99. Kostic VS, Agosta F, Pievani M, et al. Pattern of brain tissue loss associated with freezing of gait in Parkinson disease. Neurology 2012;78:409–16. 100. Tessitore A, Amboni M, Cirillo G, et al. Regional gray matter atrophy in patients with Parkinson disease and freezing of gait AJNR Am J Neuroradiol 2012;33:1804-9. 101. Herman T, Rosenberg-Katz K, Jacob Y, Giladi N, Hausdorff, JM. Gray matter atrophy and freezing of gait in Parkinson's disease: Is the evidence black-on-white? Mov Disord 2014;29:134-9. 102. Ibarretxe-Bilbao N, Junque C, Marti MJ, Tolosa E. Cerebral basis of visual hallucinations in Parkinson’s disease: structural and functional MRI studies. J. Neurol Sci 2011;310:79–81. 103. Watanabe H, Senda J, Kato S, et al. Cortical and subcortical brain atrophy in Parkinson’s disease with visual hallucination. Mov Disord 2013;28:1732-6. 104. Rosenberg-Katz K, Herman T, Jacob Y, et al. Gray matter atrophy distinguishes between Parkinson disease motor subtypes. Neurology 2013;80:1476-84. 56 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 105. Rosenberg-Katz K, Herman T, Jacob Y, et al. White matter hyperintensities in Parkinson’s disease: Do they explain the disparity between the postural instability gait difficulty and tremor dominants subtypes? Plos One 2013:8:e55193. 106. Deoni SC, Williams SC, Jezzard P, Suckling J, Murphy DG, Jones DK. Standardized structural magnetic resonance imaging in multicentre studies using quantitative T1 and T2 imaging at 1.5 T. Neuroimage 2008;40:662-71. 107. Jovicich J, Marizzoni M, Sala-Llonch R, et al. Brain morphometry reproducibility in multi-center 3 T MRI studies: A comparison of cross-sectional and longitudinal segmentations. Neuroimage 2013;83:472–84. 108. Ecker C, Suckling J, Deoni SC, et al. Brain Anatomy and Its Relationship to Behavior in Adults With Autism Spectrum Disorder. Arch Gen Psychiatry 2012;9:195209. 109. Ecker C, Ronan L, Feng Y, et al. Intrinsic gray-matter connectivity of the brain in adults with autism spectrum disorder. Proc. Natl. Acad. Sci. U.S.A. 2013;110:13222– 7. 110. Cubo E, Martín PM, Martin-Gonzalez JA, Rodríguez-Blázquez C, Kulisevsky J; ELEP Group Members. Motor laterality asymmetry and nonmotor symptoms in Parkinson's disease.Mov Disord 2010;25:70-5. 111. American Psychiatric Association. DSM-IV-TR. Manual diagnóstico y estadístico de los trastornos mentales IV. Barcelona: Masson 2003. 112. Judd LL, Rapaport MH, Paulus MP, Brown JL. Subsyndromal symptomatic depression: a new mood disorder? J Clin Psychiatry 1994;55(Suppl):18-28. 113. Ford B. Pain in Parkinson´s disease. Mov Disord 2010;25(Suppl1):S98-103. 57 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 PIE DE FIGURAS Figura 1. Periodo de reclutamiento: del 1 de mayo de 2015 al 31 de agosto de 2016 (evaluación basal de cada sujeto participante). 1A, proceso de inclusión de los pacientes y evaluación motora por parte del investigador principal (neurólogo experto en trastornos del movimiento y enfermedad de Parkinson); 2A, evaluación no motora por parte del investigador principal, enfermera especializada, psicólogo o becario con formación/capacitación adecuada; 2B, evaluación del cuidador; 2C, evaluación del control. * Sólo los pacientes con fluctuaciones motoras (UPDRS-IV) y/o que realicen pruebas complementarias (aunque no tengan fluctuaciones) serán evaluados en estado OFF-medicación y ON-medicación; el resto serán evaluados sólo en estado ON-medicación. Se almacenarán muestras de sangre de la evaluación basal de cara a poder testar otros marcadores futuros no contemplados en este momento en el proyecto. Figura 2. Seguimiento de la cohorte de pacientes (A), cuidadores (B) y controles (C). Al final del seguimiento, los pacientes (n=300) y controles (n=100) que realizaron pruebas complementarias basalmente repetirán las mismas (marcadores moleculares y estudio de imagen). Abreviaturas ADLS, Schwab & England Activities of Daily Living Scale; BDI, Beck Depression Inventory; CSI, Caregiver Strain Index; FOGQ, Freezing of Gait Questionnaire; HY, Hoenh and Yahr; NMSS, Non-Motor Symptoms Scale; NPI, Neuropsychiatric Inventory; PD-CRS, Parkinson´s Disease Cognitive Rating Scale; PDQ-39SI, Parkinson´s disease Quality of Life Questionnaire Summary Index; QUIP-RS, Questionnaire for Impulsive-Compulsive Disorders in Parkinson's Disease-Rating Scale; PDSS, Parkinson´s Disease Sleep Scale; UPDRS, Unified Parkinson´s Disease Rating Scale; VAFS, Visual Analog Fatigue Scale; VAS-Pain, Visual Analog ScalePain; ZCBI, Zarit Caregiver Burden Inventory. 58 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 ANEXO I. CENTROS E INVESTIGADORES CONFIRMADO SU PARTICIPACIÓN. Investigador principal; centro participante del IP 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. 23. 24. 25. 26. 27. 28. 29. 30. 31. 32. 33. 34. 35. 36. 37. 38. 39. 40. 41. 42. 43. 44. 45. 46. 47. Diego Santos García; Sección de Neurología, Hospital Arquitecto Marcide, Complejo Hospitalario Universitario de Ferrol (CHUF). (1) Oriol de Fábregues-Boixar Nebot y (2) Jorge Hernández Vara; Unidad de Trastornos del Movimiento, Servicio de Neurología, Hospital Universitario Vall d´Hebron. Carmen Borrue Fernández; Unidad de Trastornos del Movimiento, Servicio de Neurología, Hospital Infanta Sofía. Pablo Mir Rivera; Unidad de Trastornos del Movimiento, Servicio de Neurología y Neurofisiología Clínica, Instituto de Biomedicina de Sevilla, Hospital Universitario Virgen del Rocío, CSIC y Universidad de Sevilla. Fina Martí Domenech; Unidad de Parkinson y Trastornos del Movimiento, Servicio de Neurología, Instituto Clínico de Neurociencias, Hospital Clínic. Miquel Aguilar Barberá; Unidad de Trastornos del Movimiento, Hospital Universitario Mutua de Terrasa. Beatriz Tijero Merino; Unidad de Neurología Funcional y Enfermedad de Parkinson, Hospital de Cruces. José Chacón Peña; Unidad de Neurología, Hospital Infanta Luisa. (1) Manuel Seijo Martínez e (2) Iria Cabo López; Sección de Neurología, Hospital de Pontevedra. Víctor Puente Périz; Unidad de Trastornos del Movimiento, Servicio de Neurología, Hospital del Mar. Inés Legarda Ramiréz; Servicio de Neurología, Hospital Universitario Son Espases. Francisco Carrillo Padilla; Servicio de Neurología, Hospital Universitario de Canarias, San Cristóbal de la Laguna. Lydia López Manzanares; Unidad de Trastornos del Movimiento, Servicio de Neurología, Hospital La Princesa. Caridad Valero Merino; Unidad de Neurología, Hospital Arnau de Vilanova. Jaime Kulisevsky Bojarski; Unidad de Trastornos del Movimiento, Servicio de Neurología, Hospital de Sant Pau. Jose Manuel García Moreno; Unidad de Trastornos del Movimiento, Hospital Universitario Virgen Macarena. Benito Galeano Bilbao; Sección de Neurología, Hospital Universitario de Ceuta. Nuria Caballol Pons; Unidad de Trastornos del Movimiento, Consorci Sanitari Integral, Hospital Moisés Broggi. Mari Cruz Rodríguez Oroz; Hospital Universitario Donostia, Instituto de Investigación Biodonostia. María Iciar Gastón Zubimendi; Unidad de Trastornos del Movimiento, Servicio de Neurología, Complejo Hospitalario de Navarra. Pilar Sánchez Alonso; Servicio de Neurología, Hospital Puerta de Hierro. Esther Cubo Delgado; Servicio de Neurología, Complejo Asistencial Universitario de Burgos. Lydia Vela Desojo; Unidad de Neurología, Fundación Hospital de Alcorcón. Maria José Catalán Alonso; Unidad de Trastornos del Movimiento, Servicio de Neurología, Hospital Clínico San Carlos. Luis Manuel López Díaz; Sección de Neurología, Hospital de Burela. Maria Gema Alonso Losada; Servicio de Neurología, Hospital Meixoeiro, Complejo Hospitalario Universitario de Vigo (CHUVI). Nuria López Ariztegui; Unidad de Trastornos del Movimiento, Complejo Hospitalario de Toledo. Mónica Kurtis Urra; Unidad de Trastornos del Movimiento, Servicio de Neurología, Hospital Ruber Internacional. Jon Infante Ceberio; Unidad de Trastornos del Movimiento, Servicio de Neurología, Hospital Universitario Marqués de Valdecilla. Sonia Escalante Arroyo; Servicio de Neurología, Hospital de Tortosa Verge de la Cinta (HTVC). Juan Carlos Martínez Castrillo; Unidad de Trastornos del Movimiento, Servicio de Neurología, Hospital Ramón y Cajal. José Matías Arbelo González; Unidad de Trastornos del Movimiento y enfermedad de Parkinson, Servicio de Neurología, Hospital Universitario Insular de Gran Canaria. René Ribacoba Montero; Unidad de Trastornos del Movimiento, Servicio de Neurología, Hospital Central de Asturias. Jessica González Ardura; Servicio de Neurología, Hospital Universitario Lucus Augusti (HULA). Javier López del Val; Unidad de Trastornos del Movimiento, Servicio de Neurología, Hospital Clínico Universitario Lozano Blesa. María Asunción Ávila Rivera; Unidad de Trastornos del Movimiento, Consorci Sanitari Integral, Hospital General de L´Hospitalet. Hortensia Alonso Navarro; Sección de Neurología, Hospital Universitario del Sureste, Madrid. Carlos García Sancho; Servicio de Neurología, Complejo Hospitalario Universitario de A Coruña (CHUAC). Josefina Martínez Simón; Unidad de Trastornos del Movimiento, Servicio de Neurología, Complejo Universitario de Granada. Olga Carmona Codina; Servicio de Neurología, Hospital Josep Trueta y Parc Martí i Juliá, Girona. Juan García Caldentey; Unidad de Neurología, Hospital Quirón Palmaplanas. Ana Rojo Sebastián; Unidad de Parkinson y Movimientos Anormales, Servicio de Neurología, Hospital Universitario Príncipe de Asturias. Silvia Martí Martínez; Servicio de Neurología, Hospital General de Alicante. José Andrés Domínguez Morán; Unidad de Neurología, Hospital de la Rivera. Irene Martínez Torres; Unidad de Trastornos del Movimiento, Servicio de Neurología, Hospital La Fe. María Álvarez Sauco; Servicio de Neurología, Hospital General Universitario de Elche. Cristina Prieto Jurczynska; Unidad de Trastornos del Movimiento, Hospital Infanta Elena-Hospital Rey Juan Carlos-Hospital Collado Villalba, Madrid. QUE HAN Ciudad Pacientes (n) Controles (n) Ferrol (A Coruña) 60 10 Estudios complementarios SI Barcelona 60 (40/20) 20 (10/10) n.e. Madrid 50 10 SI Sevilla 40 10 SI Barcelona 40 10 NO Barcelona Bilbao Sevilla Pontevedra Barcelona Palma de Mallorca Santa Cruz de Tenerife 40 35-40 30-35 30 (15/15) 25-30 25 25 10 10 10 20 (10/10) 10 10 10 SI SI SI n.e. SI SI SI Madrid 25 10 SI Valencia Barcelona 20-25 20 10 10 NO NO Sevilla 20 10 SI Ceuta Sant Joan Despí (Barcelona) San Sebastián Pamplona 20-25 20 10 10 SI SI 20 20 10 10 SI NO Madrid Burgos Alcorcón (Madrid) Madrid 15-25 15 15 15 10 10 10 10 SI SI SI SI Burela (Lugo) Vigo (Pontevedra) 15 15 10 10 NO SI Toledo Madrid 15 15 10 10 SI SI Santander 15 10 SI Tortosa (Tarragona) Madrid 15 15 10 10 SI SI Las Palmas de Gran Canaria Oviedo 15 10 SI n.e. 10 n.e. Lugo Zaragoza 15 15 10 10 SI SI L´Hospitalet de Llobregat (Barcelona) Madrid A Coruña 15 10 SI 15 n.e. 10 10 SI n.e. Granada 15 10 n.e. Girona Palma de Mallorca Alcalá de Henares (Madrid) 15 15 15 10 10 10 n.e. NO SI Alicante Alcira (Valencia) Valencia Elche (Alicante) Madrid 15 15 n.e. 15 15 10 10 10 10 10 NO SI n.e. NO NO 1.030 490 31 SI 59 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 A fecha 15 de enero de 2015, 47 centros han confirmado su participación. Los investigadores han sido ordenados de acuerdo con el número de pacientes que han estimado reclutar (antes a mayor número). En caso de igual número, figura antes el que confirmó su participación más tempranamente. El número mínimo (asumiendo el mínimo de reclutamiento de 15 pacientes en aquellos centros que no especifican y el mínimo de pacientes en aquellos que dan un rango) estimado de pacientes y controles que se reclutarán es de 1.030 y 490, respectivamente. Con respecto a los estudios complementarios, se estima realizar en 20 centros estudios complementarios a 15 pacientes y 5 controles (300 pacientes y 100 controles). En el caso de los controles, se realizaría el estudio de RM a 3 varores y 2 mujeres en cada centro (en total 100 controles, 60 varones y 40 mujeres). De esta forma, participando al menos 20 centros en esta parte del estudio (pruebas complementarias) se alcanzaría el objetivo propuesto (300 pacientes y 100 controles), realizándose 20 estudios en cada uno (400 estudios en total). Significado de los datos en la columna de “estudios complementarios”: SI, centro que sí podría participar en la parte de pruebas complementarias; NO, centro que no puede participar en la parte de pruebas complementarias; n.e., no especificado. NOTA: En algunos centros (centros 2 y 9) hay más de un investigador principal. 60 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 ANEXO II. CÁLCULO DE LA DOSIS EQUIVALENTE DIARIA DE LEVODOPA. A continuación se muestra cómo calcular la dosis equivalente diaria de levodopa para diferentes tratamientos dopaminérgicos [60]. Tratamiento Dosis en mg (ejemplo) Factor de conversión Dosis-LD-equivalente (mg) LD de liberación inmediata 400 (100, 1-1-1-1) x1 400 LD de liberación retardada Entacapone (o Stalevo®) 200 (100, 1-0-0-0-0-1) 600 (Stalevo® 200, 1-1-1) x 0,75 LD x 0,33 150 198 (total, 198 + 600 = 798) Tolcapone Pramipexol 600 (200, 1-1-1) 3.15 (2.01 + 1.05) LD x 0,5 x 100 300 315 Ropinirol Rotigotina 24 16 x 20 x 30 480 480 Selegilina 10 (5, 1-1-0) x10 100 1 200 (100, 1-1-0) x 100 x1 100 200 Rasagilina Amantadina Ejemplo: Paciente que recibe diariamente la siguiente medicación (figuran nombres comerciales para que resulte más práctico): Stalevo® 200 (200 levodopa/50 carbidopa/200 entacapone) 1-1-1, Amantadine® 100 1-1-0, Neupro® 16 mg/día, Azilect® 1-0-0 y un comprimido de Sinemet retard® (200 levodopa/50 carbidopa) a las 23 horas. El cálculo sería: [200 x 3 (levodopa)] + [600 x 0,33 (entacapone)] + [200 x 100 (amantadine)] + [16 x 30 (rotigotina)] + [1 x 100 (rasagilina)] + [200 x 0,75 (levodopa retardada)] = 600 + 198 + 200 + 480 + 100 + 150 = 1.728 equivalentes de levodopa (mg/día). 61 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 ANEXO III. DEFINICIÓN DEL FENOTIPO PARKINSONIANO ATENDIENDO A LA UPDRS. Se calculará con los datos del paciente en estado OFF medicación si el paciente presenta fluctuaciones motoras (de acuerdo con la UPDRS-IV interrogada por el investigador principal) y en estado ON medicación si el paciente no presenta fluctuaciones motoras (en teoría, estado motor no cambiante). Se trata de un cociente entre el componente definido como “TD, tremor disease score” y “PIGD, postural instability/gait difficulty score” [62,63]. Se precisa de los ítems 16 (temblor) de la UPDRS-II (2.16) y 20 y 21 de la UPDRS-III (3.20 y 30.21, incluyendo todas las partes, cara, extremidades superiores, inferiores y tanto de reposo como de acción) para el cálculo del numerador, TD. Se precisa de los ítems 13 (caídas), 14 (bloqueos) y 15 (marcha) de la UPDRS-II (2.13, 2.14 y 2.15) y 29 (marcha) y 30 (estabilidad postural) de la UPDRS-III (3.29 y 3.30) para el cálculo del denominador, PIGD. El cociente será: TD (media de los 8 ítems) / PIGD (media de los 5 ítems). Los resultados posibles serán: 1) TD / PIGD ≥ 1.5: Fenotipo TD (tremórico). 2) TD / PIGD ≤ 1: Fenotipo PIGD. 3) TD / PIGD > 1 pero < 1.5: Fenotipo indeterminado. 62 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 ANEXO IV. PROTOCOLO DE LA PRUEBA DE RESOLUCIÓN DEL PUZZLE. Se utilizará el puzzle de la marca EDUCA “2 SUPER PUZZLES DISNEY MICKEY MOUSE CLUBHOUSE; EDUCA BORRAS, S. A., 2013” que le será proporcionado a cada investigador conjuntamente con el resto del material del estudio. Antes de empezar, debemos asegurarnos de que el paciente está cómodo y en condiciones adecuadas para resolver el puzzle. Le explicaremos en qué consiste la prueba incluyendo que el objetivo es intentar resolver el puzzle en el menor tiempo posible así como que le vamos a cronometrar y contabilizar las piezas correctamente colocadas. Utilizaremos sólo el puzzle de la imagen superior (tres personajes de Disney con las frutas) separando por lo tanto las piezas del otro puzzle que viene en la caja (que no esté ni visible ni disponible). Antes de empezar, las piezas estarán dentro de la caja sin la tapa puesta. Moveremos las mismas de forma aleatoria. La tapa estará colocada al lado con la imagen del puzzle a resolver perfectamente visible (de la forma mejor para el sujeto). Contaremos el tiempo total en resolver el puzzle así como el número de piezas colocadas correctamente (todas, incluyendo dos juntas correctamente unidas y separadas del resto) al minuto, 2 minutos, 3 minutos, 4 minutos y 5 minutos. Se detiene la prueba cuando se resuelve el puzzle o si han pasado los 5 minutos y no se ha resuelto. Se cubrirán los datos pertinentes de la prueba en el CRD (ver ANEXO XII). 63 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 ANEXO V. PROTOCOLO DE LA DETERMINACIÓN MARCADORES MOLECULARES EN SANGRE. DE El paciente y/o control acudirá en ayunas a realizar el análisis de sangre. El tiempo entre su extracción y la evaluación motora/inclusión no deberá ser superior a 3 meses. En caso de proceso infeccioso y/o inflamatorio (fiebre, gripe, catarro, inflamación articular, etc.) deberá esperarse a que pase dicho proceso para realizar el análisis. Las muestras (3 tubos de 1 mL de suero y 3 tubos de 1 mL de plasma EDTA) serán enviadas a un centro de análisis clínicos que será común para todos los centros: REFERENCE LABORATORY(www.reference-laboratory.es). Se obtendrán también muestra de sangre (2 tubos de 1mL de suero y otros 2 tubos de 1 mL de plasma EDTA por cada paciente o control) para congelar y poder analizar en el futuro nuevos marcadores moleculares. El envío de estas muestras se llevará a cabo conjuntamente con el de las muestras de sangre para estudios genéticos (ver ANEXO VI). Se extraerían por lo tanto un total de 10 mL de sangre para marcadores moleculares (6 mL para análisis contemplados y 4 mL para almacenar); el total de sangre extraída por sujeto será de 30 mL ya que otros 20 mL se obtendrán además de los 10 mL explicados para la realización de estudios genéticos (ver siguiente anexo, ANEXO VI). Cada investigador debe contactar con el laboratorio de su centro para coordinar el almacenamiento y envío de las muestras. Dado que enviar cada una de forma individual encarece mucho el proceso, habría dos maneras propuestas: 1) Congelar las muestras y enviarlas todas juntas (un solo envío; las muestra se deben congelar lo antes posible dado que a temperatura de nevera sin congelación el material sería válido sólo de 48 a 72 horas); 2) Se podrían mandar las muestras formando parte del envío rutinario de otras muestras en el caso de ser un centro que trabaje con REFERENCE LABORATORY. El total de muestras estimadas por centro dependerá del número de centros participantes en esta parte del protocolo. Si un centro no puede implicarse en esta parte (ni en la extracción de sangre para estudio genético y/o estudio de neuroimagen) podría participar en la parte estrictamente clínica del proyecto. El total de muestra estimadas es de 400 (300 pacientes y 100 controles). A continuación se muestra cuáles son los diferentes marcadores que se evaluarán: 1) Proteína S-100b. Es una proteína expresada y segregada por los atrocitos que a concentraciones bajas (nanomolar) actúa como un factor neurotrófico que promueve la supervivencia celular pero que a altas concentraciones (micromolar) causa apoptosis mediante acción directa sobre las neuronas y a través de activación de la microglía [85]. Los niveles séricos de la proteína S100b aumentan con la edad y están elevados en diferentes procesos como la 64 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 enfermedad de Alzheimer, demencia frontotemporal, esquizofrenia, traumatismo cerebral o enfermedades inflamatorias [39,85]. Parece que la glía juega un papel importante en el inicio y progresión de la enfermedad de Parkinson y en concreto la proteína S-100b actuaría como una citocina que participa en el inicio del proceso inflamatorio (ratones con parkinsonismo inducido por MPTP presentaron incremento de los niveles de proteína S100b a las 24 horas y la ablación genética de dicha proteína resultó tener un efecto neuroprotector [39,86]) a través de su interacción con el RAGE (receptor for advanced glycation endproducts). La proteína S-100b se ha encontrado en concentraciones más altas en la sustancia nigra y en líquido cefalorraquídeo de pacientes con enfermedad de Parkinson comparado con controles [39]. En sangre no se encontraron diferencias en dos trabajos [39,40] (pacientes frente a controles) pero en uno de ellos [40] niveles séricos más elevados se asociaron con estadios más avanzados de la enfermedad. En relación con el conocimiento existente, la proteína S-100b en sangre podría tener valor como marcador pronóstico y con la evidencia actual tampoco se puede descartar de forma absoluta que no pueda resultar útil de cara al diagnóstico. 2) TNF-alfa, interleucinas 1 (IL-1), 2 (IL-2) y 6 (IL-6) y proteína C reactiva (PCR). Son citocinas que participan en la respuesta proinflamatoria/inflamatoria mediada por el RAGE, que promueve la activación del factor nuclear KB y la expresión de IL-6 y TNF-alfa [87]. La ablación genética de la proteína S-100b no sólo reduce los niveles del RAGE sino también de TNF-alfa y se ha sugerido que la neurodegeneración asociada a la proteína S-100b es a través de la vía RAGE/TNF-alfa [39]. Varios estudios han encontrado valores elevados de TNF-alfa, IL-1, IL-2, IL-4, IL-6, factores de crecimiento (TFG-alfa, TFG-beta1 y TFG-beta2) y reducidos de neurotrofinas como BDNF (factor neurotrófico derivado del cerebro) y NGF (factor de crecimiento del nervio) en regiones dopaminérgicas de la vía nigro-estriada y en líquido cefalorraquídeo ventricular y lumbar de pacientes con enfermedad de Parkinson [88]. Recientemente, Lindqvist et al. [41] observaron niveles séricos más elevados de IL-6 en pacientes con enfermedad de Parkinson que en controles y niveles más elevados de TNFalfa y receptor de la IL-2 (sIL-2R) en aquellos pacientes con puntuaciones más elevadas en escalas de ansiedad y depresión, sugiriendo la participación del proceso inflamatorio en el desarrollo de diferentes síntomas no motores. Por ejemplo, Sawada et al. [89] observaron niveles más elevados de PCR sérica en pacientes con Parkinson y alucinaciones (frente a aquellos sin ellas). 3) Vitamina B12, ácido metilmalónico y homocisteína. La levodopa interfiere en el metabolismo de la vitamina B12 y el tratamiento crónico con levodopa 65 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 puede provocar déficit de B12 e hiperhomocisteinemia [44]. Niveles séricos elevados de homocisteína y ácido metilmalónico podrían constituir un factor y/o marcador de riesgo para el desarrollo de diferentes complicaciones en pacientes con Parkinson crónicamente tratados con levodopa como deterioro cognitivo y/o demencia, enfermedad vascular cerebral y neuropatía periférica [90-92]. 4) Ácido úrico. El ácido úrico tiene un efecto antioxidante a nivel del sistema nervioso central y podría prevenir el daño cerebral inducido por el estrés oxidativo. Se han observado niveles más bajos de ácido úrico en pacientes con enfermedad de Parkinson frente a controles y una reducción de los mismos con la progresión de la enfermedad, sugiriéndose la posibilidad de utilizarlo como biomarcador de progresión [47,48, 93]. 5) Ferritina y hierro. Algunos estudios han sugerido un trastorno del metabolismo del hierro en la enfermedad de Parkinson, encontrando un incremento de los depósitos de hierro en la sustancia nigra de los pacientes [94]. Sin embargo, su posible papel en la patogénesis de la enfermedad no está claro. Tampoco parece claro si el hierro y ferritina séricos (por sí mismo o en relación con otros marcadores) podrían tener valor como marcador diagnóstico y/o pronóstico [49,95]. 66 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 ANEXO VI. ESTUDIO GENÉTICO: OBJETIVOS Y TIPO DE ANÁLISIS. Los estudios genéticos se llevarán a cabo sobre el ADN y el ARN extraídos de los linfocitos de las muestras de sangre periférica obtenida de cada participante en este proyecto. Este material se empleará para: 1. Estudios de perfiles de expresión. 2. Secuenciación del exoma. 3. Estudios de asociación. 4. Análisis exhaustivo de determinados genes. Toma de muestras: Obtendremos de cada sujeto unos 20 mL de sangre que irán repartidos en tres tubos con el fin de obtener ADN, ARN y células blancas. Las muestras de sangre se obtendrán en: 1. Tubos con EDTA (para la obtención del ADN genómico total). 2. Tubos PaxGene (para la obtención del ARN). 3. Tubos con heparina (para la obtención de células blancas). El ADN genómico total y el ARN total se obtendrán utilizando sistemas de purificación automatizados (Maxwell 16 Purification system, de Promega; MaNaPure system, de Roche) y/o manualmente (DNA isolation kit for mammalian blood, de Roche). Las células blancas se obtendrán mediante gradiente de densidad utilizando hiotopaque-1077 (Sigma). El ADN genómico y el ARN así obtenidos se utilizarán en los diversos estudios genéticos mientras que las células blancas se almacenarán como reservorio con el fin de poderlas utilizar en posteriores estudios que requieran la obtención de proteínas o la obtención de más material genético (según las necesidades que se deriven del desarrollo del proyecto). Se establecerá la rutina que se deberá emplear en la adquisición y manejo de las muestras. La información se introducirá en una base de datos informática (utilizando un código elaborado a tal fin) que permitirá la recuperación rápida y sistemática de todos los datos. Toda la información referente a la identidad de los pacientes será considerada confidencial a todos los efectos y se tratará conforme establece la Ley Orgánica 15/1999 de 13 de diciembre (de “Protección de Datos de Carácter Personal”) y en el marco de la Ley 14/2007, de 7 de julio (“de Investigación Biomédica”). La identidad no será revelada ni divulgada excepto cuando sea necesaria para su tratamiento, seguimiento o seguridad. La información obtenida de los sujetos de estudio serán siempre mantenidos en absoluta confidencialidad. Los datos generados no estarán disponibles para otras personas que no sean los investigadores implicados en el trabajo. Todas las personas participantes en el estudio o sus representantes legales (en el caso de que la persona sea mentalmente discapacitada) serán apropiadamente informadas, oralmente y mediante un documento informativo que se le entregará (Anexo VI.1) 67 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 y deberán firmar. Igualmente, deberán firmar un consentimiento que previamente habrá sido aprobada por el comité ético del centro (Anexo VI.2). 1) Estudios de perfiles de expresión El estudio de los perfiles de expresión génica se llevará a cabo mediante el análisis del transcriptoma de cada paciente. Para ello se empleará el GeneChip Human Transcriptome Array 2.0 (Affymetrix). Los datos obtenidos se analizarán mediante el software Affymetrix® Transcriptome Analysis Console (TAC). 2) Secuenciación del exoma La metodología básica será por procedimiento de enriquecimiento del exoma de cada paciente con métodos establecidos como Haloplex o SureSelect (Agilent Technologies). Brevemente, a partir del ADN genómico, éste se fragmenta y se ligan los adaptadores de secuenciación y códigos genéticos identificativos (index o barcotes, uno por muestra) en los fragmentos producidos, obteniendo así la librería de secuenciación. Posteriormente se lleva a cabo un enriquecimiento de la librería. La fracción enriquecida se procesará en un secuenciador masivo. La secuenciación masiva (tanto la secuenciación dirigida de los genes de interés o targeted-sequencing como la del exoma completo) se llevará a cabo en servicios con reconocida experiencia en el empleo de esta técnica. Este servicio incluye la secuenciación de los exomas de interés y el análisis bioinformático de los datos (tipo BaseCaller) que permite cartografiar los resultados frente al correspondiente genoma de referencia con el fin de obtener un listado de SNPs e INDELs (pequeñas inserciones y deleciones) y determinar si un cambio concreto es nuevo o conocido. Además se llevará a cabo un análisis bioinformático más especializado con el fin de detectar la cobertura y localización de posibles deleciones exónicas. Con los datos obtenidos de la secuenciación de cada caso se generará una base de datos. Se establecerán procedimientos de cartografiado de fragmentos, anotación de variantes y catalogación de cambios únicos. Panel de genes (para la secuenciación dirigida de genes de interés o targeted-sequencing): Nos proponemos estudiar aquellos genes que se han descrito en los loci PARK (SNCA, LRRK2, FBXO7, PINK1, PRKN, DJ1, HTRA2, UCHL1, ATP13A2, VPS35, PLA2G6, GIGYF2, EIF4G1) así como el gen GBA (que se ha descrito como un importante factor de susceptibilidad para desarrollar enfermedad de Parkinson). Para ello, llevaremos a cabo la secuenciación de los exones codificantes de todos estos genes así como de sus extremos 5’-UTR y 3’-UTR. Se incluirán todos los exones que den lugar a las distintas isoformas de las proteínas. Además se incluirán los nucleótidos intrónicos adyacentes a ambos extremos de cada uno de los exones. Catalogación de los cambios obtenidos y selección de los SNPs candidatos: Para identificar las variaciones genéticas candidatas a ser específicas de la enfermedad de Parkinson de entre todos nuestros datos de secuenciación del exoma, seleccionaremos los nuevos SNPs no sinónimos, los que afecten al sitio de splicing y aquellas deleciones/inserciones 68 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 pequeñas presentes en pacientes con enfermedad de Parkinson. También seleccionaremos las mutaciones y SNPs conocidos, funcionalmente relevantes. Análisis del efecto de las variaciones encontradas a nivel de función de la proteína y conservación: Con el fin de evaluar o confirmar el papel de las variantes genéticas en la patogénesis de la enfermedad de Parkinson, realizaremos un análisis in silico con el fin de obtener la información sobre su consecuencia a nivel funcional y de conservación. Análisis in silico: La conservación evolutiva de las variaciones se examinará mediante el uso del valor “phyloP” (phyloP score) extraído de la tabla “PhyloP46wayAll” del buscador “UCSC Table” (http://genome.usc.edu/cgi-bin/hgTables). Además, definiremos las diferencias físicoquímicas entre las variaciones utilizando el valor “Grantham”. En caso de SNPs no sinónimos, el efecto patogénico de los cambios de aminoácido sobre la estructura proteica tridimensional y sus consecuencias sobre la función de la proteína se predecirá utilizando los servidores: Polyphen-2 (http://genetics.bwh.harvard.edu.pph2/), MutPred v.1.2 (http://mutpred.mutdb.org/) y Mutation Taster (http://www.mutationtaster.org/). El servidor MutPred se ha diseñado para modelar el efecto de un cambio de aminoácido dentro de una proteína dando la probabilidad de que un cambio sea deletéreo para la función de la proteína; pero además, puede generar también la hipótesis de cómo un cambio de aminoácido afecta a los mecanismos moleculares subyacentes responsables de la patogénesis de la enfermedad. La predicción de los efectos de las variaciones encontradas sobre las señales de splicing se hará utilizando diferentes herramientas: 1. Softberry (http://linux1.softberry.com/berry.phtml). 2. NNSPLICE 0.9 (SPLICE; http://www.fruitfly.org/seq_tools/splice.html). 3. SpliceView (http://zeus2.itb.cnr.it/~webgene/wwwspliceview.html). 4. HSF (http://www.umd.be/HSF/). 5. Skippy (http://research.nhgri.nih.gov/skippy/). 6. The AASsites pipeline (http://genius.embnet.dkfz-heidelberg.de/menu/biounit/openhusar/). 7. FastSNP (http://fastsnp.ibms.sinica.edu.tw/). Como controles de nuestros análisis bioinformáticos incluiremos (en caso de que sea factible) aquellas variaciones previamente descritas como patogénicas. 3) Estudios de asociación en genes candidatos: Con el fin de determinar si las variaciones potencialmente patológicas se presentan con mayor frecuencia en la enfermedad de Parkinson y, por tanto, suponen un factor de riesgo, llevaremos a cabo estudios de asociación. Genotipado de SNPs: 69 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 El genotipaje lo realizaremos mediante: a) Discriminación alélica: utilizando “TaqMan SNP genotyping Assays" (Applied Biosystems, Foster City, USA) in a Light-Cycler 480 (Roche). b) IplexGold con tecnología MassArray (Sequenom): basada en la detección de los productos de la reacción de discriminación alélica mediante MALDI-TOF. Esta estrategia permite genotipar una media de 24 variaciones en cada reacción. Aquellos pacientes con enfermedad de Parkinson que tengan un pariente de primer grado también afecto se utilizarán para identificar variaciones con un efecto neuropatológico sustancial. La segregación de las variaciones se determinará en todos los miembros de la familia disponibles (afectos y no afectos) para confirmar alelos de susceptibilidad y establecer correlaciones genotipo-fenotipo. El estudio de pacientes de enfermedad de Parkinson y los miembros de sus familias sin enfermedad de Parkinson pero quizás portadores de mutaciones genéticas podría dar una información muy importante sobre los estadios tempranos de la enfermedad. Esto podría ayudar a identificar características diagnósticas tempranas, o factores de riesgo, que podrían predisponer a la enfermedad. Además, esto podría revelar potenciales biomarcadores de la enfermedad que fuesen útiles en los estudios clínicos. 4) Análisis exhaustivo de genes. Para llevar a cabo el estudio exhaustivo de un gen determinado (con el fin de determinar/confirmar la presencia de variaciones con una implicación patológica) realizaremos su análisis mediante: - HRM (high resolution meeting) en una LightCycler 480 (Roche). - Secuenciación directa en un analizador genético ABI3500 (Applied Biosystem) en ambas direcciones. - Análisis del ARNm. Para el análisis del ARNm realizaremos una retro-PCR utilizando un kit comercial. El cDNA obtenido se utilizará en la amplificación y cuantificación relativa mediante PCR a tiempo real. Procedimiento en cada centro participante Se realizará la extracción de 20 ml de sangre (3 tubos, descrito en la página 67) a cada sujeto participante para estudios genéticos en los centros participantes en esta parte del protocolo. Se almacenarán las muestras congeladas en cada centro hasta realizar un único envío de todas las muestras juntas en hielo al laboratorio 104-Trastornos del Movimiento-Instituto de Biomedicina de Sevilla-Hospital Universitario Virgen del Rocío (Biobanco del Sistema Sanitario Público de Andalucía). Dichas muestras se almacenarían a la espera de poder conseguir financiación para su posterior análisis (unos 600 euros por muestra). Se realizará también la extracción de otros 2 tubos de 1mL de suero y 2 tubos de 1 mL de plasma EDTA a cada sujeto participante en los centros participantes en esta parte del protocolo. Dichas muestras serán almacenadas congeladas en cada centro y enviadas 70 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 posteriormente junto con las muestras para estudios genéticos. Dicho material biológico se conservará con el objetivo de poder ser utilizado en el futuro con algún fin (por ejemplo, testar un nuevo marcador sérico no contemplado en el protocolo actual del proyecto). 71 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 ANEXO VII. PROTOCOLO DE REALIZACIÓN DE LA RM CRANEAL. A pesar de los numerosos estudios que confirman la utilidad de la cuantificación de la atrofia de estructuras mediales del lóbulo temporal como un parámetro fiable para el apoyo diagnóstico de la enfermedad de Alzheimer y otras demencias, su uso aún no se ha generalizado en la práctica clínica habitual. Ello es debido a que los métodos descritos hasta el momento carecen de objetividad (escalas visuales) o son demasiado complejos para su uso rutinario (técnicas de volumetría). En la enfermedad de Parkinson varios estudios sugieren que el perfil de deterioro cognitivo difiere en los distintos subtipos de la enfermedad, diferenciándose al menos dos fenotipos diferentes. Uno sería el clásico “disejecutivo” inicialmente descrito como típico de la demencia de la enfermedad de Parkinson (PD-D) por afectación de circuitos córticosubcorticales; y otro de características más “amnésticas” similar al presente en la enfermedad de Alzheimer, por probable afectación del lóbulo temporal medial. De hecho, en los estudios necrópsicos un porcentaje de los pacientes con PD-D presentan neuropatología tipo Alzheimer, con ovillos neurofibrilares y placas neuríticas, además de la neuropatología propia de la enfermedad de Parkinson. El MTAi es un índice que permite estimar fácilmente en un único corte de RM la proporción de atrofia cerebral debida a atrofia de la región medial del lóbulo temporal (hipocampo y circunvolución parahipocampal) en relación con la atrofia cerebral global, representada por la dilatación del sistema ventricular. El protocolo de este método ha sido publicado recientemente en Frontiers in Aging Neuroscience [50] y ha sido probado en varios estudios correlacionando el deterioro cognitivo presente en la enfermedad de Alzheimer y en la enfermedad de Parkinson entre otras [51,96,97]. Actualmente, está en desarrollo un estudio de cooperación para su validación frente a técnicas de volumetría. Metodología MTAi: sobre el corte coronal de RM que pasa a través de la fosa interpeduncular se delimita el contorno del área del hipocampo y circunvolución parahipocampal (B), la región medial temporal –que incluye tanto el hipocampo y circunvolución parahipocampal como el asta temporal del ventrículo lateral y la cisura coroidea– (A) y el área del ventrículo lateral ipsilateral (C). Con estas áreas se calcula el índice que relaciona la diferencia entre el grado de atrofia debida a atrofia de estructuras mediales del lóbulo temporal (A-B) con el grado de atrofia global (C). Obtenemos así un parámetro fielmente indicativo de la proporción de atrofia cerebral debida a atrofia de estructuras mediales del lóbulo temporal en comparación con la debida a atrofia cerebral. MTAi en el estudio COPPADIS-2015: 1) Tipo de RM: es válida una RM de cualquier potencia y no precisa contraste (sin embargo, para poder llevar a cabo estudios de volumetría –ANEXO VIII–, será preciso 72 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 2) 3) 4) 5) 6) 7) un estudio T1 3D mediante protocolos estandarizados que incluya cortes frontales y/o coronales en secuencia T1 a 1.5 T o superior). Se excluirán pacientes con contraindicación para realizar RM craneal (por ejemplo, marcapasos cardiaco). La realización será voluntaria. El tiempo entre la realización de la RM y la evaluación motora-inclusión no deberá ser superior a 6 meses. Seleccionar en la secuencia T1 el corte coronal que pasa por la fosa interpeduncular. Envío de imágenes: para el estudio COPPADIS-2015 se enviará la imagen del corte de RM correspondiente en formato DICOM a la dirección de correo electrónico [email protected]. El fichero de imagen debe venir nombrado con el número de identificación del centro y del sujeto, por ejemplo: 01-03.DICOM. Se realizará un análisis de variabilidad inter e intraobservador. a) Para el análisis intraobservador, le serán remitidas 100 imágenes al evaluador (MMG) en fecha posterior al cierre del periodo de inclusión sin posibilidad de identificación por su parte (todas por un mismo investigador, Diego Santos García, DSG, procedentes de varios centros; evaluación ciega con respecto a los datos calculados por él mismo previamente). b) Para el análisis interobservador, un segundo evaluador (DSG) realizará el análisis del MTAi en 200 de los 400 estudios estimados en una fecha posterior al cierre del periodo de inclusión (evaluación ciega con respecto a los datos calculados por el otro evaluador). Se realizará previamente a esto una formación en la realización de la técnica y estudio comparativo contrastado con conocimiento y discusión por ambas partes de 25 estudios. 73 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 ANEXO VIII. ESTUDIOS MEDIANTE RM CRANEAL. DE VOLUMETRÍA CEREBRAL En la última década, numerosos trabajos han estudiado con RM la atrofia de áreas corticales y subcorticales en la enfermedad de Parkinson mediante el uso de técnicas de volumetría tales como la morfometría basada en vóxeles o técnicas de reconstrucción basadas en superficie. Muchos de estos estudios han evidenciado diferencias en regiones específicas que correlacionan con características clínicas y neuropsicológicas. Más en concreto, a nivel clínico se han indicado diferencias asociadas a la congelación de la marcha [98-101], alucinaciones visuales [102,103] y los subtipos de enfermedad de Parkinson con predominancia de temblor o predominancia de alteración de la marcha e inestabilidad postural [104,105]. Respecto a las características neuropsicológicas, se han reportado numerosos hallazgos de los que destacamos la correlación entre la atrofia en distintas áreas y el deterioro cognitivo y déficits en memoria [53,54]. Métodos: En este estudio multicéntrico se espera realizar ~300 estudios de RM a sujetos con enfermedad de Parkinson y ~100 estudios de RM a sujetos sanos, de los cuales se posee valiosa información clínica, sérica y psicológica. Para llevar a cabo los estudios de asociación entre parámetros volumétricos y las características fenotípicas, se adquirirá la RM craneal con estudio T1 3D mediante protocolos estandarizados que han demostrado una baja variabilidad entre máquinas de distintos fabricantes a 1.5T [106] y 3.0T [107] respectivamente, y que han sido utilizados en estudios con RM multicéntricos precedentes [108,109]. Dicha adquisición nos permitirá realizar un primer estudio con las RM adquiridas a 1.5T, que podrá ser validado en un segundo estudio de replicación con las RM adquiridas a 3.0T. Objetivo/s: Realizar un estudio de volumetría en busca de correlaciones, bajo hipótesis plausibles, entre los parámetros de la neuroimagen y las variables clínicas, neuropsiquiátricas, y en general fisiológicas que se recogen en este estudio. 74 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 ANEXO IX. CRITERIOS DE DETERIORO COGNITIVO LIGERO ASOCIADO A LA ENFERMEDAD DE PARKINSON (PD-MCI). 1. Criterios de inclusión: 1) Diagnóstico de enfermedad de Parkinson según criterios del United Kingdom Parkinson´s Disease Society Brain Bank [38]. 2) Deterioro cognitivo gradual y progresivo en las funciones cognitivas del paciente con el diagnóstico de enfermedad de Parkinson establecido, reportado por el paciente, cuidador o observado por el clínico. 3) Deterioro objetivado en escalas cognitivas (ver punto 3). 4) El deterioro cognitivo no es lo suficientemente significativo como para interferir en la independencia funcional del sujeto para la realización de las actividades básicas de su vida diaria pero si repercuten en otras más complejas. 2. Criterios de exclusión: 1) Diagnóstico de demencia-Parkinson (PD-D) [55] (ver ANEXO X). 2) Otra causa que explique el deterioro cognitivo (delirium, ictus, depresión mayor, trastorno metabólico y/o electrolítico, trauma craneal, efectos adversos de la medicación, etc.). 3) Otra comorbilidad que en opinión del clínico esté produciendo o explicaría el deterioro cognitivo del paciente (deterioro motor severo, ansiedad grave, depresión, somnolencia diurna, psicosis, etc.). 3. Grado de certeza en la posibilidad diagnóstica de PD-MCI: Nivel I (evaluación abreviada): Deterioro en la puntuación de una escala validada para evaluación global cognitiva de pacientes con enfermedad de Parkinson (por ejemplo, PD-CRS) o Deterioro en al menos 2 test cuando una evaluación neuropsicológica reducida es realizada (es decir, la batería incluye menos de 2 test para cada uno de los 5 dominios, (1) atención y memoria de trabajo, (2) funciones ejecutivas, (3) lenguaje, (4) memoria y (5) función visuoespacial, o incluso menos de los 5 dominios son evaluados). Nivel II (evaluación extensa detallada): Se utilizan a menos 2 test para evaluar cada uno de los 5 dominios: (1) atención y memoria de trabajo, (2) funciones ejecutivas, (3) lenguaje, (4) memoria y (5) función visuoespacial. Deterioro en al menos 2 test (ya sea los dos test de un mismo dominio o bien en uno de dos dominios diferentes). El deterioro en los test neuropsicológicos puede ser demostrado mediante: 75 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 Deterioro de 1 a 2 desviaciones estándar en relación con los valores/normas apropiado/as o Deterioro cognitivo demostrado en evaluaciones secuenciales cognitivas o Deterioro significativo en relación con nivel pre-mórbido. 4. Clasificación del tipo de PD-MCI: 1) PD-MCI de un solo dominio (alteración en 2 test correspondientes a un solo dominio, siendo preciso especificar el dominio). 2) PD-MCI multi-dominio (alteración en al menos 1 test de dos dominios o mas, siendo preciso especificar los dominios). El punto 4 será aplicable sólo para evaluaciones extensas en las que se utilicen al menos 2 test por dominio (nivel II). En el presente estudio se utilizará el MMSE (no específico para enfermedad de Parkinson) y la PD-CRS (validada específica para la enfermedad de Parkinson). Definiremos por lo tanto el deterioro cognitivo leve asociado a la enfermedad de Parkinson (MCI-PD) en relación con el nivel I del punto 3 [81]. 76 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 ANEXO X. CRITERIOS DE DEMENCIA-PARKINSON (PD-D). 1. Diagnóstico de enfermedad de Parkinson según criterios del United Kingdom Parkinson´s Disease Society Brain Bank [38]. 2. Desarrollo de la enfermedad de Parkinson antes que los síntomas/problemas cognitivos. 3. MMSE < 26. 4. El deterioro cognitivo del paciente tiene impacto en el normal desempeño de las actividades elementales de su vida diaria (cocinar, conducir, vestirse, aseo, etc.). 5. Realización de forma incorrecta de 2 o más de los siguientes test: 1) Meses del año al revés o resta de 7 en 7 (MMSE). 2) Fluencia verbal o dibujo del test del reloj (PD-CRS). 3) Copia del dibujo de los pentágonos (MMSE). 4) Recuerdo de las 3 palabras (MMSE). 6. Ausencia de depresión mayor. 7. Ausencia de delirio. 8. Ausencia de otra patología y/o posible causa concomitante. Deberán cumplirse los 8 puntos para poder establecer el diagnóstico de probable demencia Parkinson (PD-D) [55]. La presencia de apatía, ánimo depresivo (no depresión mayor), delirios y somnolencia diurna excesiva apoya la sospecha diagnóstica. 77 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 ANEXO XI. LISTADO DE PACIENTES “CONSECUTIVOS” EVALUADOS EN CADA CENTRO. Se incluirán todos los pacientes que fueran evaluados (visita 1) aunque finalmente fuese excluido de su participación, detallando siempre el motivo. Deben figurar los siguientes datos: Siglas, nombre y apellidos, NHC del centro, fecha de evaluación y motivo de exclusión si procediera. En el caso de pacientes excluidos, éstos no contarán para la enumeración del listado (ver ejemplo). 1. DSG, Diego Santos García, 234167, 1/3/2015. 2. MSG, Mariano Santos García, 265438, 2/3/2015; excluido por MMSE ≤ 24. 2. NGR, Narcisa García Rodríguez, 2887731, 10/3/15. 3. … 4. … 5. … 6. ARL, Azucena Rey López, 299775, 15/5/15; excluido por no firmar el consentimiento informado. 6. … 7. … 8. … 9. … 78 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 ANEXO XII. CRD, Cuaderno de Recogida de Datos: variables estimadas que se van a recoger. *NOTA: con intención de facilitar y reducir el tiempo empleado, figuran en azul los datos que debe evaluar y cubrir el investigador principal, en rojo los que podría cubrir un segundo evaluador (enfermera, becario…) con capacidad (ver material y métodos) y en negro cualquiera de los dos. Todo paciente tendrá su archivador con el CRD en papel y las escalas. Para facilitar el cumplimiento de los datos, se podrá cubrir directamente en el eCRD y luego imprimirlo o al revés, como el investigador considere (por ejemplo, es posible que algunas variables sea mejor cubrirlas en papel y luego pasarlo al e-CRD pero por el contrario, para la puntuación de las escalas seguramente compense pasar el dato de la escala al e-CRD directamente e imprimirlo después). ………………………………………………………………………………………………………………. I. VARIABLES DEL PACIENTE. 1. DATOS DE IDENTIFICACIÓN: 1. Número-dato asignado al paciente; ejemplo, paciente 3 del centro 4 del listado: c4.p2. 2. Número asignado al investigador principal del centro; ejemplo, centro 4 del listado: i4. 3. Comunidad Autónoma (donde está el centro participante): 4. Tipo de sujeto: (1) Caso con/sin cuidador vs (2) Control. 2. VARIABLES EPIDEMIOLÓGICAS: 5. Fecha de nacimiento: 6. Edad (en el momento de inclusión y evaluación): 7. Sexo: (1) Varón vs (2) Mujer. 8. Peso (Kgs): 9. Raza: (1) Caucásica vs (2) Negra vs (3) Asiática vs (4) Otra. 10. Nivel cultural: (1) Estudios primarios vs (2) Estudios secundarios vs (3) Universitario. 11. Estado civil: (1) Casado vs (2) Soltero vs (3) Viudo vs (4) Divorciado) vs (5) Otro. 12. Hábitat: (1) Rural (<5.000 hab) vs (2) Semiurbano (5.000-20.000 hab) vs (3) Urbano (>20.000 hab). 13. Forma de vida: (1) Solo vs (2) Con el cónyuge vs (3) Con hijo/a vs (4) Otro. 3. VARIABLES RELACIONADAS CON LA ENFERMEDAD/OTRAS ENFERMEDADES Y ANTECEDENTES: 14. ¿Hay o hubo algún caso de EP en la familia (familiar de primer o segundo grado)? (1) No vs (2) Si. 79 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 15. Fecha del diagnóstico de enfermedad de Parkinson: 16. Tiempo de evolución de enfermedad (desde el inicio de los síntomas; en años): ejemplo, 1 año y 4 meses, 1,33; 2 años y 3 meses, 2,25. 17. Tiempo entre el inicio de los síntomas y el diagnóstico (en meses): 18. Número de tratamientos antiparkinsonianos (en el momento de la evaluación, también para los ítems 18 a 21): 19. Número de tratamientos en total (todos incluyendo los antiparkinsonianos): 20. Número de tratamientos no antiparkinsonianos (todos menos los antiparkinsonianos): 21. Número de pastillas al día para la enfermedad de Parkinson (fármacos antiparkinsonianos): 22. Número de pastillas al día en total (todos los medicamentos): 23. ¿Recibe el paciente levodopa? (1) Si vs (2) No. 24. ¿Recibe el paciente un agonista dopaminérgico? (1) Si vs (2) No. 25. ¿Recibe el paciente un IMAO-B? (1) Si vs (2) No. 26. ¿Recibe el paciente un ICOMT? (1) Si vs (2) No. 27. ¿Recibe el paciente un anticolinérgico? (1) Si vs (2) No. 28. ¿Recibe el paciente amantadina? (1) Si vs (2) No. 29. ¿Qué agonista recibe? (1) Ninguno vs (2) Pramipexol vs (3) Ropinirol vs (4) Rotigotina vs (5) Otro agonista diferente vs (6) Más de un agonista simultáneamente. 30. Tiempo que lleva el paciente con el agonista actual (en años): 31. Tiempo que lleva el paciente con levodopa (en años): 32. ¿Hay documentado en la historia clínica datos de trastorno de control de impulsos previamente? (1) Si vs (2) No. 33. ¿Presenta el paciente historia pre-mórbida (antes de la enfermedad) de conducta sugestiva de trastorno de control de impulsos (juego, sexo, compras, comida, adicción a pastillas o medicamentos, “hobbysm” o “punding”), ya sea reconocida por el paciente o un familiar (entendiendo el trastorno como algo que se salga de lo que podemos considerar normal: persistente, llamativo, invalidante, reconocido por terceras personas, etc.)?: (1) Si vs (2) No. 34. ¿Hay algún familiar de primer grado o segundo grado con trastorno de control de impulsos reconocido? (1) Si vs (2) No. 35. Dosis equivalente diaria de levodopa (mg/día, [60]): 36. Dosis equivalente del agonista y/o agonistas (mg/día, [60]): 37. ¿Recibe el paciente tratamiento antidepresivo? (1) Si vs (2) No. 38. ¿Recibe el paciente tratamiento ansiolítico? (1) Si vs (2) No. 80 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 39. ¿Recibe el paciente tratamiento antipsicótico? (1) Si vs (2) No. 40. ¿Qué antidepresivo recibe? (1) Ninguno vs (2) ISRS vs (3) Dual (ISRSyN) vs (4) Tricíclico vs (5) Heterocíclico vs (6) Otro vs (7) Varios (más de uno de diferente grupo). 41. ¿Qué antipsicótico recibe? (1) Ninguno vs (2) Quetiapina vs (3) Clozapina vs (4) Risperidona vs (5) Otro antipsicótico atípico vs (6) Un antipsicótico clásico vs (7) Varios (más de uno). 42. ¿Recibe el paciente tratamiento analgésico y/o antinflamatorio o de otro tipo (antiepilépticos) para el dolor? (1) Si vs (2) No. 43. ¿Qué analgesia recibe? (1) Antiinflamatorios vs (2) Analgésicos no antiinflamatorios vs (3) Mórficos vs (4) Antiepilépticos vs (5) Varios (dos o más) vs (6) Ninguno. 44. Antecedentes de HTA: (1) Si vs (2) No. 45. Antecedentes de DM: (1) Si vs (2) No. 46. Antecedentes de DLP: (1) Si vs (2) No. 47. Antecedentes de hiperuricemia: (1) Si vs (2) No. 48. Antecedentes de cardiopatía (isquémica, valvular y/o hipertensiva): (1) Si vs (2) No. 49. Antecedentes de arritmia (fibrilación auricular, flutter, otra): (1) Si vs (2) No. 50. Antecedentes de consumo de tabaco: (1) Si vs (2) No vs (3) Exfumador. 51. Número de cigarrillos/día: 52. Antecedentes de consumo de alcohol: (1) Bebedor moderado (< 40 g/día en hombres y 24 g/día en mujeres) vs (2) Bebedor excesivo (más de 40 y 24) vs (3) No bebedor. 53. Presenta el paciente datos clínicos (preguntado de forma específica y dirigida por el neurólogo investigador principal) sugestivos de trastorno del sueño en fase REM: (1) Si vs (2) No. 4. VARIABLES DE LA EVALUACIÓN MOTORA E INCLUSIÓN DEL PACIENTE: 54. Fecha de la evaluación motora e inclusión (firma del consentimiento): 55. Hora de la evaluación motora en OFF (si no es preciso por protocolo, no cubrir; ejemplo, 8:15 horas): 8,15. 56. Puntuación en la UPDRS-III-OFF (si no es preciso por protocolo, no cubrir): 57. Estadio de Hoehn/Yahr-OFF (si no es preciso por protocolo, no cubrir): 58. Hora de la evaluación motora en ON (ejemplo, 10:15 horas): 10,15. 59. Tiempo entre el OFF y el ON (mejor ON) (ejemplo, 1 y 30 minutos): 1,5 (si no es preciso por protocolo, no cubrir). 60. Puntuación en la UPDRS-III-ON: 61. Estadio de Hoehn/Yahr-ON: 81 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 62. Puntuación en la UPDRS-IV: 63. ¿Presenta el paciente complicaciones motoras (fluctuaciones motoras y/o discinesias)? (1) Si vs (2) No. 64. ¿Presenta el paciente fluctuaciones motoras? (1) Si vs (2) No. 65. ¿Presenta el paciente discinesias? (1) Si vs (2) No. 66. Hemicuerpo predominante (ver ANEXO XIV para el cálculo [110]): (1) Derecho leve-moderado vs (2) Derecho marcado vs (3) Izquierdo leve-moderado vs (4) Izquierdo marcado vs (5) Simétrico. 67. Fenotipo predominante (ver ANEXO III para el cálculo) [62]: (1) Tremórico vs (2) PIGD (postural instability and gait disability) vs (3) Indeterminado. 68. Puntuación en el MMSE: 5. VARIABLES DE LA EVALUACIÓN NO MOTORA: 69. Fecha de la evaluación: 70. Hora de la evaluación (inicio de la misma): 71. Tiempo de evaluación (minutos): 72. Tiempo (en días) entre la evaluación motora/inclusión y esta otra evaluación: 73. Puntuación total en la PD-CRS: 74. Puntuación fronto-subcortical en la PD-CRS: 75. Puntuación cortical posterior en la PD-CRS: 76. Puntuación en la PD-CRS-memoria verbal inmediata: 77. Puntuación en la PD-CRS-denominación por confrontación: 78. Puntuación en la PD-CRS-atención mantenida: 79. Puntuación en la PD-CRS-memoria de trabajo: 80. Puntuación en la PD-CRS-dibujo espontáneo de un reloj: 81. Puntuación en la PD-CRS-copia de un reloj: 82. Puntuación en la PD-CRS-memoria verbal diferida: 83. Puntuación en la PD-CRS-fluencia verbal alternante: 84. Puntuación en la PD-CRS-fluencia verbal de acción: 85. ¿Hay deterioro cognitivo [55,81] (ANEXOS IX y X)? (1) No vs (2) Deterioro cognitivo leve vs (3) Demencia. 82 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 86. Tiempo en resolver el puzzle (minutos): ejemplo, 4 minutos y 33 segundos, 4,55. 87. Número de piezas bien colocadas al minuto: 88. Número de piezas bien colocadas a los 2 minutos: 89. Número de piezas bien colocadas a los 3 minutos: 90. Número de piezas bien colocadas a los 4 minutos: 91. Número de piezas bien colocadas a los 5 minutos: 92. ¿Practica el paciente de forma habitual la resolución de puzzles? (1) Si vs (2) No. 93. ¿Tiene el paciente alguna limitación visual que le condicione? (1) Si vs (2) No. 94. Puntuación total en la NMSS (va de 0 a 360): 95. Puntuación total en el ítem 1 (va de 0 a 12): 96. Puntuación total en el ítem 2 (va de 0 a 12): 97. Puntuación total en el dominio 1 (expresado como un porcentaje, va de 0 a 100): 98. Puntuación total en el ítem 3 (va de 0 a 12): 99. Puntuación total en el ítem 4 (va de 0 a 12): 100. Puntuación total en el ítem 5 (va de 0 a 12): 101. Puntuación total en el ítem 6 (va de 0 a 12): 102. Puntuación total en el dominio 2 (expresado como un porcentaje, va de 0 a 100): 103. Puntuación total en el ítem 7 (va de 0 a 12): 104. Puntuación total en el ítem 8 (va de 0 a 12): 105. Puntuación total en el ítem 9 (va de 0 a 12): 106. Puntuación total en el ítem 10 (va de 0 a 12): 107. Puntuación total en el ítem 11 (va de 0 a 12): 108. Puntuación total en el ítem 12 (va de 0 a 12): 109. Puntuación total en el dominio 3 (expresado como un porcentaje, va de 0 a 100): 110. Puntuación total en el ítem 13 (va de 0 a 12): 111. Puntuación total en el ítem 14 (va de 0 a 12): 112. Puntuación total en el ítem 15 (va de 0 a 12): 113. Puntuación total en el dominio 4 (expresado como un porcentaje, va de 0 a 100): 114. Puntuación total en el ítem 16 (va de 0 a 12): 115. Puntuación total en el ítem 17 (va de 0 a 12): 116. Puntuación total en el ítem 18 (va de 0 a 12): 117. Puntuación total en el dominio 5 (expresado como un porcentaje, va de 0 a 100): 83 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 118. Puntuación total en el ítem 19 (va de 0 a 12): 119. Puntuación total en el ítem 20 (va de 0 a 12): 120. Puntuación total en el ítem 21 (va de 0 a 12): 121. Puntuación total en el dominio 6 (expresado como un porcentaje, va de 0 a 100): 122. Puntuación total en el ítem 22 (va de 0 a 12): 123. Puntuación total en el ítem 23 (va de 0 a 12): 124. Puntuación total en el ítem 24 (va de 0 a 12): 125. Puntuación total en el dominio 7 (expresado como un porcentaje, va de 0 a 100): 126. Puntuación total en el ítem 25 (va de 0 a 12): 127. Puntuación total en el ítem 26 (va de 0 a 12): 128. Puntuación total en el dominio 8 (expresado como un porcentaje, va de 0 a 100): 129. Puntuación total en el ítem 27 (va de 0 a 12): 130. Puntuación total en el ítem 28 (va de 0 a 12): 131. Puntuación total en el ítem 29 (va de 0 a 12): 132. Puntuación total en el ítem 30 (va de 0 a 12): 133. Puntuación total en el dominio 9 (expresado como un porcentaje, va de 0 a 100): 134. Puntuación total en el BDI-II (0 a 63): 135. ¿Presenta el paciente sentimientos de tristeza (BDI-II-ítem 1 positivo)? (1) Si vs (2) No. 136. ¿Presenta el paciente anhedonia (BDI-II-ítem 4 positivo)? (1) Si vs (2) No. 137. ¿Presenta el paciente depresión ([111,112], ver ANEXO XV)? (1) Depresión mayor vs (2) Depresión menor vs (3) Depresión subclínica vs (4) No. 138. Puntuación total en el QUIP-RS (0-112): 139. ¿Presenta el paciente un TCI relacionado con el juego? (1) Si vs (2) No. 140. Puntuación en TCI relacionado con el juego (0-16): 141. ¿Presenta el paciente un TCI relacionado con el sexo? (1) Si vs (2) No. 142. Puntuación en TCI relacionado con el sexo (0-16): 143. ¿Presenta el paciente un TCI relacionado con las compras? (1) Si vs (2) No. 144. Puntuación en TCI relacionado con las compras (0-16): 145. ¿Presenta el paciente un TCI relacionado con la comida? (1) Si vs (2) No. 146. Puntuación en TCI relacionado con la comida (0-16): 147. ¿Presenta el paciente un TCI relacionado con el uso de medicación? (1) Si vs (2) No. 84 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 148. Puntuación en TCI relacionado con el uso de medicación (0-16): 149. ¿Presenta el paciente un TCI relacionado con otras conductas (“hobbysm”)? (1) Si vs (2) No. 150. ¿Presenta el paciente un TCI del tipo del “punding”? (1) Si vs (2) No. 151. Puntuación en TCI del tipo del “hobbysm y/o punding” (0-32): 152. ¿Presenta el paciente por tanto un TCI? (1) Si vs (2) No. 153. ¿Cuántos TCIs presenta el paciente?: 154. Puntuación total en la escala de sueño PDSS (0 a 150): 155. Puntuación en la PDSS-ítem 1 (de 0 a 10): 156. Puntuación en la PDSS-ítem 2 (de 0 a 10): 157. Puntuación en la PDSS-ítem 3 (de 0 a 10): 158. Puntuación en la PDSS-ítem 4 (de 0 a 10): 159. Puntuación en la PDSS-ítem 5 (de 0 a 10): 160. Puntuación en la PDSS-ítem 6 (de 0 a 10): 161. Puntuación en la PDSS-ítem 7 (de 0 a 10): 162. Puntuación en la PDSS-ítem 8 (de 0 a 10): 163. Puntuación en la PDSS-ítem 9 (de 0 a 10): 164. Puntuación en la PDSS-ítem 10 (de 0 a 10): 165. Puntuación en la PDSS-ítem 11 (de 0 a 10): 166. Puntuación en la PDSS-ítem 12 (de 0 a 10): 167. Puntuación en la PDSS-ítem 13 (de 0 a 10): 168. Puntuación en la PDSS-ítem 14 (de 0 a 10): 169. Puntuación en la PDSS-ítem 15 (de 0 a 10): 170. Puntuación total en el NPI (0 a 120): 171. Puntuación en el NPI-dominio 1 (delirios, 0 a 12): 172. Puntuación en el NPI-dominio 2 (alucinaciones, 0 a 12): 173. Puntuación en el NPI-dominio 3 (agitación, 0 a 12): 174. Puntuación en el NPI-dominio 4 (depresión-disforia, 0 a 12): 175. Puntuación en el NPI-dominio 5 (ansiedad, 0 a 12): 176. Puntuación en el NPI-dominio 6 (euforia/júbilo, 0 a 12): 177. Puntuación en el NPI-dominio 7 (apatía/indiferencia, 0 a 12): 178. Puntuación en el NPI-dominio 8 (desinhibición, 0 a 12): 85 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 179. Puntuación en el NPI-dominio 9 (irritación/labilidad, 0 a 12): 180. Puntuación en el NPI-dominio 10 (conducta motora sin finalidad, 0 a 12): 181. Puntuación en la VAS-PAIN (0 a 10): 182. ¿El paciente presenta dolor? (1) Si vs (2) No. 183. ¿Cuánto lleva el paciente con dolor? (1) Menos de 3 meses vs (2) Entre 3 meses y 6 meses vs (3) Entre 6 meses y 2 años vs (4) Más de 2 años vs (5) Sin dolor. 184. Tipo de dolor: (1) Neuropático vs (2) Nociceptivo-somático vs (3) Nociceptivo-visceral vs (4) Varios tipos de dolor vs (4) No dolor. 185. ¿Tiene el paciente dolor relacionado con la EP? (1) Si, dolor relacionado con la EP vs (2) Si tiene dolor pero no relacionado con la EP vs (3) No tiene dolor. 186. Tipo de dolor relacionado con la EP [113]: (1) Musculoesquelético vs (2) Distónico vs (3) Acatísico-discinético vs (4) Neuropático-central vs (5) Neuropático-periférico vs (6) Más de uno simultáneamente. 187. ¿Tiene el paciente dolor musculoesquelético? (1) Si vs (2) No. 188. ¿Tiene el paciente dolor distónico? (1) Si vs (2) No. 189. ¿Tiene el paciente dolor acatísico-discinético? (1) Si vs (2) No. 190. ¿Tiene el paciente dolor neuropático-central? (1) Si vs (2) No. 191. ¿Tiene el paciente dolor neuropático-periférico? (1) Si vs (2) No. 192. Puntuación en el FOGQ (0 a 24): 193. ¿Presenta el paciente caídas? (1) Si vs (2) No. 194. En el último mes, ¿cuántas caídas ha presentado? (1) Ninguna vs (2) Una caída vs (3) De 1 a 5 caídas vs (4) Más de 5 caídas. 195. Puntuación en la escala ADLS (0 a 100): 196. Grado de dependencia: (1) Completamente independiente (≥ 80) vs (2) Algo dependiente (51 a 80) vs (3) Más dependiente (≤ 50). 6. VARIABLES DE CALIDAD DE VIDA: 197. Puntuación total en el PDQ-39SI (se expresa como un porcentaje, 0 a 100): 198. Puntuación en el PDQ-39SI-dominio 1 (expresado como un porcentaje, 0 a 100): 199. Puntuación en el PDQ-39SI-dominio 2 (expresado como un porcentaje, 0 a 100): 86 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 200. Puntuación en el PDQ-39SI-dominio 3 (expresado como un porcentaje, 0 a 100): 201. Puntuación en el PDQ-39SI-dominio 4 (expresado como un porcentaje, 0 a 100): 202. Puntuación en el PDQ-39SI-dominio 5 (expresado como un porcentaje, 0 a 100): 203. Puntuación en el PDQ-39SI-dominio 6 (expresado como un porcentaje, 0 a 100): 204. Puntuación en el PDQ-39SI-dominio 7 (expresado como un porcentaje, 0 a 100): 205. Puntuación en el PDQ-39SI-dominio 8 (expresado como un porcentaje, 0 a 100): 206. Puntuación en el PQ-10 (0 a 10): 207. Puntuación total en el EUROHIS-QOL 8-item index: 208. Puntuación en el EUROHIS-QOL 8-item index-item 1: 209. Puntuación en el EUROHIS-QOL 8-item index-item 2: 210. Puntuación en el EUROHIS-QOL 8-item index-item 3: 211. Puntuación en el EUROHIS-QOL 8-item index-item 4: 212. Puntuación en el EUROHIS-QOL 8-item index-item 5: 213. Puntuación en el EUROHIS-QOL 8-item index-item 6: 214. Puntuación en el EUROHIS-QOL 8-item index-item 7: 215. Puntuación en el EUROHIS-QOL 8-item index-item 8: 7. VARIABLES SÉRICAS-MOLECULARES (ANÁLISIS DE SANGRE): 216. Fecha de la extracción de la determinación: 217. Días entre la evaluación motora-inclusión y esta determinación: 218. Niveles de proteína S-100b: 219. Niveles de TNF-alfa: 220. Niveles de IL-1: 221. Niveles de IL-2: 222. Niveles de IL-6: 223. Niveles de VB12: 224. Niveles de ácido metilmalónico: 225. Niveles de homocisteína: 226. Niveles de PCR (proteína C reactiva): 227. Niveles de ácido úrico: 228. Niveles de ferritina: 229. Niveles de hierro: 87 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 8. VARIABLES DE NEUROIMAGEN: 230. Fecha de la realización de la RM: 231. Días entre la evaluación motora-inclusión y la realización de la RM: 232. Valor del MTAi (Medial Temporal Atrophy Index): 233. Valor de A (media ambos lados): 234. Valor de B (media ambos lados): 235. Valor de C (media ambos lados): 236. Valor del MTAi-derecho: 237. Valor de A-derecho: 238. Valor de B-derecho: 239. Valor de C-derecho: 240. Valor del MTAi-izquierdo: 241. Valor de A-izquierdo: 242. Valor de B-izquierdo: 243. Valor de C-izquierdo: 9. VARIABLES DE LA EVALUACIÓN a los 12 meses (± 1 mes) (EVOLUCIÓN): 244. Fecha de la evaluación: 245. Tiempo (en meses) entre la evaluación motora/inclusión y esta otra evaluación: ejemplo, 12 meses y 15 días, 12,5. 246. Hora de la evaluación motora en OFF (si no es preciso por protocolo, no cubrir; ejemplo, 8:15 horas): 8,15. 247. Puntuación en la UPDRS-III-OFF (si no es preciso por protocolo, no cubrir): 248. Estadio de Hoehn/Yahr-OFF (si no es preciso por protocolo, no cubrir): 249. Hora de la evaluación motora en ON (ejemplo, 10:15 horas): 10,15. 250. Tiempo entre el OFF y el ON (mejor ON) (ejemplo, 1 y 30 minutos): 1,5 (si no es preciso por protocolo, no cubrir). 251. Puntuación en la UPDRS-III-ON: 252. Estadio de Hoehn/Yahr-ON: 253. Puntuación en la UPDRS-IV: 254. ¿Presenta el paciente complicaciones motoras (fluctuaciones motoras y/o discinesias)? (1) Si vs (2) No. 255. ¿Presenta el paciente fluctuaciones motoras? (1) Si vs (2) No. 88 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 256. ¿Presenta el paciente discinesias? (1) Si vs (2) No. 257. Dosis equivalente diaria de levodopa (mg/día, [52]): 258. Dosis equivalente del agonista y/o agonistas (mg/día, [52]): 259. ¿Recibe el paciente levodopa? (1) Si vs (2) No. 260. ¿Recibe el paciente un agonista dopaminérgico? (1) Si vs (2) No. 261. ¿Recibe el paciente un IMAO-B? (1) Si vs (2) No. 262. ¿Recibe el paciente un ICOMT? (1) Si vs (2) No. 263. Puntuación total en la NMSS (va de 0 a 360): 264. Puntuación total en el ítem 1 (va de 0 a 12): 265. Puntuación total en el ítem 2 (va de 0 a 12): 266. Puntuación total en el dominio 1 (expresado como un porcentaje, va de 0 a 100): 267. Puntuación total en el ítem 3 (va de 0 a 12): 268. Puntuación total en el ítem 4 (va de 0 a 12): 269. Puntuación total en el ítem 5 (va de 0 a 12): 270. Puntuación total en el ítem 6 (va de 0 a 12): 271. Puntuación total en el dominio 2 (expresado como un porcentaje, va de 0 a 100): 272. Puntuación total en el ítem 7 (va de 0 a 12): 273. Puntuación total en el ítem 8 (va de 0 a 12): 274. Puntuación total en el ítem 9 (va de 0 a 12): 275. Puntuación total en el ítem 10 (va de 0 a 12): 276. Puntuación total en el ítem 11 (va de 0 a 12): 277. Puntuación total en el ítem 12 (va de 0 a 12): 278. Puntuación total en el dominio 3 (expresado como un porcentaje, va de 0 a 100): 279. Puntuación total en el ítem 13 (va de 0 a 12): 280. Puntuación total en el ítem 14 (va de 0 a 12): 281. Puntuación total en el ítem 15 (va de 0 a 12): 282. Puntuación total en el dominio 4 (expresado como un porcentaje, va de 0 a 100): 283. Puntuación total en el ítem 16 (va de 0 a 12): 284. Puntuación total en el ítem 17 (va de 0 a 12): 285. Puntuación total en el ítem 18 (va de 0 a 12): 286. Puntuación total en el dominio 5 (expresado como un porcentaje, va de 0 a 100): 287. Puntuación total en el ítem 19 (va de 0 a 12): 89 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 288. Puntuación total en el ítem 20 (va de 0 a 12): 289. Puntuación total en el ítem 21 (va de 0 a 12): 290. Puntuación total en el dominio 6 (expresado como un porcentaje, va de 0 a 100): 291. Puntuación total en el ítem 22 (va de 0 a 12): 292. Puntuación total en el ítem 23 (va de 0 a 12): 293. Puntuación total en el ítem 24 (va de 0 a 12): 294. Puntuación total en el dominio 7 (expresado como un porcentaje, va de 0 a 100): 295. Puntuación total en el ítem 25 (va de 0 a 12): 296. Puntuación total en el ítem 26 (va de 0 a 12): 297. Puntuación total en el dominio 8 (expresado como un porcentaje, va de 0 a 100): 298. Puntuación total en el ítem 27 (va de 0 a 12): 299. Puntuación total en el ítem 28 (va de 0 a 12): 300. Puntuación total en el ítem 29 (va de 0 a 12): 301. Puntuación total en el ítem 30 (va de 0 a 12): 302. Puntuación total en el dominio 9 (expresado como un porcentaje, va de 0 a 100): 303. Puntuación en la escala ADLS (0 a 100): 304. Grado de dependencia: (1) Completamente independiente (≥ 80) vs (2) Algo dependiente (51 a 80) vs (3) Más dependiente (≤ 50). 10. VARIABLES SOBRE LA HOSPITALIZACIÓN A LOS 12 MESES: 305. ¿Ha presentado el paciente en algún momento durante los 12 meses (365 días) posteriores a su evaluación basal algún ingreso hospitalario no programado? (1) Si vs (2) No.* 306. Número de ingresos durante los 12 meses (365 días) posteriores a su evaluación basal: 307. Días hasta el ingreso (si varios, el primer ingreso; para calcularlo, se puede ir a http://www.calendario-365.es/calcular/el-periodo-entre-dos-fechas.html). *NOTA: el resto de los datos necesarios para el trabajo cuyo objetivo es estudiar los factores predictores de hospitalización aguda en los pacientes con enfermedad de Parkinson (página 20, objetivo 13 del seguimiento prospectivo) (estancia media, diagnóstico, servicio, etc…, mayormente descriptivos de la hospitalización) se proporcionarán en su momento. ………………………………………………………………………………………………………………. II. VARIABLES DEL CUIDADOR PRINCIPAL DEL PACIENTE: 90 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 * Las variables correspondientes a cada cuidador principal se incluirán en la base de datos del paquete estadístico con su caso correspondiente (caso 1, 2 , 3, etc…). 1. Edad (en el momento de inclusión y evaluación): 2. Sexo: (1) Varón vs (2) Mujer. 3. Peso (Kgs): 4. Raza: (1) Caucásica vs (2) Negra vs (3) Asiática vs (4) Otra. 5. Nivel cultural: (1) Estudios primarios vs (2) Estudios secundarios vs (3) Universitario. 6. Estado civil: (1) Casado vs (2) Soltero vs (3) Viudo vs (4) Divorciado) vs (5) Otro. 7. Hábitat: (1) Rural (<5.000 hab) vs (2) Semiurbano (5.000-20.000 hab) vs (3) Urbano (>20.000 hab). 8. Relación del cuidador con el paciente: (1) Cónyuge vs (2) Hijo/a vs (3) Otro grado de parentesco familiar vs (4) Otra relación (no familiares). 9. Tiempo que lleva como cuidador: (1) Menos de un año vs (2) Entre 1 y 5 años vs (3) Más de 5 años y menos de 10 años vs (4) 10 años o más. 10. Tiempo diario de cuidado: (1) Parcial (por las mañanas, tardes…) vs (2) Total (todo el tiempo). 11. Forma de vida en relación con el paciente: (1) Vive con el paciente vs (2) No vive con el paciente. 12. Actividad laboral: (1) En activo trabajando vs (2) En activo sin trabajo (paro, etc…) vs (3) Jubilado y/o pensionista vs (4) Otro. 13. Cuidado de otros personas, pacientes y/o niños: (1) Si vs (2) No. 14. Puntuación en el ZCBI (0 a 88): 15. Grado de sobrecarga: (1) Mínima o no sobrecarga (0-20) vs (2) Leve a moderada (21-40) vs (3) Moderada a severa (41-60) vs (4) Severa (61 a 88). 16. Puntuación en el CSI (0 a 13): 17. Grado de estrés: (1) No alto nivel de estrés (0 a 6) vs (2) Alto nivel de estrés (7 a 13). 18. Puntuación total en el BDI-II (0 a 63): 19. ¿Presenta el cuidador sentimientos de tristeza (BDI-II-ítem 1 positivo)? (1) Si vs (2) No. 20. ¿Presenta el cuidador anhedonia (BDI-II-ítem 4 positivo)? (1) Si vs (2) No. 21. ¿Presenta el cuidador depresión ([111,112], ver ANEXO XIII)? (1) Depresión mayor vs (2) Depresión menor vs (3) Depresión subclínica vs (4) No. 22. Puntuación en el PQ-10 (0 a 10): 23. Puntuación total en el EUROHIS-QOL 8-item index: 24. Puntuación en el EUROHIS-QOL 8-item index-item 1: 91 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 25. Puntuación en el EUROHIS-QOL 8-item index-item 2: 26. Puntuación en el EUROHIS-QOL 8-item index-item 3: 27. Puntuación en el EUROHIS-QOL 8-item index-item 4: 28. Puntuación en el EUROHIS-QOL 8-item index-item 5: 29. Puntuación en el EUROHIS-QOL 8-item index-item 6: 30. Puntuación en el EUROHIS-QOL 8-item index-item 7: 31. Puntuación en el EUROHIS-QOL 8-item index-item 8: ………………………………………………………………………………………………………………. III. VARIABLES DEL CONTROL: * Las variables correspondientes a cada control se incluirán en la base de datos del paquete estadístico como un caso más (igual que los pacientes). 1. DATOS DE IDENTIFICACIÓN: 1. Número-dato asignado al control; ejemplo, control 2 del centro 5 del listado: c5.c2. 2. Número asignado al investigador principal del centro; ejemplo, centro 4 del listado: i4. 3. Comunidad Autónoma (donde está el centro participante): 4. Tipo de sujeto: (1) Caso con/sin cuidador vs (2) Control. 2. VARIABLES EPIDEMIOLÓGICAS: 5. Fecha de nacimiento: 6. Edad (en el momento de inclusión y evaluación): 7. Sexo: (1) Varón vs (2) Mujer. 8. Peso (Kgs): 9. Raza: (1) Caucásica vs (2) Negra vs (3) Asiática vs (4) Otra. 10. Nivel cultural: (1) Estudios primarios vs (2) Estudios secundarios vs (3) Universitario. 11. Estado civil: (1) Casado vs (2) Soltero vs (3) Viudo vs (4) Divorciado) vs (5) Otro. 12. Hábitat: (1) Rural (<5.000 hab) vs (2) Semiurbano (5.000-20.000 hab) vs (3) Urbano (>20.000 hab). 13. Forma de vida: (1) Solo vs (2) Con el cónyuge vs (3) Con hijo/a vs (4) Otro. 3. VARIABLES RELACIONADAS CON SUS ENFERMEDADES Y ANTECEDENTES: 14. Número de tratamientos en total: 15. Número de pastillas al día en total (todos los medicamentos): 92 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 16. ¿Recibe el sujeto tratamiento antidepresivo? (1) Si vs (2) No. 17. ¿Recibe el sujeto tratamiento ansiolítico? (1) Si vs (2) No. 18. ¿Recibe el sujeto tratamiento antipsicótico? (1) Si vs (2) No. 19. ¿Qué antidepresivo recibe? (1) Ninguno vs (2) ISRS vs (3) Dual (ISRSyN) vs (4) Tricíclico vs (5) Heterocíclico vs (6) Otro vs (7) Varios (más de uno de diferente grupo). 20. ¿Qué antipsicótico recibe? (1) Ninguno vs (2) Quetiapina vs (3) Clozapina vs (4) Risperidona vs (5) Otro antipsicótico atípico vs (6) Un antipsicótico clásico vs (7) Varios (más de uno). 21. ¿Recibe el sujeto tratamiento analgésico y/o antinflamatorio o de otro tipo (antiepilépticos) para el dolor? (1) Si vs (2) No. 22. ¿Qué analgesia recibe? (1) Antiinflamatorios vs (2) Analgésicos no antiinflamatorios vs (3) Mórficos vs (4) Antiepilépticos vs (5) Varios (dos o más) vs (6) Ninguno. 23. Antecedentes de HTA: (1) Si vs (2) No. 24. Antecedentes de DM: (1) Si vs (2) No. 25. Antecedentes de DLP: (1) Si vs (2) No. 26. Antecedentes de hiperuricemia: (1) Si vs (2) No. 27. Antecedentes de cardiopatía (isquémica, valvular y/o hipertensiva): (1) Si vs (2) No. 28. Antecedentes de arritmia (fibrilación auricular, flutter, otra): (1) Si vs (2) No. 29. Antecedentes de consumo de tabaco: (1) Si vs (2) vs (3) Exfumador. 30. Número de cigarrillos/día: 31. Antecedentes de consumo de alcohol: (1) Bebedor moderado (< 40 g/día en hombres y 24 g/día en mujeres) vs (2) Bebedor excesivo (más de 40 y 24) vs (3) No bebedor. 32. Presenta el sujeto datos clínicos (preguntado de forma específica y dirigida por el neurólogo investigador principal) sugestivos de trastorno del sueño en fase REM: (1) Si vs (2) No. 4. VARIABLES DE LA EVALUACIÓN NO MOTORA: 33. Fecha de la evaluación: 34. Hora de la evaluación (inicio de la misma): 35. Tiempo de evaluación (minutos): 36. Puntuación total en la PD-CRS: 37. Puntuación fronto-subcortical en la PD-CRS: 38. Puntuación cortical posterior en la PD-CRS: 39. Puntuación en la PD-CRS-memoria verbal inmediata: 93 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 40. Puntuación en la PD-CRS-denominación por confrontación: 41. Puntuación en la PD-CRS-atención mantenida: 42. Puntuación en la PD-CRS-memoria de trabajo: 43. Puntuación en la PD-CRS-dibujo espontáneo de un reloj: 44. Puntuación en la PD-CRS-copia de un reloj: 45. Puntuación en la PD-CRS-memoria verbal diferida: 46. Puntuación en la PD-CRS-fluencia verbal alternante: 47. Puntuación en la PD-CRS-fluencia verbal de acción: 48. ¿Hay deterioro cognitivo [55,81] (ANEXOS IX y X)? (1) No vs (2) Deterioro cognitivo leve vs (3) Demencia. 49. Tiempo en resolver el puzzle (minutos): ejemplo, 4 minutos y 33 segundos, 4,55. 50. Número de piezas bien colocadas al minuto: 51. Número de piezas bien colocadas a los 2 minutos: 52. Número de piezas bien colocadas a los 3 minutos: 53. Número de piezas bien colocadas a los 4 minutos: 54. Número de piezas bien colocadas a los 5 minutos: 55. ¿Practica el sujeto de forma habitual la resolución de puzzles? (1) Si vs (2) No. 56. ¿Tiene el sujeto alguna limitación visual que le condicione? (1) Si vs (2) No. 57. Puntuación total en la NMSS (va de 0 a 360): 58. Puntuación total en el ítem 1 (va de 0 a 12): 59. Puntuación total en el ítem 2 (va de 0 a 12): 60. Puntuación total en el dominio 1 (expresado como un porcentaje, va de 0 a 100): 61. Puntuación total en el ítem 3 (va de 0 a 12): 62. Puntuación total en el ítem 4 (va de 0 a 12): 63. Puntuación total en el ítem 5 (va de 0 a 12): 64. Puntuación total en el ítem 6 (va de 0 a 12): 65. Puntuación total en el dominio 2 (expresado como un porcentaje, va de 0 a 100): 66. Puntuación total en el ítem 7 (va de 0 a 12): 67. Puntuación total en el ítem 8 (va de 0 a 12): 68. Puntuación total en el ítem 9 (va de 0 a 12): 69. Puntuación total en el ítem 10 (va de 0 a 12): 94 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 70. Puntuación total en el ítem 11 (va de 0 a 12): 71. Puntuación total en el ítem 12 (va de 0 a 12): 72. Puntuación total en el dominio 3 (expresado como un porcentaje, va de 0 a 100): 73. Puntuación total en el ítem 13 (va de 0 a 12): 74. Puntuación total en el ítem 14 (va de 0 a 12): 75. Puntuación total en el ítem 15 (va de 0 a 12): 76. Puntuación total en el dominio 4 (expresado como un porcentaje, va de 0 a 100): 77. Puntuación total en el ítem 16 (va de 0 a 12): 78. Puntuación total en el ítem 17 (va de 0 a 12): 79. Puntuación total en el ítem 18 (va de 0 a 12): 80. Puntuación total en el dominio 5 (expresado como un porcentaje, va de 0 a 100): 81. Puntuación total en el ítem 19 (va de 0 a 12): 82. Puntuación total en el ítem 20 (va de 0 a 12): 83. Puntuación total en el ítem 21 (va de 0 a 12): 84. Puntuación total en el dominio 6 (expresado como un porcentaje, va de 0 a 100): 85. Puntuación total en el ítem 22 (va de 0 a 12): 86. Puntuación total en el ítem 23 (va de 0 a 12): 87. Puntuación total en el ítem 24 (va de 0 a 12): 88. Puntuación total en el dominio 7 (expresado como un porcentaje, va de 0 a 100): 89. Puntuación total en el ítem 25 (va de 0 a 12): 90. Puntuación total en el ítem 26 (va de 0 a 12): 91. Puntuación total en el dominio 8 (expresado como un porcentaje, va de 0 a 100): 92. Puntuación total en el ítem 27 (va de 0 a 12): 93. Puntuación total en el ítem 28 (va de 0 a 12): 94. Puntuación total en el ítem 29 (va de 0 a 12): 95. Puntuación total en el ítem 30 (va de 0 a 12): 96. Puntuación total en el dominio 9 (expresado como un porcentaje, va de 0 a 100): 97. Puntuación total en el BDI-II (0 a 63): 98. ¿Presenta el sujeto sentimientos de tristeza (BDI-II-ítem 1 positivo)? (1) Si vs (2) No. 99. ¿Presenta el sujeto anhedonia (BDI-II-ítem 4 positivo)? (1) Si vs (2) No. 100. ¿Presenta el sujeto depresión ([111,112], ver ANEXO XV)? (1) Depresión mayor vs (2) Depresión menor vs (3) Depresión subclínica vs (4) No. 95 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 101. Puntuación total en el QUIP-RS (0-112): 102. ¿Presenta el sujeto un TCI relacionado con el juego? (1) Si vs (2) No. 103. Puntuación en TCI relacionado con el juego (0-16): 104. ¿Presenta el sujeto un TCI relacionado con el sexo? (1) Si vs (2) No. 105. Puntuación en TCI relacionado con el sexo (0-16): 106. ¿Presenta el sujeto un TCI relacionado con las compras? (1) Si vs (2) No. 107. Puntuación en TCI relacionado con las compras (0-16): 108. ¿Presenta el sujeto un TCI relacionado con la comida? (1) Si vs (2) No. 109. Puntuación en TCI relacionado con la comida (0-16): 110. ¿Presenta el sujeto un TCI relacionado con el uso de medicación? (1) Si vs (2) No. 111. Puntuación en TCI relacionado con el uso de medicación (0-16): 112. ¿Presenta el sujeto un TCI relacionado con otras conductas (“hobbysm”)? (1) Si vs (2) No. 113. ¿Presenta el sujeto un TCI del tipo del “punding”? (1) Si vs (2) No. 114. Puntuación en TCI del tipo del “hobbysm y/o punding” (0-32): 115. ¿Presenta el sujeto por tanto un TCI? (1) Si vs (2) No. 116. ¿Cuántos TCIs presenta el sujeto?: 117. Puntuación total en la escala de sueño PDSS (0 a 150): 118. Puntuación en la PDSS-ítem 1 (de 0 a 10): 119. Puntuación en la PDSS-ítem 2 (de 0 a 10): 120. Puntuación en la PDSS-ítem 3 (de 0 a 10): 121. Puntuación en la PDSS-ítem 4 (de 0 a 10): 122. Puntuación en la PDSS-ítem 5 (de 0 a 10): 123. Puntuación en la PDSS-ítem 6 (de 0 a 10): 124. Puntuación en la PDSS-ítem 7 (de 0 a 10): 125. Puntuación en la PDSS-ítem 8 (de 0 a 10): 126. Puntuación en la PDSS-ítem 9 (de 0 a 10): 127. Puntuación en la PDSS-ítem 10 (de 0 a 10): 128. Puntuación en la PDSS-ítem 11 (de 0 a 10): 129. Puntuación en la PDSS-ítem 12 (de 0 a 10): 130. Puntuación en la PDSS-ítem 13 (de 0 a 10): 131. Puntuación en la PDSS-ítem 14 (de 0 a 10): 96 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 132. Puntuación en la PDSS-ítem 15 (de 0 a 10): 133. Puntuación total en el NPI (0 a 120): 134. Puntuación en el NPI-dominio 1 (delirios, 0 a 12): 135. Puntuación en el NPI-dominio 2 (alucinaciones, 0 a 12): 136. Puntuación en el NPI-dominio 3 (agitación, 0 a 12): 137. Puntuación en el NPI-dominio 4 (depresión-disforia, 0 a 12): 138. Puntuación en el NPI-dominio 5 (ansiedad, 0 a 12): 139. Puntuación en el NPI-dominio 6 (euforia/júbilo, 0 a 12): 140. Puntuación en el NPI-dominio 7 (apatía/indiferencia, 0 a 12): 141. Puntuación en el NPI-dominio 8 (desinhibición, 0 a 12): 142. Puntuación en el NPI-dominio 9 (irritación/labilidad, 0 a 12): 143. Puntuación en el NPI-dominio 10 (conducta motora sin finalidad, 0 a 12): 144. Puntuación en la VAS-PAIN (0 a 10): 145. ¿El sujeto presenta dolor? (1) Si vs (2) No. 146. ¿Cuánto lleva el sujeto con dolor? (1) Menos de 3 meses vs (2) Entre 3 meses y 6 meses vs (3) Entre 6 meses y 2 años vs (4) Más de 2 años vs (5) Sin dolor. 147. Tipo de dolor: (1) Neuropático vs (2) Nociceptivo-somático vs (3) Nociceptivo-visceral vs (4) Varios tipos de dolor vs (4) No dolor. 148. Puntuación en el FOGQ (0 a 24): 149. ¿Presenta el sujeto caídas? (1) Si vs (2) No. 150. En el último mes, ¿cuántas caídas ha presentado? (1) Ninguna vs (2) Una caída vs (3) De 1 a 5 caídas vs (4) Más de 5 caídas. 151. Puntuación en la escala ADLS (0 a 100): 152. Grado de dependencia: (1) Completamente independiente (≥ 80) vs (2) Algo dependiente (51 a 80) vs (3) Más dependiente (≤ 50). 5. VARIABLES DE CALIDAD DE VIDA: 153. Puntuación en el PQ-10 (0 a 10): 154. Puntuación total en el EUROHIS-QOL 8-item index: 97 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 155. Puntuación en el EUROHIS-QOL 8-item index-item 1: 156. Puntuación en el EUROHIS-QOL 8-item index-item 2: 157. Puntuación en el EUROHIS-QOL 8-item index-item 3: 158. Puntuación en el EUROHIS-QOL 8-item index-item 4: 159. Puntuación en el EUROHIS-QOL 8-item index-item 5: 160. Puntuación en el EUROHIS-QOL 8-item index-item 6: 161. Puntuación en el EUROHIS-QOL 8-item index-item 7: 162. Puntuación en el EUROHIS-QOL 8-item index-item 8: 6. VARIABLES SÉRICAS-MOLECULARES (ANÁLISIS DE SANGRE): 163. Fecha de la extracción de la determinación: 164. Días entre la evaluación y esta determinación: 165. Niveles de proteína S-100b: 166. Niveles de TNF-alfa: 167. Niveles de IL-1: 168. Niveles de IL-2: 169. Niveles de IL-6: 170. Niveles de VB12: 171. Niveles de ácido metilmalónico: 172. Niveles de homocisteína: 173. Niveles de PCR (proteína C reactiva): 174. Niveles de ácido úrico: 175. Niveles de ferritina: 176. Niveles de hierro: 7. VARIABLES DE NEUROIMAGEN: 177. Fecha de la realización de la RM: 178. Días entre la evaluación y la realización de la RM: 179. Valor del MTAi (Medial Temporal Atrophy Index): 180. Valor de A (media ambos lados): 181. Valor de B (media ambos lados): 182. Valor de C (media ambos lados): 98 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 183. Valor del MTAi-derecho: 184. Valor de A-derecho: 185. Valor de B-derecho: 186. Valor de C-derecho: 187. Valor del MTAi-izquierdo: 188. Valor de A-izquierdo: 189. Valor de B-izquierdo: 190. Valor de C-izquierdo: 8. VARIABLES SOBRE LA HOSPITALIZACIÓN A LOS 12 MESES: 191. ¿Ha presentado el sujeto en algún momento durante los 12 meses (365 días) posteriores a su evaluación basal algún ingreso hospitalario no programado? (1) Si vs (2) No.* 192. Número de ingresos durante los 12 meses (365 días) posteriores a su evaluación basal: 193. Días hasta el ingreso (si varios, el primer ingreso; para calcularlo, se puede ir a http://www.calendario-365.es/calcular/el-periodo-entre-dos-fechas.html): *NOTA: el resto de los datos necesarios para el trabajo cuyo objetivo es estudiar los factores predictores de hospitalización aguda en los pacientes con enfermedad de Parkinson (frente a los sujetos control) (página 20, objetivo 13 del seguimiento prospectivo) (estancia media, diagnóstico, servicio, etc…, mayormente descriptivos de la hospitalización) se proporcionarán en su momento. ………………………………………………………………………………………………………………. *NOTA: El análisis de los datos de volumetría y genéticos se llevará a cabo por el equipo del Dr. Pablo Mir (laboratorio 104-Trastornos del Movimiento-Instituto de Biomedicina de Sevilla-Hospital Universitario Virgen del Rocío) y no constan en el presente CRD. 99 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 ANEXO XIII. TABLA RESUMEN DEL PLAN DE TRABAJO Evaluaciones Criterios in/exclusión Basal 12 m 24 m 36 m 48 m 60 m P; C Hoehn&Yahr P P P P P P UPDRS-III y UPDRS-IV P P P P P P MMSE P; C P; C P; C P; C PD-CRS P; C P; C P; C P; C Prueba del puzzle P; C P; C P; C P; C NMSS P; C P; C P; C BDI-II P; Cp; C P; Cp; C P; Cp; C P; Cp; C QUIP-RS P; C P; C P; C P; C PDSS P; C P; C P; C P; C NPI P; C P; C P; C P; C VAS-Pain y VAFS P; C P; C P; C P; C FOGQ P; C P; C P; C P; C ADLS P; C P; C P; C PDQ-39 P; C P; C P; C P; C PQ-10 P; Cp; C P; Cp; C P; Cp; C P; Cp; C EUROHIS-QOL 8 item index P; Cp; C P; Cp; C P; Cp; C P; Cp; C ZCBI Cp Cp Cp Cp CSI Cp Cp Cp Cp Muestras-marcadores séricos P; C Muestras-estudios genéticos P; C RM craneal P; C P P P; C P; C P P P; C P; C P, paciente; Cp, cuidador principal; C, control. ADLS, Schwab & England Activities of Daily Living Scale; BDI, Beck Depression Inventory; CSI, Caregiver Strain Index; FOGQ, Freezing of Gait Questionnaire; HY, Hoenh and Yahr; NMSS, Non-Motor Symptoms Scale; NPI, Neuropsychiatric Inventory; PD-CRS, Parkinson´s Disease Cognitive Rating Scale; PDQ-39SI, Parkinson´s disease Quality of Life Questionnaire Summary Index; QUIP-RS, Questionnaire for Impulsive-Compulsive Disorders in Parkinson's Disease-Rating Scale; PDSS, Parkinson´s Disease Sleep Scale; UPDRS, Unified Parkinson´s Disease Rating Scale; VAFS, Visual Analog Fatigue Scale; VAS-Pain, Visual Analog ScalePain; ZCBI, Zarit Caregiver Burden Inventory. 100 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 ANEXO XIV. PREDOMINANTE. DEFINICIÓN DEL HEMICUERPO Se definirá el hemicuerpo predominante atendiendo a las puntuaciones de los ítems de la UPDRS-III (pacientes fluctuantes en estado OFF medicación y para los no fluctuantes en estado ON medicación) sobre temblor en extremidades de reposo (3.20) y de acción (3.21), rigidez en extremidades (3.22) y cinesia en extremidades (3.23 a 3.26). Se comparará el sumatorio de las puntuaciones del lado derecho con el lado izquierdo. Se definen los siguientes fenotipos: i. Asimétrico de predominio derecho leve a moderado: cociente derecha/izquierda > 1 pero < 3. ii. Asimétrico de predominio izquierdo leve a moderado: cociente izquierda/derecha > 1 pero < 3. iii. Asimétrico de predominio derecho marcado: cociente derecha/izquierda ≥ 3. iv. Asimétrico de predominio izquierdo marcado: cociente izquierda/derecha ≥ 3. v. Simétrico: cociente derecha/izquierda = 1. Ejemplo: Paciente con puntuación en la UPDRS-III: . 3.20-derecho: 2 (temblor de reposo en ESD) + 1 (temblor de reposo en EID). . 3.20-izquierdo: 0 + 0 (sin temblor de reposo en hemicuerpo izquierdo). . 3.21-derecho: 0 (sin temblor de acción). . 3.21-izquierdo: 0 (sin temblor de acción). . 3.22-derecho: 3 (rigidez en ESD) + 2 (rigidez en EID). . 3.22-izquierdo: 1 (rigidez en ESI) + 1 (rigidez en EII). . 3.23-derecho: 2 (golpeteo de dedos con mano derecha). . 3.23-izquierdo: 1 (golpeteo de dedos con mano izquierda). . 3.24-derecho: 1 (abrir y cerrar mano derecha). . 3.24-izquierda: 0 (sin alteraciones para abrir y cerrar la mano izquieda). . 3.25-derecha: 1 (pronación-supinación de la ESD). . 3.25-izquierda: 0 (sin alteraciones para la pronación-supinación de la ESI). . 3.26-derecha: 2 (agilidad con la EID). . 3.26-izquierda: 1 (agilidad con la EII). Cociente derecha/izquierda = 3 (temblor) + 5 (rigidez) + 6 (cinesia) / 0 + 2 + 2 = 14 / 4 = 3.5 (luego es un fenotipo asimétrico de predominio derecho marcado el ser ≥ 3). 101 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 ANEXO XV. CLASIFICACIÓN DEL ESTADO EMOCIONAL ATENDIENDO AL BDI. Clasificaremos a los pacientes según la puntuación del BDI-II en las siguientes categorías: 1. Depresión mayor: De 5 a 9 síntomas del BDI (se refiere a los síntomas 1, 4, 5, 9, 13, 15, 16, 17 y 18) presentes siendo uno de ellos obligatoriamente el 1 (sentimiento de tristeza) ó 4 (anhedonia) durante > 2 semanas (DSM-IV) (el cuestionario pregunta por el mes previo) [111]. 2. Depresión menor: De 2 a 4 síntomas del BDI (se refiere a los síntomas 1, 4, 5, 9, 13, 15, 16, 17 y 18) presentes siendo uno de ellos obligatoriamente el 1 (sentimiento de tristeza) ó 4 (anhedonia) durante > 2 semanas (DSM-IV) (el cuestionario pregunta por el mes previo) [111]. 3. Depresión subclínica: De 2 a 4 síntomas del BDI (se refiere a los síntomas 1, 4, 5, 9, 13, 15, 16, 17 y 18) sin estar presentes ni el 1 (sentimiento de tristeza) ni el 4 (anhedonia) (criterios de Judd) [112]. 102 Protocolo del estudio COPPADIS.2015.v2 de 28 de enero de 2015 Seguimiento prospectivo de la cohorte 01 5 2015 > 30 centros nacionales ± 1 hora 31 8 2016 Pacientes n= ± 800 1) Criterios in/exclusión (MMSE) 2) Recogida de datos 3) HY-OFF, UPDRS-III-OFF* 4) HY-ON, UPDRS-III-ON* 5) UPDRS-IV 6) Consentimiento informado n= ± 800 1) PD-CRS 7) NPI 2) Puzzle 8) VAS-Pain y VAFS 3) NMSS 9) FOGQ 4) BDI-II 10) ADLS 5) QUIP-RS 11) PDQ-39SI 6) PDSS 12) PQ-10 y EUROHIS-QOL 8 item-index ± 2.5 horas (paciente, 2A) ± 3 horas (paciente + cuidador, 2A + 2B) ± 2.25 horas (control, 2C) 1) ZCBI 2) CSI 3) BDI-II 4) PQ-10 y EUROHIS-QOL 8 item-index n= ± 300 Cuidadores n= ± 600 1) MMSE 7) PDSS 2) PD-CRS 8) NPI 3) Puzzle 9) VAS-Pain y VAFS 4) NMSS 10) FOGQ 5) BDI-II 11) ADLS 6) QUIP-RS 12) PQ-10 y EUROHIS-QOL 8 item-index Controles n= ± 400 = marcadores moleculares n= ± 100 = estudio genético n= ± 800 pacientes (± 300 RM + sangre) n= ± 600 Cuidadores n= ± 400 controles (± 100 RM + sangre) = marcadores moleculares = estudio genético n= ± 800 pacientes n= ± 300 (RM + sangre) 12 ± 1m 24 ± 1 m 36 ± 2 m 1) HY-OFF, UPDRS-III-OFF* 1) HY-OFF, UPDRS-III-OFF* 1) HY-OFF, UPDRS-III-OFF* 1) HY-OFF, UPDRS-III-OFF* 2) HY-ON, UPDRS-III-ON* 2) HY-ON, UPDRS-III-ON* 2) HY-ON, UPDRS-III-ON* 2) HY-ON, UPDRS-III-ON* 3) UPDRS-IV 3) UPDRS-IV 3) UPDRS-IV 3) UPDRS-IV 4) NMSS 4) MMSE, PD-CRS, puzzle 4) NMSS 4) MMSE, PD-CRS, puzzle 5) ADLS 5) BDI-II, NPI, QUIP-RS 5) ADLS 5) BDI-II, NPI, QUIP-RS 60 ± 3 m 6) NMSS, PDSS, VAS-Pain, VAFS 6) NMSS, PDSS, VAS-Pain, VAFS 7) FOGQ 7) FOGQ 8) ADLS 8) ADLS 9) PDQ-39SI, PQ-10 y EUROHIS-QOL 9) PDQ-39SI, PQ-10 y EUROHIS-QOL n= ± 600 cuidadores 24 ± 1 m Evaluación completa ± = basal (clínica, sérica y neuroimagen) 48 ± 2 m 60 ± 3 m 1) ZCBI y CSI 1) ZCBI y CSI 1) ZCBI y CSI 2) BDI-II 2) BDI-II 2) BDI-II 3) PQ-10 y EUROHIS-QOL 3) PQ-10 y EUROHIS-QOL 3) PQ-10 y EUROHIS-QOL n= ± 400 controles n= ± 100 48 ± 2 m 24 ± 1 m 48 ± 2 m 1) MMSE, PD-CRS, puzzle 1) MMSE, PD-CRS, puzzle 2) BDI-II, NPI, QUIP-RS 2) BDI-II, NPI, QUIP-RS 4) NMSS, PDSS, VAS-Pain, VAFS 4) NMSS, PDSS, VAS-Pain, VAFS 5) FOGQ 5) FOGQ 6) ADLS 6) ADLS 7) PQ-10 y EUROHIS-QOL 7) PQ-10 y EUROHIS-QOL 60 ± 3 m