Formulación Inorganica Archivo
Anuncio

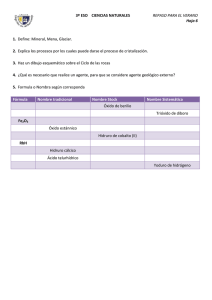
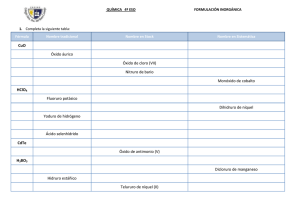
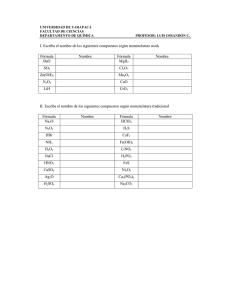
FORMULACIÓN INORGÁNICA CURSO 2012-2013 DPTO. FÍSICA Y QUÍMICA IES. ALMINARES A) SUSTANCIAS SIMPLES - Los elementos gaseosos suelen encontrarse en forma de moléculas diatómicas. Ej: H2, O2, N2, Cl2, ... Algunas excepciones son el ozono ( O3 ) , azufre ( S8 ) ... - Los metales se representan mediante el símbolo del elemento. Ej: Na, K... - Los gases nobles son monoatómicos y se representan mediante el símbolo del elemento. Ej: He, Ne... B) SUSTANCIAS COMPUESTAS. B.1.-COMPUESTOS BINARIOS B.1.1. OXÍGENO B.1.1.1. METAL →ÓXIDOS BÁSICOS → PERÓXIDOS B.1.1.2. NO METAL → ÓXIDOS ÁCIDOS B.1.2. HIDRÓGENO B.1.2.1. METAL → HIDRUROS METÁLICOS B.1.2.2. NO METAL →HIDRUROS DE LOS GRUPOS 16 Y 17 B.1.2.3. NO METAL → HIDRUROS DE LOS GRUPOS 13,14 Y 15. B.1.3. SALES B.1.3.1. METAL + NO METAL → S. NEUTRAS B.1.3.2. NO METAL + NO METAL B. 2.- COMPUESTOS TERNARIOS B.2.1. HIDRÓXIDOS ( BASES) B.2.2. ÁCIDOS OXÁCIDOS O OXÁCIDOS B.2.3. SALES NEUTRAS B.3.- COMPUESTOS CUATERNARIOS B.3.1. SALES ÁCIDAS 1 FORMULACIÓN INORGÁNICA CURSO 2012-2013 DPTO. FÍSICA Y QUÍMICA IES. ALMINARES NÚMERO DE OXIDACIÓN DE LOS ELEMENTOS Las diferentes moléculas y cristales que forman las sustancias se constituyen mediante los enlaces químicos o uniones entre los diferentes átomos que las forman. Dichos enlaces se originan mediante un intercambio mutuo de electrones, o por compartición de los mismos. Hay átomos que tienen tendencia a captar electrones (electronegativos) y otros a cederlos (electropositivos). Otros pueden captar o ceder electrones dependiendo del elemento con el que se combina o compartirlos. Se denomina número de oxidación de un elemento en los compuestos iónicos al número de electrones cedidos, captados por un átomo en su combinación química con otro para formar un enlace, y en uno covalente a la carga formal que tendría el elemento en el compuesto si la pareja o parejas de electrones que comparte se le asignase íntegramente al átomo más electronegativo. Para determinar el número de oxidación de un elemento en un compuesto hay que tener en cuenta las reglas siguientes: a) El número de oxidación de los elementos en una sustancia simple es cero. Ej: H2; Fe, He. b) En todo compuesto la suma de los números de oxidación es cero: BeH2: 1(+2)+2(-1) = 0 c) La suma de los números de oxidación de los elementos que forman un ion es igual a la carga del ion. Catión amonio NH4+ : 1 (-3) + 4(+1) = +1 d) El número de oxidación del hidrógeno combinado con un metal es (-1) y con un no metal (+1). HCl: 1(+1)+1(-1) = 0 KH: 1(+1)+1(-1) = 0 e) El oxígeno actúa con número de oxidación (-2), excepto en los peróxidos que actúa con (-1). Cuando se combina con el fluor su número de oxidación es (+2), debido a que el fluor es más electronegativo que el oxígeno. f) Los no metales suelen tener número de oxidación negativo, excepto cuando se combinan con el oxígeno. Los metales tienen número de oxidación positiva. g) Los números de oxidación de los alcalinos es +1 y el de los alcalinotérreos +2. 2 FORMULACIÓN INORGÁNICA CURSO 2012-2013 DPTO. FÍSICA Y QUÍMICA IES. ALMINARES B.1. COMPUESTOS BINARIOS B.1.1. COMBINACIONES BINARIAS DEL OXÍGENO El oxígeno se combina con todos los elementos químicos, excepto con los gases nobles que no reaccionan con ningún elemento. En todos los compuestos actúan con número de oxidación (-2), excepto en los peróxidos que actúa con (-1). ÓXIDOS: (O 2-) oxígeno + metal→ óxido básico (metálico) oxígeno + no metal → óxido ácido (no metálico) Nomenclatura SISTEMÁTICA CON PREFIJOS MULTIPLICADORES: emplea la palabra genérica ÓXIDO, precedida de los prefijos ( mono, di, tri, tetra, penta, hexa, hepta...), según el número de átomos de oxígeno que existan, e indicando de la misma forma, a continuación, la proporción del segundo elemento. Nomenclatura SISTEMÁTICA CON LA VALENCIA EN NUMEROS ROMANOS: Si el metal o el no metal puede tener más de un número de oxidación, se indica entre paréntesis, con números romanos, inmediatamente detrás del nombre. Si sólo puede presentar uno, éste no se indica. Ejemplos: Li2O: Li+ O-2 óxido de dilitio óxido de litio CuO Cu+2 O-2 monoóxido de cobre ( el prefijo mono tiende a quitarse) óxido de cobre (II) O7 Cl2 Cl+7 O-2 dicloruro de hepataoxígeno PERÓXIDOS:(O2) 2Resultan de la combinación de un metal (fundamentalmente alcalino, alcalinotérreos, Cu, Ag, y Fe Co y Ni con sus números de oxidación menores), con el oxígeno, actuando éste con número de oxidación (-1). El grupo peróxido es (O2)=. Se nombran por la nomenclatura SISTEMÁTICA CON PREFIJOS MULTIPLICADORES igual que los óxidos básicos. Para la nomenclatura SISTEMÁTICA CON LA VALENCIA EN NUMEROS ROMANOS se antepone el prefijo PER- (peróxido). En sus fórmulas siempre debe quedar un número par de átomos de oxigeno. Ejemplos: Li2O2 Li+ (O2)-2 dióxido de dilitio peróxido de litio FeO2 Fe+2 (O2)-2 dióxido de hierro peróxido de hierro (II) 3 FORMULACIÓN INORGÁNICA CURSO 2012-2013 DPTO. FÍSICA Y QUÍMICA IES. ALMINARES B.1.2. COMBINACIONES BINARIAS DEL HIDRÓGENO. B.1.2.1. HIDRUROS METÁLICOS. Resultan de la combinación de un metal con el hidrógeno, actuando éste con el número de oxidación ( -1). SISTEMÁTICA CON PREFIJOS MULTIPLICADORES : se emplea la palabra genérica HIDRURO, seguida del nombre del metal correspondiente, utilizando los prefijos numerales para indicar el número de átomos de hidrógeno. SISTEMÁTICA CON LA VALENCIA EN NUMEROS ROMANOS : se nombra igual que la anterior, pero sin prefijo, e indicando la valencia del metal, si posee más de una, con números romanos y entre paréntesis. Ejemplos: CaH2 CoH3 Ca+2H- dihidruro de calcio hidruro de calcio Co+3 H- trihidruro de cobalto hidruro de cobalto (III) B.1.2.2. HIDRUROS DE LOS GRUPOS 16 Y 17. Resultan de la combinación de un no metal de los grupos 16 o 17 (actuando con su correspondiente número de oxidación negativo) con el hidrógeno, que al ser menos electronegativo que éstos , actúa con número de oxidación ( +1). SISTEMÁTICA CON PREFIJOS MULTIPLICADORES : se nombran añadiendo el sufijo -URO al elemento más electronegativo ( no metal), seguido de la palabra HIDRÓGENO ( o numeral-HIDRÓGENO). TRADICIONAL: se nombran con la palabra ACIDO y añadiendo el sufijo -HÍDRICO al nombre del no metal. Se usa solo cuando en compuesto se encuentra en disolución acuosa. Ejemplos: HF H+ F- H2S H+ S-2 fluoruro de hidrógeno (aq) Ácido fluorhídrico. sulfuro de hidrógeno (aq) ácido sulfhídrico. B.1.2.3. HIDRUROS DE LOS GRUPOS 13 ,14 y 15. Resultan de la combinación del hidrógeno con un no metal que pertenezca a los grupos 13, 14 y 15. En las fórmulas aparece el hidrógeno a la derecha. Por la nomenclatura tradicional tienen nombres especiales. Ejemplos: NH3 N -3 H+ trihidruro de nitrógeno o amoníaco PH3 P -3 H+ trihidruro de fósforo o fosfano AsH3 As-3 H+ trihidruro de arsénico o arsano CH4 C-4 H+ tetrahidruro de carbono o metano BH3 B-3 H+ trihidruro de boro o borano. 4 FORMULACIÓN INORGÁNICA CURSO 2012-2013 DPTO. FÍSICA Y QUÍMICA IES. ALMINARES B.1.3. OTRAS COMBINACIONES BINARIAS. B.1.3.1. SALES BINARIAS Combinación de un metal con un no metal. El no metal es el elemento más electronegativo y se coloca a la derecha, nombrándose el primero con la terminación -uro. Ejemplos: CaF2 Ca+2 F- difluoruro de calcio fluoruro de calcio FeCl2 Fe+2 Cl- dicloruro de hierro cloruro de hierro(II) B.1.3.2. SALES BINARIAS NO METAL- NO METAL Son combinaciones binarias entre no metales, se coloca a la izquierda el símbolo del elemento que figure antes en la siguiente relación: B, Si, C, Sb, As, P, N, Te, Se, S, I, Br, Cl, F Estos compuestos se nombran añadiendo la terminación -uro al elemento cuyo símbolo está colocado a la derecha de la fórmula (elemento que actúa con su número de oxidación negativa ). SISTEMÁTICA CON PREFIJOS MULTIPLICADORES : se indica la proporción en la que se encuentra cada uno de los elementos. SISTEMÁTICA CON LA VALENCIA EN NUMEROS ROMANOS : indica la valencia con que actúa el elemento más electropositivo, entre paréntesis, y con números romanos. Ejemplos: BrF3 Br+3 F- trifluoruro de bromo fluoruro de bromo (III). As2Se3 As+3 Se-2 triseleniuro de diarsénico seleniuro de arsénico (III). B.2. COMPUESTOS TERNARIOS B.2.1. HIDRÓXIDOS (BASES) Son compuestos ternarios formados por la combinación de un catión metálico con iones (OH) -. Su fórmula general es X(OH)n , donde X representa un metal y n el número de oxidación de éste. SISTEMÁTICA CON PREFIJOS MULTIPLICADORES : prefijo numeral-HIDRÓXIDO DE metal SISTEMÁTICA CON LA VALENCIA EN NUMEROS ROMANOS : HIDRÓXIDO DE metal, indicando el número de oxidación del metal entre paréntesis si tiene más de uno 5 FORMULACIÓN INORGÁNICA CURSO 2012-2013 DPTO. FÍSICA Y QUÍMICA IES. ALMINARES Ejemplos: Al(OH)3 → Al+3 (OH)- trihidróxido de aluminio hidróxido de aluminio Cu(OH)2 → Cu+2 (OH)- dihidróxido de cobre hidróxido de cobre (II) B.2.2 ACIDOS OXACIDOS Son compuestos ternarios que tienen la fórmula general H x XyOz, siendo X generalmente un no metal; pero también puede ser un metal de transición como V, Cr, Mn, Mo, W, Ru, etc, cuando actúan con número de oxidación cuatro o superior a cuatro. Se obtienen por combinación de los óxidos ácidos con el agua. TRADICIONAL: se nombran usando la palabra ÁCIDO seguida del nombre del no metal acompañado de un sufijo y/o prefijo según la valencia de éste. Los prefijos usados son (HIPO-, PER-) y los sufijos (-OSO, -ICO). HIPO-OSO OSO ICO PER-ICO HALOGENOS (17) Cl, Br, I 1 3 5 7 ANFÍGENOS (16) S, Se, Te 4 6 NITROGE NOIDEOS (15) N, P, As, Sb, Bi 1 3 5 CARBONOIDEOS (14) C, Si 2 4 TERREOS (13) B 3 El Cr actúa como no metal con las valencias siguientes: -ICO (+6). Al manganeso le ocurre algo similar: -ICO (+6) y -PER-ICO (+7). Ejemplos: HNO3 → H+ (N+5 O3-2)- ácido nítrico H 2CrO4 → H2+ (Cr+6 O4 -2) 2- ácido crómico H 2SO3 → H2+ (S+4 O 3 -2) 2- ácido sulfuroso EXCEPCIONES Se pueden formular indicando el no metal con su número de oxidación correspondiente, seguido de un oxígeno más de los necesarios para que quede carga negativa y se completa con hidrógenos hasta que compense la carga. H+ (B+3 O3-2)-3 → H3BO3 H+ (P+5 O4-2)-3 → H3PO4 H+ (Si+4 O4-2)-4 → H4SiO4 ácido bórico ácido fosfórico ácido silícico DI, TRI, TETRA... hacen referencia al grado de polimerización de los ácidos respectivos. H2S2O7 ácido disulfúrico H2 Cr2O7 ácido dicrómico 6 FORMULACIÓN INORGÁNICA CURSO 2012-2013 DPTO. FÍSICA Y QUÍMICA IES. ALMINARES B.2.3. SALES TERCIARIAS (OXISALES). Son compuestos ternarios constituidos por un no metal, oxígeno y un metal. Se obtiene por reacción de un oxácido y un hidróxido, según la reacción: ÁCIDO OXOÁCIDO + HIDRÓXIDO → SAL OXOÁCIDA NEUTRA + AGUA La reacción se llama neutralización, y cuando se completa lleva consigo la sustitución de todos los iones hidrógeno del ácido por el catión del hidróxido. En la fórmula se escribirá primero el catión metálico y después el anión ( no metal y oxígeno), sin embargo, al nombrarlas se nombra primero el anión y después el catión. TRADICIONAL: Se nombra cambiando la terminación -OSO del ácido por -ITO y la -ICO por -ATO, a continuación se pone el nombre del metal con su correspondiente número de oxidación si posee más de uno. Ejemplos: Fe2(CO3)3: carbonato de hierro (III) CuSO4 : sulfato de cobre (II) Ag NO3 : nitrito de plata B.3.- COMPUESTOS CUARTENARIOS. B. 3.1. SALES ÁCIDAS Se origina cuando hay una sustitución parcial de los hidrógenos de un ácido oxácido por cationes. NOMENCLATURA TRADICIONAL: anteponiendo la palabra hidrógeno en lugar de ácido. Cr(HSO3)3 hidrógeno sulfito de cromo (III) Na 2 (HPO4) hidrógeno fosfato de sodio También se pueden formar sales ácidas cuando se sustituye parte de los hidrógenos de un ácido hidrácido por un metal. 7 FORMULACIÓN INORGÁNICA CURSO 2012-2013 DPTO. FÍSICA Y QUÍMICA IES. ALMINARES ACTIVIDADES Compuestos binarios del oxígeno: 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. 23. 24. 25. 26. 27. 28. 29. 30. 31. 32. 33. 34. 35. 36. 37. 38. 39 40. 41 óxido de hierro (II) óxido de cromo(II) óxido de cobalto (II) óxido de berilio Óxido de vanadio (V) óxido de plata óxido de platino (IV) óxido de estaño (II) óxido de cobalto (III) óxido de magnesio trióxido de dihierro óxido de cobalto óxido de disodio dióxido de plomo óxido de calcio(cal viva) óxido de cobre óxido de niquel óxido de dirubidio dióxido de estaño óxido de mercurio Óxido de azufre (IV) óxido de azufre (VI) óxido de cloro (I) Peróxido de litio Dicloruro de pentaoxígeno Dicloruro de heptaoxígeno óxido de manganeso (II) óxido de manganeso (III) óxido de manganeso (IV) óxido de manganeso (VI) óx. de manganeso (VII) óxido de cromo (II) óxido de cromo (III) óxido de cromo (VI) trióxido de dinitrógeno pentaóxido de dinitrógeno dióxido de carbono Dióxido de disodio óxido de dinitrógeno óxido de nitrógeno trióxido de azufre Nombra los siguientes compuestos: Nº 1. 2. 3. 4. 5. FÓRM. HgO Li2O Mo O3 SrO N2O 8 FORMULACIÓN INORGÁNICA CURSO 2012-2013 DPTO. FÍSICA Y QUÍMICA IES. ALMINARES 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. NO Ni2O3 CO Al2O3 Cr2O3 SiO2 P2O5 Hg2O FeO As2O3 SO2 Mn2O7 O 7Cl2 BaO2 SnO2 Compuestos binarios del hidrógeno 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. 23. 24. 25. 26. 27. 28. 29. 30. 1. 2. 3. 4. 5. hidruro de bario Hidruro de magnesio hidruro alumínico hidruro de litio hidruro de cromo (II) hidruro de hierro (II) hidruro de manganeso (II) hidruro de platino (II) hidruro de oro (I) Amoniaco Borano Silano Metano Arsano Fosfano Cloruro de hidrógeno Ácido bromhídrico Yoduro de hidrógeno Ácido fluorhídrico Sulfuro de hidrógeno Ácido selenhídrico Ácido telurhídrico trihidruro de niquel dihidruro de hierro tetrahidruro de plomo yoduro de hidrógeno sulfuro de hidrógeno selenuiro de hidrógeno hidruro de plata dihidruro de cobre NH3 BH3 H2S PbH4 KH 9 FORMULACIÓN INORGÁNICA CURSO 2012-2013 DPTO. FÍSICA Y QUÍMICA IES. ALMINARES 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. MgH2 PH3 CH4 CaH2 HCl CrH3 NiH2 CuH H2Se Hg2H2 CrH3 NaH AuH3 AgH PtH2 Sales binarias 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. Cloruro de hierro (II) tribormuro de cobalto Sulfuro argéntico bromuro de oro (III) dibromuro de calcio Seleniuro de mercurio (II) Cloruro de cobalto (II) dicloruro de bario seleniuro de mercurio (I) bromuro de oro tribromuro de hierro Sulfuro de dipotasio Sulfuro de diplata Cloruro de níquel (III) triyoduro de galio trisulfuro de dihierro Cloruro de litio dibromuro de estroncio Sulfuro de hierro (II) telururo de cinc 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. FeI2 CuS PbCl4 NaI Hg2Se CoBr2 CaSe CrI2 SnS2 AuCl CsI CuF 10 FORMULACIÓN INORGÁNICA CURSO 2012-2013 DPTO. FÍSICA Y QUÍMICA IES. ALMINARES 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. 23. 24. 25. 26. 27. 28. 29. 30. 31. 32. 33. 34. 35. 36. 37. 38. 39. 40. 41. 42. 43. 44. 45. Óxido de francio Óxido de plata Óxido de plomo (IV) Dióxido de carbono pentaóxido de difósforo trióxido de dinitrógeno Óxido nítrico Dióxido de silício heptaóxido de dicloro Óxido de fosforo(V) Óxido crómico(VI) trióxido de azufre Óxido de azufre (VI) Óxido de yodo (V) Óxido de bromo (I) Óxido de cloro (VII) óxido de mercurio (II) óxido de níquel (III) Cloruro de hidrógeno ácido sulfhídrico Amoniaco Metano hidruro de hierro (III) dihidruro de cinc Cloruro de plata Sulfuro de níquel (II) yoduro de oro hidruro de níquel (III) hidruro de calcio dihidruro de bario Silano Borano Carburo de aluminio tricloruro de hierro diyoduro de cobre sulfuro de cinc ácido yodhídrico ácido selenhídrico Yoduro de plata seleniuro de niquel (II) óxido de cinc óxido de hierro (II) hidruro de mercurio (I) Sulfuro de hidrógeno óxido de plomo (IV) Compuestos ternarios 1.Hidróxido de cinc 2.dihidróxido de niquel 3.Hidróxido de hierro (III) 4.Hidróxido de sodio (sosa) 5.Hidróxido de potasio (potasa) 6.Hidróxido de amonio 7.Hidróxido de aluminio 11 FORMULACIÓN INORGÁNICA CURSO 2012-2013 DPTO. FÍSICA Y QUÍMICA IES. ALMINARES 8.Hidróxido de Plomo(IV) 9.Hidróxido de plata 10.Hidróxido de Cromo(III) 11.Tetrahidróxido de estaño 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. 23. 24. 25. 26. 27. 28. 29. 30. 31. 32. 33. 34. 35. 36. 37. 38. 39. 40. 41. 42. 43. 44. 45. 46. sulfato de cinc nitrato de calcio perbromato de hierro (III) nitrito de oro (I) cromato de plata seleniato de hierro (II) fosfato de níquel (III) Nitrato de calcio silicato de aluminio bromato de sodio dicromato de potasio permanganato de sodio sulfito de cinc fosfito de sodio iodato de magnesio sulfato de hierro (III) perclorato de plata sulfato de mercurio (II) carbonato de cobalto (II) Sulfito de potasio nitrito de estaño (IV) seleniato de calcio manganato de cinc silicato de sodio sulfito de hierro (II) carbonato de estaño (II) fosfato de magnesio hipoclorito de plata bromato de aluminio fosfito de cinc sulfito de plomo (II) silicato de cromo (II) nitrito de cesio sulfato de magnesio perclorato de estroncio cromato de plata permanganato de berilio peryodato de hierro (III) nitrito de paladio (II) seleniato de platino (IV) sulfato de amonio manganato de potasio fosfato de plata silicato de mercurio (II) nitrato de plata sulfito hierro (II) 12 FORMULACIÓN INORGÁNICA CURSO 2012-2013 DPTO. FÍSICA Y QUÍMICA IES. ALMINARES 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. 23. 24. 25. 26. 27. 28. 29. 30. 31. 32. 33. 34. 35. 36. 37. 38. 39. 40. 41. 42. 43. Na2CO3 H4P2O7 Al2 (SO4)3 AgNO3 CaSO4 KIO4 KBrO2 Na2 SO3 Au2 SeO4 Na4 P2 O7 K3 AsO3 BaSO4 KClO KIO4 Mg(NO3)2 NaNO2 Na4SiO4 LiBO2 FeSO4 Fe2(SO4)3 Fe2(CO3)3 CoSeO3 NiPO4 Na2TeO4 HPO3 HNO2 HClO4 H4P2O7 Na2SO4 CaCO3 Na2SO4 Al PO4 H4 Sb2O5 HIO HClO3 Li3BO3 FeSeO3 Ni (ClO4)2 H2SO4 H3PO3 H4Sb2O5 H3AsO4 CuMnO4 Sales ácidas Nº 1. 2. 3. 4. 5. 6. 7. NOMBRE DEL COMPUESTO Hidrógenosulfato de plata Hidrógenofosfato de disodio Dihidrógenofosfato de sodio Hidrógenocarbonato de potasio Hidrógenoseleniato de sodio Dihidrógenofosfato de aluminio hidrógenofosfato de aluminio FÓRMULA 13 FORMULACIÓN INORGÁNICA CURSO 2012-2013 DPTO. FÍSICA Y QUÍMICA IES. ALMINARES 1. Ácido nítrico 2. Ácido fosforoso 3. Ácido permangánico 4. Ácido dicrómico 5. Ácido bórico 6. Cu SO3 7. ZnSe 8. Na H C O3 9. Pt(OH)2 10. AsH3 11. Dicromato potásico 12. Hidruro de paladio (II) 13. Carbonato de calcio 14. Ácido yodhídrico 15. Oxígeno molecular 16. Cs2O2 17. Amoníaco 18. Sn(SeO4)2 19. PCl3 20. NiO 14