Document
Anuncio
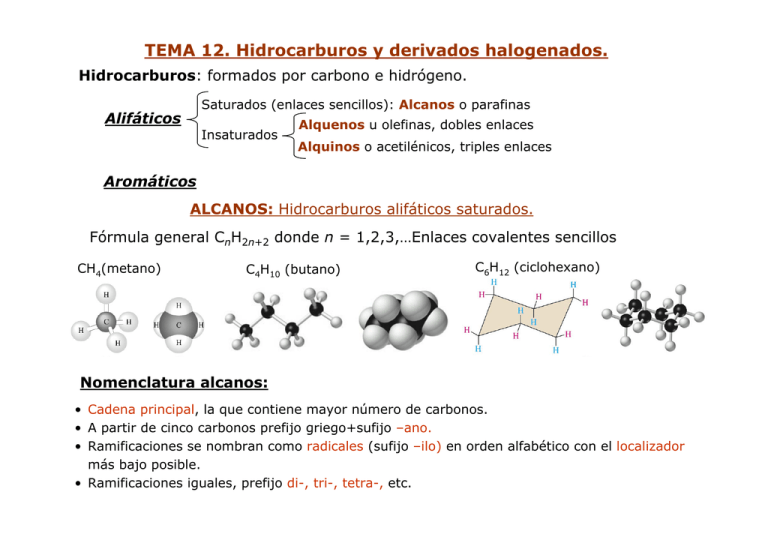
TEMA 12. Hidrocarburos y derivados halogenados. Hidrocarburos: formados por carbono e hidrógeno. Saturados (enlaces sencillos): Alcanos o parafinas Alifáticos Insaturados Alquenos u olefinas, dobles enlaces Alquinos o acetilénicos, triples enlaces Aromáticos ALCANOS: Hidrocarburos alifáticos saturados. Fórmula general CnH2n+2 donde n = 1,2,3,…Enlaces covalentes sencillos CH4(metano) C4H10 (butano) C6H12 (ciclohexano) Nomenclatura alcanos: • Cadena principal, la que contiene mayor número de carbonos. • A partir de cinco carbonos prefijo griego+sufijo –ano. • Ramificaciones se nombran como radicales (sufijo –ilo) en orden alfabético con el localizador más bajo posible. • Ramificaciones iguales, prefijo di-, tri-, tetra-, etc. Radicales frecuentes: Metilo (Me) Etilo (Et) Propilo Butilo H H CH3 H C C H CH3 H C2H5 H C CH3 CH CH2 CH CH2 CH3 2-etil-4-metilhexano 2,2-dimetilpropano Isopropilo CH3 CH3 CH3 CH3 Terbutilo C2H5 CH CH3 CH CH2 CH2 CH3 CH3 CH CH2 CHCH2CH2CH2CH3 C 4º CH3 CH3 C CH3 C 3º CH2 CH C 2º C 1º CH2 CH2 CH3 CH2 CH3 Propiedades físicas de los alcanos. Moléculas apolares o debilmente polares. Fuerzas intermoleculares débiles. Solubilidad: baja en disolventes polares, solubles en disolventes apolares (C6H6, CCl4) o poco polares (CH3CH2OCH2CH3, CHCl3). Puntos de ebullición Obtención de hidrocarburos: Fracciones principales de la destilación fraccionada del petróleo. • Fracciones ligeras: PE<200°C, C1 ≈ C10. Gasolinas, disolventes, materias primas. Petróleo • Fracciones medias: 200°C<PE<350°C C ≈ C . Gasoleos, kerosenos. 10 20 (C1 ≈ C40) • Fracciones pesadas: PE>350°C, C>20. Lubricantes, parafinas, aceites, alquitrán. Craqueo: Obtención de cadenas cortas de hidrocarburos a partir de las fracciones pesadas. •Térmico o pirólisis, fraccionamiento a altas temperaturas. •Catalítico, fraccionamiento a temperaturas bajas con catalizadores. Obtención de alcanos (escala de laboratorio): Reducción de otros grupos funcionales. CH2=CH2 CH ≡ CH CH3CH2OH Reducción (H2/Pt) ? Pt CH3CH=CH2 + H2 → CH3CH2-CH3 ∆ CH3CHO CH3COOH Reactividad de alcanos (parafinas), poco reactivos: 1. Halogenación: Obtención de haluros de alquilo. Mecanismo: radicales libres. R-H + X2 ∆ o hν R-X + HX CH4 (g) + Cl2 (g) ∆ CH3Cl (g) + HCl (g) Mecanismo: Cl• + H H3C • Radical libre intermedio Cl• + Cl• Cl2 •CH3 CH3 + Cl Cl CH3-CH2-CH3 + Cl2 hυ + HCl CH3 Cl + Cl• CH3-CHCl-CH3 + CH3-CH2-CH2Cl 2. Combustión: Oxidación completa en presencia de oxígeno. C8H18(l) + 25 O (g) → 8 CO2(g) + 9 H2O(l) 2 2 ∆H° = -5.48 103 J ALQUENOS Y ALQUINOS: Hidrocarburos alifáticos insaturados. Nomenclatura alquenos: • • • • Cadena principal, la de mayor número de carbonos conteniendo el doble enlace. Cambiar el sufijo –ano por –eno Dobles enlaces de cadena principal, el localizador más bajo posible. Ramificaciones se nombran como radicales (sufijo –ilo) en orden alfabético Radical vinilo: -CH=CH2 Radical fenilo (Ph): Eteno o etileno 2-buteno: CH3 cis-2-buteno ( CH CHCH2 CH(CH3)2 trans-2-buteno Estireno-butadieno: CH2 CH2 CH CH Tolueno Vinilbenceno (estireno) CH2 )n Sustitución en anillo aromático: CH3 CH3 orto (o-) meta (m-) para (p-) o-dimetilbenceno o-xileno Obtención de alquenos: Tipicamente reacciones de eliminación (E) de grupo funcional e hidrógeno en α. R-CHA-CHB-R’ R-CH=CH-R’+ AB 1. Deshidratación de alcoholes en medio ácido. Carbocationes. •Alcoholes 2º o 3º •Obtención de alqueno más sustituido 2. Deshalogenación de haluros de alquilo. Base fuerte en presencia de alcohol. R-CH2-CHX-R’ + NaOH alcohol R-CH=CH-R’ + H2O + NaX Haluros 1º: Eliminación bimolecular (E2 ) CH3-CH2-CH2-CH2-Br + NaOH alcohol v = k[OH-][R-Cl] CH3-CH2-CH=CH2 + H2O + NaBr Haluros 2º o 3º: eliminación unimolecular (E1 ) v = k[R-Cl] CH3-CH2-CHBr-CH3 + NaOH alcohol CH3-CH=CH-CH2 + H2O + NaBr Mecanismo: carbocationes ⇒ Obtención de alqueno más sustituido Reactividad de alquenos u olefinas: Tipicamente reaciones de adicción. R-CH=CH-R’ + AB R-CHA-CHB-R’ 1. Hidrogenación. Catalizador. catalizador CH3-CH2-CH=CH2 + H2(g) CH3-CH2-CH2-CH3 • Determinación cuantitativa de insaturaciones. • Estabilidad relativa de isómeros estructurales (cis, trans). 2. Halogenación. Obtención de dihaluros vecinales. • Determinación cualtitativa de insaturaciones. 3. Adición de ácidos. Mecanismo: carbocationes (regla de Markovnikov). R-CH=CH-R’ + HA R-CHA-CH2-R’ 2 Ácidos débilesrequieren catálisis ácida: Adición y eliminación son reacciones competitivas. Temperaturas altas favorecen la eliminación, obteniendo alqueno. HALUROS DE ALQUILO Nomenclatura: • Halógeno + cadena principal (la de mayor número de carbonos conteniendo el halógeno) se nombra como hidrocarburo. • El localizador más bajo posible se asigna al halógeno. • Otra posibilidad: nombrar como haluro de alquilo. Obtención de haluros de alquilo: 1. Halogenación de alcanos → monohaluro más sustituido. 2. Halogenación de alquenos → dihaluro vecinal. 3. Adición de HX a alqueno → monohaluro más sustituido. Reactividad de haluros de alquilo: 1. Deshalogenación de haluros de alquilo → Alquenos. 2. Reducción de haluros de alquilo → Reactivos de Grignard. Reactivo de Grignard (haluro de alquil magnesio) es un tipo de organométálico. R-CH2-X + Mg(s) 3. éter -δ +δ R-CH2-MgX Reacciones de sustitución: R-CHX-R’ + A-δB+δ nucleófilo R-CHA-R’ + BX Haluros 1º, mecanismo SN2 v=k[OH-][R-X] estado de transición Haluros 2º o 3º, mecanismo SN1 CH3-CHBr-CH3 + NaOH v=k[R-X] CH3-CHOH-CH3 + NaBr 1ª etapa: 2ª etapa: OH- OHOH- OH Producto obtenido ¿actividad óptica? Sustitución y eliminación en presencia de base fuerte, reacciones competitivas: CH3-CH2-CHBr-CH3 + NaOH CH3-CH2-CHBr-CH3 + NaOH CH3-CH2-CHOH-CH3 + NaBr alcohol CH3-CH=CH-CH3 + H2O + NaBr








