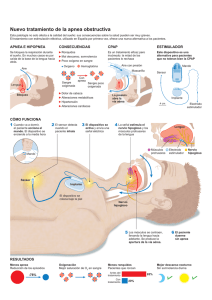
Volumen 23, Número 2, Marzo
Anuncio

Órgano oficial de la Sociedad Española de Neumología y Cirugía Torácica. SEPAR. Volumen 23, Número 2, Marzo-Abril 1987 Sumario editorial Vacunación antineumocócica: una llamada de atención. V. Ausina y M.a J. Condom. 57 originales EPOC y desnutrición. Resultados de un protocolo. L.M. Entrenas Costa, F. Santos Luna, L. Muñoz Cabrera, J. Muñoz Alguacil y A. Cosano Povedano. _____________________________________60 Cirugía de las metástasis pulmonares. Revisión de 40 casos. L. Madrigal, J. Zapatero, J. Lago, B. Baschwitz, E. Perrero y J. Candelas. 65 Rendimiento de la biopsia pulmonar con aguja de Abrams en el diagnóstico precoz de la tuberculosis miliar. E. Casariego Vales, C. Llórente, R. Pérez Alvarez, A. de la Fuente, J. Corredoira, M.J. López Alvarez y J.L. Soilan del Cerro. 69 diagnóstico y tratamiento La fatiga de los músculos respiratorios. G. Juan Samper, R. Navarro Iváñez y J. Lloret Solves. 72 notas clínicas Neumotorax espontáneo y esclerosis tuberosa. A. Pacheco Galván, J.P. Valdazo de Diego, M.T. Naya Nieto, L. Fogue Calvo, J. Lago Viguera y J. Zapatero Gavina. ______________________________________78 Manifestaciones radiológicas de los tumores germinales malignos primitivos de mediastino. J.D. Casas Curto, F.J. Alvarez Moro, R. Colomer Bosch, J. Escalada Berta y C. Tapies Barba. 81 revisión Síndrome de apnea durante el sueño. E. Barrot Cortés. 84 Órgano oficial de la Sociedad Española de Neumología y Cirugía Torácica. SEPAR. Volumen 23, Número 2, Marzo-Abril 1987 técnicas y procedimientos Utilización de un ordenador personal para mecanización de informes de exploración funcional respiratoria. M. Salgueiro Rodríguez, A. Golpe Gómez, L. Valdés Cuadrado, P. Al varez-Calderón Prat y J.R. Rodríguez Suárez. 97 cartas al director Parálisis del hemidiafragma izquierdo por herpes zóster cervical. A. Almansa. -nm Beta-dos microglobulina en líquido pleural: test inespecífico. F.J. Orriols Martínez, S. Saomil Roncero, J. Boldú Mitjans, P. Caballero García y F. de la Calle del Moral. ______________________________________101 Regresión espontánea de una proteinosis alveolar. Revisión a los diez años. R. Alvarez-Sala, C. Villasante, J.L. García Satué, S. Granados y J. Villamor. ______________________________________101 Proteinosis alveolar. Nula respuesta terapéutica a activadores del surfactante (ambroxol). J. Fernández-Bujarrabal, J.A. Hermida Gutiérrez, L. Sánchez Agudo y F.J. Guerra Sanz. ______________________________________103 Síndrome de las uñas amarillas: ¿infección por Pseudomonas aeruginosar! J.M. Aguado García. 1(\'\ EDITORIAL VACUNACIÓN ANTINEUMOCÓCICA: UNA LLAMADA DE ATENCIÓN V. AUSINA* y M.a J. CONDOM Departamento de Microbiología. Hospital de la Sta. Creu i Sant Pau. Facultad de Medicina de la Universidad Autónoma de Barcelona. Incluso con los tratamientos antibióticos actuales, la mortalidad en los pacientes de riesgo hospitalizados con bacteriemia neumocócica se ha mantenido por encima del 25 %1'3. Hoy disponemos de una nueva vacuna antineumocócica que ha sido preparada para prevenir las infecciones bacteriémicas y no bacteriémicas producidas por S. pneumoniae\^'i'. Esta nueva vacuna, como la anterior, contiene antígenos capsulares (polisacáridos) purificados y difiere de la primitiva en dos aspectos; por un lado, contiene antígenos de 23 serotipos diferentes de neumococo en lugar de los 14 que incluía la antigua formulación y, por otro, la dosis de cada antígeno ha sido reducida de 50 a 25 mcg. Se recomienda administrar una dosis única, después de la cual aparece un elevado título de anticuerpos que se mantiene por lo menos durante cinco años6. Una segunda dosis puede producir reacciones locales intensas, razón por la cual no se recomienda administrar más de una dosis, incluso a los enfermos inmunizados con la vacuna más antigua que contenía menos serotipos. Los 23 serotipos que contiene la vacuna actual son los responsables del 85-90 % de las infecciones neumocócicas bacteriémicas en distintos países6'8 y del 93-95 % de las neumonías de adquisición extrahospitalaria en nuestro medio9. Un reciente número de la prestigiosa revista Annals of Intemal Medicine contiene cuatro artículos6'10'12 y un editorial13 en los que se discute ampliamente la polémica creada en tomo a esta nueva vacuna. En dos de estos artículos se nos presentan opiniones encontradas sobre las indicaciones de la misma10'", en otro se hace un riguroso estudio coste-beneficio12 y en el último de ellos6 se sumariza la posición, coincidente con la del editorialista, del Public Pólice Committee of the American College of Physicians, que se muestra decididamente partidario de la vacunación en los enfermos que tienen un elevado riesgo de desarrollar una infección neumocócica grave. Los epidemiólogos del Center for Disease Control, salvando algunas de las antiguas dificultades que habían conducido a la obtención de resultados poco concluyentes en muchos estudios previos, han desarrollado un ingenioso método para 13 medir la eficacia de la vacuna antineumocócica; éste consiste simplemente en estudiar los serotipos causantes de infección en la población vacunada y no vacunada; si la vacuna es efectiva los serotipos deben ser diferentes en ambos grupos de población14. Con la aplicación de este método de evaluación, el estudio realizado por Bolán et al lü en USA entre mayo de 1978 y marzo de 1984 creemos que ha sido bastante decisivo contribuyendo a precisar las indicaciones de la vacuna en grupos seleccionados de población y aportar nuevos datos acerca de la eficacia de la misma en algunos casos en los que no estaba bien establecida. A la vista de los resultados de éste y otros estudios recientes, la vacunación antineumocócica debe ser especialmente recomendada a algunos grupos especiales. Pacientes con enfermedades que comportan un elevado riesgo de desarrollar una neumonía neumocócica bacteriémica o morir a consecuencia de ella si ésta se presenta, siempre que sean capaces de desarrollar una respuesta inmune adecuada a la vacuna. En esta categoría entrarían los enfermos anesplénicos o con anemia depranocítica, enfermedad pulmonar crónica, insuficiencia cardíaca congestiva, cirrosis, diabetes mellitus, síndrome nefrótico, insuficiencia renal y alcoholismo crónico. En el mencionado trabajo de Bolán et al10 la eficacia de la vacuna en este grupo de población se estimó en un 65 % (entre el 47-76 % con un intervalo de confianza del 95 %), no encontrándose diferencias estadísticamente significativas en relación a la edad en enfermos de más de dos años, ancianos inclusive. Es un hecho perfectamente establecido que la vacuna antineumocócica es poco eficaz en niños menores de dos años1'5'6. Los reparos de Williams y Mosser'' a recomendar la vacunación antineumócica en los enfermos con EPOC no nos parecen demasiado consistentes. En primer lugar, porque como han demostrado de forma concluyeme Mufson et al15, la incidencia de neumonía neumocócica en este grupo de población (160 casos por 100.000 X año) excede claramente, la de la población general y, además, porque una infección respiratoria en nuestros enfermos es intrínsecamente más grave, 57 ARCHIVOS DE BRONCONEUMOLOG1A. VOL. 23, NUM. 2, 1987 da lugar con mayor frecuencia a complicaciones y a una mayor mortalidad2'15'16. En un segundo grupo de indicaciones podrían incluirse aquellos pacientes que están natural o yatrogénicamente inmunodeprimidos y que presentan un riesgo elevado de desarrollar una infección neumocócica mortalu0. En este grupo estarían incluidos los enfermos con mieloma múltiple, leucosis linfática, hipogamaglobulinemia y enfermedad de Hodgkin tratada con radioterapia o quimioterapia y los transplantados de órganos. En general, la eficacia de la vacuna en los pacientes de este grupo no está tan bien establecida como en los del anterior. De hecho, en razón de su enfermedad de base o de las terapéuticas inmunosupresoras a que son sometidos, pueden no responder a la vacunal0'17 o el nivel de anticuerpos alcanzados con la vacunación puede descender después del inicio de la terapéutica inmunosupresora. La vacuna puede ser más eficaz si se administra dos semanas antes de la esplenectomía, la quimioterapia u otros 8procedimientos que dañen el sistema inmunitario' . Por otro lado, algunos pacientes alcohólicos con enfermedad de Hodgkin, mieloma múltiple o insuficiencia renal, producen una cantidad inadecuada de anticuerpos frente a uno o varios de los serotipos incluidos en la vacuna. Aunque, gracias al referido estudio de Bolán et al10, sabemos que, excepto en los niños menores de dos años, la eficacia de la vacuna no varía con la edad, ésta puede variar y de hecho así sucede, en relación con la enfermedad de base17. Finalmente, y esta es tal vez la indicación que ha suscitado más polémica, la vacuna antineumocócica también se recomienda para las personas de edad avanzada, especialmente aquellas de más de 65 años6. En diversos estudios recientes16'19 se ha podido comprobar que S. pneumoniae sigue siendo el principal agente de neumonía adquirida en la comunidad en adultos y el responsable de más del 80 % de los fallecimientos. En un estudio de MacFarlane et al16, el 79 % de las muertes ocurrieron en pacientes de edad igual o superior a 60 años. 20 Fedson ha sugerido que podría aplicarse la Inmunización neumocócica a todos los pacientes de más de 65 años ingresados en el hospital en el momento de ser dados de alta. Esto se fundamenta en su experiencia, corroborada posteriormente por Woodhead y MacFarlane21, de que un elevado porcentaje de los pacientes ingresados por neumonía (36 % de los que sobreviven y 49 % de los que fallecen) o por sepsis neumocócica (5060 % y 70 %, respectivamente) ya habían sido ingresados anteriormente en el curso de los cinco años precedentes. Las cifras referentes a las neumonías neumocócicas fueron similares a las de .otros tipos de neumonía y los porcentajes fueron algo superiores en los enfermos ancianos (en los 58 de más de 64 años de edad fueron del 48 y 51 %, respectivamente). Por otro lado, en el estudio de Bolán et al10 en enfermos de más de 65 años con diabetes mellitus, insuficiencia cardiaca, enfermedad pulmonar crónica o sin enfermedad de base, la eficacia global de la vacuna fue del 61 % (entre el 1 y el 85 % con un intervalo de confianza del 95 %). Difícilmente resultará factible y aceptable, fundamentalmente por razones de tipo económico y operativo, la inmunización de toda la población geriátrica, ni siquiera de aquella que ha sido ingresada en el hospital por cualquier motivo. Sin embargo, coincidimos con Fedson20 en que la inmunización de los enfermos de mediana y avanzada edad dados de alta en el hospital a consecuencia de enfermedades crónicas y que presenten alto riesgo (como enfermedades cardiacas y respiratorias o diabetes mellitus) puede ser una forma práctica y eficaz de reducir la morbilidad y mortalidad consecutivas a neumonía. En cualquier caso, no deja de ser sorprendente que un tema de tanta trascendencia sanitaria no haya sido planteado en nuestro país, ni siquiera a nivel conceptual. BIBLIOGRAFÍA 1. Schwartz JS. Pneumococcal vaccine: clinical efficacy and efectiveness. Ann Intern Med. 1982; 96:208-220. 2. Austrian R, Gold J. Pneumococcal bacteriemia with special reference to bacteremic pneumococcal pneumonia. Ann Intern Med 1964; 60:759-776. 3. Mufson MA, Kruss DM, Wasil RE, Metzger WI. Capsular types and outcome of bacteremic pneumococcal pneumonía. Aun Intern Med 1974; 143:505-510. 4. Austrian R. A reassessment of pneumococcal vaccine. N Engí J Med 1980; 303:549-552. 5. Centers for Disease Control. Update: pneumococcal polysaccharide vaccine usage. United States. MMWR 1984; 33:273-276. 6. Health and Public Policy Committee, American College of Physicians. Pneumococcal vaccine. Ann Intern Med 1986; 104:118-120. 7. Broome CV, Fackiam RR. Epidemiology of clinically significant isolates of Streptococcus pneumoniae in the United States. Rev Infect Dis 1981; 3:277-281. 8. Weisholtz J, Hartman BJ, Roberts RB. Effect of underlying disease and age on pneumococcal serotype distribution. A m J Med 1983; 75:199-205. 9. Ausina V. 1986. Datos personales no publicados. 10. Bolán G, Broome CV, Fackiam RR, Plikaytus BD, Fraser DW, Schiech WFIII. Pneumococcal vaccine efficacy in selected populations in the United States. Ann Intern Med 1986; 104:1-6. 11. Williams JH Jr, Moser KM. Pneumococcal vaccine and patients with chronic lung disease. Ann Intern Med 1986; 104:106-109. 12. Sisk JE, Riegelman RK. Cost effectiveness of vaccina- 14 V. AUSINA Y M.J. CONDOM.-VACUNACION ANTINEUMOCOCICA tion against pneumococcal pneumonia: an update. Ann Intern Med 1986; 104:79-86. 13. La Forcé FM, Eickhoff TC. Pneumococcal vaccine: the evidence mounts. Ann Intern Med 1986; 104:110-112. 14. Broome CV, Fackiam RR, Fraser DW. Pneumococcal disease after pneumococcal vaccination: an alternative method to estimate the efficacy of pneumococcal vaccine. N Engí J Med 1980; 303:544-552. 15. Mufson MA, Oley G, Hughey D. Pneumococcal disease in a medium-sized community in the United States. JAMA 1982; 248:1486-1489. 16. MacFarlane JT, Finch RG, Ward MJ, Macrae AD. Hospital study of adult community-acquired pneumonia. Lancet 1982; 2:255-258. 17. Shapiro ED, Clemens JD. A controlled evaluation of 15 the protective efficacy of pneumococcal vaccine for patients at high risk of serious pneumococcal infections. Ann Intern Med 1984; 101:325-336. 18. Siber GR, Witzman SA, Aisenberg AC. Antibody response of patients with Hodgkin's disease to protein and polysaccharide antigens. Rev Infecí Dis 1981; 3(Suppl.):S144159. 19. Foy HM, Wentworth B, Kenny GE, Kioeck JM, Grayston JT. Pneumococcal isolations from patients with pneumonia and control subjects in a prepaid medical care group. Am Rev Respir Dis 1975; 3:595-603. 20. Fedson DS. Hospital care and pneumococcal immunisation policy. Lancet 1982; 2:1226-1227. 21. Woodhead M, MacFarlane JT. Prevención de la neumonía neumocócica. Lancet (ed. cast.) 1983; 3:116. 59 ORIGINALES EPOC Y DESNUTRICIÓN. RESULTADOS DE UN PROTOCOLO L.M. ENTRENAS COSTA, F. SANTOS LUNA, L. MUÑOZ CABRERA, J. MUÑOZ ALGUACIL y A. COSANO POVEDANO Servicio de Neumología. Hospital Regional Reina Sofía. Córdoba. Se estudian 35 pacientes diagnosticadios de enfermedad pulmonar obstructiva crónica (EPOC) e ingresados por causas inherentes a su broncopatía con un protocolo de evaluación nutricional. El 88 % de los enfermos mostró algún déficit. El marasmo fue la mainutrición más frecuentemente hallada (71 %). Los parámetros nutricionales más fiables fueron el índice de creatinina/talla (ICT), el pliegue cutáneo tricipital (PCT), la circunferencia media muscular braquial (CMMB) y la circunferencia media braquial (CMB). Se encontró correlación entre parámetros antropométricos estimativos de la masa muscular (CMMB y CMB) y la capacidad vital forzada (FVC) y PaCO¡ (p < 0,05) como índices de función pulmonar. Se discute la interacción desnutrición-insuficiencia respiratoria, valorándose la utilidad de cada parámetro en nuestro caso. Arch Bronconeumol 1987; 23:60-64. Introducción El conocimiento intuitivo que los clínicos habían tenido durante mucho tiempo sobre la existencia de una desnutrición en el enfermo con insuficiencia respiratoria crónica se ha visto corroborado en los últimos años con la aparición de una serie de trabajos indicativos de que existe un descenso ponderal, como reflejo de una malnutrición latente o manifiesta, en el 40-70 % de la población con enfermedad pulmonar obstructiva crónica (EPOC) siendo más acusado en los pacientes con fallo respiratorio que necesitan hospitalización1-5. Este aspecto del enfermo con EPOC ha recibido poca atención en nuestro país. Por otra parte, está bien establecido que la malnutrición induce un deterioro de la función muscular y, en consecuencia, reduce la capacidad para mantener niveles adecuados de ventilación. Además, los enfermos con mayores déficits nutricionales están predispuestos al fallo respiratorio. Todavía se desconoce si estos cambios son consecuencia o contribución al mal estado clínico. Si Recibido el 2-4-86 y aceptado el 27-10-86. 60 COPD and mainutrition. Results of a study protocol Thirty ñve patients with chronic obstructive pulmonarv disease (COPD) admitted to hospital due to severa! reasons related to COPD were studied using a nutritional assessment protocol. At least one nutritional deficiency was found in 88 % of the patients. Marasmus was the most common form of mainutrition among our patients (71 %). The most reliable nutritional parameters were the creatinine/height ratio (ICT), the tricipital cutaneous fold (PCT), the mean brachial muscular perimeter (CMMB) and the mean brachial perimeter (CMB). A correlation was found between anthropometric parameters related to muscular mass (CMMB and CMB) and torced vital capacity (FVC) and PaCO¡ (p < 0.05) as pulmonary function indexes. The mainutrition-respiratory failure interaction is discussed while assessing the usefulness of every parameter used in our study. realmente tuvieran un efecto deletéreo sobre la condición clínica, su detección precoz e intervención terapéutica prevendrían ulteriores complicaciones. El objetivo del presente trabajo es valorar si existe desnutrición en nuestros enfermos con EPOC, su tipo y grado, determinar qué parámetros nutricionales son más útiles en la evaluación de estos pacientes y comprobar si existe relación entre desnutrición y situación funcional respiratoria. Material y métodos Durante los meses de noviembre 85 a enero 86 se han estudiado prospectivamente los enfermos ingresados en nuestro Servicio de Neumología. Eran incluidos en el protocolo de evaluación nutricional si cumplían criterios clínicos, radiológicos, fisiopatológicos, electrocardiográficos y analíticos de EPOC tipo enfisema o mixta6 y si el ingreso era debido a problema inherente a su broncopatía, fundamentalmente situaciones de descompensación secundaria a procesos infectivos y/o espásticos de las vías respiratorias. Fueron excluidos del estudio si presentaban otra causa conocida capaz de alterar de forma negativa el estado nutricional: neoplasia, hepatopatía, cardiopatía primaria avanzada, nefropatía, enfermedad endocrino-metabólica o intervención quirúrgica en los seis meses previos. 16 L.M. ENTRENAS COSTA ET AL.-EPOC Y DESNUTRICIÓN. RESULTADOS DE UN PROTOCOLO TABLA I TABLA III Estado funcional al ingreso Fiabilidad de parámetros FVC: 60.57 + 25.75 FEV 1: 35.29 + 22.19 FEV 1 %: 48.89 ± 15.91 pH: 7.370 ± 0.001 PaCO;: 46.26 ± 16.64 Pa0¡: 59.18 ± 15.40 Gasometria expresada como X ± SD. Parámetros espirométricos expresados como % del predicho ± SD. Los criterios de inclusión fueron cumplidos por 35 enfermos todos varones con historia de hábito taháquico y edad media 59,46 + 9,16 años (x ± SD) a los que se les realizó historia clínica y exploración física, radiografía de tórax en dos proyecciones, electrocardiograma, hematimetría completa, bioquímica elemental de sangre incluyendo enzimas, espirometría simple con espirómetro seco y gasometría arterial. La evaluación del estado nutricional se llevó a cabo en los primeros 5 días de hospitalización para obviar en lo posible los efectos negativos de la estancia hospitalaria sobre la nutrición7. Básicamente era una modificación del propuesto por la Scott and White Clinic" y puede dividirse en: Parámetros antropométricos: Peso corriente (PC) y talla obtenidos por báscula y reglilla graduada. Peso ideal (PI) calculado en tablas estándar según la talla. Porcentaje del peso ideal (% PI), según la fórmula % PI = PC x 100/PI. Pliegue cutáneo tricipital (PCT) medido con lipocalibre de presión continua. Circunferencia media braquial (CMB) medida con cinta métrica en el punto medio olécranonacromion. Circunferencia media muscular braquial (CMMB) según la fórmula CMMB - CMB - (0,314 X PCT). Parámetros analíticos: Excreción urinaria de creatinina en 24 horas. Debido a su variabilidad' se consideró el valor promedio de tres determinaciones obtenidas en días consecutivos10. Relacionando la cifra obtenida con la «esperada» para un adulto normal de la misma edad y sexo se obtiene el índice de creatinina/talla (ICT)10. Albúmina, cuantificada por proteinograma. Transferrina, medida por inmunodifusión radial. Parámetros estimativos de la competencia inmune: Linfocitos totales, derivados de la fórmula: linfocitos totales — total leucocitos x % linfocitos. Análisis de resultados con estadístico «Z» de la distribución normal, «t» de Student y coeficiente de correlación <cr» de Pearson. Resultados La gasometría arterial al ingreso mostraba globalmente una hipoxemia leve a moderada con ligero aumento de la PaCO;. En la espirometría Banda porcentual verdadera %PI PCT CMB CMMB ICT Albúmina Transferrina Cuota inferior Cuota superior 12% 36% 29% 34% 46% 20% 18% 47% 76% 69% 74% 85% 59% 56% practicada existía un síndrome obstructivo moderado a severo registrándose sólo en cuatro enfermos mejoría'de parámetros tras la administración de broncodilatadores (tabla I). Los resultados de la evaluación nutricional, detallados por parámetro considerado, se recogen en la tabla II. Siguiendo los criterios de Newmarks se ha clasificado el grado de desnutrición para cada parámetro en leve, moderado o severo, según sea del 90, 60-90 o menor del 60 % teórico calculado éste en tablas estándar. Conocidos los porcentajes de enfermos que, enfrentados con los valores teóricos, no alcanzaron más del 90 % de normalidad en cada parámetro observado, se evaluó la fiabilidad de los porcentajes con un riesgo de error del 1 %. Por fiabilidad debe entenderse la banda porcentual donde presumiblemente, y con un nivel de confianza del 99 %, se encuentra la verdadera proporción de sujetos que se alejan de la normalidad. Para el estudio se empleó el análisis del estadístico «Z» de la distribución normal. Los resultados para cada parámetro, expresando la banda porcentual verdadera, se reflejan en la tabla III. En la tabla II, en las columnas de normales y patológicos se reseña el valor medio para cada parámetro. La diferencia entre las medias de los valores normales y los patológicos, para cada parámetro, fue siempre significativa (p < 0,001). TABLA II Estado nutricional Parámetro %PI PCT CMB CMMB ICT ALB TRF LT Normales > 90 % N % 26 15 18 16 10 22 23 24 74 43 51 46 31 63 66 69 x 115 15 28 24 112 4 322 2.813 Leve 90 % N — — — — — 10 — 5 % — — — — — 29 — 14 Moderada 60-90 % N 9 12 17 19 11 3 10 1 % 26 34 49 54 34 8 29 3 Grave < 60 % N — 8 — — 11 — 1 5 % — 23 — — 34 — 6 14 Total patológicos N 9 20 17 19 22 13 11 11 % 26 57 49 54 69 37 34 31 x 81 8 23 21 63 3 181 1.108 P < < < < < < < < 0.001 0.001 0.001 0.001 0.001 0.001 0.001 0.001 % PI: Porcentaje del peso ideal; PCT: Pliegue cutáneo tricipital (mm); CMB: Circunferencia media braquial (cm). CMMB: Circunferencia media muscular braquial (cm); ICT: índice creatinina/talla; ALB: Albúmina sérica (g/100 mi). TRF: Transferrina (mg/100 mi); LT; Linfocitos totales por mililitro. 19 61 ARCHIVOS DE BRONCONEUMOLOG1A. VOL. 23, NUM. 2, 1987 TABLA IV Tipo del mainutrición 25 (71,4%) Marasmo Leve Moderado Severo 4 13 8 Tipo Kwashiorkor 0 6 (17,2 %) Mixto 4(11,4%) Normal Por lo que se refiere al tipo de déficit nutricional (tabla IV) en 25 enfermos se encontró un marasmo, en seis tipo mixto sin encontrarse ningún défict tipo kwashiorkor. En sólo cuatro enfermos el estado nutricional se pudo considerar por encima del 90 % del teórico en todos los parámetros y se estimó como normal. La correlación entre parámetros nutricionales y los estimativos de la función pulmonar se realizó mediante el cálculo del coeficiente «r» de Pearson. Sólo encontramos correlación a nivel significativo (p < 0,05) entre parámetros antropométicos estimativos de la masa muscular (CMB y CMMB) y la PaCO¡ y capacidad vital forzada (FVC). Discusión Para la valoración nutricional, el cuerpo puede considerarse dividido en seis compartimentos independientesn (fig. 1) llamados grasa, piel y hueso, masa extracelular, proteínas plasmáticas, protemas viscerales y proteínas somáticas o masa muscular. Durante la desnutrición los materiales de cada compartimento son utilizados en mayor o menor cuantía con objeto de proporcionar energía a los procesos metabólicos esenciales. El grado de utilización de cada compartimento es importante ya que no sólo sirven como mero almacén de calorías, sino que participan en múltiples funciones10. Especial relevancia guarda la deplección proteica, ya que no existe una cantidad ilimitada de proteínas. Las técnicas de evaluación nutricional derivan de los trabajos de Brozeck12 y Blackburn13, estos autores demostraron que una serie de medidas antropométricas y bioquímicas, junto con el recuento total de linfocitos y la medida de la reactividad cutánea a antígenos comunes, eran capaces de detectar las alteraciones que los déficits nutricionales causaban en los distintos compartimentos corporales (fig. 1). Comparando los datos obtenidos para cada paciente con los de una población estándar «normal» se obtiene un perfil del estado nutricional, aunque hay que tener en cuenta que la rigurosa aplicación de estos parámetros a un paciente sin una previa y extensa evaluación clínica puede inducir a cometer graves errores10. La revisión de nuestros enfermos nos lleva a la conclusión de que existe algún tipo de déficit nutricional en el 88 %, cifra superior a la que se señala como media en la literatura y que oscila en torno al 60 %1'4, probablemente por incluirse en estos trabajos enfermos con EPOC tipo bronquitis crónica. En los criterios de selección hemos seguido los de Openbrier5 que señala diferencias en el estado nutricional del enfisema y la bronquitis Total proteínas Pliegue cutáneo tricipital Grasa 75 Piel y esqueleto 6,3 65 Extracelular 40 Proteínas plasmáticas 0,3 Proteínas viscerales 1,5 Proteínas somáticas 4,5 Albúmina, transferrina, linfocitos, antígenos cutáneos PC, Pl, % Pl, CMB, CMMB, ICT Fig. 1. ( omparlimenlus corporales y procedimientos sugeridos para su evaluación. Modificado de Blackburn. PC: peso corriente; Pl: peso ideal; % Pl = porcentaje de peso ideal; CMB: circunferencia media braquial; CMMB: circunferencia media muscular braquial: ICT: índice de créate nina/talla. 62 20 L.M. ENTRENAS COSTA ET AL.-EPOC Y DESNUTRICIÓN. RESULTADOS DE UN PROTOCOLO crónica, no encontrándose alteraciones en estos últimos. La mainutrición tipo marasmo, originada por dieta deficitaria en calorías y caracterizada por descenso de la masa somática y depósitos grasos con preservación de los depósitos viscerales, ha sido la más habitual en nuestra serie (71 %) como en otros trabajos previos y más si se refiere a enfermos hospitalizados' \ En general, este tipo de déficit se describe como el habitual que puede adquirir todo paciente que ingresa en un hospital por enfermedad no quirúrgica14'15 y que puede pasar a una mainutrición tipo mixto si existe un factor desencadenante como la infección persistente4'7'16, tan frecuente en estos enfermos3'4'17'18 y que a su vez condiciona la hospitalización, lo que explica los 6 enfermos en que detectamos esta anomalía. Este trastorno nutricional tiene su origen en una toma calórica diaria descendida, como se ha comprobado en pacientes hospitalizados por EPOC y que presentaban signos de mainutrición severa (definida ésta por PCT < 60 % del estándar)3. Aunque algunos autores2 han detectado una ingesta calórica inversamente proporcional al deterioro de los parámetros somáticos, lo que daría un número de calorías por kg de peso aumentado en relación a sujetos sanos. Sin embargo, en el mismo trabajo se demuestra que el análisis de las calorías necesarias basado en el consumo de oxígeno en reposo, tanto en los pacientes ambulatorios como hospitalizados, indica una ingesta calórica inapropiada, cuya traducción clínica es una pérdida de peso fundamentalmente a expensas de los depósitos grasos con relativa conservación de los proteicos''4. La grasa corporal representa la adaptación a la ingesta calórica y sus reservas descienden con la inanición, así en la muerte por hambre existe una severa deplección grasa (70-90 % de los depósitos) con moderada deplección proteica (20 %)19, de aquí que se haya valorado mucho la determinación seriada del pliegue graso como método fácil, no invasivo y económico en el seguimiento clínico''3'10. Varios factores han sido implicados para explicar este disbalance calórico, desde estudios de personalidad2 hasta que la disnea incapacitaría para poder comer'. Más verosímil parece la hipótesis que atribuye a un aumento de las calorías de la dieta un incremento de la producción de C0¡ en pacientes muy sensibles a estos cambios2. A pesar de todo, el déficit de calorías y su consecuencia inmediata, el descenso ponderal, permanecen inexplicados hasta ahora'"5, aunque se conoce que los efectos de la desnutrición en el aparato respiratorio pueden centrarse en tres aspectos'7. En primer lugar, induciendo cambios en el parénquima pulmonar similares a los encontrados en el enfisema, así como alteraciones bioquímicas del surfactante20, estas últimas se corrigieron con la replección nutricional pero no así la 21 lesión anatómica. En segundo lugar, el hambre desencadena la neoglucogénesis, cuyo efecto inmediato es el paso de átomos de carbono de los aminoácidos musculares a carbonos de glucosa, con la consiguiente atrofia muscular, disminución de fuerza y reducción de la capacidad para mantener niveles adecuados de ventilación. Además se ha demostrado que la contractibilidad de las fibras restantes está reducida'7'2''23. Por último, se han detectado anomalías a nivel de los mecanismos de defensa pulmonar, fundamentalmente alteraciones del epitelio y descenso de la IgA secretora'7, Probablemente, estas anomalías contribuyan a una mayor incidencia y severidad de las infecciones. Por lo que se refiere a la utilidad de cada parámetro analizado en el estudio, la fiabilidad de cada uno se recoge en la tabla III. Dentro de esta banda porcentual se encuentra la verdadera proporción de sujetos con EPOC tipo enfisema o mixto y desnutrición. Obviamente, y dado lo reducido de la muestra, obliga a que la citada banda sea muy elástica, por lo que el presente estudio debe quedar abierto a ser completado en un futuro con un mayor número de observaciones que reduzcan la banda porcentual. No obstante, y si suponemos que la cuota inferior fuera la proporción verdadera buscada, es decir, considerando que como mínimo en una población con EPOC, en sucesivas determinaciones encontraríamos alteraciones nutricionales en porcentaje similar al de la cuota inferior, podemos deducir que los parámetros que más casos de anormalidad proporcionan son el ICT, el PCT, la CMMB y la CMB. Tales parámetros podrían afectar a más del 75 % de la población patológica. Pero dado lo complejo y variable que puede resultar la determinación del ICT9'10 y que, al igual que la CMB y CMMB, evalúa masa proteica somática, nos hace pensar en estas últimas como las más rentables a la hora de estimar este compartimento en nuestros enfermos. Son fáciles de realizar, económicas, reproducibles y no invasivas, lo que las convierte en ideales para la monitorización del paciente ambulatorio. Además se correlacionaron con la FVC y la PaCOz como estimativas de la función ventilatoria y, aunque la significación estadística fue baja (p < 0,05), en estudios sobre enfermos enfisematosos puros se ha encontrado mayor grado de correlación5. El PCT reúne las mismas ventajas que los dos parámetros antropométricos anteriores y, aunque evalúe un compartimento diferente, es útil para valorar al inicio el grado de deplección grasa y, en el seguimiento, la efectividad de la replección nutricional. La albúmina y transferrina, reflejo de la masa proteica visceral'6, y dado que este compartimento sólo se afecta en los últimos estadios del marasmo o en los déficits mixtos, sólo descendieron en 13 y 11 pacientes respectivamente. 63 ARCHIVOS DE BRONCONEUMOLOGIA. VOL. 23, NUM. 2, 1987 El contaje de linfocitos totales se encontró descendido en 11 pacientes, entre los que se incluyen los ocho de marasmo severo (tres de los cuales fallecieron durante la realización del protocolo). Aunque se haya comprobado una disminución de la respuesta inmunitaria en la desnutrición1'3'4'17'18, hay que tener en cuenta que el sistema inmune es muy complejo e influyen en él múltiples aspectos que pueden ser sensibles o no a la desnutrición. Por último, aunque clásicamente se ha hablado de bajo peso en estos enfermos, éste no se encuentra entre los parámetros más fiables en nuestro estudio, probablemente, y como señalan otros autores23'24, exista un aumento del líquido extracelular en la mainutrición que se vea agravado en el paciente con EPOC por su tendencia a retener líquidos si existe un fallo ventricular derecho asociado, y la terapéutica que se utiliza, diuréticos y corticosteroides, capaz de modificar el agua extracelular. En conclusión, nos encontramos ante un aspecto poco estudiado hasta ahora en el paciente con EPOC, pero no por ello sin importancia, como lo demuestra el alto porcentaje de afectados. Pensamos que como mínimo unas simples determinaciones antropométricas deben entrar a formar parte de la exploración rutinaria de todo paciente. Si bien los factores nutricionales per se puede que no precipiten el fallo respiratorio no cabe duda que una vez establecido juegan un papel importante en su mantenimiento, por lo que el estudio de los déficits nutricionales deberá completarse en un futuro con trabajos que demuestren los efectos de la replección nutricional. Aún no existen grandes series publicadas en este sentido pero, como piensa Rochester17, cuando existan demostrarán que ésta es beneficiosa. BIBLIOGRAFÍA 1. Driver AG, Me Alevy MT, Smith JL. Nutritional assessment of patients with chronic obstructive pulmonary disease and acute respiratory failure. Chest 1982; 82:568-571. 2. Braun SR, Kein NL, Dixon RM, Calagnaz P, Anderegg A, Shrago ES. The prevalence and determinants of nutritional changes in chronic obstructive pulmonary disease. Chest 1984; 86:558-563. 3. Braun SR, Dixon RM, Kein NL, Luby M, Anderegg A, Shrago ES. Predictive clinical valué of nutritional asessment factors in COPD. Chest 1984; 85:353-357. 64 4. Hunter AMB, Carey MA, Larsh HW. The nutritional status of patients with chronic obstructive pulmonary disease. Am Rev Respir Dis 1981; 124:376-381. 5. Openbrier DR, Irvin MM, Rogers RM, Gottiieb GP, Dauber JH, Van Thiel DH, Pennock BE. Nutritional status and lung function in patients with emphysema and chronic bronchitis. Chest 1983; 83:17-22. 6. Nash ES, Briscoe WA, Cournand A. The relationship between clinical and physiologic findings in chronic obstructive disease ofthe lung. Med Thorac 1965; 22:305-308. 7. Weinsier RL, Hunker EM, Krumdieck CL, Buttterworth CE. Hospital mainutrition: a prospective evaluation of general medical patients during the course of hospitalisation. Am 1 Clin Nutr 1979; 32:418-426. 8. Newmark SR. The role of nutritional support in the treatment of gastrointestinal disease. Therapeutic rationale and modalities. Surg Clin North Am 1979; 59:761-779. 9. Bristian BR, Blackburn GL, Sherman M. Therapeutic index of nutritonal deplection in hospitalized patients. Surg Gynecol Obstet 1975; 141:512-516. 10. Grant JP, Custer-PB, Thurlow J. Current techniques of nutritional assessment. Surg Clin North Am 1981; 61:427-463. 11. Blackburn GL, Bothe A Jr. Assessment of nutrition in cáncer patients. Cáncer Bulletin 1978; 30:90-93. 12. Brozek J. Physique and nutritional status of adult men. En: Brozek J (ed): Conference an the role of body measurements in the evaluation of human nutrition. Hum Biol 1956; 28:124-140. 13. Blackburn GL, Bristian BR, Maini BS. Nutritional and metabolic assessment of the hospitalized patient. J Parent Ent Nutr 1977; 1:11-22. 14. Blackburn GL, Bristian BR. Nutritional support resources in hospital practice. In: Nutritional Support of Medical Practico. Hagertown, Maryland, Harper and Row 1977; 139151. 15. Bristian BR, Blackburn GL, Vítale J, Cochran D, Naylor J. Prevalence of mainutrition in general medical patients. JAMA 1976; 235:1567-1570. 16. Me Burney M, Wilmore DW. Rational decisión making in nutritional care. Surg Clin North Am 1981; 61:571-582. 17. Rochester DF, Easu SA. Mainutrition and the respiratory system. Chest 1984; 85:411-415. 18. Kahan BD. Nutrition and host defense mechanism. Surg Clin North Am 1981; 61:557-570. 19. Leiter LA, Maliss EB. Survival during fasting may depend on fat as well as protein stress. JAMA 1982; 248:23062307. 20. Sahebjami H, Wirman JA. Emphysema-like changes in the lungs of starved rats. Am Rev Respir Dis 1981; 124:619624. 21. Odessey R. Amino-acid and protein metabolism in the diafragm. Am Rev Respir Dis 1979; 21:107-112. 22. Rochester DF, Arora NS, Braun NMT. Maximun contractile forcé of human diafragm muscle, determined in vivo. Trans Clin Climatol Assoc 1981; 93:200-208. 23. Elwyn DH, Bryan-Brown CW, Shoemaker WC. Nutritional áspects of body water disfocations in postoperative and depleted patiens. Ann Surg 1975; 182:76-84. 24. Cambell RHA, Brand HL, Cox JR, Howar P. Body weight and water in chronic cor pulmonale. Clin Sci Molec Med 1975; 49:323-335. 22 ORIGINALES CIRUGÍA DE LAS METÁSTASIS PULMONARES. REVISIÓN DE 40 CASOS L. MADRIGAL, J. ZAPATERO, J. LAGO, B. BASCHWITZ, E. PERRERO y J. CANDELAS Servicio Cirugía Torácica. Hospital Ramón y Cajal. Madrid. Los autores revisan un total de 40 pacientes intervenidos de metástasis pulmonares, siendo los tumores primarios más frecuentes los sarcomas osteogénicos y los tumores de Ewing, seguidos por los tumores de origen mamario y renal. El intervalo libre medio fue de 20,6 meses, existiendo relación significativa entre la duración de dicho intervalo y la supervivencia, así como con la bilateralidad o no de las lesiones. La técnica quirúrgica más frecuente fue la resección en cuña, aconsejándose la esternotomía media para los casos de afectación bilateral. La supervivencia a los tres años fue de un 38,09 % y a los cinco años de un 26,31 %. Arch Bronconeumol 1987; 23:65-68. Introducción La primera publicación en la literatura, haciendo referencia a la exéresis de un tumor metastásico pulmonar, secundario a un carcinoma renal, apareció en 1939 con motivo de un trabajo, ya histórico, de Barney'. Desde entonces, han sido numerosos los trabajos, algunos de ellos, como en el caso de Mountain2 con series muy amplias, llegando incluso, en la experiencia de Wiikins3, del Massachusetts General Hospital, a ser superior la supervivencia a cinco años para las metástasis resecadas que para el cáncer bronquial primitivo. En los últimos años, varios grupos de trabajo4 han adoptado una política más agresiva para el tratamiento de estos pacientes, basado en los beneficios de la quimioterapia adyuvante pre y postoperatoria y los buenos resultados obtenidos con las intervenciones iterativas en un mismo paciente. Material y métodos Se revisan los pacientes con metástasis pulmonares sometidos a cirugía en un período comprendido entre 1978 y 1985. Un total de 40 pacientes han sido operados por nosotros, realizánRecibido el 23-6-96 y aceptado el 10-11-86. 25 Surgical treatment of pulmonary metastases. Review of 40 cases Forty patients surgically treated for pulmonary metastases are reviewed. The most common priiiiary tumors were osteogenic sarcoma and Ewing's tumor, followed by tumors from breast and kidney origin. The mean free interval "as 20.6 months and a significant relationship was found between the length of the interval and the survival time, as well as the bilateralism or not of the disease. The most common surgical procedure was wedge resection and a middie sternotomy is recommended when both side are involved. The survival rate at 3 years was 38.09 %, being of 26.31 % at 5 years. dose un total de 44 intervenciones (toracotomías y/o esternotomías). El rango de edades fue de 2 a 77 años, con una media de 38,3 años. De estos pacientes 23 fueron varones (57,5 %) y 17 mujeres (42,5 %). Las metástasis pulmonares fueron descubiertas en controles periódicos de su tumor primario en 35 casos (87,5 %), estando todos ellos asintomáticos desde el punto de vista torácico; y en los otros cinco casos (12,5 %) los síntomas principales fueron: dolor torácico en dos casos (5 %) y sintomatología pulmonar (tos, expectoración hemoptoica, etc.) en tres casos (7,5 %). Las tomografías de tórax que se realizaron sistemáticamente, y la TAC fueron los estudios más destacables. Mediante estas pruebas se confirmaron la uni o bilateralidad de las lesiones, intentándose asimismo precisar el número de metástasis. En 23 casos (57,5 %) las lesiones fueron unilaterales y en 17 casos (42,5 %) fueron bilaterales. Se confirmó la afectación bastante similar de uno u otro pulmón. Así, de los 23 casos en que las lesiones fueron unilaterales, el pulmón derecho resultó afecto en 13 casos y el pulmón izquierdo en 10 casos. TABLA I Tumor primario (carcinomas) N.° Mama Riñon Útero Testículo Colon Tiroides Carcinoma epidermoide miembro SI Melanoma miembro SD Cilindroma maxilar superior 4 4 3 2 2 1 1 1 1 TOTAL 19 65 ARCHIVOS DE BRONCONEUMOLOG1A. VOL. 23, NUM. 2, 1987 TABLA II Tumor primario (sarcomas) N." S. osteogénico T. Ewing Fibrosarcoma Rabdomiosarcoma Liposarcoma Fibrohistiocitoma 8 8 2 1 1 1 TOTAL 21 TABLA III Tratamiento tumor primario Cirugía y RT y/o QT Cirugía RT y/o QT TOTAL Casos 28 (70 %) 9 (22,5%) 3 (7,5 %) 40 Los tipos de tumor primario se muestran en las tablas I y II, separando los carcinomas y los sarcomas, siendo el sarcoma osteogénico y el tumor de Ewing los más frecuentes (20 %) tanto para la serie de los sarcomas como para la serie total, seguidos de los tumores de origen mamario y renal (10 %). Los sarcomas fueron los tumores originarios de las metástasis pulmonares en 21 casos (52,5 %) y los carcinomas en 19 casos (47,5 %). El tratamiento del tumor primario fue cirugía más radioterapia y/o quimioterapia en la mayoría de los casos, mientras que en el resto fue cirugía sola y radioterapia o quimioterapia (tabla III). La supervivencia encontrada en nuestra serie, a los 2, 3 y 5 años fue del 52,38 %, 38,09 % y 26,31 % respectivamente (fig. 1). Discusión A la hora de establecer las indicaciones quirúrgicas de las metástasis pulmonares, existen una serie de criterios prioritarios que son admitidos por todos los autores5. Así, es imprescindible: 1) Resección completa del tumor primario sin recidiva local. 2) Ausencia de metástasis en otras partes del organismo. 3) Posibilidad de exéresis de todas las metástasis con la cirugía. Además de estas premisas, otros autores como Brandt6, añaden a su vez tres indicaciones más para la cirugía, las cuales vienen representadas por: 1) Biopsia para determinar marcadores tumores. 2) Biopsia para evaluar resultados de la quimioterapia. 3) Exéresis de la enfermedad residual tras la quimioterapia, especialmente en el caso de sarcomas osteogénicos o de los carcinomas testiculares. La cirugía sigue manteniendo su papel en aquellos casos de lesiones solitarias, en que agotadas todas las medidas menos cruentas, no se hubiera conseguido llegar a un diagnóstico histológico, máxime si existe el antecedente de un cáncer primitivo ya tratado o en tratamiento. Para McCormack7, una lesión solitaria en un pulmón suele ser metastásica si el primitivo era un sarcoma o un melanoma y sería un segundo primario si la anterior neoplasia estuvo ubicada en cabeza, cuello o Resultados En el tratamiento quirúrgico empleado en los 40 pacientes, se realizaron un total de 44 intervenciones, eligiendo como vía de abordaje la toracotomía en 25 casos (62,5 %) y la estemotomía media en 15 casos (37,5 %). Dentro de éstos, en un caso se realizó toracotomía bilateral (tabla IV). La técnica quirúrgica más empleada, en nuestra serie, fue la resección en cuña (85 %). En cuatro casos (10 %) se realizaron lobectomías más resecciones en cuña. En un caso (2,5 %) se realizó neumonectomía derecha, debido al gran tamaño de la tumoración que traspasaba las cisuras, afectando, en mayor ó menor grado, los tres lóbulos. En dos casos (5 %) fueron irresecables por la localización de las lesiones e infiltración de estructuras adyacentes (tabla V). La morbilidad fue del 5 % (dos casos), destacando pérdidas aéreas mantenidas en un caso e infección de herida quirúrgica en otro. La mortalidad operatoria ocurrió en un caso (2,5 %), falleciendo durante su estancia hospitalaria a consecuencia de una insuficiencia cardiorrespiratoria irreversible. 66 TABLA IV Tratamiento quirúrgico Toracotomía Estemotomía media Toracotomía bilateral E. media y toracotomía N.° casos 25 15 1 3 44 TOTAL TABLA V Técnicas quirúrgicas Resección en cuña Lobectomías superior derecha (1) inferior derecha (1) superior izquierda (3) inferior izquierda (2) Neumonectomías Irresecables TOTAL N.° 34 7 1 2 44 26 L. MADRIGAL ET AL.-CIRUGIA DE LAS METÁSTASIS PULMONARES. REVISIÓN DE 40 CASOS en la mama, existiendo las mismas posibilidades de que se trate de un proceso u otro, cuando estuvo alojada en el aparato gastrointestinal o genitourinario. Diversos factores de índole pronostica han sido analizados en estos pacientes. Así Putnams, pudo comprobar cómo el tiempo de duplicación de las lesiones, igual o superior a 20 días, conllevaba una mejor expectativa de vida (22 meses de supervivencia media frente a 6 meses en los que era inferior a 20 días) influyendo a su vez en la experiencia de este autor, la existencia de cuatro nodulos o menos en las tomografías preoperatorias (23 meses de supervivencia media frente a seis cuando había más de cuatro lesiones), y la duración del intervalo libre, entre el tumor primario y la aparición de las metástasis pulmonares, de tal forma que cuando era superior á un año presentaban una supervivencia media de 32 meses contra 10 meses en los que el intervalo era inferior al a&o. En nuestra serie, los pacientes que tuvieron un intervalo libre medio de 30 meses presentaron una supervivencia media de 39,9 meses, mientras que los que tuvieron un intervalo igual o inferior a 18 meses tuvieron una supervivencia media de 10,46 meses. La importancia de cada uno de estos aspectos varía según las series revisadas, coincidiendo la mayoría9'10, al igual que en nuestra experiencia, en el valor significativo que implica la duración del intervalo libre. Para Roth u , en cambio, el número de metástasis visibles en la tomografía constituiría el factor más fidedigno, si bien en la revisión de Morrow12, de 167 casos operados, el 27 % de aquellos pacientes con lesiones múltiples vivían cinco años, frente a un 22 % de los que presentaban lesiones únicas. En nuestra serie no hemos encontrado relación significativa entre el número de metástasis y la supervivencia. Así, los pacientes que fallecieron antes de los dos años presentaron una media de 4,1 lesiones por paciente, mientras que los que vivieron más de dos años presentaron una media de 6,09 lesiones por paciente. Por el contrario, sí hemos encontrado relación entre la bilateralidad de las lesiones y la supervivencia: el 60 % de los pacientes que presentaron lesiones bilaterales fallecieron antes de los dos años, mientras que el 27,27 % de los pacientes con bilateralidad de las lesiones viven más de dos anos. Chang13 pudo comprobar a su vez cómo la tomografía standard infravaloraba el número de metástasis reales comparado con la cirugía cuando aquella detectaba cuatro o más lesiones, obteniéndose la verdadera cifra multiplicando al menos por dos, resultando la TAC más sensible que la tomografía convencional, si bien menos específica, al igual que hemos podido registrar en nuestra serie. 27 Supervivencia % 10090. 8070. SOSO. 52,38 % 40- 38,09 % 30. 26,31 % 2010. Años Figura 1 Gundry14 hace hincapié en el mal pronóstico que arroja la presencia de microfocos metastásicos separados de los nodulos tumorales macroscópicos en las piezas de exéresis, desarrollándose nuevas metástasis en el 93 % de estos pacientes en un plazo medio de cinco meses, constituyendo, por lo tanto, un factor muy importante a tener en cuenta en el análisis histopatológico. Mountain15 analizó el seguimiento a cinco años de 159 casos consecutivos operados de metástasis pulmonares por carcinomas, encontrando una mayor supervivencia en aquellos provenientes del sistema urinario (50 %), aparato genital masculino (37 %), cabeza y cuello (30 %), y colon y recto (28 %), siendo la más baja los secundarios a carcinoma de mama (14%) en los cuales se aconseja la práctica de una mediastinoscopia rutinaria 12 , dada su tendencia a la invasión del mediastino. Fiye16 encuentra una supervivencia a cuatro años para aquellos casos con metástasis no sincrónicas de sarcomas osteogénicos de un 44 %, mientras que para los sarcomas de partes blandas fue de un 35 %. De este modo, la mayoría de los autores no encuentran diferencias significativas, en cuanto a la supervivencia, entre los carcinomas y los sarcomas17. Igual ocurrió en nuestra serie, en la que pudimos comprobar que de los pacientes que vivieron más de dos años, el 37,2 % fueron portadores de un sarcoma, mientras que el 41,6 % lo fueron de carcinomas. Con respecto al tratamiento quirúrgico, la vía , de abordaje puede ocasionar algunas discrepancias en cuanto a su elección. CooperIS y Takita19 se muestran partidarios de la esternotomía media en el caso de lesiones bilaterales, dada la más rápida recuperación funcional y mejor tolerancia 67 ARCHIVOS DE BRONCONEUMOLOGIA. VOL. 23, NUM. 2, 1987 que la toracotomía standard. Sin embargo, el problema se plantearía en caso de lesiones unilaterales en el estudio preoperatorio. Lógicamente en estos casos estaría indicada la toracotomía; sin embargo, Regal2" encontró en su serie cómo el 43 % de los pacientes con metástasis bilaterales fueron diagnosticados erróneamente antes de la cirugía como portadores de lesiones unilaterales única y exclusivamente, señalando además que la esternotomía media, al realizar la extirpación de las metástasis en un tiempo, permite la rápida puesta en marcha de la quimioterapia complementaria. En nuestra serie hemos empleado la esternotomía media como vía de abordaje en los casos diagnosticados de enfermedad bilateral y la toracotomía en los casos de lesiones unilaterales. En cuanto a las técnicas quirúrgicas, la resección en cuña es la técnica de elección en todas las series21'22, siempre que sea posible, tratando de economizar al máximo en la exéresis del parénquima pulmonar. Algunos autores preconizan de entrada exéresis más amplias dependiendo del tipo de tumor primario. Así Cahan23 aconseja la práctica de lobectomías en el caso de metástasis de colon o de melanomas, dado el alto índice de ganglios regionales invadidos que han sido encontrados en estos casos. Ballantine24, asimismo, se muestra partidario de esta última técnica en los niños para evitar al máximo las recidivas tras exéresis más pequeñas. En definitiva, los buenos resultados obtenidos con la cirugía y la escasa morbimortalidad registrada han colaborado al auge que ha adquirido el tratamiento quirúrgico en la terapéutica de las metástasis pulmonares25. BIBLIOGRAFÍA 1. Barney JD, Churchill EJ. Adenocarcinoma of the kidney with metastases to the lung cured by nefrectomy and lobectomy. J Urol 1939; 42:269-276. 2. Mountain CF, McMurtrey MJ, Hermes KE. Surgery for pulmonary metastases: a 20 year experience. Ann Thorac Surg 1984; 38:323-330. 3. Wiikins EW, Head JM, Burke JF. Pulmonary resection for metastatic neoplasms in the lung. Experience at the Massachusetts General Hospital. Am J Surg 1978; 135:480-483. 4. Giritsky AS, Etcubanas E, Mark JED. Pulmonary resection in children with metastatic osteogenic sarcoma. Improved survival with surgery, chemoterapy and irradiation. J Thorac Cardiovasc Surg 1978; 75:354-362. 5. Wright JO, Brandt B, Ehrenhaft JL. Results of pulmonary resection for metastatic lesions. J Thorac Cardiovasc Surg 1982; 83:94-99. 68 6. Brandt B, Ehrenhaft JL. Surgical management of pulmonary metastases in 1980, Vol. 4. Clarkieds, R.L., Hickey, R.C. Current Problems in Cáncer. Chicago, Year Book Medical Publishers Inc 1980; 4:4. 7. McCormack PM, Marini N. The changing role of surgery for pulmonary metástasis. Ann Thorac Surg 1979; 28:139-145. 8. Putnam JB, Roth JA, Wesley MN, Johnston MR, Rosenberg SA. Analysis of prognostic factors in patients undergoing resection of pulmonary metastases from soft tissue sarcomas. J Thorac Cardiovasc Surg 1984; 87:260-268. 9. Telander RL, Pairolero PC, Pritchard DJ, Sim FH, Gilchrist GS. Resection of pulmonary metastatic osteogenic sarcoma in children. Surgery 1978; 84:335-341. 10. Donzeau-Gouge GP, Fouchet MC, Bazelly B, Garnier CH, Pasquier P, Vanetti A, Daumet PH. Traitement chirurgical des metastases pulmonaires. A propos de vingt-six cas. Sem Hóp Paris 1983; 43:2985-2988. 11. Roth JA, Putnam JB, Wesley MN, Rosenberg SA. Differing determinants of prognosis following resection of pulmonary metastases from osteogenic and soft tissue sarcoma patients. Cáncer 1985; 55:1361-1366. 12. Morrow CE, Vassilopoulos PP, Grage TB. Surgical resection for metastatic neoplams of the lung: experience at the University of Minnesota Hospitals. Cáncer 1980; 45:29812985. 13. Chang AE, Schaner EG, Conkie DM, Fiye MW, Doppman JL, Rosenberg SA. Evaluation of computed tomography in the detection of pulmonary metastases. A prospective study. Cáncer 1979; 43:913-916. 14. Gundry SR, Coran AG, Lemmer J, Wesley JR, Hutchinson R. The influence of tumor microfoci on recurrence and survival following pulmonary resection of metastatic osteogenic sarcoma. Ann Thorac Surg 1984; 38:473-478. 15. Mountain CF, Khalil KG, Hermes KE, Frazier OH. The contribution of surgery to the management of carcinomatous pulmonary metastases. Cáncer 1978; 41:833-840. 16. Fiye MW, Woltering G, Rosenberg SA. Aggresive pulmonary resection for metastatic osteogenic and soft tissue sarcomas. Ann Thorac Surg 1984; 37:123-127. 17. Beattie EJ. Surgical treatment of pulmonary metastases. Cáncer 1984; 54:2729-2731. 18. Cooper JD, Nelems JM, Pearson FG. Extended indications for median sternotomy in patients requiring pulmonary resection. Ann Thorac Surg 1978; 26:413-418. 19. Takita H, Edgerton F, Karakpusis C, Douglas HO, Vincent RG, Beckiey S. Surgical management of metastases to the lung. Surg Gynecol Obstet 1981; 152:191-194. 20. Regal AM, Reese P, Antkowiak J, Hart T, Takita H. Median sternotomy for metastatic lung lesions in 131 patients. Cáncer 1985; 55:1334-1339. 21. Frenckner B, Lannergren K, Soderlund S. Results of surgical treatment of lung metastases in children. Scand J Thorac Cardiovasc Surg 1982; 16:201-204. 22. Bravo Bravo JL. Metástasis pulmonares y cirugía. Rev Clin Esp 1984; 174:137-138. 23. Cahan WG, Castro EB, Hajdu SI. Therapeutic pulmonary resection of colonic carcinoma metastatic to the lung. Dis Colon Rectum 1974; 17:302-309. 24. Ballantine TV, Wiseman N, Filler RM. Assesment of pulmonary wedge resection for the treatment of the lung metastases. J Pediatr Surg 1975; 10:671-676. 25. Marks P, Ferrag MZ, Ashraf H. Rationate for the surgical treatment of pulmonary metastases. Thorax 1981; 36:679682. 28 ORIGINALES RENDIMIENTO DE LA BIOPSIA PULMONAR CON AGUJA DE ABRAMS EN EL DIAGNOSTICO PRECOZ DE LA TUBERCULOSIS MILIAR E. CASARIEGO VALES, C. LLÓRENTE, R. PÉREZ ALVAREZ, A. DE LA FUENTE*, J. CORREDOIRA, M.J. LÓPEZ ALVAREZ y J.L. SOILAN DEL CERRO Servicio de Medicina Interna y Servicio de Anatomía Patológica*. Hospital del Insalud. Lugo. Analizamos los resultados de 17 biopsias pulmonares realizadas con aguja de Abrams en otros tantos pacientes en los que se sospechó tuberculosis miliar por métodos clínicos y radiológicos. Se apreciaron hallazgos histológicos sugestivos de tuberculosis en los 17 enfermos (100 %), cultivándose Mycobacterium tuberculosis en siete (52,9 %). Como efectos adversos sólo se registró un neumotorax (5,8 %). El período de tiempo empleado en confirmar el diagnóstico fue de 3-4 días. Concluimos que la biopsia pulmonar con aguja de Abrams es una técnica sencilla, eficaz y segura en el diagnóstico precoz de pacientes con tuberculosis miliar que presentan una radiografía de tórax sugestiva de este proceso. Effíciency of pulmonary biopsy using Abrams needle in the early diagnosis of miliary tuberculosis Arch Bronconeumot 1987, 23:69-71. We assessed the results of 17 pulmonary biopsies performed with Abrams needle in 17 patients with suspected criteria. Histológica! findings suggestive of tuberculosis were found in all the 17 patients (100 %). Cultures yielded Mycobacterium tuberculosis in 7 patients (52,9 %). The oniy adverse effect was pneumothorax in one occasion (5,8 %). The time period required to confírm the diagnosis was 3-4 days. We conclude that pulmonary biopsy using Abrams needle is a simple, effective and safe method that may be used in the early diagnosis of miliary tuberculosis provided that the thorax x-ray study is suggestive of that disease. Introducción Material y métodos La tuberculosis miliar (TM) es una forma clínico patológica de tuberculosis producida por la diseminación masiva por vía hematógena del bacilo tuberculoso. Sin tratamiento específico, el pronóstico es malo, de lo que se deduce la gran importancia del diagnóstico precoz'. En aquellos casos con fiebre y el típico patrón miliar en la radiografía de tórax, la sospecha diagnóstica no es difícil. Para este grupo de enfermos se han propuesto distintas actitudes de estudio; de entre ellas la biopsia pulmonar transtorácica ha demostrado ser una técnica de alta rentabilidad diagnóstica2 3, aunque en algunas series se ha comunicado un elevado índice de complicaciones4'5. El objetivo del presente trabajo es analizar la experiencia acumulada durante cuatro años en el empleo de la biopsia pulmonar con aguja de Abrams para el diagnóstico de la TM. Entre 1982 y 1985 se estudiaron en el Servicio de Medicina Interna del Hospital del Insalud de Lugo 26 enfermos en los que se sospechó TM en el momento del ingreso hospitalario al presentar un cuadro clínico compatible y observarse patrón miliar en la radiología torácica. En 17 de ellos (65,3 %) no se logró establecer el diagnóstico definitivo de tuberculosis en las primeras 48 horas de estancia hospitalaria a través de: a) Estudio con tinción de auramina en muestras de esputo, orina, líquidos de cavidades serosas (en su caso) o de líquido cefalorraquídeo (cuando se consideró indicada la punción lumbar), b) Tomas biópsicas de zonas de fácil acceso (piel, adenopatías), donde se realizaron estudios histológicos convencionales y tinciones para observación directa. En estos 17 enfermos se practicó biopsia pulmonar con aguja de Abrams según la técnica de Newhouse6. En todos los casos se realizaron dos extracciones de tejido de forma consecutiva para reducir los riesgos de obtener material inapropiado o insuficiente. Las muestras se enviaron a los servicios de Bacteriología y Anatomía Patológica. Los procedimientos histológicos fueron los habituales. Se utilizó la tinción de auramina para la detección microscópica de BAAR. Los medios de cultivo empleados fueron: Lowenstein Jensen y Coletsos, manteniéndose en las condiciones apropiadas durante un máximo de ocho semanas. Se consideró como indispensable para el diagnóstico el aislamiento de Mycobacterium tuberculosis o la demostración histológica de granulomas tuberculoides con presencia o no de bacilos Recibido e] 2-7-1986 y aceptado el 30-9-1986. 31 69 ARCHIVOS DE BRONCONEUMOLOGIA. VOL. 23, NUM. 2, 1987 TABLA I Resultados de la biopsia de pulmón con aguja de Abrams en 17 pacientes con tuberculosis miliar N." casos Confirmación histológica bacteriológica Complicaciones 17 9 1 % 100 52,9 5,8 ácido-alcohol resistentes; requiriéndose en este caso la curación con tratamiento específico7. Se realizó estudio necrópsico en el único paciente fallecido durante el tratamiento. La vigilancia de posibles complicaciones de la técnica consistió en el control de los signos vitales por un período de 24 horas. Se realizaron radiografías de tórax en inspiración y espiración forzada inmediatamente después de la biopsia, a las cuatro horas y a las 24 horas. El tratamiento incluyó en todos los casos isoniacida, rifampicina y etambutol. Se siguió la evolución en la policlínica por períodos comprendidos entre 6 y 45 meses (x: 18 meses). Resultados De los 17 enfermos estudiados, nueve (52,9 %) eran varones y ocho (47,1 %) mujeres. Las edades de los pacientes oscilaron entre 25 y 77 años, siendo la edad media 62,2 años. Se obtuvo tejido pulmonar representativo para el diagnóstico en los 17 pacientes (100 %). El estudio histológico se realizó en todos los casos sobre muestras escasamente distorsionadas, demostrándose hallazgos compatibles con tuberculosis en el 100 % de los especímenes remitidos. Con respecto a los fragmentos enviados al Servicio de Bacteriología, en ocho pacientes (47,1 %) se apreciaron bacilos ácido-alcohol resistentes en el examen directo, aunque el cultivo mostró Mycobacterium tuberculosis en nueve (52,9 %) (tabla I). Sólo uno (5,8 %) de nuestros enfermos presentó un neumotorax que requirió la inserción de un tubo de drenaje, lográndose una rápida reexpansión pulmonar. No se apreciaron otras complicaciones y ningún enfermo aquejó dolor persistente en la zona de punción. El retraso en obtener el diagnóstico que permitió iniciar el tratamiento específico osciló entre tres y cuatro días a contar desde el momento del ingreso hospitalario. La evolución fue satisfactoria en 16 enfermos durante el período de seguimiento. Un paciente falleció en el decimoquinto día de tratamiento, demostrándose en el estudio necrópsico la extensión de la enfermedad a múltiples órganos. Discusión El diagnóstico definitivo de cualquier tipo de tuberculosis requiere el aislamiento por cultivo y posterior identificación del Mycobacterium tuberculosis, sin embargo, ante un cuadro clínico y radiológico 70 compatible, la presencia de bacilos ácido-alcohol resistentes o de granulomas tuberculoides en el estudio histológico permite al clínico iniciar un tratamiento específico8. Puesto que el patrón miliar es el único dato que orienta firmemente hacia TM en el momento del ingreso hospitalario9, valoramos qué técnicas ofrecían una mayor rentabilidad con un menor índice de complicaciones. Seleccionamos la biopsia pulmonar con aguja de Abrams por ser un método de fácil realización en nuestro ámbito hospitalario con el que se obtienen muestras apropiadas para un correcto estudio histológico y bacteriológico; al mismo tiempo que tiene un índice bajo de complicaciones severas6. Aunque la biopsia transbronquial es una técnica con buenos resultados en el diagnóstico de tuberculosis10"12, no la valoramos en este trabajo por no estar disponible en nuestro centro en el momento que se inició el presente estudio. La rentabilidad de la biopsia pulmonar con aguja de Abrams ha sido muy alta en nuestra serie, permitiendo establecer el diagnóstico de TM en el 100 % de los casos. Los resultados de los estudios histológicos han sido excelentes y superiores a las referidas para otras localizaciones'-13'14. Asimismo hay que destacar las altas positividades del estudio bacteriológico de los fragmentos biópsicos, similares a las comunicadas para la biopia hepática y superiores a los referidos para médula ósea'-2'13. El tiempo medio transcurrido entre el ingreso del paciente y su diagnóstico con esta técnica fue de 3-4 días, período sensiblemente inferior al señalado por otros autores1'13. Esto permitió iniciar el tratamiento específico muy precozmente, lo que sin duda ha influido en la buena evolución de la mayoría de nuestros enfermos. Cuando analizamos las complicaciones de la biopsia pulmonar con aguja de Abrams encontramos que sólo uno de los 17 pacientes (5,8 %) presentó un neumotorax. Este porcentaje es inferior al publicado por otros autores en el empleo de esta técnica6-'5, hecho que puede explicarse, al menos parcialmente, por la gran experiencia acumulada en nuestro servicio en el manejo de esta exploración diagnóstica. Concluimos que la biopsia de pulmón con aguja de Abrams ofrece en nuestra serie una alta rentabilidad diagnóstica y un bajo índice de complicaciones, por lo que la consideramos una técnica recomendable para la confirmación precoz de TM con expresión radiológica. AGRADECIMIENTOS A los Dres. Rey Reparaz y López Martínez por su inestimable colaboración en la realización del presente trabajo. BIBLIOGRAFÍA 1. Munt PW. Miliary tuberculosis in the chemotherapy era: with a clinical review in 69 american adults. Medicine (Baltimore) 1971; 51:139-155. 32 E. CASARIEGO VALES ET AL.-RENDIMIENTO DE LA BIOPSIA PULMONAR CON AGUJA DE ABRAMS EN EL DIAGNOSTICO PRECOZ DE LA TUBERCULOSIS MILIAR 2. Sahn SA, NeffTA. Miliary tuberculosis. Am J Med 1974,; 56:495-505. 3. King EG, Bachynski JE, Mielke B. Percutaneus trephine lung biopsy. Evaluing role. Chest 1976; 70:212-216. 4. Graeve AH, Saúl VA, Akl BF. Role of different methods of lung biopsy in the diagnosis of lung lesions. Am J Surg 1980; 140:742-746. 5. Greenman RL, Goodal PT, King D. Lung biopsy in immunocompromised hosts. Am J Med 1975; 59:488-496. 6. Newhouse MT. Suction excisión biopsy for diffuse pulmonary disease. Chest 1973; 63:707-712. 7. International Conference on Tuberculosis. Chest 1979; 76:737-817. 8. Hopeweil PC. Tuberculosis y enfermedades producidas por micobacterias no tuberculosas. En: Stein JH ed. Medicina Interna I." edición. Barcelona, Salvat Editores SA 1983; 1473-1489. 9. Berger HW, Samortin TG. Miliary tuberculosis. Diagnostic methods with emphasis on the chest roentgenogram. Chest 1970; 58:586-589. 10. Burx JR, Virsiav J, Bynum LJ. Miliary tuberculosis diagno- 33 sed by fiberoptic bronchoscopy and transbronchial biopsy. Tubercle 1978; 59:107-109. 11. So SY, Yu YC, Lam WK. Rapid diagnosis ofsuspected pulmonary tuberculosis by fiberoptic bronchoscopy. Tubercle 1982; 63:195-200. 12. Pacheco Galván A, Gómez Manpaso E, Lázaro y de Mercado P et al. Tuberculosis pulmonar y fibrobroncoscopia. Med Clin (Barc) 1984; 83:531-533. 13. Vidal Pía R, Vilaplana M, Richart C, Morell F, Ruiz Manzano J, Morera Prat J. Presentación clínica y métodos diagnósticos en 113 casos de tuberculosis miliar. Med Clin (Barc) 1982; 78:173178. 14. Fernández Guerrero ML, Abad Alonso JA, Merchante Iglesias A, Oliva Aldamiz H. Tuberculosis miliar como problema diagnóstico. Revisión de 18 casos. Rev Clin Esp 1977; 145:175182. 15. Verea Hernado HR, Yebra Pimentel MT, Martín Egaña MT, Masa Jiménez JF, Domínguez Juncal L, Fontán Bueso JM. Biopsia pleural con aguja de Abrams. Análisis y rentabilidad en 207 casos. Aren Bronconeumol 1985; 21:99-104. 71 DIAGNOSTICO Y TRATAMIENTO LA FATIGA DE LOS MÚSCULOS RESPIRATORIOS G. JUAN SAMPER, R. NAVARRO IVAÑEZ y J. LLORET SOLVES Servicio de Neumología. Hospital General de Valencia. Introducción El aparato (•espiratorio está compuesto básicamente por dos sistemas: un órgano en donde se produce el intercambio gaseoso (pulmones), y una bomba que ventila los pulmones. La bomba está compuesta por la pared torácica, los músculos respiratorios que la desplazan, los centros respiratorios que controlan los músculos, y los nervios que conectan los centros a los músculos'. Se ha dicho que estudiar la respiración sin tener en cuenta los músculos respiratorios sería como si no se mencionase el corazón al estudiar el aparato circulatorio2. Así, al igual que la insuficiencia cardíaca es consecuencia de la incapacidad del miocardio, bien por fallo propio o por una carga externa excesiva para continuar bombeando sangre, la insuficiencia respiratoria se desarrolla habitualmente porque el balance entre la impedancia del aparato respiratorio y el poder muscular para superarla se decanta a favor del primer factor. Esta revisión va a tratar del fallo de la bomba debida a la fatiga de los músculos respiratorios, estudiando sus mecanismos de producción, factores predisponerttes, métodos de detección y posibilidades de tratamiento. afectan al sistema nervioso central, transmisión eléctrica neuromuscular, mecanismo contráctil y aporte energético al músculo. Está determinada por la fuerza generada, la intensidad a la cual se produce la contracción, y por el número y duración de las pausas entre las contracciones. En el músculo esquelético, la fuerza de una contracción máxima mantenida voluntariamente (CMV), cae en 1 %/seg en el primer minuto4'5 y tiende a estabilizarse alrededor del 10-30 % de la fuerza inicial6 (fig. 1). Si se introducen pausas entre las contracciones o éstas son de menor intensidad, la caída de la fuerza de contracción se enlentece7. El tiempo de resistencia, definido como el tiempo que un músculo es capaz de mantener la fuerza inicial, está inversamente relacionado con el ciclo de contracción (relación del tiempo en que el músculo se está contrayendo y el tiempo total) y con la fracción de la fuerza máxima a la cual se está contrayendo. En el diafragma, el tiempo de resistencia a la fatiga (Tlim) está también relacionado inversamente con el ciclo de contracción, tiempo inspira- Definición La fatiga se define como la incapacidad de un músculo para mantener la fuerza requerida o esperada después de contracciones continuas o repetidas. Como primera aproximación, en el aparato respiratorio, se define como la incapacidad para continuar generando suficiente presión para mantener la ventilación alveolar. La fatiga no se debe confundir con debilidad muscular, que consiste en incapacidad para desarrollar la fuerza esperada, en lugar de la incapacidad para mantenerla3. 15 Mecanismo de producción La fatiga muscular es un fenómeno complejo que resulta de interacciones entre procesos que Recibido el 25-2-1986 y aceptado el 2-4-1986. 72 25 50 %CMV Fig. 1. Relación entre la fuerza muscular (expresada como porcentaje de contracción máxima voluntaria: CMV) y el tiempo de resistencia a la fatiga, durante una contracción isométrica mantenida. La línea de trazo discontinuo representa el umbral de fatiga. Adaptado de Rohmert'. 34 G. JUAN SAMPER ET AL.-LA FATIGA DE LOS MÚSCULOS RESPIRATORIOS torio/tiempo total (Ti/Ttot) y con la fuerza de contracción, presión transdiafragmática/presión transdiafragmática máxima (Pdi/Pdimax), cuyo producto se conoce como índice de tensión tiempo8. Recientemente Bellemare y Grassino9 han estudiado esta relación haciendo respirar a sujetos normales con un patrón respiratorio fijo durante 45 minutos o hasta que la Pdi no se pudo mantener más al nivel fijado. Observaron que Tlim estaba inversamente relacionado con Pdi y Ti/Ttot y por ello con su producto, siguiendo una función expresada por una hipérbola cuadrática. Pdi/Pdimax multiplicado por Ti/Ttot representa el índice tensión-tiempo del diafragma (TTdi). El TTdi que se puede mantener más de 45 minutos es 0,15 y por encima del mismo Tlim disminuye a medida que aumenta TTdi (fig. 2). TUM fmini TTdi - 0-0,5 0,75 o0,8 -0,5-1 0,60 0,6 0,4 Por la situación y el tamaño de los músculos respiratorios, ni la biopsia muscular ni los niveles de ácido láctico en sangre son útiles para diagnosticar la fatiga muscular. Los test más aceptados son: 1. Curva fuerza-frecuencia: Aubier et al10 han estudiado los efectos de la fatiga del diafragma en la relación fuerza-frecuencia del mismo, obtenida por estimulación eléctrica percutánea del nervio frénico a su paso por el cuello. Se observa que cuando el diafragma está fatigado, manteniendo el mismo estiramiento muscular y la misma configuración de la caja torácica, para una determinada frecuencia se obtiene menos fuerza que cuando el músculo está descansado (fig. 3). En el proceso de recuperación de la curva fuerza-frecuencia se observa que las presiones que originan las altas frecuencias se recuperan en minutos, mientras que las presiones que originan las bajas frecuencias tardan horas o días en recuperarse. Así, se distinguen dos tipos de fatiga, la de alta frecuencia, debida probablemente a la depleción de fosfatos de alta energía, y afectación de la unión neuromuscular; y la de baja frecuencia" debida a afectación del proceso de excitacióncontracción probablemente por disminución de la liberación de Ca^ o afectación de la transmisión en el sistema tubular de la fibra muscular3. Para Aubier10, en los pacientes con enfermedad pulmonar obstructiva crónica (EPOC), debido a que están sometidos crónicamente a cargas inspiratorias internas con una posición desfavorable de sus músculos inspiratorios, podría darse este tipo de fatiga de baja frecuencia crónicamente, y dado que la frecuencia de estimulación normal del diafragma es de 25-30 Hz12, la presión pleural no alcanzaría el nivel necesario para ventilar adecuadamente el pulmón, produciéndose insuficiencia respiratoria global crónica. En este sentido Mox37 0,42 -7-15 0,32 -25-35 0,24 0,2 - < 45 0,15 0,2 Diagnóstico de la fatiga de los músculos respiratorios - 1-3 0,4 0,6 0,8 1,0 Pdi/Pdi max Fig. 2. Diagrama de curvas con el mismo TTdi y por lanío Tlim. Se muestran también la relación entre Ti/Ttot y Pdi/Pdimax. La estrella representa el Pdi/Pdimax y Ti/Ttol al cual se esta contrayendo el diafragma de un sujeto normal respirando en reposo. Adaptado de Bellemare y Grassino9. 20 40 60 80 100 20 40 60 80 100 Frecuencia (Hz) Fig. 3. Evolución en el tiempo de la relación entre Pdi (expresada como porcentaje de Pdimax) y la frecuencia de estimulación (expresada en Hz). Las líneas de trazo continuo (control) representan los valores obtenidos con el músculo descansado. Las lineas de trazo discontinuo (posifatiga) representan los valores obtenidos a los 2-4, 8-10, 14-17 y 25-30 minutos después de la fatiga. Adaptado de Aubier et al10. ham et al13 han demostrado una reducción de la respuesta al C0¡ en sujetos con fatiga muscular de baja frecuencia. Esta técnica de estudio de la curva fuerza-frecuencia en el hombre no es fácil de aplicar, requiere un alto grado de colaboración, hay que aplicar un corsé en el abdomen para mantener la configuración del diafragma y minimizar el desplazamiento del músculo durante la contracción y a menudo se estimulan otros nervios y músculos situados en el cuello, produciéndose sensaciones muy desagradables. 73 ARCHIVOS DE BRONCONEUMOLOGIA. VOL. 23, NUM. 2, 1987 Fig. 4. El trazado superior representa la Pdi y el inferior el EMG diafragmático integrado (Edi). Obsérvese que en la segunda parte del trazado ha aumentado la relación Edi/Pdi indicando una menor eficacia neuromecinica del diafragma. Adaptado de Aubier et al22. EMG total (20-1.000 Hz) tí8i|/^4\4^^^ Altas ( 1 5 0 - 1 3 5 Hz) r\hA^f\4\4J -J^/WVUVWu^Annruvv^AnJ-ü-^^^J^^^^ Bajas (20-46,7 Hz) ^^^)^^.^-^M^Wü^/>^nM/^^ Pdi (cm H^O) so «_Jm™nrinnnnRnrw •- VC ( 1 ) 0 , 5 Fig. 5. Registro poligrático de una respiración fatigante con una Pdi mantenida a 75 % Pdimax y un Ti/Ttot de 0,6. El trazado superior representa el EMG total integrado (banda de frecuencias de 20-1.000 Hz). En el segundo trazado se representa el EMG integrado de las altas frecuencias (banda de frecuencias de 150-350 Hz). En el tercer trazado se representa el EMG integrado de las bajas frecuencias (banda de frecuencias de 20-46,7 Hz). Obsérvese la caída de la relación entre altas y bajas frecuencias del EMG que precede a la caída de la Pdi. Ve es el volumen corriente. Adaptado de Bellemare y Grassino". 2. Relación entre EMG integrado y la fuerza que origina. En el diafragma, la presión (Pdi) que origina una determinada actividad eléctrica (Edi), va a depender de su geometría, que a su vez depende de la configuración de la pared toracoabdominal. Grassino et al14 usando magnetómetros han podido determinar que la relación Edi/Pdi depende de la configuración toracoabdominal y fundamentalmente de cambios en el volumen abdominal que son los que mejor reflejan el acortamiento del diafragma. La relación Edi/Pdi depende también de la velocidad de longitud del diafragma15, de tal manera que a mayor velocidad de acortamiento, determinada fundamentalmente por la velocidad de desplazamiento de la pared abdominal, mayor relación Edi/Pdi. Así pues, si se mantiene la misma configuración toracoabdominal y la misma velocidad de contracción del diafragma (habitualmente se trabaja con contracciones isométricas) un aumento de la relación Edi/Pdi indicará una menor eficacia neuromecá74 nica del diafragma que traduce debilidad muscular producida o no por fatiga muscular (fig. 4). 3. Relación entre altas y bajas frecuencias del EMG. Gross et al16 estudiaron los efectos de la presión generada por los músculos respiratorios en el espectro de frecuencias del EMG. Se estudiaron tres niveles de Pdi: 25 %, 50 % y 75 % de Pdimax. A 25 % Pdimax no se observaron cambios en el espectro del EMG, pero a 50 y 75 % Pdimax se observó un progresivo desplazamiento del espectro del EMG hacia las bajas frecuencias (fig. 5). La velocidad de este cambio fue mayor a 75 % Pdimax que a 50 % Pdimax. Además este cambio en el espectro del EMG sucedió a las 5-10 respiraciones, mucho antes de que el músculo fallase como generador de fuerza. Estos resultados sugieren que el análisis de frecuencias del EMG se puede usar para evaluar el estado de fatiga de los músculos respiratorios. Este método tiene la ventaja de no ser invasivo, ya que el EMG se puede recoger con electrodos de superficie, permite estudiar el estado del músculo respiración por respiración, y observar los cambios en el proceso de fatiga durante un largo período de tiempo. Además el registro del EMG se puede hacer mientras el sujeto respira espontáneamente y sin interrupciones por estímulos extraños. Bellemare y Grassino17 han estudiado los cambios en el espectro de frecuencias del EMG de voluntarios normales respirando a través de resistencias inspiratorias. Calcularon la velocidad de la caída de la relación de altas (150-350 Hz) y bajas frecuencias (20-46,7 Hz), a lo que llamaron constante de tiempo del proceso de fatiga (Tf). Encontraron que Tf estaba siempre relacionada con el TTdi siguiendo una relación hiperbólica. Los valores de Tf estaban directamente relacionados con el tiempo que el sujeto era capaz de mantener un determinado patrón respiratorio (Tlim). Concluye así Bellemare que los cambios en el EMG y Tlim están relacionados entre sí y son expresión de los cambios metabólicos inducidos por el patrón de contracción fatigante. 4. Velocidad de relajación. Esau et al18 han encontrado que en el diafragma fatigado, la velocidad de relajación disminuye, y lo hace de manera paralela al desplazamiento del espectro de frecuencias del EMG hacia las bajas frecuencias, es decir, directamente relacionado con el TTdi. En cuanto al mecanismo por el que se produce este hecho parece ser que es a través de la disminución de la cantidad de ATP del músculo19. 5. Signos clínicos. También hay signos clínicos que pueden sugerir la presencia de fatiga de los músculos respiratorios. Entre ellos, el movimiento paradójico del abdomen durante la parálisis o fatiga del diafragma, movimientos desordenados de la pared abdominal20, alternancia en la contracción de los músculos intercostales y diafragma, y respiración rápida y superficial. 38 G. JUAN SAMPER ET AL.-LA FATIGA DE LOS MÚSCULOS RESPIRATORIOS 6. Volúmenes pulmonares. Cambios en los volúmenes pulmonares nos pueden indicar debilidad de los músculos respiratorios producida o no por fatiga. Así, si la mecánica pulmonar y de la caja torácica son normales, una disminución de la capacidad pulmonar total y capacidad vital, con aumento del volumen residual son indicativos de debilidad muscular respiratoria. Factores predisponentes a la fatiga de los músculos respiratorios En pacientes con EPOC los músculos respiratorios y en particular el diafragma están en una posición mecánica poco ventajosa debido a que por hiperinsuflación pulmonar están acortados y el diafragma aplanado. Como consecuencia, la Pdimax está disminuida y además debido al aumento de la impedancia inspiratoria, para mantener el volumen corriente la Pdi necesaria es mayor, disminuyendo de manera importante la fuerza de reserva del diafragma. Así Bellemare21 (fig. 6) ha determinado el TTdi que necesitaban 20 pacientes con EPOC, para mantener la ventilación basal. Este osciló entre 0,01 y 0,12 con una media de 0,05 (en los sujetos normales es de 0,0005 y a 0,01) y aumentó en función de la resistencia de las vías aéreas. Imponiendo diversos patrones respiratorios a estos pacientes se observó que pequeñas modificaciones del mismo les hacían entrar en un TTdi mayor de 0,15 por lo que se producía un cambio en el espectro de frecuencias del EMG indicativo de fatiga del diafragma. Por ello concluyó que la fuerza de reserva del diafragma está disminuida en los pacientes con EPOC por un aumento del TTdi en la respiración basal relacionado con aumento de resistencia de vías aéreas y que la fuerza de reserva es usada en relativamente pequeñas modificaciones del ciclo respiratorio. La fatiga muscular ocurre también cuando la demanda de energía por el músculo supera la capacidad de aporte por la sangre. Así el shock, como han demostrado Aubier et al22 en shock por taponamiento pericárdico y Hussain et al en shock séptico23, predispone a la fatiga del diafragma por la disminución del flujo sanguíneo al músculo. Un efecto similar tendría la anemia y la hipoxemia24. También la disminución de la presión máxima que un músculo es capaz de realizar le predispone a la fatiga. En el aparato respiratorio sería la atrofia muscular respiratoria que se ve después de largos períodos de ventilación mecánica, enfermedades neuromusculares (miastenia), desnutrición intensa25, inmadurez del diafragma e hiperinsufla26 ción pulmonar y debilidad muscular en la 27 EPOC . Los cambios en el medio interno también influ39 1,0 " 0,8 ^»< X contro o Impuesto Í S \ 1 V^ ; 1 • 0,4 ^ f0. ^.0,6 F 0,2 ^-<?1» ^-r ?* ?</^>. ^Í^. i! * >< ''"' '^.^ TTdi 0,15 0 0 0,2 0,4 0,6 0,8 1,0 Pdi/Pdi max Fig. 6. Relación entre el Ti/Tlot y Pdi/Pdimax de S pacientes con EPOC durante respiración espontánea (x) y durante el patrón impuesto (o). En 4 de ellos se sobrepasó el umbral de fatiga. (•) representa el Pdi/Pdimax y Ti/Tlot al cual se contrae el diafragma de un sujeto normal respirando en reposo. Adaptado de Bellemare2'. yen en la fatigabilidad y contractilidad del diafragma. Así, se ha demostrado en perros28 y humanos29 que la acidosis respiratoria disminuye la contractilidad diafragmática y favorece el desarrollo de fatiga. Este hecho tiene importantes implicaciones para entender el desarrollo de la insuficiencia respiratoria global en muchos procesos y la importancia de la ventilación mecánica, que no sólo proporciona tiempo para que los músculos se recuperen de la fatiga, sino que también mejora su capacidad contráctil al corregir la acidosis respiratoria. También la hipocalcemia30, hipofosfatemia31 e hipomagnesemia32 y algunos agentes antimicrobianos con efecto curare33, disminuyen la contractilidad de los músculos respiratorios y por ello favorecen el desarrollo de fatiga. Posibilidades de tratamiento Naturalmente, cuando el músculo ya está fatigado, el tratamiento de elección es dejarlo descansar. En perros en shock22 la ventilación mecánica hace que haya más flujo disponible para otros órganos e impide que el metabolismo anaeróbico de los músculos respiratorios produzca un aumento de ácido láctico que les llevaría finalmente a claudicar. También, la corrección de la hipoxemia34, acidosis respiratora35 y alteraciones metabólicas antes mencionadas, hacen al músculo más difícilmente fatigable. Algunos agentes farmacológicos pueden aumentar la contractilidad y el tiempo de resistencia a la fatiga, como ocurre con la cafeína36, isoproterenol37, y aminofílina38 4 *. 75 ARCHIVOS DE BRONCONEUMOLOGIA. VOL. 23, NUM. 2, 1987 Otra posibilidad de tratamiento que no incide directamente en los músculos sería aliviarlos de su sobrecarga con medidas que disminuyen la impedancia del aparato respiratorio (broncodilatadores, antibióticos, cardiotónicos, etc.). También los músculos respiratorios, al igual que los demás músculos esqueléticos, pueden aumentar su fuerza y su resistencia a la fatiga con un entrenamiento adecuado. Así se ha observado un aumento del 55 % de la fuerza de los músculos respiratorios en sujetos que practicaron repetidas maniobras inspiratorias estáticas máximas42 y en tetrapléjicos43 respirando a través de resistencias inspiratorias por cortos períodos de tiempo cada día durante 6-8 semanas. Pardy et al44 demostraron que el entrenamiento de los músculos inspiratorios, merced al uso de cargas inspiratorias mínimamente fatigantes en sesiones de 15 minutos dos veces al día, mejoraba la capacidad contráctil de los músculos inspiratorios de los pacientes con EPOC, y que este programa era más barato, sencillo y eficaz que los métodos clásicos de fisioterapia. Más recientemente Chen et al45 han encontrado que si bien el entrenamiento muscular respirando contra resistencia mejora la resistencia muscular a la fatiga y la fuerza muscular, no tiene ninguna acción sobre la capacidad de ejercicio ni sobre los parámetros de función respiratoria. En pacientes con dificultades de desconexión del respirador, el entrenamiento muscular respirando contra resistencia también puede ser útil permitiendo en algunos casos la desconexión definitiva46. Otro tipo de ejercicio es la hiperventilación isocápnica que usada en pacientes con EPOC, produce47 un aumento de la ventilación máxima voluntaria,' consumo máximo de oxígeno, ventilación máxima al ejercicio y capacidad de ejercicio medida por el test de 12 minutos marcha. Por último, ante la posibilidad de que realmente exista una fatiga de baja frecuencia en los pacientes con insuficiencia respiratoria global crónica, se ha ensayado el uso de ventilación asistida con respiradores corporales. Rochester et al48 han demostrado que al poner a estos pacientes en un respirador corporal, hay una completa abolición de la actividad eléctrica del diafragma, que no tiene relación con el nivel de PaCO¡, y con ella la sensación de disnea desaparece completamente. Se postula, que al dejar en reposo durante algunas horas a los músculos respiratorios, después éstos estarían en mejores condiciones de contractilidad y resistencia a la fatiga. Esto ha sido demostrado por Marino et al49 que encuentran una mejoría clínica, en gases arteriales y en la capacidad contráctil de los músculos respiratorios, medida con la presión inspiratoria y espiratoria máximas, en pacientes con EPOC sometidos a 4 a 6 horas al día de ventilación mecánica intermitente. El problema surge cuando hay que definir concretamente en qué situaciones hay que entrenar y 76 cuándo hay que dejar descansar al músculo. Parece claro que en pacientes poco evolucionados y en sujetos normales el entrenamiento mejora la capacidad contráctil y la resistencia a la fatiga, pero en pacientes con EPOC muy evolucionada el entrenamiento puede ser nocivo y producir lesiones musculares. En estos pacientes, que son precisamente los más necesitados de un reposo o de un entrenamiento muscular específico, no hay datos suficientes para asegurar quiénes van a beneficiarse del reposo o del entrenamiento. Queda abierto un importante campo de investigación clínica que es de esperar proporcione respuestas más concretas en este acuciante problema. Conclusiones y perspectivas futuras Aunque se lleva únicamente una decena de a&os estudiando la fatiga de los músculos respiratorios, los avances logrados son importantes. Así, se puede afirmar incuestionablemente que la fatiga realmente existe y que puede jugar un papel en la insuficiencia respiratoria. También se ha avanzado en el estudio de sus mecanismos de producción, resaltando aquí la importancia del índice de tensión-tiempo. Se conocen mejor las alteraciones mecánicas, particularmente la hiperinsuflación pulmonar, y metabólicas, sobre todo la acidosis, que favorecen el desarrollo de fatiga. Se ha resaltado la importancia de mantener un flujo sanguíneo adecuado al diafragma, que si no se tiene en cuenta en pacientes en shock va a provocar que fallezcan por insuficiencia respiratoria o por isquemia de órganos vitales al restarles flujo sanguíneo mientras el diafragma se siga contrayendo. También ha quedado demostrado que algunas drogas como el isoproterenol y la teofilina y que algunas veces el reposo y otras el ejercicio muscular, favorecen la contractilidad diafragmática. Sin embargo, son muchas las respuestas que quedan por contestar y que son motivo de las últimas publicaciones en este campo. Entre ellas: las relaciones entre fatiga de los músculos respiratorios y disnea; tratar de encontrar un test diagnóstico más sencillo y manejable que los descritos; progresar en la farmacología de la fatiga muscular; conocer con exactitud en qué pacientes hay que entrenar los músculos y con qué tipo de ejercicio y cuándo hay que dejarlos descansar; y por fin tratar de aplicar los conocimientos de la fatiga muscular a los intentos de extubación de los pacientes sometidos a ventilación mecánica prolongada. BIBLIOGRAFÍA 1. Derenne JPH, Mackiem PT, Roussos Ch. The respiratory muscles: Mechanics, Control and Pathophysiology. Am Rev Respir Dis 1978; 118:119-133, 373-390, 581-601. 40 G. JUAN SAMPER ET AL.-LA FATIGA DE LOS MÚSCULOS RESPIRATORIOS 2. Sharp JT. Respiratory muscles: a review of oíd and newerconceps. Lung 1980; 157:185-199. 3. Edwards RHT. Human muscle function and fatigue. En: Porter R and Whelan J, ed. Human muscle fatigue: physiological mechanisms. Ciba Foundation Symposium 82. London, Pitman Medical 1981; 1-8. 4. Merton PA. Voluntary strength and fatigue. J Physiol (London) 1954; 123:553-564. 5. Stephens JA, Taylor A. Fatigue of maintained voluntary contraction in man. J Physiol (London) 1972; 220:1-18. 6. Rohmert W. Ermittung von Erholung-spausen für statische Arbeit des Menschen. Int Z Angew Pysiol 1960; 18:123. 7. Rodboard S, Bakay-Pragnay E. Contraction frecuency, blood supply and muscle pain. J Appl Physiol 1968; 24:142147. 8. Tenney SM, Reese RE. The ability to sustain great breathing efforts. Respiration Physiol 1968; 5:187-201. 9. Bellemare F, Grassino A. Effect of pressure and timing of contraction on human diaphragm fatigue. J Appl Physiol: Respirat Environ Exercise Physiol 1982; 53(5):1190-1195. 10. Aubier M, Farkas G, De Troyer, Mozes R, Roussos Ch. Detection of diaphragmatic fatigue in man by phrenic stimulation. J Appl Physiol: Respirat Environ Exercise Physiol 1981; 50:538-544. . 11. Edwards RHT, Hill DK, Jones DA, Merton PA. Fatigue of long duration in human skeletal muscle after exercise. J Physiol (London) 1977; 272:769-778. 12. Grimby G, Goldman MD, Mead J. Respiratory muscle action inferred from rib cage and abdominal V-P partitioning. J Appl Physiol 1976; 41:739-751. 13. Moxham J, Wiles CM, Newhan D, Spiro SG, Edwars RHT. Respiratory muscle fatigue reduces the ventilatory response to carbón dioxide. Clin Sci 1981; 62:102. 14. Grassino A, Goldman MD, Mead J, Sears TA. Mechanics of the human diaphragm during voluntary contraction: statics. J Appl Physiol: Respirat Environ Exercise Physiol 1978; 44:829-839. 15. Colman MD, Grassino A, Mead J, Sears TA. Mechantes of the human diafragm during voluntary contraction: dynamics. J Appl Physiol: Respirat Environ Exercise Physiol 1978; 44:840-848. 16. Gross D, Grassino A, Ross WRD, Mackiem PT. Electromyogram pattern of diaphragmatic fatigue. J Appl Physiol: Respirat Environ Exercise Physiol 1979; 46:1-7. 17. Bellemare F, Grassino A. Evaluation of human diaphragmatic fatigue. J Appl Physiol: Respirat Environ Exercise Physiol 1982; 53:1196-1206. 18. Esau Sa, Bellemare F, Grassino A, Permut S, Roussos Ch, Pardy RL. Changes in relaxation rate with diaphragmatic fatigue in man. J Appl Physiol: Respirat Environ Exercise Physiol 1983; 54:1182-1186. 19. Edwars RHT, Hill DK, Jones DA: Metabolic changes associated with the slowing of relaxation in fatigued mouse muscle. J Physiol (London) 1975; 251:287-301. 20. Cohén CA, Zagelbaum G, Gross D, Roussos CH, Mackiem PT. Clinical manifestations of inspiratory muscle fatigue. Am J Med 1982; 73:308-316. 21. Bellemare F. Diaphragmatic fatigue: mechanisms and assessment. Tesis Doctoral presentada en la McGill University, Montreal (Canadá), 1982. 22. Aubier M, Trippenbach T, Roussos Ch. Respiratory muscle failure during cardiogenic shock. J Appl Physiol 1981; 51:499-508. 23. Hussain SNA, Simkus G, Roussos Ch. Respiratory muscle fatigue: a cause of ventilatory failure in septic shock. J Appl Physiol 1985; 58:2033-2040. 24. Jardín J, Farkas G, Prefaut C, Thomas D, Macikem PT, Roussos Ch. The failing inspiratory muscles under normoxic and hypoxic conditions. Am Rev Respir Dis 1981; 124:274279. 25. Arora NS, Rochester DF. Respiratory muscle strength and maximal voluntary ventilation in undernourished patients. Am Rev Respir Dis 1982; 126:5-8. 26. Roussos Ch, Fixiey M, Gross D, Mackiem PT. Fatigue of inspiratory muscles and their synergic behavior. J Appl Phisiol: Respirat Environ Exercise Physiol 1979; 46:897-904. 41 27. Rochester DF, Braun NMT. Determinants of maximal inspiratory pressure in chronic obstructive pulmonary disease. Am Rev Respir Dis 1985; 132:42-47. 28. Schnader JY, Juan G, Howeil S, Fitzgeraid R, Roussos Ch. Arterial C0¡ partial pressure affects diphragmatic function. J Appl Physiol 1985; 58:823-829. 29. Juan G, Calverly P, Tálamo C, Schnader J, Roussos Ch. Effect of carbón dioxide on diaphragmatic function in human beings. N Engí J Med 1984; 310:874-879. 30. Aubier M, Viires N, Piquet J, Murciano D, Blanchet F, Marty Ch, Gherardi R, Pariente R. Effects of hypocalcemia on diaphragmatic strength generation. J Appl Physiol 1985; 58:2054-2061. 31. Aubier N, Murciano D, Lecognic Y, Viires N, Jacques Y, Squara P, Pariente R. Effect of hypophosphatemia on diaphragmatic contractility in patients with acute respiratory failure. N Engí J Med 1985; 313:420-424. 32. Dhingra S, Solven F, Wiison A, McCarthy DS. Hypomagnesemia and respiratory muscle power. Am Rev Respir Dis 1984; 129:497-498. 33. Antibiotic induced myasthenia. Editorial. J Am Med Assoc 1968; 204:164-165. 34. Bye PTP, Esau SA, Levy RD, Shiner RJ, Mackiem PT, Martin JG, Pardy RL. Ventilatory muscle function during exercise in air and oxigyen in patients with chronie air-flow limitation. Am Rev Respir Dis 1985; 132:236-240. 35. Scnader JY, Juan G, Howeil S, Roussos Ch. Effects of acute changes in Pco^ on the contractility of the diaphragm in dog. (Abstract) Am Rev Respir Dis 1983; 127:232. 36. Supinski GS, Chandier Deal EJr, Kelsen SG. The effects of caffeine and theophylline on diaphragm contractility. Am Rev Respir Dis 1984; 130:429-433. 37. Howeil S, Roussos Ch. Isoproterenol an aminophylline improve contractility of fatigued canine diaphragm. Am Rev Respir Dis 1984; 129:118-124. 38. Sigrist S, Thomas D, Howeil S, Roussos Ch. The effect of aminophylline in inspiratory muscle contractility. Am Rev Respir Dis 1982; 126:46-50. 39. Aubier M, De Toryer A, Sampson M, Mackiem PT, Roussos Ch. Aminophylline improves diaphragmatic contractility. N Engí J Med 1981; 305:249-252. 40. Murciano D, Aubier M, Lecocguic Y, Pariente R. Effects of theophylline on diaphragmatic strength and fatigue in patients with chronic obstructive pulmonary disease. N Engí J Med 1984; 311:349-353. 41. Howeil S, Fitzgeraid RS, Roussos Ch. Effects of aminophyline, isoproterenol, and neostigmine on hypercapnic depresión of diaphragmatic contractility. Am Rev Respir Dis 1985; 132:241-247. 42. Leith DH, Broadley M. Ventilatory muscle strength and endurance training. J Appl Physiol 1976; 41:508-516. 43. Gross D, Ladd HW, Riley EJ, Mackiem PT, Grassino A. The effect of training on strength and endurance of the diaphragm in quadriplegia. Am J Med 1980; 68:27-35. 44. Pardy RL, Rivington RN, Despas PJ, Mackiem PT. Inspiratory muscle training compared with physiotherapy in patients with chronic airflow limitation. Am Rev Respir Dis 1981; 123:421-425. 45. Chen H, Dukes R, Martin BJ. Inspiratory muscle training in patients with chronic obstructive pulmonary disease. Am Rev Respir Dis 1985; 131:251-255. 46. Aldrich TK, Karpel JP. Inspiratory muscle resisitive training in respiratory failure. Am Rev Respir Dis 1985; 131:461-462. 47. Belman MJ, Mittman C. Ventilatory muscle training improves exercise endurance in patients with chronic obstructive pulmonary disease. Am Rev Respir Dis 1980; 121:273-280. 48. Rochester DF, Braun NMT, Laine S. Diaphragmatic energy expenditure in chronic respiratory failure. Am J Med 1977; 63:223-232. 49. Marino W, Braun NMT. Reversal of the sequelae of respiratory muscle fatigue by intermittent mechanical ventilation. (Abstract) Am Rev Respir Dis 1982; 125:85. 77 NOTAS CLÍNICAS NEUMOTORAX ESPONTANEO Y ESCLEROSIS TUBEROSA A. PACHECO GALVAN, J.P. VALDAZO DE DIEGO, M.T. NAYA NIETO, L. FOGUE CALVO, J. LAGO VIGUERA y J. ZAPATERO GAVIRIA Servicio de Neumología. Hospital Ramón y Cajal. Madrid. Cuando un neumotorax espontáneo incide en una mujer en edad reproductiva debe descartarse la esclerosis tuberosa. La afectación pulmonar en la esclerosis tuberosa tiene una frecuencia menor del 1 % y se manifiesta en dos aspectos: un patrón en panal en la radiografía de tórax con posibilidad de neumotorax espontáneo debido a la rotura del espacio pleural de bullas subyacentes, y un síndrome obstructivo espiroinétrico. El dato anatómico-patológico básico es la proliferación hamartomatosa de músculo liso en capilares, linfáticos y paredes de bulla. La posibilidad de frenar el posible estímulo hormonal sobre la proliferación de músculo liso ha abierto recientes y esperanzadores resultados. Arch Bronconeumol 1987, 23:78-80. Introducción La presencia de neumotorax espontáneo asociado a patrón intersticial radiológico admite un diagnóstico diferencial relativamente corto en el que hay que incluir cuando incide en una mujer en edad reproductiva la esclerosis tuberosa o enfermedad de Bourneville. La frecuencia de afectación pulmonar en la esclerosis tuberosa es menor del 1 %1, habiéndose descrito hasta la actualidad unos 60 casos, de los que la mitad aproximadamente cursan con neumotorax espontáneo2, por lo tanto estas asociaciones constituyen casos excepcionales como el que referimos a continuación. Spontaneous pneumothorax and tuberous sclerosis Tuberous sclerosis is to be considered whenever a woman in child-bearing age develops Spontaneous pneumothorax. Pulmonary involvement in tuberous sclerosis appears with a frequency less than 1 % and has two aspects: a «honecomb pattern» in thorax X-ray examination where the possibility exists of Spontaneous pneumothorax due to rupture of underlying bullae into the pleural cavity, and an obstructive syndrome as assessed by spirometry. The main pathological finding is hamartomatous proliferation of smooth muscle in capillary and lymphatic vesseis as well as on bullae walls. The approach aimed to blunting the possible hormonal stimulus on smooth muscle proliferation has recently provided some promising results. pleural que recidivó a los pocos días por lo que se indicó tratamiento quirúrgico enviándose al Servicio de Cirugía Torácica de este hospital, donde a la vista de la radiografía de tórax con patrón en panal difuso y neumotorax derecho (fig. 1) se procedió a la toracotomía derecha por doble motivo: pleurodesis física mediante abrasión pleural y toma de muestas de parénquima pulmonar subyacente para estudio anatomopatológico. Los datos de la exploración clínica sistematizada a destacar se describen a continuación: en cara adenofibromas múltiples de 0,3 a 0,5 cm de diámetro; en la auscultación pulmonar disminución discreta del murmullo vesicular y estertores crepitantes finos en campos medio e inferior izquierdos; en la palpación Caso clínico Paciente de 43 años que ingresa en este hospital remitida desde otro centro por neumotorax recidivante. Como antecedente de interés presenta desde los 14 años y coincidiendo con la menstruación, crisis epilépticas; a los 30 años comienza a notar disnea de esfuerzo y tos seca frecuente y a los 33 años se la diagnostica un neumotorax derecho y derrame pleural izquierdo en el periodo postparto de su primer hijo; hace dos meses nuevo neumotorax en el lado derecho tratado con tubo endoRecibido el 23-6-1986 y aceptado el 25-9-1986. 78 42 A. PACHECO GALVAN ET AL.-NEUMOTORAX ESPONTANEO Y ESCLEROSIS TUBEROSA abdominal masa de 3-4 cm de diámetro en flanco izquierdo que se mueve con las maniobras de palpación anteroposterior renal y, por ultimo, en los lechos ungueales de pies y manos excrecencias sonrosadas compatibles con tumores de Koenen (fig. 2). La exploración de fondo de ojo y la ecografía cardíaca fueron normales. La ecografía abdominal mostró en ambos ríñones sendas masas d e 5 x 3 y 4 X 3 c m compatibles con angiolipomas renales. El test de inteligencia con la escala de Weis reveló un C.I. total deficiente. La radiografía de cráneo fue normal y la radiografía de tórax evidenciaba patrón en panal difuso de predominio en bases junto a paquipleuritis izquierda y neumotorax derecho de un 20 % de extensión (fig. 1). La exploración funcional respiratoria se detalla a continuación: FVC 1.390 (52%), FEVi 640, FEV/FVC 46 (61%), RV 3.570, TLC 4.860 (135%), RV/TLC'73%, Raw 3,9 cm H^O/seg, SGaw 0,0644 1/seg/cm H¡0, informándose como exploración compatible con síndrome ventilatorio obstructivo avanzado. La gasometría arterial basal al ingreso era: pH 7,42, Pa0¡ 41 mmHg, PaCO, 32 mmHg, EB -1,4, P(A-a) O, 60 mmHg (11,5 N). Tras tratamiento con oxigenoterapia, broncodilatadores y fisioterapia respiratoria se logró esta gasometría arterial de salida con FÍO, 0,24: pH 7,35, PaO; 59,2 mmHg, PaCO; 39,3 mmHg, EB —3,4, iniciándose al alta tratamiento adicional con Tamoxifen a razón de 20 mg/día con citación a los seis meses para control. El estudio anatomopatológico de las muestras de parénquima pulmonar evidenció áreas de enfisema de predominio intersticial con bullas de tipo I y «blebs» subpleurales (fig. 3), mostrando algunas de las bullas intraparenquimatosas en su pared hipertrofia de fibras musculares lisas (fig. 4). Discusión La esclerosis tuberosa es un desorden hereditario autosómico dominante, aunque puede ser esporádico y por tanto sin historia familiar en un 60 % a 80 % de los casos3. Clásicamente. se la define por la tríada de angiofibromas cutáneos, epilepsia y retardo mental. Otros hallazgos clínico-patológicos incluyen: angiolipomas renales, hamartomas cerebrales y paraventriculares, rabdomiomas cardíacos, lesiones óseas escleróticas y varias afecciones cutáneas tales como manchas achagrinadas, manchas hipomelanóticas y fibromas periungueales o tumores de Koenen. La enfermedad es rara; una serie suiza de 50.000 necropsias reveló una incidencia de 1:10.000, sin embargo, la enfermedad ha sido reconocida clínicamente en sólo 1:150.0004, pudiéndose deber esa disociación a que muchos pacientes no tienen 45 la tríada clásica sino sólo una condición o quizá sólo una de las lesiones hamartomatosas, denominándose a esas variantes formas frustradas o incompletas de esclerosis tuberosa. La manifestación pulmonar es muy rara, menos del 1 % e incide claramente en mujeres en edad reproductiva a diferencia de la forma no pulmonar que no tiene predilección de sexo. En la revisión de Dwyer2 de esclerosis tuberosa con afectación pulmonar se resaltan los siguientes 79 ARCHIVOS DE BRONCONEUMOLOGIA. VOL. 23, NUM. 2, 1987 aspectos diferenciadores: comienzo de las manifestaciones pulmonares más tarde que las neurológicas y cutáneas, situándose en la treintena el comienzo de las mismas, y contribución de esa patología a la causa de muerte principalmente por neumotorax y cor pulmonale. Nuestra paciente con la tríada clásica, epilepsia, retardo mental y angiofibromas cutáneos más tumores de Koenen y angiolipomas renales tiene una esclerosis tuberosa y el comienzo de la afectación pulmonar se sitúa en los 33 años. La expresión histológica básica de la esclerosis tuberosa es el desarrollo de nodulos hamartomatosos en cualquier órgano del cuerpo. A nivet pulmonar la imagen morfológica es variable, pues aunque la lesión patognomónica sea los nodulos referidos puros o epiteliales de músculo liso, en la mayor parte de las veces se aprecian signos de enfisema, fíbrosis septal e irregular o imágenes que sugieren linfangiomatosis de la que se supone es un aspecto particular; hay que destacar en todos los casos los crecimientos hamartomatoso-like que pueden acompañar a las paredes bullógenas, linfáticas o vasculares5, tal y como se presentó en nuestro caso (fig. 4). La proliferación de músculo liso puede resultar en obstrucción de bronquiolos y atrapamiento aéreo con formación distal de bullas y neumotorax consecuente. El interés del tratamiento en la esclerosis tuberosa con afectación pulmonar reside en que al incidir en mujeres en edad reproductiva se supone 80 un estímulo hormonal en la proliferación de músculo liso y por consiguiente en el progreso de la enfermedad; se han hecho intentos en la linfangiomiomatosis pulmonar en ese sentido con resultados esperanzadores usando andrógenos, progesterona, castración y antiestrógenos, y recientemente Luna et al6 suministraron antiestrógenos (tamoxifen) a una mujer con esclerosis tuberosa y afectación pulmonar logrando estabilizar el proceso pulmonar, lo cual nos indujo a probar ese tratamiento en nuestra paciente y comprobar la evolución. BIBLIOGRAFÍA 1. Babcok TL, Snyder BA. Spontaneous pneumothorax associated with tuberous sclerosis. J Thor Cardiovasc Surg 1982; 83:100-104. 2. Dwyer JM, Hickie JB, Garvan J. Pulmonary tuberous sclerosis: report of three patients and a review of the literature. QJMed 1971; 40:115-125. 3. Simmons K. Early diagnosis, genetic marker sought for tuberous sclerosis. JAMA 1984; 23:3061-3063. 4. Gómez MR. Tuberous sclerosis. New York. Raven Press, 1979. 5. Mark EJ. Lung biopsy interpretation. Baltimore. WiIliams and Wiikins, 1985; 128. 6. Luna CM, Gene R, Jolly E et al. Pulmonary lymphangiomyomatosis associated with tuberous sclerosis. Treatment with Tamoxifen and tetracicline-pleurodesis. Chest 1985; 88:473-475. 46 NOTAS CLÍNICAS MANIFESTACIONES RADIOLÓGICAS DE LOS TUMORES GERMINALES MALIGNOS PRIMITIVOS DE MEDIASTINO J.D. CASAS CURTO, F.J. ALVAREZ MORO, R. COLOMER BOSCH*, J. ESCALADA BERTA y C. TAPIES BARBA Servicio de Radiodiagnóstico. Servicio de Radioterapia*. Departamento de Radiología y Medicina Nuclear. C.S. Valí d'Hebron. Barcelona. Presentamos tres pacientes afectos de tumores germinales malignos, primitivos del mediastino, de origen no seminomatoso. Remarcamos los signos radiológicos más constantes de estos tumores. Si bien los hallazgos clínico-radiológicos no permiten distinguirlos de otras lesiones mediastínicas, debemos sospechar su presencia cuando a un varón joven y asintomático se le descubre casualmente en una radiografía una gran masa en el mediastino anterior. Hacemos hincapié en la utilidad de la tomografía computadorizada en el diagnóstico y seguimiento de estos tumores. Arch Bronconeumol 1987. 23:81-83. Introducción Los tumores germinales malignos asientan primariamente en el mediastino en el 8,7 % de los casos1. Como todos los tumores germinales extragonadales, suelen diagnosticarse en estado avanzado'. Histológicamente, los más frecuentes son los de origen seminomatoso. Presentamos tres pacientes afectos de tumores germinales malignos primitivos de mediastino (TGMPM) de estirpe no seminomatosa, diagnosticados y tratados en nuestro hospital. Radiological features of mediastinum primitive germinal malignant tumors We report on three patients with mediastinum primitive germinal malignant tumors of .non-seminomatous origin. The niost consisten! radiológica! findings of such tumors are discussed. While the clinical and radiológica! findings do not allow their differentiation from other mediastinum conditions, that diagnosis has to be suspected whenever a large size anterior mediastinum mass is found by X-ray examination in an othenvise healthy young adult male. The usefulness of CT sean in the diagnosis and follow-up of (hese tumors is emphazised. tráquea hacia atrás y a la derecha. La tomografía computadorizada (TC) confirmó estos hallazgos y mostró un borramiento de los planos grasos en relación con las estructuras vasculares mediastínicas (tabla II). Mediante biopsia de una adenopatía supraclavicular, se llegó al diagnóstico de carcinoma embrionario. La gammagrafía hepática mostró lesiones ocupantes de espacio en hígado y en bazo que fueron interpretadas como metástasis. Tres meses después de iniciar tratamiento quimioterápico y radioterapia centrada en mediastino, se realizó una TC de control Observaciones clínicas Paciente n.° 1: Varón de 18 años que ingresó en nuestro hospital por un síndrome tóxico de dos meses de evolución. En la exploración física se palpaban adenopatías laterocervicales. La exploración testicular fue normal. En la analítica destacaban una VSG de 35 mrn/L- h y una LDH de 299 U/l. La alfa-fetoproteína (aFP) y la fracción beta de la hormona gonadotrofina coriónica (HCGb) eran normales. En la radiografía (Rx) de tórax se observaba una masa en mediastino anterior, de 11 cm de diámetro y de densidad homogénea, con bordes polilobulados y lisos (tabla I). Dicha masa causaba una marcada convexidad del contorno mediastínico izquierdo y desplazaba la Recibido el 1-9-1986 y aceptado el 19-11-1986. 49 81 ARCHIVOS DE BRONCONEUMOLOGIA. VOL. 23, NUM. 2, 1987 TABLA I Hallazgos en radiografía de tórax Caso Localización mediastínica Tamaño (cm) Bordes Forma Densidad Desplazamiento tráquea corazón grandes vasos Otros l 2 3 anterior izquierda 11 polibulados lisos redondeada homogénea anterior-medio derecha 11 regulares lisos redondeada homogénea anterior-medio bilateral 12 polilobulados lisos oval homogénea posterior — — — — — — derrame pleural derecho derecha — — — TABLA II Hallazgos TC Caso Localización mediastínica Tamaño (cm) Bordes Planos grasos Densidad Desplazamiento tráquea corazón grandes vasos Otros 1 2 3 anterior izquierda 11 polibulados lisos borrados homogénea anterior-medio derecha 11 regulares lisos borrados heterogénea anterior-medio bilateral 12 polilobulados lisos borrados heterogénea posterior-derecha — — — — izquierda izquierda derrame pleural derecho derecha — derecha metástasis hepáticas y renales que mostró una importante reducción del tamaño de la masa. Sin embargo, a los 9 meses, el paciente sufrió un deterioro progresivo del estado general y falleció al año de su diagnóstico. Paciente n." 2: Varón de 23 años de edad que acudió a nuestro hospital por un dolor torácico derecho de 15 días de duración. La exploración física, incluida la palpación testicular, fue normal. En la analítica destacaban una VSG de 10 mm/ 1.' h y una aFP de 120 ng/ml. La HCGb era normal. La Rx de tórax mostraba un derrame pleural derecho y una masa mediastínica anterior y derecha de 11 cm de diámetro y densidad homogénea, con bordes lisos y regulares (tabla I). La TC demostró además un desplazamiento del corazón y de los grandes vasos hacia la izquierda sin plano graso de separación con la masa, cuya densidad era heterogénea pero sin calcio (tabla II). En la intervención se logró resecar la tumoración a pesar de estar adherida al pericardio y al pulmón. El diagnóstico anato- mopatológico fue de teratocarcinoma con áreas de carcinoma embrionario y de coriocarcinoma. Se realizó tratamiento quimioterápico y, a los trece meses del diagnóstico, el paciente está en remisión completa. Paciente n.° 3: Varón de 24 años de edad que acudió a nuestro centro por un dolor en pierna y cadera derechas, de tipo continuo que se exacervaba con los movimientos. La exploración física, incluida la palpación de los testículos, fue normal. En la analítica destacaban: VSG de 110 mm/1." h, LDH de 480 U/l y aFP de 2.100 ng/ml; la HCGb era normal. La Rx de tórax mostró un ensanchamiento mediastínico de predominio izquierdo, de densidad homogénea y bordes lobulados (fig. 1, tabla I). La TC, además, evidenció la presencia de una masa, bilateral, de 12 cm X 10 cm, de densidad heterogénea, sin calcio con bordes polilobulados, localizada en el mediastino anterior y medio, que borraba los planos grasos vecinos y desplazaba la tráquea y los vasos hacia la derecha (fig. 2, tabla II). La misma exploración descubrió lesiones hepáticas y renales sugestivas de metástasis. La gammagrafía ósea probó la existencia de metástasis diseminadas. Se diagnosticó de carcinoma embrionario mediante biopsia de la tumoración por mediastinoscopia. Tras iniciar tratamiento quimioterápico, la masa se había reducido de tamaño en un control por TC a los dos meses. Sin embargo, la exploración TC realizada a los seis meses del diagnóstico evidencia un nuevo aumento de tamaño de la tumoración. Comentarios Los TGMPM afectan en el 95 % de los casos a varones jóvenes, con una edad media de 29 años. El 30 % de los pacientes están asintomáticos en el momento de descubrirse, de forma casual, una gran masa mediastínica en la Rx de tórax. Las 82 50 J.D. CASAS CURTO ET AL.-MANIFESTACIONES RADIOLÓGICAS DE LOS TUMORES GERMINALES MALIGNOS PRIMITIVOS DE MEDIASTINO manifestaciones clínicas, si existen, son inespecíficas e idénticas a las de otras tumoraciones del mediastino. El síntoma más frecuente es el dolor subestemal2. La hemoptisis es un hallazgo común en los TGMPM de estirpe no seminomatosa3'4. La exploración física suele ser negativa o evidenciar adenopatías periféricas, y en ella debe comprobarse la normalidad de los testes. La diseminación inicial del tumor es local, a los ganglios regionales y, ocasionalmente, al pulmón adyacente. Las metástasis a distancia más frecuentes se producen en el hueso, el pulmón, el hígado o los ganglios paraaórticos2. La Rx de tórax en estos pacientes muestra los signos inespecíficos de toda masa mediastínica anterior. La lesión suele ser de gran tamaño, con bordes bien definidos y polilobulados. La densidad es generalmente homogénea, sin calcio, y las masas voluminosas, desplazan las estructuras mediastínicas vecinas2. Los hallazgos en la TC, aunque no son patognomónicos, revisten gran importancia. Así, en primer lugar, permiten conocer la densidad generalmente heterogénea de la masa, con áreas de diferentes valores de atenuación5'7. En nuestros casos los tres TGMPM eran homogéneos en la Rx de tórax, mientras que sólo uno de ellos lo era también en la TC. Levitt et al5 hallan una buena correlación entre el tipo histológico del tumor germinal y la densidad de la masa en la TC: los no seminomas suelen ser heterogéneos. En segundo lugar, la TC muestra con gran exactitud la relación de la lesión con las estructuras mediastínicas adyacentes y define los planos grasos vecinos6. En tercer lugar, las secciones axiales de la TC nos permiten conocer con mayor exactitud la extensión real de la masa y si existe componente tumoral a ambos lados del mediastino, como ocurrió en nuestro caso n.° 3. Por último, la TC hace posible lograr un correcto estadio de la enfermedad, al demostrar si existe afectación abdominal por la misma. Posibilita, además, la monitorización de la respuesta al tratamiento quimio y/o ra- 51 dioterápico5'8. Los marcadores tumorales juegan un papel complementario en el diagnóstico y seguimiento de los TGMPM mediante TC8. Sólo el 5-7 % de los seminomas tienen aumento inicial de la HCGb y ninguno presenta elevada la aFP; sin embargo, el 91 % de los de estirpe no seminomatosa muestran elevación de la aFP y/o de la HCGb9-10. En el diagnóstico diferencial radiológico de los TGMPM deben incluirse los tumores más frecuentes en el mediastino anterior (timoma, linfoma, metástasis, etc.) y también procesos benignos como el hematoma mediastínico que también produce borramiento de los planos grasos normales5-6. BIBLIOGRAFÍA 1. Brodeur GM, Howarth CB, Pratt CB, Caces J, Hustu HO. Malignant germ cell tumors in 57 children and adolescents. Cáncer 1981; 48:1890-1898. 2. Polansky SM, Barwick KW, Ravin CE. Primary mediastinal seminoma. AJR 1979; 132:17-21. 3. Patcher MR, Lattes R. «Germinal» tumors of the mediastinum: a clinico-pathologic study of adult teratomas, teratocarcinomas, choriocarcinomas and seminomas. Dis Chest 1964; 45:301-310. 4. Cox JD. Primary malignant germinal tumors of the mediastinum. A study of 24 cases. Cáncer 1975; 36:1162-1168. 5. Levitt RG, Husband JE, Glazer HS. CT of primary germ-cell tumors of the mediastinum. AJR 1984; 142:73-78. 6. Barón RL, Lee JKT, Sagel SS, Levitt RG. Computed tomography of the abnormal thymus. Radiology 1982; 142:127134. 7. Shin MS, Ho KJ. Computed tomography of primary mediastinal seminomas. J. Comput Assist Tomogr 1983; 7:990994. 8. Stomper PC, Jochelson MS, Friedman EL, Garnick MB, Richie JP. CT evaluation of advanced seminoma treated with chemotherapy. AJR 1986; 146:745-748. 9. Scardino PT, Cox HD, Waldmann TA, Mcintire KR, Mittemeyer B, Javadpour N. The valué of serum tumor markers in the staging and prognosis of germ cell tumors of the testis. J Urol 1977; 118:994-999. 10. Garnick MB, Prout GR, Canellos GP. Germinal tumors of the testis. En Holland JF, Frei E, eds. Cáncer Medicine, 2.a ed. Filadelfia. Lea & Febiger 1982; 1937-1956. 83 REVISIÓN SÍNDROME DE APNEA DURANTE EL SUEÑO E. BARROT CORTES Introducción En los últimos años, uno de los campos que ha acaparado gran parte del interés de los investigadores y clínicos, ha sido el de los mecanismos de control de la ventilación y el impacto de la fisiología normal del sueño en dichos mecanismos, tanto en los sujetos sanos o portadores de una enfermedad respiratoria de base —EPOC, asma bronquial, etc.— como en los cuadros clínicos, no detectables en vigilia, que se pueden poner de manifiesto al variar las condiciones de regulación de la ventilación durante el sueño. En los años 50, Aserinsky et al', describieron el sueño, no como un estado homogéneo, sino como una sucesión de distintos estadios con características diferenciales electroencefalográficas, fisiológicas y de conducta2. En los años 60, se realizaron los primeros registros poligráficos3, documentándose la existencia de episodios de apnea durante el sueño en los pacientes diagnosticados de síndrome de Pickwick; y progresivamente se ha ido demostrando que estas alteraciones no son raras y engloban una serie de patologías etiquetadas comúnmente como idiopáticas o esenciales, cuyas repercusiones en la clínica diaria, sobre la morbilidad y mortalidad, no son despreciables. Estos factores han dado lugar a una rápida proliferación, en distintos países, de centros especializados en el estudio de los fenómenos respiratorios durante el sueño, así como a un enorme volumen de literatura relacionada lo que ha condicionado, al mismo tiempo que una profundización en el conocimiento de la etiopatogenia de estos procesos, un cierto confusionismo en la terminología y en los conceptos que en la actualidad comienza a esclarecerse. Vamos a ocuparnos en esta revisión, del síndrome de apnea durante el sueño (SAS), incluyendo el síndrome de apnea obstructiva y central, cuyas características clínicas y datos poligráficos debemos diferenciar de la hipoventilación alveolar Recibido el 4-3-1986 y aceptado el 11-6-1986. 84 durante el sueño por otras causas4-5, del síndrome de hipoventilación alveolar central o síndrome de Ondine (caracterizado por un déficit en los mecanismos de control automático de la ventilación)6 y de la hipoventilación alveolar causada por un patrón respiratorio rápido y superficial como ha sido descrito recientemente7. En todos ellos, se produce una hipoxemia mantenida durante el sueño, no necesariamente ligada a la existencia de apneas, aunque naturalmente hay puntos comunes en la fisiopatología y manifestaciones clínicas de estos trastornos. Definición del síndrome de apnea. Incidencia y epidemiología El síndrome de apnea se define por la existencia de pausas respiratorias recurrentes durante el sueño, acompañadas en general por hipoxemia arterial; para diferenciar las variaciones fisiológicas de la respiración durante el sueño del SAS, se valoran como significativas las pausas de apnea si cumplen los siguientes criterios: a) duración superior a 10 segundos; b) un mínimo de 30 episodios en 7 horas de sueño (o un índice de apnea superior a 5 episodios/hora), y c) su aparición en fase REM y NREM del sueño8. En base a los registros poligráficos, las apneas pueden clasificarse en: centrales, cuando hay ausencia de movimiento en las curvas de flujo oronasal y de movimiento toracoabdominal; obstructivas, si se registra movimiento toracoabdominal en ausencia de flujo aéreo a nivel nasal y bucal por cierre o colapso de la vía aérea superior; mixtas, las que se inician como centrales reapareciendo posteriormente el esfuerzo inspiratorio en ausencia de flujo oronasal. En el hombre sano no es infrecuente la existencia de episodios de apnea al inicio del sueño o en fase REM9; por otra parte, hay sujetos que presentan una obstrucción parcial de la vía aérea o una disminución del estímulo inspiratorio (hipopneas) que no pueden etiquetarse de apneas pero cuya repercusión a nivel cardiopulmonar puede 52 E. BARROT CORTES ET AL.-SINDROME DE APNEAS DURANTE EL SUEÑO TABLA I Mecanismos de control e influencia del sueño en la respiración* Fases sueño Patrón respiratorio Nivel ventilación (Ve) Influencia dominante Respuesta a estímulo respiratorio Mecánica respiratoria 1 - II III - IV REM Periódica Fluctuante Metabólica-Vigilia Presente Regular i Ligera Metabólica Presente Irregular Irregular No metabólica (cortical?) 1 o Ausente Abolición músculos intercostales Abolición músculos vías altas t Contribución músculos intercostales t Resistencia vías altas (*) Tomado de Phillipson EA. «Sieep disorders» ser prácticamente igual. Por todo ello, algunos autores han propuesto como criterio en el diagnóstico del síndrome, la caída en la saturación arterial de oxígeno superior a un 4 % de la basal, en coincidencia con dichos episodios10. La incidencia y prevalencia del síndrome de apnea en el sueño no se conocen. Se estima que aproximadamente un 10-15 % de la población en sociedades industriales tiene problemas clínicos en relación con el sueño, y de éstos, un 5-10 % son provocados por trastornos respiratoriosn. En un estudio multicénctrico realizado por la Association of Sieep Disorders Center en 198212, encuentran, entre unos 5.000 pacientes, un 42 % cuyo motivo de estudio era hipersomnia, y de ellos, en un 43 %, el diagnóstico final fue de síndrome de apnea. En una muestra de 1.500 trabajadores israelíes, Lavie et al13 encuentran que al menos un 1-3 % tenían síndrome de apnea sintomático; entre los afectados, el coeficiente de accidentes laborales era significativamente superior. En un estudio realizado en la república de San Marino14, se observó entre unos 5.000 sujetos la existencia de hipertensión arterial sistémica en 9,1 % de los roncadores habituales frente a un 2,5 % entre los no roncadores, porcentaje que se eleva a un 30,7 % frente a un 4 % cuando se trata de sujetos obesos; ello puede indicar que la obstrucción repetida de la vía aérea durante el sueño se asocia a alteraciones en la función cardiovascular. Dement et at15 sugieren que la prevalencia del SAS es aproximadamente un espejo de la prevalencia de roncadores severos; ésta aumenta con la edad siendo, por encima de los 65 años, de un 45 % en varones y 32 % en mujeres. Las alteraciones respiratorias durante el sueño han sido descritas en todos los grupos de edad, con un claro predominio de varones (10-20: 1) y una distribución bimodal con dos picos de incidencia, en la primera y en la 5.a-6.a décadas. A partir de los 50 años de edad, la distribución varones:mujeres es prácticamente la misma16. Por último, aunque no vamos a ocupamos aquí del síndrome de muerte súbita del lactante (SIDS), es evidente que hay paralelismos entre las alteraciones respiratorias en la infancia y en adul55 tos. En niños, las apneas de tipo central u obstructivo parecen ser responsables de las características clínicas del SIDS17. En ambos grupos se ha descrito una incidencia familiar'9'19. De todas formas, las diferencias fisiopatológicas en las alteraciones respiratorias durante el sueño en niños y adultos son todavía objeto de discusión20. Control de la ventilación y estadios del sueño (tabla I) La respiración está controlada normalmente por dos elementos anatómicamente distintos pero funcionalmente integrados, el sistema de regulación metabólico, localizado en médula, cuya acción primordial radica en la homeostasis ácidobase y de los gases sanguíneos mediante aferencias de quimiorreceptores centrales y periféricos; y el sistema de regulación cortical que actúa en las funciones del aparato respiratorio no relacionadas directamente con el intercambio de gases sino con actividades como fonación, deglución, masticación, etc. Además de estos dos sistemas de control, la activación del sistema reticular ascendente de protuberancia y bulbo tiene una acción estimuladora del sistema respiratorio en vigilia que puede volverse inhibitoria durante el sueño21. Según los criterios electroencefalográficos (EEG), el sueño lo podemos dividir en sueño REM (o de movimientos oculares rápidos) y sueño NREM o sueño lento; en condiciones normales el sueño se inicia con fase NoREM, o sueño tranquilo, caracterizado en el EEG por la existencia de ondas lentas y progresiva desaparición del ritmo alfa rápido propio de la vigilia. Dentro de esta fase se diferencian cuatro estadios (I-IV), apareciendo simultáneamente una serie de cambios en los mecanismos reguladores de la respiración y en la mecánica ventilatoria: en primer lugar hay una disminución del volumen minuto por reducción de la frecuencia respiratoria y del volumen corriente, hay un relativo aumento de la contribución de la musculatura intercostal en relación a la vigilia y se elevan las resistencias de las vías altas22. Hay también cambios en la respuesta ventilatoria a los estímulos químicos, con desvia85 ARCHIVOS DE BRONCONEUMOLOG1A. VOL. 23, NUM. 2, 1987 ción de la curva de respuesta al CO^ hacia la derecha y ligera disminución de la pendiente. Así como una disminución de la respuesta ventilatoria a la hipoxia23. En vigilia, las influencias automáticas y voluntarias se interaccionan para establecer el nivel y patrón respiratorio; en los estadios más superficiales del sueño NREM (St I y II), el nivel de ventilación fluctúa por la distinta contribución de la vigilia (a través del sistema reticular ascendente y control cortical), por lo que no es raro encontrar un patrón de respiración irregular o una respiración de tipo periódico. En cambio, al profundizar el sueño (St III-IV o SWS), la ventilación está únicamente bajo control metabólico con un patrón respiratorio regular, lo que se atribuye a la pérdida del control voluntario y a la disminución de la respuesta a los estímulos ambientales. A intervalos de 60-90 minutos, en número de 3 o 4 por noche, aparece una fase REM, en la que se dan los sueños. En esta fase, el patrón EEG es desincronizado y parecido al de la vigilia, hay abolición del tono muscular, la respuesta a los estímulos químicos y ambientales está muy disminuida y el patrón respiratorio es con frecuencia irregular y caótico; hay grandes oscilaciones en el volumen corriente y a veces pausas respiratorias, lo que se ha atribuido a un control cortical de la ventilación y a que dicha respiración sea provocada por una manifestación externa de acciones como hablar, tragar, etc., de los sueños24. Es importante por tanto diferenciar lo que corresponde a variaciones fisiológicas de la respiración con el sueño y su repercusión en sujetos sanos o afectos de una enfermedad respiratoria de base, de aquellos procesos cuyo mecanismo patogénico primario radica específicamente en una alteración de la regulación de la ventilación en relación con el sueño, como ocurre en el síndrome de apnea. Hipótesis patogénica Como ya hemos dicho anteriormente, las apneas registradas durante el sueño pueden ser de tipo central, cuando no hay esfuerzo inspiratorio, y de tipo obstructivo o periférico, en las que hay movimiento toracoabdominal en ausencia de flujo aéreo por cierre de la vía aérea superior. En general, por ser más prolongadas y detectarse con mayor frecuencia, estas últimas parecen tener una mayor importancia clínica, sin embargo, gran número de apneas son en realidad de tipo mixto, con un componente central inicial seguido del componente obstructivo; por otra parte, se ha invocado una lesión anatómica que determine un estrechamiento de la vía aérea superior como causa del síndrome de apnea obstructiva, pero no ha podido demostrarse en todos los casos25'26. In86 cluso, en sujetos en los que hay un defecto anatómico, el hecho de que la obstrucción de la vía aérea se manifieste únicamente durante el sueño sugiere un factor funcional añadido dependiente de la musculatura de la vía aérea superior. Los primeros estudios realizados con técnica de cinerradiografía27'28 mostraron que el punto de obstrucción era a nivel de hipofaringe por un mecanismo de colapso; posteriormente, Weitzman et al29 sugirieron la hipótesis de un cierre activo de los músculos del velo del paladar. Pero los estudios electromiográficos30'31 han demostrado la importancia del músculo geniogloso (cuya contracción protuye la lengua hacia delante y dilata la vía aérea) en la estabilización de la faringe, en coincidencia con la presión negativa generada por la contracción inspiratoria del diafragma y músculos intercostales32. Durante el sueño, aunque se produce una hipotonía de todos los músculos citados, la contracción diafragmática está relativamente más conservada33'34; ello da lugar a que la presión transmural de las vías respiratorias alta$ sea negativa, con la consiguiente tendencia al colapso pasivo a nivel de orofaringe35. Posteriormente, los trabajos de Martin y Onal36'37 con electromiografía diafragmática y de músculo geniogloso aportaron otros datos de interés al demostrar en los pacientes con síndrome de apnea y en roncadores habituales38 una mayor hipotonía de todos los músculos anteriormente citados, lo que favorece la oclusión de la vía aérea; así como un aumento en la actividad EMG en diafragma una vez producida ésta, y que tiende a mantenerla, confirmándose la importancia de la sincronización entre ambos grupos musculares39. Hay nuevos datos que complementan la hipótesis de un mecanismo central inicial en el SAS basados en los estudios de control de la ventilación, tanto en el sueño como en vigilia24'40, que sugieren la existencia de un desequilibrio en el sistema feed-back de control de la respiración41 (fig. 1). Durante el sueño, al ser el estímulo hipóxico —es decir, los quimiorreceptores periféricos— el factor principal de regulación de la ventilación42'43, se facilita —por las características de las reservas de oxígeno y de la respuesta al mismo—44 la producción de una inestabilidad en el patrón respiratorio con oscilaciones en la amplitud y frecuencia del ciclo. Para algunos autores45, el síndrome de apnea no sería sino una exageración de dicha respiración periódica, que puede darse de forma fisiológica en las fases más superficiales del sueño. La posible conexión de este mecanismo con los datos patogénicos antes mencionados estribaría en que, al reaparecer la actividad eferente central (al alcanzar la PaO^ un nivel críticamente bajo)46, el estímulo de los músculos inspiratorios, particularmente del diafragma, precede o excede al de los músculos de la vía aérea superior47, debido a la distinta capacidad de respuesta a los estímulos 56 E. BARROT CORTES ET AL.—SÍNDROME DE APNEAS DURANTE EL SUEÑO Neuronas res piratoricas Músculos de caja torácica Quimiorreceptores Músculos de vías altas PCO; YPOz Resistencia vías altas t Ventilación Reserva de O; y CÜ2 Fig. 1. Componentes del sistema de control respiratorio de: Cherniack NS, N Eng S Med 1981, 305:325(41). químicos de los nervios de la vía superior y del diafragma48'49, provocándose una presión esofágica negativa y el consiguiente colapso. Es decir, simplificando, la apnea central precedería, y en cierto modo provocaría, al componente obstructivo. Esta hipótesis, que se ha visto reforzada en los últimos años por diversos trabajos50 52, permite por lo menos, una aproximación más lógica al problema del síndrome de apnea, sugiriendo una alteración primaria común —inestabilidad del sistema de control respiratorio— con diversos modos de expresión según se asocien unos factores predisponentes de la obstrucción de la vía alta (factores mecánicos), una respuesta individual congénita o adquirida de los quimiorreceptores centrales y/o periféricos, o bien la mayor o menor participación de otros mecanismos importantes en la terminación o prolongación de las apneas (mecanismo del despertar, etc.). Factores relacionados con la patogénesis y/o prolongación del SAS Se denomina «Arousal» o reacción de despertar al cambio EEG que se da generalmente al final de las apneas, justo antes de la reaparición del flujo aéreo, y que consiste en el paso a una fase más superficial del sueño o, en ocasiones, a un despertar consciente del sujeto con la consiguiente fragmentación del sueño nocturno53. Los factores causantes de esta respuesta no están totalmente clarificados y han sido atribuidos a cambios en los gases sanguíneos54, aumento de la presión pulmonar o sistémica, de la presión intratorácica55, a estímulos propioceptivos56 y, sin duda, al estímulo condicionado por la sensación de asfixia57. La misión principal del mecanismo del despertar ha sido objeto de diversas interpretaciones58. Para algunos es una respuesta esencial para la terminación de la apnea59; de hecho, se ha invocado un defecto en el mecanismo arousal como causa última del síndrome de muerte súbita 57 del lactante (SIDS)60. De forma similar, los pacientes con SAS pueden tolerar grados muy graves de hipoxemia antes de despertar61, por lo que es posible que en estos sujetos haya también un defecto en el mecanismo del despertar. La importancia de este mecanismo es doble. En primer lugar, la vigilia es per se un potente estímulo para la ventilación a través del sistema reticular ascendente. En segundo lugar, permite un control cortical o voluntario de la respiración además de modificar la respuesta refleja a diversos estímulos en relación al estadio del sueño62. Sin embargo, la repetición de cientos de despertares que sufre el paciente con SAS a lo largo de la noche, con la consiguiente fragmentación y falta de profundización del sueño que ello comporta, da lugar a una alteración en la respuesta ventilatoria a diversos estímulos, por ejemplo a la hipoxia63 y a un compromiso, a la larga, del propio mecanismo de despertar64, lo que prolonga la duración de las apneas además de agravar y perpetuar el síndrome de apnea. Por otra parte, la interrupción repetida del sueño, es el factor principal de la hipersomnia diurna que sufren estos pacientes. Por último, la depresión del despertar por el alcohol65 y algunos fármacos66 es probablemente el mecanismo por el que dichos agentes prolongan los episodios apneicos. Aunque uno de los factores invocados con mayor frecuencia como posible causa del SAS y de la hipoventilación alveolar primaria ha sido y es la alteración de los quimiorreceptores, se han realizado pocos estudios de forma sistemática en los pacientes con síndrome de apnea (ya sea de tipo central u obstructivo), y muchos de ellos son contradictorios, posiblemente por la heterogeneidad de los pacientes estudiados. Por ejemplo, Zwillich et al67 refieren una respuesta disminuida a la hipoxia y a la hipercapnia en pacientes con el diagnóstico de obesidad-hipoventilación alveolar que, como es sabido, se asocia con gran frecuencia al SAS; sin embargo se trata de pacientes hipercápnicos, por lo que es difícil interpretar los resulta87 ARCHIVOS DE BRONCONEUMOLOGIA. VOL. 23, NUM. 2, 1987 68 dos. Orr et al encuentran una respuesta ventilatoria normal en pacientes normocápnicos con síndrome de apnea. Por contra, Garay et al69 refieren una relación inversa entre la PCO¡ en vigilia y la respuesta ventilatoria a la hipercapnia. Lo que sí parece haber es un mecanismo de adaptación de los quimiorreceptores, como ocurre en la aclimatación a las alturas o en la exposición crónica a la hipercapnia. Ello explicaría la respuesta subnormal frecuente en estos pacientes y parece corroborarse por la progresiva normalización de la respuesta a la hipercapnia en pacientes traqueotomizados, como ha sido descrito por algunos autores70-71. Con los conocimientos actuales no es posible atribuir un valor pronóstico a los test de respuesta ventilatoria y únicamente en el síndrome de hipoventilación alveolar primaria, la ausencia de respuesta es un criterio diagnóstico importante. El calibre de la vía aérea superior es un factor clave en el síndrome de apnea obstructiva (OSAS). Como ya se ha dicho anteriormente, las fuerzas que determinan la abertura o cierre de la vía aérea dependen, por una parte, de la geometría de la vía aérea y de las propiedades elásticas de la pared de orofaringe; por otra parte, del tono muscular y de la presión transmural73. Aunque no sabemos la exacta contribución de cada uno de estos factores en la patogenia del OSAS, es evidente que cuanto más estrecha sea la vía aérea más vulnerable es al cierre y mayor el tono muscular necesario para mantenerla abierta. Además, al ser más estrecha, la vía requiere mayor presión inspiratoria para mantener un flujo aéreo adecuado. Esta elevada presión transmural favorece la obstrucción dinámica a nivel de orofaringe en la inspiración. Hay numerosas evidencias de que la existencia de amígdalas hipertróficas o adenomegalia es causa de obstrucción en el SAS, principalmente "en niños74, aunque se han descrito también en adultos75. Las malformaciones mandibulares son otra causa importante de obstrucción76, puesto que la lengua forma la pared anterior de la orofaringe y se inserta en la mandíbula, una retrognatia, por ejemplo, implica un estrechamiento a nivel de orofaringe77. Otras causas reconocidas serían el engrosamiento de la lengua en la obesidad78, la acromegalia79 y el mixedema80. Con menor frecuencia, tumores linfoides u otras neoplasias han sido descritas como causa de obstrucción81. Muchos pacientes con síndrome de apnea presentan un paladar blando hipotónico, hipertrófico o ambos a la vez, lo que puede ser el resultado de una alteración mecánica provocada a lo largo de muchos años en roncadores severos, que conduzca a una pérdida del tono tisular y a una incompetencia de los músculos tensores del velo del paladar82. Ello explicaría porque algunos ronca88 dores severos llegan a desarrollar un síndrome de apnea obstructivo. Aunque muchos pacientes no presentan evidencia clínica de estrechamiento de la vía aérea, hay recientes observaciones acerca de la posibilidad de que en algunos casos la vía aérea esté estrechada en su totalidad, incluyendo tráquea83; algunos autores han descrito la existencia de una elevada reistencia oronasal o de una alteración en las curvas flujo-volumen en pacientes con OSAS84'85. Sin embargo, estos test no discriminan el punto de estrechamiento. Recientes estudios realizados con tomografía axial computarizada indican que toda la orofaringe puede ser anormalmente estrecha en estos pacientes86'87. En este sentido, el análisis cefalométrico propugnado por Guilleminault88 puede ser de valor para evaluar el calibre de la vía aérea y conocer realmente qué porcentaje de pacientes presentan una anomalía en la geometría de la vía aérea, el valor predictivo que puede tener este hallazgo en los sujetos roncadores, etc. Por otra parte, los recientes trabajos realizados por el grupo de Toronto mediante una nueva técnica de reflexión acústica, sugieren la posibilidad de que el estrechamiento sea por un mecanismo dinámico, pues describen el hallazgo de una compliance anormalmente elevada a nivel de faringe en los sujetos con síndrome de apnea89. Características clínicas Los principales síntomas clínicos en el SAS son por orden de frecuencia8: • Alteraciones de la conducta en el sueño; ronquidos, pausas respiratorias prolongadas, despertar sobresaltado, enuresis, sonambulismo. • Hipersomnia diurna. • Deterioro intelectual, pérdida de memoria. • Alteraciones de la libido. • Trastornos del carácter y de la personalidad. • Cefalea matutina. • Alucinaciones hipnagógicas y conducta automática. • Insomnio. • Disnea de esfuerzo, edema periférico. Es importante en la evaluación clínica de estos pacientes, la realización de una historia clínica detallada, con un interrogatorio dirigido al paciente y familiares, por la gran frecuencia con que el sujeto subestima o no relaciona trastornos que a veces lleva años padeciendo, con el consiguiente deterioro de su vida familiar y social. El examen físico del paciente puede ser normal; sin embargo, es frecuente la asociación de obesidad (es más del 50 % de los sujetos con SAS), hipertensión arterial sistémica o poliglobulia. En 10-15 % de los pacientes pueden detectarse alteraciones cardiopulmonares en vigilia90, 58 E. BARROT CORTES ET AL.-SINDROME DE APNEAS DURANTE EL SUEÑO Vasoconstricción pulmonar Hipertensión pulmonar Insuficiencia cardiaca derecha Vasoconstricción sistémica Hipertensión arterial sistémica Bradicardia vagal. Isquemia e irritabilidad cardiaca Estimulación eritropoyesis Afección cerebral Fragmentación o sueño superficial Arritmias cardiacas Muerte súbita Poliglobulia Hipersomnia diurna Deterioro intelectual Alteraciones de la conducta y de la personalidad Fig. 2. Secuencia de los sucesos y complicaciones clínicas en el síndrome de apnea obstructiva tomado de Phillipson EA (21). así como signos de hipertensión pulmonar e insuficiencia respiratoria en estadios avanzados de la enfermedad. La exploración funcional respiratoria puede mostrar una disminución de los volúmenes pulmonares estáticos derivada de la propia obesidad91, una elevación de la resistencia de la vía aérea, una alteración en la curva flujo-volumen por una obstrucción extratorácica y, en ocasiones, una disminución de la respuesta ventilatoria a los estímulos químicos que tal vez juegue un papel primario en el desarrollo de la insuficiencia respiratoria o sea secundaria a la propia hipoventilación asociada a la obstrucción de la vía aérea71. Fisiopatología de las principales características clínicas Las características clínicas del paciente con SAS evolucionado, ya sea de tipo central u obstructivo, vienen dadas por la repetición, hasta cientos de veces por noche en muchos pacientes, de las pausas apneicas en una sucesión de acontecimientos que aparecen esquematizados en la figura 2. La hipersomnia diurna y las alteraciones intelectuales y de la personalidad han sido relaciona61 das con la hipoxemia nocturna, habiéndose postulado una alteración de los neurotransmisores centrales en respuesta a los episodios recurrentes de hipoxia92. Se ha invocado también la hipercapnia y el frecuente despertar con la consiguiente fragmentación del sueño como causa de la hipersomnolencia93. Sin embargo, ninguno de dichos factores explican totalmente la hipersomnia incapacitante que se da en gran número de estos pacientes, pues la hipercapnia puede producir confusión e incluso coma a niveles de PCO; superiores a 65-70 mmHg, lo que no es frecuente en estos enfermos, mientras están en vigilia. Además, pacientes con enfermedad pulmonar crónica evolucionada y grave alteración del intercambio de gases no presentan grados similares de somnolencia. Posiblemente la hipercapnia sea la causa de la cefalea y la confusión matutina94. Se ha propuesto una hipótesis, aún especulativa, acerca de la posible acción de una sustancia provocadora de sueño (factor S)95 que ha sido aislada en orina96, aunque su relación con la hipersomnia del síndrome de apnea es aún incierta. Alteraciones hemodinámicas. — La presión arterial pulmonar y sistémica se elevan en coincidencia con los episodios de apnea, volviendo al valor basal al reanudarse la ventilación. Pero cuando las apneas se suceden con gran frecuencia 89 ARCHIVOS DE BRONCONEUMOLOGIA. VOL. 23, NUM. 2, 1987 la presión no vuelve al nivel basal sino que aumenta de forma escalonada, normalizándose solamente con el despertar90. Estos cambios hemodinámicos se han documentado tanto en apneas de tipo central como mixto u obstructivo, aunque en estas últimas el aumento en la presión es mucho más pronunciado97, habiéndose registrado en algunos pacientes presiones en capilar pulmonar capaces de producir edema pulmonar98. Sin embargo, es difícil saber qué grado de desaturación arterial puede ser tolerado por el paciente antes de iniciarse la hipertensión pulmonar, poliglobulia u otras alteraciones derivadas de la hipoxemia. Por otra parte, los modelos animales sugieren que las variaciones intermitentes en la oxigenación tienen mayor repercusión en el lecho vascular pulmonar que la hipoxia mantenida99. La retención de CO; en el sueño puede tener un efecto de sumación en la respuesta vascular pulmonar a la hipoxoa100. La aparición de bradicardia sinusal u otras arritmias cardiacas como bloqueo A-V de segundo grado o asistolia es relativamente frecuencia en coincidencia con los episodios de apnea90'101. El mecanismo de estas arritmias parece ser el resultado de complejas interacciones en el sistema cardiorrespiratorio más que de una alteración cardíaca intrínseca puesto que los estudios electrofisiológicos realizados en estos pacientes no han mostrado alteraciones significativas102. Por otra parte, es sabido que estas bradiarritmias prácticamente desaparecen con la administración de atropina103 y que los pacientes con alteración intrínseca del sistema nervioso autónomo no muestran la respuesta cardiovascular típica a la hipoxia e hipercapnia, como ocurre en el síndrome de Shy-Drager. Las arritmias ventriculares complejas son probablemente el resultado de un reflejo neural central, de un desequilibrio en el flujo sanguíneo miocárdico, de una alteración del equilibrio ácido-base, o de varios de estos factores a la vez104. Las arritmias atriales, incluyendo flutter y fibrilación auricular, son posiblemente causadas por la hipertensión pulmonar y de aurícula derecha, habiéndose descrito su desaparición tras la traqueostomía105. Diagnóstico El síndrome de apnea durante el sueño puede sospecharse en aquel paciente de edad media o avanzada, obeso, hipertenso, con una larga historia de somnolencia diurna y sueño intranquilo con grandes ronquidos y pausas respiratorias. Sin embargo, es cada vez más evidente la importancia del diagnóstico de estos trastornos en los estadios más precoces así como la valoración de la repercusiones sistémicas y factores asociados (enfermedad respiratoria de base, estrechamiento anató90 TABLA II Protocolo de estudio. Síndrome de apnea I Historia clínica y exploración general: a) Obesidad, hipertensión arterial, corazón pulmonar, poliglobulia. b) Hipersomnia diurna, cefalea matutina, hipersensibilidad a sedantes, insomnio, comportamiento automático, enuresis, alteraciones ritmo respiratorio en el sueño, disminución de la libido, disminución del rendimiento intelectual. II Exploración funcional respiratoria habitual + gasometría arterial, curvas flujo-volumen, test de hiperventilación, test de sensibilidad a hipoxia e hipercapnia. III Exploraciones complementarias: Estudio ORL - Tomografía de tráquea índices cefalométricos Estudio endocrinológico - Función tiroidea Exploración neurológica IV Registro poligráfico y/o oximétrico en el sueño mico y funcional de la vía aérea), o la detección de otras enfermedades metabólicas o neurológicas que puedan desencadenar o agravar estos trastornos. Por ello cuando se sospeche la existencia de alguna alteración asociada (tabla II), debe realizarse en todos los pacientes una evaluación general y los test diagnósticos apropiados, además del registro poligráfico que dará el diagnóstico definitivo. Registro poligráfico. —El diagnóstico de certeza del SAS se basa en la documentación de los episodios de apnea mediante la monitorización y estandarización de las fases del sueño, determinación de los parámetros respiratorios y registro de otras variables (EKG, presión esofágica, etc.) que nos permitan el diagnóstico y correcta clasificación de las apneas, así como una valoración de las repercusiones que a nivel sistémico tienen dichos trastornos. Para la determinación de las fases del sueño es suficiente con dos canales de la lectura (C3A2/ A201), con los electrodos de superficie situados según las normas internacionales 10-20106, electrooculograma y electromiograma submentoniano. La lectura de las fases y su estandarización se realizan por intervalos de 20 segundos según las normas de Rechstaffen et al107. Para la documentación de los episodios apneicos, definiendo como tales la ausencia de flujo aéreo oronasal durante más de 10 segundos, y su clasificación en apneas de tipo central y obstructivo, se han venido utilizando durante mucho tiempo los termistores captadores de flujo, situados frente a los orificios nasales y boca, junto a las bandas torácica y abdominal conectadas a un dectector de volumen (Volucapt). Sin embargo, 62 E. BARROT CORTES ET AL.-SINDROME DE APNEAS DURANTE EL SUEÑO este método proporciona una información cualitativa, es decir, la presencia o no de flujo aéreo o de movimiento toracoabdominal, pero no podemos hacer una valoración cuantitativa del volumen corriente lo cual es importante por ejemplo para determinar la existencia de hipopneas, que se definen como la disminución superior a un 50 % en el volumen corriente. En la actualidad podemos realizar dichas determinaciones mediante el método pletismográfico Respitrace108 que permite determinar las variaciones de volumen de forma cuantitativa y diferenciar las apneas de tipo central y periférico; tiene además la ventaja adicional de producir mucho menor dis'confort al paciente puesto que suprimimos los termistores oronasales y únicamente requiere dos bandas rodeando caja torácica y abdomen. Es esencial asimismo la determinación de la saturación arterial de oxígeno, lo que se realiza habitualmente mediante el oxímetro cutáneo, método incruento y cuya exactitud y fiabilidad ha sido ampliamente estudiada109; una alternativa a dicho oxímetro es el modelo Waters, diseñado para registros en niños aunque es menos exacto en la determinación de las oscilaciones de la SaOz. En algunos centros se utilizan los electrodos de superficie, principalmente para la determinación continua de la PCO¡. Estos electrodos, aunque son menos engorrosos para el paciente y parecen tener una sensibilidad aceptable, están sujetos a una serie de problemas de tipo técnico —interferencia con el sudor, panículo adiposo, etc.— que los hace menos fiables para el registro continuado de estos pacientes110. Por último, es imprescindible el registro continuo de electrocardiograma mediante dos electrodos de superficie, debajo de clavícula derecha y a nivel de 7.° espacio intercostal izquierdo respectivamente, para el registro de las alteraciones del ritmo que pueden darse en coincidencia con las apneas. Otros parámetros que pueden proporcionar información adicional si se dispone de los preamplificadores adecuados y de un polígrafo con el suficiente número de canales son el electromiograma intercostal, micrófono, registro continuo de la presión esofágica o de la presión arterial sistémica, etc. índices derivados del registro poligráfico. — El índice usado más comúnmente es el de Apnea más Hipopnea (A+H)I. Para obtenerlo se divide el número total de episodios de apneas e hipopneas durante el sueño, se divide por el tiempo total de sueño en minutos y se multiplica por 60; así, el índice (A+H)I da el número de episodios por hora de sueño. Aunque este índice proporciona una idea de la severidad del síndrome, está sujeto a algunas críticas: en primer lugar, el nivel de normalidad debería ajustarse a la edad y sexo 63 TABLA III Tratamiento en el síndrome de apnea Tratamiento médico Profilaxis: Evitar fármacos depresores del centro respiratorio Evitar alcohol y drogas que alteren el despertar Corrección de la obesidad Tratamiento de las enfermedades subyacentes TTO farmacológico: Estimulantes respiratorios Drogas neuroactivas Oxigenoterapia nocturna Medidas mecánicas Corrección quirúrgica de las alteraciones anatómicas de orofaringe Presión positiva continua (CPAP) Marcapasos diafragmático Ventilación asistida nocturna del paciente, pues, aunque se ha adoptado como patológico un índice superior a 5, es arbitrario puesto que faltan estudios acerca de las oscilaciones del mismo según dichas variables111. Otros índices derivan de los valores de saturación arterial de oxígeno durante el registro poligráfico. Algunos cuentan el número de episodios asociados a un descenso en la Sa0¡ por debajo del 90 % o del 80 %. Otros dan el número de caídas en la saturacón arterial superior a un 4-5 % de la basal como «índice de desaturación arterial» o bien el tiempo de sueño en que la saturación de oxígeno se mantiene por debajo de un nivel determinado. Otro parámetro para valorar la severidad de las apneas es su duración media. Por último, se ha utilizado también el índice de arritmias cardiacas, que ayuda a valorar la severidad de algunas alteraciones específicas durante el sueño en los pacientes con síndrome de apnea. Tratamiento La aproximación terapéutica al enfermo diagnosticado de SAS debe ser individualizada, valorándose los signos y síntomas predominantes, la existencia o no de factores asociados o predisponentes, y el tipo de apnea que presenta, así como la severidad de la hipoxemia nocturna, arritmias cardíacas, etc. Las medidas terapéuticas de que disponemos en la actualidad, las podemos clasificar en médicas y mecánicas (tabla III). El tratamiento médico del SAS debe ir dirigido en primer lugar a evitar aquellos factores desencadenantes o que pueden agravar el síndrome. Por ejemplo, evitar el uso de depresores respiratorios o sedantes, incluyendo el alcohol, antihistamínicos, benzodiacepinas, etc65'112. La deprivación de sueño o factores que puedan determinar un aumento en la resistencia de la vía aérea superior como la rinitis alérgica"3. 91 ARCHIVOS DE BRONCONEUMOLOGIA. VOL. 23, NUM. 2, 1987 La prevención o corrección de la obesidad es un factor preponderante en el tratamiento, principalmente en el síndrome de apnea obstructiva. La pérdida de peso, a veces de sólo algunos kilos, conduce a una mejoría clínica llamativa en algunos pacientes114. Sin embargo, es de señalar la falta de correlación existente entre sobrepeso y aparición de los síntomas, así como la dificultad de mantener a estos pacientes establizados en su peso normal, lo que ha llevado en algunos casos a la utilización de cirugía digestiva, siendo en la actualidad la gastroplastia la técnica con menores complicaciones y efectos secundarios, y que es defendida por algunos autores115. El tratamiento de problemas médicos como la insuficiencia cardíaca congestiva o la poliglobulia puede disminuir signos y síntomas del SAS por reducción del tiempo de circulación y por favorecer la estabilización del control respiratorio. Asimismo, la corrección de enfermedades subyacentes, como el hipotiroidismo, debe realizarse mediante el tratamiento sustitutivo adecuado. El uso de oxigenoterapia nocturna de bajo flujo en el tratamiento del SAS ha sido y sigue siendo muy controvertido. Mientras para algunos autores el oxígeno prolonga la duración de las apneas aumentando el riesgo de acidosis y de arritmias cardíacas116, para otros el beneficio que comporta la prevención de la hipoxia y la mejoría de la función cardiovascular justifica su utilización a largo plazo117. La razón de estas contradicciones puede explicarse por los distintos factores que participan en el desarrollo del SAS. Si la apnea obstructiva está en relación a una progresiva disfunción del control central de la ventilación debida a la misma hipoxia118, el uso del oxígeno estaría evidentemente justificado; por otra parte, la oxigenoterapia nocturna no está indicada en los pacientes con SAS que presentan obstrucción mecánica en la vía aérea u obesidad extrema, pudiendo incluso ser perjudicial. Su uso puede ser de valor en pacientes con apneas de predominio central o mixto19. Los estudios realizados con fármacos en el SAS han sido llevados a cabo con resultados diversos, siendo en la actualidad el uso de drogas empírico y sujeto a investigación. La utilización de acetazolamida en pacientes con apneas de predominio central ha sido defendida por algunos autores120 como un estimulante respiratorio que actúa mediante la instauración de una acidosis metabólica; sin embargo, otros estudios realizados con esta droga no han mostrado resultados favorables'i. El tratamiento farmacológico del síndrome de apnea obstructiva se basa en actuar sobre los mecanismos de control mediante el aumento del impulso respiratorio a los músculos de la vía aérea superior; el uso de medroxiprogesterona, estimulante respiratorio, ha dado resultados diversos; Orr et al121 encuentran una mejoría sintomática 92 en algunos pacientes, lo que atribuyen a una mejoría en la oxigenación, sin variación significativa en el índice de apnea, mientras que Strhol et al122 refieren una mejoría objetiva con disminución en el número de apneas. La progesterona, 60 mg/ día por vía oral, es utilizada en general en pacientes con síndrome de apnea moderado o en mujeres postmenopáusicas123, aunque carecemos de datos acerca de los posibles efectos secundarios de esta droga a largo plazo. Otros fármacos utilizados son los antidepresivos tricíclicos, protriptilina y clomipramina'24. El mecanismo de acción principal es por supresión de la fase REM del sueño'25, fase en la que generalmente es más severa la hipoxemia arterial. Sin embargo, estos fármacos han mostrado diversos inconvenientes, como un efecto rebote con mayor porcentaje de fase REM al suprimir la medicación, o la aparición de tolerancia y mayor frecuencia de arritmias cardíacas en el tratamiento con protriptilina. Otras drogas que están todavía en fase de investigación, de las que no poseemos todavía resultados concluyentes, son: estricnina126, naloxone'27, nicotina128, teofilina y bromocriptina'29. Medidas mecánicas y quirúrgicas. — En los casos en que hay un estrechamiento anatómico de la vía aérea, su corrección quirúrgica (adenoidectomía74, amigdalectomía75, osteotomía mandibular)130 puede conducir a la mejoría de los síntomas y, en ocasiones, a la reversión total del síndrome. Otros procedimientos quirúrgicos sobre la vía aérea superior han sido realizados en pacientes en los que sin una estenosis mecánica evidente, la simple inspección clínica revela la existencia de una úvula engrosada con un paladar blando hipotónico y edematoso, lo que evidentemente reduce el calibre a nivel de orofaringe, tratándose además de una zona fácilmente colapsable dadas sus características físicas. En estos sujetos se ha propuesto la realización de la palatofaringoplastia (PPP)13', técnica que si bien ha sido muy controvertida por la posibilidad de provocar efectos indeseables como alteraciones de la deglución, rinolalia, etc., parece dar muy buenos resultados en la experiencia de algunos autores'32'133. De confirmarse estos resultados sería tal vez la alternativa terapéutica, junto a la CPAP de la que hablaremos más adelante, de mayor validez en los pacientes con apneas de tipo obstructivo. La traqueostomía con cierre diurno, que tuvo su momento de entusiasmo hace algunos años134'135, ha ido restringiéndose progresivamente en su aplicación puesto que, aunque evidentemente es el bypass más efectivo para la oclusión de la vía aérea superior, la frecuencia de efectos indeseables, tanto de tipo local (infección, formación de tejido de granulación) como las complicaciones generales y efectos psíquicos136, ha hecho 64 E. BARROT CORTES ET AL.-SINDROME DE APNEAS DURANTE EL SUEÑO que en la actualidad sean muy reducidas sus indicaciones, siendo en general preferible intentar antes otras medidas terapéuticas. El método desarrollado por Sullivan et al137 consistente en evitar el colapso de la vía aérea mediante la aplicación de una presión positiva continua nasal está dando resultados muy alentadores en los pacientes con apneas de tipo obstructivo138 asimismo, los controles a largo plazo parecen confirmar que dicho sistema es relativamente bien tolerado por el paciente139, por ello tal vez sea en este momento la medida terapéutica eficaz en el OSAS menos agresiva. En pacientes con apneas de predominio central se han intentado algunas otras medidas terapéuticas como la implantación del marcapasos diafragmático140 o la ventilación asistida nocturna mediante la utilización del pulmón de acero o de la coraza torácica que actúa creando una presión negativa alrededor de tórax14'. En todas ellas uno de los principales inconvenientes descritos es la facilitación del colapso de la vía aérea superior por lo que es frecuente la necesidad de practicar la traqueotomía, como han descrito Glenn et al52 en pacientes con marcapasos diafragmático implantado. BIBLIOGRAFÍA 1. Aserinsky E, Kleitman N. Regularly occurring periods of éye motility, and concomitant phenomena during sieep. Science 1953;118:273. 2. Dement W, Kleitman N. Cyclic variations in EEG during sieep and their relation to eye movements, body motility and dreaming. Electroencephalogr Clin Neurophysiol 1957; 9:73. 3. Gastaut H, Tassinari CA, Duron B. Polygraphic study of episodio dhirnal and nocturnal (hypnic and respiratory) manifestatións of the Pickwick syndrome. Brain Res 1966; 2:167. 4. De Marco FJ, Winne W, Block AJ, Boysen PG, Taasan VC. Oxygen desaturation during sieep as a determinant of the «Blue and Bloated» Syndrome. Chest 1981; 79:621-625. 5. Guilleminault C, Kurland G, Wonkie R, Miles LE. Severe Kyphoscoliosis, breathing and sieep (The «Cuasimodo» syndrome during sieep). Chest 1981; 79:626-630. 6. LugARESI E, Cirignotta F, Coccagna G, Montagna P, Zücconi M, Mondini S. Sieep related respiratory impairment. Bull Europ Physiopath Res 1982; 18 (suppl 4): 187-198. 7. Bradley TD, Day A, Hyland RH, Webster P, Rutherford R, Me Nicholas W,Phillipson EA. Chronic ventilatory failure caused by abnormal respiratory pattern generation during sieep. Am Rev Res Dis 1984; 130:678-680. 8. Guilleminault C, Van Den Hoed J, Mitler MM. Clinical overview of the sieep apnea syndromes. In: Sieep apnea syndromes. Ed by Guilleminault C and Dement WC. New York. Alan R Liss 1978; 1-12. 9. Phillipson EA. Regulation of breathing during sieep. Am Rev Res Dis 1977,155:217-227. 10. Wynne JW, Block AJ, Hemenway J, Hunt LA, Flock MR. Disordered breathing and oxygen desaturation during sieep in patients with chronic obstructive lung disease (COPD). Am J Med 1979; 66:573-579. 11. Guilleminault C, Dement WC. Sieep apnea syndrome and related sieep disorders. In: Sieep disorders: Diagnosis and treatment. Ed by RL Williams and I. Koracan. New York. John Wiley 1978; 9-28. 65 12. Colemn RM and others. SIeep-Wake disorders based on a polysomnographic diagnosis. A national cooperative study. JAMA 1982; 247:997-1003. 13. Lavie P. Sieep dysturbances in industry workers. Sieep Res 1980; 9:209-221. 14. Mondini S, Zücconi M, Cirignotta F, Aguglia U, Lenzi PL, Zauli C, Lugaresi E. Snoring as a risk factor for cardiac and circulatory problems: an epidemiológica! study. In: Sieep/ Wake disorders, Natural history, epidemiology and long-term evolution. Ed by Guilleminault C and Lugaresi E. New York. RavenPress 1983; 99-105. 15. Dement WC, Carskadon MA, Richardson G. Excessive daytime sieepiness in the sieep apnea syndrome. In: Sieep apnea syndromes. Ed by Guilleminault and Dement. New York. Alan R Liss 1978; 23-46. 16. Block AJ, Wynne JW, Boysen PG. Sieep disordered breathing and nocturnal oxygen desaturation in postmenopausal women. Am J Med 1980; 69:75-79. 17. Tonkin SL, Stewart JH, Withey S. Obstruction of the upper airway as a mechanism of sudden infant death: evidence for a restricted nasal airway contribution to pharyngeal obstruction. Sieep 1980; 3:375-382. 18. Strohl KP, Saunders NA, Feldman NT, Hallett H. Obstructive sieep apnea in family members. New Eng J Med 1978; 299:969-973. 19. Shannon DC. The sudden infant death syndrome. Clin Chest Med 1980; 1:327-338. 20. Weil JV. Familia! factors, ventilatory control and sudden infant death. N Eng J Med 1980; 302:517-519. 21. Phillipson EA, Bowes G. Sieep disorders. In: Update: Pulmonary disease and disorders. AP Fishman. Ed Me GrawHill 1982; 256-273. 22. Cherniack NS. Sieep apnea and its causes. J Clin Invest 1984; 73:1501-1506. 23. Santiago TV, Scardella AT, Edelman NH. Determinants of the ventilatory responses to hypoxia during sieep. Am Rev Respir Dis 1984; 130:179-182. 24. Phillipson EA. Control of breathing during sieep. Am Rev Respir Dis (State ofthe art) 1978; 118:909-939. 25. Guilleminault C, Eiridge FL, Simmons FB, Dement WC. Sieep apnea in eight children. Pediatrics 1976; 58:23. 26. Lugaresi E, Coccagna G, Mantovani M, Cirignotta F. Hypersomnia with periodic apnea. In: Narcolepsy. C Guilleminault, WC Dement and P Passovant. New York. Ed. Spectrum 1976;351. 27. Cirignotta F, Legaresi E. Some cineradiographics aspects of snoring and obstructive apneas. Sieep 1980; 3:225226. 28. Pedro-Botet Pons J, Fuentes Otero FJ, Sagalés MT, Moreno Fuentes JA, Roca Montanari A. Diagnóstico y tratamiento del síndrome de hipersomnia diurna y respiración periódica durante el sueño. Consideraciones etiopatogénicas. Med Clin 1978; 70:149. 29. Weitzman E, Pollak CP, Borowiecky B, Burack B, Shprintzen R, Rakoff S. The hypersomnia-Sleep apnea syndrome: site and mechanism of upper airway obstruction. In: Guilleminault C, Dement WC eds. Sieep apnea syndromes. New York. Alan R Liss 1978; 235-248. 30. Sauerland E, Orr WC, Hairston LE. EMG patterns of oropharyngeal muscles during respiration in wakefulness and sieep. Electromyogr Clin Neurophysiol 1981; 21:307-316. 31. Guilleminault C, Hill MW, Simmons FB, Dement WC. Obstructive sieep apnea. Electromyographic and fiberoptic studies. Exper Neurol 1978; 62:48-67. 32. Brouillette RT, Thach BT. A neuromuscular mechanism manteining extrathoracic airway patency. J Appl Physiol 1979; 46:772-779. 33. Sauerland E, Harper R. The human tongue during sieep: electromyographic activity of the genioglossus muscle. Exper Neurol 1976; 51:160-170. 34. Anch AM, Remmers JE, Sauerland EK, DeGroot WJ. Oropharyngeal patency during waking and sieep in the Pickwickian syndrome: electromyographic activity of the tensor veli palatini. Electromyogr Clin Neurophysiol 1981; 21:317-330. 35. Remmers J, DeGroot WJ, Sauerland EK, Anch AM. 93 ARCHIVOS DE BRONCONEUMOLOGIA. VOL. 23, NUM. 2, 1987 Pathogenesis of upper airway occiussion during sieep. J Appl Physiol 1978; 44:931-938. 36. Martin RJ, Pennock BE, Orr WC, Sanders MH, Rogers RM. Respiratory mechanics and timing during sieep in occiusive sieep apnea. J Appl Physiol 1980; 48:432-437. 37. Onal E, Lopata M. Periodic breathing and the pathogenesis of occiusive sieep apneas. Am Rev Respir Dis 1982; 126:676-680. 38. Orr WC, Stahí ML. Responses to airway occiusion during sieep in symptomatic and asymptomatic patients with sieep apnea (abstract). Chest 1982; 85:236. 39. Strohl KP, Hensley MJ, Hallett M et al. Activation of upper airway muscles before onset of inspiration in normal humans. J Appl Physiol 1980; 49:638-642. 40. Mitchell RA, Berger AJ. Neural regulation of respiration. Am Rev Respir Dis (state of the art) 1975; 111:206-224. 41. Cherniack NS. Respiratory dysrhythmias during sieep. N EngJMed 1981;305:325-330. 42. Berthon-Jones M, Sullivan CE. Ventilatory and arousal responses to hypoxia in sieeping humans. Am Rev Respir Dis 1982; 125:632-639. 43. Hedemark LL, Kronenberg RS. Ventilatory and heart rate responses to hypoxia and hypercapnia during sieep in adults. J Appl Physiol 1982; 53:307-312. 44. Douglas NJ, White DP, Weil JV, Pickett CK, Martin RJ, Hudgel DW, Zwillich CW. Hypoxic Ventilatory response decrease during sieep in normal men. Am Respir Dis 1982; 125:286-289. 45. Onal E, Lopata M, 0'Connor T. Pathogenesis of apneas in hypersomnia sieep apnea syndrome. Am Rev Respir Dis 1982;125:167-174. 46. Ghote B, Goldman MD, Cherniack NS, Mantey P. Effect of progressive hypoxia on breathing during sieep. Am Rev Respir Dis 1982; 126:97-102. 47. Cherniack NS, Von Euler C, Homma I, Kao FF. Experimentally induced Cheyne-Stokes breathing. Respir Physiol 1979; 37:185-200. 48. Weiner D, Mitra J, Salamone Jm Cherniack NS. Effect of chemical stimuly on nerves suppiying upper airway muscles. J Appl Physiol 1982; 52:530-536. 49. Bruce EN, Mitra J, Cherniack NS. Central and peripheral quemoreceptor inputs to phrenic and hypoglossal motoneurons. J Appl Physiol 1982; 53:1504-1511. 50. Sanders MH, Rogers RM, Pennock BE. Prolonged expiratory phase in sieep apnea. A unifying hypothesis. Am Rev Respir Dis 1985; 131:401-408. 51. Sanders MH, Moore SE. Inspiratory and expiratory partitioning of airway resistance during sieep in patients with sieep apnea. Am Rev Respir Dis 1983; 127:554-558. 52. Gleen WWL, Gee JBL, Colé DR, Farmer WC, Shaw RK, Bechman CHB. Combined central alveolar hypoventilation and upper airway obstruction. Treatment by tracheostomy and diaphragm pacing. Am J Med 1978; 64:50-60. 53. Kriger J, Kurtz D. EEG changes before and after apnea. In. Sieep apmea syndromes. C Guilleminault and WC Dement EDs. New York. Alan R Liss 1978; 161-176. 54. Huhelin A, Bonvallet M, Dell P. Activation reticulaire et corticale d'origine chemoceptive au cours de 1'hypoxie. Electroencephalogr Clin Neurophysiol 1959; 11:325-340. 55. Anthonisen NR, Kryger MH. Ventilation and arousal responses to hypoxemia in sieep. Am Rev Respir Dis 1982; 125:1-2. 56. Bowes G, Towsend ER, Bromley SM, Kozar LF, PhiIlipson EA. Role of the carotid body and of afferent vagal stimuli in the arousal response to airway occiusion in sieeping dogs. Am Rev Respir Dis 1981; 123:644-647. 57. Sullivan CE, Kozar LF, Murphy E, Phillipson EA. Arousal, ventilatory and airway responses to bronchopulmonary stimulation in sieeping dogs. J Appl Physiol 1979; 47:17-25. 58. Bowes G, Phillipson EA. Arousal responses to respiratory stimuli during sieep. In: Sieep and breathing. New York. Marcel Dekker Inc. 1984; 137-162. 59. Phillipson EA, Sullivan CE. Arousal: the forgotten response to respiratory stimuli. Am Rev Respir Dis 1978; 118:807-809. 94 60. Valdes-Dapena M. Sudden unexplained infant death, 1970 through 1975, an evolution in undestanding. Pathol Annu 1977; 12:117. 61. Guilleminault C, Rosekind M. The arousal threshold, sieep deprivation sieep fragmentation and obstructive sieep apnea syndroma. Bull Physiopathol Respir 1981; 17:341-349. 62. Sullivan CE, Murphy E, Kozar LF, Phillipson EA. Waking and ventilatory responses to laryngeal stimulation in sieeping dogs. J Appl Physiol 1978; 45:681-689. 63. White DP, Douglas NJ, Pickett CHK, Zwillich CW, Weil JV. Sieep deprivation and the control of ventilation. Am Rev Respir Dis 1983; 128:984-986. 64. Phillipson EA, Bowes G, Sullivan CE, Woolf GM. The influence of sieep fragmentation of arousal and ventilatory responses to respiratory stimuli. Sieep 1980; 3:281-288. 65. Issa FG, Sullivan CE. Alcohol, snoring and sieep apnea. J Neurol Neurosurg Psychiatry 1982; 45:353-359. 66. Hedemark LL, Kronenberg RS. Flurazepam attenuates the arousal response to CO; during sieep in normal subjects. Am Rev Res Dis 1983; 128:980-983. 67. Zwillich CW, Sutton FD, Pierson DJ, Creagh EM, Weil JV. Decreased hypoxic ventilatory drive in the obesity hypoventilation syndrome. Am J Med 1975; 59:343-348. 68. Orr WV, Mañin RJ, Patterson CD, Pennock B, Rogers RM. HYpercapnic ventilatory response and mouth occiusion reponses in patients with sieep apnea (abstract). Am Rev Respir Dis 1978,117:380. 69. Garay SM, Rapopart D, Sorkin B, Epstein H, Feinberg I, Goldring R. Regulation of ventilation in the obstructive sieep apnea syndrome. Am Rev Res Dis 1981; 124:451-457. 70. Aubert-TuIkens G, Willems B, Veriter CL, Coche E, Stanescu DC. Increase in ventilatory response to C0¡ following tracheostomy in obstructive sieep apnea. Bull Eur Physiopathol Respir 1980; 16:587-593. 71. Guilleminault C, Cummikey J. Progressive improvement of apnea Índex and ventilatory to C0¡ after tracheostomy in obstructive sieep apnea syndrome. Am Rev Respir Dis 1982; 126:14-20. 72. Lugaresi E, Cirignotta F, Coccagna G, Medori R, Montagna P. Ondine's curse and its opposite. In: Sieep Disorders: Intersections of basic and clinical research. New York. MH Chase Ed. Spectrum 1982; 41-47. 73. Sullivan CE, Issa FG, Berthon-Jones M, Saunders NA. Pathophysiology of sieep apnea. In: Sieep and breathing. NA Saunders, CE Sullivan Eds. New York. Marcel-Dekker 1984; 299-364. 74. Mangat E, Orr WC, Smith RO. Sieep apnea, hypersomnolence and upper airway obstruction secondary to adenotonsillar enlargement. Arch Otolaryngol 1977; 103:383-386. 75. Alfageme I, Rodríguez Becerra E, Barrot Cortés E. Corazón pulmonar crónico secundario a hipertrofia amigdalar. Rev Clin Esp 1983; 169:353. 76. Conway WA, Bower GC, Barnes ME. Hypersomnolence and intermittent upper airway obstruction: occurrence caused by micrognathia. JAMA 1977; 237:2740-2742. 77. Imes NK, Orr WC, Smith RO, Rogers RM. Retrognathia and sieep apnea. A life threatening condition masquerading as narcolepsy. JAMA 1977; 237:1596-1597. 78. Lopata M, Onal E. Mass loading, sieep apnea and the pathogenesis of obesity hypoventilation. Am Rev Respir Dis 1982; 126:640-645. 79. Mezon BJ, West P, McLean JP, Druyger MH. Sieep apnea in acromegaly. Am J Med 1980; 69:615-619. 80. Orr WC, Males JL, Imes NK. Myxedema and obstructive sieep apnea. Am J Med 1981; 70:1061-1066. 81. Zorick E, Roth T, Kramer M, Flessa H. Exacerbation of upper airway sieep apnea by lymphocytic lynphoma. Chest 1980; 77:689-690. 82. Guilleminault C, Mondini S. Need for multi-diagnostic approaches before considering treatment in obstructive sieep apnea. Bull Europ Physiopathol Respir 1983; 19:583-589. 83. Riviin J, Hoffstein V, Kalbfleisch J, McNicholas W, Zamel N, Bryan AC. Upper airway morphology in patients with idiopatic obstructive sieep apnea. Am Rev Respir Dis 1984; 129:355-360. 66 E. BARROT CORTES ET AL.-SINDROME DE APNEAS DURANTE EL SUEÑO 84. Haponik EF, Alien RP, Smith PL, Kaplan J. Abnormal inspiratory flow-volume curves in patients with sieep disordered beathing. Am Rev Respir Dis 1981; 124:571-574. 85. Sanders MH, Martin RJ, Pennock BE, Rogers RM. The detection of sieep apnea in the awake patient. JAMA 1981; 245:2414-2418. 86. Suratt PM, Dee Pm Atkinson L, Armstrong P, Wilhoit SC. Fluoroscopic and computed temographic features of the pharyngeal airway in obstructive sieep apnea. Am Rev Respir Dis 1983; 127:487. 87. Haponik EF, Bohiman ME, Smith PL, Alien R, Goldman S, Bleecker ER. CT-Scanning in obstructive sieep apnea: correlation of structure with airway physiology during sieep and wakefulnes. Am Rev Respir Dis 1982; 125:107 (abstract). 88. Riley R, Guilleminault C, Herran J, Poweil N. Cephalometric analyses and flow-volume loops in obstructive sieep apnea patients. Sieep 1983; 6:303-311. 89. Brown 1G, Bradley TD, Phillipson EA, Zamel N, Hoffstein V. Pharyngeal compliance in snoring subjects with and without obstructive sieep apnea. Am Rev Respir Dis 1985; 132:211-215. 90. Tilkian AG, Guilleminault C, Schroeder JS, Lehnnan KL, Simmons FD, Dement WC. Hemodynamics in sieep-induced apnea. Studies during wakefulnes and sieep. Ann Intern Med 1976; 85:714-719. 91. Fuentes FJO, Pedro-Botet JP, Romero RG, Farrerons MMV. A propósito de siete observaciones de síndrome de Pickwick. Importancia diagnóstica de la respiración periódica durante el año. Med Clin (Barc) 1973; 61:603-611. 92. Gibson GE, Duffy TE. Impaired synthesis of acetylcholine by mild hypoxia or nitrous oxide. J Neurochem 1981; 36:28-33. 93. Weitzman E. The syndrome of hypersomnia and sieep induced apnea. Am J Med 1979; 75:414-415. 94. Barlow PB, Bartiett D, Hauri P, Hellerson C, Nattie EE, Remmers JE, Scmidt-Nowara WW. Idiopathic hypoventilation syndrome: importance of preventing nocturnal hypoxemia and hypercapnia. Am Rev Respir Dis 1980; 121:141-145. 95. Barvezi A, Cirignotta F, Coccagna G, Calderini G, Lugaresi E. Cerebrospinal fluid homovalinic acid an 5-hydroxyindoleacetic acid in hypersomnia with periodic apnea or idiopathic hypersomnia: preliminary results. Sieep 1980; 3:347-350. 96. Krueger JM, Pappenheimer JR, Karnovsky ML. The composition of sieeppromoting factor Rx isolated from human uriñe. J Biol Chem 1982; 257:1644-1669. 97. Buda AJ, Schroeder JS, Guilleminault C. Abnormalities of pulmonary artery wedge pressure in sieep-induced apnea. Int J Cardiol 1981; 1:67-74. 98. Chaudhary BA, Ferguson DS, Speir WA. Pulmonary edema as a presenting feature of sieep apnea syndrome. Chest 1982; 82:122-124. 99. Miller MA, Hales CE. Stability of alveolar hypoxic constriction with intermittent hypoxia. J Appl Physiol 1980; 49:846-850. 100. Fishman AP. Vasomotor regulation of the pulmonary circulation. Ann Rev Physiol 1980; 42:211-220. 101. Imaizumi T. Arrhytmias in sieep apnea. Am Heart J 1980; 100:513-516. 102. Tilkian AG, Guilleminault C, Schroeder JS, Lehrman KL, Simmons FB, Dement WC. Sieep induced apnea syndrome. Prevalence of cardiac arrhytmias and their reversal after tracheostomy. Am J Med 1977; 63:348-358. 103. Guilleminault C, Winkiee R, Connolly S, Melvin K, Tilkian A. Cyclical variation of the heart rate in sieep syndrome. Lancet 1984; 21:126-131. 104. Donaid DE, Shepherd JT. Autonomic regulation of the peripheral circulation. Ann Rev Physiol 1980; 42:429-440. 105. Bartall HE, Tye KH, Roper P, Dresser KB, Benchimol A. Atrial flutter associated with obstructive sieep apnea syndrome. Arch Intern Med 1980; 140:121-122. 106. Jasper MH (committee Chairman). The ten twenty electrode system of the international federation. Electroencephalogr Clin Neurophysiol 1958; 10:371-375. 107. Rechtschaffen A, Kales A. A manual of standardized terminology, techniques and scoring system for sieep states of 67 human subjects. National Institutes of Health publication n." 204. Washington DC 1968. 108. Cohn M. Respiratory monitoring during sieep. Respiratory inductive plethymography. In: Sieeping and waking disorders: indications and techniques. C. Guilleminuait Ed. California. Addisson-Wesley 1982; 213-224. 109. Saunders NA, Powles ACP, Rebuck AS. Ear oxymetry: accuracy and practicability in the assessment of arterial oxygenation. Am Rev Respir Dis 1976; 113:745-749. 110. McLellan PA, Goldstein RS, Ramcharan V, Rebuck AS. Transcutaneous carbón dioxide monitoring. Am Rev Respir Dis 1981;124:199-201. 111. Berry DTr, Webb WB, BlocK AJ. Sieep apnea syndrome. A critical review of the apnea Índex as a diagnostic criterion. Chest 1984; 86(4):529-531. 112. Dolly FR, Block AJ. Effect of fluorazepam on sieepdisordered breathing and nocturnal oxygen desaturation in asymptomatic subjects. Am J Med 1982; 73:239-243. 113. Me Nicholas WT, Tarlo S, Colé P, Zamel N, Rutherford R, Griffin D, Phillipson EA. Obstructive apneas during sieep in patients with seasonal allergic rhinitis. Am Rev Respir Dis 1982; 126:625-628. 114. Harman EM, Wynne JW, Block AJ. The effect of weight loss on sieep disordered breathing and oxygen desaturation in morbidly obese men. Chest 1982; 3:291-294. 115. Halverson JD, Zuckerman GR, Koehier RE, Gentry K, Michael HEB, De Schryver-Kecskemeti K. Gastric bypass for morbid obesity: a medical-surgical assessment. Ann Surg 1981; 194:152-158. 116. Motta J, Guilleminault C. Effects of oxygen administration in sieep induced apneas. In: Sieep apnea syndromes. C Guilleminault and WC Dement Eds. New York. Alan R Liss 1978; 137-144. 117. Martin RJ, Sanders MH, Gray BA, Pennock BE. Acure and long-term ventilatory effects of hyperoxia in the adult sieep apnea syndrome. Am Rev Respir Dis 1982; 125:175-180. 118. Longobardo GS, Ghote B, Goldman MD, Cherniack NS. Sieep panea considered as a control system instability. Respir Physiol 1982; 50:311-333. 119. Smith PL, Haponick EF, Bleecker ER. The effects of oxygen in patients with sieep apnea. Am Rev Respir Dis 1984; 130:958-963. 120. White DP, Zwillich CW, Pickett CR, Findiey U, Hudgel DW, Weil JV. Central sieep apnea: improvement with acetazolamide therapy. Am Rev Respir Dis 1981; 123:177. 121. Orr WC, Imes NK, Martin RJ. Progesterone therapy in obese patients with sieep apnea. Arch Intern Med 1979; 139:109-111. 122. Strohl KP, Hensley MJ, Saunders NA, Scharf SM, Brown R, Ingram RH. Progesterone administration and progressive sieep apnea. JAMA 1981; 245:1230-1232. 123. Block AJ, Wynne JW, Boysen PG, Lindsey S, Martin C, Cantón B. Menopause, medroxyprogesterone and breathing during sieep. Am J Med 1981; 70:506-510. 124. Smith PL, Haponik EF, Alien RP, Bleecker ER. The effects of protriptyline in sieep-disordered breathing. Am Rev Respir Dis 1983; 127:8-13. 125. Brownweil LG, West P, Sweathman P, Acres JC, Kryger MH. Protriptyline in obstructive sieep apnea: a double blend trial. N Engí J Med 1982; 307:1037-1042. 126. Remmers JE, Anch AM, DeGroot WJ, Vaker JP Jr, Sauerland EK. Oropharyngeal muscle tone in obstructive sieep apnea before and after strychnine. Sieep 1980; 3:447-454. 127. Schiffman PL, Friedman B, Santiago TV, Edelman NH. Effect of naloxone on ventilatory control in parents of victims of sudden infant death syndrome. Am Rev Respir Div 1984; 130:964-968. 128. Ghote B, Kingman FCCP, Strohl P, Levin S, Cherniack NS. Nicotine: a different approach to treatment of obstructive sieep apnea. Chest 1985; 87:11-17. 129. Guilleminault C, Hayes B. Naloxone, theophylline, Bromocriptine and obstructive sieep apnea. Negative results. Bull Europ Physiopath Resp 1983; 19:632-634. 130. Riñey R, Guilleminault VC, Poweil N, Derman S. 95 ARCHIVOS DE BRONCONEUMOLOGIA. VOL. 23, NUM. 2, 1987 Mandibular osteotomy and hyoid bone advancement for obstructive sieep apnea: a case report. Sieep 1984; 7:79-82. 131. Fujita S, Zorick F, Conway W, Roth T, Hartse KM, Piccone P. Uvulopalato-pharyngoplasty: a new surgical treatment for upper airway sieep apnea. Sieep Res 1980; 9:197. 132. Perelló E, Quesada P, Pedro-Botet J, Roca A. Surgical treatment of the Pickwickian syndrome and allied syndromes (obstructive sieep apnea syndrome). Abstraéis XII Worid Congress ofORL. Budapest 1981; 542:123. 133. Simmons FB, Guilleminault C, Silvestri R. Snoring and some obstructive sieep apnea can be cured by oropgaryngeal surgery. Palatophraryngoplasty. Arch Otolaryngol 1983; 109:503-507. 134. Motta J, Guilleminault C, Schroeder JS, Dement WC. Tracheostomy and hemodynamic changes in sieep induced apneas. Ann Intern Med 1978; 89:454-458. 135. Conway V, Víctor L, Fujita S, Zovick F, Roth T. Long term experience with tracheostomy for sieep apnea. Am Rev RespirDis 1980; 121:122. 96 136. Guilleminault C, Simmons FB, Motta J, Cummiskey J, Rosekind M, Schroeder JS, Dement WC. Obstructive sieep apnea syndrome and tracheostomy. Long term follow up experience. Arch Intern Med 1981; 141:985-988. 137. Sullivan CE, Berthon-Jones M, Issa FG, Eves L. Reversal of obstructive sieep apnea by continuous positive airway pressure applied through the nares. Lancet 1981; 1:862-866. 138. Remmers JE, Sterling JA, Thorarinsson B, Kuna ST. Nassal airway positive pressure in patients with occiussive sieep apnea. Methods and feasibility. Am Rev Respir Dis 1984; 130:1152-1155. 139. Rapoport DM, Sorkin B, Garay SM, Goldring RM. Reversal of the «Pickwickian» syndrome by long term use of nocturnal nasal airway pressure. N Eng J Med 1982; 307:931933. 140. Gleen WWL. Diaphragm pacing: present status. Pace 1978; 1:357-370. 141. Garay SM, Turino GM, Goldring RM. Sustained reversal of chronic hypercapnia in patients with alveolar hypoventilation syndromes. Am J Med 1981; 70:269-274. 68 TÉCNICAS Y PROCEDIMIENTOS UTILIZACIÓN DE UN ORDENADOR PERSONAL PARA MECANIZACIÓN DE INFORMES DE EXPLORACIÓN FUNCIONAL RESPIRATORIA M. SALGUEIRO RODRÍGUEZ, A. GOLPE GÓMEZ, L. VALDES CUADRADO, P. ALVAREZ-CALDERON PRAT y J.R. RODRÍGUEZ SUAREZ Servicio de Neumología. Hospital General de Galicia. Santiago de Compostela. Presentamos un programa destinado a mecanizar los informes de exploración funcional respiratoria mediante el cálculo de los valores teóricos, su comparación con los reales y la presentación de resultados mediante copia impresa. El programa ha sido disenado para su utilización con equipos que respondan al standard MSX y su extensión es de 7 Kbytes. Se pueden efectuar modificaciones del programa para permitir cálculos estadísticos y sistemas de archivo. Arch Bronconeumol 1987; 23:97-99. Introducción Entre los profesionales que se ven afectados por la avalancha informática se encuentran los de la medicina''2. Actualmente existen múltiples aparatos en los cuales tanto su manejo como sus resultados vienen asistidos por ordenador. Asimismo, la utilización de los ordenadores personales se empieza a implantar, tanto en servicios hospitalarios como en consultas privadas3. La utilización de ordenadores personales en medicina se ve restringida, por el software disponible, a las funciones de archivo4, agenda informática y vademécum principalmente. Sin embargo, las posibilidades de dichos ordenadores se extienden más allá de estas funciones. Actualmente se intenta desarrollar el ordenador personal como una eficaz ayuda para el diagnóstico mediante la utilización de los llamados «sistemas expertos»5, algunos de los cuales ya han sido desarrollados para el campo de la medicina sobre ordenadores más potentes. Dentro de estos sistemas tenemos el MYCIN, desarrollado en la Universidad de Stanford para el diagnóstico de infecciones bacterianas, Internist que se utiliza en Medicina Interna, el Casnet en la terapéutica del glaucoma y otros6. El presente artículo expone un programa utilizado para procesar y mecanizar los informes de exploración funcional respiratoria. Recibido el 24-2-1986 y aceptado el 9-7-1986. 69 Use of a personal computer for automatizing respiratory function tests reports We present a computer program aimed to automatizo the reports on respiratory function tests by calculating the expected valué, comparing them with the actual ones and giving the results as a printed copy. The program was designed to be used with equipments adopted to MSX standard and its exent is 7 Kbytes. Changes may be introduced in the program to allow statistical calculations and data base systems. La función de dicho programa es la de calcular los valores normales de los parámetros de exploración funcional, compararlos con los valores reales del paciente en cuestión y suministrar la información tanto a través de la pantalla como a través de una copia obtenida por impresora. La rentabilidad de dicho programa viene dada por el ahorro tanto de tiempo, al evitar los cálculos manuales de los valores teóricos y su comparación porcentual con los valores reales, como de dinero, dado que elimina la necesidad de disponer de impresos especiales para el informe de las exploraciones realizadas a la vez que permite una agilización del laboratorio con un mayor número de exploraciones diarias. Material Para el desarrollo del programa hemos utilizado un ordenador personal Sanyo modelo MPC-100, de 64 Kbytes de memoria RAM, como «display» un televisor a color, y como impresora una máquina de escribir Olivetti, modelo Praxis 45 D, con la adición del módulo IM 45 P que permite a la máquina ser utilizada como tal a través de un inferíase del tipo paralelo. La elección del ordenador se debe a la pertenencia del mismo al standard MSX, desarrollado por microsoft, que permite una total compatibilidad con los ordenadores de otras marcas (hasta el momento 20 casas comerciales fabrican sus ordenadores de acuerdo con este standard). Asimismo el lenguaje Basic utilizado hace posible su empleo en otros ordenadores, entre los cuales destacamos el IBM PC, Olivetti M 24, Toshiba T 1500, Commodore PC, Hewlett Packard HP 150 y otros. Además los ordenadores MSX pueden utilizar uno de los sistemas operati97 ARCHIVOS DE BRONCONEUMOLOGIA. VOL. 23, NUM. 2, 1987 Inicio J Definición de funciones Introduce ón de datos del paciento Introducción de los valores hallados en la exploración funcional respiratoria i Cálculo de valores teóricos Cálculo de porcentajes valor real-valor teórico Presentación de resultados en pantalla No————— Desea copia imp esa <( Impresión de resultados Fig. 1. Diagrama de flujo. vos más usados en ordenadores de 8 bits, el CP/M (Digital research)7'8. El programa ocupa aproximadamente 7 Kbytes, por lo cual es perfectamente utilizable en cualquier ordenador MSX, incluso en aquellos con menor capacidad de memoria. Método El programa ha sido diseñado tal y como muestra el diagrama de flujo (fig. 1), definiendo en una primera fase las funciones que nos permiten calcular los valores teóricos de exploración funcional respiratoria. Para ello hemos utilizado las ecuaciones de regresión recomendadas por la Comunidad Económica del Carbón y del Acero (CECA)9 pero pueden ser fácilmente sustituidas por otras. En una segunda fase se da entrada a los datos del paciente que deben incluir sexo, edad y estatura para el cálculo de los 98 valores teóricos, introduciéndose a continuación los valores hallados en la exploración funcional respiratoria. Posteriormente se procede al cálculo de los valores teóricos, basándose en las funciones previamente definidas y que vanan según el sexo. A continuación son presentados los resultados en pantalla y, si es solicitada, se proporciona una copia impresa (tabla I). (Dada la extensión del programa lamentamos no poder publicarlo íntegramente. Los autores enviarán fotocopia del listado original a solicitud de cualquier interesado.) Una vez cargado el programa y a los pocos segundos de ser ejecutado, el ordenador nos pedirá la introducción de los datos del paciente y seguidamente los valores hallados en la exploración funcional respiratoria. En caso de carecer de uno de los valores solicitados bastará con no dar entrada a ningún dato y ese parámetro será considerado como cero por el ordenador, indicando así que este dato no está disponible. Tras introducir el último dato solicitado se presentarán en pantalla los resultados indicando: el parámetro correspondiente, su valor real en el paciente, su valor teórico, indicado en forma 70 M. SALGUEIRO RODRÍGUEZ ET AL.-UTILIZACION DE UN ORDENADOR PERSONAL PARA MECANIZACIÓN DE INFORMES DE EXPLORACIÓN FUNCIONAL RESPIRATORIA TABLA I Copia de los resultados PRUEBAS FU NCIONAL ES RESPI RATORIA S Servicio: neumología Número de identificaición: 15 Apellidos: García G arcía Nombre: Manuel Sexo: M Edad: 25 Estatura: 1.79 Fecha: 23/4/86 RESULTADOS Real Parámetro 6,03 1VC (1) 4,92 FVC(l) 7,16 TLC (1) 2,24 RV(1) 4,14 FRC (1) 31,2 RV/TLC % 57,8 FRC/TLC % 4,23 FEVl(l/s) 85,9 FEV1/VC % 5,12 FEF 25-75 % (1/s) 10,2 PEF (1/s) 8,02 MEF75(l/s) 6,31 MEF50(l/s) 3,46 MEF25 (1/s) TL CO sb (mmol/min/kPa) 12,3 Kco (mmol/min/kPa/1) 3,07 Tecórico (5,07 - 6,07) (4,71 - 5,91) (6,26 -8,18) (1,04 - 2,28) (2,45 - 4,21) (15,69 - 31,17) (43,33 -54,81) (3,98 - 4,98) (75,03 - 90,43) (3,74 - 6,46) (8,52 - 11,74) (7,51 - 9,63) (3,8 - 7,52) (1,23 -4,11) % 108 92' 99 135 124 133 117 94 103 100 100 93 111 129 (10,73 - 13,69) 100 (1,21 - 3,09) 142 de intervalo y el porcentaje que corresponde al valor real con respecto al valor teórico medio. Una vez presentados los resultados, el ordenador solicitará la conformidad y seguidamente pasará a dar una copia de los resultados en el caso de disponer de impresora (tabla I). Comentario Los ordenadores personales se están introduciendo velozmente en la práctica médica. Si bien en determinadas áreas (gestión hospitalaria, centralización de archivos) son necesarios todavía ordenadores con grandes prestaciones y capacidad de memoria, en otras funciones los pequeños ordenadores pueden ser de gran utilidad. 71 El presente artículo muestra la utilidad de un pequeño ordenador personal, de coste reducido, en un laboratorio de exploración funcional respiratoria. El procesamiento de los parámetros obtenidos en las exploraciones permite disponer rápidamente de los datos necesarios para el diagnóstico y facilita la confección de los informes. Las posibilidades del programa se amplían enormemente disponiendo de una unidad de almacenamiento de datos tipo «diskette» o disco duro que permite llevar un archivo de las exploraciones realizadas e incorporar los datos a un programa de tipo estadístico para su procesamiento con vistas a trabajos, publicaciones, etc. Actualmente existen casas comerciales que suministran equipos con microprocesadores incorporados, aunque dado su alto coste, la utilización de un pequeño ordenador, tal y como describimos, resulta un buen compromiso mientras no sea posible o necesario modificar la instalación del laboratorio. BIBLIOGRAFÍA 1. Huertas D. Iniciación al uso de los pequeños ordenadores en medicina. Barcelona. Ed Salvat, 1985. 2. Kember NF. Introducción a las aplicaciones de los ordenadores en medicina. Barcelona. Ed Salvat, 1985. 3. La consulta odontológica: un proceso de automatización con el Commodore 8032. Chips Micros 1984; 5:40-43. 4. Juanmiquel Isern L, De Gracia Roldan J, Morera Prat J. Utilización de un ordenador personal para archivar resúmenes de historias clínicas en neumología. Arch Bronconeumol 1984; 20:193-199. 5. Rodweil P. Procesadores de ideas. Chip Micros 1984; 6:50-52. 6. D'Ambrosio B. Sistemas expertos. Ordenador popular 1985; 26:71-84. 7. Vanryb A, Politis M. Introducción al MSX. Barcelona. Ed Moray, 1985. 8. Sinclair I. Programando con el MSX Basic. Indescomp Publicaciones. Madrid 1985. 9. Quanjer H, Dalhuijsen A, Van Zomern BC. Summary equations of reference valúes. Bull Europ Physiopath Resp 1983; 19 (suppl 5):45-51. 99 Parálisis del hemidiafragma izquierdo por herpes zóster cervical Sr. Director: Se presenta un caso de parálisis de hemidiafragma izquierdo por afectación de las raíces C^-C^ del nervio frénico a consecuencia de la infección por virus del herpes zóster a nivel cervical. A.M.L, varón de 76 años, acude a la consulta de su médico de cabecera, por presentar unas molestias sordas localizadas en el hombro y región anteroposterior del hemitórax izquierdos, motivo por el que se constata, a la exploración radiológica del tórax, la ausencia de cualquier anomalía intratorácica, así como la normalidad de ambos hemidiafragmas en lo que a su posición y motilidad respecta. A los pocos días aparece la erupción cutánea típica del herpes zóster, con lo que se aclara la naturaleza del dolor, sin embargo, y a pesar de las medidas terapéuticas, persiste la sensación dolorosa a los tres meses y, además, aparece una opacidad radiológica, que ocupa el tercio inferior del hemitórax izquierdo, y que se acompaña de disnea de esfuerzo. A los tres meses aproximadamente del comienzo de la sintomatología, 24-1-84, tuvimos la ocasión de explorar al paciente, pudiendo constatar los siguientes hallazgos exploratorios: disminución del murmullo respiratorio en la base del hemitórax izquierdo a la auscultación pulmonar, así como a la inspección, destaca la persistencia de las típicas lesiones vesiculares del herpes zóster, que, localizadas principalmente en hombro izquierdo, se extienden hacia atrás y adelante (regiones infraclavicular y escapular). El resto de la exploración clínica dentro de los límites de la normalidad, así como el resultado de los análisis de sangre, orina y pruebas complementarias. 100 Radiológicamente, se aprecia en placa PA una opacidad que ocupa el tercio inferior del hemitórax izquierdo (fig. 1), así como en la proyección lateral (fig. 2), una elevación de 10 cm del hemidiafragma izquierdo. Complementariamente se practica TAC, que confirma la elevación del hemidiafragma izquierdo, y la ausencia de cualquier causa mpdiastínica de parálisis frénica, así como ecografía abdominal, que aparte de constatar la elevación e inmovilidad del hemidiafragma izquierdo, confirma la ascensión del bazo y riñon izquierdos, que ocupan el espacio situado inmediatamente por debajo del hemidiafragma elevado, en el que normalmente suele alojarse la cámara gástrica. Se acepta la etiología zosteriana de la parálisis frénica, al descartar otras causas cervicales o torácicas, así como la coexistencia de otras enfermedades generales (poliomielitis, encefalitis, difteria) con posibilidades de afectación del referido nervio. El herpes zóster afecta generalmente los nervios sensitivos, ocasionando neuritis y lesiones cutáneas características en los dermatomas correspondientes; excepcionalmente, puede afectarse también el nervio motor, que emerge de las raíces anteriores de la médula, al mismo nivel, originándose en dicho caso, la parálisis flaccida correspondiente. En nuestro caso, la localización de las lesiones dérmicas corresponde a los dermatomas €3-04, a cuyo nivel se forma el plexo cervical 72 CARTAS AL DIRECTOR (C]-C2-C3-C4) del que emerge el frénico que inerva el diafragma. En 1866 se describe la primera parálisis muscular por herpes zóster1 mientras que en 19492 se publica por primera vez en la literatura anglosajona el primer caso de parálisis de hemidiafragma por herpes zóster, y en 19533 se describe el primer caso de la literatura nacional. El presente caso corresponde, pues, al número dos de la literatura nacional, y 14 de la literatura mundial, según trabajos revisados4"15. A. Almansa Pastor Málaga. BIBLIGRAFIA 1. Broadbent WH. Case of herpectic eruption in the course of branches of brachial plexus followed by partial paralysis in the corresponding motor nerves. Brit Med J 1966; 2:460. 2. Halpern SL, Covner AH. Motor manifestations of herpes zóster: report of a case of associated permanent paralysis of phrenic nerve. Arch Intern Med (Chicago) 1949; 84:907-916. 3. Cerviá T. Parálisis de hemidiafragma por herpes zóster. Rev Clin Esp 1953; 49:397-399. 4. Anderson JP, Keal EE. Cervical herpes zóster and diaphragmatic paralysis. Brit J Dis Chest 1969; 63:222-226. 5. Beard HW. Phrenic paralysis due to herpes zóster. Med Bull US Army Europe 1963; 20-106. 6. Brostoff J. Diaphragmatic paralysis after herpes zóster. Brit Med J 1966; 2:1571-1572. 7. Couch AHC. Paralysis of the diaphragm after neumonia of undetennined cause. Thorax 1953; 8:326. 8. Derveaux L, Lacquet LM. Hemidiaphragmatic paresis after cervical herpes zóster. Thorax 1982; 37:870-871. 9. Donaid TC. Paralysis of the diaphragm secondary to herpes zóster J Med Assn Alábanla 1964; 33:306. 10. Dutt AK. Diaphragmatic paralysis caused by herpes zóster. Am Rev Respir Dis 1970; 101:755-758. 11. Cárter AB, Dunlop JBW. Paresis following herpes zóster. Report of 2 cases. Brit Med J 1941; 1:234-235. 12. Parker GW, Ramos ED. Paralysis of the phrenic nerve following herpes zóster. JAMA 1962; 180:408-410. 13. Pathy MS. Motor complications of herpes zóster. Age Ageing 1979; 8:75-80. 14. Riley EA. Idiopathic diaphragmatic paralysis: a report of eight cases. Am J Med 1962; 32:404-416. 15. Taterka JH, 0'Sullivan ME. Motor complications of herpes zóster. JAMA 1943; 122:737-739. Beta-dos microglobulina en líquido pleural: test inespecéfíco Sr. Director: La beta-dos microglobulina es una pequeña proteína constituida por 100 aminoácidos que se encuentra en la superficie de las células formando parte de los antígenos del sistema HLA y es sintetizada principalmente por los linfocitos1. En recientes trabajos''4 aparecidos en la literatura médica, se sugiere que podría estar aumentada en derrames pleurales de origen tuberculoso, por lo que pudiera ser un parámetro útil para diferenciar pleuresías tuberculosas de las de otra etiología. 73 Con el fin de comprobar o no esta hipótesis se realizó un estudio prospectivo en 25 enfermos con derrame pleural unilateral, siete de ellos tuberculosos (granulomas tuberculoideos en biopsia pleural y/o crecimiento de Mycobacterium tuberculosis en cultivo de Lówenstein del líquido pleural o de la muestra biópsica), frente a 18 con otras etiologías (5 metástasis de diverso origen, 8 para o metaneumónicos, 2 eosinofílicos, 2 idiopáticos y 1 trasudado). Los valores medios en líquido pleural y plasma para las pleuresías tuberculosas fueron de X = 2.757 microgramos/1 (± 598) DS, 1.579 microgramos/1 ( ± 1.012) DS y 2.057 microgramos/1 (± 759) DS respectivamente, no encontrándose diferencia estadísticamente significativa (según método «t» de Student) entre los distintos valores comparándolos entre sí. Cabe resaltar que en dos ocasiones los valores fueron muy elevados (6,368 microgramos/1 y 9,497 microgramos/1 en líquido pleural correspondiendo a pacientes con derrames pleurales no tuberculosos de larga evolución cronológica. Estos datos deben confirmarse en posteriores estudios. En conclusión, pensamos que la cuantificación de las beta-dos microglobulinas en líquido pleural y plasma no aporta datos que permiten diferenciar los derrames pleurales tuberculosos de los de otro origen. FJ. Orriols Martínez, S. Saornil Roncero* J. Boldú Mitjans, P. Caballero García** y F. de la Calle del Moral Sección de Neumología. Servicio de Análisis Clínicos* y Servicio de Radiología**. Departamento de Medicina Interna. Hospital General de la S.S. Virgen de Lluch. Palma de Mallorca. BIBLIOGRAFÍA 1. Riska H, Petterson T. Froseth B et al. Beta-2 microglobulin in pleural effussions. Acta Med Scand 1982; 211:45-50. 2. Gresner AM et al. N. Terminal procollagen peptide and beta-2 microglobulin synovial fluids from inflammatory and nou-inflammatory joint diseases. Clin Chim Acta 1984; 141:241-245. 3. Pudek MR et al. Beta-2 microglobulin levéis in cerebrospinal fluid of children with leukemia and lymphoma. Clin Biochem 1985; 18:180-183. 4. Robinson PV et al. Beta-2 microglobulin types in mice of wiid origin. Immunogenetics 1984, 20:655-665. Regresión espontánea de una proteinosis alveolar. Revisión a. los diez años Sr. Director: La proteinosis alveolar es una enfermedad rara, de etiología desconocida, que se caracteriza por el depósito en los espacios alveolares de un material lipoproteico, similar al sur101 facíante pulmonar, aunque sin sus propiedades tensoactivas. Presentamos un caso de proteinosis alveolar, seguido a lo largo de diez años, cuya evolución clínica, radiológica y funcional ha sido favorable sin necesidad de tratamiento alguno. A nuestro juicio, esta rara circunstancia justifica la presente carta. Enferma de 40 años de edad, que acude por primera vez a nuestro servicio en noviembre de 1975 por disnea de esfuerzo, tos y escasa expectoración, de unos dos meses de evolución. La exploración física, la analítica convencional y el ECG fueron normales. Las baciloscopias y citologías seriadas de esputo, así como los estudios de inmunidad celular y humoral practicados, resultaron negativos. En la gasometría arterial se observó: PaO:, 43 mmHg; PaCO;, 30 mmHg; pH 7,46; CÜ3H- 23 mEq/1. En la exploración funcional respiratoria se evidenció un defecto ventilatorio restrictivo, con FVC del 72 % y FEV, del 78 % de los valores teóricos. La difusión para el CO (DLCO) fue de 4,41 ml/min/mmHg (teórico: 11,3 ml/min/mmHg). En las radiografías de tórax se observó un patrón alveolar difuso bilateral, de predominio en ambas bases (fig. 1). El estudio histopatológico de la biopsia pulmonar de língula, realizada mediante toracotomía izquierda, demostró la ocupación de los espacios alveolares por un material amorfo, PAS positivo, compatible con proteinosis alveolar. La disnea persistió en la enferma durante un cierto tiempo, para luego desaparecer, de forma lenta, a lo largo de los meses siguientes. Desde julio de 1976 se ha encontrado asintomática. Las 102 revisiones analíticas periódicas practicadas han sido siempre normales. La alteración ventilatoria restrictiva y el trastorno de la difusión también desaparecieron de forma progresiva; en la actualidad, ambas pruebas son completamente normales. Las anomalías gasométricas y radiológicas existentes en 1975 han remitido por completo en su último estudio, efectuado en diciembre de 1985. En general se acepta que el 10 % de las proteinosis alveolares remite de forma espontánea, el 50 a 60 % persiste sin modificación clínica-radiológica alguna y el 30 a 40 % sufre un agravamiento progresivo, que puede conducir a la muerte; ésta se produce por sobreinfección pulmonar o insuficiencia respiratoria'•2. En niños, el pronóstico es francamente peor y la mortalidad se sitúa en torno al 100 % de los casos al año del diagnóstico3. La regresión espontánea de la proteinosis alveolar ocurre en no más del 10 % de los enfermos2'4'6. Tal sería el caso en nuestra paciente, en la que, sin tratamiento alguno, pudimos constatar la desaparición total, diez años después del diagnóstico, de las manifestaciones clínicas, radiológicas y funcionales respiratorias. Desde un punto de vista terapéutico, en un principio se emplearon aerosoles con ioduro potásico, estreptoquinasa, mucolíticos, etc.2-7, con resultados muy diversos. Díaz et al7, han preconizado la utilización del ambroxol, en aerosol y por vía oral, al parecer con buenos resultados. Sin embargo, el tratamiento «princeps» en la proteinosis alveolar es el lavado alveolar. Este procedimiento debe reservarse para aquellas formas clínicas progresivas y, por supuesto, llevarse a cabo sólo por médicos con experiencia en este tipo de técnica6'8. La eficacia del lavado alveolar es, según Du Bois et al8, casi sistemática en todos los casos, si bien a veces la duración es sólo transitoria y debe repetirse incluso en varias ocasiones6. R. Alvarez-Sala, C. Villasante, J.L. García Satué, S. Granados y J. Villamor Servicio de Neumología. Departamento de Medicina Interna. R.S. La Paz. Universidad Autónoma. Madrid. BIBLIOGRAFÍA 1. Webster JR, Battifora H, Furey C, Harrison RA, Shapiro B. Pulmonary alveolar proteinosis in two siblings with decreased immunoglobulin A. Am J Med 1980; 69:786-89. 2. Fernández-Bujarrabal J, García de Cabo A, Hermida JA, Nevado A, Sánchez-Agudo L, Guerra-Sanz F. Proteinosis alveolar: a propósito de tres observaciones. Arch Bronconeumol 1985; 21:51-54. 3. Coleman M, Dehner LP, Sibley RK, Burke BA, L'Heureux PR, Thompson TR. Pulmonary alveolar proteinosis: an uncommon cause of chronic neonatal respiratory distress. Am Rev Respir Dis 1980; 121:583-586. 4. Reyes JM, Putong PB. Association of pulmonary alveolar lipoproteinosis with mycobacterial infection. Am J Clin Pathol 1980; 74:478-485. 74 5. Rubin E, Weisbrod GL, Sanders DE. Pulmonary alveolar proteinosis. Relationship silicosis and pulmonary infection. Radiology 1979; 135:35-41. 6. Heymach GJ, Shaw RC, Me Donaid JA, Vest JV. Fiberoptic bronchopulmonary lavage for alveolar proteinosis in a patient with oniy one lung. Chest 1982; 81:508-510. 7. Díaz JP, Manresa-Presas F, Benasco C, Guardiola J, Muñoz L, Clariana A. Response to surfactant activator (ambroxol) in alveolar proteinosis. Lancet 1984; 1:1023 (carta). 8. Du Bois R, McAllister W, Branthwaite M. Alveolar proteinosis: diagnosis and treatment over a 10 year period. Thorax 1983; 38:360-363. Proteinosis alveolar. Nula respuesta terapéutica a activadores del surfactante (ambroxol) Sr. Director: Recientes comunicaciones han sugerido la posibilidad de una respuesta terapéutica favorable al tratamiento con activadores del surfactante pulmonar en pacientes con proteinosis alveolar*-2. En nuestro servicio hemos diagnosticado últimamente tres casos de esta enfermedad3. A la vista de dichas comunicaciones instauramos tratamiento con ambroxol en uno de ellos. Se trataba de una mujer de 43 años de edad que refería historia de un año de evolucón consistente en tos, expectoración mucosa y disnea progresiva que al ingresar era de pequeños esfuerzos. El estudio radiográfico del tórax reflejaba la existencia de infiltrado alveolar bilateral. El diagnóstico fue obtenido por biopsia transbronquial, método inusual pero no excepcional4. Las pruebas de función pulmonar en situación estable previa a instaurar el tratamiento fueron: FVC 2,4 1 (81 % del teórico); TLCO 11 mi mmHg-1 min-1 (52,6 %); KCO 3,33 mi min-' (56,1 %); PaO; (FÍO;, = 21 %) 47 mmHg. Se decidió el uso de ambroxol oral a la dosis de 30 mg cada seis horas, habiéndose mantenido este tratamiento durante un año sin mejoría ni subjetiva ni objetiva. La paciente sufría el mismo grado de disnea, el patrón radiográfico no había variado y las pruebas de función pulmonar al cabo de este período de terapéutica eran: FVC 2,3 litros (77,8% del teórico); TLCO 8,8 mi mmHg-1 min-1 (42,1%); KCO 2,15 mi mmHg-' 1-' (51,8 %); PaO; (FÍO; = 21 %) 53 mmHg. Hasta la fecha el tratamiento de mayor efectividad en la proteinosis alveolar es el lavado broncopulmonar introducido por Ramírez en 19635'6. El procedimiento de realización es complejo, requiere anestesia general y provoca un deterioro funcional importante durante su realización. Por todo ello sería deseable que la técnica fuese desarrollada por un equipo con experiencia, lo cual no es fácil habida cuenta de la baja incidencia de esta enfermedad. Además hay que valorar a la hora de sentar la indicación de este tratamiento que el curso es variable; un tercio de los casos 75 mejoran espontáneamente, un tercio se agravan y el resto tienden a la estabilización. Conocidas estas circunstancias algunos pacientes no aceptan la posibilidad del lavado broncopulmonar y se inclinan hacia alternativas terapéuticas menos agresivas como ocurrió en el caso presentado. Otros tratamientos de carácter paliativo como los aerosoles de ioduro potásico o la estreptoquinasa, son causa de controversia en la literatura y mientras algunos autores comunican mejorías con los mismos, otros los citan como causa de complicaciones y agravamiento del curso de la enfermedad7. La infrecuencia de esta enfermedad no facilita realizar ensayos controlados sobre las distintas alternativas terapéuticas posibles, tal y como sería deseable. El caso presentado sugiere pensar que el curso clínico de la proteinosis alveolar no se ve favorecido con el tratamiento de activadores del surfactante pulmonar como el ambroxol. J. Fernández-Bujarrabal, J.A. Hermida Gutiérrez, L. Sánchez Agudo y FJ. Guerra Sanz Servicio de Neumología. Hospital de Enfermedades del Tórax Victoria Eugenia. Madrid. BIBLIOGRAFÍA 1. Díaz JP, Manresa Presas F, Benasco C, Guardiola J, Muñoz L, Clariana A. Response to surfactant activator (ambroxol) in alveolar proteinosis. Lancet 1984; 1:1023. 2. Díaz P, Manresa F, Clariana A, Muñoz L, Julia G, Alberti A, Berrat R, Benasco C. Proteinosis alveolar. Respuesta a un nuevo tratamiento. Arch Bronconeumol 1984; 20(supl 1):47-48. 3. Fernández-Bujarrabal Villoslada J, García de Cabo A, Hermida Gutiérrez JA, Nevado Caballero A, Sánchez Agudo L, Guerra Sanz FJ. Proteinosis alveolar: a propósito de tres observaciones. Arch Bronconeumol 1985; 21:51-54. 4. Lewin DC, Wicks AB, Ellis JH. Transbronchial lung biopsy via fiberoptic bronchoscope. Am Rev Respir Dis 1974; 110:4-12. 5. Ramírez RJ, Schult RB, Dutton RE. Pulmonary alveolar proteinosis: a new technique and rationale for treatment. Arch InternMed 1963; 112:419-431. 6. Ramírez RJ, Kieffer RF jr, Ball WC jr. Bronchopulmonary lavage in man. Ann Intern Med 1965; 63:819-828. 7. Arcra PL, Roper RM, Mayock RL. Alveolar proteinosis: experience with trypsin therapy. Am J Med 1968; 48:889-899. Síndrome de las uñas amarillas: ¿infección por Pseudomonas aeruginosd! Sr. Director: La lectura del reciente trabajo de F. Marcos Sánchez et al en su revista' en relación con un síndrome de las uñas amarillas asociado a sinusitis crónica, me ha recordado una entidad parecida, el llamado síndrome de las uñas verdes, que puede tener una gran semejanza con el anterior o constituir en algunos casos la misma entidad. 103 El síndrome de las uñas verdes2 consiste en la decolaración verdosa del lecho ungueal producido por Pseudomonas aeruginosa. Aunque no parece que exista verdadera invasión bacteriana de la placa ungueal, el pigmento producido por esta bacteria es capaz de difundir en la misma tiñiéndola de forma permanente. Además de P. aeruginosa, especies de Aspergillus y Candida pueden producir esta anomalía de la uña3. ¿Podrían relacionarse algunos casos de «síndrome de las uñas amarillas» con infección ungueal por P. aeruginosatf Teniendo en cuenta que muchas de las infecciones asociadas con el síndrome (bronquiectasias, sinusitis, etc.) pueden estar producidas por P. aeruginosa, esta posibilidad no parece del todo improbable. Sería interesante conocer si crecía este organismo en el tracto respiratorio, aspirado sinusal y en las uñas del pa- ciente descrito y si un tratamiento antimicrobiano específico haría desaparecer las manifestaciones ungueales, como ha sido descrito en otros casos4. J.M. Aguado García Servicio de Medicina Interna. Fundación Jiménez Díaz. Madrid. BIBLIOGRAFÍA 1. Marcos Sánchez F, Duran Pérez-Navarro A, Aguirre de Carcer A, Martínez Vidal A. Síndrome de uñas amarillas. Arch Bronconeumol 1986; 22:85-87. 2. Chernosky ME, Dukes CD. Green Nails. Arch Derm 1963; 88:548-553. 3. Moore M, Marcus MD. Green Nails. Arch Derm Syph 1951; 64:499-505. 4. Bauer MF, Cohén H. The role of Pseudomonas aeruginosa in infections about the nails. Arch Derm 1957; 75:394396. INFORMACIÓN VARIA AVANCES CLÍNICOS EN EL INTERCAMBIO GASEOSO PULMONAR Organizadores: R. Rodríguez-Roisin (Barcelona) ESPAÑA PD Wagner (San Diego) USA Barcelona, España, 5-7 octubre 1987. Temas principales: — Individuo sano (esfuerzo; alturas). — Asma bronquial. — Insuficiencia respiratoria. — Enfermedades pulmonares crónicas (EPOC, enfermedad intersticial). — Enfermedades pulmonares vasculares. — Anestesia. Treinta y seis participantes (Europa, Norteamérica y Australia). Se podrán remitir posters relacionados con los temas principales (fecha límite, 1 mayo 1987) en forma de resumen (hoja en blanco; 16,5 cm X 23 cm). Para información e inscripciones: Dr. R. Rodríguez Roisin Servei de Pneumologia Hospital Clínic Villarroel, 170 08036 BARCELONA Tel. 323 14 14 Ext. 2283 Srta. Montse. 2354 Srta. Conxi 104 76