INSTITUTO TECNOLÓGICO DE CELAYA DOSIFICACIÓN DE
Anuncio

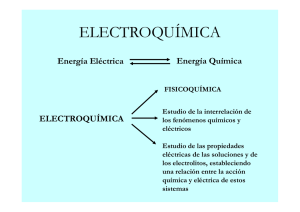
INSTITUTO TECNOLÓGICO DE CELAYA DOSIFICACIÓN DE QUÍMICA INGENIERÍA INDUSTRIAL PERIODO: ENERO -JUNIO 2012 CLAVE DEL GRUPO: AG15 GRUPO: B SEMANAS 23 al 27 enero TEMAS Y SUBTEMAS UNIDAD 1 MATERIA Y ESTRUCTURA ATÓMICA Materia: Estructura, composición, estados de agregación y clasificación por propiedades 1.1 Sustancias puras: elementos y compuestos. 1.2 Dispersiones o mezclas 1.3 Caracterización de los estados de agregación: sólido cristalino, líquido, sólido, vítreo y gel. 1.4 Cambios de estado 1.5 Estructura atómica 1.6 1.7 Configuración electrónica: Principio de construcción de Aufbau. UNIDAD 2 PERIODICIDAD QUÍMICA 30 enero al 3 febrero 2.1 2.2 2.3 6 al 10 de febrero 2.4 Desarrollo de la tabla periódica moderna Clasificación periódica de los elementos Propiedades periódicas y su variación por grupos y periodos: carga nuclear efectiva, radio atómico, radio iónico, energía de ionización, afinidad electrónica, electronegatividad (conceptual) Elementos de importancia económica, industrial y ambiental en la región o en el país PRIMER PARCIAL 13 DE FEBRERO UNIDAD 3 Enlaces químicos y el estado sólido (cristalino 20 al 24 de febrero 27 febrero al 2 marzo 5 al 9 de marzo 19 al 23 de marzo 3.1 3.2 Tipos de enlace químico. Enlace iónico y sus propiedades 3.3 3.4 3.5 Enlace covalente, formación, tipos y propiedades Enlace metálico. Fuerzas intermoleculares y estructura de los materiales. 3.6 El estado sólido cristalino SEGUNDO PARCIAL 12 DE MARZO UNIDAD 4 Compuestos orgánicos e inorgánicos Clasificación, nomenclatura y propiedades de los compuestos inorgánicos. 4.1 4.2 4.3 4.4 26 al 30 de marzo 4.5 Compuestos inorgánicos de impacto económico, industrial, ambiental y social en la región o en el país. Clasificación y propiedades de los compuestos orgánicos. Plásticos y Resinas. Principales materiales de este tipo utilizados en la industria. Compuestos orgánicos de impacto económico, industrial, ambiental y social en la región o en el país UNIDAD 5 Estequiometría. 16 al 20 de abril 5.1 Conceptos de mol, número de Avogadro, estado de oxidación, agente oxidante, agente reductor, ecuación química y condiciones TPN. 5.2 Leyes estequiométricas 5.3 5.4 5.5 5.6 23 al 27 de abril Cálculo estequiométricos relación peso-peso, relación peso-volumen Tipos de reacciones. Balanceo de reacciones (REDOX) Unidades de concentración en soluciones. UNIDAD 6 Conceptos Generales de Gases Conceptos básicos: gas ideal, gas real, propiedades críticas y factor de compresibilidad 6.1 6.2 Propiedades PVT: ley de Boyle, Charles, Gay- Lussac. Ecuación General del Estado Gaseoso. UNIDAD 7 30 abril al 4 de mayo 7.1 7.2 7.3 Ley de Conservación de la energía y sus transformaciones. Calor de formación, de reacción y solución Calorimetría y trabajo. TERCER PARCIAL 7 DE MAYO UNIDAD 8 Electroquímica. 14 al 18 de mayo 8.1 8.2 8.3 UNIDAD 9 21 al 25 de mayo 9.1 9.2 Reacción óxido reducción en electroquímica (Celda electroquímica) Fuerza electromotriz (fem) en una celda electroquímica en condiciones estándar. Tipos de pilas. Cinética química y nanotecnología. Cinética química: velocidades de reacción y factores que afectan la velocidad de reacción. Tendencias de la Nanotecnología: materiales y sus características CUARTO PARCIAL 28 DE MAYO FECHAS DE LABORATORIO 25 DE ENERO 1 DE FEBRERO 15 DE FEBRERO 29 DE FEBRERO 14 DE MARZO 18 DE ABRIL 9 DE MAYO 23 DE MAYO CRITERIOS DE EVALUACIÓN UNIDAD 1 50% Examen 5% Examen diagnóstico 10% Prácticas 35% Otros - Mapas mentales - Mapas conceptuales - Línea de tiempo - Practicas virtuales - Actividades en línea - Problemarios - Investigación documental - Exposiciones - Cuestionarios UNIDAD 2, 3, 4, 5, 6, 7, 8 Y 9 50% Examen 10% Prácticas 40% Otros - Mapas mentales - Mapas conceptuales - Línea de tiempo - Practicas virtuales - Actividades en línea - Problemarios - Investigación documental - Exposiciones - Cuestionarios NOTA IMPORTANTE: TODOS LOS PRODUCTOS DE APRENDIZAJE SÓLO SE RECIBEN UNA SOLA VEZ EN TIEMPO Y FORMA. LOS PRODUCTOS DE APRENDIZAJE NO SERÁN RECIBIDOS FUERA DE TIEMPO, LAS ÚNICAS EXCEPCIONES PARA PODER PRESENTARLOS SERÁN POR CUESTIONES DE ENFERMEDAD, ASUNTOS LABORALES O GUBERNAMENTALES, SIEMPRE PRESENTANDO UN JUSTIFICANTE OFICIAL EXPEDIDO POR SU COORDINADOR EN LA MISMA SEMANA EN LA CUAL SE HA SUSCITADO LA FALTA O EN LA SIGUIENTE SEMANA. NO SERÁN RECIBIDOS JUSTIFICANTES TRES SEMANAS DESPUÉS O UN MES DESPUÉS DE QUE EL ALUMNO HA NOTIFICADO O ACLARADO SU SITUACIÓN ANTE EL DOCENTE. BIBLIOGRAFÍA DE CONSULTA Fundamentos de Química Química Química Química General Química, la Ciencia Central, Química y Reactividad química Morris Hein y Susan Arena Daub, G., Seese, S., Chang, R. Ebbing, D., CENGAGE Learning Pearson Educación, Mc Graw Hill Mc Graw Hill Brown, Le May y Bursten, Prentice-Hall Kotz, John C., Paul M. Treichel Thomson Doceava Séptima 10ª. 6a. edición