SAT: Sperm Aneuploidy Test
Anuncio

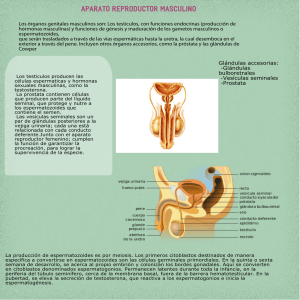
SAT: Sperm Aneuploidy Test (5 cromosomas: 13, 18, 21, X e Y) 1. Presentación. ¿Qué es? El Sperm Aneuploidy Test (SAT) permite evaluar la presencia de alteraciones en el número de cromosomas – aneuploidías y diploidía ‐ en los espermatozoides, previo al tratamiento de reproducción asistida. En este test se analizan los cromosomas cuyas anomalías pueden dar lugar a abortos o a niños nacidos vivos con cromosomopatías (cromosomas 13, 18, 21, X e Y). 2. Objetivo. ¿Para qué sirve? A nivel clínico, la presencia de alteraciones en el número de cromosomas en los espermatozoides se ha relacionado con una menor tasa de embarazo tras ICSI, así como una mayor tasa de aborto en parejas que presentan problemas de infertilidad (Rubio et al., 2001; Burrello et al., 2003; Petit et al., 2005; Nicopoullos et al., 2008; Rodrigo et al., 2011; Rodrigo et al., 2013). A nivel embrionario, se han observado diferentes consecuencias según el tipo de anomalía cromosómica observada en los espermatozoides, de manera que un incremento de espermatozoides con aneuploidía de cromosomas sexuales genera principalmente embriones aneuploides que, o no implantan, o si lo hacen pueden dar lugar a gestaciones evolutivas anormales (Síndromes de Patau, Edwards, Down, Klinefelter, Turner, XXX y XYY). Sin embargo, un incremento de espermatozoides diploides genera además embriones triploides, capaces de implantar, pero que terminan mayoritariamente en aborto (Rodrigo et al., 2010). A nivel de descendencia, en diversos estudios realizados en padres de niños con Síndrome de Turner, Síndrome de Klinefelter o Síndrome de Down, se ha relacionado el origen de la anomalía cromosómica del niño con un incremento de espermatozoides con alteraciones en el número de cromosomas sexuales o del cromosoma 21 en el padre (Eskenazi et al., 2002; Tang et al., 2004; Blanco et al., 1998). El Sperm Aneuploidy Testes una prueba diagnóstica para el estudio de la infertilidad del varón, que puede ayudar al asesoramiento de la pareja previo a la realización de un tratamiento de reproducción asistida. www.igenomix.com 3. Indicaciones. ¿Para quién? El Sperm Aneuploidy Test estaría indicado en varones infértiles en los que se sospecha de errores meióticos durante la espermatogénesis que pueden resultar en espermatozoides aneuploides y diploides. Se trata habitualmente de varones con cariotipo normal: con parámetros espermáticos alterados ‐ principalmente oligozoospermia, azoospermia secretora y casos extremos de teratozoospermia. Otras indicaciones con o sin factor seminal asociado serian: parejas con historia clínica de aborto de repetición de causa desconocida; con historia clínica de fallos repetidos de implantación tras técnicas de reproducción asistida; o con gestación previa con cromosomopatía. www.igenomix.com 4. Ventajas. ¿Qué ventajas sobre otros test? La ventaja de esta técnica frente a los estudios de meiosis es que analizamos el producto final, el espermatozoide,que va a participar directamente en la fecundación del óvulo. Para obtener un resultado con relevancia clínica, analizamos 2.000 espermatozoides para cada cromosoma, y el análisis es realizado por dos evaluadores independientes. Los resultados se comparan con controles internos del laboratorio. 5. Muestra. ¿Cómo? El SAT puede realizarse sobre muestras procedentes de eyaculado, epidídimo o testículo. La muestra obtenida mediante eyaculación, se recoge en un tubo cónico y es sometida a un primer lavado con medio de cultivo para espermatozoides. A partir de este momento la muestra se puede conservar en el laboratorio a 4oC un máximo de 3 días hasta su envío. La muestra obtenida del epidídimo o del testículo se deposita en una placa Petri con medio de cultivo para espermatozoides, se dilacera el tejido con dos bisturís y se congela según el protocolo habitual del laboratorio de FIV. Las alícuotas se envían congeladas para su procesamiento. 6. Envío. ¿Cómo, cuándo, dónde y quién? La muestra de epidídimo o de testículo se transporta en un contenedor especial frío. La muestra de eyaculado se transporta a temperatura ambiente en un tubo cónico sellado y bien protegido para evitar golpes. La dirección de entrega es: España: IGENOMIX, Laboratorio DGP cromosómico, Parc Cientific Universitat de Valencia, C/ Catedrático Agustín Escardino, n99, 46980 Paterna (Valencia). Latam: IGENOMIX Latam 7955 NW 12th St.Suite 415 Miami, Florida 33126 USA 7. Procesamiento de muestras y entrega de resultados. ¿Cuándo? El protocolo en el laboratorio requiere 2 semanas para realizar el estudio y para la entrega del informe de resultados. 8. Metodología Las principales etapas del ensayo: 1) Fijación de la muestra de espermatozoides. 2) Descondensación del núcleo de los espermatozoides. 3) Hibridación con sondas de DNA fluorescente cromosoma‐específicas. 4) Detección de las señales de hibridación y análisis manual de la muestra con microscopio de fluorescencia equipado con filtros adecuados para los haptenos fluorescentes utilizados. www.igenomix.com 9. Limitaciones de la técnica Esta técnica no permite detectar aneuploidías para cromosomas no incluidos en el análisis. En casos de azoospermias secretoras y criptozoospermia puede ocurrir que el número de espermatozoides no sea suficiente para realizar una estimación adecuada de la incidencia de aneuploidías en la muestra. 10. ¿Cómo comenzar? España: contacte con [email protected] Latam: info‐[email protected] 11. FAQ's ¿Se pueden estudiar otros cromosomas? Sí, cuando se solicita el test SAT por gestación previa con cromosomopatía, se puede analizar adicionalmente el cromosoma implicado en la cromosomopatía previa. ¿Debe existir un periodo de abstinencia sexual previo a la extracción de la muestra? Sí, es conveniente una abstinencia sexual de 2‐3 días previo a la extracción de la muestra. ¿Hay una concentración espermática mínima para poder solicitar el test SAT? No. En principio, se podrá solicitar el test siempre que se observen espermatozoides tanto en las muestras de eyaculado como en las de epidídimo o testículo. Sin embargo, en raras ocasiones puede ocurrirque el número de espermatozoides no sea suficiente para realizar una estimación adecuada de la incidencia de aneuploidías en la muestra. ¿Se puede realizar el test SAT en varones portadores de alteraciones cromosómicas estructurales? Sí, se puede diseñar un protocolo personalizado diseñando una estrategia de sondas de ADN fluorescentes dirigida al análisis de la alteración específica motivo de estudio. REFERENCIAS BIBLIOGRÁFICAS Blanco J, Gabau E, Gómez D, Baena N, Guitart M, Egozcue J, Vidal F. Chromosome 21 disomy in the spermatozoa of the fathers of children with trisomy 21, in a population with a high prevalence of Down syndrome: increased incidence in cases of paternal origin. Am J Hum Genet. 1998 Oct; 63(4):1067‐72. Burrello N, Vicari E, Shin P, Agarwal A, De Palma A, Grazioso C, D’Agata R, Calogero AE. Lower sperm aneuploidy frequency is associated with high pregnancy rates in ICSI programmes. Hum Reprod. 2003 Jul; 18(7):1371‐6. Eskenazi B, Wyrobek AJ, Kidd SA, Lowe X, Moore D 2nd, Weisiger K, Aylstock M. Sperm aneuploidy in fathers of children with paternally and maternally inherited Klinefelter syndrome. Hum Reprod. 2002 Mar; 17(3):576‐ 83. Nicopoullos JD, Gilling‐Smith C, Almeida PA, Homa S, Nice L, Tempest H, Ramsay JW. The role of sperm aneuploidy as a predictor of the success of intracytoplasmic sperm injection?. Hum Reprod. 2008 Feb; 23(2):240‐50. Petit FM, Frydman N, Benkhalifa M, Le Du A, Aboura A, Fanchin R, Frydman R, Tachdjian G. Could sperm aneuploidy rate determination be used as a predictive test before intracytoplasmic sperm injection?. J Androl. 2005 Mar‐Apr; 26(2):235‐41. Rodrigo L, Peinado V, Mateu E, Remohí J, Pellicer A, Simón C, Gil‐Salom M, Rubio C. Impact of different patterns of sperm chromosomal abnormalities on the chromosomal constitution of preimplantation embryos. FertilSteril. 2010 Sep; 94(4):1380‐6. Rodrigo L, Rubio C, Mateu E, Peinado V, Milán M, Viloria T, Al‐Asmar N, Mercader A, Buendía P, Delgado A, Escrich L, Martínez‐Jabaloyas JM, Simón c, Gil‐Salom M. FISH onsperm to identifyinfertilemalepatientswithhigheraneuploidyrisk. HumReprod. 2013 June; 28(S1). Abstract:P‐458. Rodrigo L, Rubio C, Peinado V, Villamón R, Al‐Asmar N, Remohí J, Pellicer A, Simón C, Gil‐Salom M. Testicular sperm from patients with obstructive and nonobstructiveazoospermia: aneuploidy risk and reproductive www.igenomix.com prognosis using testicular sperm from fertile donors as control samples. FertilSteril. 2001 Mar 1; 95(3):1005‐ 12. Rubio C, Gil‐Salom M, Simón C, Vidal F, Rodrigo L, Mínguez Y, Remohí J, Pellicer A. Incidence of sperm chromosomal abnormalities in a risk population: relationship with sperm quality and ICSI outcome. Hum Reprod. 2001 Oct; 16(10):2084‐92. Tang SS, Gao H, Robinson WP, Ho Yuen B, Ma S. An association between sex chromosomal aneuploidy in sperm and an abortus with 45,X of paternal origin: possible transmission of chromosomal abnormalities through ICSI. Hum Reprod. 2004 Jan; 19(1):147‐51. www.igenomix.com